Фадеев Г.Н. Пятая вертикаль периодической системы. Элементы V группы периодической системы Д.И. Менделеева
- формат djvu
- размер 3.82 МБ
- добавлен 18 марта 2011 г.
М. Просвещение. 1973. 122 с.
В книге рассказывается об элементах V группы периодической системы
Д. И. Менделеева.
Автор кратко и увлекательно описывает обстановку, в которой
проводились открытия элементов этой группы, а также рассматривает
их соединения и свойства.
Данное пособие поможет учащимся углубить знания по химии, расширить
представления о таких элементах, как ванадий, ниобий, тантал, роль
которых в радиоэлектронике и полупроводниковой технике возрастает в
связи с научно-техническим прогрессом.
Похожие разделы
- Академическая и специальная литература
- Химия и химическая промышленность
Смотрите также
- формат djvu
- размер 2.
 86 МБ
86 МБ - добавлен 18 марта 2011 г.
М. Просвещение. 1976. 112 с. Пособие входит в серию книг, рассказывающих об элементах по группам периодической системы. Цель книги – интересно, популярно и вместе с тем научно обоснованно дать описание VII группы периодической системы. Автор уделяет особое внимание рассмотрению свойств галогенов как наиболее типичных неметаллов и представителей VII группы. С необходимой полнотой приведено описание элементов побочной подгруппы марганца и его анало…
- формат djvu
- размер 6.23 МБ
- добавлен 18 марта 2011 г.
М. Просвещение. 1974. 192 с. Книга Л. Д. Вишневского “Под знаком углерода” посвящена элементам IV группы периодической системы Д. И. Менделеева. В книге интересно и доступно рассматриваются история открытия элементов, свойства простых веществ с точки зрения строения атома и характера химической связи.
- формат djvu
- размер 3.74 МБ
- добавлен 08 ноября 2010 г.
М.: Атомиздат, 1972. – 256 с. Настоящая монография написана директором Музея и Научного архива Д. И. Менделеева кандидатом химических наук А. А. Макареней. Автор свыше 15 лет изучает творчество и научное наследие великого русского ученого и опубликовал большое число работ, в том числе несколько монографий и сборников, посвященных различным сторонам деятельности Менделеева. В этой работе автор показывает формирование научных взглядов и научного ме…
- формат pdf
- размер 414.77 КБ
- добавлен 21 декабря 2010 г.
Статья – Chip №9, 2001, с. 54-55 При использовании мобильных цифровых устройств наиболее актуальной проблемой является время их работы без подзарядки. Используя современные сверхмощные ноутбуки, ничем не уступающие настольным системам, или сверхновые цифровые камеры, вы наверняка повстречаетесь с сообщениями типа «Battery low». Шагом к решению данной проблемы стали более мощные источники автономного электропитания для мобильных аппаратов. Технол…
54-55 При использовании мобильных цифровых устройств наиболее актуальной проблемой является время их работы без подзарядки. Используя современные сверхмощные ноутбуки, ничем не уступающие настольным системам, или сверхновые цифровые камеры, вы наверняка повстречаетесь с сообщениями типа «Battery low». Шагом к решению данной проблемы стали более мощные источники автономного электропитания для мобильных аппаратов. Технол…
- формат djvu
- размер 3.92 МБ
- добавлен 18 марта 2011 г.
М. Просвещение. 1976. 128 с. В книге “путешествие по шестой группе” рассказывается об элементах VI группы периодической таблицы. В ней сообщается, когда, кем и как был открыт элемент, какое он получил название при открытии. Особое внимание уделяется элементам, которые не рассматриваются в школьном курсе (строение их атомов, нахождение в природе. свойства).
- формат djvu
- размер 1.68 МБ
- добавлен 18 марта 2011 г.
ГИТТЛ. М. -Л. 1951. 63 с. Введение Атом Природные радиоактивные элементы Искусственные элементы Радиоактивные атомы – меченые атомы Заключение
- формат djvu
- размер 12.13 МБ
- добавлен 01 июля 2011 г.
М.: Изд-во Наука, 1966. – 270 с. Те, кто знаком с этой живой и увлекательной книгой, могли сполна оценить ее свежесть и занимательность. Книга не утратила своей актуальности, хотя с момента написания прошло восемь лет. Неоспоримые ее достоинства дают все основания надеяться, что второе издание русского перевода будет встречено читателями не менее благожелательно, чем первое. В процессе подготовки этого издания был сверен текст перевода и внесены…
В процессе подготовки этого издания был сверен текст перевода и внесены…
- формат djvu
- добавлен 10 апреля 2010 г.
2-е издание. – М.: Высшая школа, 1961. – 330 с. Это сборник рассказов о химических элементах, историй самостоятельных и законченных – об истории открытия и первооткрывателях, о свойствах, важности и распространенности, о научных открытиях и озарениях, о месте элементов в периодической системе, природе и нашей жизни. Книга может быть особенно полезной при изучении общего курса химии старшеклассниками и студентами нехимических вузов, как дополнение…
- формат djvu
- размер 5.33 МБ
- добавлен 31 июля 2010 г.
Изд.: Москва, “Просвещение”; Год: 1980; Стр. : 224; В книге изложена история открытия химических элементов от древних времен до наших дней. При описании этой истории авторы рассказывают о важнейших закономерностях в открытиях элементов, о роли различных методов исследования, освещают вклад ученых разных стран в развитие учения об элементах. Книга является дополнением к знаниям предмета- химия. Оглавление: Введение О понятии «химический элеме…
: 224; В книге изложена история открытия химических элементов от древних времен до наших дней. При описании этой истории авторы рассказывают о важнейших закономерностях в открытиях элементов, о роли различных методов исследования, освещают вклад ученых разных стран в развитие учения об элементах. Книга является дополнением к знаниям предмета- химия. Оглавление: Введение О понятии «химический элеме…
- формат djvu
- размер 9.81 МБ
- добавлен 07 октября 2011 г.
Книга для внеклассного чтения IX-X класс. М. Просвещение. 1977. 159 с. Понять, как устроены молекулы окрашенных веществ и от чего зависит их цвет, поможет эта книга, рассчитанная на учащихся IX-X классов средней школы. В ней раскрывается существо окраски и цвета веществ с точки зрения их химической структуры и химических свойств, а также показана роль цветных молекул в биологии, химической технологии, аналитической химии и в явлениях, с которыми.
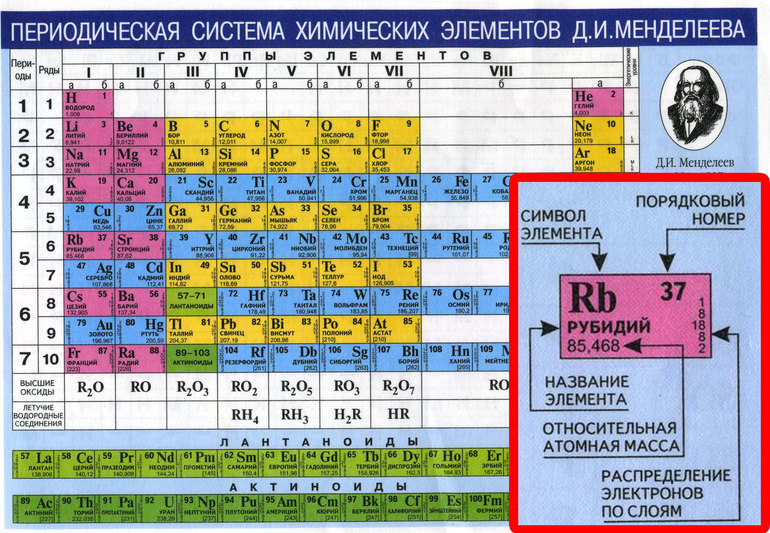
Химический Элемент Vii Группы Периодической Системы 7 Букв
Решение этого кроссворда состоит из 7 букв длиной и начинается с буквы Г
Ниже вы найдете правильный ответ на Химический элемент VII группы периодической системы 7 букв, если вам нужна дополнительная помощь в завершении кроссворда, продолжайте навигацию и воспользуйтесь нашей функцией поиска.
ответ на кроссворд и сканворд
Пятница, 19 Апреля 2019 Г.
ГАЛОГЕН
предыдущий следующий
ты знаешь ответ ?
ответ:
связанные кроссворды
- Галоген
- Бром, который пьют слабонервные, на языке науки
- Йод, которым вы смазали ранку, на языке науки
- Галоген
- Химический элемент, встречающиеся в природе в виде соли 7 букв
- Химическое вещество: хлор, йод (обобщенное) 7 букв
- Химические элементы фтор, хлор, бром, иод и астат (vii группа периодической системы) 7 букв
- Йод, которым вы смазали ранку, на языке науки 7 букв
похожие кроссворды
- Химический элемент, неметалл, элемент vi группы 5 букв
- Химический элемент, редкоземельный металл, элемент iii группы 6 букв
- Химический элемент, редкоземельный металл, элемент iii группы букв
- Химический элемент, радиоактивный элемент, металл
- Химический элемент, радиоактивный элемент, металл 8 букв
- Sm, химический элемент, 62, металл группы лантаноидов
- Редко встречающийся химический элемент из группы платиновых металлов
- Химический элемент, металл платиновой группы
- Радиоактивный химический элемент группы галогенов
- Химический элемент, металл группы лантаноидов, редкоземельный 7 букв
- Химический элемент из группы платиновых металлов 8 букв
- Химический элемент vi группы, неметалл 4 буквы
- Химический элемент 1 группы периодической системы менделеева 6 букв
- Химический элемент 1 группы 6 букв
- Химический элемент 5 группы, простое вещество 6 букв
- Химический элемент группы галогенов.
 (астат, цезий, пирит, тавот) 5 букв
(астат, цезий, пирит, тавот) 5 букв
2.5: Менделеев и таблица Менделеева
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 351211
Цели обучения
- Объяснить, как элементы организованы в периодическую таблицу.
- Опишите, как некоторые характеристики элементов связаны с их положением в периодической таблице.
Периодическая таблица для многих является символом химии. Это единое изображение, содержащее все известные элементы вселенной, объединенные в удобочитаемую таблицу. В таблице также присутствует множество шаблонов. Кажется, что все элементы подходят друг другу, соединяясь, чтобы сформировать «образ химии». Идея элементов впервые возникла в 3000 г. до н.э. Великий греческий философ Аристотель выдвинул идею, что все на земле состоит из этих элементов. В древние времена такие элементы, как золото и серебро, были легко доступны, однако элементы, которые выбрал Аристотель, были Земля, Вода, Огонь и Воздух.
В таблице также присутствует множество шаблонов. Кажется, что все элементы подходят друг другу, соединяясь, чтобы сформировать «образ химии». Идея элементов впервые возникла в 3000 г. до н.э. Великий греческий философ Аристотель выдвинул идею, что все на земле состоит из этих элементов. В древние времена такие элементы, как золото и серебро, были легко доступны, однако элементы, которые выбрал Аристотель, были Земля, Вода, Огонь и Воздух.
Возникающие закономерности и периодичность в известных элементах
Современная таблица Менделеева возникла благодаря длительной истории попыток химиков упорядочить элементы в соответствии с их свойствами, чтобы помочь в предсказании химического поведения. Одним из первых, кто предложил такое расположение, был немецкий химик Иоганн Доберейнер (1780–1849), который заметил, что многие известные элементы можно сгруппировать в триады. Триада — это набор из трех элементов, обладающих сходными свойствами, например, хлор, бром и йод; медь, серебро и золото. Доберейнер предложил сгруппировать все элементы в такие триады, но последующие попытки расширить его концепцию не увенчались успехом.
Доберейнер предложил сгруппировать все элементы в такие триады, но последующие попытки расширить его концепцию не увенчались успехом.
К середине 19 века были определены атомные массы многих элементов. Такие ученые, как Джон Ньюлендс и Александр-Эмиль Бегуйе де Шанкуртуа, создали свои собственные версии периодических таблиц. Английский химик Джон Ньюлендс (1838–1898), выдвинувший гипотезу о том, что химический состав элементов может быть связан с их массой, расположил известные элементы в порядке возрастания атомной массы и обнаружил, что каждый седьмой элемент обладает сходными свойствами. Поэтому Ньюлендс предположил, что элементы можно разделить на октавы. Он описал октавы как группу из семи элементов, которые соответствуют горизонтальным рядам в основных группах сегодняшней таблицы Менделеева. Элементов было семь, потому что инертные газы в то время не были известны. К сожалению, «закон октав» Ньюлендса, похоже, не работал для элементов тяжелее кальция, и его идея была публично высмеяна.
Периодическая таблица: Менделеев и Мейер
Периодическая таблица приобрела свою современную форму благодаря работам немецкого химика Юлиуса Лотара Мейера (1830–1895) и русского химика Дмитрия Менделеева (1834–1907), оба из которых сосредоточился на отношениях между атомной массой и различными физическими и химическими свойствами. В 1869 году они независимо друг от друга предложили практически одинаковое расположение элементов. Мейер выровнял элементы в своей таблице в соответствии с периодическими изменениями простых атомных свойств, таких как «атомный объем», который он получил путем деления атомной массы (молярной массы) в граммах на моль на плотность элемента в граммах на кубический сантиметр. . Это свойство эквивалентно тому, что сегодня определяется как молярный объем — молярная масса элемента, деленная на его плотность (измеряется в кубических сантиметрах на моль): 9{3}/моль \right ) \tag{3.1.1} \]
Менделееву, впервые опубликовавшему свою периодическую таблицу в 1869 г. (рис. \(\PageIndex{1}\) ), обычно приписывают происхождение современная периодическая таблица. Ключевое различие между его расположением элементов и расположением Мейера и других заключается в том, что Менделеев не предполагал, что все элементы были открыты (фактически в то время было известно только около двух третей встречающихся в природе элементов). . Вместо этого он намеренно оставил в своей таблице пробелы для атомных масс 44, 68, 72 и 100 — в надежде, что элементы с такими атомными массами будут обнаружены. Эти пробелы соответствуют элементам, которые мы теперь знаем как скандий, галлий, германий и технеций.
(рис. \(\PageIndex{1}\) ), обычно приписывают происхождение современная периодическая таблица. Ключевое различие между его расположением элементов и расположением Мейера и других заключается в том, что Менделеев не предполагал, что все элементы были открыты (фактически в то время было известно только около двух третей встречающихся в природе элементов). . Вместо этого он намеренно оставил в своей таблице пробелы для атомных масс 44, 68, 72 и 100 — в надежде, что элементы с такими атомными массами будут обнаружены. Эти пробелы соответствуют элементам, которые мы теперь знаем как скандий, галлий, германий и технеций.
 Атомные массы показаны после знаков равенства и увеличиваются в каждой строке слева направо.
Атомные массы показаны после знаков равенства и увеличиваются в каждой строке слева направо.Группы в таблице Менделеева определяются тем, сколько атомов кислорода или водорода необходимо для образования соединений с каждым элементом. Например, в группе I два атома водорода (H), лития (Li), натрия (Na) и калия (K) образуют соединения с одним атомом кислорода. В группе VII один атом фтора (F), хлора (Cl) и брома (Br) взаимодействует с одним атомом водорода. Обратите внимание, как у этого подхода возникают проблемы с переходными металлами. Примерно до 1960, прямоугольная таблица, основанная на реактивности и разработанная на основе таблицы Менделеева, была стандартной перед лекционными аудиториями химии.
Наиболее убедительным свидетельством в пользу менделеевского расположения элементов было открытие двух ранее неизвестных элементов, свойства которых близко соответствовали его предсказаниям (таблица \(\PageIndex{1}\) ). Два пробела, которые Менделеев оставил в своей первоначальной таблице, находились под алюминием и кремнием, ожидая открытия двух пока неизвестных элементов, эка — алюминий и эка — кремний (от санскритского эка , что означает «один», как в «один за алюминием»). Наблюдаемые свойства галлия и германия настолько соответствовали свойствам eka — алюминия и eka — кремния, что после их открытия периодическая таблица Менделеева быстро получила признание.
Наблюдаемые свойства галлия и германия настолько соответствовали свойствам eka — алюминия и eka — кремния, что после их открытия периодическая таблица Менделеева быстро получила признание.
Видео \(\PageIndex{1}\): Гениальная таблица Менделеева.
| Недвижимость | eka -Алюминий (прогноз) | Галлий (наблюдаемый) | eka -кремний (прогноз) | Германий (наблюдается) |
|---|---|---|---|---|
| “> атомная масса | 68 | 69.723 | 72 | 72,64 |
| элемент | металл | металл | грязно-серый металл | серо-белый металл |
| “> низкотемпературный* | т.пл. = 29,8°С | высокая температура | т.пл. = 938°С | |
| d = 5,9 г/см 3 | d = 5,91 г/см 3 | d = 5,5 г/см 3 | d = 5,323 г/см 3 | |
| оксид | “> Е 2 О 3 | Га 2 О 3 | ЭО 2 | ГеО 2 |
| d = 5,5 г/см 3 | d = 6,0 г/см 3 | d = 4,7 г/см 3 | d = 4,25 г/см 3 | |
| ” rowspan=”2″> хлорид | ECl 3 | GaCl 3 | ECl 4 | GeCl 4 |
| летучий | т.пл. = 78°С п.н.* = 201°C | п.н. < 100°C | п.н. = 87°C | |
*т.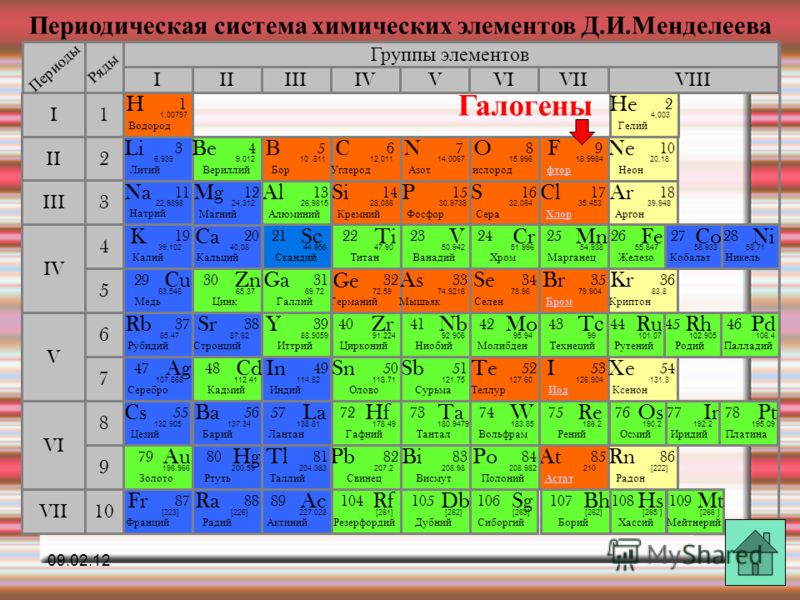 пл. = температура плавления; кп = температура кипения. пл. = температура плавления; кп = температура кипения. | ||||
Когда химические свойства элемента предполагали, что ему, возможно, было отведено неправильное место в более ранних таблицах, Менделеев тщательно пересмотрел его атомную массу. Он обнаружил, например, что ранее сообщавшиеся атомные массы бериллия, индия и урана были неверными. Первоначально сообщалось, что атомная масса индия составляет 75,6, исходя из предполагаемой стехиометрии InO для его оксида. Если бы эта атомная масса была правильной, то индий должен был бы быть помещен в середину неметаллов, между мышьяком (атомная масса 75) и селеном (атомная масса 78). Поскольку элементарный индий — серебристо-белый металл , однако Менделеев постулировал, что стехиометрия его оксида действительно In 2 O 3 , а не InO. Это означает, что атомная масса индия на самом деле равна 113, что ставит этот элемент между двумя другими металлами, кадмием и оловом.
Одна группа элементов, которая отсутствовала в таблице Менделеева, — это благородные газы, все они были открыты более чем 20 лет спустя — между 1894 и 1898 годами — сэром Уильямом Рамзи (1852–1916; Нобелевская премия по химии 19).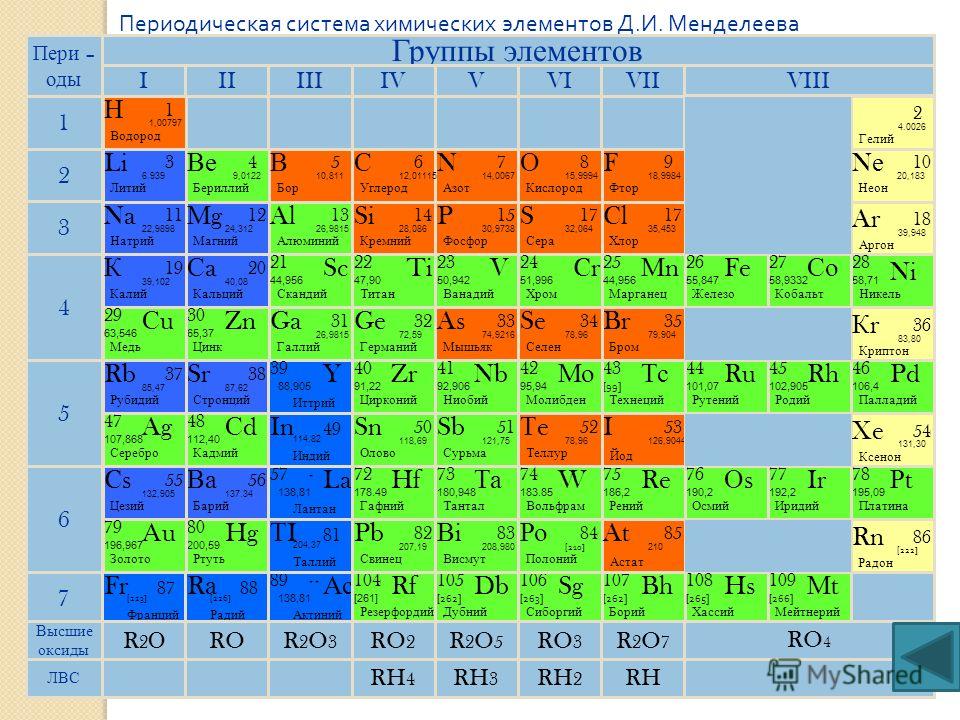 04). Изначально Рамзи не знал, где разместить эти элементы в периодической таблице. Аргон, открытый первым, имел атомную массу 40. Это больше, чем у хлора, и сравнимо с массой калия; поэтому Рамзи, рассуждая так же, как Менделеев, решил поместить благородные газы между галогенами и щелочными металлами. Однако в 1913 г. молодой британский физик Х. Г. Дж. Мозли (1887–1915) проанализировал частоты рентгеновских лучей, испускаемых элементами, и обнаружил, что в основе порядка элементов лежит атомный номер — не атомная масса. Мозли предположил, что размещение каждого элемента в его ряду соответствует его атомному номеру Z , который представляет собой количество положительных зарядов (протонов) в его ядре. Мозли оставил свою исследовательскую работу в Оксфордском университете, чтобы присоединиться к британской армии в качестве офицера связи во время Первой мировой войны. Он был убит во время битвы при Галлиполи в Турции. Наконец, в 1945 году Манхэттенский проект привел к открытию многих новых радиоактивных элементов.
04). Изначально Рамзи не знал, где разместить эти элементы в периодической таблице. Аргон, открытый первым, имел атомную массу 40. Это больше, чем у хлора, и сравнимо с массой калия; поэтому Рамзи, рассуждая так же, как Менделеев, решил поместить благородные газы между галогенами и щелочными металлами. Однако в 1913 г. молодой британский физик Х. Г. Дж. Мозли (1887–1915) проанализировал частоты рентгеновских лучей, испускаемых элементами, и обнаружил, что в основе порядка элементов лежит атомный номер — не атомная масса. Мозли предположил, что размещение каждого элемента в его ряду соответствует его атомному номеру Z , который представляет собой количество положительных зарядов (протонов) в его ядре. Мозли оставил свою исследовательскую работу в Оксфордском университете, чтобы присоединиться к британской армии в качестве офицера связи во время Первой мировой войны. Он был убит во время битвы при Галлиполи в Турции. Наконец, в 1945 году Манхэттенский проект привел к открытию многих новых радиоактивных элементов. Гленн Т. Сиборг предложил добавить ряды актинидов и лантанидов в нижнюю часть таблицы. Эта идея пришла с открытием америция и кюрия и их уникальных свойств. Сначала это изменение не было принято, но теперь оно включено во все периодические таблицы. Рисунок \(\PageIndex{2}\) показывает период времени для обнаружения различных элементов.
Гленн Т. Сиборг предложил добавить ряды актинидов и лантанидов в нижнюю часть таблицы. Эта идея пришла с открытием америция и кюрия и их уникальных свойств. Сначала это изменение не было принято, но теперь оно включено во все периодические таблицы. Рисунок \(\PageIndex{2}\) показывает период времени для обнаружения различных элементов.
- До 1800 г. (36 элементов): Открытия во время и до эпохи Просвещения.
- 18:00-18:49 (+22 элемента): Импульс научной революции, теории атома и промышленной революции.
- 1850-1899 (+23 элемента): Эпоха Классифицирующих Элементов получила импульс от Спектрального анализа.
- 1900-1949 (+13 элементов): Импульс из старой квантовой теории, уточнений периодической таблицы и квантовой механики.
- 1950–1999 (+15 элементов): Манхэттенский проект и вопросы физики элементарных частиц для атомных номеров 97 и выше.

Каждый элемент в современной периодической таблице представлен своим атомным номером и атомной массой (Рисунок \(\PageIndex{3}\)). атомная масса каждого элемента находится под символом элемента в таблица Менделеева. Примеры показаны ниже. Атомная масса олова (Sn) составляет 118,71 ед., тогда как атомная масса углерода (С) составляет 12,011 ед. С другой стороны, атомный номер (Z) каждого элемента находится на выше атомного символа.
Рисунок \(\PageIndex{3}\): Ключевая информация об элементе, указанном в записях Периодической таблицы. (общественное достояние; Pubchem)Периодическую таблицу можно найти по этой ссылке:
https://pubchem.ncbi.nlm.nih.gov/periodic-table/png/Periodic_Table_of_Elements_w_Atomic_Mass_PubChem.png
Резюме
- Современная периодическая таблица была основана на эмпирических корреляциях таких свойств, как атомная масса; ранние модели с использованием ограниченных данных отмечали существование триад и октав элементов со схожими свойствами.

- Периодическая таблица приобрела свой нынешний вид благодаря работам Дмитрия Менделеева и Юлиуса Лотара Мейера, оба из которых сосредоточились на взаимосвязи между атомной массой и химическими свойствами.
- Корреляция с электронной структурой атомов была открыта, когда Г. Г. Дж. Мозли показал, что периодическое расположение элементов определяется атомным номером, а не атомной массой.
Авторы и ссылки
- Анонимно
Изменено Джошуа Халперном (Университет Говарда)
- Гений Менделева от TED Ed на YouTube
Эд Витц (Университет Куцтауна), Джон В. Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавьер Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан.
Мариса Альвиар-Агню (Городской колледж Сакраменто)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Показать страницу TOC
- № на стр.

- Включено
- да
- Теги
- источник[1]-хим-152144
Периодическая система: математический подход | От Менделеева до Оганесона: мультидисциплинарный взгляд на периодическую таблицу
Фильтр поиска панели навигации Oxford Academic от Менделеева до Оганесона: мультидисциплинарный взгляд на периодическую таблицу Физическая химияКнигиЖурналы Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford Academic от Менделеева до Оганесона: мультидисциплинарный взгляд на периодическую таблицу Физическая химияКнигиЖурналы Термин поиска на микросайте
Расширенный поиск
Иконка Цитировать Цитировать
Разрешения
- Делиться
- Твиттер
- Подробнее
Cite
Restrepo, Guillermo,
‘The Periodic System: A Mathematical Approach’
,
in Eric Scerri, and Guillermo Restrepo (eds)
,
Mendeleev to Oganesson: A Multidisciplinary Perspective on the Periodic Таблица
(
Нью-Йорк,
2018;
онлайн-издание,
Oxford Academic
, 12 ноября 2020 г.
), https://doi.org/10.1093/oso/9780190668532.003.0007,
, по состоянию на 28 ноября 2022 г.
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации Oxford Academic от Менделеева до Оганесона: мультидисциплинарный взгляд на периодическую таблицу Физическая химияКнигиЖурналы Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford Academic от Менделеева до Оганесона: мультидисциплинарный взгляд на периодическую таблицу Физическая химияКнигиЖурналы Термин поиска на микросайте
Advanced Search
Abstract
Периодическая таблица, несмотря на то, что ей почти 150 лет, по-прежнему является важной научной конструкцией.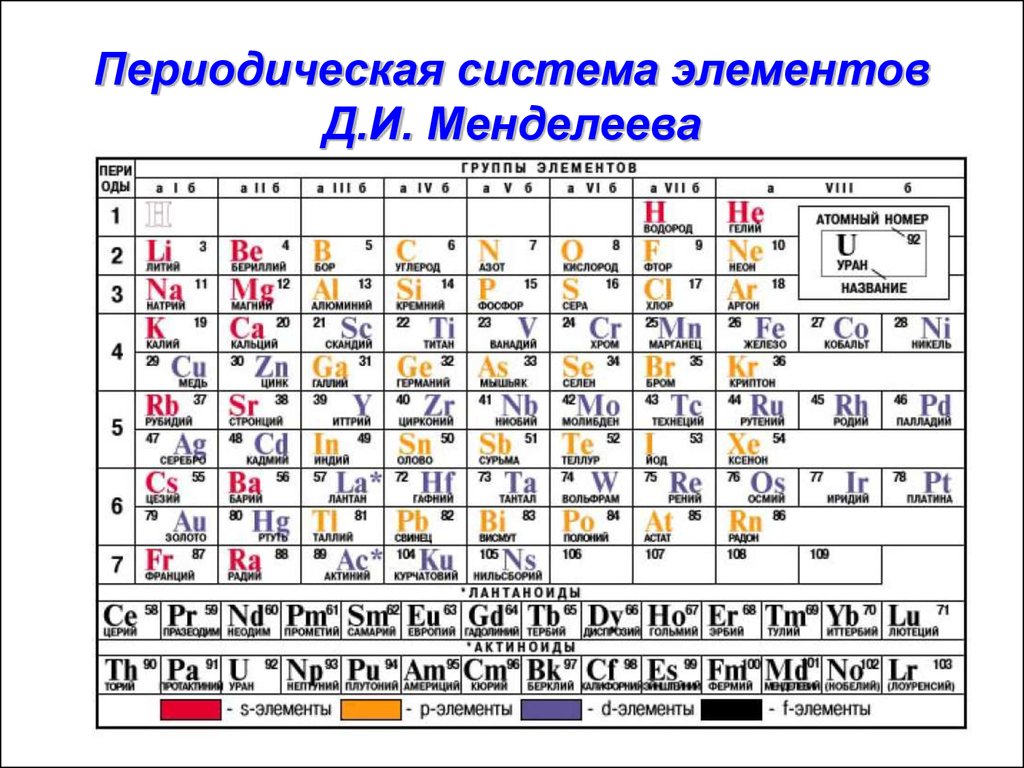 Двумя примерами этой жизнеспособности являются недавняя формулировка периодической таблицы белковых комплексов (Ahnert et al., 2015) и объявление о четырех новых химических элементах (Van Noorden, 2016). «Интересно, что не существует формального определения «периодической таблицы», — утверждает Кароль (2017) в своей главе текущего тома. И что еще хуже, связанные понятия, которые вступают в игру при обращении к периодической таблице (например, периодический закон, химический элемент, периодическая система и некоторые другие), перекрываются, что приводит к путанице. В этой главе мы исследуем значение периодической таблицы и некоторых связанных с ней терминов. При этом мы выделяем несколько распространенных ошибок, возникающих из-за смешения этих терминов и неправильного толкования других. Изучая периодическую таблицу, мы анализируем ее математику и обсуждаем недавний комментарий Хоффмана (2015): «По моему опыту никто не пытается доказать [таблицу Менделеева] неправильность, они просто хотят найти какую-то основную причину, почему она верна.
Двумя примерами этой жизнеспособности являются недавняя формулировка периодической таблицы белковых комплексов (Ahnert et al., 2015) и объявление о четырех новых химических элементах (Van Noorden, 2016). «Интересно, что не существует формального определения «периодической таблицы», — утверждает Кароль (2017) в своей главе текущего тома. И что еще хуже, связанные понятия, которые вступают в игру при обращении к периодической таблице (например, периодический закон, химический элемент, периодическая система и некоторые другие), перекрываются, что приводит к путанице. В этой главе мы исследуем значение периодической таблицы и некоторых связанных с ней терминов. При этом мы выделяем несколько распространенных ошибок, возникающих из-за смешения этих терминов и неправильного толкования других. Изучая периодическую таблицу, мы анализируем ее математику и обсуждаем недавний комментарий Хоффмана (2015): «По моему опыту никто не пытается доказать [таблицу Менделеева] неправильность, они просто хотят найти какую-то основную причину, почему она верна. ” Мы утверждаем, что если бы периодическая таблица была «неправильной», то ее структура была бы изменчивой; однако проверка временем, в том числе исследования подобия, показывают, что она довольно неизменна. Подход к структуре периодической системы, которому мы следуем в этой главе, основан на подобии. При этом мы рассматриваем семь работ, в которых рассматривается сходство химических элементов с учетом разного количества элементов и использования различных свойств, как химических, так и физических. Понятие «химический элемент» вызвало интерес у некоторых ученых, таких как Панет (1962) и до сих пор является предметом обсуждения, учитывая его двойное значение (см., например, Scerri 2007, Earley 2009, Ruthenberg 2009, Ghibaudi et al. 2013, van Brakel 2014, Restrepo & Harré 2015), что сбивает с толку, ведет к заблуждениям. Два значения понятия химического элемента – это основное и простое вещество. Согласно Панету (1962), основная субстанция принадлежит трансцендентному миру и лишена качеств, а потому не воспринимается нашими органами чувств.
” Мы утверждаем, что если бы периодическая таблица была «неправильной», то ее структура была бы изменчивой; однако проверка временем, в том числе исследования подобия, показывают, что она довольно неизменна. Подход к структуре периодической системы, которому мы следуем в этой главе, основан на подобии. При этом мы рассматриваем семь работ, в которых рассматривается сходство химических элементов с учетом разного количества элементов и использования различных свойств, как химических, так и физических. Понятие «химический элемент» вызвало интерес у некоторых ученых, таких как Панет (1962) и до сих пор является предметом обсуждения, учитывая его двойное значение (см., например, Scerri 2007, Earley 2009, Ruthenberg 2009, Ghibaudi et al. 2013, van Brakel 2014, Restrepo & Harré 2015), что сбивает с толку, ведет к заблуждениям. Два значения понятия химического элемента – это основное и простое вещество. Согласно Панету (1962), основная субстанция принадлежит трансцендентному миру и лишена качеств, а потому не воспринимается нашими органами чувств.
Ключевые слова: Актиноиды, Основное вещество, Теория категорий, Диагональные соотношения, Электромагнитные свойства, Гидриды, Лантаноиды, Математический подход, Благородные газы, Оксиды
Предмет
Физическая химия
В настоящее время у вас нет доступа к этой главе.
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Нажмите Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.
- Просмотр институциональных учетных записей, предоставляющих доступ.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции.

 (астат, цезий, пирит, тавот) 5 букв
(астат, цезий, пирит, тавот) 5 букв