V группа главная подгруппа периодической таблицы Менделеева (азот, фосфор)
1 Общая характеристика элементов 5 группы главной подгруппы
2 Нахождение в природе азота и фосфора
3 Аллотропные модификации фосфора
4 Азот
4.1 Способы получения азота
4.2 Химические свойства азота
5 Фосфор
5.1 Способы получения фосфора
5.2 Химические свойства фосфора
К элементам главной подгруппы V группы периодической таблицы Менделеева относятся:
- Азот N
- Фосфор P
- Мышьяк As
- Сурьма Sb
- Висмут Bi
Общая характеристика элементов 5 группы главной подгруппы
От N к Bi (сверху вниз в периодической таблице)
Увеличивается
- атомного радиуса,
- металлических, основных, восстановительных свойств,
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.

Электронные конфигурации у данных элементов схожи, все они содержат 5 электронов на внешнем слое ns2np3:
N – 2s2 2p3;
P – 3s23p3;
As – 4s2 4p3;
Sb – 5s2 5p3;
Bi – 6s2 6p3
Db – 7s27p3
Электронное строение азота и фосфора
Нахождение в природе азота и фосфора
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Фосфор встречается только в виде соединений. В
основном это апатиты (например, Ca3(PO4)2),
фосфориты и др.). Фосфор входит в состав важнейших биологических соединений — фосфолипидов.
Аллотропные модификации фосфора
Азот
Способы получения азота
Лабораторный способ
- Разложение азидов щелочных металлов:
2NaN3 → 2Na + 3N2
- Разложение некоторых солей аммония
NH4NO2 → N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
- Окисление аммиака и солей аммония:
4NH3 + 3O2 → 2N2 + 6H2O
8NH3 + 3Br2 → 2N2 + 6NH4Br
NH4Cl + NaNO2 → N2 + NaCl + 2H2O
- Восстановление оксида меди (II) аммиаком при температуре ~700°C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
- Пропускание воздуха над раскаленной медью.

2Cu + O2 = 2CuO
Промышленный способ
- Т.к. азот в свободном состоянии присутствует в воздухе, то в промышленности его и получают путем разделения воздушной смеси (ректификация жидкого воздуха).
Кроме этого, широко применяются азотные установки и станции, для адсорбционного и мембранного разделения
Химические свойства азота
Молекула азота химически устойчива, вследствие чего азот химически инертен.
Но при определенных условиях он реагирует с металлами, тяжелее с неметаллами.
В реакциях с металлами он выступает в качестве восстановителя, а в реакциях с неметаллами – в качестве окислителя.
Со сложными веществами азот практически не взаимодействует, т.к. его реакционная способность очень мала.
Реакция
возможна только с активными веществами и в жестких условиях.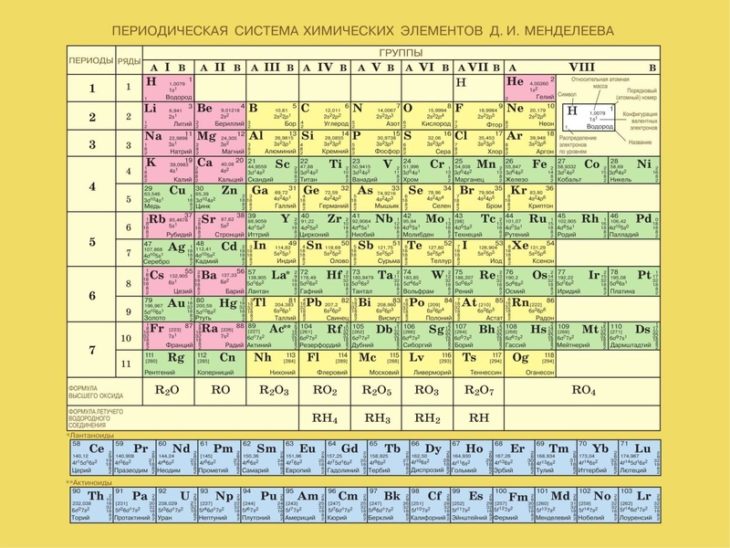
Взаимодействие азота с простыми веществами
С кислородом
С кислородом взаимодействует только при
температуре электрических искровых разрядов (2000
N2 + O2 ⇄ 2NO – Q
Процесс сопровождается поглощением теплоты (эндотермическая реакция)
С галогенами (F, Cl, Br, I)
Взаимодействует только со фтором, с образованием фторида азота:
N2 + 3F2 = 2NF3
С водородом
Взаимодействует с водородом с образованием аммиака. Реакция обратима, поэтому для смещения равновесия в сторону продуктов реакции реакцию проводят в присутствии катализатора, при высоком давлении и высокой температуре:
При этом происходит выделение теплоты (экзотермическая реакция)
С серой
Не взаимодействует
С фосфором
Не взаимодействует
С углеродом
Реакция протекает при высокой температуре (2000оС или действие электрического разряда) с образованием дициана:
2С + N2 → N≡C–C≡N
В присутствии соды реакция протекает с образованием цианид натрия:
2N2 + 5C + 2Na2CО3 = 4NaCN + 3CО2↑
С кремнием
Взаимодействие с кремнием с образованием нитрида кремния
2N2 + 3Si = Si3N4
С металлами
Реагирует с щелочными и щелочноземельными металлами с образованием нитридов
N2 + 6Li = 2Li3N
N2 + 6Cs = 2Cs3N
N2 + 3Mg = Mg3N2
Взаимодействие возможно как с чистым азотом, так и при горении металлов на воздухе
Взаимодействие азота со сложными веществами
С водой
Не взаимодействует
С кислотами
Не взаимодействует
С водными растворами щелочей
Не взаимодействует
С солями
Не взаимодействует
С оксидами
Не взаимодействует
С гидридами активных металлов
Реагирует с образованием нитридов:
N2 + 3LiH → Li3N + NH3
Фосфор
Способы получения фосфора
- Основной способ получения белого фосфора состоит в вакуум-термическом восстановлении природных минералов, содержащих Ca3(PO4)2.

Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 5CO + 2P
Таким способом получается фосфор в газообразном состоянии
- Кроме фосфатов используют и другие неорганические соединения фосфора, например:
4HPO3 + 10C → P4 + 2H2O + 10 CO
- Красный и черный фосфор получают из белого фосфора, при температуре около 400ºС, давлении около 12000 Мпа в присутствии катализатора Hg
Химические свойства фосфора
Фосфор вступает в реакции как с металлами, так и неметаллами. В реакциях с элементами, расположенными ниже и левее в Периодической системе фосфор выступает в качестве
При недостатке окислителя образуются соединения фосфора (III), при избытке — соединения фосфора (V)
Взаимодействие фосфора с простыми веществами
С кислородом
Взаимодействие с кислородом воздуха приводит к образованию оксидов – ангидридов соответствующих кислот:
4P + 3O2 → 2P2O3
4P + 5O2 → 2P2O5
С галогенами (F, Cl, Br, I)
Взаимодействует с галогенами с образованием галогенидов с общей формулой PHal3 – при недостатке галогена и PHal5 – при избытке галогена:
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
С водородом
Непосредственно не взаимодействует
С серой
При взаимодействии с серой образуются сульфиды:
2P + 3S → P2S3
2P + 5S → P2S5
С азотом
Не взаимодействует
Не взаимодействует
С кремнием
С кремнием азот реагирует в очень жестких условиях, с образованием нитридов:
3Si + 2N2→ Si3N4
С металлами
В реакциях с активными металлами фосфор выступает в качестве окислителя, образуя фосфиды металлов:
2Р + ЗСа = Са3Р2
Р + 3Na = Na3P
Взаимодействие фосфора со сложными веществами
С водой
Красный фосфор реагирует с водой при температуре 700-900ºС и в присутствии катализатора (Cu, Pt, Ti, Zr):
2P + 8H2O = 2H3PO4
С кислотами
Взаимодействует с кислотами – окислителями:
Р + 5HNО3(конц.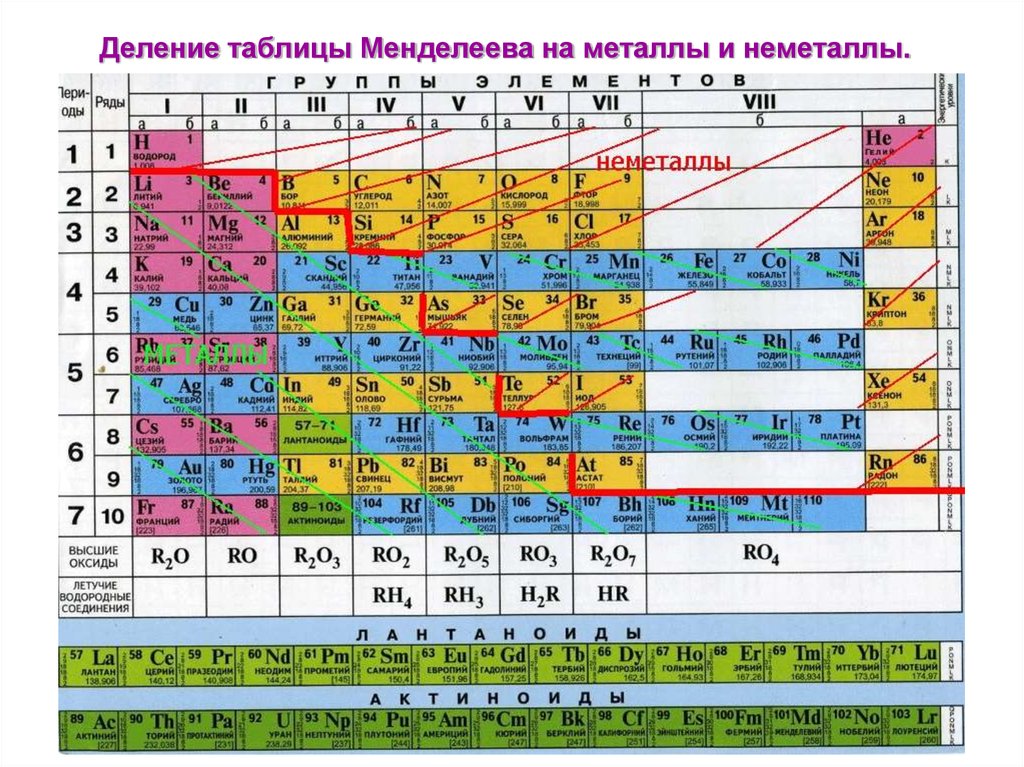 ) = Н3РО4 + 5NО2 + Н2О
) = Н3РО4 + 5NО2 + Н2О
ЗР + 5HNО3(разб.) + 2Н2О = ЗН3РО4 + 5NO
2Р + 5H2SО4(конц.)= 2Н3РО4 + 5SО2 + 2Н2О
С водными растворами щелочей
С щелочными растворами вступает в реакции диспропорционирования, с образованием фосфина:
4Р + ЗКОН + 3Н2О = РH3↑ + ЗКН2PО2
8Р + ЗВа(ОН)2+ 6Н2О = 2PH3↑ +ЗВа(Н2PО2)2
С солями
Не взаимодействует
С оксидами
Взаимодействует с сильными окислителями:
8Р+ 10NО2 = 4P2О5 + 5N2
Категории V группа (азот, фосфор), НЕОРГАНИЧЕСКАЯ ХИМИЯI группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
1 Общая характеристика щелочных металлов
2 Нахождение щелочных металлов в природе
3 Способы получения щелочных металлов
4 Химические свойства щелочных металлов
4. 1 Взаимодействие щелочных металлов с простыми веществами — неметаллами
1 Взаимодействие щелочных металлов с простыми веществами — неметаллами
4.2 Взаимодействие щелочных металлов со сложными веществами
I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы:
Литий Li,
Натрий Na,
Калий K,
Цезий Cs,
Рубидий Rb
Франций Fr
Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина.
Общая характеристика щелочных металлов
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
Электронные конфигурации у данных элементов схожи, все они содержат 1 электрон на внешнем уровне ns1:
Li — 2s1
Na — 3s1
K — 4s1
Rb — 5s1
Cs — 6s1
Fr — 7s1
Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Нахождение щелочных металлов в природе
Способы получения щелочных металлов
Литий
- Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
- Известен также способ получения лития из его оксида в вакууме при 300°С:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Натрий
- Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
- Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Na2CO3 + 2C = 2Na + 3CO
Калий
- Калий получают также электролизом расплавов солей или расплава гидроксида калия, однако на практике таким способом их не получают из-за высокой химической активности
- Наиболее распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов.
 :
:
KCl + Na = K + NaCl
KOH + Na = K + NaOH
В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний
Цезий, Рубидий
- Цезий и рубидий получают восстановлением их хлоридов специально подготовленным кальцием при 700–800 °С:
Са + 2CsCl → 2Cs + CaCl2
- В качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
2Cs2CO3 + Zr = 4Cs + ZrO2 + 2CO2
- В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме
Химические свойства щелочных металлов
Качественные реакции — окрашивание пламени солями щелочных металлов
Цвет пламени:
Li — карминно-красный
Na — желтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Взаимодействие щелочных металлов с простыми веществами — неметаллами
С кислородом
- Литий образует оксид:
4Li + O2 = 2Li2O
- Натрий образует пероксид:
2Na + O2 = Na2O2
- Калий образует надпероксид:
K + O2 = KO2
С галогенами (F, Cl, Br, I)
Щелочные металлы образуют галогениды:
2Li + F2 = 2LiF
2Na + Cl2 = 2NaCl
2K + I2 = 2KI
С водородом
Щелочные металлы образуют гидриды:
2Na + H2 = 2NaH
С серой
Щелочные металлы образуют сульфиды:
2Na + S = Na2S
С азотом
При комнатной температуре взаимодействует только литий:
6Li + N2 = 2Li3N
Остальные щелочные металлы реагируют с азотом при нагревании:
6Na + N2 = 2Na3N
С углеродом
Щелочные металлы при нагревании образуют карбиды, преимущественно ацетилениды:
2Na + 2C → Na2C2 (t = 150-200 °C)
С фосфором
Щелочные металлы активно реагируют с фосфором образуя фосфиды:
3Na + P → Na3P
Взаимодействие щелочных металлов со сложными веществами
С водой
Щелочные металлы реагируют с водой при обычных условиях:
2Na + 2H2O = 2NaOH + H2
Видео Взаимодействие щелочных металлов с водой
С кислотами
- С растворами HCl, H2SO4щелочные металлы взаимодействуют с образованием соли и выделением водорода:
2K + H2SO4(разб) = K2SO4 + H2
- С кислотами-окислителями (HNO3 и конц.
 H2SO4):
H2SO4):
с концентрированной серной:
8Na + 5H2SO4(конц) = 4Na2SO4 + H2S + 4H2O;
с разбавленной азотной
8Na + 10HNO3(разб) = 8NaNO3 + NH4NO3 + 3H2O;
с концентрированной азотной
8Na + 10HNO3(конц) = 8NaNO3 + N2O + 5H2O.
- Со слабыми кислотами
2СH3COOH + 2Li → 2CH3COOOLi + H2↑
С солями
В расплаве щелочные металлы могут взаимодействовать с некоторыми солями:
3Na + AlCl3 → 3NaCl + Al
Запомните! В растворе щелочные металлы взаимодействуют с водой, а не с солями других металлов.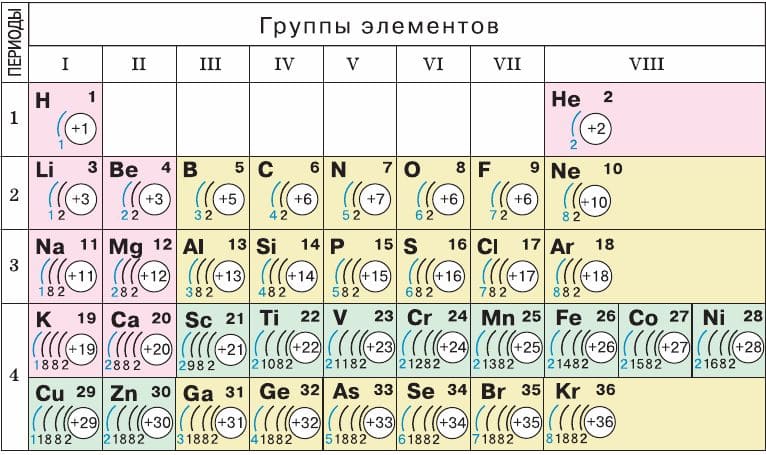
Элементы VII группы периодической таблицы Д.И. Менделеева презентация, доклад
Подготовила:
Студентка 11 группы
Бурлака К.
Проверила:
Лазовская Л. Д.
Элементы VII группы периодической таблицы
Д. И. Менделеева.
Общая характеристика элементов
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов.
Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений.
Все галогены — неметаллы, являются сильными окислителями.
На внешнем энергетическом уровне 7 электронов.
При взаимодействии с металлами возникает ионная связь, и образуются соли.
Периодическая система химических элементов Д.И.Менделеева
К VII группе периодической системы относятся: фтор, хлор, бром, иод, астат – главная группа; побочная – марганец, технеций, рений, борий.
Фтор
История открытия галогенов
Хлор
Бром
Йод
Астат
Марганец
В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C, смог на аноде получить первую порцию нового газа. В первых опытах для получения фтора Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины.
История открытия фтора
Анри Муассан
(1852 – 1907)
В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал “дефлогистированной соляной кислотой”.
В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его “хлорин” (от “хлорос” – желто-зеленый).
Он пришел к выводу, что получил новый элемент и назвал его “хлорин” (от “хлорос” – желто-зеленый).
В 1812 году Гей-Люсеок дал газу название хлор.
Хлор
Карл Вильгельм Шееле
(1742 – 1786)
В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал – “мурид” (от латинского слова muria, означающего “рассол”). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от “бромос”, с греческого “зловонный”).
Бром
Антуан Жером Балар
(1802 – 1876)
В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (правда, очень небольшое количество) фармацевтической фирме в Дижоне.
В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название “иод” происходит от греческого слова “иодэс” – “фиолетовый” (по цвету паров).
Йод
Бернар Куртуа (1777 – 1838 )
В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»).
Впервые астат был получен искусственно в 1940 г открыт Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский университет в Беркли) . Для синтеза изотопа 211At они облучали висмут альфа-частицами.
В 1943-1946 годах изотопы астата были обнаружены в составе природных радиоактивных рядов. Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата.
Астат
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен».
Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен».
В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец.
В начале XIX века для него было принято название «манганум».
Марганец
Физические свойства
Фтор
Фтор
бледножелтый
высокореакционноспособный газ,
вызывающий раздражение
дыхательных путей и коррозию материалов.
.
Хлор
Хлор едкий, химически агрессивный газ темного зеленовато-желтого цвета, менее реакционноспособен по сравнению со фтором.
Бром
Бром – тяжелая красно-коричневая жидкость при обычных условиях, но легко испаряется, превращаясь в едкий газ.
Иод
Иод – темнофиолетовое, с металлическим оттенком, вещество, твердое , но легко сублимирующееся. Часто встречается в виде блестящих серо-черные кристаллов.
Астат
Астат радиоактивный
элемент, единственный галоген, не имеющий стабильного изотопа. Он существует только в следовых
количествах в некоторых минералах.
Марганец
Твёрдый, хрупкий металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам.
Cl2 – свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Хлор вступает в реакцию со многими сложными веществами.
F2 – самый активный неметалл. Он проявляет только одну степень окисления -1, непосредственно реагирует почти со всеми металлами (даже с золотом и платиной), а также с неметаллами. Раствор фтороводорода в воде называют плавиковой кислотой, а ее соли называются фторидами. Химическим путем фтор получить невозможно, поэтому используется исключительно электролиз. Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер.
Химические свойства
Br2 – химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора. Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду».
I2 – иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой. Водный раствор иода называется «иодной водой»[5]. Иод способен растворяться в растворах иодидов с образованием комплексных анионов
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов.
Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием). При диссоциации образуются не только анионы, но и катионы At+ .
Mn – Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны). При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде. Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды. Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители.
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде. Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды. Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители.
Применение элементов VII группы
Применение фтора
Тефлон
Фреон
Окислитель ракетного топлива
Заменитель крови
Фториды в зубных пастах
Применение хлора
Отбеливатели
Производство
HCl
Получение брома, йода
Дезинфекция воды
Органические растворители
Лекарственные препараты
Хлорирование органических веществ
Получение неорганических хлоридов
Применение брома
Лекарственные препараты
Красители
Фотография
Ветеренарные препараты
Ингибиторы
Присадки к бензину
Применение йода
Лекарственные препараты
Фотография
Красители
Дезинфекция одежды
Электролампы
Применение
марганца
Металлургия
Химическая промышленность
Медицина
«Химия-9», О. С.Габриелян, М, Дрофа,2005г, стр 78-90
С.Габриелян, М, Дрофа,2005г, стр 78-90
«Химия в действии», М.Фримантл, М, «Мир»,1991г, стр 269-286.
«Неорганическая химия в таблицах»,Н.В.Манцевич, Минск, Современная школа,2008г, стр 275-280
http://www.chem100.ru/
http://rrc.dgu.ru/res/n-t.ru/ri/ps/index.htm
http://www.periodictable.ru/
http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=35
http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=23
http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=72
http://ru.wikipedia.org/wiki/%D0%A4%D1%80%D1%8D%D0%B4_%D0%90%D0%BB%D0%BB%D0%B8%D1%81%D0%BE%D0%BD
Использованная литература, интернет-ресурсы
Спасибо за внимание!!!
Таблица групп металлов и неметаллов в периодической системе Менделеева: что это такое и как определить самый мягкий элемент
Свойства химических элементов позволяют объединять их в соответствующие группы. На этом принципе была создана периодическая система, изменившая представление о существующих веществах и позволившая предположить существование новых, ранее неизвестных элементов….
На этом принципе была создана периодическая система, изменившая представление о существующих веществах и позволившая предположить существование новых, ранее неизвестных элементов….
Содержание
Периодическая система Менделеева
Периодическая таблица химических элементов была составлена Д. И. Менделеевым во второй половине XIX века. Что такое это, и для чего она нужна? Она объединяет все химические элементы по возрастанию атомного веса, причем, все они расставлены так, что их свойства изменяются периодическим образом.
Периодическая система Менделеева в химии свела в единую систему все существующие элементы, прежде считавшиеся просто отдельными веществами.
На основании ее изучения были предсказаны, а впоследствии — синтезированы новые химические вещества. Значение этого открытия для науки невозможно переоценить, оно значительно опередило свое время и дало толчок к развитию химии на многие десятилетия.
Существует три наиболее распространенных варианта таблицы, которые условно именуются «короткая», «длинная» и «сверхдлинная». Основной считается длинная таблица, она утверждена официально. Отличием между ними является компоновка элементов и длина периодов.
Основной считается длинная таблица, она утверждена официально. Отличием между ними является компоновка элементов и длина периодов.
Что такое период
Система содержит 7 периодов. Они представлены графически в виде горизонтальных строк. При этом, период может иметь одну или две строки, называемые рядами. Каждый последующий элемент отличается от предыдущего возрастанием заряда ядра (количества электронов) на единицу.
Если не усложнять, период — это горизонтальная строка периодической таблицы. Каждый из них начинается металлом и заканчивается инертным газом. Собственно, это и создает периодичность — свойства элементов изменяются внутри одного периода, вновь повторяясь в следующем. Первый, второй и третий периоды — неполные, они называются малыми и содержат соответственно 2, 8 и 8 элементов. Остальные — полные, они имеют по 18 элементов.
Что такое группа
Группа — это вертикальный столбец, содержащий элементы с одинаковым электронным строением или, говоря проще, с одинаковой высшей валентностью.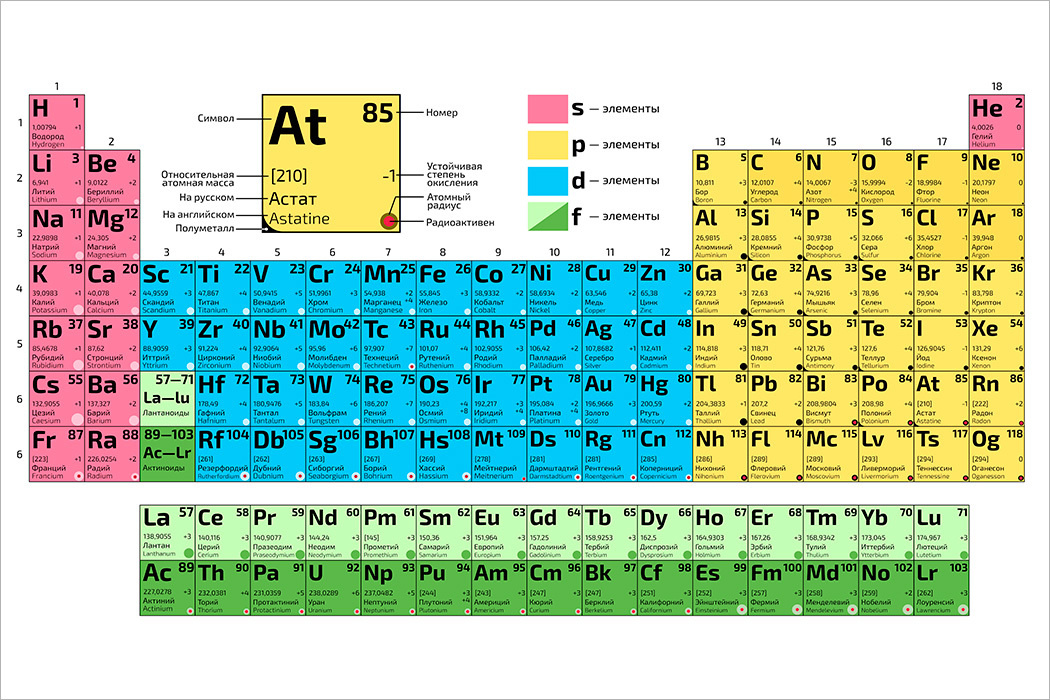 Официально утвержденная длинная таблица содержит 18 групп, которые начинаются со щелочных металлов и заканчиваются инертными газами.
Официально утвержденная длинная таблица содержит 18 групп, которые начинаются со щелочных металлов и заканчиваются инертными газами.
Каждая группа имеет свое название, облегчающее поиск или классификацию элементов. Усиливаются металлические свойства в независимости от элемента по направлению сверху-вниз. Это связано с увеличением количества атомных орбит чем их больше, тем слабее электронные связи, что делает более ярко выраженной кристаллическую решетку.
Металлы в периодической таблице
Металлы в таблице Менделеева имеют преобладающее количество, список их достаточно обширен. Они характеризуются общими признаками, по свойствам они неоднородны и делятся на группы. Некоторые из них имеют мало общего с металлами в физическом смысле, а иные могут существовать только доли секунды и в природе абсолютно не встречаются (по крайней мере, на планете Земля), поскольку созданы, точнее, вычислены и подтверждены в лабораторных условиях, искусственно. Каждая группа имеет собственные признаки, название и довольно заметно отличается от других. Особенно это различие выражено у первой группы.
Особенно это различие выражено у первой группы.
Положение металлов
Какого положение металлов в периодической системе? Элементы расположены по увеличению атомной массы или количества электронов и протонов. Их свойства изменяются периодически, поэтому аккуратного размещения по принципу «один к одному» в таблице нет. Как определить металлы, и возможно ли это сделать по таблице Менделеева? Для того, чтобы упростить вопрос, придуман специальный прием: условно по местам соединения элементов проводится диагональная линия от Бора до Полония (или до Астата). Те, что оказываются слева — металлы, справа — неметаллы. Это было бы очень просто и здорово, но есть исключения — Германий и Сурьма.
Важно! Это работает только в длинной системе, на коротком варианте таблицы Менделеева многие металлы оказываются справа.
Такая «методика» — своего рода шпаргалка, она придумана лишь для упрощения процесса запоминания. Для более точного представления следует запомнить, что список неметаллов составляет всего 22 элемента, поэтому отвечая на вопрос, сколько всего металлов всего содержится в таблице Менделеева
На рисунке можно наглядно увидеть, какие элементы являются неметаллами и как они располагаются в таблице по группам и периодам.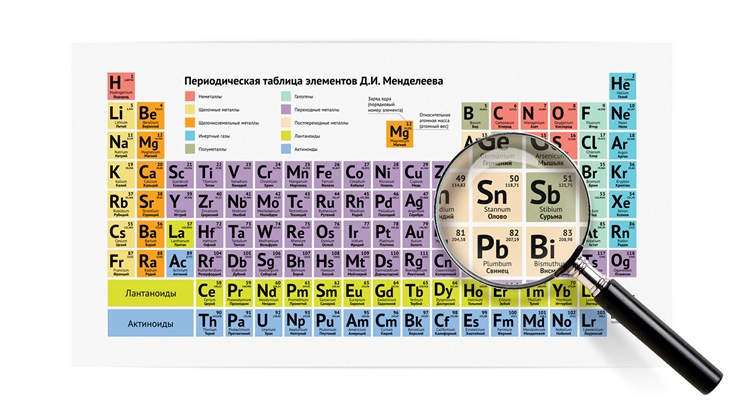
Это интересно! Каково содержание кислорода в воздухе: процентный состав и норма
Общие физические свойства
Существуют общие физические свойства металлов. К ним относятся:
- Пластичность.
- Характерный блеск.
- Электропроводность.
- Высокая теплопроводность.
- Все, кроме ртути, находятся в твердом состоянии.
Следует понимать, что свойства металлов очень различаются относительно их химической или физической сути. Некоторые из них мало похожи на металлы в обыденном понимании этого термина. Например, ртуть занимает особенное положение. Она при обычных условиях находится в жидком состоянии, не имеет кристаллической решетки, наличию которой обязаны своими свойствами другие металлы. Свойства последних в этом случае условны, с ними ртуть роднят в большей степени химические характеристики.
Интересно! Элементы первой группы, щелочные металлы, в чистом виде не встречаются, находясь в составе различных соединений.
Самый мягкий металл, существующий в природе — цезий — относится к этой группе. Он, как и другие щелочные подобные вещества, мало общего имеет с более типичными металлами. Некоторые источники утверждают, что на самом деле, самый мягкий металл калий, что сложно оспорить или подтвердить, поскольку ни тот, ни другой элемент не существует сам по себе будучи выделенным в результате химической реакци они быстро окисляются или вступают в реакцию.
Вторая группа металлов — щелочноземельные — намного ближе к основным группам. Название «щелочноземельные» происходит из древних времен, когда окислы назывались «землями», поскольку они имеют рыхлую рассыпчатую структуру. Более-менее привычными (в обиходном смысле) свойствами обладают металлы начиная с 3 группы. С увеличением номера группы количество металлов убывает, замещаясь неметаллическими элементами. Последняя группа состоит из инертных (или благородных) газов.
Определение металлов и неметаллов в таблице Менделеева. Простые и сложные вещества.
Простые и сложные вещества.
Простые вещества (металлы и неметаллы)
Вывод
Соотношение металлов и неметаллов в таблице Менделеева явно перевешивает в пользу первых. Такое положение свидетельствует о том, что группа металлов объединена слишком широко и требует более подробной классификации, что признается научным сообществом.
Это интересно! Основной закон Гесса и следствия из него
Таблица Менделеева
Таблица Менделеева, (или периодическая система химических элементов) – это таблица, которая квалифицирует химические элементы по различным свойствам, зависящим от заряда атомного ядра. Эта система выражает, в виде таблицы, периодический закон химических элементов, который в 1869 году открыл Русский ученый химик Д. И. Менделеев. Самый первый вариант таблицы, был разработан Менделеевым в 1869-1871 годах, он определял зависимость свойств химических элементов, от атомной массы (в то время это называлось атомным весом). Было предложено несколько сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы.
И. Менделеев. Самый первый вариант таблицы, был разработан Менделеевым в 1869-1871 годах, он определял зависимость свойств химических элементов, от атомной массы (в то время это называлось атомным весом). Было предложено несколько сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы.
Открытие, сделанное Русским химиком Менделеевым, сыграло (безусловно) наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке (физика атома и ядра атома). В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, (он же атомный), есть и мера электрического заряда атомного ядра этого элемента. А номер периода (т.е. горизонтального ряда), определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, (этим самым, элементы одного ряда, обязаны сходством химических свойств).
Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
Одна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп.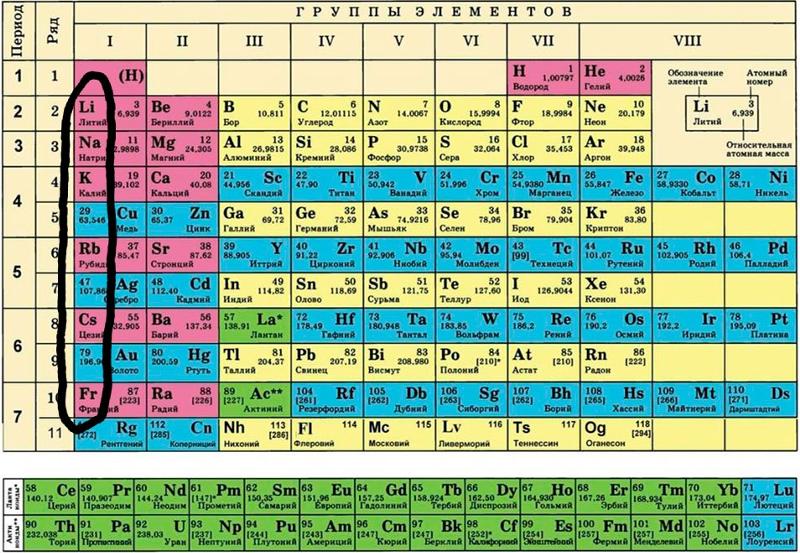 В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» – для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» – после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» – для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» – после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру – «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).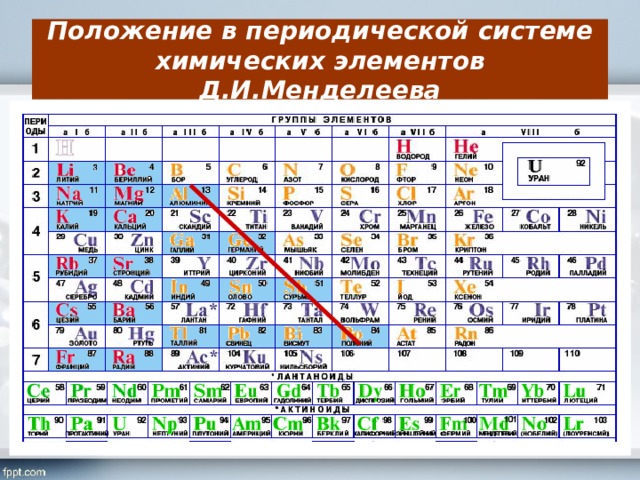
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность , это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме – возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке – с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок – D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок – F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
Периодический закон и периодическая система химических элементов Д. И. Менделеева
Химические элементы — законопослушные граждане! Они подчиняются Периодическому закону, о котором сейчас пойдет речь.
На этой странице вы узнаете:- Закономерности изменения химических свойств элементов и их соединений по периодам и группам в Периодической системе.
- Как связаны снеговик и радиус атома?
Формулировка периодического закона
В 1869 г. Д.И.Менделеев сформулировал периодический закон, современная формулировка которого звучит следующим образом:
Свойства химических элементов находятся в периодической зависимости от заряда ядра атомов химических элементов.
Давай разберем подробнее, как именно зависят свойства элемента от местонахождения в Периодической системе.
Закономерности изменения химических свойств элементов- Металлические/восстановительные свойства
Под металлическими свойствами подразумевают способность атомов отдавать электроны.
Можно провести воображаемую линию, которая начинается у атома бора и заканчивается у атома астата. Так вот, все элементы, которые попадут в левую область таблицы будут являться металлами, а элементы главных подгрупп, которые попадут в правую часть — неметаллами.
| Поэтому металлические/восстановительные свойства в периодах увеличиваются справа налево, а в группах — сверху вниз (т.е. при движении к францию). |
- Неметаллические/окислительные свойства
Здесь работает все с точностью наоборот: они будут увеличиваться слева направо в периодах, а в группах — снизу вверх (т.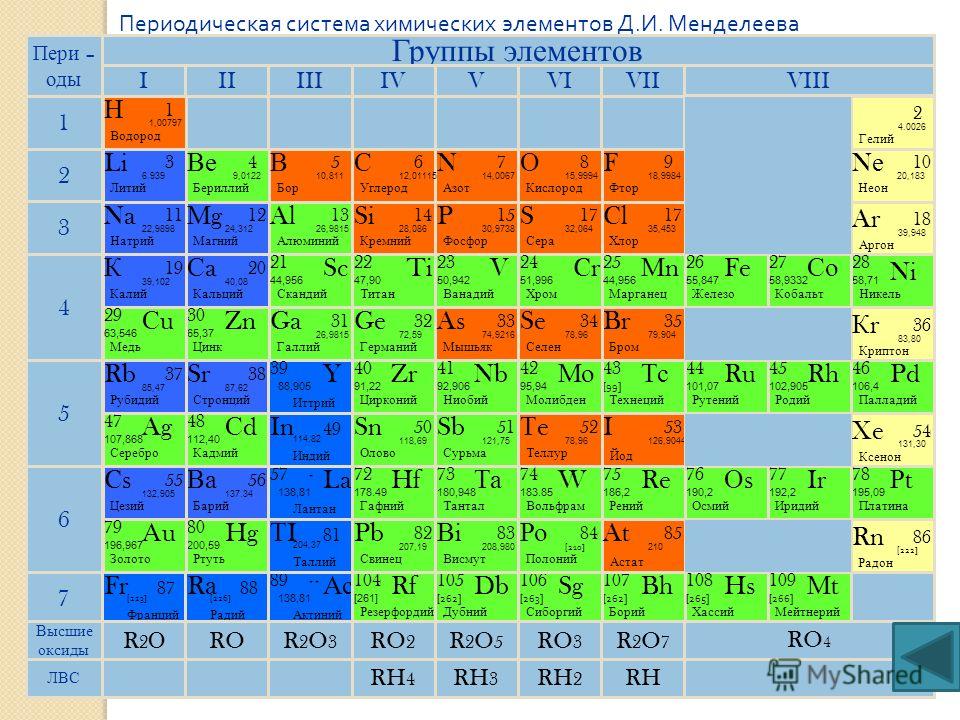 е. при движении к фтору).
е. при движении к фтору).
- Радиус атома
При движении по периоду увеличивается число электронов на соответствующем валентном уровне — электрончики начинают сильнее притягиваться к положительному ядру, тем самым «сжимая» размер радиуса. Т.е. радиус атома уменьшается слева направо при движении по периоду.
При движении по группе сверху вниз увеличивается число электронных оболочек, атом становится «толще», поэтому сверху вниз по группе радиус атома увеличивается.
| Как связаны снеговик и радиус атома? С увеличением номера периода количество электронных слоев растет, а значит, увеличивается и радиус атома; но так как к фтору увеличивается электроотрицательность, то электроны всё ближе и ближе «прижимаются» к ядру атома: атомный радиус уменьшается. Проще всего это представить в виде снеговика, у которого самая «маленькая» голова и самое «большое» туловище. Именно так увеличивается радиус ядра атома по группе. |
- Электроотрицательность
Это способность атомов оттягивать на себя электроны других атомов в химической связи. Электроотрицательность увеличивается при движении в периодической системе слева направо и снизу вверх. Самым электроотрицательным элементом является фтор, это нужно запомнить!
- Основные свойства высших оксидов/гидроксидов
Основные свойства зависят от металлических свойств и меняются точно так же — в периодах увеличиваются справа налево, а в группах — сверху вниз.
- Кислотные свойства высших оксидов/гидроксидов
Кислотные свойства зависят уже от неметаллических свойств и меняются соответствующим образом — увеличиваются слева направо в периодах, а в группах — снизу вверх.
- Высшая/низшая степень окисления
Чтобы определить высшую/низшую степень окисления элемента, необходимо смотреть на номер группы, в которой находится элемент: высшая степень окисления равна номеру группы со знаком «плюс» (+N). Низшая c.o. определяется, как разность номера группы и восьми:
Низшая c.o. определяется, как разность номера группы и восьми:
| Высшая с.o. = N Низшая с.o. = N – 8, где N — номер группы, в которой располагается элемент |
- Высшая/низшая валентность
Здесь используем следующие правила:
Высшая валентность = N
Низшая валентность = 8 — N
| Исключением является азот, у которого максимальная валентность равна IV |
Можно поинтересоваться, а почему так?
У азота есть только основное состояние атома, в котором три неспаренных электрона и неподеленная электронная пара. Возможность «рассорить» эту пару у азота попросту нет! Поэтому возможны следующие варианты:
- один неспаренный электрон = валентность I;
- два неспаренных электрона = валентность II;
- три неспаренных электрона = валентность III;
- три неспаренных электрона + неподеленная электронная пара = валентность IV.

Аналогичные исключения действует для кислорода и фтора, запоминаем их по аббревиатуре FON.
- Кислотные свойства водородных соединений
В группе кислотные свойства зависят от от радиуса атома — чем больше атом, с которым связан водород, тем легче последнему отщепляться от него, поэтому в группе кислотные свойства усиливаются сверху вниз.
В периоде кислотные свойства зависят от неметаллических свойств — они увеличиваются слева направо.
- Энергия ионизации
Это энергия, необходимая для отрыва одного электрона от нейтрального атома. В группах она увеличивается снизу вверх, в периодах — слева направо.
- Сродство к электрону
Это энергия, выделяющаяся при присоединении одного электрона к нейтральному атому. Она изменяется аналогично изменению энергии ионизации.
Фактчек- Таблица Менделеева состоит из «столбцов», т.
 е. групп и «строк», т.е. периодов;
е. групп и «строк», т.е. периодов; - Металлические свойства связаны со способностью отдавать электроны;
- Радиус атома увеличивается при увеличении числа электронных оболочек;
- Высшая валентность для большинства элементов равна номеру группы.
Задание 1.
Какова высшая валентность алюминия?
- I;
- II;
- III;
- IV.
Задание 2.
Водородное соединение какого элемента обладает наибольшими основными свойствами?
- Азот;
- Фосфор;
- Сурьма;
- Мышьяк.
Задание 3.
Из перечисленных элементов металлом является:
- Кремний;
- Франций;
- Радон;
- Астат.
Задание 4.
Гидроксид какого элемента проявляет основные свойства?
- Серы;
- Хлора;
- Рубидия;
- Фосфора.
Ответы: 1. — 3 ; 2. — 1; 3. — 2; 4. — 3.
— 1; 3. — 2; 4. — 3.
периодическая таблица | Определение, элементы, группы, сборы, тенденции и факты
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Дмитрий Менделеев Лотар Мейер Поль-Эмиль Лекок де Буабодран
- Похожие темы:
- химический элемент атом группа периодический закон период
Просмотреть весь связанный контент →
Популярные вопросы
Что такое периодическая таблица?
Периодическая таблица представляет собой табличный массив химических элементов, упорядоченных по атомному номеру, от элемента с наименьшим атомным номером, водорода, до элемента с наибольшим атомным номером, оганесона. Атомный номер элемента — это число протонов в ядре атома этого элемента. У водорода 1 протон, а у оганесона 118.
Что общего у групп периодической таблицы?
Группы периодической таблицы отображаются в виде вертикальных столбцов, пронумерованных от 1 до 18. Элементы в группе имеют очень похожие химические свойства, которые возникают из-за количества присутствующих валентных электронов, то есть количества электронов в внешняя оболочка атома.
Элементы в группе имеют очень похожие химические свойства, которые возникают из-за количества присутствующих валентных электронов, то есть количества электронов в внешняя оболочка атома.
Откуда взялась периодическая таблица?
Расположение элементов в периодической таблице определяется электронной конфигурацией элементов. Из-за принципа запрета Паули не более двух электронов могут занимать одну и ту же орбиталь. Первый ряд периодической таблицы состоит всего из двух элементов, водорода и гелия. Чем больше у атомов электронов, тем больше у них орбит, доступных для заполнения, и, таким образом, строки содержат больше элементов в нижней части таблицы.
Почему таблица Менделеева делится?
Периодическая таблица имеет две строки внизу, которые обычно отделены от основной части таблицы. Эти ряды содержат элементы лантаноидного и актиноидного рядов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (актиний до лоуренсия) соответственно. Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
Сводка
Прочтите краткий обзор этой темы
периодическая таблица , полностью периодическая таблица элементов , в химии систематизированный массив всех химических элементов в порядке возрастания атомного номера, т. е. общее количество протонов в атомном ядре. Когда химические элементы расположены таким образом, в их свойствах возникает повторяющаяся закономерность, называемая «периодическим законом», при которой элементы в одном столбце (группе) обладают сходными свойствами. Первоначальное открытие, которое сделал Д.И. Менделеев в середине 19ХХ века, сыграл неоценимую роль в развитии химии.
Изучите периодический закон химии, чтобы понять свойства элементов и то, как они связаны друг с другом их атомных номеров, целые числа которых равны положительным электрическим зарядам атомных ядер, выраженным в электронных единицах. В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
История периодического закона
Узнайте, как устроена таблица Менделеева
Просмотреть все видео к этой статье В первые годы XIX века наблюдалось бурное развитие аналитической химии — искусства различать различные химические вещества — и, как следствие, накопление обширных знаний о химических и физических свойствах как элементов, так и соединений. Это быстрое распространение химических знаний вскоре потребовало классификации, ибо на классификации химических знаний основана не только систематизированная литература по химии, но и лабораторное искусство, с помощью которого химия передается как живая наука от одного поколения химиков к другому. Отношения между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отставала от классификации соединений. Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Дж.В. Доберейнер в 1817 году показал, что совокупный вес, то есть атомный вес, стронция находится посередине между весами кальция и бария, а несколько лет спустя он показал, что существуют и другие подобные «триады» (хлор, бром и йод [галогены] и литий, натрий и калий [щелочные металлы]). Ж.-Б.-А. Дюма, Л. Гмелин, Э. Ленссен, Макс фон Петтенкофер и Дж. П. Кук расширили предположения Доберейнера между 1827 и 1858 гг., показав, что подобные отношения простираются дальше, чем триады элементов: фтор добавляется к галогенам, а магний — к щелочноземельным. металлы, в то время как кислород, сера, селен и теллур были отнесены к одному семейству, а азот, фосфор, мышьяк, сурьма и висмут – к другому семейству элементов.
Britannica Quiz
36 вопросов из самых популярных научных викторин Britannica
Насколько хорошо вы знаете астрономию? Как насчет квантовой механики? Эта викторина проведет вас через 36 самых сложных вопросов из самых популярных викторин Britannica о естественных науках. Только лучшие викторины закончат его.
Только лучшие викторины закончат его.
Позднее были предприняты попытки показать, что атомные массы элементов могут быть выражены арифметической функцией, и в 1862 г. А.-Э.-Б. де Шанкуртуа предложил классификацию элементов, основанную на новых значениях атомных весов, данных системой Станислао Канниццаро 1858 года. Де Шанкуртуа нанес атомные веса на поверхность цилиндра с окружностью 16 единиц, что соответствует приблизительному атомному весу кислород. Получившаяся винтовая кривая перенесла тесно связанные элементы в соответствующие точки цилиндра, расположенные выше или ниже друг друга, и, следовательно, он предположил, что «свойства элементов — это свойства чисел» — замечательное предсказание в свете современных знаний.
Классификация элементов
В 1864 г. Я.А.Р. Ньюлендс предложил классифицировать элементы в порядке увеличения атомного веса, при этом элементам присваивались порядковые номера от единицы и вверх, и они были разделены на семь групп, обладающих свойствами, тесно связанными с первыми семью из известных тогда элементов: водород, литий, бериллий, бор, углерод. , азот и кислород. Это соотношение было названо законом октав по аналогии с семью интервалами музыкальной гаммы.
, азот и кислород. Это соотношение было названо законом октав по аналогии с семью интервалами музыкальной гаммы.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Затем, в 1869 г., в результате обширной корреляции свойств и атомных весов элементов с особым вниманием к валентности (т. е. числу одинарных связей, которые может образовать элемент), Менделеев предложил периодическую закон, согласно которому «элементы, расположенные по величине атомного веса, обнаруживают периодическое изменение свойств». Лотар Мейер независимо пришел к аналогичному заключению, опубликованному после выхода статьи Менделеева.
Характеристики периодов и групп периодической таблицы
Физические и химические свойства элементов в современной периодической таблице постоянно варьируются в течение периодов и групп. Некоторые свойства элементов, такие как число валентных электронов, валентность, размер атома и металлический характер, изменяются при движении слева направо в периоде. Эти качества меняются по мере продвижения от вершины к низу группы. Эти свойства элементов периодической таблицы более подробно обсуждаются ниже.
Эти качества меняются по мере продвижения от вершины к низу группы. Эти свойства элементов периодической таблицы более подробно обсуждаются ниже.
Что такое современная периодическая таблица?
Настоящая периодическая таблица, как говорят, была изобретена Бором. Она также известна как периодическая таблица в ее более крупной форме. Элементы расположены в порядке возрастания атомных номеров в горизонтальных рядах, которые в современной таблице называются периодами. Другие элементы с одинаковым количеством валентных электронов сгруппированы под каждым элементом, так что все элементы с одинаковым количеством валентных электронов находятся в одном вертикальном столбце, известном как группа.
В современной периодической таблице элементы располагаются в соответствии с их атомными номерами. «Свойства элементов являются периодической функцией их атомных номеров», согласно современному периодическому закону. Это означает, что элементы с одинаковыми свойствами будут встречаться через равные промежутки времени или периоды, если атомы организованы в виде таблицы по возрастанию атомных номеров.
Электронные конфигурации элементов демонстрируют регулярную периодичность, когда атомы организованы по возрастанию атомных номеров. Периодичность электрических конфигураций элементов приводит к периодичности химических свойств элементов. Электронные конфигурации одинаковы у элементов с похожими химическими свойствами.
- Периоды — Периоды — это горизонтальные ряды элементов в периодической таблице. В периодической таблице семь периодов. Атомные номера элементов в периодической таблице идут последовательно. Количество элементов в каждый раз меняется. Количество элементов в периоде определяется максимальным числом электронов, которые могут быть размещены в различных оболочках атома.
- Группы — Группы — это вертикальные столбцы периодической таблицы. В полной форме периодической таблицы есть 18 групп. Элементы в группе не имеют одинаковых атомных номеров. Группа 1 находится в левой части таблицы Менделеева, а группа 18 — в правой.

Характеристики периодов периодической таблицы
Двигаясь слева направо по периоду таблицы Менделеева, то есть двигаясь слева направо по горизонтальному ряду таблицы Менделеева, мы обсудим изменение некоторых из важные свойства элементов, включая число валентных электронов, валентность, размер атома и металлический характер. Эти варианты будут объяснены ниже.
Валентные электроны
Число валентных электронов в элементах увеличивается от 1 до 8 по мере продвижения периода слева направо, а в первом периоде оно увеличивается от 1 до 2.
Элемент натрия (Na) содержит один валентный электрон в третьем периоде, тогда как элемент аргон (Ar) имеет восемь валентных электронов. Первый элемент каждого периода имеет один валентный электрон, а последний элемент каждого периода имеет восемь валентных электронов, за исключением первого периода, где последний элемент, гелий (Не), имеет только два валентных электрона.
Количество электронов на внешней оболочке атома увеличивается с 1 до 8 по мере изменения электронных конфигураций элементов. Вдоль периода число валентных электронов увеличивается от 1 до 8. Атомные номера элементов в периоде также следуют друг за другом. Например, элементы третьего периода, от натрия до аргона, имеют атомные номера от 11 до 189.0003
| Elements of the third period | Na | Mg | Al | Si | P | S | Cl | AR |
.0134| 2, 8, 4 | 2, 8, 5 | 2, 8, 6 | 2, 8, 7 | 2, 8, 8 | | |||
| Number of valence electrons | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Валентность
Валентность элементов увеличивается от 1 до 4 и в конечном итоге уменьшается до нуля при движении слева направо в периоде.
Натрий имеет валентность 1, магний имеет валентность 2, алюминий имеет валентность 3, кремний имеет валентность 4, фосфор имеет валентность 3, сера имеет валентность 2, хлор имеет валентность 1, а аргон имеет валентность 0 в третьем периоде. Валентность увеличивается от 1 до 4, а затем уменьшается до нуля в течение периода слева направо. Валентность увеличивается от 1 у натрия до 4 у кремния в третьем периоде таблицы Менделеева, затем уменьшается до нуля у аргона. В результате валентности элементов одного периода различаются. Валентность элемента определяется количеством электронов, потерянных, полученных или разделенных одним атомом для достижения ближайшей электронной конфигурации инертного газа.
| Elements of the third period | Na | Mg | Al | Si | P | S | Cl | AR |
. , 6 , 6 | 2, 8, 7 | 2, 8, 8 | ||||||
| Valency | 1 | 2 | 3 | 4 | 3 | 2 | 1 | 0 |
Размер атомов
В периоде размер атома уменьшается слева направо. Количество протонов и электронов со временем увеличивается по мере увеличения атомного номера, поэтому дополнительные электроны добавляются к той же оболочке. Электроны притягиваются ближе к ядру из-за сильного положительного заряда ядра, и размер атома уменьшается. В результате происходит более сильное притяжение к ядру. Следовательно, размер атома уменьшается.
Таким образом, в любой период атомы щелочных металлов (литий, натрий, калий и т. д.) в крайней левой части периодической таблицы являются самыми большими, а атомы галогенов (фтора, хлора, брома и т. д.) Крайний правый угол периодической таблицы, за исключением инертного газа, является самым маленьким. Однако атом инертного газа, с другой стороны, больше, чем предшествующий ему атом галогена.
д.) Крайний правый угол периодической таблицы, за исключением инертного газа, является самым маленьким. Однако атом инертного газа, с другой стороны, больше, чем предшествующий ему атом галогена.
Металлический характер
Металлический характер элементов уменьшается при движении слева направо, а неметаллический характер увеличивается. К металлам третьего периода относятся натрий, магний и алюминий. Кремний обладает свойствами, которые находятся между металлами и неметаллами, что делает его металлоидом. Фосфор, сера и хлор относятся к неметаллическим элементам.
Компоненты в крайней левой части периода имеют наиболее металлический характер, тогда как элементы в крайней правой части периода имеют наиболее неметаллический характер. Металлы известны как электроположительные элементы, потому что они теряют электроны и генерируют положительные ионы.
Неметаллы, с другой стороны, принимают электроны и создают отрицательные ионы, что дало им название электроотрицательных элементов.
Размер атома уменьшается слева направо с течением времени по мере увеличения ядерной силы притяжения. В результате трудно потерять валентные электроны. Следовательно, электроположительность металлов со временем уменьшается. Атом неметалла также может легко приобретать электроны.
В результате электроотрицательность неметаллов со временем увеличивается. В результате натрий является наиболее электроположительным элементом в третьем периоде, а хлор — наиболее электроотрицательным.
| Elements of the third period | Na | Mg | Al | Si | P | S | Cl |
| Nature of Elements | Металлы | Металлоид | НЕ-МЕТАЛИЯ | ||||
Характеристики в группе.
 В периоде 9002
В периоде 9002ХИРЫ В Группах. В таблице
. двигаясь сверху вниз по вертикальной колонке периодической таблицы, мы обсудим изменение некоторых важных свойств элементов, включая число валентных электронов, валентность, размер атома и металлический характер. Эти различия будут объяснены ниже.
Валентные электроны
Каждый элемент в группе периодической таблицы имеет одинаковое количество валентных электронов. Литий, натрий и калий, например, содержат в своих атомах один валентный электрон и принадлежат к группе 1 периодической таблицы. Атомы лития, натрия и калия могут легко потерять свой один валентный электрон, чтобы создать ионы калия с единичным положительным зарядом, Li, Na и K соответственно.
В результате элементы группы 1 являются одновалентными с валентностью 1. В их атомах все элементы группы 2 имеют два валентных электрона. За исключением гелия, атом которого имеет только два валентных электрона, элементы 13-й группы имеют три валентных электрона, элементы 14-й группы имеют четыре валентных электрона, элементы 15-й группы имеют пять валентных электронов, элементы 16-й группы имеют шесть валентных электронов, элементы 17-й группы имеют семь валентных электронов, а элементы 18 группы имеют восемь валентных электронов. В результате, когда вы перемещаетесь вниз по таблице Менделеева, количество валентных электронов в элементах остается неизменным.
В результате, когда вы перемещаетесь вниз по таблице Менделеева, количество валентных электронов в элементах остается неизменным.
Валентность
Все элементы в группе имеют одинаковую валентность, потому что число валентных электронов, определяющих валентность, одинаково. Литий, натрий и калий, например, имеют один валентный электрон, следовательно, все элементы в группе 1 имеют одинаковую валентность единицы.
Элементы 1 группы имеют валентность 1, элементы 2 группы имеют валентность 2, элементы 13 группы имеют валентность 3, элементы 14 группы имеют валентность 4, элементы 15 группы имеют валентность 3, элементы 16 группы элементы имеют валентность 2, элементы группы 17 имеют валентность 1, а элементы группы 18 имеют валентность 0. В результате валентность каждой группы одинакова.
Размер атомов
Размер атомов или атомный размер увеличивается по мере продвижения вниз по группе периодической таблицы.
Когда мы спускаемся в группе 1 сверху вниз, размер атомов постепенно увеличивается от лития до франция. Каждый раз, когда мы переходим от вершины к низу группы, к атомам добавляется новая оболочка электронов.
В результате количество электронных оболочек в атомах неуклонно увеличивается, что приводит к увеличению размера атомов. Таким образом, наименьший размер атома может быть найден в верхней части группы, а наибольший размер атома — в нижней части. Например, в группе 1 литий (Li) является наименьшим элементом, а франций (Fr) — самым крупным элементом.
| Li | Smallest atom |
| Na | Atomic size increases on going down the group |
| K | |
| Rb | |
| Cs | |
| Fr | Biggest atom |
Metallic Character
The metallic character of elements increases as you move from top to bottom, while the non-metallic character decreases.
Элементы в нижней половине группы имеют наиболее металлический характер. Например, металлическая природа группы 1 возрастает от лития к францию. Каждый раз, когда мы перемещаемся вниз по группе периодической таблицы, добавляется еще одна электронная оболочка, и размер атомов растет.
Валентные электроны удаляются от ядра, и цепляние ядра за валентные электроны ослабевает. В результате атом может быстрее терять валентные электроны и создавать положительные ионы, увеличивая свою электроположительность. Кроме того, по мере того, как размер атомов увеличивается по мере их прохождения через группу, ядро все больше внедряется в атом. Притяжение ядра к входящему электрону уменьшается, что затрудняет создание атомом отрицательных ионов и снижает электроотрицательные характеристики.
Примеры вопросов
Вопрос 1. Какой элемент имеет наибольший размер в третьем периоде?
Ответ:
В течение периода размер атома уменьшается слева направо.
Это указывает на то, что элемент слева от точки является наибольшим, а элемент справа от точки — наименьшим. Элементом слева в третьем периоде является натрий, следовательно, натрий (Na) имеет наибольший размер в третьем периоде.
Вопрос 2: Какова тенденция терять электроны в течение периода?
Ответ:
Заряд ядра растет по мере увеличения числа протонов в течение периода, и валентные электроны сильнее притягиваются ядром, что затрудняет потерю атомами электронов. В результате, по мере того как период движется слева направо, тенденция атомов терять электроны уменьшается.
Вопрос 3: Каковы обычные валентные электроны и валентность элементов 2 группы?
Ответ:
Элементы 2 группы – бериллий, магний, кальций, стронций, барий, радий. Все эти элементы имеют электроны на самой внешней оболочке, поэтому валентных электронов элементов группы 2 2.
Поскольку валентных электронов два, т поэтому эти элементы могут легко потерять 2 электрона, следовательно, валентность элементов группы 2 равна 2.
Вопрос 4: Элемент относится ко 2 группе таблицы Менделеева, это металл или неметалл?
Ответ:
Металлический характер элементов уменьшается при движении слева направо в периоде. Компоненты в крайней левой части периода имеют наиболее металлический характер. Поскольку элементы группы 2 находятся в левой части таблицы, значит, данный элемент является металлом.
Вопрос 5: Элемент А имеет атомный номер 4, элемент В имеет атомный номер 8, а элемент С имеет атомный номер 12. Какой из этих элементов равен член той же группы?
Ответ:
Число валентных электронов элементов в группе одинаково.
Elements
Atomic Number
Electronic configuration
A
4
2, 2
B
8
2, 6
C
12
2, 8, 2
Clearly, элементы А и С имеют 2 валентных электрона.
Следовательно, они принадлежат к одной группе.
Периодическая таблица элементов: определение, группы и тренды
Привет, друзья! Надеюсь, у вас все хорошо. В сегодняшнем уроке мы рассмотрим подробный обзор периодической таблицы. Понимание периодической таблицы — один из кошмаров, которые каждый видел хоть раз в жизни, не волнуйтесь! Я тоже был одним из тех людей. Сегодня я бы разбил эту сложную тему на более мелкие удобоваримые куски. Прежде чем углубиться в тему, позвольте мне представить вам тот факт, что атомный номер более надежен, чем атомная масса элемента, каждый элемент имеет фиксированный атомный номер, и он увеличивается на значение 1 с каждым элементом в современной таблице Менделеева. , поэтому мы используем Атомный номер вместо атомной массы в качестве основы современной периодической таблицы.
История периодической таблицы
Рим не был построен за один день, точно так же современная таблица Менделеева не является продуктом усилий одного или двух химиков, на ее создание ушло два столетия. Более старая версия периодической таблицы была основана на атомных массах Дмитрия Менделеева . Многие ученые внесли свой вклад в формирование периодической таблицы, например:
Более старая версия периодической таблицы была основана на атомных массах Дмитрия Менделеева . Многие ученые внесли свой вклад в формирование периодической таблицы, например:
- Доберинер представил идею триад , когда он наблюдал соотношение между атомными массами трех элементов. В Триаде центральный элемент имел атомную массу, равную среднему значению двух соответствующих элементов.
- Ньюлендс предложил Закон Октав в 1864 году, когда он наблюдал повторение свойств в каждом восьмом элементе, когда элементы располагались в порядке возрастания атомных масс.
Позже, после открытия атомных номеров Генри Мосли в 1913 году и некоторых новых элементов, современная периодическая таблица теперь основана на порядке возрастания атомных номеров, который был предложен самим Генри, когда он открыл атомные номера. Давайте посмотрим на правильное определение периодической таблицы:
Определение периодической таблицы
Начнем с его основного определения;
- Периодическая таблица представляет собой табличное расположение элементов в порядке возрастания атомных номеров, причем водород имеет наименьший атомный номер, а Оганесон имеет самый высокий атомный номер из всех.

- Вертикальные столбцы сверху вниз называются Группами в периодической таблице, которых насчитывается 18.
- Горизонтальные ряды слева направо называются Периодами . В Периодической таблице 7 периодов.
- Вот изображение, показывающее современную периодическую таблицу:
Периодическая таблица до сих пор насчитывает 118 элементов, мы можем многое узнать об элементе, просто взглянув на него, например:
- Атомный вес указан в правом верхнем углу.
- Атомный номер находится в верхнем левом углу.
- Электронная конфигурация валентной оболочки видна в левом нижнем углу.
Рассмотрим следующий пример для лучшего понимания:
Группы и периоды Как я упоминал ранее, элементы располагаются в порядке возрастания атомного номера в виде строк и столбцов, называемых периодами и группами соответственно. Когда я был студентом, меня всегда путали период и группа, так что вот вам хитрость, если вы тоже боретесь, просто зубрите как “9”.0668 сверху вниз в группе “, поэтому всякий раз, когда вы будете думать о группе, у вас будет представление, о чем именно вы думаете.
Когда я был студентом, меня всегда путали период и группа, так что вот вам хитрость, если вы тоже боретесь, просто зубрите как “9”.0668 сверху вниз в группе “, поэтому всякий раз, когда вы будете думать о группе, у вас будет представление, о чем именно вы думаете.
- Периодическая таблица может быть разделена на четыре блока , s, p, d и f.
- Вы когда-нибудь задумывались, почему они называются s, d и p? Их можно было бы назвать a, b, c или d! Позвольте мне понять это для вас:
- Блоки названы в честь электронной конфигурации валентных электронов.
- Например, все s-блочные элементы имеют свои валентные электроны в s-подоболочке, и то же самое касается p-блочных элементов, интересно! Не так ли?
Группы периодической таблицы
В периодической таблице есть 18 групп , которые называются:
- Группа 1, включающая Щелочные металлы
- Группа 2, содержащая щелочноземельных металлов
- Корпус группы 3 – группы 12 Переходные элементы
- Корпус группы 13 Семейство бора
- Группа 14 с семейством Carbon
- Группа 15, содержащая семейство азота
- Группа 16, имеющая семейство Oxygen
- Группа 17 с галогенами
- Группа 18, содержащая инертные или благородные газы
Группа 1 Периодической таблицы: Щелочные металлы
- Это самая первая группа таблицы Менделеева, и ее члены называются Щелочные металлы с элементами Водород, являющийся самым легким, имеет атомный номер 1, за ним следуют гелий, натрий, калий, рубидий, наконец, цезий и франкий в семействе.

- Вы могли подумать, почему их называют щелочными металлами? При взаимодействии с водой эти металлы дают сильные щелочи, называемые щелочными металлами.
Физические свойства щелочных металлов:
- Физически они блестящие, блестящие и гладкие на вид.
Химические свойства щелочных металлов:
- Щелочные металлы обладают высокой реакционной способностью, и их реакционная способность увеличивается в группе.
- Все они имеют низкую энергию ионизации, поэтому им легче потерять электрон.
- В основном они находятся в степени окисления +1.
Группа 2 Периодической таблицы
- Элементы группы 2 были открыты Хамфри, они содержат высокореакционноспособные элементы, которые при взаимодействии с кислородом образуют оксиды, и эти оксиды при растворении в воде образуют крепкие щелочные растворы, получившие свое название Щелочноземельные металлы.

- Щелочноземельные металлы содержат бериллий, магний, кальций, стронций, барий и радий в группе в порядке возрастания атомного номера.
- Они очень реакционноспособны и поэтому считаются сильными восстановителями. Вы знаете, что такое восстановитель?
«Восстановитель — это химическое вещество, которое может легко терять электроны в химической реакции и, следовательно, самоокисляется». Химические свойства щелочноземельных металлов:
- Они обладают высокой реакционной способностью в своей природной форме и являются сильными восстановителями .
- Они могут легко стать катионом с зарядом 2+ , потеряв два электрона из своей внешней оболочки.
Физические свойства щелочноземельных металлов:
- Они широко распространены в природе.
- Они имеют блестящий вид и часто серебристо-белого цвета.

- У них много коммерческих приложений.
Группа 3-12 периодической таблицы
- Эта группа состоит из блоков d и f, которые находятся в центре периодической таблицы и известны как переходных элементов.
- элементы d блока называются внешними переходными элементами, а f блока элементами называются внутренними переходными элементами, несмотря на то, что они занимают совершенно противоположные места в периодической таблице.
- Вы могли подумать, почему элементы блоков d и f называются переходными элементами?
Вот простой ответ на вопрос: элементы блоков d и f имеют свои свойства между элементами блоков s и p, некоторые из них демонстрируют характерное поведение блока s, то есть элементов групп 1 и 2, за счет потери электронов, в то время как некоторые из элементы напоминают элементы p-блока, приобретая электроны во время химической реакции, поэтому они получили свое название переходных элементов. Следующие семейства находятся в переходных группах:
Следующие семейства находятся в переходных группах:
- Группа 3 имеет семейство Scandium. Группа 4
- содержит такие элементы, как титан, что делает их семейством титана . Группа
- 5 называется семейством ванадия .
- Группа 6 включает семейство хрома , состоящее из очень известных членов, таких как вольфрам.
- Группа 7 относится к семейству марганца .
- Группа 8 – это семейство Iron , кто не знаком с этим супер известным элементом? Все мы слышим его с детства.
- Group 9 — это семейство Cobalt.
- Группа 10 состоит из никелевых семейств со своими известными членами, такими как Platinum, вы все слышали о платиновых кольцах и полосах, верно?
- Group 11 была коронована Copper вместе с Silver-Ag в качестве ее преемника.

- Группа 12, наконец, образует семейство Цинк с его всегда полезным и известным членом Ртутью, которая является единственным металлом, находящимся в жидком состоянии при комнатной температуре, поэтому он обычно используется в термометрах!
Лантаниды и актиниды:
- Это f-блочные, внутренние переходные элементы с уникальными свойствами, что ясно видно из их названий.
Актиниды обладают следующими свойствами:
- Атомный номер в диапазоне от 89 до 103
- Радиоактивный в природе
- Валентные электроны на 5f-орбиталях
- Степень окисления может быть до +6
Лантаниды обладают следующими свойствами:
- Атомный номер в диапазоне от 57 до 71
- Валентные электроны присутствуют на 4f-орбиталях
- Они не радиоактивны по своей природе
- Максимальная степень окисления +4
Химические свойства :
- Они отличные проводники электричества из-за образования электронного пула в их структуре, когда я учился в школе я привык думать о лучшем проводнике из всех Переходных Элементов, в то время у меня не было Гугла так что я мог поискать, теперь я узнал, что это серебро, которое является лучшим из всех этих металлов с точки зрения проводимости.

- Они образуют комплексные ионы и окрашенные соединения как продукт их химических реакций.
- Они имеют тугоплавкость и температуру кипения .
Физические свойства:
- В эти группы входят ковкие и пластичные металлы, что простыми словами означает; их можно превратить в листы и проволоку.
- С точки зрения внешности у них блестящий и блестящий внешний вид , если вы в любом случае забудете о свойствах, которыми обладают эти группы, просто вспомните, что Серебро – это переходный металл с блестящим, блестящим внешним видом, который также может быть превращен в ювелирные изделия.
Группа 13 Периодической таблицы
- Элементы группы 13 также называются Семейство бора с другими элементами, такими как алюминий, галлий, индий, таллий и нихоний, в порядке возрастания атомного номера, бор — самый маленький, а нихоний — самый большой элемент, но синтетический по своей природе.
 Элементы
Элементы - группы 13 также называют триэлями или трехвалентными из-за наличия трех электронов в их валентных оболочках.
Химические свойства и использование:
- Вы, должно быть, думали о химических свойствах этой группы! Итак, позвольте мне сказать вам, что они очень распространены в природе и также реакционноспособны, они могут реагировать с водородом, кислородом и галогенами, образуя гидриды , оксиды и галогениды соответственно. 9В семействе бора 0680 также есть изотопы, которые находят широкое применение в медицине.
- От бора, используемого в керамике, до алюминия, который является наиболее распространенным металлом земной коры, используемым в строительстве и металлообработке, индий и галлий не уступают другим членам группы, они также имеют много коммерческих применений.
- Таллий используется в производстве ядов для уничтожения рептилий и грызунов.

Группа 14 Периодической таблицы
- Он известен как знаменитое семейство Carbon , большинство из которых состоит из углерода и кремния.
Физические свойства и применение:
- Думая об углероде, нужно вспомнить химические реакции в органической химии, которые никогда не были легкой пилюлей! Фууу! Углерод обладает уникальной способностью связывания для образования длинных цепей, которая называется «катенация» . Благодаря катенации у нас появилась еще одна ветвь химии, известная как органическая химия. Не только органическая химия, но и алмаз и графит также являются дарами углерода, поскольку их аллотропов .
- Рядом с углеродом находится кремний, который является одним из самых распространенных элементов на планете Земля и коммерчески используется для изготовления полупроводниковых диодов и чипов, используемых в различных технологических устройствах.
 Германий также используется в производстве полупроводников.
Германий также используется в производстве полупроводников. - Кто не знает о свинце и олове? Оба элемента используются в коммерческих целях из-за их стабильной природы при формировании банок, гаек и болтов.
Химические свойства семейства углерода
- Семейство углерода имеет четыре электрона на валентных оболочках, что приводит к ковалентной связи.
- Ковалентная связь является причиной их высоких температур плавления и кипения.
- Все члены группы образуют гидриды, оксиды и галогениды, реагируя с водородом, кислородом и галогенами соответственно.
- Они обычно встречаются в степенях окисления +3, -4 и +4.
Группа 15 Периодической таблицы
- Группа 15 также известна как Азотное семейство или Пниктогены .
- Название Pnictogens указывает на способность азота задыхаться в отсутствие кислорода.
 Другие члены группы включают фосфор, мышьяк и висмут.
Другие члены группы включают фосфор, мышьяк и висмут.
Реакционная способность:
- Азот и фосфор действуют как неметаллы, тогда как мышьяк и сурьма зарекомендовали себя как металлоиды, а последний член висмут является металлом.
- Они образуют ковалентных соединений из-за наличия пяти электронов в их валентной оболочке и в основном находятся в степени окисления +3 или +5
Применение:
- Азот в изобилии встречается в природе, вы могли подумать об этом раньше, когда изучали круговорот азота в школьных учебниках. Повара, использующие жидкий азот для мгновенной заморозки десерта, всегда очаровывали меня из-за его уникальной способности оставаться нереактивным при комнатной температуре. Азот используется в удобрениях и имеет бесчисленное множество коммерческих применений.
- Между тем другие члены семейства не меньше любого другого элемента, Фосфор легко воспламеняется и используется в производстве взрывчатых веществ и фейерверков и имеет три формы красный, черный и белый.

- Мышьяк , будучи ядовитым, нашел свое применение в удобрениях.
- Висмут используется в фармацевтической промышленности для производства ряда полезных лекарств.
Группа 16 Периодической таблицы
- Элементы группы 16 также называются Халькогены , как бы интересно ни звучало название, причина названия кроется в рудообразующей способности этих элементов.
- Кислород, Сера, Селен, Теллур и Полоний являются членами этой группы.
Химическая реактивность:
- Химическая реактивность увеличивается вниз по группе с увеличением атомного номера.
- Всего валентных электронов шесть в семействе, которое поощряет ковалентную связь , так как очень трудно потерять шесть электронов, в то время как получить два электрона для завершения октета было бы проще, не так ли?
- Степень окисления -2 наиболее распространена среди группы .
 Сера также может существовать как +4 и +6 .
Сера также может существовать как +4 и +6 .
Использование:
- Кислород является наиболее распространенным, теперь мы наблюдаем огромную потребность в клиническом кислороде у пациентов, пораженных Covid, различные типы кислорода получают путем фракционной перегонки в растениях в определенных условиях, многие отрасли промышленности, такие как сталелитейные заводы, также используют кислород в своих процессах.
- Сера встречается в виде руд и используется при производстве фунгицидов и некоторых лекарств.
- Селен и теллур обладают фотопроводимостью, а полоний является редким радиоактивным металлом.
Группа 17 Периодической таблицы
- Элементы группы 17 называются Галогены и обладают высокой реакционной способностью, студенты часто спрашивают о причине их уникального названия, так что расшифровать это для вас Галоген – это Греческое слово , которое образовано от двух слов « Halo », означающих «Соль », и « Gen » означает « для производства чего-то », термин в совокупности означает « соль для производства ».

- Эти элементы называются галогенами из-за их способности образовывать соли при взаимодействии с щелочным металлом. Галогены включают фтор, хлор, бром и йод.
Химическая активность:
- Фтор является наиболее реакционноспособным элементом этой группы.
- Все галогены имеют семь электронов на внешней оболочке , поэтому они могут легко получить электрон в химической реакции. Они имеют обычную степень окисления -1.
- Они являются хорошими окислителями из-за их более высокого сродства к электрону.
Физические свойства:
- Галогены приобретают более темный цвет по мере продвижения по группе сверху вниз. Фтор имеет бледно-желтый цвет, тогда как хлор имеет зеленовато-желтый оттенок, бром встречается в коричневом цвете и, наконец, йод имеет фиолетовый оттенок.

- Первые два элемента — газы, бром — жидкость, а йод — твердое вещество при комнатной температуре.
Использование:
- Вы, наверное, видели миллион рекламных роликов по телевизору о зубной пасте с фтором, да! Он помогает предотвратить разрушение зубов. Фтор всегда был фундаментальной частью стоматологической промышленности.
- Хлор является отбеливающим агентом и используется также для очистки воды, особенно в плавательных бассейнах.
- Бром используется для очистки воды, производства пестицидов, а также в фармацевтических компаниях.
- Использование йодированной соли является обычной практикой во многих странах, поскольку она помогает улучшить рост и обмен веществ при использовании в соответствующих количествах. Йод также используется в качестве местного антисептика.
Группа 18 Периодической таблицы
Элементы группы 18 также известны как Благородные газы , кого называют благородными? Человек, который никогда ни с кем не связывается, такое же состояние и у благородных газов, они инертны и ни с чем не реагируют по вполне очевидной причине, догадываетесь? Ага! Вы правильно угадали. У них есть полный октет, им не нужно ни к кому обращаться, чтобы быть стабильными. К благородным газам относятся гелий, неон, аргон, криптон и ксенон.
У них есть полный октет, им не нужно ни к кому обращаться, чтобы быть стабильными. К благородным газам относятся гелий, неон, аргон, криптон и ксенон.
Физические и химические свойства:
- Благородные газы бесцветны и не имеют запаха в нормальных условиях.
- Они имеют низкие температуры плавления и кипения .
- Благородные газы могут использоваться в качестве окислителей при особых обстоятельствах .
Использование и применение:
- Мы все видели рожок мороженого в качестве световой вывески с яркими цветами за пределами кафе-мороженого, они называются Неоновые вывески , газ в них не совсем неон каждый раз, но всегда благородный газ. Все благородные газы при освещении выделяют свой особый цвет.
- Воздушные шары с гелием также радовали каждого из нас в детстве, так как газообразный гелий очень легкий по своей природе, поэтому его используют для наполнения воздушных шаров.

- Одним из последних применений благородных газов являются эксимеры , это диамерные формы благородных газов, которые имеют широкое применение в области медицины. Они помогают в хирургии глаза и восстановлении миокарда.
Тенденции периодической таблицы
Чтобы понять тенденции, обнаруженные в периодической таблице, мы должны понять термин периодичность. « Периодичность относится к циклической тенденции в химических и физических свойствах элементов с увеличением атомного номера». Периодичность помогает нам понять и предсказать различные тенденции среди членов семьи одной и той же группы, точно так же, как потомство от одних и тех же родителей имеет некоторые общие характеристики, все они могут иметь голубые глаза или черные волосы или что-то общее в семье, семьях периодических таблицы также имеют общие характеристики аналогичным образом. Некоторые из периодических тенденций в периодической таблице:
- Атомные радиусы.

- Энергия ионизации.
- Сродство к электрону.
- Электроотрицательность.
- Экранирующий эффект.
- Металлическое и неметаллическое поведение.
Тренд атомных радиусов в периодической таблице
- Атомные радиусы являются одним из основных аспектов, которые могут заставить элементы вести себя определенным образом в химической реакции.
Факторы, влияющие на атомные радиусы:
- Атомный номер
- Количество оболочек: по мере того, как мы движемся сверху вниз в группе, атомный номер увеличивается, это постепенное увеличение атомного номера делает атомные радиусы все больше и больше за счет добавления нескольких оболочек
Тенденция по группе:
- Когда атомные радиусы увеличиваются сверху вниз в группе, удержание ядра на валентных электронах уменьшается.

- Эта уменьшенная сила на валентных электронах увеличивает реакционную способность элемента.
- Итак, мы можем сделать вывод, что по мере продвижения ко дну можно прогнозировать увеличение реакционной способности элементов, почему? Потому что они меньше связаны ядерными силами и свободны реагировать.
Тенденция за период:
- Аналогичным образом при движении слева направо в периоде атомные радиусы уменьшаются из-за уменьшения атомного номера и, следовательно, уменьшается реактивность элементов, все благодаря сильному воздействию ядерных сил на валентные электроны, которые притягивают электронное облако к себе.
Самый большой и самый маленький элемент По отношению к радиусу
- Вы могли подумать, какой элемент является самым большим и самым маленьким по радиусу? Позвольте мне сказать вам, что самый маленький – это гелий , а самый большой – франкий.

Исключительное поведение :
- Есть несколько исключений из обычной тенденции, потому что все пять пальцев никогда не могут быть одинаковыми.
- Кислород имеет больший радиус, чем его соседний азот, потому что у азота семь протонов в ядре, а у кислорода восемь, поэтому он имеет большее значение энергии ионизации.
Тренд энергии ионизации в периодической таблице
Энергия ионизации может быть определена как:
- ” Энергия ионизации – это количество энергии, необходимое для удаления слабосвязанного электрона с внешней оболочки нейтрального газообразного атома в его основном состоянии “.
Факторы, влияющие на энергию ионизации:
- Атомный радиус
- Экранирующий эффект
- Увеличенный атомный номер
Тенденция по группе:
- Энергия ионизации в основном определяется атомными радиусами, по мере продвижения сверху вниз в группе атомные радиусы увеличиваются, что приводит к уменьшению эффективного заряда ядра.

- Уменьшение эффективного заряда ядра и увеличение экранирующего эффекта приводит к меньшей силе связывания валентных электронов, когда на валентные электроны действует меньшая ядерная сила, что произойдет? Это было бы легко удалить, отдав небольшое количество энергии, эта энергия называется энергией ионизации.
- Подводя итог, можно сказать, что энергия ионизации уменьшается вниз по группе по мере продвижения вниз.
Тренд по периоду:
- При движении по периоду слева направо эффективный заряд ядра увеличивается, что приводит к уменьшению атомных радиусов, в конечном итоге экранирующий эффект также уменьшается, все эти факторы сильно затрудняют удаление электрон, скорее они предпочли бы получить электрон или два для стабильности.
- Таким образом, мы можем сказать, что энергия ионизации увеличивается слева направо в течение периода.
Виды энергии ионизации; Существует два типа энергии ионизации.
- Первая энергия ионизации
- Вторая энергия ионизации
Ниже приведен пример первой и второй энергии ионизации:
- Энергия первой ионизации — это энергия, необходимая для удаления электронов из нейтрального газообразного атома.
- Вторая энергия ионизации относится к количеству энергии, необходимой для удаления электрона из молекулярного иона или катиона.
Итак, вот понятный ясный факт, который ни в коем случае нельзя упускать; вторая энергия ионизации всегда выше первой. Поясню почему! Это происходит из-за увеличения дополнительного положительного заряда на электронном облаке из-за удаления электрона, ядро сильнее сжимает валентную оболочку, и поэтому требуется большое количество энергии, чтобы удалить электрон, который всегда находится выше первого. один.
Экранирующий эффект Тенденции в периодической таблице
Перед изучением экранирующего эффекта давайте обсудим, что делает щит? Экран маскирует или препятствует действию любой силы, приложенной к телу, когда тот же принцип применяется к атому, мы можем определить эффект экранирования как:
- “Когда электроны внутренней оболочки экранируют эффект ядра, уменьшая эффективный заряд ядра на валентных электронах, тогда это явление называется эффектом экранирования”.

Экранирующий эффект уменьшает эффективный ядерный заряд, испытываемый валентными электронами. Итак, теперь вы, должно быть, думаете, что такое эффективный ядерный заряд?
- «Эффективный заряд ядра — это средний суммарный положительный заряд, испытываемый электроном от его ядра».
Тенденция по группе:
- По мере увеличения атомного номера количество оболочек в каждом атоме также увеличивается, с каждой дополнительной оболочкой усиливается экранирующий эффект валентных электронов.
Тренд за период:
- Экранирующий эффект увеличивается сверху вниз в группе, в то время как он остается постоянным слева направо в периоде.
- Единственной причиной постоянного экранирующего эффекта слева направо является одинаковое количество оболочек во всех элементах, находящихся в периоде, никакая дополнительная оболочка не приводит к постоянному экранирующему эффекту.
 Простой!
Простой!
Тренд электроотрицательности в периодической таблице
Электроотрицательность можно определить как
- «Способность атома частично или полностью притягивать к себе общую пару электронов, когда он связан с другим атомом в молекуле».
Всякий раз, когда мы изучаем ковалентные связи, мы часто говорим о полюсах, это полярная ковалентная связь, которая является неполярной, вы могли подумать, что вызывает эту полярность внутри молекул? Итак, теперь у вас есть ответ: разница в электроотрицательности вызывает полярность молекулы. Значения электроотрицательности некоторых элементов уже определены, разница между их значениями, то есть разница электроотрицательностей, помогает нам предсказать природу связи, будь то ионная, ковалентная, слабополярная или умеренно полярная по своей природе.
Факторы, влияющие на электроотрицательность: На электроотрицательность элемента влияют:
- Атомный номер
- Количество валентных электронов
- Экранирующий эффект и эффективный ядерный заряд
- Атомные радиусы
Тренд за период :
- В таблице Менделеева электроотрицательность увеличивается по периоду при движении слева направо, фтор коронован как самый электроотрицательный элемент из всех, имеющих значение 4.

- Все благодаря крепкой хватке ядра на электронном облаке, которая никому не позволяет вырваться из своей хватки!
Тенденция по группе:
- Между тем из-за увеличения атомного номера и экранирующего эффекта электроотрицательность уменьшается вниз по группе, поэтому эти элементы имеют меньшую тенденцию удерживать общую пару электронов по направлению к себе, поэтому мы можем сказать, что левые нижние элементы периодической таблицы никогда не могут быть хорошими хранителями общих электронов.
Тренд сродства к электрону в периодической таблице
Сродство к электрону – это противоположность энергии ионизации, которую мы обсуждали ранее, энергия ионизации – это энергия, необходимая для удаления электрона, с другой стороны, сродство к электрону – это энергия, необходимая для добавления электрона к атому.
- Сродство к электрону можно определить как «количество энергии, высвобождаемой при присоединении электрона к нейтральному газообразному атому, превращая его в анион ».

Поскольку энергия высвобождается, процесс носит экзотермический характер.
- Галогены имеют самое высокое сродство к электрону в периодической таблице
- Металлы имеют самое низкое сродство к электрону в периодической таблице.
Факторы, влияющие на сродство к электрону: На сродство к электрону влияют:
- Атомный номер
- Количество валентных электронов
- Экранирующий эффект и эффективный ядерный заряд
- Атомные радиусы.
Тенденция по группе:
- Когда мы движемся сверху вниз в группе, атомные радиусы увеличиваются, что приводит к слабому ядерному заряду на валентных электронах.
- Итак, что вы думаете сейчас, что будет в тренде? Я надеюсь, что вы можете легко догадаться об этом сейчас! Да, вы правы, сродство к электрону будет уменьшаться в группе сверху вниз.

Тенденция за период:
- Слева направо в периоде эффективный заряд ядра никогда не дает никому сбиться с пути, как уличным животным, поэтому он крепко держится за валентную оболочку, добавление электрона высвобождает огромное количество энергии, которая соответствует более высоким значениям сродства к электрону, постепенно увеличивая значения сродства к электрону в течение периода.
Элемент с самым высоким сродством к электрону:
- Хлор имеет самое высокое сродство к электрону из всех элементов, даже выше, чем у фтора, из-за его структурной компактности по сравнению с фтором.
Металлический характер Тенденция в периодической таблице
- Металлический характер — одно из наиболее интересных свойств, которыми обладают элементы, как указано в названии, « металлический характер — это способность металла терять электрон во время химической реакции ».

- Металлический характер наблюдается из-за наименьших значений энергии ионизации металлов, которые имеют тенденцию легко терять электроны, чтобы оставаться стабильными, а не сохранять их.
Теория электронного пула: Обсуждая металлический характер, мы не должны забывать о теории электронного пула. Теория электронного пула касается металлического характера металлов, которые имеют тенденцию терять все свои валентные электроны, превращая их в пул электронов вокруг положительного заряда, это причина их электрического заряда. проводимость, теперь вы знаете! Тенденция по Группе: Металлический характер увеличивается вниз по группе из-за следующих факторов, которые вступают в игру;
- Увеличенный атомный номер.
- Увеличены атомные радиусы.
- Меньшая энергия ионизации.
В присутствии вышеуказанных факторов металлы имеют тенденцию легко терять электроны.
Тенденция по периоду:
- Слева направо в периодах металлический характер уменьшается из-за более высокого эффективного заряда ядра и меньших электронных облаков, поэтому чрезвычайно трудно потерять электрон и проявить металлический характер.
Элементы с наибольшим и наименьшим содержанием металлов :
- Наиболее металлическим из всех элементов является Франций , в то время как Фтор является наименее металлическим или неметаллическим элементом периодической таблицы.
Итак, это было все о периодической таблице и ее группах с их кратким введением и общими тенденциями, я надеюсь, что это помогло вам прояснить некоторые общие заблуждения, которые у всех нас есть в наших умах относительно темы. До скорой встречи в другой теме, хорошего дня!
5.
 2 Химические свойства групп | Периодическая таблица
2 Химические свойства групп | Периодическая таблица5.2 Химические свойства групп (ESABP)
В некоторых группах элементы проявляют очень похожие химические свойства, а некоторые группы даже даны специальные имена для их идентификации. Характеристики каждой группы в основном определяются электронным расположение атомов элементов в группе. Названия групп приведены на рис. 5.3
Рисунок 5.3: Группы периодической таблицы
Несколько замечаний по поводу групп:
Хотя водород входит в группу 1, он не является щелочным металлом.
Элементы группы 15 иногда называют пниктогенами.
Элементы группы 16 иногда называют халькогенами.
Галогены и щелочные металлы являются очень реакционноспособными группами.
благородные газы являются инертными (нереакционноспособными).
 1\), у него будет более низкая первая ионизация
энергии, чем цезий (\(\text{Cs}\)).
1\), у него будет более низкая первая ионизация
энергии, чем цезий (\(\text{Cs}\)).Одной общей не показанной тенденцией являются температуры плавления и кипения. Для металлов (группы с 1 по 13) температуры плавления и кипения увеличиваются по мере продвижения вверх по группе. Для неметаллов температуры плавления и кипения уменьшаться по мере подъема группы.
Вам также следует вспомнить из главы Глава 2 что металлы находятся в левой части таблицы Менделеева, неметаллы – в правой, а металлоиды расположены на зигзагообразной линии, начинающейся от бора. 91\)
Хлориды группы 1
\(\текст{LiCl}\)
\(\text{NaCl}\)
\(\текст{KCl}\)
\(\текст{RbCl}\)
\(\текст{CsCl}\)
Все элементы группы 1 образуют соединения галогенов в соотношении 1:1
Оксиды группы 1
\(\текст{Ли}_{2}\текст{О}\)
\(\text{Na}_{2}\text{O}\)
\(\текст{К}_{2}\текст{О}\)
\(\текст{Rb}_{2}\текст{O}\)
\(\текст{Cs}_{2}\текст{O}\)
Все элементы группы 1 образуют оксиды в соотношении 2:1
Атомный радиус
Увеличивается по мере продвижения вниз по группе.

Первая энергия ионизации
Уменьшается по мере продвижения вниз по группе.
Электроотрицательность
Уменьшается по мере продвижения вниз по группе.
Температура плавления и кипения
Уменьшается по мере продвижения вниз по группе.
Плотность
Увеличивается по мере продвижения вниз по группе.
Таблица 5.2: Сводка тенденций в группе 1
Группы периодической таблицы
Учебник Упражнение 5.
 2
2Используйте Таблицу 5.2 и Рисунок 5.4, чтобы составить аналогичные таблицы для группы 2 и группы 17. 9{40}\text{Ca}\).
Размер атома (атомный радиус)
Электроотрицательность
Первая энергия ионизации
Температура кипения
Решение пока недоступно.
Изучите следующий график и объясните тенденцию электроотрицательности элементов группы 2.
Решение пока недоступно.
См. элементы, перечисленные ниже:
Литий (\(\text{Li}\))
Хлор (\(\text{Cl}\))
Магний (\(\text{Mg}\))
Неон (\(\text{Ne}\))
Кислород (\(\text{O}\))
Кальций (\(\text{Ca}\))
Углерод (\(\text{C}\))
Какой из перечисленных выше элементов:
относится к группе 1
это галоген
– благородный газ
— это щелочной металл
.
имеет атомный номер 12
имеет четыре нейтрона в ядре атома
содержит электроны на 4-м энергетическом уровне
- У
все энергетические орбитали заполнены
будет иметь химические свойства, наиболее схожие с
.
Решение пока недоступно.
Изобретение собственной периодической таблицы
Вы официальный химик планеты Зог. Вы обнаружили все те же элементы, что и мы. Земля, но у вас нет периодической таблицы. Жители Зога хотят знать, как все эти элементы соотносятся с друг друга. Как бы вы изобрели периодическую таблицу? Подумайте, как бы вы организовали имеющиеся у вас данные. и какие свойства вы бы включили.
 Не просто копируйте идеи Менделеева, будьте изобретательны и придумывайте что-то новое.
вашего собственного. Исследуйте другие формы периодической таблицы и сделайте ту, которая имеет для вас смысл. Представьте свои идеи
в свой класс.
Не просто копируйте идеи Менделеева, будьте изобретательны и придумывайте что-то новое.
вашего собственного. Исследуйте другие формы периодической таблицы и сделайте ту, которая имеет для вас смысл. Представьте свои идеи
в свой класс.Круговая таблица Менделеева
Структура и значение периодической таблицы: группы
Корпускуляризм
Корпускуляризм был теорией, предложенной Декартом, согласно которой вся материя состоит из мельчайших частиц.
Рене Декарт
Рене Декарт был известным математиком и философом 16-го века, который выдвинул теорию корпускуляризма об атоме.
Полупроводники
Полупроводники — это термин для описания металлоидов, которые способны проводить ток при подаче электрической энергии за счет движения электронов, но измерения проводимости не такие высокие, как у металлов, из-за меньшего количества электронов, несущих заряд или менее упорядоченная структура.
Ионное соединение
Ионное соединение представляет собой связь, которая образуется между металлами и неметаллами с образованием большой ионной решетки.
 Атомы водорода под действием большого количества тепла и давления вынуждены объединяться, образуя более крупный атом гелия 9.0003
Атомы водорода под действием большого количества тепла и давления вынуждены объединяться, образуя более крупный атом гелия 9.0003Принцип неопределенности
Принцип неопределенности Гейзенберга используется для описания взаимосвязи между импульсом и положением электрона. Где, если точное положение электрона известно, импульс будет неопределенным.
Гейзенберг
Вернер Гейзенберг был немецким физиком, пионером в области квантовой механики. Он разработал принцип неопределенности относительно импульса и положения электрона.
Лепестки
Лепестки относятся к форме электронных волн и области с наибольшей вероятностью, где этот электрон как частица может быть найден.
Принцип исключения Паули
Исключение Паули относится к теории, согласно которой каждый электрон может иметь только уникальный набор из 4 квантовых чисел, и никакие два электрона не могут иметь одинаковые квантовые числа
Квантовые числа
Квантовые числа — это используемый термин описать присвоение чисел электронам как математическую функцию для описания их импульса и энергии.

Модель Бора
Модель Бора относится к трактовке электронов как частиц, вращающихся вокруг ядра.
Квантовая механика
Термин квантовая механика относится к уровням энергии и теоретической области физики и химии, где математика используется для объяснения поведения субатомных частиц.
Впадина
Впадина — самая нижняя точка поперечной волны.
Пик
Пик — это самая высокая точка поперечной волны.
Колебательные моды
Колебательные моды — это термин, используемый для описания постоянного движения в молекуле. Обычно это вибрации, вращения и перемещения.
Erwin Schrodinger
Эрвин Шредингер был австрийским физиком, который использовал математические модели для усовершенствования модели Бора об электроне и создал уравнение для предсказания вероятности нахождения электрона в заданном положении.
Щелочной металл
Щелочные металлы, находящиеся в группе 1 периодической таблицы (ранее известной как группа IA), настолько реакционноспособны, что обычно встречаются в природе в сочетании с другими элементами.
 Щелочные металлы — это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении.
Щелочные металлы — это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении.Щелочноземельные металлы
Щелочноземельные металлы являются второй по реакционной способности группой элементов в периодической таблице. Они находятся в группе 2 периодической таблицы (формально известной как группа IIA).
Неизвестные элементы
Неизвестные элементы (или трансактиниды) являются самыми тяжелыми элементами периодической таблицы. Это мейтнерий (Mt, атомный номер 109), дармштадтий (Ds, атомный номер 110), рентгений (Rg, атомный номер 111), нихоний (Nh, атомный номер 113), московий (Mc, атомный номер 115), ливерморий (Lv , атомный номер 116) и теннессин (Ts, атомный номер 117).
Постпереходный металл
Постпереходные металлы находятся между переходными металлами (слева) и металлоидами (справа). К ним относятся алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi).
Oganesson
Oganesson (Og) — радиоактивный элемент с атомным номером 118 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит.
 Он находится в группе 18. Он имеет символ Og.
Он находится в группе 18. Он имеет символ Og.Теннессин
Теннессин (Ts) — радиоактивный элемент с атомным номером 117 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит. Он находится в группе 17. Он имеет символ Ts.
Ливерморий
Ливерморий (Lv) — радиоактивный элемент с атомным номером 116 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит. Он находится в группе 16. Он имеет символ Lv.
Московий
Московий (Mc) — радиоактивный металл с атомным номером 115 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Он находится в группе 15. Он имеет символ Mc.
Флеровий
Флеровий (Fl) — радиоактивный металл с атомным номером 114 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств его производства. Он находится в группе 14. Он имеет символ Fl.

Нихоний
Нихоний (Nh) — радиоактивный металл с атомным номером 112 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Он находится в группе 13. Он имеет символ Nh.
Copernicium
Copernicium (Cr) — радиоактивный металл с атомным номером 112 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 11. Он имеет символ Rg.
Рентгений
Рентгений (Rg) — радиоактивный металл с атомным номером 111 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств его производства. Это переходный металл группы 11. Он имеет символ Rg.
Darmstadtium
Darmstadtium (Ds) — радиоактивный металл с атомным номером 110 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 10. Он имеет символ Ds 9.0003
Мейтнерий
Мейтнерий (Mt) — радиоактивный металл с атомным номером 109 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства.
 Это переходный металл группы 9. Он имеет символ Mt
Это переходный металл группы 9. Он имеет символ MtХассий
Хассий (Hs) — радиоактивный металл с атомным номером 108 в периодической таблице, его внешний вид полностью неизвестен из-за ничтожных количеств. производится из него. Это переходный металл группы 8. Он имеет символ Hs.
Борий
Борий (Bh) — радиоактивный металл с атомным номером 107 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 7. Он имеет символ Bh.
Сиборгий
Сиборгий (Sg) — радиоактивный металл с атомным номером 106 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств его производства. Это переходный металл группы 6. Он имеет символ Sg.
Дубний
Дубний (Db) — радиоактивный металл с атомным номером 105 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 5.
 Он имеет символ Db.
Он имеет символ Db.Резерфордий
Резерфордий (Rf) — радиоактивный металл с атомным номером 104 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 4. Он имеет символ Rf.
Lawrencium
Lawrencium (Lr) — серебристо-белый радиоактивный металл с атомным номером 103 в периодической таблице. Это актиноидный металл с символом Lr.
Нобелий
Нобелий (No) — радиоактивный металл с атомным номером 102 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это актиноидный металл с символом №
Менделевий
Менделевий (Md) — радиоактивный металл с атомным номером 101 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это актиноидный металл с символом Md. 9.0003
Фермий
Фермий (Fm) — серебристо-белый радиоактивный металл с атомным номером 100 в периодической таблице.
 Это актиноидный металл с символом Fm.
Это актиноидный металл с символом Fm.Эйнштейний
Эйнштейний (Es) — серебристо-белый радиоактивный металл с атомным номером 99 в периодической таблице. Это актиноидный металл с символом Es.
Калифорний
Калифорний (Cf) — серебристо-белый радиоактивный металл с атомным номером 98 в периодической таблице. Это актиноидный металл с символом Cf.
Берклий
Берклий (Bk) — серебристый радиоактивный металл, имеющий атомный номер 97 в периодической таблице. Это актиноидный металл с символом Bk.
Кюрий
Кюрий (Cm) — серебристо-белый радиоактивный металл с атомным номером 96 в периодической таблице. Это актиноидный металл с символом Cm.
Америций
Америций (Am) представляет собой серебристый радиоактивный металл с атомным номером 95 в периодической таблице. Это актиноидный металл с символом Am.
Плутоний
Плутоний (Pu) представляет собой серебристый радиоактивный металл, имеющий атомный номер 94 в периодической таблице.
 Это актиноидный металл с символом Pu.
Это актиноидный металл с символом Pu.Нептуний
Нептуний (Np) — серебристый радиоактивный металл с атомным номером 93 в периодической таблице. Это актиноидный металл с символом Np.
Протактиний
Протактиний (Па) представляет собой блестящий серебристый радиоактивный металл с атомным номером 91 в периодической таблице. Это актиноидный металл с символом Pa.
Торий
Торий (Th) — серебристо-белый радиоактивный металл с атомным номером 90 в периодической таблице. Это актиноидный металл с символом Th.
Актиний
Актиний (Ac) представляет собой серебристый радиоактивный металл с атомным номером 89 в периодической таблице. Это актиноидный металл с символом Ac.
Радий
Радий (Ra) — металл серебристо-белого цвета, имеющий атомный номер 88 в периодической таблице. Это щелочноземельный металл с символом Ra, расположенный во 2-й группе периодической таблицы.
Франций
Франций (Fr) считается металлом серого цвета, имеющим атомный номер 87 в периодической таблице.
 Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.
Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.Радон
Радон (Rn) представляет собой бесцветный радиоактивный газ без запаха, неметалл, имеющий атомный номер 86 в периодической таблице в 18-й группе. Он имеет символ Rn.
Астатин
Астатин (At) — радиоактивный неметалл, имеющий атомный номер 85 в периодической таблице в 17-й группе. Он имеет символ At.
Полоний
Полоний (Po) — серебристо-серый металл с атомным номером 84 в периодической таблице в 16-й группе. Он имеет символ Po.
Висмут
Висмут (Bi) — твердый стальной серый металл, имеющий атомный номер 83 в периодической таблице в 15-й группе. Он имеет символ Bi.
Свинец
Свинец (Pb) — мягкий серый металл, имеющий атомный номер 82 в периодической таблице в 14-й группе. Он имеет символ Pb.
Таллий
Таллий (Tl) — мягкий серый металл, имеющий атомный номер 81 в периодической таблице в 13-й группе. Он имеет символ Tl.

Ртуть
Ртуть (Hg) представляет собой жидкий металл серебристого цвета, имеющий атомный номер 80 в периодической таблице. Это переходный металл группы 12. Он имеет символ Hg.
Золото
Золото (Au) — это мягкий металл золотистого цвета, имеющий атомный номер 79 в периодической таблице. Это переходный металл группы 11. Он имеет символ Au.
Платина
Платина (Pt) — тяжелый белый металл с атомным номером 78 в периодической таблице. Это переходный металл группы 10. Он имеет символ Pt.
Иридий
Иридий (Ir) — тяжелый белый металл с атомным номером 77 в периодической таблице. Это переходный металл группы 9. Он имеет символ Ir.
Осмий
Осмий (Os) представляет собой твердый мелкий черный порошок или сине-белый металл с атомным номером 76 в периодической таблице. Это переходный металл группы 8. Он имеет символ Os.
Рений
Рений (Re) — металл серебристо-белого цвета, имеющий атомный номер 75 в периодической таблице.
 Это переходный металл группы 7. Он имеет символ Re.
Это переходный металл группы 7. Он имеет символ Re.Вольфрам
Вольфрам (W) — металл серо-стального цвета, имеющий атомный номер 74 в периодической таблице. Это переходный металл группы 6. Он имеет символ W.
Тантал
Тантал (Ta) — металл серого цвета с атомным номером 73 в периодической таблице. Это переходный металл группы 5. Он имеет символ Та.
Гафний
Гафний (Hf) — металл серебристого цвета с атомным номером 72 в периодической таблице. Это переходный металл группы 4. Он имеет символ Hf.
Лютеций
Лютеций (Lu) — металл серебристо-белого цвета, имеющий атомный номер 71 в периодической таблице. Это лантаноидный металл. Он имеет символ Лу.
Иттербий
Иттербий (Yb) представляет собой металл серебристого цвета с атомным номером 70 в периодической таблице. Это лантаноидный металл. Он имеет символ Yb.
Тулий
Тулий (Tm) представляет собой металл серебристого цвета с атомным номером 69 в периодической таблице.
 Это лантаноидный металл. Он имеет обозначение Tm.
Это лантаноидный металл. Он имеет обозначение Tm.Эрбий
Эрбий (Er) — металл серебристого цвета, имеющий атомный номер 68 в периодической таблице. Это лантаноидный металл. Он имеет символ Er.
Гольмий
Гольмий (Но) — металл серебристого цвета, имеющий атомный номер 67 в периодической таблице. Это лантаноидный металл. Он имеет символ Хо.
Диспрозий
Диспрозий (Dy) представляет собой серебристый металл с атомным номером 66 в периодической таблице. Это лантаноидный металл. Он имеет символ Dy.
Тербий
Тербий (Tb) представляет собой металл серебристо-серого цвета, имеющий атомный номер 65 в периодической таблице. Это лантаноидный металл. Он имеет символ Tb.
Гадолиний
Гадолиний (Gd) — металл серебристо-белого цвета, имеющий атомный номер 64 в периодической таблице. Это лантаноидный металл. Он имеет символ Gd.
Европий
Европий (Eu) — металл серебристо-белого цвета, имеющий атомный номер 63 в периодической таблице.
 Это лантаноидный металл. Он имеет символ Eu.
Это лантаноидный металл. Он имеет символ Eu.Самарий
Самарий (Sm) представляет собой металл серебристого цвета с атомным номером 62 в периодической таблице. Это лантаноидный металл. Он имеет символ Sm.
Прометий
Прометий (Pm) — редкий металл с атомным номером 61 в периодической таблице. Это лантаноидный металл. Он имеет символ Pm.
Неодим
Неодим (Nd) — металл серебристо-белого цвета, имеющий атомный номер 60 в периодической таблице. Это лантаноидный металл. Он имеет символ Nd.
Празеодим
Празеодим (Pr) представляет собой серебристо-белый металл с атомным номером 59 в периодической таблице. Это лантаноидный металл. Он имеет обозначение Pr.
Церий
Церий (Ce) представляет собой металл серо-железного цвета, имеющий атомный номер 58 в периодической таблице. Это лантаноидный металл. Он имеет символ Ce.
Лантан
Лантан (La) — мягкий серебристо-белый металл с атомным номером 57 в периодической таблице.
 Это лантаноидный металл. Имеет обозначение La.
Это лантаноидный металл. Имеет обозначение La.Барий
Барий (Ba) — мягкий серебристо-белый металл с атомным номером 56 в периодической таблице. Это щелочноземельный металл, расположенный во 2-й группе периодической таблицы. он имеет символ Ba.
Цезий
Цезий (Cs) — мягкий металл серого цвета, имеющий атомный номер 55 в периодической таблице. Это щелочной металл и находится в группе 1 периодической таблицы. он имеет символ Cs.
Ксенон
Ксенон (Хе) существует в виде бесцветного газа без запаха и химически инертен. Он имеет атомный номер 54 в периодической таблице и принадлежит к группе 18, Благородные газы. Это неметалл с символом Xe.
Йод
Йод (I) представляет собой пурпурно-серый твердый неметалл. Он имеет атомный номер 53 в периодической таблице. Он расположен в группе 17, галогены. Он имеет символ I.
Теллур
Теллур (Te) — серебристо-белый полуметалл с атомным номером 52 в периодической таблице. Он расположен в 16 группе периодической таблицы.
 Он имеет символ Те.
Он имеет символ Те.Сурьма
Сурьма (Sb) представляет собой твердый хрупкий серебристо-белый полуметалл с атомным номером 51 в периодической таблице. Он расположен в 15 группе периодической таблицы. Он имеет символ Sb.
Олово
Олово (Sn) — серебристо-белый металл с атомным номером 50 в периодической таблице. Он расположен в 14 группе периодической таблицы. Он имеет обозначение Sn.
Индий
Индий (In) — серебристо-белый металл с атомным номером 49 в периодической таблице. Он расположен в 13 группе периодической таблицы. Он имеет символ В.
Кадмий
Кадмий (Cd) — бело-голубой металл с атомным номером 48 в периодической таблице. Это переходный металл, расположенный в 12-й группе периодической таблицы. Он имеет обозначение Cd.
Серебро
Серебро (Ag) — металл серебра, имеющий атомный номер 47 в периодической таблице. Это переходный металл, расположенный в 11-й группе периодической таблицы. Он имеет символ Ag.
Палладий
Палладий (Pd) — серебристо-белый металл с атомным номером 46 в периодической таблице.
 Это переходный металл, расположенный в 10-й группе периодической таблицы. Он имеет обозначение Pd.
Это переходный металл, расположенный в 10-й группе периодической таблицы. Он имеет обозначение Pd.Родий
Родий (Rh) — хрупкий серебристо-белый металл с атомным номером 45 в периодической таблице. Это переходный металл, расположенный в группе 9.периодической таблицы. Он имеет обозначение Rh.
Рутений
Рутений (Ru) представляет собой хрупкий металл серебристо-серого цвета, имеющий атомный номер 44 в периодической таблице. Это переходный металл, расположенный в 8-й группе периодической таблицы. Имеет обозначение Ru.
Технеций
Технеций (Tc) представляет собой серебристо-серый металл с атомным номером 43 в периодической таблице. Это переходный металл, расположенный в 7-й группе периодической таблицы. Он имеет символ Tc.
Молибден
Молибден (Мо) — серебристо-белый металл с атомным номером 42 в периодической таблице. Это переходный металл, расположенный в 6-й группе периодической таблицы. Он имеет обозначение Mb.
Ниобий
Ниобий (Nb) — блестящий белый металл с атомным номером 41 в периодической таблице.
 Это переходный металл, расположенный в группе 5 периодической таблицы. Он имеет символ Nb.
Это переходный металл, расположенный в группе 5 периодической таблицы. Он имеет символ Nb.Цирконий
Цирконий (Zr) представляет собой серо-белый металл с атомным номером 40 в периодической таблице. Это переходный металл, расположенный в 4-й группе периодической таблицы. Он имеет символ Zr.
Иттрий
Иттрий (Y) — серебристый металл с атомным номером 39 в периодической таблице. Это переходный металл, расположенный в группе 3 периодической таблицы. Он имеет символ Y.
Объяснение групп периодической таблицы !! (С именами групп от 1 до 18)
от Admin
Группы периодической таблицы: Вертикальные столбцы периодической таблицы известны как группы периодической таблицы. Всего в периодической таблице 18 групп (вертикальных столбцов).
Итак, вы видели приведенную выше периодическую таблицу, помеченную названиями групп (от 1 до 18).
 Верно?
Верно?Теперь давайте посмотрим от 1 до 18 отдельных групп Периодической таблицы вместе с названиями их групп.
Давайте погрузимся прямо в это !!
Группы в периодической таблице (с названиями групп)Всего в периодической таблице 18 различных групп.
- Группа 1: Группа щелочных металлов (водород не включен)
- Группа 2: Группа щелочноземельных металлов
- Группа 3-12: Группа перехода и внутреннего перехода
- Группа 13: Борона Группа
- Группа 14: Группа углерод
- ГРУППА 15: Группа NITRODE
- ГРУППА 15: Группа NITRED
- ГРУППА 15: Группа NITRODE
- ГРУППА 15: Группа NITRODE
- 9 ГРУППА 15: Группа NITROGE Группа
- Группа 17: Галогены Группа
- Группа 18: Инертные газы Группа
Позвольте мне кратко объяснить каждую из этих групп.

Посмотрите, как эта интерактивная периодическая таблица поможет вам
- Вы можете легко найти каждую деталь об элементах из этой единственной интерактивной периодической таблицы.
- Вы получите подробную информацию о таблице Менделеева, которая превратит новичка в профессионала.
- Вы также получите HD-изображение Периодической таблицы (БЕСПЛАТНО).
Посетите ➢ Периодическая таблица
Группа 1: Группа щелочных металловГруппа щелочных металлов – самая первая группа (группа 1) периодической таблицы.
Элементы, включенные в группу щелочных металлов;
- Литий (Li)
- Натрий (Na)
- Калий (K)
- Рубидий (Rb)
- Цезий (Cs)
- Франций (Fr)
См. также: Почему щелочные металлы так реагируют с водой?
также: Почему щелочные металлы так реагируют с водой?
Щелочноземельные металлы относятся к элементам 2 группы периодической таблицы.
Элементы, включенные в группу щелочноземельных металлов:
- Бериллий (Be)
- Магний (Mg)
- Кальций (Ca)
- Стронций (Sr)
- Барий (Ba)
- Радий (Ra)
См. также: Почему элементы 2 группы называют щелочноземельными металлами?
Группа 3-12: группа переходных и внутренних переходных металловЭлементы, лежащие в группах с 3 по 12 периодической таблицы, называются переходными металлами и внутренними переходными металлами.
Элементы в двух нижних строках периодической таблицы также включены в эти группы.
Они размещены в двух отдельных рядах внизу, так как обладают несколькими различными свойствами.
На самом деле элементы в нижних рядах являются расширением только группы 3. Поэтому они включены в группу 3.
Но поскольку эти элементы имеют несколько различных свойств, они сгруппированы в отдельные элементы, известные как внутренние переходные элементы.
Подробную информацию о переходных и внутренних переходных металлах читайте в основных статьях Переходные металлы периодической таблицы и Внутренние переходные металлы периодической таблицы.
Группа 13: Группа бораГруппа бора — это группа 13 в периодической таблице.
Элементы, входящие в группу бора;
- Бор (B)
- Алюминий (Al)
- Галлий (Ga)
- Индий (In)
- Таллий (Tl)
- Нигоний (Nh) 9 900 См. также полную информацию по элементу бора: 9005. Группа 14: Группа углерода
- Углерод (C)
- Кремний (Si)
- Германий (Ge)
- Олово (Sn)
- Свинец (Pb)
- Флеровий (Fl)
- Азот (N)
- Фосфор (P)
- Мышьяк (As)
- Сурьма (Sb)
- Висмут (Bi)
- Московий (Mc)
- Кислород (O)
- Серная (S)
- Селен (SE)
- Tellurium (TE)
- Polonium (PO)
- Livermorium (LV)
- Фтор (F)
- Хлор (Cl)
- Бром (Br)
- Йод (I)
- Астат (At)
- Теннессин (Ts)
Группа углерода — это группа 14 в периодической таблице.
Элементы, включенные в группу углерода;
См. также: Полная информация об элементе Углерод.
Группа 15: Группа азотаГруппа азота — это группа 15 в периодической таблице.
Элементы, включенные в группу азота;
См. также: Полная информация об элементе Азот.
Группа 16: Группа кислородаГруппа кислорода — это группа 16 в периодической таблице.
Элементы, входящие в группу Кислород;
 группа – это группа 17 в периодической таблице.
группа – это группа 17 в периодической таблице.Элементы, включенные в группу галогенов;
Группа благородных газов является последней группой (группа 18) в периодической таблице.
Элементы, включенные в группу благородных газов:
- Helium (He)
- Neon (Ne)
- Argon (Ar)
- Krypton (Kr)
- Xenon (Xe)
- Radon (Rn)
- Oganesson (Og)
For detailed information on благородные газы, прочитать основную статью Благородные газы таблицы Менделеева.
Заключительные слова Группы — это вертикальные столбцы периодической таблицы. Всего в периодической таблице 18 вертикальных столбцов. Отсюда 18 групп.
Всего в периодической таблице 18 вертикальных столбцов. Отсюда 18 групп.
Элементы, находящиеся в одних и тех же группах, обладают сходными химическими свойствами и имеют одинаковое число валентных электронов.
Например;
Пример группы 1
Все элементы группы 1 сильно реагируют с водой. Они мягкие и легко режутся кухонным ножом.
Также все элементы группы 1 имеют один валентный электрон.
Пример группы 18
Все элементы группы 18 химически инертны (это означает, что они не легко реагируют с другими элементами).
А все элементы группы 18 имеют полный октет (это значит, что у них 8 электронов на внешней оболочке).
Таким образом, элементы одной группы проявляют сходные химические свойства и имеют одинаковое количество валентных электронов.
Бесплатный подарок для вас: Интерактивная таблица Менделеева Позвольте мне рассказать вам, как эта Интерактивная таблица Менделеева поможет вам в учебе.


 :
: H2SO4):
H2SO4):
