| Адроны | msimagelist>|
| Альфа-распад | msimagelist>|
| Альфа-частица | msimagelist>|
| Аннигиляция | msimagelist>|
| Антивещество | msimagelist>|
| Антинейтрон | msimagelist>|
| Антипротон | msimagelist>|
| Античастицы | msimagelist>|
| Атом | msimagelist>|
| Атомная единица массы | msimagelist>|
| Атомная электростанция | msimagelist>|
| Барионное число | msimagelist>|
| Барионы | msimagelist>|
| Бета-распад | msimagelist>|
| Бетатрон | msimagelist>|
| Бета-частицы | msimagelist>|
| Бозе – Эйнштейна статистика | msimagelist>|
| Бозоны | msimagelist>|
| Большой адронный коллайдер | msimagelist>|
| Большой Взрыв | msimagelist>|
Боттом. Боттомоний Боттомоний | msimagelist>|
| Брейта-Вигнера формула | msimagelist>|
| Быстрота | msimagelist>|
| Векторная доминантность | msimagelist>|
| Великое объединение | msimagelist>|
| Взаимодействие частиц | msimagelist>|
| Вильсона камера | msimagelist>|
| Водорода атом | msimagelist>|
| Возбуждённые состояния ядер | msimagelist>|
| Волновая функция | msimagelist>|
| Волновое уравнение | msimagelist>|
| Волны де Бройля | msimagelist>|
| Встречные пучки | |
| Гамильтониан | msimagelist>|
| Гамма-излучение | msimagelist>|
| Гамма-квант | msimagelist>|
| Гамма-спектрометр | msimagelist>|
| Гамма-спектроскопия | msimagelist>|
| Гаусса распределение | msimagelist>|
| Гейгера счётчик | msimagelist>|
| Гигантский дипольный резонанс | msimagelist>|
| Гиперядра | msimagelist>|
| Глюоны | msimagelist>|
| Годоскоп | msimagelist>|
| Гравитационное взаимодействие | msimagelist>|
| Дейтрон | msimagelist>|
| Деление атомных ядер | msimagelist>|
| Детекторы частиц | msimagelist>|
| Дирака уравнение | msimagelist>|
| Дифракция частиц | msimagelist>|
| Доза излучения | msimagelist>|
| Дозиметр | msimagelist>|
| Единая теория поля | msimagelist>|
| Зарядовое сопряжение | msimagelist>|
| Зеркальные ядра | msimagelist>|
| Избыток массы (дефект массы) | msimagelist>|
| Изобары | msimagelist>|
| Изомерия ядерная | msimagelist>|
| Изоспин | msimagelist>|
| Изоспиновый мультиплет | msimagelist>|
| Изотопов разделение | msimagelist>|
| Изотопы | msimagelist>|
| Ионизирующее излучение | msimagelist>|
| Искровая камера | msimagelist>|
| Квантовая механика | msimagelist>|
| Квантовая теория поля | msimagelist>|
| Квантовые операторы | msimagelist>|
| Квантовые числа | msimagelist>|
| Квантовый переход | msimagelist>|
| Квант света | msimagelist>|
| Кварк-глюонная плазма | msimagelist>|
| Кварки | msimagelist>|
| Коллайдер | msimagelist>|
| Комбинированная инверсия | msimagelist>|
| Комптона эффект | msimagelist>|
| Комптоновская длина волны | msimagelist>|
| Конверсия внутренняя | msimagelist>|
| Константы связи | msimagelist>|
| Конфайнмент | msimagelist>|
| Корпускулярно волновой дуализм | msimagelist>|
| Космические лучи | msimagelist>|
| Критическая масса | msimagelist>|
| Лептоны | msimagelist>|
| Линейные ускорители | msimagelist>|
| Лоренца преобразования | msimagelist>|
| Лоренца сила | msimagelist>|
| Магические ядра | msimagelist>|
| Магнитный дипольный момент ядра | msimagelist>|
| Магнитный спектрометр | msimagelist>|
| Максвелла уравнения | msimagelist>|
| Масса частицы | msimagelist>|
| Масс-спектрометр | msimagelist>|
| Массовое число | msimagelist>|
| Масштабная инвариантность | msimagelist>|
| Мезоны | msimagelist>|
| Мессбауэра эффект | msimagelist>|
| Меченые атомы | msimagelist>|
| Микротрон | msimagelist>|
| Нейтрино | msimagelist>|
| Нейтрон | msimagelist>|
| Нейтронная звезда | msimagelist>|
| Нейтронная физика | msimagelist>|
| Неопределённостей соотношения | msimagelist>|
| Нормы радиационной безопасности | msimagelist>|
| Нуклеосинтез | msimagelist>|
| Нуклид | msimagelist>|
| Нуклон | msimagelist>|
| Обращение времени | msimagelist>|
| Орбитальный момент | msimagelist>|
| Осциллятор | msimagelist>|
| Отбора правила | msimagelist>|
| Пар образование | msimagelist>|
| Период полураспада | msimagelist>|
| Планка постоянная | msimagelist>|
| Планка формула | msimagelist>|
| Позитрон | msimagelist>|
| Поляризация | msimagelist>|
| Поляризация вакуума | msimagelist>|
| Потенциальная яма | msimagelist>|
| Потенциальный барьер | msimagelist>|
| Принцип Паули | msimagelist>|
| Принцип суперпозиции | msimagelist>|
| Промежуточные W-, Z-бозоны | msimagelist>|
| Пропагатор | msimagelist>|
| Пропорциональный счётчик | msimagelist>|
| Пространственная инверсия | msimagelist>|
| Пространственная четность | msimagelist>|
| Протон | msimagelist>|
| Пуассона распределение | msimagelist>|
| Пузырьковая камера | msimagelist>|
| Радиационный фон | msimagelist>|
| Радиоактивность | msimagelist>|
| Радиоактивные семейства | msimagelist>|
| Радиометрия | msimagelist>|
| Расходимости | msimagelist>|
| Резерфорда опыт | msimagelist>|
| Резонансы (резонансные частицы) | msimagelist>|
| Реликтовое микроволновое излучение | msimagelist>|
| Светимость ускорителя | msimagelist>|
| Сечение эффективное | msimagelist>|
| Сильное взаимодействие | msimagelist>|
| Синтеза реакции | msimagelist>|
| Синхротрон | msimagelist>|
| Синхрофазотрон | msimagelist>|
| Синхроциклотрон | msimagelist>|
| Система единиц измерений | msimagelist>|
| Слабое взаимодействие | msimagelist>|
| Солнечные нейтрино | msimagelist>|
| Сохранения законы | msimagelist>|
| Спаривания эффект | msimagelist>|
| Спин | msimagelist>|
| Спин-орбитальное взаимодействие | msimagelist>|
| Спиральность | msimagelist>|
| Стандартная модель | msimagelist>|
| Статистика | msimagelist>|
| Странные частицы | msimagelist>|
| Струи адронные | msimagelist>|
| Субатомные частицы | msimagelist>|
| Суперсимметрия | msimagelist>|
| Сферическая система координат | msimagelist>|
| Тёмная материя | msimagelist>|
| Термоядерные реакции | msimagelist>|
| Термоядерный реактор | msimagelist>|
| Тормозное излучение | msimagelist>|
| Трансурановые элементы | msimagelist>|
| Трек | msimagelist>|
| Туннельный эффект | msimagelist>|
| Ускорители заряженных частиц | msimagelist>|
| Фазотрон | msimagelist>|
| Фейнмана диаграммы | msimagelist>|
| Фермионы | msimagelist>|
| Формфактор | msimagelist>|
| Фотон | msimagelist>|
| Фотоэффект | msimagelist>|
| Фундаментальная длина | msimagelist>|
| Хиггса бозон | msimagelist>|
| Цвет | msimagelist>|
| Цепные ядерные реакции | msimagelist>|
| Цикл CNO | msimagelist>|
| Циклические ускорители | msimagelist>|
| Циклотрон | msimagelist>|
Чарм. Чармоний Чармоний | msimagelist>|
| Черенковский счётчик | msimagelist>|
| Черенковсое излучение | msimagelist>|
| Черные дыры | msimagelist>|
| Шредингера уравнение | msimagelist>|
| Электрический квадрупольный момент ядра | msimagelist>|
| Электромагнитное взаимодействие | msimagelist>|
| Электрон | msimagelist>|
| Электрослабое взаимодействие | msimagelist>|
| Элементарные частицы | msimagelist>|
| Ядерная физика | msimagelist>|
| Ядерная энергия | msimagelist>|
| Ядерные модели | msimagelist>|
| Ядерные реакции | msimagelist>|
| Ядерный взрыв | msimagelist>|
| Ядерный реактор | msimagelist>|
| Ядра энергия связи | msimagelist>|
| Ядро атомное | msimagelist>|
| Ядерный магнитный резонанс (ЯМР) | msimagelist>
Индекс Хирша (h-индекс) и импакт-фактор
Индекс Хирша или h-индекс— наукометрический показатель, предложенный в 2005 американским физиком Хорхе Хиршем из университета Сан-Диего, Калифорния. Индекс Хирша является количественной характеристикой продуктивности учёного, основанной на количестве его публикаций и количестве цитирований этих публикаций.
Индекс Хирша является количественной характеристикой продуктивности учёного, основанной на количестве его публикаций и количестве цитирований этих публикаций.
Импакт-фактор
Важнейшим среди всех критериев оценки уровня научных исследований в мировой практике считается импакт-фактор (ИФ). Согласно общепринятой формулировке, импакт-фактор — это численный показатель важности научного журнала.
Согласно общепринятой формулировке, импакт-фактор — это численный показатель важности научного журнала.
Методика расчёта импакт-фактора в РИНЦ
- Импакт-фактор в РИНЦ рассчитывается только для российских научных журналов, зарубежных журналов на русском языке, а также зарубежных журналов, имеющих лицензионное соглашение с НЭБ на передачу данных в РИНЦ. Для переводных российских журналов импакт-фактор рассчитывается только для оригинальной русской версии. Не рассматриваются реферативные журналы и журналы, не выходящие в настоящее время.
- Импакт-фактор рассчитывается на основе данных по цитированию журнала в РИНЦ за предыдущие два года (или пять лет). При этом данные по цитированию берутся из публикаций года, для которого рассчитывается импакт-фактор. При расчете импакт-фактора число ссылок, сделанных в расчетном году из всех обрабатываемых в РИНЦ журналов на статьи, опубликованные в данном журнале за предыдущие два года (или пять лет), делится на общее число этих статей.
 То есть, по сути, данный показатель отражает среднее число цитирований одной статьи в журнале. Например, при расчете пятилетнего импакт-фактора за 2013 год суммарное число ссылок, сделанных в 2013 году на статьи, опубликованные в журнале в период с 2008 по 2012 год включительно, делится на общее число статей, опубликованных в выпусках журнала за 2008-2011 годы.
То есть, по сути, данный показатель отражает среднее число цитирований одной статьи в журнале. Например, при расчете пятилетнего импакт-фактора за 2013 год суммарное число ссылок, сделанных в 2013 году на статьи, опубликованные в журнале в период с 2008 по 2012 год включительно, делится на общее число статей, опубликованных в выпусках журнала за 2008-2011 годы. - Необходимым условием для расчета двухлетнего и пятилетнего импакт-факторов является наличие в РИНЦ всех выпусков журнала соответственно за три года (год расчета импакт-фактора плюс два предыдущих года) и за шесть лет (год расчета импакт-фактора плюс пять предыдущих лет).
- Для новых журналов, дата основания которых попадает в требуемый для расчета импакт-фактора период, в РИНЦ должны быть представлены все выпуски с момента основания журнала. Для двухлетнего импакт-фактора необходимый архив журнала: год расчета импакт-фактора плюс один предыдущий год, для пятилетнего импакт-фактора – год расчета импакт-фактора плюс два предыдущих года.
 Это означает, что для расчета двухлетнего импакт-фактора журнал должен выходить как минимум 2 года, а для расчета пятилетнего – 3 года.
Это означает, что для расчета двухлетнего импакт-фактора журнал должен выходить как минимум 2 года, а для расчета пятилетнего – 3 года. - При расчете импакт-фактора журнала учитываются только научные статьи, обзорные статьи и краткие сообщения (это относится как к цитирующим, так и к цитируемым статьям). Не учитываются ссылки из сборников статей, монографий, материалов конференций и т.д., только ссылки из научных журналов. Кроме того, не учитываются публикации, у которых нет авторов. Исключение составляет двухлетний импакт-фактор с учетом цитирования из всех источников, при расчете которого учитываются все ссылки на журналв, в том числе сделанные в монографиях, сборниках статей, трудах конференций, диссертациях и т.д.
- Если журнал переименовывался в течение последних лет, то учитывается суммарное количество цитирований данного журнала и его предыдущей версии. Если журнал имеет переводную английскую версию, то учитывается суммарное количество цитирований оригинальной русскоязычной и переводной версии.
 Для журналов, у которых только часть статей попадает в составной переводной журнал, учитываются все ссылки на русскую версию, а также ссылки на отдельные статьи, включенные в английскую версию.
Для журналов, у которых только часть статей попадает в составной переводной журнал, учитываются все ссылки на русскую версию, а также ссылки на отдельные статьи, включенные в английскую версию. - В случае цитирования из российского журнала, имеющего переводную версию на английском языке, которая также представлена в РИНЦ, засчитывается только ссылка из оригинальной статьи на русском языке. Это позволяет избежать дублирования ссылок из оригинальной статьи и ее переводной версии.
- База данных РИНЦ постоянно растет и пополняется как новыми журналами, так и новыми выпусками уже обрабатываемых журналов, в том числе архивными. Чтобы учесть эти обновления, импакт-факторы журналов периодически пересчитываются и, соответственно, могут несколько меняться с течением времени.
Алгоритм поиска импакт-фактора в РИНЦ
Алгоритм поиска импакт-фактора в Web of Science
Сообщение EM_SETREADONLY (Winuser.
 h) – Win32 apps
h) – Win32 apps
- Чтение занимает 2 мин
Please rate your experience
Да Нет
Хотите оставить дополнительный отзыв?
Отзывы будут отправляться в корпорацию Майкрософт. Нажав кнопку “Отправить”, вы разрешаете использовать свой отзыв для улучшения продуктов и служб Майкрософт. Политика конфиденциальности.
Отправить
Спасибо!
В этой статье
Задает или удаляет доступный только для чтения стиль (_ ReadOnly) элемента управления “поле ввода”. Это сообщение можно отправить либо в элемент управления “поле ввода”, либо в элемент управления Rich Edit.
Это сообщение можно отправить либо в элемент управления “поле ввода”, либо в элемент управления Rich Edit.
Параметры
wParam
Указывает, следует ли устанавливать или удалять стиль _ только для чтения ES . Значение true задает стиль, _ доступный только для чтения и т. е. значение false удаляет стиль _ только для чтения .
lParam
Этот параметр не используется.
Возвращаемое значение
Если операция выполнена удачно, возвращаемое значение не равно нулю.
Если операция завершается ошибкой, возвращаемое значение равно нулю.
Комментарии
Если элемент управления “поле ввода” имеет стиль ” _ только для чтения “, пользователь не может изменить текст в элементе управления “поле ввода”.
Чтобы определить, имеет ли элемент управления “поле ввода” стиль ” _ только для чтения “, используйте функцию жетвиндовлонг с _ флагом стиля ГВЛ.
Расширенное редактирование: Поддерживается в Microsoft Rich Edit 1,0 и более поздних версиях. Дополнительные сведения о совместимости расширенных версий редактирования с различными версиями системы см. в разделе Общие сведения об элементах управления редактированием.
Требования
| Требование | Значение |
|---|---|
| Минимальная версия клиента | Windows [Только классические приложения Vista] |
| Минимальная версия сервера | Windows Только для [ настольных приложений сервера 2003] |
| Заголовок |
|
См. также раздел
жетвиндовлонг
Как узнать индекс Хирша во всех базах?
Что такое индекс Хирша, или h-индекс? Индекс Хирша – это наукометрический показатель значимости научных исследований. Критерий используется в мировом научном сообществе в качестве альтернативы индексу цитируемости.
Показатель h-индекс имеет принципиальное значение, когда нужно, например, выделить грант, сделать кадровые перестановки, оценить активность ученого в плане публикации или получить звание кандидата или доктора наук.
Содержание:
- Как рассчитать индекс Хирша?
- Как узнать индекс Хирша в РИНЦ?
- Как узнать индекс Хирша в Scopus
- Определение индекса Хирша по Web of Science
- Сравнение индекса Хирша
- Как повысить индекс Хирша?
С момента его введения в науку в 2005 г. и по настоящее время термин получил большую популярность. Автором метода является профессор физики и преподаватель Калифорнийского университета Хорхе Хирш.
Индекс применяется в целях оценки значимости трудов и при сравнении ученых и коллективов. Он выделяет именно те труды, чья востребованность заметна больше других. Этим он отличается от простого подсчета цитат всех научных трудов одного автора.
Как рассчитать индекс Хирша?
Принцип расчета базируется на анализе цитирования научных работ ученого в соотношении с количеством его работ. Индекса Хирша рассчитывается по следующей формуле:
- Ученый опубликовал 10 статей, и каждую процитировали по 1 разу, индекс Хирша равен 1.
- Ученый опубликовал 1 статью, и ее процитировали 10 раз, получаем h-индекс равный 1.
На основании данных идеальных примеров можно сделать важный вывод о том, что можно опубликовать одну качественную и интересную статью в известном научном журнале, что будет формально равно тем же стараниям, что человек затратит на «штамповку» посредственных статей и публикацию их в слабых журналах. В реальности чаще происходят ситуации, когда у одного автора есть 10 статей, но они цитируются с разной частотой. Приведем примеры расчета индекса Хирша:
Следовательно, для получения значения h-индекса надо сделать 2 шага:
- Выстроить статьи от большего объема их цитирования к меньшему.

- Определить научный труд, чей номер равняется количеству ссылок на него.
На выходе мы получим искомое. В онлайн-базах данных индекс автоматически определяется программами. В каждой научной базе значение различается из-за неравнозначности объема анализируемых данных.
Как узнать индекс Хирша в elibrary?
Портал elibrary.ru был создан в целях обеспечения поддержки базы данных РИНЦ (Российский индекс научного цитирования).
Посмотреть индекс Хирша в elibrary можно, пройдя по ссылке http://elibrary.ru и введя свои логин и пароль. Вверху выбирается вкладка “Для авторов” – “Персональный профиль автора ” –- “Мои публикации”. Здесь появляется список публикаций. Диапазон поиска можно сузить, используя указатели направленности научной тематики.
Индекс Хирша по РИНЦ
Список самых цитируемых и продуктивных отечественных научных сотрудников разрабатывается на платформе РИНЦ. Чтобы узнать индекс Хирша по публикациям в базе РИНЦ, на главной страничке сайта выбирается пункт меню Навигатор – Авторский указатель, так происходит поиск интересующего автора.
Схема поиска цитируемости в РИНЦ такова:
- До того как отправить данные в библиотеку elibrary.ru, программа формирует специальный файл с информацией обо всех статьях, опубликованных в отдельном номере.
- Производится загрузка файла в библиотеку.
- Следует двухэтапная проверка специальными программами и сотрудниками РИНЦ. Присутствие человеческого фактора повышает качество, одновременно понижая скорость.
- Проводится индексация. Когда находится цитата, программа прибавляет автоматически «1» к числу ее упоминаний.
1) Чтобы определить индекс Хирша по ядру РИНЦ, необходимо пройти по ссылке Авторский указатель в левом меню:
2) Далее указываем фамилию и при необходимости другие данные, чтобы сузить поиск:
3) Надо нажать на значок, изображающий диаграммы, что позволит определить искомое значение индекса Хирша по РИНЦ.
Как узнать индекс Хирша по Scopus?
Среди платных баз данных следует выделить систему Scopus, созданную в 1995 г. Наукометрическая база Scopus индексирует более чем 25000 изданий и ежедневно обновляется. Чтобы узнать индекс Хирша в Scopus, зайдите на сайт http://www.scopus.com (ваша научная работа должна быть проиндексированной).
Когда статья проиндексируется, появится профиль автора и автоматически будет рассчитываться индекс Хирша по Scopus. Поэтому нужно следить за количеством цитирований и повышать их.
1) На главной странице сайта нажмите на Author search. После чего в открывшемся окошке надо набрать фамилию в латинской транскрипции (важно: именно так, как указано в публикации) и нажать кнопку Search:
2) Появляется число, обозначающее количество публикаций (оно находится в столбце Documents). Жмите на него.
3) Чтобы узнать индекс Хирша в Скопусе, следует поставить галочку рядом со словом All. Потом надо нажать на View citation overview:
Потом надо нажать на View citation overview:
4) На открывшейся странице индекс Хирша по Scopus будет обозначен наверху справа.
Как узнать индекс Хирша в Web of Science?
Web of Science – иностранная база, которая охватывает научные издания из разных стран и сотрудничает с 12000 изданий на английском и других национальных языках. Узнать индекс Хирша по WoS можно на официальном сайте http://apps.webofknowledge.com. Для этого научная работа должна быть проиндексированной в WoS.
1) необходимо воспользоваться поиском по автору (вкладка Author Search).
2) Заполняем фамилию на английском языке и жмем на Finish Search.
3) В новом окне нажимаем на Create Citation Report и получаем данные индекса Хирша по WoS.
4) Он обозначен справа от списка работ. Внизу видны слова «h index». Таков путь к этому значению в Веб оф Сайнс.
Таков путь к этому значению в Веб оф Сайнс.
Все названные сайты требуют регистрации, чтобы работать с ними.
Сравнение индекса Хирша у известных ученых
Индекс Хирша широко используется в качестве наукометрического показателя. Сравнивая h-индекс ученых, учитывают особенности, сопряженные с результатом научно-исследовательской деятельности автора (организации) и культурой цитирования в разных направлениях науки.
Наукометрический показатель Хирша считается адекватной оценкой только при сравнении ученых, которые работают в одной сфере науки. Так, цитирование, например, в биологии и медицинской сфере намного выше, чем в физике и математике. Наукометрический индекс критикуют, а многие математики вовсе его не признают.
| ФИО | Научная деятельность | Индекс Хирша по РИНЦ | Индекс Хирша в Scopus |
| Сергеев Александр Михайлович | физик, президент Федерального научно-исследовательского института в Нижнем Новгороде | 48 | 38 |
| Садовничий Виктор Антонович | физик, МГУ М. В. Ломоносова, Москва В. Ломоносова, Москва |
27 | 11 |
| Новоселов Константин Сергеевич | российско-британский физик, университет в Манчестере | 76 | 111 |
| Альберт Эйнштейн | физик-теоретик, автор теории относительности | 0 | 40 |
Как видно выше, у Альберта Эйнштейна показатель h-индекс 40. Если посмотреть на цифры, можно понять, что многие российские ученые опережают физика в рейтинге ученых. Почему же у Эйнштейна научный индекс такой низкий? Вполне вероятно, это подтверждает, что излагаемые им идеи обгоняют текущий результат науки и техники.
У молодых научных деятелей отсутствует h-индекс цитируемости. Причина тому – непродолжительная научная карьера. А ведь определенно для них количественные показатели важны для продвижения по карьерной лестнице и инвестирования в исследования. Из-за малого опыта научные работы невысоко ценятся.
Как повысить индекс Хирша самостоятельно?
Выполнить повышение индекса Хирша сложно по ряду причин. Бывают случаи, когда в базе имеется только часть трудов какого-либо автора и присутствуют не все цитаты, взятые из других публикаций. Иногда в результате соавторства, а также сходства фамилий двух авторов происходит так, что достижения одного ученого присваиваются другому.
Поднять индексы цитируемости Хирша можно следующим образом:
- Издавать уникальные научные статьи такого качества, которые будут цитироваться другими учеными.
- Сотрудничать при написании трудов с учеными, имеющими повышенный индекс Хирша.
- Публикуясь в иностранных изданиях, ссылаться на собственные работы, не превышая строгий порог.
- Публиковаться в изданиях, рекомендуемых экспертным советом ВАК.
- Обмениваться ссылками на публикации с другими учеными.
Способы повышения индекса Хирша (чек-лист)
Если необходимо повышение цитируемости индекс Хирша в Scopus, то можно:
- найдите интересные и востребованные темы, но помните главное не количество, а качество статей;
- заинтересуйте исследователей содержанием и аннотацией, так как их читают видят в первую очередь;
- следить за оформлением статей и соблюдать требования редакций;
- ознакомьтесь заранее с условиями публикации на официальном сайте журнала;
- распространяйте информацию о своих статьях в научных социальных сетях, например ResearchGate.

Именно этими методами возможно реально увеличить индекс Хирша.
В России данный показатель влияет на рейтинг вузов по качеству образования. При оценке активности научной деятельности в первую очередь будут смотреть на него. Высокий индекс Хирша говорит о значимости исследователи и значительно повышает шансы на получение российских грантов.
Показатели цитируемости для различных отраслей знания отличаются большим диапазоном. К цитатам из медицинских работ прибегают чаще, а, к примеру, математическим – реже. Вот почему индекс Хирша работает хорошо только при сравнительном анализе ученых одной области науки.
С введением в науку h-индекса стало возможным определить степень популярности конкретного научного труда ученого. Это более точный инструмент, если сравнивать с простым сопоставлением общего количества изданных трудов и их цитирований.
Сероводород h3S – Что такое Сероводород h3S?
Бесцветный газ с неприятным запахом тухлых яиц. Также является побочным продуктом нефтепереработки
Также является побочным продуктом нефтепереработки
Сероводород (сернистый водород, сульфид водорода, дигидросульфид) H2S – самое активное из серосодержащих соединений.
В нормальных условиях – бесцветный газ с неприятным запахом тухлых яиц.
Газ – потому что атомы водорода в молекуле не образуют прочных водородных связей, в отличие от молекул воды,.
Растворим в воде (в 1V H2O растворяется 3V H2S при н.у.), растворяется в этаноле.
Растворимость H2S в углеводородной фазе выше, чем в водной, коэффициент распределения H2S между фазами зависит в 1ю очередь от состава углеводородной фазы: в бензоле – 5 9 – 6 0; в керосине – 2 4 – 2 5; в легкой нефти – 1,5 – 1,75.
Взрывоопасен в смеси с воздухом в диапазоне 4 – 45% об.
Вызывает сильную коррозию металлов.
Также является продуктом нефтепереработки.
Используется в химической промышленности в оргсинтезе для получения тиофена и меркаптанов, получения серы, серной кислоты, сульфидов.
В медицине используется в сероводородных ваннах.
Сероводород – токсичный газ 3 класса опасности, действующий непосредственно на нервную систему.
Сероводород притупляет обонятельный нерв и интоксикация может произойти внезапно.
Ощутимый запах – при концентрации H2S 1,4 – 2,3 мг/м3, значительный запах – 4 мг/м3, тяжелый запах – от 7 мг/м3.
Острое отравление наступает уже при концентрациях 0,2 – 0,3 мг/л, концентрация более 1 мг/л ( 0,1% концентрация газа в воздухе) – смертельна для человека.
Признаки сильного отравления сероводородом: отек легких, судороги, паралич нервов, последующая кома.
Если в содержится от 0,02% H2S, то ощущается головокружение, головная боль, тошнота и довольно скорое привыкание к запаху тухлых яиц.
При хроническом отравлении ухудшается зрение, поражается слизистая оболочка глаза, вероятен конъюнктивит, светобоязнь.
При отравлении H2S, нужно срочно выйти на свежий воздух, принять сердечные и дыхательные аналептики, препараты железа, глюкозу, витамины.
Предельно-допустимая концентрация (ПДК) H2S в воздухе в рабочей зоне – 10 мг/м3 (ГН 2.2.5.1313-03 Предельно допустимые концентрации вредных веществ в воздухе рабочей зоны), в смеси с углеводородами – 3 мг/м3.
ПДК H2S в воздухе населенных мест- 0,008 мг/м3 (ГН 2.1.6.1338-03 Предельно допустимые концентрации загрязняющих веществ в атмосферном воздухе населенных мест).
Получение H2S:
– реакция взаимодействия разбавленных кислот с сульфидами
– реакция взаимодействия сульфида алюминия с водой
– сплавление парафина с серой.
В природе встречается довольно редко в составе попутного нефтяного газа (ПНГ), природного газа, вулканического газа, в растворенном виде в природных водах.
К примеру, в Черном море слои воды, расположенные глубже 150 -200 м содержат растворенный H2S.
Содержится в сырой нефти.
Образуется при гниении белков, содержащих в составе серосодержащие аминокислоты метионин или цистеин.
Кишечные газы человека и животных тоже содержат H2S. Чуть – чуть, но малоприятно.
Сочетания клавиш Mac – Служба поддержки Apple (RU)
Нажатие определенных сочетаний клавиш позволяет выполнять операции, для которых обычно необходима мышь, трекпад или другие устройства ввода.
Для использования сочетания клавиш нажмите и удерживайте одну или более клавиш модификации, а затем нажмите последнюю клавишу сочетания. Например, чтобы использовать сочетание Command-C (копировать), нажмите и удерживайте клавишу Command, затем клавишу C, затем отпустите обе клавиши. В меню и на клавиатурах компьютеров Mac часто используются символы для определенных клавиш, в том числе для клавиш модификации:
Например, чтобы использовать сочетание Command-C (копировать), нажмите и удерживайте клавишу Command, затем клавишу C, затем отпустите обе клавиши. В меню и на клавиатурах компьютеров Mac часто используются символы для определенных клавиш, в том числе для клавиш модификации:
- Command (или Cmd) ⌘
- Shift ⇧
- Option (или Alt) ⌥
- Control (или Ctrl) ⌃
На клавиатурах, предназначенных для компьютеров с ОС Windows, используйте клавишу Alt вместо Option и клавишу с логотипом Windows вместо Command.
Некоторые клавиши на некоторых клавиатурах Apple имеют специальные символы и функции: яркость дисплея , яркость клавиатуры , Mission Control и другие. Если на клавиатуре эти функции недоступны, для некоторых из них можно создать собственные сочетания клавиш. В сочетании с клавишей Fn эти клавиши работают как F1, F2, F3 или другие стандартные функциональные клавиши.
В сочетании с клавишей Fn эти клавиши работают как F1, F2, F3 или другие стандартные функциональные клавиши.
Сочетания клавиш для копирования, вставки и других часто используемых операций
- Command-X: вырезание выделенного объекта и его копирование в буфер обмена.
- Command-C: копирование выделенного объекта в буфер обмена. Это сочетание клавиш также работает для файлов в Finder.
- Command-V: вставка содержимого буфера обмена в текущий документ или приложение. Это сочетание клавиш также работает для файлов в Finder.
- Command-Z: отмена предыдущей команды. Отмену также можно обратить, нажав клавиши Command-Shift-Z для повтора отмененной команды. В некоторых приложениях можно отменять и повторять несколько последних команд.
- Command-A: выбор всех объектов.

- Command-F: поиск объектов в документе или открытие окна Find.
- Command-G (Повторить поиск): поиск следующего вхождения ранее найденного объекта. Чтобы найти предыдущее вхождение, нажмите клавиши Shift-Command-G.
- Command-H: скрытие окна активного приложения. Чтобы оставить открытым окно активного приложения, но скрыть все остальные, нажмите клавиши Option-Command-H.
- Command-M: свертывание активного окна в значок на панели Dock. Чтобы свернуть все окна активного приложения, нажмите клавиши Option-Command-M.
- Command-O: открытие выделенного объекта или вызов диалогового окна, позволяющего выбрать файл для открытия.
- Command-P: печать текущего документа.
- Command-S: сохранение текущего документа.
- Command-T: открытие новой вкладки.
- Command-W: закрытие активного окна.
 Чтобы закрыть все окна приложения, нажмите клавиши Option-Command-W.
Чтобы закрыть все окна приложения, нажмите клавиши Option-Command-W. - Option-Command-Esc: принудительное завершение работы приложения.
- Command-Пробел: отображение или скрытие поля поиска Spotlight. Чтобы выполнить поиск Spotlight в окне Finder, нажмите клавиши Command-Option-Пробел. (Если вы используете несколько источников ввода для набора текста на разных языках, эти сочетания клавиш меняют источники ввода вместо вызова Spotlight. Узнайте, как изменить конфликтующее сочетание клавиш.)
- Control-Command-Пробел: отображение панели «Символы», с которой можно выбирать эмодзи и другие символы.
- Control-Command-F: переход в полноэкранный режим (если поддерживается приложением).
- Пробел: использование быстрого просмотра для выделенного объекта.
- Command-Tab: переключение на следующее недавно использованное приложение среди открытых приложений.

- Shift-Command-5: создание снимка или записи экрана в macOS Mojave или более поздней версии. Для создания снимков экрана также можно использовать сочетание клавиш Shift-Command-3 или Shift-Command-4. Узнайте больше о снимках экрана.
- Shift-Command-N: создание новой папки в Finder.
- Command-Запятая (,): открытие окна настроек активного приложения.
Сочетания клавиш для перехода в режим сна, выхода из системы и выключения
Некоторые из этих сочетаний клавиш необходимо удерживать несколько дольше, чем другие. Это помогает избежать их непреднамеренного срабатывания.
* Неприменимо к датчику Touch ID.
Сочетания клавиш Finder и системы
- Command-D: создание дубликатов выделенных файлов.

- Command-E: извлечение выбранного диска или тома.
- Command-F: запуск поиска Spotlight в окне Finder.
- Command-I: отображение окна свойств для выделенного файла.
- Command-R: (1) отображение первоначального файла для выбранного псевдонима в Finder. (2) В некоторых приложениях, например «Календарь» или Safari, сочетание используется для обновления или перезагрузки страницы. (3) В окне настроек «Обновление ПО»: повторная проверка наличия обновлений.
- Shift-Command-C: открытие окна «Компьютер».
- Shift-Command-D: открытие папки рабочего стола.
- Shift-Command-F: открытие окна «Недавние» со списком файлов, которые недавно просматривались или редактировались.
- Shift-Command-G: открытие окна «Переход к папке».
- Shift-Command-H: открытие личной папки текущей учетной записи пользователя macOS.

- Shift-Command-I: открытие iCloud Drive.
- Shift-Command-K: открытие окна «Сеть».
- Option-Command-L: открытие папки «Загрузки».
- Shift-Command-N: создание новой папки.
- Shift-Command-O: открытие папки «Документы».
- Shift-Command-P: отображение или скрытие области предварительного просмотра в окнах Finder.
- Shift-Command-R: открытие окна AirDrop.
- Shift-Command-T: отображение или скрытие строки вкладок в окнах Finder.
- Control-Shift-Command-T: добавление выбранного объекта Finder на панель Dock (OS X Mavericks или более поздней версии).
- Shift-Command-U: открытие папки «Утилиты».
- Option-Command-D: отображение или скрытие панели Dock.
- Control-Command-T: добавление выбранного объекта на боковую панель (OS X Mavericks или более поздней версии).

- Option-Command-P: скрытие или отображение строки пути в окнах Finder.
- Option-Command-S: скрытие или отображение боковой панели в окнах Finder.
- Command-Косая черта (/): скрытие или отображение строки состояния в окнах Finder.
- Command-J: «Показать параметры вида».
- Command-K: открытие окна «Подключение к серверу».
- Control-Command-A: создание псевдонима для выбранного объекта.
- Command-N: открытие нового окна Finder.
- Option-Command-N: создание новой смарт-папки.
- Command-T: отображение или скрытие панели вкладок, когда в текущем окне Finder открыта одна вкладка.
- Option-Command-T: отображение или скрытие панели инструментов, когда в текущем окне Finder открыта одна вкладка.
- Option-Command-V: перемещение файлов, находящихся в буфере обмена, из исходного местоположения в текущее.

- Command-Y: предварительный просмотр выделенных файлов с помощью функции «Быстрый просмотр».
- Option-Command-Y: просмотр слайд-шоу «Быстрый просмотр» для выделенных файлов.
- Command-1: просмотр объектов в окне Finder в виде значков.
- Command-2: просмотр объектов в окне Finder в виде списка.
- Command-3: просмотр объектов в окне Finder в виде столбцов.
- Command-4: просмотр объектов в окне Finder в виде галереи.
- Command-Левая квадратная скобка ([): переход к предыдущей папке.
- Command-Правая квадратная скобка (]): переход к следующей папке.
- Command-Стрелка вверх: открытие папки, содержащей текущую папку.
- Command-Control-Стрелка вверх: открытие папки, содержащей текущую папку, в новом окне.
- Command-Стрелка вниз: открытие выделенного объекта.

- Стрелка вправо: открытие выделенной папки. Работает только при отображении объектов списком.
- Стрелка вниз: закрытие выделенной папки. Работает только при отображении объектов списком.
- Command-Delete: перемещение выделенного объекта в корзину.
- Shift-Command-Delete: очистка корзины.
- Option-Shift-Command-Delete: очистка корзины без вывода диалогового окна подтверждения.
- Command-Уменьшение яркости: включение или выключение видеоповтора, когда компьютер Mac подключен к нескольким дисплеям.
- Option-Увеличение яркости: открытие окна настроек «Мониторы». Работает с любой из клавиш настройки яркости.
- Control-Увеличение яркости или Control-Уменьшение яркости: изменение яркости внешнего дисплея (если поддерживается дисплеем).
- Option-Shift-Увеличение яркости или Option-Shift-Уменьшение яркости: регулирование яркости дисплея с меньшим шагом.
 Добавление клавиши Control к этому сочетанию клавиш позволяет регулировать яркость внешнего дисплея (если поддерживается дисплеем).
Добавление клавиши Control к этому сочетанию клавиш позволяет регулировать яркость внешнего дисплея (если поддерживается дисплеем). - Option-Mission Control: открытие окна настроек Mission Control.
- Command-Mission Control: отображение рабочего стола.
- Control-Стрелка вниз: отображение всех окон активного приложения.
- Option-Увеличение громкости: открытие окна настроек «Звук». Работает с любой из клавиш настройки громкости.
- Option-Shift-Увеличение громкости или Option-Shift-Уменьшение громкости: регулировка громкости с меньшим шагом.
- Option-Увеличение яркости клавиатуры: открытие окна настроек «Клавиатура». Работает с любой из клавиш настройки яркости клавиатуры.
- Option-Shift-Увеличение яркости клавиатуры или Option-Shift-Уменьшение яркости клавиатуры: регулировка яркости клавиатуры с меньшим шагом.

- Двойной щелчок при нажатой клавише Option: открытие объекта в отдельном окне с закрытием исходного окна.
- Двойной щелчок при нажатой клавише Command: открытие папки на отдельной вкладке или в отдельном окне.
- Перетаскивание на другой том при нажатой клавише Command: перемещение перетаскиваемого объекта на другой том вместо копирования.
- Перетаскивание при нажатой клавише Option: копирование перетаскиваемого объекта. При перетаскивании объекта указатель меняется.
- Option-Command при перетягивании: создание псевдонима перетаскиваемого объекта. При перетаскивании объекта указатель меняется.
- Щелчок треугольника раскрытия при нажатой клавише Option: открытие всех папок в выбранной папке. Работает только при отображении объектов списком.
- Щелчок заголовка окна при нажатой клавише Command: просмотр папок, содержащих текущую папку.

- Узнайте, как использовать клавиши Command и Shift для выбора нескольких объектов в Finder.
- Щелкните «Переход» в строке меню Finder, чтобы просмотреть сочетания клавиш для открытия множества часто используемых папок, таких как «Программы», «Документы», «Загрузки», «Утилиты» и «iCloud Drive».
Сочетания клавиш для документов
Назначение следующих сочетаний клавиш может различаться в зависимости от приложения.
- Command-B: применение полужирного начертания к выделенному тексту или включение/выключение использования полужирного шрифта.
- Command-I: применение курсивного начертания к выделенному тексту или включение/выключение использования курсива.
- Command-K: добавление веб-ссылки.
- Command-U: применение подчеркивания к выделенному тексту или включение/выключение использования подчеркивания.

- Command-T: отображение или скрытие окна «Шрифты».
- Command-D: выбор папки «Рабочий стол» в диалоговом окне открытия или сохранения файла.
- Control-Command-D: отображение или скрытие определения выделенного слова.
- Shift-Command-Двоеточие (:): открытие окна «Правописание и грамматика».
- Command-Точка с запятой (;): поиск неправильно написанных слов в документе.
- Option-Delete: удаление слова слева от точки вставки.
- Control-H: удаление символа слева от точки вставки. Или используйте клавишу Delete.
- Control-D: Удаление символа справа от точки вставки. Или используйте клавиши Fn-Delete.
- Fn-Delete: удаление вперед на клавиатурах, на которых отсутствует клавиша Forward Delete. Или используйте сочетание клавиш Control-D.
- Control-K: удаление текста между точкой вставки и концом строки или абзаца.

- Fn-Стрелка вверх (Page Up): прокрутка вверх на одну страницу.
- Fn-Стрелка вниз (Page Down): прокрутка вниз на одну страницу.
- Fn-Стрелка влево (Home): прокрутка к началу документа.
- Fn-Стрелка вправо (End): прокрутка к концу документа.
- Command-Стрелка вверх: перемещение точки вставки в начало документа.
- Command-Стрелка вниз: перемещение точки вставки в конец документа.
- Command-Стрелка влево: перемещение точки вставки в начало текущей строки.
- Command-Стрелка вправо: перемещение точки вставки в конец текущей строки.
- Option-Стрелка влево: перемещение точки вставки в начало предыдущего слова.
- Option-Стрелка вправо: перемещение точки вставки в конец предыдущего слова.
- Shift-Command-Стрелка вверх: выделение текста между точкой вставки и началом документа.

- Shift-Command-Стрелка вниз: выделение текста между точкой вставки и концом документа.
- Shift-Command-Стрелка влево: выделение текста между точкой вставки и началом текущей строки.
- Shift-Command-Стрелка вправо: выделение текста между точкой вставки и концом текущей строки.
- Shift-Стрелка вверх: распространение области выделения текста до ближайшего символа в той же позиции по горизонтали на одну строку выше.
- Shift-Стрелка вниз: распространение области выделения текста до ближайшего символа в той же позиции по горизонтали на одну строку ниже.
- Shift-Стрелка влево: расширение области выделения текста на один символ влево.
- Shift-Стрелка вправо: расширение области выделения текста на один символ вправо.
- Option-Shift-Стрелка влево: расширение области выделения текста до начала текущего абзаца, при повторном нажатии — до начала следующего абзаца.

- Option-Shift-Стрелка вниз: расширение области выделения текста до конца текущего абзаца, при повторном нажатии — до конца следующего абзаца.
- Option-Shift-Стрелка влево: расширение области выделения текста до начала текущего слова, при повторном нажатии — до начала следующего слова.
- Option-Shift-Стрелка вправо: расширение области выделения текста до конца текущего слова, при повторном нажатии — до конца следующего слова.
- Control-A: переход в начало строки или абзаца.
- Control-E: переход в конец строки или абзаца.
- Control-F: переход на один символ вперед.
- Control-B: переход на один символ назад.
- Control-L: расположение курсора или выделенного фрагмента по центру видимой области.
- Control-P: переход на одну строку вверх.
- Control-N: переход на одну строку вниз.

- Control-O: вставка новой строки за точкой вставки.
- Control-T: обмен позиций символа после точки вставки и символа перед точкой вставки.
- Command-Левая фигурная скобка ({): выравнивание по левому краю.
- Command-Правая фигурная скобка (}): выравнивание по правому краю.
- Shift-Command-Вертикальная черта (|): выравнивание по центру.
- Option-Command-F: переход в поле поиска.
- Option-Command-T: отображение или скрытие панели инструментов в приложении.
- Option-Command-C (Скопировать стиль): копирование параметров форматирования выбранного объекта в буфер обмена.
- Option-Command-V (Вставить стиль): применение скопированного стиля к выбранному объекту.
- Option-Shift-Command-V (Вставить и согласовать стиль): применение к вставленному объекту стиля окружающего текста.

- Option-Command-I: Отображение или скрытие окна «Инспектор».
- Shift-Command-P (Параметры страницы): отображение окна для выбора настроек документа.
- Shift-Command-S: вызов диалогового окна «Сохранить как» или дублирование текущего документа.
- Shift-Command-Знак минуса (-): уменьшение размера выделенного объекта.
- Shift-Command-Знак плюса (+): Увеличение размера выделенного объекта. Command-Знак равенства (=) выполняет ту же функцию.
- Shift-Command-Знак вопроса (?): открытие меню «Справка».
Другие сочетания клавиш
Дополнительные сочетания клавиш показаны в меню приложений. В каждом приложении могут быть свои сочетания клавиш, и сочетания, работающие в одном приложении, могут не работать в другом.
Дополнительная информация
Дата публикации:
Молярная масса водорода (H), формула и примеры
Молярная масса водорода
Молярную массу обычно выражают в г/моль, реже в кг/кмоль. Поскольку в одном моле любого вещества содержится одинаковое число структурных единиц, то молярная масса вещества пропорциональная массе соответствующей структурной единицы, т.е. относительной атомной массе данного вещества (Mr):
M = κ × Mr,
где κ – коэффициент пропорциональности, одинаковый для всех веществ. Относительная молекулярная масса – величина безразмерная. Её вычисляют, используя относительные атомные массы химических элементов, указанных в Периодической системе Д.И. Менделеева.
Относительная молекулярная масса – величина безразмерная. Её вычисляют, используя относительные атомные массы химических элементов, указанных в Периодической системе Д.И. Менделеева.
Относительная атомная масса атомарного водорода равна 1,008 а.е.м. Его относительная молекулярная масса будет равна 1,008, а молярная масса:
M(H) = Mr (H) × 1 моль = 1,008 г/моль.
Известно, что молекула водорода двухатомна – H2, тогда, относительная атомная масса молекулы водорода будет равна:
Ar(H2) = 1,008 × 2 = 2,016 а.е.м.
Относительная молекулярная масса молекулы водорода будет равна 2,016, а молярная масса:
M(H) = Mr (H) × 1 моль = 2,016 г/моль или просто 2 г/моль.
Водород представляет собой газ без цвета и запаха (схема строения атома представлена на рис. 1), который при температуре (-240oC) и под давлением способен сжижаться, а при быстром испарении полученной жидкости переходить в твердое состояние (прозрачные кристаллы).
Рис. 1. Строение атома водорода.
Молекулярную массу вещества в газообразном состоянии можно определить, используя понятие о его молярном объеме. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества, а затем вычисляют массу 22,4 л этого вещества при тех же условиях.
Для достижения данной цели (вычисление молярной массы) возможно использование уравнения состояния идеального газа (уравнение Менделеева-Клапейрона):
pV = mRT / M,
где p – давление газа (Па), V – объем газа (м3), m – масса вещества (г), M – молярная масса вещества (г/моль), Т – абсолютная температура (К), R – универсальная газовая постоянная равная 8,314 Дж/(моль×К).
Примеры решения задач
Энтальпия – Химия LibreTexts
Когда процесс происходит при постоянном давлении, выделяемое тепло (выделяемое или поглощаемое) равно изменению энтальпии. Энтальпия (\ (H \)) – это сумма внутренней энергии (\ (U \)) и произведения давления на объем (\ (PV \)), определяемой уравнением:
\ [H = U + PV \]
Когда процесс происходит при постоянном давлении, выделяемое тепло (выделяемое или поглощаемое) равно изменению энтальпии. Энтальпия – это функция состояния, которая полностью зависит от функций состояния \ (T \), \ (P \) и \ (U \).Энтальпия обычно выражается как изменение энтальпии (\ (\ Delta H \)) для процесса между начальным и конечным состояниями:
Энтальпия – это функция состояния, которая полностью зависит от функций состояния \ (T \), \ (P \) и \ (U \).Энтальпия обычно выражается как изменение энтальпии (\ (\ Delta H \)) для процесса между начальным и конечным состояниями:
\ [\ Delta H = ΔU + ΔPV \]
Если температура и давление остаются постоянными в течение всего процесса, а работа ограничивается работой давление-объем, то изменение энтальпии определяется уравнением:
\ [\ Delta H = ΔU + PΔV \]
Также при постоянном давлении тепловой поток (\ (q \)) для процесса равен изменению энтальпии, определяемому уравнением:
\ [\ Delta H = q \]
Посмотрев, является ли q экзотермическим или эндотермическим, мы можем определить взаимосвязь между \ (\ Delta H \) и \ (q \).Если реакция поглощает тепло, она является эндотермической, что означает, что реакция потребляет тепло из окружающей среды, так что \ (q> 0 \) (положительный результат). Следовательно, при постоянных температуре и давлении, согласно приведенному выше уравнению, если q положительно, то \ (\ Delta H \) также положительно. То же самое происходит, если реакция выделяет тепло, то она экзотермична, то есть система отдает тепло своему окружению, поэтому \ (q <0 \) (отрицательно). Если \ (q \) отрицательно, то \ (\ Delta H \) также будет отрицательным.
То же самое происходит, если реакция выделяет тепло, то она экзотермична, то есть система отдает тепло своему окружению, поэтому \ (q <0 \) (отрицательно). Если \ (q \) отрицательно, то \ (\ Delta H \) также будет отрицательным.
Изменение энтальпии, сопровождающее изменение состояния
Когда жидкость испаряется, жидкость должна поглощать тепло из окружающей среды, чтобы заменить энергию, потребляемую испаряющимися молекулами, чтобы температура оставалась постоянной.Это тепло, необходимое для испарения жидкости, называется энтальпией испарения (или теплотой испарения). Например, при испарении одного моля воды энтальпия определяется как:
ΔH = 44,0 кДж при 298 К
Когда твердое тело плавится, требуемая энергия также называется энтальпией плавления (или теплотой плавления). Например, для одного моля льда энтальпия имеет вид:
.ΔH = 6,01 кДж при 273,15 К
\ [\ Delta {H} = \ Delta {U} + p \ Delta {V} \ label {1} \]
Энтальпию можно также выразить как молярную энтальпию, \ (\ Delta {H} _m \), разделив энтальпию или изменение энтальпии на количество молей. Энтальпия – это функция состояния. Это означает, что когда система переходит из одного состояния в другое, изменение энтальпии не зависит от пути между двумя состояниями системы.
Энтальпия – это функция состояния. Это означает, что когда система переходит из одного состояния в другое, изменение энтальпии не зависит от пути между двумя состояниями системы.
Если в системе нет работы, не связанной с расширением, а давление все еще остается постоянным, то изменение энтальпии будет равно количеству тепла, потребляемого или выделяемого системой (q).
\ [\ Delta {H} = q \ label {2} \]
Это соотношение может помочь определить, является ли реакция эндотермической или экзотермической.При постоянном давлении эндотермическая реакция происходит при поглощении тепла. Это означает, что система потребляет тепло из окружающей среды, поэтому \ (q \) больше нуля. Следовательно, согласно второму уравнению, \ (\ Delta {H} \) также будет больше нуля. С другой стороны, экзотермическая реакция при постоянном давлении – это выделение тепла. Это означает, что система отдает тепло в окружающую среду, поэтому \ (q \) меньше нуля. Кроме того, \ (\ Delta {H} \) будет меньше нуля.
Влияние температуры на энтальпию
Когда температура увеличивается, количество молекулярных взаимодействий также увеличивается.Когда количество взаимодействий увеличивается, внутренняя энергия системы возрастает. Согласно первому приведенному уравнению, если внутренняя энергия (\ (U \)) увеличивается, то \ (\ Delta {H} \) увеличивается с ростом температуры. Мы можем использовать уравнение для теплоемкости и уравнение 2, чтобы вывести это соотношение.
\ [C = \ dfrac {q} {\ Delta {T}} \ label {3} \]
При постоянном давлении подставьте уравнение \ ref {2} в уравнение \ ref {3}:
\ [C_p = \ left (\ dfrac {\ Delta {H}} {\ Delta {T}} \ right) _P \ label {4} \]
, где нижний индекс \ (P \) указывает, что производная выполняется при постоянном давлении.о_ {вап}} \]
Энтальпия конденсации обратно энтальпии испарения, а энтальпия замерзания обратно энтальпии плавления. Изменение энтальпии обратного фазового перехода является отрицательным по отношению к изменению энтальпии прямого фазового перехода. Также изменение энтальпии полного процесса представляет собой сумму изменений энтальпии для каждого из фазовых переходов, включенных в процесс.
Также изменение энтальпии полного процесса представляет собой сумму изменений энтальпии для каждого из фазовых переходов, включенных в процесс.
Внешние ссылки
- Канагаратна, Себастьян Г.«Наглядное пособие по расчетам энтальпии» J. Chem. Educ. 2000 77 1178.
- Кеннеди-старший, Элвин П. «Определение энтальпии испарения с использованием микроволновой печи» J. Chem. Educ. 1997 74 1231
- Трептов, Ричард С. «Как термодинамические данные и константы равновесия изменились, когда стандартное давление стало 1 бар» J. Chem. Educ. 1999 76 212.
- Йи, Л., Шэн-Лу, К., Сон-Шэн, Цюй. «Некоторые взгляды на внутреннюю энергию и энтальпию газов». J. Chem. Educ. 1995 : 72, 408.
Список литературы
- Аткинс, Питер и де Паула, Хулио; Физическая химия для наук о жизни, США, 2006 г.
 , Кэтрин Херли,
, Кэтрин Херли, - Петруччи и др. Общие принципы химии и современные приложения. 9 изд. Река Аппер Сэдл, штат Нью-Джерси: Pearson Prentice Hall, 2007
Проблемы
- Вычислите энтальпию (ΔH) процесса, в котором 45.0 граммов воды превращается из жидкости при 10 ° C в пар при 25 ° C.
Раствор
Часть 1: Отопительная вода от 10,0 до 25,0 ° C
ΔkJ = 45,0g h30 x (4,184J / gH 2 O ° C) x (25,0 – 10,0) ° C x 1 кДж / 1000J = 2,82 кДж
Часть 2: испарение воды при 25,0 ° C
ΔkJ = 45,0 г H 2 O x 1 моль H 2 O / 18,02 г H 2 O x 44,0 кДж / 1 моль H 2 O = 110 кДж
Часть 3: Общее изменение энтальпии
ΔH = 2.82 кДж + 110 кДж
Авторы и авторство
- Кэтрин Херли (UCD), Дженнифер Шейми (UCD)
1/4 (h + 8) больше или равно 9
Осенний Т.
2 ответа от опытных преподавателей
К:
1/4 (h + 8) ≥ 9
1 / 4h + 1/4 (8) ≥ 9
1 / 4h + 2 ≥ 9
1/4 h ≥ 9-2
1 / 4h ≥ 7
ч ≥ 7 (4)
ч ≥ 28
Марк М.ответил • 29.03.21
Учитель математики – Высшая квалификация NCLB
(1/4) (h + 8) ≥ 9
Что-нибудь еще?
Все еще ищете помощь? Получите правильный ответ быстро.

ИЛИ
Найдите онлайн-репетитора сейчасВыберите эксперта и познакомьтесь онлайн.Никаких пакетов или подписок, платите только за необходимое время.
¢ € £ ¥ ‰ µ · • § ¶ SS ‹ › « » < > ≤ ≥ – – ¯ ‾ ¤ ¦ ¨ ¡ ¿ ˆ ˜ ° – ± ÷ ⁄ × ƒ ∫ ∑ ∞ √ ∼ ≅ ≈ ≠ ≡ ∈ ∉ ∋ ∏ ∧ ∨ ¬ ∩ ∪ ∂ ∀ ∃ ∅ ∇ * ∝ ∠ ´ ¸ ª º † ‡ А Á Â Ã Ä Å Æ Ç È É Ê Ë Я Я Я Я Ð Ñ Ò Ó Ô Õ Ö Ø Œ Š Ù Ú Û Ü Ý Ÿ Þ à á â ã ä å æ ç è é ê ë я я я я ð ñ ò ó ô х ö ø œ š ù ú û ü ý þ ÿ Α Β Γ Δ Ε Ζ Η Θ Ι Κ Λ Μ Ν Ξ Ο Π Ρ Σ Τ Υ Φ Χ Ψ Ω α β γ δ ε ζ η θ ι κ λ μ ν ξ ο π ρ ς σ τ υ φ χ ψ ω ℵ ϖ ℜ ϒ ℘ ℑ ← ↑ → ↓ ↔ ↵ ⇐ ⇑ ⇒ ⇓ ⇔ ∴ ⊂ ⊃ ⊄ ⊆ ⊇ ⊕ ⊗ ⊥ ⋅ ⌈ ⌉ ⌊ ⌋ 〈 〉 ◊
Решите h / 3 = -12 Tiger Algebra Solver
Переставьте:
Переставьте уравнение, вычтя то, что находится справа от знака равенства из обеих частей уравнения:
h / 3 – (- 12) = 0
Пошаговое решение:
Шаг 1:
ч
Упростить -
3
Уравнение в конце шага 1:
ч - - -12 = 0 3
Шаг 2:
Переписывание целого как эквивалентной дроби:
2. 1 Вычитание целого из дроби
1 Вычитание целого из дроби
Перепишем целое как дробь, используя 3 в знаменателе:
-12-12 • 3
-12 = ——— = ———————
1 3
Эквивалентная дробь: Полученная таким образом дробь выглядит иначе, но имеет то же значение, что и целое
Общий знаменатель: Эквивалентная дробь и другая дробь, участвующие в вычислении, имеют один и тот же знаменатель
Сложение дробей, имеющих общий знаменатель:
2.2 Сложение двух эквивалентных дробей
Сложите две эквивалентные дроби, которые теперь имеют общий знаменатель
Объедините числители, сложите сумму или разность над общим знаменателем, затем уменьшите до наименьших членов, если возможно:
ч - (-12 • 3) ч + 36
знак равно
3 3
Уравнение в конце шага 2:
h + 36
—————— = 0
3
Шаг 3:
Когда дробь равна нулю:
3.1 Когда дробь равна нулю ...
Если дробь равна нулю, ее числитель, часть, которая находится над чертой дроби, должен быть равен нулю.
Теперь, чтобы избавиться от знаменателя, Тигр умножает обе части уравнения на знаменатель.
Вот как:
h + 36 ———— • 3 = 0 • 3 3
Теперь, в левой части, 3 отменяет знаменатель, в то время как в правой части ноль, умноженный на что-либо, по-прежнему равно нулю.
Уравнение теперь принимает форму:
h + 36 = 0
Решение уравнения с одной переменной:
3.2 Решите: h + 36 = 0
Вычтем 36 из обеих частей уравнения:
h = -36
Было найдено одно решение:
h = -36Удельная теплоемкость
Термодинамика – это раздел физики который имеет дело с энергией и работой системы. Термодинамика занимается только крупномасштабный ответ системы, которую мы можем наблюдайте и измеряйте в экспериментах. В аэродинамике мы больше всех интересуется термодинамикой из-за той роли, которую она играет в конструкция двигателя а также высокоскоростной полет.
На этом слайде мы выводим некоторые уравнения, которые связывают теплоемкость газа к газовой постоянной, используемой в
уравнение состояния. Мы собираемся использовать специальный значения переменных состояния.
Для ученого “конкретная” переменная состояния означает значение переменной.
делится на массу вещества. Это позволяет нам вывести отношения между
переменные без учета количества имеющегося у нас вещества. Мы можем
умножьте конкретную переменную на количество вещества в любое время
для определения фактического значения переменной расхода.Из наших исследований
теплопередача,
мы знаем, что количество тепла, передаваемого между двумя объектами, равно
пропорционально
температура
разница между объектами и
теплоемкость объектов.
Тепловая мощность – это
константа, показывающая, сколько тепла добавляется на единицу повышения температуры.
Значение константы различно для разных материалов и зависит от
о процессе. Теплоемкость не является переменной состояния .
Мы собираемся использовать специальный значения переменных состояния.
Для ученого “конкретная” переменная состояния означает значение переменной.
делится на массу вещества. Это позволяет нам вывести отношения между
переменные без учета количества имеющегося у нас вещества. Мы можем
умножьте конкретную переменную на количество вещества в любое время
для определения фактического значения переменной расхода.Из наших исследований
теплопередача,
мы знаем, что количество тепла, передаваемого между двумя объектами, равно
пропорционально
температура
разница между объектами и
теплоемкость объектов.
Тепловая мощность – это
константа, показывающая, сколько тепла добавляется на единицу повышения температуры.
Значение константы различно для разных материалов и зависит от
о процессе. Теплоемкость не является переменной состояния .
Если мы имеем дело с газом, удобнее всего использовать формы уравнения термодинамики на основе энтальпия газа.Из определения энтальпии:
ч = е + р * v
где удельная энтальпия h , p давление, v – это
удельный объем,
и e – конкретный
внутренняя энергия. Во время процесса значения этих переменных изменяются. Обозначим
изменение на греческую букву дельта , которая выглядит как треугольник.
Таким образом, «дельта h» означает изменение «h» из состояния 1 в состояние 2 во время процесса.
Затем для процесса с постоянным давлением уравнение энтальпии принимает следующий вид:
Во время процесса значения этих переменных изменяются. Обозначим
изменение на греческую букву дельта , которая выглядит как треугольник.
Таким образом, «дельта h» означает изменение «h» из состояния 1 в состояние 2 во время процесса.
Затем для процесса с постоянным давлением уравнение энтальпии принимает следующий вид:
дельта h = дельта е + р * дельта v
Энтальпия, внутренняя энергия и объем изменяются, но давление остается прежним.Из нашего вывода уравнение энтальпии, изменение удельной энтальпии равно теплоотдаче для процесса постоянного давления:
дельта h = cp * дельта T
где дельта T – это изменение температуры газа во время процесса, а c – удельная теплоемкость. Мы добавили индекс «p» к удельной теплоемкости, чтобы напомнить нам, что это значение относится только к процессу с постоянным давлением.
Уравнение состояния газа связывает температуру,
давление и объем через газовую постоянную R . Газовая постоянная, используемая
аэродинамики выводится из универсальной газовой постоянной, но имеет уникальное значение
на каждый газ.
Газовая постоянная, используемая
аэродинамики выводится из универсальной газовой постоянной, но имеет уникальное значение
на каждый газ.
р * v = R * T
Если у нас процесс постоянного давления, то:
p * дельта v = R * дельта T
Теперь представим, что у нас есть процесс с постоянным объемом с нашим газом, который производит точно такое же изменение температуры, что и процесс постоянного давления, который мы обсуждали. Тогда Первый закон термодинамики говорит нам:
дельта е = дельта q – дельта w
где q – удельная теплоотдача, а w – работа, выполняемая газ.Для процесса с постоянным объемом Работа равно нулю. И мы можем выразить теплопередача как постоянная величина, умноженная на изменение температуры. Это дает:
дельта е = cv * дельта Т
где дельта T – это изменение температуры газа во время процесса, а c – удельная теплоемкость.
Мы добавили индекс «v» к удельной теплоемкости, чтобы напомнить нам, что это значение
применимо только к процессу с постоянным объемом. Несмотря на то, что изменение температуры одинаково для этого процесса и постоянная
давления процесса, значение удельной теплоемкости другое.
Несмотря на то, что изменение температуры одинаково для этого процесса и постоянная
давления процесса, значение удельной теплоемкости другое.
Поскольку мы выбрали процесс постоянного объема, чтобы дать такое же изменение в температура в качестве нашего процесса постоянного давления, мы можем заменить выражение приведено выше для «дельта е» в уравнении энтальпии. В общем, нельзя сделайте эту замену, потому что процесс с постоянным давлением и процесс с постоянным объемом производить различные изменения температуры Если мы подставим выражения для «дельта е», «р * дельта v» и «дельта h» в уравнение энтальпии получим:
cp * дельта T = cv * дельта T + R * дельта T
деление на «дельту Т» дает соотношение:
cp = cv + R
Константы теплоемкости для процессов с постоянным давлением и постоянным объемом
связаны с газовой постоянной для данного газа.Этот довольно замечательный результат
был получен из термодинамических соотношений, которые основаны на наблюдениях
физических систем и процессов. С помощью
кинетическая теория
газов, тот же результат может быть получен
из соображений сохранения энергии на молекулярном уровне.
С помощью
кинетическая теория
газов, тот же результат может быть получен
из соображений сохранения энергии на молекулярном уровне.
Мы можем определить дополнительные переменная, называемая удельной теплоемкостью соотношение, что дано греческому символ «гамма», который равен cp, деленному на cv:
гамма = cp / cv
«Гамма» – это просто число, значение которого зависит от состояния газа.Для воздуха, гамма = 1,4 для стандартных дневных условий. «Гамма» появляется во многих уравнениях жидкостей. включая уравнение, связывающее давление, температуру и объем во время простое сжатие или расширение процесса, уравнение для скорость звука, и все уравнения для изэнтропические потоки, а также ударные волны. Потому что ценность «гамма» просто зависит от состояния газа, есть таблицы этих значений для данных газов. Таблицы можно использовать для решения задач газовой динамики.
Действия:
Экскурсии с гидом
Навигация. .
.
- Руководство для начинающих Домашняя страница
Пусть f (x) = -3x – 4. Если h не равно 0, то коэффициент разности можно упростить как frac {f (x + h) – f (x)} {h} = Ah + Bx + C, где A, B и C – константы. Найдите константы. Используйте упрощенное выражение, чтобы найти f ‘(x) = lim_ {h to 0} frac {f (
Вопрос:
Пусть {eq} f (x) = -3x – 4. {/ eq} Если {eq} h \ neq 0 {/ eq}, то коэффициент разности можно упростить как
{eq} \ frac {f (x + h) – f (x)} {h} = Ah + Bx + C, {/ eq}
где {eq} A, B, {/ eq} и {eq} C {/ eq} – константы.
Найдите константы.
{экв} A = \\ B = \\ C = {/ eq}
Используйте упрощенное выражение, чтобы найти
{eq} f ‘(x) = \ lim_ {h \ to 0} \ frac {f (x + h) – f (x)} {h} = {/ eq}
Наконец, найдите каждое из следующего:
{eq} f ‘(1) = \\ f’ (2) = \\ f ‘(3) = {/ eq}
Производная:
Производная функции – это еще одна функция, которая сообщает нам скорость изменения исходной функции в каждом {eq} x {/ eq} значение. Другими словами, производная сообщает нам наклон прямой, касательной к графику функции в каждой точке. Мы можем разработать формальное определение производной, исходя из известной формулы наклона. Рассмотрим две точки на графике функции {eq} f (x) {/ экв}. Назовем эти точки {eq} (x, \: f (x)) {/ eq} и {eq} (x + h, \: f (x + h)) {/ экв}. А теперь представьте, что эти точки соединяются прямой линией. У него будет следующий наклон:
Другими словами, производная сообщает нам наклон прямой, касательной к графику функции в каждой точке. Мы можем разработать формальное определение производной, исходя из известной формулы наклона. Рассмотрим две точки на графике функции {eq} f (x) {/ экв}. Назовем эти точки {eq} (x, \: f (x)) {/ eq} и {eq} (x + h, \: f (x + h)) {/ экв}. А теперь представьте, что эти точки соединяются прямой линией. У него будет следующий наклон:
$$ \ dfrac {f (x + h) -f (x)} {(x + h) -x} \\ \: \\ \ dfrac {f (x + h) -f (x)} {h} $$
Теперь, если нам нужен наклон линии, касательной к графику в определенной точке, мы можем представить, как перемещаем нашу вторую точку все ближе и ближе к первой точке.В пределе, когда {eq} h {/ eq} приближается к нулю, две точки фактически находятся друг над другом, и наша линия должна быть касательной в этой точке. Таким образом, наклон нашей касательной линии определяется следующим образом:
$$ \ lim_ {h \ rightarrow 0} \ dfrac {f (x + h) -f (x)} {h} $$
Это формальное определение производной функции. Его можно применить к любой функции.
Его можно применить к любой функции.
Ответ и объяснение:
Мы можем найти константы, просто подставив нашу функцию в коэффициент разности.
$$ \ dfrac {(- 3 (x + h) -4) – (- 3x-4)} {h} = Ah + Bx + C \\ \: \\ \ dfrac {-3 …
См. Полный ответ ниже.
Чему равно H? – MVOrganizing
Что такое H?
Постоянная Планка, обозначаемая символом h, связывает энергию одного кванта (фотона) электромагнитного излучения с частотой этого излучения. В Международной системе единиц (СИ) постоянная равна примерно 6,626176 x 10-34 джоуль-секунды.
Что такое физика единиц K?
k – это постоянная, называемая жесткостью или жесткостью пружины (в единицах СИ: Н / м или кг / с2).
Что такое тепловая единица?
Джоуль
Почему Q используется для обогрева?
Использование символа Q для обозначения общего количества энергии, переданной в виде тепла, было принято Рудольфом Клаузиусом в 1850 году: «Пусть количество тепла, которое должно быть передано во время перехода газа определенным образом из одного данного состояния в другое, в котором его объем равен v, а температура t, назовем Q ».
Что больше CP или CV?
сП больше, чем CV, потому что, когда газ нагревается при постоянном объеме, все подводимое тепло используется только для повышения температуры. Но когда газ нагревается при постоянном давлении, подводимое тепло используется для увеличения как температуры, так и объема газа.
Как называется CP CV?
Отношение Cp / Cv также называется отношением теплоемкости. В термодинамике коэффициент теплоемкости известен как показатель адиабаты.
Что такое CV для идеального газа?
Молярная удельная теплоемкость газа при постоянном объеме (Cv) – это количество тепла, необходимое для повышения температуры 1 моля газа на 1 ° C при постоянном объеме.Его значение для одноатомного идеального газа составляет 3R / 2, а значение для двухатомного идеального газа – 5R / 2.
Всегда ли CP CV r?
CP – CV для идеального газа R.
Какое значение CV для трехатомного газа?
Сохраняются три типа степеней свободы: поступательная, вращательная и колебательная. Это отношение γ = 1,66 для идеального одноатомного газа и γ = 1,4 для воздуха, который преимущественно называют двухатомным газом.
Это отношение γ = 1,66 для идеального одноатомного газа и γ = 1,4 для воздуха, который преимущественно называют двухатомным газом.
Какое значение CV в термодинамике?
Теплоемкость при постоянном объеме, Cv, является производной внутренней энергии по температуре, поэтому для нашего одноатомного газа Cv = 3/2 R.Теплоемкость при постоянном давлении может быть оценена, поскольку разница между молярными Cp и Cv равна R; Cp – Cv = R.
Как рассчитать гамму газа?
Отношение удельных теплоемкостей γ = CP / CV является фактором в адиабатических процессах двигателя и при определении скорости звука в газе. Это отношение γ = 1,66 для идеального одноатомного газа и γ = 1,4 для воздуха, который является преимущественно двухатомным газом.
Воздух двухатомный или одноатомный?
Характеристики воздуха Отдельные атомы могут объединяться с другими атомами в молекулы.В частности, кислород и азот, которые являются основными компонентами воздуха, встречаются в природе в виде двухатомных (2 атомных) молекул.
Углерод – одноатомный элемент?
Одноатомный – состоит из 1 атома, например He, Ne, Ar (все благородные газы одноатомные) Двухатомный – состоит из 2 атомов, например. h3, N2, O… .Примеры.
| Атомный номер | Элемент | Атомарность |
|---|---|---|
| 6 | Углерод | 1 |
| 7 | Азот | 2 |
| 8 | Кислород | 2 |
| 9 | Фтор | 2 |
Горит ли одноатомный газ на воздухе?
Одноатомный – это комбинация двух слов «моно» и «атомный», означающих один атом.Благородные газы представляют собой одноатомные газы, поскольку они неактивны по своей природе, что является свойством этих газов. Они находят применение в повседневной жизни, например: гелий используется для наполнения воздушных шаров, поскольку их плотность ниже, чем у воздуха.
Является ли метан одноатомным?
для моля идеального одноатомного газа. для моля идеального двухатомного газа. для моля идеального многоатомного газа….
для моля идеального двухатомного газа. для моля идеального многоатомного газа….
| Молекула | Cv | CP |
|---|---|---|
| Двухатомный | ||
| Многоатомный | 3R | 4R |
Что такое одноатомный элемент?
Одноатомные или одноатомные элементы – это элементы, которые стабильны как отдельные атомы.Mon- или Mono- означает один. Чтобы элемент был стабильным сам по себе, он должен иметь стабильный октет валентных электронов.
Что такое многоатомные элементы?
Многоатомный: – Элементы, которые имеют более двух атомов, связанных ковалентной связью, называются многоатомными элементами.
Что такое многоатомная молекула?
определение. В молекуле. … Чем два атома называются многоатомными молекулами, например, двуокись углерода (CO2) и вода (h3O). Молекулы полимера могут содержать многие тысячи составляющих атомов.
Почему сера называется многоатомной?
Термин “многоатомный” используется для обозначения молекулы или иона, которые содержат два или более двух атомов. Сера называется многоатомной, потому что каждая молекула серы состоит из 8 атомов серы. Таким образом, молекула серы обозначается S8.
Сера называется многоатомной, потому что каждая молекула серы состоит из 8 атомов серы. Таким образом, молекула серы обозначается S8.
Какой пример многоатомного элемента?
Любая молекула, содержащая более двух атомов, является многоатомной. Таким образом, это озон (O3) и т. Д. Все, что состоит из двух или более атомов, называется молекулярным, например кислород (O2), азот (N2), озон (O3), диоксид углерода (CO2), метан (Ch5). , бензол (C6H6) и намного больше, например ротаксан, белки или полимеры.
Тепло и энтальпия
В химии мы хотели бы количественно определить количество изменений энергии, связанных с физическими и химическими изменениями. Это было бы просто, если бы
мы могли просто измерить тепло и работу, связанную с любым изменением. Тем не менее, труд часто бывает трудно определить количественно. С другой стороны, тепло
довольно просто измерить. Более того, как мы увидим, когда рассмотрим второй закон термодинамики, тепловой поток связан с изменением энтропии процесса. В результате нас очень интересует тепловой поток, связанный с химическими изменениями.
В результате нас очень интересует тепловой поток, связанный с химическими изменениями.
В лаборатории количественно определить тепловой поток несложно. Было бы неплохо, если бы была функция состояния изменение которого напрямую связано с количеством тепла, протекающего в данном процессе. Оказывается, мы можем изобрести один: энтлапи . Энтальпия обозначается символом H. В химии лучший способ думать об энтальпии – это то, что она почти эквивалентна «энергии» системы.Наиболее важно то, что изменение энтальпии для процесса при постоянном давлении точно равно теплу, которое течет между системой и окружающей средой для этого процесса. Таким образом, если мы можем количественно оценить тепловой поток при постоянном давлении, мы можем измерить изменение энтальпии системы.
Энтальпия
Поскольку тепло и работа не являются функциями состояния, мы не можем просто приравнять их по отдельности к изменениям в функциях состояния. Однако при определенных условиях это возможно.
Например, если мы работаем в условиях постоянного объема, то работа PV равна нулю. В этом случае изменение внутренней энергии просто равно тепловому потоку.
\ [q_v = \ Delta U \]
Обозначим условия постоянного объема индексом v.
Однако в химии мы почти всегда работаем в условиях постоянного давления, а не постоянного объема. Нам нужна новая функция состояния, равная тепловому потоку при постоянном давлении.Итак, мы изобрели один и назвали его энтальпией , , H
.Тепло при постоянном давлении дает
\ [q_p = \ Delta U – w = \ Delta U + P \ Delta V \]
\ [q_p = (U_f – U_i) + P (V_f – V_i) = (U_f + PV_f) – (U_i + PV_i) \]
Следовательно, если мы определим новую функцию состояния, H, которая определяется как\ [H = U + PV \]
В итоге получаем хорошее соотношение: тепловой поток при постоянном давлении равен \ (\ Delta H \)\ [q_p = H_f – H_i = \ Delta H \]
Итак, энтальпия – это не что иное, как изобретение новой энергии, эквивалентной тепловому потоку, измеренному при постоянном давлении. Если изменение происходит не при постоянном давлении, тогда энтальпия имеет значение, но не равно тепловому потоку.
Если изменение происходит не при постоянном давлении, тогда энтальпия имеет значение, но не равно тепловому потоку.
Есть два других важных химических термина, которые мы связываем с изменением энтальпии. Когда процесс снижает энтальпию системы, \ (\ Delta H экзотермический. Для экзотермического процесса при постоянном давлении энергия течет из системы в окружающую среду в виде тепла. Сжигание – это экзотермический процесс, который мы все знакомы с. Когда процесс увеличивает энтальпию системы, \ (\ Delta H> 0 \), мы называем этот процесс эндотермическим .Таяние льда – эндотермический процесс. Энергия поглощается системой в виде теплового потока, который приводит к превращению твердого вещества в жидкость.
Объяснение энтальпии
Кривые нагрева
Давайте рассмотрим изменения тепла и энтальпии для системы, претерпевающей физические изменения.
Хороший пример, который знаком большинству людей, – это нагрев воды. Если мы возьмем стакан, наполненный льдом (твердая вода), и поставим его на горячую плиту с температурой 120 ° C, мы все знаем, что произойдет.Сначала лед растает до жидкой воды. Тогда температура воды повысится. Тогда, наконец, вода закипит. В течение всего этого процесса температура температура плиты будет выше, чем температура стакана с водой. Таким образом, в течение всего этого процесса энергия в виде тепла будет перетекать от горячей плиты в воду. Скорее всего, мы бы описали воду как систему, а горячую плиту – как окружающую среду с постоянной температурой.
Для этого процесса нас интересует количество тепла, поступающего из окружающей среды в систему.Помните, что жара может быть сложной задачей. Когда нет химии или фазовых переходов, тогда энергия, поступающая в систему в виде тепла, приведет к изменению температуры. Однако, когда есть химия или фазовый переход, тогда будет поступать энергия, а температура может оставаться постоянной. Почему не поднимается температура? Поступающая энергия приводит к более высокой потенциальной энергии, а не к более высокой кинетической энергии. Нарушение IMF между молекулами приводит к высокой потенциальной энергии.
Это легко увидеть на кривой нагрева, которая отображает температуру системы как функцию теплового потока в систему.Первоначально система представляет собой твердое тело, затем она имеет переход плавления, затем жидкость, затем переход к испарению, а затем – газ.
На приведенной ниже диаграмме показана кривая нагрева воды. Температура системы отображается как функция времени. Тепло течет с постоянной скоростью, поэтому время можно интерпретировать как тепло.
Изначально в системе используется твердая вода с температурой -20 ° C. По мере поступления тепла температура льда увеличивается.Наклон этой линии – теплоемкость твердой воды. Поскольку он находится при постоянном давлении, то \ (q = \ Delta H = mC \ Delta T \), где q – тепло, m – масса, C – удельная теплоемкость, а \ (\ Delta T \) – изменение температура. Поскольку этот график представляет собой график зависимости T от q, наклон фактически равен 1 / мкКл.
Далее твердая фаза плавится. В это время поддерживается постоянная температура 0 ° C. Тепло поступает в систему, но температура не меняется. В начале этого перехода вся вода твердая.По мере поступления тепла в систему твердое вещество начинает плавиться в жидкость, но температура остается постоянной. Это потому, что энергия который поступает в систему, поскольку тепло переходит в потенциальную энергию преодоления межмолекулярных сил, удерживающих воду в твердой решетке. Длина линии при 0 ° C – это количество тепла, необходимое для плавления всего твердого вещества в жидкость. Это тепло называется энтальпией плавления. Фьюжн – это научный термин, обозначающий плавление. Вы могли бы назвать это энтальпией плавления, но вместо этого она называется энтальпией плавления.Энтальпия плавления обозначается как \ (\ Delta H_ {fusion} \) и обычно выражается в кДж / моль -1 . Таким образом, фактическая длина линии будет \ ({n \ times \ Delta H_ {fus}} \), поскольку вам нужно умножить на количество молей твердого тела, чтобы получить общую теплоту фазового перехода.
После того, как все твердое вещество превратилось в жидкость, температура повышается с увеличением теплового потока. Наклон этой линии снова связан с теплоемкостью. Однако на этот раз это теплоемкость жидкости.Как только температура достигает точки кипения 100 ° C, температура снова остается постоянной, так как жидкость переведен на газ. Тепло, необходимое для преобразования всей жидкости в газ, называется энтальпией испарения, \ (\ Delta H_ {парообразование} \). Вы можете увидеть тепло для испарения воды требуется значительно больше тепла, чем для таяния воды. Это верно для большинства веществ. Слияние включает в себя простое разделение МВФ, чтобы позволить поступательное движение молекул; испарение требует по существу полного преодоления IMF, чтобы вывести молекулы из конденсированной фазы.Как только вся жидкость превращается в газ, температура увеличивается с наклоном, связанным с теплоемкостью газа.
Кривая нагрева воды – рабочий пример
Энтальпия изменения фазы
Энтальпия, связанная с любым фазовым переходом, может быть количественно определена экспериментально и сведена в таблицу. Каждому конкретному фазовому переходу соответствует тепло и определенное название.
Например, изменение энтальпии плавления определяется как изменение энтальпии при переходе от твердого вещества к жидкости при температуре плавления.{\ circ} C) \]
Процесс перехода от твердого тела к жидкости называется «плавлением». Энтальпия этого изменения равна \ (\ Delta H_ {fusion} \). Это изменение энтальпии,
\ [\ Delta H_ {сплав} = H_f – H_i = H_ {жидкость} – H_ {твердое тело} \]
Из-за этого энтальпия для противоположного процесса, замораживания, будет точно равна, но с противоположным знаком.
\ [\ Delta H_ {замерзание} = H_ {твердое тело} – H_ {жидкость} = – \ Delta H_ {fusion} \].
Это означает, что в таблицу всегда включается только одно значение.Обычно это эндотермический процесс. Таким образом, для твердого вещества / жидкости значение плавления сведено в таблицу. Для жидкостей / газов вы будете найти табличные данные для \ (\ Delta H_ {парообразование} \). Опять же для процесса противостояния (газ жидкости) энтальпия равна по противоположному знаку.
\ [\ Delta H_ {парообразование} = – \ Delta H_ {конденсация} \]
.То же самое следует и для фазовых переходов твердое тело / газ при сублимации (твердое тело в газ) и осаждении (газ в твердое тело).
\ [\ Delta H_ {сублимация} = – \ Delta H_ {отложение} \]
.Энтальпия плавления – рабочий пример
Энтальпия реакции
Для химической реакции мы часто смотрим, сколько тепла связано с этим конкретным химическим изменением. \ circ \).Он имеет единицы энергии на моль реакции (rxn). Реакция на моль относится к сбалансированному уравнению. Для данной реакции 1 моль rxn будет таким же, как 1 моль прореагировавшего CH 4 (г), или 2 моля прореагировавшего O 2 (г), или образовавшегося 1 моль CO 2 , или 2 моля H 2 O. Поскольку количество молей каждого реагента и продукта связано сбалансированными уравнениями, знать, что происходит с одним из них, то же самое, что знать их все. Мы сворачиваем эту концепцию в одну идею, которая называется «кротовой реакцией».\ circ \]
, где n – количество «молей реакции». Для приведенного выше примера, если бы я прореагировал 1 моль O 2 , это было бы только 0,5 «мольной реакции», так как мне нужно 2 моля O 2 в сбалансированном уравнении.
Изменение энтальпии с химическим изменением
Реакция с участием газов
Хотя химики обычно интересуются изменениями энтальпии, бывают моменты, когда мы хотели бы вместо этого посмотреть на изменение внутренней энергии.В большинстве случаев эти двое практически равны. Это связано с тем, что большинство химических изменений подразумевают минимальную передачу энергии в виде работы. Это не относится к химическим реакциям, в которых участвуют молекулы газа, где часто происходит изменение объема при постоянном давлении.
Чтобы связать \ (\ Delta H \) и \ (\ Delta U \) для таких реакций, нам нужно подумать о тепле и работе при постоянном давлении.
\ [\ Delta U = q + w \]
Это первый закон термодинамики.При постоянном давлении \ (q = \ Delta H \) и \ (w = -P \ Delta V \). Взяв эти два, мы видим, что
\ [\ Delta U = \ Delta H – P \ Delta V \]
Если мы смотрим на реакцию при постоянной температуре и постоянном давлении, единственный способ изменить объем – это изменить количество молей газа (при условии, что у нас есть идеальные газы). Таким образом, мы можем переписать срок работы как
\ [w = -P \ Delta V = – \ Delta n_ {gas} RT \]
Итак, работу можно найти по изменению количества молей газа, \ (\ Delta n_ {gas} = n _ {\ rm {gas \; final}} – n _ {\ rm {gas \; initial}} \).

 То есть, по сути, данный показатель отражает среднее число цитирований одной статьи в журнале. Например, при расчете пятилетнего импакт-фактора за 2013 год суммарное число ссылок, сделанных в 2013 году на статьи, опубликованные в журнале в период с 2008 по 2012 год включительно, делится на общее число статей, опубликованных в выпусках журнала за 2008-2011 годы.
То есть, по сути, данный показатель отражает среднее число цитирований одной статьи в журнале. Например, при расчете пятилетнего импакт-фактора за 2013 год суммарное число ссылок, сделанных в 2013 году на статьи, опубликованные в журнале в период с 2008 по 2012 год включительно, делится на общее число статей, опубликованных в выпусках журнала за 2008-2011 годы. Это означает, что для расчета двухлетнего импакт-фактора журнал должен выходить как минимум 2 года, а для расчета пятилетнего – 3 года.
Это означает, что для расчета двухлетнего импакт-фактора журнал должен выходить как минимум 2 года, а для расчета пятилетнего – 3 года. Для журналов, у которых только часть статей попадает в составной переводной журнал, учитываются все ссылки на русскую версию, а также ссылки на отдельные статьи, включенные в английскую версию.
Для журналов, у которых только часть статей попадает в составной переводной журнал, учитываются все ссылки на русскую версию, а также ссылки на отдельные статьи, включенные в английскую версию.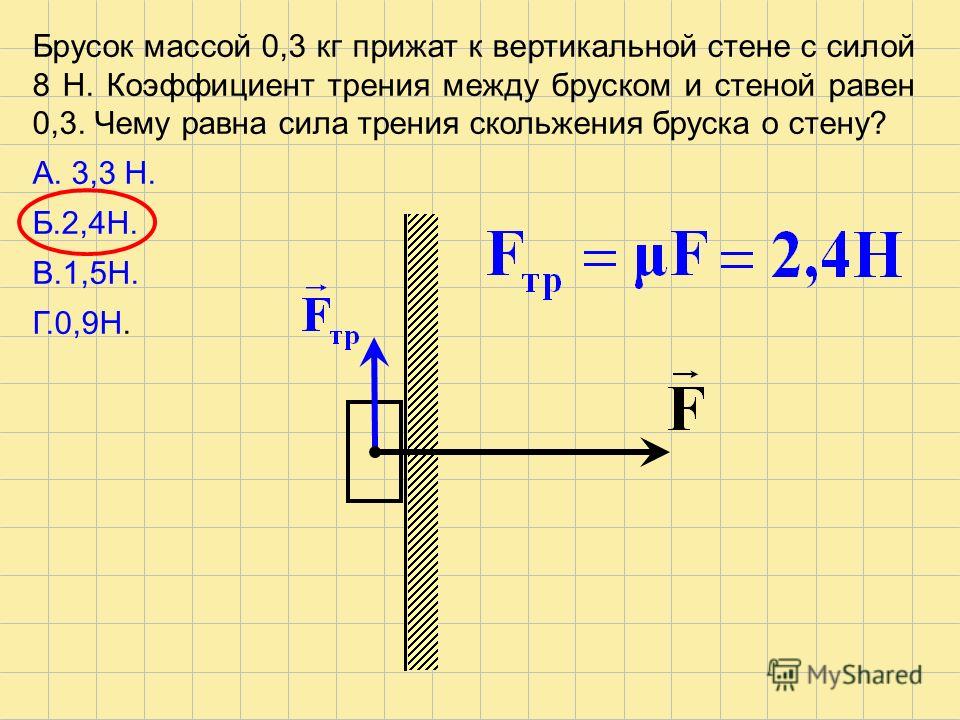


 Чтобы закрыть все окна приложения, нажмите клавиши Option-Command-W.
Чтобы закрыть все окна приложения, нажмите клавиши Option-Command-W.





 Добавление клавиши Control к этому сочетанию клавиш позволяет регулировать яркость внешнего дисплея (если поддерживается дисплеем).
Добавление клавиши Control к этому сочетанию клавиш позволяет регулировать яркость внешнего дисплея (если поддерживается дисплеем).







 , Кэтрин Херли,
, Кэтрин Херли,