Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: h3, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: h3O, Nh4, OF2, h3SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С – алмаз, графит, карбин, фуллерен.
- O – кислород, озон.
- S – ромбическая, моноклинная, пластическая.
- P – белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).

Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Bh4 — боран
B2H6 — диборан
Ch5 — метан
Sih5 — силан
Nh4 — аммиак
Ph4 — фосфин
Ash4 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — h3SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — h3CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония Nh5+
Пример
NaOH, Nh5OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
h3SO4, HNO3, h3Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или Nh5+) и кислотных остатков.
Общая формула солей: MexAcy
- Me – металл
- Ac – кислотный остаток
Пример
KNO3 — нитрат калия
(Nh5)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | h3S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | h3SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | h3SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | h3CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | h3SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | h4PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
Школьный этап ВсОШ 2022/23, Химия 7-8 класс, 4 группа 07.10.2022
Автор PANDAEXAM На чтение 6 мин Просмотров 429 Опубликовано
Задания и ответы школьного этапа 2022 всероссийской олимпиады школьников ВСОШ по Химии 7−11 классов на платформе «Сириус Курсы» пройдет 4-7 октября согласно графику проведения.
ПОДПИШИСЬ НА ТЕЛЕГРАМ ОТВЕТЫ и ЗАДАНИЯ 2022-2023 гг. на олимпиаду СИРИУС, ВСОШ
1. Альфред составил кроссворд из названий элементов‑неметаллов, оставив в качестве подсказки несколько букв.
В кроссворде Альфред зашифровал свою фамилию. Запишите её.
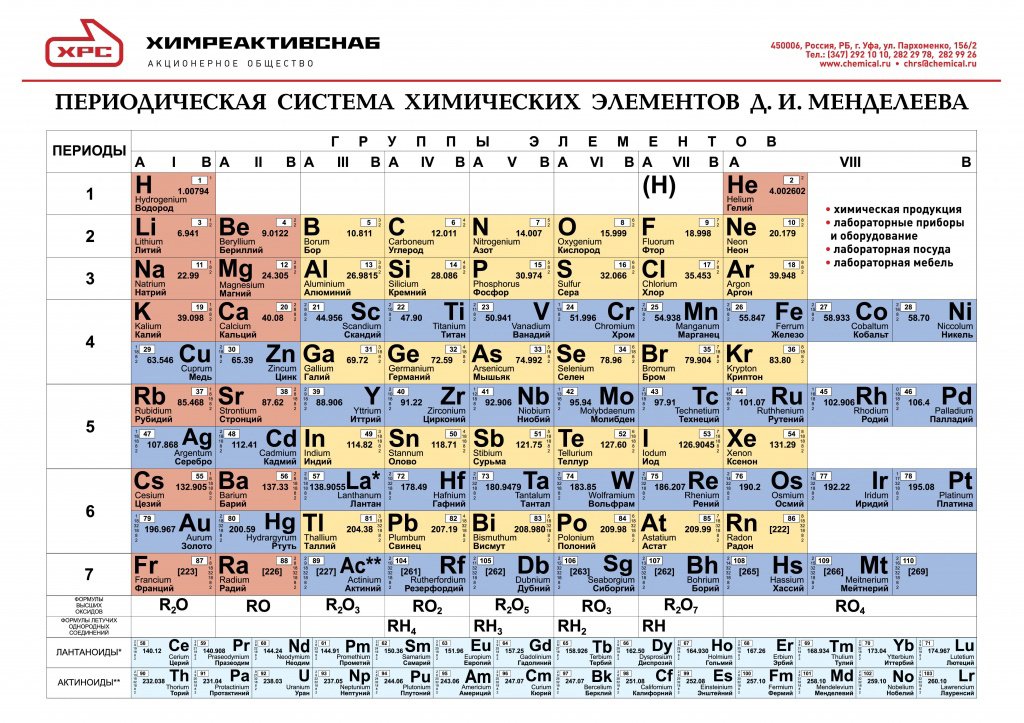
Открыл периодическую систему химических элементов
Обнаружил крупнейшую черную дыру
Открыл радиоактивность
Учредил премии за достижения в науке и культуре
2. Если вам вдруг приснится таблица Менделеева, сразу не просыпайтесь… а вдруг выучите.Старый анекдот
Соотнесите изображённые предметы с формулами веществ, из которых они состоят.
C
NaCl
Al
SiO2
Cu
h3O
3. Не столь прекрасно знать латынь, сколь постыдно её не знать.Марк Тулий Цицерон
По древней традиции все химические элементы получали свои названия на латинском языке. Сопоставьте русские названия элементов с их латинскими корнями.
Водород
Бром
Азот
Сера
Алюминий
Золото
Aluminium
Bromum
Hydrogenium
Aurum
Sulfur
Nitrogenium
4. Теперь вы видите, что ничего не видно.А почему ничего не видно, вы сейчас увидите.
Теперь вы видите, что ничего не видно.А почему ничего не видно, вы сейчас увидите.
Эрнест Резерфорд
Однажды Лжец пришёл к Правдолюбу попросить немного вещества, которое у него закончилось. Лжецописал это вещество так:
твёрдое; без запаха; окрашено; в составе формулы вещества содержится элемент‑металл.
Зная, что Лжец всегда врёт, определите, что за вещество он описывает:
Дистиллированная вода
Марганцовка
Медный купорос
Столовый уксус
Поваренная соль
Глицерин
Углекислый газ
Сода
Как вы думаете, зачем Лжецу понадобилось это вещество?
Для обработки раны
Для приготовления мыла
Для надувания воздушного шара
Для приготовления торта
Для удобрения цветка
Для использования в аромалампе
Для смазки дверных петель
ПОДПИШИСЬ НА ТЕЛЕГРАМ ОТВЕТЫ и ЗАДАНИЯ 2022-2023 гг. на олимпиаду СИРИУС, ВСОШ
5. Студент на лабораторной по химии:
— Ой, а я не знал, что никель тоже железо!
Старый анекдот
Как и в анекдоте, в повседневной жизни часто происходит путаница основных химических определений. Попробуйте в ней разобраться.
Попробуйте в ней разобраться.
Какие нижеперечисленные слова могут обозначать название вещества,
но не являются названием элемента?
Железо
Вода
Кислород
Ацетон
Цинк
Озон
Углекислый газ
Выберите изображения, на которых представлены вещества, а не элементы.
6. Перед вами структурная формула вещества, известного как кофеин:
Зная, что валентность является мерой способности атома соединяться с другими атомами, определите валентность элементов в кофеине.
Азот N
Водород H
Кислород O
Углерод C
ПОДПИШИСЬ НА ТЕЛЕГРАМ ОТВЕТЫ и ЗАДАНИЯ 2022-2023 гг. на олимпиаду СИРИУС, ВСОШ
7. Среди каждой пары картинок выберите ту, где соблюдаются правила техники безопасности при работев кабинете химии.Как правильно нюхать химические вещества?
Как должно выглядеть рабочее место?
Как пользоваться пипетками?
Как работать со спиртовкой?
Куда вылить избыток вещества?
8. Даны фотографии веществ:
Даны фотографии веществ:
Также известно, что:
Вещество А в своём составе содержит три разных элемента;
Вещество Б содержит почти в раз больше металла, чем неметалла по массе;
Вещество В относится к классу оснований;
Вещество Г можно найти на любой кухне;
Вещество Д содержит примерно протонов в грамме порошка.
Установите соответствие между изображёнными веществами и их формулами.
Вещество А
Вещество Б
Вещество В
Вещество Г
Вещество Д
Сера S
Хлорид натрия NaCl
Оксид
меди (I) O Cu2
Гидроксид никеля Ni(OH)2
Карбонат
кобальта (II) CoCO3
ПОДПИШИСЬ НА ТЕЛЕГРАМ ОТВЕТЫ и ЗАДАНИЯ 2022-2023 гг. на олимпиаду СИРИУС, ВСОШ
9. Для хлорирования воды в бассейне размерами 30*20 м и глубиной 2м использовали 720 мг хлора.
Определите концентрацию хлора в воде. Ответ выразите в мг/м3 , округлите до десятых.
«Предельно допустимая концентрация» (ПДК) это такое содержание вредных химических веществ в окружающей среде, которое практически не влияет на здоровье человека при постоянном контакте.
ПДК хлора в воде плавательных бассейнов составляет 0.5 мкг/л. Определите, насколько концентрация хлора в воде данного бассейна превышает значение ПДК. Ответ выразите в мкг/л, округлите до десятых.
10. Фараоновы змеи одни из самых зрелищных опытов в химии. Они сопровождаются бурным выделением газа и образованием большого объёма пористого продукта «змеи», которая извивается и ползёт по столу.
Самый простой способ получения «змеи» это положить таблетку глюконата кальция (можно найти в любой аптеке) на таблетку сухого спирта и поджечь его. Разложение глюконата кальция CaC12h32 O14 приводит к образованию углерода, оксида кальция, углекислого газа и воды:
1CaC12h32 O14 + 1O2 = … CaO + … C + … CO2↑ + … h3O↑
Вставьте в уравнение реакции пропущенные коэффициенты. В ответ запишите сумму всех коэффициентов в реакции.
Вычислите массу твёрдого остатка, который образуется при сгорании четырёх таблеток глюконата кальция.
Вес каждой таблетки равен 430 мг. Ответ выразите в граммах, округлите до десятых.
Ответ выразите в граммах, округлите до десятых.
11. Кристаллогидраты это вещества, в состав которых входят молекулы воды. В зависимости от содержания воды вещество может обладать разными свойствами, например, иметь разный цвет. Так, если намочить платок в растворе кристаллогидрата CoCl2 ⋅ 6h3O, то платок приобретёт розовый оттенок. Но если этот платок затем прогладить утюгом, то цвет поменяется на синий.
Всё дело в испарении воды, протекающем при нагревании платка (реакция не уравнена):
CoCl2 ⋅ 6h3O = CoCl2 ⋅ xh3O + h3O
Найдите величину x, если известно, что при глажке утюгом масса платка уменьшилась на 37.8 % (считать, что при глажке утюгом испаряется только вода из кристаллогидрата). В ответ запишите целое число.
Сколько литров воды испарилось, если масса мокрого платка до глажки составляла 15 г? Не забудьте воспользоваться данными из первого пункта задачи и уравнением Менделеева-Клапейрона:
P V = nRT
где n V
P T R
количество вещества в молях; объём газа в литрах;
давление, P = 101. 325 кПа;
325 кПа;
температура, T = 373 К;
универсальная газовая постоянная, R = 8.314 Дж/(моль K).
Ответ выразите в литрах, округлите до сотых.
12. Из двух элементов X и Y составлены три бинарных вещества A, B и C. Состав этих веществ в атомных и массовых процентах приведён в таблице:
Содержание Y в атомных % Содержание Y в массовых %
Вещество A 66.667 22.485
Вещество B 80 36.715
Вещество C 85.714 46.531
Также известно, что элемент Y находится во II периоде.
Запишите химический символ элемента X:
Запишите химический символ элемента Y:
ПОДПИШИСЬ НА ТЕЛЕГРАМ ОТВЕТЫ и ЗАДАНИЯ 2022-2023 гг. на олимпиаду СИРИУС, ВСОШ
Периодическая таблица WebElements » Водород » вода
- Формула: H 2 O
- Формула системы Hill: H 2 O 1
- Регистрационный номер CAS: [7732-18-5]
- Вес формулы: 18.
 015
015 - Класс: оксид
- Цвет: бесцветный
- Внешний вид: жидкость
- Температура плавления: 0,00°C
- Температура кипения: 100,00°C
- Плотность: 1000 кг·м -3 при 4°C; 997 кг м -3 при 25°C
Ниже приведены некоторые синонимы вода :
- вода
- оксид водорода(I)
- монооксид дигидрогена
- дигидрооксид
Степень окисления водорода в воде 1 .
Синтез
Недоступно
Твердотельная структура
- Геометрия водорода: 1 координата: конечная точка
- Прототип конструкции:
Элементный анализ
В таблице показано процентное содержание элементов для H 2 O (вода).
| Элемент | % |
|---|---|
| Н | 11.19 |
| О | 88,81 |
Изотопная схема H
2 OНа приведенной ниже диаграмме показана рассчитанная изотопная картина для формулы H 2 O с наиболее интенсивным ионом, установленным на 100%.
Каталожные номера
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Reinhold, New York, USA, 1960.
- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
- Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Передовая неорганическая химия , John Wiley & Sons, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.

- Р.В.Г. Wyckoff, in Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975 г.
- Дж.Д.Х. Донней, (редактор) в Определяющие таблицы данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.
- Д.Р. Лиде, (редактор) в справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996.
- Дж.В. Меллор в Всесторонний трактат по неорганической и теоретической химии , тома 1-16, Longmans, Лондон, Великобритания, 1922-1937.
- Дж. Э. Макинтайр (редактор) в Словаре неорганических соединений , тома 1–3, Chapman & Hall, Лондон, Великобритания, 1992.
Исследуйте периодические свойства по этим ссылкам
Как использовать периодическую таблицу
••• http://61. 19.145.8/student/m5year2006-2/502/group11/periodic_table.gif
19.145.8/student/m5year2006-2/502/group11/periodic_table.gif
Обновлено 24 апреля 2017 г.
От редакции
Большинство людей, не знакомых с химией, плохо понимают периодическую таблицу элементов. Удивительно знать, какую роль играет каждый элемент в нашей жизни. Простую молекулу, такую как вода, можно понять, взглянув на периодическую таблицу и используя ее.
- Периодическая таблица
- Химические ноу-хау
Эта статья предназначена для быстрого объяснения. Вам нужно будет прочитать об орбиталях и кислотах, чтобы лучше понять.
Структура периодической таблицы очень важна для ее понимания. Он был выложен так, что элементы идут по порядку атомного номера. Атомный номер – это количество протонов и электронов в нейтральном атоме. Водород, первый элемент в таблице, имеет атомный номер один. Чтобы этот элемент был нейтральным, он должен иметь один протон (+) и один электрон (-). Другой пример — кислород. Кислород имеет атомный номер 8. Это означает, что он имеет всего 8 протонов (+) и 8 электронов (-). По мере того, как мы перемещаемся по таблице Менделеева и вниз, мы добавляем протоны и электроны.
Теперь, когда вы поняли, что такое атомный номер, давайте посмотрим, как устроены электроны в элементе. Электроны расположены по орбиталям. Орбитали – это «дом» электронов. Думайте об орбитах как о многоквартирном доме. Первый этаж имеет наименьшую энергию и является s-орбиталью. Второй этаж имеет немного больше энергии и является p-орбиталями. Третий этаж обладает еще большей энергией и представляет собой d-орбитали, и так далее, и тому подобное.
Электроны расположены по орбиталям. Орбитали – это «дом» электронов. Думайте об орбитах как о многоквартирном доме. Первый этаж имеет наименьшую энергию и является s-орбиталью. Второй этаж имеет немного больше энергии и является p-орбиталями. Третий этаж обладает еще большей энергией и представляет собой d-орбитали, и так далее, и тому подобное.
Электроны устроены так, что они первыми выйдут на орбиталь с наименьшей энергией. Например, кислород, который имеет 8 электронов, будет иметь два на своей 1S-орбитали, два на своей 2S-орбитали и четыре на своих 2P-орбиталях (x, y, z). Дело в том, что электроны НЕНАВИДЯТ находиться в паре на одной и той же орбите. Поскольку на 2P-орбитали всего шесть возможных мест (2 по x, 2 по y и 2 по z) и только четыре электрона, два из них будут неспаренными. Эти неспаренные электроны используются для «связи» с другими элементами. Их называют валентными электронами.
Чтобы понять, как электроны связываются друг с другом, давайте взглянем на воду (h3O). Глядя на периодическую таблицу, мы видим, что атомный номер водорода равен единице. Это означает, что у него есть один электрон на его 1S-орбитали. Теперь, поскольку этот электрон не спарен, его можно использовать для связи. Кислород, который мы знаем из шага 3, имеет 2 неспаренных электрона для связи. Вода состоит из двух элементов водорода и одного элемента кислорода. Это означает, что мы можем сделать «гибрид», взяв два электрона от водорода и соединив их с двумя электронами от кислорода. Делая это, мы устраняем любые свободные электроны, и теперь молекула стабильна.
Глядя на периодическую таблицу, мы видим, что атомный номер водорода равен единице. Это означает, что у него есть один электрон на его 1S-орбитали. Теперь, поскольку этот электрон не спарен, его можно использовать для связи. Кислород, который мы знаем из шага 3, имеет 2 неспаренных электрона для связи. Вода состоит из двух элементов водорода и одного элемента кислорода. Это означает, что мы можем сделать «гибрид», взяв два электрона от водорода и соединив их с двумя электронами от кислорода. Делая это, мы устраняем любые свободные электроны, и теперь молекула стабильна.
Теперь, когда вы знаете, как соединять простые элементы, давайте рассмотрим понятие электроотрицательности (для краткости я буду использовать e-neg). E-neg — это мера того, насколько электроотрицательным является элемент. Другими словами, это мера того, насколько элемент любит притягивать к себе электроны. E-neg увеличивается вверх и вправо в периодической таблице. Фтор является наиболее электроотрицательным элементом и имеет тенденцию притягивать к себе все электроны. Именно эта концепция делает фтороводород (HF) такой сильной кислотой. Единственный одинокий электрон водорода так сильно притягивается к фтору, что водород может быть очень быстро вытеснен другим элементом. Чем легче удалить водород из молекулы, тем более кислой она будет.
Именно эта концепция делает фтороводород (HF) такой сильной кислотой. Единственный одинокий электрон водорода так сильно притягивается к фтору, что водород может быть очень быстро вытеснен другим элементом. Чем легче удалить водород из молекулы, тем более кислой она будет.
Всякий раз, когда у вас есть возможность, сядьте и попробуйте нарисовать орбитали для каждого элемента и посмотреть, сколько неспаренных электронов получится. Если вы можете освоить периодическую таблицу, вы можете освоить химию!
Вещи, которые вам понадобятся
Статьи по теме
Советы
- Эта статья предназначена для быстрого объяснения. Вам нужно будет прочитать об орбиталях и кислотах, чтобы лучше понять.
Об авторе
Эта статья была написана командой CareerTrend, отредактирована и проверена с помощью многоточечной системы аудита, чтобы наши читатели получали только самую лучшую информацию.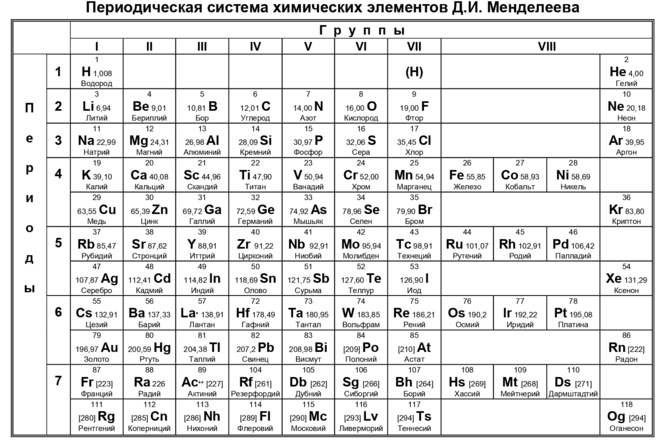


 015
015