Характеристика химического элемента по положению в псхэ. Характеристика химического элемента на основании его положения в псхэ д.и
Зная формулировка периодического закона и используя периодическую систему элементов Д. И. Менделеева, можно дать характеристику любому химическому элементу и его соединениям. Такую характеристику химического элемента удобно складывать по плану.
I. Символ химического элемента и его название.
II. Положение химического элемента в периодической системе элементов Д.И. Менделеева:
- порядковый номер;
- номер периода;
- номер группы;
- подгруппа (главная или побочная).
III. Строение атома химического элемента:
- заряд ядра атома;
- относительная атомная масса химического элемента;
- число протонов;
- число электронов;
- число нейтронов;
- число электронных уровней в атоме.
IV. Электронная и электронно-графическая формулы атома, его валентные электроны.
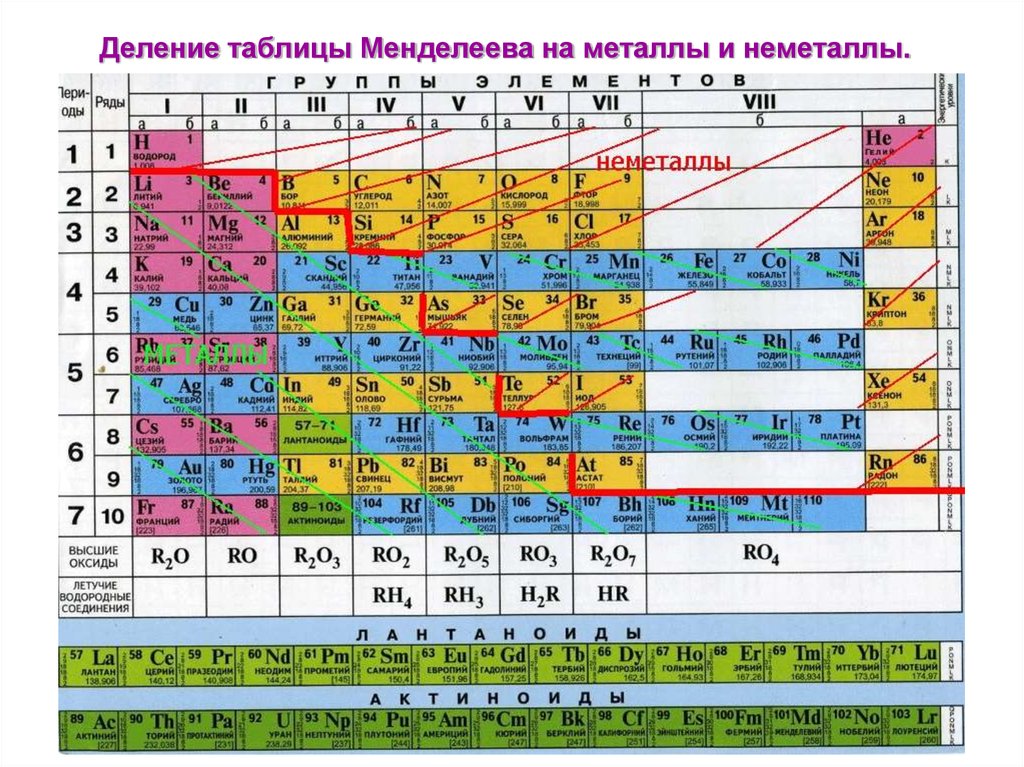
V. Тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
VI. Формулы высшего оксида и гидроксида химического элемента, характеристика их свойств (основные, кислотные или амфотерные).
VII. Сравнение металлических или неметаллических свойств химического элемента со свойствами элементов-соседей по периоду и подгруппой.
VIII. Максимальная и минимальная степень окисления атома.
Например, предоставим характеристику химического элемента с порядковым номером 15 и его соединениям по положению в периодической системе элементов Д. И. Менделеева и строению атома.
I. Находим в таблице Д. И. Менделеева клетку с номером химического элемента, записываем его символ и название.
Химический элемент номер 15 — Фосфор. Его символ Р.
II. Охарактеризуем положение элемента в таблице Д. И. Менделеева (номер периода, группы, тип подгруппы).
Фосфор находится в главной подгруппе V группы, в 3-м периоде.
III.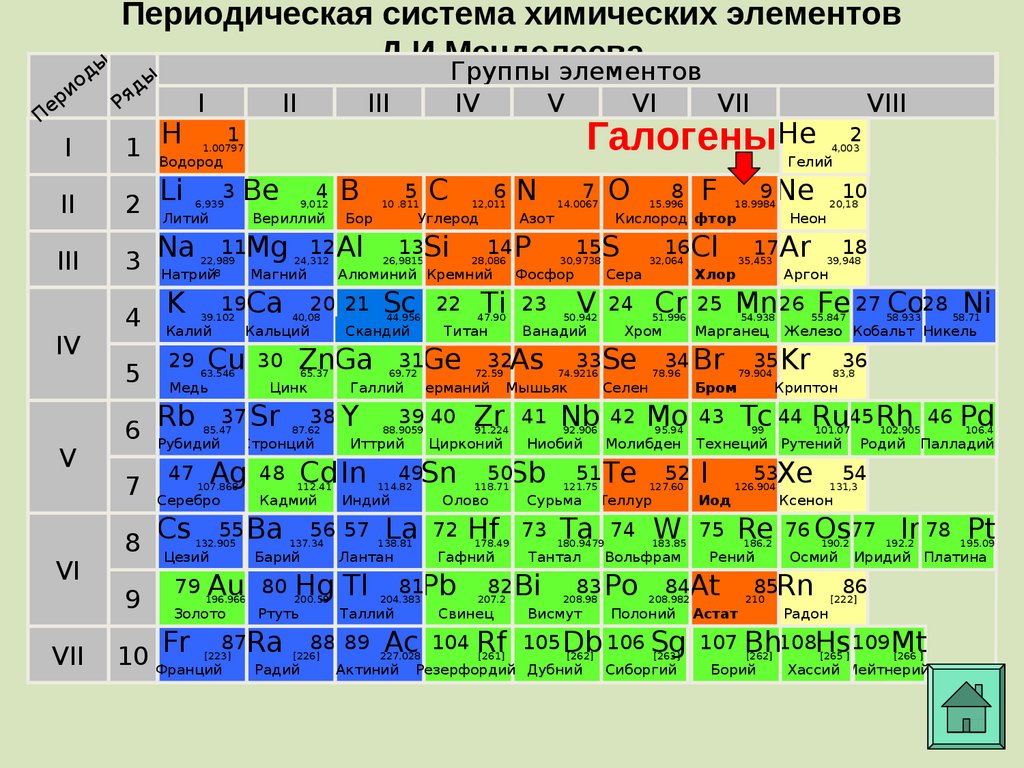 Предоставим общую характеристику состава атома химического элемента (заряд ядра, атомная масса, число протонов, нейтронов, электронов и электронных уровней).
Предоставим общую характеристику состава атома химического элемента (заряд ядра, атомная масса, число протонов, нейтронов, электронов и электронных уровней).
Заряд ядра атома фосфора равен +15. Относительная атомная масса фосфора равна 31. Ядро атома содержит 15 протонов и 16 нейтронов (31 — 15 = 16). Атом фосфора имеет три энергетических уровня, на которых находятся 15 электронов.
IV. Составляем электронной и электронно-графическую формулы атома, отмечаем его валентные электроны.
Электронная формула атома фосфора: 15 P 1s 2 2s 2 2p 6 3s 2 3p 3 .
Электронно-графическая формула внешнего уровня атома фосфора: на третьем энергетическом уровне на 3s-подуровня находятся два электрона (в одной клетке записываются две стрелки, имеющие противоположное направление), на три р-подуровне находятся три электрона (в каждой из трех клеток записываются по одной стрелке, имеющие одинаковое направление).
Валентными электронами являются электроны внешнего уровня, т.е. 3s2 3p3 электроны.
V. Определяем тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
Фосфор — неметалл. Поскольку в последнее подуровнем в атоме фосфора, который заполняется электронами, является p-подуровень, Фосфор относится к семейству p-элементов.
VI. Составляем формулы высшего оксида и гидроксида фосфора и характеризуем их свойства (основные, кислотные или амфотерные).
Высший оксид фосфора P 2 O 5 , проявляет свойства кислотного оксида. Гидроксид, соответствующий высшему оксиду, H 3 PO 4 , проявляет свойства кислоты. Подтвердим указанные свойства уравнениями видповиних химических реакций:
P 2 O 5 + 3 Na 2 O = 2Na 3 PO 4
H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O
VII. Сравним неметаллические свойства фосфора со свойствами элементов-соседей по периоду и подгруппой.
Соседом фосфора по подгруппе являются азот. Соседями фосфора за периодом является кремний и Сера. Неметаллические свойства атомов химических элементов главных подгрупп с ростом порядкового номера растут в периодах и снижаются в группах. Поэтому неметаллические свойства фосфора более выражены, чем у кремния и менее выражены, чем у азота и серы.
Поэтому неметаллические свойства фосфора более выражены, чем у кремния и менее выражены, чем у азота и серы.
VIII. Определяем максимальную и минимальную степень окисления атома фосфора.
Максимальный положительный степень окисления для химических элементов главных подгрупп равен номеру группы. Фосфор находится в главной подгруппе пятой группы, поэтому максимальная степень окисления фосфора +5.
Минимальная степень окисления для неметаллов в большинстве случаев равен разнице между номером группы и числом восемь. Так, минимальная степень окисления фосфора -3.
уметь характеризовать элемент на основании его положения в периодической системе, систематизировать знания о составе и свойствах соединений, образуемых металлами
Просмотр содержимого документа
«Урок 1 характеристика элемента-металла»
Конспект урока по химии
в 9 классе
«Характеристика химического элемента-металла на основании его положения в Периодической системе Д. И. Менделеева.
Тема урока: Характеристика химического элемента-металла на основании его положения в Периодической системе Д. И. Менделеева. (1 слайд)
Цели урока: актуализировать знания о структуре периодической системы,
систематизировать знания о составе и строении атома элемента,
уметь характеризовать элемент на основании его положения в периодической системе, систематизировать знания о составе и свойствах соединений, образуемых металлами (2 слайд)
Оборудование: Таблица Д. И. Менделеева. Простые вещества – металлы и неметаллы, компьютер, проектор, презентация по теме.
I . Организационный момент
Приветственное слово учителя. Поздравление ребят с началом нового учебного года.
П. Повторение основных теоретических вопросов программы 8 класса
Основным вопросом программы 8 класса является Периодическая система химических элементов Д. И. Менделеева. Она же является базой для изучения курса химии 9 класса.
Напоминаю, что таблица Д. И. Менделеева представляет собой «дом», в котором живут все химические элементы. Каждый элемент имеет номер (порядковый), который можно сравнить с номером квартиры. «Квартира» расположена на определенном «этаже» (т. е. периоде) и в определенном «подъезде» (т. е. группе). Каждая группа в свою очередь делится на подгруппы: главную и побочную. Пример: элемент магний Mg
имеет порядковый номер (№) 12 и расположен в третьем периоде, в главной подгруппе второй группы.
И. Менделеева представляет собой «дом», в котором живут все химические элементы. Каждый элемент имеет номер (порядковый), который можно сравнить с номером квартиры. «Квартира» расположена на определенном «этаже» (т. е. периоде) и в определенном «подъезде» (т. е. группе). Каждая группа в свою очередь делится на подгруппы: главную и побочную. Пример: элемент магний Mg
имеет порядковый номер (№) 12 и расположен в третьем периоде, в главной подгруппе второй группы.
Свойства химического элемента зависят от его положения в таблице Д. И. Менделеева. Поэтому очень важно научиться характеризовать свойства химических элементов на основании их положения в Периодической системе.
III . План характеристики химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Алгоритм характеристики: (3-5 слайды)
1. Положение элемента в ПС
в) группа
д) относительная атомная масса.
а) число протонов (р +), нейтронов (n 0), электронов (е -)
б) заряд ядра
д) электронная формула атома
е) графическая формула атома
ж) семейство элемента.
Три последних пункта, для хорошо подготовленных классов.
3. Свойства атома
Записать в виде схем-уравнений. Сравнить с соседними атомами.
4. Возможные степени окисления.
5. Формула высшего оксида, его характер.
6. Формула высшего гидроксида, его характер.
7. Формула летучего водородного соединения, его характер.
Обратить внимание: При рассмотрении пунктов 5 и 7 все формулы высших оксидов и летучих водородных соединений помещены внизу таблицы Д. И. Менделеева, что фактически является «законной шпаргалкой».
Так как в начале, при характеристике элементов ребята могут испытывать определенные трудности, поэтому им полезно пользоваться «законными шпаргалками» – табл. 1 и др. Потом, по мере накопления опыта и знаний, эти помощники уже не потребуются.
Задание: Охарактеризуйте химический элемент натрий на основании его положения в периодической системе Д.И. Менделеева. (слайд 6)
Работает весь класс, записи поочередно ведут обучающиеся на доске.
Образец ответа. (слайд 7)
Na – натрий
1) 11, 3 период, малый, 1 группа, А
2) 11 р + , 12n 0 , 11 е –
+ 11 2-8-1
1s 2 2s 2 2p 6 3s 1 3p 0 3d 0 – s – элемент
3) Na 0 – 1 e → Na +
восстановитель
R a: Li Mg
по группе по периоду
Ме св-ва: Li Na K Na Mg
по группе по периоду
4) Na : 0, +1
5) Na 2 O – основный оксид
6) NaOH – основание, щелочь.
7) Не образует
IV
Каждый химический элемент образует простое вещество, обладающее определенным строением и свойствами. Простое вещество характеризуют по следующим параметрам: (слайд 8)
Простое вещество характеризуют по следующим параметрам: (слайд 8)
1) Тип связи.
2) Тип кристаллической решетки.
3) Физические свойства.
4) Химические свойства (схема).
Образец ответа : (слайд 9)
Металлическая связь [Na 0 – 1 e → Na + ]
– Металлическая кристаллическая решетка
– Твердое вещество, мягкий металл (режется ножом), белого цвета, блестящий, тепло-и электропроводен.
Металл продемонстрировать. Отметить, что в связи с высокой химической активностью, его хранят под слоем керосина.
– Na 0 – 1 e → Na + → взаимодействует с веществами-окислителями
восстановитель
Неметаллы + оксиды металлов (менее активные)
Кислоты + соли
Задание : Запишите уравнения реакций, характеризующие свойства простого вещества натрия. Рассмотрите уравнения с позиций окислительно-восстановительных процессов. (слайд 10)
(слайд 10)
Пять учащихся по желанию работают у доски.
1) 2 Na + Cl 2 → 2 NaCl
Cl 2 0 + 2e → 2Cl – │1 окислитель – восстановление
2) 2 Na + 2HCl → 2 NaCl + H 2
Na 0 – 1e → Na + │2 восстановитель – окисление
3) 2 Na + 2H 2 O → 2 NaOH + H 2
Na 0 – 1e → Na + │2 восстановитель – окисление
2H + + 2e → H 2 0 │1 окислитель – восстановление
4) 2 Na + MgO → Na 2 O + Mg
Na 0 – 1e → Na + │2 восстановитель – окисление
Mg 2+ + 2e → Mg 0 │1 окислитель – восстановление
5) 2 Na + CuCl 2 (расплав) → 2 NaCl + Cu
Na 0 – 1e → Na + │2 восстановитель – окисление
Cu 2+ + 2e → Cu 0 │1 окислитель – восстановление
V
Для каждого химического элемента характерно образование сложных веществ различных классов – оксиды, основания, кислоты, соли. Основными параметрами характеристики сложного вещества являются: (слайд 11)
Формула соединения.
Вид связи.
Характер соединения.
Химические свойства соединения (схема).
Образец ответа:
I . Оксид (слайд 12)
Na 2 O
Ионная связь
Химические свойства:
основный оксид + кислота → соль и вода
основный оксид + кислотный оксид → соль
основный оксид + Н 2 О → щелочь
(растворимый оксид)
II. Гидроксид (слайд 13)
1) NaOH
2) Ионная связь
3) Основание, щелочь.
4) Химические свойства:
основание (любое) + кислота = соль + вода
щёлочь + соль = новое основание + новая соль
щёлочь + оксид неметалла = соль + вода
Самостоятельная работа.
Задание: Запишите уравнения реакций, характеризующие свойства оксида и гидроксида. Уравнения рассмотрите с позиций окислительно-восстановительных процессов и ионного обмена. (слайд 14)
Образец ответов.
Оксид натрия:
l ) Na 2 O + 2HC 1 = 2NaCl + Н 2 О (реакция обмена)
2) Na 2 O + SO 2 = Na 2 SO 3 (реакция соединения)
3) Na 2 O + H 2 O = 2NaOH (реакция соединения)
Гидроксид натрия:
1) 2NaOH + H 2 SO 4 = Na 2 SO 4 + 2Н 2 О (реакция обмена)
2Na + + 2ОН – + 2Н + + SO 4 2- = 2Na + + SO 4 2- + 2Н 2 О
ОН – + Н + = Н 2 О
2) 2NaOH + СО 2 = Na 2 CO 3 + Н 2 О (реакция обмена)
2Na + + 2ОН- + СО 2 = 2Na + + СО 3 2- + Н 2 О
3) 2NaOH + CuSO 4 = Na 2 SO 4 + Cu (OH) 2 (реакцияобмена)
2Na + + 2 ОН – + Cu 2+ + SO 4 2- = 2Na + + SO 4 2- + Cu (OH) 2
2OH – + Cu 2+ = Cu (OH ) 2
Вспомнить условия протекания реакций обмена до конца (образование осадка, газа или слабого электролита).
Для натрия, как и для всех металлов, характерно образование генетического ряда: (слайд 15)
Металл → основный оксид → основание (щелочь) → соль
Na → Na 2 O → NaOH → NaCl (Na 2 SO 4 , NaNO 3 , Na 3 PO 4 )
(слайд 16)
§ 1, упр. 1 (б), 3; составить уравнения реакций для генетического ряда Na
Просмотр содержимого презентации
«Характеристика элемента-металла»
Урок: «Характеристика химического элемента-металла на основании его положения в Периодической системе Д. И. Менделеева» урок химии, 9 класс
- актуализировать знания о структуре периодической системы,
- систематизировать знания о составе и строении атома элемента,
- уметь характеризовать элемент на основании его положения в периодической системе,
- систематизировать знания о составе и свойствах соединений, образуемых металлами
Алгоритм
характеристики элемента
- Положение элемента в ПС
а) порядковый номер химического элемента
б) период (большой или малый).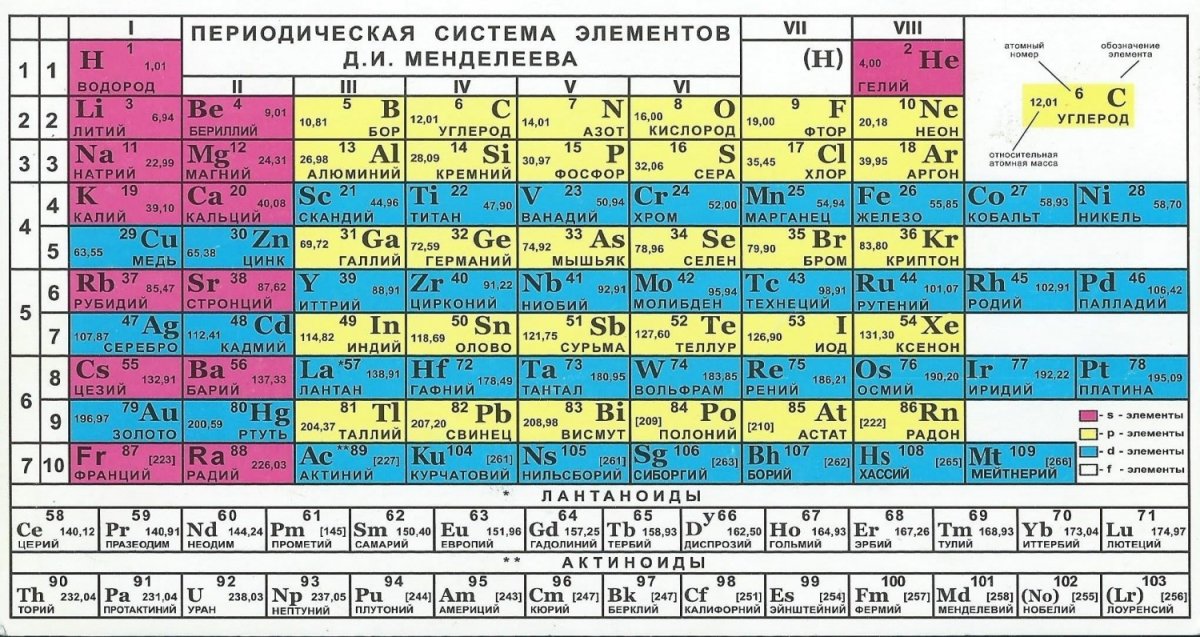
в) группа
г) подгруппа (главная или побочная)
д) относительная атомная масса
а) число протонов (р+), нейтронов (n 0), электронов (е -)
б) заряд ядра
в) число энергетических уровней в атоме
г) число электронов на уровнях
д) электронная формула атома
е) графическая формула атома
ж) семейство элемента.
- Свойства атома
а) способность отдавать электроны (восстановитель)
б) способность принимать электроны (окислитель).
- Возможные степени окисления.
- Формула высшего оксида, его характер.
- Формула высшего гидроксида, его характер.
- Формула летучего водородного соединения, его характер.
Задание: Охарактеризуйте химический элемент натрий на основании его положения в периодической системе Д.И. Менделеева.
Mg по группе по периоду Ме св-ва: Li Na K Na Mg по группе по периоду Na: 0, +1 Na 2 O – основный оксид NaOH – основание, щелочь.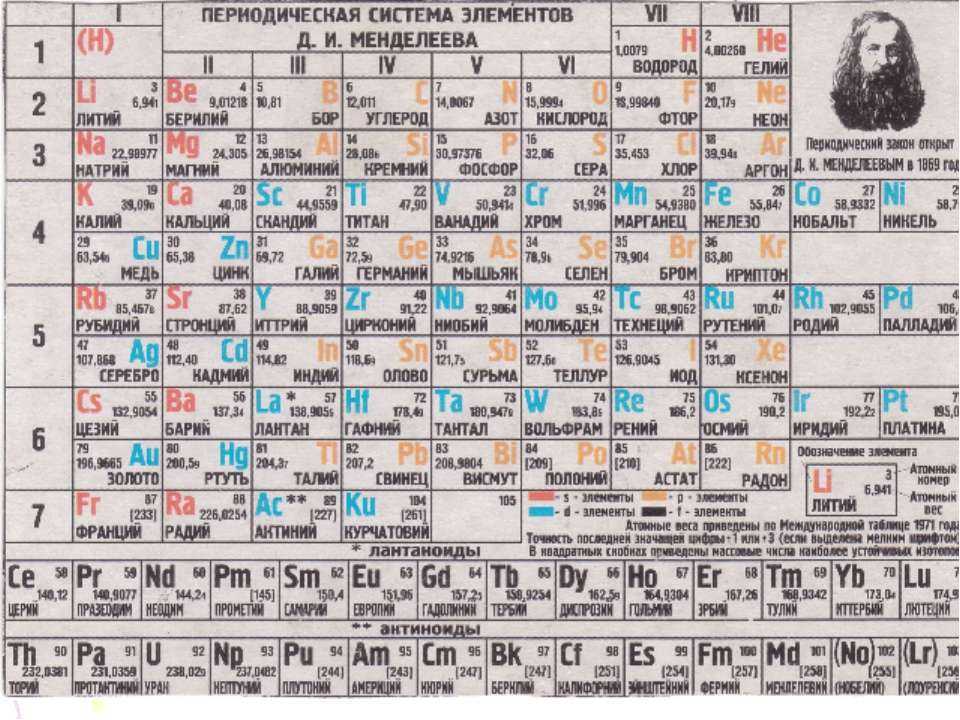 Не образует”
Не образует”
- Na – натрий
- 11, 3 период, малый, 1 группа, А
- 11 р +, 12n 0 , 11 е –
- +11 2-8-1
- 1s 2 2s 2 2p 6 3s 1 3p 0 3d 0 – s – элемент
- Na 0 – 1 e → Na +
- восстановитель
- Ra: Li Na Mg
- по группе по периоду
- Ме св-ва: Li Na K Na Mg
- по группе по периоду
- Na : 0, +1
- Na 2 O – основный оксид
- NaOH – основание, щелочь.
- Не образует
- Тип связи
- Тип кристаллической решетки
- Физические свойства
- Химические свойства (схема)
Образец ответа
- Металлическая связь [ Na 0 – 1 e → Na + ]
- Металлическая кристаллическая решетка
- Твердое вещество, мягкий металл (режется ножом), белого цвета, блестящий, тепло – и электропроводен.

- Na – восстановитель → взаимодействует с веществами-окислителями
Неметаллы + кислоты
Вода + соли
Оксиды металлов (менее активные)
Задание : Запишите уравнения реакций, характеризующие свойства простого вещества натрия.
Рассмотрите уравнения с позиций окислительно-восстановительных процессов.
- Формула соединения.
- Вид связи.
- Характер соединения.
- Химические свойства соединения (схема)
Образец ответа: Оксид натрия
- Na 2 O
- Ионная связь
- Солеобразующий, основный оксид.
- Химические свойства:
Основный оксид + кислота → соль и вода
Основный оксид + кислотный оксид → соль
Основный оксид + Н 2 О → щелочь
(растворимый оксид)
Гидроксид натрия
- Ионная связь
- Основание, щелочь.
- Химические свойства:
Щёлочь + кислота = соль + вода
Щёлочь + соль = новое основание + новая соль
Щёлочь + оксид неметалла = соль + вода
Самостоятельная работа
Задание: Запишите уравнения реакций, характеризующие свойства оксида и гидроксида.
Уравнения рассмотрите с позиций окислительно-восстановительных процессов и ионного обмена.
Генетический ряд натрия
Металл → Основный оксид →
→ Основание (щелочь) → Соль
Na → Na 2 O → NaOH → NaCl ( Na 2 SO 4 , NaNO 3 , Na 3 PO 4 )
- упр. 1 (б), 3
- составьте уравнения реакций для генетического ряда Na .
Все многообразие окружающей нас природы состоит из сочетаний сравнительно небольшого числа химических элементов. Так какова же характеристика химического элемента, и чем он отличается от простого вещества?
Химический элемент: история открытия
В различные исторические эпохи в понятие «элемент» вкладывался различный смысл. Древнегреческие философы в качестве таких «элементов» рассматривали 4 «стихии» – тепло, холод, сухость и влажность. Сочетаясь попарно они образовывали четыре «начала» всего на свете – огонь, воздух, воду и землю.
Сочетаясь попарно они образовывали четыре «начала» всего на свете – огонь, воздух, воду и землю.
В XVII веке Р. Бойль указал на то, что все элементы носят материальный характер и их число может быть достаточно велико.
В 1787 году французский химик А. Лавуазье создал «Таблицу простых тел». В нее вошли все известные к тому времени элементы. Под последними понимались простые тела, которые не удавалось разложить химическими методами на еще более простые. Впоследствии выяснилось, что в таблицу вошли и некоторые сложные вещества.
К моменту, когда Д. И. Менделеев открыл периодический закон, было известно всего 63 химических элементов. Открытие ученого не только привело к упорядоченной классификации химических элементов, а также помогло предсказать существование новых, еще не открытых элементов.
Рис. 1. А. Лавуазье.
Что такое химический элемент?
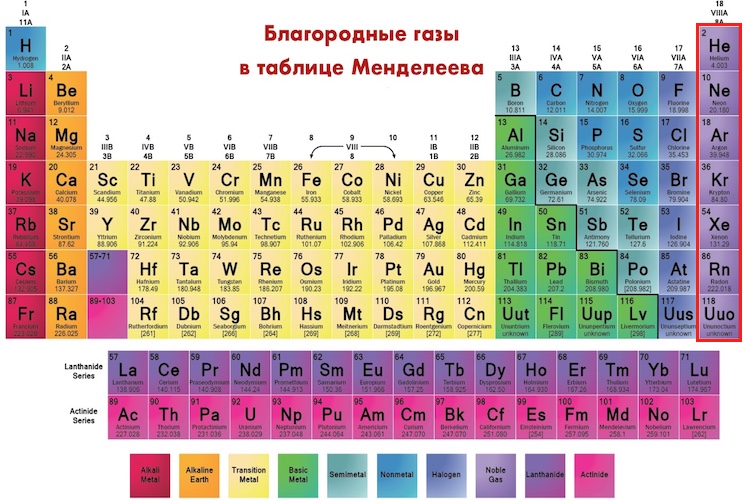
Химическим элементом называют определенный вид атомов. В настоящее время известно 118 химических элементов. Каждый элемент обозначают символом, который представляет одну или две буквы из его латинского названия. Например, элемент водород обозначают латинской буквой H и формулой H 2 – первой буквой латинского названия элемента Hydrogenium. Все достаточно хорошо изученные элементы имеют символы и названия, которые можно найти в главных и побочных подгруппах Периодической системы, где все они расположены в определенном порядке.
Каждый элемент обозначают символом, который представляет одну или две буквы из его латинского названия. Например, элемент водород обозначают латинской буквой H и формулой H 2 – первой буквой латинского названия элемента Hydrogenium. Все достаточно хорошо изученные элементы имеют символы и названия, которые можно найти в главных и побочных подгруппах Периодической системы, где все они расположены в определенном порядке.
Cуществует много видов систем, но общепринятой является Периодическая система химических элементов Д. И. Менделеева, которая является графическим выражением Периодического закона Д. И. Менделеева. Обычно используют короткую и длинную формы Периодической системы.
Рис. 2. Периодическая система элементов Д. И. Менделеева.
Что же является главным признаком, по которому атом относят к определенному элементу? Д. И. Менделеев и другие ученые-химики XIX века считали главным признаком атома массу как наиболее стабильную его характеристику, поэтому элементы в Периодической системе расположены в порядке возрастания атомной массы (за немногим исключением).
По современным представлениям, главным свойством атома, относящим его к определенному элементу, является заряд ядра. Таким образом, химический элемент – это вид атомов, характеризующихся определенным значением (величиной) части химического элемента – положительного заряда ядра.
Из всех существующих 118 химических элементов большую часть (около 90) можно обнаружить в природе. Остальные же получены искусственно с помощью ядерных реакций. Элементы 104-107 были синтезированы учеными-физиками в Объединенном институте ядерных исследований в городе Дубне. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми номерами.
Все элементы делятся на металлы и неметаллы. Более 80 элементов относятся к металлам. Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы – металлические свойства.
Содержание различных элементов в природных объектах колеблется в широких пределах. 8 химических элементов (кислород, кремний, алюминий, железо, кальций, натрий, калий, магний) составляют 99% земной коры по массе, все остальные – менее 1%. Большинство химических элементов имеют природное происхождение (95), хотя некоторые из них изначально были выведены искусственно (например, прометий).
8 химических элементов (кислород, кремний, алюминий, железо, кальций, натрий, калий, магний) составляют 99% земной коры по массе, все остальные – менее 1%. Большинство химических элементов имеют природное происхождение (95), хотя некоторые из них изначально были выведены искусственно (например, прометий).
Следует различать понятия «простое вещество» и «химический элемент». Простое вещество характеризуется определенными химическими и физическими свойствами. В процессе химического превращения простое вещество утрачивает часть своих свойств и входит в новое вещество в виде элемента. Например, азот и водород, входящие в состав аммиака, содержатся в нем не в виде простых веществ, а в виде элементов.
Некоторые элементы объединяются в группы, такие как органогены (углерод, кислород, водород, азот), щелочные металлы (литий, натрий, калий и т.д.), лантаноиды (лантан, церий и т.д.), галогены (фтор, хлор, бром и т.д.), инертные элементы (гелий, неон, аргон)
Закономерности изменения некоторых свойств химических элементов в ПС. ХарактеристикаВ пределах периодаВ пределах одной группы (для элементов главных подгрупп) Заряд ядра атома Увеличивается Число энергетических уровней Не изменяется Увеличивается Число электронов на внешнем энергетическом уровне Увеличивается Не изменяется Радиус атома Уменьшается Увеличивается Электроотрицательность УвеличиваетсяУменьшается Восстановительные свойства Уменьшаются Увеличиваются Металлические свойства Уменьшаются Увеличиваются
ХарактеристикаВ пределах периодаВ пределах одной группы (для элементов главных подгрупп) Заряд ядра атома Увеличивается Число энергетических уровней Не изменяется Увеличивается Число электронов на внешнем энергетическом уровне Увеличивается Не изменяется Радиус атома Уменьшается Увеличивается Электроотрицательность УвеличиваетсяУменьшается Восстановительные свойства Уменьшаются Увеличиваются Металлические свойства Уменьшаются Увеличиваются
Натрий Хлор Заряд ядра Число нуклоновp=11, n=12p=17,n=18 Число электроновe=11E=17 Число энергетических уровней 33 Электронная формула 1s 2 2s 2 2p 6 3s 1 1s 2 2s 2 2p 6 3s 2 3p 5 Высшая степень окисления+1+7 Окислительно-восстановительные свойства Восстановитель Окислитель 1. Положение элемента в ПС и строение его атома
Натрий Хлор Оксид натрия Na2O проявляет основные свойства. Ему соответствует основание NaOH. Na 2 O + H 2 O = 2NaOH Na 2 O + 2HCl = 2NaCl + H 2 O Na 2 O + SO 3 = Na 2 SO 4 Высший оксид хлора Cl2O7 является кислотным оксидом. Ему соответствует кислота HClO4. Cl 2 O 7 + H 2 O = 2HClO 4 Cl 2 O 7 + Na 2 O = 2NaClO 4 Cl 2 O 7 + 2NaOH = 2NaClO 4 + H 2 O
Ему соответствует кислота HClO4. Cl 2 O 7 + H 2 O = 2HClO 4 Cl 2 O 7 + Na 2 O = 2NaClO 4 Cl 2 O 7 + 2NaOH = 2NaClO 4 + H 2 O
Натрий Хлор Гидроксид натрия NaOH, является сильным основанием и проявляет свойства, характерные для основания. NaOH + HCl = NaCl + h3O 2NaOH + CO2 = Na2CO3 + h3O 2NaOH + CuCl2 = Cu(OH)2 + 2NaCl Хлорная кислота HClO4 проявляет свойства сильной кислоты. HClO2 + KOH = KClO4 + h3O
(от др.-греч. αλλος «другой», τροπος «поворот, свойство») существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам так называемых аллотропических модификаций или аллотропических форм.др.-греч.химического элемента простых веществ
Тема 2. Характеристика элемента-неметалла на основании его положения в периодической системе Д. И. Менделеева.
Часть I
По плану, рассмотренному на прошлом уроке, дайте характеристику элемента фосфора.
1) Это элемент VA группы ПС, 3-го малого периода.
2) Электронная формула атома: +15Р 2е, 6е, 5е.
3) Фосфор может проявлять окислительные свойства по отношению к металлам и водороду, а также восстановительные свойства по отношению к более электроотрицательным элементам, например: О, Cl.
4-6) Для фосфора характерно явление аллотропии. Он образует две аллотропные модификации: Р красный и Р белый. У первого – атомная кристаллическая решётка, а у второго – молекулярная кристаллическая решётка и формула Р4. Следовательно, причиной аллотропии фосфора является кристаллическая решётка, т.е. разное строение.
Фосфор красный и молекулы Р4 образованы за счёт ковалентной неполярной связи. Между молекулами Р4 – слабые межмолекулярные силы взаимодействия.
7-8) Р > активный НМ, чем Si, но < активный, чем S.
Фосфор < активный восстановитель, чем Si, но > активный, чем S.
9) Высший оксид фосфора имеет формулу Р2О5 и название оксид фосфора V. Это кислотный оксид.
Это кислотный оксид.
Он взаимодействует (запишите уравнения возможных реакций, в том числе в полной и сокращённой ионной форме для реакций с участием электролитов):
10) Высший гидроксид фосфора – это фосфорная кислота, формула которой .
Это двухосновная, кислородсодержащая, растворимая в воде, нелетучая, стабильная, но слабая кислота. Поэтому в ионных уравнениях реакций с участием фосфорной кислоты её формулу следует записывать в молекулярной форме.
Реакция с металлами для фосфорной кислоты нехарактерна. Остальные свойства – типичные для кислот. Она взаимодействует (составьте уравнения возможных реакций – молекулярные, полные и сокращённые ионные):
11) Летучее водородное соединение фосфора имеет формулу PH3. Оно построено за счёт ковалентной химической связи. Схема её образования:
Часть II
1. Вычеркните «лишнее».
Вычеркните «лишнее».
4) Be
2. Какая из следующих групп содержит только неметаллы?
1) VIIA
3. Исключите «лишний» элемент с точки зрения возможности образования аллотропных модификаций.
2) азот
4. Какой тип химической связи может иметь место только между атомами неметаллов?
1) ковалентная полярная
4) ковалентная неполярная
5. Раствор летучего водородного соединения хлора в воде называется соляной или хлороводородной кислотой.
Приведите характеристики кислоты:
по основности – одноосновная
по содержанию кислорода – бескислородная
по растворимости – растворимая
по силе – сильная.
Соединение проявляет все типичные свойства кислот (запишите уравнения возможных реакций в молекулярной, полный и сокращённой ионной формах):
7. Оксид хлора (VII) проявляет все типичные свойства кислотных оксидов (подтвердите уравнениями соответствующих реакций в молекулярной, полной и сокращённой ионной формах, где это имеет место):
8. Хлорная кислота HClO4 – очень сильная кислота, проявляет все типичные свойства кислот. Подтвердите этот вывод уравнениями соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
Хлорная кислота HClO4 – очень сильная кислота, проявляет все типичные свойства кислот. Подтвердите этот вывод уравнениями соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
Характеристики и физические свойства элементов группы 15
Содержание
- 1 Репрезентативные элементы или элементы основной группы
- 2 Элементы группы 15
- 3 Общие характеристики элементов группы 15
- 5 Состояние окисления
6
- 4 Атомные и физические свойства 90
- 5.1 (i) Отрицательные степени окисления
- 5.2 (ii) Положительные степени окисления
В подробной форме периодической таблицы элементы были разделены на четыре блока: s, p, d и f в зависимости от подоболочки, в которую входит последний электрон.
Элементы, принадлежащие s- и p-блокам в периодической таблице, называются репрезентативными элементами или основной группой элементов. Они относятся к группам 1, 2 и с 13 по 18.
Они относятся к группам 1, 2 и с 13 по 18.
Элементы, принадлежащие к группам 1 и 2, относятся к s-блоку и имеют общую конфигурацию ns 1-2 . Элементы групп с 13 по 18 относятся к p-блоку и имеют общую конфигурацию ns 2 np 1-6 .
Группа 15 Элементы
Содержит пять элементов, а именно азот (N), фосфор (P), мышьяк (As), сурьму (Sb) и висмут (Bi). Эта группа считается семейством азота .
Распространение
Молекулярный азот составляет около 78% по объему атмосферы Земли, он не очень распространен в земной коре. Поскольку нитраты хорошо растворимы в воде, они не распространены в земной коре. . Единственными крупными нитратными минералами являются NaNO 9.0067 3 и KNO 3
Азот также является важным компонентом белков, аминокислот и нуклеиновых кислот растений и животных. Непрерывный обмен азотом между атмосферой и биосферой называется азотным циклом .
Непрерывный обмен азотом между атмосферой и биосферой называется азотным циклом .
Фосфор — одиннадцатый элемент по распространенности в кристаллических горных породах Земли. Все его известные минералы представляют собой ортофосфатов.
Обычные минералы фосфора:
(I) Фосфорит CA 3 (PO 4 ) 2
(II) FluorApatite CA 5 (PO 4 (II) FluorApatite CA 5 (PO 4 (III) Chlorapatite CA 5 (PO 4 ) 3 CL OR 3CA 3 (PO
(iv) Гидроксиапатит: Ca 5 (PO 4 ) 3 OH or 3Ca 3 (PO 4 ) 2 .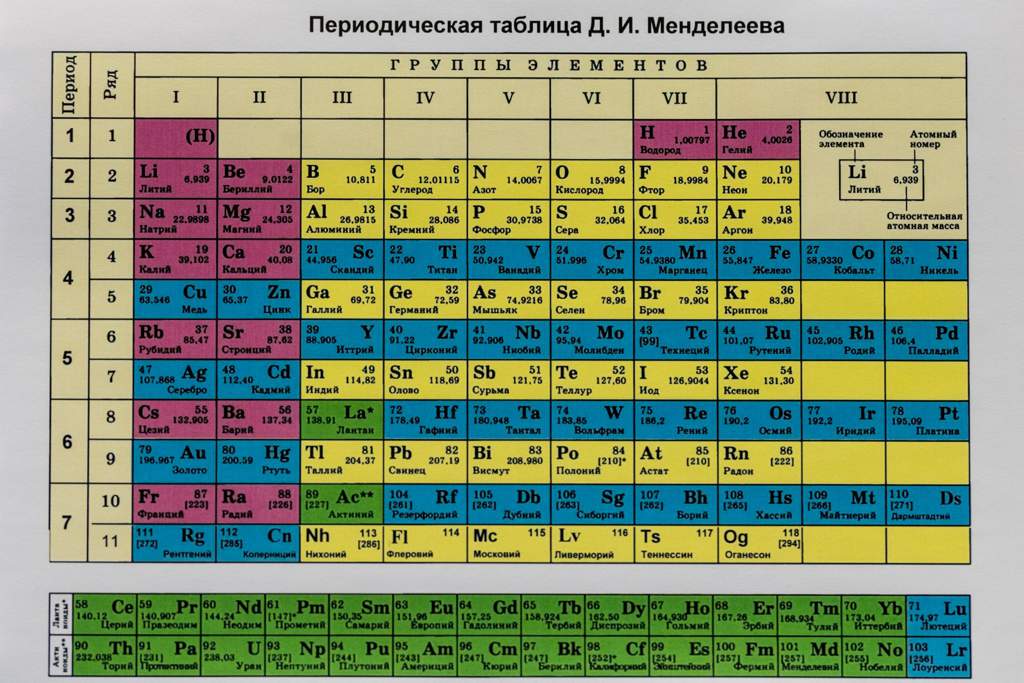 Ca(OH) 2
Ca(OH) 2
Phosphorus is essential for life, both as a структурный материал животных и растений. Он присутствует в костях, а также в живых клетках. Около 60% костей и зубов составляют CA 3 (PO 4 ) 2 или [3 {CA 3 (PO 4 } 2 .CAF 2 ]. встречается в нуклеиновых кислотах (ДНК и РНК), которые контролируют наследственные эффекты у людей. Фосфор также содержится в АТФ (аденозинтрифосфат и АДФ (аденозиндифосфат)).
Элементы мышьяк, сурьма и висмут не очень распространены. Их получают как побочные продукты металлургии при обжиге сульфидных руд.
Общие характеристики групп 15 Элементов
Электронные конфигурации
9000 2 9002
9000 2 9000 2 9002.
 и три в подоболочке p.
и три в подоболочке p.Общая электронная конфигурация этой группы может быть выражена как ns 2 np 3 .
Атомные и физические свойства
(1) Атомные и ионные радиусы: Атомные и ионные радиусы элементов группы 15 меньше, чем атомные радиусы соответствующих элементов группы 14.
При движении вниз по группе атомные радиусы увеличиваются с увеличением атомного номера.
Объяснение: Заряд ядра у элементов 15-й группы больше, чем у элементов 14-й группы. Из-за повышенного заряда ядра электроны сильно притягиваются к ядру и, следовательно, атомные радиусы уменьшаются. Таким образом, атомные радиусы элементов 15-й группы меньше, чем у элементов 14-й группы. элемент.
Однако от As к Bi наблюдается лишь небольшое увеличение ковалентного радиуса. Это связано с наличием полностью заполненных d- и/или f-орбиталей в более тяжелых членах.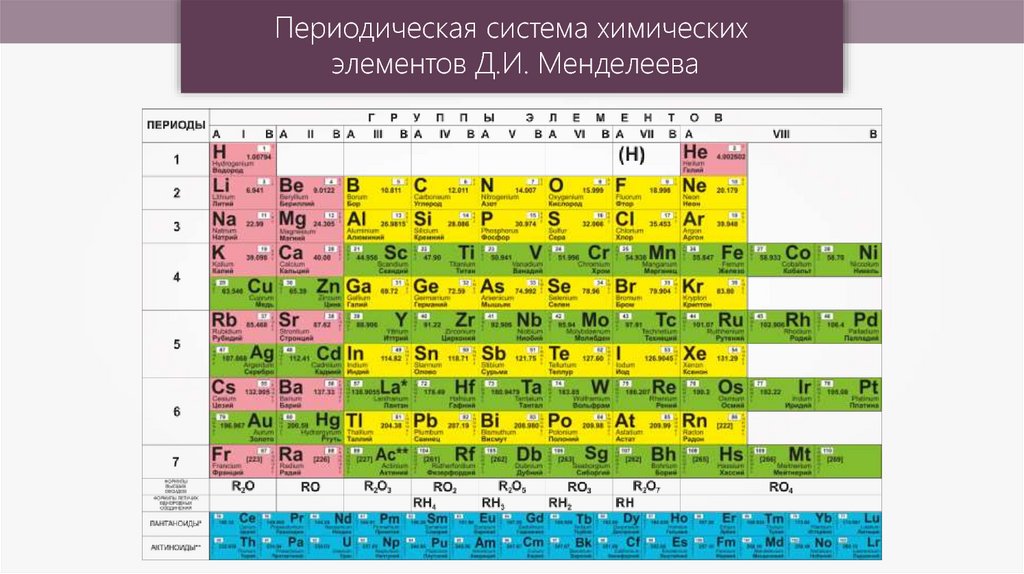
(2) энтальпии ионизации: Первые энтальпии ионизации элементов 15-й группы выше, чем у соответствующих элементов 14-й группы.
При движении по вниз по группе энтальпии ионизации уменьшаются.
Пояснение: Большая энтальпия ионизации обусловлена большим ядерным зарядом, малым размером и стабильной конфигурацией атомов элементов 15 группы.
Электронная конфигурация атомов группы 15 заполнена наполовину, np x 1 , np y 2 np z 1 и стабильны. Поэтому они имеют высокие энтальпии ионизации.
Уменьшение энтальпии ионизации по мере продвижения вниз по группе связано с увеличением размера атомов и эффектом экранирования, которые перевешивают эффект увеличения заряда ядра.
(3) Электроотрицательность: Значения электроотрицательности элементов 15-й группы выше, чем у соответствующих элементов 14-й группы.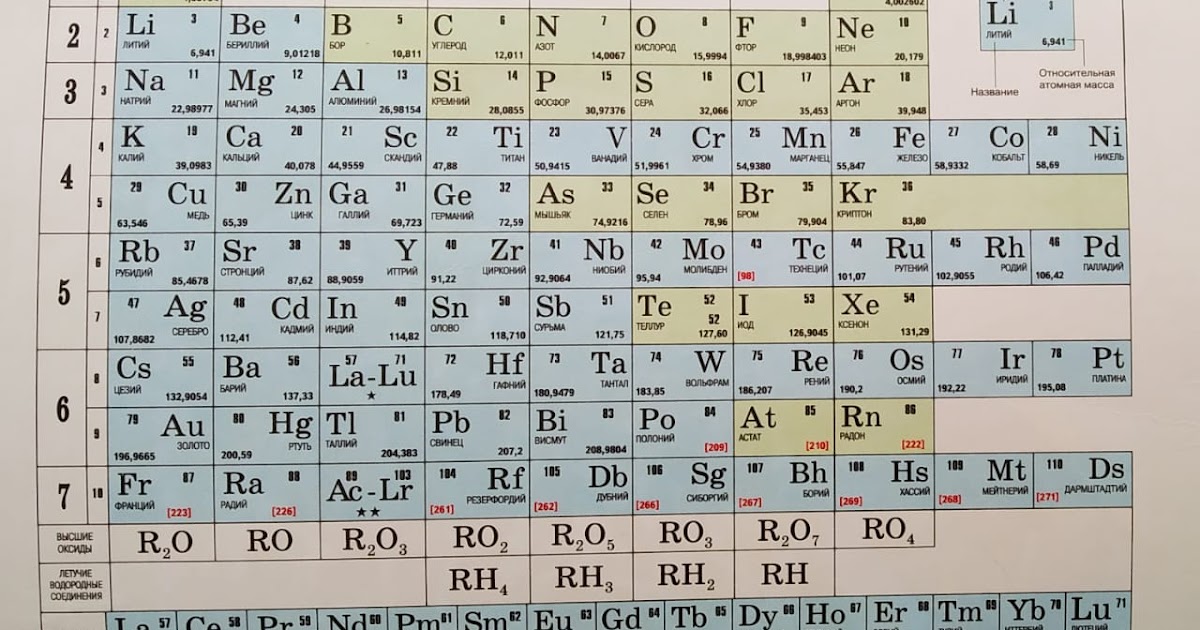
Пояснение: Элементы 15 группы имеют меньший размер и больший ядерный заряд атомов и поэтому имеют более высокие значения электроотрицательности.
Уменьшение электроотрицательности при движении вниз по группе связано с увеличением размеров атомов и экранирующим действием внутренних электронных оболочек при движении вниз по группе.
(4) Металлический характер: Элементы группы 15 менее металлические. Однако при спуске по группе металлический характер возрастает от N до Bi. Например: N и P — неметаллы, As и Sb — частично неметаллы, а Bi — металл.
Пояснение: Из-за повышенного заряда ядра и более высокой электроотрицательности элементы 15-й группы менее металличны, чем соответствующие элементы 14-й группы. количество промежуточных электронов увеличивается. В результате энтальпия ионизации уменьшается и, следовательно, металлический характер увеличивается вниз по группе.
(5) Точки плавления и кипения: Точки плавления элементов группы 15 сначала увеличиваются от азота до мышьяка, а затем понижаются до сурьмы и висмута. Однако температуры кипения регулярно повышаются при переходе от азота к висмуту.
Однако температуры кипения регулярно повышаются при переходе от азота к висмуту.
Объяснение: Температуры плавления увеличиваются вниз по группе из-за увеличения атомного размера Однако неожиданное снижение температур плавления Sb и Bi происходит из-за их тенденции к образованию трех ковалентных связей вместо пяти эффект инертной пары. В результате притяжение между их атомами слабое и, следовательно, их температуры плавления низкие. Из-за большого размера атомов Bi имеет еще более слабые межатомные силы, чем Sb, и, следовательно, имеет еще более низкую температуру плавления. Температуры кипения увеличиваются по группе от N до Bi из-за увеличения их атомного размера.
(6) Катетерация: Элементы группы 15 также проявляют тенденцию к образованию связей друг с другом (самосвязывание атомов), известное как катенация. Например: гидразин (H 2 NNH 2 ) имеет два связанных вместе атома N, азотистоводородная кислота (N 3 H) имеет три атома N, азид-ион, N 3 ¯ также имеет три атома N связаны вместе
Среди элементов 15-й группы фосфор имеет максимальную склонность к катетенации, образуя циклические соединения, а также соединения с открытой цепью, состоящие из многих атомов фосфора.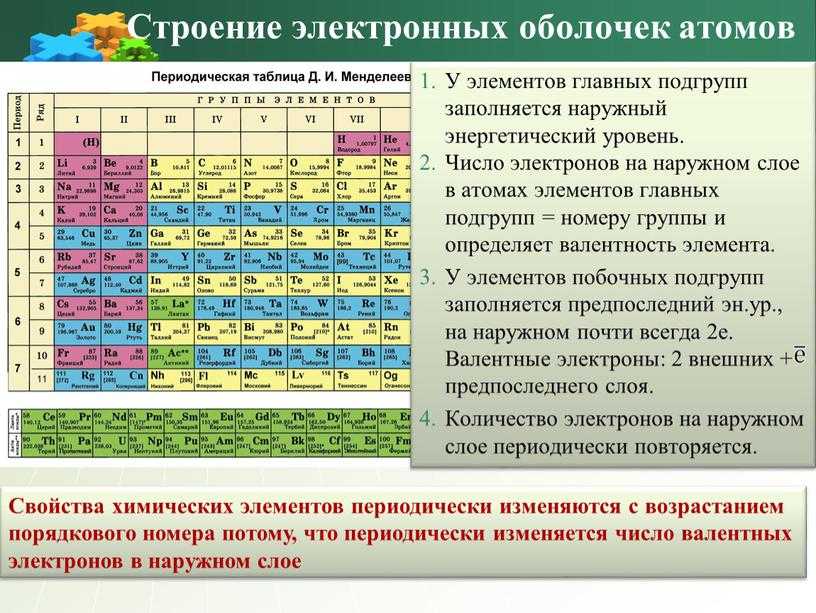
Меньшая склонность элементов группы 15 к проявлению катенации по сравнению с углеродом обусловлена их низкой (М-М) энтальпией диссоциации связи.
(7) Аллотропия: За исключением азота и висмута, все другие элементы этой группы проявляют аллотропию.
Например:
а) фосфор существует в виде белого, черного или красного фосфора.
b) мышьяк существует в виде желтого или серого мышьяка
c) сурьма существует в виде желтой или серебристо-серой аллотропной формы.
Степени окисления
Элементы группы 15 имеют пять электронов на валентной оболочке. Они проявляют различные степени окисления от -3 до +5.
(i) Отрицательные степени окисления
Эти элементы имеют пять электронов на валентной оболочке (ns 2 np 3 ) . Но присоединение трех электронов энергетически невыгодно, поскольку для присоединения трех электронов и образования M 9 требуется очень большое количество энергии. 0041 3- ионы.
0041 3- ионы.
(1) Азот, будучи наименьшим и наиболее электроотрицательным элементом группы, образует ион N 3 – (нитрид) и проявляет степень окисления 3 в нитридах некоторых высокоэлектроположительных металлов, таких как Mg 3 N 2 , Ca 3 N 2 и др.
(2) Остальные элементы этой группы образуют ковалентные соединения даже с металлами и проявляют с металлами степень окисления -3. Например: фосфид кальция (Ca 3 P 2 ), арсенид натрия (Na 3 As), антимонид цинка (Zn 3 Sb 2 ), висмутид магния (Mg 3 Bi7 2 9).
(3) Склонность элементов проявлять степень окисления -3 уменьшается при переходе от P к Bi из-за увеличения размера и металлического характера. Последний член группы, Bi, почти не образует соединений в степени окисления -3.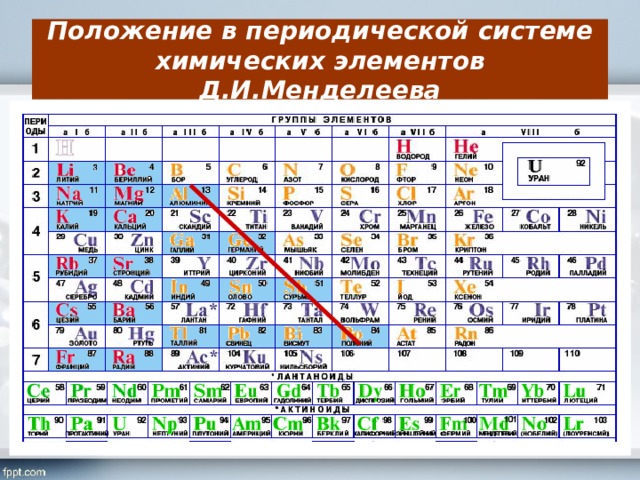
(4) В дополнение к степени окисления -3, N и P показывают степени окисления -2 в гидразине (NH 2 NH 2 ) и дифосфин (P 2 H 4 ) соответственно.
Азот также имеет степень окисления -1 в гидроксиламине (NH 2 OH), а P нет.
(ii) Положительные степени окисления
(1) Все элементы группы 15 имеют положительные степени окисления +3 и +5. Однако при движении вниз по группе стабильность степени окисления +5 снижается, а степень окисления +3 увеличивается из-за эффекта инертной пары.
Из-за энергетических соображений эти элементы не могут потерять все пять валентных электронов. Поэтому они не образуют ионов M 5+ и все соединения элементов группы 15, имеющие степень окисления +5 (т.е. PF 5 , PCl 5 , SbF 5 , BiF 5 ), по существу являются ковалентные соединения.
(2) Азот не образует соединений в степени окисления +5, таких как NF 5 , NCl 5 и т. д., поскольку он не имеет в своей валентной оболочке вакантных d-орбиталей, которые могут расширить его октет. Стабильность высшей степени окисления (+5) снижается вниз по группе. Степень окисления +5 у Bi менее стабильна, чем у Sb. Это связано с эффектом инертной пары.
(3) Элементы группы 15 образуют оба ковалента (например, NCL 3 , PCL 3 , ASCL 3 , SBCL 3 ) и Ionic Compounds (E.G., BIF 3 ) и Ionic Compounds (E.G., BIF 3 ) и Ionic Compounds (E.G., BIF 3 ) и Ionic Compounds (E.G., BIF 3 ) и Ionic Compounds (E.G., BIF 3 ) и Ionic Compounds (E.G., BIF 3 ). , SbF 3 ) в степени окисления +3. Степень окисления +3 становится все более и более стабильной при движении вниз по группе.
(4) Азот и фосфор также проявляют степень окисления +4 из-за способности одной неподеленной пары на NH 3 и PH 3 для образования дательных связей с кислотами Льюиса. Однако азот может существовать в различных степенях окисления от -3 до +5 в своих гидридах, оксидах и оксокислотах.
(5) Фосфор также проявляет степени окисления +1 и +4 в некоторых оксокислотах. В азоте все степени окисления от +1 до +4 имеют тенденцию к непропорциональности в кислом растворе. В P почти все промежуточные степени окисления диспропорционируют на +5 и -3 как в кислых, так и в щелочных растворах.
(6) Максимальная ковалентность азота ограничена четырьмя, поскольку он не имеет вакантных d-орбиталей в своей внешней валентной оболочке (n = 2). Следовательно, для связывания доступны только четыре (одна 2s и три 2p) орбитали, и он не может расширить свою валентность за пределы четырех. По этой причине азот не образует пентагалогениды, такие как NF 5 или NCl 5 . С другой стороны, фосфор и все другие элементы имеют вакантные d-орбитали в своих валентных оболочках и могут использовать все свои валентные орбитали, чтобы продемонстрировать ковалентность пять или шесть, например, PF 5 , PCL 5 , ASF 5 , PF 6 ¯, [SBF 6 ] ‾ и т. Д.
По этой причине азот не образует пентагалогениды, такие как NF 5 или NCl 5 . С другой стороны, фосфор и все другие элементы имеют вакантные d-орбитали в своих валентных оболочках и могут использовать все свои валентные орбитали, чтобы продемонстрировать ковалентность пять или шесть, например, PF 5 , PCL 5 , ASF 5 , PF 6 ¯, [SBF 6 ] ‾ и т. Д.
Atomic № 15 Факты элементов
Эта запись была опубликована на 69
. Эта запись была опубликована на 69
. Энн Хельменстин (обновлено )
Зеленое свечение излучается фосфором, атомный номер 15, в присутствии кислорода, атомный номер 8. Люк Виатур, Creative Commons License
Фосфор — это элемент, который атомный номер 15 в периодической таблице. Фосфор является элементом, который необходим для жизни человека и содержится во многих повседневных продуктах.
Атомный номер 15 Факты об элементе
- Символ элемента 15 — P.
- Этот элемент был открыт алхимиком Хеннигом Брандом, который искал другой элемент, золото. Изначально фосфор выделяли из мочи человека. Метод включает сбор большого объема мочи, выпаривание воды, нагревание остатка, а также сбор и конденсацию паров, богатых фосфором.
- Фосфор является химически активным элементом, который содержится в химических соединениях. В природе в чистом виде не встречается.
- Название «фосфор» происходит от греческого слова «фосфорос», что означает «несущий свет». Название связано с тем, как белый фосфор светится зеленым на воздухе. Слово фосфоресценция происходит от названия элемента, хотя фосфор излучает свет в результате хемилюминесценции и , а не фосфоресценции!
- Фосфор является твердым веществом при комнатной температуре и давлении. Однако он может принимать одну из четырех форм или аллотропов: красный, белый, желтый и черный/фиолетовый.
 Эти формы имеют разные характеристики. Черный фосфор является наименее реакционноспособным аллотропом. Эта форма элемента 15 напоминает графит, используемый в карандашах. Белый фосфор самопроизвольно окисляется на воздухе, заставляя его светиться зеленым цветом. Белый фосфор также чрезвычайно токсичен. Красный фосфор используется в бойках современных безопасных спичек. «Безопасность» заключается в том, что эти спички не загораются самопроизвольно, плюс они значительно менее ядовиты, чем спички старого типа, в которых использовался белый фосфор. Однако красный фосфор самопроизвольно превращается в белый фосфор при нагревании, поэтому боек спичек не является категорически безопасным. Один интересный проект, который вы можете сделать (желательно в перчатках), состоит в том, чтобы очистить фосфор от зажигалок спичек, чтобы светящийся дым исходил из ваших пальцев.
Эти формы имеют разные характеристики. Черный фосфор является наименее реакционноспособным аллотропом. Эта форма элемента 15 напоминает графит, используемый в карандашах. Белый фосфор самопроизвольно окисляется на воздухе, заставляя его светиться зеленым цветом. Белый фосфор также чрезвычайно токсичен. Красный фосфор используется в бойках современных безопасных спичек. «Безопасность» заключается в том, что эти спички не загораются самопроизвольно, плюс они значительно менее ядовиты, чем спички старого типа, в которых использовался белый фосфор. Однако красный фосфор самопроизвольно превращается в белый фосфор при нагревании, поэтому боек спичек не является категорически безопасным. Один интересный проект, который вы можете сделать (желательно в перчатках), состоит в том, чтобы очистить фосфор от зажигалок спичек, чтобы светящийся дым исходил из ваших пальцев. - Элемент 15 — неметалл. Фосфор часто кажется восковым или рассыпчатым. Это плохой проводник электричества, он не пластичен и не податлив.



 Эти формы имеют разные характеристики. Черный фосфор является наименее реакционноспособным аллотропом. Эта форма элемента 15 напоминает графит, используемый в карандашах. Белый фосфор самопроизвольно окисляется на воздухе, заставляя его светиться зеленым цветом. Белый фосфор также чрезвычайно токсичен. Красный фосфор используется в бойках современных безопасных спичек. «Безопасность» заключается в том, что эти спички не загораются самопроизвольно, плюс они значительно менее ядовиты, чем спички старого типа, в которых использовался белый фосфор. Однако красный фосфор самопроизвольно превращается в белый фосфор при нагревании, поэтому боек спичек не является категорически безопасным. Один интересный проект, который вы можете сделать (желательно в перчатках), состоит в том, чтобы очистить фосфор от зажигалок спичек, чтобы светящийся дым исходил из ваших пальцев.
Эти формы имеют разные характеристики. Черный фосфор является наименее реакционноспособным аллотропом. Эта форма элемента 15 напоминает графит, используемый в карандашах. Белый фосфор самопроизвольно окисляется на воздухе, заставляя его светиться зеленым цветом. Белый фосфор также чрезвычайно токсичен. Красный фосфор используется в бойках современных безопасных спичек. «Безопасность» заключается в том, что эти спички не загораются самопроизвольно, плюс они значительно менее ядовиты, чем спички старого типа, в которых использовался белый фосфор. Однако красный фосфор самопроизвольно превращается в белый фосфор при нагревании, поэтому боек спичек не является категорически безопасным. Один интересный проект, который вы можете сделать (желательно в перчатках), состоит в том, чтобы очистить фосфор от зажигалок спичек, чтобы светящийся дым исходил из ваших пальцев.