Записать электронные формулы элементов с порядковым номером 4,7,11,12,14,16,30,27,30. Дать характеристику элемента по его положению ПСХЭ.
1). Химический элемент с порядковым номером 4 – бериллий.
Ве находится во II периоде, II – А – группе. Порядковый номер 4. Атомная масса 9. Заряд ядра +4. Число протонов 4, электронов 4, нейтронов 5 (N = Ar – Z, 10 – 5 = 5).
Степень окисления +2, валентность II.
Ве – амфотерный элемент. Металлические свойства выражены сильнее , чем у бора, но слабее, чем у лития и магния.
Высший оксид бора имеет формулу ВеО – амфотерный оксид.
Высший гидроксид Ве(ОН)2 – амфотерный.
Летучего водородного соединения не имеет.
Схема расположения электронов по орбиталям : 1s 2 2s 2 .
2). Химический элемент с порядковым номером 7 – азот.
Азот находится во II периоде, V – А – группе. Порядковый номер 7. Атомная масса 14. Заряд ядра +7. Число протонов 7, электронов 7, нейтронов 7 (N = Ar – Z, 14 – 7 = 7).
Степень окисления +1 – +5, -3; высшая валентность V.
N – неметалл. Окислительные свойства выражены сильнее , чем у углерода, фосфора, но слабее, чем у кислорода .
Высший оксид бора имеет формулу ВеО – амфотерный оксид.
Высший гидроксид HNO3 – азотная кислота.
Летучее водородное соединение NH3 -аммиак .
Схема расположения электронов по орбиталям : 1s2 2s2 2p3.
3). Химический элемент с порядковым номером 11 – натрий.
Натрий находится во III периоде, I – А – группе. Порядковый номер 11. Атомная масса 23. Заряд ядра +11. Число протонов 11, электронов 11, нейтронов 12 (N = Ar – Z, 23 – 11 = 12).
Степень окисления +1; высшая валентность I.
Nа – металл. Металлические свойства выражены сильнее , чем магния, но слабее, чем у калия. Высший оксид натрия имеет формулу Na2О – основный оксид.
Высший гидроксид NaOH – основание.
Летучего водородного соединения не имеет.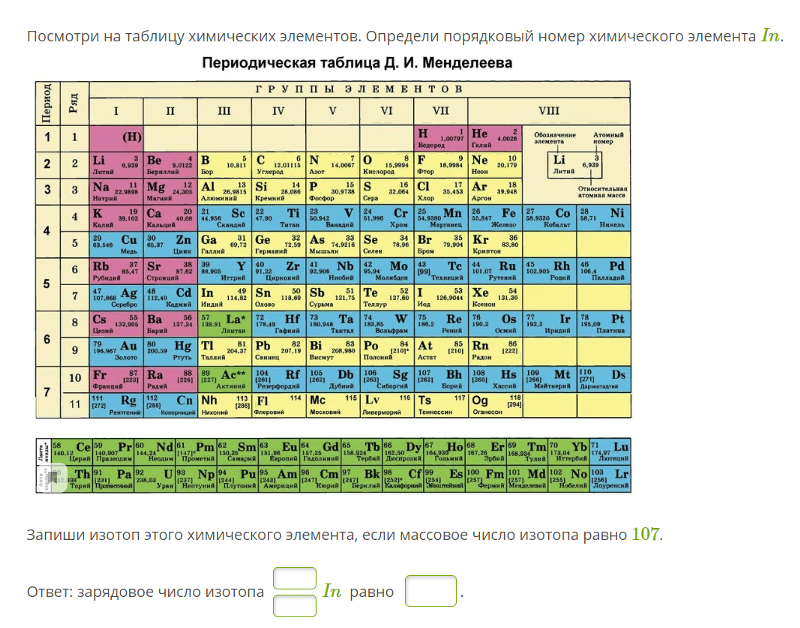
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s1.
4). Химический элемент с порядковым номером 12 – магний.
Магний находится во III периоде, II – А – группе. Порядковый номер 12. Атомная масса 24. Заряд ядра +12. Число протонов 12, электронов 12, нейтронов 12 (N = Ar – Z, 24 – 12 = 12).
Степень окисления +2; высшая валентность II.
Mg – металл. Металлические свойства выражены сильнее , чем у бериллия,алюминия, но слабее, чем у натрия, кальция .
Высший оксид магния имеет формулу Mg О – основный оксид.
Высший гидроксид Mg (OH)2 – основание.
Летучего водородного соединения не имеет.
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s2.
5). Химический элемент с порядковым номером 14 – кремний.
Кремний находится в III периоде, IV – А – группе. Порядковый номер 14. Атомная масса 28. Заряд ядра +14. Число протонов 14, электронов 14, нейтронов 14 (N = Ar – Z, 28 – 14 = 14).
Число протонов 14, электронов 14, нейтронов 14 (N = Ar – Z, 28 – 14 = 14).
Степень окисления +4 ; высшая валентность IV.
Si – неметалл. Окислительные свойства выражены сильнее , чем у алюминия, но слабее, чем у фосфора,углерода .
Высший оксид кремния имеет формулу SiО2 – кислотный оксид.
Высший гидроксид H2SiО3 – кремниевая кислота.
Летучее водородное соединение SiН4.
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s2 p2.
6). Химический элемент с порядковым номером 16 – cера.
Сера находится в III периоде, VI – А – группе. Порядковый номер 16. Атомная масса 32. Заряд ядра +1. Число протонов 16, электронов 16, нейтронов 16 (N = Ar – Z, 32 – 16 = 16).
Высшая степень окисления +6 ; высшая валентность VI.
S – неметалл. Окислительные свойства выражены сильнее , чем у фосфора, но слабее, чем у хлора, кислорода.
Высший оксид серы имеет формулу SО3 – кислотный оксид.
Высший гидроксид H2SО4 – серная кислота.
Летучее водородное соединение Н2S.
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s2 p6.
7). Химический элемент с порядковым номером 27 – кобальт.
Кобальт находится во IV периоде, VIII -B – группе. Порядковый номер 27. Атомная масса 59. Заряд ядра +27. Число протонов 27, электронов 27, нейтронов 32 (N = Ar – Z, 59 – 27 = 32).
Высшая степень окисления +2 ; +3 высшая валентность III .
Co – имеет слабо выраженные амфотерные свойства.
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s2 p6 3 d7 4 s2 .
8).Химический элемент с порядковым номером 30 – цинк.
Цинк находится во IV периоде, II – А – группе. Порядковый номер 30. Атомная масса 65. Заряд ядра +30. Число протонов 30, электронов 30, нейтронов 35 (N = Ar – Z, 65 – 30 = 35).
Атомная масса 65. Заряд ядра +30. Число протонов 30, электронов 30, нейтронов 35 (N = Ar – Z, 65 – 30 = 35).
Высшая степень окисления +2 ; высшая валентность II .
Zn – амфотерный элемент. Металлические свойства выражены сильнее , чем у меди, но слабее, чем у кальция.
Высший оксид цинка имеет формулу ZnО– амфотерный оксид.
Амфотерный гидроксид – Zn(ОН)2 .
Летучее водородное соединение не образует.
Схема расположения электронов по орбиталям : 1s2 2s2 2p6 3s2 p6 d10 4 s2 .
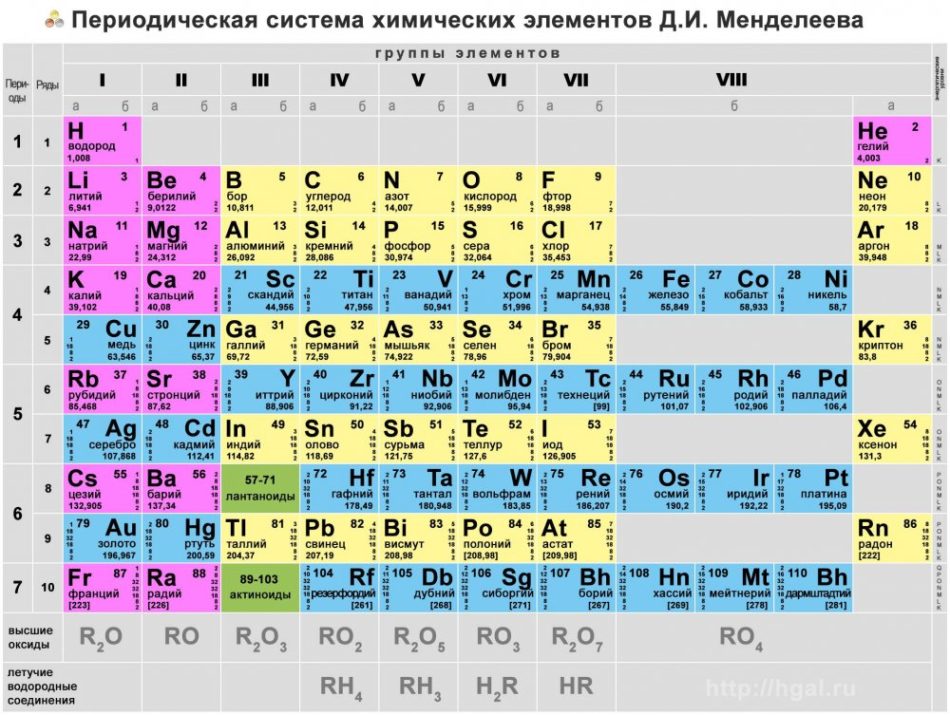
Физические и химические свойства серы. Оксиды серы
Билет № 16
1. Сера: положение этого химического элемента в периодической системе, строение его атома. Физические и химические свойства серы. Оксиды серы, их химические свойства
Положение в периодической системе: сера находится в 3 периоде, VI группе, главной (А) подгруппе.
Атомный номер серы 16, следовательно, заряд ядра атома серы равен +16, число электронов 16. Три электронных уровня (равно периоду), на внешнем уровне 6 электронов (равно номеру группы для главных подгрупп).
Три электронных уровня (равно периоду), на внешнем уровне 6 электронов (равно номеру группы для главных подгрупп).
Схема расположения электронов по уровням:
16S ) ) )
2 8 6
Ядро атома серы 32S содержит 16 протонов (равно заряду ядра) и 16 нейтронов (атомная масса минус число протонов: 32 − 16 = 16).
Сера как простое вещество образует аллотропные модификации: кристаллическая сера и пластическая.
Кристаллическая сера — твердое вещество желтого цвета, хрупкое, легкоплавкое (температура плавления 112° С), нерастворима в воде. Сера и многие руды, содержащие серу, не смачиваются водой. Поэтому порошок серы может плавать на поверхности, хотя сера тяжелее воды (плотность 2 г/см
На этом основан метод обогащения руд под названием флотация: измельченная руда погружается в емкость с водой, через которую продувается воздух. Частички полезной руды подхватываются пузырьками воздуха и выносятся наверх, а пустая порода (например, песок) оседает на дно.
Пластическая сера темного цвета и способна растягиваться, как резина.
Это отличие в свойствах связано со строением молекул: кристаллическая сера состоит из кольцевых молекул, содержащих 8 атомов серы, а в пластической сере атомы соединены в длинные цепи. Пластическую серу можно получить, если нагреть серу до кипения и вылить в холодную воду.
В уравнениях для простоты записывают серу без указания числа атомов в молекуле: S.
Химические свойства:
- В реакциях с восстановителями: металлами, водородом, — сера проявляет себя как окислитель (степень окисления −2,валентность II). При нагревании порошков серы и железа образуется сульфид железа:
Fe + S = FeS
Со ртутью, натрием порошок серы реагирует при комнатной температуре:
Hg + S = HgS - При пропускании водорода через расплавленную серу образуется сероводород:
H2 + S = H2S - В реакциях с сильными окислителями сера окисляется.

S + O2 = SO2
Оксид серы (IV) — кислотный оксид. Реагирует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
Эта реакция происходит в атмосфере при сжигании каменного угля, который обычно содержит примеси серы. В результате выпадают кислотные дожди, поэтому очень важно подвергать очистке дымовые газы котельных.
2SO2 + O2 2SO3 (реакция обратима)
Оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO3 + H2O = H2SO4
SO3 — бесцветная жидкость, кристаллизуется при 17° С, переходит в газообразное состояние при 45° С
2. Опыт. Проведение реакций, подтверждающих свойства гидроксида кальция.
- Гидроксид кальция (гашеная известь) — малорастворимое вещество.
 Взбалтываем немного извести в 2 мл воды (около 2 см по высоте пробирки), даем постоять несколько минут. Большая часть извести не растворится, осядет на дно.
Взбалтываем немного извести в 2 мл воды (около 2 см по высоте пробирки), даем постоять несколько минут. Большая часть извести не растворится, осядет на дно. - Сливаем раствор, фильтруем (если нет фильтра, ждем пока отстоится). Прозрачный раствор гидроксида кальция называется известковой водой. Делим на 2 пробирки. В одну капаем индикатор фенолфталеин (ф-ф), он окрашивается в малиновый цвет, что доказывает осно́вные свойства извести:
Ca(OH)2 Ca2+ + 2OH− - Во вторую пробирку пропускаем углекислый газ, известковая вода мутнеет в результате образования нерастворимого карбоната кальция (это качественная реакция для обнаружения углекислого газа):
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Если придется делать эти реакции на практике, углекислый газ можно получить в пробирке с газоотводной трубкой, добавив соляную или азотную кислоту в мел или соду.
Можно несколько раз пропустить выдыхаемый воздух через трубочку от коктейля или сока, принесенную с собой. Не стоит шокировать комиссию — дуть в трубку из лабораторного оборудования — в кабинете химии ничего нельзя пробовать на вкус!
Не стоит шокировать комиссию — дуть в трубку из лабораторного оборудования — в кабинете химии ничего нельзя пробовать на вкус!
автор: Владимир Соколов
Кислородный групповой элемент | группа химических элементов
таблица Менделеева
Просмотреть все СМИ
- Похожие темы:
- сера кислород селен теллур полоний
См. все связанные материалы →
элемент кислородной группы , также называемый халькоген , любой из шести химических элементов, составляющих группу 16 (VIa) периодической классификации, а именно кислород (O), сера (S), селен (Se), теллур (Te), полоний (Po) и ливерморий (Lv). Родство между первыми тремя членами группы было признано еще в 1829 году.; теллур занял свое место к 1865 г., а полоний был открыт в 1898 г. В 2000 г. российские и американские физики создали ливерморий, шестой член группы 16, на ускорителе частиц.
Оценки пропорций различных видов атомов во Вселенной ставят кислород на четвертое место по распространенности после водорода, гелия и неона, но важность такого ранжирования невелика, поскольку атомы водорода составляют почти 94 процента от общего количества атомов.
Кислород представлен химическим символом O. В воздухе кислород существует в основном в виде молекул, каждая из которых состоит из двух атомов (O 2 ), хотя небольшое количество озона (O 3 ), в котором три атома кислород составляют каждую молекулу, присутствуют в атмосфере. Кислород представляет собой бесцветный газ без запаха и вкуса, необходимый для живых организмов, который поглощается животными и превращает его в углекислый газ; растения, в свою очередь, используют углекислый газ в качестве источника углерода и возвращают кислород в атмосферу.
По распространенности в космосе сера занимает девятое место среди элементов, составляя только один атом из каждых 20 000–30 000. Сера встречается в несвязанном состоянии, а также в сочетании с другими элементами в широко распространенных горных породах и минералах, хотя и относится к второстепенным компонентам земной коры, в которых ее доля оценивается в пределах от 0,03 до 0,06%. На основании того, что некоторые метеориты содержат около 12 процентов серы, было высказано предположение, что более глубокие слои Земли содержат гораздо большую долю. Морская вода содержит около 0,09процентов серы в виде сульфата. Наиболее важным источником являются подземные месторождения очень чистой серы, присутствующие в куполообразных геологических структурах, где считается, что сера образовалась в результате воздействия бактерий на минеральный ангидрит, в котором сера соединяется с кислородом и кальцием.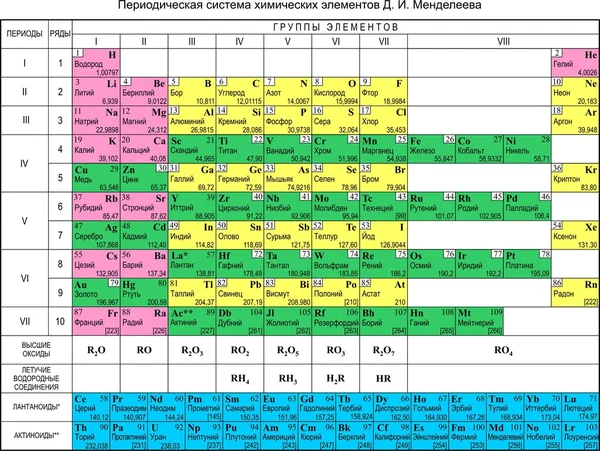
Britannica Quiz
Периодическая таблица элементов
Сера существует в обычных условиях в виде бледно-желтого кристаллического неметаллического твердого вещества; он не имеет запаха и вкуса, горюч и нерастворим в воде. Его химический символ S. Он реагирует со всеми металлами, кроме золота и платины, образуя сульфиды; он также образует соединения с некоторыми неметаллическими элементами. Ежегодно производится несколько миллионов тонн серы, в основном для производства серной кислоты, которая широко используется в промышленности.
Элемент селен (символ Se) встречается намного реже, чем кислород или сера, и составляет примерно 90 частей на миллиард в земной коре. Иногда он встречается в несвязанном виде вместе с самородной серой, но чаще встречается в сочетании с тяжелыми металлами (такими как медь, ртуть, свинец или серебро) в некоторых минералах. Основным коммерческим источником селена является побочный продукт рафинирования меди; его основные области применения – производство электронного оборудования, пигментов и стекла. Серая металлическая форма элемента наиболее устойчива в обычных условиях; эта форма обладает необычным свойством значительно увеличивать электропроводность при воздействии света. Соединения селена токсичны для животных; растения, выращенные на селенсодержащих почвах, могут концентрировать элемент и стать ядовитыми.
Основным коммерческим источником селена является побочный продукт рафинирования меди; его основные области применения – производство электронного оборудования, пигментов и стекла. Серая металлическая форма элемента наиболее устойчива в обычных условиях; эта форма обладает необычным свойством значительно увеличивать электропроводность при воздействии света. Соединения селена токсичны для животных; растения, выращенные на селенсодержащих почвах, могут концентрировать элемент и стать ядовитыми.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Теллур — серебристо-белый элемент (символ Те) со свойствами, промежуточными между металлами и неметаллами; он составляет примерно одну часть на миллиард земной коры. Подобно селену, он реже встречается в несвязанном виде, чем в виде соединений таких металлов, как медь, свинец, серебро или золото, и получается главным образом как побочный продукт рафинирования меди или свинца. Большого применения теллуру не нашли.
Полоний (символ Po) — чрезвычайно редкий радиоактивный элемент, обнаруженный в минералах, содержащих уран. Он имеет некоторые научные применения в качестве источника альфа-излучения.
Группа 16: Общие свойства и реакции
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31734
Семейство кислорода, также называемое халькогенами, состоит из элементов, находящихся в группе 16 периодической таблицы, и считается одним из основных элементов группы. Он состоит из элементов кислорода, серы, селена, теллура и полония. Они встречаются в природе как в свободном, так и в связанном состоянии. Элементы группы 16 тесно связаны с жизнью. Мы нуждаемся в кислороде все время на протяжении всей нашей жизни. Знаете ли вы, что сера также является одним из основных элементов жизни? Он отвечает за некоторые белковые структуры во всех живых организмах. Многие отрасли промышленности используют серу, но выброс соединений серы часто рассматривается скорее как проблема, чем как природное явление. Металлические свойства увеличиваются с увеличением атомного номера. Элемент полоний не имеет стабильных изотопов, а изотоп с массовым числом 209имеет самый длинный период полураспада 103 лет.
Знаете ли вы, что сера также является одним из основных элементов жизни? Он отвечает за некоторые белковые структуры во всех живых организмах. Многие отрасли промышленности используют серу, но выброс соединений серы часто рассматривается скорее как проблема, чем как природное явление. Металлические свойства увеличиваются с увеличением атомного номера. Элемент полоний не имеет стабильных изотопов, а изотоп с массовым числом 209имеет самый длинный период полураспада 103 лет.
Свойства и периодические тенденции
Свойства кислорода сильно отличаются от свойств других элементов группы, но все они имеют 2 электрона на внешней s-орбитали и 4 электрона на p-орбитали, обычно обозначаемые как s 2 p 4
Электронные конфигурации для каждого элемента приведены ниже:
- Кислород : 1s 2 2s 2 2p 4
- Сера : 1s 2 2s 2 p 6 3s 2 p 4
- Selenium : 1S 2 2S 2 P 6 3S 2 P 6 D 10 4S 2 P 4
- Tellurium : 1s 2 2s 2 p 6 3s 2 p 6 d 10 4s 2 p 6 d 10 5s 2 p 4
- Polonium : 1S 2 2S 2 P 6 3S 2 P 6 D 10 4S 2 P 6 D 4S 2 P 6 D 2 2 2 .
 6 д 10 6s 2 р 4
6 д 10 6s 2 р 4
Пример \(\PageIndex{1}\): Полоний
Полоний можно записать как [Xe] 6s 2 4f 14 5d 10 6p 4
3 Тенденции их свойств в этой группе интересны. Знание тренда позволяет нам предсказывать их реакции с другими элементами. Большинство тенденций верны для всех групп элементов, а групповые тенденции в основном связаны с размером атомов и количеством электронов на атом. Тенденции описаны ниже:
- Металлические свойства увеличиваются в порядке кислорода, серы, селена, теллура или полония. Полоний по сути является металлом. Его открыла М. Кюри, назвавшая его в честь своей родины Польши.
- Электроотрицательность, энергия ионизации (или потенциал ионизации IP) и сродство к электрону уменьшаются для группы по мере увеличения атомного веса.
- Увеличиваются атомные радиусы и температура плавления.
- Кислород отличается от серы химическими свойствами из-за своего небольшого размера.
 Различий между \(\ce{O}\) и \(\ce{S}\) больше, чем различий между другими элементами.
Различий между \(\ce{O}\) и \(\ce{S}\) больше, чем различий между другими элементами.
Металлический характер увеличивается вниз по группе, при этом теллур классифицируется как металлоид, а полоний — как металл. Температура плавления, точка кипения, плотность, атомный радиус и ионный радиус увеличиваются вниз по группе. Энергия ионизации уменьшается вниз по группе. Наиболее распространенная степень окисления -2; однако сера также может существовать в состояниях +4 и +6, а степени окисления +2, +4 и +6 возможны для Se, Te и Po.
| Кислород | Сера | Селен | Теллур | Полоний | |
|---|---|---|---|---|---|
| Температура кипения (°C) | -182,962 | 444,674 | 685 | 989,9 | 962 |
| Энергия ионизации (кДж/моль) | 1314 | 1000 | 941 | 869 | 812 |
| Ионный радиус (пм) | 140 | 184 | 198 | 221 |
Кислород
Кислород представляет собой газ при комнатной температуре и давлении 1 атм, бесцветный, без запаха и вкуса. Это самый распространенный элемент по массе как в земной коре, так и в организме человека. Он уступает азоту как самый распространенный элемент в атмосфере. Существует множество коммерческих применений газообразного кислорода, который обычно получают путем фракционной перегонки. Он используется в производстве железа, стали и других химических веществ. Он также используется при очистке воды, в качестве окислителя в ракетном топливе, в медицинских целях и при переработке нефти.
Это самый распространенный элемент по массе как в земной коре, так и в организме человека. Он уступает азоту как самый распространенный элемент в атмосфере. Существует множество коммерческих применений газообразного кислорода, который обычно получают путем фракционной перегонки. Он используется в производстве железа, стали и других химических веществ. Он также используется при очистке воды, в качестве окислителя в ракетном топливе, в медицинских целях и при переработке нефти.
Кислород имеет два аллотропа, O 2 и O 3 . В общем, O 2 (или дикислород) — это форма, на которую ссылаются, когда говорят об элементарной или молекулярной форме, потому что это наиболее распространенная форма элемента. Связь O 2 очень прочная, и кислород также может образовывать прочные связи с другими элементами. Однако соединения, содержащие кислород, считаются более термодинамически стабильными, чем O 2 .
Последний аллотроп, озон, представляет собой бледно-голубой ядовитый газ с сильным запахом.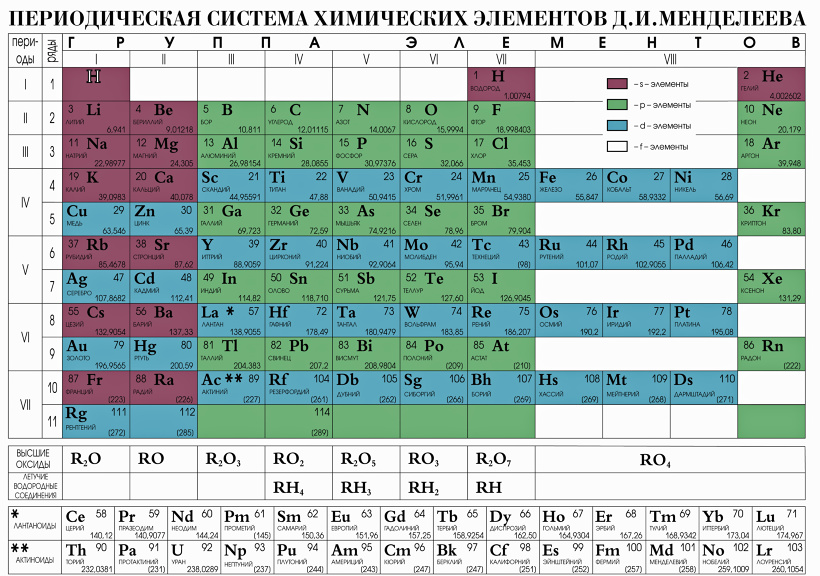 Это очень хороший окислитель, более сильный, чем молекулярный кислород, и его можно использовать вместо хлора при очистке питьевой воды, не придавая воде странного вкуса. Однако из-за своей нестабильной природы он исчезает и оставляет воду незащищенной от бактерий. Озон на очень больших высотах в атмосфере отвечает за защиту поверхности Земли от ультрафиолетового излучения; однако на более низких высотах он становится основным компонентом смога.
Это очень хороший окислитель, более сильный, чем молекулярный кислород, и его можно использовать вместо хлора при очистке питьевой воды, не придавая воде странного вкуса. Однако из-за своей нестабильной природы он исчезает и оставляет воду незащищенной от бактерий. Озон на очень больших высотах в атмосфере отвечает за защиту поверхности Земли от ультрафиолетового излучения; однако на более низких высотах он становится основным компонентом смога.
Первичные степени окисления кислорода -2, -1, 0 и -1/2 (в O 2 – ), но -2 является наиболее распространенным. Обычно соединения с кислородом в этой степени окисления называются оксидами . Когда кислород реагирует с металлами, он образует оксиды, которые в основном имеют ионную природу. Они могут растворяться в воде и реагировать с образованием гидроксидов; поэтому их называют основными ангидридами или основными оксидами . Оксиды неметаллов, образующие ковалентные связи, представляют собой простые молекулы с низкими температурами плавления и кипения.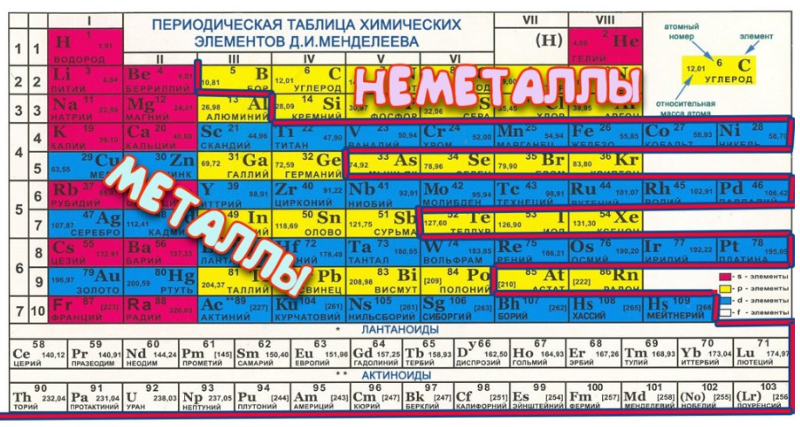 9-\), соединение называется супероксидом .
9-\), соединение называется супероксидом .
Кислород редко является центральным атомом в структуре и никогда не может связываться более чем с 4 элементами из-за его небольшого размера и неспособности создавать расширенную валентную оболочку. Кислород реагирует с водородом с образованием воды, которая сильно связана водородными связями, имеет большой дипольный момент и считается универсальным растворителем.
Существует большое разнообразие кислородсодержащих соединений, как органических, так и неорганических: оксиды, пероксиды и супероксиды, спирты, фенолы, простые эфиры и карбонилсодержащие соединения, такие как альдегиды, кетоны, сложные эфиры, амиды, карбонаты, карбаматы, карбоновые кислоты. кислоты и ангидриды.
Сера
Сера является твердым веществом при комнатной температуре и давлении 1 атм. Обычно он желтый, безвкусный и почти без запаха. Это шестнадцатый по распространенности элемент в земной коре. Он существует в природе в различных формах, включая элементарную серу, сульфиды, сульфаты и сероорганические соединения. С 1890-х годов сера добывается с использованием процесса Фраша, который полезен для извлечения серы из месторождений, находящихся под водой или в зыбучих песках. Сера, полученная в результате этого процесса, используется различными способами, в том числе для вулканизации каучука и в качестве фунгицида для защиты винограда и клубники.
С 1890-х годов сера добывается с использованием процесса Фраша, который полезен для извлечения серы из месторождений, находящихся под водой или в зыбучих песках. Сера, полученная в результате этого процесса, используется различными способами, в том числе для вулканизации каучука и в качестве фунгицида для защиты винограда и клубники.
Сера уникальна своей способностью образовывать широкий спектр аллотропов, больше, чем любой другой элемент в периодической таблице. Наиболее распространенным состоянием является твердое кольцо S 8 , так как это наиболее термодинамически стабильная форма при комнатной температуре. Сера существует в газообразной форме в пяти различных формах (S, S 2 , S 4 , S 6 и S 8 ). Для превращения серы между этими соединениями необходимо подвод достаточного количества тепла.
Двумя распространенными оксидами серы являются диоксид серы (SO 2 ) и триоксид серы (SO 3 ). Двуокись серы образуется при сгорании серы на воздухе с образованием ядовитого газа с сильным запахом. Эти два соединения используются в производстве серной кислоты, которая используется в различных реакциях. Серная кислота является одним из ведущих химических веществ, производимых в Соединенных Штатах, и в основном используется в производстве удобрений.
Эти два соединения используются в производстве серной кислоты, которая используется в различных реакциях. Серная кислота является одним из ведущих химических веществ, производимых в Соединенных Штатах, и в основном используется в производстве удобрений.
Сера также имеет широкий диапазон степеней окисления со значениями от -2 до +6. Он часто является центральным ионом в соединении и может легко связываться с 6 атомами. В присутствии водорода образует соединение сероводорода H 2 S, ядовитый газ, неспособный к образованию водородных связей и с очень малым дипольным моментом. Сероводород легко распознать по сильному запаху, похожему на запах тухлых яиц, но этот запах можно обнаружить только при низких, нетоксичных концентрациях. Эта реакция с водородом показывает, насколько по-разному действуют кислород и сера, несмотря на их общую конфигурацию валентных электронов и общие неметаллические свойства.
Существует множество серосодержащих соединений, многие из которых органические. Префикс тио- в названии кислородсодержащего соединения означает, что атом кислорода замещен атомом серы. Общие категории серосодержащих соединений включают тиолы (меркаптаны), тиофенолы, органические сульфиды (тиоэфиры), дисульфиды, тиокарбонилы, тиоэфиры, сульфоксиды, сульфонилы, сульфамиды, сульфокислоты, сульфонаты и сульфаты.
Префикс тио- в названии кислородсодержащего соединения означает, что атом кислорода замещен атомом серы. Общие категории серосодержащих соединений включают тиолы (меркаптаны), тиофенолы, органические сульфиды (тиоэфиры), дисульфиды, тиокарбонилы, тиоэфиры, сульфоксиды, сульфонилы, сульфамиды, сульфокислоты, сульфонаты и сульфаты.
Селен
Селен выглядит как красное или черное аморфное твердое вещество или красная или серая кристаллическая структура; последний наиболее стабилен. Селен имеет свойства, очень похожие на свойства серы; однако он более металлический, хотя по-прежнему классифицируется как неметалл. Он действует как полупроводник и поэтому часто используется при изготовлении выпрямителей, представляющих собой устройства, преобразующие переменный ток в постоянный. Селен также является фотопроводником, что означает, что в присутствии света электропроводность селена увеличивается. Он также используется в барабанах лазерных принтеров и копировальных аппаратов. Кроме того, он нашел более широкое применение теперь, когда свинец был удален из сантехнической латуни.
Кроме того, он нашел более широкое применение теперь, когда свинец был удален из сантехнической латуни.
В природе селен редко встречается в чистом виде; обычно его необходимо удалять в процессе рафинирования, обычно с участием меди. Он часто встречается в почвах и в тканях растений, биоаккумулировавших элемент. В больших дозах элемент токсичен; однако многим животным он необходим как незаменимый микроэлемент. Атомы селена входят в состав фермента глутатионпероксидазы, который разрушает перекиси, повреждающие липиды. В организме человека он является важным кофактором в поддержании функции щитовидной железы. Кроме того, некоторые исследования показали корреляцию между почвой с дефицитом селена и повышенным риском заражения вирусом ВИЧ/СПИДа.
Теллур
Теллур – это металлоид кислородного семейства серебристо-белого цвета с металлическим блеском, похожим на блеск олова при комнатной температуре. Как и селен, он также проявляет фотопроводимость. Теллур — чрезвычайно редкий элемент, чаще всего встречающийся в виде теллурида золота. Часто используется в металлургии в сочетании с медью, свинцом и железом. Кроме того, он используется в солнечных панелях и микросхемах памяти для компьютеров. Не токсичен и не канцерогенен; однако, когда люди подвергаются воздействию слишком большого количества этого вещества, у них появляется чесночный запах изо рта.
Часто используется в металлургии в сочетании с медью, свинцом и железом. Кроме того, он используется в солнечных панелях и микросхемах памяти для компьютеров. Не токсичен и не канцерогенен; однако, когда люди подвергаются воздействию слишком большого количества этого вещества, у них появляется чесночный запах изо рта.
Полоний
Полоний — очень редкий радиоактивный металл. Существует 33 различных изотопа элемента, и все изотопы радиоактивны. Он существует в различных состояниях и имеет два металлических аллотропа. Легко растворяется в разбавленных кислотах. Полоний не существует в природе в соединениях, но может образовывать синтетические соединения в лаборатории. Он используется в виде сплава с бериллием в качестве источника нейтронов для ядерного оружия.
Полоний является высокотоксичным элементом. Излучаемое им излучение делает его очень опасным в обращении. Он может быть немедленно смертельным при применении в правильной дозировке или вызвать рак, если происходит хроническое воздействие радиации. Методы лечения людей, зараженных полонием, все еще изучаются, и было показано, что хелатирующие агенты могут быть использованы для обеззараживания людей. 9 «Руководство для промышленности. Внутреннее радиоактивное загрязнение — разработка агентов декорпорации» (PDF) . http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm071944.pdf. Проверено 23 мая 2010 г. .
Методы лечения людей, зараженных полонием, все еще изучаются, и было показано, что хелатирующие агенты могут быть использованы для обеззараживания людей. 9 «Руководство для промышленности. Внутреннее радиоактивное загрязнение — разработка агентов декорпорации» (PDF) . http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm071944.pdf. Проверено 23 мая 2010 г. .
Проблемы
- Какие свойства увеличиваются в семействе кислорода?
- Какой элемент может образовывать наибольшее количество аллотропов в периодической таблице?
- Что такое фотопроводимость и какие элементы обладают этим свойством?
- Озон (\(O_3\)) является источником смога: правда или ложь
- Сколько электронов имеют элементы семейства кислорода на внешней оболочке?6. Что означает термин «пероксид»?
- Сколько элементов в семействе кислорода являются металлами и какие из них?
- Какова наиболее распространенная степень окисления элементов семейства кислорода?
- Какой элемент по массе наиболее распространен в земной коре и в организме человека?
Растворы
- Температура плавления, точка кипения, плотность, атомный радиус и ионный радиус
- Сера
- Фотопроводимость — это когда электрическая проводимость элемента увеличивается в присутствии света.

