Состав атомного ядра. Число протонов — урок. Химия, 8–9 класс.
Предложенная Э. Резерфордом в \(1911\) году ядерная (планетарная) модель строения атома сводится к следующим положениям:
- атом состоит из положительно заряженного ядра и движущихся вокруг него электронов;
- более \(99,96\) % массы атома сосредоточено в его ядре;
- диаметр ядра примерно в сто тысяч раз меньше диаметра самого атома.
Согласно этой модели можно дать следующее определение атома:
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядро атома состоит из элементарных частиц: протонов и нейтронов. Протоны и нейтроны имеют общее название нуклоны (ядерные частицы).
Протон (\(p\)) — частица, имеющая заряд \(+1\) и относительную массу, равную \(1\).
Нейтрон (\(n\)) — частица без заряда с относительной массой \(1\).
К элементарным частицам относятся также электроны (\(e\)), которые образуют электронную оболочку атома.
Рис. \(1\). Строение атома
Протоны и нейтроны имеют одинаковую массу. Масса электрона составляет 11840 массы протона и нейтрона. Поэтому основная масса атома сосредоточена в его ядре.
Протон имеет положительный заряд \(+1\). Заряд электрона — отрицательный и по величине равен заряду протона: \(–\)\(1\).
Частицы | Обозначения | Относительная масса | Относительный заряд |
| Протон | \(p\) | \(1\) | \(+1\) |
| Нейтрон | \(n\) | \(1\) | \(0\) |
| Электрон | \(e\) | \(1/1840\) | \(–1\) |
Установлено, что число протонов в ядре равно порядковому номеру элемента в Периодической таблице.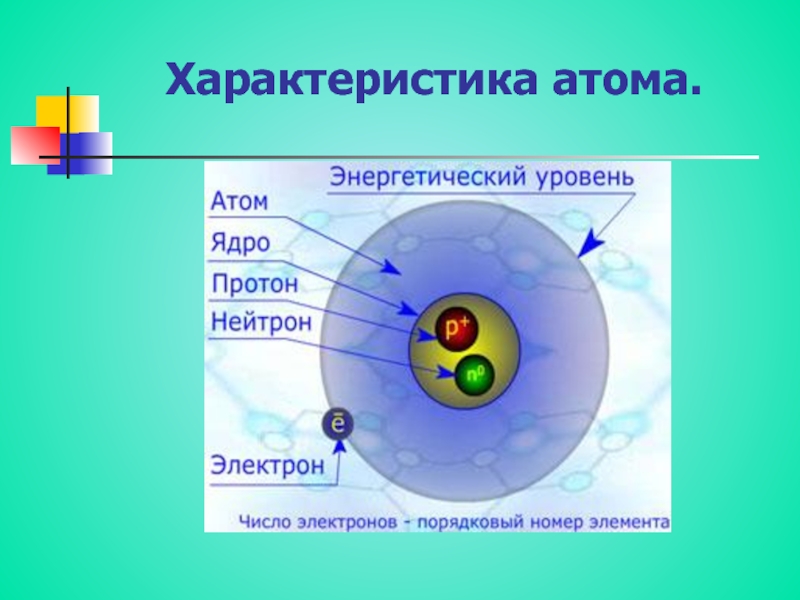
Заряд ядра определяется числом протонов в нём. Значит, заряд ядра тоже равен порядковому номеру элемента.
Атом — электронейтральная частица, поэтому число электронов в нём равно числу протонов.
Обрати внимание!
Порядковый номер элемента \(=\) заряд ядра атома \(=\) число протонов в ядре \(=\) число электронов в атоме.
Водород — элемент № \(1\). Заряд ядра его атома равен \(+1\). В ядре находится один протон, а в электронной оболочке — один электрон.
Углерод — элемент № \(6\). Заряд ядра его атома равен \(+6\), в нём — \(6\) протонов. В атоме содержится \(6\) электронов с общим зарядом \(–\)\(6\).
Обрати внимание!
Заряд ядра — главная характеристика атома.
Изучение строения атомных ядер привело к уточнению формулировки периодического закона. Современная формулировка звучит следующим образом:
Современная формулировка звучит следующим образом:
cвойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величин зарядов ядер их атомов.
Источники:
Рис. 1. Строение атома © ЯКласс
Перечислите известные вам характеристики атома.
Виписати окремо назви речовин і сумішей:нафта,повітря,срібло,зубна паста,кисень,золото,кефір,дистильована вода
ПОЖАЛУЙСТА Укажи, при взаємодії яких речовин відбувається реакція йонного обміну з виділенням вуглекислого газу. Можливі кілька варіантів правильних в … ідповідейкарбонатна кислота при нагріванні калій карбонат і сульфатна кислота кальцій карбонат і калій гідроксид кальцій карбонат і хлоридна кислота
Закончить уравнение реакции, расставить степень окисления элементов в веществах, составить электронный баланс, указать восстановитель и окислитель, ра … сставить коэффициенты: Al + h3SO4 (разб.)= ____+_____
спрогнозируйте возможные протекания реакции замещение металлов, используя ряд активности металлов: CuSO4+Fe_____ZnCl2+Mg_____MnSO4+Sn_____
Коли до фенолфталеїну (C20h24O4) додали HCI розчин залишився безбарвним.
Fe3CL змішали з NaOH й утворився аморфний бурий осад. Na3PO4 (безбарвний) змішали з AgNO3(безбарвний) й утворився жовтий кристалічний осад. 4,5 пункти … я не знаю. Зовсім не розумію рівняння
І — вариант 1. С какими из приведенных веществ реагирует оксид углерода (IV)? Напишите уравнения реакций. HNO3, NaOH, SO, NaO, HSO4, Ca(OH), К,0 (IV) … необходимого для превращения 10 г карбоната 2. Рассчитайте объём оксида углерода кальция в гидрокарбонат. 3. Уравняйте окислительно-восстановительную реакцию. Определите окислитель h3O восстановитель. SiCl + NaOH = NaSiO3 + NaCI + H,0 4. Напишите уравнения реакций для осуществления следующей схемы: SiO, CO – CO, CaCO3 –Ca(HCO3), — CaCI, – 2 и = – СО ZN Пн. 1500 с
что означает запись? ch5+2o2=co2+2h3oпомогите пожалуйстаааааа
найдите относительную массу и массовые отношения в веществах: Na2SO4 ; h3CO3 ; P2O5пожалуйста помогите мне нужно сдать через 23 мин!!!!!! срочно
Знайдіть відносну молекулярну масу сполуки: Na2 S та відношення мас атомів калію до сульфуру.
Технические характеристики – Пусковое устройство Aurora ATOM 18 EVOLUTION
Напряжение заряжаемых аккумуляторов
Зарядка щелочных аккумуляторов
нет
Ток пуска, А
600
нет
Режим Boost
есть
Габариты, мм
224х87х29
Китай
Напряжение питания, В
12/220
Тип аккумулятора
Li-Po
Max ток запуска, А
600
Сможет запустить
мотоцикл, автомобиль
Родина бренда
12
Гарантия
12 месяцев
Тип устройства
пусковое
Функциональные характеристики :: Atom
Содержание.

- Терминология.
- Принципы функционирования.
- Функциональные характеристики.
- Бизнес-процессы, выполняемые с использованием системы.
- Участники информационного взаимодействия.
1. Терминология
В данном руководстве используются следующие термины (Таблица 1):
| Термин | Пояснение |
|---|---|
| АТОМ | Автоматическое тестирование объектов мониторинга |
| Консоль | Интерфейс управления + средства визуализации |
| ОС | Операционная система |
| Система | Комплекс программных и аппаратных средств участвующих в функционировании АТОМ |
| Нижний уровень системы | Серверы, размещенные на географически распределенных локациях, с которых выполняется АТОМ |
| Верхний уровень системы | Сервер базы данных и ПО Администратора системы |
| КСПД | Комплексная среда передачи данных |
| Пользователи Системы | |
| АРМ | Автоматизированное рабочее место |
2.
 Принципы функционирования
Принципы функционирования
Функционирование АТОМ осуществляется в соответствии с назначением и учетом требований к организации работ по мониторингу ИТ-систем. Включает в себя необходимый состав технологических и функциональных процедур (операций, мероприятий), обеспечивающих внутренние и внешние взаимосвязи, совместимость процессов автоматизированной и неавтоматизированной деятельности.
Функционирование Системы определяется и характеризуется следующими основными автоматизированными процессами:
- сбора, получения, передачи, предоставления, обработки, защиты и хранения данных, обеспечивающих формирование информационного ресурса в рамках функциональных задач;
- предоставления заинтересованным пользователям необходимой информации, определенной техническими требованиями к Системе, в соответствующем объеме и формате, согласно утвержденным регламентам и порядку предоставления данных;
- отображения данных контроля, диагностики и мониторинга на соответствующих АРМ операторов Системы;
- преобразования данных для их представления в табличном или графическом виде с выводом на экран монитора АРМ пользователя;
- взаимодействия (интеграции) с существующими автоматизированными системами.

Информационно-логическая (инфологическая) модель Системы определена как двухзвенная структура в виде иерархических уровней (нижнего и верхнего), взаимодействие между которыми (обмен информационными потоками) осуществляется с использованием комплексной среды передачи данных (КСПД).
К нижнему уровню Системы (НУ) относятся все информационные объекты (источники и поставщики информации), с которых в автоматическом режиме выполняется тестирование объектов функционального мониторинга.
Для сбора необходимой информации используется КСПД – основной вариант автоматического сбора данных.
КСПД организована с использованием сетей VLAN.
Вся информация нижнего уровня собирается на ВУ Системы, где осуществляется анализ и контроль достоверности полученных данных, их окончательная обработка (агрегация), формирование итоговых сведений и их передача в среду визуализации и внешним системам мониторинга.
Верхний уровень Системы (ВУ) представляет собой единый вычислительный центр, обработки, анализа, хранения и распределения информационных ресурсов, обеспечивающий функции контроля, мониторинга, аудита и администрирования компонентов Системы.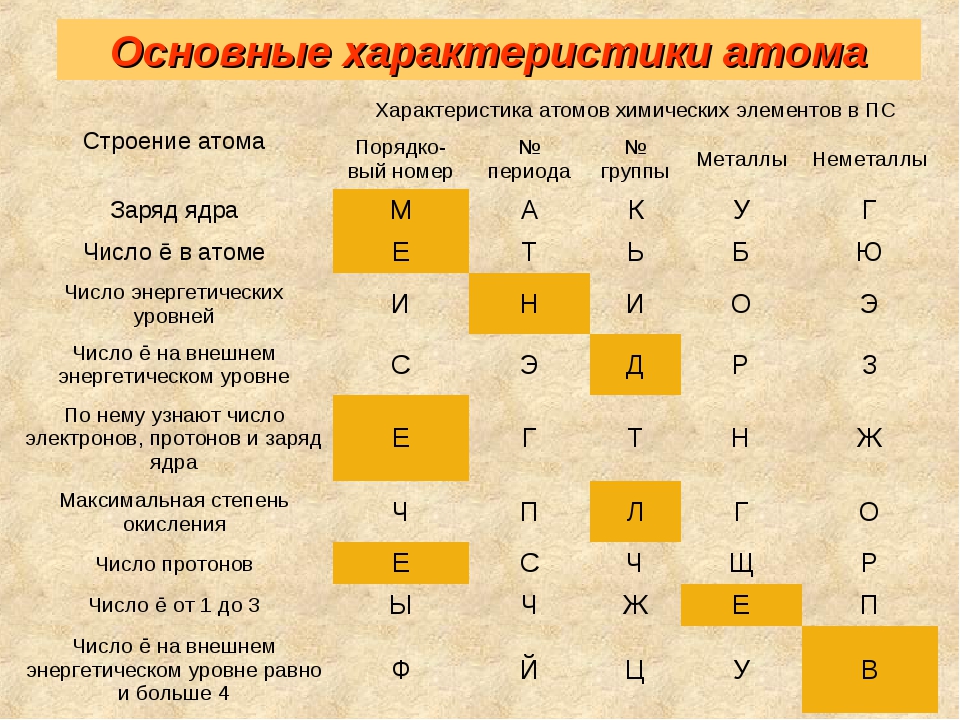
На ВУ осуществляются процессы организации и поддержки функционирования Системы, синхронизации данных, организация информационного взаимодействия с внешними системами и заинтересованными пользователями.
3. Функциональные характеристики
Система обеспечивает реализацию следующих функций:
- контроль состояния ИТ-сервисов с точки зрения реального пользователя;
- сбор и обработка метрик «Доступность», «Здоровье», «Производительность» ИТ-сервиса;
- визуализация показателей функционирования ИТ-сервиса для заинтересованных лиц;
- передача информации о показателях функционирования ИТ-сервиса в зонтичные системы мониторинга посредством интеграции;
Архитектура Системы строится по трехуровневой схеме;
- автоматизированные рабочие места организованы по технологии «толстого» клиента, без необходимости инсталляции;
- обработка информации от площадок функционального мониторинга осуществляется непосредственно на уровне Базы Данных системы;
- сервера, размещенные во всех МРФ, выполняющие роль площадок функционального мониторинга, с которых выполняется тестирование ИТ-сервисов.

4. Бизнес-процессы, выполняемые с использованием системы
Система обеспечивает выполнение заданного рамками технических требований уровня автоматизации следующих процессов:
- мониторинг состояния ИТ-систем с позиции конечного пользователя;
- сбор показателей доступности, здоровья и производительности ИТ-сервиса;
- проактивный контроль и выявление деградации ИТ-сервисов;
- предоставление отчетности о функционировании ИТ-систем;
5. Участники информационного взаимодействия
Основными участниками бизнес-процессов являются:
- Подразделения эксплуатации и развития ИТ-систем.
- Бизнес-заказчики ИТ-систем;
- Пользователи ИТ-систем.
Скачать PDF
Гендиректор УВЗ раскрыл характеристики боевой машины “Атом-2”
Гендиректор “Уралвагонзавода” Олег Сиенко рассказал в интервью “Российской газете” о том, что санкции пока не оказали влияния на работу предприятия, и о новой боевой машине, разрабатываемой УВЗ.
“Рушить чисто деловые взаимоотношения в угоду сиюминутным политическим амбициям, как нам кажется, никто из европейских промышленников не хочет. Они ведь понимают, что рынок пустоты не терпит. Есть немало ведущих по мировым масштабам азиатских корпораций, которые готовы занять место европейцев, если они прекратят сотрудничать с нами в области высоких технологий. Но уходить пока никто не собирается. В противном случае мы не затевали бы проект “Атом-2”, – сказал Сиенко. По его словам, в настоящее время “Уралвагонзавод” совместно с французской компанией Renault Trucks Defence создает боевую машину нового поколения “Атом”. Это БМ на базе модифицированного шасси французской БМП VBCI.
“Кстати, открою секрет. Недавно мы приступили к работам по проекту “Атом-2”, который также будет совместным, но уже не с французами. У новой машины – совершенно иные боевые возможности, и, на взгляд наших специалистов, она станет не менее интересной, чем первый “Атом”, – сказал Сиенко.
Он отметил, что участники проекта “Атом” не копировали чужие разработки, а создавали действительно совместный продукт. “В итоге получилось почти ровно 50 на 50. Корпус и шасси – французские. Компоновка и боевой модуль – наши. На первых образцах, возможно, будет стоять импортный дизельный двигатель. Однако мы уже подобрали отечественный, который входит в габариты “Атома” и удовлетворяет нас по всем характеристикам. Кстати, машина эта плавающая, и на ней предусмотрено два двигателя. Для движения по суше и для движения по воде. Это интересное конструкторское решение”, – сказал Сиенко.
“В итоге получилось почти ровно 50 на 50. Корпус и шасси – французские. Компоновка и боевой модуль – наши. На первых образцах, возможно, будет стоять импортный дизельный двигатель. Однако мы уже подобрали отечественный, который входит в габариты “Атома” и удовлетворяет нас по всем характеристикам. Кстати, машина эта плавающая, и на ней предусмотрено два двигателя. Для движения по суше и для движения по воде. Это интересное конструкторское решение”, – сказал Сиенко.
По его словам, у машины очень удачная компоновка. Десанту просторно, удобен выход через заднюю аппарель. Сиденья обеспечивают защиту от динамического удара. Корпус рассчитывался на противоминную устойчивость. Управление машиной компьютеризировано, предусмотрено оснащение современным оптико-электронным оборудованием.
“Однако самое важное – боевой модуль. Он оснащен скорострельной корабельной артустановкой калибра 57 мм, естественно, адаптированной к сухопутной машине. Пушка отличается высокой скорострельностью и точностью стрельбы на дальности до 16 км. Она может уверенно поражать не только наземные цели, но и воздушные. В ПВО Сухопутных войск сейчас нет артустановок калибра выше 30 мм. Между тем наши расчеты показали, что именно 57 мм пушки должны хорошо работать практически по всем типам беспилотных летательных аппаратов. Так что у “Атома” хорошие перспективы как по экспорту, так и по оснащению этими машинами российской армии”, – сказал Сиенко.
Она может уверенно поражать не только наземные цели, но и воздушные. В ПВО Сухопутных войск сейчас нет артустановок калибра выше 30 мм. Между тем наши расчеты показали, что именно 57 мм пушки должны хорошо работать практически по всем типам беспилотных летательных аппаратов. Так что у “Атома” хорошие перспективы как по экспорту, так и по оснащению этими машинами российской армии”, – сказал Сиенко.
Intel готовит линейку наследников легендарных процессоров Atom. Рассекречены все их характеристики
Техника Маркет | Поделиться Инсайдеры раскрыли характеристики будущих 10-нанометровых гибридных процессоров Intel Pentium и Celeron для недорогих ноутбуков ПК с пассивным охлаждением.
Процессоры Jasper Lake
Корпорация Intel выпустит новую линейку x86-совместимых гибридных процессоров семейства Jasper Lake в начале 2021 г. на замену чипам актуального семейства Gemini Lake Refresh. Об этом сообщил профильный ресурс FanlessTech. Новые однокристальные системы (SoC) предназначены для применения в недорогих ноутбуках, компактных ПК с пассивным охлаждением и прочих системах начального уровня.
Выпускать чипы будут по 10-нанометрому технологическому процессу. По данным инсайдеров, отличительной чертой новинок станет микроархитектура Tremont. Tremont – актуальное поколение энергоэффективной процессорной микроархитектуры Intel, пришедшей на смену Goldmont (Plus), которая успешно использовалась в «атомных» (Intel Atom) процессорах семейств Apollo Lake и Gemini Lake с 2016 г.
FanlessTech также опубликовал основные характеристики SoC Jasper Lake. По данным ресурса, «флагман» линейки, нацеленный на настольные системы – Pentium N6005 – будет работать на базовой частоте в 2 ГГц с возможностью автоматического разгона до 3,3 ГГц с помощью функции Turbo Boost.
Intel выпустит новые гибридные процессоры Pentium и Celeron в начале 2021 г.
Все представители семейства получат по четыре ядра, 4 МБ кэш-памяти второго уровня, встроенную графику Intel UHD. Исключение составят мобильный Celeron N4500 и десктопный Celeron N4505 – они содержат всего по два ядра. Показатель TDP (Thermal Design Power, «Тепловой пакет») мобильных версий чипов составит 6 Вт, у настольных – достигнет 10 Вт.
Краткие характеристики первых чипов Intel Jasper Lake
| Модель | Ядра/Потоки | Базовая/максимальная тактовая частота | Кэш второго уровня | TDP |
|---|---|---|---|---|
| Pentium Silver N6005 | 4/4 | 2 ГГц / 3,3 ГГц | 4 МБ | 10 Вт |
| Celeron N5105 | 4/4 | 2 ГГц / 2,8 ГГц | 4 МБ | 10 Вт |
| Celeron N4505 | 2/2 | 2 ГГц / 2,9 ГГц | 4 МБ | 10 Вт |
| Pentium Silver N6000 | 4/4 | 1,1 ГГц / 3,1 ГГц | 4 МБ | 6 Вт |
| Celeron N5100 | 4/4 | 1,1 ГГц / 2,8 ГГц | 4 МБ | 6 Вт |
| Celeron N4500 | 2/2 | 1,1 ГГц / 2,8 ГГц | 4 МБ | 6 Вт |
Источник: FanlessTech
Напомним, в начале сентября 2020 г.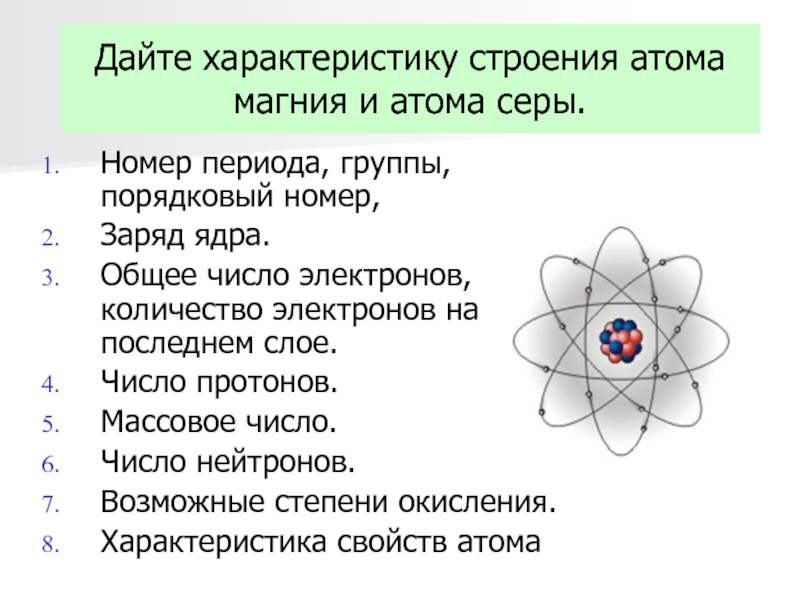 Intel продемонстрировала новые процессоры Core 11 поколения линейки Tiger Lake. Она, как писал CNews, показала девять чипов для мобильных ПК, которые, по ее утверждению, в несколько раз опережают по производительности в играх, графических редакторах и офисных программах конкурирующие решения AMD. Первые ноутбуки на Tiger Lake должны поступить в продажу до конца 2020 г.
Intel продемонстрировала новые процессоры Core 11 поколения линейки Tiger Lake. Она, как писал CNews, показала девять чипов для мобильных ПК, которые, по ее утверждению, в несколько раз опережают по производительности в играх, графических редакторах и офисных программах конкурирующие решения AMD. Первые ноутбуки на Tiger Lake должны поступить в продажу до конца 2020 г.
Гетерогенные процессоры Intel
Над собственными гибридными или гетерогенными процессорами, то есть сочетающими несколько видов ядер – «больших» и «малых», на одном кристалле, Intel работала на протяжении нескольких лет. Впервые о возможном появлении таких чипов в каталоге компании стало известно еще в апреле 2018 г., а свое подтверждение они нашли в январе 2019 г., когда Intel раскрыла первые подробности о них, заявив, что будет использовать не только несколько различных ядер в одном процессоре, но и трехмерную их компоновку, получившую название Foveros.
Быстрее, выше, сильнее: около сотни цифровых решений для спортсменов предложили разработчики столичным федерациям и клубам
Инновации и стартапыВесь 2019 г. Intel работала над новыми для нее процессорами, и в середине февраля 2020 г. она, как сообщал CNews, опубликовала фотографии первого представителя новой линейки. Это оказался очень компактный процессор размерами 12х12х1 мм, выделявшийся не только габаритами, но и нечетным количеством ядер – их в нем было пять.
Intel работала над новыми для нее процессорами, и в середине февраля 2020 г. она, как сообщал CNews, опубликовала фотографии первого представителя новой линейки. Это оказался очень компактный процессор размерами 12х12х1 мм, выделявшийся не только габаритами, но и нечетным количеством ядер – их в нем было пять.
Используемая в Lakefield технология Foveros позволила объединить в одном кристалле 22-нанометровую подложку с 4 МБ кэша третьего уровня и набором системной логики, слой с модулями памяти LPDDR4 объемом 8 ГБ и 10-нанометровый «чиплета» с вычислительными ядрами и графической подсистемой. В данном процессоре используется одно производительное ядро Sunny Cove (такие ядра можно встретить в чипах нового поколения Ice Lake) и четыре энергоэффективных ядра Tremont. Видеоподсистема процессора – Intel UHD Gen 11.
Позже выяснилось, что все, о чем говорила Intel в феврале 2020 г., относилось к процессору Core i5-L16G7, ставшему одним из двух первых представителей линейки Lakefield. Вторым оказался менее производительный чип Core i3-L13G4. Оба оснащаются одним «большим» ядром на архитектуре Sunny Cove и четырьмя «малыми» Tremont.
Вторым оказался менее производительный чип Core i3-L13G4. Оба оснащаются одним «большим» ядром на архитектуре Sunny Cove и четырьмя «малыми» Tremont.
Премьеру своих новинок Intel провела в середине июня 2020 г., и других чипов Lakefield, помимо двух перечисленных, в ее модельном ряду не существует. Процессоры уже находятся в производстве и даже используются в потребительской электронике.
Одним из первых устройств на базе Lakefield стал ноутбук Samsung Galaxy Book S, дебютровавший в середине июля 2020 г. Он вышел в комплектациях на обоих пятиядерных чипах – Core i5-L16G7 (1,4-3,0 ГГц) и Core i3-L13G4 (0,8-2,8 ГГц).
Дмитрий Степанов
КЛИНИКО-БИОХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ПАЦИЕНТОВ С ПЕРВИЧНЫМ БИЛИАРНЫМ ЦИРРОЗОМ ПЕЧЕНИ
- Е. Г. Шевченко УО «Белорусский государственный медицинский университет», Минск, Беларусь
- З.
 П. Лемешевская
УО «Гродненский государственный медицинский университет»
П. Лемешевская
УО «Гродненский государственный медицинский университет» - Н. И. Прокопчик УО «Гродненский государственный медицинский университет»
Аннотация
Введение. Первичный билиарный цирроз (ПБЦ) – редкое аутоиммунное заболевание, характеризующееся медленным прогредиентным течением воспалительного процесса в портальных трактах и иммуноопосредованной деструкцией внутрипеченочных желчных протоков.Цель исследования – представить клинико-лабораторную характеристику пациентов с ПБЦ в Республике Беларусь.
Материалы и методы.
 Объектом исследования был 71 пациент с диагнозом ПБЦ. Материалом для исследований служили: плазма и сыворотка крови пациентов, биопсийный материал печени, данные теста связывания чисел. Качество жизни определялось при поступлении с помощью Short Form Medical Outcomes Study (SF-36).
Объектом исследования был 71 пациент с диагнозом ПБЦ. Материалом для исследований служили: плазма и сыворотка крови пациентов, биопсийный материал печени, данные теста связывания чисел. Качество жизни определялось при поступлении с помощью Short Form Medical Outcomes Study (SF-36). Результаты. Все пациенты с ПБЦ – женского пола, средний возраст – 55 лет, что совпадает с климактерическим периодом. Представлена клинико-лабораторная характеристика и проведен анализ психоэмоционального статуса пациентов с ПБЦ.
Заключение. В статье дано описание пациентов с ПБЦ с учетом клинико-биохимической характеристики и возраста. Владение этой информацией позволит на более ранних стадиях выявлять данную патологию, проводить профилактику развития терминальной стадии заболевания, что ведет к уменьшению влияния прогрессивного характера болезни.
Литература
1. Jones DE, Donaldson PT. Genetic factors in the pathogenesis of primary biliary cirrhosis. Clin. Liver Dis. 2003;7(4):841-864.
Genetic factors in the pathogenesis of primary biliary cirrhosis. Clin. Liver Dis. 2003;7(4):841-864.
2. Parikh-Patel A, Gold EB, Worman H, Krivy KE, Gershwin ME. Risk factors for primary biliary cirrhosis in a cohort of patients from the United States. Hepatology. 2001;33(1):16-21. doi: 10.1053/jhep.2001.21165.
3. Bittencourt PL, Farias AQ, Abrantes-Lemos CP, Goncalves LL, Goncalves PL, Magalhães EP, Carrilho FJ, Laudanna AA, Cançado EL. Prevalence of immune disturbances and chronic liver disease in family members of patients with primary biliary cirrhosis. J. Gastroenterol. Hepatol. 2004;19(8):873-878. doi: 10.1111/j.1440-1746.2004.03396.x.
Опубликован
2019-06-05
Как цитировать
1.
Шевченко ЕГ, Лемешевская ЗП, Прокопчик НИ. КЛИНИКО-БИОХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ПАЦИЕНТОВ С ПЕРВИЧНЫМ БИЛИАРНЫМ ЦИРРОЗОМ ПЕЧЕНИ. journalHandG [Интернет]. 5 июнь 2019 г. [цитируется по 2 ноябрь 2021 г.];3(1):49-4. доступно на: http://www.pkc.grsmu.by/index.php/journalHandG/article/view/97
Другие форматы библиографических ссылокСкачать ссылку
Раздел
Оригинальные исследования
атомов
атомАтомы и изотопы; Соединения и минералы
Атомы – наименьшая часть элемента, которая может существовать, и
еще показать характеристики элемента. Сами атомы состоят по существу
электронов (1 отрицательный заряд), протонов (1 положительный заряд) и нейтронов (без заряда). Упрощенно мы можем представить атомы как состоящие из ядра с протонами и
нейтроны, окруженные электронами для баланса заряда.Атомы разных элементов
различаются по количеству протонов в ядре. Водород имеет простейший
(и самый легкий) атом всего с одним протоном и одним электроном, а затем сложность
постепенно увеличивается, пока мы не дойдем до урана с 92 протонами, 146 нейтронами и 92
электроны. Упрощенно мы можем представить атомы как состоящие из ядра с протонами и
нейтроны, окруженные электронами для баланса заряда.Атомы разных элементов
различаются по количеству протонов в ядре. Водород имеет простейший
(и самый легкий) атом всего с одним протоном и одним электроном, а затем сложность
постепенно увеличивается, пока мы не дойдем до урана с 92 протонами, 146 нейтронами и 92
электроны. |
Обычно количество электронов равно количеству протонов, однако атом может теряют или собирают электроны и имеют отрицательный или положительный заряд, и в этом случае мы говорим около ионов, а не атомов.
Хотя показанная выше “планетарная” модель атома
легко визуализировать, реальность немного страннее. Согласно квантовой
механический подход, впервые предложенный Шредингером,
поведение электронов можно представить как функции вероятности
формы волны. | Число нейтронов («клей» между протонами) в ядре может
также варьируются в пределах данного элемента. Эти разновидности данного атома (одинаковое количество протонов,
разное количество нейтронов) называются изотопами . Иллюстрация
слева показаны три изотопа водорода: «нормальный: водород с 1 протоном и 1
электрон, дейтерий и тритий. Ученые в различных лабораториях работают над тем, чтобы
производить управляемый синтез дейтерия в гелий.В случае успеха это будет
быть практически неиссякаемым источником энергии. Хотя дейтерий составляет лишь небольшую
доля водорода на Земле (несколько литров на каждый кубический километр океанской воды),
необходимо использовать большой объем океанской воды. атомов могут соединяться вместе, образуя молекул. Большинство веществ, окружающих нас, состоят из молекул и называются соединениями различные элементы. Молекулы – самая маленькая частица соединения обладающий всеми химическими свойствами этого соединения.Они состоят из двух или более атомы одного и того же элемента или двух или более разных элементов. Молекулы и соединения содержат составляющие их элементы в определенных пропорции, характерные для соединения . Например, вода (H 2 O), хорошо известное и простое соединение, содержит водород и кислород в соотношение 2 к 1. На рисунке ниже показано, как литий и фтор объединяются, образуя
соединение фторид лития .По сути, литий отдает электрон и
становится положительно заряженным, тогда как фтор захватывает этот электрон и становится отрицательно заряженным.
заряжен. Притяжение между противоположно заряженными ионами заставляет их объединяться в
так называемая ионная связь . | |
Другими типами связей являются ковалентная связь (атомы разделяют электроны) и металлическая связь (атомы окружены «электронным супом»).Какая связь находится в данном соединении, зависит от присутствующих элементов. и химические характеристики задействованных элементов.
Материалы, составляющие земную кору и мантию, называются горными породами (существует
их большое количество), и эти породы состоят из смеси чистых элементов (например,
алмазы [чистый углерод], золото) и различные химические соединения кремнезема, кислорода, железа,
магний, алюминий и т. д. Как было сказано выше, каждое химическое соединение проявляет очень специфические
пропорции элементов, из которых он состоит.Эти пропорции зависят от
электронная конфигурация элементов-участников. Одна особенность
соединения, которые составляют горные породы, заключается в том, что они не только демонстрируют специфические для соединения пропорции
элементы, но также и то, что каждый из них имеет определенное внутреннее расположение атомов. Из-за такого регулярного расположения атомов они являются кристаллическими веществами. Мы
называют этот тип соединений минералами. Минералы – основные
строительные блоки всех пород .
Из-за такого регулярного расположения атомов они являются кристаллическими веществами. Мы
называют этот тип соединений минералами. Минералы – основные
строительные блоки всех пород .
По определению минералы имеют следующие характеристики:
- 1) это натуральные (не искусственные) вещества
- 2) они цельнолитые
- 3) образуются неорганическими процессами
- 4) имеют специфический химический состав
- 5) имеют характерную кристаллическую структуру
| Кристаллическая структура поваренной соли хлорида натрия (NaCl). Структура состоит из чередующихся ионов натрия (положительный заряд, маленький черный шары) и ионы хлора (отрицательный заряд, большие желтые шары). В этом случае ионы размещены на прямоугольной сетке, в трех измерениях мы имеем кубических состав.  В зависимости от относительного размера ионов мы получаем разные структурные углы
и структурные типы. В зависимости от относительного размера ионов мы получаем разные структурные углы
и структурные типы. |
Согласно приведенному выше определению, все минералы имеют кристаллическую структуру. Не все кристаллические вещества , однако, – это обязательно минералы .Сахар, например, образует очень красивые кристаллы, но это не минерал, потому что он органическое вещество. Минералы – это неорганические вещества.
Минералы обладают определенными физическими свойствами, которые используются для различения и классифицируйте их. Эти свойства:
- 1) Внутренняя структура (см. Выше) / Морфология кристаллов
- 2) Раскол (кальцит всегда ломается ромбами [см. Ниже], поваренная соль – кубиками)
- 3) Цвет / полосы
- 4) Твердость (от талька до алмаза)
- 5) Плотность (PbS плотнее FeS)
Эти свойства зависят от прочности сцепления, внутренней структуры и
химический состав минерала.
| Раскол в кальците (CaCO 3 ). Независимо от того, как часто Кристалл кальцита разбивается на более мелкие и мелкие части, в результате всегда получаются фрагменты. показать ромбоэдрический спайность. Это так из-за внутреннего расположения атомов. в кристалле кальцита. Углы спайности – фундаментальное свойство любого заданного минеральная. |
| Данное соединение может встречаться более чем в одной кристаллической структуре . На картинке слева изображены алмаз и графит (используются в карандашах). Оба состоят из
чистый углерод (C), но заметно различаются по своим свойствам. Графит мягкий, блестящий
темно-серый, имеет слоистую, пластинчатую внутреннюю структуру. Напротив, алмаз
более плотное, часто прозрачное и самое твердое вещество, известное человеку. |
Теория атома – Описание характеристик атомов – электронов, элементов, элементов и частиц
Одним из первых описываемых атрибутов атомов была относительная атомная масса . Хотя отдельный атом был слишком мал для веса, атомы можно было сравнивать друг с другом.Химик Йонс Берцелиус предположил, что равные объемы газов при одной и той же температуре и давлении содержат одинаковое количество атомов. Он использовал эту идею, чтобы Эволюция атомной теории. Иллюстрация Ганса и Кэссиди. Предоставлено Gale Group. сравните веса реагирующих газов. Он смог определить, например, что атомы кислорода в 16 раз тяжелее атомов водорода. Он составил список этих относительных атомных весов для всех известных ему элементов.Он разработал символы для элементов, используя первую букву или первые две буквы их латинских имен, и эта система используется до сих пор. Символ для водорода – H, для кислорода – O, для натрия – (натрий, на латыни) – Na и так далее. Символы также оказались полезными при описании того, сколько атомов объединяются, чтобы сформировать молекулу определенного соединения. Например, чтобы показать, что вода состоит из двух атомов водорода и одного атома кислорода, символ воды – H 2 O.Один атом кислорода может даже объединиться с другим атомом кислорода с образованием молекулы кислорода с символом O 2 .
сравните веса реагирующих газов. Он смог определить, например, что атомы кислорода в 16 раз тяжелее атомов водорода. Он составил список этих относительных атомных весов для всех известных ему элементов.Он разработал символы для элементов, используя первую букву или первые две буквы их латинских имен, и эта система используется до сих пор. Символ для водорода – H, для кислорода – O, для натрия – (натрий, на латыни) – Na и так далее. Символы также оказались полезными при описании того, сколько атомов объединяются, чтобы сформировать молекулу определенного соединения. Например, чтобы показать, что вода состоит из двух атомов водорода и одного атома кислорода, символ воды – H 2 O.Один атом кислорода может даже объединиться с другим атомом кислорода с образованием молекулы кислорода с символом O 2 .
По мере того, как открывалось все больше и больше элементов, стало удобно начинать перечислять их в виде символов на диаграмме.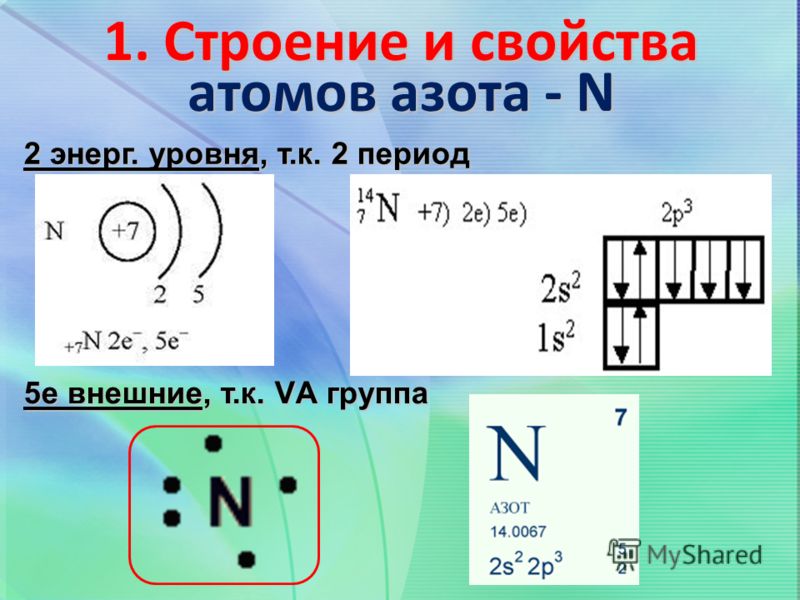 В 1869 году Дмитрий Менделеев перечислил элементы в порядке возрастания атомного веса и сгруппировал элементы, которые, казалось, имели сходные химические реакции. Например, литий , (Li), натрий (Na) и калий (K) – все металлические элементы, которые воспламеняются при намокании.Подобные элементы были помещены в тот же столбец его диаграммы. Менделеев начал замечать закономерность среди элементов, в которой каждый восьмой элемент в списке атомных весов должен принадлежать одному и тому же столбцу. Из-за этой периодичности или повторяемости диаграмма Менделеева называется «Периодической таблицей элементов». На самом деле таблица была настолько правильной, что, когда в таблице образовывалась «дыра», Менделеев предсказывал, что в конечном итоге будет обнаружен элемент, который заполнит это место. Например, было пространство для элемента с атомным весом около 72 (в 72 раза тяжелее водорода), но не было известного элемента.В 1886 году, через 15 лет после его предсказания, был выделен элемент германий (Ge), и было обнаружено, что его атомный вес составляет 72,3.
В 1869 году Дмитрий Менделеев перечислил элементы в порядке возрастания атомного веса и сгруппировал элементы, которые, казалось, имели сходные химические реакции. Например, литий , (Li), натрий (Na) и калий (K) – все металлические элементы, которые воспламеняются при намокании.Подобные элементы были помещены в тот же столбец его диаграммы. Менделеев начал замечать закономерность среди элементов, в которой каждый восьмой элемент в списке атомных весов должен принадлежать одному и тому же столбцу. Из-за этой периодичности или повторяемости диаграмма Менделеева называется «Периодической таблицей элементов». На самом деле таблица была настолько правильной, что, когда в таблице образовывалась «дыра», Менделеев предсказывал, что в конечном итоге будет обнаружен элемент, который заполнит это место. Например, было пространство для элемента с атомным весом около 72 (в 72 раза тяжелее водорода), но не было известного элемента.В 1886 году, через 15 лет после его предсказания, был выделен элемент германий (Ge), и было обнаружено, что его атомный вес составляет 72,3. Таким образом продолжалось предсказание и обнаружение многих других элементов. Однако по мере того, как в периодическую таблицу было добавлено больше элементов, было обнаружено, что если некоторые элементы были помещены в правильный столбец из-за сходных реакций, они не следовали правильному порядку увеличения атомного веса. Чтобы правильно упорядочить элементы, требовалась какая-то другая атомная характеристика.Прошло много лет, прежде чем была найдена подходящая недвижимость.
Таким образом продолжалось предсказание и обнаружение многих других элементов. Однако по мере того, как в периодическую таблицу было добавлено больше элементов, было обнаружено, что если некоторые элементы были помещены в правильный столбец из-за сходных реакций, они не следовали правильному порядку увеличения атомного веса. Чтобы правильно упорядочить элементы, требовалась какая-то другая атомная характеристика.Прошло много лет, прежде чем была найдена подходящая недвижимость.
По мере того, как химические эксперименты искали и характеризовали больше элементов, другие отрасли науки делали открытия, касающиеся электричества и света , которые должны были внести свой вклад в развитие теории атома. Майкл Фарадей проделал большую работу по характеристике электричества; Джеймс Клерк Максвелл характеризовал свет. В 1870-х годах Уильям Крукс построил прибор, который теперь называется трубкой Крукса, для исследования «лучей», испускаемых металлами.Он хотел определить, были ли лучи светом или электричеством, основываясь на описаниях обоих Фарадеем и Максвеллом. Трубка Крукса состояла из стеклянной колбы , из которой была удалена большая часть воздуха, и заключала в себе две металлические пластины , называемые электродами. Один электрод назывался анодом , а другой – катодом . Каждая пластина имела провод, ведущий за пределы лампы к источнику электричества. Когда на электроды подавали электричество, казалось, что от катода исходят лучи.Крукс определил, что эти катодные лучи были частицами с отрицательным электрическим зарядом , которые испускались металлом катодной пластины. В 1897 году Дж. Дж. Томсон обнаружил, что эти отрицательно заряженные частицы исходят из атомов и должны изначально присутствовать в атомах металла. Он назвал эти отрицательно заряженных субатомных частиц «электронами». Поскольку электроны были заряжены отрицательно, остальная часть атома должна была быть заряжена положительно.Томсон считал, что электроны рассеиваются в атоме, как изюм в положительно заряженном хлебном тесте или как сливы в пудинге.
Трубка Крукса состояла из стеклянной колбы , из которой была удалена большая часть воздуха, и заключала в себе две металлические пластины , называемые электродами. Один электрод назывался анодом , а другой – катодом . Каждая пластина имела провод, ведущий за пределы лампы к источнику электричества. Когда на электроды подавали электричество, казалось, что от катода исходят лучи.Крукс определил, что эти катодные лучи были частицами с отрицательным электрическим зарядом , которые испускались металлом катодной пластины. В 1897 году Дж. Дж. Томсон обнаружил, что эти отрицательно заряженные частицы исходят из атомов и должны изначально присутствовать в атомах металла. Он назвал эти отрицательно заряженных субатомных частиц «электронами». Поскольку электроны были заряжены отрицательно, остальная часть атома должна была быть заряжена положительно.Томсон считал, что электроны рассеиваются в атоме, как изюм в положительно заряженном хлебном тесте или как сливы в пудинге. Хотя модель “сливового пудинга” Томсона не была правильной, это была первая попытка показать, что атомы более сложны, чем просто однородные сферы.
Хотя модель “сливового пудинга” Томсона не была правильной, это была первая попытка показать, что атомы более сложны, чем просто однородные сферы.
В то же время ученые изучали другие виды загадочных лучей, исходящих из трубки Крукса, которые не исходили от ее катода. В 1895 году Вильгельм Рентген заметил, что фотопластинки, держащиеся рядом с трубкой Крукса, будут запотеваны некоторыми невидимыми, неизвестными лучами.Рентген назвал эти лучи «рентгеновскими лучами», используя «x» для неизвестного, как в математике . Рентген также установил использование фотопластинок как способа снимать загадочные лучи. Он обнаружил, что, блокируя рентгеновских лучей рукой, например, кости блокируют рентгеновские лучи, а кожа и ткань – нет. Врачи до сих пор используют рентгеновские лучи для визуализации человеческого тела.
Фотопластинки стали стандартным оборудованием ученых времен Рентгена.Один из этих ученых, Анри Беккерель, оставил в ящике несколько фотопластинок с ураном , новым элементом, который он изучал. Когда он снял пластины, он обнаружил, что они запотели. Поскольку в ящике больше ничего не было, он пришел к выводу, что уран, должно быть, испускал какой-то тип луча. Беккерель показал, что это излучение не было таким проникающим, как рентгеновские лучи, поскольку оно могло быть заблокировано бумагой . Сам элемент активно излучал излучение – свойство, называемое радиоактивностью.Во многом благодаря работам Пьера и Мари Кюри было обнаружено больше радиоактивных элементов. Попытки охарактеризовать различные типы радиоактивности привели к следующей большой главе в развитии теории атома.
Когда он снял пластины, он обнаружил, что они запотели. Поскольку в ящике больше ничего не было, он пришел к выводу, что уран, должно быть, испускал какой-то тип луча. Беккерель показал, что это излучение не было таким проникающим, как рентгеновские лучи, поскольку оно могло быть заблокировано бумагой . Сам элемент активно излучал излучение – свойство, называемое радиоактивностью.Во многом благодаря работам Пьера и Мари Кюри было обнаружено больше радиоактивных элементов. Попытки охарактеризовать различные типы радиоактивности привели к следующей большой главе в развитии теории атома.
В 1896 году Эрнест Резерфорд, ученик Дж. Дж. Томсона, начал изучать радиоактивность. Проверяя различные элементы и определяя, какие материалы могут блокировать попадание излучения на фотопластинку, Резерфорд пришел к выводу, что существует два типа радиоактивности, исходящей от элементов.Он назвал их, используя первые две буквы греческого алфавита, альфа и бета. Альфа-излучение состоит из положительно заряженных частиц, которые примерно в четыре раза тяжелее атома водорода. Бета-излучение состоит из отрицательно заряженных частиц, похожих на электроны. Резерфорд решил провести эксперимент с альфа-частицами. Он установил кусок тонкой золотой фольги с фотографическими пластинками по периметру. Затем он позволил альфа-частицам попасть в золото. Большая часть альфа-частиц прошла через золотую фольгу.Но некоторые из них этого не сделали. Несколько альфа-частиц отклонились от своего прямого курса. Некоторые даже отступили. Резерфорд писал, что это так же удивительно, как если бы кто-то выстрелил в кусок папиросной бумаги только для того, чтобы тот отлетел. Резерфорд пришел к выводу, что, поскольку большая часть альфа-частиц прошла, атомы золота должны быть в основном пустым пространством, а не сливовым пудингом Томсона, заполняющим пространство. Поскольку несколько альфа-частиц были отклонены, в каждом атоме должна быть плотно упакованная положительная область, которую он назвал ядром.При всем положительном заряде ядра следующим вопросом было расположение электронов в атоме.
Бета-излучение состоит из отрицательно заряженных частиц, похожих на электроны. Резерфорд решил провести эксперимент с альфа-частицами. Он установил кусок тонкой золотой фольги с фотографическими пластинками по периметру. Затем он позволил альфа-частицам попасть в золото. Большая часть альфа-частиц прошла через золотую фольгу.Но некоторые из них этого не сделали. Несколько альфа-частиц отклонились от своего прямого курса. Некоторые даже отступили. Резерфорд писал, что это так же удивительно, как если бы кто-то выстрелил в кусок папиросной бумаги только для того, чтобы тот отлетел. Резерфорд пришел к выводу, что, поскольку большая часть альфа-частиц прошла, атомы золота должны быть в основном пустым пространством, а не сливовым пудингом Томсона, заполняющим пространство. Поскольку несколько альфа-частиц были отклонены, в каждом атоме должна быть плотно упакованная положительная область, которую он назвал ядром.При всем положительном заряде ядра следующим вопросом было расположение электронов в атоме.
В 1900 году физик Макс Планк изучал процессы света и тепла , в частности, пытаясь понять световое излучение, испускаемое «черным телом», идеальной полостью, образованной идеально отражающими стенками. Эта полость представлялась как содержащая объекты, называемые осцилляторами, которые поглощают и излучают свет и тепло. При наличии достаточного количества времени излучение такого черного тела будет производить распределение цветного света, называемое спектром , которое зависит только от температуры черного тела, а не от того, из чего оно сделано.Многие ученые пытались найти математическое соотношение, которое предсказывало бы, как осцилляторы черного тела могут производить определенное спектральное распределение. Макс Планк обнаружил это правильное математическое соотношение. Он предположил, что энергия , поглощенная или испускаемая осцилляторами, всегда кратна некоторому фундаментальному «пакету энергии», который он назвал квантом. Объекты, которые излучают или поглощают энергию, делают это в дискретных количествах, называемых квантами.
В это же время с Томсоном и Резерфордом работал физик по имени Нильс Бор.Бор понял, что идея кванта энергии может объяснить, как устроены электроны в атоме. Он описал электроны как находящиеся «на орбите» вокруг ядра, как планеты вокруг солнца . Подобно осцилляторам в черном теле, у электронов в атоме не может быть любой энергии на орбите или . Были только Изотопы водорода: водород, дейтерий и тритий. Иллюстрация Ганса и Кэссиди. Предоставлено Gale Group.определенные расстояния, которые допускала энергия электрона . Если электрон определенного атома поглотит точно правильный квант энергии, он сможет уйти дальше от ядра. Если бы электрон, находящийся дальше от ядра, излучал точно правильный квант энергии, он мог бы приблизиться к ядру. Какие именно правильные значения различались для каждого элемента. Эти значения могут быть определены с помощью процесса, называемого атомной спектроскопией , экспериментального метода, который рассматривает спектр света, создаваемый атомами.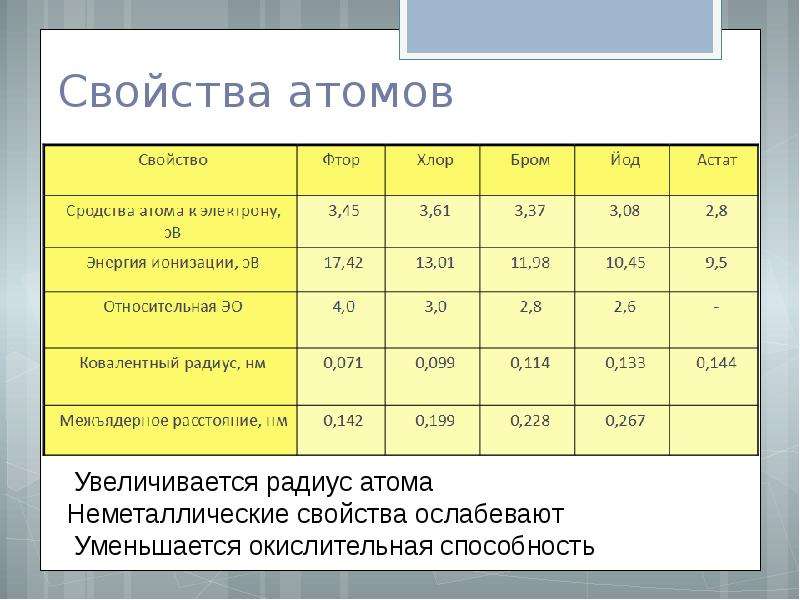 Атом был нагрет так, что все его электроны были удалены от ядра. По мере приближения к ядру электроны начинают излучать свои кванты энергии в виде света. Спектр излучаемого света можно было исследовать с помощью призмы . Спектр, полученный таким образом, не показал все возможные цвета , а только те немногие, которые соответствовали энергиям, соответствующим разностям электронных орбит. Хотя позже уточненная “планетарная модель” атома Бора достаточно хорошо объяснила данные атомной спектроскопии , ученые снова обратили внимание на ядро атома.
Атом был нагрет так, что все его электроны были удалены от ядра. По мере приближения к ядру электроны начинают излучать свои кванты энергии в виде света. Спектр излучаемого света можно было исследовать с помощью призмы . Спектр, полученный таким образом, не показал все возможные цвета , а только те немногие, которые соответствовали энергиям, соответствующим разностям электронных орбит. Хотя позже уточненная “планетарная модель” атома Бора достаточно хорошо объяснила данные атомной спектроскопии , ученые снова обратили внимание на ядро атома.
Резерфорд вместе с Фредериком Содди продолжили работу с радиоактивными элементами. Содди, в частности, заметил, что когда альфа- и бета-частицы испускались из атомов, атомы менялись одним из двух способов: (1) элемент стал совершенно другим элементом с совершенно новыми химическими реакциями, или (2) элемент поддерживал те же химические реакции и тот же атомный спектр, но изменился только атомный вес.
Он назвал атомы второй группы изотопами, атомами одного элемента с разным атомным весом. В любом природном образце элемента может быть несколько типов изотопов. В результате атомный вес элемента, который был рассчитан Берцелиусом, фактически был средним из всех весов изотопа для этого элемента. Это было причиной того, что некоторые элементы не располагались в правильном порядке в периодической таблице Менделеева – средний атомный вес зависел от количества присутствующих изотопа каждого вида. Содди предложил расположить элементы в периодической таблице по сходству химических реакций, а затем пронумеровать их по порядку.Номер, присвоенный каждому элементу таким образом, называется атомным номером . Атомные номера были удобным способом обозначать элементы.
В любом природном образце элемента может быть несколько типов изотопов. В результате атомный вес элемента, который был рассчитан Берцелиусом, фактически был средним из всех весов изотопа для этого элемента. Это было причиной того, что некоторые элементы не располагались в правильном порядке в периодической таблице Менделеева – средний атомный вес зависел от количества присутствующих изотопа каждого вида. Содди предложил расположить элементы в периодической таблице по сходству химических реакций, а затем пронумеровать их по порядку.Номер, присвоенный каждому элементу таким образом, называется атомным номером . Атомные номера были удобным способом обозначать элементы.
Тем временем Томсон продолжил свою работу с трубкой Крукса. Он обнаружил, что генерируются не только катодные лучи электронов, но и положительные частицы. После долгой кропотливой работы он смог разделить множество различных видов положительных частиц по весу. Основываясь на этих измерениях, он смог определить элементарную частицу, наименьшую из произведенных положительных частиц, названную протоном .Поскольку они были произведены атомами катода и поскольку Резерфорд показал, что ядро атома положительно, Томсон понял, что ядро атома должно содержать протоны. Молодой ученый Генри Мозли экспериментировал с бомбардировкой атомов различных элементов рентгеновскими лучами. Как и в атомной спектроскопии, где тепло дает электронам больше энергии, рентгеновские лучи дают протонам в ядре больше энергии. И точно так же, как электроны излучают свет определенной энергии при охлаждении, ядро излучает рентгеновские лучи определенной энергии, когда оно «снимает возбуждение».Мозли обнаружил, что энергия испускаемых рентгеновских лучей для каждого элемента подчиняется простой математической зависимости. Энергия зависит от атомного номера этого элемента, а атомный номер соответствует количеству положительных зарядов в ядре. Так что правильный порядок периодической таблицы Менделеева за счет увеличения числа протонов в атомном ядре. Число протонов равно количеству электронов в нейтральном атоме. Электроны несут ответственность за химические реакции. Элементы в одном столбце периодической таблицы имеют схожее расположение электронов с наибольшей энергией, и поэтому их реакции подобны.
Осталась только одна проблема. Электроны имели очень небольшой вес, 1/1836 веса протона. Однако протоны не учитывают весь атомный вес атома. Лишь в 1932 году Джеймс Чедвик обнаружил в ядре частицу без электрического заряда, но с массой немного больше, чем у протона. Он назвал эту частицу , нейтрон . Нейтроны ответственны за существование изотопов. Два атома одного и того же элемента будут иметь одинаковое количество протонов и электронов, но у них может быть разное количество нейтронов и, следовательно, разный атомный вес.Изотопы именуются указанием названия элемента, а затем количества протонов и нейтронов в ядре. Сумма протонов и нейтронов называется массовым числом . Например, уран-235 имеет 235 протонов и нейтронов. Мы можем взглянуть на периодическую таблицу, чтобы найти атомный номер урана (92), который сообщает нам количество протонов. Затем, вычитая, мы узнаем, что у этого изотопа 143 нейтрона. Есть еще один изотоп урана, , 238, , U, с 92 протонами и 146 нейтронами.Некоторые комбинации протонов и нейтронов менее стабильны, чем другие. Представьте, что вы пытаетесь держать в руках 10 шаров для боулинга. Будет какая-то договоренность, по которой вы, возможно, сможете с этим справиться. Теперь попробуйте держать 11 или только девять. Возможно, не будет стабильной конструкции, и вы уроните шары для боулинга. То же самое происходит с протонами и нейтронами. Неустойчивые устройства самопроизвольно разваливаются, испуская частицы, пока не будет достигнута стабильная структура. Так образуется радиоактивность, подобная альфа-частицам.Альфа-частицы состоят из двух протонов и двух нейтронов, вылетающих из нестабильного ядра.
Водород имеет три вида изотопов: водород, 2 H (дейтерий) и 3 H (тритий).
Атомные массы других элементов первоначально сравнивались с водородом без указания изотопов. Также трудно получить отдельные атомы водорода, потому что он обычно реагирует с другими атомами с образованием молекул, таких как H 2 или H 2 O.Поэтому для сравнения был выбран изотоп другого элемента. Атомные веса теперь основаны на 12 C (углерод-12). В ядре этого изотопа шесть протонов и шесть нейтронов. Углерод-12 был определен как 12 атомных единиц массы . (Атомные единицы массы, сокращенно а.е.м., используются для сравнения относительных масс атомов. Одна а.е.м. меньше 200 секстиллионтов грамма.) С этим сравнивается любой другой изотоп любого другого элемента. Затем веса изотопов данного элемента усредняются, чтобы получить атомные веса, найденные в периодической таблице.
До этого момента в истории атома все частицы, составляющие атом, представлялись твердыми однородными сферами. Начиная с 1920 года с творчеством Луи де Бройля этот образ изменился. Де Бройль показал, что частицы, подобные электронам, иногда могут обладать свойствами волн. Например, если волны на воде создаются двумя источниками, например, при падении двух камешков в пруд, волны могут мешать друг другу. Это означает, что высокие точки складываются, чтобы получить еще более высокие точки. Низкие точки добавляют, чтобы сделать еще более низкие области.Когда электроны проходили через двойную щель, причем часть электронов проходила через одну щель, а часть – через другую, они фактически создавали два источника. Электроны показали такую же интерференцию , создавая узор на собирающей пластине. Способность электронов и других частиц иногда проявлять свойства частиц, а иногда и волн, называется дуальностью волна-частица. Такое усложнение природы электрона означало, что идея Бора о планетарном атоме была не совсем верной.Электроны действительно имеют разные дискретные энергии, но они не движутся по круговым орбитам. В 1925 году Вернер Гейзенберг заявил, что точная скорость и местоположение электрона не могут быть известны одновременно. Этот «Принцип неопределенности Гейзенберга» вдохновил Эрвина Шредингера на создание уравнения для расчета движения электрона с определенной энергией. Уравнение Шредингера описывает области в атоме, где, вероятно, находится электрон с определенной энергией, но не совсем там, где он находится.Эта область вероятности называется орбитальной. Электроны движутся по этим орбиталям так быстро, что мы можем думать о них как о размытии электронного облака . Электроны перемещаются с одной орбитали на другую, поглощая или испуская квант энергии, как объяснил Бор.
| Размер | Размер атома составляет примерно 10 -10 метра (или 10 -8 сантиметра). Этот означает, что ряд из 10 8 (или 100000000) атомов будет растягиваться на сантиметр размером с ноготь.Атомы разных элементов разных размеров, но 10 -10 м можно рассматривать как приблизительное значение для любой атом. Также неплохо думать об атомах как об атомах. сферической формы, хотя они не всегда таковы. Атом с наименьшая масса – атом водорода; его масса составляет порядка 10 -27 кг. Масса других атомов увеличивается примерно в 200 раз. Ядро атома имеет размер 10 -15 м; это означает, что речь идет о 10 -5 (или 1/100 000) размера всего атома.Хорошее сравнение ядра с атомом похоже на горошину посреди ипподрома. (10 -15 м. типичен для ядер меньшего размера; большие увеличиваются примерно в 10 раз что.) | ||||||||||||||
| Масса | Ядро хоть и очень маленькое, но массивное по сравнению с остальная часть атома. Обычно ядро содержит более 99,9% массы атома. (Следовательно, числа, приведенные выше для масс атомы также относятся приблизительно только к ядру.) Ядра обычно сферические. по форме, хотя некоторые имеют сфероидальную (яйцевидную) форму. | Субатомные частицы | Ядро состоит из протонов и нейтронов, связанных вместе силы притяжения. Внешний объем атома (что означает большую часть атом) занят электронами. Сам электрон мал (его размер неизвестен, но мы знаем, что он меньше ядра), но он занимает пространство атома, постоянно кружась в своего рода орбита вокруг ядра. Протон и нейтрон имеют сферическую форму, радиус около протон и нейтрон имеют почти одинаковую массу – нейтрон немного больше. Эти массы более чем в 2000 раз превышают массу электрона. Вот почему ядро имеет большую массу атома. | ||||||||||||
| Силы внутри атома | Электрон имеет отрицательный электрический заряд; протон имеет положительный электрический заряд точно такой же силы; у нейтрона нет электрического плата.Подобные обвинения отталкивают, а непохожие – притягивают. Ядро – это плотный шар положительного заряда в центре атома, и он оказывает сила притяжения на электроны, тем самым удерживая их как часть атома. Другими словами, атомов не существовало бы, если бы не электрическая сила. | ||||||||||||||
| Стабильность атома | Почему электроны не попадают в ядро под действием этого сила? Внешне атом выглядит как Солнечная система с планетами, вращающимися вокруг центрального Солнца.Но причина стабильности атома – тот факт, что орбита электрона не коллапсирует – кроется в фундаментальной природе квантовой механики, науки, которая заменяет механику Ньютона в мире атомов. Электрон может существовать только в одном из дискретного набора «энергетических состояний», и состояние с самой низкой энергией является стабильным. Электрон перескакивает из одного состояния в другое, когда он получает или испускает квант энергии в виде света (или другой формы электромагнитного излучения). | ||||||||||||||
| Ядерная сила | Внутри ядра все электрические силы отталкиваются, потому что протоны отталкиваются друг от друга, и нейтроны не чувствуют никакой электрической силы.Как тогда ядро удерживается вместе? Есть еще одна сила, называемая ядерная сила , которая в основном притягивает и действует между двумя протонами, между двумя нейтроны, и между нейтроном и протоном. В ядрах эта сила сильнее чем электрическая сила отталкивания, и поэтому ядра удерживаются вместе. | ||||||||||||||
| Атомы, молекулы и материя в массе | В атоме количество электронов равно количеству протонов, N e = N p .Возможна установка системы с N e , отличной от N p , но тогда это не называется атомом; его называют ионом. На земле большая часть того, что мы делаем контакт с выполнен из атомов. Однако на солнце и звездах большая часть материя находится в форме ионов. Вероятно, что большая часть дела в Вселенная находится в форме ионов. Количество нейтронов в ядре составляет во многих случаях примерно равно количеству протонов. Небольшое количество атомов может объединиться в молекулу, такую как вода (H 2 O) или диоксид углерода (CO 2 . Расположение и перегруппировка атомов в молекулах составляют область химии. Твердое тело состоит из регулярного массива или решетки, содержащей очень большое количество молекулы или атомы. Типичное количество атомов в куске материи в человеческом масштабе 10 24 . S $ конечный поток эндобдж 13 0 объект >>> / BBox [0 0 453.S $ конечный поток эндобдж 15 0 объект > поток Королевское общество © 2017 ABBYY Recognition Server; изменено с помощью iText 4.2.0 пользователем 1T3XT
Произошла ошибка при настройке пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Настройка вашего браузера на прием файлов cookieСуществует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie?Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня. Что сохраняется в файле cookie?Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется. Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать. Произошла ошибка при настройке пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Настройка вашего браузера на прием файлов cookieСуществует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie?Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня. Что сохраняется в файле cookie?Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется. |

 Если вероятности изображены в 3D, они выглядят как
анимированные картинки выше. Все картинки описывают электрон
распределение атома водорода в различных энергетических состояниях (квантовые состояния,
заявляет, если “возбуждение”).
Если вероятности изображены в 3D, они выглядят как
анимированные картинки выше. Все картинки описывают электрон
распределение атома водорода в различных энергетических состояниях (квантовые состояния,
заявляет, если “возбуждение”).
 Разница заключается в
3D каркасная структура алмаза, которая придает ему большую прочность и структурность
целостность (причина в том, что алмаз образуется под очень высоким давлением верхних
мантия).Когда соединение может образовывать более одного типа кристаллической структуры, оно
называется полиморфным. Алмаз и графит представляют собой полиморфы углерода.
Разница заключается в
3D каркасная структура алмаза, которая придает ему большую прочность и структурность
целостность (причина в том, что алмаз образуется под очень высоким давлением верхних
мантия).Когда соединение может образовывать более одного типа кристаллической структуры, оно
называется полиморфным. Алмаз и графит представляют собой полиморфы углерода.