Характеристика химического элемента по положению в Периодической системе химических элементов Д.И.Менделеева. — Балабақша әлемі
Share:
Тема урока: Характеристика химического элемента по положению в Периодической системе химических элементов Д.И.Менделеева.
Тип урока: комбинированный.
Цель: развитие знаний учащихся о характеристике химического элемента по положению в Периодической системе химических элементов Д.И.Менделеева.
Образовательные задачи: научить давать характеристику химическим элементам на основе их положения в периодической системе и строения атома;
Воспитательные задачи: содействовать формированию основных мировоззренческих идей – материальность и познаваемость мира.
Развивающие задачи: содействовать развитию внимания, памяти, интереса учащихся.
Оборудование: учебник, компьютер, интерактивная доска, магнитная доска, магниты, периодическая система, карточки, листы самооценки, лото, черный ящик.
Ход урока.
I. Первоначальный организационный момент: приветствие, проверка отсутствующих, настрой на урок, цель урока.
II. Опрос домашнего задания.
1. «Химический диктант» — работа по точкам.
2. «Пинг-понг»
Сколько групп в таблице Д.И.Менделеева?
Сколько периодов в таблице Д.И.Менделеева?
Какие элементы расположены в первой группе главной подгруппы?
Какие элементы расположены в третьей группе побочной подгруппы?
Металлические свойства по периодам слева направо…….?
Неметаллические свойства по периодам слева направо ….?
Уберите лишний элемент среди ниже перечисленных: натрий, калий, цинк, цезий.
Уберите лишний элемент среди ниже перечисленных: золото, сера, углерод, фосфор.
3. «Заполнить таблицу»
III. Изложение новой темы:
Учитель предлагает рассмотреть план (таблицу) характеристики химического элемента. Учащиеся при рассмотрении плана замечают, что он включает в себя пункты, по которым уже имеется необходимая база знаний.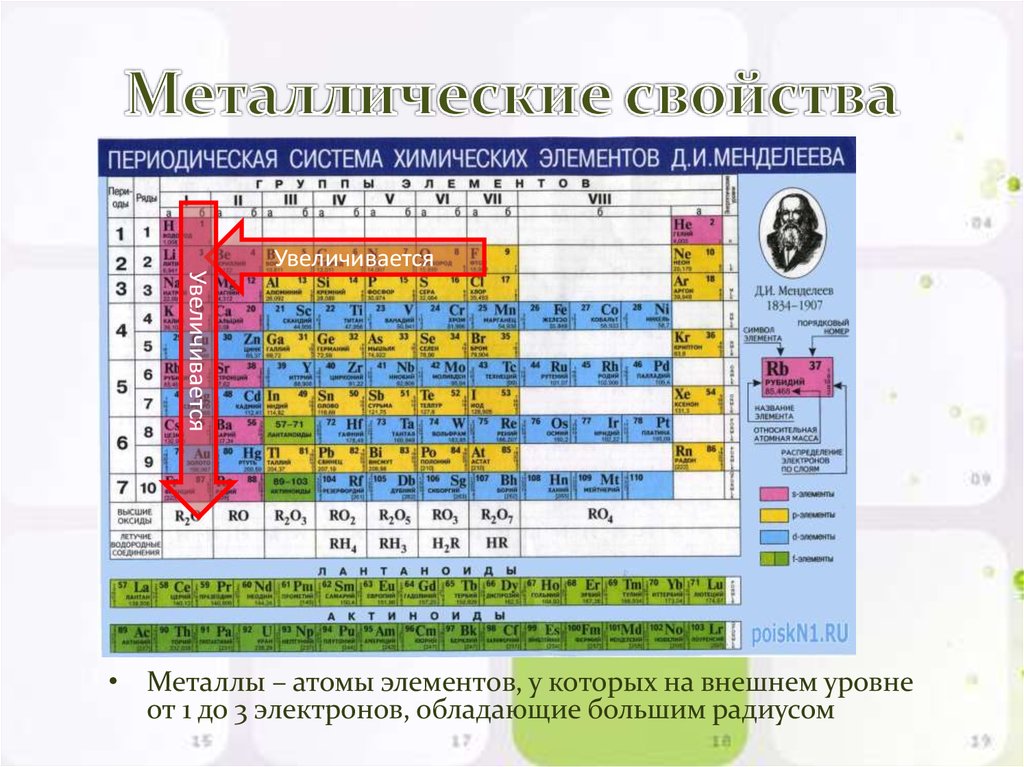 Принимается решение совместно охарактеризовать по плану химический элемент № 11.
Принимается решение совместно охарактеризовать по плану химический элемент № 11.
1. Химический знак и название элемента. Na, натрий
2. Положение элемента в Периодической системе Д.И.Менделеева 3-й период, группа I, главная подгруппа,
порядковый номер – 11
Относительная атомная масса — 23
3. Состав и строение атомов элемента Na (11р,12n),11е
+11 2) 8) 1)
4. Свойство простого вещества, образованного данным элементом, валентность. Na – щелочной металл
Валентность = I
5. Формула высшего оксида и водородного соединения.
IV. Закрепление:
1. «Кот в мешке». Каждый учащийся получает задание охарактеризовать по плану доставшийся химический элемент (химические элементы(бочонки лото) учащиеся достают из мешочка), и заполнить заранее выданную таблицу.
2. Дополнительный материал:
а) «Инсерт» — заполнить текст по учебнику стр.154-156
1. Периодическая ………………… химических …………………………. Д.И.Менделеева содержит …………………………, позволяющие описать строение ……….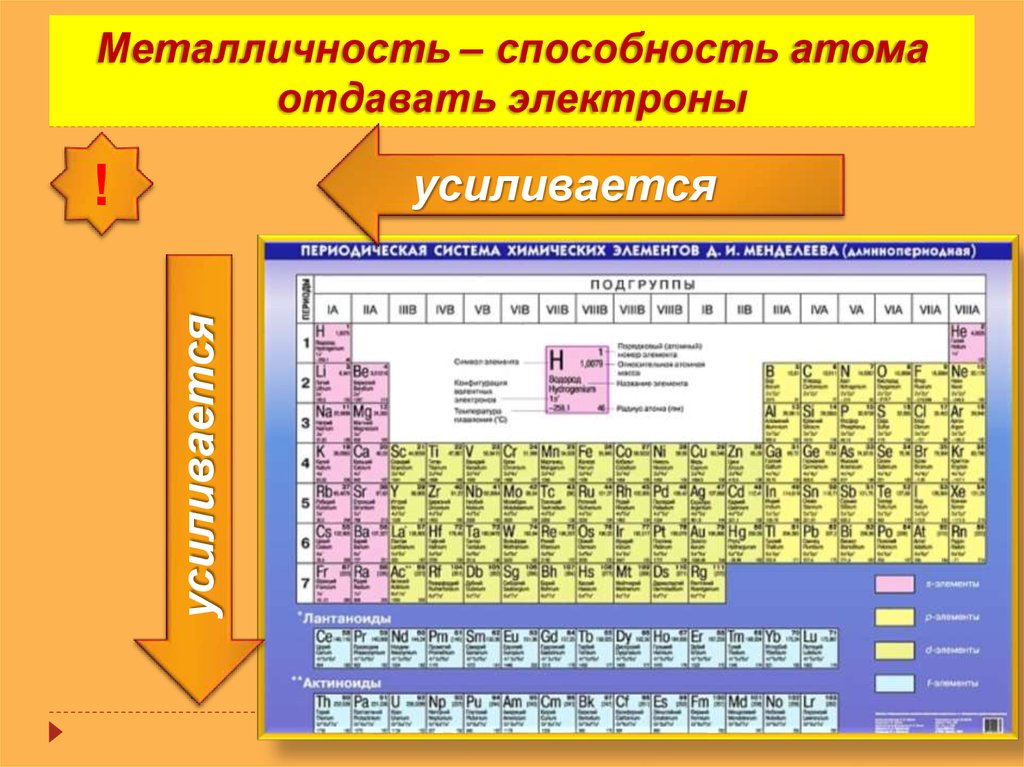 . элементов, предсказать свойства ……………………….. веществ, состав и свойства наиболее характерных ……………… — высших …………………………, соответствующих ……………………………….., а также летучих …………………………….. соединений.
. элементов, предсказать свойства ……………………….. веществ, состав и свойства наиболее характерных ……………… — высших …………………………, соответствующих ……………………………….., а также летучих …………………………….. соединений.
2. Руководствуясь ……………………… законом, Периодической ……………………. химических ………………. Д.И.Менделеева, а также теорией ……………………. атомов, можно объяснить и предсказать строение ………………………. элементов, свойства образованных ими ……………………………… и …………………… веществ.
б) «Темная лошадка» — загадки про химические элементы.
в) «Это интересно…»
V. Рефлексия «Щелочной металл, амфотерный металл, инертный газ»
VI. Подведение итогов, оценивание, выводы.
VII. Домашнее задание
§ 59 стр. 154-156, задание № 1,2
Доклад: Биологическая роль элементов в организме человека.
Shares
Характеристика химического элемента по его положению в периодической системе химических элементов.
Тема: Характеристика химического элемента по его положению в периодической системе
химических элементов.
Цели урока:
-научить составлять план общей характеристики элемента по его положению в периодической системе химических элементов; закрепить умение характеризовать элемент, его свойства и свойства его соединений по положению в периодической системе;
– развивать умение самостоятельно добывать и использовать необходимую информацию, умение делать выводы на основании полученной информации;
– формирование умения работать самостоятельно и в группе.
Тип урока: комбинированный.
Форма урока: индивидуальная, групповая.
Методы урока: прием развития критического мышления «древо знаний», самостоятельное выполнение заданий в группах, защита постеров, обучение через диалог учителя и учащихся.
Оборудование: ПСХЭ, раздаточный материал (яблочки, смайлики, оценочные листы, тест на самооценку для рефлексии,ватманы и фломастеры), интерактивная доска, презентация.
Ход урока
1.Организационный
момент (3 мин). Приветствие.
Приветствие.
Делим класс на 4 группы с помощью химических элементов. Учащиеся, вытянувшие карточки с одним и тем же элементом образуют одну группу. Элементы: натрий, алюминий, фосфор, хлор. Выбор спикеров, которые распределяют работу внутри группы и ведут оценочный лист.
Группам раздаются оценочные листы. Разъяснения по оценочному листу.
2. Проверка домашнего задания (11 мин).
– «красные яблоки уже созрели» – они висят высоко, сорвать их тяжело – вопросы на них самые трудные,
– «желтые яблоки» – висят ниже, сорвать легче – вопросы тоже легче,
–
«зеленые яблоки» – висят
совсем низко, поэтому и вопросы самые простые.
Учащиеся по очереди выбирают яблоки и соответствующие вопросы. Ребята отвечают на вопросы устно, а учитель получает хороший материал для диагностики не только в освоении темы, но и уровня самооценки учащихся. Бумажные яблоки разных цветов раздаются детям за правильные ответы.
Вопросы для карточек зелёного цвета.
1. Кем и когда был открыт периодический закон? (Д.И.Менделеев. 1869 год)
2. Формулировка периодического закона, данная Д.И.Менделеевым. (Свойства элементов, а также состав и свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от их атомных масс)
3. Современная формулировка периодического закона. (Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атом этих элементов)
4. Что представляет собой период? (Период- это ряд химических элементов, расположенных в порядке возрастания атомных масс. Период начинается щелочным металлом и заканчивается инертным элементом)
5. Что
такое периодическая система химических элементов? (Периодическая система
химических элементов – это графическое изображение периодического закона и
естественной классификации химических элементов)
Что
такое периодическая система химических элементов? (Периодическая система
химических элементов – это графическое изображение периодического закона и
естественной классификации химических элементов)
6. Каким образом подразделяют периоды? Почему? (Малые периоды: 1-3 периоды содержат 2-8 химических элементов, большие периоды: 4-7 периоды содержат 18-32 химических элемента)
7. Что представляет собой группа? Сколько групп? (Группа – это вертикальные ряды, в которых располагаются элементы, принадлежащие к одному семейству с одинаковым количество внешних электронов и соответственно проявляющие одинаковые свойства. 8 групп.)
8. Какие элементы образуют главные подгруппы? (Элементы малых и больших периодов)
9. Какие элементы образуют побочные подгруппы? (Переходные элементы больших периодов)
10. Элементы каких групп образуют летучие соединения с водородом? (Элементы главных подгрупп IV-VII групп)
Вопросы для карточек жёлтого цвета.
1. Какие свойства химических элементов Д.И.Менделеев положил в основу их классификации? (Атомную массу, валентность химических элементов и свойства образуемых ими соединений)
2. Какой элемент из предложенных проявляет наиболее ярко выраженные неметаллические свойства: кислород, сера, селен, теллур? Объясните почему? (Кислород. В главных подгруппах сверху вниз неметаллические свойства ослабевают, а металлические усиливаются)
3. Как изменяются свойства химических элементов в периодах? (Слева направо металлические свойства ослабевают, неметаллические свойства усиливаются)
4. Какой элемент из предложенных проявляет наиболее ярко выраженные металлические свойства: магний, кальций, стронций, барий? Объясните почему? (Барий. В главных подгруппах сверху вниз металлические свойства усиливаются, неметаллические ослабевают)
5. У какого
из предложенных элементов наиболее ярко выраженные неметаллические: магний,
кремний, сера, хлор? Объясните почему? (Хлор.
6. У какого элемента из предложенных наиболее ярко выраженные металлические свойства: натрий, магний, алюминий, кремний? Объясните почему? (Натрий. В периодах слева направо металлические свойства ослабевают)
Вопросы для карточек красного цвета.
1. В чем основная причина изменения свойств элементов в периоде? (В постепенном увеличении числа протонов в ядре и числа электронов на внешнем энергетическом уровне)
2. В чем причина усиления металлических свойств элементов в главных подгруппах сверху вниз? (С возрастанием заряда ядер увеличивается число энергетических уровней, внешние валентные электроны отдаляются от ядра, связь с ядром ослабевает и соответственно усиливаются металлические свойства)
3. Почему
изменилась современная формулировка периодического закона? (В связи с открытием
строения атома. Главной характеристикой химического элемента является не его
атомная масса, а заряд ядра его атома. Именно заряд ядра атома определяет
количество электронов, а количество электронов в атоме и их распределение по
уровням определяет свойства химических элементов и их соединений)
Именно заряд ядра атома определяет
количество электронов, а количество электронов в атоме и их распределение по
уровням определяет свойства химических элементов и их соединений)
За каждый правильный ответ учащиеся получают соответствующего цвета яблоки. Зеленые яблоки- 1 балл, жёлтые-2 балла, красные- 3 балла.
Количество баллов учащихся на оценочных листах отмечают спикеры от каждой группы.
Оценочный лист
Группа _____________ Спикер _______________________
№ | Ф.И. учащегося | Количество яблок | Количест во смай ликов | Баллы по количеству яблок: Зеленые-1 балл Желтые-2 балла Красные-3 балла | Баллы по количеству смайликов: 1 балл за каждый смайлик | Всего баллов | Оценка за урок |
1. |
| Зеленых- Желтых- Красных- |
|
|
|
|
|
2. |
| Зеленых- Желтых- Красных- |
|
|
|
|
|
3. |
| Зеленых- Желтых- Красных- |
|
|
|
|
|
4. |
| Зеленых- Желтых- Красных- |
|
|
|
|
|
5. |
| Зеленых- Желтых- Красных- |
|
|
|
|
|
6. |
| Зеленых- Желтых- Красных- |
|
|
|
|
|
Перевод баллов в оценки:
1-4 балла – оценка «3»
5-8 баллов – оценка «4»
9 баллов и больше – оценка «5»
Спикеру необходимо
ознакомить учащихся с их оценками внутри группы.
3. Изучение новой темы (6 мин).
Учитель: Ребята, вы изучили такие темы как «Состав и строение атома», «Периодический закон и периодическая система химических элементов». Сегодня на уроке мы с вами научимся давать характеристику химическому элементу по его положению в периодической системе химических элементов. Запишите тему урока в тетрадях «Характеристика химического элемента по его положению в периодической системе химических элементов». Главной характеристикой атома является его строение, т.е. такие характеристики как заряд ядра, распределение электронов по уровням, валентность. Скажите можем ли мы эти сведения получить из периодической системы химических элементов.
Давай вспомним и заполним таблицу, показывающую взаимосвязь главных характеристик Периодической системы со строением атома элемента.
Таблицу учащиеся чертят и заполняют в тетрадях.
Главные характеристики элементов и их взаимосвязь со строением атомов.
Периодическая система химических элементов | Строение атомов химических элементов |
1. | 1. Положительный заряд ядра, число протонов и общее число электронов |
2. Номер периода | 2. Число электронных слоев в атоме |
3. Номер группы | 3. Число электронов внешнего электронного слоя (для элементов главных подгрупп), высшая валентность в кислородных соединениях |
Вопросы, задаваемые в ходе заполнения таблицы:
1. Что является главной характеристикой химического элемента в периодической системе химических элементов? (порядковый номер)
2. Что можно определить в строении атома по порядковому номеру химического элемента? (положительный заряд ядра, число протонов и общее число электронов)
3. Какие еще характеристики Периодической системы мы знаем? (номер периода, номер группы)
4. Что можно определить по номеру периода в котором находится химический элемент? (число электронных слоев в атоме этого элемента)
5. Что можно
определить по номеру группы в котором находится химический элемент? (Число
электронов внешнего электронного слоя (для элементов главных подгрупп), высшая
валентность в кислородных соединениях)
Что можно
определить по номеру группы в котором находится химический элемент? (Число
электронов внешнего электронного слоя (для элементов главных подгрупп), высшая
валентность в кислородных соединениях)
За правильные ответы учащимся раздаются смайлики.
Далее предлагаю вам ознакомиться с планом по которому мы будем давать характеристику химическим элементам.
План характеристики химических элементов на основе теории строения атома и положения его в периодической системе.
План характеристики | Пример | |||||||||||||
1. Химический символ и название элемента | Mg, магний | |||||||||||||
2. Положение элемента в периодической системе химических элементов: -порядковый номер -относительная атомная масса, Аr -период -группа,
подгруппа. |
№12 элемент Аr(Mg)=24 3-ий период ІІ группа, главная подгруппа | |||||||||||||
3. Состав и строение атома элемента: -состав атома -распределение электронов по уровням -электронная формула атома
– графическая электронная формула | 24 _ 12Mg(12р, 12n), 12 е +12 Mg )2 )8 )2 1s22s22p63s23p03d0
1s2 2s2 2p6 3s2 3p0
| |||||||||||||
4. -металл или неметалл, или же проявляет амфотерные свойства -высшая валентность |
Mg- металл
Валентность постоянная – ІІ | |||||||||||||
5. Формула высшего оксида и летучего водородного соединения | MgО – оксид магния, летучее водородное соединение не образует |
В ходе рассмотрения плана характеристики химического элемента учащимся задаются уточняющие и дополняющие вопросы, за ответы на которые учащимся раздаются смайлики:
1. Как определяют количество нейтронов в атоме? (находим по разности между относительной атомной массы и порядковым номером: N= Аr-Z)
2. Как определяем максимальное количество электронов которое может разместиться на уровне? (по формуле N=2n2)
3. Сколько
электронов максимально может разместиться на первом, втором, третьем, четвертом
уровнях? (на первом-2 электрона, на втором-8 электронов, на третьем-18
электронов, на четвертом-32 электрона)
Сколько
электронов максимально может разместиться на первом, втором, третьем, четвертом
уровнях? (на первом-2 электрона, на втором-8 электронов, на третьем-18
электронов, на четвертом-32 электрона)
4. Какие подуровни имеются на каждом уровне? (на первом уровне – s-подуровень, на втором- s и p-подуровни, на третьем – s, p и d-подуровни, на четвертом- s, p, d и f-подуровни)
5. Сколько электронов может разместиться на каждом из подуровней? (на s-подуровне 2 электрона, на p-подуровне 6 электронов, на d-подуровне 10 электронов и на f-подуровне 14 электронов)
6. Как можно определить по количеству внешних электронов свойства элементов? (1-3 электрона- металл, 4-8 электрона – неметалл)
7. Чему равна высшая валентность химического элемента в оксидах? (высшую валентность можно определить по номеру группы для элементов главных подгрупп)
4.
Закрепление (18 мин). Учитель: Далее каждая группа
выполняет следующие задания (на интерактивной доске). Оценивание этого задания
осуществляет спикер. Спикер будет решать кому дать смайлик по следующим
критериям: участие учащегося в выполнении задания на ватмане и выступление
перед классом.
Спикер будет решать кому дать смайлик по следующим
критериям: участие учащегося в выполнении задания на ватмане и выступление
перед классом.
1 задание. Учащиеся каждой группы на ватманах дают характеристику тому элементу по которому они поделились на группы в начале урока: натрий, алюминий, фосфор, хлор.
Ответы учащихся:
Na, натрий | Al, алюминий | P, фосфор | Cl, хлор | ||||||||||||||||||||||||||||||||||||||||||||||||||||
№11 элемент Аr(Na)=23 3-ий период І группа, главная подгруппа | №13 элемент Аr(Al)=27 3-ий период ІІІ группа, главная подгруппа | №15 элемент Аr(P)=31 3-ий период V группа, главная подгруппа | №17 элемент Аr(Cl)=35,5 3-ий период VІІ группа, главная подгруппа | ||||||||||||||||||||||||||||||||||||||||||||||||||||
23 _ 11Na (11р, 12n), 11 е +11 Na )2 )8 )1 1s22s22p63s13p03d0
1s2 2s2 2p6 3s2 3p0
| 27 _ 13Al (13р, 14n), 13 е +13 Al )2 )8 )3 1s22s22p63s23p13d0
1s2 2s2 2p6 3s2 3p1
| 31 _ 15P (15р, 16n), 15 е +15 P )2 )8 )5 1s22s22p63s23p33d0
1s2 2s2 2p6 3s2 3p3
| 35 _ 17Cl (17р, 18n), 17 е +17 Cl )2 )8 )7 1s22s22p63s23p53d0
1s2 2s2 2p6 3s2 3p0
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Na- металл Валентность постоянная – І | Al- амфотерный элемент Валентность постоянная – ІІІ | P-неметалл Валентность переменная, высшая валентность – V | Cl-неметалл Валентность переменная, высшая валентность – VII | ||||||||||||||||||||||||||||||||||||||||||||||||||||
Na 2О – оксид натрия, летучее водородное соединение не образует | Al2O3– оксид алюминия, летучее водородное соединение не образует | P2O5– оксид фосфора (V), летучее водородное соединение – PH3 | Cl2O7– оксид хлора (VII) летучее водородное соединение – HCl |
Учащиеся защищают
свои постеры. Работу учащихся в группах оцениваем совместно со спикерами.
Учитель: Спикер, кому из учащихся твоей группы за выполнение этого задания ты
хотел бы дать смайлики? Раздаются смайлики членам групп.
Работу учащихся в группах оцениваем совместно со спикерами.
Учитель: Спикер, кому из учащихся твоей группы за выполнение этого задания ты
хотел бы дать смайлики? Раздаются смайлики членам групп.
Спикеры групп считают количество баллов по количеству яблок и смайликов.
Если останется время можно выполнить следующее задание.
Задание 2. (если останется время на его выполнение)
Задача для группы Na.
Назвать элемент по таким данным: находится в III группе, относительная молекулярная масса высшего оксида 102.
а) Алюминий; б)Скандий; в)Галлий.
Дано: Решение:
R2O3
Mr(R2O3)=102
Mr(R2O3)=102, Ar(O)=16
2x+16*3=102
2x=102-48
2x=54
x=27
R-?
Данная Аг соответствует элементу Al.
Ответ: Алюминий.
Задача для группы Al.
Назвать элемент по таким данным: находится во VI группе, относительная молекулярная масса высшего оксида 80.
а) Сера; б) Селен ; в) Теллур
Дано: Решение:
RО3
Mr(RО3)
Mr(RО3)=80, Ar(O)=16
R-?
x+16*3=80,
x=80-48=32
Данная Аг
соответствует элементу S.
Ответ: Сера
Задача для группы P.
Назвать элемент по таким данным: находится в IV группе, относительная молекулярная масса высшего оксида 60.
а) Олово; б) Кремний; в) Углерод
RO2
Mr(RO2)=60
Mr(RO2)=60, Ar(O)=16
x+32=60
x=60-32=28
R-?
Дано: Решение:
Данная Аг соответствует элементу Si.
Ответ: Кремний
Задача для группы Cl.
Назвать элемент по таким данным: находится в V группе, относительная молекулярная масса высшего оксида 108.
а) Азот; б)Фосфор; в)Мышьяк.
Дано: Решение:
R2O5
Mr(R2O5)=108
Mr(R2O5)=102, Ar(O)=16
2x+16*5=108
2x=108-80
2x=28
x=214
R-?
Данная Аг соответствует элементу N.
Ответ: Азот
Домашнее задание (1 мин) §59, дать характеристику двум элементам: металлу и неметаллу по плану.
Оценивание
(2 мин) Спикеры
на оценочных листах проставляют баллы и оценки, знакомят членов группы с их
оценками за урок.
Рефлексия (3 мин)
По результатам своей работы на уроке, вам необходимо установить степень достижения учебной цели и приобретение уверенности в своих знаниях.
Предлагаю проанализировать то, чему вы научились на уроке. Выполните тест.
Ф.И. учащегося___________________________________
Тест (для самоанализа полученных знаний и приобретенных умений)
Знания и умения | Да(+) | Нет(-) |
1) Я знаю, что такое : |
|
|
а) план характеристики элемента по положению в периодический системе |
|
|
б) логическая последовательность характеристики элемента по положению в периодической системе |
|
|
2) Я умею определять для элемента : |
|
|
а) число элементарных частиц (протонов, нейтронов, электронов) в атоме |
|
|
б) число энергетических уровней |
|
|
в) электронную формулу |
|
|
г) число электронов на внешнем уровне у атома |
|
|
д) валентность элемента |
|
|
е) высшую степень окисления элемента |
|
|
ж) металлом или неметаллом является описываемый элемент |
|
|
з) формулу высшего оксида и водородного соединения |
|
|
3) Я умею сравнивать свойства элемента со свойствами соседних по периодической системе элементов |
|
|
Подведение
итогов.
Свойства элементов | Биология для неспециалистов I
Результаты обучения
- Определение свойств элементов с учетом периодической таблицы
Атомный номер и масса
Каждый элемент имеет свои уникальные свойства. Каждый из них содержит разное количество протонов и нейтронов, что дает ему собственный атомный номер и массовое число. Атомный номер элемента равен количеству протонов, содержащихся в этом элементе. массовое число — это количество протонов плюс количество нейтронов этого элемента. Следовательно, можно определить количество нейтронов, вычитая атомный номер из массового числа.
Эти номера предоставляют информацию об элементах и о том, как они будут реагировать при объединении. Различные элементы имеют разные температуры плавления и кипения и находятся в разных состояниях (жидком, твердом или газообразном) при комнатной температуре. Они также сочетаются по-разному. Некоторые образуют определенные типы связей, а другие нет. То, как они объединяются, зависит от количества присутствующих электронов. Из-за этих характеристик элементы расположены в периодическая таблица элементов , таблица элементов, которая включает атомный номер и относительную атомную массу каждого элемента. Периодическая таблица также предоставляет ключевую информацию о свойствах элементов (рис. 1), часто обозначаемых цветовой маркировкой. Расположение в таблице также показывает, как организованы электроны в каждом элементе, и дает важные сведения о том, как атомы будут реагировать друг с другом, образуя молекулы.
То, как они объединяются, зависит от количества присутствующих электронов. Из-за этих характеристик элементы расположены в периодическая таблица элементов , таблица элементов, которая включает атомный номер и относительную атомную массу каждого элемента. Периодическая таблица также предоставляет ключевую информацию о свойствах элементов (рис. 1), часто обозначаемых цветовой маркировкой. Расположение в таблице также показывает, как организованы электроны в каждом элементе, и дает важные сведения о том, как атомы будут реагировать друг с другом, образуя молекулы.
Рисунок 1. Периодическая таблица, расположенная в столбцах и строках в зависимости от характеристик элементов, содержит ключевую информацию об элементах и о том, как они могут взаимодействовать друг с другом, образуя молекулы. Большинство периодических таблиц содержат ключ или легенду к содержащейся в них информации.
Практический вопрос
Заполните следующую таблицу информацией из периодической таблицы
| Название элемента | Символ | Атомный номер | Атомная масса (округлить до ближайшего целого числа) |
|---|---|---|---|
| Бериллий | |||
| 8 | |||
| С | |||
| 32 | |||
| На |
Показать заполненную таблицу
Взаимодействие элементов
То, как элементы взаимодействуют друг с другом, зависит от того, как расположены их электроны и сколько отверстий для электронов существует в самой внешней области, где электроны присутствуют в атоме.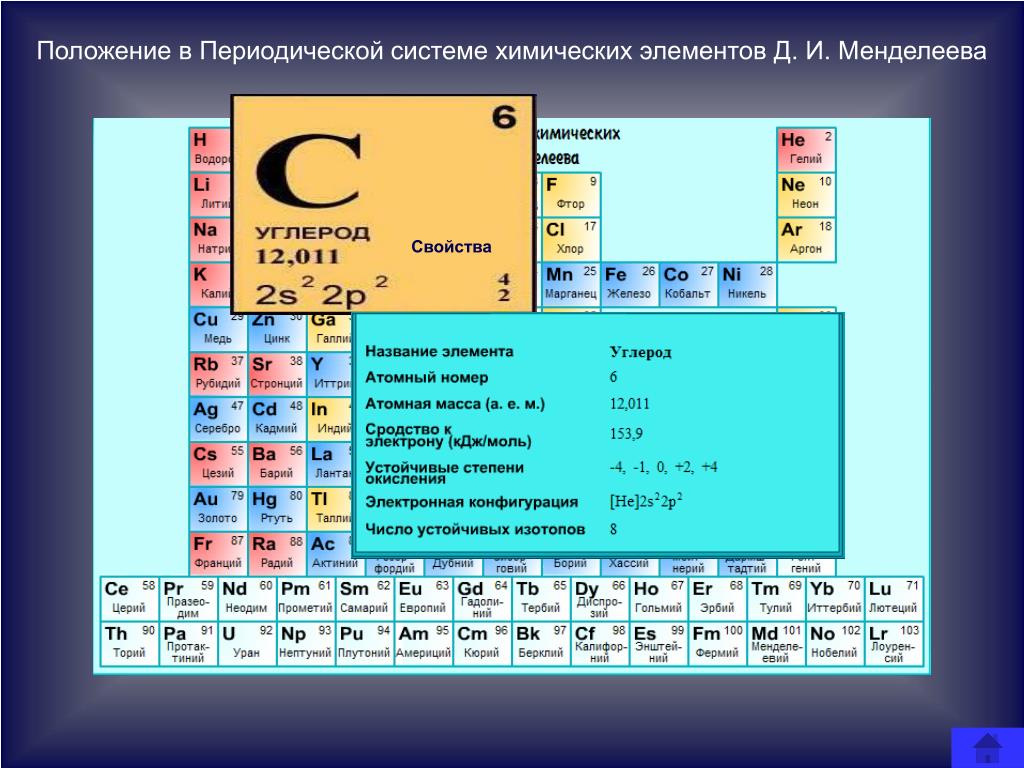 Электроны существуют на энергетических уровнях, которые образуют оболочки вокруг ядра. Ближайшая оболочка может содержать до двух электронов. Ближайшая к ядру оболочка всегда заполняется первой, прежде чем может быть заполнена любая другая оболочка. Водород имеет один электрон; поэтому у него занято только одно место в самой нижней оболочке. У гелия два электрона; поэтому он может полностью заполнить нижнюю оболочку своими двумя электронами. Если вы посмотрите на периодическую таблицу, то увидите, что водород и гелий — единственные два элемента в первой строке. Это потому, что у них есть только электроны в их первой оболочке. Водород и гелий — единственные два элемента, которые имеют самую нижнюю оболочку и не имеют других оболочек.
Электроны существуют на энергетических уровнях, которые образуют оболочки вокруг ядра. Ближайшая оболочка может содержать до двух электронов. Ближайшая к ядру оболочка всегда заполняется первой, прежде чем может быть заполнена любая другая оболочка. Водород имеет один электрон; поэтому у него занято только одно место в самой нижней оболочке. У гелия два электрона; поэтому он может полностью заполнить нижнюю оболочку своими двумя электронами. Если вы посмотрите на периодическую таблицу, то увидите, что водород и гелий — единственные два элемента в первой строке. Это потому, что у них есть только электроны в их первой оболочке. Водород и гелий — единственные два элемента, которые имеют самую нижнюю оболочку и не имеют других оболочек.
Второй и третий энергетические уровни могут содержать до восьми электронов. Восемь электронов расположены в четырех парах, и одна позиция в каждой паре заполняется электроном до того, как любые пары будут заполнены.
Рис. 2. Диаграммы Бора для водорода, гелия, лития, углерода, фтора, неона, натрия, кремния, хлора и аргона.
Снова взглянув на периодическую таблицу (рис. 1), вы заметите, что в ней семь строк. Эти строки соответствуют количеству оболочек, которые имеют элементы в этой строке. Элементы в определенной строке имеют увеличивающееся количество электронов по мере продвижения столбцов слева направо. Хотя каждый элемент имеет одинаковое количество оболочек, не все оболочки полностью заполнены электронами. Если вы посмотрите на вторую строку периодической таблицы, вы найдете литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F), и неон (Ne). Все они имеют электроны, которые занимают только первую и вторую оболочки. У лития только один электрон на внешней оболочке, у бериллия — два электрона, у бора — три и так далее, пока вся оболочка не будет заполнена восемью электронами, как в случае с неоном.
Подробный рисунок электронных оболочек для каждого элемента можно найти здесь.
Попробуйте
Внесите свой вклад!
У вас есть идеи по улучшению этого контента? Мы будем признательны за ваш вклад.
Улучшить эту страницуПодробнее
Справочник по характеристикам элемента
В химии чистое вещество относится к тем веществам, которые состоят из одинаковых составляющих частиц (атомов или молекул). Элементы – это чистые вещества, состоящие из атомов одного вида. Их нельзя разбить на более простые частицы посредством физических или химических изменений. В периодической таблице элементов они сгруппированы в металлы, неметаллы и металлоиды. Известно, что металлы обладают некоторыми отличительными свойствами, которых лишены неметаллы. Металлоиды, с другой стороны, являются границей между металлами и неметаллами и обладают свойствами обеих групп.
Периодическая таблица: Таблица элементов
Все известные элементы расположены в небольшой шпаргалке, специально предназначенной для этой цели, известной как периодическая таблица. В настоящее время человеку известно около 118 элементов. Периодическая таблица разделена на строки и столбцы. Строки периодической таблицы называются периодами и определяют количество орбиталей для этого конкретного периода. Вертикальные столбцы периодической таблицы называются группами. Все элементы в определенной группе будут иметь одинаковое количество валентных электронов.
Вертикальные столбцы периодической таблицы называются группами. Все элементы в определенной группе будут иметь одинаковое количество валентных электронов.
Важными характеристиками элемента в периодической таблице являются его атомный символ, атомный номер и массовое число.
Заслуга в создании проекта современной таблицы Менделеева принадлежит Дмитрию Менделееву, русскому химику. Когда он составлял свою периодическую таблицу, было известно всего 63 элемента. В настоящее время человечеству известно около 118 элементов, которые занесены в периодическую таблицу.
Характеристики элемента
Элемент обладает несколькими характеристиками. Эти характеристики определяют элемент и являются точками различия между различными элементами и между элементами и другими веществами. Вот некоторые из характеристик элемента:
- Элемент состоит из одинаковых типов атомов. Это означает, что их нельзя разложить на более простые компоненты с помощью каких-либо физических или химических процессов.

- Атомный номер элемента является наиболее определяющей характеристикой элемента, которая отличает его от других элементов. Атомный номер элемента относится к количеству протонов, содержащихся в одном атоме этого конкретного элемента. Например, атомный номер водорода равен 1. Это означает, что количество протонов в одном атоме типичного водорода равно 1. Атомный номер элемента обозначается буквой Z.
- Атомный символ элемента используется как форма представления указанного элемента в периодической таблице. Например, атомный символ углерода – C. Следовательно, буква C представляет собой элемент углерода в периодической таблице.
- Массовое число элемента обозначает атомную массу указанного элемента. Буква А обозначает массовое число элемента. Оно равно общему числу протонов и нейтронов атома, так как электроны имеют ничтожно малую массу. Например, массовое число кислорода равно 16. Следовательно, для элемента кислорода «А» равно 16,9.0006
- Различные элементы имеют разные температуры плавления и кипения.

Субатомные частицы
До открытия субатомных частиц считалось, что атомы неделимы. Однако после открытия субатомных частиц в конце девятнадцатого века эта область мысли была заброшена.
Атомы состоят из протонов, нейтронов и электронов. Согласно атомной модели Бора, протоны и нейтроны находятся в ядре атома. Электроны вращаются вокруг ядра на фиксированных энергетических уровнях. Число электронов на самой внешней оболочке известно как валентные электроны. Атомы отдают, получают или делят электроны, когда они реагируют, чтобы получить октет в самой внешней оболочке. Число электронов, которые элемент приобретает или теряет, чтобы получить октет, называется его валентностью.
Электронная конфигурация элемента
Электронная конфигурация элемента относится к расположению электронов на орбитах конкретного элемента. Согласно атомной модели Бора, максимальное число электронов, которые могут разместиться на данной оболочке, рассчитывается по формуле 2n2, где n равно номеру оболочки. Согласно этой формуле, на первой оболочке могут разместиться 2 электрона, на второй оболочке — 8 электронов, на третьей — до 18 электронов и так далее. Согласно правилу октета, максимальное количество электронов, которое может быть размещено на самой внешней/валентной оболочке элемента, равно 8.
Согласно этой формуле, на первой оболочке могут разместиться 2 электрона, на второй оболочке — 8 электронов, на третьей — до 18 электронов и так далее. Согласно правилу октета, максимальное количество электронов, которое может быть размещено на самой внешней/валентной оболочке элемента, равно 8.
Электроны заполняются в порядке возрастания энергетических уровней. Это свойство называется принципом Ауфбау. Сначала заполняются орбитали с наименьшими энергетическими уровнями, а затем с более высокими энергетическими уровнями. Первая оболочка (n=1) состоит только из одной орбитали (ей). Вторая оболочка (n=2) состоит из двух орбиталей (s,p). Третья оболочка (n=3) состоит из трех орбиталей (s,p,d). Четвертая оболочка (n=4) состоит из четырех орбиталей (s,p,d,f).
Электронная конфигурация некоторых элементов
Электронная конфигурация первых 20 элементов приведена следующим образом:
- Hydrogen-1S1
- Helium-1S2
- Lithium-1S2,2S1
- Beryllium-1S2,2S2
- BORON-1S1 2S21P1666666S2
- BORON-1S1 2.




 Порядковый
номер элемента
Порядковый
номер элемента
 Свойства простого вещества, образованного данным элементом:
Свойства простого вещества, образованного данным элементом:

