Характеристика химического элемента на основании его положения в Периодической системе химических элементов Д.И. Менделеева | Презентация к уроку по химии (9 класс) на тему:
Слайд 1
Характеристика химического элемента на основании его положения в Периодической системе химических элементов Д.И. Менделеева
Слайд 2
Открытие Периодического закона В 1869 году Д.И.Менделеев на основе данных накопленных о химических элементах сформулировал свой периодический закон. Тогда он звучал так: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных масс элементов» . Очень долго физический смысл закона Д.И.Менделеева был непонятен. Всё встало на свои места после открытия в XX веке строения атома.
Слайд 3
Современная формулировка Периодического закона «Свойства простых веществ, также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома».
Слайд 4
Число протонов и электронов в атоме Заряд ядра атома равен числу протонов в ядре. Число протонов уравновешивается числом электронов в атоме. Таким образом, атом электронейтрален . Заряд ядра атома в Периодической таблице – это порядковый номер элемента. Номер периода показывает число энергетических уровней, на которых вращаются электроны. Номер группы показывает число валентных электронов. Для элементов главных подгрупп число валентных электронов равно числу электронов на внешнем энергетическом уровне. Именно валентные электроны отвечают за образование химических связей элемента. Химические элементы 8 группы – инертные газы имеют на внешней электронной оболочке 8 электронов. Такая электронная оболочка энергетически выгодна. Все атомы стремятся заполнить свою внешнюю электронную оболочку до 8 электронов.
Слайд 5
Число нейтронов в ядре Если относительную атомную массу химического элемента обозначить А , заряд ядра обозначить Z , то число нейтронов можно рассчитать по формуле: n = A-Z
Слайд 6
Изменение радиуса атомов химических элементов в группах и периодах Как изменяется радиус атома химического элемента сверху вниз в группах? Как изменяется радиус атома химического элемента в слева направо в периодах? Почему так происходит? Какие свойства химических элементов связаны с радиусом атома?
Слайд 7
Внешние электронные оболочки инертных газов Содержат 2 (гелий) либо 8 (все остальные) электронов и являются очень устойчивыми.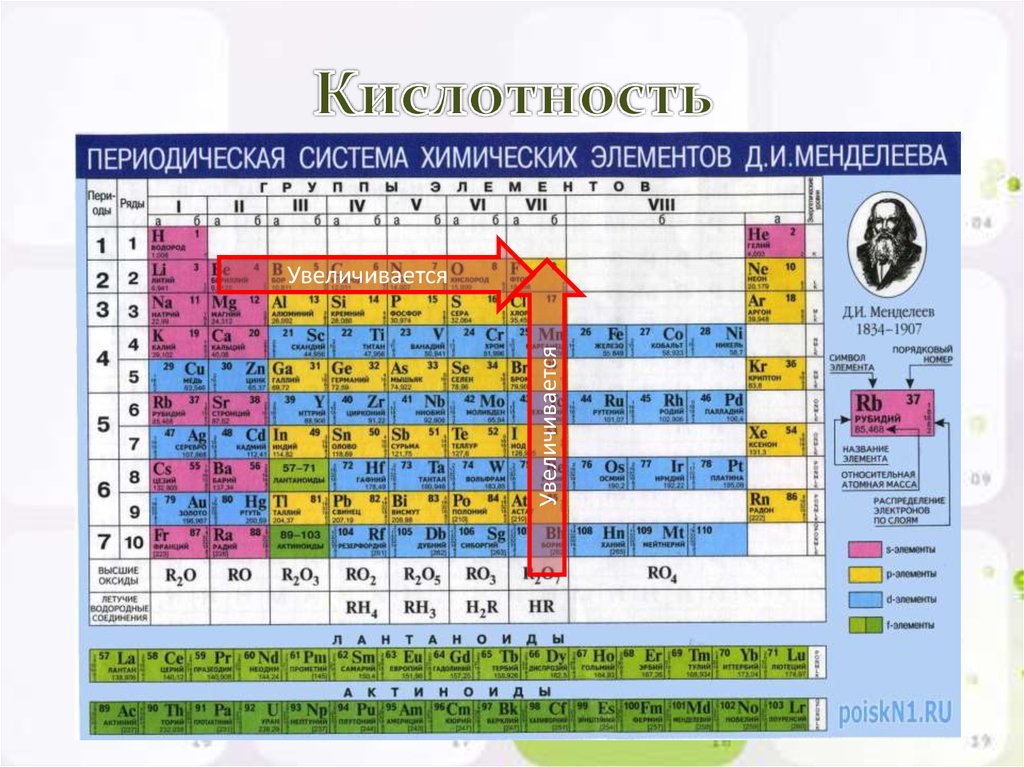 Правило «октета-дублета» Все остальные химические элементы, вступая в реакции, стремятся иметь внешнюю электронную оболочку как у инертных газов. Атомы каких химических элементов легче всего отдают электроны, а каких забирают?
Правило «октета-дублета» Все остальные химические элементы, вступая в реакции, стремятся иметь внешнюю электронную оболочку как у инертных газов. Атомы каких химических элементов легче всего отдают электроны, а каких забирают?
Слайд 8
Степень окисления В процессе отдачи или присоединения электронов атом приобретает условный заряд . Этот условный заряд называется степенью окисления . – Простые вещества обладают степенью окисления равной нулю. – Элементы могут проявлять максимальную степень окисления и минимальную . Максимальную степень окисления элемент проявляет тогда, когда отдает все свои валентные электроны с внешнего электронного уровня. Если число валентных электронов равно номеру группы, то и максимальная степень окисления равна номеру группы.
Слайд 9
Характеристика хлора по его положению в ПСХЭ
Слайд 10
План характеристики химического элемента 1. Символ элемента а. Порядковый номер элемента б. Значение относительной атомной массы элемента. в. Число протонов, электронов, нейтронов. г. Номер периода. д. Номер и тип группы (тип элемента s -, p -, d -, f – элемент) 2. Металл или неметалл 3. Сравнение свойств элемента (металлических и неметаллических) с соседними элементами по периоду и группе. 4. Написать распределение электронов по атомным орбиталям – квантовую диаграмму. Написать электронную формулу. 5. Зарисовать распределение электронов по энергетическим уровням 6. Определить высшую степень окисления атома и формулу его высшего оксида. Определить характер оксида (основной, кислотный, амфотерный ). 7. Определить низшую степень окисления элемента и формулу его водородного соединения (если такое есть).
г. Номер периода. д. Номер и тип группы (тип элемента s -, p -, d -, f – элемент) 2. Металл или неметалл 3. Сравнение свойств элемента (металлических и неметаллических) с соседними элементами по периоду и группе. 4. Написать распределение электронов по атомным орбиталям – квантовую диаграмму. Написать электронную формулу. 5. Зарисовать распределение электронов по энергетическим уровням 6. Определить высшую степень окисления атома и формулу его высшего оксида. Определить характер оксида (основной, кислотный, амфотерный ). 7. Определить низшую степень окисления элемента и формулу его водородного соединения (если такое есть).
Слайд 11
Домашнее задание §1, ответить на вопросы. Пользуясь планом-характеристикой химического элемента, охарактеризовать B, C, Si, Rb , Sr , Br . Не забываем, что если элемент находится в главной подгруппе, то мы его сравниваем только с элементами главной подгруппы .
1. Общая характеристика элементов-металлов
Лекция 5. Металлы
Из 114 элементов,
известных в настоящее время, 96 являются
металлами. Металлы и их соединения
играют важную роль в минеральной и
органической жизни Земли. Атомы и ионы
металлов входят в состав важнейших
соединений, участвующих в жизнедеятельности
растений, животных и человека.
Металлы и их соединения
играют важную роль в минеральной и
органической жизни Земли. Атомы и ионы
металлов входят в состав важнейших
соединений, участвующих в жизнедеятельности
растений, животных и человека.
По своей химической природе металлы – это химические элементы, атомы которых отдают электроны с внешнего или предвнешнего энергетического уровней, образуя при этом положительно заряженные ионы.
Практически все металлы имеют сравнительно большие радиусы и малое, от 1 до 3, число электронов на внешнем энергетическом уровне, исключения составляют только германий, олово, свинец (4 электрона), сурьма, висмут (5 электронов) и полоний (6 электронов). Для атомов металлов характерны низкие значения электороотрицательности и восстановительные свойства.
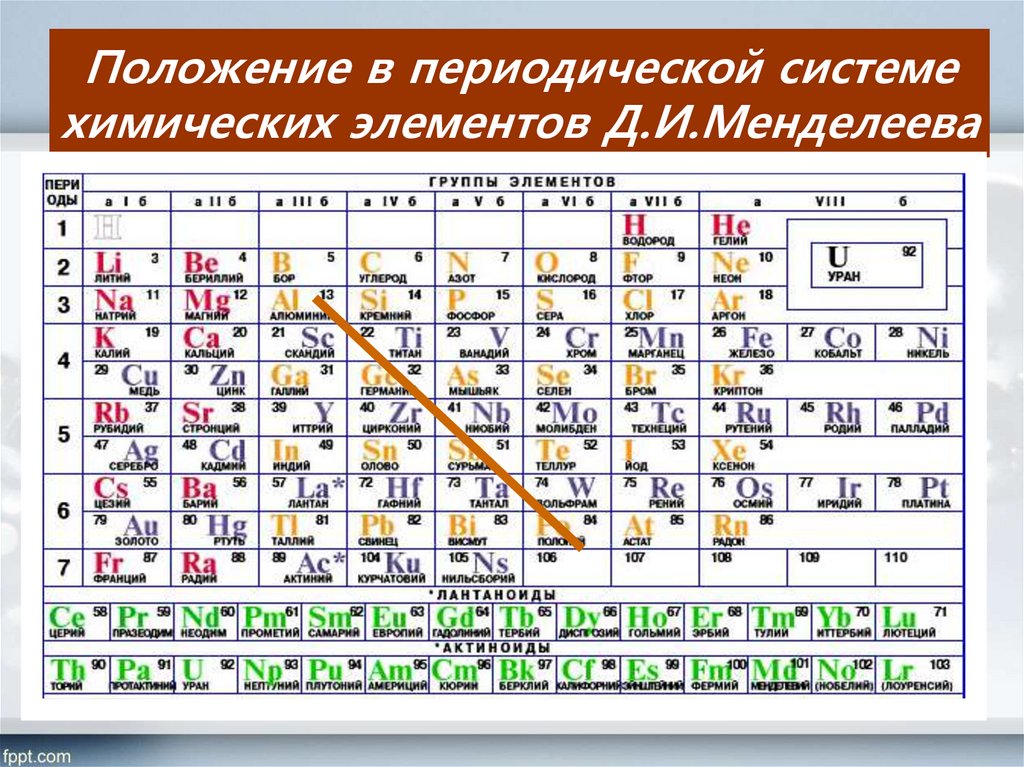
1.1. Положение металлов в Периодической системе элементов д.И. Менделеева
В Периодической
системе химических элементов
Д.И. Менделеева металлы располагаются
ниже диагонали бериллий – астат.
Элементы, расположенные вблизи диагонали,
например, бериллий, алюминий, титан,
германий, сурьма обладают двойственным
характером и относятся к металлоидам. Металлы располагаются в начале периодов,
к ним относятся s-элементы 1 и 2 групп,
р-элементы 3 группы, все, кроме бора, 4
группы: германий, олово, свинец, 5 группы:
сурьма, висмут, а также все d- и f- элементы.
Металлы располагаются в начале периодов,
к ним относятся s-элементы 1 и 2 групп,
р-элементы 3 группы, все, кроме бора, 4
группы: германий, олово, свинец, 5 группы:
сурьма, висмут, а также все d- и f- элементы.
1.2. Электронное строение элементов-металлов
По своему электронному строению металлы делятся на s-, p-, d- и f-металлы.
s-металлы расположены в 1 и 2 группах Периодической системы химических элементов, р-металлы – в 3, 4, 5, 6 группах. Все они, за исключением германия, олова, свинца, сурьмы, висмута и полония, на внешнем энергетическом уровне имеют 1–3 электрона.
Электронные конфигурации валентных электронов s- и р-металлов приведены в таблице:
ns1 | ns2 | ns2np1 | ns2np2 | ns2np3 | ns2np4 |
Li | Be | ||||
Na | Mg | Al | |||
K | Ca | Ga | Ge | ||
Rb | Sr | In | Sn | Sb | |
Cs | Ba | Tl | Pb | Bi | Po |
В группах s- и
р-металлов число электронов на внешнем
энергетическом уровне не изменяется,
радиус атома увеличивается,
электроотрицательность
уменьшается, восстановительные
свойства усиливаются, металлические
свойства усиливаются.
Начиная с 4 периода, появляются вставные декады d-элементов, у которых заполняется предвнешний энергетический уровень. d-элементы расположены в 3–12 группах Периодической системы химических элементов, все они являются металлами, имеют большое количество валентных электронов, так как ими являются не только s-, но и d-электроны. Это свойство обеспечивает большое разнообразие степеней окисления и ярко выраженную склонность к комплексообразованию.
Электронные конфигурации валентных электронов d-металлов приведены в таблице:
(n-1)d1ns2 | (n-1)d2ns2 | (n-1)d3ns2 | (n-1)d4ns2 | (n-1)d5ns2 | (n-1)d6ns2 | (n-1)d7ns2 | (n-1)d8ns2 | (n-1)d9ns2 | |
Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn |
Y | Zr | Nb | Mo | Ru | Rh | Pd | Ag | Cd | |
La | Hf | Ta | W | Re | Os | Ir | Pt | Au |
В группах d-металлов
число электронов на внешнем энергетическом
уровне не изменяется, радиус атома
увеличивается, хотя в меньшей степени,
чем у s- и р-металлов, восстановительные
свойства чаще всего уменьшаются,
устойчивость высшей степени окисления
увеличивается.
Начиная с 6 периода, появляются семейства лантаноидов и актиноидов, которые включают по 14 f-элементов, у них заполняется третий с конца энергетический уровень. f-элементы расположены в 3 группе Периодической системы химических элементов, их электронная конфигурация
(n-2)f1-14(n-1)d
Дмитрий Менделеев
Дмитрий МенделеевО связи свойств элементов с их атомным весом
Д. Менделеев, Zeitschrift für Chemie 12 , 405-406 (1869) перевод с немецкого Кармен Джунта. Примечание. Я включил гиперссылки из трех пустых мест в этой таблице на отчеты об открытиях соответствующих элементов на сайте ChemTeam. Я оставил символы элементов такими, какими они были в немецком реферате. –CJG] Упорядочив элементы по возрастанию атомного веса в вертикальных рядах так, чтобы горизонтальные ряды содержали аналогичные элементы, все еще упорядоченные по возрастанию атомного веса, можно получить следующее расположение, из которого можно вывести несколько общих выводов.
| Ti=50 | Zr=90 | ?=180 | |||
| V=51 | Nb=94 | Ta=182 | |||
| Cr=52 | Mo=96 | W=186 | |||
| Mn=55 | Rh=104,4 | Pt=197,4 | |||
| Fe=56 | Ru=104,4 | Ir=198 | |||
| Ni=Co=59 | Pd=106,6 | Os=199 | |||
| H=1 | Cu=63,4 | Ag=108 | Hg=200 | ||
| Be=9,4 | Mg=24 | Zn=65,2 | Cd=112 | ||
| B=11 | Al=27,4 | ?=68 | Ur=116 | Au=197? | |
| C=12 | Si=28 | ?=70 | Sn=118 | ||
| N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
| O=16 | S=32 | Se=79,4 | Te=128? | ||
| F=19 | Cl=35,5 | Br=80 | J=127 | ||
| Na=23 | K=39 | Rb=85,4 | Cs=133 | Tl=204 | |
| Ca=40 | Sr=87,6 | Ba=137 | Pb=207 | ||
| ?=45 | Се=92 | ||||
| ?Er=56 | La=94 | ||||
| ?Yt=60 | Di=95 | ||||
| ?In=75,6 | Th=118? |
 Элементы, расположенные в соответствии с их атомным весом, проявляют периодичность свойств.
Элементы, расположенные в соответствии с их атомным весом, проявляют периодичность свойств.2. Химически аналогичные элементы имеют либо одинаковые атомные веса (Pt, Ir, Os), либо веса, увеличивающиеся на равные приращения (K, Rb, Cs).
3. Расположение по атомному весу соответствует валентности элемента и в некоторой степени различию в химическом поведении, например Li, Be, B, C, N, O, F.
4. Наиболее широко распространенные в природе элементы имеют малый атомный вес, и все такие элементы отличаются своеобразием своего поведения. Таким образом, они представляют собой 90 221 репрезентативных элементов из 90 222; и поэтому самый легкий элемент H правильно выбран как наиболее представительный.
5. величина атомного веса определяет свойства элемента. Поэтому при изучении соединений следует принимать во внимание не только количества и свойства элементов и их взаимное поведение, но и атомный вес элементов. Так, соединения S и Tl [имелось в виду Te], Cl и J обнаруживают не только много аналогий, но и разительные различия.
Так, соединения S и Tl [имелось в виду Te], Cl и J обнаруживают не только много аналогий, но и разительные различия.
6. Можно предсказать открытие многих новых элементов, например аналоги Si и Al с атомным весом 65-75.
7. Несколько атомных весов, вероятно, потребуют коррекции; например Te не может иметь атомный вес 128, а скорее 123-126.
8. Из вышеприведенной таблицы выявляются некоторые новые аналогии между элементами. Таким образом, Бо (?) [sic — очевидно, имелось в виду Ур] появляется как аналог Бо и А1, что, как хорошо известно, давно установлено экспериментально.
(Русское химическое общество 1, 60)
Вернуться к списку избранных исторических документов.
Вернуться к началу классической химии.
Периодические свойства и развитие периодической таблицы
Периодические свойства и развитие периодической таблицы| Химия 2 | |
- Первая таблица Менделеева была составлена Дмитрием Менделеевым в 1869 году.

- Он был профессором химии. в Санкт-Петербургском университете
в России и столкнулся с проблемой, как преподавать
различные элементы, известные в то время. Он решил организовать элементы, изучая свойства элементов. Он смотрел на такие вещи, как:
- Плотность
- Температура плавления
- Химическая формула
- Он заметил, что если расположить элементы в порядке от наименьшей атомной массы к наибольшей, то различные свойства будут повторяться «периодически».
- Он также увидел, что соединения, образованные этими элементами, также периодически менялись, образуя следующую структуру, где R представляет интересующий элемент: R 2 O, RO, R 2 O 3 , RO 2 , R 2 O 5 , RO 3 , прав. Ниже приведен график плотности, подобный приведенному выше, с добавлением соединения, образованного элементом, в каждой точке данных.
 Нажмите на график, чтобы просмотреть его на весь экран.
Нажмите на график, чтобы просмотреть его на весь экран.
- Менделеев составил таблицу элементов со строками и столбцами на основе закономерностей, которые он видел на графиках выше. Какие закономерности вы можете найти?
- Используя данные на графиках выше, Менделеев изучил закономерности элементов и нашел пробелы там, где казалось, что элемента не хватает. Он предсказал, что будут открыты новые элементы, чтобы заполнить недостающие части его таблицы. В приведенной выше таблице он предсказал наличие трех новых элементов с атомной массой менее 80. Между какими элементами, по вашему предположению, должен существовать еще один элемент.
- Какие свойства вы бы предсказали для этих новых элементов (они перечислены от наименьшей атомной массы к наибольшей):
Атомная масса (а.  е.м.)
е.м.) Формула Плотность (г/см 3 ) предсказано фактический предсказано фактический предсказано фактический Экаборон (Скандий) не предсказано Менделеевым Экаалюминий (галлий) Экасиликон (германий) - Итак, Менделеев создал таблицу со строками и столбцами.
- Он был профессором химии. в Санкт-Петербургском университете
в России и столкнулся с проблемой, как преподавать
различные элементы, известные в то время. Он решил организовать элементы, изучая свойства элементов. Он смотрел на такие вещи, как:
