Урок 1-2. Характеристика элемента по его положению в Периодической системе химических элементов Д. И. Менделеева
Урок 1-2. Характеристика элемента по его положению в Периодической системе химических элементов Д. И. Менделеева
Технологические карты к учебнику О. С. Габриеляна «Химия. 9 класс»
Смотреть все за 9 класс
|
ПЛАНИРУЕМЫЕ ОБРАЗОВАТЕЛЬНЫЕ РЕЗУЛЬТАТЫ |
||
|
Предметные |
Метапредметные |
Личностные |
|
Умения характеризовать химиеские элементы 1-3го периодов по их положению в Периодической системе химических элементов Д. И. Менделеева; обосновывать свойства оксидов и гидроксидов металлов и неметаллов посредством молекулярных, полных и сокращенных ионных уравнений реакций |
Умения строить логические рассуждения, устанавливать причинноследственные связи, осуществлять сравнение, создавать обобщения, устанавливать аналогии, делать выводы; понимать, структурировать и интерпретировать информацию, представленную в табличной форме |
Понимание значимости фундаментальных представлений об атомномолекулярном строении вещества для формирования целостной естественнонаучной картины мира |
|
Решаемая учебная проблема |
Какую информацию можно получить о свойствах химического элемента и его соединений исходя из положения элемента в Периодической системе химических элементов Д. |
|
|
Основные понятия, изучаемые на уроках |
Характеристика элемента металла, характеристика элемента неметалла, генетические ряды металла, генетические ряды неметалла |
|
|
Демонстрации. Лабораторные опыты |
Демонстрации. Модели атомов элементов 1—3го периодов |
|
|
Вид используемых на уроках средств ИКТ |
Универсальные (электронные книги, компьютер, интерактивная доска) |
|
|
ОРГАНИЗАЦИОННАЯ СТРУКТУРА УРОКОВ |
||
|
ЭТАП 1. Вхождение в тему урока и создание условий для осознанного восприятия нового материала Диалог на уроке |
||
|
Формирование конкретного образовательного результата / группы результатов |
Актуализация знаний о строении атома и Периодическом законе Д. свойствах в свете теории электролитической диссоциации и окислительновосстановительных реакциях, о генетической связи между классами соединений |
|
|
Длительность этапа |
35—40 минут |
|
|
Основной вид учебной деятельности, направленный на формирование данного образовательного результата |
Устные и письменные ответы обучающихся на вопросы учителя. Обсуждение сказанного, записи обучающихся в тетрадь |
|
|
Методы обучения |
Диалогическое изложение. Систематизирующая беседа |
|
|
Форма организации деятельности обучающихся |
Коллективная мыслительная деятельность |
|
|
Функция / роль учителя на данном этапе |
Организаторская, корректирующая |
|
|
Основные виды деятельности учителя |
Координация деятельности обучающихся |
|
|
ЭТАП 2. Систематизация пройденного материала |
|
Формирование конкретного образовательного результата / группы результатов |
Умение характеризовать химические элементы по их положению в периодической таблице Д. И. Менделеева |
|
Длительность этапа |
35—40 минут |
|
Основной вид учебной деятельности, направленный на формирование данного образовательного результата |
Самостоятельная работа по составлению характеристик химических элементов—металлов и неметаллов по их положению в периодической таблице Д. И. Менделеева. Составление генетических рядов металлов и неметаллов |
|
|
Самостоятельная работа с последующей само или взаимопроверкой и коррекцией допущенных ошибок |
|
Форма организации деятельности обучающихся |
Коллективная и индивидуальная мыслительная деятельность |
|
Функция / роль учителя на данном этапе |
Организаторская, контролирующая, корректирующая |
|
Основные виды деятельности учителя |
Координация, контроль, коррекция деятельности обучающихся |
|
|
|
|
Формирование конкретного образовательного результата / группы результатов |
Обобщение. Устный ответ на проблемный вопрос уроков |
|
Длительность этапа |
3—5 минут |
|
Форма организации деятельности обучающихся |
Индивидуальная, коллективная |
|
Функция / роль учителя на данном этапе |
Организация самоконтроля обучающихся с последующей самооценкой |
|
Основные виды деятельности учителя |
Координация деятельности обучающихся |
|
Рефлексия по достигнутым или недостигнутым образовательным результатам |
Обучающиеся оценивают свою работу на уроке, учитель выставляет отметки за конкретные виды работы обучающимся на основе их самооценки. |
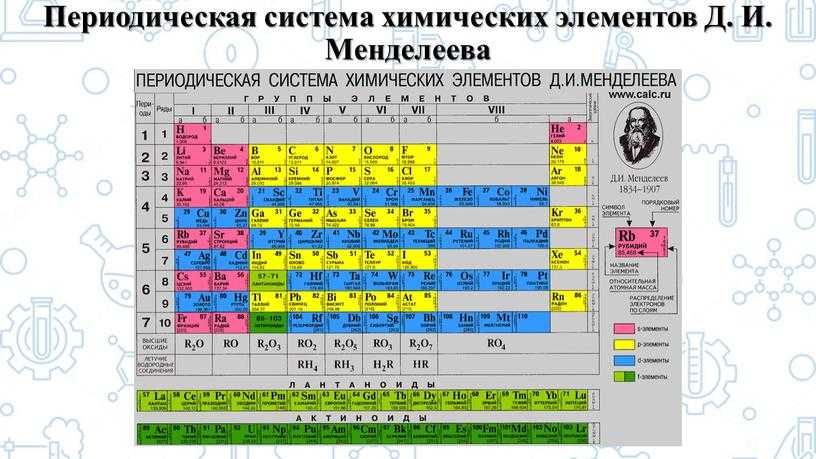
Цель уроков. Формирование умений характеризовать химические элементы и их соединения исходя из положения элементов в периодической таблице Д. И. Менделеева.
Проблемный вопрос уроков. Какую информацию можно получить о свойствах химического элемента и его соединений исходя из положения элемента в Периодической системе химических элементов Д. И. Менделеева?
ХОД УРОКОВ
I. Диалог на уроке
Актуализация знаний обучающихся о строении атома и Периодическом законе Д. И. Менделеева, классификации неорганических веществ и их свойствах в свете теории электролитической диссоциации и окислительновосстановительных реакциях, о генетической связи между классами соединений.
Изучение нового материала происходит с опорой на содержание § 1 учебника.
Вопросы и задания
1) Вспомните, какая взаимосвязь существует между строением атома химического элемента и его положением в Периодической системе Д. И. Менделеева (заряд ядра атома, число протонов, нейтронов, общее число электронов, число заполняемых энергетических уровней, число внешних электронов у элементов главных подгрупп).
2) Как изменяются свойства атомов, простых веществ и соединений, образованных химическими элементами, в пределах главных подгрупп и периодов Периодической системы Д. И. Менделеева? Мотивируйте свой ответ.
3) Дайте характеристику химического элемента лития в соответствии с планом.
Записи в тетради
План характеристики химического элемента
- Положение в Периодической системе химических элементов Д. И. Менделеева и строение его атомов (заряд ядра атома, массовое число протонов, нейтронов, общее число электронов в нейтральном атоме, строение электронной оболочки, высшая степень окисления).
- Характер простого вещества (металл, неметалл).

- Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
- Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
- Состав высшего оксида, его характер (осно́вный, кислотный, амфотерный).
- Состав высшего гидроксида, его характер (основание, кислородсодержащая кислота, амфотерный гидроксид).
Состав летучего водородного соединения (для неметаллов).
4) Какой тип химической связи существует в соединении натрия с водородом? Какими физическими свойствами будет обладать это соединение?
5) Составьте генетический ряд натрия (металла).
6) Дайте характеристику химического элемента фосфора в соответствии с планом.
7) Составьте генетический ряд фосфора (неметалла).
I. Систематизация пройденного материала
Выполнение заданий № 1(б), 2, 3 после § 1 учебника с последующей само или взаимопровер кой и, в случае необходимости, коррекцией допущенных ошибок.
II. Подведение итогов
Обучающиеся устно отвечают на проблемный вопрос урока.
Домашнее задание: § 1, выполнить задания № 4—7 после § 1; № 8 на с. 17 в рабочей тетради.
Тест по химии Характеристика химического элемента на основании положения в Периодической системе Д.И. Менделеева 9 класс
19.08.2018 Тесты по предметам Химия 9 класс
Тест по химии Характеристика химического элемента на основании положения в Периодической системе Д.И. Менделеева 9 класс с ответами. Тест содержит 2 части. В части 1 — 15 заданий базового уровня. В части 2 — 3 задания повышенного уровня.
Часть 1
1. В периодах слева направо заряд ядра атома
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала увеличивается, а затем уменьшается
2. В главных подгруппах снизу вверх заряд ядра атома
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала увеличивается, а затем уменьшается
3. В главных подгруппах сверху вниз число электронов на внешнем уровне
В главных подгруппах сверху вниз число электронов на внешнем уровне
1) увеличивается
2) уменьшается
а) не изменяется
4) сначала увеличивается, а затем уменьшается
4. В периодах справа налево число энергетических уровней
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала увеличивается, а затем уменьшается
5. В главных подгруппах снизу вверх восстановительные свойства элемента
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала ослабевают, а затем усиливаются
6. В периодах слева направо восстановительные свойства элемента
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала ослабевают, а затем усиливаются
7. В главных подгруппах сверху вниз окислительные свойства элемента
1) усиливаются
2) ослабевают
3) не изменяются
4) сна чала ослабевают, а за тем усиливаются
8. В периодах слева направо окислительные свойства элемента
1) усиливаются
2) ослабевают
3) не изменяются
4) сначала ослабевают, а затем усиливаются
9. В главных подгруппах сверху вниз высшая положительная степень окисления
В главных подгруппах сверху вниз высшая положительная степень окисления
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала увеличивается, а затем уменьшается
10. Оксид кальция СаО не реагирует с
1) NaOH
2) HCl
3) СО2
4) H2O
11. Оксид cepы(IV) SO2не реагирует с
1) NaOH
4) H2O
3) СаО
4) HCl
12. Укажите вещество Х в генетическом ряду серы:
S → Х → H2SO3
1) Na2SO3
2) SO3
3) H2S
4) SO2
13. Укажите вещество Х в генетическом ряду кальция:
Са → Х → Са(ОН)2
1) СаО
2) CaCl2
3) СаСO3
4) Ca(NO3)2
14. Используя метод электронного баланса, определите сумму коэффициентов в уравнении реакции по схеме:
NH3 + O2 → N2 + Н2О
1) 12
2) 13
3) 14
4) 15
15. Сожгли 335 г технической серы, содержащей 10% примесей. Определите объем (н.у.) образовавшегося оксида cepы(IV), если выход этого оксида составил 90% от теоретически возможного.
Сожгли 335 г технической серы, содержащей 10% примесей. Определите объем (н.у.) образовавшегося оксида cepы(IV), если выход этого оксида составил 90% от теоретически возможного.
1) 170 л
2) 180 л
3) 190 л
4) 200 л
Часть 2
1. Расположите элементы в порядке возрастания их металлических свойств:
1) Са,
2) Ва,
3) Ве,
4) Sr.
Ответ дайте в виде последовательности цифр.
2. Расположите элементы в порядке возрастания их окислительной способности:
1) S,
2) Cl,
3) Р,
4) Sb.
Ответ дайте в виде последовательности цифр.
3. Ознакомьтесь в Интернете с тем, какие элементы Периодической системы элементов называют металлами, неметаллами, полуметаллами и инертными газами. Установите соответствие между элементом и его классификацией. Ответ дайте в виде последовательности цифр, соответствующей буквам по алфавиту.
Элемент
А) германий
Б) свинец
В) аргон
Г) селен
Классификация
1) металлы
2) неметаллы
3) полуметаллы
4) инертные газы
Ответы на тест по химии Характеристика химического элемента на основании положения в Периодической системе Д. И. Менделеева 9 класс
И. Менделеева 9 класс
Часть 1
1-1
2-2
3-3
4-3
5-2
6-2
7-2
8-1
9-3
10-1
11-4
12-4
13-1
14-4
15-3
Часть 2
1-3142
2-4312
3-3142
Опубликовано: 19.08.2018 Обновлено: 19.08.2018
Поделиться
Найти:5 способов сделать периодическую таблицу элементов доступной для учащихся
Введение в периодическую таблицу:Периодическая таблица представляет собой расположение элементов в соответствии с их химическими и физическими свойствами. В периодической таблице элементы располагаются в разных строках и столбцах в соответствии с их физическими и химическими свойствами.
Химические свойства , которые отличают элементы друг от друга, это атомный номер, атомная масса, электроотрицательность, плотность, температура плавления, температура кипения и ионный радиус . Физическими свойствами элементов периодической таблицы являются цвет, блеск, ковкость, твердость, растворимость и электропроводность. На основе этих свойств элементы делятся на разные категории.
На основе этих свойств элементы делятся на разные категории.
Периодическая таблица организована в соответствии с атомным весом и валентными электронами во внешних оболочках элементов. Строки в периодической таблице известны как периодов , а каждый столбец известен как группы . В периодической таблице семь строк и 18 столбцов. В одном ряду все элементы имеют одинаковое количество атомных орбиталей (пространств, в которых существуют электроны).
Между тем, группа показывает количество электронов в самой внешней оболочке атома. Эти электроны известны как валентных электрона. Они могут легко образовывать химические связи с валентными электронами других элементов. Тип связи может быть ионным или ковалентным.
Периодическая таблица основана на принципе, согласно которому «свойства являются периодической функцией их атомной массы». Это основной принцип существования периодической таблицы. Это означает, что химические и физические свойства элементов периодически повторяются, если элементы расположены в соответствии с их атомным весом.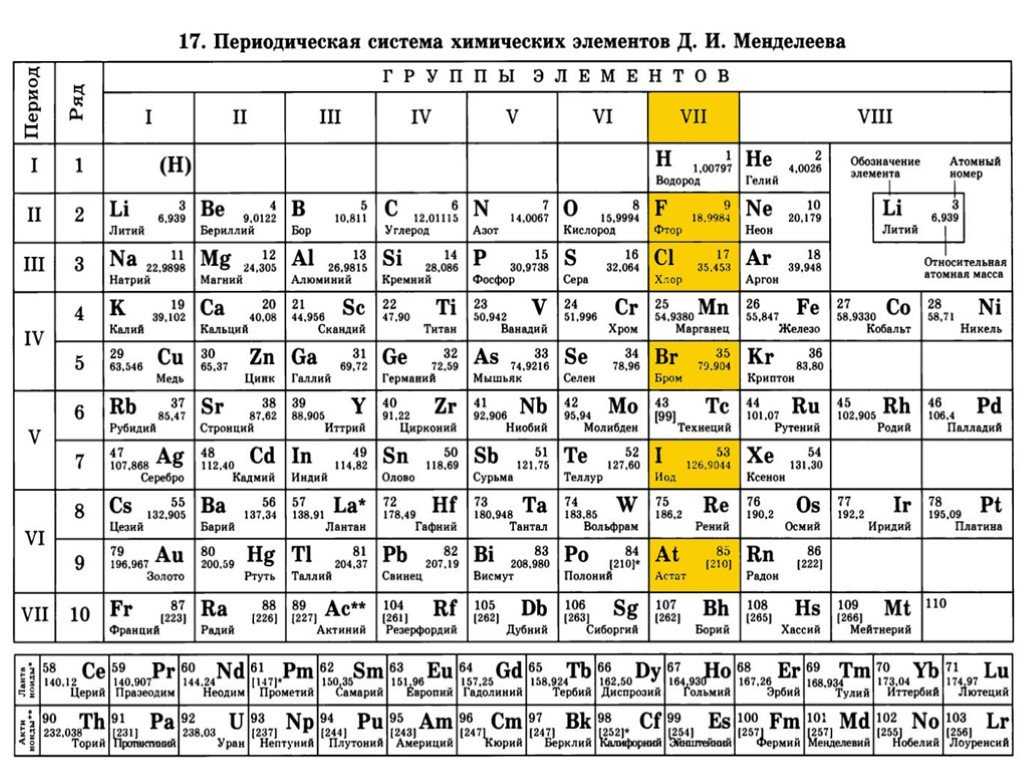 Атомный вес также известен как относительная атомная масса. Это отношение атомов химического элемента к некоторому эталону. С 1961 года стандартной единицей атомной массы является одна двенадцатая массы изотопа углерода-12.
Атомный вес также известен как относительная атомная масса. Это отношение атомов химического элемента к некоторому эталону. С 1961 года стандартной единицей атомной массы является одна двенадцатая массы изотопа углерода-12.
Элементы также классифицируются по цветовому тесту пламени . Это один из параметров классификации периодической таблицы. Если вы хотите поместить элемент в периодическую таблицу, вы заметите его цвет пламени, а затем поместите его в соответствующую строку и столбец.
Элементы периодической таблицы подразделяются на металлы, неметаллы, металлоиды, галогены, благородные газы и редкоземельные элементы.
Почему периодическую таблицу и ее принцип сложно понять?Хотя кажется очень интересным взглянуть на периодическую таблицу, чтобы понять ее, это не интересная тема для студентов. Скорее это скучная и беспокойная тема для студентов. Наверняка, на то есть причины. Итак, давайте обсудим причины затруднений учащихся в понимании этой темы:
1 Это сложно:
Многие химические и физические свойства элементов понять непросто, а многие свойства связаны друг с другом, что затрудняет понимание периодической таблицы и ее элементов. Когда вы подробно изучаете строки и столбцы периодической таблицы, учащиеся должны помнить о многих деталях, чтобы сделать ее доступной и легкой. Существует путаница между атомными номерами и атомными массами. Чтобы полностью усвоить концепции, нужна практика, поэтому все эти вещи усложняют понимание студентами поначалу.
Когда вы подробно изучаете строки и столбцы периодической таблицы, учащиеся должны помнить о многих деталях, чтобы сделать ее доступной и легкой. Существует путаница между атомными номерами и атомными массами. Чтобы полностью усвоить концепции, нужна практика, поэтому все эти вещи усложняют понимание студентами поначалу.
Элементы подразделяются на металлы, неметаллы, металлоиды, благородные газы, галогены и другие редкоземельные элементы. Все эти категории имеют разные свойства, и при чтении таблицы Менделеева возникает ощущение рассеянности, когда приходится подходить ко всем понятиям и свойствам. Трудно точно сказать, что вы должны помнить, чтобы полностью понять периодическую таблицу.
3 Слишком много терминов для понимания и запоминания Периодическая таблица основана на понимании элементов и их свойств. Существуют атомные массы, атомные номера, относительные атомные номера, цвета пламени, электропроводность, температуры плавления и кипения и другие свойства, которые являются основой классификации периодической таблицы, и это первый шаг к пониманию периодической таблицы для запоминания. все определения и понятия этих свойств. По этой причине учащимся может быть трудно освоить эту тему, из-за чего они устают.
все определения и понятия этих свойств. По этой причине учащимся может быть трудно освоить эту тему, из-за чего они устают.
Поскольку мы знакомы с проблемами, с которыми студенты могут столкнуться при изучении этой темы, вот 5 способов сделать ее более простой и понятной.
1. L заработать о людях, стоящих за открытием периодической таблицы:В настоящее время в периодической таблице 118 элементов. Еще в 19 веке было известно всего 30 элементов. Ученым стало бременем помнить элементы и их свойства, поскольку количество открытых элементов постоянно увеличивалось. Они начали классифицировать элементы в соответствии с их свойствами. Классификация элементов в табличной форме в соответствии с их свойствами стала популярной, и в конечном итоге такое расположение элементов в табличной форме стало известно как периодическая таблица.
Дмитрий Иванович Менделеев (1834-1907)
Дмитрий Менделеев был русским химиком. Он внес важный вклад в разработку периодической таблицы. Составленная им периодическая таблица является самой важной версией всех периодических таблиц.
Он внес важный вклад в разработку периодической таблицы. Составленная им периодическая таблица является самой важной версией всех периодических таблиц.
В 1869 году, после того как был отвергнут закон октавы Ньюленда, на сцену вышла периодическая таблица Менделеева.
В этой периодической таблице элементы расположены в соответствии с их атомной массой и химическими свойствами. Во времена Менделеева только 63 элемента были известны. Наблюдая за свойствами, он обнаружил, что свойства элементов периодически связаны с атомной массой. Он расположил элементы так, чтобы элементы с одинаковыми химическими свойствами попадали в одни и те же вертикальные столбцы периодической таблицы. Менделеев оставил некоторые пробелы для неоткрытых элементов. Каждый вновь обнаруженный элемент может быть включен в группу, не мешая другим элементам.
Благородные газы не были включены в периодическую таблицу Менделеева, так как не были тогда открыты. В нынешней форме периодической таблицы благородные газы расположены в отдельной группе под названием 9. 0003 Группа-18.
0003 Группа-18.
Чтобы лучше понять периодическую таблицу, необходимо запомнить и хорошо подготовить некоторые основные принципы и определения. Понимание концепции очень важно.
Учащиеся должны изучить элементы периодической таблицы. Принцип периодической таблицы очень важен
Некоторые основные определения, которые помогут учащимся легче понять периодическую таблицу:
· Периодическая таблица: Это прямоугольное расположение химических элементов, основанное на их атомных массах.
· Атомная масса: Атомная масса элемента – это средняя масса атомов элемента, измеренная в атомной единице массы. Атомная единица массы известна как «аму» и «дальтон».
· Валентные электроны: Неспаренные электроны в самой внешней оболочке атома элемента.
· Цвет пламени: — это одно из свойств элементов, которое помогает ученым различать элементы по цвету пламени.
· Типы элементов: В таблице Менделеева есть металлы, неметаллы, металлоиды, инертные газы, галогены и другие редкоземельные элементы.
3. Присвоение новых имен строкамОдин из методов запоминания элементов периодической таблицы заключается в присвоении каждому столбцу новых имен на основе элементов в этом столбце.
Давайте поговорим о рисунке выше. Вот столбец периодической таблицы, который содержит бериллий, магний, кальций, стронций, барий и радий. Таким образом, взяв инициалы всех элементов, мы можем создать новую фразу для этого столбца, которая будет «Но мой спокойный сын просит (для) регби». Таким образом, вы можете запомнить элементы этого столбца. Это очень уникальный и простой способ понять и запомнить положение элементов в периодической таблице.
4. Видеть значит верить Часто говорят, что люди узнают больше из визуального представления темы. Цвета и картинки добавляют интереса к теме. Визуальное представление усиливает творческие идеи учащихся, и они могут увидеть то, что вообразили. Это помогает учащимся справиться с темой и лучше понять тему. То же самое и с периодической таблицей. Учащиеся могут только представить тест цвета пламени и химические свойства элементов, но визуальное видение вашего воображения дает вам уверенность и удовлетворение.
Визуальное представление усиливает творческие идеи учащихся, и они могут увидеть то, что вообразили. Это помогает учащимся справиться с темой и лучше понять тему. То же самое и с периодической таблицей. Учащиеся могут только представить тест цвета пламени и химические свойства элементов, но визуальное видение вашего воображения дает вам уверенность и удовлетворение.
Рисунок: изображение расположения металлов, неметаллов и металлоидов в периодической таблице.
5. U se моделирование виртуальной лабораторииВиртуальная лаборатория — отличный источник обучения для студентов. В Labster студенты могут смотреть 3D-симуляции, связанные с их темами. Студенты также могут применить свои знания. Речь идет об опыте применения своих знаний и видении результатов.
Учителя следят за деятельностью учащихся. В Лабстере есть тема подсчета очков. Симуляции короткие и их легко смотреть. Эта платформа помогает учащимся обрести уверенность в своих знаниях и поощряет их пробовать больше теорий.
Имеются две 3D-симуляции, в которых показано проведение испытаний пламенем. Выделение различных элементов показано очень четко. Учащиеся могут легче относиться к теме.
Периодическая таблица элементов: наведите порядок в таблице вовремя! Виртуальная лаборатория
Периодическая таблица (принципы): систематизируйте таблицу во времени Виртуальная лаборатория
Предсказание относительных свойств элементов
Основы химических элементов
При изучении химии важно понимать основы химических элементов. Термин «элемент» относится к чистым веществам, состоящим только из атомов с одинаковым числом протонов в ядрах. В отличие от химических соединений, элементы не могут быть разделены какой-либо химической реакцией на более простые вещества; это означает, что они считаются одним целым – отдельной вещью, а не различными частями, смешанными вместе.
Как определить химические элементы?
Существует множество свойств, которые можно использовать для идентификации элемента. В этом случае у двух наиболее важных есть кое-что общее: их обоих можно найти в периодической таблице. Чтобы идентифицировать элемент, ищите атомный номер или количество протонов в атоме. Количество нейтронов, электронов и протонов обычно одинаково для конкретного атома. Фактически, вы можете предсказать свойства элементов, основываясь на структуре электронов. Однако некоторые атомы могут иметь разные номера, поэтому важно уделять пристальное внимание, чтобы избежать ошибочной идентификации элемента.
В этом случае у двух наиболее важных есть кое-что общее: их обоих можно найти в периодической таблице. Чтобы идентифицировать элемент, ищите атомный номер или количество протонов в атоме. Количество нейтронов, электронов и протонов обычно одинаково для конкретного атома. Фактически, вы можете предсказать свойства элементов, основываясь на структуре электронов. Однако некоторые атомы могут иметь разные номера, поэтому важно уделять пристальное внимание, чтобы избежать ошибочной идентификации элемента.
Что является примером химического элемента?
Периодическая таблица — самый полезный инструмент для идентификации химических элементов. Это организованная диаграмма, содержащая все известные элементы, перечисленные в порядке их символа и атомного номера. Вот несколько примеров химических элементов, найденных в периодической таблице:
- Водород
- Гелий
- Кислород
- Углерод
- Фтор
- Натрий
Это всего лишь несколько примеров. Есть еще много элементов, которые будут изучаться позже на уроках химии. Некоторые учащиеся могут уже знать, что такое элементы, потому что они уже видели их в периодической таблице!
Есть еще много элементов, которые будут изучаться позже на уроках химии. Некоторые учащиеся могут уже знать, что такое элементы, потому что они уже видели их в периодической таблице!
Каковы основные атомные свойства элементов?
Все элементы организованы в соответствии с их свойствами. Список основных свойств элементов включает, но не ограничивается:
- Средняя атомная масса
- Атомный номер
- Температура кипения
- Сродство к электрону
- Электронная оболочка
- Электроотрицательность (Полинг)
- Первая энергия ионизации
- Ионный радиус
- Изотопы
- Температура плавления
- Стандартный потенциал
- Радиус Ван-дер-Ваальса
Список элементов по атомным свойствам
| Название элемента | Символ | Атомный номер | Электроотрицательность Полинга (χ) | Средняя атомная масса | Энергия первой ионизации (эВ) | Атомные радиусы | Радиус Ван-дер-Ваальса | Ковалентные радиусы | Валентные электроны | |
| Актиний | Ас | 89 | 1,1 | [227] | 5,17 | 195 | — | — | 2 | |
| Алюминий | Ал | 13 | 1,61 | 26. 9815386(8) 9815386(8) | 5,98577 | 125 | — | 118 | 3 | |
| Америций | утра | 95 | 1,3 | [243] | 5,9738 | 175 | — | — | 2 | |
| Сурьма | Сб | 51 | 2,05 | 121.760(1) | 8.6084 | 145 | — | 138 | 5 | |
| Аргон | Ар | 18 | – | 39.948(1) | 15.75962 | 71 | 188 | 97 | 8 | |
| Мышьяк | Как | 33 | 2,18 | 74. | (2)9,7886 | 115 | 185 | 119 | 5 | |
| Астатин | В | 85 | 2,2 | [210] | — | — | — | — | 7 | |
| Барий | Ба | 56 | 0,89 | 137.327(7) | 5. 2117 2117 | 215 | — | 198 | 2 | |
| Берклиум | Бк | 97 | 1,3 | [247] | 6.1979 | — | — | — | 2 | |
| Бериллий | Быть | 4 | 1,57 | 9.012182(3) | 9.3227 | 105 | — | 90 | 2 | |
| Висмут | Би | 83 | 2,02 | 208.98040(1) | 7,2856 | 160 | — | 146 | 5 | |
| Борий | Бх | 107 | – | [270] | — | — | — | — | 7 | |
| Бор | Б | 5 | 2,04 | 10.811(7) | 8.29803 | 85 | — | 82 | 3 | |
| Бром | Бр | 35 | 2,96 | 79.904(1) | 11.81381 | 115 | 185 | 114 | 7 | |
| Кадмий | CD | 48 | 1,69 | 112. 411(8) 411(8) | 8,9938 | 155 | 158 | 148 | 2 | |
| Кальций | Са | 20 | 1 | 40.078(4) | 6.11316 | 180 | — | 174 | 2 | |
| Калифорния | См. | 98 | 1,3 | [251] | 6.2817 | — | — | — | 2 | |
| Углерод | С | 6 | 2,55 | 12.0107(8) | 11.2603 | 70 | 170 | 77 | 4 | |
| Церий | Се | 58 | 1,12 | 140.116(1) | 5,5387 | 185 | — | — | 2 | |
| Цезий | цезий | 55 | 0,79 | 132. | 19(2) | 3,8939 | 260 | — | 225 | 1 |
| Хлор | Кл | 17 | 3,16 | 35. 453(2) 453(2) | 12,96764 | 100 | 175 | 99 | 7 | |
| Хром | Кр | 24 | 1,66 | 51.9961(6) | 6,7665 | 140 | — | 127 | 1 | |
| Кобальт | Со | 27 | 1,88 | 58.933195(5) | 7,6398 | 135 | 163 | 121 | 2 | |
| Коперниций | Сп | 112 | – | [285] | — | — | — | — | — | |
| Медь | Cu | 29 | 1,9 | 63.546(3) | 7,72638 | 135 | 140 | 138 | 1 | |
| Кюриум | См | 96 | 1,3 | [247] | 5,9915 | — | — | — | 2 | |
| Дармштадтиум | Дс | 110 | – | [281] | — | — | — | — | — | |
| Дубний | Дб | 105 | – | [268] | — | — | — | — | 5 | |
| Диспрозий | Дай | 66 | 1,22 | 162. 500(1) 500(1) | 5,9389 | 175 | — | — | 2 | |
| Эйнштейний | Эс | 99 | 1,3 | [252] | 6,42 | — | — | — | 2 | |
| Эрбий | Er | 68 | 1,24 | 167.259(3) | 6.1077 | 175 | — | — | 2 | |
| Европий | ЕС | 63 | – | 151.964(1) | 5.6704 | 185 | — | — | 2 | |
| Фермиум | фм | 100 | 1,3 | [257] | 6,5 | — | — | — | 2 | |
| Флеровиум | Фл | 114 | – | [289] | — | — | — | — | — | |
| Фтор | Ф | 9 | 3,98 | 18.9984032(5) | 17.42282 | 50 | 147 | 71 | 7 | |
| Франций | Пт | 87 | 0,7 | [223] | 4. 0727 0727 | — | — | — | 1 | |
| Гадолиний | Гд | 64 | 1,2 | 157,25(3) | 6.1501 | 180 | — | — | 2 | |
| Галлий | Га | 31 | 1,81 | 69.723(1) | 5,9993 | 130 | 187 | 126 | 3 | |
| Германий | Гэ | 32 | 2,01 | 72,63(1) | 7,8994 | 125 | — | 122 | 4 | |
| Золото | Золото | 79 | 2,54 | 196.966569(4) | 9.2255 | 135 | 166 | 144 | 1 | |
| Гафний | Хф | 72 | 1,3 | 178.49(2) | 6.82507 | 155 | — | 150 | 2 | |
| Хассиум | Гс | 108 | – | [277] | — | — | — | — | — | |
| Гелий | Он | 2 | – | 4. 002602(2) 002602(2) | 24.58741 | 31 | 140 | 32 | 2 | |
| Гольмий | Хо | 67 | 1,23 | 164.93032(2) | 6.0215 | 175 | — | — | 2 | |
| Водород | Х | 1 | 2,2 | 1.007 | 13,59844 | 25 | 120 | 38 | 1 | |
| Индий | В | 49 | 1,78 | 114.818(3) | 5,78636 | 155 | 193 | 144 | 3 | |
| Йод | я | 53 | 2,66 | 126, | (3) | 10.45126 | 140 | 198 | 133 | 7 |
| Иридий | Ир | 77 | 2,2 | 192.217(3) | 8,967 | 135 | — | 137 | 2 | |
| Железо | Fe | 26 | 1,83 | 55. 845(2) 845(2) | 7.9024 | 140 | — | 125 | 2 | |
| Криптон | Кр | 36 | 3 | 83.798(2) | 13,99961 | 88 | 202 | 110 | 8 | |
| Лантан | Ла | 57 | 1,1 | 138. | 5,5769 | 195 | — | 169 | 2 | |
| Лоуренсиум | Лр | 103 | – | [266] | 4,9 | — | — | — | 3 | |
| Свинец | Пб | 82 | 2,33 | 207.2(1) | 7.41666 | 180 | 202 | 147 | 4 | |
| Литий | Ли | 3 | 0,98 | 6.941(2) | 5.39172 | 145 | 182 | 134 | 1 | |
| Лютеций | Лу | 71 | 1,27 | 174. 9668(1) 9668(1) | 5.4259 | 175 | — | 160 | 2 | |
| Магний | Мг | 12 | 1,31 | 24.3050(6) | 7,64624 | 150 | 173 | 130 | 2 | |
| Марганец | Мн | 25 | 1,55 | 54.938045(5) | 7.43402 | 140 | — | 139 | 2 | |
| Мейтнерий | Мт | 109 | – | [278] | — | — | — | — | — | |
| Менделевий | Мд | 101 | 1,3 | [258] | 6,58 | — | — | — | 2 | |
| Меркурий | рт.ст. | 80 | 2 | 200.59(2) | 10.4375 | 150 | 155 | 149 | 2 | |
| Молибден | Пн | 42 | 2,16 | 95,96(2) | 7. 09243 09243 | 145 | — | 145 | 1 | |
| Неодим | Нд | 60 | 1,14 | 144.242(3) | 5,525 | 185 | — | — | 2 | |
| Неон | Не | 10 | – | 20.1797(6) | 21,5646 | 38 | 154 | 69 | 8 | |
| Нептуний | Нп | 93 | 1,36 | [237] | 6.26576.2657 | 175 | — | — | 2 | |
| Никель | Ni | 28 | 1,91 | 58.6934(4) | 7,881 | 135 | — | 126 | 2 | |
| Ниобий | № | 41 | 1,6 | 92. | (2)6.75885 | 145 | — | 137 | 1 | |
| Азот | № | 7 | 3,04 | 14.0067(2) | 14. 53414 53414 | 65 | 155 | 75 | 5 | |
| Нобелий | № | 102 | 1,3 | [259] | 6,65 | — | — | — | 2 | |
| Оганесон | Ууо | 118 | – | — | — | — | — | — | — | |
| Осмий | Ос | 76 | 2,2 | 190.23(3) | 8.4382 | 130 | — | 128 | 2 | |
| Кислород | О | 8 | 3,44 | 15.9994(3) | 13.61806 | 60 | 152 | 73 | 6 | |
| Палладий | Pd | 46 | 2,2 | 106.42(1) | 8.3369 | 140 | 163 | 131 | — | |
| Фосфор | Р | 15 | 2,19 | 30.973762(2) | 10.48669 | 100 | 180 | 106 | 5 | |
| Платина | Пт | 78 | 2,28 | 195. 084(9) 084(9) | 8,9587 | 135 | 175 | 128 | 1 | |
| Плутоний | Пу | 94 | 1,28 | [244] | 6.0262 | 175 | — | — | 2 | |
| Полоний | ПО | 84 | 2 | [209] | 8.417 | 190 | — | — | 6 | |
| Калий | К | 19 | 0,82 | 39.0983(1) | 4.34066 | 220 | 275 | 196 | 1 | |
| Празеодим | Пр | 59 | 1,13 | 140. | (2) | 5.473 | 185 | — | — | 2 |
| Прометий | вечера | 61 | – | [145] | 5,582 | 185 | — | — | 2 | |
| Протактиний | Па | 91 | 1,5 | 231. 03588(2) 03588(2) | 5,89 | 180 | — | — | 2 | |
| Радий | Ра | 88 | 0,9 | [226] | 5,2784 | 215 | — | — | 2 | |
| Радон | Рн | 86 | – | [222] | 10,7485 | 120 | — | 145 | 8 | |
| Рений | Ре | 75 | 1,9 | 186.207(1) | 7,8335 | 135 | — | 159 | 2 | |
| Родий | Rh | 45 | 2,28 | 102. | (2)7,4589 | 135 | — | 135 | 1 | |
| Рентгений | Рг | 111 | – | [282] | — | — | — | — | — | |
| Рубидий | руб | 37 | 0,82 | 85.4678(3) | 4. 17713 17713 | 235 | — | 211 | 1 | |
| Рутений | Ру | 44 | 2,2 | 101.07(2) | 7.3605 | 130 | — | 126 | 1 | |
| Резерфордий | Рф | 104 | – | [267] | 6 | — | — | — | 4 | |
| Самарий | См | 62 | 1,17 | 150.36(2) | 5,6436 | 185 | — | — | 2 | |
| Скандий | Sc | 21 | 1,36 | 44.955912(6) | 6,5615 | 160 | — | 144 | 2 | |
| Сиборгиум | Сг | 106 | – | [269] | — | — | — | — | 6 | |
| Селен | Se | 34 | 2,55 | 78,96(3) | 9,75238 | 115 | 190 | 116 | 6 | |
| Кремний | Си | 14 | 1,9 | 28. 0855(3) 0855(3) | 8.15169 | 110 | 210 | 111 | 4 | |
| Серебро | Аг | 47 | 1,93 | 107.8682(2) | 7,5762 | 160 | 172 | 153 | 1 | |
| Натрий | На | 11 | 0,93 | 22.98976928(2) | 5.13908 | 180 | 227 | 154 | 1 | |
| Стронций | Старший | 38 | 0,95 | 87,62(1) | 5,6949 | 200 | — | 192 | 2 | |
| Сера | С | 16 | 2,58 | 32.065(5) | 10.36001 | 100 | 180 | 102 | 6 | |
| Тантал | Та | 73 | 1,5 | 180.94788(2) | 7,5496 | 145 | — | 138 | 2 | |
| Технеций | ТК | 43 | 1,9 | [98] | 7,28 | 135 | — | 156 | 1 | |
| Теллур | Те | 52 | 2. 1 1 | 127,60(3) | 9.0096 | 140 | 206 | 135 | 6 | |
| Тербий | Тб | 65 | – | 158. | (2) | 5,8638 | 175 | — | — | 2 |
| Таллий | Тл | 81 | 1,62 | 204.3833(2) | 6.1082 | 190 | 196 | 148 | 3 | |
| Торий | 90 | 1,3 | 232.03806(2) | 6.3067 | 180 | — | — | 2 | ||
| Тулий | Тм | 69 | 1,25 | 168.93421(2) | 6.18431 | 175 | — | — | 2 | |
| Олово | Сн | 50 | 1,96 | 118.710(7) | 7,3439 | 145 | 217 | 141 | 4 | |
| Титан | Ти | 22 | 1,54 | 47. 867(1) 867(1) | 6,8281 | 140 | — | 136 | 2 | |
| Вольфрам | Вт | 74 | 2,36 | 183,84(1) | 7,864 | 135 | — | 146 | 2 | |
| Уран | У | 92 | 1,38 | 238.02891(3) | 6.19405 | 175 | 186 | — | 2 | |
| Ванадий | В | 23 | 1,63 | 50.9415(1) | 6,7462 | 135 | — | 125 | 2 | |
| Ксенон | Хе | 54 | 2,6 | 131.293(6) | 12.1298 | 108 | 216 | 130 | 8 | |
| Иттербий | Ыб | 70 | – | 173.054(5) | 6.25416 | 175 | — | — | 2 | |
| Иттрий | Д | 39 | 1,22 | 88. | (2) | 6.2171 | 180 | — | 162 | 2 |
| Цинк | Цинк | 30 | 1,65 | 65,38(2) | 9.3942 | 135 | 139 | 131 | 2 | |
| Цирконий | Зр | 40 | 1,33 | 91.224(2) | 6,6339 | 155 | — | 148 | 2 |
Почему важно знать свойства элементов?
Изучение свойств элементов важно, потому что оно позволяет ученым предсказать, как они могут вести себя в различных реакциях. Поскольку все элементы имеют уникальное поведение, их понимание может помочь учащимся также узнать о поведении соединения. Например, зная, что кислород любит связываться с металлами, химик может предположить, что вода замерзнет при более низких температурах, поскольку водород
Каковы основные типы элементов?
Металлические элементы являются основными строительными блоками материи.

 И. Менделеева, классификации неорганических веществ и их
И. Менделеева, классификации неорганических веществ и их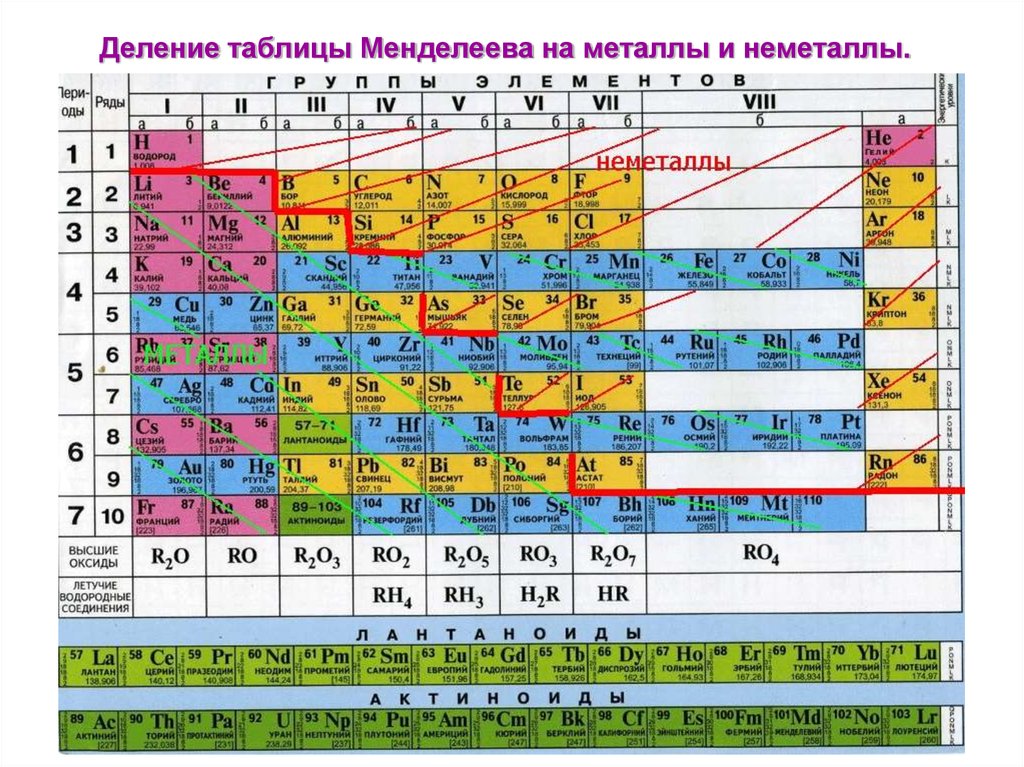 Организация и самоорганизация обучающихся в ходе дальнейшего усвоения материала
Организация и самоорганизация обучающихся в ходе дальнейшего усвоения материала Подведение итогов, домашнее задание
Подведение итогов, домашнее задание Домашнее задание с комментариями
Домашнее задание с комментариями