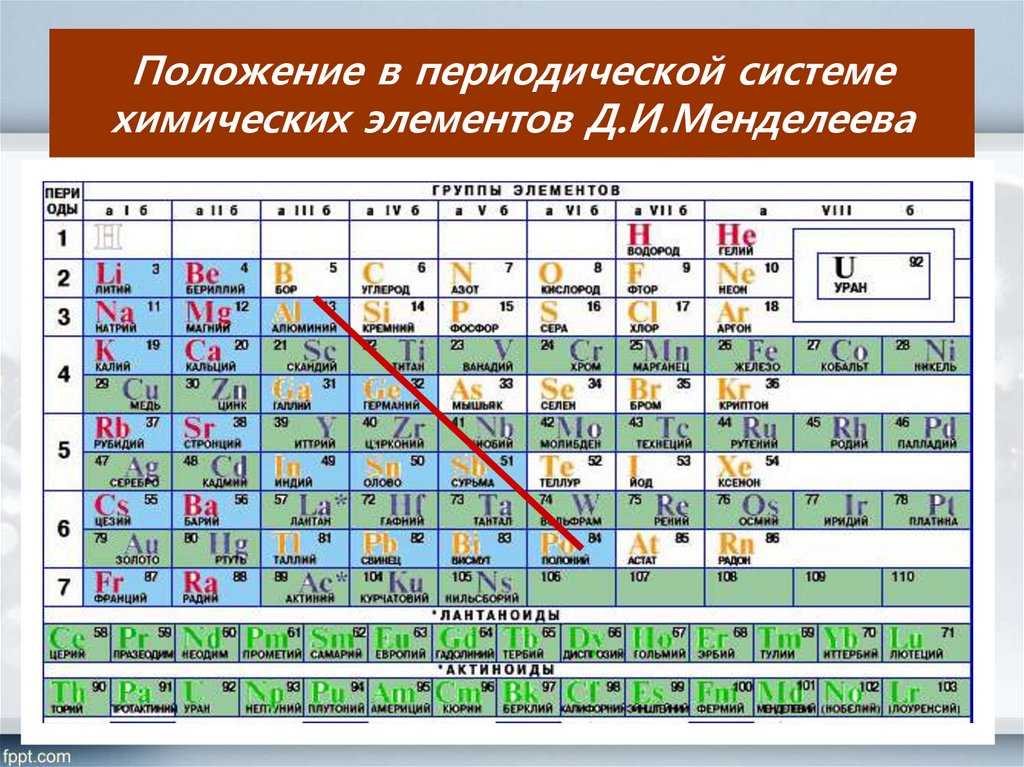
Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева.
Химические элементы в Периодической системе – это герои, и им, как и любым героям, нужно давать определенные характеристики. За основу их характеристики нужно брать Периодическую систему химических элементов Д.И. Менделеева.
Описывать химический элемент нужно будет по 7 пунктам:
1. указать Положение элемента в Периодической системе Д.И. Менделеева и строение его атома
2. характер простого вещества, т.е. металлом или неметаллом является этот химический элемент
3. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами
4. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними
5. определить
состав высшего оксида и его характер (основный, кислотный, амфотерный)
определить
состав высшего оксида и его характер (основный, кислотный, амфотерный)
6. состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
7. для неметаллов ещё указать состав летучего водородного соединения.
Но для этого, придется вспомнить основные закономерности изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп.
Для атомов химических элементов в группах сверху вниз
· увеличивается
· радиус атомов тоже увеличивается, т.к. увеличивается число энергетических уровней, а число энергетических уровней определяется номером периода
· при этом число электронов остается неизменным, электроны все дальше и дальше отдаляются от ядра, поэтому их становится легче отдать и восстановительные свойства усиливаются
·
окислительные
– ослабевают.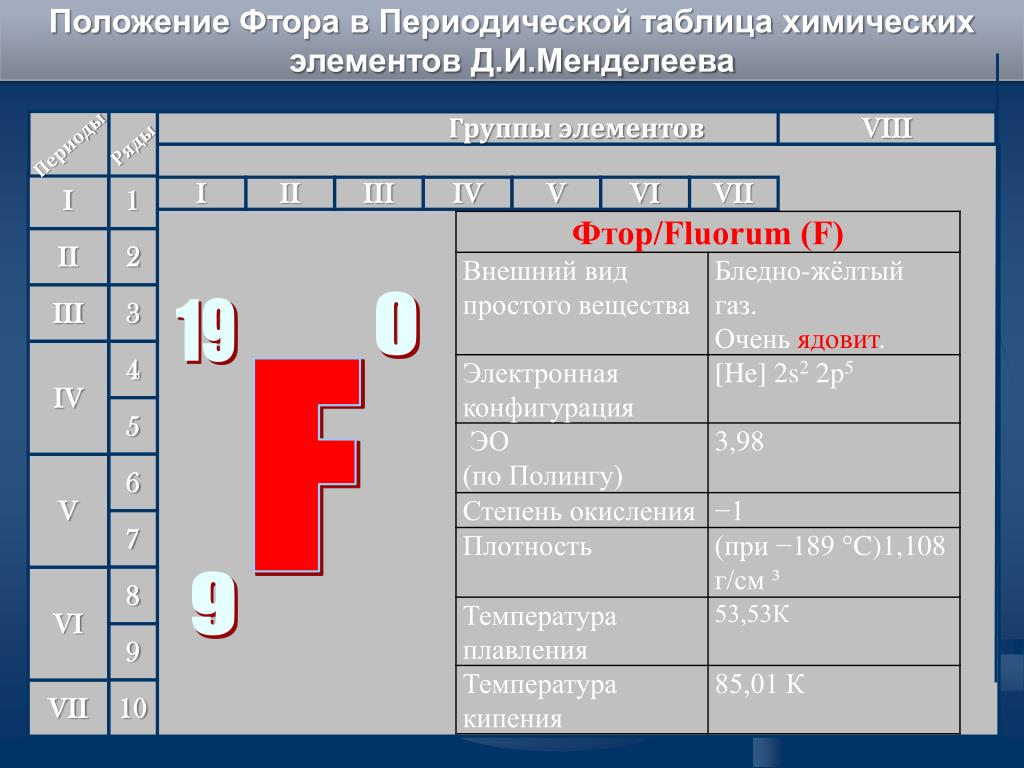
· высшая степень окисления
· низшая степень окисления тоже не изменяется и равна № группы – 8.
В периодах слева направо:
· заряд ядра увеличивается
· радиус уменьшается, т.к. увеличивается число электронов на внешнем уровне, которое определяется по номеру группы и электроны крепче связаны с ядром
· число энергетических уровней остается неизменным
· восстановительные свойства ослабевают
· усиливаются окислительные свойства.
·
·
низшая
степень окисления изменяется от -4 до -1: в четвертой группе она
равна -4, в пятой -3, в шестой -2, а в седьмой -1.
Что касается простых веществ, то металлические свойства в группах сверху вниз усиливаются, а в периодах слева направо ослабевают. Неметаллические свойства, наоборот, в группах сверху вниз ослабевают, а в периодах
Для соединений химических элементов характерно то, что в группах сверху вниз усиливаются основные свойства, а кислотные ослабевают. Например, в I группе, основные свойства оксида калия (K2O)выражены сильнее, чем у оксида лития (Li2O), а в IV группе у оксида кремния (IV) (SiO2)– кислотные свойства выражены сильнее, чем у оксида свинца (IV) (PbO2). В периодах слева направо усиливаются кислотные свойства, а ослабевают основные. Например, у оксида магния (MgO) основные свойства выражены сильнее, чем у

Нам пришлось много вспомнить из курса химии 8 класса, но зато теперь мы может охарактеризовать металл натрий по всем признакам.
· Порядковый номер натрия (Na), т.е. клетка, в которой он стоит – 11
· Массовое число – 23
· Значит, заряд его ядра
·
Натрий
находится в 3-ем периоде, у него 3 энергетических уровня,
на которых располагаются все его электроны. На первом уровне 2 электрона (это
максимально), на втором – 8, на третьем – 1 электрон.
Т.к. у натрия
Охарактеризуем натрий как простое вещество. Натрий – это металл, для него характерна металлическая химическая связь и металлическая кристаллическая решетка. Как и для любого металла для него характерны такие физические свойства, как металлический блеск, пластичность, тепло и – электропроводность.
Сравним свойства натрия со свойствами его
Сравним
свойства натрия со свойствами его соседей по периоду: металлические
свойства натрия выражены сильнее, чем у магния, т. к. в периодах,
слева направо радиус атомов уменьшается, а число электронов на
внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их
становится тяжелее оторвать, чем присоединить.
к. в периодах,
слева направо радиус атомов уменьшается, а число электронов на
внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их
становится тяжелее оторвать, чем присоединить.
Составим формулу оксида натрия, и определить его характер.
Т.к. натрий – металл I A группы, то ему соответствует оксид натрия – Na2O, значит, это основный оксид и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи.
Гидроксид натрия – это NaOH, он является щёлочью – растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями.
Натрий
– металл, но он не образует летучих водородных соединений.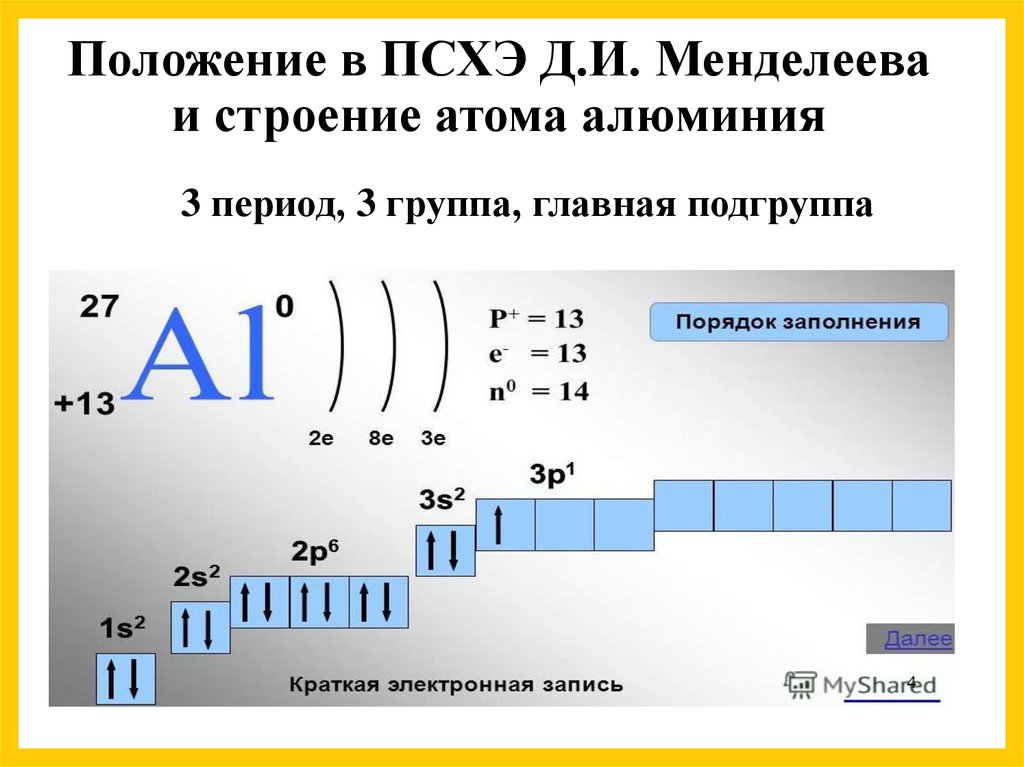
Охарактеризуем фосфор.
Фосфор находится в клетке номер 15, т.е. порядковый номер его – 15. Заряд ядра его атома будет +15. Число протонов, как и число электронов равно 15: (р = 15, ē = 15). Массовое число фосфора – 31, поэтому число нейтронов будет равно 16, т.к. если мы от массового числа отнимем число протонов, то будет 16 (31 – 15 = 16).
Фосфор находится в 3 периоде, значит, у него 3 энергетических уровня, на первом уровне – 2 электрона, на втором – 8, а на третьем будет пять: (2ē, 8ē, 5ē). На внешнем энергетическом уровне у фосфора 5 электронов.
Фосфор – это неметалл, он может быть как окислителем, так и восстановителем. Как окислитель, он может присоединить 3 электрона до завершения внешнего уровня, получая при этом степень окисления -3 (Р0 + 3 ē → Р-3), а как восстановитель, он может отдать 3 или 5 электронов и получить степень окисления +3 или +5

Фосфор – неметалл. Для него характерно явление аллотропии, как и для серы. Т.е. он может образовывать несколько простых веществ, отличающихся своими свойствами. Например, белый фосфор имеет белый цвет и молекулярную кристаллическую решетку, молекула имеет вид тетраэдра, а красный фосфор представляет собой полимер, черный фосфор является полупроводником и имеет металлический блеск.
Сравнить свойства фосфора и его соседей. Неметаллические свойства фосфора выражены сильнее, чем у мышьяка, но слабее, чем у азота, т.к. радиус у азота меньше, чем у фосфора. По сравнению с соседями по периоду, свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы.
Составим формулу оксида и гидроксида фосфора.
Высший
оксид фосфора – P2O5. Это кислотный оксид, который проявляет свойства, характерные для этих
оксидов: он реагирует с основными оксидами, основаниями и водой с
образованием соответствующей кислоты.
Это кислотный оксид, который проявляет свойства, характерные для этих
оксидов: он реагирует с основными оксидами, основаниями и водой с
образованием соответствующей кислоты.
Высший гидроксид фосфора – это фосфорная кислота, или ортофосфорная – H3PO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями.
Фосфор – неметалл, поэтому имеет летучее водородное соединение – РН3 – фосфин.
Нам пришлось потрудиться, но мы смогли выполнить все задание.
Характеристика элемента по его положению в периодической системе
Характеристика элемента по его положению в периодической системе
План урока
- План характеристики химического элемента
- Характеристика металла и его соединений
- Характеристика неметалла и его соединений
Цели урока
- Рассмотреть план характеристики химического элемента на основании его положения в ПС.

- Научиться описывать свойства химического элемента и его соединений на основе плана характеристики.
- Расширить и углубить знания о химических элементах, периодической системе и строению атомов.
Элементы и атомы
В менделеевский взятые круг,
Сделали химию самой богатой
И самой творческой из наук
Г. Санников
Можно предположить, что химические элементы в Периодической системе – это герои, и им, как и любым героям, можно давать определенные характеристики. За основу характеристики химических элементов мы будем брать Периодическую систему химических элементов (ПСХЭ) Д.И. Менделеева
План характеристики элементов по ПСХЭ
- Порядковый номер элемента, относительная атомная масса (Ar), химический знак.
- Строение атома (заряд ядра (Z), количество протонов, нейтронов, электронов).
- Положение элемента в ПС (период, группа, подгруппа), семейство элемента (s, p, d, f).

- Распределение электронов по энергетическим уровням, электронная формула атома.
- Характер элемента (металл, неметалл).
- Характеристика химической связи, физические свойства.
- Сравнение со свойствами соседних элементов (по группе, по периоду).
- Формула высшего оксида, название, его характер.
- Формула гидроксида (основания или кислоты), название, его характер.
- Состав летучего водородного соединения (для неметаллов главных подгрупп), название, характер.
Характеристика металла и его соединений
Охарактеризуем металл калий К
1. Порядковый номер калия, т.е. клетка, в которой он стоит – 19, относительная атомная масса Ar – 39. Химический символ – K.
2. Значит, заряд его ядра равен Z = +19, (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 19 электронов (19 e–), и 19 протонов (19 p+), а число нейтронов определяется по формуле n = Ar – Z, т. е. 39 – 19 = 20, значит в атоме 20 нейтронов (12 n0).
е. 39 – 19 = 20, значит в атоме 20 нейтронов (12 n0).
3. Калий расположен в ПС в I группе, главной (A) подгруппе, 4 большом периоде, относится к элементам s – семейства.
4. Так как калий находится в 4-ом периоде, значит, у него будет 4 энергетических уровня, на которых будут располагаться все его электроны. На первом уровне 2 электрона (это максимально), на втором – 8, на третьем – 8, на четвертом, значит, – 1 электрон.
Электронная формула атома калия: 1s22s22p63s23p64s1.
5. Т.к. у калия 1 электрон на внешнем уровне, то этот элемент относится к металлам. В реакциях он будет отдавать 1 электрон, проявляя восстановительные свойства, и получать степень окисления +1.
Рис.1. Металл калий.
6. Раз калий – это металл, то для него характерна металлическая химическая связь и металлическая кристаллическая решетка. Поэтому, как и для любого металла для него характерны такие физические свойства, как металлический блеск, пластичность, тепло и – электропроводность.
Поэтому, как и для любого металла для него характерны такие физические свойства, как металлический блеск, пластичность, тепло и – электропроводность.
7. Сравнение свойств элемента калия со свойствами его соседей по группе: металлические свойства калия выражены сильнее, чем у натрия, но слабее, чем у
рубидия, т.к. в группе сверху вниз увеличивается радиус атома и электроны больше отдаляются от ядра и их становится легче отдавать. Сравнение свойств элемента калия со свойствами его соседей по периоду: металлические свойства натрия выражены сильнее, чем у кальция, т.к. в периодах, слева направо радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается, электроны крепче связаны с ядром, поэтому их становится тяжелее отдавать, чем присоединить.
8. Калий – металл I A группы, его высшая валентность I (определяется номером группы). Металлу соответствует оксид калия – K2O, значит, это основный оксид, и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи. Это подтверждается уравнениями реакции:
Это подтверждается уравнениями реакции:
К2О + 2HCl → 2KCl + h3O
K2O + SO3 → K2SO4
K2O + h3O → 2KOH
9. Гидроксид калия (едкое кали) – это KOH, он является щёлочью – растворимым в воде основанием. Для него будут характерны следующие свойства: реакции с кислотами и кислотными оксидами, реакции с солями. Это подтверждается уравнениями реакции:
КОH + HNO3 → KNO3 + h3O
2KOH + CO2 → K2CO3 + h3O
2KOH + CaCl2 → 2KCl + Ca(OH)2
10. Если калий – металл, то он не образует летучих водородных соединений.
Характеристика неметалла и его соединений
Охарактеризуем неметалл сера S
1. Сера находится в клетке номер 16, т.е. ее порядковый номер – 16, относительная атомная масса Ar – 32. Химический символ – S.
2. Значит, заряд ядра ее атома будет Z = +16, а число протонов, как и число электронов равно 16: (р0 = 16, e- = 16). Число нейтронов будет равно 16, т.к. если мы от относительной атомной массы отнимем число протонов, то будет 16 (n0 = 32 – 16 = 16).
Число нейтронов будет равно 16, т.к. если мы от относительной атомной массы отнимем число протонов, то будет 16 (n0 = 32 – 16 = 16).
3. Сера расположена в ПС в VI группе, главной (A) подгруппе, 3 малом периоде, относится к элементам p – семейства.
4. Сера находится в третьем периоде, значит, у нее три энергетических уровня, на первом уровне 2 электрона, на втором – 8, а на третьем будет – 6.
Электронная формула атома серы: 1s22s22p63s23p4.
5. Сера – это неметалл, значит, она может быть как окислителем, так и восстановителем. Как окислитель, она может присоединить 2 электрона до завершения внешнего уровня, получая при этом степень окисления -2 (S0 + 2e- → S-2), а как восстановитель, она может отдать 4 или 6 электронов и получить степень окисления +4 или +6 (S0 – 4e- → S+4, S0 – 6e- → S+6).
6. Сера – неметалл. Для нее характерно явление
аллотропии
, т.е. она может образовывать несколько простых веществ, отличающихся своими свойствами.
Для нее характерно явление
аллотропии
, т.е. она может образовывать несколько простых веществ, отличающихся своими свойствами.
Рис.2. Аллотропные модификации серы: а – ромбическая; б – моноклинная; в – пластическая.
Наиболее устойчивая модификация серы – ромбическая сера S8, это хрупкое вещество желтого цвета. Моноклинная сера – в которой атомы соединены в циклы в виде «короны» представляет собой твердое вещество, состоящее из темно-желтых игл, устойчивое при температуре более 960С, а при обычной температуре превращающееся в ромбическую серу. Пластическая сера – длинные полимерные цепи пластической коричневой массы, нерастворимой в воде.
7. Сравнение свойств элемента серы со свойствами ее соседей по группе: неметаллические свойства серы выражены сильнее, чем у селена, но слабее, чем у кислорода, так как радиус у кислорода меньше, чем у серы. По сравнению с соседями по периоду свойства серы выражены сильнее, чем у фосфора, но слабее, чем у хлора.
8. Сера имеет высшую валентность 6 и низшую валентность 2 (определяется по формуле: 8-N, где N – номер группы). Высший оксид серы (VI) – SO3. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты. Это подтверждается уравнениями реакции:
SO3 + BaO → BaSO4
SО3 + 2NaOH → Na2SO4 + h3O
SO3 + h3O → h3SO4
9. Высший гидроксид серы – это серная кислота – h3SO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями. Это подтверждается уравнениями реакции:
h3SО4 + Mg → MgSO4 + h3
h3SO4 + Ca(OH)2 → CaSO4 + 2h3O
h3SO4 + CaO → CaSO4 + h3O
h3SO4 + Na2SiO3 → h3SiO3 + Na2SO4
10. Сера – неметалл, поэтому имеет летучее водородное соединение – h3S – сероводород.
Пример 1
Охарактеризуем химический элемент кальций по следующим характеристикам:
Характеристика | Элемент | |
Химический знак | ||
Название элемента | кальций | |
Порядковый номер | ||
Номер группы, подгруппа (главная, побочная) | II, главная | |
Металл, неметалл, амфотерный элемент | металл | |
Номер периода (большой, малый) | 4 большой | |
Относительная атомная масса (Аr) | Аr = 40 | |
Формула высшего оксида | ||
Формула высшего гидроксида | ||
Формула летучего водородного соединения | ||
Строение атома: | ||
а) Заряд ядра | ||
б) Количество электронов и протонов | ||
в) Количество нейтронов (n = Ar – Z) | n=40-20=20 | |
г) Количество энергетических уровней | ||
д) Количество электронов на последнем уровне | ||
е) Распределение электронов по энергетическим уровням и подуровням | 1s22s22p63s23p64s2 | |
ж) s-, p-, d-, f-элемент | s-элемент | |
Упражнение
Охарактеризуйте химический элемент кремний по тем же характеристикам, что и в примере.
Контрольные вопросы
- Перечислите пункты плана характеристики химического элемента.
- Каким элементам характерно наличие летучих водородных соединений?
Ответы
Характеристика | Элемент | |
Химический знак | ||
Название элемента | кремний | |
Порядковый номер | ||
Номер группы, подгруппа (главная, побочная) | IV, главная | |
Металл, неметалл, амфотерный элемент | неметалл | |
Номер периода (большой, малый) | 3 малый | |
Относительная атомная масса (Аr) | Аr = 28 | |
Формула высшего оксида | ||
Формула высшего гидроксида | h3SiO3 | |
Формула летучего водородного соединения | ||
Строение атома: | ||
а) Заряд ядра | ||
б) Количество электронов и протонов | ||
в) Количество нейтронов (n = Ar – Z) | n=28-14=14 | |
г) Количество энергетических уровней | ||
д) Количество электронов на последнем уровне | ||
е) Распределение электронов по энергетическим уровням и подуровням | 1s22s22p63s23p2 | |
ж) s-, p-, d-, f-элемент | p-элемент | |
Насколько важна периодическая таблица для описания характеристик составляющих элементов данного вещества?
Периодическая таблица — , самый важный справочник по химии — . Он упорядочивает все известные элементы в информативном массиве. Элементы располагаются слева направо и сверху вниз в порядке возрастания атомного номера. Порядок обычно совпадает с увеличением атомной массы.
Он упорядочивает все известные элементы в информативном массиве. Элементы располагаются слева направо и сверху вниз в порядке возрастания атомного номера. Порядок обычно совпадает с увеличением атомной массы.
|
Посмотреть полный ответ на Periodic.lanl.gov
Каково значение периодической таблицы элементов в знании характеристик и свойств элементов?
Периодическая таблица элементов объединяет все известные элементы в группы со схожими свойствами. Это делает его важным инструментом для химиков, нанотехнологов и других ученых. Если вы поймете периодическую таблицу и научитесь ею пользоваться, вы сможете предсказать, как поведут себя химические вещества.
Запрос на удаление |
Посмотреть полный ответ на sciencelearn.org.nz
Что важного периодическая таблица говорит нам об элементах?
Ученые используют периодическую таблицу, чтобы быстро получить информацию об элементе, такую как атомная масса и химический символ. Устройство периодической таблицы также позволяет ученым различать тенденции в свойствах элементов, включая электроотрицательность, энергию ионизации и атомный радиус.
Устройство периодической таблицы также позволяет ученым различать тенденции в свойствах элементов, включая электроотрицательность, энергию ионизации и атомный радиус.
|
Посмотреть полный ответ на acs.org
Почему важно использовать периодическую таблицу для предсказания химического поведения элемента?
Положение каждого элемента в таблице дает важную информацию о его структуре, свойствах и поведении в химических реакциях. В частности, положение элемента в периодической таблице помогает вам выяснить его электронную конфигурацию, то, как электроны организованы вокруг ядра.
Запрос на удаление |
Посмотреть полный ответ на khanacademy.org
Как важно знать, как точно расположены элементы в периодической таблице?
Элементы в периодической таблице расположены в порядке возрастания атомного номера. Все эти элементы демонстрируют несколько другие тенденции, и мы можем использовать периодический закон и формирование таблицы, чтобы предсказать их химические, физические и атомные свойства.
Все эти элементы демонстрируют несколько другие тенденции, и мы можем использовать периодический закон и формирование таблицы, чтобы предсказать их химические, физические и атомные свойства.
|
Посмотреть полный ответ на chem.libretexts.org
Периодическая таблица: Ускоренный курс химии #4
Какова цель периодической таблицы, что она представляет?
Периодическая таблица (также известная как периодическая таблица элементов) организована таким образом, чтобы ученые могли быстро различать свойства отдельных элементов, такие как их масса, число электронов, конфигурация электронов и их уникальные химические свойства.
|
Посмотреть полный ответ на sigmaaldrich.com
Почему периодическая таблица так важна?
Краткое содержание. Подводя итог, можно сказать, что периодическая таблица важна, потому что она организована таким образом, чтобы предоставить большой объем информации об элементах и о том, как они соотносятся друг с другом, в одном простом в использовании справочнике. Таблицу можно использовать для предсказания свойств элементов, даже тех, которые еще не открыты.
Запрос на удаление |
Полный ответ см. на сайте thinkco.com
Как периодическая таблица объясняет поведение элементов?
Периодическая таблица содержит огромное количество информации: Атомный номер: Количество протонов в ядре атома называется атомным номером этого элемента. Количество протонов определяет, какой это элемент, а также определяет химическое поведение элемента.
|
Посмотреть полный ответ на livecience.com
Что такое периодическая таблица и каково ее значение в изучении химии Что такое группы и периоды в периодической таблице?
Периодическая таблица — самый важный справочник по химии. Он упорядочивает все известные элементы в информативном массиве. Элементы располагаются слева направо и сверху вниз в порядке возрастания атомного номера. Порядок обычно совпадает с увеличением атомной массы.
Запрос на удаление |
Посмотреть полный ответ на Periodic.lanl.gov
Почему элементы важны Каким образом они важны?
Элементы — это существенные единицы, которые являются основными составляющими всех живых и неживых существ. Они являются ядром вселенной. Каждая крошечная или огромная частица состоит из элементов. Наше тело состоит из пяти основных элементов: углерода, водорода, кислорода, азота и кальция.
|
Посмотреть полный ответ на сайте healthontime.com
Как понимание периодической таблицы может предсказать характеристики и свойства различных веществ?
Периодическая таблица может предсказывать свойства новых элементов, поскольку она упорядочивает элементы в соответствии с их атомными номерами. Создание новых элементов — не простой процесс. Ученые используют ускоритель частиц, чтобы разбить легкие атомы на тонкую металлическую фольгу, содержащую более тяжелые атомы.
Запрос на удаление |
Посмотреть полный ответ на socratic.org
Какова цель периодической таблицы и как она устроена?
Периодическая таблица представляет собой табличный массив химических элементов, упорядоченных по атомному номеру, от элемента с наименьшим атомным номером, водорода, до элемента с наибольшим атомным номером, оганесона. Атомный номер элемента — это число протонов в ядре атома этого элемента.
Атомный номер элемента — это число протонов в ядре атома этого элемента.
|
Посмотреть полный ответ на britannica.com
Каковы характеристики периодической таблицы элементов?
Важными характеристиками элемента в периодической таблице являются его атомный символ, атомный номер и массовое число. Заслуга в создании проекта современной периодической таблицы принадлежит Дмитрию Менделееву, русскому химику.
Запрос на удаление |
Посмотреть полный ответ на unacademy.com
Как вы думаете, как таблица Менделеева поможет вам в учебе?
Периодическая таблица представляет собой краткую энциклопедию элементов. В таблице рассказывается почти все об элементе, каковы его размеры, реакции, физическое состояние и т. д. Будучи студентом, вы можете узнать атомные массы и атомные номера элементов, используя эту таблицу.
|
Посмотреть полный ответ на labster.com
Важно ли изучать периодическую таблицу?
Запоминание периодической таблицы важно, потому что она организована и дает много информации об элементах. Кроме того, это помогает учащимся понять, как элементы связаны друг с другом. Он используется для предсказания свойств каждого элемента.
Запрос на удаление |
Посмотреть полный ответ на byjus.com
Что самое важное в периодической таблице?
Ответ: Водород: самый важный элемент периодической таблицы, потому что самая важная функция водорода в организме человека — поддерживать водный баланс. Вода состоит из водорода и кислорода и поглощается клетками организма.
Запрос на удаление |
Посмотреть полный ответ на brainly.in
Какова важная характеристика группы в периодической таблице?
Элементы каждой группы имеют одинаковое количество валентных электронов. В результате элементы одной и той же группы часто проявляют схожие свойства и реакционную способность.
В результате элементы одной и той же группы часто проявляют схожие свойства и реакционную способность.
|
Посмотреть полный ответ на khanacademy.org
Какова основная характеристика последних элементов в периодах таблицы Менделеева 7 Каково общее название таких элементов?
Главный герой последнего элемента таблицы Менделеева в своих самых внешних оболочках полностью заполнен либо двумя, либо 8 электронами. Эти элементы известны как инертные газы. Этот ответ был полезен?
Запрос на удаление |
Посмотреть полный ответ на toppr.com
Почему важно знать и понимать свойства и характеристики материи?
Ученые должны понимать свойства материи, потому что она состоит из нее. Твердое, жидкое и газообразное – три основные фазы материи. В зависимости от их физических свойств большая часть материи будет существовать в любом из этих состояний.
|
Посмотреть полный ответ на byjus.com
Какое значение имеет знание классификации веществ и их свойств?
Целью классификации является выявление объектов с общими или сходными свойствами. Твердые вещества, жидкости и газы обеспечивают простые средства классификации состояния материи, но это не единственные группы, используемые учеными. Некоторые вещества очень трудно «классифицировать».
Запрос на удаление |
Посмотреть полный ответ на сайте education.vic.gov.au
Какой элемент вы считаете самым важным и почему?
Углерод является самым важным элементом для жизни. Без этого элемента жизнь, какой мы ее знаем, не существовала бы. Как вы увидите, углерод является центральным элементом в соединениях, необходимых для жизни.
Запрос на удаление |
Посмотреть полный ответ на сайте bio. libretexts.org
libretexts.org
Почему элементы так важны для жизни?
Химические элементы важны для живых организмов, потому что они составляют органические молекулы, присутствующие во всех живых существах. Органические молекулы — это углеводы, белки, липиды и нуклеиновые кислоты, и все эти молекулы содержат углерод в качестве основного элемента.
Запрос на удаление |
Полный ответ см. на сайте homework.study.com
Каковы наиболее важные свойства элемента?
Атомные свойства, которые имеют решающее значение для поведения элементов, – это электронная конфигурация, размер атома, энергия ионизации, сродство к электрону и электроотрицательность.
Запрос на удаление |
Полный ответ см. на сайте berkleycitycollege.edu
Как элементы используются в нашей повседневной жизни?
- Углерод. Наш корпус состоит из 18% углерода.
 …
… - Водород- Используется для синтеза воды, необходимой для жизни. …
- Кислород- необходим для дыхания, кровообращения и многих других физиологических процессов. …
- Хлор- Используется как дезинфицирующее средство для воды. …
- Сера-Используется в синтезе серной кислоты.
|
Посмотреть полный ответ на byjus.com
Как свойства и характеристики веществ помогают определить их вид или классификацию?
Каждый тип материи имеет свои уникальные свойства. Свойство — это характеристика или черта, которую люди используют для идентификации материи. Свойства материи позволяют нам идентифицировать различные вещества. Например, мы используем свойства материи, чтобы узнать, что дерево — это дерево, а золото — это золото.
Запрос на удаление |
Посмотреть полный ответ на letstalkscience.ca
← Предыдущий вопрос
Какова цель менструации у женщины?
Следующий вопрос →
Откуда появился первый черный ковбой?
Какие общие характеристики имеют элементы внутри группы по.
 .. Какие общие характеристики имеют элементы внутри группы по… | Pearson+ Channels
.. Какие общие характеристики имеют элементы внутри группы по… | Pearson+ ChannelsRecent Channels
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Biology
- Microbiology
- Anatomy & Physiology
- Genetics
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Микроэкономика
- Макроэкономика
- Финансовый учет
Социальные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
Общая химия2. Атомы и элементыПериодическая таблица: Имена групп
1:05
минуты
Задача 58
Вопрос из учебника
Проверенное решение
Это видео-решение было рекомендовано нашими преподавателями как полезное для решения указанной выше задачи.
123просмотров
Было ли это полезно?
Смотреть дальше
Master Periodic Table: Group Names with a bite sized video explanation from Jules Bruno
Start learning
Related Videos
Related Practice
Notes: Periodic Table Families and Valence Electrons
Tyson Poppleton
82views
Семейства периодической таблицы
Джессика Боненбергер
119views
Периодическая таблица объяснений
Lincoln Learning Solutions
128Views
Периодическая таблица: Названия групп
ЖУЛЕС БРУНО
360VIEWS
Части периодической таблицы
Химия.