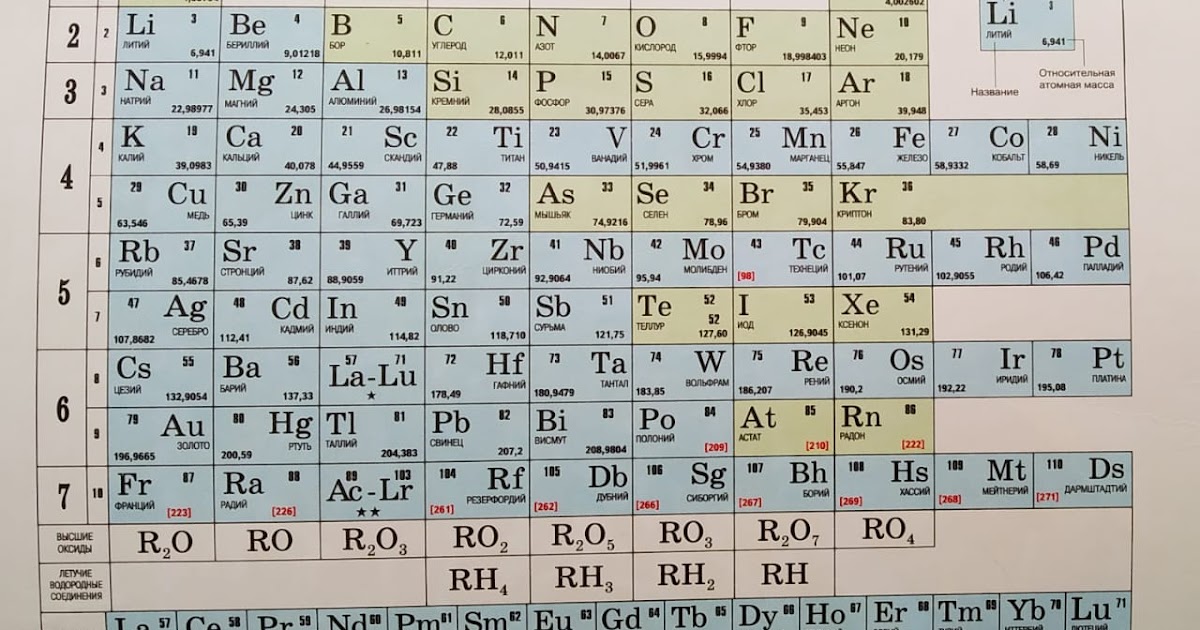
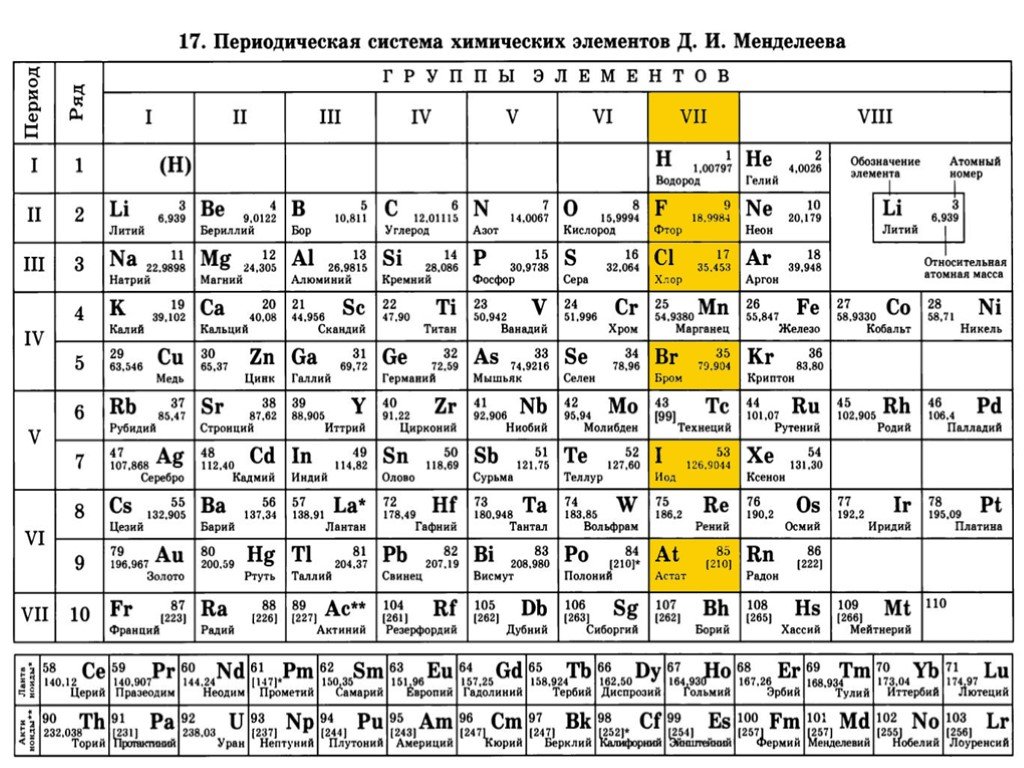
Характеристика химических элементов
Характеристика химических элементов| № | Название | Символ | |
|---|---|---|---|
| 1 | Водород | H | Водород H |
| 3 | Литий | Li | Литий Li |
| 4 | Бериллий | Be | Бериллий Be |
| 5 | Бор | B | Бор B |
| 6 | Углерод | C | Углерод C |
| 7 | Азот | N | Азот N |
| 8 | Кислород | O | Кислород O |
| 9 | Фтор | F | Фтор F |
| 11 | Натрий | Na | Натрий Na |
| Магний | Mg | Магний Mg | |
| 13 | Алюминий | Al | Алюминий Al |
| 14 | Кремний | Si | Кремний Si |
| 15 | Фосфор | P | Фосфор P |
| 16 | Сера | S | Сера S |
| 17 | Хлор | Cl | Хлор Cl |
| 19 | Калий | K | Калий K |
| 20 | Кальций | Ca | Кальций Ca |
| 21 | Скандий | Sc | Скандий Sc |
| 22 | Титан | Ti | Титан Ti |
| 23 | Ванадий | V | Ванадий V |
| 25 | Марганец | Mn | Марганец Mn |
| 26 | Железо | Fe | Железо Fe |
| 27 | Кобальт | Co | Кобальт Co |
| 28 | Никель | Ni | Никель Ni |
| 30 | Цинк | Цинк Zn | |
| 31 | Галлий | Ga | Галлий Ga |
| 32 | Германий | Ge | Германий Ge |
| 33 | Мышьяк | As | Мышьяк As |
| 34 | Селен | Se | Селен Se |
| 35 | Бром | Br | Бром Br |
| 37 | Рубидий | Rb | Рубидий Rb |
| 38 | Стронций | Sr | |
| 39 | Иттрий | Y | Иттрий Y |
| 40 | Цирконий | Zr | Цирконий Zr |
| 43 | Технеций | Tc | Технеций Tc |
| 48 | Кадмий | Cd | Кадмий Cd |
| 49 | Индий | In | Индий In |
| 50 | Олово | Sn | Олово Sn |
| 51 | Сурьма | Sb | Сурьма Sb |
| 52 | Теллур | Te | Теллур Te |
| 53 | Иод | I | Иод I |
| 55 | Цезий | Cs | Цезий Cs |
| 56 | Барий | Ba | Барий Ba |
| 72 | Гафний | Hf | Гафний Hf |
| 73 | Тантал | Ta | Тантал Ta |
| 74 | Вольфрам | W | Вольфрам W |
| 80 | Ртуть | Hg | Ртуть Hg |
| Таллий | Tl | Таллий Tl | |
| 82 | Свинец | Pb | Свинец Pb |
| 83 | Висмут | Bi | Висмут Bi |
| 84 | Полоний | Po | Полоний Po |
| 85 | Астат | At | Астат At |
Ответы | § 35.
 -}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
-}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества N2\mathrm{N_2}N2.
5) Валентность азота в высшем оксиде равна V, так как это элемент V группы. Валентность в летучем водородном соединении равна III.
6) Формула высшего оксида — N2O5\mathrm{N_2O_5}N2O5. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, предел являет собой кислоту HNO3\mathrm{HNO_3}HNO3.
7) Формула летучего водородного соединения — Nh4\mathrm{NH_3}Nh4.
в) Алюминий
1) Название химического элемента — алюминий, химический знак Al, относительная масса 27.
2) Атомный (порядковый) номер в периодической системе 13, элемент 3-го периода (малого), IIIA-группы (главной).
3) Заряд ядра атома 13+, оно содержит 13 протонов; в ядре нуклида 1327Al  14\mathrm{_{13}^{27}Al\,\, 14}1327Al14 нейтронов.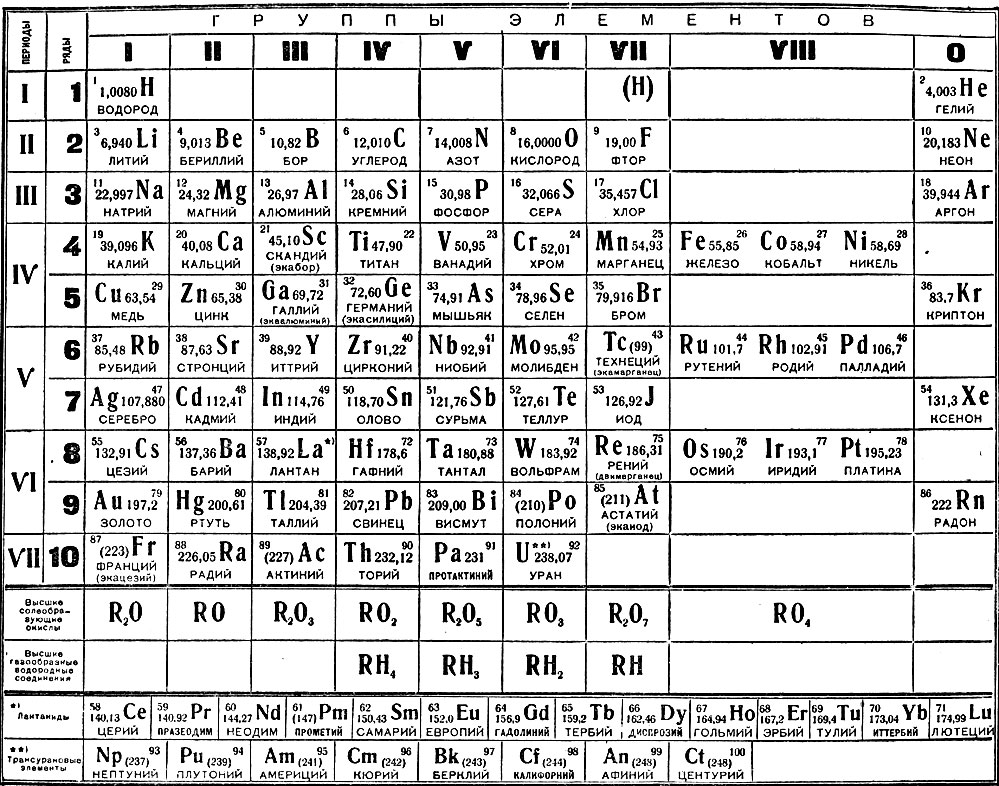 -.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
-.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества — Cl2\mathrm{Cl_2}Cl2.
5) Валентность хлора в высшем оксиде равна VII, так как это элемент VII-А группы. Валентность в летучем водородном соединении равна I.
6) Формула высшего оксида — Cl2O7\mathrm{Cl_2O_7}Cl2O7. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, представляет собой кислоту — HClO4\mathrm{HClO_4}HClO4.
7) Формула летучего водородного соединения — HCl\mathrm{HCl}HCl.
Кремний химический элемент, валентность, электронная формула, степень окисления, применение, плотность, температура плавления, молярная масса, строение атома кремния
Кремний – химический элемент таблицы Менделеева. Попробуем разобраться, что же такое кремний – металл или неметалл?
Какова его природа, общая характеристика и свойства не только в физике, но и в химии? Как реагирует с другими веществами? Какие соединения образуют? Каковы области применения этого элемента?
Содержание
Общая характеристика
Обозначение этого элемента в таблице Менделеева – Si (silicium – «силициум»). В таблице он стоит в четвертой группе третьего периода. Является неметаллом.
В таблице он стоит в четвертой группе третьего периода. Является неметаллом.
Первое название этого элемента силиций. В середине 19 века его стали называть «кремнием».
Основные особенности:
- Второй по распространенности элемент таблицы Менделеева.
- Аналог углерода – это элемент (а также его генетический ряд) со своими специфическими особенностями.
Где можно взять кремний? В основном, в природе он находится в земле в виде оксидов и других структур горных пород (кварц, силикат и т. д.).
Состав и структура кремния
Рассмотрим основные параметры этого элемента в таблице.
| Признак | Характеристика |
| Атомная масса | 28,086 а. е. м. |
| Молекулярная (молярная) масса | 28,086 г/моль |
| Размер атома / заряд ядра | 14 |
| Валентность | 2,4 |
| Степень окисления | ±4, -2 |
| Плотность | 2,33 г/см3 |
| Температура плавления | 1688 К |
| Химическая связь | ковалентная неполярная |
| Кристаллическая решетка | атомная |
У кремния есть 3 изотопа: Si (28), Si (29), Si (30).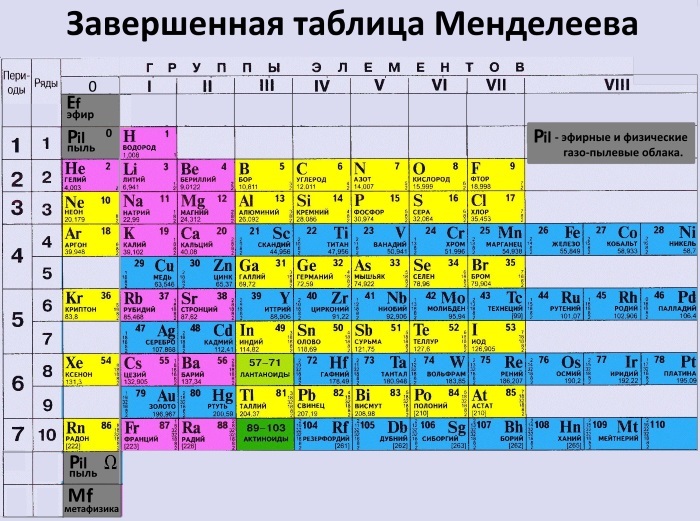
Электронное строение атома кремния показано на картинке:
Физические свойства
Строение атома кремния, из которого состоит большинство материалов, позволяет доказать ученым наличие аллотропии у этого элемента.
Выделяют 2 модификации:
- аморфный,
- кристаллический.
Первый представляет собой порошок коричневого цвета, который плавится при температуре свыше 1400 градусов Цельсия.
Второй – кристаллизованный кремний темно-серого оттенка с блестящей поверхностью.
По сравнению с предыдущим, обладает высокими показателями тепло- и электропроводности.
Химические свойства
Поскольку он находится в четвертой группе главной подгруппе таблицы Менделеева, то может проявлять как окислительные, так и восстановительные свойства.
Рассмотрим по отдельности каждый вид реакций.
Восстановительные процессы
С простыми веществами:
Si + 2Br2 = SiBr4,
Si + O2 = SiO2.
Со сложными веществами:
Кислоты
3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8h3O.
Гидроксиды
Si + 2NaOH + h3O = Na2SiO3 + 2h3.
Окислительные процессы
Он проявляет при взаимодействии с гидридами, металлами, солями, сильными концентрированными кислотами.
Как правило, в качестве побочных продуктов в таких реакциях выступают окиси неметаллов, сульфаты, нитраты и другие соли, содержащие этот элемент.
Получение кремния
Различают два способа получения кремния: лабораторный и промышленный. Рассмотрим подробно оба.
В лаборатории
Его восстанавливают с помощью магния или алюминия при нагревании.
В промышленности
Получение этим способом требует больших усилий:
- В печах под действием кокса идет разложение диоксида кремния при температуре свыше 1790 градусов по Цельсию.
- Очищают полученный кремний от примесей. Как правило, получают соль, а затем обрабатывают кислотами.
- Очистку проводят до тех пор, пока массовая доля в образце не будет ниже 95%.

Кроме того, в промышленности в последние годы популярным способом очистки стало хлорирование. Оно используется чаще, поскольку этот метод экономически выгоден и дает большую степень очистки.
В России существует всего два завода по производству технического кремния: Каменск-Уральский и Усолье-Сибирский.
Области применения
Кремний имеет широкую область применения:
- Он является хорошим сырьем для получения его аллотропных модификаций и различных соединений на его основе.
- Это главный компонент при получении различных сплавов. EuroEscortBabes Как правило, в металлургии это главный окислитель и модифицирующий элемент.
- Кремний часто используется для получения стекла и цемента.
- Он является незаменимым компонентом в производстве батарей.
- Кремний чаще всего используется как подручное средство для получения других простых веществ в лаборатории.
Плюсы и минусы кремния
Попробуем разобраться, в чем же заключаются преимущества и недостатки этого элемента? Как он вообще влияет на жизнь различных организмов?
Кремний необходим растениям для питания и роста, некоторым простейшим организмам для правильного протекания процессов жизнедеятельности.
В организмах высших существ он играет важную роль (является одним из незаменимых микроэлементов), но помимо этого может вредить им (вызывать силикоз – отравление солями этого неметалла).
Незаменима его роль в промышленности и технике, металлургии. А вот медицинские показатели еще до конца не изучены, поэтому применять его для лечения различных заболеваний можно с осторожностью и только по рекомендациям врача.
Заключение
Кремний незаменим в химии и физике. Он играет важнейшую роль в биохимических реакциях организма человека. Правда избыток этого элемента может привести к хроническим болезням.
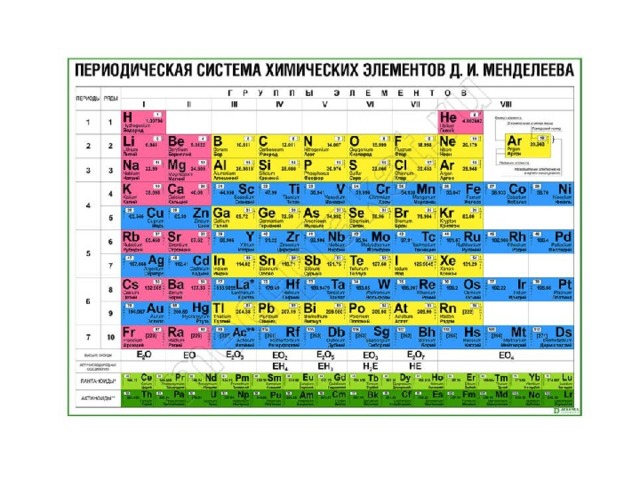
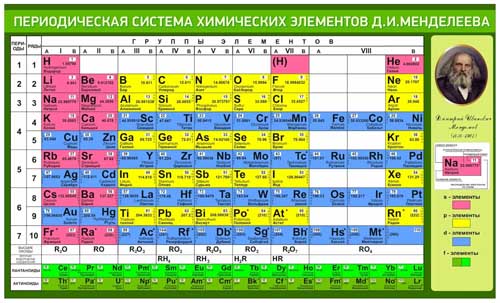
Характеристики и свойства семейства – ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ
характеристики и свойства семейства Элементы одного семейства имеют схожие характеристики, такие как химическая реактивность или одинаковое количество валентных электронов.
щелочные металлы
СВОЙСТВА И ХАРАКТЕРИСТИКИ
– Эти металлы находятся в группе 1 вашей таблицы Менделеева также называемые щелочными растворами
– Большинство реактивных металлов
– имеют тенденцию пожертвовать электроны в реакциях и имеют состояние окисления плюс 1
– Точка с низкой кипением и температуру плавления
– менее плотные, чем большинство других элементов
– Все найдены естественным образом по природе, но не в чистых формах
– Большие атомные радиусы
– Высокореактивная
-Увеличение электроотрицательности и энергии ионизации в течение периода и повышение группы
(другими словами, щелочные металлы имеют самую низкую электроотрицательность и энергию ионизации)
– Атомный радиус увеличивается справа налево в течение периода и вниз по группе
– Точки кипения и точки плавления увеличиваются от нижней части группы до вершины группы
щелочноземельные металлы
СВОЙСТВА И ХАРАКТЕРИСТИКИ – Имеют 2 электрона в валентной оболочке со степенью окисления плюс 2 – Легко теряют электроны появляются в чистом виде – Низкая энергия ионизации – Существуют с зарядом 2 плюс большую часть времени – Легко образующие двухвалентные катионы |
галогены
СВОЙСТВА И ХАРАКТЕРИСТИКИ – Имеют 7 валентных электронов, которым требуется только один другой электрон для образования полного октета, чем другие металлы 77 группы |
благородные газы
СВОЙСТВА И ХАРАКТЕРИСТИКИ – Имеющие заполненные валентные электроны – Первая энергия ионизации Уменьшается вниз по группе в таблице Менделеева – Имеют наибольшую энергию ионизации – Увеличение плотности вниз по группе – Стабильные и не склонные к образованию связей – Благородные газы – это бесцветные, не имеющие запаха, вкуса и негорючие газы при стандартных условиях |
переходные металлы
СВОЙСТВА И ХАРАКТЕРИСТИКИ – очень твердые – 5 d-орбиталей становятся более заполненными, слева направо в таблице |
Чудесные металлоиды периодической таблицы
Что такое металлоиды? Большинство элементов относительно четко вписываются в одну из двух категорий: металлы и неметаллы. Металлоиды, однако, могут быть классифицированы как нечто среднее. По этой причине их иногда, но реже, называют полуметаллами.
Металлоиды, однако, могут быть классифицированы как нечто среднее. По этой причине их иногда, но реже, называют полуметаллами.
Элементы, отнесенные к категории металлоидов, часто выделяются в так называемую «ступеньку металлоидной лестницы», потому что эта группа элементов чем-то напоминает лестницу, если они окрашены иначе, чем соседние элементы. Металлоиды отделяют переходные металлы от неметаллов в периодической таблице. Давайте рассмотрим свойства и характеристики металлоидов и их список.
Металлоиды выделены зеленым цветом. Селен также иногда считают металлоидом. Металлоиды, как правило, имеют металлический вид, но в большинстве химических реакций ведут себя скорее как неметаллы. Все металлоиды твердые при комнатной температуре. Они гораздо более хрупкие, чем металлы, но гораздо хуже проводят электрический ток. Гибридные характеристики, которыми обладают металлоиды, предлагают широкий спектр реальных применений, таких как металлические сплавы, антипирены и полупроводники / электроника.
Характерные свойства металлоидов
- Металлоиды представляют собой твердые вещества
- Они имеют металлический блеск и в целом выглядят как металлы
- Они хрупкие и легко разрушаются
- Металлоиды могут проводить электричество, но не так хорошо, как металлы.
- Химически они больше похожи на неметаллы, легко образуя анионы, имея несколько степеней окисления и образуя ковалентные связи.
- Их энергия ионизации и электроотрицательность находятся между значениями металлов и неметаллов.
Металлоиды представляют собой самую маленькую группу элементов, поскольку только шесть элементов окончательно классифицируются как металлоиды. У них может быть от трех до шести валентных электронов на внешней энергетической оболочке. Это является движущей силой их реактивности/химического поведения. Бор, у которого всего три валентных электрона, во время химических реакций ведет себя как металл, отдавая свои электроны. Другие металлоиды с четырьмя и более валентными электронами ведут себя скорее как неметаллы, приобретая электроны в ходе реакций. Давайте узнаем некоторые факты об отдельных металлоидах, начиная с бора.
Давайте узнаем некоторые факты об отдельных металлоидах, начиная с бора.
Список металлоидов
БорЭлемент бор имеет сильную склонность к образованию ковалентных связей, что означает, что химически он является неметаллом, таким как углерод или кремний. Он имеет много аллотропов (различных форм чистого элемента) и обладает высокой электроотрицательностью, поскольку находится в верхнем правом углу периодической таблицы.
Бор имеет два основных стабильных изотопа, 11_B и 10_B, содержание которых составляет около 80,4% и 19,6% соответственно. Чистый бор часто используется для воспламенения топлива, но этот элемент также имеет множество медицинских применений, таких как антисептики и глазные капли, в которых используются соединения на основе бора. Некоторые люди потребляют бор в качестве пищевой добавки, потому что этот микроэлемент важен для гормональной регуляции, восстановления и усвоения некоторых витаминов.
Кремний Кремний представляет собой хрупкое кристаллическое твердое вещество с металлическим внешним видом. Это мощный полупроводник, то есть он более эффективно проводит электричество при более высоких температурах. Соединения кремния, называемые силикатами, составляют почти 90% земной коры, чистый кремний встречается редко. Однако это относительно часто встречается на астероидах, лунах и космической пыли. Силикаты часто используются в производстве цемента, фарфора и керамики.
Это мощный полупроводник, то есть он более эффективно проводит электричество при более высоких температурах. Соединения кремния, называемые силикатами, составляют почти 90% земной коры, чистый кремний встречается редко. Однако это относительно часто встречается на астероидах, лунах и космической пыли. Силикаты часто используются в производстве цемента, фарфора и керамики.
В 21 веке кремний оказал огромное влияние на мировую экономику благодаря своей роли в развитии полупроводниковой электроники. Чистый кремний был жизненно важен для разработки микросхем интегральных схем и транзисторов, которые являются важными компонентами современных электронных устройств, таких как сотовые телефоны, телевизоры и бытовая техника.
Германий Германий представляет собой твердо-хрупкий металлоид светло-серого цвета, очень похожий на кремний. Он также является хорошим полупроводником и редко встречается на Земле в чистом виде. Германий часто кристаллизуется в алмазную структуру. Дмитрий Менделеев предсказал существование германия за несколько лет до того, как он был открыт. Он также смог предсказать многие из его свойств, используя свое понимание периодических тенденций и знание других металлоидов и близлежащих элементов.
Дмитрий Менделеев предсказал существование германия за несколько лет до того, как он был открыт. Он также смог предсказать многие из его свойств, используя свое понимание периодических тенденций и знание других металлоидов и близлежащих элементов.
Как и кремний, германий также имеет решающее значение для современных технологий, хотя он в основном используется в других областях, чем его металлический родственник. Германий часто используется для инфракрасной оптики, солнечной энергетики и многочисленных металлических сплавов.
Мышьяк Мышьяк — это элемент с блестящим серовато-металлическим оттенком, очень похожий на другие металлоиды. Он легко образует ковалентные связи с неметаллами. Мышьяк применяется в сплавах, электронике и пестицидах/гербицидах. Однако мышьяк очень токсичен для большинства млекопитающих, включая человека, и поэтому многие виды его использования в промышленности постепенно прекращаются. Он классифицируется как канцероген группы А. Несмотря на его токсичность, для метаболизма человека требуются очень небольшие количества мышьяка, но механизм этого неизвестен.
Несмотря на его токсичность, для метаболизма человека требуются очень небольшие количества мышьяка, но механизм этого неизвестен.
Сурьма представляет собой блестящий серебристо-белый металлоид с хрупкой текстурой. Он встречается в природе примерно на ⅕ содержания мышьяка. Сурьма также имеет атомную структуру, аналогичную мышьяку, с тремя наполовину заполненными электронными оболочками в самой внешней оболочке. Обычно он образует ковалентные связи и обладает высокой реакционной способностью с галогенами, такими как сера, и при горении образует ярко-синее пламя.
Сурьма обладает уникальной способностью упрочнять металлические сплавы при добавлении даже в относительно небольших количествах. Сурьма также может придавать прочность чистым металлам (образующим сплавы), а именно свинцу. Благодаря своим укрепляющим свойствам сурьма незаменима во многих отраслях промышленности, таких как автомобильные аккумуляторы, боеприпасы, кабели и сантехника. Как и другие металлоиды, высокоочищенная сурьма может использоваться в полупроводниковых технологиях.
Как и другие металлоиды, высокоочищенная сурьма может использоваться в полупроводниковых технологиях.
Теллур — это металлоид, по описанию сходный с сурьмой. Обычно встречается в виде серого порошка. теллур очень реактивен с серой и селеном и при горении дает зелено-голубое пламя. Теллур в промышленности используется в качестве добавки к стали и может быть легирован алюминием, медью, свинцом или оловом.
Как и сурьма, теллур также может упрочнять другие металлы, но также может уменьшать коррозию при добавлении к вышеупомянутым металлам. Кроме того, теллур служит прочным полупроводником, особенно при воздействии света. В природе большая часть теллура содержится в угле, хотя его следовые количества обнаруживаются в некоторых растениях.
Заключение по металлоидам
Стоит отметить, что иногда селен также считается полуметаллом – это зависит от того, кто занимается классификацией. Астат и полоний, вероятно, также являются полуметаллами, но они очень радиоактивны и с ними можно обращаться только в особых условиях. Независимо от того, какие элементы вы включаете, мы все можем согласиться с тем, что металлоиды — интересная и увлекательная группа элементов!
Независимо от того, какие элементы вы включаете, мы все можем согласиться с тем, что металлоиды — интересная и увлекательная группа элементов!
Хаускрофт, Кэтрин Э. и Алан Г. Шарп. Неорганическая химия . 5-е издание, Pearson, 2018.
Lejla Peace — собственная работа, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=15363940
Miessler, Gary L., and Donald А. Тарр. Неорганическая химия . 3-е издание, Пирсон, 2009 г.
Полинг, Линус. Общая химия . 1-е издание, Дувр, 1947 г.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 два следующих модуля Chemcal:
два следующих модуля Chemcal: 

 Химические характеристики металлов
включают следующее:
Химические характеристики металлов
включают следующее:  Однако для металлов эта потребность в энергии намного меньше, чем для металлов.
неметаллов в тот же период таблицы. Например, первый
энергия ионизации металлического натрия составляет 502 кДж/моль, а у
неметаллический хлор того же периода составляет 1257 кДж/моль.
энергия, необходимая для отрыва второго электрона от любого атома, выше
чем для первого, поскольку существует большее притяжение между
оставшиеся электроны и избыток заряда +1, который несет ядро
после потери первого электрона. Требуется еще больше энергии
убрать третий электрон и так далее.
Однако для металлов эта потребность в энергии намного меньше, чем для металлов.
неметаллов в тот же период таблицы. Например, первый
энергия ионизации металлического натрия составляет 502 кДж/моль, а у
неметаллический хлор того же периода составляет 1257 кДж/моль.
энергия, необходимая для отрыва второго электрона от любого атома, выше
чем для первого, поскольку существует большее притяжение между
оставшиеся электроны и избыток заряда +1, который несет ядро
после потери первого электрона. Требуется еще больше энергии
убрать третий электрон и так далее.
 Такие соединения, содержащие
O 2- анион также должен содержать катион. Это определяющее
свойство металлов, что они образуют катионы в соединениях, потому что их
внешние электроны относительно легко удаляются в реакциях. Таким образом
основные оксиды обычно представляют собой оксиды металлов.
Такие соединения, содержащие
O 2- анион также должен содержать катион. Это определяющее
свойство металлов, что они образуют катионы в соединениях, потому что их
внешние электроны относительно легко удаляются в реакциях. Таким образом
основные оксиды обычно представляют собой оксиды металлов.


 энергия с позицией периодической таблицы.
энергия с позицией периодической таблицы.  е. ионизировать атом.
е. ионизировать атом.