Общая характеристика элементов неметаллов — урок. Химия, 8–9 класс.
Неметаллы в природе
Из \(118\) известных на данный момент химических элементов \(96\) являются металлическими, и только \(22\) химических элемента относятся к неметаллическим.
Неметаллические химические элементы широко распространены в земной коре.
Кислород и кремний составляют около \(76\) % (практически три четверти) от массы земной коры (\(O_2\) — \(49,4\) %, \(Si\) — \(25,8\) %).
Алюминий \(Al\) — \(7,5\) %.
Железо \(Fe\) — \(4,7\) %.
Кальций \(Ca\) — \(3,4\) %.
Натрий \(Na\) — \(2,6\) %.
Калий \(K\) — \(2,4\) %.
Магний \(Mg\) — \(1,9\) %.
Водород \(H\) — \(0,9\) %.
Титан \(Ti\) — \(0,9\) %.
Рис. \(1\). Содержание химических элементов в земной коре
Такие химические элементы, как углерод \(C\), водород \(H\), кислород \(O\), азот \(N\), фосфор \(P\) и сера \(S\), составляют \(98,5\) % от массы растений и \(97,6\) % от массы тела человека.
Рис. \(2\). Содержание химических элементов в теле человека
На долю неметаллических химических элементов приходится большая часть массы живых организмов.
В состав земной атмосферы входят как простые, так и сложные вещества, образованные элементами-неметаллами.
В объёмных долях на азот N2 приходится \(78\) %, на кислород O2 — \(21\) %, а инертные газы составляют \(0,96\) % от объёма воздуха. В состав земной атмосферы также постоянно входит углекислый газ CO2, доля которого (по разным оценкам) составляет около \(0,04\) % от состава чистого воздуха.
Следует иметь в виду, что в воздухе постоянно содержится водяной пар h3O и другие соединения неметаллов, доля которых не является постоянной.
Рис. \(3\). Состав воздуха
Неметаллические химические элементы образуют большую часть веществ, входящих в состав воздуха
Главный химический элемент Вселенной — это водород. Из него образованы Солнце и другие звёзды, газовые облака и т. д. И на нашей планете из каждых \(100\) атомов \(17\) — это атомы водорода.
Из него образованы Солнце и другие звёзды, газовые облака и т. д. И на нашей планете из каждых \(100\) атомов \(17\) — это атомы водорода.
Положение элементов неметаллов в Периодической системе, особенности строения и свойств их атомов
В Периодической системе химических элементов неметаллы занимают правый верхний угол и находятся только в главных (А) группах.
Рис. \(4\). Положение неметаллов в периодической системе
Знаки неметаллических химических элементов выделены красным и фиолетовым цветом.
В электронной оболочке атомов неметаллов на внешнем энергетическом уровне, как правило, содержится от \(4\) до \(8\) электронов. Исключение составляют только водород \(H\), у которого в электронной оболочке атома вообще только один электрон, гелий \(He\) с двумя электронами и бор \(B\), у которого на наружном энергетическом уровне имеются три электрона.
Радиусы атомов неметаллов меньше, чем у металлов того же периода, поэтому в силу близости положительно заряженного ядра атома неметаллы хорошо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
Рис. \(5\). Характер изменения радиусов атомов химических элементов в периодах и в группах
Радиусы атомов неметаллов существенно меньше, чем радиусы атомов металлов, находящихся в том же периоде.
Главное отличительное свойство неметаллов — это их высокая электроотрицательность, т. е. способность в химических соединениях притягивать электроны.
Рис. \(6\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу)
ОЭО неметаллических химических элементов (выделены красным цветом) превосходит соответствующую величину металлических химических элементов
Атомы неметаллов способны как принимать, так и отдавать электроны, а значит, химические вещества, содержащие такие атомы, в ходе превращений могут выступать как в роли окислителей, так и в роли восстановителей.
Источники:
Рис. 1. Содержание химических элементов в земной коре © ЯКласс
Рис. 2. Содержание химических элементов в теле человека © ЯКласс
2. Содержание химических элементов в теле человека © ЯКласс
Рис. 3. Состав воздуха https://cdn.pixabay.com/photo/2017/02/18/09/04/sky-2076868_960_720.jpg
Рис. 4. Положение неметаллов в периодической системе © ЯКласс
Рис. 5. Характер изменения радиусов атомов химических элементов в периодах и в группах © ЯКласс
Рис. 6. Величины относительных электроотрицательностей © ЯКласс
Характеристика золота | Периодическая таблица химических элементов Д. И. Менделеева с историческими сведениями
Общая характеристика золота как элемента
Химический знак – Au
Относительная атомная масса – 196,967
В соединениях золото одновалентно, проявляет степень окисления +1.
Золото как вещество
Способы получения золота:
- Разложением оксида золота(III):
2Au2O3 → 4Au + 3O2
- Восстановлением оксида золота(III) водородом:
2Au2O3 + 3H2 → 2Au + 3H2O
- В промышленности золото может быть получено:
- Промывкой;
- Амальгамацией;
- Цианированием;
- Регенерацией.

Физические свойства золота:
- Тяжёлый, ковкий, мягкий благородный металл жёлтого цвета.
- Температура плавления равна 1064,4°С, температура кипения равна 2947°С.
Химические свойства золота:
Устойчив в сухом и влажном воздухе. Переводится в раствор действием «царской водки», смесями галогенов и галогеноводородных кислот, кислородом в присутствии цианидов щелочных металлов. В растворе простых катионов не образует. В особых условиях образуется коллоидное золото.
При нагревании реагирует с галогенами, селеновой кислотой. Со ртутью образует амальгаму.
Не реагирует с водой, кислотами-неокислителями, концентрированными серной и азотной кислотами, щелочами, гидратом аммиака, кислородом, азотом, углеродом, серой.
Au + HNO3(конц.) + 4HCl(конц.) → H[AuCl4] + NO↑ + 2H2O
2Au + 6H2SeO4(ж. )→ Au2(SeO4)3 + 3SeO2 + 6H2O
)→ Au2(SeO4)3 + 3SeO2 + 6H2O
2Au + 3Cl2→ 2AuCl3
2Au + Cl2→ 2AuCl
Применение золота:
В промышленности: материал для электрических контактов, в качестве покрытия зеркал, в качестве специальной оболочки в нейтронной бомбе, при пайке металлов, защита от коррозии. Золото широко применяется при изготовлении ювелирных изделий. В стоматологии золото применяют для коронок и зубных протезов. В медицине и фармакологии золото – это одна из составляющих препаратов, используемых при лечении туберкулёза, ревматоидных артритов, злокачественных опухолей. Золото зарегистрировано в качестве пищевой добавки Е175.
Источники
1. https://ru.wikipedia.org/wiki.
2. Лидин, Р. А. Химические свойства неорганических веществ / Р. А. Лидин, В. А. Молочко, Л. Л. Андреева. – М.: Химия, 2000.
Элементы III периода таблицы Д.
 И.Менделеева. Задачи 35
И.Менделеева. Задачи 35
Характер химической связи в оксидах элементов 3-го периода таблицы Д.И.Менделеева
Задача 35.
Руководствуясь разностью электроотрицательностей, определить, как меняется характер химической связи в оксидах элементов III периода таблицы Д.И.Менделеева.
Электроотрицательность (“Х”) представляет собой обобщенную характеристику элемента, связанную не с электронами на отдельных орбиталях, а с внешними электронами вообще, определяемую как сумма энергии ионизации и сродства к электрону. Под электроотрицательностью понимают относительную характеристику способности атома, притягивать электронную пару. Относительная электроотрицательность в периоде возрастает и уменьшается в подгруппе с ростом заряда ядра.Основные свойства высших оксидов и гидроксидов элементов в периоде закономерно ослабляются, что связано с увеличением силы притяжения гидроксид-ионов к центральному атому с ростом заряда его ядра и уменьшением атомного радиуса, а в подгруппе, в основном, усиливаются, потому что атомный радиус элементов возрастает.

Кислотные свойства этих соединений изменяются в обратном направлении. Неметаллические свойства в периоде, как правило усиливаются слева направо, а в подгруппе – ослабевают сверху вниз, металлические – наоборот.
Если электроотрицательность атомов, образующих молекулу, одинакова или очень близка, то общая электронная пара располагается симметрично по отношению к обоим ядрам.
Если
Подобные ковалентные связи называют полярными. Степень полярности такой связи оценивается значением электрического момента диполя – m, равного произведению эффективного заряда на длину диполя: m = q·l
Наконец, если разница электроотрицательностей (ΔX) превышает 1,9, то образуется ионная связь – предельный случай ковалентной полярной связи. Её можно рассматривать как электростатическое притяжение, возникающее между разноименно заряженными ионами.
Ионная связь, в отличие от ковалентной, является ненаправленной, ненасыщенной, а координационные числа в ионных соединениях определяются соотношением радиусов взаимодействующих ионов:
(ΔX) Nа2О = 3,44 – 0,93 = 2,51 – связь ионная;
(ΔX) МgО = 3,44 -1,31 = 2,13 –
(ΔX) Аl2О3 = 3,44 – 1,61 = 1,83 – связь ковалентная полярная;
(ΔX) SiО2 = 3,44 – 1,90 = 1,54 – связь ковалентная полярная;
(ΔX) Р2О5 = 3,44 – 2,19 = 1,25 – связь ковалентная полярная;
(ΔX)SОх = 3,44 – 2,58 = 0,86 – связь ковалентная полярная;
(ΔX)СlуОх = 3,44 – 3,16 = 0,28 – связь ковалентная неполярная [(ΔX) < 0,4].
Электронные формулы элементов 3-го периода
Задача 36.
Напишите электронные формулы для элементов III периода, определите их валентные электроны и охарактеризуйте их с помощью квантовых чисел.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f Последовательность заполнения энергетических уровней и подуровней следующая:
Последовательность заполнения энергетических уровней и подуровней следующая:
1s►2s►2р►3s►3р►4s►3d►4р►5s►4d►5р►6s►(5d1)►4f►5d►6р►7s►(6d1-2►5f►6d►7р
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для элементов III периода электронные формулы имеют вид:
а) +11Na 1s2 2s2 2p6 3s1 3p0
Валентные электроны натрия 3s1 находятся на 3s-подуровне На валентной орбитали атома Na находится 1 электрон. Поэтому элемент помещают в первую группу периодической системы Д.И.Менделеева.
б) +12Mg 1s2 2s2 2p6 3s2 3p0
Валентные электроны магния 3s2 находятся на 3s-подуровне На валентной орбитали атома Mg находится 2 электрона. Поэтому элемент помещают во вторую группу периодической системы Д.
в) +13Al 1s2 2s2 2p6 3s2 3p1
Валентные электроны алюминия 3s2 3p1 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома Al находится 3 электрона. Поэтому элемент помещают в третью группу периодической системы Д.И.Менделеева.
г) +14Si 1s2 2s2 2p6 3s2 3p2
Валентные электроны кремния 3s2 3p2 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома Si находится 4 электрона. Поэтому элемент помещают в четвертую группу периодической системы Д.И.Менделеева.
д) +15P 1s2 2s2 2p6 3s2 3p3
Валентные электроны фосфора 3s2 3p3 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома Р находится 5 электронов. Поэтому элемент помещают в пятую группу периодической системы Д.И.Менделеева.
Поэтому элемент помещают в пятую группу периодической системы Д.И.Менделеева.
е) +16S 1s2 2s2 2p6 3s2 3p4
Валентные электроны серы 3s2 3p4 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома S находится 6 электронов. Поэтому элемент помещают в шестую группу периодической системы Д.И.Менделеева.
ж) +17Cl 1s2 2s2 2p6 3s2 3p5
Валентные электроны хлора 3s2 3p5 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома Cl находится 7 электронов. Поэтому элемент помещают в седьмую группу периодической системы Д.И.Менделеева.
з) +18Ar 1s2 2s2 2p6 3s2 3p6.
Валентные электроны аргона 3s2 3p6 находятся на 3s- и 3p-подуровнях На валентных орбиталях атома Ar находится 8 электронов. Поэтому элемент помещают в восьмую группу периодической системы Д.И.Менделеева.
Поэтому элемент помещают в восьмую группу периодической системы Д.И.Менделеева.
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Открытие, сделанное Русским химиком Менделеевым, сыграло (безусловно) наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке (физика атома и ядра атома). В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, (он же атомный), есть и мера электрического заряда атомного ядра этого элемента. А номер периода (т.е. горизонтального ряда), определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, (этим самым, элементы одного ряда, обязаны сходством химических свойств).
Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
Таблица МенделееваОдна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы.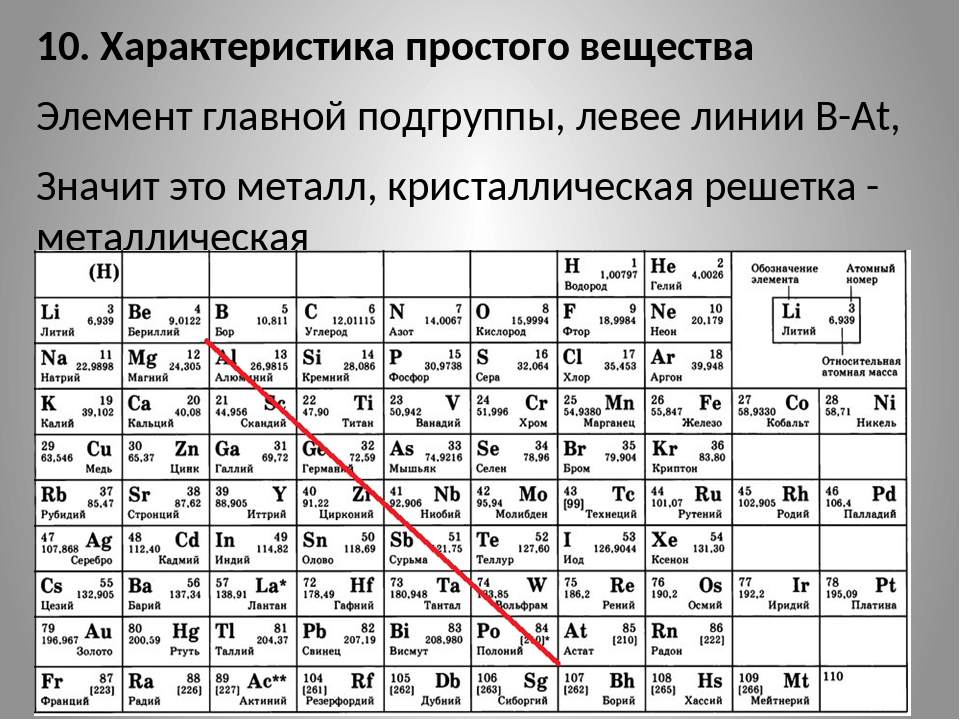 Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» – для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» – после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру – «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность, это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме – возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке – с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок – D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок – F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
Зная формулировка периодического закона и используя периодическую систему элементов Д. И. Менделеева, можно дать характеристику любому химическому элементу и его соединениям. Такую характеристику химического элемента удобно складывать по плану.
I. Символ химического элемента и его название.
II. Положение химического элемента в периодической системе элементов Д.И. Менделеева:
- порядковый номер;
- номер периода;
- номер группы;
- подгруппа (главная или побочная).
III. Строение атома химического элемента:
- заряд ядра атома;
- относительная атомная масса химического элемента;
- число протонов;
- число электронов;
- число нейтронов;
- число электронных уровней в атоме.
IV. Электронная и электронно-графическая формулы атома, его валентные электроны.
V. Тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
VI. Формулы высшего оксида и гидроксида химического элемента, характеристика их свойств (основные, кислотные или амфотерные).
VII. Сравнение металлических или неметаллических свойств химического элемента со свойствами элементов-соседей по периоду и подгруппой.
VIII. Максимальная и минимальная степень окисления атома.
Например, предоставим характеристику химического элемента с порядковым номером 15 и его соединениям по положению в периодической системе элементов Д. И. Менделеева и строению атома.
I. Находим в таблице Д. И. Менделеева клетку с номером химического элемента, записываем его символ и название.
Химический элемент номер 15 — Фосфор. Его символ Р.
II. Охарактеризуем положение элемента в таблице Д. И. Менделеева (номер периода, группы, тип подгруппы).
Фосфор находится в главной подгруппе V группы, в 3-м периоде.
III. Предоставим общую характеристику состава атома химического элемента (заряд ядра, атомная масса, число протонов, нейтронов, электронов и электронных уровней).
Заряд ядра атома фосфора равен +15. Относительная атомная масса фосфора равна 31. Ядро атома содержит 15 протонов и 16 нейтронов (31 — 15 = 16). Атом фосфора имеет три энергетических уровня, на которых находятся 15 электронов.
IV. Составляем электронной и электронно-графическую формулы атома, отмечаем его валентные электроны.
Электронная формула атома фосфора: 15 P 1s 2 2s 2 2p 6 3s 2 3p 3 .
Электронно-графическая формула внешнего уровня атома фосфора: на третьем энергетическом уровне на 3s-подуровня находятся два электрона (в одной клетке записываются две стрелки, имеющие противоположное направление), на три р-подуровне находятся три электрона (в каждой из трех клеток записываются по одной стрелке, имеющие одинаковое направление).
Валентными электронами являются электроны внешнего уровня, т.е. 3s2 3p3 электроны.
V. Определяем тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
Фосфор — неметалл. Поскольку в последнее подуровнем в атоме фосфора, который заполняется электронами, является p-подуровень, Фосфор относится к семейству p-элементов.
VI. Составляем формулы высшего оксида и гидроксида фосфора и характеризуем их свойства (основные, кислотные или амфотерные).
Высший оксид фосфора P 2 O 5 , проявляет свойства кислотного оксида. Гидроксид, соответствующий высшему оксиду, H 3 PO 4 , проявляет свойства кислоты. Подтвердим указанные свойства уравнениями видповиних химических реакций:
Подтвердим указанные свойства уравнениями видповиних химических реакций:
P 2 O 5 + 3 Na 2 O = 2Na 3 PO 4
H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O
VII. Сравним неметаллические свойства фосфора со свойствами элементов-соседей по периоду и подгруппой.
Соседом фосфора по подгруппе являются азот. Соседями фосфора за периодом является кремний и Сера. Неметаллические свойства атомов химических элементов главных подгрупп с ростом порядкового номера растут в периодах и снижаются в группах. Поэтому неметаллические свойства фосфора более выражены, чем у кремния и менее выражены, чем у азота и серы.
VIII. Определяем максимальную и минимальную степень окисления атома фосфора.
Максимальный положительный степень окисления для химических элементов главных подгрупп равен номеру группы. Фосфор находится в главной подгруппе пятой группы, поэтому максимальная степень окисления фосфора +5.
Минимальная степень окисления для неметаллов в большинстве случаев равен разнице между номером группы и числом восемь. Так, минимальная степень окисления фосфора -3.
Так, минимальная степень окисления фосфора -3.
Как пользоваться таблицей Менделеева?Для непосвященного человека читать таблицу Менделеева – все равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева, между прочим, если ей правильно пользоваться, может рассказать о мире очень многое. Помимо того, что сослужит Вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов. Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов. Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств. Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств. Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически. Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.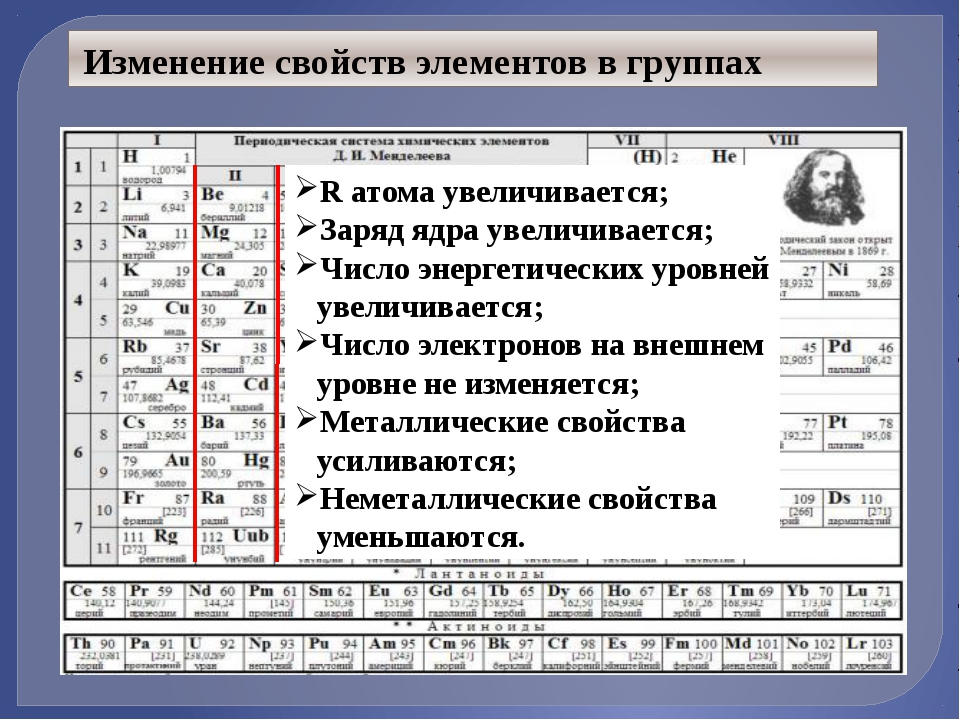
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
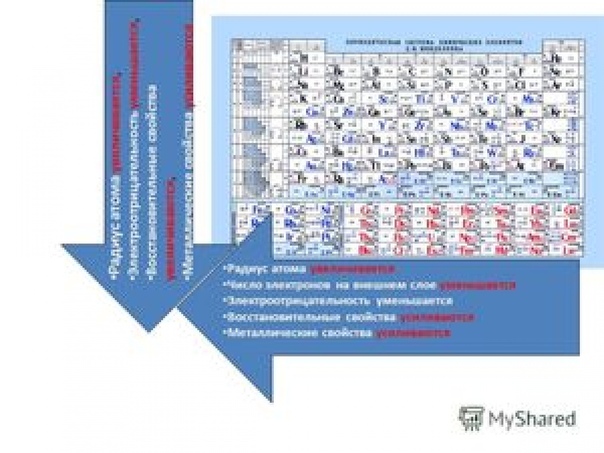
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваютс я.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.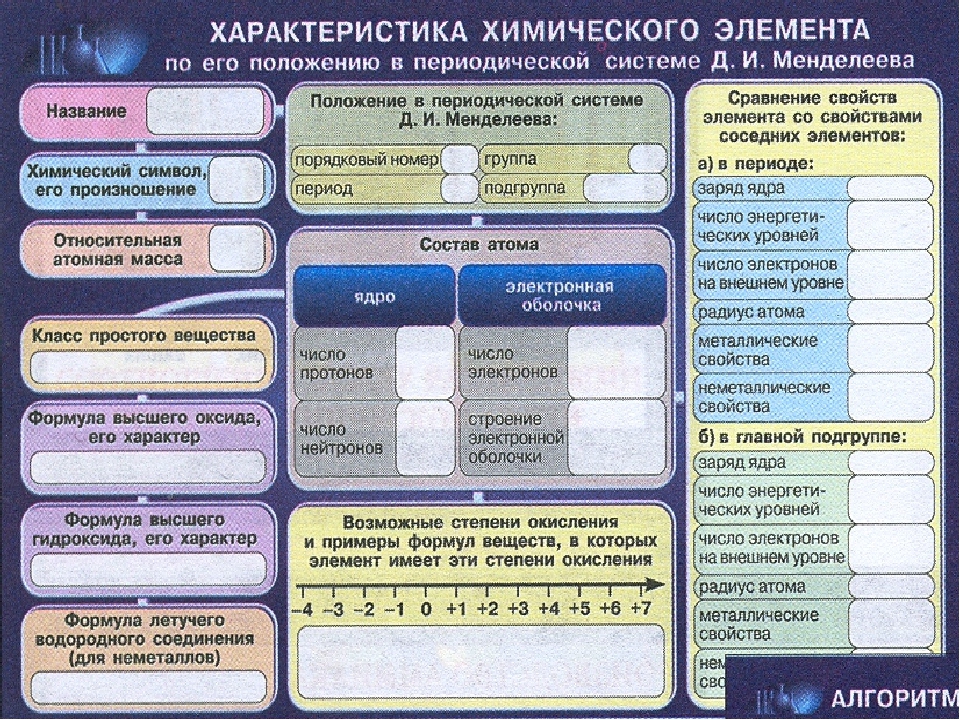
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс “Таблица Менделеева для чайников”. В завершение, предлагаем Вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал Вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника.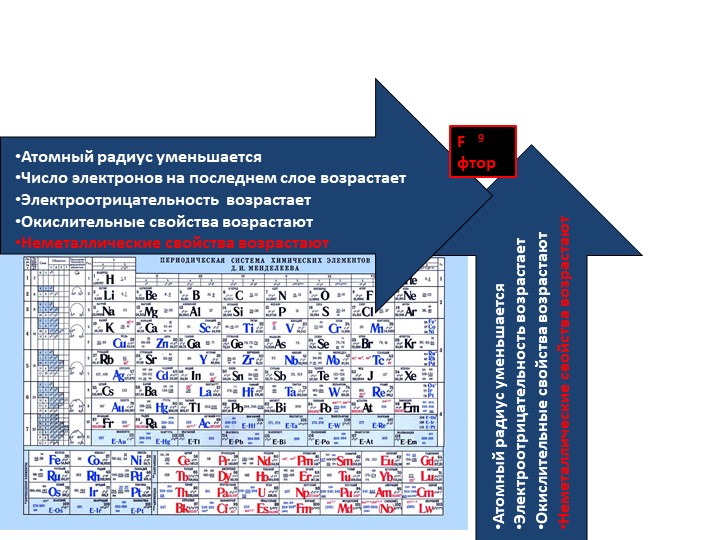 Именно поэтому, никогда не стоит забывать о , которые с радостью поделятся с Вами своими знаниями и опытом.
Именно поэтому, никогда не стоит забывать о , которые с радостью поделятся с Вами своими знаниями и опытом.
115 элемент таблицы Менделеева: краткая характеристика
115 элемент таблицы Менделеева – московий (moscovium) – сверхтяжелый синтетический элемент с символом Mc и атомным номером 115. Он был впервые получен в 2003 году совместной командой российских и американских ученых в Объединенном институте ядерных исследований (ОИЯИ) в Дубне, Россия. В декабре 2015 года признан одним из четырех новых элементов Объединенной рабочей группой международных научных организаций IUPAC/IUPAP. 28 ноября 2016 года он был официально назван в честь Московского региона, в котором находится ОИЯИ.
Характеристика
115 элемент таблицы Менделеева является чрезвычайно радиоактивным веществом: его наиболее стабильный известный изотоп, moscovium-290 имеет период полураспада всего 0,8 секунды. Ученые относят московий к непереходным металлам, по ряду характеристик схожим с висмутом. В периодической таблице относится к трансактинидным элементам p-блока 7-го периода и помещен в группу 15 как самый тяжелый пниктоген (элемент подгруппы азота), хотя и не подтверждено, что он ведет себя, как более тяжелый гомолог висмута.
В периодической таблице относится к трансактинидным элементам p-блока 7-го периода и помещен в группу 15 как самый тяжелый пниктоген (элемент подгруппы азота), хотя и не подтверждено, что он ведет себя, как более тяжелый гомолог висмута.
Согласно расчетам, элемент обладает некоторыми свойствами, схожими с более легкими гомологами: азотом, фосфором, мышьяком, сурьмой и висмутом. При этом демонстрирует несколько существенных отличий от них. На сегодня синтезировано около 100 атомов московия, которые имеют массовые числа от 287 до 290.
Физические свойства
Валентные электроны 115 элемента таблицы Менделеева московия делятся на три подоболочки: 7s (два электрона), 7p1/2 (два электрона) и 7p3/2 (один электрон). Первые два из них релятивистски стабилизируются и, следовательно, ведут себя, как инертные газы, а последние релятивистски дестабилизируются и могут легко участвовать в химических взаимодействиях. Таким образом, первичный потенциал ионизации московия должен составлять около 5,58 эВ. Согласно расчетам, moscovium должен быть плотным металлом из-за его высокого атомного веса с плотностью около 13,5 г/см3.
Согласно расчетам, moscovium должен быть плотным металлом из-за его высокого атомного веса с плотностью около 13,5 г/см3.
Предполагаемые расчетные характеристики:
- Фаза: твердая.
- Температура плавления: 400°С (670°К, 750°F).
- Точка кипения: 1100°С (1400°К, 2000°F).
- Удельная теплота плавления: 5,90-5,98 кДж/моль.
- Удельная теплота парообразования и конденсации: 138 кДж/моль.
Химические свойства
115-й элемент таблицы Менделеева стоит третьим в ряду химических элементов 7p и является самым тяжелым членом группы 15 в периодической таблице, располагаясь ниже висмута. Химическое взаимодействие московия в водном растворе обусловлено характеристиками ионов Mc+ и Mc3+. Первые, предположительно, легко гидролизуются и образуют ионную связь с галогенами, цианидами и аммиаком. Гидроксид московия (I) (McOH), карбонат (Mc2CO3), оксалат (Mc2C2O4) и фторид (McF) должны растворяться в воде. Сульфид (Мс2S) должен быть нерастворимым. Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) – слаборастворимые соединения.
Сульфид (Мс2S) должен быть нерастворимым. Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) – слаборастворимые соединения.
Фторид московия (III) (McF3) и тиозонид (McS3), предположительно, нерастворимы в воде (аналогично соответствующим соединениям висмута). В то время, как хлорид (III) (McCl3), бромид (McBr3) и иодид (McI3) должны быть легко растворимы и легко гидролизованы с образованием оксогалогенидов, таких как McOCl и McOBr (также аналогично висмуту). Оксиды московия (I) и (III) обладают схожими состояниями окисления, и их относительная стабильность в значительной степени зависит от того, с какими элементами они взаимодействуют.
Неопределенность
Вследствие того, что 115 элемент таблицы Менделеева синтезируется единичными атомами, определить экспериментально его точные характеристики проблематично. Ученым приходится ориентироваться на теоретические расчеты и сравнивать с более стабильными элементами, схожими по свойствам.
В 2011 году были проведены эксперименты по созданию изотопов нихония, флеровия и московия в реакциях между «ускорителями» (кальцием-48) и «мишенями» (америцием-243 и плутонием-244) для исследования их свойств. Однако «мишени» включали примеси свинца и висмута и, следовательно, были получены в реакциях переноса нуклонов некоторые изотопы висмута и полония, что осложнило проведение эксперимента. Между тем, полученные данные помогут в будущем ученым более детально исследовать тяжелые гомологи висмута и полония, такие как moscovium и livermorium.
Открытие
Первым успешным синтезом 115 элемента таблицы Менделеева была совместная работа российских и американских ученых в августе 2003 года в ОИЯИ в Дубне. В команду во главе с физиком-ядерщиком Юрием Оганесяном, помимо отечественных специалистов, вошли коллеги из Ливерморской национальной лаборатории Лоуренса. Исследователи 2 февраля 2004 года опубликовали в издании Physical Review информацию, что они бомбардировали америций-243 ионами кальция-48 на циклотроне У-400 и получили четыре атома нового вещества (одно ядро 287Mc и три ядра 288Mc).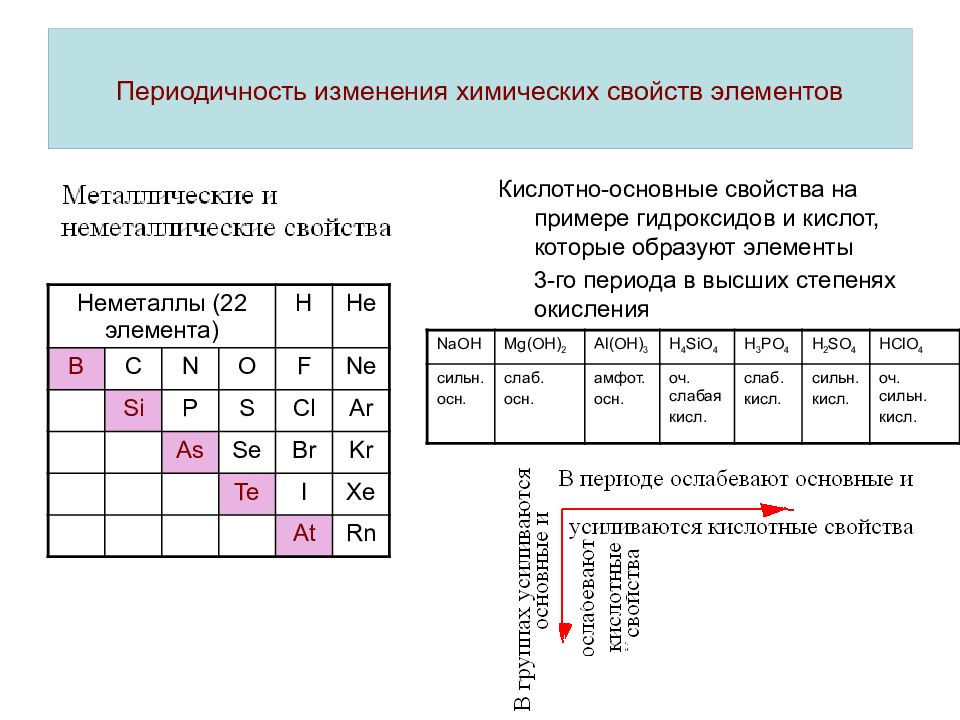 Эти атомы затухают (распадаются) за счет эмиссии альфа-частиц до элемента нихония примерно за 100 миллисекунд. Два более тяжелых изотопа московия, 289Mc и 290Mc, были обнаружены в 2009-2010 годах.
Эти атомы затухают (распадаются) за счет эмиссии альфа-частиц до элемента нихония примерно за 100 миллисекунд. Два более тяжелых изотопа московия, 289Mc и 290Mc, были обнаружены в 2009-2010 годах.
Первоначально IUPAC не могла утвердить открытие нового элемента. Требовалось подтверждение из других источников. В течение следующих нескольких лет была проведена еще одна оценка более поздних экспериментов, и еще раз выдвинуто заявление дубненской команды об открытии 115-го элемента.
В августе 2013 года группа исследователей из Университета Лунда и Института тяжелых ионов в Дармштадте (Германия) объявили, что они повторили эксперимент 2004 года, подтвердив результаты, полученные в Дубне. Еще одно подтверждение было опубликовано командой ученых, работавших в Беркли в 2015 году. В декабре 2015 года совместная рабочая группа IUPAC/IUPAP признала обнаружение этого элемента и отдала приоритет в открытии российско-американской команде исследователей.
Название
115 элемент таблицы Менделеева в 1979 году согласно рекомендации IUPAC было решено назвать «унунпентий» и обозначать соответствующим символом UUP. Несмотря на то, что данное название с тех пор широко использовалось в отношении неоткрытого (но теоретически предсказанного) элемента, в сообществе физиков оно не прижилось. Чаще всего вещество так и называли – элемент №115 или E115.
Несмотря на то, что данное название с тех пор широко использовалось в отношении неоткрытого (но теоретически предсказанного) элемента, в сообществе физиков оно не прижилось. Чаще всего вещество так и называли – элемент №115 или E115.
30 декабря 2015 года обнаружение нового элемента было признано Международным союзом чистой и прикладной химии. Согласно новым правилам, первооткрыватели имеют право предложить собственное название нового вещества. Сначала предполагалось назвать 115 элемент таблицы Менделеева «лангевиний» в честь физика Поля Ланжевена. Позднее команда ученых из Дубны, как вариант, предложила наименование «московий» в честь Московской области, где и было совершено открытие. В июне 2016 года IUPAC одобрил инициативу и 28 ноября 2016 официально утвердил название «moscovium».
Характеристика атома элемента по его положению в ПСХЭ Д.И. Менделеева
Муниципальное бюджетное общеобразовательное учреждение
«Гвардейская школа № 1» Симферопольского района Республики Крым
ул. Карла Маркса, дом 97, сп Гвардейское, Симферопольский район,
Карла Маркса, дом 97, сп Гвардейское, Симферопольский район,
Республика Крым, Российская Федерация, 297513
тел. (3652) 32-30-45, e-mail: [email protected] ОГРН 1159102031329, ИНН 9109010395
«Характеристика атома элемента по его положению в периодической системе химических элементов
Д.И. Менделеева»
учитель физики и химии
высшей категории
Стулень Виктор Иванович
сп Гвардейское. 2017 год
Характеристика атома элемента по его положению
в периодической системе химических элементов Д.И. Менделеева.
В совсем уже близком по времени 2019 году исполнится 150 лет со дня открытия Периодического закона химических элементов… Полтора века назад – первого марта 1869 года русский учёный Дмитрий Иванович Менделеев впервые обнародовал периодический закон и его следствие – таблицу химических элементов. В 1870 году он назвал систему атомов элементов «естественной», а спустя год – «периодической системой». С тех пор невозможно представить себе химическую науку и практику без периодического закона и периодической системы химических элементов Д.И. Менделеева.
В 1870 году он назвал систему атомов элементов «естественной», а спустя год – «периодической системой». С тех пор невозможно представить себе химическую науку и практику без периодического закона и периодической системы химических элементов Д.И. Менделеева.
Отличительной особенностью периодического закона химических элементов среди других фундаментальных законов природы является то, что он не имеет выражения в виде математического уравнения (формулы). Уникальным графическим воплощением закона является разработанная Менделеевым Периодическая система химических элементов.
В настоящее время наиболее широко используемыми для практического применения видами периодической системы химических элементов являются:
а) Короткая форма таблицы. Она до сих пор приводится в подавляющем большинстве российских справочников и учебных пособий, хотя официально не рекомендована к использованию ИЮПАК ещё в 1989 году. Таблица состоит из восьми групп (I – VIII (+ 0) группы) «типических» элементов, главной и побочной подгрупп, периодов и рядов элементов. В современной зарубежной научной литературе короткая форма исключена полностью, вместо неё используется длинная форма.
В современной зарубежной научной литературе короткая форма исключена полностью, вместо неё используется длинная форма.
б) Длинная (реже называемая длиннопериодной или полудлинной) форма таблицы. Она была рекомендована к применению ИЮПАК в 1989 году, состоит из 18 групп, обозначенных арабскими (вместо римских) цифрами, и не содержит «типических» элементов, подгрупп, рядов и семейств. Её упрощённые варианты впервые появились сравнительно давно, но чаще всего с одним характерным отличием от современного варианта – групп, обозначенных римскими цифрами, было восемь (с их растяжкой до восемнадцати за счёт буквенных приставок a и b и искусственным созданием триад элементов).
в) Сверхдлинная (реже именуемая длинной) форма таблицы состоит из 32 групп элементов. Официально она вряд ли будет принята к массовому использованию в обозримом будущем, так как каждая из 14 (сверх 18) дополнительных групп содержит лишь по 2 элемента (один лантаноид и один актиноид), близкие по свойствам ко всем остальным тринадцати элементам периода.
Хорошо подготовленный химик, лишь взглянув на место, занимаемое атомом какого-либо химического элемента в периодической системе, может рассказать о нём очень многое: какие валентности или степени окисления может проявлять атом элемента, вступая в химические реакции и образуя соединения; формулы и характер образуемых этим атомом оксидов и летучих водородных соединений или гидроксидов; металлический или неметаллический характер проявляет он в своих соединениях.
Для меня, как практикующего учителя химии, удивительным является тот факт, что до настоящего времени не разработан общепринятый план характеристики атома химического элемента по его положению в периодической системе. Впервые передо мною подобная проблема возникла 32 года назад, когда после службы в Советской Армии я начал преподавать химию в средней школе.
Пытаясь наиболее доступно объяснять учащимся строение атома и строение периодической системы химических элементов Д. И. Менделеева, решил в основе характеристики атома химического элемента использовать физический смысл порядкового номера, номера периода и номера группы. Это дало возможность очень сложный для понимания учебный материал использовать и запоминать учащимися более осознанно.
И. Менделеева, решил в основе характеристики атома химического элемента использовать физический смысл порядкового номера, номера периода и номера группы. Это дало возможность очень сложный для понимания учебный материал использовать и запоминать учащимися более осознанно.
Предлагаю для практического применения учителями химии свой вариант плана характеристики атома элемента по положению в периодической системе химических элементов Д.И. Менделеева, который я использую уже более тридцати лет.
П Л А Н
характеристики атома элемента
по положению в Периодической системе химических элементов Д.И. Менделеева
(короткая форма таблицы).
1. Общие сведения об элементе – название элемента, знак его, произношение знака, нуклонное число А (относительная атомная масса элемента – Аr(Э)).
2. Порядковый номер атома, заряд ядра атома (зарядное число Z), количество электронов, протонов*, нейтронов (нейтронное число N = A – Z).
3. Период, ряд, количество энергетических уровней (электронных слоев).
4. Группа, подгруппа (главная «А» или побочная «Б»), количество электронов на внешнем энергетическом уровне.
5. Общее строение атома, электронная конфигурация атома в квантовых ячейках в стационарном (и возбуждённом) состоянии, возможные валентности и степени окисления, семейство элементов.
6. Металлические или неметаллические свойства простого вещества.
7. Высший оксид, летучее водородное соединение или гидроксид и их характер.
8. Сравнение металлических или неметаллических свойств со свойствами других элементов, которые стоят рядом в периоде и группе.
* числовые значения подчёркнутых величин одинаковы (совпадают).
Учебный материал, который необходимо знать, приступая к характеристике атома элемента по его положению в ПСХЭ Д. И. Менделеева (короткая форма).
И. Менделеева (короткая форма).
1. Нуклонное число А (относительная атомная масса элемента) определяется по периодической системе. Записанное в ней дробное значение относительной атомной массы округляется до ближайшего целого числа по правилам математического округления. Относительная атомная масса хлора при характеристике его принимается равной 35 атомных единиц массы.
2. Физический смысл порядкового номера атома в ПСХЭ – порядковый номер совпадает с положительным зарядом ядра атома (зарядное число Z). В свою очередь, положительный заряд ядра равен количеству протонов в нём, каждый протон несёт заряд +1. Следуя принципу электронейтральности атомов, приходим к выводу о том, что положительный заряд ядра атома нейтрализуется таким же по величине, но противоположным (отрицательным) по знаку зарядом электронов (таким же их количеством). Следовательно, количество протонов в ядре атома равно количеству электронов, обращающихся вокруг ядра.
Значительную часть массы атома (около 99,97 %) представляет его ядро. А массу ядра определяют массы протонов и нейтронов. Поэтому количество нейтронов в ядре каждого атома (нейтронное число N) будет равно разности между нуклонным и зарядным числами N = A – Z.
3. Физический смысл номера периода ПС – количество энергетических уровней (электронных слоёв), на которых «заселяются» электроны в атоме.
4. Физический смысл номера группы ПС (для элементов главных подгрупп) – количество электронов на внешнем энергетическом уровне (электронном слое).
У s– и p-элементов электронами заполняется внешний энергетический уровень (электронный слой), поэтому количество электронов на нём равно номеру группы.
У d-элементов электронами заполняется предвнешний энергетический уровень, на внешнем энергетическом уровне атомов большинства d-элементов находится два s-электрона. Исключениями из этого правила являются атомы следующих элементов: №24 – хром, №29 – медь, №41 – ниобий, №42 – молибден, №44 – рутений, №45 – родий, №47 – серебро, №78 – платина, №79 – золото, которые содержат по одному электрону на внешнем энергетическом уровне и №46 – палладий, у которого нет электронов на внешнем энергетическом уровне.
Исключениями из этого правила являются атомы следующих элементов: №24 – хром, №29 – медь, №41 – ниобий, №42 – молибден, №44 – рутений, №45 – родий, №47 – серебро, №78 – платина, №79 – золото, которые содержат по одному электрону на внешнем энергетическом уровне и №46 – палладий, у которого нет электронов на внешнем энергетическом уровне.
5. Общее строение атома включает в себя заряд ядра атома и распределение по энергетическим уровням всех его электронов. Заряд ядра атома (зарядное число Z) и количество энергетических уровней нами были определены раньше.
Максимально возможное количество электронов, заселяющих уровень, можно определить по формуле Nэлектронов = 2n2, в которой n – номер энергетического уровня. Согласно формуле, максимально возможное количество электронов на I уровне – 2, на II – 8, на III – 18, на IV – 32 электрона.
Для записи электронной конфигурации характеризуемого атома в квантовых ячейках в стационарном (и возбуждённом) состоянии следует воспользоваться рядом подуровней, расположенных в порядке возрастания запаса энергии (энергоёмкости): 1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <4f <5d <6p <7s.
Если распределение электронов по подуровням изучалось согласно графической формуле, учитывающей значение запаса энергии электрона каждого подуровня, то запись конфигурации значительно упрощается. Пример такого бланка для записи электронной конфигурации атома приведён ниже:
Заполнение электронами квантовых ячеек производится снизу-вверх. На одной орбитали может находиться не более двух электронов (0 – вакантная – свободная – орбиталь, 1 – орбиталь заполнена неспаренным электроном, 2 – орбиталь заполнена электронной парой). Орбитали одного подуровня (p– или d-) заполняются сначала только одним электроном, и лишь после этого – вторым, если электронов для заполнения достаточно.Возможные валентности атома в его соединениях определяются по количеству неспаренных электронов на внешнем энергетическом уровне (для d – элементов – по количеству неспаренных электронов на предпоследнем d – подуровне и внешнем s – подуровне) в стационарном и возбуждённом состояниях. Количество этих электронов чётко видно по электронным конфигурациям атома в квантовых ячейках.
Количество этих электронов чётко видно по электронным конфигурациям атома в квантовых ячейках.
Максимальная положительная степень окисления атомов равна количеству электронов на внешнем энергетическом уровне (номеру группы), при этом минимальная степень окисления равна количеству электронов, которое атом может принять от других атомов в химических соединениях.
Принадлежность к семейству элементов определяется тем, какой энергетический подуровень заполняется электронами в атоме до полного завершения (s-, p-, d-, f-).
6. Простые вещества, образуемые атомами химических элементов, проявляют либо металлические, либо неметаллические свойства. Такое деление атомов условно, однако оно помогает прогнозировать свойства большинства образуемых атомом соединений. Возможно три способа разделить металлы и неметаллы в периодической системе:
6.1. Металлы и неметаллы разделяются линией, которая проходит по элементам №5 – №85. Левее и ниже этой линии в главных подгруппах расположены металлы, вдоль этой линии и выше – неметаллы. Все элементы побочных подгрупп – металлы.
Левее и ниже этой линии в главных подгруппах расположены металлы, вдоль этой линии и выше – неметаллы. Все элементы побочных подгрупп – металлы.
6.2. Количество элементов-неметаллов в каждой группе (главной подгруппе) на 2 меньше, чем её номер.
6.3. Количество неметаллов в каждой группе (главной подгруппе) определяется методом обратного счёта – VIII (6), VII (5), VI (4), V (3), IV (2), III (1), II (0), I (1).
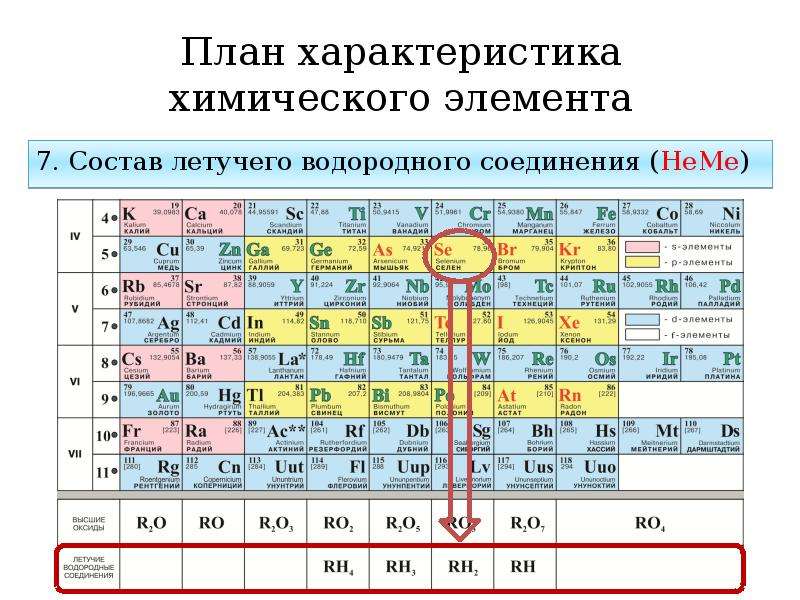
7. Формулы высшего оксида элемента, а также летучего водородного соединения неметалла записаны в общем виде в нижней части периодической системы. Формулу гидроксида металла можно составить, исходя из валентности его атома.
Высшие оксиды могут проявлять основный, амфотерный и кислотный характер. Все высшие оксиды металлов главных подгрупп I и II групп (кроме BeO), а также высшие оксиды элементов побочных подгрупп III группы (кроме скандия) – иттрия, лантана и актиния – проявляют основные свойства.
Высшие оксиды металлов главных подгрупп III группы (кроме оксида таллия), а также неметалла III группы – бора, и оксиды металлов главных подгрупп IV группы валентности II проявляют амфотерные свойства. Оксиды металлов побочных подгрупп валентности III (кроме оксидов иттрия, лантана и актиния) проявляют амфотерные свойства.
Высшие оксиды металлов главных подгрупп IV группы проявляют различные свойства: оксид олова (IV) – амфотерные свойства, оксиды германия (IV) и свинца (IV) – кислотные свойства.
Все высшие оксиды металлов валентностей V, VI и VII, а также все высшие оксиды неметаллов (кроме оксида бора B2O3) проявляют кислотные свойства.
Летучие водородные соединения неметаллов проявляют следующие свойства:
боран – BH3 и диборан – B2H6 – сильные кислоты;
метан – CH4 – несолеобразующее соединение;
силан – SiH4 – слабая кислота;
аммиак – NH3 – слабая щелочь;
фосфин – PH3 – очень слабое основание;
арсин – AsH3 – следы основных свойств при пониженной температуре;
вода (оксид водорода, гидроксид водорода) – H2O – амфотерное соединение;
сероводород (сульфид водорода, дигидросульфид) – H2S – очень слабая кислота;
селеноводород (селан) – H2Se – слабая кислота;
теллуроводород (теллуран) – H2Te – кислота средней силы;
фтороводород (фтористый водород, гидрофторид) – HF – кислота средней силы;
хлороводород (хлористый водород, гидрохлорид) – HCl – сильная кислота;
бромоводород (бромистый водород) – HBr – очень сильная кислота;
йодоводород (йодистый водород) – HI – самая сильная кислота.
Гидроксиды металлов валентности I проявляют сильные щелочные свойства; гидроксиды металлов валентности II проявляют средние и слабые основные свойства. Гидроксиды металлов валентности III по большей части не растворяются в воде, проявляют преимущественно амфотерные свойства.
8. Металлические свойства сильнее всего проявляются у атомов элементов, имеющих на внешнем энергетическом уровне один электрон; самые сильные металлы стоят в начале каждого периода, в I-ой группе ПСХЭ.
Также металлические свойства усиливаются с увеличением радиуса атома, а это происходит в группах с увеличением порядкового номера элемента – сверху-вниз по ПСХЭ, самые сильные металлы стоят в 7-ом периоде. Наиболее сильный металл в периодической системе находится в I-ой группе 7-ом периоде – франций, Fr.
Самый сильный неметалл находится в VII-ой группе 2-ом периоде – фтор, F.
Рассмотрим, например, характеристику одного металла и одного неметалла по предложенному плану.
Характеристика калия по положению в ПСХЭ.
1. Калий, К, калий, Ar(K) = 39.
2. Порядковый номер 19, заряд ядра +19, количество ё = 19, р+ = 19, n0 = 39 – 19 = 20.
3. Период 4, ряд 4, количество энергетических уровней (электронных слоёв) 4.
4. Группа I, подгруппа А – главная, 1 ё на внешнем слое.
5. Общее строение атома K +19)2)8)8)1; электронная конфигурация атома в квантовых ячейках в стационарном (невозбуждённом) состоянии:
1s22s22p63s23p64s1Возбуждённого состояния у атома калия нет.
Возможная валентность I, возможная степень окисления +1.
Семейство s – элементов.
6. Простое вещество – металл.
7. Высший оксид K2O – оксид калия, основный; летучего водородного соединения не образует; гидроксид KOH – гидроксид калия, сильное основание.
8. Металлические свойства проявляются сильнее, чем у натрия, но слабее, чем у рубидия. Металлические свойства проявляются значительно сильнее, чем у аргона, и немного сильнее, чем у кальция.
При проведении характеристики атома по положению в периодической системе химических элементов допустима сокращённая запись терминов.
Характеристика фосфора по положению в ПСХЭ.
1. Фосфор, P, пэ, Ar (P) = 31.
2. Порядковый номер 15, заряд ядра +15, количество ё = 15, р+ = 15, n0 = 31 – 15 = 16.
3. Период 3, ряд 3, количество энергетических уровней (электронных слоёв) 3.
4. Группа V, подгруппа А – главная, 5 ё на внешнем слое.
5. Общее строение атома P +15)2)8)5; электронная конфигурация атома в квантовых ячейках в стационарном (невозбуждённом) состоянии:
1s22s22p63s23p3Электронная конфигурация атома в квантовых ячейках в возбуждённом состоянии:
1s22s22p63s13p33d1Возможные валентности III и V, возможные степени окисления -3, +3, +5.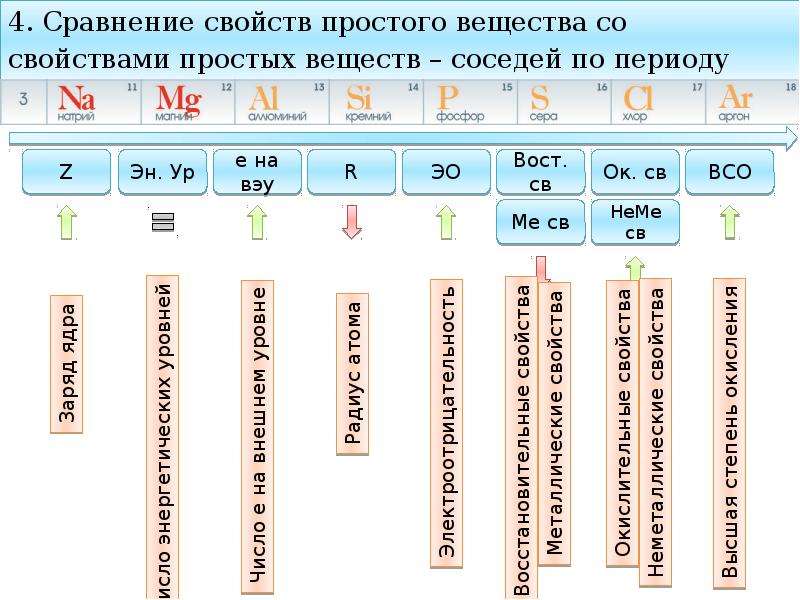
Семейство p – элементов.
6. Простое вещество – неметалл.
7. Высший оксид P2O5 – оксид фосфора (V), кислотный; летучее водородное соединение PH3 – фосфин, очень слабое основание.
8. Неметаллические свойства проявляются сильнее, чем у мышьяка, но слабее, чем у азота. Также неметаллические свойства проявляются сильнее, чем у кремния, но слабее, чем у серы.
Вследствие того факта, что короткая форма периодической системы химических элементов официально не рекомендована к использованию ИЮПАК ещё в 1989 году, в ближайшее время в Российской Федерации вполне возможен переход на длинный (полудлинный) вариант ПСХЭ. Предлагаемый в этой статье план характеристики атома элемента по его положению в ПСХЭ может быть легко модифицирован под новую форму периодической системы.
П Л А Н
характеристики атома элемента
по положению в Периодической системе химических элементов Д.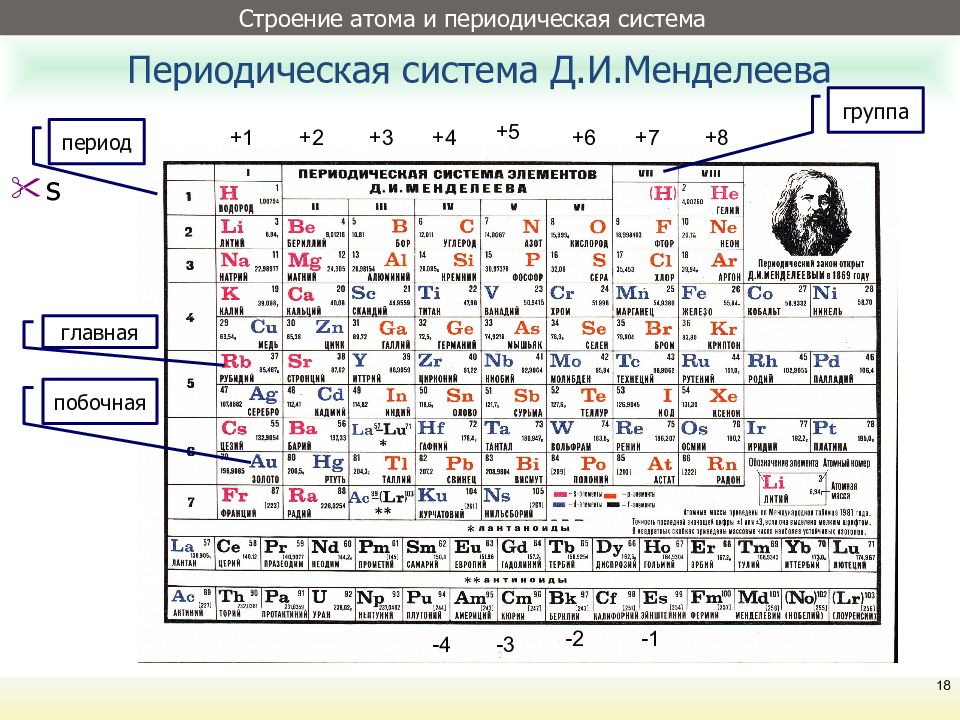 И. Менделеева
И. Менделеева
(полудлинный вариант таблицы).
1. Общие сведения об элементе – название элемента, знак его, произношение знака, нуклонное число А (относительная атомная масса элемента – Аr(Э)).
2. Порядковый номер атома, заряд ядра атома (зарядное число Z), количество электронов, протонов*, нейтронов (нейтронное число N = A – Z).
3. Период, количество энергетических уровней (электронных слоев).
4. Группа, количество электронов на внешнем энергетическом уровне.
5. Общее строение атома, электронная конфигурация атома в квантовых ячейках в стационарном (и возбуждённом) состоянии, возможные валентности и степени окисления, семейство элементов.
6. Металлические или неметаллические свойства простого вещества.
7. Высший оксид, летучее водородное соединение или гидроксид и их характер.
Высший оксид, летучее водородное соединение или гидроксид и их характер.
8. Сравнение металлических или неметаллических свойств со свойствами других элементов, которые стоят рядом в периоде и группе.
* числовые значения подчёркнутых величин одинаковы (совпадают).
Учебный материал, который необходимо знать, приступая к характеристике атома элемента по его положению в ПСХЭ Д.И. Менделеева (полудлинный вариант).
1. Нуклонное число А (относительная атомная масса элемента) определяется по периодической системе. Записанное в ней дробное значение относительной атомной массы округляется до ближайшего целого числа по правилам математического округления. Относительная атомная масса хлора при характеристике его принимается равной 35 атомных единиц массы.
2. Физический смысл порядкового номера атома в ПСХЭ – порядковый номер совпадает с положительным зарядом ядра атома (зарядное число Z). В свою очередь, положительный заряд ядра равен количеству протонов в нём, каждый протон несёт заряд +1. Следуя принципу электронейтральности атомов, приходим к выводу о том, что положительный заряд ядра атома нейтрализуется таким же по величине, но противоположным (отрицательным) по знаку зарядом электронов (таким же их количеством). Следовательно, количество протонов в ядре атома равно количеству электронов, обращающихся вокруг ядра.
В свою очередь, положительный заряд ядра равен количеству протонов в нём, каждый протон несёт заряд +1. Следуя принципу электронейтральности атомов, приходим к выводу о том, что положительный заряд ядра атома нейтрализуется таким же по величине, но противоположным (отрицательным) по знаку зарядом электронов (таким же их количеством). Следовательно, количество протонов в ядре атома равно количеству электронов, обращающихся вокруг ядра.
Значительную часть массы атома (чуть более 99,97 %) представляет его ядро. А массу ядра определяют массы протонов и нейтронов. Поэтому количество нейтронов в ядре каждого атома (нейтронное число N) будет равно разности между нуклонным и зарядным числами N = A – Z.
3. Физический смысл номера периода ПС – количество энергетических уровней (электронных слоёв), на которых «заселяются» электроны в атоме.
4. Физический смысл номера группы ПС – у элементов 01, 02, 13, 14, 15, 16, 17 и 18 групп последняя цифра номера показывает количество электронов на внешнем энергетическом уровне (электронном слое) атома.
У s– и p-элементов (элементы 01, 02, 13, 14, 15, 16, 17 и 18 групп) электронами заполняется внешний энергетический уровень (электронный слой) атома, поэтому количество электронов на этом уровне равно последней цифре номера группы.
У d-элементов (элементы 03, 04, 05, 06, 07, 08, 09, 10, 11 и 12 групп) электронами заполняется предвнешний энергетический уровень, на внешнем энергетическом уровне атомов большинства d-элементов находится два s-электрона. Исключениями из этого правила являются атомы следующих элементов: №24 – хром, №29 – медь, №41 – ниобий, №42 – молибден, №44 – рутений, №45 – родий, №47 – серебро, №78 – платина, №79 – золото, которые содержат по одному электрону на внешнем энергетическом уровне и №46 – палладий, у которого нет электронов на внешнем энергетическом уровне.
5. Общее строение атома включает в себя заряд ядра атома и распределение по энергетическим уровням всех его электронов. Заряд ядра атома (зарядное число Z) и количество энергетических уровней нами были определены раньше.
Заряд ядра атома (зарядное число Z) и количество энергетических уровней нами были определены раньше.
Максимально возможное количество электронов, заселяющих уровень, можно определить по формуле Nэлектронов = 2n2, в которой n – номер энергетического уровня. Согласно формуле, максимально возможное количество электронов на I уровне – 2, на II – 8, на III – 18, на IV – 32 электрона.
Для записи электронной конфигурации характеризуемого атома в квантовых ячейках в стационарном (и возбуждённом) состоянии следует воспользоваться рядом подуровней, расположенных в порядке возрастания запаса энергии (энергоёмкости): 1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <4f <5d <6p <7s.
Если распределение электронов по подуровням изучалось согласно графической формуле, учитывающей значение запаса энергии электрона каждого подуровня, то запись конфигурации значительно упрощается. Пример такого бланка для записи электронной конфигурации атома приведён ниже:
Заполнение электронами квантовых ячеек производится снизу-вверх. На одной орбитали может находиться не более двух электронов (0 – вакантная – свободная – орбиталь, 1 – орбиталь заполнена неспаренным электроном, 2 – орбиталь заполнена электронной парой). Орбитали одного подуровня (p– или d–) заполняются сначала только одним электроном, и лишь после этого вторым, если электронов для заполнения достаточно.
Возможные валентности атома в его соединениях определяются по количеству неспаренных электронов на внешнем энергетическом уровне (для d – элементов – по количеству неспаренных электронов на предпоследнем d – подуровне и внешнем s – подуровне) в стационарном и возбуждённом состояниях. Количество этих электронов чётко видно по электронным конфигурациям атома в квантовых ячейках.
Количество этих электронов чётко видно по электронным конфигурациям атома в квантовых ячейках.
Максимальная положительная степень окисления атомов равна количеству электронов на внешнем энергетическом уровне, при этом минимальная степень окисления равна количеству электронов, которое атом может принять от других атомов в химических соединениях.
Принадлежность к семейству элементов определяется тем, какой энергетический подуровень заполняется электронами в атоме до полного завершения (s-, p-, d-, f-).
6. Простые вещества, образуемые атомами химических элементов, проявляют либо металлические, либо неметаллические свойства. Такое деление атомов условно, однако оно помогает прогнозировать свойства большинства образуемых атомом соединений.
Возможно разделить металлы и неметаллы в периодической системе линией, которая проходит по элементам №5 – №118. Левее и ниже этой линии в таблице расположены металлы, вдоль этой линии и выше – неметаллы.
7. Формулы высшего оксида элемента, а также летучего водородного соединения неметалла записаны в общем виде в нижней части периодической системы. Формулу гидроксида металла можно составить, исходя из валентности его атома.
Высшие оксиды могут проявлять основный, амфотерный и кислотный характер. Все высшие оксиды металлов 01 и 02 групп (кроме BeO), оксид металла 13 группы – таллия, а также высшие оксиды элементов 03 группы (кроме скандия) – иттрия, лантана и актиния – проявляют основные свойства.
Высшие оксиды металлов 13 группы (кроме оксида таллия), а также неметалла 13 группы – бора, и оксиды металлов 14 группы валентности II проявляют амфотерные свойства. Оксиды металлов 03 – 12 групп валентности III (кроме оксидов иттрия, лантана и актиния) также проявляют амфотерные свойства.
Высшие оксиды металлов 14 группы проявляют различные свойства: оксид олова (IV) – амфотерные свойства, оксиды германия (IV) и свинца (IV) – кислотные свойства.
Все высшие оксиды металлов валентностей V, VI и VII, а также все высшие оксиды неметаллов (кроме оксида бора B2O3) проявляют кислотные свойства.
Летучие водородные соединения неметаллов проявляют следующие свойства:
боран – BH3 и диборан – B2H6 – сильные кислоты;
метан – CH4 – несолеобразующее соединение;
силан – SiH4 – слабая кислота;
аммиак – NH3 – слабая щелочь;
фосфин – PH3 – очень слабое основание;
арсин – AsH3 – следы основных свойств при пониженной температуре;
вода (оксид водорода, гидроксид водорода) – H2O – амфотерное соединение;
сероводород (сульфид водорода, дигидросульфид) – H2S – очень слабая кислота;
селеноводород (селан) – H2Se – слабая кислота;
теллуроводород (теллуран) – H2Te – кислота средней силы;
фтороводород (фтористый водород, гидрофторид) – HF – кислота средней силы;
хлороводород (хлористый водород, гидрохлорид) – HCl – сильная кислота;
бромоводород (бромистый водород) – HBr – очень сильная кислота;
йодоводород (йодистый водород) – HI – самая сильная кислота.
Гидроксиды металлов валентности I проявляют сильные щелочные свойства; гидроксиды металлов валентности II проявляют средние и слабые основные свойства. Гидроксиды металлов валентности III по большей части не растворяются в воде, проявляют преимущественно амфотерные свойства.
8. Металлические свойства сильнее всего проявляются у атомов элементов, имеющих на внешнем энергетическом уровне один электрон; самые сильные металлы стоят в начале каждого периода, в 1-ой группе ПСХЭ.
Также металлические свойства усиливаются с увеличением радиуса атома, а это происходит в группах с увеличением порядкового номера элемента – сверху-вниз по ПСХЭ, самые сильные металлы стоят в 7-ом периоде. Наиболее сильный металл в периодической системе находится в 1-ой группе 7-ом периоде – франций, Fr.
Самый сильный неметалл находится в 17-ой группе 2-ом периоде – фтор, F.
Содержание характеристики атома элемента по его положению в периодической системе химических элементов Д.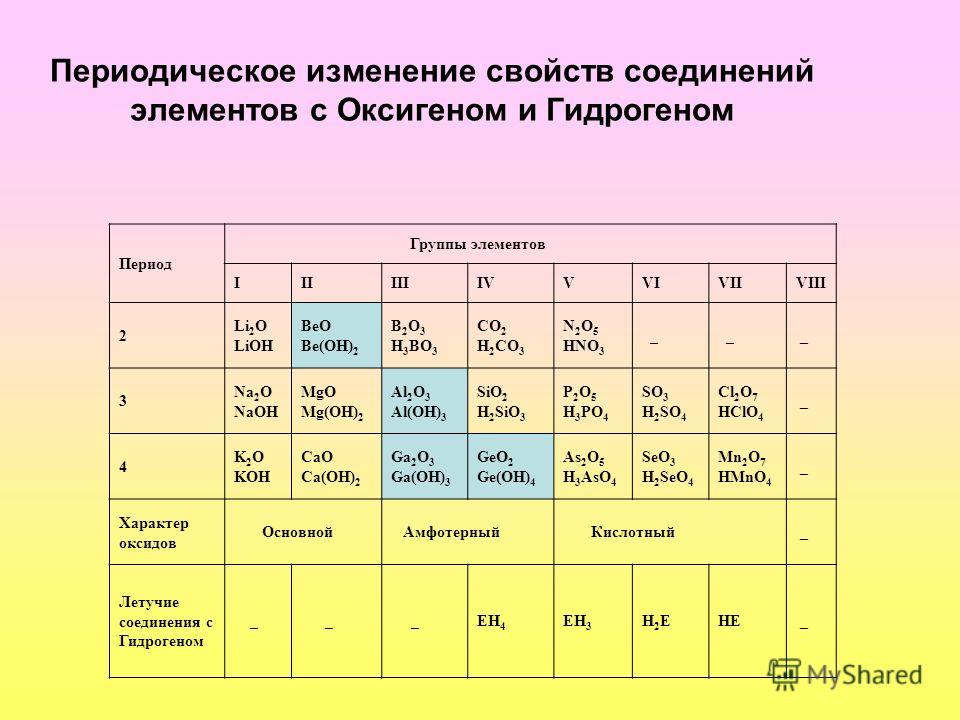 И. Менделеева для полудлинного варианта таблицы будет, практически, таким же, что и для короткой формы таблицы.
И. Менделеева для полудлинного варианта таблицы будет, практически, таким же, что и для короткой формы таблицы.
Следующий Менделеевский съезд Российского химического общества (РХО) имени Д.И. Менделеева будет посвящён 150-летию открытия периодического закона и 150-летию образования РХО, и пройдёт он в Санкт-Петербурге в 2019 году. В связи с этим участники прошедшего в 2016 году съезда обратились к президенту РАН и в Министерство иностранных дел России, международные организации с просьбой объявить 2019 год Международным годом Периодической системы (таблицы) химических элементов.
Если возникнет желание обсудить разработку, высказать замечания или предложения, пишите на адрес: [email protected]
Урок “Характеристика химического элемента” 8 класс | Уроки по Химии
Урок “Характеристика химического элемента” 8 класс
06.12.2017 2095 434 Cулейменова Жания АрстановнаТема урока: Характеристика химического элемента Школа: Рыспайская основная школа
Дата: ФИО учителя: Сулейменова Жания Арстановна
КЛАСС: 8 «Б» Количество присутствующих: Количество отсутствующих:
Цели обучения, которые необходимо достичь на данном уроке • Изучить план характеристики химического элемента и научиться применять его на практике.
Цели обучения Все учащиеся смогут:
• Давать характеристику химического элемента по его положению в ПСХЭ и строению атома
Большинство учащихся будут уметь:
• работать с таблицей химических элементов
Некоторые учащиеся смогут:
• объяснять основные закономерности изменения свойств элементов, отраженные в периодическом законе
Языковая цель • Предметная лексика и терминология:
атом, молекула, элемент, протон, нейтрон, электрон,
•
Предыдущее обучение Учащиеся знают строение атома, принцип построения периодической таблицы Д.И. Менделеева
План
Планируемые сроки Планируемые действия (замените записи ниже запланированными действиями) Ресурсы
Начало урока
0-2 мин
Приветствие:
Встаньте прямо, расправьте плечи, приподнимите головку, улыбнитесь гостям, пожелайте удачи мне и друг другу. Я желаю вам хорошей плодотворной работы на уроке. Мы многому научились. Пусть девизом нашего урока будут слова:
«Умеешь сам – научи других»
Активити Деление на группы: на стикерах записаны слова- металлы и неметаллы Формируются две группы, раздаются оценочные листы
Презентация
Слайд 1
Стикеры
Приложение 1
10 мин Выход на тему
Отвечают на вопросы и отгадывают кроссворд.
Учащиеся, ответившие на 4 вопроса, получают «5», на 3 вопроса- «4», на два- «3»
1.Наука о веществах, их свойствах и превращениях в другие вещества
2. Мельчайшие частицы, сохранющие свойства и состав данного вещества
3. Элемент, имеющий заряд дра +14
4. Способность атомов химического элемента присоединть определенное число атомов другого элемента
5. Элемент, содержащий 19 протонов в ядре
6. Атомы определенного вида
7. Простые вещества, проводщие тепло и электрический ток
8. Частица с массой, равной 1, но не имеющая зарда
9. Разновидности атомов одного и того же элемента, имеющие одинаковое число протонов в ядре, но разную массу
10. Элемент с электронной формулой …3s23p4
11. Частица с зарядом +1 и относительной атомной массой, равной 1
12.Тип реакции, при которой из двух или нескольких веществ образуется одно новое сложное вещество.
13. Отрицательно заряженные частицы
14. Мельчайшие, химически неделимые частицы
Получается два ключевых слова: характеристика и элемент.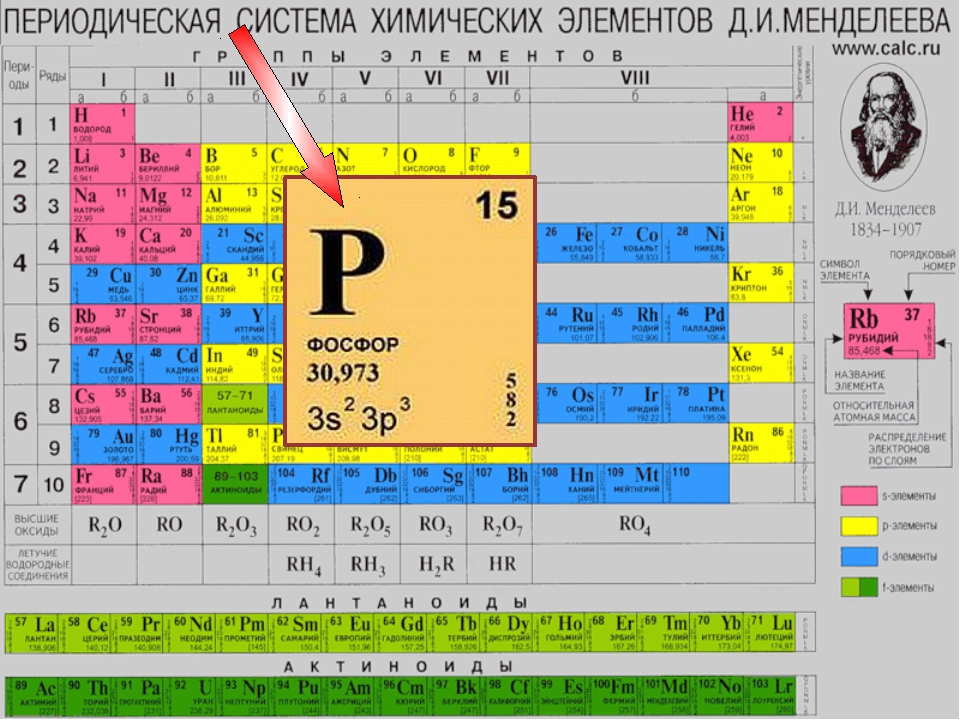 Таким образом, открываем тему урока
Таким образом, открываем тему урока
Назовите цели урока Презентация
Слайд 2
Слайд 3, 4
Середина урока
5 мин
10 мин
10 мин Работа по группам
Задание: Используя текст учебника, изучите план характеристики элемента по его положению в ПСХЭ Д.И. Менделеева и строению атома
Работа с флипчартом
1 группа – дать характеристику элемента натрия
2 группа- дать характеристику фосфора
Защита постера
ФО: Прием «Три звезды»
Критерий оценивания
1. Соблюдение порядка описания элемента
2. Дана полная характеристика элемента
3. Эстетичность оформления
Обобщение материала
Прием «Тонкие и толстые вопросы»
На доске вопросы низкого и высокого порядка, учащиеся выбирают вопрос и отвечают на него.
1. Какое строение имеет атом
2. Из каких частиц состоит ядро
3. В чем физический смысл порядкового номера
4. Электроны по электронным слоям располагаются следующим образом 2, 8, 2 Определите элемент
5. Что обозначает номер периода
Что обозначает номер периода
6. Назовите элемент, имеющий следующую электронную формулу: 1s2 2s2 2p6 3s2
7. Дайте объяснение, почему в периодах с возрастанием относительных атомных масс неметаллические свойства усиливаются
8. Предположите, какое строение атома будет иметь элемент с порядковым номером 116
9. Оцените научный подвиг Д.И. Менделеева
10. Высший оксид химического элемента, расположенного в 3 периоде, имеет состав R2O7. Определите группу и подгруппу, в которых находится этот элемент.
11. В группах сверху вниз усиливаются металлические свойства. Объясните причину
12. Относительная атомная масса аргона 39,948, а калия 39,0938 Предположите, что будет, если поменять местами аргон и калий.
Слайд 5
Слайд 6
Маркеры
На доске закреплены листы, на обратной стороне которых записаны вопросы, ученики подходят к доске, выбирают сами карточку с вопросом и отвечают на них
Конец урока Рефлексия
Полный текст материала смотрите в скачиваемом файле.
На странице приведен только фрагмент материала.
Химические свойства элементов и соединений
Атомный номер
Атомный номер указывает количество протонов в ядре атома. Атомный номер является важным понятием в химии и квантовой механике. Из этой концепции вытекают элемент и его место в периодической таблице.
Когда атом обычно электрически нейтрален, атомный номер будет равен количеству электронов в атоме, которое можно найти вокруг ядра.Эти электроны в основном определяют химическое поведение атома. Атомы, несущие электрический заряд, называются ионами. Ионы имеют число электронов больше (отрицательно заряженных) или меньше (положительно заряженных), чем атомный номер.
Атомная масса
Название указывает на массу атома, выраженную в атомных единицах массы (а.е.м.). Большая часть массы атома сосредоточена в протонах и нейтронах, содержащихся в ядре. Каждый протон или нейтрон весит около 1 а. е.м., и, таким образом, атомная масса всегда очень близка к массе (или нуклону), числу , которое указывает число частиц в ядре атома; это означает протоны и нейтроны.Каждый изотоп химического элемента может различаться по массе. Атомная масса изотопа указывает на количество нейтронов, присутствующих в ядре атомов. Суммарная атомная масса элемента эквивалентна единицам массы его изотопов. Относительное распространение изотопов в природе является важным фактором в определении общей атомной массы элемента. Применительно к определенному химическому элементу атомная масса, показанная в периодической таблице, представляет собой среднюю атомную массу всех стабильных изотопов химического элемента.Среднее значение взвешивается относительным естественным содержанием изотопов элемента.
е.м., и, таким образом, атомная масса всегда очень близка к массе (или нуклону), числу , которое указывает число частиц в ядре атома; это означает протоны и нейтроны.Каждый изотоп химического элемента может различаться по массе. Атомная масса изотопа указывает на количество нейтронов, присутствующих в ядре атомов. Суммарная атомная масса элемента эквивалентна единицам массы его изотопов. Относительное распространение изотопов в природе является важным фактором в определении общей атомной массы элемента. Применительно к определенному химическому элементу атомная масса, показанная в периодической таблице, представляет собой среднюю атомную массу всех стабильных изотопов химического элемента.Среднее значение взвешивается относительным естественным содержанием изотопов элемента.
Электроотрицательность по Полингу
Электроотрицательность измеряет склонность атома тянуть электронное облако в своем направлении во время химической связи с другим атомом.
Шкала Полинга — широко используемый метод упорядочения химических элементов по их электроотрицательности. Лауреат Нобелевской премии Линус Полинг разработал эту шкалу в 1932 году.
Значения электроотрицательности не рассчитываются на основе математической формулы или измерения.Это больше похоже на прагматический диапазон.
Полинг дал элементу с максимально возможной электроотрицательностью, фтору, значение 4,0. Францию, элементу с минимально возможной электроотрицательностью, было присвоено значение 0,7. Всем остальным элементам присваивается значение где-то между этими двумя крайними значениями.
Плотность
Плотность элемента указывает количество единиц массы элемента, присутствующих в определенном объеме среды. Традиционно плотность выражается греческой буквой ro (пишется как r).В системе единиц СИ плотность выражается в килограммах на кубический метр (кг/м 3 ). Плотность элемента обычно выражается графически с помощью температуры и давления воздуха, потому что эти два свойства влияют на плотность.
Температура плавления
Температура плавления элемента или соединения означает температуру, при которой твердая форма элемента или соединения находится в равновесии с жидкой формой. Обычно мы предполагаем, что атмосферное давление равно 1 атмосфере.
Например: точка плавления воды составляет 0 o C или 273 K.
Температура кипения
Температура кипения элемента или соединения означает температуру, при которой жидкая форма элемента или соединения в равновесии с газообразной формой. Обычно мы предполагаем, что атмосферное давление равно 1 атмосфере.
Например: температура кипения воды составляет 100 o C или 373 K.
При температуре кипения давление паров элемента или соединения составляет 1 атмосферу.
Радиус Вандерваальса
Даже когда два атома, находящиеся рядом друг с другом, не связываются, они все равно будут притягиваться друг к другу. Это явление известно как взаимодействие Вандерваальса.
Силы Вандерваальса вызывают силу между двумя атомами. Эта сила становится сильнее по мере того, как атомы сближаются. Однако, когда два атома приближаются слишком близко друг к другу, начинает действовать отталкивающая сила вследствие чрезмерного отталкивания между отрицательно заряженными электронами обоих атомов.В результате между двумя атомами образуется определенное расстояние, известное как радиус Вандерваальса.
Путем сравнения радиусов Вандерваальса нескольких различных пар атомов мы разработали систему радиусов Вандерваальса, с помощью которой мы можем предсказать радиус Вандерваальса между двумя атомами путем сложения.
Ионный радиус
Ионный радиус — это радиус, который ион имеет в ионном кристалле, где ионы упакованы вместе до точки, где их самые внешние электронные орбитали соприкасаются друг с другом.Орбиталь — это область вокруг атома, где, согласно орбитальной теории, вероятность нахождения электрона наибольшая.
Изотопы
Атомный номер не определяет количество нейтронов в атомном ядре. В результате количество нейтронов в атоме может варьироваться. Тогда атомы с одинаковым атомным номером могут отличаться по атомной массе. Атомы одного и того же элемента, отличающиеся атомной массой, называются изотопами.
В результате количество нейтронов в атоме может варьироваться. Тогда атомы с одинаковым атомным номером могут отличаться по атомной массе. Атомы одного и того же элемента, отличающиеся атомной массой, называются изотопами.
В основном у более тяжелых атомов с более высоким атомным номером количество нейтронов в ядре может превышать количество протонов.
Изотопы одного и того же элемента часто встречаются в природе попеременно или в смесях.
Пример: хлор имеет атомный номер 17, что в основном означает, что все атомы хлора содержат 17 протонов в своем ядре. Есть два изотопа. Три четверти встречающихся в природе атомов хлора содержат 18 нейтронов, а одна четверть — 20 нейтронов. Массовые числа этих изотопов 17 + 18 = 35 и 17 + 20 = 37. Изотопы записываются следующим образом: 35Cl и 37Cl.
При таком обозначении изотопов количество протонов и нейтронов не нужно указывать отдельно, потому что символ хлора в периодической таблице (Cl) ставится на семнадцатом месте.Это уже указывает на число протонов, так что всегда можно легко вычислить число нейтронов с помощью массового числа.
Большое количество изотопов нестабильны. Они развалятся в процессе радиоактивного распада. Изотопы, обладающие радиоактивностью, называются радиоизотопами.
Электронная оболочка
Электронная конфигурация атома — это описание расположения электронов по кругу вокруг ядра. Эти круги не совсем круглые; они содержат волнообразный рисунок.Для каждого круга вероятность присутствия электрона в определенном месте описывается математической формулой. Каждый из кругов имеет определенный уровень энергии по сравнению с ядром. Обычно энергетические уровни электронов выше, когда они находятся дальше от ядра, но из-за их зарядов электроны также могут влиять на энергетические уровни друг друга. Обычно первыми заполняются средние круги, но могут быть и исключения из-за отказов.
Круги разделены на оболочки и подоболочки, которые можно пронумеровать с помощью количества.
Энергия первой ионизации
Энергия ионизации означает энергию, необходимую для того, чтобы свободный атом или молекула потеряли электрон в вакууме. Другими словами; энергия ионизации является мерой прочности электронных связей с молекулами. Это касается только электронов во внешнем круге.
Другими словами; энергия ионизации является мерой прочности электронных связей с молекулами. Это касается только электронов во внешнем круге.
Энергия второй ионизации
Помимо энергии первой ионизации, которая показывает, насколько трудно удалить первый электрон из атома, существует также энергетическая мера второй ионизации.Эта энергия вторичной ионизации указывает на степень трудности удаления второго атома.
Таким образом, существует также энергия третьей ионизации, а иногда даже энергия четвертой или пятой ионизации.
Стандартный потенциал
Стандартный потенциал означает потенциал окислительно-восстановительной реакции, когда она находится в равновесии, относительно нуля. Когда стандартный потенциал превышает ноль, мы имеем дело с реакцией окисления. Когда стандартный потенциал ниже нуля, мы имеем дело с реакцией восстановления.Стандартный потенциал электронов выражается в вольтах (В) символом V 0 .
Назад к Периодической таблице или к предметам Химия
Элементы состоят из чрезвычайно маленькие частицы, называемые атомами . Атом – это мельчайшая часть элемент, который сохраняет все характеристики элемента.Атомы состоит из протонов , нейтронов и электронов , которые состоит из основных строительных блоков материи, лептонов, и кварков . Этим субатомным частицам не хватает отчетливого характеристики элементов. Протоны и нейтронов состоят из различных комбинаций кварков .
Существует шесть различных типов кварков, известных как ароматы . Отрицательно заряжен частицы называются электронами и являются одним из шести типов лептонов . Электроны находятся вдали от ядра на разных расстояния от ядра, называемые атомными орбиталями или энергии уровни .Каждая из орбиталей может содержать определенное количество электронов, но в этой модели сложно точно описать, где можно найти электроны. О периодическом
Таблица элементов, орбитали которых можно определить, глядя на валентность .
конфигурация оболочки . Эта конфигурация представляет собой расширенный взгляд на
атомная структура элементов. В рекомендованной периодической таблице вы
можете найти этот номер в правом нижнем углу.
|
Каковы две основные характеристики элементов? – М.В.Организинг
Каковы две основные характеристики элементов?
Все элементы имеют определенные характеристики, которые суммированы в периодической таблице.Эти характеристики включают символ элемента, атомный номер и атомную массу. Вы узнаете, как количество протонов в атоме связано с атомным номером элемента, и изучите, как изотопы влияют на атомную массу.
Что особенного в элементе?
Элемент — это вещество, которое нельзя разложить на какое-либо другое вещество. Существует около 100 элементов, каждый из которых имеет свой тип атома. Все во Вселенной содержит атомы по крайней мере одного или нескольких элементов.В периодической таблице перечислены все известные элементы, сгруппированные вместе с похожими свойствами.
Как отличить один элемент от другого?
Число протонов определяет атомный номер элемента и используется для отличия одного элемента от другого. Количество нейтронов является переменным, в результате чего изотопы, которые являются различными формами одного и того же атома, различаются только количеством нейтронов, которыми они обладают.
Количество нейтронов является переменным, в результате чего изотопы, которые являются различными формами одного и того же атома, различаются только количеством нейтронов, которыми они обладают.
Каковы свойства элемента?
Химические свойства
- Атомный номер.Атомный номер указывает количество протонов в ядре атома.
- Атомная масса. Название указывает на массу атома, выраженную в атомных единицах массы (а.е.м.).
- Электроотрицательность по Полингу.
- Плотность.
- Точка плавления.
- Температура кипения.
- Радиус Вандерваальса.
- Ионный радиус.
Какие 4 периодических свойства?
Основные периодические тренды включают: электроотрицательность, энергию ионизации, сродство к электрону, атомный радиус, температуру плавления и металлический характер.Периодические тенденции, возникающие в результате расположения периодической таблицы, предоставляют химикам бесценный инструмент для быстрого прогнозирования свойств элемента.
Почему важно знать свойства элементов?
Ученым важно знать свойства материи, потому что все вещи состоят из материи. Каждый тип материи имеет разные физические характеристики, и ученым необходимо знать и понимать эти характеристики для проведения расчетов. Основными фазами вещества являются твердое, жидкое и газообразное.
Насколько важны элементы в нашей повседневной жизни?
1. Обратите внимание, что большая часть живой материи состоит в основном из так называемых объемных элементов: кислорода, углерода, водорода, азота и серы — строительных блоков соединений, из которых состоят наши органы и мышцы. Эти пять элементов также составляют основную часть нашего рациона; человеку требуются десятки граммов в день.
Какова важность элемента?
и многое другое! Элемент — это простейшая форма материи, которую нельзя разбить на более мелкие частицы с помощью химических веществ.
Все ли элементы важны?
Ученые считают, что около 25 известных элементов необходимы для жизни. Всего четыре из них — углерод (C), кислород (O), водород (H) и азот (N) — составляют около 96% человеческого тела. Организм человека функционирует в результате большого количества химических реакций с участием соединений всех этих элементов.
Всего четыре из них — углерод (C), кислород (O), водород (H) и азот (N) — составляют около 96% человеческого тела. Организм человека функционирует в результате большого количества химических реакций с участием соединений всех этих элементов.
Какие 25 элементов входят в состав человеческого тела?
Функция элементов в теле
- Кислород (O) – 65% массы тела.
- Углерод (С) – 18% массы тела.
- Водород (H) – 10% массы тела.
- Азот (N) – 3% от массы тела.
- Кальций (Ca) – 1,4% массы тела.
- Фосфор (P) – 1% от массы тела.
- Калий (К) – 0,25%
- Сера (S) – 0,25%
Какие 10 элементов есть в организме человека?
- Кислород. Химический символ О2; 65% массы тела человека.
- Углерод. Химический символ С; 18% массы тела человека.
- Водород. Химический символ h3; 10% массы тела человека.
- Азот. Химический символ N2; 3% массы тела человека.
- Кальций.
 Химический символ Са; 1,5% массы тела человека.
Химический символ Са; 1,5% массы тела человека. - Фосфор.
- Калий.
- Сера.
Каковы характеристики периодической таблицы? – Restaurantnorman.com
Каковы характеристики периодической таблицы?
- Периодическая таблица представляет собой табличный массив химических элементов, упорядоченных по атомному номеру, от элемента с наименьшим атомным номером, водорода, до элемента с наибольшим атомным номером, оганесона.
- Группы периодической таблицы отображаются в виде вертикальных столбцов, пронумерованных от 1 до 18.
Что характерно для элементов первого столбца периодической таблицы элементов?
Например, элементы группы 1 (первая колонка) образуют соединения, состоящие из одного атома элемента и одного атома водорода. Эти элементы (кроме водорода) известны как щелочные металлы, и все они имеют схожие химические свойства.
Как столбцы организованы в периодической таблице?
Химические элементы расположены в порядке возрастания атомного номера. Горизонтальные строки называются периодами, а вертикальные столбцы — группами. Элементы одной группы имеют сходные химические свойства. Это потому, что они имеют одинаковое количество внешних электронов и одинаковую валентность.
Горизонтальные строки называются периодами, а вертикальные столбцы — группами. Элементы одной группы имеют сходные химические свойства. Это потому, что они имеют одинаковое количество внешних электронов и одинаковую валентность.
Что является первым элементом таблицы Менделеева?
Водород
Что из следующего лучше всего описывает, как организована таблица Менделеева?
Теперь периодическая таблица была организована на основе атомного номера элемента, так как считается, что атомный номер связан со свойствами элементов.В зависимости от атомного номера элементы объединялись в группы со сходными свойствами.
Какие элементы обладают подобными свойствами?
Элементы одной группы периодической таблицы имеют сходные химические свойства. Элементы можно классифицировать как металлы, металлоиды и неметаллы или как элементы основной группы, переходные металлы и внутренние переходные металлы.
Имеют ли периоды схожие свойства?
Период в периодической таблице представляет собой ряд химических элементов.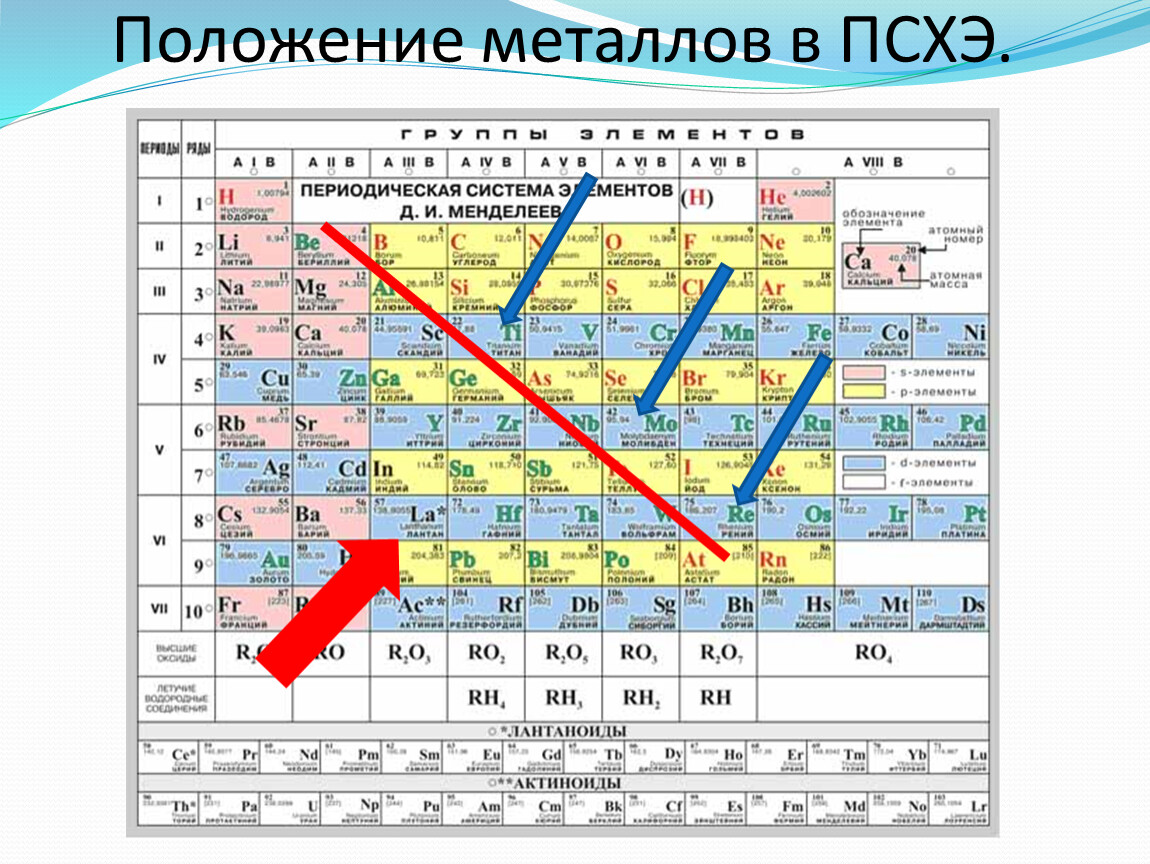 При таком расположении группы элементов в одном столбце имеют сходные химические и физические свойства, отражающие периодический закон.
При таком расположении группы элементов в одном столбце имеют сходные химические и физические свойства, отражающие периодический закон.
Какой элемент обладает такими же свойствами, как гелий?
Благородный газ
Какой элемент ближе всего к кислороду?
Пояснение: Кислород находится в группе 16/VIA, которая называется халькогенами, и члены одной и той же группы обладают сходными свойствами. Сера и селен — следующие два элемента в группе, и они реагируют с газообразным водородом (h3) аналогично кислороду.
Почему 16 групп называются халькогенами?
Халькогены означают рудообразующие, поскольку большинство руд в земной коре представляют собой либо оксиды, либо сульфиды, элементы 16 группы называются халькогенами. например: Кислород является самым распространенным из всех элементов на земле.
Почему группу 15 называют пниктогенами?
Элементы группы 15 также известны как пниктогены, потому что в переводе с греческого голубь означает «задыхаться» или «задыхаться». В отсутствие кислорода этим свойством обладает молекулярный азот.Вот почему элементы группы 15 известны как семейство азота или пниктогены.
В отсутствие кислорода этим свойством обладает молекулярный азот.Вот почему элементы группы 15 известны как семейство азота или пниктогены.
Является ли кислород металлом или неметаллом?
Кислород, углерод, сера и хлор являются примерами неметаллических элементов.
Какой элемент является первым элементом группы 16?
кислород
Как учить элементы 16 группы?
Группа 16 известна как группа халькогенов или кислородная группа. Он включает кислород (O), серу (S), селен (Se), теллур (Te) и радиоактивный элемент полоний (Po).Мнемоника для группы 16: О! Стиль Се Тел Польский.
Что общего у элементов 16 группы?
Семейство кислорода состоит из элементов, которые составляют группу 16 в периодической таблице: кислород, сера, селен, теллур и полоний. Все эти элементы имеют шесть электронов на внешнем энергетическом уровне, что объясняет некоторые общие химические свойства.
В чем уникальность халькогенов?
Свойства, общие для халькогенов Большинство членов этой группы получают два электрона от другого элемента, поэтому они могут иметь восемь валентных электронов. Атомы стабильны, когда у них восемь валентных электронов, поэтому, получив два, халькогены становятся стабильными.
Атомы стабильны, когда у них восемь валентных электронов, поэтому, получив два, халькогены становятся стабильными.
С какой группой кислород не реагирует?
благородные газы
Является ли группа 17 металлом или неметаллом?
Галогены
Элементы, соединения и смеси
Элементы, соединения и смесиЭлементы, Соединения и смеси
Элементы
Известно любое вещество, содержащее только один вид атома. как элемент .Поскольку атомы не могут быть созданы или разрушаются в химической реакции такие элементы, как фосфор (P 4 ) или сера (S 8 ) не может быть разбита на более простые веществ в результате этих реакций.
Пример: вода разлагается на смесь водорода и
кислорода при пропускании электрического тока через жидкость.
Водород и кислород, с другой стороны, не могут быть разложены на
более простые вещества. Следовательно, они являются элементарными или
простейшие, химические вещества – элементы.
Следовательно, они являются элементарными или
простейшие, химические вещества – элементы.
Каждый элемент представлен уникальным символом. Обозначение для каждого элемента можно найти в периодической таблице элементов.
Элементы можно разделить на три категории, которые имеют характерные свойства: металлы, неметаллы и полуметаллы. Большинство элементов — это металлы, которые находятся слева и ближе к нижней части периодической таблицы. Горстка неметаллов сгруппированы в правом верхнем углу таблицы Менделеева.То полуметаллы можно найти вдоль разделительной линии между металлов и неметаллов.
Атомы
Элементы состоят из атомов, мельчайших частица, обладающая любым из свойств элемента.Джон Дальтон в 1803 году предложил современную теорию атома, основанную на следующие предположения.
1. |
2. Все атомы элемента идентичный. |
3. Атомы различных элементов имеют разный вес и разные химические свойства. |
4. Атомы различных элементов соединяются в простые целые числа, образуя соединения. |
5.Атомы не могут быть созданы или уничтожен. При разложении соединения атомы восстановлен без изменений. |
Соединения
Элементы объединяются, образуя химические соединения, которые часто разделить на две категории.
Металлы часто реагируют с неметаллами с образованием ионных соединений .
Эти соединения состоят из положительных и отрицательных ионов, образованных
путем добавления или вычитания электронов из нейтральных атомов и
молекулы.
Неметаллы соединяются друг с другом, образуя ковалентных соединения , которые существуют в виде нейтральных молекул.
Сокращенное обозначение соединения описывает количество атомов каждого элемента, что обозначается нижним индексом, написанным после символа элемента. По соглашению индекс не пишется, когда молекула содержит только один атом элемента. Таким образом, вода — это H 2 O, а углекислый газ — CO 2 .
Характеристики Ионные и ковалентные соединения
Ионная Соединения | Ковалентные соединения | |
Содержит положительные и отрицательные ионы (Na + Cl – ) | Существовать как нейтральный молекулы (C 6 H 12 O 2 ) | |
Твердые вещества например, поваренная соль (NaCl (s) ) | Твердые вещества, жидкости или газы (C 6 H 12 O 6(s) , H 2 O (l) , СО 2(г) ) | |
Высокий температуры плавления и кипения | Нижняя плавка и
точки кипения (т. | |
Сильный сила притяжения между частицами | Относительно слабая сила притяжения между молекулами | |
Отдельно на заряженные частицы в воде, чтобы получить раствор, который проводит электричество | Оставаться той же молекулой в воде и не проводит электричество | |
Определение наличия Соединение является ионным или ковалентным
Рассчитайте разницу между электроотрицательностями
два элемента в соединении и среднее их
электроотрицательности, и найти пересечение этих значений на
рисунок, показанный ниже, поможет определить, является ли соединение ионным
или ковалентный, или металлический.
| Практическая задача 1: Для каждого из следующих соединений, предскажите, будете ли вы можно было бы ожидать, что он будет ионным или ковалентным. (а) оксид хрома(III), Cr 2 O 3 (b) четыреххлористый углерод, CCl 4 (c) метанол, CH 3 OH (d) фторид стронция, SrF 2 Нажмите здесь чтобы проверить свой ответ на практическое задание 1 |
| Практическая задача 2: Использование
следующие данные, чтобы предложить способ различения
между ионными и ковалентными соединениями.
Нажмите здесь, чтобы проверить свой ответ на практическое задание 2 |
Формулы
Молекула — это наименьшая частица, имеющая любой из
свойства соединения. Формула молекулы должна быть
нейтральный. При написании формулы ионного соединения
заряды на ионах должны уравновешиваться, количество положительных зарядов
должно равняться числу отрицательных зарядов.
Формула молекулы должна быть
нейтральный. При написании формулы ионного соединения
заряды на ионах должны уравновешиваться, количество положительных зарядов
должно равняться числу отрицательных зарядов.
Примеры:
| CaCl 2 | Сбалансированная формула имеет 2 положительных заряда (1 кальций ион с зарядом +2) и 2 отрицательных заряда (2 хлорида ионы с зарядом -1) |
| Ал 2 (СО 4 ) 3 | Сбалансированная формула имеет 6 положительных зарядов (2 алюминиевых ионов с зарядом +3) и 6 отрицательных зарядов (3 сульфата ионы с зарядом -2) |
Смеси Против.Соединения
Закон о постоянном составе гласит, что
соотношение по массе элементов в химическом соединении равно
всегда одинаковы, независимо от источника соединения. То
Закон постоянного состава можно использовать для различения
соединения и смеси элементов: Соединения имеют
постоянный состав; смеси не . Вода всегда
88,8% O и 11,2% H по весу независимо от его источника.Латунь
пример смеси двух элементов: меди и цинка. Оно может
содержат всего 10% или целых 45% цинка.
То
Закон постоянного состава можно использовать для различения
соединения и смеси элементов: Соединения имеют
постоянный состав; смеси не . Вода всегда
88,8% O и 11,2% H по весу независимо от его источника.Латунь
пример смеси двух элементов: меди и цинка. Оно может
содержат всего 10% или целых 45% цинка.
Еще одно различие между соединениями и смесями элементов это легкость, с которой элементы могут быть разделены. Смеси, например, атмосфера, содержат два или более веществ, относительно легко отделить. Отдельные компоненты смеси могут быть физически отделены друг от друга.
Химические соединения сильно отличаются от смесей: элементы в химическом соединении можно разделить только разрушая состав.Некоторые различия между химическими соединения и смеси элементов иллюстрируются следующий пример с использованием изюмных отрубей и “Crispix”.
Изюмные отруби обладают следующими характерными свойствами смеси .
- Зерно не имеет постоянного состава; в
соотношение изюма и отрубей меняется от образца к образцу.
 образец.
образец. - Легко физически разделить два “элементы”, чтобы выбрать изюм, для Например, и есть их отдельно.
Crispix обладает некоторыми характерными свойствами соединения .
- Соотношение рисовых хлопьев и кукурузных хлопьев постоянно; Это составляет 1:1 в каждом образце.
- Нет возможности разделить “элементы” не разрывая узы, удерживающие их вместе.
112 элементов периодической таблицы, представленных в виде символов
Наука требует не только множества технических ноу-хау, но и большого творчества и воображения.Часто наука и искусство рассматриваются как противоположности, что не может быть дальше от истины. В худшем случае они дополняют друг друга. Во-первых, искусство может быть лучшим способом донести науку до тех, кто еще не посещал занятия или не имел вдохновенного влияния в свое время.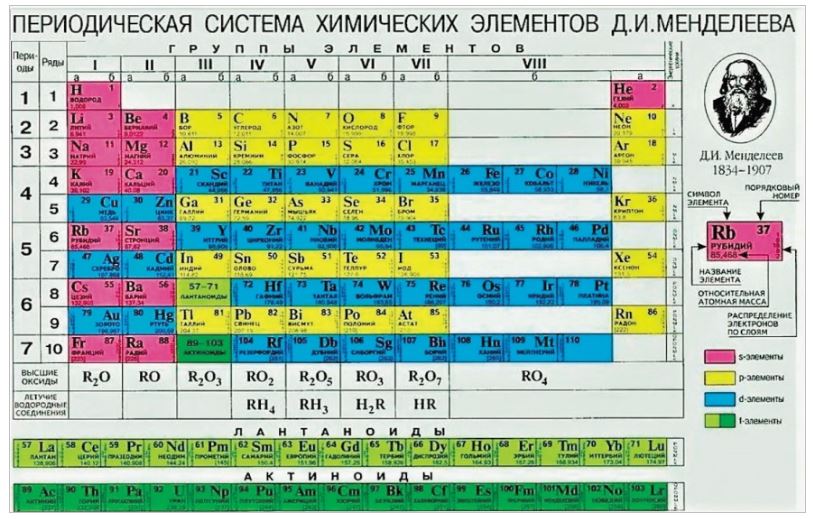 Возьмем, к примеру, дипломную работу Кейси Данлэп под названием « элементов — эксперименты в дизайне персонажей ». Для своего проекта Кейси решила передать нам свою страсть к дизайну персонажей, чтобы придать химии более гуманный вид.Поэтому она амбициозно нарисовала от руки остроумный персонаж для каждых 112 химических элементов из таблицы Менделеева.
Возьмем, к примеру, дипломную работу Кейси Данлэп под названием « элементов — эксперименты в дизайне персонажей ». Для своего проекта Кейси решила передать нам свою страсть к дизайну персонажей, чтобы придать химии более гуманный вид.Поэтому она амбициозно нарисовала от руки остроумный персонаж для каждых 112 химических элементов из таблицы Менделеева.
На создание некоторых элементов Кейси вдохновили ее друзья, а на другие — знаменитости. Например, Фредди Меркьюри демонстрируется для Меркьюри.
«Художник с рождения, я был ребенком, который все время рисовал в классе. Эта фаза сохранилась и в художественной школе, где рисовать на уроках было нормально! По мере приближения выпускного года они призвали нас придумать идею для нашей диссертации, которая объединила бы все, чему мы научились в школе, и дала бы представление о том, кто мы такие и что нас вдохновляет.Нарисованная карандашом и раскрашенная в Photoshop, я взяла свою первую любовь — персонажей — и объединила их с сильной идеей, чтобы создать эти 112 иллюстраций», — написала Кейси на BoredPanda.
Кейси сейчас работает над тем, чтобы связать всех этих персонажей в общую историю, которая может превратиться в комикс или даже анимацию.
Оставшиеся шесть элементов периодической таблицы, которые (пока) не были проиллюстрированы, — это унунтрий, флеровий, унунпентий, ливерморий, унунсептий, унунонктий.
Если вы хотите, чтобы они были напечатаны, Кейси превратила свой проект в колоду карточек. Каждая карточка содержит изображение элемента на лицевой стороне и его атомный вес, плотность и забавный факт на обратной стороне. Вы можете заказать собственную колоду за 35 долларов.
.



 В периодической таблице относится к трансактинидным элементам p-блока 7-го периода и помещен в группу 15 как самый тяжелый пниктоген (элемент подгруппы азота), хотя и не подтверждено, что он ведет себя, как более тяжелый гомолог висмута.
В периодической таблице относится к трансактинидным элементам p-блока 7-го периода и помещен в группу 15 как самый тяжелый пниктоген (элемент подгруппы азота), хотя и не подтверждено, что он ведет себя, как более тяжелый гомолог висмута. Согласно расчетам, moscovium должен быть плотным металлом из-за его высокого атомного веса с плотностью около 13,5 г/см 3 .
Согласно расчетам, moscovium должен быть плотным металлом из-за его высокого атомного веса с плотностью около 13,5 г/см 3 . Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) – слаборастворимые соединения.
Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) – слаборастворимые соединения. Однако «мишени» включали примеси свинца и висмута и, следовательно, были получены в реакциях переноса нуклонов некоторые изотопы висмута и полония, что осложнило проведение эксперимента. Между тем, полученные данные помогут в будущем ученым более детально исследовать тяжелые гомологи висмута и полония, такие как moscovium и livermorium.
Однако «мишени» включали примеси свинца и висмута и, следовательно, были получены в реакциях переноса нуклонов некоторые изотопы висмута и полония, что осложнило проведение эксперимента. Между тем, полученные данные помогут в будущем ученым более детально исследовать тяжелые гомологи висмута и полония, такие как moscovium и livermorium. Два более тяжелых изотопа московия, 289 Mc и 290 Mc, были обнаружены в 2009-2010 годах.
Два более тяжелых изотопа московия, 289 Mc и 290 Mc, были обнаружены в 2009-2010 годах. Несмотря на то, что данное название с тех пор широко использовалось в отношении неоткрытого (но теоретически предсказанного) элемента, в сообществе физиков оно не прижилось. Чаще всего вещество так и называли – элемент №115 или E115.
Несмотря на то, что данное название с тех пор широко использовалось в отношении неоткрытого (но теоретически предсказанного) элемента, в сообществе физиков оно не прижилось. Чаще всего вещество так и называли – элемент №115 или E115. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
 включая вверх, вниз, прелесть, странность, верх и низ .
Протоны положительно заряжены , а нейтроны электрически нейтральный . Нейтроны и протоны находятся в ядре
атом.
включая вверх, вниз, прелесть, странность, верх и низ .
Протоны положительно заряжены , а нейтроны электрически нейтральный . Нейтроны и протоны находятся в ядре
атом. Атомные орбитали математически выведены и описывают движение и размещение
электроны атома. Ранние исследователи думали, что электроны раньше
вращаются вокруг ядра подобно планетам, вращающимся вокруг Солнца. Тем не мение,
электрон не твердый, как планета, поэтому термин орбитальный теперь используется вместо орбиты. Орбитали названы s (острый), p (основной), d (диффузный) и f (основной).То
использование s, p, d и f было использовано из-за их отношения к .
спектральные характеристики для определения числа электронов.
Однако спектральный анализ больше не используется, но химики по-прежнему сохраняют
буквы.
Атомные орбитали математически выведены и описывают движение и размещение
электроны атома. Ранние исследователи думали, что электроны раньше
вращаются вокруг ядра подобно планетам, вращающимся вокруг Солнца. Тем не мение,
электрон не твердый, как планета, поэтому термин орбитальный теперь используется вместо орбиты. Орбитали названы s (острый), p (основной), d (диффузный) и f (основной).То
использование s, p, d и f было использовано из-за их отношения к .
спектральные характеристики для определения числа электронов.
Однако спектральный анализ больше не используется, но химики по-прежнему сохраняют
буквы.
 Химический символ Са; 1,5% массы тела человека.
Химический символ Са; 1,5% массы тела человека. э., часто существуют в виде жидкости или газа при
комнатной температуре)
э., часто существуют в виде жидкости или газа при
комнатной температуре)
 образец.
образец.