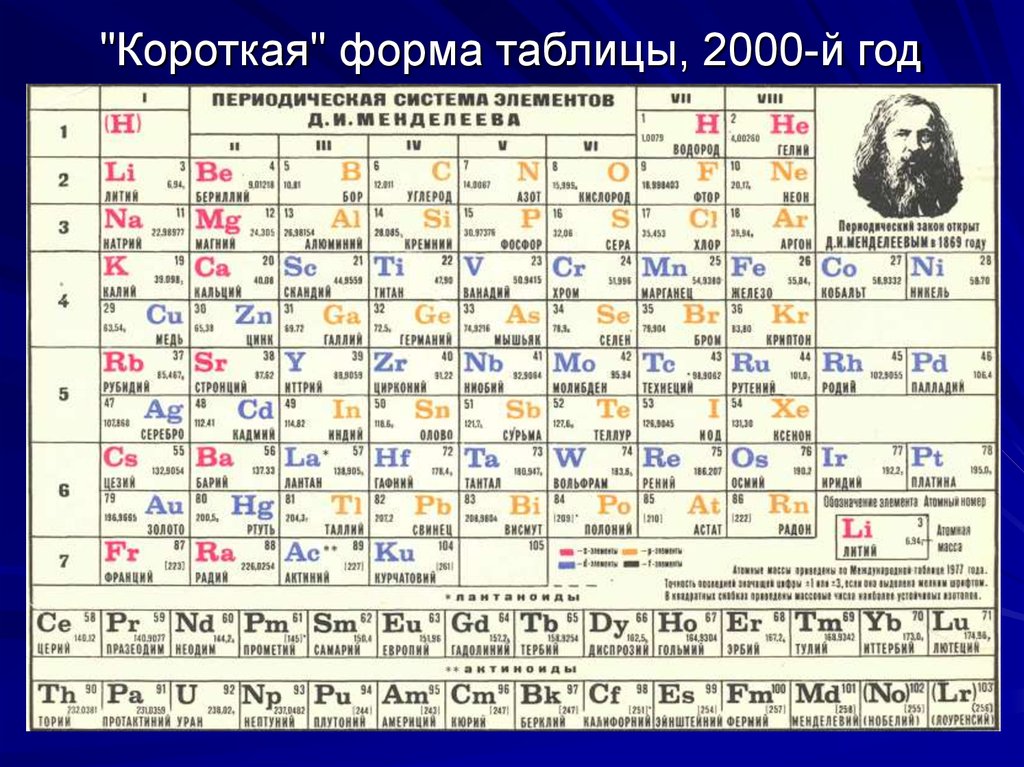
Технические аэрозоли и промышленная химия
О компании
Компания “ТехАэрозоль” — импортер и дистрибьютор технических аэрозолей, химии и промышленных решений из Европы.
Являясь дистрибьютором многих международных производителей, мы оперативно и качественно обрабатываем заявки по химическим продуктам, выполняем проекты по поставкам инструментов и промышленных решений на предприятия многих сегментов: от пищевой промышленности до заводов, связанных с электроникой; сервисы, морские порты, монтажные службы и многие другие.
Благодаря транспортным компаниям оперативно доставляем продукцию по всей России.
Нам доверяют: структуры РосАтома, Центральный Банк РФ, ПАО Камаз, Северсталь, ОАО Группа Илим, АО Климов, ПАО Силовые Машины, Петербургский тракторный завод, Русал, ВГТРК, подрядчики башни Лахта-центр.
Наша компания является эксклюзивным дистрибьютором технических аэрозолей PRF финской компании Taerosol Oy, которая в течение 50 лет производит технические аэрозоли т. м. PRF для применения в промышленности и электронике.
м. PRF для применения в промышленности и электронике.
Ваши преимущества, при работе с нами
| Высочайшее качество ________ | Оперативность ________ | Выгодные условия ________ | |||
|---|---|---|---|---|---|
| Продукция из Европы — гарантия качества | Быстрая обработка и доставка товаров в сжатые сроки | Прямые поставки, выгодные цены | |||
| Официальные поставки, сертификаты на товары | Имеем в наличии большой складской запас | Возможна компенсация транспортных расходов | |||
| Товары отлично справятся с поставленными задачами | Доставляем по России и ЕАЭС ТК Деловые Линии, СДЭК | Возможна рассрочка платежа постоянным партнерам | |||
ТехАэрозоль – технические аэрозоли, химия и промышленные решения от брендов:
Запрашиваемая страница “/%25d0%25bf%25d1%2580%25d0%25be%25d0%25bc%25d1%258b%25d1%2588%25d0%25bb%25d0%25b5%25d0%25bd%25d0%25bd%25d0%25b0%25d1%258f-%25d1%2585%25d0%25b8%25d0%25bc%25d0%25b8%25d1%258f/%25d0%25ba%25d0%25bb%25d0%25b5%25d0%25b8/weicon-hb-300-1-%25d0%25ba%25d0%25b3-%25d1%258d%25d0%25bf%25d0%25be%25d0%25ba%25d1%2581%25d0%25b8%25d0%25b4%25d0%25bd%25d1%258b%25d0%25b9-%25d0%25ba%25d0%25be%25d0%25bc%25d0%25bf%25d0%25be%25d0%25b7%25d0%25b8%25d1%2582-%25d0%25bc%25d0%25b5%25d1%2582%25d0%25b0%25d0%25bb%25d0%25bb%25d0%25be-%25d0%25bf%25d0%25bb%25d0%25b0%25d1%2581%25d1%2582%25d0%25b8%25d0%25ba-%25d0%25bd%25d0%25b0%25d0%25bf%25d0%25be%25d0%25bb%25d0%25bd%25d0%25b5%25d0%25bd%25d0%25bd%25d1%258b%25d0%25b9-%25d1%2581%25d1%2582%25d0%25b0%25d0%25bb%25d1%258c%25d1%258e” не найдена.
Сертификаты
Предлагаемая нами продукция гарантирует Вам получение оригинального товара, оформленного в соответствии с законодательством Российской Федерации. По запросу Вам могут быть предоставлены все необходимые сертификаты.
Продукция PRF от компании Taerosol Oy имеет сертификаты системы менеджмента качества ISO 9001, экологического менеджмента ISO 14001 и менеджмента косметических средств ISO 22716 (GMP), заверенные DNV (Det Norske Veritas).
В ассортименте PRF есть смазочные продукты, имеющих пищевой допуск h2, 3Н, зарегистрированный InS. Эти продукты могут быть использованы во всех пищевых, молочных и пивоваренных производствах.
Сертификат официального дистрибьютора | Сертификаты качества ISO 9001/14001/22716 | Сертификаты пищевого допуска InS h2 |
Доставка и оплата
Оформление заказаОформить свой заказ Вы можете следующими способами:
– отправить заказ в отдел продаж по электронной почте на адрес: sale@techaerosol. ru
ru
– позвонить в отдел продаж по телефону +7 (812) 908-80-81
– выбрать товар в электронном каталоге сайта и через раздел «Корзина» оформить заказ
– через обратную связь в разделе «Контакты»
Работаем только с юридическими лицами. Оплата – безналичным банковским переводом.
Вместе с заказом вышлите нам реквизиты Вашей компании, отдел продаж выставит Вам счёт и вышлет его по электронной почте.
Способы доставки– доставка по России ТК “Деловые Линии” (рассчитывается менеджером)
Бесплатная доставка до терминала г. Санкт-Петербург
– забор из пункта самовывоза (необходимо предварительное согласование)
Вы сами забираете товар с нашего склада по адресу: Санкт-Петербург, ул.Б.Пороховская д.23 лит.А офис 38 1 этаж
– доставка курьером по Санкт-Петербургу до 3 кг – 350 руб (до 14:00 – на следующий день; после 14:00 — через день).
Иные условия доставки рассчитываются менеджером отдельно.
– доставка курьером компании СДЭК
Возможна практически во все города России: Санкт-Петербург, Москва, Нижний Новгород, Калуга, Ярославль, Кострома, Орел, Брянск, Тверь, Вологда, Иваново, Владимир, Екатеринбург, Челябинск и т.д.
– если Вы хотите использовать другие варианты оплаты или доставки Вашего заказа, свяжитесь с нами.
Весь товар проверяется перед отправкой на целостность и сопровождается всеми необходимыми документами
В каталоге указаны рублевые розничные цены за штуку с НДС. По условиям получения оптовых цен, дополнительных скидок и прочих изменений в стандартной схеме взаиморасчетов обращайтесь по адресу [email protected] или по телефону +7 (812) 908-80-81
Контакты
+7 (812) 908-80-81 | Наши реквизиты | Официальный дилер в Казахстане |
sale@techaerosol. ru ru | ООО «Родис» / Rodis Ltd. | |
195176, Санкт-Петербург, Большая Пороховская ул., 23А | ИНН 7814167499, КПП 780601001, | 130000, Республика Казахстан, |
Информация на сайте носит сугубо рекламно-информационный характер, и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса РФ. Точную и окончательную информацию о наличии и стоимости указанных товаров Вы можете узнать у менеджеров отдела продаж по телефону (812) 908-80-81 или по электронной почте sale@techaerosol.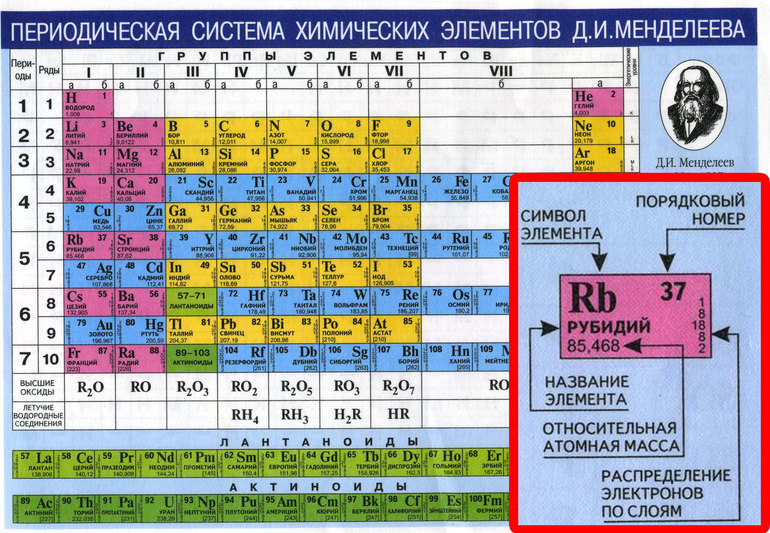 | ||
WEICON HB-300 | Дерус
WEICON HB-300 | ДерусШпаклевочная масса, которая может применяться на вертикальных поверхностях. С особенно простым и практическим использованием. Пропорция смешивания 1:1. Высокая термостойкость до +280°С.
Характеристики
Артикул…………………………………………………………………………………………wcn10450010-34
Производитель……………………………………………………………………………………………Weicon
Производство………………………………………………………………………………………….Германия
Термостойкость, °C……………………………………………-35 до +200 (кратковременно +280)
Цвет…………………………………………………………………………………………………..Темно-серый
Основа………………….. ……………………………..Эпоксидная смола с наполнением из стали
……………………………..Эпоксидная смола с наполнением из стали
Вес, кг…………………………………………………………………………………………………………………..1
Жизнеспособность при +20 °С………………………………………………………………………30 мин
Начальная прочность……………………………………………………………………………………….12 ч
Полная прочность…………………………………………………………………………………………….24 ч
Среднее значение прочности на сжатие (+ 25 °С) в соотв. с DIN 53281-83, Мра……100
Среднее значение прочности на разрыв (+ 25 °С) в соотв. с DIN 53281-83, Мра…….27
Среднее значение прочности на сдвиг (+ 25 °С) в соотв. с DIN 53281-83, Мра……….42
Вязкость………………………………………………………………………………………..1.700.000 мПа∙с
Объемная усадка при отверждении. 3
3
Состояние……………………………………………………………………………………………..Шпатлевка
Пропорция смешивания (смола/отвердитель)………………………………………………100:100
Макс. толщина слоя за один рабочий процесс………………………………………………..20 мм
Особенности:
- легко наносится, не требует специального инструмента;
- образует соединение с большинством металлов и бетоном;
- поддается механической обработке;
- устойчив к большинству химических сред.
Примененяется при:
- ремонте металлических частей, поврежденных вследствие износа или усталости;
- исправлении отливок;
- изготовлении сборочных приспособлений и крепеж;
- восстановлении корпусов насосов и арматуры;
- восстановлении валов и подшипников.
Все новости
18.01.2023
Смазка для кофемашин EFELE стала доступна в новой компактной упаковке
Смазка для кофемашин EFELE уже завоевала доверие владельцев кофейных аппаратов благодаря своей непревзойденной эффективности и безопасности. Ее регулярное применение позволяет увеличить срок службы машин и обеспечить их оптимальные рабочие параметры.
Ее регулярное применение позволяет увеличить срок службы машин и обеспечить их оптимальные рабочие параметры.
подробнее
11.01.2023
Водостойкие смазки EFELE позволят погружным электронасосам работать намного дольше
Производители погружных насосов отметили, что смазки EFELE, заложенной при сборке, хватает на весь срок эксплуатации оборудования. Отсутствие необходимости в досмазывании позволяет снизить затраты на обслуживание и избежать простоя техники.
подробнее
Химия гемоглобина и миоглобина
Химия гемоглобина и миоглобинаХимия Гемоглобин и миоглобин
В тот или иной момент каждый испытывал мгновенный
ощущение необходимости остановиться, «отдышаться»,
пока достаточное количество O 2 не сможет абсорбироваться легкими и
транспортируются током крови. Представь, какой будет жизнь
как если бы нам приходилось полагаться только на свои легкие и воду в нашем
крови для транспортировки кислорода через наши тела.
O 2 мало растворим (< 0,0001 M )
в плазме крови при физиологическом рН. Если бы нам пришлось полагаться на
кислород, растворенный в крови в качестве нашего источника кислорода, мы бы
получают примерно 1% кислорода, к которому мы привыкли.
(Подумайте, какой была бы жизнь, если бы количество кислорода, которое вы
полученный был эквивалентен только одному вдоху каждые 5 минут, вместо этого
одного вдоха каждые 3 с.) Эволюция форм жизни даже по мере
сложная как дождевой червь потребовала разработки механизма
активно транспортировать кислород по системе. Наш поток крови
содержит около 150 г/л белка, известного как 
Место, где кислород связывается с гемоглобином и миоглобин представляет собой гем , показанный на рисунке ниже.
В центре гема находится атом Fe(II). Четыре из шести координационные центры вокруг этого атома заняты азотом атомы из плоского кольца порфирина . Пятый Координационный центр занят атомом азота гистидиновой боковой цепи одной из аминокислот в белке. Последний координационный сайт доступен для связывания O 2 молекула. Таким образом, гем является переносчиком кислорода. молекулы гемоглобина и миоглобина. Это поднимает вопрос: Какова функция глобулярного белка или “глобиновая” часть этих молекул?
Структура миоглобина позволяет предположить, что переносчик кислорода
гемовая группа скрыта внутри белковой части этой молекулы,
который не позволяет парам групп гемов сближаться слишком близко друг к другу.
Это важно, потому что этим белкам необходимо связывать O 2 обратимо, а гем Fe(II) сам по себе этого сделать не может. Когда
нет глобина для защиты гема, он реагирует с кислородом на
образуют окисленный атом Fe(III) вместо Fe(II)-O
Когда
нет глобина для защиты гема, он реагирует с кислородом на
образуют окисленный атом Fe(III) вместо Fe(II)-O
Гемоглобин состоит из четырех белковых цепей, каждая из которых размер молекулы миоглобина, которые складываются, образуя структуру, очень похоже на миоглобин. Таким образом, гемоглобин имеет четыре отдельные группы гема, способные связывать молекулу O 2 . Несмотря на то, что расстояние между атомами железа соседних гемов в гемоглобине очень большое от 250 до 370 нм акт связывания О 2 молекула в одном из четырех гемов гемоглобина приводит к значительное увеличение сродства к связыванию O 2 при другие гемы.
Это совместное взаимодействие
 Гемы
слишком далеко друг от друга, чтобы взаимодействовать напрямую. Но изменения, происходящие
в структуре глобина, окружающего гем, когда он
улавливает молекулу O 2 механически передаются
к другим глобинам в этом белке. Эти изменения несут в себе
сигнал, который облегчает усиление или потерю O 2 молекулы другими гемами.
Гемы
слишком далеко друг от друга, чтобы взаимодействовать напрямую. Но изменения, происходящие
в структуре глобина, окружающего гем, когда он
улавливает молекулу O 2 механически передаются
к другим глобинам в этом белке. Эти изменения несут в себе
сигнал, который облегчает усиление или потерю O 2 молекулы другими гемами. Рисунки структур белков часто передают
впечатление неподвижной, жесткой структуры, в которой боковые цепи
отдельные аминокислотные остатки фиксируются в определенном положении.
Нет ничего более далекого от правды. Изменения, которые происходят
в структуре гемоглобина, когда кислород связывается с гемом
настолько велики, что кристаллы деоксигенированного гемоглобина разрушаются при
подвергается воздействию кислорода. Еще одно свидетельство гибкости
белки можно получить, заметив, что в
кристаллические структуры миоглобина и гемоглобина, вдоль которых O 2 молекула может путешествовать, чтобы достичь группы гема. Тот факт, что эти
белки обратимо связывают кислород, предполагает, что они должны пройти
простые изменения их строения изменения
которые были названы дыхательными движениями . которые открывают, а затем закрывают путь, по которому O 2
Молекула перемещается, входя в белок. Компьютер
моделирования движения внутри белков предполагает, что
внутренняя часть белка обладает значительной «текучестью»,
с группами, перемещающимися внутри белка на целых 20 нм.
Тот факт, что эти
белки обратимо связывают кислород, предполагает, что они должны пройти
простые изменения их строения изменения
которые были названы дыхательными движениями . которые открывают, а затем закрывают путь, по которому O 2
Молекула перемещается, входя в белок. Компьютер
моделирования движения внутри белков предполагает, что
внутренняя часть белка обладает значительной «текучестью»,
с группами, перемещающимися внутри белка на целых 20 нм.
Структурно-функциональные отношения гемоглобинов человека
1. Перуц М.Ф., Россманн М.Г., Каллис М.Г., Мюрхед Х., Уилл Г., Норт АСТ Структура гемоглобина. Трехмерный синтез Фурье с разрешением 5,5 Å, полученный с помощью рентгеноструктурного анализа. Природа. 1960; (185): 416–422. [PubMed] [Google Scholar]
2. Инграм В.М. Генные мутации гемоглобина человека: химическая разница между нормальным и серповидноклеточным гемоглобином. Природа. 1957;(180):326–328. [PubMed] [Google Scholar]
Природа. 1957;(180):326–328. [PubMed] [Google Scholar]
3. Эллисон А.С. Защита, обеспечиваемая серповидно-клеточным признаком, против субтертической малярийной инфекции. Br Med J. 1954; (1): 290–294. [PMC free article] [PubMed] [Google Scholar]
4. Perutz MF, Lehmann H. Молекулярная патология гемоглобина человека. Природа. 1968; 219(157):902–909. [PubMed] [Google Scholar]
5. Маренго-Роу А. Гемоглобинопатии. Бр Дж Хосп Мед. 1971; 6: 617–630. [Google Scholar]
6. Перуц М.Ф. Белки и нуклеиновые кислоты: структура и функции. Амстердам: Эльзевир; 1962. С. 35–48. [Google Scholar]
7. Конотей-Ахулу ФИД. Наследственные качественные и количественные дефекты эритроцитов в Гане. Историко-географический обзор. Ghana Med J. 1968; (7): 118–119. [Google Scholar]
8. Херрик Дж. Б. Своеобразные удлиненные и серповидные эритроциты при тяжелой анемии. Arch Intern Med. 1910;6:517. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Bunn HF. Патогенез и лечение серповидноклеточной анемии. N Engl J Med. 1997; 337(11):762–769.. [PubMed] [Google Scholar]
N Engl J Med. 1997; 337(11):762–769.. [PubMed] [Google Scholar]
10. Рафаэль Р.И. Патофизиология и лечение серповидно-клеточной анемии. Clin Adv Hematol Oncol. 2005;3(6):492–505. [PubMed] [Google Scholar]
11. Pauling L, Itano HA, Singer SJ, Wells IC. Серповидноклеточная анемия, молекулярное заболевание. Наука. 1949; (110): 543–548. [PubMed] [Google Scholar]
12. Nagel RL, Platt OS. Общая патофизиология серповидноклеточной анемии. В: Steinberg MH, Forget BG, Higgs DR, редакторы. Нарушения гемоглобина. Кембридж: Издательство Кембриджского университета; 2001. стр. 49.4–526. [Google Scholar]
13. Патаре А., Кинди С.А., Даар С., Деннисон Д. Цитокины при серповидноклеточной анемии. Гематология. 2003;8(5):329–337. [PubMed] [Google Scholar]
14. Hebbel RP, Mohandas N. Клеточная адгезия и микрореология при серповидно-клеточной анемии. В: Steinberg MH, Forget BG, Higgs DR, редакторы. Нарушения гемоглобина. Кембридж: Издательство Кембриджского университета; 2001. стр. 527–549. [Google Scholar]
стр. 527–549. [Google Scholar]
15. Адамс Р. Дж., Брамбилла Д. Оптимизация первичной профилактики инсульта при серповидноклеточной анемии (СТОП 2). Исследователи, прекращающие профилактические переливания, используемые для предотвращения инсульта при серповидноклеточной анемии. N Engl J Med. 2005;353(26):2769–2778. [PubMed] [Google Scholar]
16. Marengo-Rowe AJ, Beale D, Lehmann H. Новый вариант человеческого гемоглобина из южной Аравии: G-Audhali (альфа-23B4 глутаминовая кислота → валин) и вариабельность B4 в человеческом гемоглобине . Природа. 1968;219(159):1164–1166. [PubMed] [Google Scholar]
17. Perutz RR, Ligouri AM, Eirich F. Рентгенологическое исследование и исследование растворимости гемоглобина у пациентов с серповидноклеточной анемией. Природа. 1951; 167 (4258): 929–931. [PubMed] [Google Scholar]
18. Баллас С.К., Смит Э.Д. Изменения эритроцитов во время развития болезненного кризиса серповидноклеточной анемии. Кровь. 1992;79(8):2154–2163. [PubMed] [Google Scholar]
19. Вичинский Е.П. Комплексная помощь при серповидно-клеточной анемии: ее влияние на заболеваемость и смертность. Семин Гематол. 1991;28(3):220–226. [PubMed] [Google Scholar]
Вичинский Е.П. Комплексная помощь при серповидно-клеточной анемии: ее влияние на заболеваемость и смертность. Семин Гематол. 1991;28(3):220–226. [PubMed] [Google Scholar]
20. Национальный институт сердца, легких и крови, Национальный институт здоровья. Лечение серповидноклеточной анемии (публикация NIH № 02-2117). Bethesda, MD: NIH, 2002. Доступно на http://www.nhlbi.nih.gov/health/prof/blood/sickle/; по состоянию на 13 февраля 2006 г.
21. Vermylen C, Cornu G. Трансплантация гемопоэтических стволовых клеток при серповидноклеточной анемии. Карр Опин Гематол. 1997;4(6):377–380. [PubMed] [Google Scholar]
22. Steinberg MH, Barton F, Castro O, Pegelow CH, Ballas SK, Kutlar A, Orringer E, Bellevue R, Olivieri N, Eckman J, Varma M, Ramirez G, Adler B, Smith W, Carlos T, Ataga K, DeCastro L, Bigelow C, Saunthararajah Y, Telfer M, Vichinsky E, Claster S, Shurin S, Bridges K, Waclawiw M, Bonds D, Terrin M. Влияние гидроксимочевины на смертность и заболеваемость в Серповидноклеточная анемия взрослых: риски и преимущества до 9лет лечения. ДЖАМА. 2003; 289(13):1645–1651. [PubMed] [Google Scholar]
ДЖАМА. 2003; 289(13):1645–1651. [PubMed] [Google Scholar]
23. Cokic VP, Smith RD, Beleslin-Cokic BB, Njoroge JM, Miller JL, Gladwin MT, Schechter AN. Гидроксимочевина индуцирует фетальный гемоглобин за счет зависимой от оксида азота активации растворимой гуанилатциклазы. Джей Клин Инвест. 2003;111(2):231–239. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Platt OS, Brambilla DJ, Rosse WF, Milner PF, Castro O, Steinberg MH, Klug PP. Смертность при серповидноклеточной анемии. Продолжительность жизни и факторы риска ранней смерти. N Engl J Med. 1994;330(23):1639–1644. [PubMed] [Google Scholar]
25. Удани М., Зен К., Коттман М., Леонард Н., Джефферсон С., Даймонт С., Траски Г. Молекула адгезии базальных клеток/лютеранский белок. Рецептор, ответственный за адгезию серповидных клеток к ламинину. Джей Клин Инвест. 1998;101(11):2550–2558. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Ataga KI, Orringer EP. Гиперкоагуляция при серповидно-клеточной анемии: любопытный парадокс. Am J Med. 2003;115(9):721–728. [PubMed] [Google Scholar]
Am J Med. 2003;115(9):721–728. [PubMed] [Google Scholar]
27. Вествик Дж., Уотсон-Уильямс Э.Дж., Кришнамурти С., Маркс Г., Эллис В., Скалли М.Ф., Уайт Дж.М., Каккар В.В. Активация тромбоцитов при стационарной серповидно-клеточной анемии. J Мед. 1983;14(1):17–36. [PubMed] [Google Scholar]
28. Westerman MP, Green D, Gilman-Sachs A, Beaman K, Freels S, Boggio L, Allen S, Zuckerman L, Schlegel R, Williamson P. Антифосфолипидные антитела, белки C и S и изменения коагуляции при серповидно-клеточной анемии. J Lab Clin Med. 1999;134(4):352–362. [PubMed] [Google Scholar]
29. Фрэнсис Р.Б., мл. Тромбоциты, коагуляция и фибринолиз при серповидно-клеточной анемии: их возможная роль в окклюзии сосудов. Коагуляционный фибринолиз крови. 1991;2(2):341–353. [PubMed] [Google Scholar]
30. Перуц М.Ф. Стереохимия кооперативных эффектов в гемоглобине. Природа. 1970; 228(5273):726–739. [PubMed] [Google Scholar]
31. Перуц М.Ф., Уилкинсон А.Дж., Паоли М., Додсон Г.Г. Новый взгляд на стереохимический механизм кооперативных эффектов в гемоглобине. Annu Rev Biophys Biomol Struct. 1998; (27): 1–34. [PubMed] [Google Scholar]
Annu Rev Biophys Biomol Struct. 1998; (27): 1–34. [PubMed] [Google Scholar]
32. Charache S, Weatherall DJ, Clegg JB. Полицитемия, ассоциированная с гемоглобинопатией. Джей Клин Инвест. 1966;45(6):813–822. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Botha MC, Beale D, Isaacs WA, Lehmann H. Гемоглобин J Кейптаун-альфа-2 92 аргинин заменен глутамином бета-2. Природа. 1966; 212(64):792–795. [PubMed] [Google Scholar]
34. Джонс Р.Т., Осгуд Э.Е., Бримхолл Б., Колер Р.Д. Гемоглобин Якина. I. Клинико-биохимические исследования. Джей Клин Инвест. 1967; 46 (11): 1840–1847. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Lokich JJ, Moloney WC, Bunn HF, Bruckheimer SM, Ranney HM. Гемоглобин Бригама (α 2 A β 2 100 Pro→Leu). Вариант гемоглобина, связанный с семейным эритроцитозом. Джей Клин Инвест. 1973;52(8):2060–2067. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Адамсон Дж. В., Парер Дж. Т., Стаматояннопулос Г. Эритроцитоз, связанный с гемоглобином Ренье: кислородное равновесие и регуляция костного мозга. Джей Клин Инвест. 1969; 48 (8): 1376–1386. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Т., Стаматояннопулос Г. Эритроцитоз, связанный с гемоглобином Ренье: кислородное равновесие и регуляция костного мозга. Джей Клин Инвест. 1969; 48 (8): 1376–1386. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Bunn HF, Bradley TB, Davis WE, Drysdale JW, Burke JF, Beck WS, Layer MB. Структурно-функциональные исследования гемоглобина Bethesda (α 2 A β 2 l45His ), вариант, связанный с компенсаторным эритроцитозом. Джей Клин Инвест. 1972; 51 (9): 2299–2309. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Дженсен М., Оски Ф.А., Натан Д.Г., Банн Х.Ф. Гемоглобин Syracuse A (α 2 A β 2 143 (h31)His→Pro), новый высокоаффинный вариант, обнаруженный специальными методами электрофореза. Наблюдения за самоокислением нормального и вариантного гемоглобинов. Джей Клин Инвест. 1975;55(3):469–477. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Reissmann KR, Ruth WE, Nomura T. Человеческий гемоглобин с пониженным сродством к кислороду и нарушенными гем-гемовыми взаимодействиями. Джей Клин Инвест. 1961; (40): 1826–1833. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Человеческий гемоглобин с пониженным сродством к кислороду и нарушенными гем-гемовыми взаимодействиями. Джей Клин Инвест. 1961; (40): 1826–1833. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Imamura T, Fujita S, Ohta Y, Hanada M, Yanase T. Гемоглобин Йошизука (G10(108)β-аспарагин→аспарагиновая кислота): новый вариант с пониженное сродство к кислороду из японской семьи. Джей Клин Инвест. 1969;48(12):2341–2348. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Имаи К., Моримото Х., Котани М., Шибата С., Мияджи Т. Исследования функции аномальных гемоглобинов. II. Кислородное равновесие аномальных гемоглобинов: Симоносеки, Убэ II, Хикари, Гифу и Агеноги. Биохим Биофиз Акта. 1970; 200(2):197–202. [PubMed] [Google Scholar]
42. Каррелл Р.В., Леманн Х., Хатчинсон Х.Е. Гемоглобин Колн (β-98 валин → метионин): нестабильный белок, вызывающий анемию с тельцами включения. Природа. 1966; 210(39):915–916. [PubMed] [Google Scholar]
43. Dacie JV, Shinton NK, Gaffney PJ, Jr, Lehmann H. Гемоглобин Хаммерсмит (бета-42 (CDI) Phe заменен на Ser) Nature. 1967;216(5116):663–665. [PubMed] [Google Scholar]
Гемоглобин Хаммерсмит (бета-42 (CDI) Phe заменен на Ser) Nature. 1967;216(5116):663–665. [PubMed] [Google Scholar]
44. Sakuragawa M, Ohba Y, Miyaji T, Yamamoto K, Miwa S. Японский мальчик с гемолитической анемией из-за нестабильного гемоглобина (Hb Bristol) Nippon Ketsueki Gakkai Zasshi. 1984;47(4):896–902. [PubMed] [Google Scholar]
45. Murari J, Smith LL, Wilson JB, Schneider RG, Huisman TH. Некоторые свойства гемоглобина Ган Хилл. Гемоглобин. 1977;1(3):267–282. [PubMed] [Google Scholar]
46. Plaseska D, Dimovski AJ, Wilson JB, Webber BB, Hume HA, Huisman TH. Гемоглобин Монреаль: новый вариант с расширенной бета-цепью из-за делеции Asp, Gly, Leu в положениях 73, 74 и 75 и вставки Ala, Arg, Cys, Gln в том же месте. Кровь. 1991;77(1):178–181. [PubMed] [Google Scholar]
47. Winterbourn CC, Carrell RW. Изучение денатурации гемоглобина и образования телец Гейнца в нестабильных гемоглобинах. Джей Клин Инвест. 1974; 54 (3): 678–689. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Кэти IAB. Явная идиопатическая анемия с тельцами Гейнца. Грейт-Ормонд-стрит, Дж. 1952; (2): 43–48. [Google Scholar]
Кэти IAB. Явная идиопатическая анемия с тельцами Гейнца. Грейт-Ормонд-стрит, Дж. 1952; (2): 43–48. [Google Scholar]
49. Hörlein H, Weber G. Über Chronishce Familiare Metthämoglobinamie und Eine Modification des Methämoglobins. Dtsch Med Wochenschr. 1948;73:476. [PubMed] [Google Scholar]
50. Джеральд П.С., Эфрон М.Л. Химические исследования нескольких разновидностей Hb, M. Proc Natl Acad Sci U S A. 1961; (47): 1758–1767. [PMC free article] [PubMed] [Google Scholar]
51. Stavem P, Stromme J, Lorkin PA, Lehmann H. Гемоглобин M Saskatoon с легким постоянным гемолизом, заметно повышенным сульфаниламидами. Scand J Haematol. 1972;9(6):566–571. [PubMed] [Google Scholar]
52. Hayashi N, Motokawa Y, Kikuchi G. Исследования взаимосвязи между структурой и функцией гемоглобина M-Iwate. Дж. Биол. Хим. 1966;241(1):79–84. [PubMed] [Google Scholar]
53. Хатт П.Дж., Пишотта А.В., Фэрбенкс В.Ф., Тибодо С.Н., Грин М.М. Анализ последовательности ДНК доказывает, что Hb M-Milwaukee-2 обусловлен кодоном 92 гена бета-глобина (CAC → TAC), предполагаемой мутацией Hb M-Hyde Park и Hb M-Akita.
