Таблица менделеева – Электронный учебник K-tree
Электронный учебник
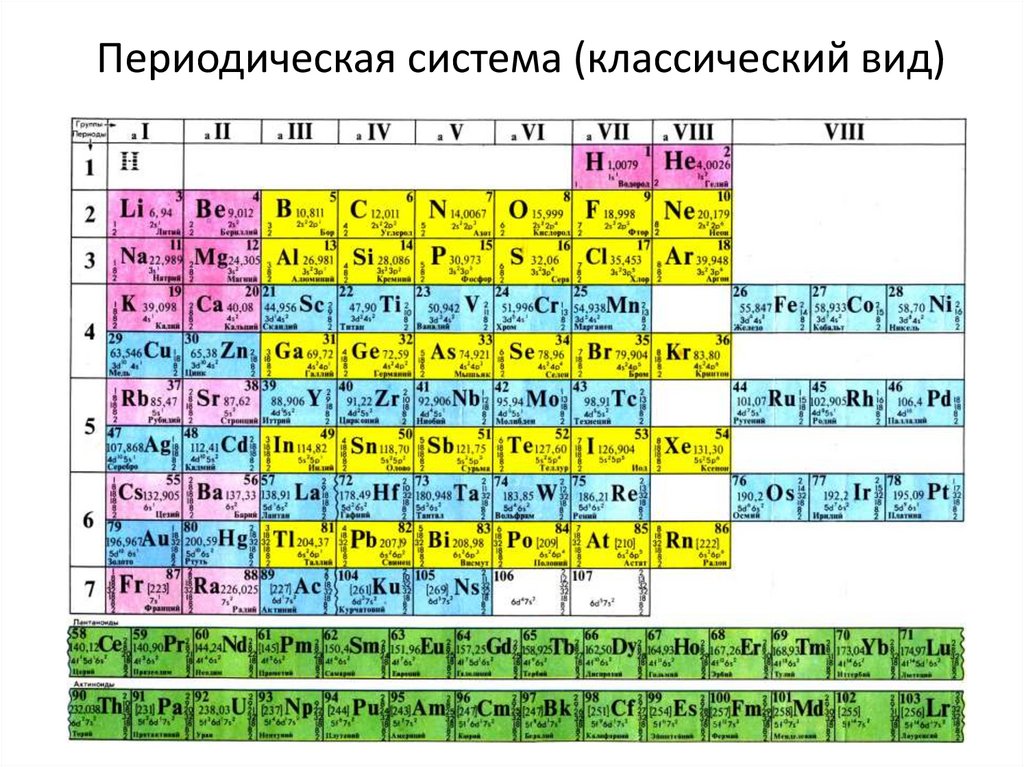
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Ртуть – Таблица Менделева
Ртуть (Hg, от лат. Hydrargyrum) – элемент шестого периода
периодической системы химических элементов Д. И. Менделеева с атомным номером
80, относящийся к подгруппе цинка (побочной подгруппе II группы). Простое вещество ртуть –
переходный металл, при комнатной температуре представляющий собой тяжёлую
серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть – один из
двух химических элементов (и единственный металл), простые вещества которых при
нормальных условиях находятся в жидком агрегатном состоянии (второй такой
элемент – бром).
Ртуть известна с древних времен. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твердость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 г. Для представления элемента как у алхимиков, так и в нынешнее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства: ковкость, электропроводность и др.
Ртуть – вещество первого класса опасности. Является переходным металлом,
представляющим собой серебристо-белую жидкость с тяжелой массой, пары которой
очень ядовиты (в условиях привычной температуры жилых помещений).
Ртуть Hg, химический элемент II группы периодичной системы, атомное число 80, атомная масса 200,59. Природная ртуть состоит из семи стабильных изотопов: 196Hg (0,146%), 198Hg (10,02%), 199Hg (16,84%), 200Hg (23,13%), 201Hg (13,22%), 202Hg (29,80%), 204Hg (6,85%). Поперечное сечение захвата тепловых нейтронов для природной смеси изотопов 38·10-27м2. Конфигурация внешних электронных оболочек атома 5s25p65d106s2; степень окисления + 1 и + 2; энергии ионизации Hg0:Hg+:Hg2+:Hg3+ соответственно 10,4376, 18,756 и 34,2 эВ; сродство к электрону – 0,19 эВ; работа выхода электрона 4,52 эВ; электроотрицательность по Полингу 1,9; атомный радиус 0,155 нм, ковалентный радиус 0,149 нм, ионный радиус (в скобках указано координационное число) Hg+ 0,111 нм (3), 0,133 нм (6), Hg2+ 0,083 нм (2), 0,110 нм (4), 0,116 нм (6), 0,128нм (8).
Для ртути характерны две степени
окисления: +1 и +2. В степени окисления +1 ртуть представляет собой
двухъядерный катион Hg22+ со
связью металл-металл. Ртуть – один из немногих металлов, способных формировать
такие катионы, и у ртути они – самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании и подщелачивании.
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся.
На холоде ртуть +2 и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I).
В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10−4моль/л) растворах. В более концентрированных растворах он дегидратируется
В очень концентрированной щелочи оксид ртути частично растворяется с образованием гидроксокомплекса
Ртуть в степени окисления +2 образует уникально прочные комплексы со
многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом
(-1), серой (-2) и углеродом она образует очень прочные ковалентные связи.
Из элементов IIБ группы именно у ртути появляется возможность разрушения очень устойчивой 6d10 – электронной оболочки, что приводит к возможности существования соединений ртути(IV), но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, при взаимодействии атомов ртути и смеси неона и фтора при температуре 4К получен HgF4.
Ртуть – единственный металл, который находится в жидком состоянии при комнатной температуре. Температура плавления составляет 234,32 K (-38,83 °C),кипит при 629,88 K (356,73 °C), критическая точка –1750 K (1477 °C), 152 МПа (1500 атм). Обладает свойствами диамагнетика. Образует со многими металлами жидкие и твёрдые сплавы – амальгамы. Стойкие к амальгамированию металлы: V, Fe, Mo, Cs, Nb, Ta, W, Co .
Плотность ртути при
нормальных условиях – 13 500 кг/м3.
Таблица 1 – Зависимость плотности от температуры
Температура в °С | ρ, 103 кг/м3 | Температура в °С | ρ, 103 кг/м3 |
0 | 13,5951 | 50 | 13,4723 |
5 | 13,5827 | 55 | 13,4601 |
10 | 13,5704 | 60 | 13,4480 |
15 | 13,5580 | 65 | 13,4358 |
20 | 13,5457 | 70 | 13,4237 |
25 | 13,5335 | 75 | 13,4116 |
30 | 13,5212 | 80 | 13,3995 |
35 | 13,5090 | 90 | 13,3753 |
40 | 13,4967 | 100 | 13,3514 |
45 | 13,4845 | 300 | 12,875 |
Простое вещество ртуть (CAS-номер: 7439-97-6) – переходный металл, при комнатной
температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой
чрезвычайно ядовиты. Ртуть – один из двух химических элементов (и единственный
металл), простые вещества которых при нормальных условиях находятся в жидком
агрегатном состоянии (второй элемент – бром).
Ртуть – один из двух химических элементов (и единственный
металл), простые вещества которых при нормальных условиях находятся в жидком
агрегатном состоянии (второй элемент – бром).
Ртуть получают путём восстановления из её наиболее распространённого минерала – киновари.
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия вовладениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмдена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI–IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.
Ртуть – относительно редкий элемент в земной коре со средней концентрацией
83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее
распространёнными в земной коре элементами, ртутные руды могут быть очень
концентрированными по сравнению с обычными породами. Наиболее богатые ртутью
руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе – рассеянная,
и только 0,02 % её заключено в месторождениях. Содержание ртути в различных
типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород
максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т).
В водах Мирового океана содержание ртути – 0,1 мкг/л. Важнейшей геохимической
особенностью ртути является то, что среди других халькофильных элементов она
обладает самым высоким потенциалом ионизации. Это определяет такие свойства
ртути, как способность восстанавливаться до атомарной формы (самородной ртути),
значительную химическую стойкость к кислороду и кислотам.
Однако ввиду того, что ртуть слабо связывается химически с наиболее
распространёнными в земной коре элементами, ртутные руды могут быть очень
концентрированными по сравнению с обычными породами. Наиболее богатые ртутью
руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе – рассеянная,
и только 0,02 % её заключено в месторождениях. Содержание ртути в различных
типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород
максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т).
В водах Мирового океана содержание ртути – 0,1 мкг/л. Важнейшей геохимической
особенностью ртути является то, что среди других халькофильных элементов она
обладает самым высоким потенциалом ионизации. Это определяет такие свойства
ртути, как способность восстанавливаться до атомарной формы (самородной ртути),
значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно
высокие её содержания (до тысячных и сотых долей процента) устанавливаются в
блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов
двухвалентной ртути и кальция, одновалентной ртути и бария определяет их
изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда
замещается селеном или теллуром; содержание селена часто составляет сотые и
десятые доли процента. Известны крайне редкие селениды ртути – тиманит (HgSe) и онофрит (смесь
тиманита и сфалерита).
Близость ионных радиусов
двухвалентной ртути и кальция, одновалентной ртути и бария определяет их
изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда
замещается селеном или теллуром; содержание селена часто составляет сотые и
десятые доли процента. Известны крайне редкие селениды ртути – тиманит (HgSe) и онофрит (смесь
тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В поверхностных условиях киноварь и металлическая ртуть не растворимы
в воде, но при их наличии (Fe2(SO4)3,
озон, пероксид водорода) растворимость этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах едких щелочей с образованием,
например, комплекса HgS•nNa2S. Ртуть легко сорбируется
глинами, гидроокислами железа и марганца, глинистыми сланцами и углями.
Особенно хорошо растворяется ртуть в сульфидах едких щелочей с образованием,
например, комплекса HgS•nNa2S. Ртуть легко сорбируется
глинами, гидроокислами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное
значение имеет киноварь HgS
(86,2 % Hg). В редких
случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда – шватцит
(до 17 % Hg). На
единственном месторождении Гуитцуко (Мексика) главным рудным минералом является
ливингстонит HgSb4S7. В зоне
окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся,
прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же
первичных минералов большей чистотой состава. Относительно распространена
каломель Hg2Cl2. На
месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные
соединения – терлингуаит Hg2ClO, эглестонит Hg4Cl.
Медицина
В связи с высокой токсичностью ртуть почти полностью вытеснена из медицинских препаратов. Её соединения (в частности, мертиолят) иногда используются в малых количествах как консервант для вакцин. Сама ртуть сохраняется в ртутных медицинских термометрах (один медицинский термометр содержит до 2 г ртути).
Однако вплоть до 1970-х годов соединения ртути использовались в медицине очень активно:
● хлорид ртути (I) (каломель) – слабительное;
● меркузал и промеран – сильные мочегонные;
● хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) – антисептики (в том числе в составе мазей).
Известны случаи, когда при завороте кишок больному вливали в желудок стакан ртути. По мнению древних врачевателей, предлагавших такой метод лечения, ртуть благодаря своей тяжести и подвижности должна была пройти по кишечнику и под своим весом расправить его перекрутившиеся части.
Амальгаму серебра применяли в стоматологии в качестве материала
зубных пломб до появления светоотверждаемых материалов.
Ртуть-203 (T1/2 = 53 сек) используется в радиофармакологии.
Техника
● Ртуть используется как рабочее тело в ртутных термометрах (особенно высокоточных), так как (а) обладает довольно широким диапазоном, в котором находится в жидком состоянии, (б) её коэффициент термического расширения почти не зависит от температуры и (в) обладает сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для низкотемпературных термометров.
● Парами ртути заполняют люминесцентные лампы, поскольку пары светятся в тлеющем разряде. В спектре испускания паров ртути много ультрафиолетового света и, чтобы преобразовать его в видимый, стекло люминесцентных ламп изнутри покрывают люминофором. Без люминофора ртутные лампы являются источником жесткого ультрафиолета (254 нм), в каковом качестве и используются. Такие лампы делают из кварцевого стекла, пропускающего ультрафиолет, поэтому они называются кварцевыми.
●
Ртутные электрические вентили
(игнитроны) в мощных выпрямительных устройствах, электроприводах,
электросварочных устройствах, тяговых и выпрямительных подстанциях и т. п.[18] со
средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
п.[18] со
средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
● Ртуть и сплавы на её основе используются в герметичных выключателях, включающихся при определённом положении.
● Ртуть используется в датчиках положения.
● В некоторых химических источниках тока (например, ртутно-цинковых), в эталонных источниках напряжения (Нормальный элемент Вестона).
● Ртуть также иногда применяется в качестве рабочего тела в тяжелонагруженных гидродинамических подшипниках.
● Ртуть ранее входила в состав некоторых биоцидных красок для предотвращения обрастания корпуса судов в морской воде. Сейчас запрещается использовать такого типа покрытия.
● Иодид ртути(I) используется как полупроводниковый детектор радиоактивного излучения.
● Фульминат ртути(II) («гремучая ртуть») издавна применяется в качестве инициирующего ВВ (Детонаторы).
●
Бромид ртути(I) применяется при термохимическом
разложении воды на водород и кислород (атомно-водородная энергетика).
● Перспективно использование ртути в сплавах с цезием в качестве высокоэффективного рабочего тела в ионных двигателях.
● До середины 20 века ртуть широко применялась в барометрах и манометрах.
● Ртутные вакуумные насосы были основными источниками вакуума в 19 и начале 20 веков.
● Ранее ртуть использовали для золочения поверхностей методом амальгамирования, однако в настоящее время от этого метода отказались из-за токсичности ртути.
● Соединения ртути использовались в шляпном производстве для выделки фетра.
Металлургия
● Металлическая ртуть применяется для получения целого ряда важнейших сплавов.
● Ранее различные амальгамы металлов, особенно золота и серебра, широко использовались в ювелирном деле, в производстве зеркал.
●
Металлическая ртуть служит катодом
для электролитического получения ряда активных металлов, хлора и щелочей. Сейчас
вместо ртутных катодов используют электролиз с диафрагмой.
● Ртуть используется для переработки вторичного алюминия (см. амальгамация)
● Ртуть хорошо смачивает золото, поэтому ей обрабатывают золотоносные глины для выделения из них этого металла. Эта технология распространена, в частности, в Амазонии.
Химическая промышленность
● Соли ртути использовали в качестве катализатора промышленного получения ацетальдегида из ацетилена (реакция Кучерова), однако в настоящее время ацетальдегид получают прямым каталитическим окислением этана или этена.
● Реактив Несслера используется для количественного определения аммиака.
Сельское хозяйство
Высокотоксичные соединения ртути – каломель, сулему, мертиолят и другие – используют для протравливания семенного зерна и в качестве пестицидов.
Запрет использования ртутьсодержащей продукции
С 2020 года международная
конвенция, названная в честь массового отравления ртутью и подписанная многими
странами, запретит производство, экспорт и импорт нескольких различных видов
ртутьсодержащих продукции применяемой в быту, в том числе электрических
батарей, электрических выключателей и реле, некоторых видов компактных
люминесцентных ламп (КЛЛ), люминесцентных ламп с холодным катодом или с внешним
электродом, ртутных термометров и приборов измерения давлении. Конвенция вводит
регулирование использования ртути и ограничивает ряд промышленных процессов и
отраслей, в том числе горнодобывающую (особенно непромышленную добычу золота),
производство цемента.
Конвенция вводит
регулирование использования ртути и ограничивает ряд промышленных процессов и
отраслей, в том числе горнодобывающую (особенно непромышленную добычу золота),
производство цемента.
Демеркуризация
Очистка помещений и предметов от загрязнений металлической ртутью и источников ртутных паров называется демеркуризацией. В быту широко применяется демеркуризация с помощью серы и хлорного железа FeCl3.
Гигиеническое нормирование концентраций ртути
Предельно допустимые уровни загрязнённости металлической ртутью и её парами:
● ПДК в населённых пунктах (среднесуточная) – 0,0003 мг/м³
● ПДК в жилых помещениях (среднесуточная) – 0,0003 мг/м³
● ПДК воздуха в рабочей зоне (макс. разовая) – 0,01 мг/м³
● ПДК воздуха в рабочей зоне (среднесменная) – 0,005 мг/м³
● ПДК сточных вод (для неорганических соединений в пересчёте на двухвалентную ртуть) – 0,005 мг/л
● ПДК водных объектов хозяйственно-питьевого и культурного водопользования, в воде водоёмов – 0,0005 мг/л
● ПДК морских водоёмов – 0,0001 мг/л
1. Ртуть //Материал из Википедии – свободной энциклопедии.
Ртуть //Материал из Википедии – свободной энциклопедии.
2. Ртуть // химик.
3. Ртуть //Глоссарий. Химия.
Mercury (Hg) – Chemical properties, Health and Environmental effects
- Home
- Periodic table
- Elements
- Mercury
|
Ртуть является единственным жидким металлом при обычных температурах. Наиболее важными солями ртути являются хлорид ртути HgCl 2 (коррозионная сулема – сильнодействующий яд), хлорид ртути Hg 2 Cl 2 (каломель, до сих пор иногда используется в медицине), гремучая ртуть (Hg(ONC) 2 , детонатор, используемый во взрывчатых веществах) и сульфид ртути (HgS, киноварь, высококачественный пигмент для краски). Применение Ртутный металл имеет множество применений. Из-за своей высокой плотности он используется в барометрах и манометрах. Он широко используется в термометрах благодаря высокой скорости теплового расширения, которая остается довольно постоянной в широком диапазоне температур. Его легкость в слиянии с золотом используется при извлечении золота из его руд. Промышленность использует металлическую ртуть в качестве жидкого электрода при производстве хлора и гидроксида натрия путем электролиза рассола. Ртуть до сих пор используется в некоторых электрических устройствах, таких как переключатели и выпрямители, которые должны быть надежными, а также для промышленного катализа. В настоящее время в бытовых батареях и флуоресцентном освещении используется гораздо меньше ртути, но полностью она не устранена. Соединения ртути имеют множество применений. Каломель (хлорид ртути, Hg 2 Cl 2 ) используется как эталон в электрохимических измерениях и в медицине как слабительное. Хлорид ртути (коррозионная сулема, HgCl 2 ) используется как инсектицид, в крысином яде и как дезинфицирующее средство. Оксид ртути используется в кожных мазях. Сульфат ртути используется в качестве катализатора в органической химии. Вермильон, красный пигмент, представляет собой сульфид ртути; другая кристаллическая форма сульфида (также используемого в качестве пигмента) имеет черный цвет. Ртуть в окружающей среде Ртуть в ограниченном количестве встречается в природе в несвязанном виде. Он редко встречается в природе в свободном виде и встречается в основном в киноварной руде (HgS) в Испании, России, Италии, Китае и Словении. Мировое производство ртути составляет около 8000 тонн в год. Извлекаемые запасы составляют около 600 000 тонн. Ртуть — это соединение, которое естественным образом встречается в окружающей среде. Его можно найти в металлической форме, в виде солей ртути или в виде органических соединений ртути. Ртуть попадает в окружающую среду в результате нормального распада минералов в горных породах и почве под воздействием ветра и воды. Выбросы ртути из природных источников на протяжении многих лет остаются практически неизменными. Тем не менее концентрации ртути в окружающей среде растут; это приписывается деятельности человека. Ртуть в природе не содержится в пищевых продуктах, но она может попасть в пищу, поскольку может распространяться в пищевых цепочках более мелкими организмами, потребляемыми людьми, например, через рыбу. Концентрации ртути в рыбе обычно значительно превышают концентрации в воде, в которой они живут. Продукты животноводства также могут содержать значительное количество ртути. Ртуть обычно не содержится в растительных продуктах, но она может попадать в организм человека через овощи и другие культуры, когда в сельском хозяйстве применяются аэрозоли, содержащие ртуть.
Для получения дополнительных эффектов на экосистему пресной воды. Посмотрите на Меркурий в пресной воде . Серебро Алюминий Americium Argon Arsenic Astatine Gold Boron Barium Beryllium Bohrium Bismuth Berkelium Bromine Carbon Calcium Cadmium Cerium Калифорний Хлор Кюрий Кобальт Хром Цезий Медь Дубний Darmstadtium Dysprosium Erbium Einsteinium Europium Fluorine Iron Fermium Francium Gallium Gadolinium Germanium Hydrogen Helium Hafnium Holmium Хассий Йод Индий Иридий Калий Криптон Лантан Lithium Lawrencium Lutetium Mendelevium Magnesium Manganese Molybdenum Meitnerium Nitrogen Sodium Niobium Neodymium Neon Nickel Nobelium Neptunium Кислород Осмий Фосфор Протактиний Свинец Палладий Promethium Polonium Praseodymium Platinum Plutonium Radium Rubidium Rhenium Rutherfordium Roentgenium Rhodium Radon Ruthenium Sulfur Antimony Scandium Селен Сиборгий Кремний Самарий Олово Стронций Тантал Тербий Технеций Теллур Торий РтутьЗона данных | Открытие | Факты | Внешний вид и характеристики | Использование | Изобилие и изотопы | Ссылки 80 Hg 200. Химический элемент ртуть классифицируется как переходный металл. Оно известно с древних времен. Его первооткрыватель и дата открытия неизвестны. Зона данных
Окисление, Реакции, Соединения, Радиусы, Проводимости”>Показать больше, в том числе: Теплота, Энергия,
Капли ртути. Гебер, Джабир ибн Хайян, родился в Персии (Иране) в 6 веке нашей эры. Гебер систематизировал и привнес в алхимию экспериментальные методы. Он считал, что все металлы основаны на ртути, смешанной в разных пропорциях и разной чистоте с серой. Если бы ртуть и сера были совершенно чистыми и смешаны в идеальных пропорциях, они образовали бы золото. (10a) Открытие МеркурияДоктор Дуг Стюарт Ртуть или ртуть известна с древних времен. Мы не знаем, кто его обнаружил. Меркурий был известен древним китайцам, египтянам и индусам и был найден в египетских гробницах, датируемых примерно 1500 г. до н.э. (1), (2), (3) В четвертом веке до н.э. мы находим, что Аристотель письменно называет ртуть «гидро-аргирос», что переводится как «жидкое серебро» или «вода-серебро». (4) Римляне немного изменили греческое название, назвав ртуть Hydragyrum, от которого мы получили современный химический символ ртути Hg. Современное название элемента было дано алхимиками. Алхимики наблюдали за быстрым жидким потоком элемента и сравнивали его с самой быстро движущейся планетой, Меркурием. (Планета была названа в честь быстро движущегося римского посланника богов Меркурия. (3) ) Алхимики считали ртуть самой важной из всех субстанций, поскольку она заключала в себе твердое и жидкое, землю и небо, жизнь и жизнь. смерть. Они также считали, что это открывает путь, по которому неблагородные металлы могут стать золотом, и представляет собой квинтэссенцию свойства текучести. (5),(6) Конечно, ошиблись! Китайские императоры использовали ртуть для продления жизни (3) – хотя, по всей вероятности, это имело обратный эффект. (Несмотря на тот факт, что в настоящее время известно, что ртуть очень токсична, некоторые традиционные китайские лекарства по-прежнему содержат большое количество ртути. (7), (8) ) В Санкт-Петербурге твердая ртуть была получена путем замораживания ртутного термометра в смеси снега и концентрированной азотной кислоты. В 1772 и 1774 годах шведский ученый Карл В. Шееле и английский химик Джозеф Пристли нагревали оксид ртути и обнаружили, что он дает газ, благодаря которому свеча горит в пять раз быстрее, чем обычно — они открыли кислород. (9) Пристли открыл несколько газов, таких как закись азота (веселящий газ), потому что он собирал их над ртутной ванной вместо более обычной воды. В отличие от воды, ртуть не растворяла газы, оставляя их доступными для обнаружения. (10) Английский химик Хамфри Дэви использовал ртуть в других исследованиях. Например, Дэви впервые выделил кальций, используя ртутный электрод для образования амальгамы с кальцием.
Пушечное ядро плавает в ртутной ванне. youtube.com/embed/wPYysvKqwus?rel=0″ allowfullscreen=””>Киноварь (ртутная руда) перерабатывается для получения жидкой ртути. Ртуть замораживается в твердый металл с использованием ацетона/сухого льда. Внешний вид и характеристикиВредное воздействие: Ртуть и большинство ее соединений высокотоксичны. Чистый металл легко всасывается при вдыхании, приеме внутрь или через кожу. Это также хронический загрязнитель, и ртуть концентрируется в тканях животных/рыб во все возрастающих количествах по пищевой цепочке. Характеристики: Ртуть — плотный серебристо-белый ядовитый металл с зеркальным видом. Это единственный распространенный металл, который находится в жидком состоянии при комнатной температуре. Ртуть медленно испаряется при комнатной температуре. Другими металлами, которые находятся в жидком состоянии при комнатной температуре, являются галлий, франций и цезий. Металл относительно стабилен в сухом воздухе, но во влажном воздухе медленно тускнеет, образуя серое оксидное покрытие. Ртуть имеет высокое поверхностное натяжение и при проливании распадается на мельчайшие шарики. Ртуть легко образует сплавы (так называемые амальгамы) с другими металлами, такими как серебро, золото и олово. Поскольку ртуть не соединяется с железом, ее часто хранят в железных контейнерах. Использование ртутиРтуть используется в барометрах и манометрах (приборах для измерения давления газов и жидкостей) из-за ее высокой плотности. Этот металл также имеет высокую скорость почти линейного теплового расширения, поэтому он широко используется в термометрах. Легкость амальгамирования с металлами используется при извлечении золота, серебра и платины из руд. Ртуть широко используется при изготовлении рекламных вывесок, ртутных выключателей и других электрических устройств. Он также используется в ртутных лампах (которые излучают свет, насыщенный ультрафиолетовым излучением). Различные соединения ртути используются в медицине, стоматологии, косметике (тушь для ресниц), а также в сельском хозяйстве для изготовления фунгицидов. Изобилие и изотопыИзобилие в земной коре: 85 частей на миллиард по массе, 9 частей на миллиард по молям Изобилие в Солнечной системе: 20 частей на миллиард по массе, 120 частей на триллион по молям Стоимость в чистом виде: 48 долларов США за 100 г Стоимость, оптом: 1,74 доллара США за 100 г Источник: Ртуть редко встречается в природе в свободном виде, но ее можно найти в рудах, в основном сульфид ртути (киноварь, HgS). Металл извлекается путем обжига киновари в токе воздуха. Образовавшиеся пары ртути конденсируют для сбора жидкого металла. Изотопы: Ртуть имеет 34 изотопа, периоды полураспада которых известны, с массовыми числами от 175 до 208. Встречающаяся в природе ртуть представляет собой смесь семи изотопов, и они находятся в указанных процентах: 196 Hg (0,2%), 198 Hg (10,0%), 199 Hg (16,9%), 200 Hg (23,1%), 201 Hg (13,2%), 30 29,9%) и 204 рт. Ссылки
|

 6 °C
6 °C Ртуть иногда называют ртутью. Это тяжелый серебристо-белый жидкий металл. Это довольно плохой проводник тепла по сравнению с другими металлами, но хороший проводник электричества. Он легко сплавляется со многими металлами, такими как золото, серебро и олово. Эти сплавы называются амальгамами.
Ртуть иногда называют ртутью. Это тяжелый серебристо-белый жидкий металл. Это довольно плохой проводник тепла по сравнению с другими металлами, но хороший проводник электричества. Он легко сплавляется со многими металлами, такими как золото, серебро и олово. Эти сплавы называются амальгамами.
 Гремучая ртуть Hg(CNO) 2 используется в качестве детонатора.
Гремучая ртуть Hg(CNO) 2 используется в качестве детонатора.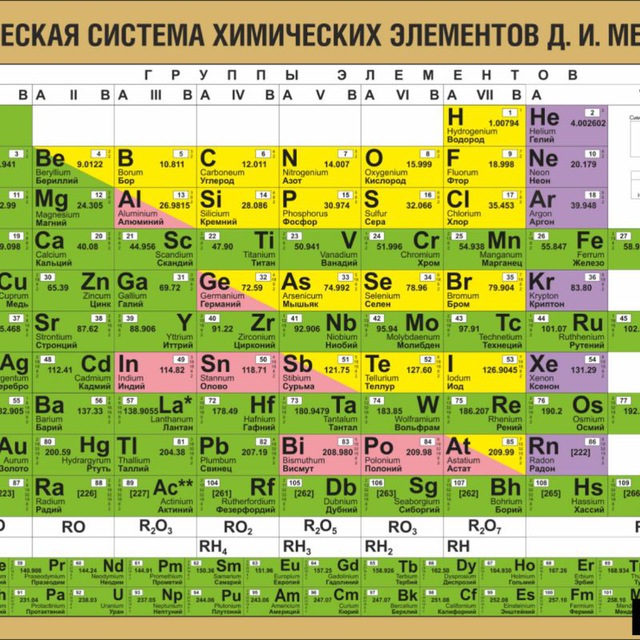 Некоторые формы человеческой деятельности выбрасывают ртуть непосредственно в почву или воду, например, при внесении сельскохозяйственных удобрений и сбросе промышленных сточных вод. Вся ртуть, выбрасываемая в окружающую среду, в конечном итоге попадает в почву или поверхностные воды.
Некоторые формы человеческой деятельности выбрасывают ртуть непосредственно в почву или воду, например, при внесении сельскохозяйственных удобрений и сбросе промышленных сточных вод. Вся ртуть, выбрасываемая в окружающую среду, в конечном итоге попадает в почву или поверхностные воды.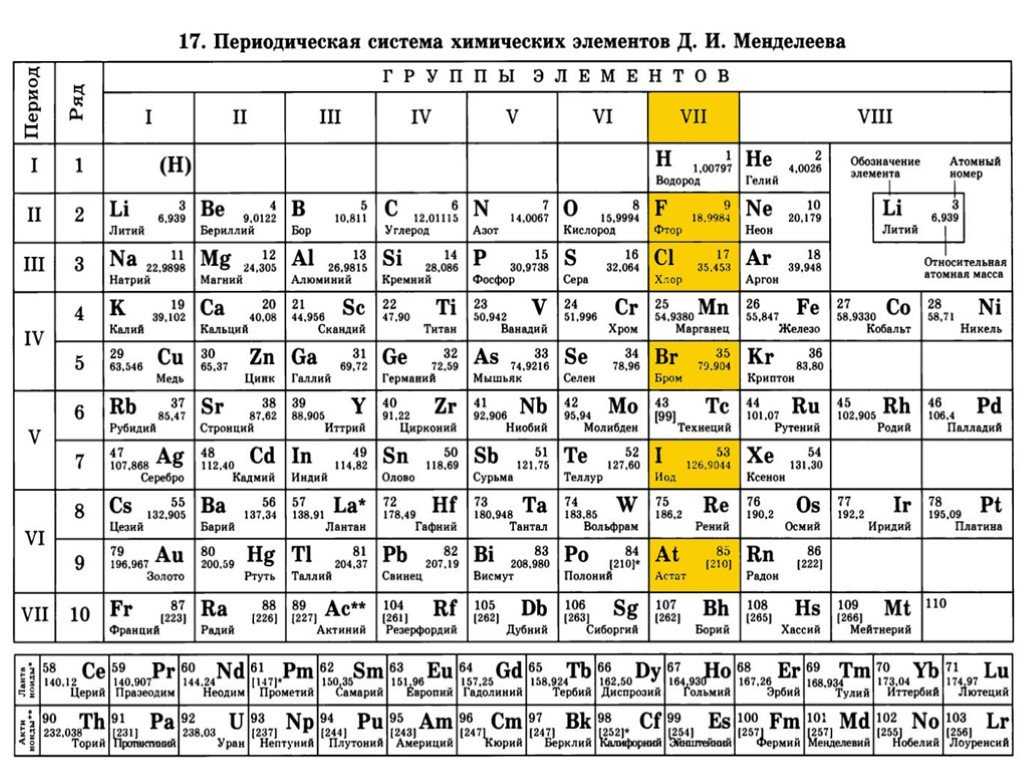 Ртуть в этих устройствах задерживается и обычно не вызывает проблем со здоровьем. Однако, когда термометр сломается, в течение короткого периода времени будет происходить значительное воздействие ртути при дыхании, пока она испаряется. Это может привести к вредным последствиям, таким как повреждение нервов, головного мозга и почек, раздражение легких, раздражение глаз, кожная сыпь, рвота и диарея.
Ртуть в этих устройствах задерживается и обычно не вызывает проблем со здоровьем. Однако, когда термометр сломается, в течение короткого периода времени будет происходить значительное воздействие ртути при дыхании, пока она испаряется. Это может привести к вредным последствиям, таким как повреждение нервов, головного мозга и почек, раздражение легких, раздражение глаз, кожная сыпь, рвота и диарея. Известно, что хромосомные повреждения вызывают монголизм.
Известно, что хромосомные повреждения вызывают монголизм.
 6
6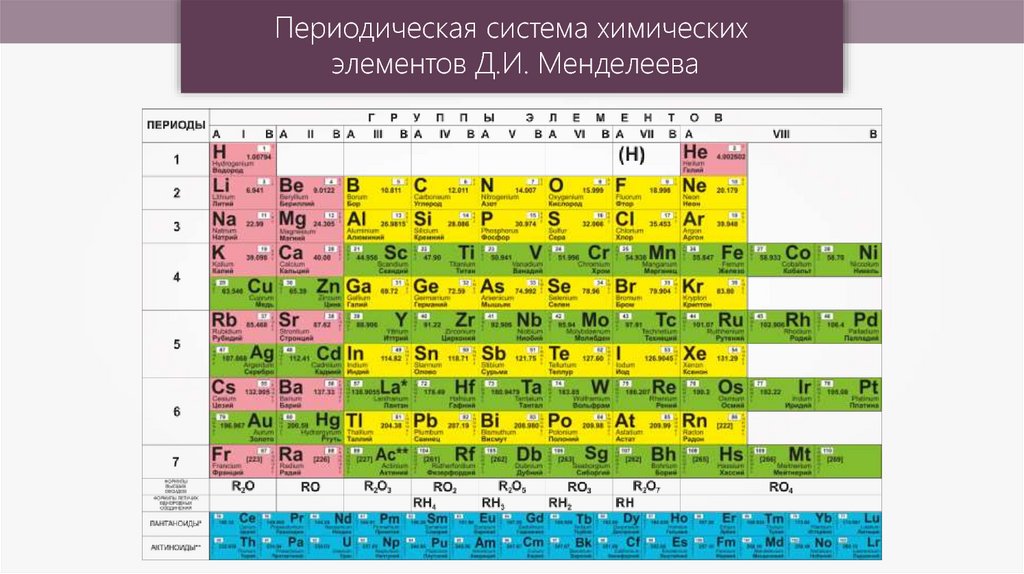 общее окисление нет.
общее окисление нет.
