Смартфоны выбивают элементы из таблицы Менделеева
27 февраля 2019, 21:06
Технологии
Фото: biboroda.livejournal.com/profile
Таблице Менделеева в нынешнем году исполняется 150 лет. К этой годовщине Европейское химическое сообщество опубликовало таблицу в необычном виде, чтобы показать, какие химические элементы находятся под угрозой из-за чрезмерного использования. Многие из них пока незаменимы в производстве электроники.
Сокращение запасов химических элементов даже страшнее, чем сокращение популяций редких растений и животных. Живая природа, как известно, ресурс исчерпаемый но восстановимый – если запретить охоту на тех же зубров или бобров – их численность восстанавливается, как это произошло за последние 100 лет. А вот если, например, выработать все местрождения индия – новых уже никак не появится.
“Только 90 химических элементов встречаются в природе, – пишет в своём Живом Журнале Анатолий Андросюк. – Остальные в основном представляют собой быстро распадающиеся сверхтяжелые вещества, созданные в лабораториях в результате ядерных реакций.
Сами по себе химические элементы не исчезают, но по мере использования становятся более рассеянными, с трудом поддаются восстановлению. В новой таблице такие элементы обозначены красным. Оранжевый цвет указывает на приближающуюся угрозу, связанную с растущим использованием, желтым обозначены элементы с ограниченной доступностью, зеленым — самые распространенные.
Фото:biboroda.livejournal.com/profile
По прогнозам химиков, через 100 лет дефицитом станет гелий (He), серебро (Ag), теллур (Te), галлий (Ga), германий (Ge), стронций (Sr), иттрий (Y), цинк (Zn), индий (In), мышьяк (As), гафний (Hf) и тантал (Ta). Четыре элемента — олово (Sn), тантал (Ta), вольфрам (W) и золото (Au) — окрашены черным, поскольку они относятся к “конфликтным минералам” и часто добываются в странах, в которых ведутся войны. Создатели новой таблицы напоминают, что производители должны тщательно отслеживать их происхождение и не использовать материалы, поставленные ценой человеческих жизней.
31 из 90 элементов в новой таблице обозначены символом смартфона. Это означает, что все они содержатся в наших гаджетах — включая 4 элемента из “конфликтных минералов” и 6 из уязвимой группы. Например, индий (In), окрашенный в таблице красным, входит в состав ЖК-экранов телевизоров, мониторов и сенсорных экранов смартфонов. Этот элемент становится все более рассеянным, и если в ближайшие 20 лет не сделать ничего для сохранения его запасов, потребительская электроника очень подорожает.
Это означает, что все они содержатся в наших гаджетах — включая 4 элемента из “конфликтных минералов” и 6 из уязвимой группы. Например, индий (In), окрашенный в таблице красным, входит в состав ЖК-экранов телевизоров, мониторов и сенсорных экранов смартфонов. Этот элемент становится все более рассеянным, и если в ближайшие 20 лет не сделать ничего для сохранения его запасов, потребительская электроника очень подорожает.
Индий повторно добывают из экранов старых смартфонов, телевизоров и мониторов, но на переработку попадает лишь малая часть электронного мусора. При этом в одной только Европе каждый месяц продается более 10 млн новых смартфонов.
“Можно ли оправдать смену телефона каждые два года, глядя на эту периодическую таблицу и учитывая ценность многих ее элементов? – пишет химик Дэвид Коул-Гамильтон из Университета Сент-Эндрюс (Шотландия) в колонке для The Conversation. – Мы должны сделать все возможное для сохранения и переработки 90 элементов – драгоценных строительных блоков, составляющих наш мир.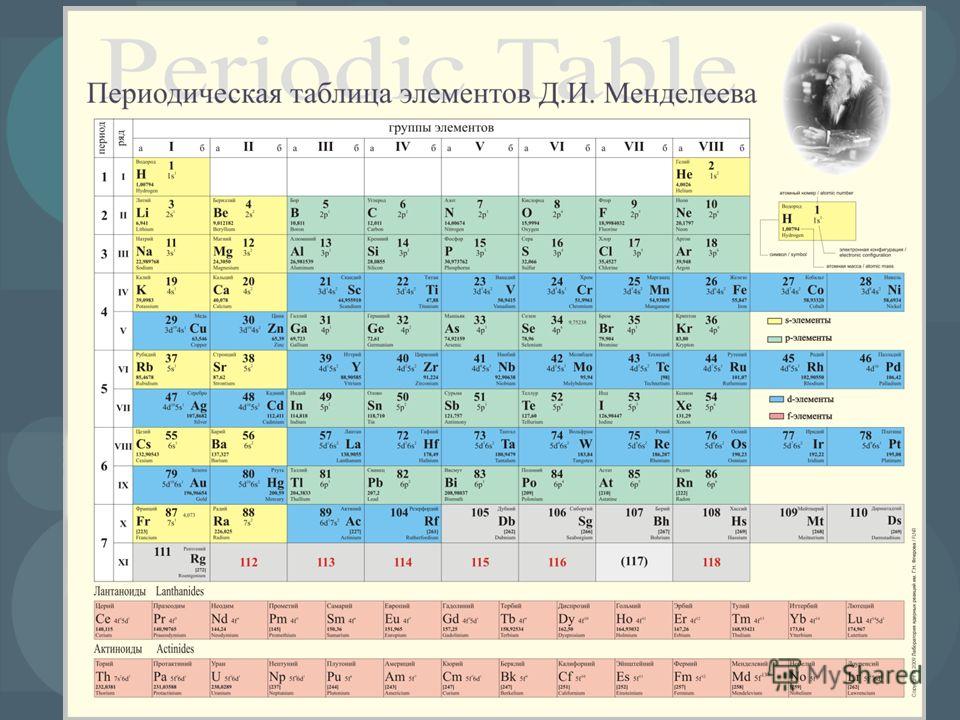 Иначе многие из объектов и технологий, которые сегодня воспринимаются как должное, через несколько поколений станут реликвиями, либо дефицитом, доступным только для богатых людей”.
Иначе многие из объектов и технологий, которые сегодня воспринимаются как должное, через несколько поколений станут реликвиями, либо дефицитом, доступным только для богатых людей”.
Материалы по теме:
В российской армии могут запретить смартфоны
Роскачество назвало самые прочные и непотопляемые смартфоны
Осторожно, Китай: смартфоны из Поднебесной шпионят по всему миру
Технологии
Нашли опечатку в тексте? Выделите её и нажмите ctrl+enter
Химические элементы их год открытия и ученые их открывшие (Таблица)
В справочной таблице, кроме порядкового номера элементов, их символа, названия и атомного веса, даны еще краткие исторические справки: кто и когда открыл тот или другой элемент. Указанные в таблице даты отвечают преимущественно тем годам, когда элементы были получены в чистом виде, т. е. в металлическом или свободном состоянии, а не в виде химических соединений; приводится также имя ученого, который впервые этого достиг. Дополнительные указания по этим вопросам для некоторых элементов даны в примечаниях к таблице. Введенное в таблице сокращение «Изв. с др.» означает «известны с древнего времени», остальные сокращения понятны.
Введенное в таблице сокращение «Изв. с др.» означает «известны с древнего времени», остальные сокращения понятны.
|
Атомный номер Z |
Символ |
Название |
Атомный вес A |
Кто открыл |
Год открытия элемента |
|
1 |
H |
Водород |
1,0080 |
Кавендиш |
1766 |
|
2 |
He |
Гелии 1) |
4,003 |
Рамзай и Клив |
1895 |
|
3 |
Li |
Литий |
6,94 0 |
Арфведсон |
1817 |
|
4 |
Be |
Бериллий |
9,013 |
Велер и Бюсси |
1828 |
|
5 |
В |
Бор |
10,82 |
Гей-Люссак и Тенар |
1808 |
|
6 |
C |
Углерод |
12,011 |
Изв. |
– |
|
7 |
N |
Азот |
14,008 |
Д. Резерфорд |
1772 |
|
8 |
O |
Кислород |
16,0000 |
|
1774 |
|
9 |
F |
Фтор 2) |
19,00 |
Муассан |
1886 |
|
10 |
Ne |
Неон |
20,183 |
Рамзай и Траверс |
1898 |
|
11 |
Na |
Натрий |
|
Деви |
1807 |
|
12 |
Mg |
Магний 3) |
24,32 |
Либих и Бюсси |
1831 |
|
13 |
Al |
Алюминий |
26,98 |
Вёлер |
1827 |
|
14 |
Si |
Кремний |
28,09 |
Берцелиус |
1823 |
|
15 |
P |
Фосфор |
30,975 |
Бранд |
1669 |
|
16 |
S |
Сера |
32,066 |
Изв. |
– |
|
17 |
Cl |
Хлор |
35,457 |
Шееле |
1774 |
|
18 |
Ar |
Аргон |
39,944 |
Рэлей и Рамзай |
1894 |
|
19 |
К |
Калий |
39,100 |
Деви |
1807 |
|
20 |
Ca |
Кальций |
40,08 |
Деви (Берцелиус) |
1808 |
|
21 |
Sc |
Скандий |
44,96 |
Нильсон |
1879 |
|
22 |
Ti |
Титан 4) |
47,90 |
Грегор |
1791 |
|
|
V |
Ванадий |
50,95 |
Зефштрем |
1830 |
|
24 |
Cr |
Хром |
52,01 |
Воклен |
1797 |
|
25 |
Mn |
Марганец |
54,94 |
Ган |
1774 |
|
|
Fe |
Железо |
55,85 |
Изв. |
– |
|
27 |
Co |
Кобальт |
58,94 |
Брандт |
1735 |
|
28 |
Ni |
Никель |
58,69 |
Кронстедт |
|
|
29 |
Cu |
Медь |
63,54 |
Изв. с др. |
– |
|
30 |
Zn |
Цинк |
65,38 |
Маркграф |
1746 |
|
31 |
Ga |
Галлий |
69,72 |
Лекок де Буабодрант |
1875 |
|
32 |
Ge |
Германий |
72,60 |
Винклер |
1886 |
|
33 |
As |
Мышьяк 5) |
74,91 |
Альберт Великий |
XIII в. |
|
34 |
Se |
Селен |
78,96 |
Берцелиус |
1817 |
|
35 |
Br |
Бром |
79,916 |
Балард |
1826 |
|
36 |
Kr |
Криптон |
83,80 |
Рамзай и Траверс |
1898 |
|
37 |
Rb |
Рубидий |
85,48 |
Бунзен и Кирхгоф |
1861 |
|
33 |
Sr |
Стронций |
87,63 |
Деви |
1808 |
|
39 |
Y |
Иттрий |
88,92 |
Вёлер |
1828 |
|
40 |
Zr |
Цирконий |
91. |
Берцелиус |
1824 |
|
41 |
Nb |
Ниобий 6) |
92,91 |
Розе |
1844 |
|
42 |
Mo |
Молибден |
95,95 |
Гьельм |
1782 |
|
43 |
Tc |
Технеций |
99 |
Перрье и Сегре |
1937 |
|
44 |
Ru |
Рутений |
101,1 |
Клаус |
1844 |
|
45 |
Rh |
Родий |
102,91 |
Волластон |
1803 |
|
46 |
Pd |
Палладий |
106,7 |
Волластон |
1803 |
|
47 |
Ag |
Серебро |
107,880 |
Изв. |
– |
|
48 |
Cd |
Кадмий |
112,41 |
Герман и Штромберг |
1817 |
|
49 |
In |
Индий |
114,76 |
Рейх и Рихтер |
1863 |
|
60 |
Sn |
Олово |
118,70 |
Изв. с др. |
– |
|
51 |
Sb |
Сурьма |
|
В. Валентин |
XV в. |
|
52 |
Те |
Теллур |
127,61 |
Рихенштейн |
1782 |
|
53 |
J |
Иод |
|
Куртуа |
1811 |
|
54 |
Xe |
Ксенон |
131,3 |
Рамзай и Траверс |
1898 |
|
55 |
Cs |
Цезий |
|
Бунзен и Кирхгофф |
1860 |
|
56 |
Ba |
Барий |
|
Деви |
1808 |
|
57 |
La |
Лантан |
138,92 |
Мозандер |
1839 |
|
58 |
Ce |
Церий 7) |
140,13 |
Гяльдербранд и Нортон |
1875 |
|
59 |
Pr |
Празеодим |
140,92 |
Вейсбах |
1885 |
|
60 |
Nd |
Неодим 8) |
144,27 |
Вейсбах |
1885 |
|
61 |
Pm |
Прометий |
145 |
Марянский и Гленденев |
1947 |
|
62 |
Sm |
Самарий |
150,43 |
Лекок де Буабодран |
1879 |
|
63 |
Eu |
Европий |
152,0 |
Демарсей |
1896 |
|
64 |
Gd |
Гадолиний |
156,9 |
Мариньяк и Лекок де Буабодран |
1880 |
|
65 |
Tb |
Тербий |
158,93 |
Мозандер |
1843 |
|
66 |
Dy |
Диспрозий |
162,46 |
Лекок де Буабодран |
1886 |
|
67 |
Ho |
Гольмий |
164,94 |
Клеве |
1880 |
|
68 |
Er |
Эрбий |
167,2 |
Мозандер |
1843 |
|
69 |
Tu |
Туллий |
168,94 |
Клеве |
1879 |
|
70 |
Yb |
Иттербий |
173,04 |
Мариньяк |
1878 |
|
71 |
Lu |
Лютеций |
174,99 |
У роен |
1908 |
|
72 |
Hf |
Гафний |
178,6 |
Костер и Хевеши |
1923 |
|
73 |
Та |
Тантал |
180,95 |
Экеберг |
1802 |
|
74 |
W |
Вольфрам |
183,92 |
Бр. |
1783 |
|
75 |
Re |
Рений |
186,31 |
Ноддак и Таске |
1925 |
|
76 |
Os |
Осмий |
190,2 |
Теннант |
1803 |
|
77 |
Ir |
Иридий |
192,2 |
Теннант |
1804 |
|
78 |
Pt |
Платина 9) |
195,23 |
Упом. в XVI в. |
1861 |
|
79 |
Au |
Золото |
197,0 |
Изв. |
|
|
80 |
Hg |
Ртуть |
200,61 |
Упом. за III в. до н. в. |
|
|
81 |
Tl |
Таллий |
204,39 |
Крукс |
|
|
82 |
Pb |
Ивинец |
207,21 |
Упом. Плинием |
|
|
83 |
Bi |
Висмут |
209,00 |
Упом. В. Валентин в XV в. |
|
|
84 |
Ро |
Полоний |
210 |
Кюри М. |
1898 |
|
85 |
At |
Астатин |
210 |
Корзон и Мэккензи |
1940 |
|
86 |
Rn |
Радон |
222 |
Дорн |
1900 |
|
87 |
Fr |
Франций |
223 |
М. Перей |
1939 |
|
88 |
Ra |
Радий |
226,05 |
Кюри М. |
1898 |
|
89 |
Ac |
Актиний |
227 |
Дебьерн |
1902 |
|
90 |
Th |
Торий |
232,05 |
Берцелиус |
1828 |
|
91 |
Pa |
Протактиний |
231 |
Мейтнер и Ган |
1918 |
|
92 |
U |
Уран 10) |
238,07 |
Клапрот |
1789 |
|
93 |
Np |
Нептуний |
237 |
Мэкмиллан и Абельсон |
1940 |
|
04 |
Pu |
Плутоний |
242 |
Сиборг и Мэкмиллан |
1940 |
|
95 |
Am |
Америций |
243 |
Сиборг и Джемс |
1945 |
|
96 |
Cm |
Кюрий |
245 |
Сиборг и Джемс |
1944 |
|
97 |
Bk |
Беркелий |
245 |
Сиборг и Томпсон |
I960 |
|
98 |
Cf |
Калифорний |
248 |
Сиборг и Томпсон |
1950 |
|
99 |
En |
Эйнштейний |
253 |
|
1953 |
|
100 |
Fm |
Фермий |
255 |
|
1953 |
|
101 |
Mv |
Менделевий |
256 |
|
1953 |
Примечания к таблице:
1) Жансен и независимо от него Локьер в 1868 г. обнаружили в спектре солнца неизвестные до того времени линии; этот новый элемент был назван гелием, так как предполагалось, что он находится только на солнце. Через 27 лет Рамзаи и Клив обнаружили те же линии в спектре нового газа, полученного ими при анализе минерала клевеита; название гелий для этого элемента было сохранено.
обнаружили в спектре солнца неизвестные до того времени линии; этот новый элемент был назван гелием, так как предполагалось, что он находится только на солнце. Через 27 лет Рамзаи и Клив обнаружили те же линии в спектре нового газа, полученного ими при анализе минерала клевеита; название гелий для этого элемента было сохранено.
2) Еще в конце XVIII в. было известно, что при действии серной кислоты на плавиковый шпат выделяется особая кислота, которая разъедает стекло. В 1810 г. Ампер показал, что эта кислота подобна соляной и является соединением с водородом некоторого неизвестного элемента, который он назвал фтором. В чистом виде фтор удалось получить Муассану только в 1886 г.
3) Окись магния была известна давно, ее исследовал Блэк еще в 1775 г. Деви в 1808 г. пытался получить металлический магний, но в чистом виде металл получить ему не удалось.
4) Двуокись титана была получена лабораторным путем еще в конце XVIII в., Берцелиус получал титан, но не вполне чистый. Более чистый металлический титан был получен Грегор, затем Муассаном.
5) Сернистые соединения мышьяка былп известны в древнее время.
6) В начале XIX в. была получена смесь ниобия и тантала, которая рассматривалась как новый элемент; ему было присвоено название колумбий. В Америке и Англии ниобий до сих пор носит название колумбий.
7) В виде окиси церий был получен в 1803 г.
8) Долгое время смесь празеодима и неодима считалась отдельным элементом, который назывался дидием (Di).
9) Как особый металл платина была описана в 1750 г.; до 1810 г. единственным местом добычи платины была Колумбия. Затем платина была найдена в других местах, в том числе на Урале, который до настоящего времени является наиболее богатым источником ее получения.
10) Двуокись урана, полученная впервые еще в 1789 г., была принята вначале за новый элемент. Металлический уран был получен впервые в 1842 г., его радиоактивные свойства были открыты только в 1896 г.
_______________
Источник информации: КРАТКИЙ ФИЗИКО-ТЕХНИЧЕСКИЙ СПРАВОЧНИК/ Том 1, – М. : 1960.
: 1960.
Объяснение периодической таблицы элементов
Для чего была разработана периодическая таблица:
В 1869 году русский химик Дмитрий Менделеев хотел выяснить, существует ли закономерность в химических свойствах известных ему элементов. Он нашел закономерность, упорядочив элементы по возрастанию атомного номера и расположив их на диаграмме, создав первую периодическую таблицу. Эта структура помогла Менделееву и другим ученым определить сходства и различия между элементами, чтобы предсказать будущие химические реакции.
Периодическая таблица Менделеева включала 63 элемента. Он ожидал, что в один прекрасный день будут обнаружены и другие, поэтому он оставил свободное место в своей таблице для дополнений. Сегодня 118 химических элементов, идентифицированных в периодической таблице, включают материалы, из которых состоят все известные объекты во Вселенной.
Знаете ли вы? Самым распространенным элементом (по массе), составляющим Землю4, является железо (Fe). 2 Кислород (O) — самый распространенный элемент в земной коре. 3
2 Кислород (O) — самый распространенный элемент в земной коре. 3
Как элементы организованы в периодической таблице:
Элементы организованы в горизонтальные ряды по возрастанию атомного номера. 4 Атомный номер, расположенный в верхнем левом углу символа элемента, означает количество протонов в ядре атома.
Под символом элемента указан атомный вес, который представляет собой средний вес протонов и нейтронов в атоме. Поскольку в природе атомы имеют разное количество нейтронов (известных как изотопы), атомная масса представляет собой среднее значение всех весов всех изотопов для данного атома.
Что такое периоды?
Горизонтальные строки периодической таблицы называются периодами. Периодическая таблица содержит семь периодов 5 (девять, если считать ряды лантанидов и актиноидов). В каждом периоде атомные номера элементов увеличиваются слева направо. Все элементы одного и того же периода имеют одинаковое количество электронных оболочек, но разное количество электронов и протонов.
Все элементы одного и того же периода имеют одинаковое количество электронных оболочек, но разное количество электронов и протонов.
Зная количество электронов в химическом элементе, вы можете рассчитать его валентность. 6 Это способность атома или группы атомов образовывать химические связи с другими атомами. Валентность является важным аспектом расчета химических формул для студентов и химиков.
Что такое семьи?
«Семейства» — это группы элементов, представленные в девяти из 18 вертикальных столбцов периодической таблицы. 7 Семейства химических элементов имеют схожие свойства, например электронные конфигурации. 8 Например, элементы со свойствами, сходными с натрием (Na), такие как литий (Li) и калий (K), входят в одно и то же семейство.
Как элементы добавляются в таблицу?
Международный союз теоретической и прикладной химии (IUPAC) ведет периодическую таблицу и устанавливает критерии для новых дополнений. 9 В последний раз ИЮПАК обновлял периодическую таблицу в 2016 году, добавляя четыре новых элемента: нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). 10
9 В последний раз ИЮПАК обновлял периодическую таблицу в 2016 году, добавляя четыре новых элемента: нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). 10
Как читать и интерпретировать периодическую таблицу:
Периодическая таблица помогает химикам классифицировать элементы по свойствам и сходству. Один из способов сортировки элементов состоит в том, чтобы разделить их на три категории: металлы, неметаллы и металлоиды:
- Большинство элементов в периодической таблице считаются металлами . У них схожие характеристики — большинство из них твердые, блестящие, хорошо проводят электричество и податливы.
- Неметаллы обладают свойствами, противоположными металлам – они хрупкие, негибкие и плохо проводят тепло или электричество. Некоторые неметаллы являются жидкостями, некоторые газообразными.
- Металлоиды или полуметаллы считаются чем-то средним между металлами и неметаллами.
 Металлоиды обладают уникальными свойствами проводимости, что делает их полезными в производстве полупроводников и компьютерных микросхем. 11
Металлоиды обладают уникальными свойствами проводимости, что делает их полезными в производстве полупроводников и компьютерных микросхем. 11
Периодическая таблица элементов помогает нам лучше понять химические элементы и их связь друг с другом. Продукты, материалы и технологии, формирующие нашу жизнь, создаются элементами и тем, как они взаимодействуют друг с другом.
Четыре химических элемента добавлены в периодическую таблицу
Элементы 113, 115, 117 и 118 будут названы учеными из России, США и Японии.
НАБЛЮДЕНИЕ ЗА ТЕНДЕНЦИЕЙ: Четыре новых элемента были официально добавлены в периодическую таблицу, заполнив ее седьмую строку.
Элементы 113, 115, 117 и 118 были занесены в таблицу в течение многих лет, и лаборатории в России, США и Японии неоднократно заявляли об их открытии. Но официального признания пришлось ждать до конца 2015 года, когда группа независимых экспертов согласилась, что доказательства достоверны (см. график). Международный союз теоретической и прикладной химии (IUPAC), штаб-квартира которого находится в Research Triangle Park, Северная Каролина, объявил выводы группы 30 декабря.
график). Международный союз теоретической и прикладной химии (IUPAC), штаб-квартира которого находится в Research Triangle Park, Северная Каролина, объявил выводы группы 30 декабря.
Все элементы были созданы в лаборатории путем столкновений более легких атомных ядер. Нестабильные скопления протонов и нейтронов существуют всего доли секунды, прежде чем они распадаются на более мелкие и более стабильные фрагменты.
Команды, получившие признание за открытия, теперь могут выдвигать предложения по названиям элементов и двухбуквенным символам. Элементы могут быть названы в честь одного из их химических или физических свойств, мифологической концепции, минерала, места или страны или ученого.
Приоритет в открытии элемента 113 достался исследователям из Японии, которые особенно рады тому, что он станет первым искусственным элементом, получившим название в Восточной Азии. Когда этот элемент был впервые обнаружен 12 лет назад, в качестве названия было предложено название «японий».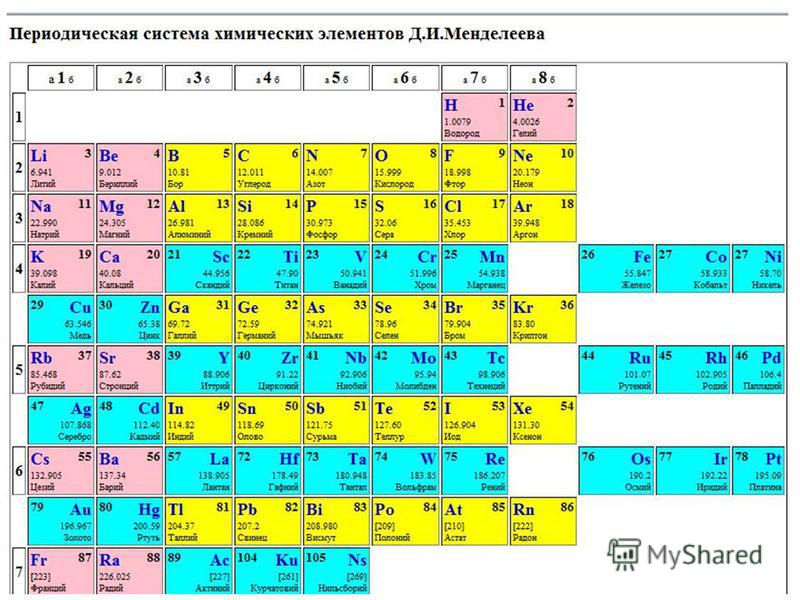
Японский химик Косуке Морита является частью команды, которая получила признание за открытие элемента 113. Авторы и права: Kazuhiro Nogi/AFP/Getty
Команда Центра ускорительной науки RIKEN Nishina в Вако, недалеко от Токио, сделала первое заявление об обнаружении 113-го элемента в 2004 году, а затем более убедительно обнаружила его в 2012. К тому времени было создано три атома элемента. «Для ученых это имеет большую ценность, чем олимпийская золотая медаль», — сказал Рёдзи Ноёри, лауреат Нобелевской премии по химии 2001 года, на пресс-конференции, посвященной решению IUPAC. (Ноёри не был членом японской команды, но является бывшим президентом RIKEN).
Российские и американские исследователи сделали соперничающие заявления об открытии 113, но группа экспертов, составленная из IUPAC и Международного союза теоретической и прикладной физики (IUPAP), не отдала им приоритет.
Тем не менее, Россия и США получили кредит и права на наименование других новых элементов. Элементы 115 и 117 были впервые созданы в сотрудничестве между Объединенным институтом ядерных исследований в Дубне, Россия, Ливерморской национальной лабораторией Лоуренса в Ливерморе, Калифорния, и Национальной лабораторией Ок-Ридж в Теннесси, заявил комитет IUPAC/IUPAP. Работа других команд, таких как шведская группа, использующая немецкий ускоритель, помогла подтвердить существование элемента 115.
Элементы 115 и 117 были впервые созданы в сотрудничестве между Объединенным институтом ядерных исследований в Дубне, Россия, Ливерморской национальной лабораторией Лоуренса в Ливерморе, Калифорния, и Национальной лабораторией Ок-Ридж в Теннесси, заявил комитет IUPAC/IUPAP. Работа других команд, таких как шведская группа, использующая немецкий ускоритель, помогла подтвердить существование элемента 115.
Заслуга открытия 118-го элемента — самого тяжелого из когда-либо созданных — принадлежит командам из Дубны и Лоуренса Ливермора. У этого элемента пестрая история: заявление 1999 года о его создании было отозвано два года спустя на фоне обвинений в фальсификации данных.
Теперь физики попытаются создать элементы 119 и 120, что вполне возможно при современных технологиях, говорит Рольф-Дитмар Герцберг, физик-ядерщик из Ливерпульского университета, Великобритания. Однако никто еще не заявил о наблюдении: исследователи из Центра исследований тяжелых ионов им. Гельмгольца GSI в Дармштадте, Германия, безуспешно пытались в течение пяти месяцев в 2012 году.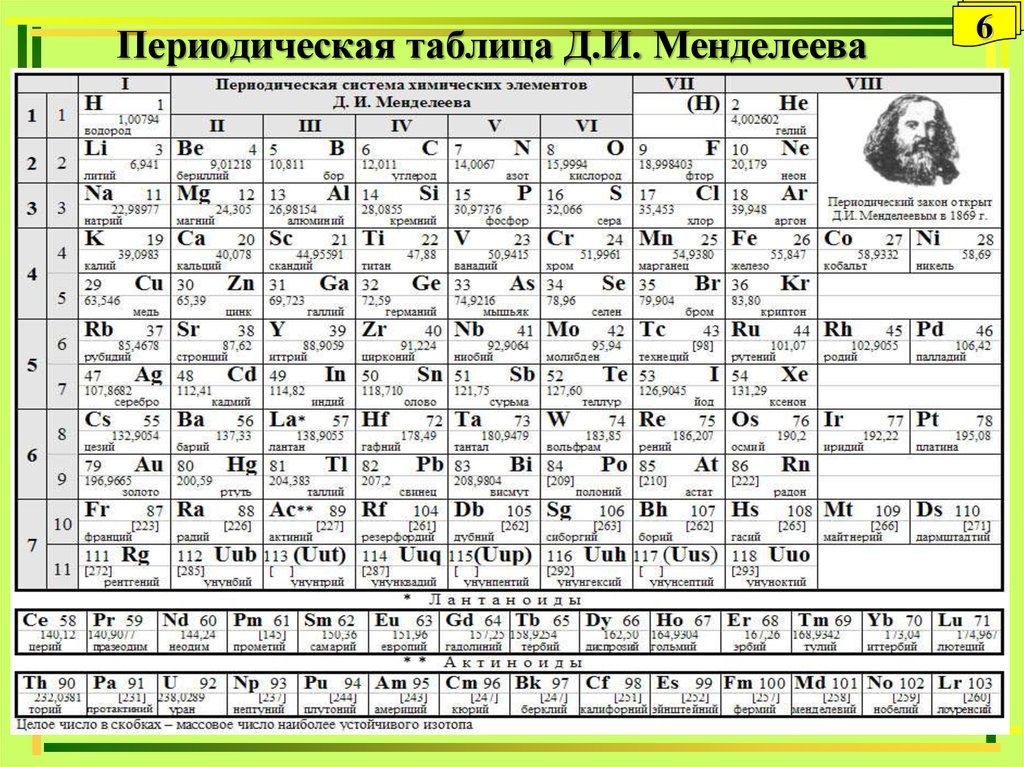

 с др.
с др. с др.
с др. с др.
с др.
 22
22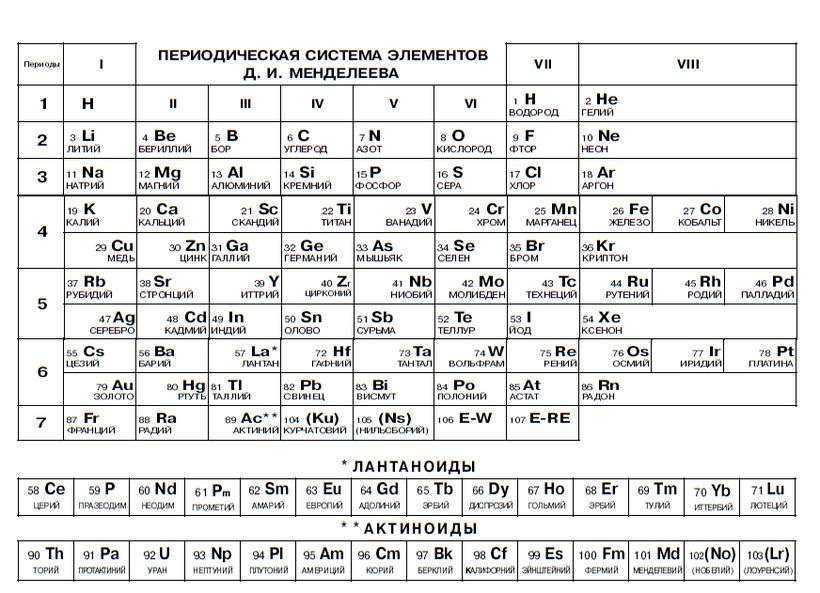 с др.
с др.
 д’Эльюар
д’Эльюар с др.
с др.
 Металлоиды обладают уникальными свойствами проводимости, что делает их полезными в производстве полупроводников и компьютерных микросхем. 11
Металлоиды обладают уникальными свойствами проводимости, что делает их полезными в производстве полупроводников и компьютерных микросхем. 11