2 период, второй период — периодическая система химических элементов
2 период, второй период — периодическая система химических элементов- Главная
- Статьи
- Периодическая система элементов — Периодическая система химических элементов, периодическая система элементов Менделеева
- 2 период, второй период — периодическая система химических элементов
+++++
Второй период периодической системы элементов
Второй период (Li — Ne) содержит 8 элементов. Он начинается щелочным металлом Li, единственная степень окисления которого равна I. Затем идёт Be — металл, степень окисления II. Металлический характер следующего элемента В выражен слабо (степень окисления III). Идущий за ним C — типичный неметалл, может быть как положительно, так и отрицательно четырёхвалентным. Последующие N, O, F и Ne — неметаллы, причём только у N высшая степень окисления V соответствует номеру группы; кислород лишь в редких случаях проявляет положительную валентность, а для F известна степень окисления VI. Завершает период инертный газ Ne.
Металлический характер следующего элемента В выражен слабо (степень окисления III). Идущий за ним C — типичный неметалл, может быть как положительно, так и отрицательно четырёхвалентным. Последующие N, O, F и Ne — неметаллы, причём только у N высшая степень окисления V соответствует номеру группы; кислород лишь в редких случаях проявляет положительную валентность, а для F известна степень окисления VI. Завершает период инертный газ Ne.
Второй период периодической системы химических элементов
|
IA |
IIA |
IIIB |
IVB |
VB |
VIB |
VIIB |
—- |
VIIIB |
—- |
IB |
IIB |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
| Период | ||||||||||||||||||
| 2 |
3
Li |
4
Be |
5
B |
6
C |
7
N |
8
O |
9
F |
10
Ne |
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Инертные газы |
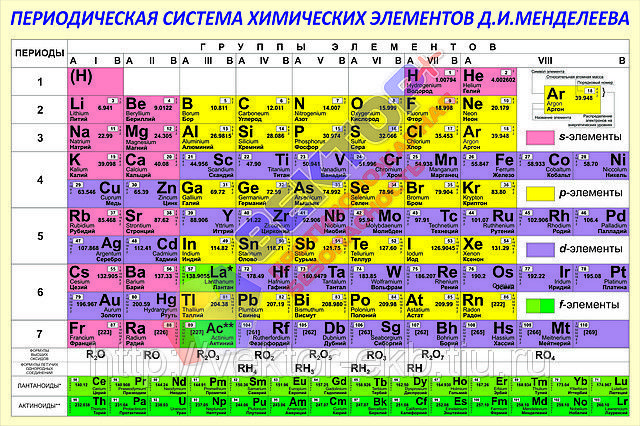
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
27(Хим элемент и хим соединение.
 Периодический закон Менделеева)
Периодический закон Менделеева)Хими?ческий элеме?нт — множество атомов с одинаковым зарядом ядра, числом протонов, совпадающим с порядковым или атомным номером в таблице Менделеева[1]. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе элементов Дмитрия Ивановича Менделеева. вещество,
состоящее из химически связанных атомов двух или нескольких элементов. Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (например, азот , кислород и др.). Состав химического соединения записывается в виде химических формул, а строение часто изображается структурными формулами.
В
подавляющем большинстве случаев
химические соединения подчиняется
закону постоянства состава и закону
кратных отношений. Однако известны
довольно многочисленные соединения
переменного состава. Химические
соединения получают в результате
химических реакций. Образование
химических соединений сопровождается
выделением (экзотермическая реакция)
или поглощением (Эндотермическая
реакция) энергии.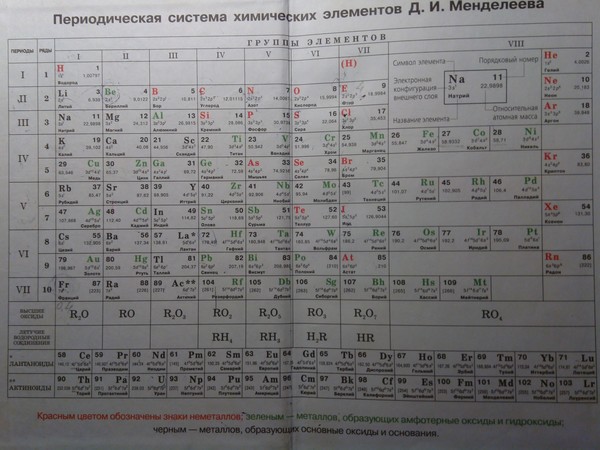 Физические и химические
свойства химических соединений отличаются
от свойств веществ, из которых они
получены. Химические соединения
разделяются на неорганические и
органические. Известно более 100 тыс.
неорганических и более 3 млн органических
соединений.
Физические и химические
свойства химических соединений отличаются
от свойств веществ, из которых они
получены. Химические соединения
разделяются на неорганические и
органические. Известно более 100 тыс.
неорганических и более 3 млн органических
соединений.
Периодический закон Д. И. Менделеева — фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от
увеличения
зарядов ядер их атомов. Открыт
Д. И. Менделеевым в марте 1869 года
при сопоставлении свойств всех известных
в то время элементов и величин их атомных
масс (весов). Термин «периодический
закон» Менделеев впервые употребил в
ноябре 1870, а в октябре 1871 дал окончательную
формулировку Периодического закона:
«свойства простых тел, а также формы и
свойства соединений элементов, а потому
и свойства образуемых ими простых и
сложных тел, стоят в периодической
зависимости от их атомного веса».[1]
Графическим (табличным) выражением
периодического закона является
разработанная Менделеевым периодическая
система элементов.
28(химические процессы. Энергетика хим процессов) Хими?ческая реа?кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции),
электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Самопроизвольное превращение веществ осуществляется при условии, что они обладают энергией, достаточной для преодоления потенциального барьера, разделяющего исходное и конечное состояния системы (Энергия активации).
Химическая
термодинамика – это раздел физической
химии, которая изучает превращения
различных видов энергии при химических
реакциях, процессах растворения,
кристаллизации. Химическая термодинамика
исследует возможности и границы
самопроизвольного протекания физических
процессов. Объектом изучения в
термодинамике является термодинамическая
система, под которой понимают условно
выделенную из пространства совокупность
тел, между которыми возможен масса- и
теплообмен. Системы, которые могут
обмениваться с окружающей средой и
энергией и веществом называются
открытыми. Системы, которые обмениваются
только энергией, называются закрытыми.
Если между средой и системой отсутствует
и тепло- и массообмен – это изолированная
система. Различают также
Химическая термодинамика
исследует возможности и границы
самопроизвольного протекания физических
процессов. Объектом изучения в
термодинамике является термодинамическая
система, под которой понимают условно
выделенную из пространства совокупность
тел, между которыми возможен масса- и
теплообмен. Системы, которые могут
обмениваться с окружающей средой и
энергией и веществом называются
открытыми. Системы, которые обмениваются
только энергией, называются закрытыми.
Если между средой и системой отсутствует
и тепло- и массообмен – это изолированная
система. Различают также
гомогенные системы, состоящие из одной фазы и гетерогенные, состоящие из нескольких фаз. Реакции, которые протекают на границе раздела фаз – гетерогенные. Состояние системы называется равновесным, если параметры системы во времени самопроизвольно не изменяются. Неравновесная система – параметры во времени изменяются.
29(реакционная
способность веществ) Реакционная
способность, характеристика химической
активности веществ, учитывающая как
разнообразие реакций, возможных для
данного вещества, так и их скорость. Например, благородные металлы (Au, Pt) и
инертные газы (Не, Ar, Kr, Xe) химически
инертны, т. е. у них низкая Р. с.; щелочные
металлы (Li, Na, К, Cs) и галогены (F, Cl, Вг, I)
химически активны, т. е. обладают высокой
Р. с. В органической химии насыщенные
углеводороды характеризуются низкой
Р. С, для них возможны немногочисленные
реакции (радикальное галогенирование
и нитрование, дегидрирование, деструкция
с разрывом С—С-связей и некоторые др.),
происходящие в жёстких условиях (высокая
температура, ультрафиолетовое облучение).
Наличие в молекуле двойных и тройных
связей, функциональных групп (гидроксильной
—ОН, карбоксильной —СООН, аминогруппы
—Nh3 и др.) приводит к дальнейшему
увеличению Р. с. Количественно Р. с.
выражают константами скоростей реакций
или константами равновесия в случае
обратимых процессов
Например, благородные металлы (Au, Pt) и
инертные газы (Не, Ar, Kr, Xe) химически
инертны, т. е. у них низкая Р. с.; щелочные
металлы (Li, Na, К, Cs) и галогены (F, Cl, Вг, I)
химически активны, т. е. обладают высокой
Р. с. В органической химии насыщенные
углеводороды характеризуются низкой
Р. С, для них возможны немногочисленные
реакции (радикальное галогенирование
и нитрование, дегидрирование, деструкция
с разрывом С—С-связей и некоторые др.),
происходящие в жёстких условиях (высокая
температура, ультрафиолетовое облучение).
Наличие в молекуле двойных и тройных
связей, функциональных групп (гидроксильной
—ОН, карбоксильной —СООН, аминогруппы
—Nh3 и др.) приводит к дальнейшему
увеличению Р. с. Количественно Р. с.
выражают константами скоростей реакций
или константами равновесия в случае
обратимых процессов
Современные
представления о Р. с. основаны на
электронной теории валентности и на
рассмотрении распределения (и смещения
под действием реагента) электронной
плотности в молекуле.
Электронные смещения качественно описываются в терминах индуктивных и мезомерных эффектов, количественно — с применением квантовомеханических расчётов. Главный фактор, определяющий относительную Р. с. в ряду родственных соединений, — строение молекулы: характер заместителей, их электронное и пространственное влияние на реакционный центр, геометрия молекул . Р. с. зависит и от условий реакции (природы среды, присутствия катализаторов или ингибиторов, давления, температуры, облучения и т.п.).
Все эти факторы оказывают на скорость реакций различное, а иногда противоположное влияние в зависимости от механизма данной реакции. Количественная связь между константами скорости (или равновесия) в пределах одной реакционной серии может быть представлена корреляционными уравнениями, описывающими изменения констант в зависимости от изменения какого-либо параметра (например, эффекта заместителя — уравнение Гаммета — Тафта, полярности растворителя — уравнение Брёнстеда и т.п.).
На
скорость некоторых химических реакций
можно влиять присутствием небольшого
количества определенных веществ, которые
сами в реакции участия не принимают. Вещества эти называются катализаторами.
Катализаторы бывают положительными,
ускоряющими реакцию, и отрицательными
— замедляющими ее. Каталитическое
ускорение химической реакции называется
катализом и является приемом современной
химической технологии (производство
полимерных материалов, синтетического
топлива и др.). Считается, что удельный
вес каталитических процессов в химической
промышленности достигает 80%. Благодаря
катализу существенно повысилась
эффективность экономики химической
промышленности, поскольку ускорение
химических реакций заметно влияет на
снижение издержек производства.
Вещества эти называются катализаторами.
Катализаторы бывают положительными,
ускоряющими реакцию, и отрицательными
— замедляющими ее. Каталитическое
ускорение химической реакции называется
катализом и является приемом современной
химической технологии (производство
полимерных материалов, синтетического
топлива и др.). Считается, что удельный
вес каталитических процессов в химической
промышленности достигает 80%. Благодаря
катализу существенно повысилась
эффективность экономики химической
промышленности, поскольку ускорение
химических реакций заметно влияет на
снижение издержек производства.
30(химические системы) Можно сказать что до открытия в 1869 г. периодической системы химических элементов Дмитрием Ивановичем Менделеевым (1834—1907) не существовало той объединяющей системы, с помощью которой можно было бы объяснить весь накопленный фактический материал, а следовательно, представить все наличное знание как систему теоретической химии.
Характер
любой химической системы, как известно,
зависит не только от состава и строения
ее элементов, но и от их взаимодействия. Именно такое взаимодействие определяет
специфические, целостные свойства самой
системы. Поэтому при исследовании
разнообразных веществ и их реакционной
способности ученым приходилось заниматься
и изучением их структур. Соответственно
уровню достигнутых знаний менялись и
представления о химической структуре
веществ. Хотя разные ученые по-разному
истолковывали характер взаимодействия
между элементами химических систем,
тем не менее все они подчеркивали, что
целостные свойства этих систем
определяются именно специфическими
особенностями взаимодействия между их
элементами.
Именно такое взаимодействие определяет
специфические, целостные свойства самой
системы. Поэтому при исследовании
разнообразных веществ и их реакционной
способности ученым приходилось заниматься
и изучением их структур. Соответственно
уровню достигнутых знаний менялись и
представления о химической структуре
веществ. Хотя разные ученые по-разному
истолковывали характер взаимодействия
между элементами химических систем,
тем не менее все они подчеркивали, что
целостные свойства этих систем
определяются именно специфическими
особенностями взаимодействия между их
элементами.
В качестве первичной химической системы рассматривалась при этом молекула, и поэтому, когда речь заходила о структуре веществ, то имелась в виду именно структура молекулы как наименьшей единицы вещества.
Попытку
раскрытия структуры молекул и
синтезирования новых веществ предпринял
известный немецкий химик Фридрих Кекуле
(1829—1896). Он стал связывать структуру с
понятием валентности элемента, или
числа единиц его сродства. На этой основе
и возникли те структурные формулы,
которыми с определенными модификациями
пользуются при изучении органической
химии в школе. В этих формулах элементы
связывались друг с другом по числу
единиц их валентности. Эволюция понятия
химической системы осуществлялась в
направлении, с одной стороны, анализа
ее составных частей или элементов, а с
другой — установления характера
физико-химического взаимодействия
между ними. Последнее особенно важно
для ясного понимания структуры с точки
зрения системного подхода, где под
структурой подразумевают упорядоченную
связь и взаимодействие между элементами
системы, благодаря которой и возникают
новые целостные ее свойства. В такой
химической системе, как молекула, именно
специфический характер взаимодействия
составляющих ее атомов определяет
свойства молекулы.
На этой основе
и возникли те структурные формулы,
которыми с определенными модификациями
пользуются при изучении органической
химии в школе. В этих формулах элементы
связывались друг с другом по числу
единиц их валентности. Эволюция понятия
химической системы осуществлялась в
направлении, с одной стороны, анализа
ее составных частей или элементов, а с
другой — установления характера
физико-химического взаимодействия
между ними. Последнее особенно важно
для ясного понимания структуры с точки
зрения системного подхода, где под
структурой подразумевают упорядоченную
связь и взаимодействие между элементами
системы, благодаря которой и возникают
новые целостные ее свойства. В такой
химической системе, как молекула, именно
специфический характер взаимодействия
составляющих ее атомов определяет
свойства молекулы.
Важной компонентой, характеризующей химические процессы, является их энергетика, представляющая собой потенциал взаимодействия элементов химической системы.
31(теории
возникновения жизни) Эволюция жизни
предполагает ее истоки, начало. Проблема
происхождения жизни является одной из
важнейших не только в биологии, но и во
всем естествознании и имеет большое
мировоззренческое значение.
Проблема
происхождения жизни является одной из
важнейших не только в биологии, но и во
всем естествознании и имеет большое
мировоззренческое значение.
креационизм — основана на вере и поэтому не относится к области науки.
самопроизвольного зарождения жизни из неживого вещества появилась в древности; ее придерживался еще Аристотель.
принцип Реди, или концепция биогенеза). Живое из живого
пастеризация
Концепция стационарного состояния предполагает, что Земля и жизнь на ней существовали всегда, причем в неизменном виде.
Концепция панспермии связывает появление жизни на Земле с ее занесением из космического пространства.
концепцию биохимической эволюции. Согласно современному варианту концепции, жизнь зародилась на Земле естественным путем в результате химических, а затем — биохимических процессов.
Теория абиогенного происхождения жизни
все
начиналось с белков, и на возможности
в определенных условиях спонтанного
химического синтеза мономеров белков
– аминокислот и белковоподобных полимеров
(полипептидов) абиогенным путем. Основным
ее постулатом было то, что спонтанно
возникавшие в первичном «бульоне»
белковоподобные соединения объединялись
в коацерватные капли – обособленные
коллоидные системы плавающие в более
разбавленном водном растворе. Это давало
главную предпосылку возникновения
организмов – обособление некой
биохимической системы от окружающей
среды, ее компартментализацию. Так как
некоторые белковоподобные соединения
коацерватных капель могли обладать
каталитической активностью, то появлялась
возможность прохождения биохимических
реакций синтеза внутри капель – возникало
подобие ассимиляции, а значит, роста
коацервата с последующим его распадом
на части – размножением. Ассимилирующий,
растущий и размножающийся делением
коацерват рассматривался как прообраз
живой клетки.
Основным
ее постулатом было то, что спонтанно
возникавшие в первичном «бульоне»
белковоподобные соединения объединялись
в коацерватные капли – обособленные
коллоидные системы плавающие в более
разбавленном водном растворе. Это давало
главную предпосылку возникновения
организмов – обособление некой
биохимической системы от окружающей
среды, ее компартментализацию. Так как
некоторые белковоподобные соединения
коацерватных капель могли обладать
каталитической активностью, то появлялась
возможность прохождения биохимических
реакций синтеза внутри капель – возникало
подобие ассимиляции, а значит, роста
коацервата с последующим его распадом
на части – размножением. Ассимилирующий,
растущий и размножающийся делением
коацерват рассматривался как прообраз
живой клетки.
Теория эволюции
До настоящего времени в научной и общеобразовательной среде основной теорией возникновения жизни на Земле во всём её многообразии считалась теория эволюции.
Теория
эволюции, которую часто называют
Дарвиновской теорией или дарвинизмом,
возникла не на пустом месте. Ко времени
Дарвина общепризнанной стала
космологическая теория Эммануила Канта,
с его бесконечной в пространстве и во
времени Вселенной, подчинённой законам
механики, описанным Исааком Ньютоном.
Таким образом был создан фундамент
теории эволюции, на котором Чарльз
Дарвин создал стройное здание своей
теории публикацией книг: “Происхождение
видов”, “Изменение домашних животных
и культурных растений”, “Происхождение
человека и половой отбор” и других.
Ко времени
Дарвина общепризнанной стала
космологическая теория Эммануила Канта,
с его бесконечной в пространстве и во
времени Вселенной, подчинённой законам
механики, описанным Исааком Ньютоном.
Таким образом был создан фундамент
теории эволюции, на котором Чарльз
Дарвин создал стройное здание своей
теории публикацией книг: “Происхождение
видов”, “Изменение домашних животных
и культурных растений”, “Происхождение
человека и половой отбор” и других.
Дарвиновская теория
По Дарвину эволюция, т.е. история развития органического мира Земли, осуществляется в результате взаимодействия трёх основных факторов: изменчивости, наследственности и естественного отбора. Благодаря этим факторам организмы в процессе развития накапливают всё новые приспособительные признаки, что в конечном итоге ведёт к образованию новых видов.
Может ли человек делать химические элементы
Из 26 известных в настоящее время трансурановых элементов 24 не встречаются на нашей планете. Они были созданы человеком. Как же синтезируют тяжелые и сверхтяжелые элементы?
Как же синтезируют тяжелые и сверхтяжелые элементы?
Алексей Левин
Первый список из тридцати трех предполагаемых элементов, «Таблицу субстанций, принадлежащих всем царствам природы, которые могут считаться простейшими составными частями тел», опубликовал Антуан Лоран Лавуазье в 1789 году. Вместе с кислородом, азотом, водородом, семнадцатью металлами и еще несколькими настоящими элементами в нем фигурировали свет, теплород и некоторые окислы. А когда 80 лет спустя Менделеев придумал Периодическую систему, химики знали 62 элемента. К началу XX века считалось, что в природе существуют 92 элемента — от водорода до урана, хотя некоторые из них еще не были открыты.
Тем не менее уже в конце XIX века ученые допускали существование элементов, следующих в таблице Менделеева за ураном (трансуранов), но обнаружить их никак не удавалось. Сейчас известно, что в земной коре содержатся следовые количества 93-го и 94-го элементов — нептуния и плутония. Но исторически эти элементы сначала получили искусственно и лишь потом обнаружили в составе минералов.
Но исторически эти элементы сначала получили искусственно и лишь потом обнаружили в составе минералов.
Из 94 первых элементов у 83 имеются либо стабильные, либо долгоживущие изотопы, период полураспада которых сравним с возрастом Солнечной системы (они попали на нашу планету из протопланетного облака). Жизнь остальных 11 природных элементов много короче, и потому они возникают в земной коре лишь в результате радиоактивных распадов на краткое время. А как же все остальные элементы, от 95-го до 118-го? На нашей планете их нет. Все они были получены искусственным путем.
Первый искусственный
Создание искусственных элементов имеет долгую историю. Принципиальная возможность этого стала понятна в 1932 году, когда Вернер Гейзенберг и Дмитрий Иваненко пришли к выводу, что атомные ядра состоят из протонов и нейтронов. Два года спустя группа Энрико Ферми попыталась получить трансураны, облучая уран медленными нейтронами.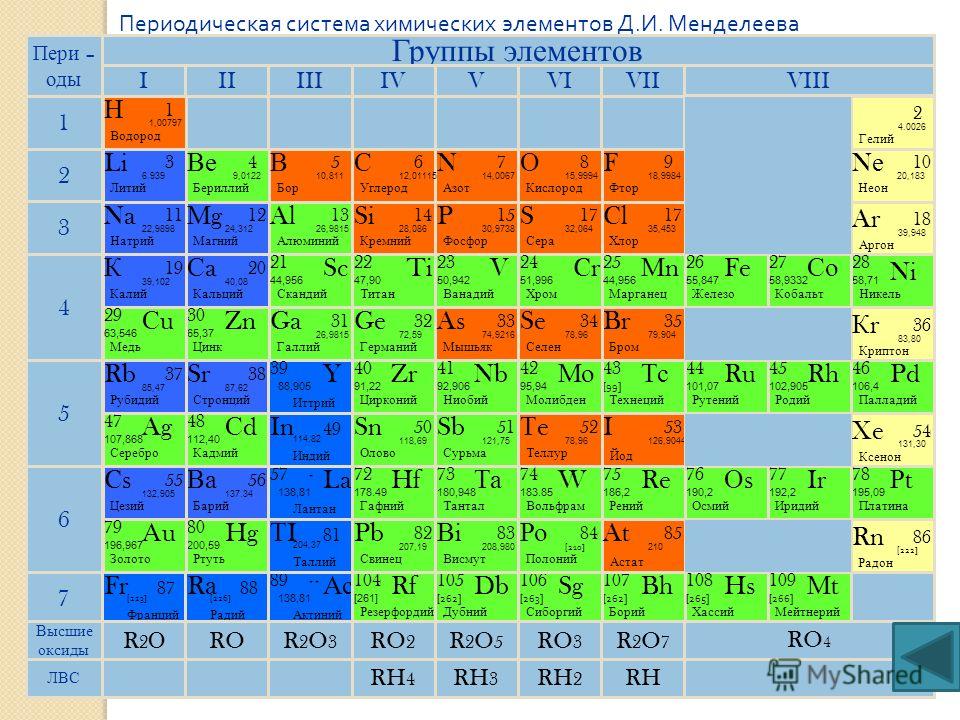 Предполагалось, что ядро урана захватит один или два нейтрона, после чего претерпит бета-распад с рождением 93-го или 94-го элементов. Они даже поспешили объявить об открытии трансуранов, которые в 1938 году в своей Нобелевской речи Ферми назвал аусонием и гесперием. Однако немецкие радиохимики Отто Ган и Фриц Штрассман вместе с австрийским физиком Лизой Мейтнер вскоре показали, что Ферми ошибся: эти нуклиды были изотопами уже известных элементов, возникшими в результате расщепления ядер урана на пары осколков приблизительно одинаковой массы. Именно это открытие, совершенное в декабре 1938 года, сделало возможным создание ядерного реактора и атомной бомбы.
Предполагалось, что ядро урана захватит один или два нейтрона, после чего претерпит бета-распад с рождением 93-го или 94-го элементов. Они даже поспешили объявить об открытии трансуранов, которые в 1938 году в своей Нобелевской речи Ферми назвал аусонием и гесперием. Однако немецкие радиохимики Отто Ган и Фриц Штрассман вместе с австрийским физиком Лизой Мейтнер вскоре показали, что Ферми ошибся: эти нуклиды были изотопами уже известных элементов, возникшими в результате расщепления ядер урана на пары осколков приблизительно одинаковой массы. Именно это открытие, совершенное в декабре 1938 года, сделало возможным создание ядерного реактора и атомной бомбы.
Первым же синтезированным элементом стал вовсе не трансуран, а предсказанный еще Менделеевым экамарганец. Его искали в различных рудах, но безуспешно. А в 1937 году экамарганец, позднее названный технецием (от греческого — искусственный) был получен при обстреле молибденовой мишени ядрами дейтерия, разогнанными в циклотроне Национальной лаборатории имени Лоуренса в Беркли.
Легкие снаряды
Элементы с 93-го до 101-го были получены при взаимодействии ядер урана либо следующих за ним трансуранов с нейтронами, дейтронами (ядрами дейтерия) или альфа-частицами (ядрами гелия). Первого успеха здесь добились американцы Эдвин Макмиллан и Филип Эйбелсон, которые в 1940 году синтезировали нептуний-239, отработав идею Ферми: захват ураном-238 медленных нейтронов и последующий бета-распад урана-239.
Следующий, 94-й элемент — плутоний — впервые обнаружили при изучении бета-распада нептуния-238, полученного дейтронной бомбардировкой урана на циклотроне Калифорнийского университета в Беркли в начале 1941 года. А вскоре стало понятно, что плутоний-239 под действием медленных нейтронов делится не хуже урана-235 и может служить начинкой атомной бомбы. Поэтому все сведения о получении и свойствах этого элемента засекретили, и статья Макмиллана, Гленна Сиборга (за свои открытия они разделили Нобелевскую премию 1951 года) и их коллег с сообщением о втором трансуране появилась в печати лишь в 1946 году.
Американские власти почти на шесть лет задержали и публикацию об открытии 95-го элемента, америция, который в конце 1944 года был выделен группой Сиборга из продуктов нейтронной бомбардировки плутония в ядерном реакторе. Несколькими месяцами ранее физики из этой же команды получили первый изотоп 96-го элемента с атомным весом 242, синтезированный при бомбардировке урана-239 ускоренными альфа-частицами. Его назвали кюрием в знак признания научных заслуг Пьера и Марии Кюри, открыв тем самым традицию наименования трансуранов в честь классиков физики и химии.
60-дюймовый циклотрон Калифорнийского университета стал местом сотворения еще трех элементов, 97-го, 98-го и 101-го. Первые два назвали по месту рождения — берклием и калифорнием. Берклий был синтезирован в декабре 1949 года при обстреле альфа-частицами мишени из америция, калифорний — двумя месяцами позже при такой же бомбардировке кюрия. 99-й и 100-й элементы, эйнштейний и фермий, были обнаружены при радиохимическом анализе проб, собранных в районе атолла Эниветок, где 1 ноября 1952 года американцы взорвали десятимегатонный термоядерный заряд «Майк», оболочка которого была изготовлена из урана-238. Во время взрыва ядра урана поглощали до пятнадцати нейтронов, после чего претерпевали цепочки бета-распадов, которые и вели к образованию этих элементов. 101-й элемент, менделевий, был получен в начале 1955 года. Сиборг, Альберт Гиорсо, Бернард Харви, Грегори Чоппин и Стэнли Томсон подвергли альфа-частичной бомбардировке около миллиарда (это очень мало, но больше просто не было) атомов эйнштейния, электролитически нанесенных на золотую фольгу. Несмотря на чрезвычайно высокую плотность пучка (60 трлн альфа-частиц в секунду), было получено лишь 17 атомов менделевия, но при этом удалось установить их радиационные и химические свойства.
Во время взрыва ядра урана поглощали до пятнадцати нейтронов, после чего претерпевали цепочки бета-распадов, которые и вели к образованию этих элементов. 101-й элемент, менделевий, был получен в начале 1955 года. Сиборг, Альберт Гиорсо, Бернард Харви, Грегори Чоппин и Стэнли Томсон подвергли альфа-частичной бомбардировке около миллиарда (это очень мало, но больше просто не было) атомов эйнштейния, электролитически нанесенных на золотую фольгу. Несмотря на чрезвычайно высокую плотность пучка (60 трлн альфа-частиц в секунду), было получено лишь 17 атомов менделевия, но при этом удалось установить их радиационные и химические свойства.
Тяжелые ионы
Менделевий стал последним трансураном, полученным с помощью нейтронов, дейтронов или альфа-частиц. Для получения следующих элементов требовались мишени из элемента номер 100 — фермия, которые тогда было невозможно изготовить (даже сейчас в ядерных реакторах фермий получают в нанограммовых количествах).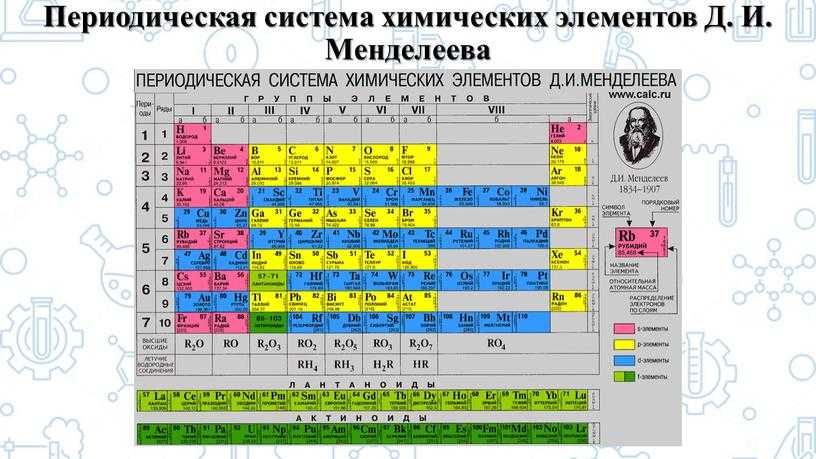
Ученые пошли другим путем: использовали для бомбардировки мишеней ионизированные атомы, чьи ядра содержат более двух протонов (их называют тяжелыми ионами). Для разгона ионных пучков потребовались специализированные ускорители. Первую такую машину HILAC (Heavy Ion Linear Accelerator) запустили в Беркли в 1957 году, вторую, циклотрон У-300 — в Лаборатории ядерных реакций Объединенного института ядерных исследований в Дубне в 1960-м. Позднее в Дубне заработали и более мощные установки У-400 и У-400М. Еще один ускоритель UNILAC (Universal Linear Accelerator) с конца 1975 года действует в немецком Центре по исследованию тяжелых ионов имени Гельмгольца, в Виксхаузене, одном из районов Дармштадта.
В ходе бомбардировок тяжелыми ионами мишеней из свинца, висмута, урана или трансуранов возникают сильно возбужденные (горячие) ядра, которые либо разваливаются, либо сбрасывают избыточную энергию посредством испускания (испарения) нейтронов. Иногда эти ядра испускают один-два нейтрона, после чего претерпевают и другие превращения — например, альфа-распад. Такой тип синтеза называется холодным. В Дармштадте с его помощью получили элементы с номерами от 107 (борий) до 112 (коперниций). Этим же способом в 2004 году японские физики создали один атом 113-го элемента (годом ранее он был получен в Дубне). При горячем синтезе новорожденные ядра теряют больше нейтронов — от трех до пяти. Этим способом в Беркли и в Дубне синтезировали элементы со 102-го (нобелий) до 106-го (сиборгий, в честь Гленна Сиборга, под руководством которого было создано девять новых элементов). Позднее в Дубне таким путем изготовили шесть самых массивных сверхтяжеловесов — с 113-го по 118-й. Международный союз теоретической и прикладной химии (IUPAC, International Union of Pure and Applied Chemistry) пока утвердил лишь имена 114-го (флеровий) и 116-го (ливерморий) элементов.
Такой тип синтеза называется холодным. В Дармштадте с его помощью получили элементы с номерами от 107 (борий) до 112 (коперниций). Этим же способом в 2004 году японские физики создали один атом 113-го элемента (годом ранее он был получен в Дубне). При горячем синтезе новорожденные ядра теряют больше нейтронов — от трех до пяти. Этим способом в Беркли и в Дубне синтезировали элементы со 102-го (нобелий) до 106-го (сиборгий, в честь Гленна Сиборга, под руководством которого было создано девять новых элементов). Позднее в Дубне таким путем изготовили шесть самых массивных сверхтяжеловесов — с 113-го по 118-й. Международный союз теоретической и прикладной химии (IUPAC, International Union of Pure and Applied Chemistry) пока утвердил лишь имена 114-го (флеровий) и 116-го (ливерморий) элементов.
Всего три атома
118-й элемент с временным названием унуноктий и символом Uuo (по правилам IUPAC, временные имена элементов образуются от латинских и греческих корней названий цифр их атомного номера, un-un-oct (ium) — 118) был создан совместными усилиями двух научных групп: дубнинской под руководством Юрия Оганесяна и Ливерморской национальной лаборатории под руководством Кентона Муди, ученика Сиборга. Унуноктий в таблице Менделеева расположен под радоном и поэтому может быть благородным газом. Однако его химические свойства пока выяснить не удалось, поскольку физики создали лишь три атома этого элемента с массовым числом 294 (118 протонов, 176 нейтронов) и периодом полураспада около миллисекунды: два в 2002 году и один в 2005-м. Их получили бомбардировкой мишени из калифорния-249 (98 протонов, 151 нейтрон) ионами тяжелого изотопа кальция с атомной массой 48 (20 протонов и 28 нейтронов), разогнанными на ускорителе У-400. Общее число кальциевых «пуль» составило 4,1х1019, так что производительность дубнинского «унуноктиевого генератора» крайне мала. Однако, по словам Кентона Муди, У-400 — единственная в мире машина, на которой можно было синтезировать 118-й элемент.
Унуноктий в таблице Менделеева расположен под радоном и поэтому может быть благородным газом. Однако его химические свойства пока выяснить не удалось, поскольку физики создали лишь три атома этого элемента с массовым числом 294 (118 протонов, 176 нейтронов) и периодом полураспада около миллисекунды: два в 2002 году и один в 2005-м. Их получили бомбардировкой мишени из калифорния-249 (98 протонов, 151 нейтрон) ионами тяжелого изотопа кальция с атомной массой 48 (20 протонов и 28 нейтронов), разогнанными на ускорителе У-400. Общее число кальциевых «пуль» составило 4,1х1019, так что производительность дубнинского «унуноктиевого генератора» крайне мала. Однако, по словам Кентона Муди, У-400 — единственная в мире машина, на которой можно было синтезировать 118-й элемент.
«Каждая серия опытов по синтезу трансуранов добавляет новую информацию о структуре ядерной материи, которую используют для моделирования свойств сверхтяжелых ядер. В частности, работы по синтезу 118-го элемента позволили отбросить несколько прежних моделей, — вспоминает Кентон Муди. — Мы сделали мишень из калифорния, поскольку более тяжелые элементы в нужных количествах были недоступны. Кальций-48 содержит восемь добавочных нейтронов по сравнению со своим основным изотопом кальцием-40. При слиянии его ядра с ядром калифорния образовывались ядра со 179 нейтронами. Они находились в сильно возбужденных и поэтому особо нестабильных состояниях, из которых быстро выходили, сбрасывая нейтроны. В результате мы получили изотоп 118-го элемента со 176 нейтронами. И это были настоящие нейтральные атомы с полным набором электронов! Живи они чуть подольше, можно было бы судить и об их химических свойствах».
— Мы сделали мишень из калифорния, поскольку более тяжелые элементы в нужных количествах были недоступны. Кальций-48 содержит восемь добавочных нейтронов по сравнению со своим основным изотопом кальцием-40. При слиянии его ядра с ядром калифорния образовывались ядра со 179 нейтронами. Они находились в сильно возбужденных и поэтому особо нестабильных состояниях, из которых быстро выходили, сбрасывая нейтроны. В результате мы получили изотоп 118-го элемента со 176 нейтронами. И это были настоящие нейтральные атомы с полным набором электронов! Живи они чуть подольше, можно было бы судить и об их химических свойствах».
Мафусаил номер 117
Элемент 117, он же унунсептий, был получен позже — в марте 2010 года. Этот элемент был рожден на той же машине У-400, где, как и раньше, обстреливали ионами кальция-48 мишень из берклия-249, синтезированного в Окриджской национальной лаборатории. При столкновении ядер берклия и кальция возникали сильно возбужденные ядра унунсептия-297 (117 протонов и 180 нейтронов). Экспериментаторам удалось получить шесть ядер, пять из которых испарили по четыре нейтрона и превратились в унунсептий-293, а оставшееся испустило три нейтрона и дало начало унунсептию-294.
Экспериментаторам удалось получить шесть ядер, пять из которых испарили по четыре нейтрона и превратились в унунсептий-293, а оставшееся испустило три нейтрона и дало начало унунсептию-294.
В сравнении с унуноктием унунсептий оказался настоящим Мафусаилом. Период полураспада более легкого изотопа — 14 миллисекунд, а более тяжелого — целых 78 миллисекунд! В 2012 году дубнинские физики получили еще пять атомов унунсептия-293, позже — несколько атомов обоих изотопов. Весной 2014 года ученые из Дармштадта сообщили о синтезе четырех ядер 117-го элемента, два из которых имели атомную массу 294. Период полураспада этого «тяжелого» унунсептия, измеренный немецкими учеными, составил около 51 миллисекунды (это хорошо согласуется с оценками ученых из Дубны).
Сейчас в Дармштадте готовят проект нового линейного ускорителя тяжелых ионов на сверхпроводящих магнитах, который позволит провести синтез 119-го и 120-го элементов. Аналогичные планы осуществляют и в Дубне, где строится новый циклотрон ДС-280. Не исключено, что всего через несколько лет станет возможным синтез новых сверхтяжелых трансуранов. И сотворение 120-го, а то и 126-го элемента со 184 нейтронами и открытие острова стабильности станут реальностью.
Не исключено, что всего через несколько лет станет возможным синтез новых сверхтяжелых трансуранов. И сотворение 120-го, а то и 126-го элемента со 184 нейтронами и открытие острова стабильности станут реальностью.
Периодическая система между химией и физикой
150 лет назад Дмитрий Иванович Менделеев сформулировал периодическую систему , фундаментальный закон химии, который впоследствии был объяснен в терминах квантовой физики. Весной 1869 года 34-летний Д. И. Менделеев представил свою первую версию того, что впоследствии стало известно как периодическая система или таблица, только что созданному Русскому химическому обществу. Я буду использовать два термина периодическая система или таблица как синонимы.
1. Макроскопическое представление внутренней структуры атома
Менделеевская система или классификация химических элементов обеспечила неорганическую химию прочным фундаментом, который упорядочил запутанное количество экспериментальных данных; в то же время он предсказал существование нескольких до сих пор неизвестных элементов.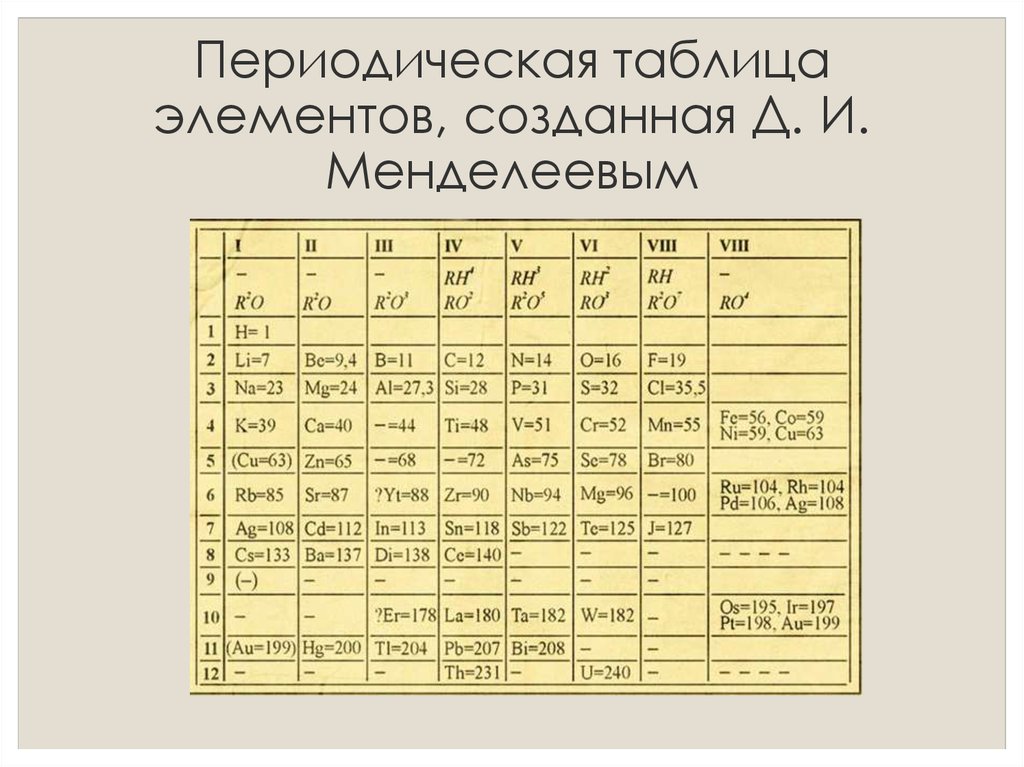 Короче говоря, он оказался чрезвычайно плодородным.
Короче говоря, он оказался чрезвычайно плодородным.
Хотя нынешние версии периодической таблицы содержат 118 элементов по сравнению с 63 в исходной таблице Менделеева, системы, используемые сегодня, происходят непосредственно от системы, предложенной в 1869 году.. До конца девятнадцатого века периодическая система принадлежала исключительно науке химии, но когда дело дошло до объяснения того, почему система работает так хорошо, инициативу взяли на себя физики. Как выяснилось в 1920-х годах, периодическая система представляет собой макроскопическое представление внутренней структуры атомов. С этой точки зрения речь идет не только о химии, но и о физике.
Рис. 1. Дмитрий Иванович Менделеев (1834–1819 гг.)07) и его периодическая таблица.
2. Химические элементы
Конечно, периодическая система предполагает знание того, что представляет собой химический элемент. Современная концепция элемента восходит к концу восемнадцатого века и многим обязана французскому химику Антуану-Лорану Лавуазье, великому реформатору химии. Определение элемента, данное Лавуазье, было эмпирическим в той мере, в какой он ограничивал элементы субстанциями, которые не могли быть разложены на еще более простые субстанции. Хотя это определение не зависит от того, состоит ли материя из атомов или нет, в 1808 году Джон Дальтон сделал важный шаг, чтобы связать воедино элементы и атомы.
Определение элемента, данное Лавуазье, было эмпирическим в той мере, в какой он ограничивал элементы субстанциями, которые не могли быть разложены на еще более простые субстанции. Хотя это определение не зависит от того, состоит ли материя из атомов или нет, в 1808 году Джон Дальтон сделал важный шаг, чтобы связать воедино элементы и атомы.
Согласно Дальтону, атом — это наименьшая единица элемента, а это означает, что существует столько различных атомов, сколько существует различных элементов. Более того, Дальтон ввел важнейшее понятие атомного веса, тем самым связав элемент с измеримой величиной. Таким образом, чистый элемент можно определить как вещество с определенным атомным весом.
К концу 1850-х годов, когда идеи Дальтона получили широкое признание, определение атомного веса стало важной частью химии. Именно на этой основе Менделеев построил свою систему элементов, и именно на этой основе немецкий химик Юлиус Лотар Мейер независимо предложил примерно аналогичную схему позже в 1869 г.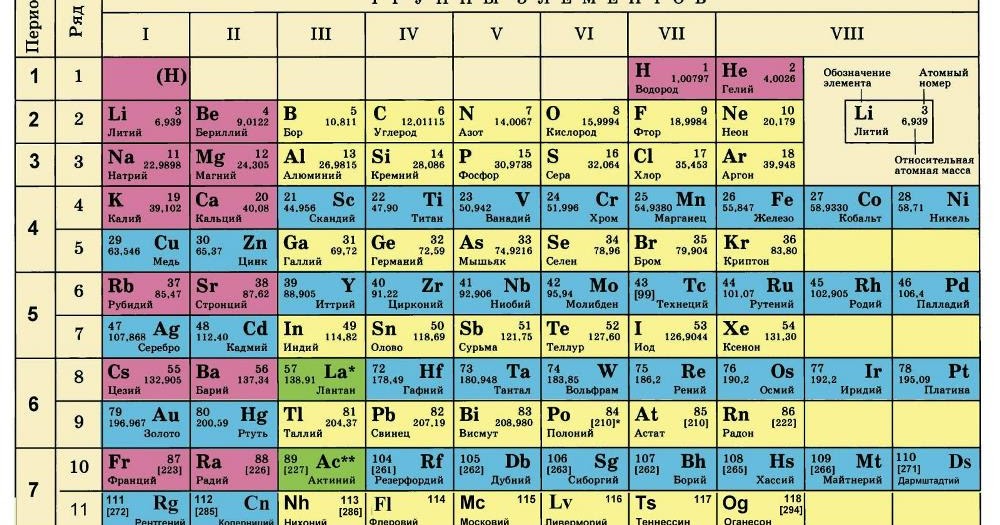 . Таким образом, периодическая система имеет двух отцов, но первым появился Менделеев, и его система имела большее влияние, чем система Мейера.
. Таким образом, периодическая система имеет двух отцов, но первым появился Менделеев, и его система имела большее влияние, чем система Мейера.
Рис. 2. Юлиус Лотар Мейер (1830–1895) и Лоран Лавуазье (1743–1794).
3. Прогнозы, успехи и проблемы
3.1. Преимущества Периодической таблицы Менделеева
К середине 1880-х годов периодическая система была признана незаменимым ключом к пониманию элементов и их комбинаций в химических соединениях. В основном было две основные причины, по которым химики так положительно отреагировали на нововведение Менделеева: во-первых, он упорядочил все известные элементы в одну связную систему и, таким образом, впервые установил организующий принцип, справедливый для всех элементов и их свойств.
Во-вторых, что еще более важно, система Менделеева обладала замечательной предсказательной силой. Она не только предсказала существование новых элементов, которые впоследствии были открыты, но и пересмотрела атомный вес некоторых элементов. Например, считалось, что атомный вес бериллия составляет примерно 14,5, что делает этот элемент гомологом алюминия, тогда как Менделеев утверждал, что его система требует, чтобы атомный вес был близок к 9. Когда эксперименты, проведенные примерно в 1880 году, доказали атомную массу бериллия вес будет 9.1, естественно, это считалось триумфом системы классификации Менделеева.
Например, считалось, что атомный вес бериллия составляет примерно 14,5, что делает этот элемент гомологом алюминия, тогда как Менделеев утверждал, что его система требует, чтобы атомный вес был близок к 9. Когда эксперименты, проведенные примерно в 1880 году, доказали атомную массу бериллия вес будет 9.1, естественно, это считалось триумфом системы классификации Менделеева.
Что касается предсказания новых элементов, Менделеев, как известно, заявил, что пробелы в его системе соответствуют трем неизвестным элементам с атомными номерами ок. 44, 68 и 72 и напоминающие бор, алюминий и кремний соответственно. Когда эти три элемента были открыты в природе между 1875 и 1886 гг., они были названы скандием (1879 г.), галлием (1875 г.) и германием (1886 г.), и оказалось, что их свойства близко соответствуют предсказанным Менделеевым.
Для большинства химиков эти и другие успешные предсказания доказали правильность периодической системы вне всяких разумных сомнений. Однако некоторые из предсказаний Менделеева оказались совершенно неверными, например, его предсказание «эка-цезия» с атомным весом ок. 175 и его более позднем предположении, что эфир физиков был химическим элементом, намного более легким, чем водород.
175 и его более позднем предположении, что эфир физиков был химическим элементом, намного более легким, чем водород.
2.2. Благородные газы
Несмотря на многочисленные успехи, к концу девятнадцатого века периодическая система столкнулась с проблемами и аномалиями, указывающими на недостатки исходной системы. Например, из таблицы Менделеева следовало, что йод обязательно должен иметь атомный вес больше, чем теллур, а между тем опыты показали обратное. Когда в 189 г. был неожиданно открыт аргон.4 и оказался одноатомным газом с атомным весом 39,8, это создало проблемы. Для нового элемента в периодической системе, казалось, не нашлось места, что сначала заставило Менделеева усомниться в его существовании и предположить, что, возможно, это не элемент, а трехатомный азот N 3 . С открытием гелия и других благородных газов стало понятно, что угроза периодической системе только кажется существующей. Все, что было необходимо, это расширить исходную систему новой группой, зарезервированной для благородных газов.
Тем не менее, оставалось проблемой то, что атомный вес аргона находился между атомным весом калия (39,1) и кальция (40,1). Могло ли случиться так, что атомный вес не был, в конце концов, правильным параметром упорядочения периодической системы?
4. Первые попытки объяснения
4.1. Атомное строение и массы
Согласно Менделееву и большинству химиков, периодическая система элементов была прежде всего эмпирическим законом, не нуждающимся в дальнейшем объяснении в терминах, например, строения атомов. На самом деле Менделеев категорически отрицал, что атомы могут состоять из более мелких частиц. Тем не менее, некоторые химики с спекулятивным мышлением задавались вопросом, почему атомные массы, представленные в системе, имеют определенные значения, а другие отсутствуют. Например, почему элементы первого периода имеют атомный вес примерно 7 (Li), 9(Be), 11 (B), 12 (C), 16 (O) и 19 (F), при этом нет ни одного с весами, близкими к 8, 10, 13, 15 и так далее?
В то время как Менделеев отклонял такие вопросы как бессмыслицу, другие химики предположили, что все атомы представляют собой конгломераты очень маленьких первичных частиц, либо атомов водорода, либо чего-то меньшего размера. К этой группе принадлежали Уильям Крукс из Лондона, Великобритания, Юлиус Дж. Томсен из Копенгагена, Дания, а также Лотар Мейер из Тюбингена, Германия, которые считали, что периодическую систему можно объяснить с точки зрения строения атома. Однако их расплывчатые и качественные предложения не приветствовались большинством химиков. Только с открытием электрона Дж. Дж. Томсоном в конце века они были преобразованы в количественную теорию, а затем уже физиком, а не химиком.
К этой группе принадлежали Уильям Крукс из Лондона, Великобритания, Юлиус Дж. Томсен из Копенгагена, Дания, а также Лотар Мейер из Тюбингена, Германия, которые считали, что периодическую систему можно объяснить с точки зрения строения атома. Однако их расплывчатые и качественные предложения не приветствовались большинством химиков. Только с открытием электрона Дж. Дж. Томсоном в конце века они были преобразованы в количественную теорию, а затем уже физиком, а не химиком.
Рис. 3. Уильям Крукс (1832–1919) и Джулиус Дж. Томсен (1826–1909).
4.2. Модель атома Томсона
Согласно атомной модели Томсона примерно 1904 года, атомы состояли из большого количества отрицательно заряженных электронов, движущихся по круговым орбитам внутри положительно заряженной невесомой сферы. На основе этой картины Томсен провел сложные расчеты, чтобы найти устойчивые электронные конфигурации, которые, как он предположил, были аналогичны конфигурациям реальных атомов. Таким образом, он пришел к конфигурациям, которые показали заметную периодичность того же рода, что и таблица Менделеева. Или, как оптимистично писала химик Ида Фройнд в 1904, теория Томсона дала «объяснение эмпирических отношений между атомным весом и атомными свойствами, воплощенными в периодическом законе».
Таким образом, он пришел к конфигурациям, которые показали заметную периодичность того же рода, что и таблица Менделеева. Или, как оптимистично писала химик Ида Фройнд в 1904, теория Томсона дала «объяснение эмпирических отношений между атомным весом и атомными свойствами, воплощенными в периодическом законе».
Согласно модели Томсона, химические свойства элементов были связаны с определенными структурами электронов, которые соответствовали химическим группам и объясняли их. Однако он связывал группы с внутренними электронными структурами, а не, как в более поздних теориях, с электронами в самом внешнем кольце. Энергичная попытка Томсона объяснить периодическую систему с точки зрения электронных конфигураций была не только схематичной, но и построенной на неверной атомной модели, просуществовавшей менее десяти лет. Тем не менее, это была первая подобная попытка, и только по этой причине она заслуживает места в истории науки.
5. Ядерный атом и его последствия
5.
 1. Радиоактивность
1. РадиоактивностьОткрытие радиоактивности в 1896 году и признание того факта, что радиоактивный распад связан с нестабильностью некоторых элементов, вызвали проблемы для общепринятого понимания элементов и их классификации. Менделеев категорически отрицал, что радиоактивность является атомным свойством, а также что радий и другие тяжелые элементы самопроизвольно превращались в другие элементы. Он считал, что это противоречит самой природе элементов, на которых покоится периодический закон.
Связанной с этим проблемой было запутанное количество радиоактивных веществ, выделенных из ряда распада урана, тория и актиния. Некоторые из этих веществ были химически неотделимы от других элементов, и тем не менее они отличались от них и не имели собственного положения в таблице Менделеева.
5.2. Изотопы
В 1910 году Фредерик Содди предположил, что существуют разные виды одного и того же элемента с разным атомным весом. Предложение было радикальным, поскольку оно нарушало установленный химический принцип, согласно которому каждая часть элемента имеет одинаковую атомную массу. Как признал Содди, это «прямо противоречило принципу периодического закона». Три года спустя он придумал слово «изотоп», которое теперь связывал с гипотезой Эрнеста Резерфорда об атомном ядре.
Как признал Содди, это «прямо противоречило принципу периодического закона». Три года спустя он придумал слово «изотоп», которое теперь связывал с гипотезой Эрнеста Резерфорда об атомном ядре.
Примерно к 1915 году многие физики обратились к новому представлению об атоме, разработанному Резерфордом и Нильсом Бором, в том числе к тому, что атомный номер, определяемый зарядом ядра, был определяющим параметром элемента. Поскольку два изотопа имеют одинаковый атомный номер, они занимают одинаковое положение в периодической таблице, несмотря на то, что имеют разный атомный вес; и поскольку электронная конфигурация зависит только от заряда ядра, они обладают одинаковыми химическими свойствами.
Концепция атомного номера получила убедительное подтверждение в рентгеновских спектроскопических измерениях, впервые проведенных Генри Мозли. Это также обеспечило сильную поддержку модели атома Резерфорда-Бора. Метод Мозли был исключительно важен, поскольку он привел к новой интерпретации природы системы Менделеева.
6. Теория периодической системы Бора
Уже в своей атомной теории 1913 г. более сложной теории, что он разработал полномасштабное объяснение, основанное на принципах старой квантовой теории. В работах между 1921 и 1923 годами он охарактеризовал орбиты электронов их главным и азимутальным квантовыми числами, которые в то время обозначались как 9.0131 н и к . Руководствуясь принципом соответствия, данными рентгеновской спектроскопии и химическими свойствами элементов, он впервые присвоил электронные конфигурации всем элементам от водорода до урана. Таким образом, он смог реконструировать периодическую систему, включая малоизученную группу редкоземельных металлов, которая, по Бору, состояла ровно из 14 элементов.
В своей нобелевской лекции 1922 года Бор пошел еще дальше, предложив электронную конфигурацию гипотетического элемента с атомным номером 118. Этот элемент (оганесон) недавно был синтезирован в ядерных реакциях, и, что примечательно, его электронная структура считается будет таким же, как предсказал Бор почти столетие назад. Возможное существование трансурановых элементов обсуждал и немецкий физик Рихард Свинн, который в 1925, приписывал электронную структуру элементам с атомными номерами от 92 до 105.
Возможное существование трансурановых элементов обсуждал и немецкий физик Рихард Свинн, который в 1925, приписывал электронную структуру элементам с атомными номерами от 92 до 105.
Боровская реконструкция периодической системы вызвала большой положительный интерес, хотя больше среди физиков-атомщиков, чем среди химиков. В спорном случае с неизвестным элементом 72 Бор пришел к выводу, что он должен быть химически аналогичен цирконию, а не редкоземельному элементу, как считало большинство химиков. Вдохновленные предсказанием Бора, двум ученым из его института в Копенгагене, Джорджу фон Хевеси и Дирку Костеру, удалось обнаружить характерные рентгеновские линии элемента в минералах циркония. Открытие гафния, как был назван новый элемент, широко рассматривалось как триумф теории Бора. Но вскоре выяснилось, что впечатляющая теория была лишь предварительным ответом на загадку объяснения периодической системы.
Рис. 4. Нильс Бор (1885 – 1962) и его таблица Менделеева от 1922 г. Положение элемента 72 (гафний) пока свободно, гипотетический элемент 118 представлен в составе группы благородных газы, символ элемента 86 (Em, эманация) относится к старому названию радона (Rn).
Положение элемента 72 (гафний) пока свободно, гипотетический элемент 118 представлен в составе группы благородных газы, символ элемента 86 (Em, эманация) относится к старому названию радона (Rn).
7. Принцип Паули. Критически пересмотрев теорию Бора, британский физик Эдмунд Стоунер классифицировал в 1924 уровни энергии в атоме на три квантовых числа, а не на два. Результатом стала система электронных конфигураций, более полная и детальная, чем у Бора.
Теория Стоунера побудила Вольфганга Паули написать ставшую уже классической статью, опубликованную в Zeitschrift für Physik в марте 1925 г., в которой он представил знаменитый принцип исключения [1]. Когда Паули с опозданием был удостоен Нобелевской премии в 1945 году, это произошло за открытие «нового закона природы, принципа запрета или принципа Паули».
Как известно сегодня, в своей наиболее общей форме принцип исключения утверждает, что два идентичных фермиона не могут занимать одно и то же квантовое состояние. Применительно к атомным электронам он утверждает, что два электрона в атоме не могут иметь одинаковые значения четырех квантовых чисел.
Применительно к атомным электронам он утверждает, что два электрона в атоме не могут иметь одинаковые значения четырех квантовых чисел.
Одним из квантовых чисел является спиновое квантовое число, которое может принимать только два значения, соответствующие «вращению вверх» и «вращению вниз». Однако в марте 1925 г. ни спин, ни квантовая механика еще не были открыты. Вместо этого Паули ввел то, что он назвал «двойственностью» электрона (Zweideutigkeit), которую можно считать предтечей спина.
Паули не только объяснил детали периодической системы на этой основе, но также обнаружил, что максимальное число N элементов в периоде равно N = 2 n 2 , где n обозначает главное квантовое число n = 1, 2, … Это правило известно как правило Ридберга в честь шведского физика Янне Ридберга. В 1906 году он заметил, что в таком виде можно записать количество элементов в периодах (2, 8, 18 и 32). Подобное правило было впервые сформулировано Юлиусом Томсеном еще в 189 г. 5, но в то время, когда группа благородных газов была еще неизвестна.
5, но в то время, когда группа благородных газов была еще неизвестна.
8. Заключение
С помощью принципа исключения и полного механизма квантовой механики периодическая система Менделеева была объяснена с точки зрения фундаментальной физики, по крайней мере, в целом. Менделеев, основоположник системы, не приветствовал бы это развитие, ибо для него периодическая система была самостоятельным и неприводимым законом химии.
Статья опубликована на немецком языке:
- Elemente mit System,
Helge Kragh,
Physik Journal 2019 , 3 , 53–57.
Ссылки
[1] W. Pauli, über den einfluß der geschwindigkitsabhängigkeit der elektronenmase auf den zeemanfefkt, zeitschrift für Physik 913 1. 9, . http://dx.doi.org/10.1007/BF02980592
Дополнительная литература
- M. Kaji, H. Kragh, G.
 Palo, Early Responses to the Periodic System , Oxford University Press, Оксфорд, Великобритания 2015 .
Palo, Early Responses to the Periodic System , Oxford University Press, Оксфорд, Великобритания 2015 . - Х. Краг, Нильс Бор и квантовый атом , Oxford University Press, Оксфорд, Великобритания 2012 .
- Э. Шерри, Периодическая таблица , Oxford University Press, Оксфорд, Великобритания 2007 .
- Дж. В. Ван Спронсен, Периодическая система химических элементов , Эльзевир, Амстердам, Нидерланды 1969 .
Исследователи изучают историческое развитие периодической системы химических элементов
Яна Грегор, Общество Макса Планка
Химическое пространство и периодическая система химических элементов. Авторы и права: Томас Эндлер / Институт математики Макса Планка. В 1860-х годах химики Лотар Мейер и Дмитрий Менделеев независимо представили первую периодическую систему.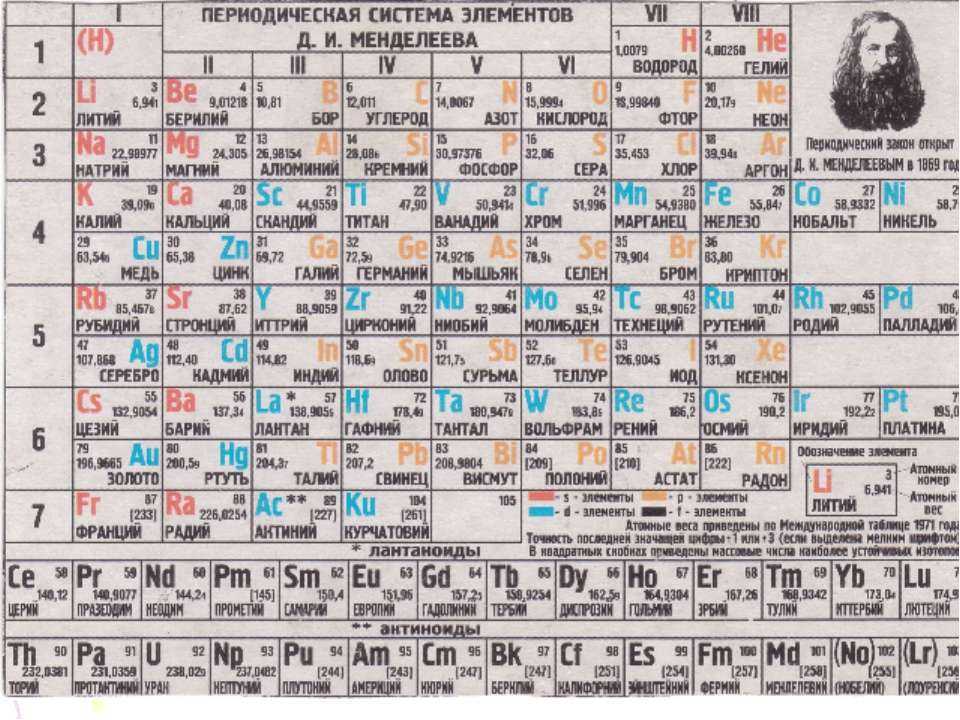 С тех пор известное табличное расположение элементов стало руководящим принципом химии. Группа исследователей из Института математики Макса Планка и Междисциплинарного центра биоинформатики при Лейпцигском университете предлагает вычислительные подходы, основанные на обширных наборах данных из базы данных по химии Reaxys, которые объясняют развитие первых периодических систем. Их результаты важны как для истории науки, так и для будущего расширения химических знаний.
С тех пор известное табличное расположение элементов стало руководящим принципом химии. Группа исследователей из Института математики Макса Планка и Междисциплинарного центра биоинформатики при Лейпцигском университете предлагает вычислительные подходы, основанные на обширных наборах данных из базы данных по химии Reaxys, которые объясняют развитие первых периодических систем. Их результаты важны как для истории науки, так и для будущего расширения химических знаний.
В недавно опубликованной статье в журнале Proceedings of the National Academy of Sciences ( PNAS ) ученые обращаются к истокам периодической системы, структура которой характеризуется сходством и порядковыми отношениями между элементами. Периодические таблицы возникли из знаний о существующих или потенциально возможных химических элементах и соединениях, известных в то время. Суммарное сочетание этих двух компонентов образует так называемое химическое пространство. Отношения порядка первоначально устанавливались на основе атомного веса и сходства с точки зрения общности химического состава. По мере того как знания о химических веществах росли на протяжении всей истории науки, росли и потенциально возможные периодические системы, находящиеся под влиянием состояния химического пространства того времени. «Нас привлекал вопрос о том, как расширение химического пространства способствовало образованию первых периодических систем. Об этом мало что было известно. Итак, мы исследовали, в частности, химическое пространство между 1800 и 1869 гг.выяснить, насколько хорошо таблица Менделеева соответствует химическим данным на момент ее составления», — описывает цель исследовательской группы Гильермо Рестрепо, руководитель проекта Института математики им. Макса Планка.
Отношения порядка первоначально устанавливались на основе атомного веса и сходства с точки зрения общности химического состава. По мере того как знания о химических веществах росли на протяжении всей истории науки, росли и потенциально возможные периодические системы, находящиеся под влиянием состояния химического пространства того времени. «Нас привлекал вопрос о том, как расширение химического пространства способствовало образованию первых периодических систем. Об этом мало что было известно. Итак, мы исследовали, в частности, химическое пространство между 1800 и 1869 гг.выяснить, насколько хорошо таблица Менделеева соответствует химическим данным на момент ее составления», — описывает цель исследовательской группы Гильермо Рестрепо, руководитель проекта Института математики им. Макса Планка.
Расширение химического пространства между 1800 и 1869
Их анализ знаний о химическом пространстве показал, что периодическая таблица химических элементов сходилась к четко видимой базовой структуре еще в 1840-х годах и, таким образом, уже была закодирована в пространстве примерно за два с половиной десятилетия до его формулировка
Первая четверть 19 века характеризовалась быстрым открытием химических элементов и их соединений, что привело к нестабильному периоду с большим разнообразием периодических таблиц, лишь немногие из которых выдержали испытание временем. В 1826 году открытие элементов замедлилось, что позволило химикам продолжить изучение свойств известных веществ и открыть соединения с новой валентностью и, следовательно, новые сходства между известными химическими элементами. Эти открытия сохранялись в течение многих лет и обеспечили консолидацию химического пространства и, таким образом, достаточно стабильных периодических систем. Между 1835 и 1845 годами система продолжала приближаться к своей базовой структуре, которая окончательно раскрылась в 1860-х годах.
В 1826 году открытие элементов замедлилось, что позволило химикам продолжить изучение свойств известных веществ и открыть соединения с новой валентностью и, следовательно, новые сходства между известными химическими элементами. Эти открытия сохранялись в течение многих лет и обеспечили консолидацию химического пространства и, таким образом, достаточно стабильных периодических систем. Между 1835 и 1845 годами система продолжала приближаться к своей базовой структуре, которая окончательно раскрылась в 1860-х годах.
Влияние органической химии
Уилмер Лил, докторант Института Макса Планка и Лейпцигского университета, описывает существенную роль органической химии в формулировании периодической системы: «Подъем органической химии в 1830-х гг. ключевую роль в облегчении распознавания сходства между элементами, широко представленными в химическом пространстве, такими как кислород, водород, углерод, азот и сера, и между металлами, часто связанными с органическими соединениями, такими как натрий, калий, палладий, платина. , барий и кальций. В то же время изобилие органических соединений затрудняло выявление сходства между металлами, которые плохо представлены в органическом пространстве».
, барий и кальций. В то же время изобилие органических соединений затрудняло выявление сходства между металлами, которые плохо представлены в органическом пространстве».
Что касается периодических систем Лотара Мейера и Дмитрия Менделеева, то оба химика уже тогда могли полагаться на зрелое химическое пространство и достаточно стабильный набор атомных весов. Таким образом, сформулированные ими системы в значительной степени соответствовали другим периодическим системам, которые были возможны в то время, согласно вычислительному анализу.
Вычислительная реконструкция химического пространства по атомным весам
Воспроизведение химического пространства до 1869 г.и учитывать роль атомных весов, известных в 19 веке, исследователи использовали базу данных по химии Reaxys и, основываясь на ее обширной информации, представили алгоритм для настройки химического пространства на различные наборы весов. Это позволяет преобразовать текущие химические формулы в любую систему атомных весов. Это позволяет приблизиться к химическому пространству, известному химикам прошлого, и оценить полученные периодические системы времени.
Это позволяет приблизиться к химическому пространству, известному химикам прошлого, и оценить полученные периодические системы времени.
Анализируя различные периодические системы, сформулированные с течением времени, ученые обнаружили, что их структура определяется главным образом сходством между химическими элементами и в меньшей степени их порядком, основанным на атомном весе. «Измерение этих сходств было для нас самой сложной частью, и результаты были довольно неожиданными. Ранее предполагалось, что периодические системы могут быть сформулированы только в том случае, если задана стабильная система атомных весов. Однако мы смогли продемонстрировать, что даже нестабильные веса, о которых сообщалось до 1860 года, давали довольно стабильные периодические системы», — говорит Петер Штадлер, профессор Междисциплинарного центра биоинформатики Лейпцигского университета.
Обзор с видением
Метод, представленный в статье для формулирования периодической системы для данного химического пространства, не ограничивается прошлым, но также может быть применен ко всем возможным средам, таким как изучение химических пространств, созданных при экстремальные условия давления и температуры. Внедрение этого метода может дать исчерпывающую картину химии в режиме реального времени, что также будет иметь значение для преподавания и будущего этой области. Хотя их подход является скорее вычислительным, чем историческим, ученые надеются, что он сможет дополнить другие инструменты в истории химии и способствовать развитию химических знаний.
Внедрение этого метода может дать исчерпывающую картину химии в режиме реального времени, что также будет иметь значение для преподавания и будущего этой области. Хотя их подход является скорее вычислительным, чем историческим, ученые надеются, что он сможет дополнить другие инструменты в истории химии и способствовать развитию химических знаний.
Узнать больше
Скрытая структура периодической системы
Дополнительная информация: Уилмер Лил и др., Расширение химического пространства в 1826 и 1840-х годах привело к сближению с периодической системой, Proceedings of the National Academy of Sciences (2022). DOI: 10.1073/pnas.21119
Алгоритм: keeper.mpdl.mpg.de/d/2284ca87fd124ea9823f/
Информация журнала: Труды Национальной академии наук
Предоставлено Общество Макса Планка
Цитата :
Исследователи изучают историческое развитие периодической системы химических элементов (2022, 1 августа)
получено 4 октября 2022 г. из https://phys.org/news/2022-08-исторический-периодический-химический-элементы.html
из https://phys.org/news/2022-08-исторический-периодический-химический-элементы.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Что показывает периодическая таблица?
Периодическая таблица Merch Store |
Периодическая таблица химических элементов является культурной иконой и выдающимся объектом в научном пространстве. На этой странице исследуется, что такое периодическая таблица с точки зрения философии науки .
На этой странице исследуется, что такое периодическая таблица с точки зрения философии науки .
Введение
Хемогенез Интернет-книга исследует, как химическая реактивность возникает из периодического таблица элементов, использующая метафору химического дерева корень-ствол-ветвь, с периодической таблицей, расположенной у основания ствола. Вопрос в том, что на самом деле это периодическая таблица , и что показывает ? Выясняется, что дело обстоит несколько сложнее, чем могло бы быть на самом деле. сначала появляются …
Во-первых, длинная форма Периодическая таблица из 32 столбцов (по мнению автора, это предпочтительная формулировка):
Периодическая таблица из 32 столбцов [полная форма]
, ПТ обычно сводится к «классическому» 18 столбцу средняя форма периодическая таблица, используемая WebElements и большинством других веб-сайтов и учебников:
The WebElements 18 Column [Medium Form] Periodic Table следующую страницу этой веб-книги.
Философия | Химия | Периодическая таблица
“[В 1913 году], когда Генри Мозли экспериментально определил и проанализировал рентгеновские спектры внутренней оболочки атома, а Нильс Бор изобрел свою атомную модель, эмпирическая и теоретическая основа для числа элементов была найдена как число протонов в ядре для физика и число электронов нейтрального атома для химика.0005 “Это отражает концептуальную разницу:
«[Атомный номер] Z оказался полезным в качестве порядкового номера для упорядочения ядер на изотопной диаграмме [Сегре], а также для получения химически значимого порядка химических элементов». Откуда: Физическое происхождение химических периодичностей в системе элементов , Чистая и прикладная химия | Том 91: Выпуск 12, 2019 г. |
Философы-химики считают элементы по-разному:
- Во-первых, существует химический элемент как “основное вещество” , то есть абстрактное или трансцендентальное элемент, сущность элемента , элемент как «носитель свойств», но не имеющий реальных свойства, кроме атомного номера Z. Химические символы, таких как H и Cu, и названия присвоены элементу как основному веществу.
- Изотопный состав ядра сохраняется , а различные ядерные свойства изменяются вместе с элементом по мере того, как он претерпевает химические превращения и химические реакции: средняя атомная масса, радиоактивность, ядерный спин, электроотрицательность и потому, что 0003 Z = n (атомный номер равен основному квантовому числу в нейтральном атоме), квантовые числа и электроотрицательность.

- В-третьих, есть
это элемент как простое вещество . настоящий физический кусок медного металла весом 5,00 г имеет множество,
измеримые, внутренние свойства, такие как: плотность, проводимость,
цвет, чистота и т. д. Важно отметить, что эти свойства НЕ сохраняются, когда медь подвергается химическим реакциям, таким как растворение в концентрированной азотной кислоте.
[В этой теме есть языковая проблема, и она касается использования технических терминов: «базовый» и «простой». Эти слова используются в стольких различных контекстах, что бывает очень трудно запомнить, что здесь они имеют очень специфические значения.]
Важно только основное вещество и ядерные свойства сохраняются в соединении. Эти идеи можно проиллюстрировать утверждением:
“Натрий металлик свойства и хлор, зеленый газ , не существуют в виде бесцветной кристаллической ионной соли, хлорид натрия .
”
Другими словами, «аспект серебристого металла натрия» и «аспект зеленого газа хлора» не существуют в бинарном соединении хлорида натрия.
Эти вопросы обсуждаются в статье Эрика Scerri, HYLE – Международный журнал философии химии, Vol. 11, № 2 (2005), стр. 127-145: Некоторые аспекты метафизики химии и природы The Elements (2-е изд. 2020 г.)
Обобщая аргументы Шерри:
- Существует метафизический взгляд на природу элементов как основных субстанций и носителей свойств восходит к древним грекам, задолго до открытие атомов.
- Менделеев настаивал что его система периодической классификации относилась к элементам как к основным вещества, обладающие только одним свойством — атомной массой.
- Панет, один из
основоположники современной радиохимии восприняли взгляды Менделеева на
природа основной и простой субстанции, но изменено основное/трансцендентное/абстрактное свойство
элемента от атомного веса/массы до атомного номера, Z.

- Элементы как базовые вещество представляет собой природные виды , хорошо понимаемое философское положение о характере классификации. Элементы как простые вещества не проходят тест на естественный вид из-за существования изотопов и аллотропы и др.
Эрик Шерри отмечает, что периодическая таблица иногда характеризовалась как:
- представление, упорядоченная область, система классификации, модель, закон и/или теория
Этот автор согласен с Шерри в том, что периодическая таблица представляет собой упорядоченный домен . Но периодическая таблица — это тоже схема . Данные, информация и знания о химических элементах могут быть отображены на периодической таблице.
| Периодические таблицы на стенах и в книгах: Что они показывают ? Почему возникла проблема ? Периодические таблицы используют дизайн в качестве организующей схемы для перечисления химических элементов и представления физических данных и свойств материалов элементов. В своей простейшей форме периодические таблицы показывают элементы только с атомным номером Z и символом элемента. Строго , это показывает элементы как основную [трансцендентальную, абстрактную] субстанцию. Однако они могут продолжить:
По мнению автора, было логическая ловкость рук . Метафизическую периодическую таблицу абстрактных, основных веществ выдают за периодическую таблицу материальных свойств простых веществ, что совсем не одно и то же. Это вызывает путаницу в отношении того, что именно представляет собой конкретная таблица Менделеева и что она показывает. |
Преобразование нескольких периодических таблиц
По крайней мере можно легко идентифицировать три таблицы Менделеева (но, как мы увидим, на самом деле гораздо больше ):
- Периодическая таблица основных элементов с атомным номером Z и соответствующим символом атома: H, He , Ли и др.
- Периодическая таблица атомов газовой фазы с соответствующими энергиями ионизации, спектрами и т. д.
- Затем есть периодическая таблица химических веществ в бутылках , фактические материалы при стандартной [комнатной] температуре и условиях давления.
При перемещении по этих трех периодических таблиц сложность системы и количество свойств резко возрастают.
- Элементы периодической таблицы основных веществ имеют только свойство: атомный номер Z.
- Атомы газовой фазы обладают такими свойствами: энергия ионизации, сродство к электрону, атомный радиус, атомный эмиссионный спектр и т.
 д.
д. - Элементы стандартного состояния обладают десятками свойств: электропроводностью, плотностью, молярными объемами, цветом, кристаллической структурой, энтальпией гидратации и т. д. В качестве веществ элементы могут представлять собой: металлы, молекулярные ван-дер-ваальсовые материалы, сетчатые ковалентные вещества и даже промежуточные металлоиды.
И есть еще больше периодических таблиц:
Периодические таблицы могут показывать фазовое состояние (твердое, жидкое или газообразное) элементарных материалов при стандартной температуре 25°C и при других температурах, например 2025°C (из pTable):
Или:
- Даты открытия
- Страны, в которых было сделано открытие
- Использование
- ЯМР свойства
- и т.д…
Все эти многие и различные периодические таблицы превращаются друг в друга , чтобы дать составной объект, который широко известен как [и представлен как] Периодическая таблица .
- Периодическая таблица в веб-пространстве, которая лучше всего иллюстрирует эту склонность к множественным преобразованиям, — это динамическая pTable Майкла Дайи.
Периодическая таблица элементов как основных веществ
Полная периодическая таблица основных, абстрактных, трансцендентных веществ, показывающая единственное свойство, атомный номер Z, ведущее себя как порядковый номер:
Периодическая таблица основных веществ (атомный номер Z)
Символы и названия элементов присвоены атомному номеру Z:
Периодическая таблица основных веществ (атомный символ)
В основном веществе , атомный номер кислорода 8 – это «O», а не обычная молекула «O 2 ». Точно так же сера (Z = 16) представляет собой S, а не желтое твердое вещество S 8 .
Обычная схема таблицы Менделеева просто показывает символы элементов в их
соответствующие периоды, группы и блоки.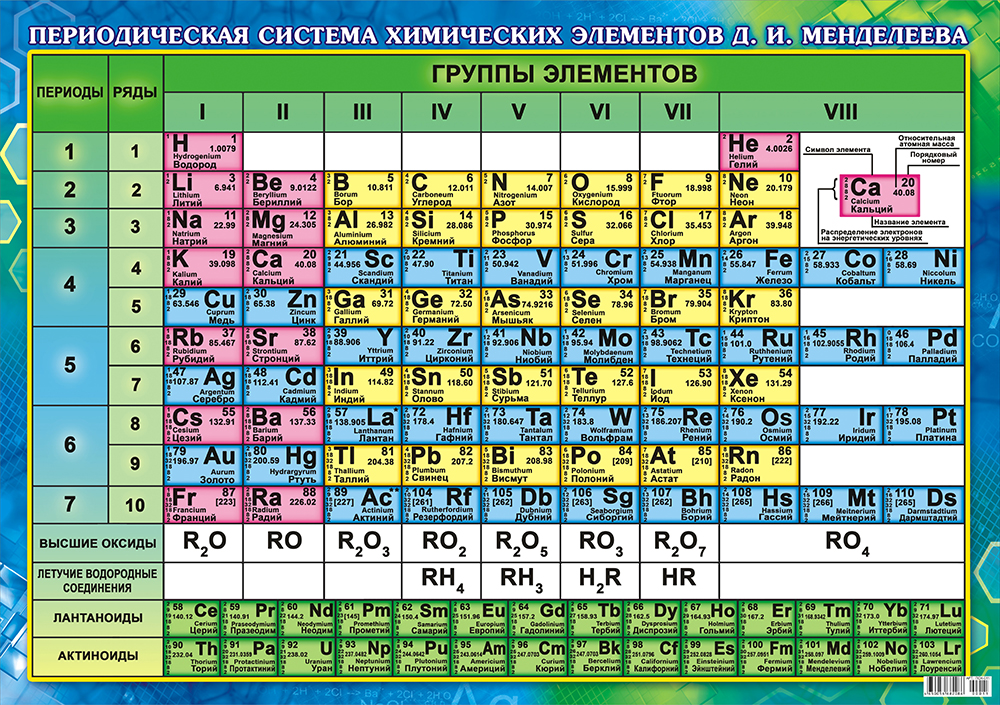
Это или эквивалентная формулировка представляет собой периодическую таблицу Менделеева. задумал это: схема, показывающая элементы как основные субстанции с их позиции в схеме, подчеркивающие периодичность закон:
” Периодический закон – это принцип, согласно которому определенные свойства элементов проявляются периодически при упорядочении по атомному номеру. Эти сходства можно отразить лучше всего с помощью таблицы, так что общие черты между элементами проявляются как в строк и в столбцах таблицы .” Википедия
Периодическая таблица сохраняющихся [ядерных] свойств
Сохраняющиеся ядерные свойства являются следствием изотопного состава элемента, который непосредственно определяет относительную атомную массу (определяемую как отношение средней массы атомов химического элемента в данном образце по сравнению с 1/12 массы атома углерода-12.)
Относительная атомная масса сохраняется в химических реакциях:
Na (масса = 22,99) + Cl (масса = 35,45) → NaCl (масса = 22,99 + 34,45 = 58,44)
Аналогично, радиоактивность переносится с атомами.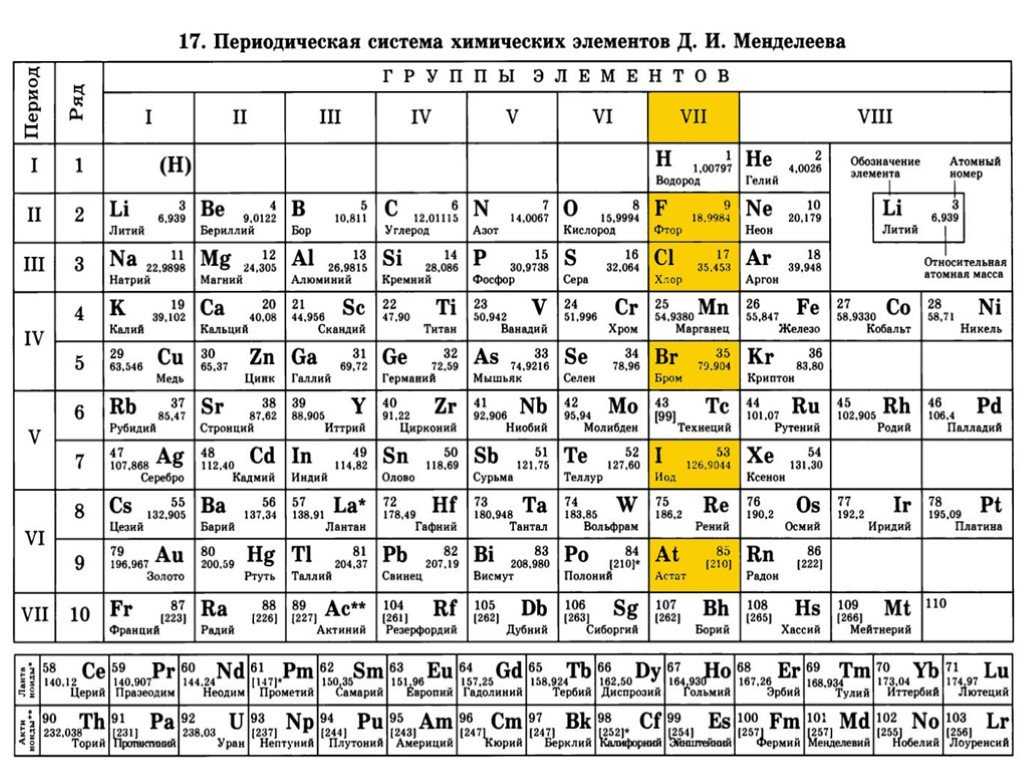 Натрий с радиоактивной меткой будет реагировать с хлором с образованием хлорида натрия с радиоактивной меткой.
Натрий с радиоактивной меткой будет реагировать с хлором с образованием хлорида натрия с радиоактивной меткой.
Существует незначительный (но важный) кинетический изотопный эффект или КИЭ. Более тяжелые изотопы очень немного менее реакционноспособны, чем более легкие изотопы, просто потому, что они менее подвижны. Эффект KIE наиболее заметен для водорода, где дейтерий 2 H, имеет двойную массу протия, 1 H. Однако в первом приближении КИЭ можно не учитывать.
В элементе как основном (абстрактном) веществе атомный номер Z является просто порядковым (порядковым) номером. В периодической таблице сохраняющихся [ядерных] свойств Z — это заряд атомного ядра, в нейтральном атоме это также число электронов, и, следовательно, оно напрямую определяет главное квантовое число 9.0003 п .
Квантовые числа, N , ℓ , M ℓ и M S , rative rouption or respert rol -or respert rotherlon . Нейтральные атомы: N = Z Ионы: N = ( Z – Заряд) † Обратите внимание, что не все атомные электронные структуры могут быть так легко выведены: упрощенные искусственные правила, такие как принцип ауфбау Бора и правило Маделунга, подходят для более легких элементов главной группы, но они не всегда дают правильные результаты. с более тяжелыми d -блочными элементами. Ядерный спин — это изотопное свойство, которое используется в ЯМР-спектроскопии, особенно с 9Изотопы 0171 1 H и 13 C. Ядерный спин сохраняется и передается вместе с атомом из элементарного вещества в его соединения. Для электроотрицательности этот автор использует определение: ” Электроотрицательность представляет собой интегрированную по многочисленным физическим параметрам меру способности газовой фазы или связанного атома притягивать к себе электроны . Натрий — это крупный атом, который легко ионизируется. В реакциях натрий обычно реагирует с образованием иона натрия Na + . Эти особенности позволяют сделать вывод, что натрий является электроположительным элементом . Хлор представляет собой небольшой атом с высоким сродством к электрону и склонностью к образованию ионов хлора, Cl – . Эти особенности позволяют сделать вывод, что хлор является электроотрицательным элементом . Электроотрицательность не является «простым» свойством элементарного вещества, подобно металлическому блеску натрия или хлора в виде зеленого газа, а является присущей к каждому аспекту химии элемента, и он путешествует с атомом. Электроотрицательность — это законсервированное свойство, являющееся следствием из Z . Химические элементы как реальные, простые
элементарные вещества могут быть физически нормализованы в аналогичный набор путем изучения одноатомных атомов газовой фазы в основном состоянии материального вещества. Периодическая таблица почвы
состояние атомов газовой фазы известно, и она представляет собой периодическую таблицу очень
простейшие простые вещества: Периодическая таблица атомов газовой фазы Помимо названия, графическое
точно такая же, как периодическая таблица основных веществ, но эта периодическая таблица представляет
реальные химические объекты с реальными измеримыми физическими свойствами, в том числе: Многие современные технологии используют
атомы газовой фазы, в том числе: Что особенно важно, , когда мы рассматриваем электронную структуру атома [или орбитальную структуру молекулы, если уж на то пошло], мы рассматриваем атом как изолированную сущность, точно такую же, как в газе. фаза. Например, когда мы говорим: «Натрий имеет 1 s 2 , 2 s 2 , 2 p 6 , 3 s 1 , атом натрия, электронная структура, не натрий в твердом, металлическом состоянии, Na(s) При стандартных условиях, 298K и 100 кПа (25°C и 1,0 атм), химические элементы как простые вещества – настоящие химикаты, химические реагенты, химикаты во флаконах – присутствует как: Примечание: Химические элементы как материал
вещества обладают многими свойствами, в том числе [от WebElements,
медь]: Изобилие
элементов (земная кора) Твердость по Виккерсу ЯМР относительная чувствительность В первой половине двадцатого
века, много усилий было затрачено на то, чтобы составить периодическую таблицу
элементы аксиоматичны (“само собой разумеющиеся” или “бесспорные”), т.е. пытаясь полностью понять
система Менделеева с точки зрения
квантовая механика. В 1929 г. Пол
Дирак, как известно, утверждал, что эта ситуация была 90 254 полностью и полностью достигнута 90 003 в
принцип ” Базовый
физические законы, необходимые для математической теории значительной части
Таким образом, физика и вся химия полностью известны и
трудность только в том, что точное применение этих законов приводит
к уравнениям, слишком сложным для решения. Мы обязательно учим в школе
и студенты университета, что “ таблица Менделеева полностью понята с точки зрения электронной теории “, и эта линия рассуждений
продвинутый в других местах этой веб-книги, здесь и на сайте HyperPhysics, здесь. Аргумент выдвинут
что: Да, существует эмпирическое (экспериментальное) соответствие между атомами газовой фазы и их спектрами, но Существует ли соответствие 1-к-1-к-1 между периодической таблицей, атомными спектрами и квантовой механикой? Эрик
Шерри: Эрик Шерри, Периодическая таблица: история и значение , Oxford University Press, 2006. оспаривает
полное и полное аксиоматическое отображение между теорией и периодической таблицей: ” Электронный
конфигурации не [полностью] не сведены ни к квантовой механике, ни
могут ли они быть получены из любого другого теоретического подхода. они получены
смесью спектроскопических наблюдений и полуэмпирических методов
как схема ауфбау Бора “. Была ли периодическая таблица полностью аксиоматизирована? Эркеннтнис , 47 , 229-243, 1997 Причина расхождения
касается трудности работы с многоэлектронными атомами (ионами и молекулами). Эффект
производить хороший быстрый компьютерный код, который может эффективно предсказывать такие свойства, как атомная и молекулярная энергия, геометрия и спектры и т. д., но за счет
полной аксиоматичности теории: формально логика лежащей в основе
теория становится размытой. В результате мы
получить полезную модель, но не математическое доказательство. Подробнее здесь: Физическое происхождение химических периодичностей в системе элементов , Чистая и прикладная химия | Том 91: Выпуск 12, 2019 г., Li & Schwarz и др. др. Кроме того, есть проблема даже с концепцией атомной орбитали : Из: Philosophy of Chemistry
Мартин Лабарка: “Орбитали нельзя наблюдать, поскольку, строго говоря, их не существует.” Дискуссия [об орбиталях] является проявлением проблемы, которая имеет глубокие последствия для преподавания химии, поскольку преподаватели этой дисциплины не могут обойтись без концепции орбиталей в своем обучении [ включая в эту веб-книгу ! ]. Некоторые авторы указывали, что эта позиция противоречит предположению, что квантовая механика имеет последнее слово в этом вопросе: правомерно только понятие волновой функции; термин «орбитальный» не имеет отношения к реальному миру. В частности, реалистический взгляд на орбитали, принятый учителями химии, оказывается несовместимым с их собственной позицией, когда они вводят квантовую механику как основную объяснительную теорию химических явлений. На эту проблему прямо указывает Шерри, когда задает вопрос: «Могут ли орбитали быть реальными в химии, но не в физике?» Представляется совершенно очевидным, что эта парадоксальная ситуация имеет негативные последствия для глубокого понимания дисциплины по следующим причинам: а) Студенты сталкиваются с альтернативой: жить в своего рода «концептуальной шизофрении» или признать, что химия описывает просто очевидные явления или [является] «метафорической». б) Если «правильное» определение понятия атомной орбитали лежит только в области физики, студенты, решившие изучать химию, обнаружат, что учебники по их собственной дисциплине дают «неправильное» определение понятия. Читатель может подумать, что
концепция элемента-как-основной-субстанции и -элемента-как-простой-субстанции как тайного отвлечения . Начинающие студенты-химики всегда имеют доступ к периодической таблице, но, к сожалению, это может быть не тот PT , который им действительно нужен . Ожидается, что учащиеся знают и понимают, что все уравнения реакций с участием химических элементов, вероятно, будут включать химическое вещество, химическое вещество в бутылке, реагент . Таким образом, реакции водорода включают и должны показывать молекулярный водород, H 2 и поэтому должны быть записаны как: 2H 2 + O 2 → 2H 2 O и нет: 2H + O → H 2 O . Также: азот – N 2 , OxyGen O 2, 2 , 2 , 2 , 2 , азот: азот – 2 , oxygen O , азот: NATICE – N 2 , OXYGEN. фтор F 2 , хлор Cl 2 , бром Br 2 и йод I 2 . © Марк Р. Лич, 1999- Если у вас есть: Запросы , пожалуйста, свяжитесь с автором Марком Р. Личем, используя адрес [email protected] Этот бесплатный, открытый
Доступ к веб-книге — это текущий проект , и ваш вклад приветствуется. Периодическая таблица Периодическая таблица химических элементов представляет собой табличное отображение химических элементов. Первоначальная таблица была создана без знания внутренней структуры атомов, а скорее путем сопоставления физических и химических свойств элементов с атомной массой. За этим последовал английский химик Джон Ньюлендс, который в 1865 году заметил, что элементы подобного типа повторяются с интервалом в восемь, который он сравнил с октавами музыки, хотя его закон октав был осмеян современниками. В 1913 году Генри Мозли переставил таблицу в соответствии с атомным номером, чтобы улучшить наблюдаемую периодичность химических свойств в таблице. Сегодняшняя таблица использует это упорядочение по атомному номеру (количеству протонов). Разработка Менделеевым и Мозли периодической таблицы была одним из величайших достижений современной химии. В 1940-е Гленн Т. Сиборг определил трансурановые лантаноиды и актиниды, которые могут быть помещены в таблицу или ниже (см. различные возможные расположения ниже). Естественное явление Элементы без границ еще не открыты/не синтезированы. Элементы с пунктирными границами не встречаются в природе (синтетические элементы). Элементы с пунктирными границами естественным образом возникают в результате распада других химических элементов. Элементы со сплошными границами старше Земли (первичные элементы). Каждый элемент появляется в поле, которое содержит символ элемента и его атомный номер. Многие таблицы также включают атомную массу, а некоторые также содержат дополнительную информацию. Фундаментальное упорядочение элементов представляет собой список в соответствии с их атомным номером (количеством протонов). По состоянию на 2005 год таблица содержит 116 химических элементов, открытие которых подтверждено. Из тех 94 встречаются в природе на Земле, а остальные представляют собой синтетические элементы, искусственно произведенные в лабораториях. Следуя этому базовому порядку, элементы располагаются в таблице, которая содержит определенные столбцы и строки, известные как группы и периоды соответственно (см. Столбцы таблицы известны как группы или семейства . Все элементы в группе имеют схожие свойства. Размещение элементов в группах является одним из наиболее важных способов их классификации. Есть некоторые различия в свойствах внутри группы, но изменения относительно невелики по мере продвижения вниз (или вверх) по группе. Каждая группа элементов образует то, что называется химическая серия . Существует три способа нумерации групп периодической таблицы. Стандартная система Международного союза теоретической и прикладной химии (IUPAC) состоит в том, чтобы просто нумеровать их от 1 до 18, как в таблице выше. Есть также две более старые системы, использующие римские цифры. Имена римскими цифрами являются оригинальными традиционными названиями групп; стандартная система IUPAC заменяет старые названия в попытке уменьшить путаницу, вызванную двумя старыми, но взаимозапутанными схемами. Некоторые группы имеют специальные названия (см. Существует значительная путаница вокруг двух старых используемых систем (старых IUPAC и CAS), которые сочетали использование римских цифр с буквами. В старой системе IUPAC буквы A и B обозначались в левой (A) и правой (B) частях таблицы, а в системе CAS буквы A и B обозначались для элементов главной группы (A) и переходных металлов. (Б). Первая система часто использовалась в Европе, а вторая — в Америке. Новая схема IUPAC была разработана для замены обеих систем, поскольку они ошибочно использовали одни и те же имена для обозначения разных вещей. Строки таблицы известны как периоды. Форма периодической таблицы и положение элемента в определенной группе или периоде определяется электронной структурой атомов элемента. На самом деле химические и физические свойства элемента определяются его электронной структурой. Таким образом, именно электронные структуры элементов являются источником наблюдаемой периодичности свойств, групп и периодов таблицы Менделеева. Электронные структуры элементов вытекают из квантовой механики. Квантово-механическое описание атома предполагает, что электроны имеют сложную, но точную организацию, окружающую атомное ядро. Электроны организованы в основном в снарядов увеличивающегося размера и энергии, которые нумеруются последовательно, начиная с 1 как наименьшей энергии. Особое значение имеют электроны в самой высокой энергетической (самой внешней) оболочке. Именно электроны определяют положение элемента в таблице и в первую очередь отвечают за свойства элемента. В элементах главной группы эти самые внешние электроны известны как валентные электроны. Все элементы в данной группе имеют одинаковое количество валентных электронов, но они располагаются на последовательно более высоких оболочках по мере продвижения вниз по группе. Это то, что придает элементам в группе сходные свойства. Например, все основные элементы группы с четырьмя валентными электронами находятся в группе 14, начиная с углерода. Все они имеют свои валентные электроны в подоболочках s и p. Эти четыре s- и p-электрона будут вести себя одинаково независимо от оболочки, в которой они находятся. В дополнение к разделению таблицы на группы и периоды таблицу можно разделить на блоки (см. Периодическая таблица, заполненная блоками), где последняя подоболочка, в которой находятся самые внешние электроны атома, определяет «блок», к которому он принадлежит. Углерод, например, находится в p-блоке, потому что его последние электроны находятся в подоболочке p. Общее количество электронных оболочек атома определяет период, к которому он принадлежит. Поскольку каждая оболочка разделена на разные подоболочки, по мере того, как мы переходим через элементы по атомному номеру, подоболочки будут заполняться электронами примерно в порядке, показанном в таблице ниже (в таблице числа относятся к оболочке, а буквы к подоболочке). ): Ссылки ISBN поддерживают NWE за счет реферальных сборов Все ссылки получены 7 февраля 2019 г. Периодические таблицы Энциклопедия Нового Света писатели и редакторы переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . История этой статьи с момента ее импорта в New World Encyclopedia : Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения. Фильтр поиска панели навигации
Oxford Academic от Менделеева до Оганесона: мультидисциплинарный взгляд на периодическую таблицу Физическая химияКнигиЖурналы
Термин поиска мобильного микросайта Закрыть Фильтр поиска панели навигации
Oxford Academic от Менделеева до Оганесона: мультидисциплинарный взгляд на периодическую таблицу Физическая химияКнигиЖурналы
Термин поиска на микросайте Расширенный поиск Иконка Цитировать Цитировать Разрешения Стюарт, Филип Дж, «Любители и профессионалы в химии: случай периодической системы» , Эрик Шерри и Гильермо Рестрепо (редакторы) , New York, 2018; online edn, Oxford Academic , 12 Nov. ), https://doi.org/10.1093/oso/97801 532.003.0006, accessed 4 Oct. 2022. Выберите формат
Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks) Закрыть Фильтр поиска панели навигации
Oxford Academic от Менделеева до Оганесона: мультидисциплинарный взгляд на периодическую таблицу Физическая химияКнигиЖурналы
Термин поиска мобильного микросайта Закрыть Фильтр поиска панели навигации
Oxford Academic от Менделеева до Оганесона: мультидисциплинарный взгляд на периодическую таблицу Физическая химияКнигиЖурналы
Термин поиска на микросайте Advanced Search Любители внесли ценный вклад в различные науки, включая астрономию, геологию, биологию и инженерию. Ключевые слова:
Периодический куб Адомы, Elementree, F-блок, галогены, лантаноиды, набор Мандельброта, периодический фрактал, скандий (Sc) Предмет Физическая химия В настоящее время у вас нет доступа к этой главе. Получить помощь с доступом Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией. Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic. Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору. Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю. Доступ члена общества к журналу достигается одним из следующих способов: Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале: Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество. Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже. Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок. Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Щелкните значок учетной записи в правом верхнем углу, чтобы: Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю. Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д. Наши книги можно приобрести по подписке или приобрести в библиотеках и учреждениях. Информация о покупке В этом году исполняется 150 лет со дня публикации первой таблицы Менделеева. Это потому, что периодическая таблица — это гораздо больше, чем просто список известных нам элементов. Это способ классифицировать и сортировать их: находить порядок в беспорядке химических реакций. Поразительное осознание состояло в том, что существует повторяющийся паттерн — периодичность — в свойствах элементов, например, в том, как они реагируют друг с другом. (Теперь мы знаем, что в основном это сводится к тому, как электроны в атоме, определяющие его поведение, размещаются в последовательных оболочках вокруг ядра.) Известные элементы можно расположить в ряды и столбцы, выстроив их в ряды. те же общие характеристики столбца, что и в химическом семействе. Вспышка озарения Менделеева (позже он утверждал, что видел во сне всю свою грандиозную конструкцию) также позволила ему сделать вывод о существовании еще не открытых элементов — дыр в кирпичной кладке известных элементов — и даже предсказать их свойства. Он постулировал, что «экаалюминий» должен находиться в промежутке в его таблице непосредственно под алюминием; теперь мы знаем его как галлий, и его прогнозы относительно его свойств оказались точными. В то время у Менделеева был только 61 известный элемент для сортировки, но к началу 20-го века мы идентифицировали 85 из этих фундаментальных строительных блоков Вселенной, и все они аккуратно встали на свои места в структуре. Все эти элементы встречаются в природе, и химики смогли обнаружить и изолировать их, изучая большое количество различных минералов со всего мира, подобно исследователям элементов, выискивающим новые находки. Но с середины 1930-х химики научились управлять ядерными реакциями, чтобы создавать свои собственные элементы (по сути, достигая трансмутации и мечтаний алхимиков). На данный момент искусственно создано 24 элемента; расширение нижней строки периодической таблицы с новыми творениями. Эти элементы не существуют в природе на Земле — их атомные ядра настолько раздуты и нестабильны, что они быстро подвергаются радиоактивному распаду или ядерному делению, чтобы снова распасться на другие элементы. Итак, сегодня химия вышла за рамки простого составления карты природного ландшафта таблицы Менделеева и стала фактически дополнять ее, как проекты мелиорации земель Голландии. Последний, элемент 118, был официально назван только в ноябре 2016 года: оганесон. Сейчас ученые обдумывают смелую перспективу: начать совершенно новый, восьмой ряд периодической таблицы и выйти на совершенно неизведанную территорию прямо на краю химического мира. Эти синтетические элементы не имеют применения — их можно производить только в абсолютно ничтожных количествах, и они быстро разлагаются — но растет беспокойство по поводу растущего дефицита многих экзотических элементов, которые стали крайне важными для работы нашего современного мира. На протяжении большей части истории цивилизации мы использовали довольно небольшой набор металлов, включая медь и олово для изготовления инструментов бронзового века, железо для стали, а также свинец, золото и серебро. Наш репертуар начал диверсифицироваться за последнее столетие или около того, с широким использованием алюминия и других новых металлов. Но за последние несколько десятилетий количество различных металлов, которыми мы владеем в нашем технологическом обществе, резко возросло. Современный смартфон содержит более 30 различных элементов. К ним относятся углерод и водород в пластиковом корпусе, кремний для пластин микрочипа, медная проводка и золотые контакты. Но есть также небольшое количество большого количества других металлов, каждый из которых используется из-за своих особых электронных свойств или для крошечных мощных магнитов, используемых в динамике и вибрационном двигателе. Гелий, например, считается, что в ближайшие 100 лет ему будет угрожать серьезная опасность. Это второй по распространенности элемент во Вселенной, но он чрезвычайно редок на Земле, потому что он достаточно легкий, чтобы просто покинуть верхнюю часть нашей атмосферы. Гелий, который мы используем, эффективно добывается глубоко под землей, обычно вместе с природным газом, поскольку он образуется в виде частиц излучения при распаде таких элементов, как уран. Гелий очень полезен — например, в качестве охлаждающей жидкости для сверхпроводящих магнитов в больничных томографах или в качестве чрезвычайно легкого газа для метеозондов и дирижаблей. Но как только он просачивается в воздух, он теряется навсегда, и есть опасения по поводу обеспечения поставок в будущем. С этой точки зрения его легкомысленное использование в воздушных шарах для вечеринок кажется почти болезненно расточительным. Многие из этих находящихся под угрозой исчезновения элементов представляют собой экзотические металлы, используемые в современной электронике, и действительно, поставка 17 элементов, необходимых для смартфонов, может вызвать беспокойство в ближайшие годы. Особую тревогу вызывает тот факт, что многие из тех, кто сталкивается с потенциальным дефицитом, являются именно теми элементами, которые нам нужны для «зеленых» технологий, чтобы заменить нашу зависимость от ископаемого топлива — тех, которые используются в перезаряжаемых батареях, солнечных панелях и мощных магнитах в двигателях электромобилей или электромобилей. генераторы в ветряных турбинах. Галлий, например, необходим для интегральных схем, солнечных батарей, синих светодиодов и лазерных диодов для дисков Blu-ray. Индий используется во всем, от телевизоров до ноутбуков, и, в частности, в сенсорных экранах современных смартфонов и планшетов. Подсчитано, что при нынешних темпах использования доступный индий будет израсходован через 50 лет, и его сбор и очистка станут очень дорогими.
Символ 0004 З n = (Z – заряд) нет электронная структура Нет данных 11 11 – 0 11 1 с 2 , 2 с 2 , 2 с 6 , 3 с 1 Нет + 11 11- 1 10 1 s 2 , 2 s 2 , 2 p 6 Класс 17 17 – 0 17 1 s 2 , 2 s 2 , 2 p 6 , 3 s 2 , 3 p 5 Класс – 17 17 – –1 = 17 + 1 18 1 S 2 , 2 S 2 , 2 P 6 , 3 S 2 , 3 P 2 , 3 P 2 , 3 P 2 , 3 P 2 , 3 .  0132 6
0132 6  ”
”
Периодическая таблица газовой фазы
Атомы 
 ..
..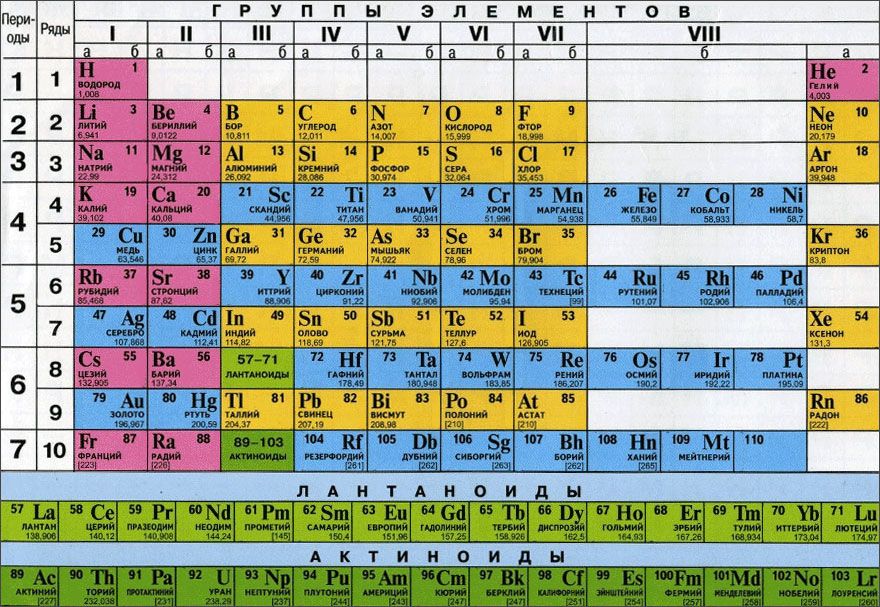
Периодическая таблица химических веществ при стандартных условиях 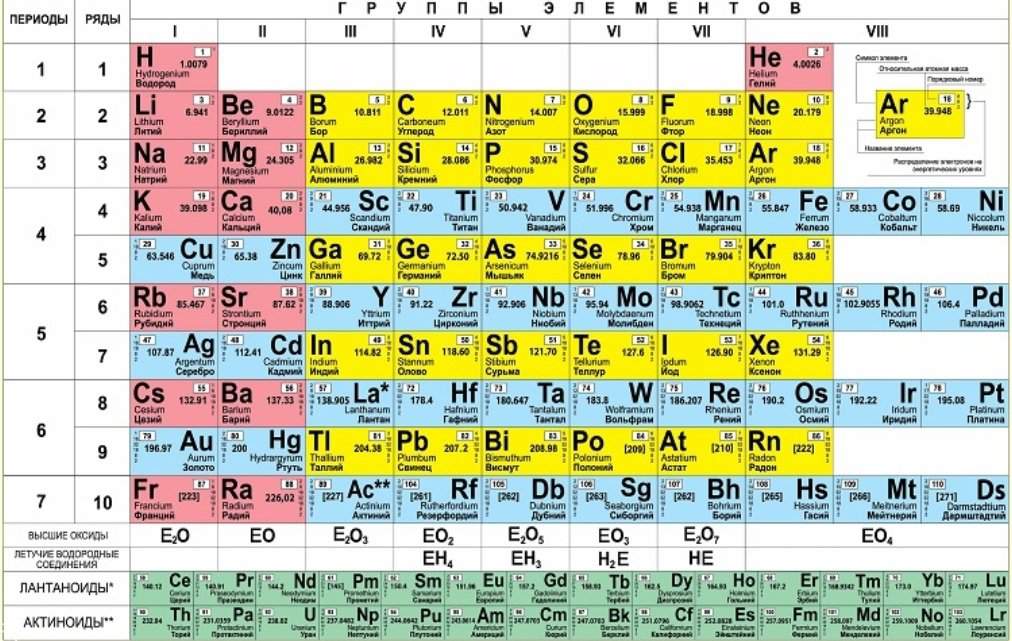 Существует много аллотропов B, P, S, Si и т. д. Много металлических фаз Pu и т. д.
Существует много аллотропов B, P, S, Si и т. д. Много металлических фаз Pu и т. д.
Изобилие элементов (океаны)
Изобилие элементов (метеориты)
Изобилие элементов (поток)
Изобилие элементов (солнце)
Изобилие элементов (Вселенная)
Изобилие в людях
Биологическая роль
Температура кипения
Энтальпия связи (двухатомные)
Объемный модуль
Ковалентный радиус
Критическая температура
Кристаллическая структура
Плотность
Описание
Открытие
Удельное электрическое сопротивление
Длина связи элемента
Энтальпия атомизации
Энтальпия плавления
Энтальпия испарения
Примеры соединений
Твердость по Бринеллю
Опасность для здоровья
История элемента
Ионные радиусы (Шеннон)
Ионный радиус (Полинг)
Ионный радиус (Полинг) монокатиона
Изоляция
Содержание изотопов
Изотоп ядерный
spins
Isotope nominal mass
Isotope nuclear magnetic moment
Lattice energies
Linear expansion coefficient
Meaning of name
Melting point
Mineralogical hardness
Molar volume
Names and symbols
NMR frequency
NMR isotopes
NMR magnetogyric ratio
NMR quadrupole moment
NMR восприимчивость
Соотношение Пуассона
Свойства некоторых соединений
Радиус Металлик
Радиоактивные изотопы
Элементы
Потенциал восстановления
Отражающая способность
Индекс преломления
Стандартный 3 -й 3 -й. свойства
свойства
Применение
Валентная орбиталь
R(max)
Радиус Ван-дер-Ваальса
Скорость звука
Рентгеновский кристалл
структура
модуль Юнга
Квантовая механика,
Спектры излучения и аксиоматическая периодическая таблица  “
“
П.А.М. Дирак, Proc.R.Soc.Lond.Ser.A
123 (1929) 714 Эрик Шерри: химик | Философ | Теоретик | Автор
 Интервью с автором читайте здесь, а рецензию на книгу — здесь.
Интервью с автором читайте здесь, а рецензию на книгу — здесь. д., Википедия. Для многоэлектронных
систем, приближения в математике должны быть сделаны, чтобы иметь дело с электрон-электронным
взаимодействия и корреляции. Многоэлектронные атомы сложны
объекты в системном смысле. математический
методы, используемые для описания химических систем, обычно прагматичны.
а не строгие, и они часто носят полуэмпирический характер, т. е. частично
на основе экспериментальных данных.
д., Википедия. Для многоэлектронных
систем, приближения в математике должны быть сделаны, чтобы иметь дело с электрон-электронным
взаимодействия и корреляции. Многоэлектронные атомы сложны
объекты в системном смысле. математический
методы, используемые для описания химических систем, обычно прагматичны.
а не строгие, и они часто носят полуэмпирический характер, т. е. частично
на основе экспериментальных данных. ”
”

Базовый и простой
Вещество | Теоретическая и практическая химия: Имеет ли что-нибудь из этого значение ?  Однако анализ на самом деле влияет на то, как мы понимаем и
преподавать предмет химия.
Однако анализ на самом деле влияет на то, как мы понимаем и
преподавать предмет химия. Реакции с участием этих объектов всегда следует записывать так, чтобы показать димерные виды. Однако каким-то образом ученики также должны знать что молекулярная сера, S 8 , и фосфор, P 4 , обычно записываются как содержащие S и P.
Реакции с участием этих объектов всегда следует записывать так, чтобы показать димерные виды. Однако каким-то образом ученики также должны знать что молекулярная сера, S 8 , и фосфор, P 4 , обычно записываются как содержащие S и P. ИНТЕРНЕТ База данных периодических таблиц Запросы,
Предложения, ошибки, ошибки, опечатки…
Комментарии
Предложения
Предложения по ссылкам
Сообщения об ошибках, опечатках или грамматических ошибках на этой странице, Периодическая таблица – Энциклопедия Нового Света
 Это наверное значок химии и многое говорит о физических и химических свойствах известных элементов. Возникновение периодической таблицы произошло одновременно с развитием научных представлений о составе вещества. В своем нынешнем виде она многим обязана квантовой механике. Электронные структуры, полученные из квантовой механики, используются для теоретического объяснения экспериментально наблюдаемых периодических изменений свойств элементов. Периодическая таблица является одним из важнейших компонентов нашего понимания Вселенной и лежит в основе всей химии.
Это наверное значок химии и многое говорит о физических и химических свойствах известных элементов. Возникновение периодической таблицы произошло одновременно с развитием научных представлений о составе вещества. В своем нынешнем виде она многим обязана квантовой механике. Электронные структуры, полученные из квантовой механики, используются для теоретического объяснения экспериментально наблюдаемых периодических изменений свойств элементов. Периодическая таблица является одним из важнейших компонентов нашего понимания Вселенной и лежит в основе всей химии. Содержание
История
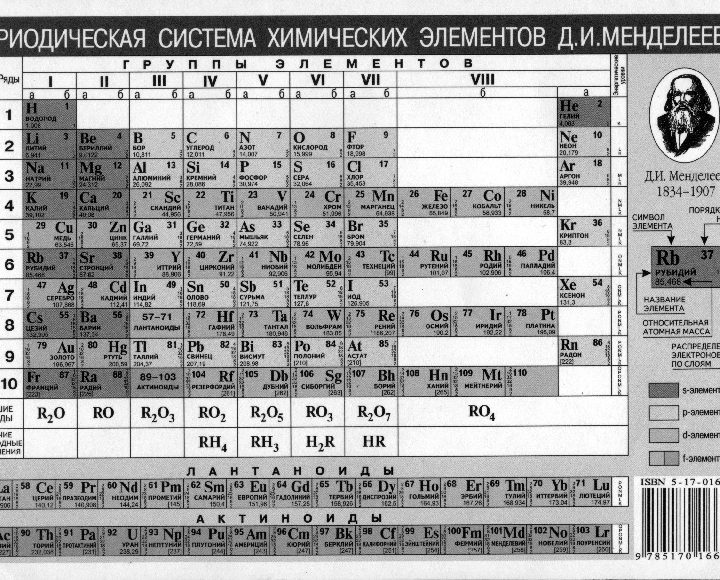 Если элементы упорядочиваются по атомной массе, то может наблюдаться определенная периодичность , или регулярное повторение физических и химических свойств. Первым, кто обнаружил эти закономерности, был немецкий химик Иоганн Вольфганг Доберейнер, который в 1829 г., заметил ряд триад подобных элементов:
Если элементы упорядочиваются по атомной массе, то может наблюдаться определенная периодичность , или регулярное повторение физических и химических свойств. Первым, кто обнаружил эти закономерности, был немецкий химик Иоганн Вольфганг Доберейнер, который в 1829 г., заметил ряд триад подобных элементов: Элемент Молярная масса
(г/моль) Плотность
(г/см³) Коэффициент
(см³/моль) хлор 35.4527 0,003214 11030 бром 79,904 3,122 25,6 йод 126. 4,93 25,7 кальций 40.078 1,54 26,0 стронций 87,62 2,64 33,2 барий 137,327 3,594 38,2  Наконец, в 1869 году немец Юлий Лотар Мейер и русский профессор химии Дмитрий Иванович Менделеев почти одновременно разработали первую периодическую таблицу, расположив элементы по массе. Однако Менделеев нанес несколько элементов вне строгой последовательности масс, чтобы лучше соответствовать свойствам их соседей по таблице. Он также исправил ошибки в значениях нескольких атомных масс и предсказал существование и свойства нескольких новых элементов в пустых ячейках своей таблицы. Позднее Менделеев был подтвержден открытием электронной структуры элементов в конце девятнадцатого и начале двадцатого веков. Современная таблица основана на этом понимании электронных структур.
Наконец, в 1869 году немец Юлий Лотар Мейер и русский профессор химии Дмитрий Иванович Менделеев почти одновременно разработали первую периодическую таблицу, расположив элементы по массе. Однако Менделеев нанес несколько элементов вне строгой последовательности масс, чтобы лучше соответствовать свойствам их соседей по таблице. Он также исправил ошибки в значениях нескольких атомных масс и предсказал существование и свойства нескольких новых элементов в пустых ячейках своей таблицы. Позднее Менделеев был подтвержден открытием электронной структуры элементов в конце девятнадцатого и начале двадцатого веков. Современная таблица основана на этом понимании электронных структур.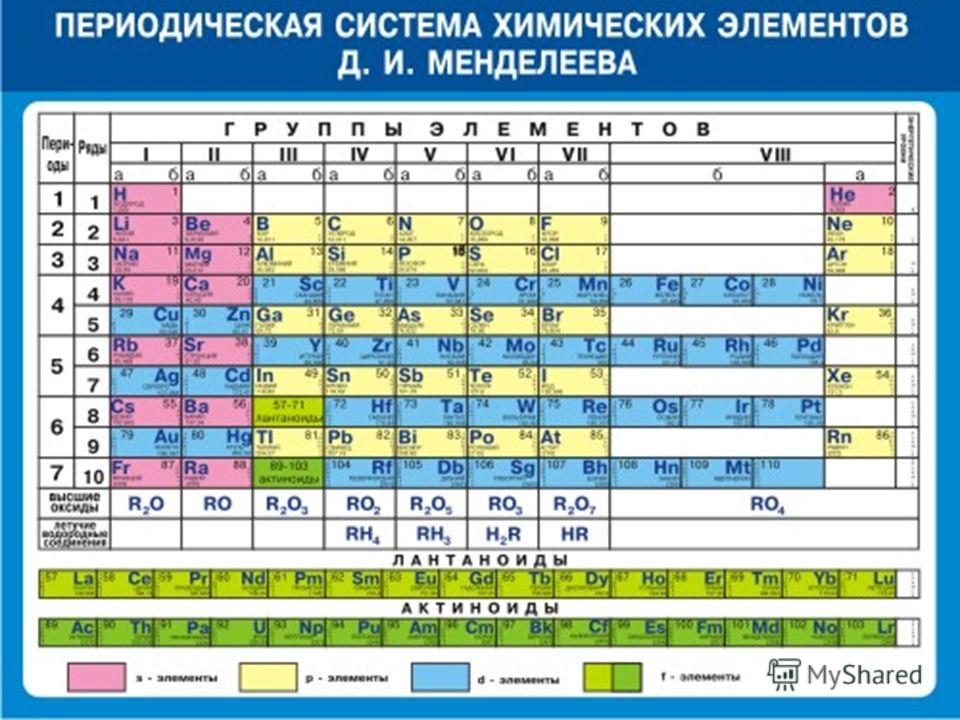 Химики смогли качественно объяснить поведение элементов и предсказать существование еще не открытых.
Химики смогли качественно объяснить поведение элементов и предсказать существование еще не открытых. Методы отображения периодической таблицы
Стандартная периодическая таблица
Группа → 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Период ↓ 1 1
Н 2
Он 2 3
Ли 4
Бе 5
Б 6
С 7
Н 8
О 9
Ф 10
Не 3 11
Нет 12
мг 13
Ал 14
Си 15
П 16
С 17
Кл 18
Ар 4 19
К 20
Ка 21
Sc 22
Ти 23
В 24
Кр 25
Мн 26
Fe 27
Ко 28
Никель 29
Медь 30
цинк 31
Га 32
Ге 33
Как 34
Се 35
Бр 36
Кр 5 37
руб.
38
Старший 39
Д 40
Зр 41
Нб 42
Мо 43
Тк 44
Ру 45
Правая 46
палладий 47
Аг 48
CD 49
В 50
Сн 51
Сб 52
Те 53
я 54
Хе 6 55
цезий 56
Ба * 72
Хф 73
Та 74
Вт 75
Ре 76
Ос 77
Ир 78
Точка 79
Золото 80
рт.ст. 81
Тл 82
Pb 83
Би 84
По 85
В 86
р-н 7 87
Пт 88
Ра ** 104
РФ 105
Дб 106
Сг 107
Бх 108
Гс 109
Мт 110
Дс 111
Рг 112
Ууб 113
Уут 114
Уук 115
Ууп 116
Уух 117
Уус 118
Ууо * Лантаниды 57
Ла 58
Се 59
Пр 60
Нд 61
м 62
см 63
ЕС 64
Гд 65
Тб 66
Дай 67
Хо 68
Эр 69
Тм 70
Ыб 71
Лу ** Актиниды 89
Ас 90
Чт 91
Па 92
У 93
Нп 94
Пу 95
Ам 96
см 97
Бк 98
См.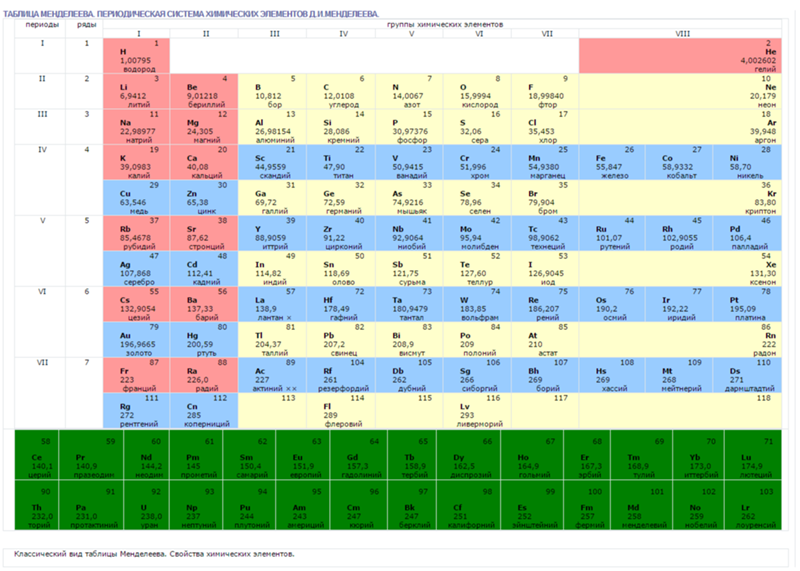
99
Эс 100
FM 101
Мд 102
Нет 103
Лр Щелочные металлы Щелочноземельные металлы Лантаниды Актиниды Переходные металлы Бедные металлы Металлоиды Неметаллы Галогены Благородные газы
Состояние при стандартной температуре и давлении 
Другие изображения
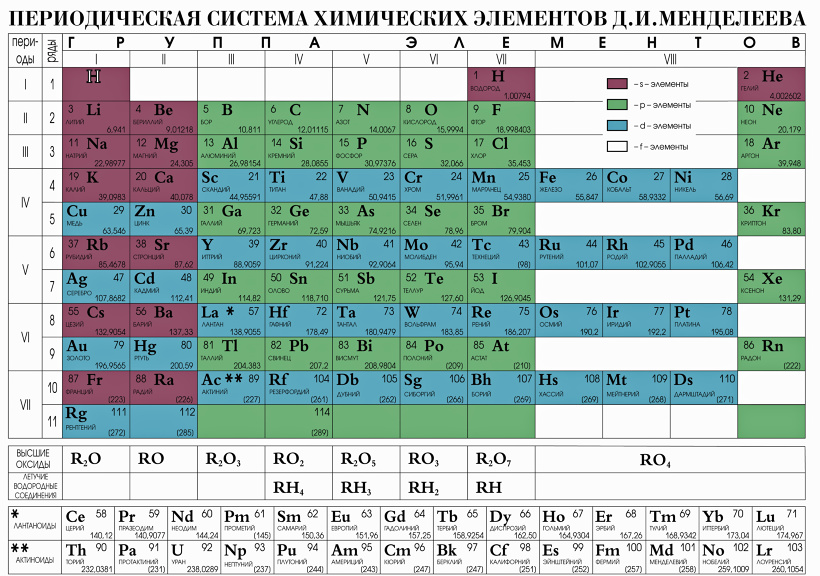
Структура таблицы
 таблицу выше).
таблицу выше). Группы
 ниже). Группы 1, 2, 13, 14, 15, 16, 17 и 18 также известны как основные группы или репрезентативные элементы, а группы с 3 по 12 являются переходными металлами.
ниже). Группы 1, 2, 13, 14, 15, 16, 17 и 18 также известны как основные группы или репрезентативные элементы, а группы с 3 по 12 являются переходными металлами.
Группы периодической таблицы следующие (в скобках указаны старые системы: европейская и американская): Периоды
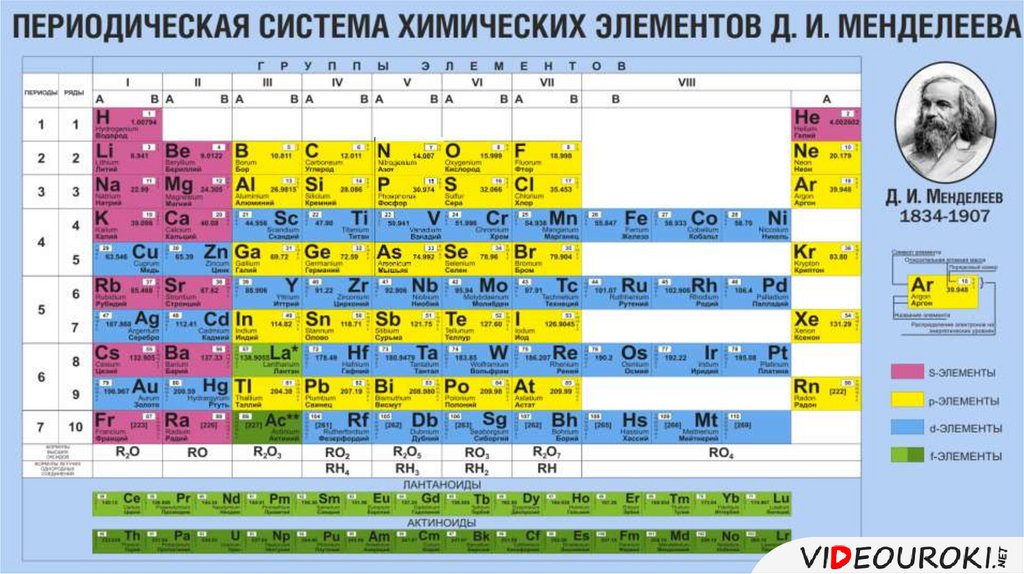 Именно в сменяющих друг друга периодах мы наблюдаем периодичность свойств элементов. Каждый период имеет полный набор свойств. Например, слева от точки находится больше металлических элементов, а справа меньше металлических элементов; или оксиды элементов слева являются основными и кислотными для элементов справа. Периоды просто пронумерованы от 1 до 7 сверху вниз.
Именно в сменяющих друг друга периодах мы наблюдаем периодичность свойств элементов. Каждый период имеет полный набор свойств. Например, слева от точки находится больше металлических элементов, а справа меньше металлических элементов; или оксиды элементов слева являются основными и кислотными для элементов справа. Периоды просто пронумерованы от 1 до 7 сверху вниз. Электронная структура
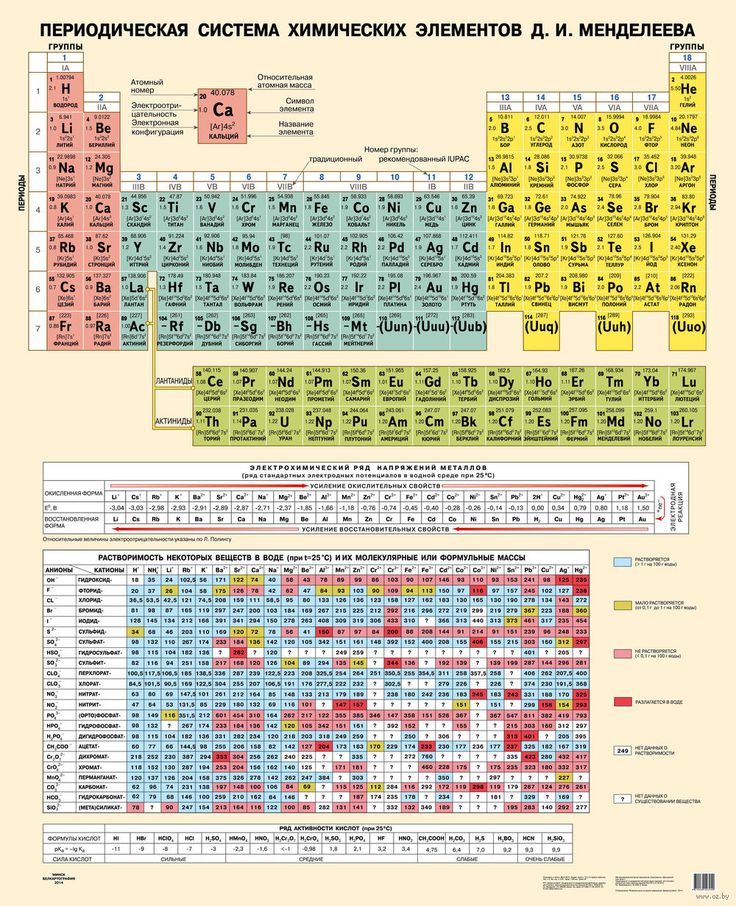 Оболочки содержат подоболочки , которые могут быть представлены буквами. Наиболее распространенными подоболочками являются s , p и d . Подоболочки, в свою очередь, состоят из орбиталей , где каждая орбиталь может содержать два электрона.
Оболочки содержат подоболочки , которые могут быть представлены буквами. Наиболее распространенными подоболочками являются s , p и d . Подоболочки, в свою очередь, состоят из орбиталей , где каждая орбиталь может содержать два электрона.
Подоболочка: С Г Ф Д Р Период 1 1с 2 2 с 2р 3 3 с 3р 4 4с 3д 4р 5 5с 4д 5р 6 6с 4ф 5д 6р 7 7 с 5f 6д 7р 8 8 с 5 г 6ф 7д 8р
Отсюда и структура таблицы.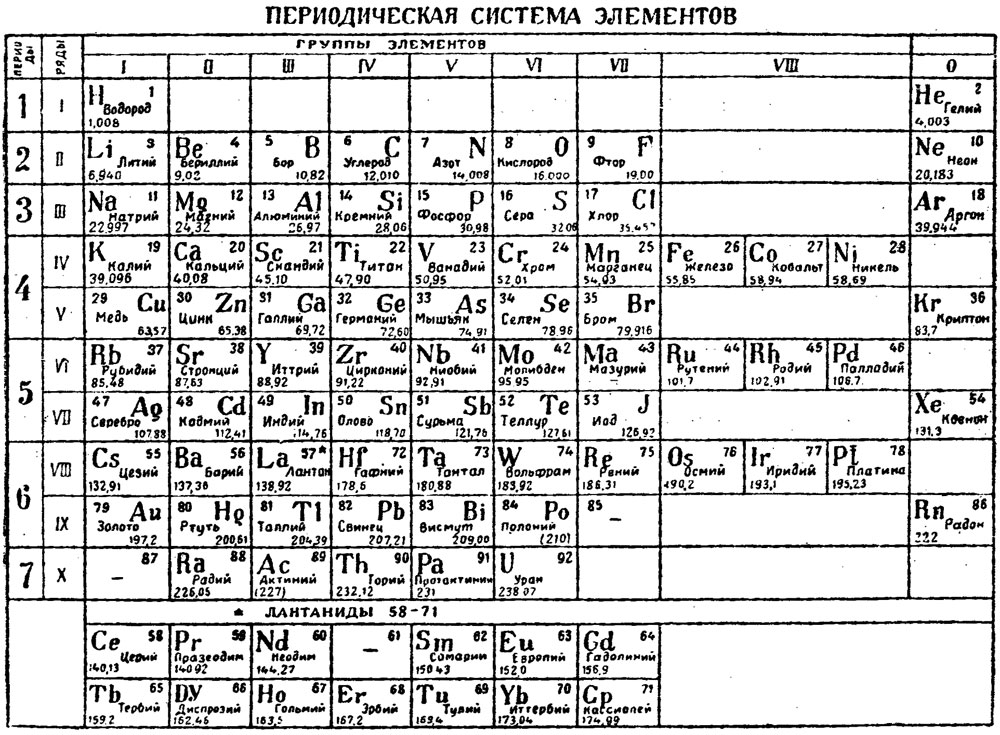 Поскольку самые внешние электроны определяют химические свойства, те, у которых одинаковое количество валентных электронов, группируются вместе.
Поскольку самые внешние электроны определяют химические свойства, те, у которых одинаковое количество валентных электронов, группируются вместе. См. также
Ссылки
 Университет, Алабама: University of Alabama Press. ISBN 0817332006
Университет, Алабама: University of Alabama Press. ISBN 0817332006 Внешние ссылки
Стандартный стол | Вертикальный стол | Таблица с именами | Имена и атомные массы (большие) | Имена и атомные массы (маленькие) | Имена и атомные массы (только текст) | Встроенный F-блок | Элементы до 218 | Электронные конфигурации | Металлы и неметаллы | Таблица по блокам | Список элементов по имени Группы: 1 – 2 – 3 – 4 – 5 – 6 – 7 – 8 – 9 – 10 – 11 – 12 – 13 – 14 – 15 – 16 – 17 – 18 Периоды: 1 – 2 – 3 – 4 – 5 – 6 – 7 – 8 Серия: Щелочи – Щелочные земли – Лантаниды – Актиниды – Переходные металлы – Бедные металлы – Металлоиды – Неметаллы – Галогены – Инертные газы Блоки: s-блок – p-блок – d-блок – f-блок – g-блок Общие разделы естественных наук Астрономия | Биология | Химия | Науки о Земле | Экология | Физика Авторы
 Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь: Любители и профессионалы в химии: случай периодической системы | От Менделеева до Оганесона: мультидисциплинарный взгляд на периодическую таблицу
Процитируйте
 2020
2020 Abstract
 В химии их привлекала периодическая система элементов с ее обманчивой простотой, плотностью информации, ее эстетическим потенциалом и ее причастностью к глубокому порядку во Вселенной. Они предложили новые способы визуального представления, в частности спирали и лемнискаты в двух или трех измерениях. Однако в течение полутора веков профессиональные химики, как правило, игнорировали любительские варианты таблицы и ограничивались парой утилитарных таблиц. Эдвард Мазурс, один из двух великих историков периодической системы, изучил около 700 графических изображений, созданных между 1862 и 1919 годами.72. Он был одержим классификацией и насчитал 146 различных типов. Кажется удивительным, что из всех этих только две когда-либо получили прочное и широкое распространение среди профессионалов. Краткая форма Дмитрия Менделеева была быстро подхвачена химиками и оставалась эталоном в течение полувека. Он был компактным и легко читаемым, а благодаря искусному приему объединения трех или четырех групп элементов в столбец VIII он скрывал разницу в длине между тем, что мы теперь называем блоком p и блоком d.
В химии их привлекала периодическая система элементов с ее обманчивой простотой, плотностью информации, ее эстетическим потенциалом и ее причастностью к глубокому порядку во Вселенной. Они предложили новые способы визуального представления, в частности спирали и лемнискаты в двух или трех измерениях. Однако в течение полутора веков профессиональные химики, как правило, игнорировали любительские варианты таблицы и ограничивались парой утилитарных таблиц. Эдвард Мазурс, один из двух великих историков периодической системы, изучил около 700 графических изображений, созданных между 1862 и 1919 годами.72. Он был одержим классификацией и насчитал 146 различных типов. Кажется удивительным, что из всех этих только две когда-либо получили прочное и широкое распространение среди профессионалов. Краткая форма Дмитрия Менделеева была быстро подхвачена химиками и оставалась эталоном в течение полувека. Он был компактным и легко читаемым, а благодаря искусному приему объединения трех или четырех групп элементов в столбец VIII он скрывал разницу в длине между тем, что мы теперь называем блоком p и блоком d. Действительно, это спутало их; Предсказанные Менделеевым свойства скандия (в d-блоке) были основаны на свойствах бора (в p-блоке). Его неспособность разобраться с f-блоком не привлекла внимания, потому что было известно еще очень мало лантаноидов и что ранние актиноиды ведут себя скорее как первые члены d-блока. В межвоенные годы стандартная среднедлинная форма постепенно вытесняла менделеевскую краткую форму, а с 1940-х годов он стал повсеместным. Мазурс классифицировал его как свой тип IIC2-4 и ссылался на него 67 раз — больше, чем на любой другой тип (стр. 175–180), — но он так плохо думал о нем, что уделил его обсуждению меньше страницы.
Действительно, это спутало их; Предсказанные Менделеевым свойства скандия (в d-блоке) были основаны на свойствах бора (в p-блоке). Его неспособность разобраться с f-блоком не привлекла внимания, потому что было известно еще очень мало лантаноидов и что ранние актиноиды ведут себя скорее как первые члены d-блока. В межвоенные годы стандартная среднедлинная форма постепенно вытесняла менделеевскую краткую форму, а с 1940-х годов он стал повсеместным. Мазурс классифицировал его как свой тип IIC2-4 и ссылался на него 67 раз — больше, чем на любой другой тип (стр. 175–180), — но он так плохо думал о нем, что уделил его обсуждению меньше страницы. Войти
Получить помощь с доступом
Доступ для учреждений
 Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов: Доступ на основе IP
Войдите через свое учреждение
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. Войти с помощью читательского билета
Члены общества
Войти через сайт сообщества
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. Вход через личный кабинет
Личный кабинет
Просмотр учетных записей, вошедших в систему

Выполнен вход, но нет доступа к содержимому
Ведение счетов организаций
Покупка
Elemental: таблица Менделеева на 150 | Химия
 Это похожее на сетку расположение элементов, вероятно, знакомо большинству из нас только по невзрачному плакату, висевшему на стене в кабинете химии в школе, лишь немногим менее запоминающемуся, чем слабый фон странных запахов в лаборатории. Но когда русский химик Дмитрий Менделеев изложил свое видение устройства химического мира в 1869 г., это было революционно.
Это похожее на сетку расположение элементов, вероятно, знакомо большинству из нас только по невзрачному плакату, висевшему на стене в кабинете химии в школе, лишь немногим менее запоминающемуся, чем слабый фон странных запахов в лаборатории. Но когда русский химик Дмитрий Менделеев изложил свое видение устройства химического мира в 1869 г., это было революционно.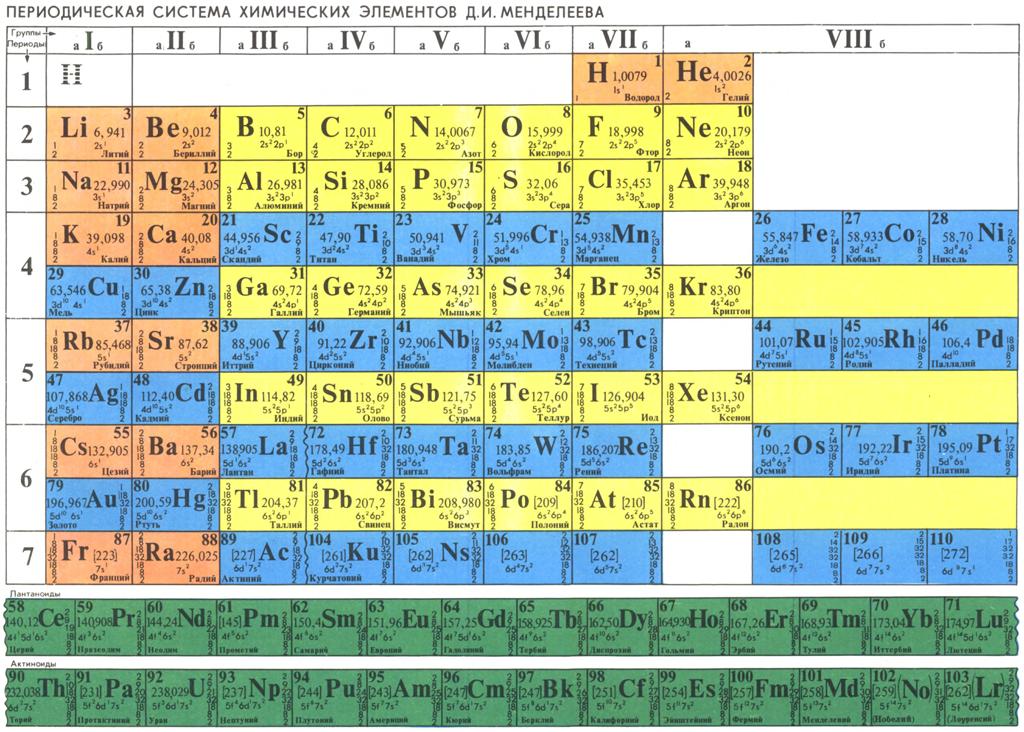 Неон, аргон и ксенон, например, обладают схожими свойствами: это благородные газы, и они крайне неохотно вовлекаются в какие-либо реакции. А когда через полную трубку пропускают электричество, они излучают яркие цвета; огни, которые стали синонимами Лас-Вегаса и других городских центров.
Неон, аргон и ксенон, например, обладают схожими свойствами: это благородные газы, и они крайне неохотно вовлекаются в какие-либо реакции. А когда через полную трубку пропускают электричество, они излучают яркие цвета; огни, которые стали синонимами Лас-Вегаса и других городских центров. Если у вас есть смартфон, значит, у вас в кармане значительная часть всех стабильных элементов таблицы Менделеева


 Это означает, что если у вас есть смартфон, у вас в кармане есть существенная доля всех стабильных элементов таблицы Менделеева. И не только современная электроника требует огромного разнообразия различных металлов. То же самое можно сказать и о высокоэффективных сплавах, используемых в турбинах электростанций или реактивных двигателях самолетов, или катализаторах, ускоряющих реакции, которые мы используем в промышленной химии для очистки нефти, производства пластмасс или синтеза современных лекарственных препаратов. Тем не менее, большинство из нас никогда даже не слышали о многих из этих важнейших металлов — элементах с экзотическими названиями, такими как тантал, иттрий или диспрозий.
Это означает, что если у вас есть смартфон, у вас в кармане есть существенная доля всех стабильных элементов таблицы Менделеева. И не только современная электроника требует огромного разнообразия различных металлов. То же самое можно сказать и о высокоэффективных сплавах, используемых в турбинах электростанций или реактивных двигателях самолетов, или катализаторах, ускоряющих реакции, которые мы используем в промышленной химии для очистки нефти, производства пластмасс или синтеза современных лекарственных препаратов. Тем не менее, большинство из нас никогда даже не слышали о многих из этих важнейших металлов — элементах с экзотическими названиями, такими как тантал, иттрий или диспрозий. В связи с юбилеем Менделеева Европейское химическое общество (EuChemS) выпустило версию таблицы Менделеева (см. выше), чтобы выделить элементы, которым грозит наибольшая опасность в ближайшие десятилетия.
В связи с юбилеем Менделеева Европейское химическое общество (EuChemS) выпустило версию таблицы Менделеева (см. выше), чтобы выделить элементы, которым грозит наибольшая опасность в ближайшие десятилетия.


 Palo, Early Responses to the Periodic System , Oxford University Press, Оксфорд, Великобритания 2015 .
Palo, Early Responses to the Periodic System , Oxford University Press, Оксфорд, Великобритания 2015 .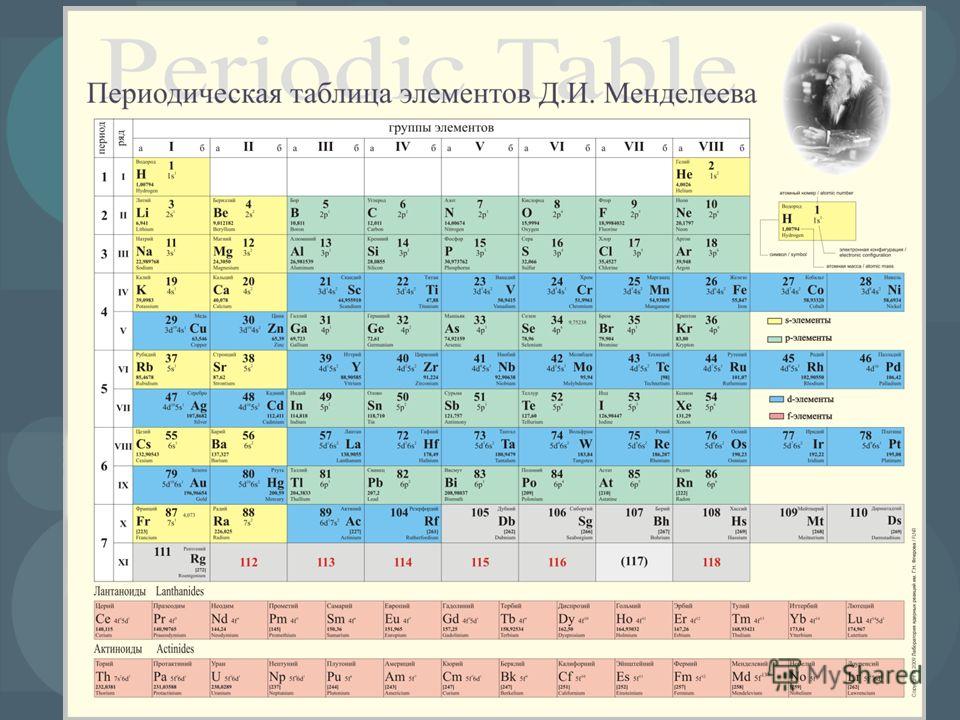 , Li & Schwarz и др. др.
, Li & Schwarz и др. др. 
 ”
” 


 д.
д.