Таблица химической совместимости сред с фильтрующими элементами и материалами уплотнений
Главная » Техдокументация » Таблица химической совместимости
|
Фильтруемая среда при нормальных условиях |
Марки фильтрующих элементов ЭФП-XYZ |
Уплотнение* | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
100 110 |
101 111 |
103 |
202 |
222 |
400 |
401 601 |
403 |
404 |
515 |
525 |
535 |
555 |
сили- |
EPDM | ||
|
КИСЛОТЫ: |
(80%) (98%) |
Р Р Р |
Р Н Н |
О Н Н |
О Н Н |
О Н Н |
О Н Н |
Р Н Н |
О Н Н |
Н Н Н |
О Н Н |
О Н Н |
Н Н Н |
О Н Н |
Р Н Н |
Р Н Н |
|
Азотная (5%) (50%) (94%) |
Р Р Р |
Н Н Н |
Н Н Н |
Н Н Н |
Н Н Н |
Н Н Н |
Н Н Н |
Н Н Н |
Н Н Н |
Н Н Н |
Н Н Н |
Н Н Н |
Н Н Н |
Н Н Н |
Н Н Н |
|
Соляная (5%) (36%) |
Р Р |
Р Р |
О Н |
О Н |
О Н |
Р Н |
Р Р |
Р Н |
О Н |
О Н |
Р Н |
О Н |
Р Н |
Р Р |
Р Н |
|
|
Фосфорная (5%) (конц. |
Р Р |
Р О |
О Н |
О Н |
О Н |
Р О |
Р О |
Р О |
О Н |
О Н |
Р О |
О Н |
О Н |
Р Р |
Р Р |
|
|
Плавиковая (50%) |
Р |
О |
Н |
Н |
Н |
Н |
О |
Н |
Н |
Н |
Н |
Н |
Н |
Р |
О |
|
|
Уксусная (5%) (90%) |
Р Р |
Р Р |
Р Н |
Р О |
Р О |
Р О |
Р Р |
Р О |
Р Н |
Р Н |
Р |
О Н |
Р О |
Р Р |
Р Р |
|
|
ОКИСЛИТЕЛИ |
Н2О2 (3%) (30%) |
Р Р |
Р О |
О Н |
О Н |
Р Р |
О Н |
Р О |
О Н |
Н Н |
О Н |
О Н |
Н Н |
О Н |
Р Р |
Р О |
|
Перманганат калия (3%) |
Р |
Р |
О |
О |
Р |
|
Р |
О |
Н |
О |
О |
Н |
О |
Р |
Р |
|
|
ЩЕЛОЧИ: |
NaOH (5%) (40%) |
Р Р |
Р Р |
Р О |
Р О |
Р Р |
О |
Р Р |
Р О |
О Н |
О Н |
Р О |
Р О |
Р Н |
Р Р |
Р Р |
|
KOH (5%) (40%) |
Р Р |
Р Р |
Р О |
Р О |
Р Р |
Р О |
Р Р |
Р О |
О Н |
О Н |
Р О |
Р О |
Р Н |
Р Р |
Р Р |
|
|
NH4OH (5%) (30%) |
Р Р |
Р Р |
Р Р |
Р О |
Р Р |
Р О |
Р Р |
Р О |
О Н |
О Н |
Р О |
Р О |
Р О |
Р Р |
Р Р |
|
|
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ: |
Альдегиды |
Р |
Р |
О |
О |
Р |
О |
Р |
О |
О |
О |
О |
Р |
О |
Р |
Р |
|
Амины |
Р |
Р |
О |
О |
Р |
О |
Р |
О |
Н |
О |
О |
О |
О |
Р |
О |
|
|
Амиды |
Р |
Р |
О |
О |
Р |
О |
Р |
О |
Н |
О |
О |
О |
Н |
Р |
Р |
|
|
Кетоны |
Р |
Р |
О |
О |
Р |
О |
Р |
О |
Н |
О |
О |
Р |
Н |
Р |
Р |
|
|
Спирты |
Р |
Р |
О |
О |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
|
Кислоты |
Р |
Р |
О |
О |
Р |
О |
Р |
О |
Н |
О |
О |
О |
О |
Р |
Р |
|
|
УГЛЕВОДОРОДЫ: |
Алифатические |
Р |
Р |
Н |
О |
Р |
О |
О |
О |
О |
Н |
О |
Р |
О |
Р |
О |
|
Ароматические |
Р |
О |
Н |
О |
Р |
О |
О |
О |
Н |
Н |
О |
Р |
Н |
Р |
О |
|
|
Галогензамещ. |
Р |
О |
Н |
О |
Р |
О |
О |
О |
Н |
Н |
О |
О |
Н |
Р |
О |
|
|
ЭФИРЫ: |
Простые |
Р |
Р |
О |
О |
Р |
О |
Р |
О |
Н |
О |
О |
Р |
Н |
Н |
Н |
|
Сложные |
Р |
Р |
О |
О |
Р |
О |
Р |
О |
О |
О |
О |
Р |
Н |
Н |
Н |
|
|
МАСЛА: |
Растительные |
Р |
О |
О |
О |
Р |
О |
О |
О |
О |
О |
О |
О |
Р |
Р |
О |
|
Минеральные |
Р |
О |
О |
О |
Р |
О |
О |
О |
О |
О |
О |
О |
Р |
Р |
О |
|
|
Эфирные |
Р |
О |
О |
О |
Р |
О |
О |
О |
О |
О |
О |
О |
Р |
Р |
О |
|
|
Силиконовые |
Р |
Р |
О |
О |
Р |
О |
Р |
О |
О |
О |
О |
О |
Р |
Н |
О |
|
|
ФРЕОНЫ: |
Р |
Р |
О |
Р |
Р |
Р |
Р |
О |
Р |
Р |
Р |
О |
О |
Р |
О |
|
|
НЕФТЕПРОДУКТЫ: |
Р |
О |
О |
О |
Р |
О |
О |
О |
О |
О |
О |
Р |
Р |
Р |
Р |
|
|
ГАЗЫ: |
Воздух, N2, h3,CO2, инертные газы |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
О |
Р |
О |
Р |
Р |
Р |
|
Углеводороды |
Р |
Р |
О |
Р |
Р |
Р |
Р |
Р |
Р |
О |
О |
Н |
Н |
Р |
Р |
|
|
Аммиак |
Р |
Р |
Р |
Р |
Р |
О |
Р |
О |
О |
О |
О |
Н |
Н |
Р |
Р |
|
|
Сероводород |
Р |
Р |
О |
О |
Р |
Р |
Р |
Р |
Н |
Н |
Р |
Н |
Н |
О |
Р |
|
|
Хлор |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
О |
Н |
|
|
ВОДЯНОЙ ПАР (+100 – +135°С) |
Р |
Н |
Н |
О |
Р |
Р |
Н |
О |
Н |
Н |
Р |
Н |
О |
Р |
Р |
|
ПРИМЕЧАНИЕ: Р – Рекомендуется, Н – Не рекомендуется, О – Ограниченное применение.
* Возможно применение других уплотнительных материалов, по всем вопросам обращаться в ООО “НПП Эко-Фильтр”.
Приведенные данные имеют исключительно рекомендательный характер, т. к. на срок службы фильтроэлементов и уплотнений влияют многие факторы, например, тип раствора, его концентрация, температура, наличие примесей и т. д.
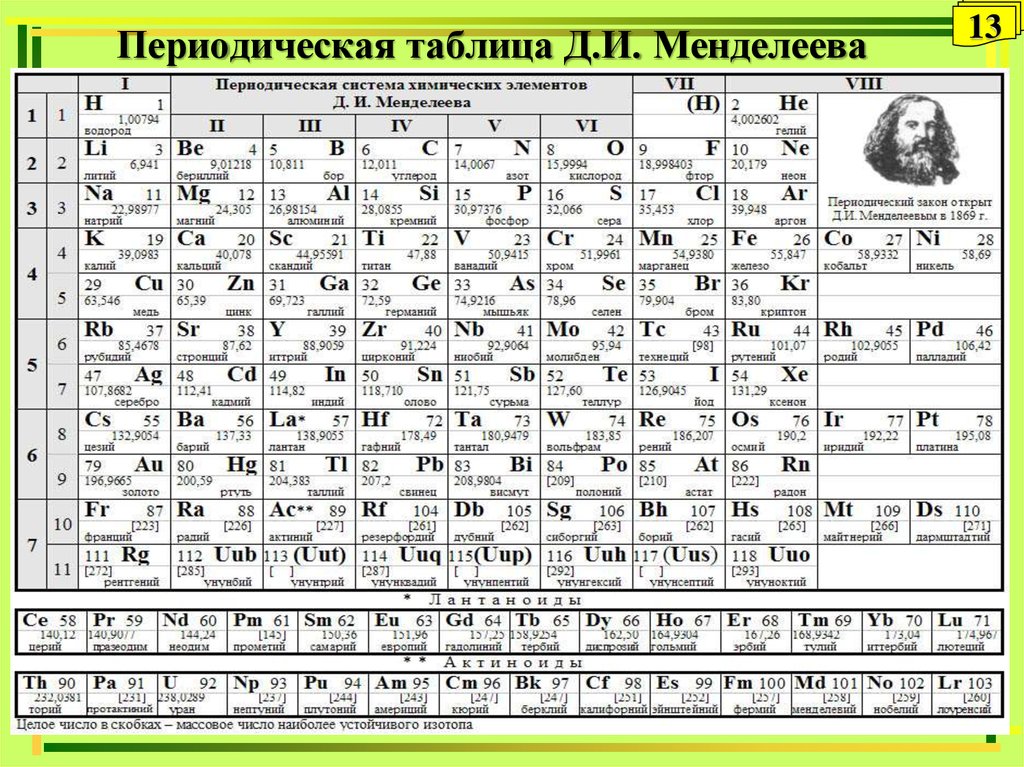
| Периоды | Группы элементов | |||||||||||||
| I | II | III | IV | V | VI | VII | VIII | |||||||
| 1 | 1 H Водород 1,008 1s1 | 1 (H) Водород 1,008 1s1 | 2 He Гелий 4,003 1s2 | |||||||||||
| 2 | 3 Li Литий 6,941 [He]2s1 | 4 Be Бериллий 9,012 [He]2s2 | 5 B Бор 10,811 [He]2s22p1 | 6 C Углерод 12,011 [He]2s22p2 | 7 N Азот 14,007 [He]2s22p3 | 8 O Кислород 15,999 [He]2s22p4 | 9 F Фтор 18,998 [He]2s22p5 | 10 Ne Неон 20,179 [He]2s22p6 | ||||||
| 3 | 11 Na Натрий 22,989 [Ne]3s1 | 12 Mg Магний 24,305 [Ne]3s2 | 13 Al Алюминий 26,982 [Ne]3s23p1 | 14 Si Кремний 28,086 [Ne]3s23p2 | 15 P Фосфор 30,974 [Ne]3s23p3 | 16 S Сера 32,066 [Ne]3s23p4 | 17 Cl Хлор 35,453 [Ne]3s23p5 | 18 Ar Аргон 39,948 [Ne]3s23p6 | ||||||
| 4 | 19 K Калий 39,098 [Ar]4s1 | 20 Ca Кальций 40,078 [Ar]4s2 | 21 Sc Скандий 44,956 [Ar]3d14s2 | 22 Ti Титан 47,88 [Ar]3d24s2 | 23 V Ванадий 50,942 [Ar]3d34s2 | 24 Cr Хром 51,996 [Ar]3d54s1 | 25 Mn Марганец 54,938 [Ar]3d54s2 | 26 Fe Железо 55,847 [Ar]3d64s2 | 27 Co Кобальт 58,933 [Ar]3d74s2 | 28 Ni Никель 58,69 [Ar]3d84s2 | ||||
29 Cu Медь 63,546 [Ar]3d104s1 | 30 Zn Цинк 65,37 [Ar]3d104s2 | 31 Ga Галлий 69,72 [Ar]3d104s24p1 | 32 Ge Германий 72,59 [Ar]3d104s24p2 | 33 As Мышьяк 74,92 [Ar]3d104s24p3 | 34 Se Селен 78,96 [Ar]3d104s24p4 | 35 Br Бром 79,904 [Ar]3d104s24p5 | 36 Kr Криптон 83,80 [Ar]3d104s24p6 | |||||||
| 5 | 37 Rb Рубидий 85,47 [Kr]5s1 | 38 Sr Стронций 87,62 [Kr]5s2 | 39 Y Иттрий 88,905 [Kr]4d15s2 | 40 Zr Цирконий 91,22 [Kr]4d25s2 | 41 Nb Ниобий 92,906 [Kr]4d45s1 | 42 Mo Молибден 95,94 [Kr]4d55s1 | 43 Tc Технеций 97,91 [Kr]4d55s2 | 44 Ru Рутений 101,07 [Kr]4d75s1 | 45 Rh Родий 102,905 [Kr]4d85s1 | 46 Pd Палладий 106,4 [Kr]4d105s0 | ||||
47 Ag Серебро 107,868 [Kr]4d105s1 | 48 Cd Кадмий 112,40 [Kr]4d105s2 | 49 In Индий 114,82 [Kr]4d105s25p1 | 50 Sn Олово 118,69 [Kr]4d105s25p2 | 51 Sb Сурьма 121,75 [Kr]4d105s25p3 | 52 Te Теллур 127,60 [Kr]4d105s25p4 | 53 I Йод 126,904 [Kr]4d105s25p5 | 54 Xe Ксенон 131,30 [Kr]4d105s25p6 | |||||||
| 6 | 55 Cs Цезий 132,905 [Xe]6s1 | 56 Ba Барий 137,33 [Xe]6s2 | 57 La* Лантан 138,906 [Xe]5d16s2 | 72 Hf Гафний 178,49 [Xe]4f145d26s2 | 73 Ta Тантал 180,948 [Xe]4f145d36s2 | 74 W Вольфрам 183,85 [Xe]4f145d46s2 | 75 Re Рений 186,207 [Xe]4f145d56s2 | 76 Os Осмий 190,2 [Xe]4f145d66s2 | 77 Ir Иридий 192,22 [Xe]4f145d76s2 | 78 Pt Платина 195,08 [Xe]4f145d96s1 | ||||
79 Au Золото 196,967 [Xe]4f145d106s1 | 80 Hg Ртуть 200,59 [Xe]4f145d106s2 | 81 Tl Таллий 204,383 [Xe]4f145d106s26p1 | 82 Pb Свинец 307,2 [Xe]4f145d106s26p2 | 83 Bi Висмут 280,980 [Xe]4f145d106s26p3 | 84 Po Полоний 208,982 [Xe]4f145d106s26p4 | 85 At Астат 209,987 [Xe]4f145d106s26p5 | 86 Rn Радон 222,018 [Xe]4f145d106s26p6 | |||||||
| 7 | 87 Fr Франций 222,019 [Rn]7s1 | 88 Ra Радий 226,025 [Rn]7s2 | 89 Ac** Актиний 227,028 [Rn]6d17s2 | 104 Rf Резерфордий [267] [Rn]5f146d27s2 | 105 Db Дубний [268] [Rn]5f146d37s2 | 106 Sg Сиборгий [269] [Rn]5f146d47s2 | 107 Bh Борий [270] [Rn]5f146d57s2 | 108 Hs Хасий [269] [Rn]5f146d67s2 | 109 Mt Мейтнерий [278] [Rn]5f146d77s2 | 110 Ds Дармштадтий [281] [Rn]5f146d87s2 | ||||
111 Rg Рентгений [282] [Rn]5f146d97s2 | 112 Cn Коперниций [285] [Rn]5f146d107s2 | 113 Nh Нихоний [286] [Rn]5f146d107s27p1 | 114 Fl Флеровий [289] [Rn]5f146d107s27p2 | 115 Mc Московий [290] [Rn]5f146d107s27p3 | 116 Lv Ливерморий [293] [Rn]5f146d107s27p4 | 117 Ts Теннессин [294] [Rn]5f146d107s27p5 | 118 Og Оганесон [294] [Rn]5f146d107s27p6 | |||||||
| RxOy | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | ||||||
| RHx | RH4 | RH3 | H2R | HR | ||||||||||
| *Лантаноиды | 58 Ce Церий 140,12 [Xe]4f25d06s2 | 59 Pr Празеодим 140,908 [Xe]4f35d06s2 | 60 Nd Неодим 144,24 [Xe]4f45d06s2 | 61 Pm Прометий 144,913 [Xe]4f55d06s2 | 62 Sm Самарий 150,36 [Xe]4f65d06s2 | 63 Eu Европий 151,96 [Xe]4f75d06s2 | 64 Gd Гадолиний 157,25 [Xe]4f75d16s2 | 65 Tb Тербий 158,925 [Xe]4f95d06s2 | 66 Dy Диспрозий 162,50 [Xe]4f105d06s2 | 67 Ho Гольмий 164,930 [Xe]4f115d06s2 | 68 Er Эрбий 167,26 [Xe]4f125d06s2 | 69 Tm Тулий 168,934 [Xe]4f135d06s2 | 70 Yb Иттербий 173,04 [Xe]4f145d06s2 | 71 Lu Лютеций 174,967 [Xe]4f145d16s2 |
| **Актиноиды | 90 Th Торий 232,038 [Rn]5f06d27s2 | 91 Pa Протактиний 231,036 [Rn]5f26d17s2 | 92 U Уран 238,030 [Rn]5f36d17s2 | 93 Np Нептуний 237,049 [Rn]5f46d17s2 | 94 Pu Плутоний 244,064 [Rn]5f56d17s2 | 95 Am Америций 243,061 [Rn]5f76d07s2 | 96 Cm Кюрий 247,070 [Rn]5f76d17s2 | 97 Bk Берклий 247,070 [Rn]5f86d17s2 | 98 Cf Калифорний 251,080 [Rn]5f106d07s2 | 99 Es Эйнштейний 252,083 [Rn]5f116d07s2 | 100 Fm Фермий 257,095 [Rn]5f126d07s2 | 101 Md Менделевий 258,099 [Rn]5f136d07s2 | 102 No Нобелий [259] [Rn]5f146d07s2 | 103 Lr Лоуренсий [266] [Rn]5f146d17s2 |
Категория: Периодическая таблица — Wikimedia Commons
14LaAc периодическая таблица IIb. jpg
1576 × 844; 182 КБ
jpg
1576 × 844; 182 КБ
14LaAc периодическая таблица.jpg
1426 × 771; 161 КБ
15LaAc с LaAc в группе 3.jpg
565 × 435; 22 КБ
16DL PT.jpg
1828 × 1712; 724 КБ
Периодическая таблица из 18 столбцов, с Lu и Lr в группе 3-sr.png
2022 × 1084; 199 КБ
Периодическая таблица из 18 столбцов, с Lu и Lr в группе 3.png
2694 × 1446; 314 КБ
Периодическая таблица с 19 столбцами.png
1752 × 938; 233 КБ
203 Таблица Менделеева-02.jpg
3045 × 2365; 3,59 МБ
32 столбца La таблица с диагоналями.jpg
2144 × 874; 458 КБ
Периодическая таблица из 32 столбцов с раздвоенной группой 3.png
1852 × 698; 221 КБ
32 столбца растянутой таблицы Менделеева.jpg
945×313; 23 КБ
Периодическая таблица с 32 столбцами и раздвоенной группой 3.png
2610 × 1834; 1017 КБ
Периодическая таблица с 32 столбцами-a. svg
2142 × 622; 478 КБ
svg
2142 × 622; 478 КБ
Периодическая таблица с 32 столбцами-b.png
2862 × 890; 215 КБ
Периодическая таблица с 32 столбцами-sr.png
2880 × 910; 174 КБ
96
6.thumb3.jpeg
640 × 555; 58 КБ
Обычная периодическая таблица, показывающая щелочные металлы (A) и неметаллические галогены (H).png
1434 × 688; 31 КБ
Абб 2-2.gif
558 × 262; 4 КБ
Периодическая таблица ALD — май 2019.png
1663 × 847; 222 КБ
Щелочные и щелочноземельные металлы.svg
96 × 313; 28 КБ
Другой тип таблицы Менделеева для электрона.png
1377 × 369; 19 КБ
Атомный радиус.png
449× 254; 7 КБ
Атом(вер.2018.06).jpg
1921 × 1358; 1,19 МБ
Атомные радиусы.gif
665 × 391; 7 КБ
Атоомрадиус.png
480 × 270; 5 КБ
Ч/Б PT. jpg
1952 × 1084; 553 КБ
jpg
1952 × 1084; 553 КБ
Голая периодическая таблица.png
497 × 207; 5 КБ
Bilder für Atombindung mit Schalenmodell – drei Perioden.svg
2713 × 1076; 351 КБ
Биоэлементос.jpg
697 × 441; 113 КБ
Блоки и категории PT.jpg
1990 × 1492; 891 КБ
Bloco de Notas – “Tabela Periódica”.webm
9 мин 29 с, 1920 × 1080; 98,54 МБ
Блоки периодической таблицы 2014.png
419 × 191; 6 КБ
Bundesarchiv Bild 183-30176-0016, Obhausen, Gespräch nach einem Vortrag.jpg
607 × 800; 76 КБ
Camice con tavola Periodica.jpg
3000 × 4000; 5,33 МБ
Элементы Шанкуртуа.png
243 × 775; 18 КБ
Класс химических элементов словесные ассоциации.png
1568 × 1300; 522 КБ
Химические элементы origin.jpg
1080 × 1080; 430 КБ
Химические элементы. png
6972 × 5065; 3,79 МБ
png
6972 × 5065; 3,79 МБ
Химическая PT.png
2294 × 1620; 610 КБ
Китайская периодическая таблица, CN пиньинь.png
4725 × 3300; 2,83 МБ
Китайская периодическая таблица, TW zhuyin.png
4725 × 3300; 2,99 МБ
Классификация Goldschmidt.png
1024 × 611; 54 КБ
Периодическая классификация элементов – 2017.png
1906 × 1043; 688 КБ
Кобальт(элемент).png
1430 × 1066; 1,25 МБ
Компактная периодическая таблица с водородом в группе 13.png
1296 × 829; 413 КБ
Сравнение таблиц2020020 06.jpg
1406 × 742; 246 КБ
Configuraçãoeletronica.jpg
439 × 263; 43 КБ
Список критических сырьевых материалов (список CRM), сводка за 2011, 2014 и 2017 годы.jpg
3500 × 2188; 857 КБ
Кромо и Ванадио.jpg
1575 × 945; 1,19 МБ
Detailiertes Periodensystem mit Elektronenconfiguration. png
4160 × 1768; 183 КБ
png
4160 × 1768; 183 КБ
Дискообразный стол.jpg
1700 × 2338; 746 КБ
Открытие elements.svg
2970 × 2100; 144 КБ
Предпочтительные настройки DS Visualizer colors.png
615 × 426; 42 КБ
EA ИЛИ chart.png
2434 × 1742; 395 КБ
Периодическая таблица восьми категорий (Mk2).png
1497 × 994; 56 КБ
Восьмая категория PT.jpg
1934 × 1468; 998 КБ
Электроотрицательный.jpg
876 × 454; 79 КБ
Электронегативит44.jpg
1930 × 1016; 462 КБ
Электроотрицательность bar.png
1338 × 1254; 107 КБ
Происхождение элемента.jpg
1200 × 840; 163 КБ
Элементарно Мой дорогой Ватсон – Flickr – muffinn.jpg
3850 × 2567; 16,89 МБ
Элементы atmófilos.png
736 × 440; 32 КБ
Elementos calcófilos.png
729 × 441; 32 КБ
Элементос litófilos. png
736 × 442; 33 КБ
png
736 × 442; 33 КБ
Elementos siderófilos.png
732 × 442; 32 КБ
Элементы карты.pdf
1275 × 1650, 32 страницы; 7,66 МБ
Элементы современной периодической таблицы.jpg
4045 × 2592; 2,49 МБ
Элементы.png
917 × 697; 111 КБ
Erfindung des Periodensystems.webm
3 мин 48 с, 1920 × 1080; 228,68 МБ
Эррера 1900.png
1167 × 726; 1,45 МБ
Периодическая выставка инаугураций.jpg
1600 × 1200; 603 КБ
Выставка Табла Периодика 1.jpg
674 × 937; 660 КБ
Расширенная раскладка PT с g-блоком (a).png
2112 × 1266; 319 КБ
Расширенная компоновка PT, с g block.jpg
697 × 418; 92 КБ
Семейства Элементов.png
504 × 434; 17 КБ
Fig3-Top-Stowes-Middle-Le-Cornecs-and-Bottom-Tarantolas-versions-of-the-Periodic-Chart.gif
567 × 113; 28 КБ
Флуор. jpg
771 × 787; 325 КБ
jpg
771 × 787; 325 КБ
Вытяжной шкаф и таблица элементов, начало ХХ в.jpg
4128 × 2322; 2,32 МБ
Классификация элементов Гольдшмидта.jpg
1562 × 738; 582 КБ
Группа, период и grunnstoff.png
1552 × 816; 219 КБ
Hardsoftacids.png
558 × 235; 61 КБ
Hardsoftbases.png
650 × 863; 28 КБ
Hassium (ячейка периодической таблицы).svg
744 × 1052; 5 КБ
HC Starck Kompetenzen.jpg
400 × 237; 48 КБ
Генри Д. Хаббард перед своей периодической таблицей 1924 года LCCN2016888001.tiff
10 008 × 7 752; 147,98 МБ
Генри Д. Хаббард перед своей периодической таблицей 1924 года.jpg
10 008 × 7 752; 11,44 МБ
Гексафториды 16.png
1204 × 670; 29 КБ
Периодическая диаграмма атомов Хаббарда NMAH-2007-4685.jpg
2000 × 1485; 4,03 МБ
Hüdriidide liigitus. png
422 × 249; 166 КБ
png
422 × 249; 166 КБ
Idrogeno e carbonio unità di misura della massa atomica relativa.png
800 × 337; 87 КБ
Периодическая система.png
551 × 382; 12 КБ
IMG-20210829-WA0003.jpg
1080 × 879; 99 КБ
Начальный экстракт PT.png
1642 × 878; 128 КБ
Периодическая таблица ИЮПАК изменена.PNG
968 × 455; 46 КБ
Периодическая таблица ИЮПАК.PNG
968 × 455; 45 КБ
IYPT Translation Edit-a-thon на Тайване.jpg
1958 × 1468; 204 КБ
Яри-яри атом дан ionik.jpg
516 × 430; 200 КБ
Ка аиктеки аскик.jpg
5661 × 3269; 6,06 МБ
Кетературан Джеджари Атом.jpg
269 × 325; 56 КБ
L&L PT.png
1454 × 1342; 245 КБ
La tabla Periodica del Coleccionista.jpg
2176 × 1176; 913 КБ
La tavola Periodica.jpg
960 × 720; 125 КБ
Lärbok i kemien (vol. I-III).jpg
6000 × 4000; 11,45 МБ
I-III).jpg
6000 × 4000; 11,45 МБ
Музей Марии Склодовской-Кюри Варшава 05.JPG
4646 × 3177; 4,6 МБ
Основной стол Masson 1895.png
980 × 589; 1,13 МБ
МАКС. фазы периодической таблицы.png
868 × 366; 61 КБ
Точка плавления элементов (К).png
1522 × 867; 194 КБ
Таблица Менделеева 5-я II.jpg
2116 × 2556; 865 КБ
Металак таула периодикоан.png
615 × 475; 161 КБ
Металлы и не металлы.png
2008 × 1134; 179 КБ
Металлы, полуметаллы, неметаллы.png
1366 × 768; 177 КБ
Металлы, вызывающие аллергию.jpg
775 × 342; 82 КБ
Metodos para memorisar la tabla Periodica de los elementos.png
3284 × 5072; 4,24 МБ
ММС ПТ.png
939 × 583; 182 КБ
Молярные объемы жидкой и твердой фазы элементов.jpg
2091 × 3032; 523 КБ
Молярные объемы жидко-твердой фазы элементов. svg
1200 × 1703; 196 КБ
svg
1200 × 1703; 196 КБ
МоссбауэроваСпектроскопия1.jpg
733 × 404; 78 КБ
МП период 6-7 metals.png
1066 × 928; 83 КБ
МУНИ-УКБ-Периодическая таблица.jpg
3120 × 4160; 3,52 МБ
Мур Менделеев, Московский проспект, Санкт-Петербург.jpg
1000 × 1500; 582 КБ
Периодическая таблица Нео (2).png
1377 × 530; 24 КБ
Нео периодическая таблица.png
1377 × 438; 10 КБ
Ниохим 2001.jpg
616 × 443; 63 КБ
Неметаллы, определение.png
1714 × 1697; 194 КБ
Неметаллы, подкатегории.png
1,714 × 1,697; 203 КБ
Неметаллы.png
956 × 1125; 149 КБ
Таблица Менделеева нуклеосинтеза textured.svg
512 × 244; 54 КБ
Периодическая таблица нуклеосинтеза-fr.svg
512 × 256; 118 КБ
Периодическая таблица нуклеосинтеза. pdf
1754 × 1241; 238 КБ
pdf
1754 × 1241; 238 КБ
Омп перийодик.jpg
960 × 615; 124 КБ
ИЛИ крест EN.png
2950 × 1778; 490 КБ
OrgChem MainGrp Интересующие металлыDPSderived.png
950 × 560; 77 КБ
Номер окисления trend.jpg
1644 × 1252; 774 КБ
Частично разупорядоченный PT.png
1974 × 1664; 450 КБ
Таблица EN Полинга.png
720 × 405; 356 КБ
Периодическая таблица элементов.pdf
1239 × 1754; 308 КБ
Peridická soustava prvků PřF MUNI.jpg
1280 × 958; 244 КБ
Периодическая таблица Мейера-Макеева 20220506.jpg
2228 × 3149; 573 КБ
Periodensystem in Orbitalanordnung.jpg
1237 × 373; 131 КБ
Periodensystem Kugelteilchen vereinfacht.svg
512 × 362; 2,09 МБ
Periodensystem Kugelteilchen.svg
512 × 362; 3,54 МБ
Periodensystem Kugelwolkenmodell vereinfacht.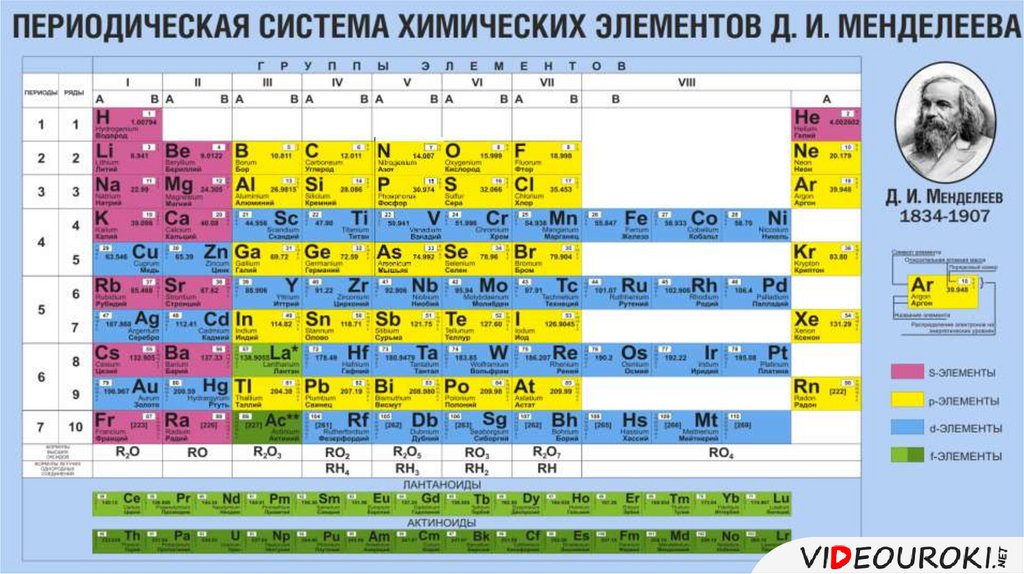 svg
512 × 362; 4,34 МБ
svg
512 × 362; 4,34 МБ
Periodensystem Kugelwolkenmodell.svg
512 × 362; 7,53 МБ
Periodensystem Lewis vereinfacht.svg
512 × 362; 1,58 МБ
Periodensystem Lewis.svg
512 × 362; 3,86 МБ
Periodensystem Mendelejews.jpg
709 × 325; 120 КБ
Periodensystem Schalenmodell vereinfacht.svg
512 × 362; 2 МБ
Periodensystem Schalenmodell.svg
512 × 362; 4,05 МБ
Periodensystem Текст vereinfacht.svg
512 × 362; 1,46 МБ
Periodensystem Text.svg
512 × 362; 2,53 МБ
Periodesystem med fargekodig для blokker.svg
6024 × 3543; 53 КБ
Periodesystemet med fargekoding для blokkar.svg
6024 × 3543; 53 КБ
Периодическая таблица (18 колонок, enwiki), черно-белая.png
1148 × 903; 89 КБ
Периодическая таблица (32 столбца, enwiki), черно-белая. png
1096 × 350; 35 КБ
png
1096 × 350; 35 КБ
Периодическая таблица (7258944296).png
882 × 471; 222 КБ
Периодическая таблица (немецкий).png
2000 × 1083; 315 КБ
Периодическая таблица (версия в формате JPEG).jpg
1088 × 593; 256 КБ
Периодическая таблица (металлоиды).png
339 × 334; 8 КБ
Периодическая таблица (металлы-металлоиды-неметаллы, 32 столбца).png
783 × 210; 4 КБ
Периодическая таблица (металлы–металлоиды–неметаллы, 32 столбца).svg
2059 × 500; 20 КБ
Периодическая таблица — версия 1871 г., аннотированное изменение с короткой на полную форму.png
2216 × 1050; 897 КБ
Периодическая таблица — переход от краткой (1871 г.) к полной форме, иллюстрированный.png
1014 × 591; 74 КБ
Форма Периодической таблицы 14CeTh — Группа 3 = Sc-Y-La-Ac.jpg
1140 × 878; 72 КБ
Форма Периодической таблицы 14LaAc — Группа 3 = Sc-Y-Lu-Lr. jpg
1140 × 878; 105 КБ
jpg
1140 × 878; 105 КБ
Форма периодической таблицы 15LaAc — Группа 3 = неопределенная.jpg
1140 × 878; 73 КБ
Форма Периодической таблицы 15LaAc — Группа 3.svg
779 × 600; 33 КБ
Таблица Менделеева 2100мм растр.png
47 277 × 33 589; 7,36 МБ
Таблица Менделеева 4 MEIS.pdf
2479 × 1754; 268 КБ
Периодическая таблица AH.png
3215 × 2276; 701 КБ
Таблица Менделеева при 1,884 эВ, что соответствует темно-красному цвету.png
2590 × 1658; 467 КБ
Блоки периодической таблицы he.png
800 × 465; 112 КБ
Периодическая таблица по статьям value.png
1800 × 1018; 334 КБ
Периодическая таблица Мехеди Хасана.jpg
4297 × 3011; 5,61 МБ
Периодическая таблица по просмотрам страниц.PNG
1345 × 707; 125 КБ
Таблица Менделеева с реактивными неметаллами. png
2694 × 1452; 475 КБ
png
2694 × 1452; 475 КБ
Периодическая таблица Chart-first-row-highlighted.png
2560 × 1355; 321 КБ
Таблица Менделеева консенсус.png
1344 × 196; 17 КБ
Кексы с периодической таблицей 1.jpg
3872 × 2592; 689 КБ
Кексы ПЕРИОДИЧЕСКИЙ СТОЛ Ида Фройнд 2017.jpg
744 × 491; 143 КБ
Подробная периодическая таблица v1.svg
5953 × 4209; 3,24 МБ
Подробная периодическая таблица v2.svg
512 × 378; 2,9 МБ
Периодическая таблица редактируемый текст.svg
7087 × 5011; 1,57 МБ
Периодическая таблица в Городском музее науки Нагои 20150125.JPG
3264 × 2448; 1,79 МБ
Таблица Менделеева большая 2016-es.png
2000 × 1100; 417 КБ
Таблица Менделеева большая 20170808.svg
1800 × 990; 534 КБ
Таблица Менделеева big-is.svg
1022 × 604; 229 КБ
Таблица Менделеева big-sr. png
1893 × 1016; 430 КБ
png
1893 × 1016; 430 КБ
Периодическая таблица металлоидов.jpg
4500 × 1396; 953 КБ
Периодическая таблица nucleo.png
1356 × 631; 436 КБ
Периодическая таблица элементов по цвету.png
327 × 168; 12 КБ
Периодическая таблица элементов, показывающая электронные оболочки (без текста).svg
4,213 × 2,980; 1008 КБ
Периодическая таблица элементов с указанием электронных оболочек (восстановлено).svg
4213 × 2980; 1009 КБ
Периодическая таблица элементов с электронными оболочками.png
7022 × 4967; 5,88 МБ
Периодическая таблица элементов.jpg
10 400 × 13 172; 5,37 МБ
Периодическая таблица элементов.png
1458 × 1087; 835 КБ
Периодическая таблица трендов степеней окисления.png
2522 × 2010; 558 КБ
Периодическая таблица фотографий Element Spectra.png
1248 × 1008; 446 КБ
Периодическая таблица химических элементов (1-118)Пищевые минералы.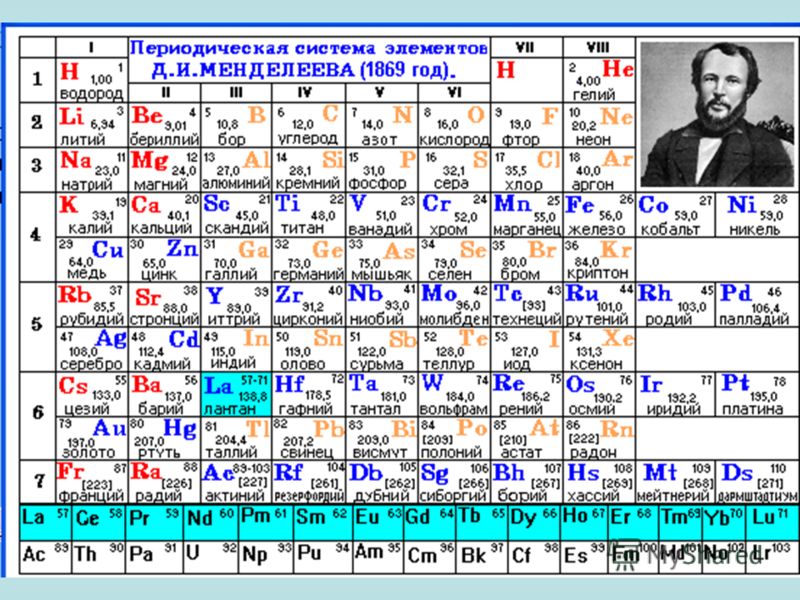 PNG
712 × 380; 19 КБ
PNG
712 × 380; 19 КБ
Периодическая таблица химических элементов (1-118)必須元素.PNG
712 × 380; 19 КБ
Периодическая таблица элементов (46dcda15-95a8-4af0-a576-1f11c2274927).jpg
724 × 483; 150 КБ
2.7: Периодическая таблица — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 83054
Развитие навыков
- Объясните, как элементы организованы в периодическую таблицу.
- Опишите, как некоторые характеристики элементов связаны с их положением в периодической таблице.
В 19 веке было открыто много ранее неизвестных элементов, и ученые отметили, что определенные наборы элементов имеют схожие химические свойства. Например, хлор, бром и йод реагируют с другими элементами (такими как натрий) с образованием подобных соединений. Точно так же литий, натрий и калий реагируют с другими элементами (такими как кислород) с образованием подобных соединений. Почему это так?
Например, хлор, бром и йод реагируют с другими элементами (такими как натрий) с образованием подобных соединений. Точно так же литий, натрий и калий реагируют с другими элементами (такими как кислород) с образованием подобных соединений. Почему это так?
В 1864 году Юлиус Лотар Мейер, немецкий химик, организовал элементы по атомной массе и сгруппировал их в соответствии с их химическими свойствами. Позднее в том же десятилетии русский химик Дмитрий Менделеев систематизировал все известные элементы по схожим свойствам. Он оставил пробелы в своей таблице для того, что, по его мнению, было неоткрытыми элементами, и сделал несколько смелых предсказаний относительно свойств этих неоткрытых элементов. Когда позже были обнаружены элементы, свойства которых точно соответствовали предсказаниям Менделеева, его версия таблицы завоевала популярность в научном сообществе. Поскольку определенные свойства элементов регулярно повторяются по всей таблице (то есть они периодические), она стала известна как периодическая таблица.
Менделееву пришлось перечислить некоторые элементы в порядке их атомных масс, чтобы сгруппировать их с другими элементами, обладающими сходными свойствами.
Периодическая таблица является одним из краеугольных камней химии, потому что она систематизирует все известные элементы на основе их химических свойств. Современная версия показана на рисунке \(\PageIndex{1}\). Большинство периодических таблиц предоставляют дополнительные данные (например, атомную массу) в поле, содержащем символ каждого элемента. Элементы перечислены в порядке атомного номера.
Рисунок \(\PageIndex{1}\) Современная периодическая таблица. В современной периодической таблице элементы перечислены слева направо по атомному номеру.
Особенности периодической таблицы
Элементы, обладающие сходными химическими свойствами, сгруппированы в столбцы, называемые группами (или семействами). Помимо нумерации, некоторые из этих групп имеют названия, например, щелочные металлы (первый столбец элементов), щелочноземельные металлы (второй столбец элементов), галогенов (предпоследний столбец элементов) и благородных газов (последний столбец элементов).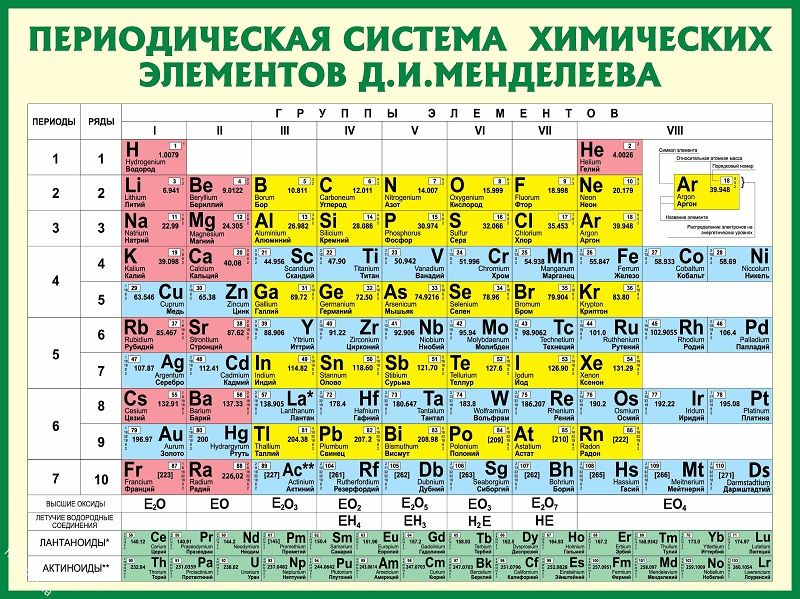
Слово «галоген» происходит от греческого слова «производитель соли», потому что эти элементы объединяются с другими элементами, образуя группу соединений, называемых солями.
Для вашего здоровья: Радон
Радон — это невидимый благородный газ без запаха, который медленно выделяется из-под земли, особенно из горных пород и почв с высоким содержанием урана. Поскольку это благородный газ, радон химически не активен. К сожалению, он радиоактивный, и повышенное воздействие его коррелирует с повышенным риском рака легких.
Поскольку радон поступает из земли, мы не можем полностью избежать его появления. Кроме того, поскольку он плотнее воздуха, радон имеет тенденцию накапливаться в подвалах, которые при неправильной вентиляции могут быть опасны для жителей здания. К счастью, специализированная вентиляция сводит к минимуму количество радона, который может накапливаться. Доступны специальные вентиляторно-вентиляционные системы, которые забирают воздух из-под цокольного этажа, прежде чем он попадет в жилое помещение, и выпускают его над крышей дома.
После курения радон считается вторым по величине предотвратимых причин рака легких в Соединенных Штатах. По оценкам Американского онкологического общества, 10% всех случаев рака легких связаны с воздействием радона. Существует неопределенность в отношении того, какие уровни воздействия вызывают рак, а также что может быть точным возбудителем (радон или один из продуктов его распада, многие из которых также радиоактивны и, в отличие от радона, не являются газами). Агентство по охране окружающей среды США рекомендует тестировать каждый этаж ниже третьего этажа на уровень радона, чтобы предотвратить долгосрочные последствия для здоровья.
Каждая строка элементов периодической таблицы называется периодом. Периоды имеют разную длину; в первом периоде всего 2 элемента (водород и гелий), а во втором и третьем периодах по 8 элементов. Четвертый и пятый периоды содержат по 18 элементов каждый, а более поздние периоды настолько длинные, что сегмент каждого из них удаляется и помещается под основную часть таблицы.
Некоторые свойства элементов становятся очевидными при рассмотрении периодической таблицы в целом. Каждый элемент можно классифицировать как металл, неметалл или полуметалл, как показано на рисунке \(\PageIndex{2}\). Металл — это блестящее вещество, обычно (но не всегда) серебристое, прекрасно проводящее электричество и тепло. Металлы также податливы (их можно бить в тонкие листы) и пластичны (их можно вытягивать в тонкие проволоки). Неметалл обычно тусклый и плохой проводник электричества и тепла. Твердые неметаллы также очень хрупкие. Как показано на рисунке \(\PageIndex{2}\), металлы занимают левые три четверти периодической таблицы, а неметаллы (за исключением водорода) сгруппированы в верхнем правом углу периодической таблицы. Элементы со свойствами, промежуточными между свойствами металлов и неметаллов, называются полуметаллами (или металлоидами). Элементы, расположенные рядом с жирной линией в правой части таблицы Менделеева, обладают свойствами полуметаллов.
Рисунок \(\PageIndex{2}\) : Типы элементов.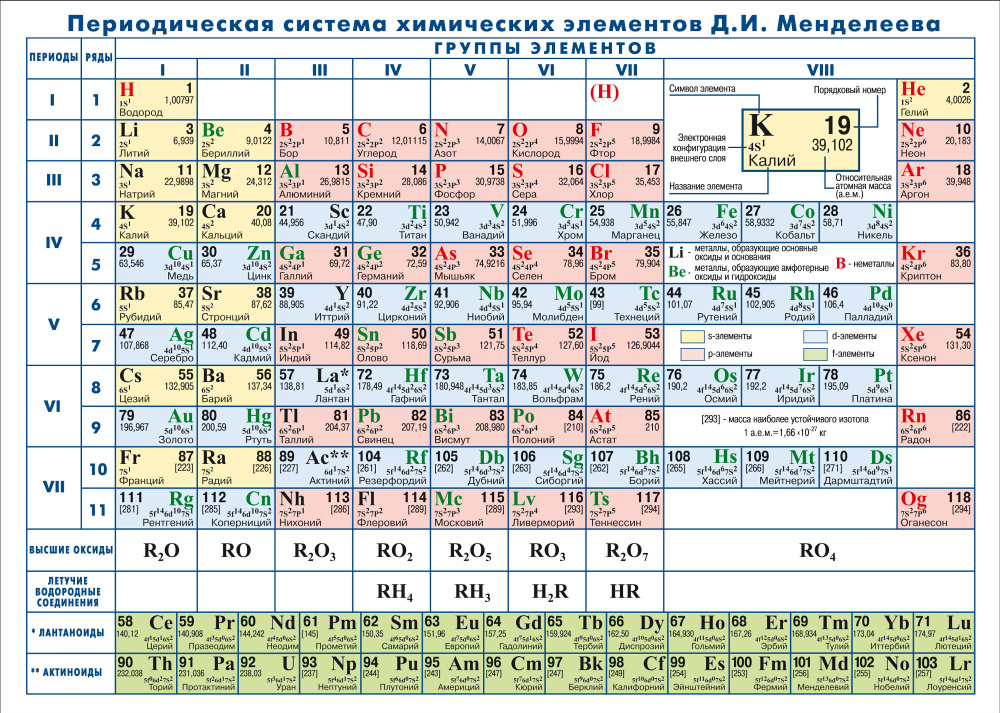 Элементы бывают металлами, неметаллами или полуметаллами. Каждая группа расположена в другой части периодической таблицы.
Элементы бывают металлами, неметаллами или полуметаллами. Каждая группа расположена в другой части периодической таблицы.
Другой способ классификации элементов периодической таблицы показан на рисунке \(\PageIndex{3}\). Первые два столбца слева и последние шесть столбцов справа называются основными элементами группы. Блок из десяти столбцов между этими столбцами содержит переходные металлы. Две строки под основной частью периодической таблицы содержат внутренние переходные металлы. Элементы в этих двух строках также называются, соответственно, 9-ю.1047 лантанидные металлы и актинидные металлы .
Рисунок \(\PageIndex{3}\) : Специальные названия разделов периодической таблицы. Некоторые разделы периодической таблицы имеют специальные названия. Элементы литий, натрий, калий, рубидий, цезий и франций вместе известны как щелочные металлы.
Для вашего здоровья: переходные металлы в организме
Согласно таблице 2.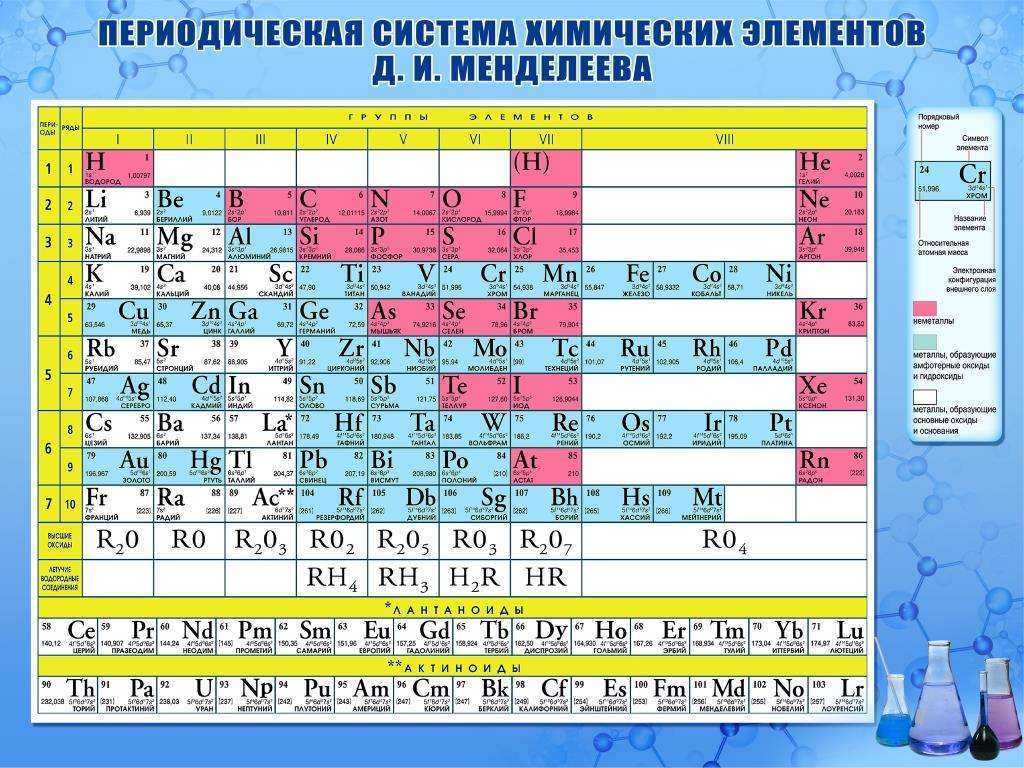 2, большую часть элементного состава тела человека составляют элементы основных групп. Первым элементом в списке, который не является элементом основной группы, является железо с содержанием 0,006 процента по массе. Поскольку железо имеет относительно массивные атомы, оно окажется еще ниже в списке, организованном в процентах на 9 процентов.1046 атомов , а не массовые проценты.
2, большую часть элементного состава тела человека составляют элементы основных групп. Первым элементом в списке, который не является элементом основной группы, является железо с содержанием 0,006 процента по массе. Поскольку железо имеет относительно массивные атомы, оно окажется еще ниже в списке, организованном в процентах на 9 процентов.1046 атомов , а не массовые проценты.
Железо является переходным металлом. Переходные металлы обладают интересными химическими свойствами, отчасти потому, что некоторые из их электронов находятся в подоболочках d . Химический состав железа делает его ключевым компонентом правильного функционирования эритроцитов.
Эритроциты — это клетки, которые переносят кислород от легких к клеткам тела, а затем переносят углекислый газ от клеток к легким. Без эритроцитов известного нам дыхания животных не существовало бы. Важнейшей частью эритроцита является белок под названием 9.1046 гемоглобин . Гемоглобин соединяется с кислородом и углекислым газом, транспортируя эти газы из одного места в другое в организме. Гемоглобин представляет собой относительно крупную молекулу с массой около 65 000 ед.
Гемоглобин представляет собой относительно крупную молекулу с массой около 65 000 ед.
Ключевым атомом в белке гемоглобина является железо. Каждая молекула гемоглобина имеет четыре атома железа, которые действуют как центры связывания кислорода. Именно присутствие этого переходного металла в красных кровяных тельцах позволяет вам использовать кислород, который вы вдыхаете.
Другие переходные металлы выполняют важные функции в организме, несмотря на то, что присутствуют в небольших количествах. Цинк необходим для правильной работы иммунной системы организма, а также для синтеза белка и роста тканей и клеток. Медь также необходима для правильного функционирования некоторых белков в организме. Марганец необходим организму для правильного метаболизма кислорода. Кобальт является необходимым компонентом витамина B-12, жизненно важного питательного вещества. Эти последние три металла не указаны в явном виде в таблице 2.2, поэтому они присутствуют в организме в очень малых количествах. Однако даже эти небольшие количества необходимы для нормального функционирования организма.
Однако даже эти небольшие количества необходимы для нормального функционирования организма.
Обратите внимание, что при сравнении рисунка \(\PageIndex{3}\) и рисунка \(\PageIndex{5}\) члены одного и того же семейства имеют одинаковое количество валентных электронов.
- Все щелочные металлы (Li, Na, K, Rb, Cs, Fr) имеют один валентный электрон. (Водород имеет один валентный электрон, но является неметаллом.)
- Все щелочноземельные металлы (Be, Mg, Ca, Sr, Ba, Ra) имеют два валентных электрона.
- Все галогены (F, Cl, Br, I, At, Ts) имеют семь валентных электронов.
- Благородные газы (He, Ne, Ar, Kr, Xe, Rn, Og) имеют восемь* валентных электронов. (Гелий — благородный газ, но имеет только два валентных электрона.)
Элементы каждого семейства реагируют одинаково, потому что они имеют одинаковое количество электронов снаружи.
Рисунок \(\PageIndex{5}\) : Валентные электроны для основных семейств периодической таблицы
Пример \(\PageIndex{1}\)
Какие элементы имели бы химические свойства, сходные с перечисленными ниже?
- углерод, C
- йод, I
РАСТВОР
- Углерод принадлежит к тому же семейству (столбцу), что и Si, Ge, Sn, Pb и F, и имеет сходные химические свойства с Si, Ge, Sn, Pb и F.

- Йод относится к тому же семейству (колонке), что и химические свойства F, Cl, Br, At и Ts, и будет иметь сходные с ними свойства.
Пример \(\PageIndex{2}\)
В каком семействе не все члены имеют одинаковое число валентных электронов?
РАСТВОР
Благородные газы. У гелия два валентных электрона, а у неона, аргона, криптона, ксенона и радона — восемь.
Атомный радиус
Периодическая таблица полезна для понимания атомных свойств, которые показывают периодические тенденции. Одним из таких свойств является атомный радиус (рис. \(\PageIndex{5}\)). Как упоминалось ранее, чем выше номер оболочки, тем дальше от ядра могут находиться электроны в этой оболочке. Другими словами, размер атома обычно определяется количеством электронных оболочек; больше оболочек электронов, сложенных друг на друге, занимают больше места. Следовательно, когда мы спускаемся вниз по столбцу периодической таблицы, атомный радиус увеличивается. Как мы идем через период в периодической таблице, однако электроны добавляются к той же валентной оболочке ; тем временем к ядру добавляется больше протонов, поэтому положительный заряд ядра увеличивается. Увеличивающийся положительный заряд сильнее притягивает электроны, притягивая их ближе к ядру. Следовательно, по мере прохождения периода атомный радиус уменьшается. Эти тенденции хорошо видны на рисунке \(\PageIndex{5}\).
Как мы идем через период в периодической таблице, однако электроны добавляются к той же валентной оболочке ; тем временем к ядру добавляется больше протонов, поэтому положительный заряд ядра увеличивается. Увеличивающийся положительный заряд сильнее притягивает электроны, притягивая их ближе к ядру. Следовательно, по мере прохождения периода атомный радиус уменьшается. Эти тенденции хорошо видны на рисунке \(\PageIndex{5}\).
Рисунок \(\PageIndex{5}\): Тенденции периодической таблицы. Относительные размеры атомов показывают несколько тенденций в отношении структуры периодической таблицы. Атомы становятся больше по мере продвижения вниз по столбцу и меньше по периоду.
Пример \(\PageIndex{3}\)
Используя периодическую таблицу (а не рисунок \(\PageIndex{5}\) выше), какой атом больше?
- Н или Би
- Мг или Cl
РЕШЕНИЕ
- Поскольку Bi находится ниже N в периодической таблице, мы ожидаем, что атомы Bi больше, чем атомы N.
 Электроны в оболочках с более высокими номерами (ниже в таблице Менделеева) находятся дальше от ядра и, таким образом, делают атом больше.
Электроны в оболочках с более высокими номерами (ниже в таблице Менделеева) находятся дальше от ядра и, таким образом, делают атом больше. - И Mg, и Cl находятся в периоде 3 периодической таблицы (та же строка). Поскольку Mg находится левее, мы ожидаем, что Mg будет больше. И Mg, и Cl имеют три оболочки электронов, но у Mg меньше протонов в ядре, поэтому электроны не притягиваются так близко.
Сфера деятельности: клинический химик
Клиническая химия — это область химии, связанная с анализом биологических жидкостей для определения состояния здоровья человека. Клинические химики измеряют различные вещества, от простых элементов, таких как натрий и калий, до сложных молекул, таких как белки и ферменты, в крови, моче и других жидкостях организма. Отсутствие или присутствие, аномально низкое или повышенное количество вещества может быть признаком какого-либо заболевания или показателем здоровья. Многие клинические химики используют в своей работе сложное оборудование и сложные химические реакции, поэтому им необходимо не только разбираться в основах химии, но и уметь обращаться со специальными приборами и уметь интерпретировать результаты анализов.
Упражнения по обзору концепции
Как элементы организованы в периодической таблице?
Глядя на периодическую таблицу, где появляются следующие элементы?
- металлы
- неметаллы
- галогены
- переходные металлы
Опишите тренды атомных радиусов в зависимости от положения элемента в периодической таблице.
Ответы
Элементы организованы по атомному номеру.
- левые три четверти таблицы Менделеева
- правая четверть периодической таблицы
- предпоследний столбец периодической таблицы
- средний раздел периодической таблицы
При просмотре периодической таблицы атомные радиусы уменьшаются; по мере того, как вы спускаетесь по периодической таблице, атомные радиусы увеличиваются.


 )
)

 Электроны в оболочках с более высокими номерами (ниже в таблице Менделеева) находятся дальше от ядра и, таким образом, делают атом больше.
Электроны в оболочках с более высокими номерами (ниже в таблице Менделеева) находятся дальше от ядра и, таким образом, делают атом больше.