Формулы для решения задач по химии ЕГЭ 2021 / Блог / Справочник :: Бингоскул
Формулы для расчета:
- v – количества моль, моль
- m – масса, г
- M – молярная масса, г/моль
- C – концентрация, моль/л
- N – количество атомов, молекул
- NA – число Авогадро
- V – объем, л
- Vm – молярный объем = 22,4 л/моль
- p – плотность
- D – относительная плотность
Число Авогадро NA
1 моль = 6,02 · 1023 частиц
Закон Авогадро: 1 моль идеального газа при нормальных условиях имеет один и тот же объём Vm = 22,413 996(39) л
Количество вещества n (моль) |
|
| Масса вещества m (г) | |
| Объем вещества V(л) |
|
| Масса |
|
| Количество вещества |
|
| Объем |
|
| Число частиц |
|
| Молярный объем |
|
| Молярная масса | |
| Относительная молекулярная масса |
|
Решай с ответами:
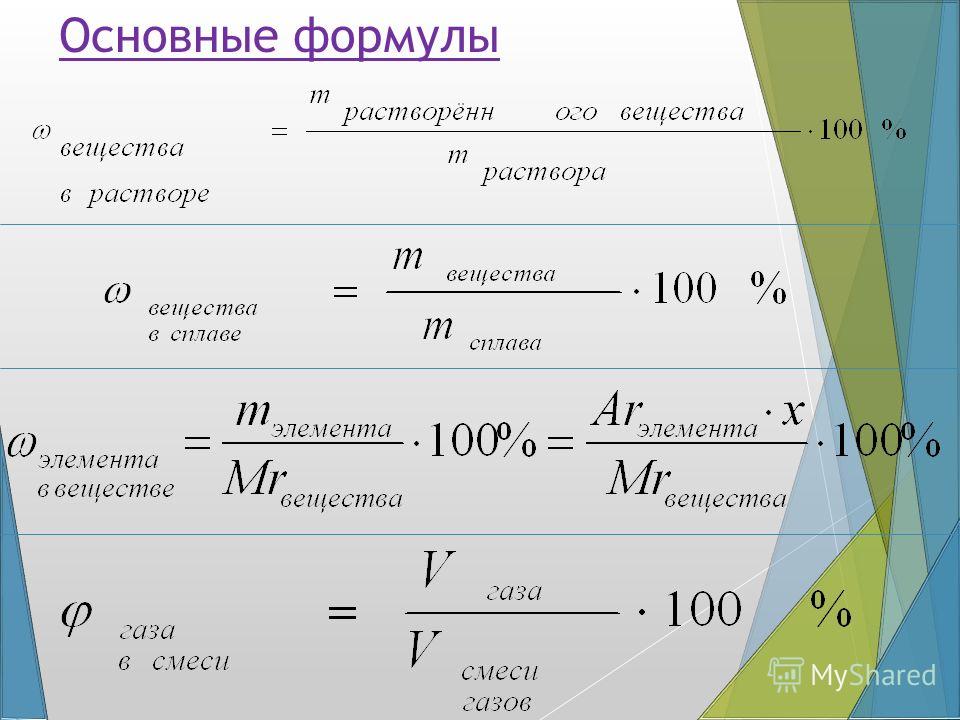
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 440 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 г\моль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества
n=m\M
n=V\22. 4 (л\моль)
4 (л\моль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (л\моль)
или вот еще удобная табличка:
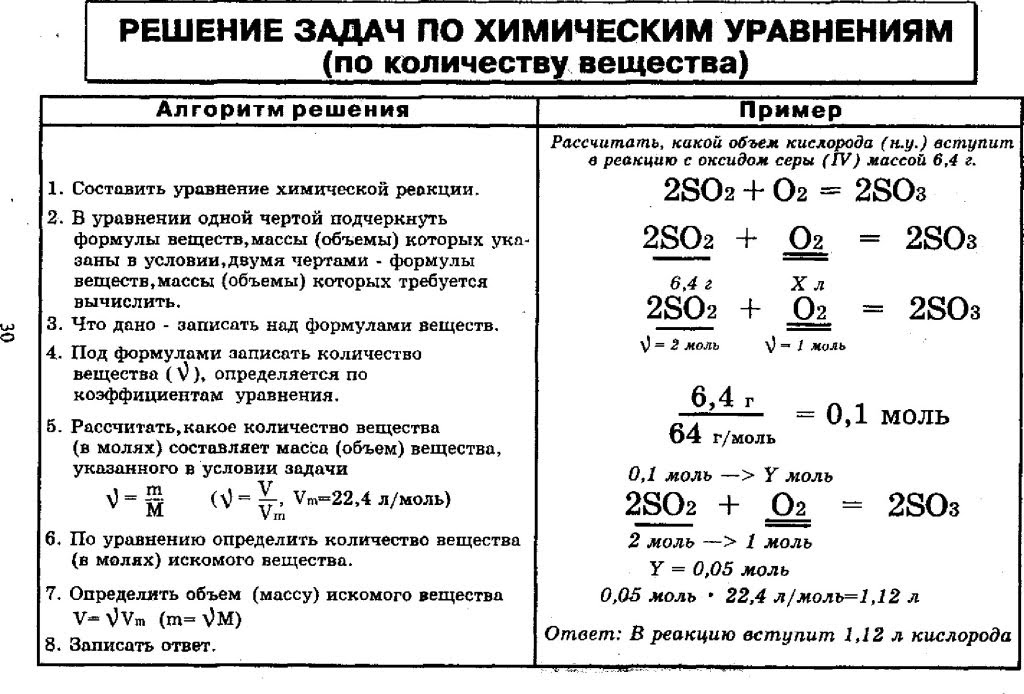
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем \ массу \ кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.
8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.
Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории: |
Обсуждение: “Основные формулы для решения задач по химии”
(Правила комментирования)Основные формулы для решения задач
Соотношение | |
Атомная масса элемента Х (относительная) | |
Порядковый номер элемента | Z = N(е–) = N(р+) |
Массовая доля элемента Э в веществе Х, в долях единицы, в %) | |
Количество вещества Х, моль | |
Количество вещества газа, моль | Vm = 22,4 л/моль (н. н.у. – р = 101 325 Па, Т = 273 К |
Молярная масса вещества Х, г/моль, кг/моль | |
Масса вещества X, г, кг | |
Молярный объем газа, л/моль, м3/моль | Vm = 22,4 л/моль при н.у. |
Объем газа, м3 | V = Vm×n |
Выход продукта | |
Плотность вещества Х, г/л, г/мл, кг/м3 | |
Плотность газообразного вещества Х по воздуху | М(воздуха) = 29 г/моль |
Объединенный газовый закон | |
Уравнение Менделеева-Клапейрона | PV = nRT, R = 8,314 Дж/моль×К |
Объемная доля газообразного вещества в смеси газов, в долях единицы или в % | |
Молярная масса смеси газов | |
Молярная доля вещества (Х) в смеси | |
Количество теплоты, Дж, кДж | Q = n(X)Q(X) |
Тепловой эффект реакции | Q =–H |
Скорость химической реакции (моль/лсек) | |
Закон действия масс (для простой реакции) | aA + вB = сС + dD u = kс a(A)с в(B) |
Правило Вант-Гоффа | |
Растворимость вещества (Х) (г/100 г растворителя) | |
Массовая доля вещества Х в смеси А + Х, в долях единицы, в % | |
Масса раствора, г, кг | m(р-р) = m(X) + m(H2O) m(р-р) = V(р-р)(р-р) |
Массовая доля растворенного вещества в растворе, в долях единицы, в % | |
Плотность раствора | |
Объем раствора, см3, л, м3 | |
Молярная концентрация, моль/л | |
Степень диссоциации электролита (Х), в долях единицы или % | |
Ионное произведение воды | K(H2O) = [H+][OH–] |
Водородный показатель | рН = –lg[H+] |
Рекомендуемая литература
Основная:
Кузнецова
Н. Е. и др.
Химия. 8 кл-10 кл.. – М.: Вентана-Граф,
2005-2007.
Е. и др.
Химия. 8 кл-10 кл.. – М.: Вентана-Граф,
2005-2007.
Кузнецова Н.Е., Литвинова Т.Н., Левкин А.Н. Химия.11 класс в 2-х частях, 2005-2007 гг.
Егоров А.С. Химия. Новое учебное пособие для подготовки в вузы. Ростов н/Д: Феникс, 2004.– 640 с.
Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
Егоров А.С. Самоучитель по решению химических задач. – Ростов-на-Дону: Феникс, 2000.– 352 с.
Химия/пособие-репетитор для поступающих в вузы. Ростов-н/Д, Феникс, 2005– 536 с.
Хомченко Г.П.,Хомченко И.Г. Задачи по химии для поступающих в вузы. М.: Высшая школа. 2007.–302с.
Дополнительная:
Врублевский А.И. Учебно-тренировочные материалы для подготовки к централизованному тестированию по химии/ А.И. Врублевский –Мн.: ООО «Юнипресс», 2004.– 368 с.
Врублевский
А. И. 1000 задач
по химии с цепочками превращений и
контрольными тестами для школьников и
абитуриентов.– Мн.: ООО «Юнипресс»,
2003.– 400 с.
И. 1000 задач
по химии с цепочками превращений и
контрольными тестами для школьников и
абитуриентов.– Мн.: ООО «Юнипресс»,
2003.– 400 с.
Егоров А.С. Все типы расчетных задач по химии для подготовки к ЕГЭ.–Ростов н/Д: Феникс, 2003.–320с.
Егоров А.С., Аминова Г.Х. Типовые задания и упражнения для подготовки к экзамену по химии. – Ростов н/Д: Феникс, 2005.– 448 с.
Единый государственный экзамен 2007. Химия. Учебно-тренировочные материалы для подготовки учащихся/ФИПИ – М.: Интеллект-Центр, 2007.– 272 с.
ЕГЭ-2011. Химия. Учебно-тренировочный комплект под ред. А.А. Кавериной.– М.: Национальное образование, 2011.
Единственные реальные варианты заданий для подготовки к единому государственному экзамену. ЕГЭ.2007. Химия/В.Ю. Мишина, Е.Н. Стрельникова. М.: Федеральный центр тестирования, 2007.–151с.
Каверина
А.А. Оптимальный
банк заданий для подготовки учащихся. Единый государственный экзамен
2012.Химия. Учебное пособие./ А.А. Каверина,
Д.Ю. Добротин, Ю.Н. Медведев, М.Г. Снастина.–
М.: Интеллект-Центр, 2012.– 256 с.
Единый государственный экзамен
2012.Химия. Учебное пособие./ А.А. Каверина,
Д.Ю. Добротин, Ю.Н. Медведев, М.Г. Снастина.–
М.: Интеллект-Центр, 2012.– 256 с.
Литвинова Т.Н., Выскубова Н.К., Ажипа Л.Т., Соловьева М.В. Тестовые задания в дополнение к контрольным работам для слушателей 10-месячных заочных подготовительных курсов (методические указания). Краснодар, 2004. – С. 18 – 70.
Литвинова Т.Н. Химия. ЕГЭ-2011. Тренировочные тесты. Ростов н/Д: Феникс, 2011.– 349 с.
Литвинова Т.Н. Химия. Тесты к ЕГЭ. Ростов н/Д.: Феникс, 2012. – 284 с.
Литвинова Т.Н. Химия. Законы, свойства элементов и их соединений. Ростов н/Д.: Феникс, 2012. – 156 с.
Литвинова Т.Н., Мельникова Е.Д., Соловьева М.В., Ажипа Л.Т., Выскубова Н.К. Химия в задачах для поступающих в вузы.– М.: ООО «Изд-во Оникс»: ООО «Изд-во «Мир и образование», 2009.– 832 с.
Учебно-методический
комплекс по химии для учащихся
медико-биологических классов под ред.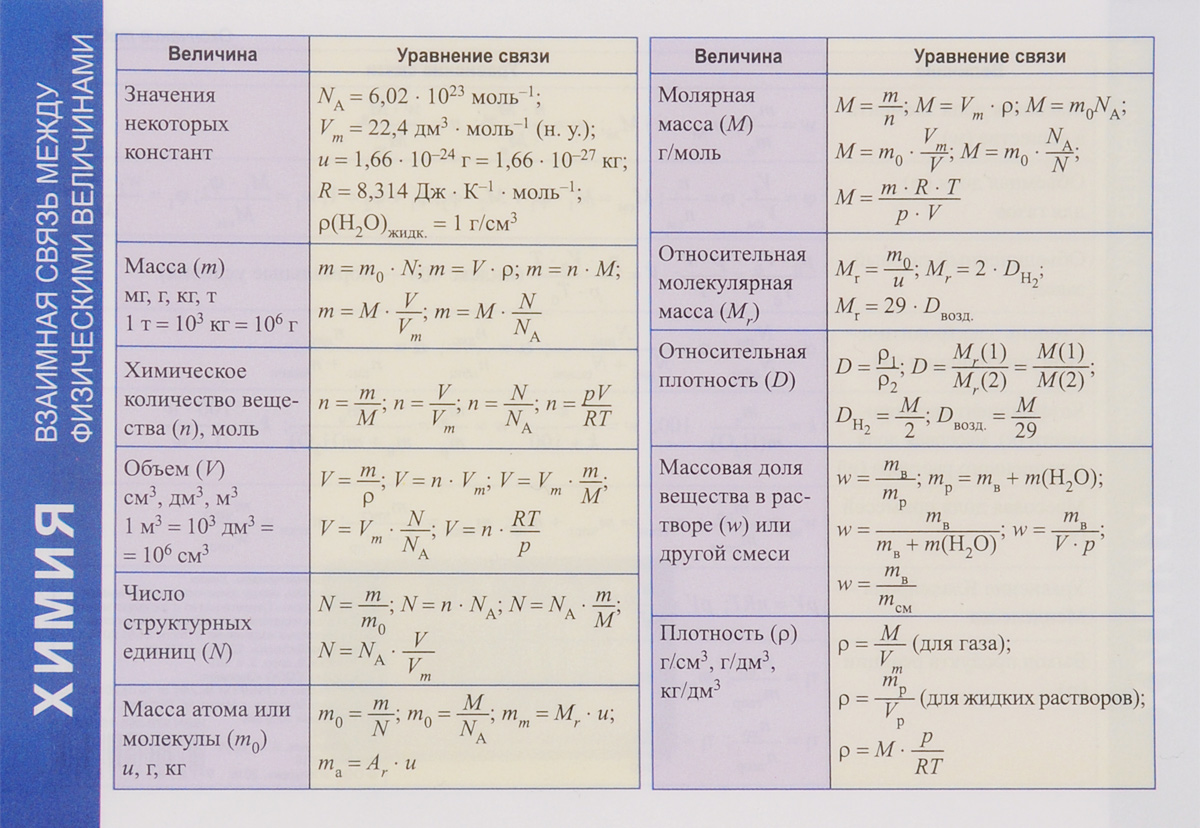 Т.Н.Литвиновой.– Краснодар.: КГМУ, –
2008.
Т.Н.Литвиновой.– Краснодар.: КГМУ, –
2008.
Химия. ЕГЭ–2008. Вступительные испытания, учебно-методическое пособие / под ред. В.Н. Доронькина. – Ростов н/Д: Легион, 2008.– 271 с
Список сайтов по химии:
1. Alhimik. http://www.alhimik.ru
2. Химия для всех. Электронный справочник за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
3. Школьная химия – справочник. http://www.schoolchemistry.by.ru
4. Репетитор по химии. http://www. chemistry.nm.ru
Интернет-ресурсы
Alhimik. http://www.
 alhimik.ru
alhimik.ruХимия для всех. Электронный справочник за полный курс химии.
http://www.informika.ru/text/database/chemy/START.html
Школьная химия – справочник. http://www.schoolchemistry.by.ru
http://www.classchem.narod.ru
Репетитор по химии. http://www. chemistry.nm.ru
http://www.alleng.ru/edu/chem.htm – образовательные ресурсы Интернета по химии
http://schoolchemistry.by.ru/ – школьная химия. На этом сайте есть возможность пройти On-line тестирование по разным темам, а также демонстрационные варианты Единого Государственного Экзамена
Химия и жизнь–ХХ1 век: научно-популярный журнал.
 http://www.hij.ru
http://www.hij.ru
Решение задач
ХИМИЯПредлагаем цикл занятий “Развивай навыки решения задач по химии” (программа 12.5 ч , 5 дней) для учеников 8-9 классов. К курсу также могут присоединиться ученики 10-12-х классов, которые хотят улучшить свои знания основ химии.
Достаточно часто решение задач по химии доставляет определенные сложности. Почему? У каждого будет свой ответ. Мы в свою очередь на дополнительных занятиях по химии освоим алгоритмы решения задач, которые помогут справиться не только с задачами уровня основной школы, но и сформируют базовые навыки для решения задач уровня средней школы. Во время занятий поможем систематизировать алгоритмы решения задач таким образом, чтобы в процессе решения можно было легко выбрать наиболее подходящие формулы и путь решения.
Наша цель, чтобы в результате данных занятий участники приобрели следующие навыки и умения:
- научились правильно определять заданные величины в заданиях и таблицах данных;
- научились использовать и преобразовывать формулы в соответствии с условиями задач;
- определять свой путь решения задачи;
- выбрать соответствующие формулы в комплексных задачах;
- правильно составлять химические формулы по названиям;
- правильно составлять уравнения реакций;
- проверять правильность составленного уравнения реакций;
- находить взаимосвязь уравнений реакций с расчетами.

Темы занятий:
- Количество вещества. Молярная масса. Молярный объем. Число Авогадро. Число атомов и молекул.
- Уравнения реакций. Степени окисления. Индексы. Коэффициенты. Цепи реакций.
- Задачи с уравнениями реакций. Молярное соотношение. Преобладание реагентов.
- Задачи, в вычисление которых используют растворы. Молярная масса. Молярная концентрация. Кристаллогидраты. Смешивание растворов.
- Комбинированные задачи с уравнениями реакций и растворами.
ЗАПИСАТЬСЯ
ФИЗИКА
Предлагаем цикл занятий “Развивай навыки решения задач по физике” (программа 12.5 ч , 5 дней) для учеников 8-9 классов. К курсу также могут присоединиться ученики 10-12-х классов, которые хотят улучшить свои знания основ физики.
Достаточно часто решение задач по физике доставляет определенные сложности. Почему? У каждого будет свой ответ. Мы в свою очередь на дополнительных занятиях по физике освоим алгоритмы решения задач, которые помогут справиться не только с задачами уровня основной школы, но и сформируют базовые навыки для решения задач уровня средней школы. Во время занятий поможем систематизировать алгоритмы решения задач таким образом, чтобы в процессе решения можно было легко выбрать наиболее подходящий путь решения и формулы.
Мы в свою очередь на дополнительных занятиях по физике освоим алгоритмы решения задач, которые помогут справиться не только с задачами уровня основной школы, но и сформируют базовые навыки для решения задач уровня средней школы. Во время занятий поможем систематизировать алгоритмы решения задач таким образом, чтобы в процессе решения можно было легко выбрать наиболее подходящий путь решения и формулы.
Цель команды нашей школы, чтобы в результате этих занятий участники приобрели следующие навыки и умения:
- правильно определить заданные величины и задании и в таблицах данных;
- использовать и преобразовывать формулы в соответствии с условиями задач;
- объединить несколько формул решений в одно;
- определить свой путь решения задачи;
- преобразовывать и анализировать единицы измерения;
- вычислить и преобразовать числа в нормальную форму;
- оценить достоверность полученного ответа;
- отобразить в задании происходящие процессы и развить воображение.

Темы занятий:
- Механика (скорость, ускорение, сила, гравитация)
- Энергия (потенциальная и кинетическая энергия, теплота, сохранение энергии)
- Волны (свет, звук)
- Электричество (Закон Ома, электрические цепи, мощность)
- Комбинированные задачи (в которых объединены несколько тем по физике)
ЗАПИСАТЬСЯ
ОПЛАТА И ДРУГАЯ ВАЖНАЯ ИНФОРМАЦИЯ
Занятия будут проходить 1 раз в неделю, 5 раз.
Длительность одного занятия – 2,5 часа (включен перерыв – 15 минут).
В каждом занятии 20% времени предусмотрено на разъяснение теории и 80% времени на практическое решение задач.
Количество участников: до 16 учеников
Взять с собой: тетрадь для записей, ручка, калькулятор.
Занятия будут проходить удаленно через платформу Google Classroom
Включенные в программу задачи дифференцированы по нескольким уровням сложности, начиная с базового и вплоть до уровня олимпиадных задач. Таким образом каждый участник приобретет новые знания и навыки независимо от уровня знаний на начало занятий. Занятие проводит учитель с ассистентом, чтобы была возможность при решении задач уделить каждому участнику индивидуальное внимание и обеспечить максимально эффективные процесс обучения. Уровень освоения материала будет оцениваться с помощью теста в конце каждого занятия. По окончанию всего цикла занятий будет проведен завершающий тест для закрепления и проверки приобретенных знаний и навыков.
Таким образом каждый участник приобретет новые знания и навыки независимо от уровня знаний на начало занятий. Занятие проводит учитель с ассистентом, чтобы была возможность при решении задач уделить каждому участнику индивидуальное внимание и обеспечить максимально эффективные процесс обучения. Уровень освоения материала будет оцениваться с помощью теста в конце каждого занятия. По окончанию всего цикла занятий будет проведен завершающий тест для закрепления и проверки приобретенных знаний и навыков.
Цена: 75 Eur за всю программу (5 раз), 20 Eur за отдельное занятие (отдельно можно посещать только темы 1, 2, 3, 4 занятия).
Оплатить занятия следует до начала первого занятия по Счету, который будет вам выставлен и выслан после заполнения заявки – анкеты.
ЗАПИСАТЬСЯ
ДАТЫ БЛИЖАЙШИХ КУРСОВ
ДРУГИЕ КУРСЫ:
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Олимпиада по химии 2020-21 • Формула Единства
К участию в олимпиаде приглашаются российские школьники 8–11 классов. Участие в олимпиаде бесплатное. Призёры олимпиады получают право на льготную путёвку в образовательные лагеря «Формула Единства».
Участие в олимпиаде бесплатное. Призёры олимпиады получают право на льготную путёвку в образовательные лагеря «Формула Единства».
Организатор олимпиады
Санкт-Петербургский Химико-Фармацевтический Университет.
Контакты оргкомитета олимпиады
Официальные документы
Текущий статус: Подведены итоги заключительного этапа. Информация о церемонии награждения будет позднее.
Хронология событий
Все новости олимпиады будут публиковаться ниже от более новых к более старым.В соответствии с Порядком проведения олимпиад школьников, утверждённым Приказом Минобрнауки России от 4 апреля 2014 г. №267, здесь опубликованы олимпиадные работы победителей и призёров олимпиады «Формула Единства» / «Третье тысячелетие» по химии 2020/21 г.
Уважаемые участники!
Публикуем окончательные результаты официальных участников заключительного этапа
Границы дипломов были установлены следующие:
| 8 класс | 9 класс | 10 класс | 11 класс | |
| I диплом | 80 | 95 | 80 | 75 |
| II диплом | 60 | 70 | 70 | 70 |
| III диплом | 50 | 60 | 65 | 60 |
Информация относительно призов будет направлена на почту.
Внеконкурсным участникам для получения своего балла необходимо зарегистрироваться в системе с указанием своего кода.
Уважаемые участники!
Публикуем предварительные результаты и решения задач заключительного этапа:
Не позднее 23:59 6 апреля по московскому времени участники могут запросить работу и/или подать апелляцию (запрос на пересмотр решения определённой задачи). Для этого нужно прислать письмо на адрес жюри olimp.[email protected]formulo.org, указав в теме письма номер класса. В тексте письма напишите «Запрос работы» или «Апелляция по задаче №…», укажите свои фамилию и имя. Обратите внимание, что в результате апелляции баллы за решение могут как увеличиться, так и снизиться.
Если Вы обнаружили, что результаты участника заключительного этапа отсутствуют или есть ошибка в персональных данных, просим безотлагательно сообщить об этом в жюри.
Решение о присуждении дипломов будет принято при подведении окончательных итогов (7 апреля).
Внеконкурсные участники должны зарегистрироваться в системе до 7 апреля с указанием своего кода.
Участники заключительного этапа олимпиады по химии имеют возможность выбрать площадку в следующих населённых пунктах: Ангарск, Бавлы, Брянск, Волгоград, Вологда, Волжский, Воронеж, Геленджик, Глазов, Дербент, Екатеринбург, Иваново, Казань, Калининград, Киров, Краснодар, Красноярск, Липецк, Магнитогорск, Мезень, Москва, Невинномысск, Нижний Новгород, Новосибирск, Ростов-на-Дону, Санкт-Петербург, Саранск, Симферополь, Томск, Тула, Уфа, Ухта, Хабаровск, Челябинск, Череповец, Ярославль.
Для выбора площадки в личном кабинете нужно найти олимпиаду «Химия 2020–21» в таблице олимпиад и нажать зелёную кнопку «Открыть» под словами «Заключительный этап».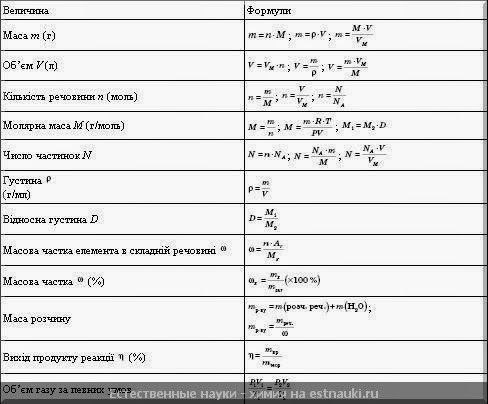 Обратите внимание, что время проведения на выбранной площадке может быть нестандартным (время в информационной системе указывается московское.)
Обратите внимание, что время проведения на выбранной площадке может быть нестандартным (время в информационной системе указывается московское.)
Площадка в любом случае должна быть выбрана не позднее 11 марта.
При возникновении любых сложностей предлагаем обращаться в оргкомитет по адресу olimp.[email protected]formulo.org.
Публикуем полный список участников, приглашенных на заключительный этап, который состоится 13 марта на многочисленных региональных площадках (как правило, в 11:00 по местному времени). Информация о площадках проведения будет опубликована в ближайшие дни.
Уважаемые участники второго отборочного этапа!
Жюри завершило проверку поступивших работ. С набранными баллами Вы можете ознакомиться в личном кабинете в Информационной системе. Там же указано, набран у Вас проходной балл для участия в заключительном этапе или нет. Ниже прикреплены решения и критерии:
Ниже прикреплены решения и критерии:
Уважаемые участники олимпиады, их родители, учителя и руководители кружков! Публикуем полный протокол первого отборочного этапа.
Благодаря поддержке нескольких компаний — доноров Фонда Эйлера Оргкомитет олимпиады объявляет о призах для победителей и призёров олимпиады «Формула Единства» / «Третье тысячелетие» по химии.
Участники, награждаемые дипломом I степени, получат (на выбор) бесплатную путёвку на одну из смен лагеря «Формула Единства» в 2021 г. или сертификат на приобретение продукции в магазинах bookvoed.ru/ozon.ru номиналом 10 000 р.
Участники, награждаемые дипломом II/III степени, получат (на выбор) скидку в размере 50/30 % на путёвку в лагерь «Формула Единства» или сертификат номиналом 5000/3000 р.
Перед Вами задачи дополнительного отборочного этапа химической олимпиады «Формула Единства» / «Третье тысячелетие».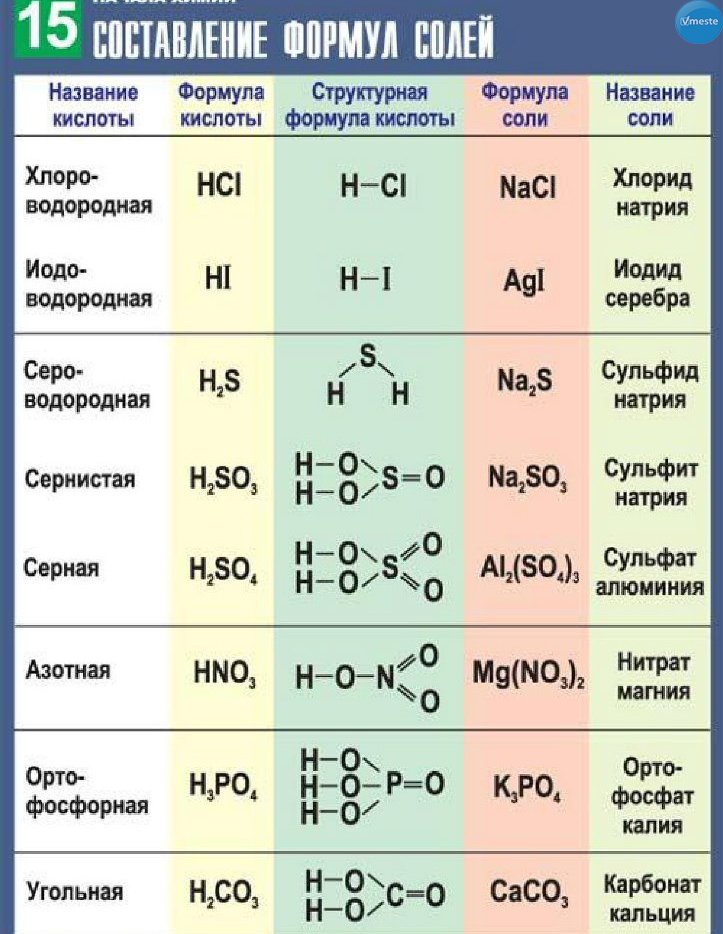 Принять в нём участие могут все желающие российские школьники 8–11 классов.
Принять в нём участие могут все желающие российские школьники 8–11 классов.
Помните, что решение задачи должно включать не только правильный ответ, но и полное обоснование этого ответа. Мы будем рады, если в олимпиаде примут участие Ваши друзья, которым нравится химия. Однако работы с признаками списывания и «коллективного творчества» рассматриваться не будут.
Условия задач в работу переписывать не нужно. Работа должна быть оформлена на русском языке.
Напоминаем, что если у Вас набран проходной балл в первом отборочном этапе, то Вы приглашены СРАЗУ на заключительный этап, который состоится 13 марта 2021 года на региональных площадках.
Порядок участия в олимпиаде
Для участия в олимпиаде необходимо в срок до 14 февраля 2021 г. включительно подготовить файлы с решениями задач (каждая задача — отдельный файл), зарегистрироваться в нашей информационной системе и отправить файлы через личный кабинет:
Загрузить можно как текстовые файлы (в форматах TXT, DOC, DOCX или PDF), сканы бумажных работ (в форматах JPG и PNG), архивы в формате ZIP. На каждую задачу разрешено прикрепить ровно 1 файл. В файлах с решениями задач не должны указываться фамилия, имя и другие личные данные участника!
На каждую задачу разрешено прикрепить ровно 1 файл. В файлах с решениями задач не должны указываться фамилия, имя и другие личные данные участника!
Вопросы?
Все вопросы Оргкомитету по условиям задач и о порядке проведения Олимпиады можно задать по электронной почте olimp.[email protected]formulo.org или по телефону +7 (953) 345–85–17.
Вопросы по работе информационной системы можно задать по электронной почте [email protected]formulo.org.
В связи с малым количеством участников отборочного этапа было принято решение о проведении дополнительного тура олимпиады по химии.
Второй отборочный этап будет проходить 1.02.21 — 14.02.21. К участию приглашаются все желающие школьники 8–11 классов. Для этого необходимо зарегистрироваться в информационной системе и загрузить решения в период проведения этапа. Задания будут доступны с 1 февраля.
Уважаемые участники первого отборочного этапа по химии этого года! Вы можете ознакомиться со своими результатами в информационной системе. Если у Вас набран проходной балл, то Вы приглашены СРАЗУ на заключительный этап, который состоится 13 марта 2021 года на региональных площадках.
Если Вы не набрали проходного балла, то Вы можете поучаствовать во втором отборочном этапе олимпиады по химии, и, в случае успешного прохождения, мы Вас пригласим на заключительный этап.
Уважаемые участники отборочного этапа!
Жюри завершило проверку поступивших работ. С набранными баллами вы можете ознакомиться в личном кабинете в Информационной системе. Ниже прикреплены решения и критерии:
Окончательное решение по итогам этапа будет опубликовано в ближайшие несколько дней.
Перед Вами задачи отборочного этапа второй химической олимпиады «Формула Единства» / «Третье тысячелетие».
Помните, что решение задачи должно включать не только правильный ответ, но и полное обоснование этого ответа. Мы будем рады, если в олимпиаде примут участие Ваши друзья, которым нравится химия. Однако работы с признаками списывания и «коллективного творчества» рассматриваться не будут.
Условия задач в работу переписывать не нужно. Работа должна быть оформлена на русском языке. Использование других языков должно быть заранее согласовано с организаторами.
Призёры первой химической олимпиады «Формула Единства» / «Третье тысячелетие» 2019/20 г. будут приглашены непосредственно на заключительный этап.
Порядок участия в олимпиаде
Для участия в олимпиаде необходимо в срок до 10 декабря 2020 г. включительно подготовить файлы с решениями задач (каждая задача — отдельный файл), зарегистрироваться в нашей информационной системе и отправить файлы через личный кабинет:
Загрузить можно как текстовые файлы (в форматах TXT, DOC, DOCX или PDF), сканы бумажных работ (в форматах JPG и PNG), архивы в формате ZIP. На каждую задачу разрешено прикрепить ровно 1 файл. В файлах с решениями задач не должны указываться фамилия, имя и другие личные данные участника!
На каждую задачу разрешено прикрепить ровно 1 файл. В файлах с решениями задач не должны указываться фамилия, имя и другие личные данные участника!
Обращаем внимание, что наша информационная система была запущена всего несколько месяцев назад, и все участники должны регистрироваться заново (прежняя регистрация на других площадках не действует).
Вопросы?
Все вопросы Оргкомитету по условиям задач и о порядке проведения Олимпиады можно задать по электронной почте olimp.[email protected]formulo.org или по телефону +7 (953) 345–85–17.
Вопросы по работе информационной системы можно задать по электронной почте [email protected]formulo.org.
Примеры решения задач на нахождение формулы вещества
Примеры решения задач на нахождение формулы вещества
Эмпирическая формула любого вещества – это формула, которая выражает простейшее целочисленное отношение элементов, содержащихся в данном веществе. Эмпирические формулы иногда называют также простейшими формулами. Для вывода эмпирической формулы вещества достаточно знать его количественный состав – массовые доли элементов.
Эмпирические формулы иногда называют также простейшими формулами. Для вывода эмпирической формулы вещества достаточно знать его количественный состав – массовые доли элементов.
Вывод химических формул, если известны массовые доли химических элементов, входящих в состав данного вещества
Пример 1. Известно, что вещество состоит из 0,4 (40%) массовых долей кальция Са, 0,12 (12%) массовых долей углерода С, 0,48 (48%) массовых долей кислорода О. Вывести химическую формулу этого вещества.
Решение. При делении численных значений массовых долей химических элементов, входящих в состав данного вещества, на их относительные атомные массы находят отношение числа атомов: 0,4:0,12:0,48
0,4/40 (Са) : 0,12/12 (С): 0,48/16 (О) = 0,01 : 0,01 : 0,03 = 1 : 1 : 3
В этих расчетах часто употребляют массовые доли, выраженные в процентах:
40/40 (Сa) : 12/12 (С) : 48/16 (О) = 1 : 1 : 3
Расчет показывает, что в данном веществе на один атом кальция приходится один атом углерода и три атома кислорода. Следовательно, химическая формула данного вещества СаСО3
Следовательно, химическая формула данного вещества СаСО3
Пример 2. Соединение содержит 36,5% натрия, 25,4% серы и 38,1% кислорода. Определите формулу вещества.
1. С помощью соответствующих обозначений запишем условие задачи, найдем атомные массы элементов, о которых идет речь в условии задачи
Дано: ω(Na) = 36,5% ω(S) = 25,4% ω(O) = 38,1% Ar(Na) = 23 Ar(S) = 32 Ar(O) = 16 | Решение 2. Разделим массовую долю каждого элемента на его атомную массу x : y : z = 36,5 / 23 : 25.4 / 32 : 38 / 16 x : y : z = 1,587 : 0,793 : 2,381 3. Разделим полученные величины на наименьшую. Полученные числа – индексы элементов в формуле соединения. x : y : z = 1,587 / 0,793 : 0,793 / 0,793 : 2,381 / 0,793 x : y : z = 2 : 1 : 3, следовательно Na2SO3 4. Ответ: Na2SO3 |
Найти: NaxSyOz – ? |
Химические формулы в химии – формулы и определения с примерами решения задач
Содержание:
- Химические формулы
- Составление химических формул по валентности
- Относительная молекулярная масса
Химическая формула — условное обозначение химического состава и структуры соединений с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п.). Химические формулы являются составной частью языка химии.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Химические формулыХимическая формула — это условная запись состава вещества с помощью символов химических элементов и индексов. Вы знаете, что символ химического элемента показывает один атом этого элемента, а индекс — число атомов данного химического элемента в молекуле и пишется в формуле после знака химического элемента внизу.
Вы знаете, что символ химического элемента показывает один атом этого элемента, а индекс — число атомов данного химического элемента в молекуле и пишется в формуле после знака химического элемента внизу.
Вспомните, молекулы каких простых веществ состоят из двух атомов. Выучите их формулы: h3, N2, O2, F2, Cl2, Br2, I2.
Химическая формула показывает качественный и количественный состав вещества.
Чтобы указать число свободных атомов химического элемента или число молекул вещества, пользуются коэффициентом, который записывается перед символом химического элемента или перед химической формулой (табл. 13).
Таблица 13
Химические формулы
| Состав молекулы | Химическая формула | Рисунок молекулы | Прочтение формулы |
| Два атома водорода | H2 | “аш-два” | |
| Один атом серы и три атома кислорода | SO3 | “эс-о-три” | |
| Два атома калия, один атом серы и четыре атома кислорода | K2SO4 | “калий-два-эс-о-четыре” | |
| Три молекулы аммиака | 3NH3 | “три-эн-аш-три” |
Химические формулы можно вывести на основе данных о составе веществ. Однако чаще всего при составлении химических формул учитывается валентность элементов.
Однако чаще всего при составлении химических формул учитывается валентность элементов.
Валентность — это свойство атомов химического элемента присоединять определенное число атомов другого химического элемента.
За единицу валентности принята валентность атома водорода. Если к одному атому данного элемента присоединяется один атом водорода, то элемент одновалентен, если два — двухвалентен и т. д.
Например: численное значение валентности обозначается римскими числами, которые ставятся над знаками химических элементов.
Водородные соединения известны не для всех элементов, но практически все элементы образуют соединения с кислородом. Кислород постоянно двухвалентен, поэтому валентность определяют также по кислороду. Например: MgO, СаО, так как кислород двухвалентен и в этих оксидах на один атом элемента приходится по одному атому кислорода, то магний и кальций двухвалентны.
Многие элементы в соединениях проявляют постоянную валентность. Но есть элементы, обладающие переменной валентностью (табл. 14). Сера в химическом соединении SO2 имеет валентность, равную четырем, а в соединении SO3 валентность серы равна шести.
14). Сера в химическом соединении SO2 имеет валентность, равную четырем, а в соединении SO3 валентность серы равна шести.
Таблица 14
Валентность некоторых химических элементов
| Валентность | Химические элементы |
| С постоянной валентностью | |
| I | H, Na, K, Li |
| II | O, Be, Mg, Ca, Ba, Zn |
| III | Al, B |
| С переменной валентностью | |
| I и II | Cu |
| II и III | Fe, Co, Ni |
| II и IV | Sn, Pb |
| III и V | P |
| II, III и VI | Cr |
| II, IV и VI | S |
Вещество, состоящее из двух элементов, называется бинарным соединением. Примером бинарных соединении являются оксиды. Чтобы составлять их химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение (табл. 14). Будем составлять формулы в соответствии с алгоритмом.
Примером бинарных соединении являются оксиды. Чтобы составлять их химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение (табл. 14). Будем составлять формулы в соответствии с алгоритмом.
1) записываем рядом символы химических элементов:
NaO, AlO, РО
2) ставим над химическими элементами их валентности римскими цифрами:
3) находим наименьшее общее кратное чисел, выражающих валентность обоих элементов:
4) делим его на валентности элементов и находим индексы соответствующего элемента (индекс 1 не пишется):
Na2O, Al2O3, P2O5
Знаешь ли ты?
Самым длинным химическим названием обладает ДНК, выделенная из митохондрии человека. Полное название этого соединения, рассчитанное теоретически, должно содержать около 207 тыс. знаков.
Если у данного элемента валентность переменная» то ее указывают в скобках. Например, FeO — оксид железа (II), Fе2О3 — оксид железа (III). А также, зная формулу вещества, можно определить валентность элементов. Например, в оксиде алюминия Al2O3 валентность кислорода равна двум. Общее число единиц валентностей трех атомов кислорода равно шести (2*3). Следовательно, шесть валентностей кислорода приходятся на два атома алюминия, а на один атом алюминия приходится три единицы валентности (6:2).
Например, FeO — оксид железа (II), Fе2О3 — оксид железа (III). А также, зная формулу вещества, можно определить валентность элементов. Например, в оксиде алюминия Al2O3 валентность кислорода равна двум. Общее число единиц валентностей трех атомов кислорода равно шести (2*3). Следовательно, шесть валентностей кислорода приходятся на два атома алюминия, а на один атом алюминия приходится три единицы валентности (6:2).
Знаешь ли ты?
Если 100 миллионов атомов водорода расположить рядом друг с другом, то они образуют цепочку длиной 1 см.
Относительная молекулярная массаМасса молекулы, выраженная в атомных единицах массы, называется молекулярной массой данного вещества.
Относительная молекулярная масса (Мr) вещества показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Например, молекула водорода в два раза тяжелее, чем атомная единица массы (рис. 28).
28).
Рис. 28. Молекула водорода в два раза тяжелее, чем атомная единица массы
По химической формуле вещества можно вычислить его относительную молекулярную массу, исходя из величин относительных атомных масс элементов вещества. Относительная молекулярная масса является безразмерной величиной, потому что атомные массы элементов, входящих в состав молекулы, также безразмерные величины. Относительная молекулярная масса обозначается символом (Мr).
Относительная молекулярная масса вещества вычисляется следующим образом: относительная атомная масса каждого элемента умножается на число его атомов в составе молекулы и полученные величины суммируются (см. табл. 15).
Теперь можно выяснить, что показывает химическая формула. Рассмотрим это на примере воды и сульфида магния (см. табл. 16).
Пользуясь химическими формулами, производят различные расчеты. Рассмотрим, как по химическим формулам вычисляется отношение масс атомов элементов в сложном веществе.
• Задача. Вычислите массовое соотношение элементов в карбонате магния (MgCO3).
Решение. Зная относительные атомные массы элементов и число атомов, входящих в состав химического соединения, можно определить массовое соотношение этих элементов;
w(Mg) : w(C): w(O)= 24 : 12 : 48 = 2 : 1: 4:
2 + 1 + 4 = 7.
Это означает, что на 7 мас. ч. карбоната магния приходится 2 мас. ч, магния, 1 мас. ч. углерода и 4 мас. ч. кислорода. Массовые части можно измерить любыми единицами (г, кг, т). 7 г карбоната магния содержат 2 г магния, 1 г углерода и 4 г кислорода.качестве чистящего средства. В виде медицинского раствора оно служит для обработки ран.
Таблица 15
Относительные молекулярные массы
| N2 | Mr(N2) = 2 • 14 = 28 | |
| SO3 | Mr(SO3) = 32 + 3 • 16 = 80 | |
| H2SO4 | Mr(H2SO4) = 1 • 2 + 32 +4 • 16 = 98 | |
| Fe(NO3)2 | Mr(Fe(NO3)2) = 56 + 2 • (14+3 • 16) = 180 |
Таблица 16
| 1 | Химическая формула вещества | H2O | MgS |
| 2 | Название вещества | Вода | Сульфид магния |
| 3 | Одна молекула данного вещества | Одна молекула воды | Одна молекула сульфида магния |
| 4 | Качественный состав (из каких химических элементов состоит данное вещество) | В состав воды входят химические элементы водород Н и кислород О | В состав сульфида магния входят химические элементы магний Мg и сера S |
| 5 | Количественный состав | Молекула воды образована двумя атомами водорода Н и одним атомом кислорода О | В состав сульфида магния входят один атом магния и один атом серы |
| 6 | Массовые отношения элементов в этом веществе | m(H) : m(O) = 2:16 = 1 : 8 | m(Mg) : m(S) = 24 : 32 = 3 : 4 |
| 7 | Относительная молекулярная масса | Mr(H2O) = 2 • 1+16 = 18 | Mr(MgS) = 24 + 32 = 56 |
Знаешь ли ты?
Молекулярная формула перекиси водорода H2O2.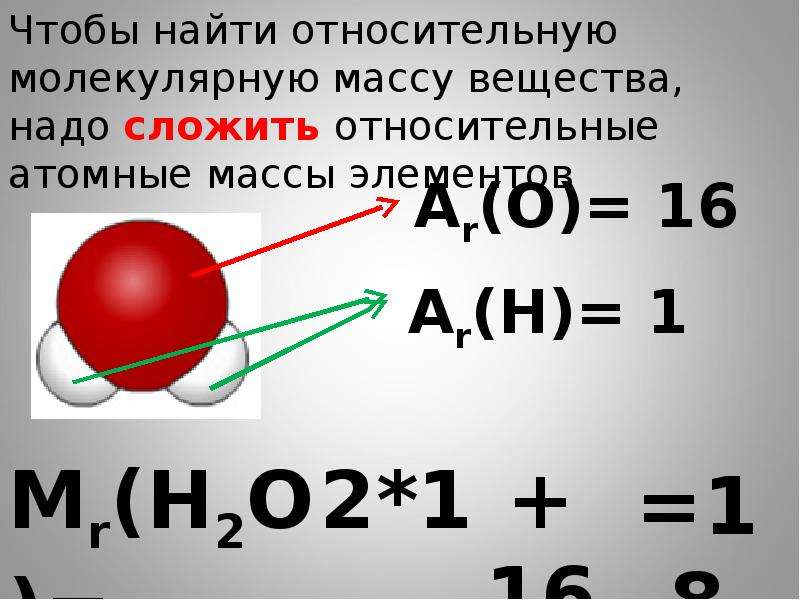 Это вещество часто используют для осветления волос и в качестве чистящего средства. В виде медицинского раствора оно служит для обработки ран.
Это вещество часто используют для осветления волос и в качестве чистящего средства. В виде медицинского раствора оно служит для обработки ран.
Самое важное
Химическая формула — это условное обозначение состава вещества с помощью символов химических элементов и индексов. Химическая формула показывает количественный и качественный состав вещества. Индекс показывает количество атомов элемента в химической формуле. Коэффициент показывает количество атомов или молекул. Вещество, состоящее из двух элементов, называется бинарным соединением. Валентность — это свойство атомов одного химического элемента присоединять определенное число атомов другого химического элемента. Валентность бывает постоянной и переменной.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д.
 И. Менделеева
И. Менделеева - Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А.
 М. Бутлерова
М. Бутлерова - Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
3.3: Написание химических формул (задачи)
ПРОБЛЕМА \ (\ PageIndex {1} \)
Объясните, почему символ атома элемента кислорода и формула молекулы кислорода различаются.
- Ответ
Символ кислородного элемента, O, представляет как элемент, так и один атом кислорода. Молекула кислорода O 2 содержит два атома кислорода; индекс 2 в формуле должен использоваться, чтобы отличать двухатомную молекулу от двух одиночных атомов кислорода.
ПРОБЛЕМА \ (\ PageIndex {2} \)
Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
(г)
- Ответьте на
молекулярный: CO 2
эмпирический: CO 2
- Ответ б
молекулярный: C 2 H 2
эмпирический: CH
- Ответ c
молекулярный: C 2 H 4
эмпирический: CH 2
- Ответ d
молекулярный: H 2 SO 4
эмпирический: H 2 SO4
ПРОБЛЕМА \ (\ PageIndex {3} \)
Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
(г)
- Ответьте на
молекулярный: C 4 H 8
эмпирический: CH 2
- Ответ б
молекулярный: C 4 H 6
эмпирический: C 2 H 3
- Ответ c
молекулярный: H 2 Si 2 Cl 4
эмпирический: HSiCl 2
- Ответ d
молекулярный: H 3 PO 4
эмпирический: H 3 PO4
- Нажмите здесь, чтобы просмотреть видео о решении
ПРОБЛЕМА \ (\ PageIndex {4} \)
Определите эмпирические формулы для следующих соединений:
(а) кофеин, C 8 H 10 N 4 O 2
(б) фруктоза, C 12 H 22 O 11
(в) пероксид водорода, H 2 O 2
(г) глюкоза, C 6 H 12 O 6
(д) аскорбиновая кислота (витамин C), C 6 H 8 O 6
- Ответьте на
C 4 H 5 N 2 O
- Ответ б
С 12 В 22 О 11
- Ответ c
HO
- Ответ d
CH 2 O
- Ответ e
С 3 H 4 O3
ПРОБЛЕМА \ (\ PageIndex {5} \)
Определите эмпирические формулы для следующих соединений:
(а) уксусная кислота, C 2 H 4 O 2
(б) лимонная кислота, C 6 H 8 O 7
(в) гидразин, N 2 H 4
(d) никотин, C 10 H 14 N 2
(e) бутан, C 4 H 10
- Ответьте на
CH 2 O
- Ответ б
С 6 В 8 О 7
- Ответ c
NH 2
- Ответ d
C 5 H 7N
- Ответ e
С 2 В 5
- Нажмите здесь, чтобы просмотреть видео о решении
Коллекция из 62 химических калькуляторов и утилит
В вашем браузере отключен JavaScript.
Вам необходимо включить его, чтобы использовать наши калькуляторы на основе JavasSript.
Содержание
Обзор
Химия – это наука о материи: о ее составе, свойствах, изменениях, которые приводят к ее образованию, и способах ее взаимодействия с другими веществами в окружающей среде. Мы начинаем со строительных блоков материи – электронов, нейтронов и протонов – и строим атомы и ионы, которые затем образуют молекулы и ионные соединения, которые могут реагировать, создавая известный нам материальный мир.Тщательное исследование свойств и тенденций этих материальных образований способствует лучшему пониманию возможностей материального мира.
Этот сборник химических калькуляторов, разбитых на различные фундаментальные концепции, является хорошим обзором вводной химии, но также содержит некоторые инструменты для более высоких усилий по таким темам, как квантовые числа и продвинутая стехиометрия.
Кислотно-основные реакции
- Калькулятор pH WebQC – нужно знать pKa раствора? Или, может быть, даже просто pH? Посетите эту страницу, чтобы узнать обо всех ваших потребностях в кислотно-щелочной реакции.
- EasyCalculation Neutralization Reaction – Есть два способа проверить вашу работу: сдать ее и надеяться на лучшее или использовать этот сайт. Это так же просто, как нажмите, подключите и проверьте!
- Meracalculator Neutralization Reactions – Отлично подходит при работе с реакциями нейтрализации кислот и оснований, возвращайтесь к «нормальному состоянию» с помощью этого простого в использовании инструмента для решения проблем.
Буферы
- Рецепты буфера PFG – Этот простой инструмент дает быстрые и точные ответы, а также дает возможность распечатать результаты и создать буферный рецепт для использования в будущем.
- Wiley Buffers – Очень простой сайт без рекламы для расчета буфера.
- Science Gateway Общие реагенты и буферы – нужно знать массу или объем буферов? Как насчет объема буфера, необходимого для разбавления раствора? Щелкните здесь также, чтобы просмотреть список общих реагентов.
Катализ
- Энергия активации – Вам нужно знать энергию активации реакции в Дж / моль, а не в британских тепловых единицах / фунт-моль? Просто подключите и выпейте здесь свои ответы об энергии активации, чтобы быстро и удобно проводить вычисления.

Химическое равновесие
- Onlinesciencetools Химическое равновесие – склоните чашу весов в правильном направлении с помощью этих простых в использовании равновесных весов. Просто вставьте свои фигуры в отведенные места, и ваши формулы всегда будут выровнены.
- Tutorvista Equilibrium Constant – Найдите константу равновесия для любого уравнения с помощью этого простого в использовании онлайн-уравнения. Просто введите значения равновесия и нажмите «рассчитать константу равновесия».”
- Colorado State Equilibria – более продвинутый и точный онлайн-источник для подсчета равновесий.
Эмпирические и молекулярные формулы
Электрохимия
- Калькулятор электрической движущей силы
- – Определите движущую силу любой электрохимической реакции с помощью этого простого в использовании инструмента.
- Calctool.org Nernst Solver – Вам нужно знать фактический или стандартный обратимый потенциал уравнения Нернста? Введите свои данные в текстовые поля и начните получать ответы.
- TutorVista Nernst Equation – Найдите редукционный потенциал уравнения, используя это простое уравнение Нернста. Заполните отведенные текстовые поля своими фигурами и позвольте ему сделать все остальное.
Электролиз
Электронные квантовые числа
Газовые законы (идеальный закон, закон Дальтона и Грэма)
- AJ Design Формулы и уравнения закона идеального газа – Решаете ли вы для плотности, давления, температуры или объема с помощью закона идеального газа, Закон идеального газа
- WebQC – идеальное место для любого химика, студента или кого-либо другого, чтобы иметь быстрый доступ к множеству уравнений и простых в использовании расчетов.
- EasyCalculation Закон идеального газа – Просто введите цифры, которые вы знаете из уравнений закона идеального газа, а все остальное сделает easycalculation.com.
- Mera Calculator Закон Дальтона – Если вам нужно знать парциальные давления уравнения, то meracalculator.com – это то, что вам нужно. Этот сайт использует закон Далтона для вычисления этих значений парциального давления за вас.
- 1728 Закон диффузии Грэма. Это отличное место для изучения закона диффузии уравнений Грэма.Удобные, точные результаты.
Ионные / ковалентные связи
Ионы и молекулы
- Цифровое ионное уравнение – Вы знаете название молекулы, но не знаете, из чего она состоит? Просто введите название, и этот инструмент предоставит вам молярную массу и эмпирическую формулу молекулы.
- Shodor Polyatomic Ion – Если вы знаете эмпирическую формулу иона или молекулы, то можете узнать ее название. Отлично подходит, если вы новичок в ионах и молекулах или просто хотите перепроверить свою работу.
- Mera Calculator Polyatomic Ion – Простой, но эффективный, этот калькулятор позволяет ввести положительные и отрицательные ионы из эмпирической формулы, а затем выдает название молекулы.
Кинетика
Масс-спектрометрия
Ядерный распад
Реакции окисления-восстановления
- TutorVista Oxidation Number – Введите желаемую химическую формулу, и этот полезный онлайн-инструмент покажет окислительно-восстановительное число за секунды. Окислительно-восстановительные реакции
- Shodor – Для более глубокого изучения окислительно-восстановительных реакций воспользуйтесь этим отличным средством для решения проблем «plug and chug». Вольфрамовое число окисления
- – просто введите химическую формулу, и вы сразу же получите числа реакций окисления-восстановления и структурную диаграмму.
Процентный состав
Значимые цифры
- Значимые цифры – Не сбавляйте скорость из-за длинных рукописных формул.Вставьте здесь свои уравнения или числа, чтобы быстро и надежно подсчитать значимые числа.
- Ostermiller Значительные цифры – Значительные цифры сбивают вас с толку? Щелкните здесь и введите свои числа, чтобы получить правильное количество значащих цифр для любого числа, а также определить наименее значащий десятичный разделитель. Счетчик значащих цифр
- для химиков – Хотите перепроверить количество значащих цифр? Просто введите свои числа, чтобы получить точные значащие цифры.
- CalculatorSoup Significant Figures – Этот инструмент, содержащий подробные сведения об идентификации значащих цифр, также помогает научить вас округлять (и может проверить вашу работу).
- TutorCircle Significant Figures – Обширный список примеров и инструкций по значимым цифрам, со счетчиком сигнатур, так что вы даже можете проверить свою работу.
Концентрация раствора
Стехиометрия раствора (моли, титрование и расчеты молярности)
- Endmemo Chemical Mole Grams – Введите здесь химические формулы, чтобы вычислить количество молей или граммов в химической формуле.
- AJ Design Формулы и уравнения закона идеального газа – Используйте этот онлайн-вычислитель для решения уравнений и формул закона идеального газа с использованием давления, объема и температуры.
- Lenntech Molecular Weights – Рассчитайте среднюю молекулярную массу (MW) по молекулярной формуле или по одному из двух списков распространенных органических соединений или элементов периодической таблицы. Инструмент стехиометрии
- – введите свои сбалансированные химические уравнения (при необходимости используйте балансировщик химических уравнений!), Чтобы получить стехиометрию каждого уравнения.
- OST Стехиометрия – с широким диапазоном входных параметров и опций для типа газа, а также выхода, этот инструмент незаменим для ваших расчетов стехиометрии.
- Стехиометрия реакции – задайте реакцию и выберите, хотите ли вы рассчитать реагент или продукт.
- Концентрация раствора с помощью титрования – онлайн-инструмент для титрования образцов с учетом концентрации стандарта, объема титранта, необходимого для титрования стандарта и образца.
- GraphPad Молярность – масса, объем и концентрация: имея два, легко вычислить другое или разбавить исходный раствор.
- Molaritycalculator.com – позволяя рассчитывать массу, объем или концентрацию в зависимости от того, какие два из них известны, на этой странице также есть подробные объяснения различных способов выполнения этих расчетов вручную.
- Sigma-Aldrich Mass Molarity – Рассчитайте массу, необходимую для молярного раствора определенной концентрации и объема.
Дополнительные инструменты
Список общих уравнений
Периодическая таблица
- Интерактивная таблица Менделеева
- – Нужна справочная информация, пока вы делаете домашнее задание по химии, или, может быть, вы просто хотите узнать больше об элементах? В таком случае эта интерактивная таблица Менделеева идеально подходит для обычного браузера или подготовки к тестам.
Основные единицы измерения (метрическая система / СИ)
- UCDavis Единицы СИ – Вам нужно знать, какую единицу измерения использовать для этого уравнения плотности? Может быть, вам нужно освежить свои префиксы измерений? В любом случае, этот список единиц СИ является удобной справочной информацией.
В вашем браузере отключен JavaScript.
Вам необходимо включить его, чтобы использовать наши калькуляторы на основе JavasSript.
Решение проблем в химии Учебник
Ключевые понятия
Есть 5 шагов к решению задач по химии (1) , которые можно представить как светофор:
| 1: | СТОП! | S проблема времени. | ↓ | СТОП | ← | 5: | СТОП! | S раствор для пирога или S снова пирог |
|---|---|---|---|---|---|---|---|---|
| 2: | ПАУЗА! | P план ремонта. | ↓ | ПАУЗА | ↑ | 4: | ПАУЗА! | P На достоверность. |
| 3: | GO! | G o с планом игры. | → | GO | ↑ |
AUS-e-TUTE называет это подходом к решению проблем Sto P Go P S :
| Шаг 1: | Sto p, чтобы сформулировать проблему и извлечь все данные из вопроса. |
|---|---|
| Шаг 2: | P поможет подготовить ваш план игры, ваш подход к решению проблемы. |
| Шаг 3: | Go сделай это! Следуйте инструкциям вашего плана игры. |
| Шаг 4: | P позволяет задуматься, разумно ли ваше решение проблемы. Проверьте правильность примененных вами научных принципов. Проверить правильность формул, расчетов, единиц измерения и т. Д. |
| Шаг 5: | S верх. Довольны вашим решением? Назовите решение! Не устраивает ваше решение? Снова начните процесс решения проблемы с шага 1. |
Здесь вы найдете одностраничный шаблон (pdf), который можно использовать для решения проблем.
Все учебные пособия AUS-e-TUTE используют эту эвристическую «временную» процедуру для решения проблем.
Это руководство намного длиннее, чем нам хотелось бы, но это потому, что мы собираемся сосредоточиться на некоторых проблемных областях, поднятых экзаменаторами (экзаменаторами) в их отчетах о внешних экзаменах.
Итак, прежде чем вы начнете, вы можете пойти в ванную, взять что-нибудь попить и / или поесть и получить дополнительную подушку для своего стула….
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
СТОП! Сформулируйте проблему
Цель этого первого шага – разобрать вопрос так, чтобы вы могли ясно видеть:
- что вас просит сделать вопрос
- какие научные принципы необходимо применять
- какая информация была предоставлена вам в вопросе
Шаг 1. Внимательно прочтите вопрос.
Шаг 2. Подчеркните слова или фразы в вопросе, которые говорят вам, что вас просят сделать.
| Ключевое слово | Значение |
|---|---|
| счет | укажите причины этого или сообщите об этом |
| анализировать | определить компоненты в этом и отношения между этими компонентами |
| применить | использовать информацию, данную в данной конкретной ситуации |
| оценка | оцените стоимость этого |
| оценить | оценить стоимость этого |
| оценить | выносит суждение об этом на основании его ценности, качества, результата, результата или размера |
| рассчитать | определить значение для этого на основе данных |
| уточнить | сделайте это ясно или просто |
| классифицировать | упорядочить данные по группам, категориям или классам |
| сравнить | показать, как эти вещи одинаковы или разные |
| конструкция | создать или построить вещь или набор аргументов |
| контраст | показывают, как все обстоит иначе или как одно противоположно другому |
| критически | проанализирует и оценит это на предмет степени точности и глубины понимания, то есть определит компоненты и взаимосвязь между ними, а затем вынесет суждение. |
| вывод | сделайте выводы по этому поводу |
| определить | укажите значение этого и определите его основные компоненты |
| продемонстрировать | покажите это на примере |
| описать | дать характеристики и особенности этого |
| обсудить | выявить проблемы и дать ключевые аргументы за и против этого |
| различить | обратите внимание на различия между этими вещами |
| оценить | сделать суждение об этом на основе определенных критериев или определить стоимость этого |
| изучить | запросить |
| объяснить | связывает причину и следствие, проясняет взаимосвязь между вещами, объясняет, почему и как это так |
| исследовать | внимательно изучите предоставленную информацию, чтобы что-то обнаружить |
| экстракт | из предоставленной информации выберите соответствующие и / или соответствующие данные |
| экстраполировать | сделать вывод об этом из того, что известно |
| идентифицировать | узнайте и назовите это |
| интерпретировать | извлечь смысл из этого |
| расследовать | планируют, исследуют и делают выводы об этом |
| по ширине | обосновать аргумент или вывод, указав причины |
| организовать | использовать различные фрагменты информации, чтобы создать единое целое |
| контур | дайте основные характеристики этого, набросайте в общих чертах |
| прогноз | предположить, что может произойти на основании предоставленной информации |
| предложить | выдвинул на рассмотрение пример, точку зрения, идею, аргумент, предложение и т. Д. |
| отзыв | представить запомненные идеи, факты, опыт |
| распознать | определить по знаниям, опыту или характеру |
| рекомендовать | приводят доводы в пользу этого |
| пересчет | пересказ череды событий |
| выбрать | тщательно выбирайте что-то, отдавая предпочтение другому |
| подвести итог | кратко укажите соответствующие подробности |
| синтезировать | объединить различные фрагменты данных в единое целое |
Шаг 3. Запишите, что вас просят сделать в вопросе, то есть сформулируйте проблему.
Используйте ключевое слово в начале оператора.
Пример: Вычислить молей газа.
Пример: Объясните , почему скорость реакции увеличивается.
Шаг 4. Выделите ключевых слова, обозначающих научные принципы, которые вам нужно будет применить.
| Слово / фраза | Научный принцип (тип проблемы) |
|---|---|
| кислота | Определение (Аррениус? Бронстед-Лоури? Льюис? Монопротический? Дипротический? Трипротический? Полипротический?)? Нейтрализация? Титрование? Расчет pH / pOH / концентрации? Равновесие? Буфер? Скорость реакции? Кислотный дождь? |
| активность | Activity Series? Тенденция периодической таблицы? |
| аммиак | Структура / внутримолекулярные силы (связывание)? Межмолекулярные силы? Газ (стехиометрия? Газовые законы?)? Процесс Габера (равновесие? Скорость реакции? Катализаторы? Уравнение? Стехиометрия?)? |
| основание | Определение (Аррениус? Бронстед-Лоури?), Нейтрализация? Титрование? Расчет pH / pOH / концентрации? Равновесие? Буфер? Скорость реакции? |
| облигация | Внутримолекулярные силы (ковалентные? Ионные? Металлические?)? Межмолекулярные силы (дисперсионные силы? Диполь-дипольные взаимодействия? Водородная связь?)? |
| буфер | Равновесие? Кислотно-щелочная? Теория Бронстеда-Лоури? Сила кислот / оснований? |
| катализатор | Скорость реакции? Изменение энтальпии? Энергетический профиль? Использование? Фермент? |
| хроматография | Тип (бумага? Тонкий слой? Газ? Высокоэффективная жидкость?)? Расчет (коэффициент замедления? Время удерживания? Концентрация?)? |
| горение | Органическая химия (написать уравнение? Полное / неполное?)? Энтальпия (Расчет теплоты сгорания? Энергетический профиль? Закон Гесса?)? Калориметрия? Топливо (эффективность сгорания? Факторы, влияющие на?) |
| концентрация | Тип раствора (водный раствор? Газовая смесь? И т. Д.)? Стехиометрия (расчет)? Преобразование единиц измерения? Разбавление? |
| конъюгат | Теория Бренстеда-Лоури? Сила кислот / оснований? |
| цикл | Тип (углерод? Азот?)? Стехиометрия (расчет)? Химическое уравнение? Равновесие? Скорость реакции? |
| моющее средство | Структура (анионная, катионная, нейтральная)? Очистка (мицеллы? Межмолекулярные силы? Поверхностное натяжение?)? |
| рабочий объем | Уравнение реакции вытеснения? Серия мероприятий? Расчет электродного потенциала (ЭДС)? |
| электролизный / электролитический | Электролитическая ячейка? Уравнение окислительно-восстановительной реакции? Расчет электродного потенциала (ЭДС)? Применение (зарядка аккумуляторов? Гальваника? Извлечение / рафинирование металлов?)? |
| электрофорез | Техника? Разделение аминокислот? ДНК? |
| энтальпия | Расчет стохиометрии? Закон Гесса? Энергетический профиль? Жар реакции? Жар нейтрализации? Теплота раствора? Теплота сгорания? Теплота образования? Связанная энергия? Скрытая теплота? Калориметрия? Равновесие? Скорость реакции? |
| равновесие | Принцип Ле Шателье? Расчет / с использованием константы равновесия (K)? Расчет / использование коэффициента реакции (Q)? Кислота (K a )? База (K b )? Вода (K aw )? Осадок (K sp )? Применение (кровь? Процесс Хабера? Контактный процесс? Процесс Solvay?)? |
| формула | Органический (молекулярная формула? 2-мерная структурная формула? 3-мерная структурная формула? Сжатая (полу) структурная формула? Скелетная формула?)? Соль? Переходный Металлический Комплекс? |
| газ | Закон Гей-Люссака? Принцип Авогадро? Закон Бойля? Закон Чарльза? Комбинированное газовое уравнение? Закон об идеальном газе? Кинетическая теория газов? Закон частичных давлений Дальтона? Законы Грэма излияния и диффузии? |
| теплица | Эффект? Газы (вид «стехиометрических» уравнений?) |
| период полураспада | Ядерный распад? Скорость реакции? |
| изотоп | Атомная теория? Ядерный распад? Относительная атомная масса? Масс-спектроскопия? Период полураспада? Свойства / использование? Стабильность? |
| масса | Стехиометрия (расчет?)? Преобразование единиц измерения? Относительная атомная масса? Молярная масса? Молекулярная масса? Формула массы? Изотопная масса? Масс-спектроскопия? |
| металл | Периодическая таблица Тенденции? Реакции? Стехиометрия? Металлическое соединение? Серия мероприятий? Извлечение металлов из руд? Свойства / использование? |
| молярность | Стехиометрия (расчет)? Тип реакции (кислотно-щелочной? Окислительно-восстановительный? Металл + кислота? Вытеснение? Горение? Синтез и т. Д?)? Написать химическое уравнение? Разбавление? |
| моль | Стехиометрия (расчет)? Газ? Твердый? Жидкость? Решение? Тип реакции (кислотно-щелочное? Вытеснение? Окислительно-восстановительный? Синтез? Горение? И т.д.)? Ограничение количества реагента / реагента в избытке? |
| наименование | Органическая номенклатура (IUPAC? Common?), Бинарное неорганическое соединение или соль? Переходный Металлический Комплекс? |
| нейтрализация | Теория Аррениуса? Теория Бронстеда-Лоури? Перенос протонов? Титрование? Соль (pH? Концентрация? Идентичность?)? |
| ядерный распад | Написать уравнение? Расчет (период полураспада? Масса? Процент?) Изотопов? Излучение (альфа?, Бета?, Гамма?)? |
| окисление | Органическая химия (напишите уравнение? Окислители?)? Электрохимия (степень окисления? Написать полууравнение? Окислитель?) |
| озон | Структура? Озоновый слой? Истощение озонового слоя? Стехиометрия (расчет)? Химическое уравнение? |
| полимер | Имя / Структура? Типа (добавление / конденсация?)? Примеры? |
| осадок | Уравнение (молекулярное? Ионное? Чистое ионное?)? Стехиометрия (расчет?)? Правила растворимости? Продукт растворимости (K sp )? Гравиметрический анализ? Межмолекулярные силы? |
| оценка | Теория столкновений? Распределение кинетической энергии? Закон о ставке? Равновесие? Энтальпия / энергия? |
| редокс | Состояние окисления? Реакция окисления? Редукционная реакция? Полуравнение? Уравнение окислительно-восстановительного потенциала? Электродные потенциалы (ЭДС)? Гальванический элемент? Электролитическая ячейка? Законы электролиза Фарадея? Гальваника (электроосаждение)? Добыча металла из руды? Титрование? |
| редуктор | Organic Chemistry (напишите уравнение? Восстанавливающий агент?)? Электрохимия (степень окисления? Полууравнение? Восстановитель?) |
| соль | Реакция нейтрализации? Бинарная неорганическая номенклатура? Металл + кислота? Карбонат + кислота? Теория Аррениуса? Теория Бронстеда-Лоури? Титрование? |
| мыло | Синтез / структура (омыление)? Очистка (мицеллы? Межмолекулярные силы? Поверхностное натяжение?)? |
| спектроскопия | Тип (масса? Атомная абсорбция? Излучение? Инфракрасное? УФ-видимое? 1 H? 13 C?)? Качественный? Количественный? |
| серная кислота | Стехиометрия? Кислотная сила? Нейтрализация? Реакция обезвоживания? Окисляющая кислота? Контактный процесс (равновесие? Скорость реакции? Катализаторы? Стехиометрия?) |
| поверхность | Адгезия? Сплоченность? Поверхностное натяжение? Смачивание? Капиллярное действие? Межмолекулярные силы? Моющее средство? Мыло? Катализ (скорость реакции? Изменение энтальфии?)? |
| раствор | Расчет стехиометрии (концентрация, разведение)? Коллигативные свойства растворов (понижение точки замерзания, повышение температуры кипения, понижение давления пара, осмотическое давление)? |
| растворимость | Правила растворимости? Осадки? Межмолекулярные силы? Энергия решетки? Стехиометрия (расчет)? Продукт растворимости (K sp )? Равновесие? Скорость реакции? Решение? |
| титрование | Тип (прямое кислотно-основное? Обратное титрование? Окислительно-восстановительный? Комплексометрический? Кондуктометрический?)? Техника? Стехиометрия (расчет)? Нейтрализация? Показатель? Кривая титрования? |
| объем | Твердый? Жидкость? Газ? Решение? Преобразование единиц измерения? Плотность? |
| вода | Равновесие (K w )? Водные растворы (стехиометрия? Уравнения? Реакции?)? Анализ? Очищение? Поверхностное натяжение? Смачивание? Структура / внутримолекулярные силы (связь)? Межмолекулярные силы? |
| доход | Расчет стехиометрии? Равновесие против скорости реакции? |
Под вашей формулировкой проблемы напишите краткую заметку, в которой сообщается, какой научный принцип (выделен) вы будете применять.
Начните заметку такими словами, как «Использовать …» или «Применить ….»
Шаг 5. Извлеките всю информацию, данные, приведенные в вопросе, и запишите их в виде списка под своим примечанием о применимых научных принципах.
При необходимости укажите единицы измерения.
Шаг 6. При необходимости напишите символ для фрагмента данных рядом с ним в списке.
| Некоторые примеры | |||
|---|---|---|---|
| количество | символ | кол-во | условное обозначение |
| число Авогадро | N A | моль | n |
| изменение: макроскопическое | Δ | давление | P |
| изменение: бесконечно малое | δ | коэффициент реакции | Q |
| концентрация (молярность) | c | коэффициент замедления | R f |
| энтальпия | H | время удерживания | R т |
| константа равновесия | К | удельная теплоемкость | C г |
| постоянная Фарадея | F | стандартный потенциал электрода | E или |
| период полураспада | т 1/2 | температура | Т |
| постоянная идеального газа | R | раз | т |
| масса | м | том | В |
| молярная масса | M | ||
ПАУЗА! Подготовьте план игры
После выполнения шага СТОП, описанного выше, у вас должна появиться страница, которая выглядит как на диаграмме ниже:
| Проблема:………… Применить …………….. Данные |
Цель этого шага – подготовить план игры, которому вы можете следовать, чтобы решить проблему.
План может быть набором пронумерованных шагов или блок-схемой, но это должно быть то, чему вы можете следовать последовательно.
Шаг 1: Под списком данных, которые вы уже записали, запишите список шагов , скажем, 10 шагов, оставляя достаточно места между каждым из них:
| Проблема:………… Применить …………….. Данные |
Шаг 1 Шаг 2 Шаг 3 и т. Д. |
Вы всегда можете добавить дополнительные шаги позже, если вам нужно, или проигнорировать те, которые вы не используете.
Шаг 2: Подумайте о том, как ваше неизвестное (то, что вам нужно найти) связано с информацией, полученной вами в соответствии с научными принципами, которые вы выбрали.
От того, как неизвестное связано с известными, указанными в вопросе, будет зависеть, что вы напишете рядом с каждым числом в вашем списке шагов.
- Что вам нужно сделать в первую очередь?
Вам нужно написать химическое уравнение? Сделайте этот шаг 1.
Пример: Шаг 1: напишите сбалансированное химическое уравнение реакции между X и Y с образованием Z - Что вам нужно делать дальше?
Вам нужно найти стехиометрическое (мольное) соотношение? Сделайте этот шаг 2.
Пример: Шаг 2: найдите n (x): n (z), используя сбалансированное химическое уравнение. - Что вам нужно делать дальше?
Вам нужно рассчитать количество молей реагента? Сделайте этот шаг 3.
Пример: Шаг 3: вычислить n (X) - Что вам нужно делать дальше?
Нужно ли использовать мольное соотношение для расчета количества молей образовавшегося продукта? Сделайте этот шаг 4.
Пример: Шаг 4: используйте мольное отношение для расчета n (Z) - Что вам нужно делать дальше?
Вам нужно рассчитать массу продукта? Сделайте этот шаг 5.
Пример: Шаг 5: вычислить m (Z) в граммах - Позволяет ли этот последний шаг решить проблему? Если да, то у вас есть основа для вашего плана!
Шаг 3: Прочтите ваши шаги и решите, нужно ли вам использовать формулу (уравнение) , и запишите это как часть этого шага:
| Шаг 1: | запишите вычисленное химическое уравнение реакции X и Y с образованием Z | .
| Шаг 2: | найдите n (x): n (z), используя вычисленное химическое уравнение |
| Шаг 3: | вычислить n (X) n (X) = c (X) x V (X) |
| Шаг 4: | использовать мольное отношение для расчета n (Z) |
| Шаг 5: | рассчитать m (Z) в граммах м (Z) = n (Z) x M (Z) |
Шаг 4: Прочитайте ваши шаги еще раз и поместите информацию , которую вы получили, под заголовком для соответствующего шага.
| Шаг 1: | запишите вычисленное химическое уравнение реакции X и Y с образованием Z | .
| Шаг 2: | найдите n (x): n (z), используя вычисленное химическое уравнение |
| Шаг 3: | вычислить n (X) п (Х) = с (Х) х V (Х) c (X) = 0,010 моль л -1 В (Х) = 25.0 мл |
| Шаг 4: | использовать мольное соотношение для расчета n (Z) |
| Шаг 5: | рассчитать m (Z) в граммах м (Z) = n (Z) x M (Z) |
Шаг 5: Прочтите свои шаги еще раз. Вам нужно сделать какие-либо предположения , чтобы решить проблему? Если да, запишите их на этом этапе:
| Шаг 1: | запишите вычисленное химическое уравнение реакции X и Y с образованием Z | .
| Шаг 2: | найдите n (x): n (z), используя вычисленное химическое уравнение |
| Шаг 3: | вычислить n (X) п (Х) = с (Х) х V (Х) с (Х) = 0.010 моль л -1 V (X) = 25,0 мл |
| Шаг 4: | использовать мольное соотношение для расчета n (Z) предположим, что реакция завершится |
| Шаг 5: | рассчитать m (Z) в граммах м (Z) = n (Z) x M (Z) |
Шаг 6: Нужна ли вам дополнительная информация , например, нужно ли вам использовать Периодическую таблицу для определения относительных атомных масс? Или вам нужно использовать таблицу данных, чтобы найти физическую / химическую константу? Если да, запишите это в соответствующий шаг:
| Шаг 1: | запишите вычисленное химическое уравнение реакции X и Y с образованием Z | .
| Шаг 2: | найдите n (x): n (z), используя вычисленное химическое уравнение |
| Шаг 3: | вычислить n (X) п (Х) = с (Х) х V (Х) с (Х) = 0.010 моль л -1 V (X) = 25,0 мл |
| Шаг 4: | использовать мольное соотношение для расчета n (Z) предположим, что реакция завершится |
| Шаг 5: | рассчитать m (Z) в граммах используйте таблицу Менделеева для определения относительных атомных масс элементов, составляющих соединение Z рассчитать M (Z), используя относительные атомные массы м (Z) = n (Z) x M (Z) |
Шаг 7: Вам нужно преобразовать единицы в , чтобы все используемые единицы были согласованы? Например, вам нужно преобразовать объем в мл в объем в л? Если да, добавьте это к соответствующему шагу:
| Шаг 1: | запишите вычисленное химическое уравнение реакции X и Y с образованием Z | .
| Шаг 2: | найдите n (x): n (z), используя вычисленное химическое уравнение |
| Шаг 3: | вычислить n (X) п (Х) = с (Х) х V (Х) с (Х) = 0.010 моль л -1 V (X) = 25,0 мл |
| Шаг 4: | использовать мольное соотношение для расчета n (Z) предположим, что реакция завершится |
| Шаг 5: | рассчитать m (Z) в граммах используйте Периодическую таблицу, чтобы найти относительные атомные массы элементов, составляющих соединение Z рассчитать M (Z), используя относительные атомные массы м (Z) = n (Z) x M (Z) |
Шаг 8: Прочтите свои шаги еще раз.Переходит ли шаг 1 логически к шагу 2, затем к шагу 3 и т. Д.?
Если кажется, что все это имеет смысл, то пора реализовать план игры!
GO! с планом игры
Если вы подготовили хороший план игры, описанный выше, все, что вам нужно сделать, это следовать каждому шагу, который вы написали.
Если вы обнаружите, что в вашем плане игры есть пробелы, то есть вещи, которые вам нужны, но не включены, пора сделать паузу! и внимательно прочитайте каждый шаг в своем плане игры, внося при необходимости любые дополнения, ПРЕЖДЕ, чем продолжить реализацию плана игры.
Подставляйте значения в уравнения по мере продвижения, шаг за шагом, и вычисляйте каждое значение по мере его появления.
Когда вы выполните последний шаг в своем плане игры, вы должны искать решение проблемы.
На этом этапе важно сделать ПАУЗУ! и вдумайтесь!
ПАУЗА! Обдумайте правдоподобность своего решения
Прежде чем вы назовете эту проблему «завершенной» и перейдете к следующей проблеме, подумайте о своем решении в связи с заданным вопросом.
Шаг 1: Вы действительно ответили на заданный вопрос?
Прежде чем вы рассмеетесь, я должен вам сказать, что одна из многих маркеров жалоб на экзаменационные работы студентов заключается в том, что студенты НЕ ответили на заданный вопрос … так что давайте продолжим …
Прочтите вопрос еще раз.
Прочтите свое решение.
Дает ли ваше решение ответ на заданный вопрос?
Проверьте это, задав себе следующий вопрос: «Если бы я дал свое решение проблемы кому-то, кто не читал проблему, могли бы они угадать, какой вопрос был задан?»
Если ваше решение действительно ответит на вопрос… отличная работа!
Но если этого не произойдет … ОСТАНОВИТЕСЬ прямо здесь! Вернитесь к началу процесса решения проблемы!
Шаг 2: Разумно ли ваше решение?
Одна из наиболее распространенных ошибок, которые студенты допускают при сдаче экзаменационных работ, заключается в том, что они неправильно или пренебрегают преобразованием единиц измерения, в результате чего получается неправильный ответ на несколько порядков (множитель 10).
Вы можете проверить, кажется ли ваше решение разумным во многих отношениях, вот несколько:
- Получите цифру из парка мячей и посмотрите, как она соотносится с вашим ответом.
То есть округлите все числа, которые вы используете, в большую или меньшую сторону до ближайших 5 или 10, например, 0,89, потому что 1, 22,76 станет 20 и т. Д., А затем используйте эти округленные числа, чтобы произвести быстрые вычисления в уме, просто чтобы проверить что вы не на порядки.
Если вы в конечном итоге получите число мячей, равное 50, а решение, которое вы тщательно рассчитали, было 64,71, вы выглядите хорошо, но если ваше тщательно рассчитанное решение было 0,6471, это означает, что где-то что-то ужасно не так, поэтому пора ОСТАНОВИТЬ и вернитесь к началу процесса решения проблемы. - Должно ли число быть больше или меньше заданного?
Если вопрос касается, например, разбавления раствора, то концентрация раствора после разбавления будет меньше, чем концентрация раствора до его разбавления.
Если ваш ответ дает концентрацию разбавленного раствора выше, чем исходный раствор, ОСТАНОВИТЕСЬ и вернитесь к началу процесса решения проблемы.Если реакция выделяет энергию (экзотермическая), температура реакционной смеси должна повыситься, если ваш ответ показывает падение температуры, вам нужно ОСТАНОВИТЬ и вернуться к началу процесса решения проблемы.
Точно так же, если температура реакционной смеси увеличилась, поскольку реакция выделяла тепло, но ваш ответ дает положительное (а не отрицательное) значение для изменения энтальпии, вам нужно ОСТАНОВИТЬ и вернуться к началу решения проблемы. процесс.
- Вернитесь назад, используя свой ответ, чтобы вычислить одну из известных величин, указанных в вопросе (или используйте все известные величины и ваше значение для неизвестного, чтобы вычислить значение константы в уравнении) и т. Д.
Шаг 3: Убедитесь, что все данные, которые вы использовали, верны.
Да, это еще одна распространенная ошибка экзаменационных работ.
Проверьте, например, формулу ионов; сульфат – SO 4 2-, сульфит – SO 3 2- , сульфид – S 2-
Убедитесь, что химические уравнения правильно сбалансированы.
Убедитесь, что вы использовали правильное стехиометрическое (мольное) соотношение
Убедитесь, что вы использовали правильную формулу (уравнение) при каждом расчете.
Если вы изменили формулу, убедитесь, что вы сделали это правильно, например, если c = n / V, то V = n / c
Убедитесь, что вы использовали правильные единицы измерения и что все используемые единицы согласованы.
Убедитесь, что у вас есть соответствующее количество значащих цифр, например, если вам дали pH = 1,32, концентрация ионов водорода НЕ будет 0,047863!
Шаг 4: Проверьте правописание!
Есть некоторые орфографические ошибки, которые, вероятно, не будут волновать экзаменаторов, например, там / их / они, где / носят и т. Д.
Но некоторые орфографические ошибки, например, алкан / алкен / алкин (огромная разница в реакционной способности, во-первых!), Гарантированно потеряют ваш след.
Шаг 5: Убедитесь, что научные принципы, которые вы применили, действительны для этой проблемы.
Это также означает проверку любых предположений, которые вы могли сделать.
Если вы проверили все вышеперечисленное, то пора ….
СТОП!
Если после выполнения шага «ПАУЗА для размышления», описанного выше, все выглядело хорошо, значит, проблема решена.
Запишите свое решение проблемы.
Прекратите работу над этой проблемой.
Если, однако, есть сомнения в ценности или качестве вашего ответа после прохождения вышеуказанных проверок, вам следует ОСТАНОВИТЬ здесь и начать процесс решения проблемы снова, с самого начала, с шага 1.
Сноски:
(1) Этот подход основан на подходе Пойи к решению задач в математике, который я всегда называю «оружием деконструкции математики», но это хороший общий подход к решению задач.
Polya, G. Как решить ; 2 д изд .; Издательство Принстонского университета: Принстон, Нью-Джерси, 1985.
Молекулярная формула и пример простейшей формулы Задача
Молекулярная формула соединения перечисляет все элементы и количество атомов каждого элемента, которые фактически составляют соединение. Самая простая формула аналогична, когда все элементы перечислены, но числа соответствуют соотношениям между элементами.Этот рабочий пример задачи демонстрирует, как использовать простейшую формулу соединения и его молекулярную массу, чтобы найти молекулярную формулу.
Молекулярная формула из задачи простейшей формулы
Самая простая формула витамина C: C 3 H 4 O 3 . Экспериментальные данные показывают, что молекулярная масса витамина С составляет около 180. Какова молекулярная формула витамина С?
Решение
Сначала вычислите сумму атомных масс для C 3 H 4 O 3 .Найдите атомные массы для элементов из Периодической таблицы. Найдено, что атомные массы равны:
H составляет 1,01
C составляет 12,01
O составляет 16,00
Подставляя эти числа, сумма атомных масс для C 3 H 4 O 3 составляет:
3 ( 12,0) + 4 (1,0) + 3 (16,0) = 88,0
Это означает, что формульная масса витамина С равна 88,0. Сравните формулу массы (88,0) с приблизительной молекулярной массой (180). Молекулярная масса в два раза превышает формульную массу (180/88 = 2,0), поэтому простейшую формулу нужно умножить на 2, чтобы получить молекулярную формулу:
молекулярная формула витамин C = 2 x C 3 H 4 O 3 = C 6 H 8 O 6
Ответ
C 6 H 8 O 6
Советы по устранению рабочих проблем
Приблизительной молекулярной массы обычно достаточно для определения формулы массы, но расчеты, как правило, не работают «даже», как в этом примере.Вы ищете ближайшее целое число, которое нужно умножить на формулу массы, чтобы получить молекулярную массу.
Если вы видите, что соотношение между формульной массой и молекулярной массой составляет 2,5, возможно, вы смотрите на соотношение 2 или 3, но более вероятно, что вам нужно умножить формулу массы на 5. Часто в процессе проб и ошибок получение правильного ответа. Хорошая идея – проверить свой ответ, выполнив математические вычисления (иногда более чем одним способом), чтобы увидеть, какое значение является наиболее близким.
Если вы используете экспериментальные данные, в расчете молекулярной массы будет некоторая ошибка.Обычно соединения, назначаемые в лабораторных условиях, будут иметь отношения 2 или 3, а не большие числа, такие как 5, 6, 8 или 10 (хотя эти значения также возможны, особенно в лаборатории колледжа или в реальных условиях).
Стоит отметить, что в то время как химические задачи решаются с использованием молекулярных и простейших формул, реальные соединения не всегда подчиняются правилам. Атомы могут иметь общие электроны, например, в соотношении 1,5. Однако при выполнении домашних заданий по химии используйте целые числа!
Определение молекулярной формулы по простейшей формуле
Формульная задача
Самая простая формула бутана – это C2H5, а его молекулярная масса составляет около 60.Какова молекулярная формула бутана?
Решение
Сначала вычислите сумму атомных масс для C2H5. Найдите атомные массы для элементов из Периодической таблицы. Атомные массы оказываются равными:
H составляет 1,01
C составляет 12,01
Подставляя эти числа, сумма атомных масс для C2H5 составляет:
2 (12,0) + 5 (1,0) = 29,0
Это означает, что формула массы бутана 29,0. Сравните формулу массы (29,0) с приблизительной молекулярной массой (60). Молекулярная масса практически вдвое превышает формульную массу (60/29 = 2.1), поэтому простейшую формулу нужно умножить на 2, чтобы получить молекулярную формулу:
молекулярная формула бутана = 2 x C2H5 = C4h20
Ответ
Молекулярная формула бутана – C4h20.
ChemTeam: Уравновешивание химических уравнений: проблемы № 1
ChemTeam: Уравновешивание химических уравнений: проблемы №1–10Уравновешивание химических уравнений
Задачи № 1-10
Проблема № 1: FeCl 3 + MgO —> Fe 2 O 3 + MgCl 2
Решение:
1) Сбалансируйте Cl (обратите внимание, что 2 x 3 = 3 x 2):
2FeCl 3 + MgO —> Fe 2 O 3 + 3MgCl 2На этом этапе Fe также уравновешивается.
2) Выберите либо O, либо Mg для следующего баланса:
2FeCl 3 + 3MgO —> Fe 2 O 3 + 3MgCl 2Другой элемент (Mg или O, в зависимости от того, какой вы выбрали) также балансируется на этом этапе.
Проблема № 2: Li + H 3 PO 4 —> H 2 + Li 3 PO 4
Решение:
1) Уравновесить Ли:
3Li + H 3 PO 4 —> H 2 + Li 3 PO 4
2) Теперь посмотрим на атомы водорода.Видите, как H появляется только группами по 3 человека слева и только группами по 2 человека справа? Сделай это:
3Li + 2H 3 PO 4 —> 3H 2 + Li 3 PO 4Помните, что 2 x 3 = 6 и 3 x 2 = 6. При балансировке появляется много проблемы (если вы еще этого не поняли!).
3) Сбалансируйте фосфаты как группу:
3Li + 2H 3 PO 4 —> 3H 2 + 2Li 3 PO 4
4) Ой, литий испортился, поэтому исправляем:
6Li + 2H 3 PO 4 —> 3H 2 + 2Li 3 PO 4
Проблема № 3: ZnS + O 2 —> ZnO + SO 2
1) Сбалансируйте кислород с помощью дробного коэффициента (Zn и S уже сбалансированы):
ZnS + (3/2) O 2 —> ZnO + SO 2
2) Умножьте, чтобы очистить дробь:
2ZnS + 3O 2 —> 2ZnO + 2SO 2
Проблема № 4: FeS 2 + Cl 2 —> FeCl 3 + S 2 Cl 2
Решение:
1) Видите, как Fe и S уже сбалансированы? Итак, посмотрите только на Cl.С правой стороны их всего 5, поэтому мы помещаем 5 слева:
FeS 2 + (5/2) Cl 2 —> FeCl 3 + S 2 Cl 2
2) Очистите дробь, умножив ее на 2:
2FeS 2 + 5Cl 2 —> 2FeCl 3 + 2S 2 Cl 2
Проблема № 5: Fe + HC 2 H 3 O 2 —> Fe (C 2 H 3 O 2 ) 3 + H 2
Решение:
1) Уравновесить ацетат:
Fe + 3HC 2 H 3 O 2 —> Fe (C 2 H 3 O 2 ) 3 + H 2
2) Уравновесить водород:
Fe + 3HC 2 H 3 O 2 —> Fe (C 2 H 3 O 2 ) 3 + (3/2) H 2
3) Очистить дробь:
2Fe + 6HC 2 H 3 O 2 —> 2Fe (C 2 H 3 O 2 ) 3 + 3H 2
Проблема № 6: H 2 (г) + V 2 O 5 (с) —> V 2 O 3 (с) + H 2 O (ℓ )
Решение:
1) Сбалансируйте кислород:
H 2 (г) + V 2 O 5 (с) —> V 2 O 3 (с) + 2H 2 O (ℓ)
2) Уравновесить водород:
2H 2 (г) + V 2 O 5 (с) —> V 2 O 3 (с) + 2H 2 O (ℓ)
Обратите внимание, что ванадий не рассматривался, потому что он все время оставался в равновесии.Обратите внимание, как водород вначале был сбалансированным, но баланс кислорода повлиял на водород, который мы рассмотрели на втором этапе.
Проблема № 7: HCl (водный) + MnO 2 (с) —> MnCl 2 (водный) + Cl 2 (г) + H 2 O (ℓ)
Решение:
1) Сбалансируйте хлор:
4HCl (водн.) + MnO 2 (с) —> MnCl 2 (водн.) + Cl 2 (г) + H 2 O ()
2) Уравновесить водород:
4HCl (водн.) + MnO 2 (т) —> MnCl 2 (водн.) + Cl 2 (г) + 2H 2 O ()
На этом последнем этапе кислород также уравновешивается, а Mn никогда не упоминался, потому что он изначально был сбалансированным и так и остался.
Проблема № 8: Fe 2 O 3 (s) + C (s) —> Fe (s) + CO 2 (g)
Решение:
1) Уравновесить утюг:
Fe 2 O 3 (т) + C (т) —> 2Fe (т) + CO 2 (г)
2) Сбалансируйте кислород:
Fe 2 O 3 (с) + C (с) —> 2Fe (с) + 3 ⁄ 2 CO 2 (г)
3) Сбалансируйте углерод:
Fe 2 O 3 (s) + 3 ⁄ 2 C (s) —> 2Fe (s) + 3 ⁄ 2 CO 2 (g)
Обратите внимание на 3 ⁄ 2 перед буквой C и CO 2 .Что ты говоришь? У вас не может быть 3 ⁄ 2 атома? Ах, погоди.
4) Умножьте на два, чтобы получить окончательный ответ:
2Fe 2 O 3 (т) + 3C (т) —> 4Fe (т) + 3CO 2 (г)
Комментарий: один из способов взглянуть на это состоит в том, что использование 3 ⁄ 2 было просто математическим уловкой для уравновешивания уравнения. В окончательном ответе отражена химическая реальность атомов, реагирующих в соотношении малых целых чисел.
Еще один способ взглянуть на коэффициенты – в молях. Мы определенно можем иметь 3 ⁄ 2 моля атомов углерода или 3 ⁄ 2 моля молекул углекислого газа. Последний шаг к целочисленным коэффициентам – это просто соглашение. Химическое уравнение сбалансировано в химически правильном смысле с дробными коэффициентами.
Проблема № 9: C 5 H 11 NH 2 + O 2 —> CO 2 + H 2 O + NO 2
Решение:
1) Сначала сбалансируйте водород:
2C 5 H 11 NH 2 + O 2 —> CO 2 + 13H 2 O + NO 2
Обратите внимание, что я использовал 2 перед C 5 H 11 NH 2 .Это потому, что я знал, что в C 5 H 11 NH 2 содержится 13 атомов водорода, и это означало, что 13 ⁄ 2 перед водой. Я знал, что в конечном итоге мне придется очистить 13 ⁄ 2 , поэтому я решил сделать это с самого начала.
2) Сбалансируйте азот и углерод:
2C 5 H 11 NH 2 + O 2 —> 10CO 2 + 13H 2 O + 2NO 2
3) Кислород:
2C 5 H 11 NH 2 + 37 ⁄ 2 O 2 —> 10CO 2 + 13H 2 O + 2NO 2
4) Умножить на 2 для:
4, 37 —> 20, 26, 4
Проблема № 10: CO 2 + S 8 —> CS 2 + SO 2
Решение:
1) Единственное, что уже не сбалансировано, это S:
CO 2 + 3 ⁄ 8 S 8 —> CS 2 + SO 2В большинстве случаев дробь, используемая для баланса, представляет собой что-то с двойкой в знаменателе: Например, 1 ⁄ 2 или 5 ⁄ 2 или 13 ⁄ 2 .Не так часто можно увидеть 3 ⁄ 8 . Довольно сложно!
2) Умножить на 8:
8CO 2 + 3S 8 —> 8CS 2 + 8SO 2
Проблема с бонусом: P 4 + O 2 —> P 2 O 3
Решение:
1) Предположим, вы решили сначала уравновесить кислород:
P 4 + 3O 2 —> 2P 2 O 3Это зависит от того, что кислород слева поступает по два, а кислород справа по три.Итак, вы используете тройку и двойку, чтобы получить по шесть атомов кислорода с каждой стороны. Наименьшее общее кратное, детка !!
2) Предположим, вы сначала уравновешиваете фосфор (целым числом):
P 4 + O 2 —> 2P 2 O 3Затем кислород уравновешивается:
-пол. 4 + 3O 2 —> 2-пол. 2 O 3
3) Предположим, вы сначала уравновешиваете фосфор (с долей):
1 ⁄ 2 P 4 + O 2 —> P 2 O 3Давайте также уравновесим кислород фракцией:
1 ⁄ 2 P 4 + 3 ⁄ 2 O 2 —> P 2 O 3
Наконец, умножаем на два:
-пол. 4 + 3O 2 —> 2-пол. 2 O 3
Уравнения балансировки – это весело !!
Пошаговые решения для химии: химические реакции – блог Wolfram
Если вы изучаете химию или изучаете дисциплину, требующую обязательных курсов по химии, то вы знаете, насколько дорогими могут быть необходимые учебники.Чтобы бороться с этим, сообщество химического образования разработало открытые образовательные ресурсы, чтобы предоставить бесплатные учебники химии. Однако, хотя бесплатные учебники хранят деньги в вашем кошельке, в них нет руководств по решению всех домашних задач.
К счастью, функция «Пошаговые решения» в Wolfram | Alpha вас поддержала! Независимо от того, учитесь ли вы удаленно или сотрудничаете с помощью видеоконференцсвязи, Wolfram | Alpha поможет вам изучить и применить фреймворки для решения химических задач.Пошаговые решения содержат пошаговые руководства по решениям, которые можно просматривать по очереди или все сразу. Руководства не только оттачивают эффективное решение проблем, но и способствуют более глубокому изучению концепций, которые все еще могут быть неясными.
В течение следующих нескольких недель мы будем изучать некоторые популярные темы, с которыми учащиеся средних школ, старшеклассников и колледжей сталкиваются на курсах химии и выпускных экзаменах: химические реакции, структура и связывание, химические растворы и, наконец, квантовая химия.Прочтите, например, о проблемах химических реакций и их пошаговых решениях!
Уравновешивание химических уравнений
Фундаментальный аспект химии – уравновешивание химических уравнений. Если химические уравнения – это язык, на котором выражаются химические процессы, то уравновешивающие химические уравнения – это соответствующая грамматика. Пошаговое решение проведет вас через надежный алгебраический подход к определению стехиометрических коэффициентов.
Пример задачи
Напишите сбалансированное уравнение реакции меди с азотной кислотой с образованием нитрата меди, оксида азота и воды.
Пошаговое решение
Для этого класса задач просто введите «баланс медь + азотная кислота -> нитрат меди + диоксид азота + вода».
Масса
После уравновешивания соответствующих химических уравнений следующим шагом в планировании лабораторного эксперимента является вычисление количества каждого реагента, которое необходимо отмерить. Для этого нужна молярная масса каждого реагента. Доступны пошаговые решения для молекулярной массы и относительной молекулярной массы в дополнение к молярной массе.Во всех случаях общая структура для решения этих типов проблем предоставляется на этапе «Планирование». Предоставляется подробная информация о том, какую формулу использовать и как собрать необходимую информацию.
Пример задачи
Рассчитайте молярную массу сульфата серебра Ag 2 SO 4 .
Пошаговое решение
В этом случае просто введите «молярная масса сульфата серебра».
Массовый состав
Один из способов анализа отдельных химических веществ – вычисление и сравнение массовых и атомных процентов.Пошаговое решение обеспечивает общую основу для решения этого класса проблем на этапе «Планирование». Приведены подробные сведения о соответствующих уравнениях, а также о том, как вычислить необходимые промежуточные значения. Способы, которыми вы можете проверить свою работу во время расчетов, также доступны с помощью кнопок «Показать промежуточные шаги».
Пример задачи
Антигемофильный фактор – коагулянт с формулой C 11794 H 18314 N 3220 O 355 S 83 .Каков его процентный состав?
Пошаговое решение
Для ответа просто введите «элементный состав антигемофильного фактора».
Химическая конверсия
Химические превращения возникают почти в каждом домашнем задании по химии или в исследовательской задаче. Таким образом, доступны пошаговые решения для преобразования между молями, массой, объемом, молекулами и атомами. Предоставляется преобразование единиц измерения и подробный анализ размеров.
Пример задачи
Сколько атомов в пяти миллилитрах единицы.5 мМ раствор гидроксида магния?
Пошаговое решение
Чтобы решить эту проблему, просто введите «преобразовать 5 мл 1,5 мМ гидроксида магния в атомы».
Стехиометрия
После проведения химической реакции часто хочется узнать, как протекает реакция, вычисляя выходы реакции. Доступны пошаговые решения для расчета количества необходимых реагентов и теоретического выхода в дополнение к процентному выходу. Подробно объясняется использование стехиометрических факторов для получения желаемых значений.
Пример задачи
При взаимодействии 1,274 грамма сульфата меди с избытком металлического цинка было получено 0,392 грамма металлической меди в соответствии со следующим уравнением: CuSO 4 (водн.) + Zn (s) & xrarr; Cu (s) + ZnSO 4 (водн.). Какой процент доходности?
Пошаговое решение
Чтобы найти процентный выход, просто добавьте значения массы к соответствующим химическим соединениям и запросите стехиометрию: «1,274 г CuSO4 + Zn -> 0,392 г Cu + ZnSO4, стехиометрия».
Задачи-вызовы
Проверьте свои навыки решения проблем с химическими реакциями, используя описанные инструменты Wolfram | Alpha для решения этих словесных задач. Ответы будут предоставлены в следующем сообщении блога этой серии.
- Вычислите молекулярную массу ацетаминофена. Является ли элемент с наибольшим числом атомов элементом с наибольшим массовым процентом?
- Каков предельный реагент и теоретический выход при 24,8 граммах белого фосфора и 0.200 молей кислорода реагируют с образованием 10,0 граммов пятиокиси фосфора?
И еще больше химии в будущем
Готовитесь ли вы к предстоящим выпускным экзаменам, решаете ли вы домашнее задание или просто хотите освежиться, химические реакции – одна из многих тем по химии, охватываемых базой знаний Wolfram | Alpha. На следующей неделе мы рассмотрим пошаговые инструкции для химических растворов, затем структуру и связывание, а затем квантовую химию. Если у вас есть предложения по другому пошаговому содержанию (по химии или другим предметам), сообщите нам об этом! Вы можете связаться с нами, оставив комментарий ниже или отправив отзыв внизу любой страницы запроса Wolfram | Alpha.
Балансировка химических уравнений: практика и обзор
Внимание: Этот пост был написан несколько лет назад и может не отражать последние изменения в программе AP®. Мы постепенно обновляем эти сообщения и удалим этот отказ от ответственности после обновления этого сообщения. Спасибо за ваше терпение!
Из всех навыков, которые нужно знать в области химии, уравновешивание химических уравнений, пожалуй, является самым важным, которым нужно овладеть.Многие области химии зависят от этого жизненно важного навыка, включая стехиометрию, анализ реакций и лабораторную работу. Это подробное руководство покажет вам, как уравновесить даже самые сложные реакции, и проведет вас через серию примеров, от простых до сложных.
Конечная цель уравновешивания химических реакций – уравнять обе стороны реакции, реагенты и продукты, по количеству атомов на элемент. Это проистекает из универсального закона сохранения массы, который гласит, что материю нельзя ни создать, ни разрушить.Итак, если мы начнем с десяти атомов кислорода перед реакцией, нам нужно закончить с десятью атомами кислорода после реакции. Это означает, что химические реакции не меняют реальных строительных блоков материи; скорее они просто меняют расположение блоков. Легкий способ понять это – изобразить дом из блоков. Мы можем разбить дом на части и построить самолет, но цвет и форма блоков не меняются.
Но как нам сбалансировать эти уравнения? Мы знаем, что количество атомов каждого элемента должно быть одинаковым с обеих сторон уравнения, поэтому для этого достаточно найти правильные коэффициенты (числа перед каждой молекулой).Лучше всего начать с атома, который наименьшее количество раз появляется на одной стороне, и сначала уравновесить его. Затем перейдите к атому, который появляется вторым наименьшим числом раз, и так далее. В конце не забудьте снова подсчитать количество атомов каждого элемента на каждой стороне, на всякий случай.
Проиллюстрируем это на примере:
P 4 O 10 + H 2 O → H 3 PO 4
Во-первых, давайте посмотрим на элемент, который встречается реже всего.Обратите внимание, что кислород встречается дважды с левой стороны, так что это не лучший элемент для начала. Мы могли бы начать с фосфора или водорода, так что давайте начнем с фосфора. С левой стороны четыре атома фосфора, а с правой – только один. Итак, мы можем поставить коэффициент 4 на молекулу, которая имеет фосфор справа, чтобы уравновесить их.
P 4 O 10 + H 2 O → 4 H 3 PO 4
Теперь мы можем проверить водород.Мы по-прежнему хотим избежать уравновешивания кислорода, потому что он присутствует более чем в одной молекуле с левой стороны. Проще всего начать с молекул, которые появляются только один раз с каждой стороны. Итак, есть две молекулы водорода с левой стороны и двенадцать с правой стороны (обратите внимание, что их по три на молекулу H 3 PO 4 , а у нас четыре молекулы). Итак, чтобы уравновесить их, мы должны поставить шестерку перед H 2 O слева.
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
На этом этапе мы можем проверить кислород, чтобы увидеть, сбалансированы ли они.Слева у нас есть десять атомов кислорода из P 4 O 10 и шесть из H 2 O, всего 16. Справа у нас также 16 (четыре на молекулу, с четырьмя молекулами). ). Итак, кислород уже сбалансирован. Это дает нам окончательное сбалансированное уравнение
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
Практические задачи по уравновешиванию химических уравненийПопробуйте уравновесить эти десять уравнений самостоятельно, а затем проверьте ответы ниже.Они различаются по уровню сложности, поэтому не расстраивайтесь, если некоторые из них покажутся вам слишком сложными. Просто не забудьте начать с элемента, который появляется меньше всего, и продолжайте оттуда. Лучше всего подходить к этим проблемам медленно и систематически. Глядя на все сразу, вы легко можете ошеломить. Удачи!
- CO 2 + H 2 O → C 6 H 12 O 6 + O 2
- SiCl 4 + H 2 O → H 4 SiO 4 + HCl
- Al + HCl → AlCl 3 + H 2
- Na 2 CO 3 + HCl → NaCl + H 2 O + CO 2
- C 7 H 6 O 2 + O 2 → CO 2 + H 2 O
- Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe (OH) 3
- Ca (PO 4 ) 2 + SiO 2 → P 4 O 10 + CaSiO 3
- KClO 3 → KClO 4 + KCl
- Al 2 (SO 4 ) 3 + Ca (OH) 2 → Al (OH) 3 + CaSO 4
- H 2 SO 4 + HI → H 2 S + I 2 + H 2 O
Комплексные решения:
1.CO 2 + H 2 O → C 6 H 12 O 6 + O 2Первый шаг – сосредоточиться на элементах, которые появляются только один раз с каждой стороны уравнения. Здесь и углерод, и водород соответствуют этому требованию. Итак, начнем с углерода. С левой стороны только один атом углерода, а с правой – шесть. Итак, мы добавляем коэффициент шесть к углеродсодержащей молекуле слева.
6CO 2 + H 2 O → C 6 H 12 O 6 + O 2
Теперь давайте посмотрим на водород.Слева расположены два атома водорода, а справа – двенадцать. Итак, мы добавим коэффициент шесть к водородсодержащей молекуле слева.
6CO 2 + 6H 2 O → C 6 H 12 O 6 + O 2
А теперь пора проверить кислород. Слева всего 18 молекул кислорода (6 × 2 + 6 × 1). Справа восемь молекул кислорода. Теперь у нас есть два варианта выровнять правую часть: мы можем либо умножить C 6 H 12 O 6 или O 2 на коэффициент.Однако, если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к О 2 справа. Наш окончательный ответ:
6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2
2.SiCl 4 + H 2 O → H 4 SiO 4 + HClЕдинственный элемент, который встречается здесь более одного раза в одной и той же части уравнения, – это водород, поэтому мы можем начать с любого другого элемента. Начнем с кремния. Обратите внимание, что с обеих сторон есть только один атом кремния, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Теперь давайте посмотрим на хлор. Слева расположены четыре атома хлора, а справа – только один. Итак, мы добавим коэффициент четыре справа.
SiCl 4 + H 2 O → H 4 SiO 4 + 4HCl
Теперь давайте посмотрим на кислород. Помните, что сначала мы хотим проанализировать все элементы, которые встречаются только один раз на одной стороне уравнения. Слева всего один атом кислорода, а справа четыре. Итак, мы добавим коэффициент четыре в левую часть уравнения.
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Мы почти закончили! Теперь нам просто нужно проверить количество атомов водорода с каждой стороны.Слева их восемь, а справа тоже восемь, так что мы закончили. Наш окончательный ответ –
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Как всегда, не забудьте дважды проверить, что количество атомов каждого элемента уравновешивается с каждой стороны, прежде чем продолжить.
3. Al + HCl → AlCl 3 + H 2Эта проблема немного сложная, поэтому будьте осторожны. Когда по одну сторону уравнения находится один атом, проще всего начать с этого элемента.Итак, начнем с подсчета атомов алюминия с обеих сторон. Один слева и один справа, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Теперь давайте посмотрим на водород. Еще один слева, но два справа. Итак, мы добавим слева коэффициент два.
Al + 2HCl → AlCl 3 + H 2
Далее мы рассмотрим хлор. Теперь их два слева, а три справа. Это не так просто, как просто прибавить коэффициент к одной стороне.Нам нужно, чтобы количество атомов хлора было одинаковым с обеих сторон, поэтому нам нужно, чтобы два и три были равны. Мы можем добиться этого, найдя наименьшее общее кратное. В этом случае мы можем умножить два на три и три на два, чтобы получить наименьшее общее кратное шести. Итак, умножим 2HCl на три, а AlCl 3 на два:
Al + 6HCl → 2AlCl 3 + H 2
Мы рассмотрели все элементы, поэтому легко сказать, что все готово. Однако всегда проверяйте дважды.В этом случае, поскольку мы добавили коэффициент к молекуле, содержащей алюминий с правой стороны, алюминий больше не сбалансирован. Один слева, а два справа. Итак, добавим еще один коэффициент.
2Al + 6HCl → 2AlCl 3 + H 2
Мы еще не закончили. Просматривая уравнение в последний раз, мы видим, что водород также не сбалансирован. Их шесть слева, а два справа. Итак, сделав последнюю корректировку, мы получили окончательный ответ:
.2Al + 6HCl → 2AlCl 3 + 3H 2
4.Na 2 CO 3 + HCl → NaCl + H 2 O + CO 2Надеюсь, к этому моменту балансировка уравнений станет проще, и вы научитесь этому. Глядя на натрий, мы видим, что он встречается дважды слева и один раз справа. Итак, мы можем добавить наш первый коэффициент к NaCl справа.
Na 2 CO 3 + HCl → 2NaCl + H 2 O + CO 2
Теперь давайте посмотрим на углерод. Один слева, а другой справа, поэтому нет никаких коэффициентов для добавления.Поскольку кислород присутствует более чем в одном месте слева, мы оставим его напоследок. Вместо этого посмотрите на водород. Один слева и два справа, поэтому мы добавим коэффициент слева.
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
Затем, глядя на хлор, мы видим, что он уже сбалансирован по два с каждой стороны. Теперь мы можем вернуться к исследованию кислорода. Их три слева и три справа, поэтому наш окончательный ответ –
.Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
5.C 7 H 6 O 2 + O 2 → CO 2 + H 2 OМы можем начать балансировать это уравнение, взглянув на углерод или водород. Глядя на углерод, мы видим, что семь атомов слева и только один справа. Итак, мы можем добавить коэффициент семь справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + H 2 O
Тогда для водорода шесть атомов слева и два справа.Итак, мы добавим коэффициент три справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + 3H 2 O
Теперь с кислородом все станет немного сложнее. Кислород присутствует в каждой молекуле в уравнении, поэтому мы должны быть очень осторожны при его балансировке. Слева четыре атома кислорода, справа 17. Нет очевидного способа уравновесить эти числа, поэтому мы должны использовать небольшой трюк: дроби. Теперь, когда мы пишем наш окончательный ответ, мы не можем включать дроби, так как это неправильная форма, но иногда помогает использовать их для решения проблемы.Кроме того, старайтесь избегать чрезмерных манипуляций с органическими молекулами. Вы можете легко идентифицировать органические молекулы, также известные как молекулы CHO, потому что они состоят только из углерода, водорода и кислорода. Мы не любим работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы имеют тенденцию быть более стабильными, чем молекулы меньшего размера, и с меньшей вероятностью вступят в реакцию в больших количествах.
Итак, чтобы уравновесить четыре и семнадцать, мы можем умножить 0 2 слева на 7.5. Это даст нам
C 7 H 6 O 2 + 7,5O 2 → 7CO 2 + 3H 2 O
Помните, что дроби (и десятичные дроби) не допускаются в формальных сбалансированных уравнениях, поэтому умножьте все на два, чтобы получить целые числа. Наш окончательный ответ –
.2C 7 H 6 O 2 + 15O 2 → 14CO 2 + 6H 2 O
6. Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe (OH) 3-Начнем с балансировки утюга с обеих сторон.У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + 2Fe (OH) 3-
Затем мы можем взглянуть на серу. Слева их три, а справа только один. Итак, мы добавим коэффициент три в правую часть.
Fe 2 (SO 4 ) 3 + KOH → 3K 2 SO 4 + 2Fe (OH) 3-
Мы почти закончили.Осталось только сбалансировать калий. Один атом слева и шесть справа, поэтому мы можем уравновесить их, добавив коэффициент шесть. Итак, наш окончательный ответ –
.Fe 2 (SO 4 ) 3 + 6KOH → 3K 2 SO 4 + 2Fe (OH) 3-
7. Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + CaSiO 3Глядя на кальций, мы видим, что их три слева и один справа, поэтому мы можем добавить коэффициент три справа, чтобы уравновесить их.
Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + 3CaSiO 3
Затем, что касается фосфора, мы видим, что их два слева и четыре справа. Чтобы уравновесить их, добавьте слева коэффициент два.
2Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + 3CaSiO 3
Обратите внимание, что таким образом мы изменили количество атомов кальция слева.Каждый раз, когда вы добавляете коэффициент, дважды проверяйте, влияет ли шаг на какие-либо элементы, которые вы уже сбалансировали. В этом случае количество атомов кальция слева увеличилось до шести, а справа осталось три, поэтому мы можем изменить коэффициент справа, чтобы отразить это изменение.
2Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + 6CaSiO 3
Поскольку кислород присутствует в каждой молекуле в уравнении, мы его пока пропустим.Сосредоточившись на кремнии, мы видим, что один слева, а шесть справа, поэтому мы можем добавить коэффициент слева.
2Ca 3 (PO 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3
Теперь проверим количество атомов кислорода с каждой стороны. Слева есть 28 атомов, а справа также 28. Итак, после проверки того, что все остальные атомы одинаковы с обеих сторон, мы получаем окончательный ответ
2Ca 3 (PO 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3
8.KClO 3 → KClO 4 + KClЭта проблема особенно сложна, потому что каждый атом, кроме кислорода, присутствует в каждой молекуле в уравнении. Итак, поскольку кислород появляется наименьшее количество раз, мы начнем с него. Их три слева и четыре справа. Чтобы уравновесить их, мы находим наименьшее общее кратное; в данном случае 12. Добавляя коэффициент четыре слева и три справа, мы можем сбалансировать содержание кислорода.
4KClO 3 → 3KClO 4 + KCl
Теперь мы можем проверить калий и хлор.Четыре молекулы калия слева и четыре справа, поэтому они уравновешены. Хлор также сбалансирован, по четыре с каждой стороны, поэтому мы закончили с окончательным ответом
.4KClO 3 → 3KClO 4 + KCl
9. Al 2 (SO 4 ) 3 + Ca (OH) 2 → Al (OH) 3 + CaSO 4Здесь мы можем начать с балансировки атомов алюминия с обеих сторон. Слева есть две молекулы, а справа только одна, поэтому мы добавим коэффициент два справа.
Al 2 (SO 4 ) 3 + Ca (OH) 2 → 2Al (OH) 3 + CaSO 4
Теперь мы можем проверить серу. Их три слева и только один справа, поэтому добавление коэффициента три уравновесит их.
Al 2 (SO 4 ) 3 + Ca (OH) 2 → 2Al (OH) 3 + 3CaSO 4
Переходя к кальцию, слева только один, а справа три, поэтому мы должны добавить коэффициент три.
Al 2 (SO 4 ) 3 + 3Ca (OH) 2 → 2Al (OH) 3 + 3CaSO 4
Дважды проверив все атомы, мы видим, что все элементы сбалансированы, поэтому наше окончательное уравнение –
.Al 2 (SO 4 ) 3 + 3Ca (OH) 2 → 2Al (OH) 3 + 3CaSO 4
10. H 2 SO 4 + HI → H 2 S + I 2 + H 2 OПоскольку водород встречается более одного раза слева, мы временно пропустим его и перейдем к сере.Один атом слева и один справа, так что балансировать пока нечего. Если посмотреть на кислород, их четыре слева и один справа, поэтому мы можем добавить коэффициент четыре, чтобы уравновесить их.
H 2 SO 4 + HI → H 2 S + I 2 + 4H 2 O
Есть только один йод слева и два справа, поэтому простое изменение коэффициента может уравновесить их.
H 2 SO 4 + 2HI → H 2 S + I 2 + 4H 2 O
Теперь мы можем взглянуть на самый сложный элемент: водород.Слева их четыре, а справа десять. Итак, мы знаем, что нам нужно изменить коэффициент либо H 2 SO 4 , либо HI. Мы хотим изменить что-то, что впоследствии потребует наименьшего количества настроек, поэтому мы изменим коэффициент HI. Чтобы в левой части было десять атомов водорода, нам нужно, чтобы в HI было восемь атомов водорода, поскольку в H 2 SO 4 уже есть два. Итак, изменим коэффициент с 2 на 8.
H 2 SO 4 + 8HI → H 2 S + I 2 + 4H 2 O
Однако это также изменяет баланс йода.Слева их восемь, а справа только двое. Чтобы исправить это, мы добавим справа коэффициент 4. Убедившись, что все остальное тоже уравновешено, мы получаем окончательный ответ
.H 2 SO 4 + 8HI → H 2 S + 4I 2 + 4H 2 O
Как и в случае с большинством других навыков, практика приводит к совершенству при изучении того, как уравновесить химические уравнения. Продолжайте усердно работать и постарайтесь решить как можно больше задач, чтобы отточить свои навыки балансировки.
Есть ли у вас какие-нибудь советы или рекомендации, которые помогут сбалансировать химические уравнения? Дайте нам знать об этом в комментариях!
Давайте реализуем все на практике. Ответьте на этот вопрос общей практики химии: Ищете дополнительную практику по общей химии?Вы можете найти тысячи практических вопросов на Albert.io. Albert.io позволяет настроить процесс обучения так, чтобы он ориентировался на практику там, где вам больше всего нужна помощь.

 4 (л/моль)
4 (л/моль)
 у.)
у.):format(png):watermark(177f2936fcd4422.s.siteapi.org/watermark/hghzznn66bk04sggg0s8w0484gw0gs,-1,-1,0,15,none)/177f2936fcd4422.s.siteapi.org/img/p9ub82aokw040088skskkkosssw408)