Составление химических формул простым и доступным языком
Одной из самых главных задач в химии является правильное составление химических формул. Химическая формула — это письменное представление состава химического вещества с помощью латинского обозначения элемента и индексов. Для правильного составления формулы нам обязательно понадобится таблица Менделеева и знание простых правил. Они достаточно простые и запомнить их смогут даже дети.
Как составлять химические формулы
Основным понятием при составлении химических формул является «валентность«. Валентность — это свойство одного элемента удерживать определенное число атомов в соединении. Валентность химического элемента можно посмотреть в таблице Менделеева, а также нужно помнить и уметь применять простые общие правила.
- Валентность металла всегда равна номеру группы, при условии, что он находится в главной подгруппе. Например, калий имеет валентность 1, а кальций — 2.
- С неметаллами немного сложнее.
 Неметалл может иметь высшую и низшую валентности. Высшая валентность равна номеру группы. Низшую валентность можно определить вычтя номер группы элемента из восьми. При соединении с металлами неметаллы всегда имеют низшую валентность. Кислород всегда имеет валентность 2.
Неметалл может иметь высшую и низшую валентности. Высшая валентность равна номеру группы. Низшую валентность можно определить вычтя номер группы элемента из восьми. При соединении с металлами неметаллы всегда имеют низшую валентность. Кислород всегда имеет валентность 2. - В соединении двух неметаллов низшую валентность имеет тот химический элемент, который находится в таблице Менделеева правее и выше. Однако, фтор всегда имеет валентность 1.
- И еще одно важное правило при расстановке коэффициентов! Общее число валентностей одного элемента всегда должно быть равно общему количеству валентностей другого элемента!
Закрепим полученные знания на примере соединения лития и азота. Металл литий имеет валентность, равную 1. Неметалл азот располагается в 5 группе и имеет высшую валентность 5 и низшую — 3. Как мы уже знаем, в соединениях с металлами неметаллы всегда имеют низшую валентность, поэтому азот в данном случае будет иметь валентность равную трем. Расставляем коэффициенты и получаем искомую формулу: Li3N.
Вот так, достаточно просто, мы научились составлять химические формулы! А для лучшего запоминания алгоритма составления формул мы подготовили его графическое представление.
Составление химических формул: алгоритм
Алгоритм составления химических формулПонравилась статья? Поделиться с друзьями:
Формулы химические – Справочник химика 21
На основании атомистической теории Дальтона, гипотезы Авогадро, закона Дюлонга и Пти и метода Канниццаро стало возможным получать атомные массы элементов ио данным химического анализа, плотности газов и удельной теплоемкости твердых тел. Все это привело к известной нам таблице атомных масс, помещенной на внутренней стороне обложки этой книги. Объяснение формул химических соединений, которые стало возможным получать на этой основе, представляло собой очередную важнейшую задачу химии. [c.294]Для определения брутто-формулы химического соединения используют данные его качественного и количественного элементного анализа.
 Это осуществляется в следующей последовательности. [c.130]
Это осуществляется в следующей последовательности. [c.130]Определение эмпирической формулы химического соединения [c.98]
Нахождение формулы химического соединения по его известным массовым долям элементов. (Звездочкой отмечены задачи повышенной трудности.) [c.209]
Определение истинных формул химических [c.14]
Как мы знаем, все твердые вещества как кристаллического, так и непериодического строения имеют остов, вид и мерность которого определяют строение вещества. Атом представляет собой систему, состоящую из валентных электронов и атомного остова. Атомное ядро отклоняется от положения равновесия весьма незначительно и практически локализовано внутри атома, тогда как валентные электроны совершают колебания с амплитудой, равной междуатомным расстояниям. Поэтому по местонахождению ядер можно определить, какое положение занимают данные атомы в молекулах и кристаллах. Зная, что степень перекрывания волновых функций достигает максимума при сближении атомов на определенное расстояние (речь идет о средних межатомных расстояниях в твердом теле, которые могут быть найдены, например, рентгеноструктурным методом) и резко уменьшается на несколько большем расстоянии, можно точно установить, какие атомы связаны между собой химическими связями.
Химические формулы. Химическими формулами пользуются для обозначения состава простых и сложных веществ. Химическая формула вещества показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы. Например, формула N2 показывает, что молекула азота состоит из двух атомов азота aS04 — в молекуле сульфата кальция содержится один атом кальция, один атом серы и четыре атома кислорода.
Электронные формулы Химические формулы, в которых точками обозначают внешние электроны каждого атома, участвующие в образовании химических связей [c.549]
Задание. Как влияет концентрация раствора нелетучего вещества на температуры его кристаллизации и кипения Проанализируйте формулу химического потенциала растворителя. Вспомните, что химический потенциал характеризует способность компонента выделяться из данной фазы.
Воспользуемся формулой химического потенциала идеального газа (4.49) и перейдем к парциальным давлениям [c.127]
Установление простейших и истинных формул химических соединений [c.14]
Из сказанного следует, что в методе ВС каждая МО формируется из двух АО, а химическая связь объясняется взаимодействием двух электронов с антипараллельными спинами. Это наглядно и удобно, так как такая пара электронов аналогична валентному штриху в структурных формулах химических соединений. Однако существуют соединения, обусловленные химической связью с одним или несколькими электронами, обобществленными разными атомами, свойства которых трудно описать с помощью метода ВС. По этой причине большее распространение в настоящее время получил метод молекулярных орбиталей (метод МО), разработанный Малликеном, Гундом, Хюккелем и др.
Такое соотношение отвечает как формуле НСО2, так и формулам Н2С 04, НзС зОй и т.
В другом примере рассмотрим предсказание формулы химического соединения на основании периодической таблицы. [c.127]
В основе газификации жидких и твердых видов топлива в промышленных установках ЗПГ лежат сложные химические реакции. Если в разных процессах производства ЗПГ одни реакции являются доминирующими и, следовательно, одни формулы химического равновесия более -существенны, чем другие (например реакции углерода с паром в процессе риформинга и углерода с водородом — при гидрогазификации), то на практике, вероятно, при любых методах газификации устанавливаются равновесные условия всех четырнадцати реакций, упомянутых выше.
Для определения состава смесей парафиновых и нафтеновых углеводородов пользуются графиком (фиг. 10), где удельные рефракции нафтенов разных рядов и парафинов, вычисленные из атомных рефракций, даны как функция молекулярного веса фракции. Значения удельной рефракции нафтенов представлены серией кривых, каждая из которых отвечает представителям нафтеновых углеводородов отдельного ряда. По этому графику, зная показатель преломления, удельный и молекулярный веса фракции, можно определить 1) среднее число колец в молекуле 2) общую формулу химического состава. Например, для некоторой фракции найдены удельная рефракция 0,3225 и молекуля1рный вес 450. По графику (фиг. 10) определяем среднее число колещ в молекуле— три и эмпирическая формула для углеводородов фракции— СлНгл-4, что при молекулярном весе 450 дает Сзз.ч Нво,4. Для дальнейшей характеристики фракции нужно задаться типом нафтенов.
10), где удельные рефракции нафтенов разных рядов и парафинов, вычисленные из атомных рефракций, даны как функция молекулярного веса фракции. Значения удельной рефракции нафтенов представлены серией кривых, каждая из которых отвечает представителям нафтеновых углеводородов отдельного ряда. По этому графику, зная показатель преломления, удельный и молекулярный веса фракции, можно определить 1) среднее число колец в молекуле 2) общую формулу химического состава. Например, для некоторой фракции найдены удельная рефракция 0,3225 и молекуля1рный вес 450. По графику (фиг. 10) определяем среднее число колещ в молекуле— три и эмпирическая формула для углеводородов фракции— СлНгл-4, что при молекулярном весе 450 дает Сзз.ч Нво,4. Для дальнейшей характеристики фракции нужно задаться типом нафтенов.
Запись данных опыта. Составить последовательный ряд формул химических соединений, которые были получены в работе, начиная с безводного сульфата меди, кончая металлической, медью.
Так же как и в случае реального газа, удобно сохранить внешний вид формулы химического потенциала и для неидеального раствора. Тогда все термодинамические зависимости, полученные для идеального раствора, сохранят свой вид для любого раствора. С этой целью вводится термодинамическая величина, называемая активностью. [c.182]
С формулами химического уравнения связывают определенные количества вещества обычно формуле вещества отвечает его количество, равное 1 молю, например
Определить на рис. 8 1) число и род фаз, число степеней свободы в системе, заданной точкой М. 2) указать изменения состава жидкой фазы при охлаждении системы состава Л1 3) установить формулу химического соединения, образующегося в системе гОз—5102 4) определить, какие фазы образуются при охлаждении до 1900° С жидкого расплава, содержащего 80% АЬОз 5) определить количества равновесных фаз, образующихся при охлаждении 100 г расплава, содержащего 80% АЬОз, до 1700° С.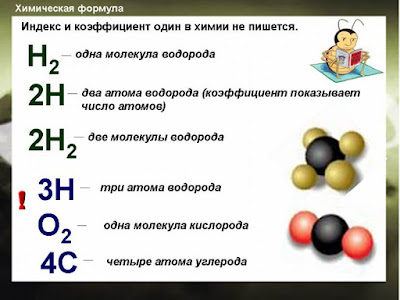
Расчеты по формулам химических соединений [c.20]
Расчеты по формулам. Химическая формула может дать много сведений о веществе. Прежде всего она показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента имеется в его молекуле. Затем она позволяет рассчитать ряд величин, характеризующих данное вещество. Укажем важнейшие из этих расчетов. [c.35]
Активностью а, компонента раствора называется термодинамическая величина, подстановка которой вместо концентрации в формулу химического потенциала компонента идеального раствора делает ее справедливой для реального раствора. [c.182]
СТЕХИОМЕТРИЧЕСКАЯ ФОРМУЛА — химическая формула молекулы, отвечающая идеальному составу химического соединения и удовлетворяющая
По формулам химических соединений можно определять молекулярную массу вещества, его количественный состав, содержание (в отношениях масс или процентах) каждого элемента в данном веществе. [c.20]
[c.20]
Прежде чем перейти к номенклатуре неорганических веществ, напомним, что состав вещества отображается с помощью химической формулы. Химическая формула отображает атомы каких видов и в каких количественных соотношениях составляют вещество. Соотношение количеств атомов каждого вида обозначается индексом (вообще, химическая формула – это более общее понятие, включающее брутто-формулу, струетурную, графическую и т. д., но об этом будет сказано позже, в разделе, посвященном химической связи). Так, химическая формула Н 80з отображает, что вещество содержит атомы трех химических элементов – водорода Н, серы 8, кислорода О. На один аггом серы приходится 2 атома водорода и 3 атома кислорода. Если вещество имеет молекулярное строение, то формула должна отображать количество атомов каждого вида в молекуле. Например, химическая формула показывает, что молекула кислорода состоит из двух атомов. По составу все вещества делятся на простые и сложные.
ФОРМУЛА ХИМИЧЕСКАЯ — условная запись буквами латинского алфавита и числовыми индексами состава химического соединения или простого вещества.
 Ф. X. показывает, как и в каком количестве атомы входят в состав соединения. [c.264]
Ф. X. показывает, как и в каком количестве атомы входят в состав соединения. [c.264]О д н о к о м п о н е н т н ы й р е а л ь н ы ii газ и компонент смеси реальных газов. Для вывода формулы химического потенциала в реальном ra- je имеется два способа. Во-первых, можно вести рассуждение так я е, как и для идеального газа, но при интегрировании пользоваться не уравнением Менделеева — Клапейрона, а каким-либо эмпирическим уравнением состояния. Этот способ применялся до 20-х годов нашего века. Помимо трудностей, связанных с интегрированием, этот способ неудобен еще и потому, что не существует универсального уравнения состояния реального газа. Поэтому для каждого реального газа получается свое выражение для химического потенциала. [c.58]
По возможности кратко опишите порядок операций для установления формулы химического вещества по известному его составу (в %). Ответ оценивается по степени краткости и универсальности применения созданного Вами предписания (алгоритм действия). Если Вам трудно составить алгоритм, воспользуйтесь числовыми данными и проведите по ним расчет например, при анализе медного колчедана найдено (в % по массе) 34,64% Си, 30,42% Ре и 34,94% 5. [c.16]
Если Вам трудно составить алгоритм, воспользуйтесь числовыми данными и проведите по ним расчет например, при анализе медного колчедана найдено (в % по массе) 34,64% Си, 30,42% Ре и 34,94% 5. [c.16]
Блестящим дальнейшим развитием атомно-молекулярного учения в доквантовый период явилась классическая теория химического строения, созданная в первую очередь работами замечательного русского химика А. М. Бутлерова (1828—1886), который обосновал утверждение, что структурные формулы — формулы химического строения — открывают последовательность химических связей атомов в молекулах . [c.13]
Предельно кратко опишите порядок операций для установления формулы химического вещества по известному его составу (в %). Оценка производится по степени краткости и универсальности применения созданного вами предписания (это так называемый алг0 ритм действия). Если вам трудно это сделать по памяти, воспользуйтесь примером при анализе медного колчедана найдено (в % по массе) 34,64% Си, 30,42% Ре и 34,94% 3. Написанный вами алгоритм проверьте, предложив решить задачу человеку, не знакомому с решением такого типа задач. [c.17]
Написанный вами алгоритм проверьте, предложив решить задачу человеку, не знакомому с решением такого типа задач. [c.17]
Установить формулу химического соединения, состоящего из 50,8% КзгО и 49,2% Si02 (масс, доли, %). 4. Указать температуру, при которой начнется кристаллизация расплава, содержащего 70% (масс, доли, %) Si02. Указать температуру, при которой закончится процесс кристаллизации. [c.73]
Согласно этой формуле химический сдвиг б измеряется относительно стандартного вещества, магнитные ядра которого структурно эквивалентны. Так, для резонанса на протонах стандартами служат тетраметилсилан, циклогексан, вода и др. На рис. 8.23, а расстояние между максимумами СНз- и Hj-rpynn равно 98 Гц [c.217]
Рассчитайте по эмпирическим формулам химические сдвиги метинового протона в изобутане и протонов метилено аой группы в н-бутане. [c.135]
Написать формулы химических соединений, зная их процентный состав а) 8—50%, 0—50% б) Н—1,597о. N-22,22%, 0-76,19%. [c.356]
N-22,22%, 0-76,19%. [c.356]
Химия для поступающих в вузы 1985 (1985) — [ c.15 ]
Химия для поступающих в вузы 1993 (1993) — [ c.14 ]
Учебник общей химии (1981) — [ c.24 , c.533 ]
Справочник Химия изд.2 (2000) — [ c.26 ]
Курс общей химии (1964) — [ c.17 ]
Неорганическая химия (1979) — [ c.20 ]
Неорганическая химия (1950) — [ c.38 ]
Неорганическая химия (1950) — [ c.31 ]
Химия Издание 2 (1988) — [ c.14 ]
Сочинения Научно-популярные, исторические, критико-библиографические и другие работы по химии Том 3 (1958) — [
c. 56
,
c.57
,
c.80
,
c.142
,
c.172
,
c.173
,
c.175
,
c.176
,
c.178
,
c.180
,
c.181
,
c.185
,
c.189
,
c.192
,
c.195
,
c.201
,
c.209
,
c.211
,
c.216
,
c.217
,
c.220
,
c.
56
,
c.57
,
c.80
,
c.142
,
c.172
,
c.173
,
c.175
,
c.176
,
c.178
,
c.180
,
c.181
,
c.185
,
c.189
,
c.192
,
c.195
,
c.201
,
c.209
,
c.211
,
c.216
,
c.217
,
c.220
,
c. 221
,
c.224
,
c.225
,
c.227
,
c.232
,
c.234
,
c.235
,
c.245
,
c.246
,
c.248
,
c.249
,
c.251
,
c.252
,
c.255
,
c.256
,
c.260
,
c.262
,
c.272
,
c.273
,
c.275
,
c.277
]
Основы общей химии Том 2 Издание 3 (1973) — [
c. 27
,
c.33
,
c.59
,
c.568
,
c.591
,
c.591
,
c.594
]
27
,
c.33
,
c.59
,
c.568
,
c.591
,
c.591
,
c.594
]
Общая химия (1968) — [ c.51 ]
Урок 5. Химическая формула – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.
Состав любого вещества выражается в виде химической формулы.
Химическая формула — это условная запись состава вещества с помощью химических знаков и индексов.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:
и читается «аш-два».
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора.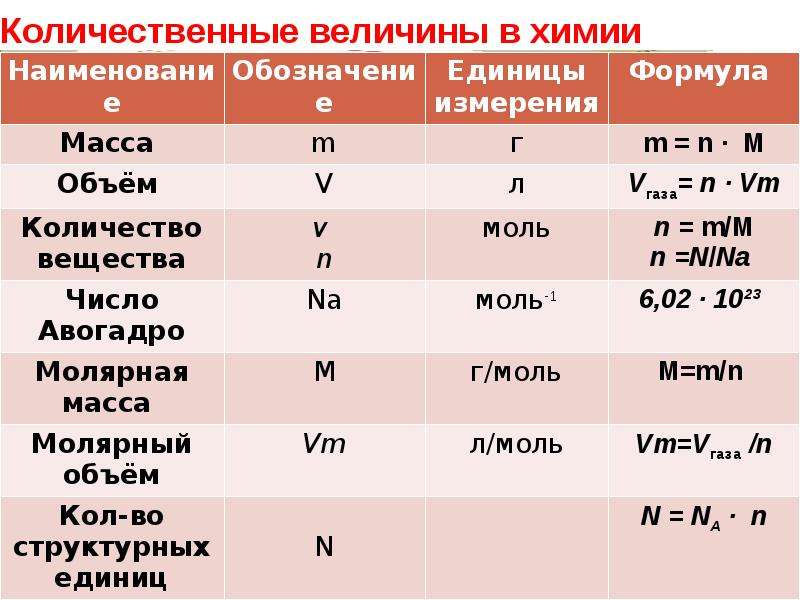 Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
- Качественный и количественный состав вещества выражается с помощью химических формул.
- Химическая формула вещества молекулярного строения показывает состав его молекулы, которая является элементарной структурной единицей данного вещества.

- Химическая формула вещества немолекулярного строения показывает простейшее соотношение атомов в его формульной единице.
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Разбор химической формулы в Python
Я пытаюсь решить эту проблему: https://leetcode.com/articles/number-of-atoms / #approach-1-recursion-accepted .
Вопрос в следующем: учитывая формулу типа C(Mg2(OH)4)2 , верните таблицу hash с элементами и их количеством. Имена элементов всегда начинаются с заглавной буквы и могут сопровождаться строчной.
Я подумал, что сначала начну с решения самого простого случая: никаких скобок.
def bracket_hash(formula):
element = ""
atom_count = 0
element_hash = {}
for x in formula:
if x. isupper():
if element!="":
element_hash[element] = 1
element = ""
element = x
elif x.islower():
element += x
else:
element_count = int(x)
element_hash[element] = element_count
element_count = 0
element = ""
if element!="":
element_hash[element] = 1
return element_hash
isupper():
if element!="":
element_hash[element] = 1
element = ""
element = x
elif x.islower():
element += x
else:
element_count = int(x)
element_hash[element] = element_count
element_count = 0
element = ""
if element!="":
element_hash[element] = 1
return element_hash
Этот код отлично работает в таких случаях, как:
print(bracket_hash("h3O"))
print(bracket_hash("CO2"))
print(bracket_hash("Mg2O4"))
print(bracket_hash("OH"))
Теперь я подумал , что каким-то образом стеки должны использоваться для обработки случая нескольких скобок, таких как OH(Ag3(OH)2)4, здесь число Ag должно быть 3*4, а число O и H будет 2*4 + 1.
До сих пор я начинал с чего-то вроде этого:
def formula_hash(formula):
stack = []
final_hash = {}
cur = ""
i = 0
while i < len(formula):
if formula[i] == '(':
j = i
while formula[j]!=')':
j = j + 1
cur = formula[i:j]
stack. append(bracket_hash(cur))
cur = ""
i = j + 1
append(bracket_hash(cur))
cur = ""
i = j + 1
но теперь я застрял.
Я как бы застреваю по мере того, как проблемы кодирования становятся все длиннее и требуют решения множества структур данных. Здесь они используют таблицу Hash и стек.
Поэтому мой вопрос таков: как разбить эту проблему на управляемые части и решить ее. Если я действительно решаю эту проблему, я должен сопоставить ее с управляемыми сегментами кода. Любая помощь будет очень признательна.
Спасибо.
python algorithm data-structures hash stackПоделиться Источник mourinho 27 февраля 2018 в 12:44
2 ответа
- Разбор химической формулы из строки в C#?
Я пытаюсь разобрать химическую формулу (в формате, например: Al2O3 или O3 или C или C11h32O12 ) в C# из строки. Он прекрасно работает, если только нет только одного атома определенного элемента (например, атома кислорода в h3O ).
 ), как я могу решить эту проблему, и, кроме того, есть ли лучший…
), как я могу решить эту проблему, и, кроме того, есть ли лучший… - Разбор химической формулы
Синтаксический анализ: напишите функцию, которая возьмет строку, представляющую химический вид , и вернет список кортежей, состоящих из элементов и соответствующих индексов. При отсутствии подстрочного индекса подстрочный индекс должен быть равен 1. Пример: вызов вашей функции с вводом: h3SO4…
4
Я думаю, что вы можете использовать рекурсивность для решения этой проблемы. Вот как должна работать ваша функция:
- Делайте то же, что и в первом коде, пока не столкнетесь с открывающей скобкой.
- Когда вы столкнетесь с открывающей скобкой, найдите соответствующую закрывающую скобку. Это можно сделать с помощью счетчика: инициализируйте его до 1, затем, когда вы сталкиваетесь с новой открывающей скобкой, вы увеличиваете счетчик, а когда вы сталкиваетесь с закрывающей скобкой, вы уменьшаете его.
 Когда счетчик равен 0, вы нашли соответствующую закрывающую скобку.
Когда счетчик равен 0, вы нашли соответствующую закрывающую скобку. - Вырежьте строку между скобками и вызовите ту же функцию с этой строкой (вот рекурсивный аспект).
- Добавьте значения в возвращенном словаре в текущий словарь, умноженные на число, которое следует за скобкой.
Если у вас возникли проблемы с реализацией некоторых частей этого решения, сообщите мне, и я дам более подробную информацию.
EDIT: о подходе к стеку Подход к стеку просто имитирует рекурсивность. Вместо того, чтобы снова вызывать функцию и иметь локальный счетчик, у нее есть стек счетчиков. Когда открывающая скобка открыта, она считается в этом контексте, а когда она закрыта, она сливается с контекстом, который ее содержит, с соответствующей кратностью.
Я предпочитаю рекурсивный подход, который более естественен.
Поделиться nyr1o 27 февраля 2018 в 12:57
1
Возможно, вы захотите поискать в Google python parser generator . Генератор парсеров -это библиотека, которая помогает разработчикам создавать парсеры для любого вида формулы или языка (технически, любого “grammar”), не выполняя всю работу с нуля.
Генератор парсеров -это библиотека, которая помогает разработчикам создавать парсеры для любого вида формулы или языка (технически, любого “grammar”), не выполняя всю работу с нуля.
Возможно, вам придется немного почитать, чтобы понять, какого типа grammar придерживается химическая формула.
Интересный обзор для Python заключается в следующем .
Поделиться DCS 27 февраля 2018 в 13:17
Похожие вопросы:
Вычислите молекулярную массу на основе химической формулы
Я пытаюсь написать программу, которая вычислит молекулярную массу данной молекулы на основе ее химической формулы. Этот код может разделить молекулярную формулу, такую как Ch4OH , на массив {C H 3 O…
разбор химической формулы со смесями элементов
Я хотел бы использовать boost::spirit для того, чтобы извлечь стехиометрию соединений, состоящих из нескольких элементов, из грубой формулы. В пределах данного соединения мой парсер должен быть…
В пределах данного соединения мой парсер должен быть…
LaTeX-формулы в Python
Я хотел бы напечатать формулы LaTeX mathmode на изображениях (предпочтительно без сохранения на жесткий диск) в Python. Я уже нашел matplotlib, но, похоже, нельзя динамически уменьшить размер…
Разбор химической формулы из строки в C#?
Я пытаюсь разобрать химическую формулу (в формате, например: Al2O3 или O3 или C или C11h32O12 ) в C# из строки. Он прекрасно работает, если только нет только одного атома определенного элемента…
Разбор химической формулы
Синтаксический анализ: напишите функцию, которая возьмет строку, представляющую химический вид , и вернет список кортежей, состоящих из элементов и соответствующих индексов. При отсутствии…
Python: разбор формулы из электронной таблицы
Я хочу сделать что-то вроде простой электронной таблицы с python. Мне нужно разобрать формулу из строки. () Формулы всегда будут начинаться с=….
() Формулы всегда будут начинаться с=….
Замена текста в строке химической формулы
У меня возникли проблемы с написанием функции, которая возьмет строку химической формулы, такую как NiNFe(AsO2)2, и удалит один из элементов. моя нынешняя попытка: pattern = new RegExp(symbol, g)…
Как определить приоритет химической реакции?
Если в контейнере происходит более одной химической реакции, как определить порядок среди этих реакций? Например, в одном стакане находятся три химических вещества, называемые А,В и C. Химическое…
Преобразование химической формулы в ее название iupac
У меня есть периодическая таблица, которую я закодировал в java, и я работаю над созданием простых соединений (только бинарных соединений) и возвращением информации о них, но у меня возникли…
Как извлечь число водородов из химической формулы (т. е. из C18h46P1, чтобы получить 36) с помощью Pandas
Я хотел бы иметь возможность сделать новую колонку в pandas dataframe, которая содержит количество водородов из химической формулы. Получение числа водородов из этой химической формулы C18h46P1S1…
Получение числа водородов из этой химической формулы C18h46P1S1…
Химические формулы и уравнения | Образование
(Здравствуйте уважаемый читатель.Наше настоятельное пожелание-посетите главную страницу сайта.)
Химические формулы выражают состав соединения. Со-
отношение атомов элементов указывается численными индек-
сами после символа каждого элемента, входящего в молекулу. Например,
серная кислота имеет формулу h3SO4, которая показывает, что это соеди-
нение состоит из атомов водорода, серы и кислорода, находящихся в соот-
ношении 2 : 1 : 4.
Если вещество состоит из отдельных молекул, то его формульный со-
став, например Nh4, показывает число различных атомов в одной молеку-
ле. Аммимак существует как отдельная частица в газовом, жидком и твер-
дом состояниях.
Формулы соединений ионного типа выражают простейшее соот-
ношение между ионами (катионами и анионами). Например, кристалл поварен-
Например, кристалл поварен-
ной соли NaCl состоит из ионов Na+ и Сl–, находящихся в соотношении 1 : 1,
что обеспечивает электронейтральность соединения в целом. Рассуждая
аналогичным образом, видно, что кристаллы CaF2 состоят из ионов Са2+ и F– в со-
отношении 1 : 2. В соединениях подобного типа нельзя обнаружить отдель-
ные молекулы NaCl или CaF2, и поэтому эти формулы указывают лишь на
соотношение катионов и анионов, из которых состоят эти вещества.
Существуют эмпирические и истинные формулы. Эмпирическая форму-
ла выражает простейшую формулу вещества, которую устанавливают пу-
тем элементного анализа. Так, анализ показывает, что простейшая, или эм-
пирическая, формула некоторого соединения соответствует СН. Истинная
формула показывает, какое количество таких простейших групп СН содер-
жится в молекуле. Представим истинную формулу в виде (СН)x, тогда при
значении х = 2 имеем ацетилен С2Н2, при x = 6 — бензол C6H6.
По валентности элементов можно составлять истинные формулы соеди-
нений, и наоборот, исходя из истинных формул можно определять валент-
ности элементов в данных соединениях. При этом для молекул, состоящих
При этом для молекул, состоящих
из атомов двух элементов, необходимо исходить из принципа, что произве-
дение валентности одного элемента на число его атомов равно произведению
валентности второго элемента на число его атомов. Так, чтобы составить
формулу оксида азота(V), следует записать сверху над символами валент-
ности элементов NO (V и II). Определив наименьшее общее кратное и раз-
делив его на соответствующие валентности, получим атомное соотношение
азота к кислороду, а именно, 2 : 5. Следовательно, формула оксида азота(V)
соответствует N2O5. Для определения валентности поступают наоборот.
С помощью формул можно изображать ход химических реакций. Хими-
ческие реакции — это процессы превращения одних веществ в другие. Их
выражают с помощью химических уравнений. Каждая формула, входящая
в уравнение, должна строго соответствовать составу вещества, участвующе-
го в реакции. При составлении уравнений обязательно учитываются зако-
ны сохранения массы и зарядов. Как правило, уравнение реакции содержит
Как правило, уравнение реакции содержит
лишь формулы веществ, вводимых в реакционную смесь и образующихся
в результате реакции.
Количества веществ, которые соответствуют уравнению реакции, назы-
вают стехиометрическими количествами. Стехиометрические расчеты ос-
нованы на двух важнейших принципах:
1) состав любого вещества выражают определенной формулой;
2) взаимодействие между веществами протекает в строгом соответствии
с законом сохранения массы.
Например, при взаимодействии сульфата натрия с хлоридом бария про-
исходит обменная реакция, при которой образуются хлорид натрия и суль-
фат бария:
Na2SO4 + ВаСl2 = NaCl + BaSO4
Хотя формулы исходных и конечных продуктов реакции написаны пра-
вильно, данное изображение хода химической реакции еще не является
уравнением реакции, ибо пока не соблюден закон сохранения массы. Что-
бы выполнялся этот закон, необходимо путем подсчета подобрать соответ-
ствующие коэффициенты. В рассматриваемом примере полное уравнение
В рассматриваемом примере полное уравнение
реакции приобретает вид
Na2SO4 + ВаСl2 = 2NaCl + BaSO4
В большинстве случаев химическая реакция редко протекает в соответствии с теми ко-
личественными соотношениями, которые рассчитываются по уравнению.
Это зависит от наличия примесей и побочных процессов, которые снижают
выход конечного продукта. Поэтому необходимо производить соответству-
ющие перерасчеты химического процесса, осуществляемого в промышлен-
ных масштабах.
химических формул | Безграничная химия
Молекулярные формулы
Молекулярные формулы – это компактные химические обозначения, которые описывают тип и количество атомов в одной молекуле соединения.
Цели обучения
Определите молекулярную формулу соединения по его названию или структурной формуле.
Основные выводы
Ключевые моменты
- Молекулярная формула состоит из химических символов составляющих элементов, за которыми следуют числовые индексы, описывающие количество атомов каждого элемента, присутствующего в молекуле.

- Эмпирическая формула представляет собой простейшее целочисленное отношение атомов в соединении. Молекулярная формула соединения может быть такой же или кратной эмпирической формуле соединения.
- Молекулярные формулы компактны и просты в передаче; однако им не хватает информации о связи и расположении атомов, которая содержится в структурной формуле.
Ключевые термины
- молекулярная формула : Формула, которая описывает точное количество и тип атомов в одной молекуле соединения.
- эмпирическая формула : Формула, которая указывает простейшее целочисленное отношение всех атомов в молекуле.
- структурная формула : Формула, указывающая не только количество атомов, но и их расположение в пространстве.
Молекулярные формулы описывают точное количество и тип атомов в одной молекуле соединения. Составляющие элементы представлены своими химическими символами, а количество атомов каждого элемента, присутствующего в каждой молекуле, показано нижним индексом, следующим за символом этого элемента. Молекулярная формула выражает информацию о пропорциях атомов, составляющих конкретное химическое соединение, с использованием одной строки символов и чисел химических элементов. Иногда он также включает другие символы, такие как круглые скобки, тире, квадратные скобки, а также знаки плюс (+) и минус (-).
Молекулярная формула выражает информацию о пропорциях атомов, составляющих конкретное химическое соединение, с использованием одной строки символов и чисел химических элементов. Иногда он также включает другие символы, такие как круглые скобки, тире, квадратные скобки, а также знаки плюс (+) и минус (-).
Для органических соединений углерод и водород указаны как первые элементы в молекулярной формуле, а за ними следуют остальные элементы в алфавитном порядке. Например, для бутана молекулярная формула C 4 H 10 .Для ионных соединений катион предшествует аниону в молекулярной формуле. Например, молекулярная формула фторида натрия – NaF.
Молекулярная формула – это не химическое название, и оно не содержит слов. Хотя молекулярная формула может подразумевать определенные простые химические структуры, это не то же самое, что полная химическая структурная формула. Молекулярные формулы более ограничивают, чем химические названия и структурные формулы.
Эмпирические и молекулярные формулы
Самые простые типы химических формул называются эмпирическими формулами, которые указывают соотношение каждого элемента в молекуле. Эмпирическая формула – это простейшее целочисленное отношение всех атомов в молекуле. Например:
Эмпирическая формула – это простейшее целочисленное отношение всех атомов в молекуле. Например:
- Молекулярная формула глюкозы: C 6 H 12 O 6 . Молекулярная формула указывает точное количество атомов в молекуле.
- Эмпирическая формула выражает наименьшее целочисленное отношение атомов в элементе. В этом случае эмпирическая формула глюкозы CH 2 O.
Чтобы преобразовать эмпирическую формулу в молекулярную, эмпирическую формулу можно умножить на целое число, чтобы получить молекулярную формулу.В этом случае эмпирическая формула должна быть умножена на 6, чтобы получить молекулярную формулу.
Примеры эмпирических и молекулярных формул
- Соединение гексоксида дихлора имеет эмпирическую формулу ClO 3 и молекулярную формулу Cl 2 O 6
- Соединение перекиси водорода имеет эмпирическую формулу HO и молекулярную формулу H 2 O 2
Молекулярные формулы и структурные формулы
Молекулярные формулы не содержат информации о расположении атомов. По этой причине одна молекулярная формула может описывать несколько различных химических структур. Структурная формула используется для обозначения не только количества атомов, но и их расположения в пространстве. Структурная формула не так компактна и проста в передаче, но она дает информацию, которую молекулярная формула не касается относительного расположения атомов и связи между атомами. Соединения, которые имеют общую химическую формулу, но имеют различную химическую структуру, известны как изомеры, и они могут иметь совершенно разные физические свойства.
По этой причине одна молекулярная формула может описывать несколько различных химических структур. Структурная формула используется для обозначения не только количества атомов, но и их расположения в пространстве. Структурная формула не так компактна и проста в передаче, но она дает информацию, которую молекулярная формула не касается относительного расположения атомов и связи между атомами. Соединения, которые имеют общую химическую формулу, но имеют различную химическую структуру, известны как изомеры, и они могут иметь совершенно разные физические свойства.
Структурная формула бутана : Химическая структура бутана указывает не только на количество атомов, но и на их расположение в пространстве.
Эмпирические формулы
Эмпирические формулы описывают простейшее целочисленное соотношение элементов в соединении.
Цели обучения
Вывести эмпирическую формулу молекулы с учетом ее массового состава
Основные выводы
Ключевые моменты
- Эмпирические формулы – это самая простая форма записи.
- Молекулярная формула соединения равна его эмпирической формуле или является целым числом, кратным ей.
- Подобно молекулярным формулам, эмпирические формулы не уникальны и могут описывать ряд различных химических структур или изомеров.
- Для определения эмпирической формулы массовый состав ее элементов может использоваться для математического определения их соотношения.
Ключевые термины
- эмпирическая формула : Обозначение, указывающее соотношения различных элементов, присутствующих в соединении, без учета фактических чисел.
Химики используют различные обозначения для описания и обобщения атомных составляющих соединений. Эти обозначения, которые включают эмпирические, молекулярные и структурные формулы, используют химические символы для элементов вместе с числовыми значениями для описания атомного состава.
Эмпирические формулы – самая простая форма записи. Они обеспечивают наименьшее целочисленное соотношение между элементами в соединении. В отличие от молекулярных формул, они не предоставляют информацию об абсолютном количестве атомов в одной молекуле соединения.Молекулярная формула соединения равна его эмпирической формуле или является целым числом.
В отличие от молекулярных формул, они не предоставляют информацию об абсолютном количестве атомов в одной молекуле соединения.Молекулярная формула соединения равна его эмпирической формуле или является целым числом.
Структурные формулы против эмпирических формул
Эмпирическая формула (например, молекулярная формула) не содержит какой-либо структурной информации о расположении или связывании атомов в молекуле. Таким образом, он может описывать ряд различных структур или изомеров с различными физическими свойствами. Для бутана и изобутана эмпирическая формула для обеих молекул: C 2 H 5 , и они имеют одну и ту же молекулярную формулу, C 4 H 10 .Однако одно структурное представление для бутана – CH 3 CH 2 CH 2 CH 3 , в то время как изобутан можно описать с помощью структурной формулы (CH 3 ) 3 CH.
Бутан : Структурная формула бутана.
Изобутан : структурная формула изобутана.
Определение эмпирических формул
Эмпирические формулы могут быть получены с использованием данных о массовом составе. Например, анализ горения можно использовать следующим образом:
- Анализатор CHN (прибор, который может определять состав молекулы) может использоваться для определения массовых долей углерода, водорода, кислорода и других атомов в образце неизвестного органического соединения.
- Как только относительные массовые доли элементов известны, эту информацию можно преобразовать в моли.
- Эмпирическая формула – это наименьшее возможное целочисленное отношение элементов.
Пример 1
Предположим, вам дали такое соединение, как метилацетат, растворитель, обычно используемый в красках, чернилах и клеях. При химическом анализе метилацетата было обнаружено, что он содержит 48,64% углерода (C), 8,16% водорода (H) и 43,20% кислорода (O). Для определения эмпирических формул мы предполагаем, что у нас есть 100 г соединения. В этом случае проценты будут равны массе каждого элемента в граммах.
Для определения эмпирических формул мы предполагаем, что у нас есть 100 г соединения. В этом случае проценты будут равны массе каждого элемента в граммах.
Шаг 1: Измените каждый процент на выражение массы каждого элемента в граммах. То есть 48,64% C превращается в 48,64 г C, 8,16% H превращается в 8,16 г H, а 43,20% O превращается в 43,20 г O, потому что мы предполагаем, что у нас есть 100 г всего соединения.
Шаг 2: Преобразуйте количество каждого элемента в граммах в его количество в молях.
[латекс] \ left (\ frac {48.64 \ mbox {g C}} {1} \ right) \ left (\ frac {1 \ mbox {mol}} {12.01 \ mbox {g C}} \ right) = 4.049 \ \ text {mol} [/ латекс]
[латекс] \ left (\ frac {8.16 \ mbox {g H}} {1} \ right) \ left (\ frac {1 \ mbox {mol}} {1.008 \ mbox {g H}} \ right) = 8.095 \ \ text {mol} [/ латекс]
[латекс] \ left (\ frac {43.20 \ mbox {g O}} {1} \ right) \ left (\ frac {1 \ mbox {mol}} {16.00 \ mbox {g O}} \ right) = 2.7 \ \ text {mol} [/ латекс]
Шаг 3: Разделите каждое мольное значение на наименьшее из мольных значений.
[латекс] \ frac {4.049 \ mbox {mol}} {2.7 \ mbox {mol}} = 1.5 [/ латекс]
[латекс] \ frac {8.095 \ mbox {mol}} {2.7 \ mbox {mol}} = 3 [/ латекс]
[латекс] \ frac {2.7 \ mbox {mol}} {2.7 \ mbox {mol}} = 1 [/ latex]
Шаг 4: При необходимости умножьте эти числа на целые, чтобы получить целые числа; если операция выполняется с одним из номеров, она должна выполняться со всеми ними.
[латекс] 1,5 \ раз 2 = 3 [/ латекс]
[латекс] 3 \ раз 2 = 6 [/ латекс]
[латекс] 1 \ times 2 = 2 [/ латекс]
Таким образом, эмпирическая формула метилацетата: C 3 H 6 O 2 .
Пример 2
Эмпирическая формула декана: C 5 H 11 . Его молекулярная масса составляет 142,286 г / моль. Какова молекулярная формула декана?
Шаг 1. Рассчитайте молекулярную массу по эмпирической формуле (молекулярная масса C = 12,011 г / моль и H = 1,008 г / моль)
5 (12,0111 г / моль) + 11 (1,008 г / моль) = C 5 H 11
60,055 г / моль + 11,008 г / моль = 71,143 г / моль на C 5 H 11
Шаг 2: Разделите молекулярную массу молекулярной формулы на молекулярную массу эмпирической формулы, чтобы найти соотношение между ними.
[латекс] \ frac {142,286 \ г / моль} {71,143 \ г / моль} = 2 [/ латекс]
Поскольку вес молекулярной формулы в два раза больше веса эмпирической формулы, должно быть вдвое больше атомов, но в том же соотношении. Следовательно, если эмпирическая формула декана C 5 H 11 , молекулярная формула декана вдвое больше, или C 10 H 22 .
От молекулярной формулы к эмпирической формуле – YouTube : Это видео показывает, как перейти от молекулярной формулы соединения к соответствующей эмпирической формуле.
Формулы ионных соединений
Ионная формула должна удовлетворять правилу октетов для составляющих атомов и электрической нейтральности для всего соединения.
Цели обучения
Создайте эмпирическую формулу ионного соединения, учитывая его молекулярные составляющие.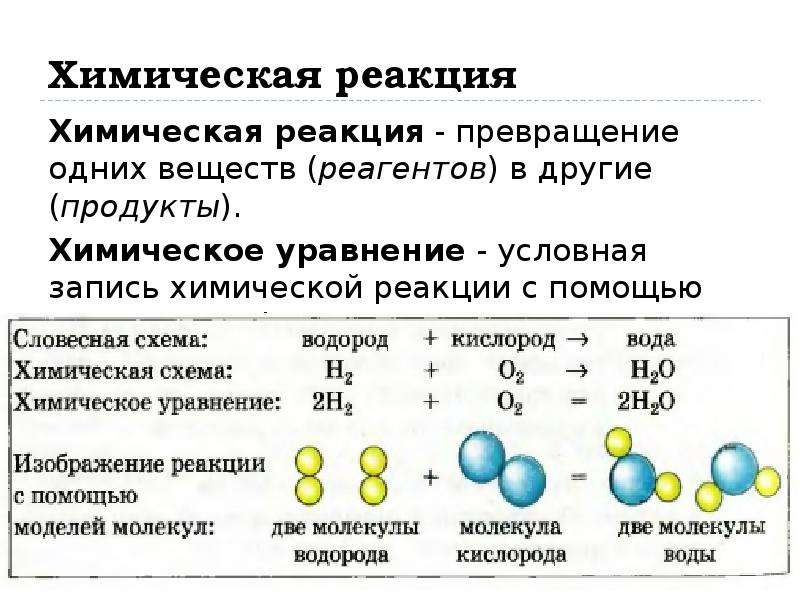
Основные выводы
Ключевые моменты
- Общая ионная формула соединения должна быть электрически нейтральной, то есть не иметь заряда.
- При написании формулы ионного соединения сначала идет катион, затем анион, оба с числовыми индексами, указывающими количество атомов каждого.
- Многоатомные ионы – это набор ковалентно связанных атомов, которые имеют общий заряд, что делает их ионами.
- Многоатомные ионы образуют ионные связи обычным образом, балансируя таким образом, чтобы все соединение было электрически нейтральным.
Ключевые термины
- многоатомный ион : набор ковалентно связанных атомов, которые имеют общий заряд, что делает их ионом.
- одноатомный ион : Ион, состоящий только из одного атома, например Cl-.
Ионные связи образуются за счет переноса одного или нескольких валентных электронов между атомами, обычно между металлами и неметаллами. Перенос электронов позволяет атомам эффективно достигать гораздо более стабильной электронной конфигурации с восемью электронами на внешней валентной оболочке (правило октетов). Когда натрий отдает валентный электрон фтору, чтобы стать фторидом натрия, это является примером образования ионной связи.
Перенос электронов позволяет атомам эффективно достигать гораздо более стабильной электронной конфигурации с восемью электронами на внешней валентной оболочке (правило октетов). Когда натрий отдает валентный электрон фтору, чтобы стать фторидом натрия, это является примером образования ионной связи.
Образование фторида натрия : перенос электронов между двумя атомами с образованием двух ионов, которые притягиваются друг к другу, потому что они заряжены противоположно.
Написание ионных формул
Ионные соединения могут быть описаны с использованием химических формул, которые представляют собой отношения взаимодействующих элементов, которые находятся в ионном твердом веществе или соли. Ионные твердые тела обычно представлены их эмпирическими формулами. В обозначениях формул элементы представлены своими химическими символами, за которыми следуют числовые индексы, которые указывают относительные соотношения составляющих атомов. Полная формула ионного соединения может быть определена при выполнении двух условий:
- Во-первых, заряд составляющих ионов может быть определен на основе переноса валентных электронов, необходимого для удовлетворения правила октетов.

- Во-вторых, катионы и анионы соединяются таким образом, что образуется электрически нейтральное соединение.
Например, при реакции кальция и хлора соединение называется хлоридом кальция. Он состоит из катионов Ca 2+ и анионов Cl – ; эти ионы стабильны, поскольку они заполнили валентные оболочки. Его ионная формула записывается как CaCl 2 , нейтральная комбинация этих ионов. В конечном соединении потребовались два иона хлорида, потому что кальций имел заряд 2+.Чтобы создать нейтральное соединение, CaCl 2 , потребовались два иона 1- хлорида, чтобы сбалансировать заряд 2+ от кальция.
Многоатомные ионы
Многоатомные ионы представляют собой набор ковалентно связанных атомов, имеющих общий заряд, что делает их ионами. Например, гидроксид-ион имеет формулу OH -1 . Гидроксид – это соединение, состоящее из кислорода и водорода, которые связаны вместе. В процессе превращения в соединение гидроксид откуда-то получил дополнительный электрон, сделав его OH -1 . Создавая ионные соединения с этими многоатомными ионами, относитесь к ним так же, как к обычным одноатомным ионам (только один атом).
Создавая ионные соединения с этими многоатомными ионами, относитесь к ним так же, как к обычным одноатомным ионам (только один атом).
Например, гидроксид кальция имеет формулу Ca (OH) 2 , потому что гидроксид имеет заряд -1, а кальций имеет заряд 2+. Два гидроксида были необходимы, чтобы уравновесить +2 заряда кальция. Скобки использовались, чтобы указать, что ОН был многоатомным ионом и предлагался как «комплексное решение». Два гидроксида нельзя было записать как O 2 H 2 , потому что это совершенно другое соединение, чем (OH) 2 .Скобки всегда используются, когда соединение содержит кратные числа многоатомного иона.
Вот список общих многоатомных ионов:
- Аммоний, NH 4 +
- Карбонат, CO 3 2-
- Бикарбонат, HCO 3 –
- Цианид, CN –
- Фосфат, PO 4 3-
- Гидроксид, OH –
- Нитрат, NO 3 –
- Перманганат, MnO 4 –
- Сульфат, SO 4 2-
- Тиоцианат, SCN –
- Пероксид, O 2 2-
Серия видеороликов «Введение в ионные соединения» от Leah5sci – YouTube : В этом видеоролике объясняются основы работы с ионами.
Образование катионов и анионов – Ионные соединения, часть 2 – YouTube : Это видео показывает, как моноатомные ионы получают свой заряд и как быстро определить заряд ионов, глядя на периодическую таблицу.
Easy Way to Learn Chemistry Formulas
Химические формулы – это сокращенные способы представления количества и типа атомов в соединении или молекуле, например H 2 O для воды или NaCl для хлорида натрия или соли.При написании химических формул следует соблюдать несколько правил, поэтому процесс может быть довольно сложным. Чем больше вы познакомитесь с периодической таблицей и названиями распространенных соединений, тем легче будет научиться писать химические формулы.
Используйте периодическую таблицу
Чтобы написать химические формулы, познакомьтесь с химическими символами, которые легче всего найти в периодической таблице элементов. Периодическая таблица представляет собой таблицу всех известных элементов, и она часто включает как полное название каждого элемента, так и его символ, например H для водорода или Cl для хлора.Некоторые из этих символов очевидны, например, O для кислорода, в то время как другие не так интуитивно понятны с их английским названием; Например, Na означает натрий, но этот символ происходит от латинского слова natrium, обозначающего натрий. Вы можете использовать периодическую таблицу, чтобы сослаться на символы, которые вы не можете запомнить.
Определение химических символов
Прежде чем вы сможете написать свою химическую формулу, вам нужно записать символ каждого атома, присутствующего в вашей молекуле или соединении. Вам могут дать название соединения, например, хлорид натрия, и вы должны определить, какие атомы присутствуют.Напишите Na для натрия и Cl для хлорида, форму элемента хлора, которые вместе создают формулу NaCl для хлорида натрия или соли. Ковалентные соединения, образованные из двух неметаллов, легко записать по их имени. Могут присутствовать префиксы для обозначения более чем одного атома. Например, формула диоксида углерода – CO 2 , потому что di определяет два атома кислорода.
Вам могут дать название соединения, например, хлорид натрия, и вы должны определить, какие атомы присутствуют.Напишите Na для натрия и Cl для хлорида, форму элемента хлора, которые вместе создают формулу NaCl для хлорида натрия или соли. Ковалентные соединения, образованные из двух неметаллов, легко записать по их имени. Могут присутствовать префиксы для обозначения более чем одного атома. Например, формула диоксида углерода – CO 2 , потому что di определяет два атома кислорода.
Определение валентности
Ионные соединения, образованные из металла и неметалла, являются более сложными, чем ковалентные соединения, поскольку они содержат заряженные атомы.Вы могли заметить, что в некоторых таблицах Менделеева указаны валентности, положительный или отрицательный заряд. Катионы или положительные ионы находятся в группе 1 с зарядом +1; группа 2, с зарядом +2; и переходные элементы, находящиеся в группах с 3 по 12. Группы 13, 14 и 18 имеют переменные заряды, а группы с 15 по 17 являются анионами, что означает, что они имеют отрицательные заряды.
Уравновешивание зарядов
Определение валентности каждого элемента важно при написании, потому что вам нужно сбалансировать свою химическую формулу, чтобы она не имела заряда.Например, напишите символы оксида магния вместе с соответствующими зарядами. Магний или Mg имеет заряд +2, а оксид, который относится к кислороду, имеет заряд -2. Так как сумма +2 и -2 равна O, вы получаете только по одному атому магния и кислорода. Соедините символы, чтобы получить MgO, формулу оксида магния.
Написание химической формулы
В химических формулах нижние индексы используются для обозначения количества каждого атома в молекуле или соединении. В предыдущем примере вы написали MgO, потому что каждый элемент содержит только один атом; обратите внимание, вы не используете индекс 1 только для одного атома.С другой стороны, чтобы сбалансировать хлорид магния, записанный MgCl 2 , вам нужно два атома хлора на один атом магния; цифра 2 написана как нижний индекс рядом с Cl, чтобы указать два атома хлора.
Дополнительные советы
По мере того, как вы попрактикуетесь в написании химических формул, вы познакомитесь с химической номенклатурой или терминами, используемыми для описания соединений. Например, элементы, оканчивающиеся на -ide, можно найти в группах с 15 по 17 периодической таблицы. Римские цифры в скобках, как видно из железа (II), обозначают заряды, в данном случае a +2.Когда многоатомные ионы или группы атомов, такие как гидроксид, обозначаемые как ОН, объединяются в соединение, они заключаются в скобки в химических формулах, как видно из формулы Al (OH) 3 , формулы гидроксида алюминия.
Как сбалансировать химические уравнения: 11 шагов (с изображениями)
Об этой статье
Соавторы:
Ученый-эколог
Соавтором этой статьи является Bess Ruff, MA.Бесс Рафф – аспирант по географии в Университете штата Флорида. Она получила степень магистра наук об окружающей среде и менеджменте в Калифорнийском университете в Санта-Барбаре в 2016 году. Она проводила исследования для проектов морского пространственного планирования в Карибском бассейне и оказывала поддержку в исследованиях в качестве аспиранта Группы устойчивого рыболовства. Эту статью просмотрели 4 211 264 раз (а).Соавторы: 163
Обновлено: 9 сентября 2021 г.
Просмотры: 4,211,264
Резюме статьиXЧтобы сбалансировать химическое уравнение, сначала запишите данную формулу с реагентами слева от стрелки и продуктами справа.Например, ваше уравнение должно выглядеть примерно так: «h3 + O2 → h3O». Подсчитайте количество атомов в каждом элементе с каждой стороны уравнения и перечислите их под этой стороной. В уравнении h3 + O2 → h3O 2 атома водорода добавляются к 2 атомам кислорода слева, поэтому вы должны написать «H = 2» и «O = 2» под левой стороной. Справа расположены 2 атома водорода и 1 атом кислорода, поэтому вы должны написать «H = 2» и «O = 1» под правой стороной. Поскольку количество атомов в каждом элементе не одинаково с обеих сторон, уравнение не сбалансировано.Чтобы сбалансировать уравнение, вам нужно добавить коэффициенты, чтобы изменить количество атомов с одной стороны, чтобы оно соответствовало другой. Для уравнения h3 + O2 → h3O вы должны добавить коэффициент 2 перед h3O в правой части, чтобы на каждой стороне уравнения было по 2 атома кислорода, например h3 + O2 → 2h3O. Однако нижние индексы не могут быть изменены и всегда умножаются на коэффициент, что означает, что теперь в правой части уравнения есть 4 атома водорода и только 2 атома водорода в левой части. Чтобы сбалансировать это, добавьте коэффициент 2 перед h3 в левой части уравнения, чтобы с каждой стороны было по 4 атома водорода, например 2h3 + O2 → 2h3O.Теперь количество атомов в каждом элементе одинаково с обеих сторон уравнения, поэтому уравнение сбалансировано. Помните, что если перед элементом нет коэффициента, предполагается, что коэффициент равен 1. Чтобы узнать, как сбалансировать химические уравнения алгебраически, прокрутите вниз!
- Печать
- Отправить письмо поклонника авторам
Что такое химическая формула? – Определение, типы и примеры – Видео и стенограмма урока
Молекулярная формула
Молекулярная формула , иногда известная как истинная формула , сообщает нам фактическое количество различных элементов в одной молекуле соединения.В молекулярной формуле каждый элемент записан как их символы в периодической таблице, а количество атомов для каждого элемента показано нижним индексом (маленькое число в правом нижнем углу элемента). Вот несколько примеров молекулярных формул:
Если мы посмотрим на бутан, мы увидим, что он имеет 4 атома углерода (C) и 10 атомов водорода (H).
Эмпирическая формула
Слово эмпирический определяется как то, что подтверждается наблюдением.В химии мы проверяем факты, проводя эксперименты. Итак, эмпирическая формула определяется как простейшее соотношение целых чисел элементов, составляющих соединение, и этот тип формулы выводится из экспериментальных данных.
Так же, как мы упрощаем дроби в классе математики, в химии мы можем также упрощать формулы. В этом случае давайте посмотрим на молекулярную формулу глюкозы:
В то время как молекулярная формула дает нам фактическое количество атомов каждого элемента в молекуле, эмпирическая формула дает нам простейшее соотношение, а не фактическое количество атомов элемента.Вот несколько примеров эмпирических формул, полученных из молекулярных формул:
Иногда есть молекулярные формулы, которые уже находятся в их простейшем соотношении, что означает, что они не могут быть далее сокращены. В этих случаях молекулярная формула совпадает с эмпирической формулой, которую можно увидеть на этих примерах.
В сахарозе индексы 12, 22 и 11 не имеют наибольшего общего множителя, поэтому их нельзя уменьшить.То же самое и с этанолом.
Структурная формула
Когда мы просто пишем молекулярную формулу, мы не знаем, как атомы расположены или какие атомы связаны друг с другом. Структурная формула показывает как фактическое количество атомов элементов в соединении, так и то, как атомы расположены, и какие атомы связаны друг с другом.
Вот структурные формулы этана, пропана и этанола. Молекулярные формулы каждого из них отражены под структурными формулами.
Давайте посмотрим на этан. Это показывает, что атом углерода (C) слева связан с тремя атомами водорода (H) и другим атомом углерода. Углерод справа также связан с тремя атомами водорода и углеродом слева.
Иногда встречаются соединения, имеющие одинаковую молекулярную формулу, но разную химическую структуру. Например, соединения этанол и диметиловый эфир имеют одинаковую молекулярную формулу C2H6O, но разные структуры:
Краткая структурная формула
Структурные формулы может быть утомительно писать и рисовать, и они занимают много места.Однако есть другой способ написать структурные формулы, и это делается путем написания сжатой структурной формулы. Сводная структурная формула показывает положение атомов по отношению друг к другу без указания их связей.
Для более сложных структур сжатая структурная формула показывает ограниченную информацию. Однако для более простых химических веществ этого типа формулы достаточно. Вот несколько примеров сокращенных структурных формул:
Сводная структурная формула также является хорошим способом записать формулы длинных цепочек или повторяющихся групп, как показано здесь:
| Различные типы химических формул показывают присутствующие элементы, а также соотношение элементов, присутствующих в химическом соединении. Каждый тип химической формулы предоставляет различную информацию о химическом соединении. |
| Молекулярный | Эмпирический | Строительный | Конденсированные структурные |
|---|---|---|---|
| Показывает количество атомов для каждого элемента в соединении | Показывает простейшее соотношение атомов элементов в соединении | Показывает количество атомов для каждого элемента в соединении, а также расположение и связи атомов | Показывает положение атомов соединения относительно друг друга без отображения связей |
Результаты обучения
Оцените преимущества изучения химических формул на этом уроке, включая способность:
- Обратите внимание на характеристики химической формулы
- Сравните химическую формулу с соединением
- Обсудить типы химических формул
простых шагов для балансировки химических уравнений
Химическое уравнение – это письменное описание того, что происходит в химической реакции.Исходные материалы, называемые реагентами, указаны в левой части уравнения. Далее идет стрелка, указывающая направление реакции. В правой части реакции перечислены производимые вещества, называемые продуктами.
Сбалансированное химическое уравнение сообщает вам количество реагентов и продуктов, необходимых для удовлетворения Закона сохранения массы. По сути, это означает, что в левой части уравнения находится такое же количество атомов каждого типа, что и в правой части. уравнения.Кажется, что балансировать уравнения должно быть просто, но это навык, требующий практики. Итак, хотя вы можете чувствовать себя манекеном, это не так! Вот шаг за шагом процесс, которому вы следуете, чтобы сбалансировать уравнения. Вы можете применить эти же шаги, чтобы сбалансировать любое несбалансированное химическое уравнение …
Простые шаги по уравновешиванию химических уравнений
Выполните четыре простых шага, чтобы сбалансировать химическое уравнение:
- Напишите несбалансированное уравнение, чтобы показать реагенты и продукты.
- Запишите, сколько атомов каждого элемента находится по обе стороны от стрелки реакции.
- Сложите коэффициенты (числа перед формулами), чтобы количество атомов каждого элемента было одинаковым с обеих сторон уравнения. Проще всего уравновесить атомы водорода и кислорода последними.
- Укажите состояние вещества реагентов и продуктов и проверьте свою работу.
Запишите несбалансированное химическое уравнение
Первый шаг – написать несбалансированное химическое уравнение.Если вам повезет, это вам дадут. Если вам сказали сбалансировать химическое уравнение и дали только названия продуктов и реагентов, вам нужно будет либо найти их, либо применить правила наименования соединений, чтобы определить их формулы.
Давайте попрактикуемся, используя реакцию из реальной жизни – ржавчину железа в воздухе. Чтобы написать реакцию, вам нужно идентифицировать реагенты (железо и кислород) и продукты (ржавчину). Затем напишите несбалансированное химическое уравнение:
Fe + O 2 → Fe 2 O 3
Обратите внимание, что реагенты всегда идут слева от стрелки.Их разделяет знак «плюс». Далее идет стрелка, указывающая направление реакции (реагенты превращаются в продукты). Товары всегда находятся справа от стрелки. Порядок, в котором вы пишете реагенты и продукты, не важен.
Запишите количество атомов
Следующим шагом для уравновешивания химического уравнения является определение количества атомов каждого элемента на каждой стороне стрелки:
Fe + O 2 → Fe 2 O 3
Для этого имейте в виду, что нижний индекс указывает количество атомов.Например, O 2 имеет 2 атома кислорода. В Fe 2 O 3 2 атома железа и 3 атома кислорода. В Fe 1 атом. Отсутствие нижнего индекса означает, что имеется 1 атом.
Со стороны реагента:
1 Fe
2 O
Со стороны продукта:
2 Fe
3 O
Откуда вы знаете, что уравнение еще не сбалансировано? Потому что количество атомов на каждой стороне не одинаковое! Сохранение массовых состояний Масса не создается и не разрушается в результате химической реакции, поэтому вам нужно добавить коэффициенты перед химическими формулами, чтобы отрегулировать количество атомов, чтобы они были одинаковыми с обеих сторон.
Добавить коэффициенты для уравновешивания массы в химическом уравнении
При балансировании уравнений вы никогда не меняете индексы . Вы добавляете коэффициенты . Коэффициенты – это множители целых чисел. Если, например, вы напишете 2 H 2 O, это означает, что у вас в 2 раза больше атомов в каждой молекуле воды, то есть 4 атома водорода и 2 атома кислорода. Как и в случае с индексами, вы не пишете коэффициент «1», поэтому, если вы не видите коэффициент, это означает, что имеется одна молекула.
Существует стратегия, которая поможет вам быстрее сбалансировать уравнения. Она называется балансировкой по осмотру . По сути, вы смотрите, сколько атомов у вас есть на каждой стороне уравнения, и добавляете коэффициенты к молекулам, чтобы сбалансировать количество атомов.
- Сначала уравновесить атомы, присутствующие в одной молекуле реагента и продукта.
- Остаток любых атомов кислорода или водорода последними.
В примере:
Fe + O 2 → Fe 2 O 3
Железо присутствует в одном реагенте и одном продукте, поэтому сначала сбалансируйте его атомы.Один атом железа слева и два справа, так что вы можете подумать, что размещение 2 Fe слева будет работать. Хотя это уравновесит железо, вы уже знаете, что вам придется регулировать и кислород, потому что он не сбалансирован. Путем осмотра (то есть смотря на это) вы знаете, что должны отбросить коэффициент 2 для некоторого большего числа.
3 Fe не работает слева, потому что вы не можете ввести коэффициент из Fe 2 O 3 , который бы уравновесил его.
4 Fe работает, если вы затем добавите коэффициент 2 перед молекулой ржавчины (оксида железа), получив 2 Fe 2 O 3 .Это дает вам:
4 Fe + O 2 → 2 Fe 2 O 3
Железо сбалансировано, по 4 атома железа на каждой стороне уравнения. Далее вам нужно сбалансировать кислород.
Баланс последних атомов кислорода и водорода
Это уравнение сбалансировано для железа:
4 Fe + O 2 → 2 Fe 2 O 3
При балансировании химических уравнений последний шаг – добавить коэффициенты к атомам кислорода и водорода.Причина в том, что они обычно появляются в нескольких реагентах и продуктах, поэтому, если вы сначала разберетесь с ними, вы обычно делаете дополнительную работу для себя.
Теперь посмотрите на уравнение (используйте осмотр), чтобы увидеть, какой коэффициент будет работать для баланса кислорода. Если вы введете 2 из O 2 , это даст вам 4 атома кислорода, но у вас будет 6 атомов кислорода в продукте (коэффициент 2, умноженный на индекс 3). Итак, 2 не работает.
Если вы попробуете 3 O 2 , то у вас будет 6 атомов кислорода на стороне реагента, а также 6 атомов кислорода на стороне продукта.Это работает! Сбалансированное химическое уравнение:
4 Fe + 3 O 2 → 2 Fe 2 O 3
Примечание: Вы могли бы написать сбалансированное уравнение, используя кратные коэффициенты. Например, если вы удвоите все коэффициенты, у вас все равно будет сбалансированное уравнение:
8 Fe + 6 O 2 → 4 Fe 2 O 3
Однако химики всегда пишут простейшие уравнения, поэтому проверьте свою работу, чтобы убедиться, что вы не можете уменьшить свои коэффициенты.
Вот как вы сбалансируете простое химическое уравнение для массы. Вам также может потребоваться сбалансировать уравнения для массы и заряда. Кроме того, вам может потребоваться указать состояние вещества (твердое, жидкое, водное, газообразное) реагентов и продуктов.
Сбалансированные уравнения с состояниями материи (плюс примеры)
Пошаговые инструкции по уравновешиванию уравнений окисления-восстановления
Молекулярные формулы и номенклатура
Нижеследующее содержание является сутью лекции 9.В этой лекции мы рассмотрим взаимосвязь между эмпирическими и молекулярными формулами, а также расчеты, используемые для определения одной формулы из другой.
Эмпирическая формула
Эмпирическая формула – это химическая формула соединения, которая дает пропорции (соотношения) элементов, присутствующих в соединении, но не фактическое количество или расположение атомов.
Это будет наименьшее целочисленное отношение элементов в соединении.
Например:
Чтобы определить эмпирическую формулу соединения или молекулы, нам необходимо знать массовые проценты элементов в соединении.Получив эту информацию, мы можем преобразовать ее в моли, чтобы определить соотношение между элементами.
Для запоминания процесса можно использовать простую рифму:
Процент к массе
Масса к моль
Разделить на малое
Умножить на целое
Например:
NutraSweet содержит 57,14% C, 6,16% H, 9,52% N и 27.18% О. Рассчитайте эмпирическую формулу NutraSweet и найдите молекулярную формулу. (Молярная масса NutraSweet составляет 294,30 г / моль)
Начните с количества граммов каждого элемента, указанного в задаче.
Если даны проценты, предположим, что общая масса равна 100 граммам, так что
масса каждого элемента = заданный процент.Преобразуйте массу каждого элемента в моль, используя молярную массу из периодической таблицы.
Разделите каждое значение молей на наименьшее вычисленное число молей. Округлить до ближайшего целого числа.
Это мольное соотношение элементов, которое в эмпирической формуле представлено нижними индексами.
Если число слишком велико для округления (x.1 ~ x.9), умножьте каждое решение на то же
множитель, чтобы получить кратное наименьшее целое число.Теперь мы можем найти молекулярную формулу, найдя массу по эмпирической формуле и установив соотношение:
Более подробная инструкция:
Вот несколько практических задач с ответами:
2.4 Химические формулы – Химия
Цели обучения
К концу этого раздела вы сможете:
- Обозначить состав молекул с использованием молекулярных формул и эмпирических формул
- Изобразите расположение связей атомов в молекулах, используя структурные формулы
Молекулярная формула представляет собой представление молекулы, в которой используются химические символы для обозначения типов атомов, за которыми следуют нижние индексы, чтобы показать количество атомов каждого типа в молекуле.(Нижний индекс используется только в том случае, если присутствует более одного атома данного типа.) Молекулярные формулы также используются в качестве сокращений для названий соединений.
Структурная формула для соединения дает ту же информацию, что и его молекулярная формула (типы и количество атомов в молекуле), но также показывает, как атомы связаны в молекуле. Структурная формула метана содержит символы для одного атома C и четырех атомов H, обозначающих количество атомов в молекуле (рис. 1).Линии представляют собой связи, удерживающие атомы вместе. (Химическая связь – это притяжение между атомами или ионами, которое удерживает их вместе в молекуле или кристалле.) Мы обсудим химические связи и посмотрим, как предсказать расположение атомов в молекуле позже. А пока просто знайте, что линии указывают на то, как атомы связаны в молекуле. Модель шара и палки показывает геометрическое расположение атомов с атомными размерами не в масштабе, а модель заполнения пространства показывает относительные размеры атомов.
Рис. 1. Молекула метана может быть представлена в виде (а) молекулярной формулы, (б) структурной формулы, (в) шаровой модели и (г) модели заполнения пространства. Атомы углерода и водорода представлены черными и белыми сферами соответственно.Хотя многие элементы состоят из отдельных отдельных атомов, некоторые существуют в виде молекул, состоящих из двух или более атомов элемента, химически связанных вместе. Например, большинство образцов элементов водорода, кислорода и азота состоят из молекул, каждая из которых содержит по два атома (называемых двухатомными молекулами), и поэтому имеют молекулярные формулы H 2 , O 2 и N 2 , соответственно.Другими элементами, обычно встречающимися в виде двухатомных молекул, являются фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Наиболее распространенная форма элемента сера состоит из молекул, состоящих из восьми атомов серы; его молекулярная формула S 8 (рис. 2).
Рис. 2. Молекула серы состоит из восьми атомов серы и поэтому записывается как S 8 . Его можно представить в виде (а) структурной формулы, (б) модели шара и ручки и (в) модели заполнения пространства.Атомы серы представлены желтыми сферами.Важно отметить, что нижний индекс после символа и число перед символом не представляют одно и то же; например, H 2 и 2H представляют собой совершенно разные виды. H 2 – это молекулярная формула; он представляет собой двухатомную молекулу водорода, состоящую из двух атомов элемента, которые химически связаны друг с другом. Выражение 2H, с другой стороны, указывает на два отдельных атома водорода, которые не объединены в единое целое.Выражение 2H 2 представляет две молекулы двухатомного водорода (рис. 3).
Рис. 3. Символы H, 2H, H 2 и 2H 2 представляют собой очень разные объекты.Соединения образуются при химическом соединении двух или более элементов, в результате чего образуются связи. Например, водород и кислород могут реагировать с образованием воды, а натрий и хлор могут реагировать с образованием поваренной соли. Иногда мы описываем состав этих соединений с помощью эмпирической формулы , которая указывает типы присутствующих атомов, а – простейшее целочисленное отношение числа атомов (или ионов) в соединении .Например, диоксид титана (используемый в качестве пигмента в белой краске и в толстом, белом блокирующем типе солнцезащитного крема) имеет эмпирическую формулу TiO 2 . Это идентифицирует элементы титана (Ti) и кислорода (O) как составляющие диоксида титана и указывает на присутствие в два раза большего количества атомов кислорода элемента, чем атомов элемента титана (рис. 4).
Рис. 4. (a) Белое соединение диоксида титана обеспечивает эффективную защиту от солнца. (б) Кристалл диоксида титана TiO 2 содержит титан и кислород в соотношении 1: 2.Атомы титана серые, а атомы кислорода красные. (ссылка a: модификация работы «osseous» / Flickr)Как обсуждалось ранее, мы можем описать соединение с молекулярной формулой, в которой нижние индексы указывают на фактическое количество атомов каждого элемента в молекуле соединения . Во многих случаях молекулярная формула вещества получается из экспериментального определения как его эмпирической формулы, так и его молекулярной массы (суммы атомных масс всех атомов, составляющих молекулу).Например, экспериментально можно определить, что бензол содержит два элемента, углерод (C) и водород (H), и что на каждый атом углерода в бензоле приходится один атом водорода. Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 (рис. 5).
Рис. 5. Бензол, C 6 H 6 , производится при переработке нефти и имеет множество промышленных применений.Молекула бензола может быть представлена в виде (а) структурной формулы, (б) шаровой модели и (в) модели заполнения пространства. (d) Бензол – прозрачная жидкость. (кредит d: модификация работы Сахара Атвы)Если мы знаем формулу соединения, мы можем легко определить эмпирическую формулу. (Это в некотором роде академическое упражнение; на практике обычно соблюдают обратную хронологию.) Например, молекулярная формула уксусной кислоты, компонента, придающего уксусу его острый вкус, составляет C 2 H 4 O 2 .Эта формула показывает, что молекула уксусной кислоты (рис. 6) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2: 4: 2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное отношение атомов 1: 2: 1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным числу эмпирическая формула.
Рис. 6. (a) Уксус содержит уксусную кислоту, C 2 H 4 O 2 , которая имеет эмпирическую формулу CH 2 O.Его можно представить в виде (б) структурной формулы и (в) как шаровой модели. (кредит а: модификация работы «HomeSpot HQ» / Flickr)Пример 1
Эмпирические и молекулярные формулы
Молекулы глюкозы (сахара в крови) содержат 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Каковы молекулярные и эмпирические формулы глюкозы?
Раствор
Молекулярная формула: C 6 H 12 O 6 , потому что одна молекула фактически содержит 6 атомов C, 12 H и 6 O.Простейшее целочисленное отношение атомов C к H и O в глюкозе составляет 1: 2: 1, поэтому эмпирическая формула CH 2 O.
Проверьте свои знания
Молекула метальдегида (пестицида, используемого для улиток и слизней) содержит 8 атомов углерода, 16 атомов водорода и 4 атома кислорода. Каковы молекулярные и эмпирические формулы метальдегида?
Ответ:
Химическая формула, C 8 H 16 O 4 ; эмпирическая формула, C 2 H 4 O
Вы можете изучить построение молекул с помощью онлайн-моделирования.
Ли Кронин
Чем занимаются химики? Согласно Lee Cronin (рис. 7), химики создают очень сложные молекулы, «измельчая» маленькие молекулы и «реверсивно проектируя» их. Он задается вопросом, можем ли мы «сделать действительно крутой универсальный химический набор» с помощью того, что он называет «прикладной» химией. Можем ли мы «приложить» химию?
В своем выступлении на TED в 2012 году Ли описывает одну интересную возможность: объединить набор химических «чернил» с 3D-принтером, способным создать реакционный аппарат (крошечные пробирки, химические стаканы и т. Д.) Для создания «универсального химического набора инструментов». .Этот набор инструментов можно использовать для создания индивидуальных лекарств для борьбы с новой супербактерийной микробой или для «печати» лекарств, персонально настроенных в соответствии с вашим генетическим составом, окружающей средой и состоянием здоровья. Кронин говорит: «То, что Apple сделала для музыки, я хотел бы сделать для открытия и распространения рецептурных лекарств». Полный текст его выступления можно найти на сайте TED.
Рис. 7. Химик Ли Кронин был назван одним из 10 самых вдохновляющих ученых Великобритании. Самый молодой председатель Университета Глазго, Ли руководит большой исследовательской группой, сотрудничает со многими учеными по всему миру, опубликовал более 250 статей в ведущих научных журналах и провел более 150 приглашенных выступлений.Его исследования сосредоточены на сложных химических системах и их потенциале для преобразования технологий, а также на отраслях нанонауки, солнечного топлива, синтетической биологии и даже искусственной жизни и эволюции. (кредит: изображение любезно предоставлено Ли Кронином)Важно знать, что одни и те же атомы могут быть расположены по-разному: соединения с одинаковой молекулярной формулой могут иметь разные межатомные связи и, следовательно, разные структуры. Например, может ли существовать другое соединение с той же формулой, что и уксусная кислота, C 2 H 4 O 2 ? И если да, то какова будет структура его молекул?
Если вы предсказываете, что может существовать другое соединение с формулой C 2 H 4 O 2 , то вы продемонстрировали хорошее химическое понимание и правы.Два атома C, четыре атома H и два атома O также могут быть скомпонованы с образованием метилформиата, который используется в производстве в качестве инсектицида и для быстросохнущих отделочных материалов. Молекулы метилформиата имеют один из атомов кислорода между двумя атомами углерода, что отличается от расположения в молекулах уксусной кислоты. Уксусная кислота и метилформиат являются примерами изомеров – соединений с той же химической формулой, но с разными молекулярными структурами (рис. 8). Обратите внимание, что эта небольшая разница в расположении атомов имеет большое влияние на их соответствующие химические свойства.Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса) при приготовлении заправки для салатов.
Рис. 8. Молекулы (а) уксусной кислоты и метилформиата (б) являются структурными изомерами; они имеют одинаковую формулу (C 2 H 4 O 2 ), но разную структуру (и, следовательно, разные химические свойства).Существует множество типов изомеров (рис. 9). Уксусная кислота и метилформиат – это структурных изомеров , соединения, в которых молекулы различаются тем, как атомы связаны друг с другом.Существуют также различные типы пространственных изомеров , в которых относительная ориентация атомов в пространстве может быть разной. Например, составной карвон (содержащийся в семенах тмина, мяты и кожуре мандарина) состоит из двух изомеров, которые являются зеркальным отображением друг друга. S – (+) – карвон пахнет тмином, а R – (-) – карвон пахнет мятой.
Рис. 9. Молекулы карвона являются пространственными изомерами; они отличаются только относительной ориентацией атомов в пространстве.(кредит внизу слева: модификация работы «Miansari66» / Wikimedia Commons; кредит внизу справа: модификация работы Фореста и Ким Старр)Выберите эту ссылку, чтобы просмотреть объяснение изомеров, пространственных изомеров и почему они имеют разные запахи (выберите видео под названием «Mirror Molecule: Carvone»).
В молекулярной формуле используются химические символы и индексы для обозначения точного числа различных атомов в молекуле или соединении. Эмпирическая формула дает простейшее целочисленное отношение атомов в соединении.Структурная формула указывает на расположение атомов в молекуле. Шаровидные модели и модели, заполняющие пространство, показывают геометрическое расположение атомов в молекуле. Изомеры – это соединения с одной и той же молекулярной формулой, но с различным расположением атомов.
Химия: упражнения в конце главы
- Объясните, почему символ атома элемента кислорода и формула молекулы кислорода различаются.
- Объясните, почему символ элемента сера и формула молекулы серы различаются.
- Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
(г) - Напишите молекулярные и эмпирические формулы следующих соединений:
(а)
(б)
(в)
(г)
- Определите эмпирические формулы для следующих соединений:
(а) кофеин, C 8 H 10 N 4 O 2
(б) фруктоза, C 12 H 22 O 11
(в) пероксид водорода, H 2 O 2
(г) глюкоза, C 6 H 12 O 6
(e) аскорбиновая кислота (витамин C), C 6 H 8 O 6
- Определите эмпирические формулы для следующих соединений:
(а) уксусная кислота, C 2 H 4 O 2
(б) лимонная кислота, C 6 H 8 O 7
(в) гидразин, N 2 H 4
(d) никотин, C 10 H 14 N 2
(е) бутан, C 4 H 10
- Напишите эмпирические формулы для следующих соединений:
(а)
(б)
- Откройте симуляцию «Построить молекулу» и выберите вкладку «Большие молекулы».Выберите соответствующий набор атомов, чтобы построить молекулу с двумя атомами углерода и шестью атомами водорода. Перетащите атомы в пространство над «Набором», чтобы создать молекулу. Имя появится, когда вы создадите настоящую существующую молекулу (даже если это не та, которую вы хотите). Вы можете использовать ножницы для разделения атомов, если хотите изменить связи. Нажмите «3D», чтобы увидеть молекулу, и посмотрите на возможности заполнения пространства и шарика и палки.
(a) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы каким-либо образом, чтобы получить другое соединение?
- Воспользуйтесь имитацией «Построение молекулы», чтобы повторить упражнение 8 в конце главы «Химия», но постройте молекулу с двумя атомами углерода, шестью атомами водорода и одним кислородом.
(a) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы так, чтобы образовалась другая молекула? Если да, нарисуйте его структурную формулу и назовите его название.
(c) Как молекулы, изображенные на (a) и (b), одинаковы? Чем они отличаются? Как они называются (тип взаимоотношений между этими молекулами, а не их названия).
- Используйте симуляцию «Построение молекулы», чтобы повторить «Химия» в конце главы упражнения 8, но постройте молекулу с тремя атомами углерода, семью атомами водорода и одним хлором.
(a) Нарисуйте структурную формулу этой молекулы и укажите ее название.
(b) Можете ли вы расположить эти атомы так, чтобы образовалась другая молекула? Если да, нарисуйте его структурную формулу и назовите его название.
(c) Как молекулы, изображенные на (a) и (b), одинаковы? Чем они отличаются? Как они называются (тип взаимоотношений между этими молекулами, а не их имена)?
Глоссарий
- эмпирическая формула
- формула, показывающая состав соединения как простейшее целочисленное отношение атомов
- изомеры
- соединения с одинаковой химической формулой, но разной структурой
- молекулярная формула
- формула, указывающая состав молекулы соединения и дающая фактическое количество атомов каждого элемента в молекуле соединения.
- пространственные изомеры
- соединения, в которых взаимная ориентация атомов в пространстве различается
- структурная формула
- показывает атомы в молекуле и то, как они связаны
- структурный изомер
- одно из двух веществ с одинаковой молекулярной формулой, но с разными физическими и химическими свойствами, поскольку их атомы связаны по-разному
Решения
Ответы на упражнения в конце главы по химии
1.Символ кислородного элемента, O, представляет как элемент, так и один атом кислорода. Молекула кислорода O 2 содержит два атома кислорода; индекс 2 в формуле должен использоваться, чтобы отличать двухатомную молекулу от двух одиночных атомов кислорода.
3. (а) молекулярный CO 2 , эмпирический CO 2 ; (б) молекулярный C 2 H 2 , эмпирический CH; (в) молекулярный C 2 H 4 , эмпирический CH 2 ; (г) молекулярная H 2 SO 4 , эмпирическая H 2 SO 4
5.а) C 4 H 5 N 2 O; (б) C 12 H 22 O 11 ; (c) HO; (d) CH 2 O; (e) C 3 H 4 O 3
7. (а) CH 2 O; (б) C 2 H 4 O
9. (а) этанол
(b) метоксиметан, более известный как диметиловый эфир
(c) Эти молекулы имеют одинаковый химический состав (типы и количество атомов), но разные химические структуры.Это структурные изомеры.
.