Химическая формула в химии – виды записи и определение с примерами
Содержание:
Составление химических формул по валентности:
Пользуясь знаками представленных химических элементов, запишите химические формулы воды, поваренной соли, углекислого газа, серной кислоты. На чём основывается запись химических формул веществ?
Химические формулы веществ можно вывести на основе различных химических опытов. Рассмотрим формулы водородных соединений некоторых элементов (таблица 1).
Из таблицы становится ясно, что атом хлора присоединяется с 1, атом кислорода – с 2, атом азота – с 3, а атом углерода – с 4 атомами водорода. Следовательно, химические элементы обладают разной способностью присоединять к себе атомы водорода. Для объяснения этого пользуются понятием «валентности». Свойство атомов химических элементов присоединять к себе определенное число атомов других химических элементов называют валентностью. Понятие валентности впервые было введено в 1852 году английским ученым Э.Франклендом.
Понятие валентности впервые было введено в 1852 году английским ученым Э.Франклендом.
Английский химик. В 1852 г. им было введено в науку понятие о соединительной силе атомов друг к другу. Данное свойство атомов впоследствии было названо валентностью.
Кислород в угарном газе в ионе гидроксония является I I I – валентным. А углерод бывает I I I – валентным только в угарном газе
Валентность выражают римскими цифрами. Валентность водорода принята за единицу, и поэтому валентности других элементов берутся в сопоставлении с ним.
Валентность некоторых химических элементов остается неизменной во всех их химических соединениях, т.е. всегда обозначается одной и той же цифрой. Это элементы с постоянной валентностью (таблица 2).
Однако другая группа элементов в различных химических соединениях имеет различную валентность. Их называют элементами с переменной валентностью (таблица 3).
Зная валентность химических элементов, можно легко составить формулу бинарного (двухэлементного) соединения, образованного ими. Для этого следует записать химические знаки элементов, проставив над ними их валентность. Далее, определив наименьшее общее кратное чисел, выражающих валентность этих элементов, его делят на валентность каждого из них и находят их индексы. Например:
1) Определим валентность атома алюминия по кислороду в химическом соединении (оксид алюминия).
2) Составим химическую формулу соединения VII-валентного элемента марганца с кислородом:
3) Если при составлении формулы по валентности полученные индексы сократить до минимальных целых чисел, в таком случае можно, проведя эту операцию, получить простую формулу вещества (поделив VI и II на самый большой делитель – 2, можно получить формулу).
Химическая формулаЗаполните таблицу. Как произносится химическая формула вещества?
Все вещества имеют химическую формулу. Условное обозначение состава вещества при помощи химических знаков и индексов называют химической формулой. Химическая формула вещества выражает его количественный и качественный состав. Качественный состав вещества показывает, из атомов каких элементов оно состоит, а его количественный состав – число атомов элемента, содержащихся в его составе, т.е. в одной молекуле. Число, расположенное справа внизу у знака элемента и показывающее количество атомов, называется индексом (схема 1).
Условное обозначение состава вещества при помощи химических знаков и индексов называют химической формулой. Химическая формула вещества выражает его количественный и качественный состав. Качественный состав вещества показывает, из атомов каких элементов оно состоит, а его количественный состав – число атомов элемента, содержащихся в его составе, т.е. в одной молекуле. Число, расположенное справа внизу у знака элемента и показывающее количество атомов, называется индексом (схема 1).
Число, стоящее перед химическими формулами и химическими знаками, называется коэффициентом.
На основе представленных в таблице 1 моделей молекул и химических формул водорода, кислорода, воды и углекислого газа можно определить число атомов в их составе
Пользуясь краткими названиями химических элементов, можно прочитать формулы:
Выясним, какие сведения о веществе можно получить по его химической формуле (таблица 3).
Состав веществ определяют разными физико-химическими способами, методом анализа результатов химических опытов. Так, например, в результате разложения воды под воздействием постоянного электрического тока наблюдается превышение в два разаТ.е. при распаде 9 г воды будут получены 1 г водорода и 8 г кислорода. При сопоставлении данных чисел с относительными атомными массами элементов можно прийти к выводу, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Состав воды и других химических соединений, независимо от способа их получения и места нахождения, всегда остается постоянным. Основываясь на этом, в 1799 году французским химиком Ж.Л.Прустом был открыт
Французский химик.
Данный закон о постоянстве и неизменности состава и свойств веществ с молекулярным строением является одним из основных законов химии. Для большинства химических соединений немолекулярного строения закон постоянства состава не подходит.
Как известно, не все вещества имеют молекулярное строение. Целая группа веществ имеет немолекулярное строение. Как же составляются химические формулы этих веществ? Химические формулы веществ с немолекулярным строением составляются на основе количественного соотношения частиц элементов (атомов или ионов) в соединениях. Для определения этого соотношения выясняется, сколько частиц другого элемента окружает (соединяется) частицу элемента в кристалле вещества немолекулярного строения. Исследования физическими методами строения кристаллов вещества позволяют получить такие сведения.
Для овладения всесторонними знаниями о величинах атомов, а также их относительных и абсолютных массах требуется усвоить следующие важнейшие понятия.
Атом — это мельчайшая химически неделимая частица вещества.
Слово “атом” в переводе с древнегреческого языка означает ~ “неделимый”.
В настоящее время доказано, что атом состоит из ряда более мелких частиц.
Химический элемент — это вид определенных атомов. Например, атомы кислорода означают элемент кислород (табл. 1).
Каждый химический элемент обозначается символом — первой буквой своего латинского названия или при необходимости первой и следующей за ней буквами.
Будучи мельчайшими частицами, атомы обладают определенной массой. Так, абсолютная масса атома водорода составляет 0,00000000000000000000001674 г или 1,674• г. Абсолютная масса атома углерода — 19,993• г.
Относительная масса атома — это число, указывающее, во сколько раз масса атома химического элемента больше массы атома — изотопа массы атома — изотопа равна 1,66057• — 1 а.е.м.
Относительная масса атома обозначается буквой Аг, где г — относительность (relative).
Количество вещества — величина, численно равная относительной атомной массе элемента, — выражается в г-молях (или молях).
В 1 моле любого вещества содержится 6,02• частиц (атомов, молекул, ионов). Число 6,02• называется постоянной Авогадро.
Таблица 1
Показатели некоторых химических элементов
| Химический элемент | Символ | Абсолютная масса атома, г | Абсолютная масса атома, | Число атомов в 1 моле |
| Водород | Н | 1,674• | 1,008 | 6,02• |
| Кислород | О | 26,567• | 15,999 | 6,02• |
| Углерод | С | 19,993• | 12,011 | 6,02• |
Пример №1
Абсолютная масса атома кислорода равна 2,667• г. Определите его относительную атомную массу.
Определите его относительную атомную массу.
Решение. Единица массы 1 атома равна 1,66057• г.
Ответ: =16.
Пример №2
Какой будет масса (г) 0,301 • атомов кислорода?
Решение. 6,02 • атомов кислорода составляют 1 моль и равны 16 г.
Тогда, если 6,02 • атомов кислорода —16 г, то 0,301• атомов кислорода — х.
Ответ: 0,8 г.
Определение химической формулы- Химическая формула — это выражение состава молекулы вещества посредством химических символов и (при необходимости) индексов.
- По химической формуле можно определить качественный и количественный состав вещества.
Например: — серная кислота. Химическая формула показывает, что это — одна молекула серной кислоты, в которой содержатся 2 атома водорода, 1 атом серы и 4 атома кислорода, или 1 моль вещества.
Точно так же можно найти абсолютную и относительную массы молекулы.
1 моль — значение, выраженное в граммах и численно равное относительной молекулярной массе вещества.
1 моль — количество вещества, содержащего столько структурных единиц (молекул, атомов, ионов, электронов), сколько атомов в 12 г изотопа углерода ().
В 12 г углерода содержится 6,02• атомов.
Количество вещества обозначается буквой n и его значение выражается в молях.
Молярная масса вещества обозначается буквой М и выражается в г/молях (табл. 2).
Таблица 2
Показатели некоторых химических веществ
| Вещество | Химическая формула | Молярная масса, г/моль | Количество вещества, моль | Число молекул |
| Вода | 18 | 1 | 6,02• | |
| Углекислый газ | 44 | 1 | 6,02• | |
| Серная кислота | 98 | 1 | 6,02• |
1.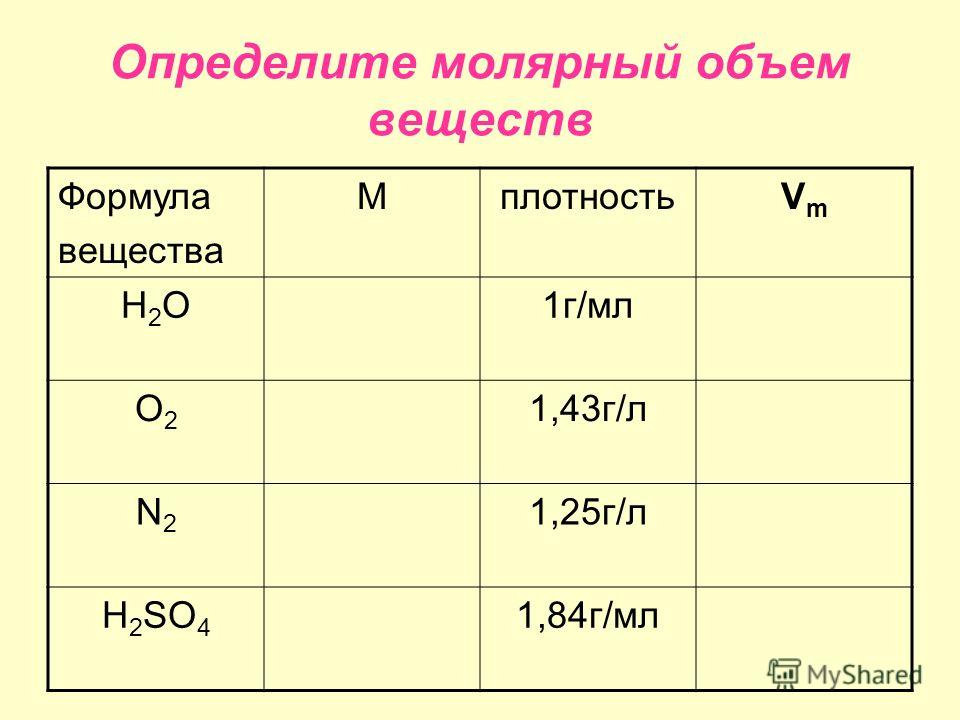 Нахождение валентности элементов, входящих в состав вещества, по данным химическим формулам.
Нахождение валентности элементов, входящих в состав вещества, по данным химическим формулам.
Свойство атомов элемента присоединять определенное число атомов другого элемента называется валентностью.
В качестве единицы измерения валентности принята валентность водорода.
Валентность атома водорода равна единице. Атом кислорода всегда двухвалентен.
Неизвестная валентность элемента определяется по водородным или кислородным соединениям, а также соединениям с каким-нибудь другим элементом, валентность которого известна.
Пример №3
Перепишите в тетрадь формулы следующих соединений и определите их валентность:
Решение.
1) — валентность кислорода равна двум. Число атомов кислорода — пять, валентность каждого — два, общая валентность атомов кислорода (2•5=10) равна 10. Общая валентность мышьяка также должна быть равна десяти. Число атомов мышьяка в соединении — два: 10: 2 = 5. Следовательно, каждому атому мышьяка соответствуют 5 единиц. Валентность мышьяка в соединении — 5;
Валентность мышьяка в соединении — 5;
2) — 21•2, 2:2=1. Медь одновалентна;
3) — 2•3 = 6, 6:1=6. Теллур шестивалентен;
4) — 1•2 = 2, 2:1 = 2. Селен двухвалентен;
5) — 2 • 7 = 14, 14 : 2 = 7. Хлор семивалентен;
6) КН — 1•1 = 1, 1 : 1 =1. Калий одновалентен.
2. Составление формулы вещества, состоящего из двух элементов, валентности которых известны.
Пример №4
Составьте формулу оксида фосфора (V), зная, что фосфор пятивалентен, кислород двухвалентен.
Решение:
1) запишем символы фосфора и кислорода — РО;
2) запишем валентности элементов римскими цифрами над их символами — ;
3) определим самое малое общее делимое чисел, выражающих валентности, то есть пяти и двух. Оно равно десяти;
4) чтобы найти число атомов элементов в формуле, разделим общее делимое на валентности элементов: фосфор — 10 : 5 = 2; кислород — 10:2 = 5. Следовательно, в соединении фосфор представлен двумя, а кислород — пятью атомами.
5) запишем найденные числа атомов в индексе химических символов – .
Пример №5
Определите валентность углерода в оксиде углерода (IV). Решение. Валентность кислорода в соединении равна двум, углерода — m. Если известны формула соединения и валентность (n) одного из элементов, валентность (m) второго можно определить по формуле
Например, валентность углерода в , равна ; валентность кислорода —n = 2, число атомов кислорода — у = 2, число атомов углерода — х = 1.
Количество веществаОпределение количества вещества, если известна его масса, или нахождение его массы, если известно количество вещества.
Пример №6
Вычислите количество вещества в 49 г серной кислоты.
Решение.
1) = 98 г/моль;
2) вычислим количество вещества n по формуле
Ответ: 0,5 моля.
Пример №7
Сколько граммов составляют 5 молей оксида меди(||)?
Решение.
1) М (СuО) = 64+ 16- 80 г/моль;
2) найдем массу вещества по формуле
Ответ: 5 молей СuО равны 400 г.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул (
Таблица 3
Молярные объемы некоторых газообразных веществ
| Вещество | Молярная масса, г/моль | Молярный объем, л | Число молекул | |
| 2 | 2 | 22,4 | 6,02• | |
| 44 | 44 | 22,4 | 6,02• | |
| 71 | 71 | 22,4 | 6,02• |
Плотность газа определятся по формуле , а относительная плотность газа — по формуле .
1. Определение объема газов.
Пример №8
Какой объем (л, ну) займут 22 г углекислого газа?
Решение:
1) – 44 г/моль;
2) вычислим объем 22 г с помощью пропорции: 44 г занимают объем 22,4 л, 22 г — займут х л объема,
Ответ: 22 г занимают объем 11,2 л.
Определив количество вещества в 22 г углекислого газа, зная, что 1 моль любого газа занимает объем 22,4 л (н.у.), найдем
моля.
Если 1 моль газа занимает объем 22,4 л, то 0,5 моля — 11,2 л.
Пример №9
Каким будет объем 90 г воды, переведенной в газообразное (пар) состояние при 20°С ?
Решение. Жидкие и твердые вещества при переходе в газообразное состояние подчиняются тем же законам, что и газы. Поэтому:
1) М() = 18 г/моль;
2) рассчитаем объем 90 г воды в газообразном состоянии с помощью пропорции:
18 г (пар) занимают объем 22,4 л,
90г (пар) — х л объема,
Ответ: объем 90 г водяного пара — 112 л.
Пример №10
Определите массу 7,84 м3 смеси, содержащей 71,45% метана и 28,55% оксида углерода (II).
Решение:
1) сколько метана и оксида углерода (II) содержится в 7,84 м3 смеси?
3)найдем массу 5,6 м3 СН4 с помощью пропорции: 22,4 м3 СН4 – 16 кг,
4) найдем массу 2,24 м3 СО с помощью пропорции: 22,4 м3 СО – 28 кг,
5) общая масса смеси газов: 4 кг + 2,8 кг = 6,8 кг.
Ответ: общая масса смеси газов — 6,8 кг.
Пример №11
Рассчитайте количество вещества и число молекул в 1 л воды при 20°С .
Решение:
1) найдем массу 1 л воды. Плотность воды — 1 г/см3. Отсюда т{) = 1000 см3 • 1 г/см3 = 1000 г;
2) вычислим количество вещества в 1000 г воды:
моль.
3) определим число молекул в 1 л (в 1000 г, или 55,56 моля) воды с помощью пропорции: в 1 моле воды — 6,02• молекул, в 55,56 молях воды — х молекул,
Ответ: в 1 л воды содержится 55,56 моля, 334,4 • или 3,344 • молекул.
Пример №12
Какой объем (л,н.у.) займут 16 г оксида серы (IV)?
Решение:
1) найдем количество вещества в 16 г :
.
2) вычислим, какой объем займут 16 г (или 0,25 моля) с помощью пропорции:
Ответ: 16 г займут 5,6 л объема.
Вычисление плотности газовПлотность газов определяется путем деления их молярной массы на молярный объем:
Пример №13
Рассчитайте плотность углекислого газа.
Решение:
Ответ: плотность углекислого газа — 1,96 г/л.
Пример 2. Рассчитайте молярную массу газа с плотностью р = 2,86 г/л.
Решение.
Из формулы
Ответ: молярная масса газа с плотностью 2,86 г/л —64 г.
Вычисление относительной плотности газовПример №14
Вычислите плотность метана относительно водорода.
Решение:
1) рассчитаем молекулярные массы метана и водорода:
2) определим плотность метана относительно водорода:
Ответ: плотность метана относительно водорода равна 8, или метан тяжелее водорода в 8 раз.
Пример №15
Определите относительную плотность газовой смеси, содержащей 40% угарного газа и 60 % углекислого газа.
Решение:
1) найдем среднюю молекулярную массу газовой смеси.
2) вычислим плотность газовой смеси относительно водорода:
Ответ: плотность газовой смеси относительно водорода равна 18,8. Пример 3. В процессе производства азотного удобрения на Ферганском производственном объединении “Азот” в качестве промежуточного вещества образуется оксид азота (IV). Найдите плотность оксида азота (IV) относительно воздуха.
Решение:
1) молекулярная масса оксида азота (IV)
M() = 46 г/моль.
Средняя молекулярная масса воздуха — 29 г/моль;
2) вычислим плотность оксида азота (IV) относительно воздуха:
Ответ: плотность оксида азота (IV) относительно воздуха равна 1,59.
Пример №16
Плотность пара белого фосфора относительно гелия равна 31. Рассчитайте молекулярную массу белого фосфора.
Решение.
Из формулы
следует, что М(белый фосфор) = • М (Не) = 31•4 = 124 г/моль.
Ответ: молекулярная масса белого фосфора равна 124.
Закон эквивалентности
Химические элементы присоединяются друг к другу или замещаются в весовых количествах, пропорциональных своим эквивалентам (закон эквивалентности).
Эквивалентностью элемента называется количество этого элемента, присоединяющего или замещающего 1 моль или 1 г атомов водорода.
Отношение относительной атомной массы элемента к его валентноcти есть эквивалентность этого элемента:
Эквивалентность оксида выражается формулой: где — молекулярная масса оксида; V — валентность элемента, образующего оксид; n — число атомов элемента, образующего данный оксид.
Эквивалентность оснований выражается формулой:
где — молекулярная масса основания; n(ОН) — число гидроксильных групп в основании.
Эквивалентность кислот выражается формулой: где — молекулярная масса кислоты;
n(H) — число атомов водорода, замещаемых металлом, содержащимся в кислоте.
Эквивалентность солей выражается формулой: где — молекулярная масса соли; V — валентность металла, образующего соль; n — число атомов металла, образующего соль.
Пример №17
Определите эквивалентность железа в двух- и трехвалентных соединениях.
Решение:
1) найдем эквивалентность железа в двухвалентных соединениях:
2) найдем эквивалентность железа в трехвалентных соединениях:
Ответ: эквивалентность железа в двухвалентных соединениях равна 28, в трехвалентных соединениях — 18,67 г/моль.
Пример №18
47,26 г меди, соединяясь с 52,74 г хлора, образуют соль хлорид меди (II). Рассчитайте эквивалентность меди, зная, что эквивалентность хлора равна 35,45 г/моль.
Рассчитайте эквивалентность меди, зная, что эквивалентность хлора равна 35,45 г/моль.
Решение:
1) уточним условия задачи:
2) определим эквивалентность меди, пользуясь формулой
Ответ: эквивалентность меди равна 31,8 г/моль.
Энергетические явления в химических реакциях
Во всех химических реакциях происходит выделение или поглощение энергии.
Реакции, сопровождающиеся выделением теплоты, называются экзотермическими.
Реакции, сопровождающиеся поглощением теплоты, называются эндотермическими.
Количество теплоты, которое выделяется или поглощается при образовании из простых веществ 1 моля сложного вещества, называется теплотой образования вещества. Теплота разложения любого сложного вещества на простые вещества равна его теплоте образования и выражается противоположным знаком (закон Лавуазье и Лапласа).
Например: Тепловой эффект реакций обусловлен природой исходных веществ и образовавшихся продуктов и не имеет отношения к промежуточным этапам реакции (закон Гесса).
Пример №19
Для приготовления пищи в школьной столовой израсходовано 100 л метана (метан — основной компонент природного газа). Сколько тепла выделилось при сгорании 100 л метана? Тепловой эффект реакции горения метана равен + 880 кДж/моль.
Решение.
При полном сгорании 1 моля метана (22,4 л) выделяется 880 кДж тепла. Сколько тепла выделится при сгорании 100 л метана?
Ответ: при сгорании 100 л метана выделяется 3928 кДж.
Пример №20
Рассчитайте тепловой эффект реакции горения аммиака. Известно, что теплота испарения воды 241,88 кДж/моль, теплота образования — 46,2 кДж/моль.
Решение.
Запишем реакцию горения аммиака:
Найдем тепловой эффект реакции горения аммиака на основе закона Гесса. Для этого из суммы теплоты образования продуктов реакции вычтем сумму теплоты образования веществ, взятых в реакцию (примем, что теплота образования простых веществ равна нулю).
Ответ: 633,24 кДж.
Как определить формулу вещества
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.
 Массовая доля химического элемента: что означает и как высчитывается
Массовая доля химического элемента: что означает и как высчитываетсяМассовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
Разберем примеры решения задач с использованием общей молекулярной формулы вещества.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?
4.
 2. Как определить формулу органического соединения
2. Как определить формулу органического соединенияпо продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.
5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Определение формулы соли в тестах ЕГЭ
Задача 114.
В 20 г сульфата некоторого металла содержится 4,5 г атомов серы. Определите формулу соли, если известно, что металл проявляет в этом соединении степень окисления (+1).
Дано: масса образца сульфата некоторого металла: m(соли) = 20 г; масса серы в образце: m(S) = 4,5 г; степень окисления неизвестного металла: +1.
Найти: формулу сульфата.
Решение:
Для идентификации металла необходимо определить его молярную массу. Здесь возможны 2 способа решения.
I способ (последовательно-разветвленный алгоритм).
Схематично алгоритм данного способа можно записать следующим образом:
Применим предложенный алгоритм.
1) m(S) → m(SО4)2–
По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SO4)2–. В кислотном остатке серной кислоты (SО4)2– соотношение атомов строго определено уже известными индексами. Поэтому мы легко сможем определить массу кислотного остатка в 20 г сульфата металла по массе серы:
М(SО4)2– = М(S) . 1 + М(О) . 4 = 32 . 1 + 16 . 4 = 96 г/моль.
1 + М(О) . 4 = 32 . 1 + 16 . 4 = 96 г/моль.
Масса 1 моль кислотного остатка (SО4)2– составляет 96 г1.
Составим пропорцию:
вклад серы в 96 г ионов (SО4)2– составляет 32 г (по молярной массе)
вклад серы в х г ионов (SО4)2– составляет 4,5 г (по условию)
2) m(SО4)2– → n(SО4)2–
Находим количество вещества ионов (SО4)2–
3) n(SО4)2– → n(Me+)
Находим количество вещества ионов Ме+, соответствующее содержанию ионов кислотного остатка n(SО4)2– = 0,141 моль. Используя формулу Ме2+(SО4)2–, составим пропорцию:
на 2 моль ионов Ме+ приходится 1 моль ионов (SО4)2– (по индексам в формуле)
на х моль ионов Ме+, приходится 0,141 моль ионов (SО4)2– (по условию)
4) m(SО4)2– → m(Me)+
Находим массу металла в 20 г соли Ме2SО4.
m(Ме+) = m Ме2+(SО4)2– – m(SО4)2– = 20 – 13,5 = 6,5 г.
5) Находим молярную массу атомов металла
В данном случае молярную массу ионов металла можно приравнять к молярной массе незаряженных атомов:
М(Ме+) = М(Ме) = 23 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 23г/моль. Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
II способ (встречный алгоритм).
Схематично алгоритм данного способа можно записать следующим образом:
Применим данный алгоритм.
1) По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SО4)2–
2) По массе серы в образце определяем ее количество вещества:
3) По записи формулы сульфата Ме2+моль ионов Ме+ содержится в 20 г соли Ме2SO4 видно, что количество вещества серы равно количеству вещества соли:
n(S) = nМе2+(SО4)2–. = 0,141 моль.
= 0,141 моль.
4) По значениям количества вещества и массы образца сульфата определяем значение молярной массы соли:
5) Записываем выражение для определения молярной массы для сульфата металла, исходя из значений молярных масс элементов:
М(Ме2+(SО4)2–) = М(Ме) . 2 + М(S) .1 + М(О) . 4 =
= М(Ме) . 2 + 32 . 1 + 16 . 4 = [М(Ме) . 2 + 96] г/моль.
6) Приравниваем полученное выражение к значению молярной массы соли, полученному в четвертом действии:
М(Ме) . 2 + 96 = 142.
Получили одно математическое уравнение с одним неизвестным. Его решение дает нам молярную массу искомого металла: М(Ме) = 23 г/моль.
По таблице Д. И. Менделеева находим элемент, имеющий молярную массу 23 г/моль.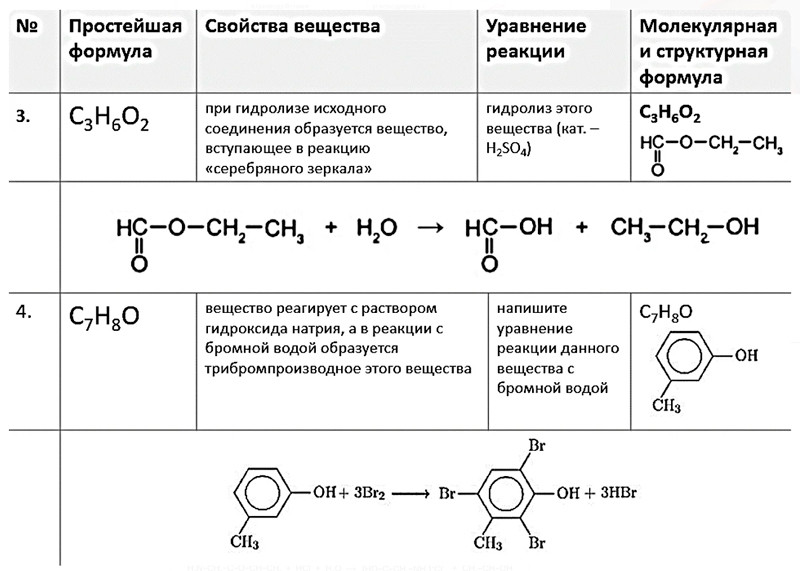 Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
III способ (встречный алгоритм).
Графический алгоритм данного способа будет следующим:
Применим данный алгоритм.
1) По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SО4)2–. Записываем значение молярной массы для этого вещества:
М(Ме2+(SО4)2–) = М(Ме) . 2 + М(S) . 1 + М(О) .4 =
= М(Ме) . 2 + 32 . 1 + 64 . 4 = (М(Ме) . 2 + 96) г/моль.
Вклад серы в общую массу 1 моль Ме2+(SО4)2– составляет:
М(S) . 1 = 32 . 1 = 32 г.
Выбираем в качестве образца массу 1 моль Ме2+(SО4)2–:
M(Ме2+(SО4)2–) = (М(Ме) .2 + 96) г
Масса серы в этом выбранном образце: m(S) = 32 г.
2) Составляем пропорцию:
(М(Ме) . 2 + 96) г Ме2+(SО4)2– содержит 32 г (S) (по молярной массе)
20 г Ме2+(SО4)2– содержит 4,5 г (S) (по условию)
3) Из пропорции получаем уравнение с одним неизвестным:
(M(Ме) . 2 + 96) .4,5 = 20 . 32
4) Решая уравнение, получаем значение молярной массы искомого металла:
М(Ме) = 23,1 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 23,1 г/моль. Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
Ответ: Nа2SО4.
Комментарии:
1 Молярную массу любых ионов можно считать точно так, как и молярную массу нейтральных частиц. Молярная масса любого иона отличается от молярной массы такой же незаряженной частицы на массу нескольких электронов. Если заряд иона «+n», то М(иона) < М(незаряженной частицы) на массу n электронов, если заряд иона «-n», то M(иона) > М(незаряженной частицы) на массу n электронов. Так как масса электрона значительно меньше (в 1840 раз) массы даже самого легкого атома водорода, не говоря уже о более тяжелых атомах других металлов, то массой электронов при подсчете молярной массы можно пренебречь и считать условно, что M(иона) = М(незаряженной частицы).
Решение логических задач — как решать задачи на логику
Логика – это основа рационального мышления и фундамент для развития интеллекта ребенка. Решение различных логических задач дает возможность детям научиться анализировать ситуацию, находить взаимосвязи, отличать главное и второстепенное, формировать стратегию, применять в нужном месте свои знания и навыки.
Решение различных логических задач дает возможность детям научиться анализировать ситуацию, находить взаимосвязи, отличать главное и второстепенное, формировать стратегию, применять в нужном месте свои знания и навыки.
Эти умения пригодятся не только в учебе, но и в реальной жизни. Рассуждая логически, ребенок может грамотно выразить свое мнение, подойти к решению той или иной задачи более осознанно, дать обоснование всевозможным явлениям, быстро сориентироваться в ситуации.
Поэтому решение логических задач должно быть неотъемлемой частью детского развития и образования. А для того, чтобы щелкать их как орешки, нужно понимать, какими приемами и методами пользоваться при решении.
Самое главное в решении логических задач
Почти у любой задачи есть несколько вариантов решения. Чтобы легко справляться даже с самыми непростыми заданиями, надо знать, какой способ будет наиболее подходящим в той или иной ситуации.
Понимание разных методов позволяет находить оптимальный вариант решения, что особенно важно в условиях ограниченного времени.
Все задачи на развитие логики можно разделить на группы:
- Математические ребусы;
- Задачи на истинность утверждений;
- Задачи на перемещение, взвешивание или переливание;
- Задачи, которые решаются с конца;
- Работа с множествами;
- Задачи на сопоставление «Кто есть кто?»
Выбор способа решения зависит от того, к какой группе относится задание.
Известные техники решения логических задач
- Табличный метод (таблицы соответствий, истинности, совмещенные, кубические):
таблицы создают наглядность, прозрачность рассуждений, помогают сделать верные выводы. - Применение законов из алгебры логики: вводятся обозначения для простых высказываний и преобразовываются в некую формулу.
- Метод рассуждений: подходит для решения простых задач с небольшим количеством объектов. Последовательное рассуждение над каждым условием задачи приводит к правильному выводу.
- Черчение блок-схем: способ, подходящий для решения задач на переливание, взвешивание.
 Рисуется схема, на которой отмечают последовательность действий и результат, полученный при их выполнении.
Рисуется схема, на которой отмечают последовательность действий и результат, полученный при их выполнении. - Графический метод: подходит для решения задач на объединение или пересечение множеств. Самый популярный графический метод называется «Круги Эйлера». Нарисованная геометрическая схема наглядно показывает отношение между множествами.
- Метод «математический бильярд»: используется для решения задач на переливание жидкостей. Вычерчивается траектория движения бильярдного шара, который отталкивается от бортов стола в форме параллелограмма.
Рассмотрим подробно самые распространенные способы, которые могут использовать в решении логических задач ученики начальных классов:
Табличный метод
Условия задачи и результаты записываем в специальную таблицу. На пересечении строк и столбцов ставим «+», если утверждения не противоречат друг другу и «-», если они расходятся.
Задача:
У Сони, Маши, Антона, Кости и Юры есть домашние животные. У каждого из ребят живет или собака, или кошка, или попугай. Вот только девочки собак не держат, а у мальчиков нет попугаев. У Сони и Маши разные питомцы, а вот у Маши с Антоном – одинаковые. У Сони нет кошки. У Кости с Юрой живут одинаковые животные, а у Антона с Костей – разные. Какие животные живут у каждого?
У каждого из ребят живет или собака, или кошка, или попугай. Вот только девочки собак не держат, а у мальчиков нет попугаев. У Сони и Маши разные питомцы, а вот у Маши с Антоном – одинаковые. У Сони нет кошки. У Кости с Юрой живут одинаковые животные, а у Антона с Костей – разные. Какие животные живут у каждого?
Решение:
Чертим таблицу, где названия столбцов – имена ребят, а названия строк – животные. Ставим в каждой ячейке знаки «+» или «-», опираясь на условия задачи:
1. Девочки собак не держат (ставим «-» на пересечении этих ячеек).
2. У мальчиков нет попугаев (в этих ячейках тоже ставим «-»).
3. У Сони нет кошки (ставим «-»).
4. Значит, у Сони есть попугай (ставим «+»).
5. У Сони и Маши разные питомцы. Получается, у Маши нет попугая (ставим «-»), зато есть кошка (ставим «+»).
6. У Маши с Антоном одинаковые животные. Значит, у Антона тоже живет кошка (ставим «+») и нет собаки (ставим «-»).
7. У Антона с Костей разные питомцы, выходит, что у Кости нет кошки (ставим «-»), зато есть собака (ставим «+»).
8. У Кости с Юрой одинаковые животные, значит у Юры тоже собака (ставим «+»), а не кошка (ставим «-»).
Так мы узнали, какие питомцы живут у каждого из ребят (ячейки со знаком «+»).
Ответ: У Сони попугай, у Маши и Антона кошки, у Кости и Юры собаки.
Круги Эйлера
Чтобы было легче разобраться в условиях задачи и найти решение, чертим круги, каждый из которых – отдельное множество.
Задача:
Всему классу задали на лето читать книжки. В списке литературы были такие произведения, как «Робинзон Крузо» Даниэля Дефо и «Белый клык» Джека Лондона. Известно, что 15 человек из класса прочитали «Робинзон Крузо», а остальные 11 – «Белый клык». Но среди них были 6 ребят, которые прочитали обе книги. Сколько человек прочитало только «Белый клык»?
Решение:
Чертим два круга, каждый из которых – множество детей, прочитавших определенную книгу, а пересечение кругов – дети, прочитавшие обе книги.
1.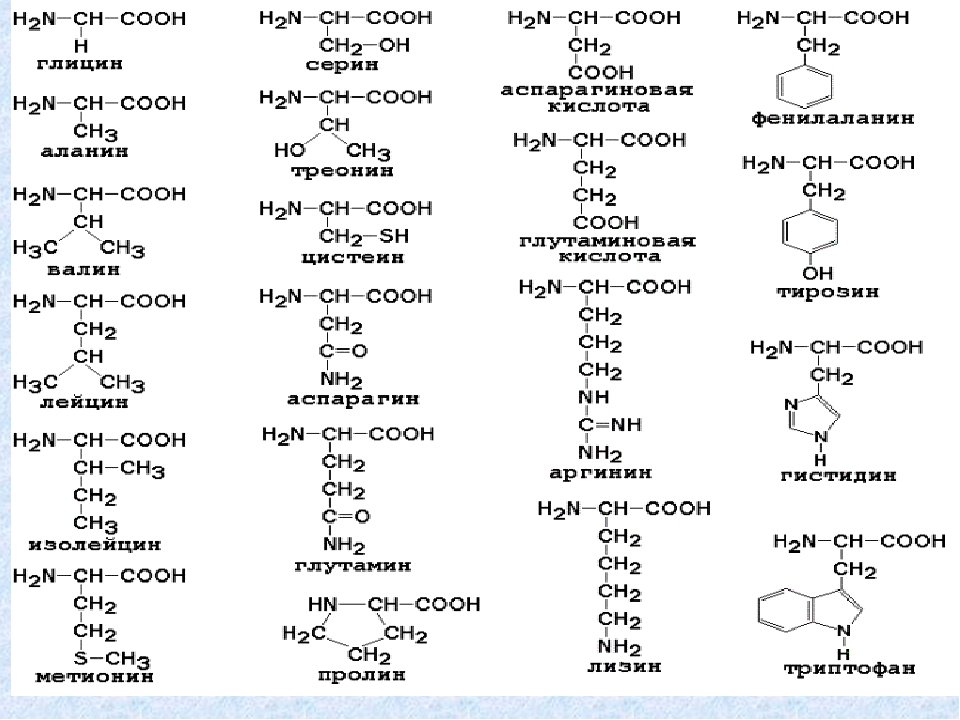 15 – 6 = 9 – дети, которые прочитали только «Робинзон Крузо».
15 – 6 = 9 – дети, которые прочитали только «Робинзон Крузо».
2. 11 – 6 = 5 – дети, которые читали лишь «Белый клык».
Ответ: 5 человек.
Метод рассуждений
Поочередно рассматриваем каждое из условий задачи и делаем логические выводы.
Задача:
На столе стоят вазы: голубая, зеленая, розовая и оранжевая. Третьей в ряду стоит та ваза, название цвета которой содержит больше всего букв. А зеленая стоит между оранжевой и розовой. Какая ваза стоит последней?
Решение:
1. Больше всего букв в слове «оранжевая», значит она третья по счету.
2. Если зеленая ваза стоит между оранжевой и розовой, значит, она будет второй в ряду, так как если ее поставить четвертой, то не останется места для розовой.
3. Соответственно, розовая будет стоять первой.
4. Остается голубая, она будет четвертой, то есть последней.
Ответ: голубая ваза.
Метод рассуждений «с конца»
Начинаем раскручивать клубок с конца, а затем сопоставляем результат с условиями задачи.
Задача:
Маме, папе и сыну вместе 125 лет. Когда родился сын, маме был 21 год. А папа старше мамы на 2 года. Сколько лет сейчас каждому из них?
Решение:
1. 21+2= 23 — было папе ( значит вместе родителям было 44 года)
2. (125 — 44) : 3 = 27 — возраст сына
3. 27 + 21 = 48 — возраст мамы
4. 48 + 2 = 50 — возраст папы
Ответ: 27, 48 и 50 лет.
Мы рассмотрели самые популярные и доступные методы, с помощью которых можно легко справиться с заданием. Главное – подобрать подходящий способ решения, который быстро приведет к правильному результату.
Для этого необходимо регулярно практиковаться и развивать свои способности. Отточить навыки решения подобных логических задач и многих других вы можете с помощью образовательной онлайн-платформы «Умназия».
Попробуйте решить вместе с ребенком задачу из раздела «логика» и переходите к регулярным занятиям на тренажере
Поробуйте решить задачу Умназии прямо сейчас!
Попробовать
Математика
Умназисты соревновались в поедании пирожков. Соревнование длилось ровно 45 минут. За это время все соревнующиеся в сумме съели 179 пирожков.
Соревнование длилось ровно 45 минут. За это время все соревнующиеся в сумме съели 179 пирожков.
Посмотри на информацию о соревнующихся на рисунке. Можешь ли ты сказать, кто из умназистов занял почётное третье место?
Выбери ответ:
Третье место заняла Ума Коала.
Третье место занял Мышлен.
Третье место занял Грамотигр.
Третье место занял Ква-Квариус.
Третье место заняла Сообразебра.
ответить
Логика решения:
Мы знаем, что Мышлен ел по 1 пирожку в минуту, значит за 45 минут соревнования он съел 45 пирожков (1 х 45 = 45).
Если Мышлен съел на 10 пирожков больше, чем Сообразебра, то Сообразебра съела 35 пирожков (45 – 10 = 35).
Если Ума-Коала съела на 5 пирожков меньше, чем Сообразебра, то Ума-Коала съела 30 пирожков (35 – 5 = 30).
Чтобы выяснить, сколько съели Грамотигр и Ква-Квариус, сложим все пирожки, которые съели Мышлен, Ума-Коала и Сообразебра. Получается 45 + 35 + 30 = 110 пирожков.
От общего количества съеденных пирожков вычтем съеденное тремя умназистами: 179 – 110 = 69. Значит, Ква-Квариус и Грамотигр вместе съели 69 пирожков.
Значит, Ква-Квариус и Грамотигр вместе съели 69 пирожков.
Из условия мы знаем, что Грамотигр съел пирожков в 2 раза больше, чем Ква-Квариус.
Допустим, Ква-Квариус съел 23 пирожка, тогда Грамотигр съел в два раза больше, то есть 23 х 2 = 46 пирожков.
Теперь снова сложим их пирожки, чтобы проверить себя: 23 + 46 = 69. Сходится.
Значит, Грамотигр (46 пирожков) занял первое место, Мышлен (45 пирожков) – второе, а Сообразебра (35 пирожков) – третье.
Если вам понравилось, было весело интересно и полезно, то ждем вас на нашей онлайн платформе!
Умназия сегодня — это:
1. Онлайн тренажер развития навыков мышления — логики, внимания, эрудиции.
2. Программа «Культурный код» по развитию кругозора. Для самых любознательных и тех, кого кажется уже ничем не удивить!
3. Курсы развития памяти. Хотите чтобы Ваш ребенок без труда учил стихи, запоминал иностранные слова и всегда помнил про день рождения бабушки? На курсах покажем и расскажем как же этого достичь.
4. Пять ступеней финансовой грамотности. Увлекательная история героя, которая полностью зависит от действий ребенка и не имеет определенного результата. Сможет ли он пройти все финансовые ловушки и освоить пятую ступень?
Ждем вас, будет весело и интересно!
Математика и логика для детей 7-13 лет
Развиваем логическое мышление через решение сюжетных математических задач в интерактивном игровом формате
узнать подробнее
Читайте также:
- 15 сложных загадок на логику
- Загадки на логику с подвохом
- Логические загадки для детей
- Смешные логические загадки
- Загадки Эйнштейна на логику
Таблица химических формул AP® и таблица Менделеева: формулы, которые нужно помнить
Table of ContentsЧто такое AP Chemistry Formula SheetПериодическая таблица элементов
AP® Chemistry — это курс, который охватывает много информации, включая значение и функции нескольких уравнений, констант и периодической таблицы.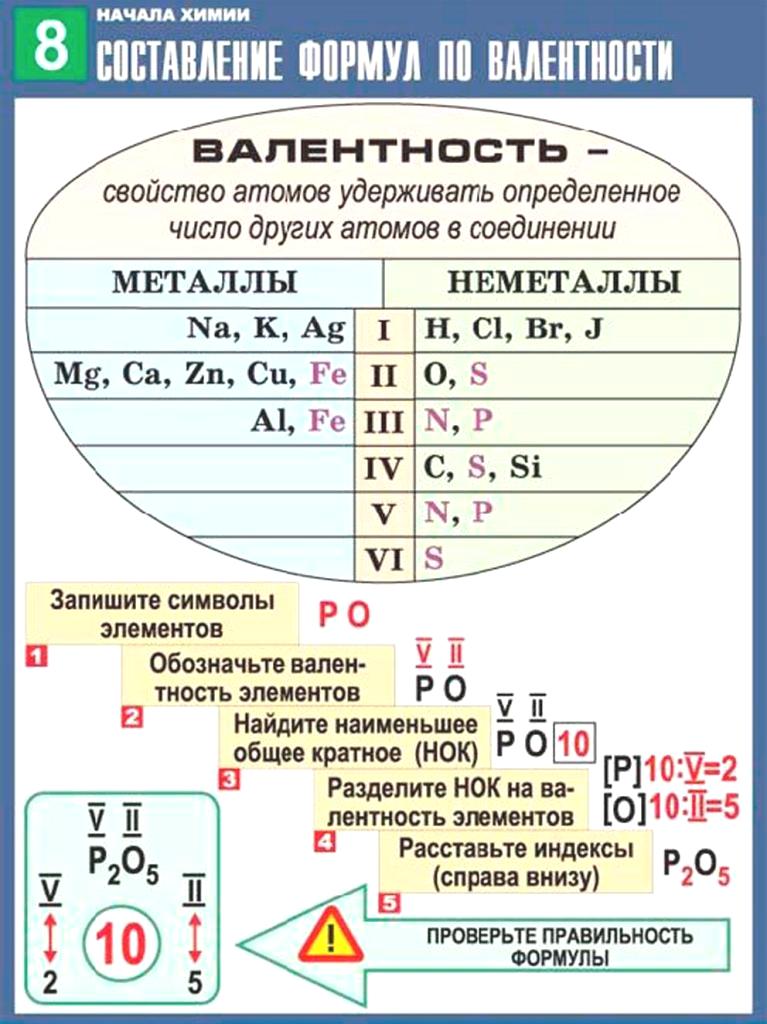 Это может показаться огромным количеством контента, но вы можете расслабиться, потому что вам не нужно запоминать все это!
Это может показаться огромным количеством контента, но вы можете расслабиться, потому что вам не нужно запоминать все это!
Что такое таблица формул AP Chemistry?
Лист формул AP Chemistry занимает две страницы и содержит сокращения единиц измерения, а также уравнения, константы и определения переменных, сгруппированных по темам. Таблица формул AP Chemistry и таблица Менделеева предоставляются в начале экзамена AP Chemistry как с множественным выбором, так и со свободным ответом.
Хотя вам, возможно, не придется запоминать всю информацию, предоставленную вам на листе уравнений AP Chemistry и периодической таблице, вам все же необходимо понимать содержащиеся в нем формулы и переменные, знать, как применять уравнения и понимать значение значений. по периодической таблице. Распечатка периодической таблицы AP Chemistry и таблицы формул AP Chemistry для использования во время практических тестов — отличная подготовка к экзамену.
Использование листа формул AP Chemistry
Чтобы сделать вашу подготовку к экзамену проще и быстрее, мы составили копию листа формул AP Chemistry, который обычно включается в ваш буклет экзамена AP Chemistry. Используйте этот лист при работе с вопросами на практических экзаменах AP Chemistry и ознакомьтесь со структурой уравнений и констант AP Chemistry. Это поможет вам быстро получить доступ к этим формулам при решении проблемы. Это значительно улучшит вашу скорость ответа на вопрос в день экзамена.
Используйте этот лист при работе с вопросами на практических экзаменах AP Chemistry и ознакомьтесь со структурой уравнений и констант AP Chemistry. Это поможет вам быстро получить доступ к этим формулам при решении проблемы. Это значительно улучшит вашу скорость ответа на вопрос в день экзамена.
Ниже приведено все, что вам нужно знать о том, какая информация содержится в таблице уравнений и периодической таблице AP Chemistry.
Единицы с первого взгляда
Ниже приведены единицы измерения, обычно используемые в AP Chemistry. Вы увидите эти аббревиатуры единиц, используемые на экзамене AP Chemistry.
Структура атома
Структура атома исследует состав атома, его электронную структуру и то, что происходит во время электронных переходов, когда фотон поглощается или испускается. Уравнения и константы, связанные с этими идеями, представлены в разделе «Атомная структура» листа уравнений AP Chemistry.
Энергия фотона уравнения
- Уравнение (1) показывает, как энергия E фотона связана с постоянной Планка h и частотой ν .

- Уравнение (2) связывает скорость света c с длиной волны λ и частотой ν .
Константы (числовое значение, которое всегда одинаково и не меняется), такие как постоянная Планка, скорость света, число Авогадро и заряд электрона.
Химия AP® — это сложно, но мы можем помочь.
Учитесь по расписанию, в своем темпе и по доступной цене.
Равновесие
Равновесие фокусируется на обратимых реакциях, включая некоторые кислотно-основные реакции, и на том, как изменение условий реакции влияет на направление реакции. Выполнение расчетов с использованием константы равновесия K и понимание того, что значение K подразумевает в отношении равновесных концентраций, необходимы для успешной сдачи экзамена AP Chemistry.
Раздел «Равновесие» листа формул AP Chemistry дает несколько уравнений, необходимых для задач, связанных с равновесной или кислотно-основной химией.
Константа равновесия K уравнения
- K определяется как отношение либо равновесных молярных концентраций, либо парциальных давлений продуктов над реагентами, где каждое возводится в степень соответствующего стехиометрического коэффициента (число перед продуктом или реагентом в сбалансированном уравнении реакции).

- Уравнение (1) определяет K c , константу равновесия при использовании равновесных молярных концентраций.
- Уравнение (2) определяет K p , константу равновесия при использовании парциальных давлений.
Уравнения кислотно-основной химии
- Константа равновесия для кислоты или основания представляет собой отношение равновесных концентраций ионов продукта к неионизированному реагенту. Это значение описывает силу кислоты или основания.
- Уравнение (3) определяет константу кислотного равновесия K a .
- Уравнение (4) определяет базовую константу равновесия K b .
- Уравнение (5) показывает автоионизацию воды K w .
- Уравнение (6) определяет, как рассчитать кислотность (pH) раствора, используя концентрацию ионов водорода [H + ].

- Уравнение (7) показывает, как рассчитать основность (pOH) раствора, используя концентрацию ионов гидроксида [OH – ].
- Уравнение (8) показывает, как в числовом выражении связаны pH и pOH.
- Уравнение (9) представляет собой уравнение Хендерсона-Хассельбаха, полученное из выражения K a и использующее pH, p K a и отношение концентраций сопряженного основания [A – ] и кислоты [HA].
- Уравнение (10) показывает, как выразить K a через p K a .
- Уравнение (11) в этом разделе показывает, как выразить K b через p K b .
Кинетика
Кинетика фокусируется на скорости реакции или на том, как быстро происходит химическая реакция. Скорость реакции описывается законом скорости, а константа скорости k , используемая в выражениях закона скорости, рассчитывается путем измерения изменения концентрации реагентов во времени.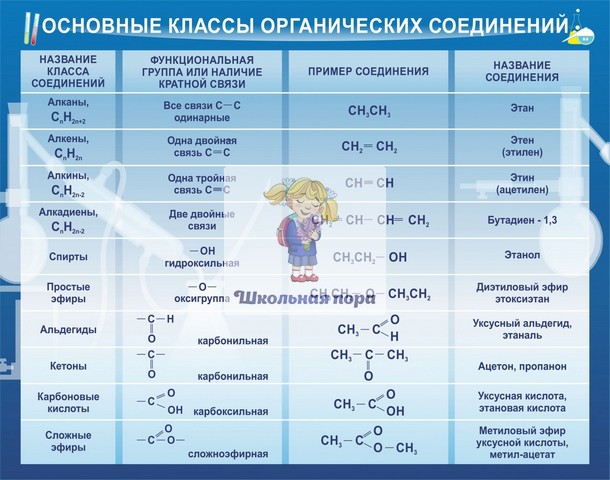 Данные, полученные в результате измерения изменения концентрации реагентов во времени, наносятся тремя способами, и один из трех графиков будет линейным, что указывает на порядок реакции.
Данные, полученные в результате измерения изменения концентрации реагентов во времени, наносятся тремя способами, и один из трех графиков будет линейным, что указывает на порядок реакции.
Раздел «Кинетика» таблицы уравнений экзамена AP Chemistry содержит различные уравнения, которые можно использовать для расчета константы скорости k в зависимости от порядка реакции.
Интегральные уравнения скоростей
- Используя Уравнение (1) , можно вычислить k для реакций нулевого порядка.
- Используя Уравнение (2) , вы можете рассчитать k для реакций первого порядка.
- Использование Уравнение (3) , можно рассчитать k для реакций второго порядка.
Уравнение периода полураспада
- Период полураспада t 1/2 реакции – это время, за которое концентрация реагентов уменьшается вдвое.
- Уравнение (4) позволяет вам рассчитать k для реакций первого порядка, если вы знаете t 1/2 реакции.

Газы, жидкости и растворы
Вещество существует в различных состояниях (т. е. твердое, жидкое или газообразное), и твердые вещества можно растворить в жидкости, чтобы получить раствор. Различные состояния вещества и растворов проявляют различные макроскопические (то есть «крупномасштабные») свойства, такие как давление, плотность, температура и концентрация.
Раздел «Газы, жидкости и растворы» таблицы уравнений AP Chemistry содержит несколько уравнений, используемых для расчета различных макроскопических свойств газов, жидкостей и растворов, а также различные константы, используемые в этих уравнениях.
Уравнения газа
- Уравнение (1) — это закон идеального газа, который иллюстрирует поведение идеального газа и используется для предсказания поведения реального газа. Закон идеального газа показывает, что давление P и объем V прямо пропорциональны количеству молей газа n и температуре T .

- Уравнение (2) использует мольную долю X A и полное давление P Всего в контейнере для расчета парциального давления одного компонента P A в образце.
- Уравнение (3) показывает, что общее давление P total в контейнере представляет собой сумму парциальных давлений каждого компонента ( P A , P B и т. д.) в образце.
- Уравнение (4) показывает, как рассчитать количество молей n вещества, используя массу м и молярная масса м этого вещества. Это уравнение не ограничивается использованием в газовых уравнениях. Несколько различных типов расчетов требуют n , включая концентрацию раствора.
Уравнения молекулярного движения
- Уравнение (5) показывает, как преобразовать температуру T в градусах Цельсия (°C) в Кельвины (K). Важно знать, что делать с уравнениями, требующими температуры Кельвина, такими как закон идеального газа.

- Уравнение (7) показывает, как масса m и скорость v используются для расчета кинетической энергии KE молекулы.
Решения уравнений
- Уравнение (6) показывает, что плотность D вещества есть отношение массы m к объему V.
- Уравнение (8) описывает, как рассчитать концентрацию (молярность) раствора, используя количество молей растворенного вещества и объем раствора.
- Уравнение (9) в этом разделе представляет собой закон Бера, который используется в УФ-видимой спектроскопии (измерении поглощения УФ-видимого света раствором при разных длинах волн). Закон Бера описывает взаимосвязь между коэффициентом поглощения A, молярным коэффициентом поглощения ε, длиной пути b сосуда, через который проходит свет, и концентрацией раствора c.
Константы
Даны три значения газовой постоянной R (используемой в законе идеального газа). Единственная разница между каждым значением заключается в единицах давления. Вы можете использовать любое из этих значений в уравнении закона идеального газа, если единицы давления для значения R соответствует единицам давления для P .
Вы можете использовать любое из этих значений в уравнении закона идеального газа, если единицы давления для значения R соответствует единицам давления для P .
Откладываете подготовку к экзамену AP?
Хотите учиться, но не можете сосредоточиться? Сделайте UWorld своим компаньоном.
Также приведены условия СТП (стандартная температура и давление) и молярный объем идеального газа при СТП.
Термодинамика/электрохимия
Термодинамика фокусируется на связи между свободной энергией Гиббса G , энтальпией H и энтропией S , и как изменение стандартной свободной энергии Гиббса Δ G ° связано с благоприятностью химической реакции.
Электрохимия охватывает гальванические и электролитические элементы, как определить стандартный потенциал элемента E ° и свободную энергию элемента, а также как применить уравнение Нернста и закон Фарадея.
Последний раздел листа формул AP Chemistry содержит несколько уравнений и констант, используемых в задачах, связанных с термодинамикой и электрохимией.
Уравнения термодинамики
- Уравнение (1) используется для определения количества тепла q поглощаемого или выделяемого веществом и требует знания массы вещества m , удельной теплоемкости этого вещества c , а изменение температуры Δ T (т.е. T конечное − T начальное ) в ℃. Это уравнение часто используется в задачах калориметрии.
- Уравнение (2) показывает, что стандартное изменение энтропии Δ S ° для реакции рассчитывается путем вычитания суммы стандартных энтропий продуктов S ° продуктов из суммы стандартных энтропий реагенты S ° реагенты .
- Уравнение (3) используется для расчета стандартного изменения энтальпии Δ H ° для реакции. Δ H ° определяется вычитанием суммы стандартных энтальпий образования продуктов Δ H f ° продуктов из суммы стандартных энтальпий образования реагентов Δ H f ° реагентов .

- Уравнение (4) показывает, что стандартное изменение свободной энергии Гиббса Δ G ° для реакции находится вычитанием суммы стандартных свободных энергий образования продуктов Δ G f ° произведения из суммы стандартных свободных энергий образования реагентов Δ H f ° реагенты .
- Не забудьте умножить значения S °, Δ H f ° и Δ G f ° из сбалансированного уравнения реакции на стехиометрический коэффициент .
- Уравнение (5) связывает стандартное изменение свободной энергии Гиббса Δ G ° с изменениями энтальпии Δ H °, энтропии Δ S °, а температура Δ T .
- Уравнение (6) связывает стандартное изменение свободной энергии Гиббса Δ G ° и константу равновесия K .
Уравнения электрохимии
- Уравнение (7) показывает, как рассчитать Δ G ° электрохимической ячейки, используя число переданных электронов n , стандартную ячейку и потенциал Фарадея F Е °.

- Уравнение (8) дает взаимосвязь между током I , зарядом q и временем t . Это уравнение используется вместе с законом Фарадея в задачах, связанных с электролизом.
- Уравнение (9) представляет собой уравнение Нернста, которое используется для определения E ячейки в нестандартных условиях (стандартными условиями являются концентрации раствора 1 М, давление в системе 1 атм и температура 25 ℃).
Константы
Приведена постоянная Фарадея F , которая используется в некоторых расчетах Δ G ° и уравнения Нернста. Дано соотношение между вольтами, джоулями и кулонами.
Периодическая таблица элементов
Вам также предоставляется периодическая таблица элементов для справки на экзамене AP по химии. Периодическая таблица содержит ценную информацию, которую вы будете использовать для решения различных задач на экзамене. Ниже приведены компоненты, содержащиеся в каждом квадрате периодической таблицы, и некоторые особенности периодической таблицы AP Chemistry, с которыми вы должны быть знакомы в день экзамена.
- Каждый квадрат периодической таблицы содержит
- Атомный номер в верхней части квадрата. Это значение соответствует количеству протонов в ядре.
- Уникальный одно- или двухбуквенный химический символ для соответствующего элемента в центре квадрата.
- Внизу квадрата находится атомная масса (молярная масса) , выраженная в а.е.м. или г/моль. Это значение говорит вам о массе одного моля элемента.
- Номер группы расположен в верхней части каждого столбца периодической таблицы.
Поздравляем! Вы завершили обзор важных уравнений, констант и частей периодической таблицы на листе уравнений, который выдали вам на экзамене AP Chemistry. Вы будете готовы решать проблемы с помощью таблицы уравнений с уверенностью и опытом! Просто помните, чтобы успешно сдать экзамен AP Chemistry, важно знать как структуру листа формул, так и то, как применять уравнения и константы к любым математическим задачам, с которыми вы сталкиваетесь.
Не откладывайте подготовку к экзаменам AP!
Позвольте нам помочь вам раскрыть секрет успеха AP. Учитесь умнее с визуальным обучением.
Узнайте больше о программе AP Chemistry
Учебное пособие и материалы программы AP Chemistry
Хотите узнать о стратегиях начисления очков для поступления в элитные школы? Посетите наше созданное экспертами учебное пособие AP Chem со всеми необходимыми ресурсами для успешной сдачи экзамена.
Описание курса и экзамена AP Chem
Хотите знать, как выглядит каждый раздел, тема и концепция в AP Chemistry? Узнайте о каждом из 9единиц, 4 больших идеи и 6 лабораторных работ в нашем CED AP Chemistry.
Формат экзамена AP по химии
Формат экзамена AP может сбивать с толку. Ознакомьтесь с нашей статьей о формате экзамена AP по химии, в которой объясняется формат экзамена, типы вопросов и многое другое!
Об экзамене AP Chemistry
Хотите лучше понять курс и экзамен AP Chem? Мы составили список часто задаваемых вопросов, а также ценную информацию об AP Chemistry.
Скорость реакции и как определить закон скорости
Некоторые реакции будут идти быстро, а некоторые будут идти медленно – скорость реакции равна скорости реакции , которая определяется законом скорости . В этой статье мы узнаем о скорости реакции, законах скорости, константе скорости и порядке реакции.
Скорость химической реакции определяется и изменяется многими факторами, включая природу (реактивность) реагентов, площадь поверхности, температуру, концентрацию и катализаторы. Для каждой уникальной химической реакции закон скорости можно записать за 9 секунд.0603 уравнение закона скорости , чтобы показать, как концентрации реагентов влияют на скорость реакции. Важно отметить, что закон скорости можно определить только экспериментально !
Что такое тарифный закон? Уравнение закона скорости
Скорость реакции может зависеть от концентрации наших реагентов. Закон скорости химической реакции представляет собой уравнение, описывающее зависимость между концентрациями реагентов в реакции и скоростью реакции. В стандартной форме уравнение закона скорости записывается как:
В стандартной форме уравнение закона скорости записывается как:
R = k [A] n [B] m
- R – скорость реакции, выраженная в концентрации в единицу времени (обычно М/с = молярность /секунда)
- k – удельная константа скорости
- A и B – молярные концентрации реагентов, выраженные в М (моль растворенного вещества/л раствора)
- n и m – порядки реакции
Давайте разберем каждый из этих компонентов.
Скорость реакции
R = k [A] n [B] m
Как упоминалось ранее, на скорость реакции влияет множество факторов. Вот почему каждая химическая реакция имеет уникальный закон скорости — каждая реакция имеет разный набор реагентов, а также разные экспериментальные условия, влияющие на скорость реакции.
Скорости реакции определяются как концентрация продукта, образующегося по мере протекания реакции с течением времени, поэтому они обычно выражаются в молярности/времени в секундах (М/с).
Константа удельной скорости
R = k [A] n [B] m
Каждая реакция имеет свою константу в уравнении скорости. Удельная константа скорости ( k ) является константой пропорциональности, уникальной для каждой экспериментальной реакции. Это означает, что его значение зависит от других факторов эксперимента, влияющих на скорость реакции, таких как температура. Даже с одними и теми же соединениями, используемыми в реакции, k может измениться при изменении других факторов, влияющих на скорость.
Кроме того, единицы конкретной константы скорости зависят от порядка реакции. Это будет обсуждаться более подробно позже.
Молярные концентрации реагентов
R = k [A] n [B] m
Закон скорости реакции использует молярные концентрации реагентов. Как правило, увеличение концентрации реагентов увеличивает скорость реакции, потому что больше молекул сталкивается и взаимодействует друг с другом.
Обозначение «[A]» читается как «молярная концентрация реагента A».
Концентрации реагентов выражены в молярных единицах (М) или молях растворенного вещества/л раствора.
Порядки реагентов и реакции
R = k [A] n [B] m
Степень концентрации реагента возводится в уравнение закона скорости. Порядок математически показывает, как концентрация реагента влияет на закон скорости.
Начнем с самой простой версии уравнения закона скорости, R = k [A] n
Когда порядок равен 1 или n = 1, это означает, что связь между концентрацией реагента A и скорость реакции прямо пропорциональна. Когда A увеличивается, R будет увеличиваться пропорционально. Если A удваивается, R тоже удваивается.
Когда порядок равен 2 или n = 2, это означает, что скорость реакции прямо пропорциональна квадрату концентрации Реагента А. При увеличении А R будет увеличиваться, но не пропорционально. Например, если A удваивается, R увеличивается в четыре раза (поскольку [2A] 2 = 4A 2 .
Например, если A удваивается, R увеличивается в четыре раза (поскольку [2A] 2 = 4A 2 .
Когда порядок равен 0 или n = 0, это означает, что на скорость реакции не влияет никакое изменение в концентрации реагента Это не означает что реагент не нужен, реагент все равно нужен в реакции, но количество реагента не влияет на скорость реакции.
Общий порядок реакции представляет собой сумму всех порядков реагентов, n + m.
Как определить закон ставки
Есть два основных вопроса, которые вам зададут, когда вас попросят определить закон ставки. Первый тип просит вас найти закон скорости из элементарных шагов. Второй тип предлагает вам найти закон скорости из таблицы, в которой перечислены различные эксперименты с различными концентрациями реагентов и скоростями реакции.
Иногда вам нужно найти закон скорости реакции с промежуточным продуктом. Для этого вам нужно найти шаг определения скорости.
Из элементарных шагов
Во многих реакциях химическое уравнение чрезмерно упрощает процесс реакции. Обычно существует много промежуточных реакций или элементарных стадий, которые происходят для перехода от реагентов к продуктам.
Например, уравнение NO 2 (г) + CO (г) → NO (г) + CO 2 (г) представляет собой последовательность из 2 элементарных шагов:
- NO 2 + NO 2 → NO 3 + NO [медленный]
- NO 3 + CO → NO 2 + CO 2 [fast]
Если сложить шаги вместе, вы получите: NO 2 + NO 2 + NO 3 + CO6 → NO 39008 + НЕТ + НЕТ 2 + CO 2 .
NO 3 и NO 2 сокращаются в обеих частях уравнения, поэтому у вас остается исходное уравнение.
В этих задачах вам обычно даются элементарные шаги и скорости каждого из шагов. Например, в приведенном выше уравнении шаг 1 является медленным шагом, а шаг 2 — более быстрым. Более медленный шаг используется как определяющая скорость стадия — потому что скорость реакции может быть такой же высокой, как и самая медленная стадия. Вы должны использовать шаг определения скорости, чтобы написать закон скорости, используя его реагенты.
Более медленный шаг используется как определяющая скорость стадия — потому что скорость реакции может быть такой же высокой, как и самая медленная стадия. Вы должны использовать шаг определения скорости, чтобы написать закон скорости, используя его реагенты.
R = k [NO 2 ][NO 2 ] или R = k [NO 2 ] 2
химическое уравнение). Это связано с тем, что CO не используется на более медленном этапе, определяющем скорость, поэтому он не влияет на скорость реакции.
Из таблицы
Чтобы определить закон скорости из таблицы, вы должны математически рассчитать, как различия в молярных концентрациях реагентов влияют на скорость реакции, чтобы определить порядок каждого реагента. Затем подставьте значения скорости реакции и концентрации реагентов, чтобы найти конкретную константу скорости. Наконец, перепишите закон скорости, вставив конкретную константу скорости и порядок реагентов.
В данной таблице перечислены различные тесты реакции. Каждый отдельный тест будет иметь разные концентрации реагентов, и, как результат, скорости реакции для этого теста будут разными. Вот пример таблицы данных для эксперимента: 2HI (g) → H 2 (G) + I 2 (G)
| Эксперимент | [HI] (M) | Скорость (м/с) |
| 1 | ||
| 1 | ||
| 1 | ||
| 1 | ||
| 1 | ||
| 1 | ||
| 1 | . -3 M/s||
| 2 | 0.030 | 4.4 * 10 -3 M/s |
| 3 | 0.045 | 9.9 * 10 -3 M/s |
Чтение таблицы
В эксперименте реагентом является йодистый водород HI, а H 2 и I 2 являются продуктами. Из таблицы видно, что было проведено 3 эксперимента с одной и той же реакцией с разными концентрациями HI. В каждом эксперименте скорость реакции была разной из-за разных концентраций HI.
В каждом эксперименте скорость реакции была разной из-за разных концентраций HI.
Определение закона скорости с помощью таблицы
Определение порядка реагентов
Переходя от эксперимента 1 к эксперименту 2, вы можете видеть, что концентрация HI удвоилась (0,015 x 2 = 0,030). В результате (между теми же экспериментами) скорость реакции увеличилась в четыре раза (1,1 x 10 -3 х 4 = 4,4 х 10 -3 ). Отсюда вы знаете, что порядок [HI] должен быть 2. Причина этого в том, что [2HI] x = 4HI 2 , поэтому x = 2. Другими словами, 2 2 = 4,
Вы также можете проверить этот результат, используя эксперименты 1 и 3. Между этими тестами концентрация HI утроилась (0,015 * 3 = 0,045). В результате скорость реакции увеличилась в 9 раз (1,1*10 -3 *9 = 9,9*10 -3 ). С 3 2 = 9, вы знаете, что порядок [HI] равен 2.
Математически вы можете использовать тот же процесс для нахождения порядков реагентов, подставляя значения в следующее уравнение:
В этом уравнении вы по существу используете соотношения уравнения закона скорости (R = k [A] n [B] m ), чтобы найти порядки реагентов. Подставив значения из приведенной выше таблицы, вы получите:
Подставив значения из приведенной выше таблицы, вы получите:
(4,4 * 10 -3 М/с)/(1,1 * 10 -3 М/с) = k [0,030 M] n / k [0,015 M] n
Что упрощает до: 4 = 2 n , поэтому n = 2. Как и ожидалось, это тот же порядок, который вы вычислили ранее .
Нахождение константы удельной скорости
Теперь, когда вы знаете порядок реагентов HI, вы можете приступить к написанию закона скорости. Во-первых, подключите заказ в уравнение закона скорости.
R = k [HI] 2
Теперь вы должны найти k , конкретную константу скорости. Помните, что k уникален для этого эксперимента и этой реакции. Подставив значения любого из экспериментов в уравнение, вы можете найти k . Если мы подставим значения из эксперимента 1, мы получим:
1,1 * 10 -3 М/с = к [0,015 М] 2
к = 4,913 М -1 -1
Итак, окончательный закон скорости для этого эксперимента: R = 4,9 M -1 с -1 [HI] 2
Единицы для конкретной константы скорости
Как упоминалось ранее, единицы для конкретной константы скорости зависят от порядка реакции. Имейте в виду:
Имейте в виду:
- Единицей скорости реакции является M/s
- Порядок реагентов меняет единицы измерения в правой части уравнения
s = k [0,015 M] 2 , расширение правой части уравнения дает 1,1 * 10 -3 М/с = k (0,000225 M 2 ). Чтобы изолировать k , вы можете разделить обе части уравнения на 0,000225 M 2 , чтобы получить k = (1,1 * 10 -3 М/с)/(0,000225 M 2 ). Единицы k становятся M -1 s -1 .
Однако в другом (отдельном, несвязанном) примере, если бы закон скоростей был 4,5 * 10 -3 М/с = k [0,034 М] 2 [0,048 М] 3 , единицы для к будет другим. В этом случае расширение правой части уравнения дает единицы M 5 в правой части. Изолируя k , единицами измерения k будут (M/s)/M 5 или M -4 s -1 .
Как видите, порядок каждого реагента влияет на единицы измерения конкретной константы скорости.
Примеры вопросов для определения закона скорости
Из элементарных шагов
Напишите закон скорости для следующей реакции, учитывая элементарные шаги механизма реакции: 2NO 2 (ж) + F 2 (ж) → 2NO 2 F (ж)
- NO 2 + F 2 → NO 2 F + F0 9 (s034low1) NO 2 → NO 2 F (быстрый)
Объяснение: Поскольку шаг 1 является более медленным, он является определяющим для данной реакции. Запишите закон скорости, подставив реагенты в уравнение закона скорости.
Ответ: R = k [NO 2 ][F 2 ]
Из таблицы
| Experiment | [A] (M) | [B] (M) | Rate (M/s) |
| 1 | 1.2 | 2.4 | 8.0 * 10 -8 |
| 2 | 1. 2 2 | 1.2 | 4.0 * 10 -8 |
| 3 | 3.6 | 2.4 | 7.2 * 10 -7 |
Explanation:
To начнем, напишем закон скорости для уравнения: R = k [A] n [B] m
Нахождение порядка реагентов
Начнем с нахождения порядка реагента A. Как видно из таблицы, между экспериментами 1 и 2 концентрация B изменилась, но концентрация A не изменилась — это было бы бесполезно для нахождения порядка A. Однако между экспериментами 1 и 3 концентрация A изменилась, а B не изменилась — это идеально подходит для нахождения порядка А, потому что А — единственное, что изменилось, и, следовательно, единственная переменная, которая могла повлиять на скорость реакции.
Подставляя значения из таблицы, получаем:
(7,2 * 10 -7 М/с)/(8,0 * 10 -8 М/с) = ( k [3,6 М] n [2,4 M] m )/( k [1,2 M] n [2,4 M] m )
Как видите, в правой части уравнения k и Значения [B] компенсируются, изолируя [A]. Упрощая уравнение, получаем:
Упрощая уравнение, получаем:
9 = 3 n , поэтому n = 2. Порядок [A] равен 2 .
Теперь давайте найдем порядок Реагента B. Как упоминалось ранее, между экспериментами 1 и 2 переменная [B] изолирована, потому что это единственная переменная, которая изменяется.
(4,0 * 10 -8 М/с)/(8,0 * 10 -8 М/с) = ( k [1,2 М] n [1,2 М] м 2/3 k [1,2 M] n [2,4 M] m )
Опять же, значения k и [A] компенсируются. Упрощая уравнение, получаем:
1/2 = (1/2) m , поэтому m = 1. порядок [B] равен 1.
*В качестве примечания, вы также можете сделать это, сравнив значения в таблице, не используя уравнение. Между экспериментами 1 и 2, поскольку [B] уменьшилось вдвое, скорость реакции также уменьшилась вдвое. Таким образом, вы знаете, что концентрация B прямо пропорционально влияет на скорость реакции, а порядок B равен 1.
Нахождение константы удельной скорости
Теперь, когда вы знаете порядок обоих реагентов, подставьте их в таблицу уравнение. Р = k [A] 2 [B]
Наконец, найдите значение k , подставив значения из любого из экспериментов. Если мы решим использовать эксперимент 1, мы получим:
8,0 * 10 -8 М/с = к [1,2 М] 2 [2,4 М] = к (3,456 М 3 k = 2,3 * 10 -8 M -2 с -1 Итак, окончательный закон скорости для этого эксперимента: R = (2,3 * 10 -8 M -2 s -1 )[A] 2 [B] Перечисленные здесь химические формулы охватывают различные темы программы, и вы можете разумно охватить всю программу. Вы можете положиться на таблицу формул здесь, так как она подготовлена экспертами в данной области после обширных исследований. Здесь приведены различные понятия, такие как атомная структура, химическое равновесие, химическая кинетика, периодическая таблица, формулы полимеров. Вы можете использовать эти шпаргалки и таблицы по химии, чтобы легко ознакомиться с различными темами. Определить уравнение закона скорости
Наше последнее потрясающее видео о химии
org” frameborder=”0″ allow=”accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””> крутые видео скоро будут! Скорости реакций и закон скоростей – дополнительная литература
Химические формулы | Список химических формул, таблица формул и таблицы
Пероидная таблица элементов
Список элементов по атомному номеру
Вот список элементов, отсортированных по атомному номеру.
| element | symbol | atomic number | atomic weight | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| hydrogen | H | 1 | [1.00784, 1.00811] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| helium | He | 2 | 4.002602 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| литиевый | литиевый | 3 | [6.938, 6.997] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| beryllium | Be | 4 | 9.0121831 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| boron | B | 5 | [10.806, 10.821] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| carbon | C | 6 | [12.0096, 12.0116] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| nitrogen | N | 7 | [14.00643, 14.00728] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| oxygen | O | 8 | [15. , 15.] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fluorine | F | 9 | 18.9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| neon | Ne | 10 | 20. 1797 1797 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| sodium | Na | 11 | 22.988 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnesium | Mg | 12 | [24.304, 24.307] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| aluminum (aluminium) | Al | 13 | 26.
Elements with атомный вес, указанный в квадратных скобках, имеет атомный вес, указанный в виде диапазона. Перечень химических формул и их общих названий с химическими соединениямиВ приведенной ниже таблице представлены химические соединения и их формулы с их общепринятыми названиями. Эти перечисленные ниже соединения и их формулы регулярно задают на экзаменах SSC или государственных экзаменах. Вы также можете скачать бесплатный PDF-файл, приведенный в этой статье, чтобы запомнить приведенный ниже список.
Химия.2. Абсолютный ноль самая низкая теоретически достижимая температура 3. Абсорбция процесс, при котором одно вещество проникает в другое 4. качество близкое к истинному 5. Кислота любое из различных водорастворимых соединений, имеющее кислый вкус 6. Энергия активации энергия, до того, как может произойти процесс (такой как выброс или реакция) 7. Реакция присоединения химическая реакция, в которой одна молекула присоединяется к другой 8. Спирт летучее соединение, получаемое путем перегонки 9. Щелочной металл любой из одновалентных металлов I группы периодической таблицы (литий, или натрий, или калий, или рубидий, или цезий, или франций) 10. Щелочной металл относящийся к щелочи или содержащий ее 11. Щелочно-земельный металл любой из двухвалентных металлов II группы периодической таблицы 12. Аллотроп структурно отличающаяся форма элемента 13. смесь, содержащая два или более металлических элемента 14. Аморфный без реальной или видимой кристаллической формы 3 90 без воды; особенно без кристаллизационной воды 16. Анион частица с отрицательным электрическим зарядом 17. Водный раствор раствор в воде 90. Атом0604 наименьшая составляющая элемента 19. Атомная масса свойство атома, благодаря которому он имеет вес 20. Атомный номер количество атомов в ядре атома протонов элемент 21. Атомная теория теория строения атома 22. Атомный вес (химия) масса атома химического элемента, выраженная в атомных единицах массы 23. Закон Авогадро принцип, согласно которому равные объемы всех газов (при одинаковых температуре и давлении) содержат одинаковое количество молекул 24. вещество 25. Весы привести в равновесие 26. Основание соединение, реагирующее с кислотой с образованием соли и воды 9. Химический стакан плоскодонная банка из стекла или пластика 28. Бинарное соединение химическое соединение, состоящее только из двух элементов 30. Температура кипения температура кипения жидкости на уровне моря 31. Закон Бойля давление идеального газа при постоянной температуре изменяется обратно пропорционально объему 32. Бдинка , имея небольшую эластичность 33. Буфер (Химия) Ионное соединение, которое защищает изменения в своем pH 34. Bunsen Burner Asab 35. Плавучесть склонность всплывать в воде или другой жидкости 36. измерение количества тепла 37. Катализатор вещество, инициирующее или ускоряющее химическую реакцию 38. Катион частица с положительным электрическим зарядом 39. Цепная реакция продукт одной химической реакции, 40. Заряд количество неуравновешенного электричества в теле 41. Закон Шарля (физика) плотность идеального газа при постоянном давлении изменяется обратно пропорционально температуре 42. Химическая связь электрическая сила, связывающая атомы 43. Химическое изменение процесс, определяемый составом и строением веществ 44. Химическая энергия вещество, которое может быть высвобождено в результате химической реакции45. Химическая формула представление вещества с использованием символов для составляющих его элементов 9 47. процесс превращения одних веществ в другие 48. Химия 04 вещества49. Хроматография процесс, используемый для разделения смесей на основании различий в поглощающей способности 50. Коэффициент постоянное число, служащее мерой некоторого свойства 51. Когезия сила, удерживающая вместе молекулы в твердом или жидком раствор и тонкая суспензия 53. Горение реакция вещества с кислородом с выделением тепла и света 54. Состав способ соединения кого-либо или чего-либо 55. Соединение Вещество, сформированное химическим союзом двух или более элементов 56. Концентрация Прочность на раствор 57. Конденсация Процесс. жидкое или твердое состояние 58. свойство передавать тепло, электричество или звук 59. Проводник вещество, которое легко служит средой для передачи 60. Ковалентная связь химическая связь, связанная с общей парой электронов между атомами в молекуле 61. Тигель сосуд, используемый для высокотемпературных химических реакций 60003 906 906твердое тело с очень регулярной атомной структурой 63. Кристаллическое состоящее из кристаллов, содержащее их или имеющее природу кристаллов 64. Реакция разложения (химия) разделение вещества на два или более веществ, которые могут отличаться друг от друга и от исходного вещества 65. Плотность количество на единицу размера 66. Осаждение 3 3 естественный процесс отложения чего-либо 67. удаление соли 68. Двухатомный молекулы, состоящей из двух атомов 69. Разведение Раствор. Раствор снижение прочности или концентрации 70. Растворить Пропуск в раствор 71. Дистилляция Очищение жидкости. 72. Дмитрий Менделеев Русский химик, разработавший периодическую таблицу химических элементов и предсказавший открытие ряда новых элементов (1834-1907) 73. Двойная связь ковалентная связь, при которой две пары электронов являются общими между двумя атомами 74. Двойная реакция замещения положительный ион другого соединения 75. Пластичный способный формироваться, изгибаться или вытягиваться 76. Электролиз (химия) химическая реакция разложения, происходящая при пропускании электрического тока через раствор, содержащий ионы 77. элементарная частица с отрицательным зарядом 78. Электроотрицательность (химия) склонность атома или радикала притягивать электроны при образовании ионной связи 7 903 9003 900 Элемент вещество, которое нельзя разделить на более простые вещества 80. Эмпирическая формула химическая формула, показывающая соотношение элементов в соединении, а не общее число атомов 81. Endothermic , возникающий или образованный с поглощением тепла 82. Эндотермическая реакция Химическая реакция, сопровождаемая Absorption 83. 83. Энергиона .84. Энтропия энергия в системе больше не доступна для механической работы 85. сложный белок, вырабатываемый клетками, который действует как катализатор 86. Равновесие Химическая реакция и его обратное проходит с равными скоростями 87. Испарение Процесс становления частиц в воздухе 88. образуется с выделением тепла 89. Экзотермическая реакция химическая реакция, сопровождающаяся выделением тепла 90. Семья совокупность вещей, имеющих общий признак 91. Ферментация расщепление органического вещества, такого как сахар, на спирт 92. Первый закон термодинамики фундаментальный принцип физики, согласно которому полная энергия изолированной системы постоянна, несмотря на внутренние изменения 93. Деление расщепление массивного ядра с выделением энергии 94. Легковоспламеняющиеся легко воспламеняющиеся 95. (физика) термодинамическая величина, эквивалентная способности физической системы совершать работу; единицами энергии являются джоули или эрги 96. Замерзание отвод тепла для превращения чего-либо из жидкости в твердое тело 97. Температура замерзания температура, ниже которой жидкость превращается в твердое тело 98. Слияние реакция, при которой ядра объединяются, образуя более массивные ядра 99. Газ состояние вещества, отличное от твердого и жидкого 100. Закон Гей-Люссака (физика) плотность идеального газа при постоянном давлении изменяется обратно пропорционально температуре 33 HEAT HEAT  Идеальный газ Идеальный газ  Кельвин Кельвин ) теория о том, что газы состоят из мелких частиц, находящихся в беспорядочном движении что-то, что светится отраженным светом что-то, что светится отраженным светом 139. Смешиваемый 139. Смешиваемый 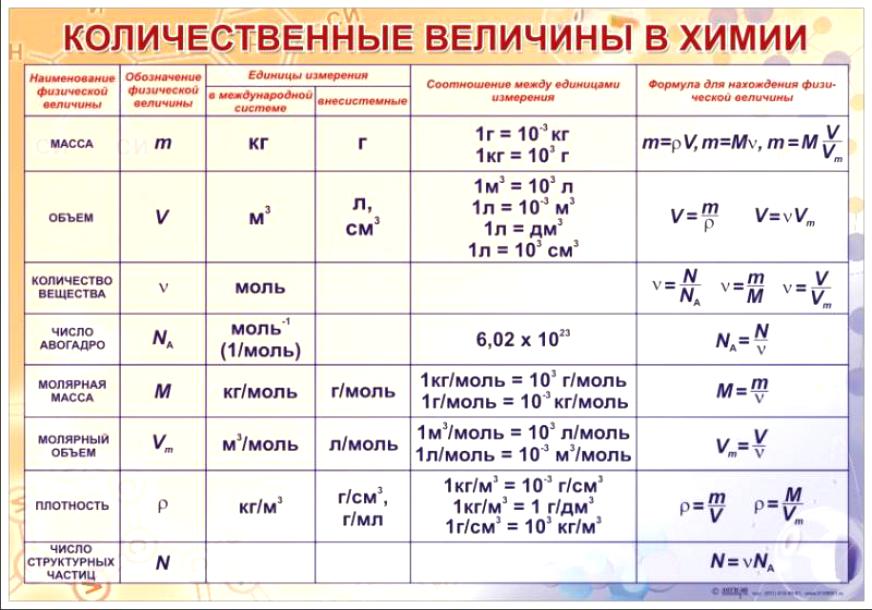 Благородный газ Благородный газ  Окисление Окисление 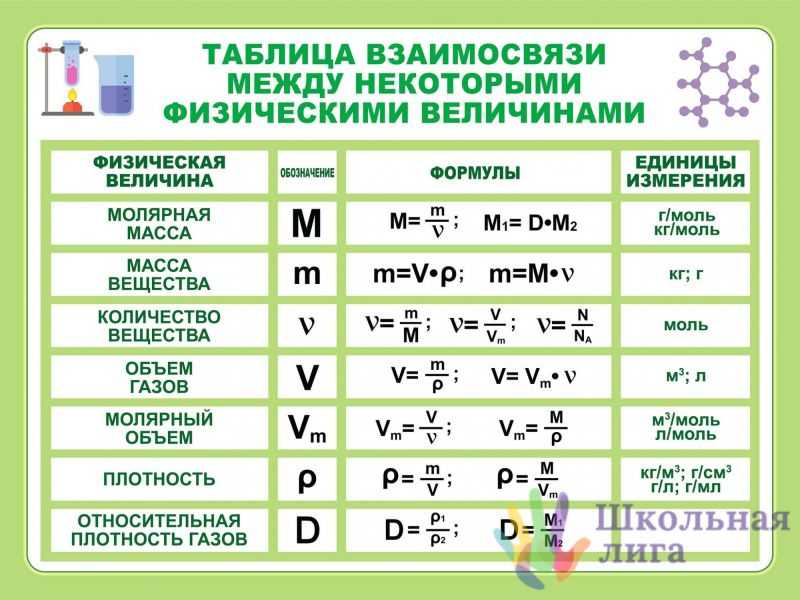 Плазма Плазма  Радиоизотоп Радиоизотоп  Раствор Раствор  Нижний индекс Нижний индекс  Термодинамика Термодинамика  Выход Выход Объем газа зависит от его температуры и давления. Согласно закону Бойля объем (V) определенного количества газа обратно пропорционален его давлению (P) при постоянной температуре (T). В = K/P K = постоянная PV = K Начальный объем газа = V1 Конечное давление газа = P2 Конечный объем газа = V2 Согласно закону Шарля объем (V) определенного количества газа прямо пропорционален его абсолютной температуре (T) при постоянном давлении (P) . V = KT K = Constant V/T = K Similarly V 1 /T 1 = V 2 /T 2 V 1 /V 2 = T 1 /T 2 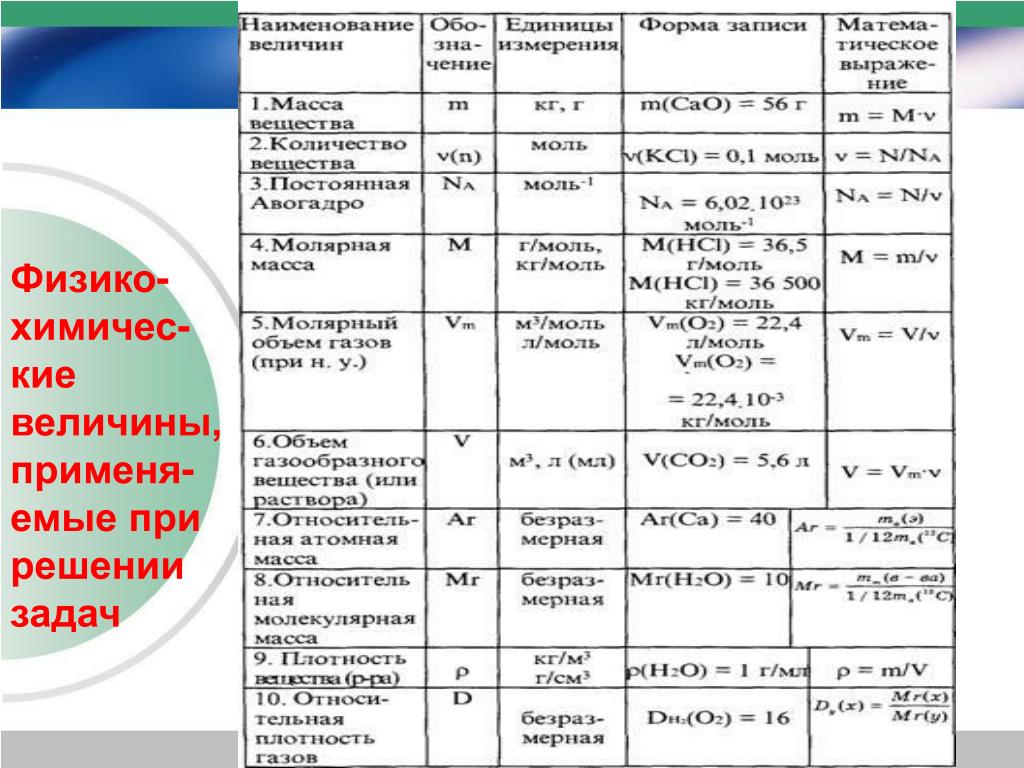 Температура, при которой объем гипотетического газа будет равен нулю, называется температурой Кельвина или абсолютной температурой. Кельвин обнаружил это, и температура составляет -273°C. Связь между температурой Кельвина (T) и температурой Цельсия (t) показана ниже. Температура, при которой объем гипотетического газа будет равен нулю, называется температурой Кельвина или абсолютной температурой. Кельвин обнаружил это, и температура составляет -273°C. Связь между температурой Кельвина (T) и температурой Цельсия (t) показана ниже.Согласно закону Гей-Люссака, давление газа определенного количества при постоянном объеме прямо пропорционально абсолютной температуре. P = KT P/T =K P 1 /P 2 = T 1 /T 2 P 1 V VAIL = = = = = = = = = = = = = = = = = = .  x x В x = P 1 V 1 / P 2 …………………………………….(1) V x T 1 7 T 2 6 2 V x = V 2 T 2 /T 1 ……………………………………………(2) P 1 V 1 / P 2 = V 2 T 2 /T 1 5 9 70034 P 1 V 1 /T 1 = P 2 V 2 /T 2 PV = KT PV = NRT Закон Дальтона основан на парциальном давлении газа. Парциальное давление представляет собой сумму индивидуальных давлений каждого газа в газовой смеси. 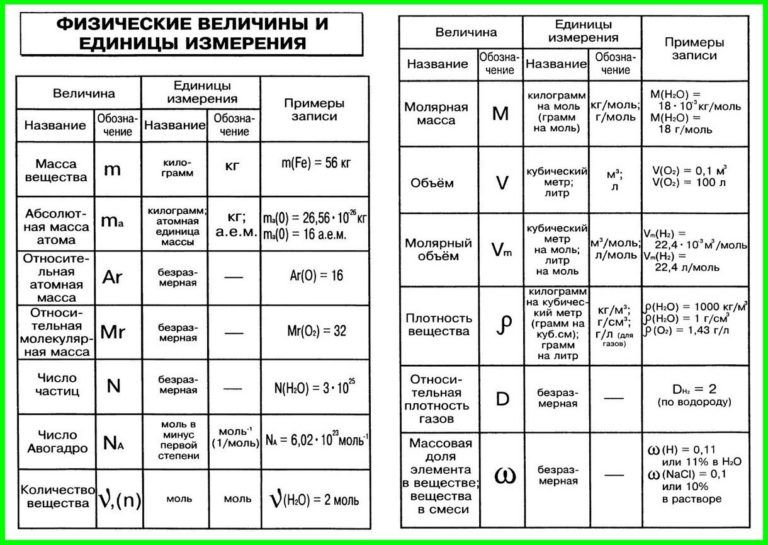 P = PA + PB Согласно закону Грэма скорость диффузии различных газов обратно пропорциональна квадратному корню из их плотностей при постоянной температуре и давлении. d = плотность газа  Первоначально эта отрасль химии была ограничена соединениями, производимыми живыми организмами, но была расширена за счет включения созданных человеком веществ, таких как пластмассы. Диапазон применения органических соединений огромен и включает, помимо прочего, фармацевтику, нефтехимию, продукты питания, взрывчатые вещества, краски и косметику. Первоначально эта отрасль химии была ограничена соединениями, производимыми живыми организмами, но была расширена за счет включения созданных человеком веществ, таких как пластмассы. Диапазон применения органических соединений огромен и включает, помимо прочего, фармацевтику, нефтехимию, продукты питания, взрывчатые вещества, краски и косметику. Многие современные высокотехнологичные материалы хотя бы частично состоят из органических соединений. Многие современные высокотехнологичные материалы хотя бы частично состоят из органических соединений. Они часто имеют высокие температуры плавления и специфические свойства высокой или низкой электропроводности, что делает их полезными для определенных целей. Например: Они часто имеют высокие температуры плавления и специфические свойства высокой или низкой электропроводности, что делает их полезными для определенных целей. Например: Узнайте о преимуществах подготовки по формулам химии. Они как под Узнайте о преимуществах подготовки по формулам химии. Они как под  Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!      N = количество частиц n = моли частиц N A = число Авогадро = 6,022 × 10 23  Определить число атомов водорода в 1,5 молях воды, H 2 O, молекул. Определить число атомов водорода в 1,5 молях воды, H 2 O, молекул.N = количество частиц n = моли частиц N A = число Авогадро = 6,022 × 10 23 N(H 2 молекул O) = количество молекул воды н(Н 2 молекул O) = моли молекул воды = 1,5 моль N A = число Авогадро = 6,022 × 10 23  Сколько молей молекул углекислого газа содержится в образце? где N A = число Авогадро = 6,022 × 10 23  Образец содержит 2,4 × 10 22 молекул газообразного кислорода (O 2 ). Образец содержит 2,4 × 10 22 молекул газообразного кислорода (O 2 ). Сколько молей атомов кислорода содержится в образце? где N A = число Авогадро = 6,022 × 10 23 , где N A = число Авогадро = 6,022 × 10 23  Бо попросил химика Криса приготовить 1 литр раствора, содержащего 0,50 моль ионов хлора, Cl – , растворенных в воде.
Раствор также должен содержать равное количество ионов натрия, Na + и ионы калия К + .
Крис делает раствор, растворяя немного хлорида натрия, NaCl, и хлорида калия, KCl, в 1 литре деионизированной воды. Бо попросил химика Криса приготовить 1 литр раствора, содержащего 0,50 моль ионов хлора, Cl – , растворенных в воде.
Раствор также должен содержать равное количество ионов натрия, Na + и ионы калия К + .
Крис делает раствор, растворяя немного хлорида натрия, NaCl, и хлорида калия, KCl, в 1 литре деионизированной воды. Сколько ионов натрия содержится в растворе?      | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Эта коробка содержит:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Эта коробка теперь содержит:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| n (количество вещества в молях) | × | N A (номер Авогадро) | = | N (количество частиц) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 моль | × | 6,022 × 10 23 | = | 6,022 × 10 23 частицы | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 моль | × | 6,022 × 10 23 | = | 1,204 × 10 24 частицы | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10 моль | × | 6,022 × 10 23 | = | 6,022 × 10 24 частицы | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0,5 моль | × | 6,022 × 10 23 | = | 3,011 × 10 23 частицы | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| XY 2 (формула) | n(XY 2 ) (моли XY 2 ) | n(X) (моль атомов элемента X) | N(X) (количество атомов X) | n(Y) (моль атомов элемента Y) | N(Y) (количество атомов Y) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| СО 2 | и | n × 1 = n моль атомов C | n × N A атомов C | n × 2 = 2n моль атомов O | 2n × N A атомов O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НЕТ 2 | и | n × 1 = n моль атомов N | n × N A атомов N | n × 2 = 2n моль атомов O | 2n × N A атомов O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SCl 2 | и | n × 1 = n моль атомов S | n × N A атомов S | n × 2 = 2n моль атомов Cl | 2n × N A атомов Cl | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| XY 2 (формула) | n(XY 2 ) (моли XY 2 ) | n(X) (моль атомов элемента X) | N(X) (количество атомов X) | n(Y) (моль атомов элемента Y) | N(Y) (число атомов Y) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| СО 2 | 5 | 5 × 1 = 5 моль С | 5 × N А Атомы С | 5 × 2 = 10 моль О | 10 × N А Атомы О | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НЕТ 2 | 5 | 5 × 1 = 5 моль N | 5 × N A Атомы N | 5 × 2 = 10 моль О | 10 × N А Атомы О | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SCl 2 | 5 | 5 × 1 = 5 моль S | 5 × N A Атомы S | 5 × 2 = 10 моль Cl | 10 × N А Атомы Cl | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Н Н А | = | N × | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Н Н А | = | и | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N (количество частиц) | ÷ | N A (номер Авогадро) | = | n (моль частиц) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (3,011 × 10 23 ) | ÷ | (6,022 × 10 23 ) | = | 0,5 моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (1,204 × 10 24 ) | ÷ | (6,022 × 10 23 ) | = | 2 моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (6,022 × 10 24 ) | ÷ | (6,022 × 10 23 ) | = | 10 моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| X 2 Y (формула) | N(X 2 Y) (количество молекул X 2 Y) | N(X) (количество атомов элемента X) | n(X) (моль атомов X) | N(Y) (число атомов элемента Y) | n(Y) (моль атомов Y) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| В 2 Ю | 1,927 × 10 24 | 2 × (1,927 × 10 24 ) атомов Н = 3,854 × 10 24 атомов Н | (3,854 × 10 24 ) ÷ (6,022 × 10 23 ) = 6,4 моль атомов H | 1 × (1,927 × 10 24 ) атомов S = 1,927 × 10 24 атомов S | (1,927 × 10 24 ) ÷ (6,022 × 10 23 ) = 3,2 моль атомов S | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Н 2 О | 1,927 × 10 24 | 2 × (1,927 × 10 24 ) атомов Н = 3,854 × 10 24 атомов Н | (3,854 × 10 24 ) ÷ (6,022 × 10 23 ) = 6,4 моль атомов H | 1 × (1,927 × 10 24 ) атомов О = 1,927 × 10 24 атомов О | (1,927 × 10 24 ) ÷ (6,022 × 10 23 ) = 3,2 моль атомов О | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| н(атомы О) | = | N(атомы O) N A | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| = | 2 × N(O 2 молекул) Н А | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| = | 2 × N(O 2 молекул) 6,022 × 10 23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| н(атомы О) | = | 2 × N(O 2 молекул) 6,022 × 10 23 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| = | 2 × (2,4 × 10 22 ) 6,022 × 10 23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| = | 0,080 моль атомов кислорода | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сформулируйте вопрос. | Какой вопрос просит вас сделать? Определите количество ионов натрия в растворе. N(ионы натрия) = количество ионов натрия = ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пауза для планирования. | Какой химический принцип вам нужно применить? Применение стехиометрии (N = n × N A ) Какую информацию (данные) вам предоставили?
Этап 1: Рассчитать количество ионов Cl – в растворе Предположим, что вода, используемая для приготовления раствора, НЕ содержит ионов хлора, Cl – . Шаг 2: Напишите уравнение зависимости между количеством ионов хлора, натрия и калия Предположим, что вода, используемая для приготовления раствора, НЕ содержит ионов натрия, Na + , или ионов калия, K + Шаг 3: Решите уравнение для определения количества ионов натрия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Следуйте плану. | Этап 1: Рассчитайте количество ионов Cl – в растворе Предположим, что вода, используемая для приготовления раствора, НЕ содержит ионов хлора, Cl – . N (Cl – в растворе) = 0,50 × ( 6,022 × 10 23 ) N(Cl – в растворе) = 3,011 × 10 23 ионы хлорида Шаг 2: Напишите уравнение зависимости между количеством ионов хлора, натрия и калия Предположим, что вода, используемая для приготовления раствора, НЕ содержит ионов натрия, Na + , или ионов калия, K + N(Cl – в растворе) = N(Cl – из NaCl) + N(Cl – из KCl) Рассмотрим только NaCl: 1 “молекула” NaCl содержит 1 Na + и 1 Cl – , значит N(Cl – из NaCl) = N(Na + ) = N(NaCl) Рассмотрим только KCl: 1 “молекула” KCl содержит 1 K + и 1 Cl – , поэтому Н(Кл – из KCl) = N(K + ) = N(KCl) Следовательно: N(Cl – в растворе) = N(Na + ) + N(K + ) Так как N(Na + ) = N(K + ) N (Cl – в растворе) = 2 × N (Na + ) Шаг 3: Решите уравнение для определения количества ионов натрия N (Cl – в растворе) = 2 × N (Na + ) 3,011 × 10 23 = 2 × N(Na + )
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Подумайте о правдоподобии. | Вы ответили на заданный вопрос? Да, мы определили количество ионов натрия в растворе. Вы использовали правильное количество значащих цифр? При умножении или делении количество значащих цифр в результате равно наименьшему количеству значащих цифр в любом из условий: Разумно ли ваше решение вопроса? Давайте поработаем в обратном порядке, чтобы увидеть, даст ли рассчитанное нами количество ионов натрия правильное количество молей ионов хлорида в растворе. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Укажите решение. | Сколько ионов натрия в растворе? 1,5 × 10 23 ионы натрия в растворе | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Рисуется схема, на которой отмечают последовательность действий и результат, полученный при их выполнении.
Рисуется схема, на которой отмечают последовательность действий и результат, полученный при их выполнении.

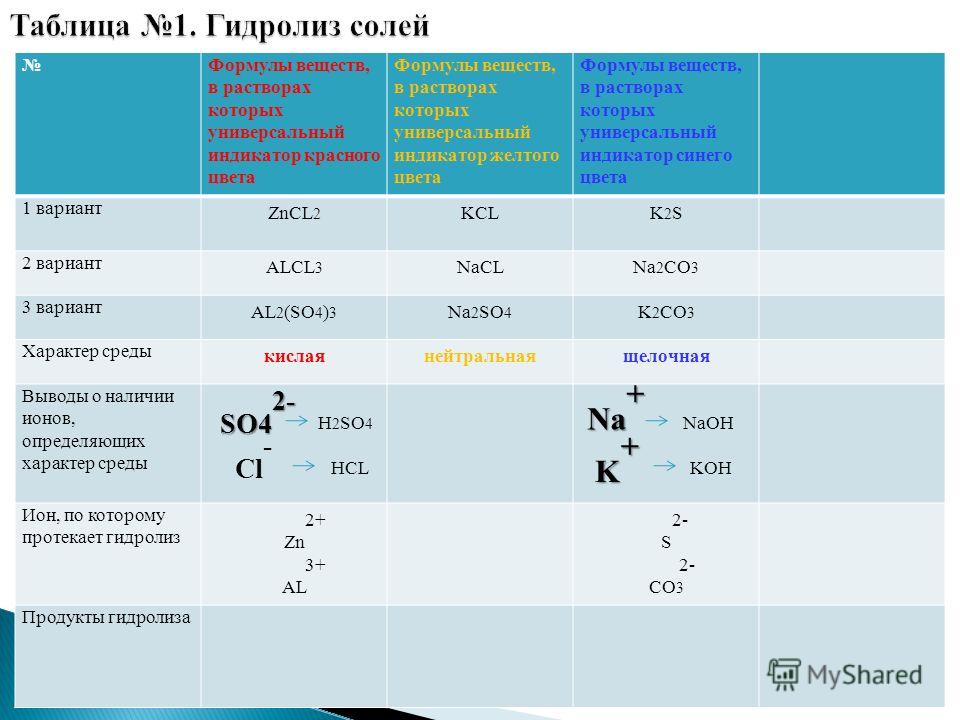






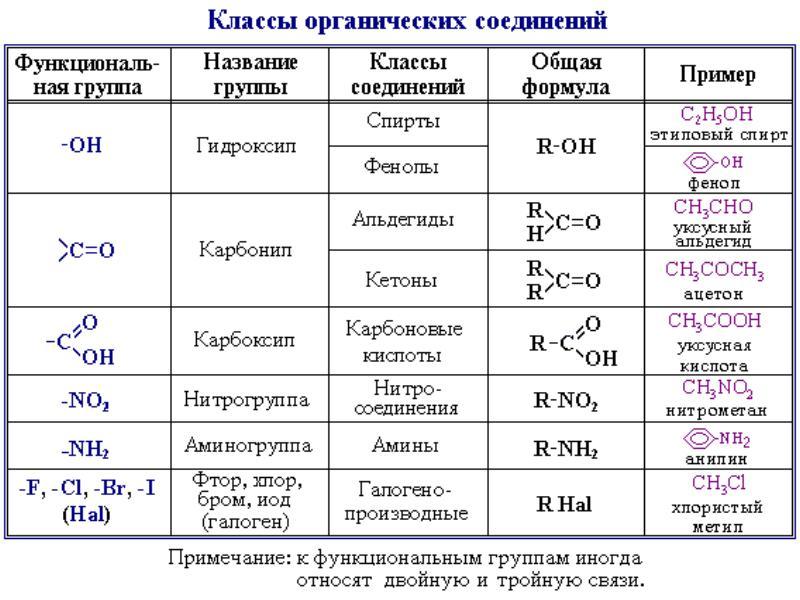 971
971 8682
8682 0837
0837 9668
9668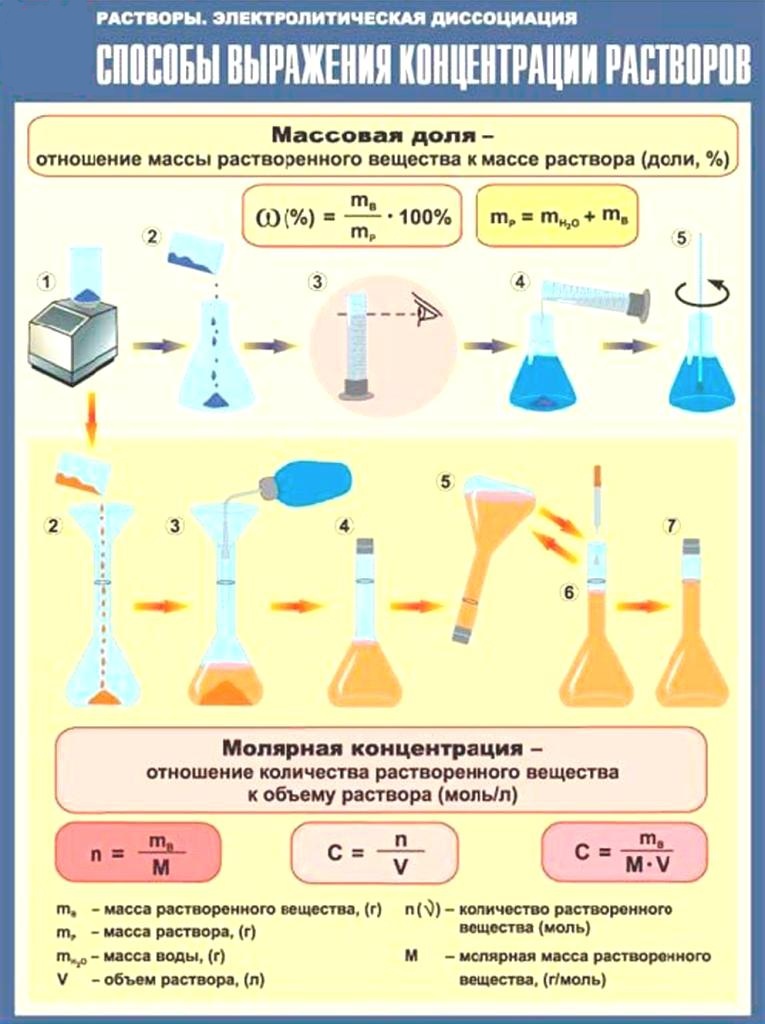 2
2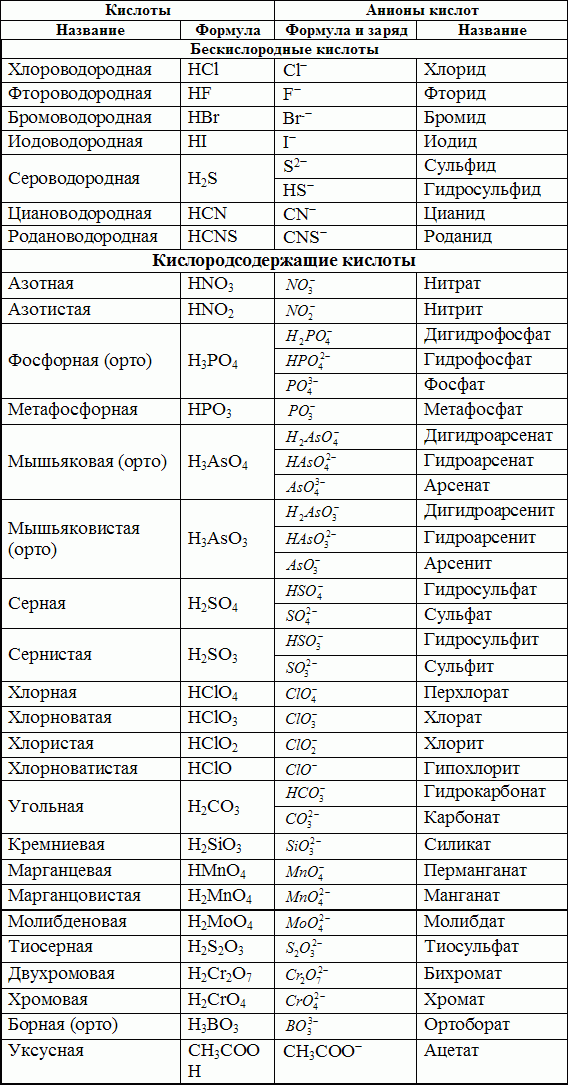 Элементы с атомным весом в скобках указывают вес изотопа с самым длинным периодом полураспада.
Элементы с атомным весом в скобках указывают вес изотопа с самым длинным периодом полураспада.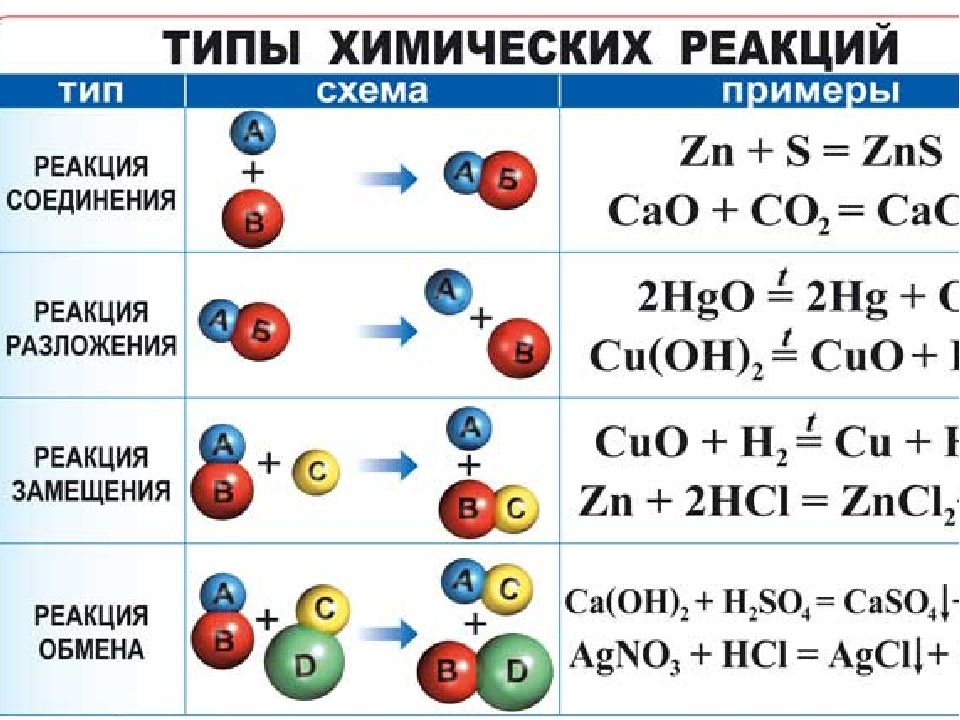 044 g/mol
044 g/mol 092 g/mol
092 g/mol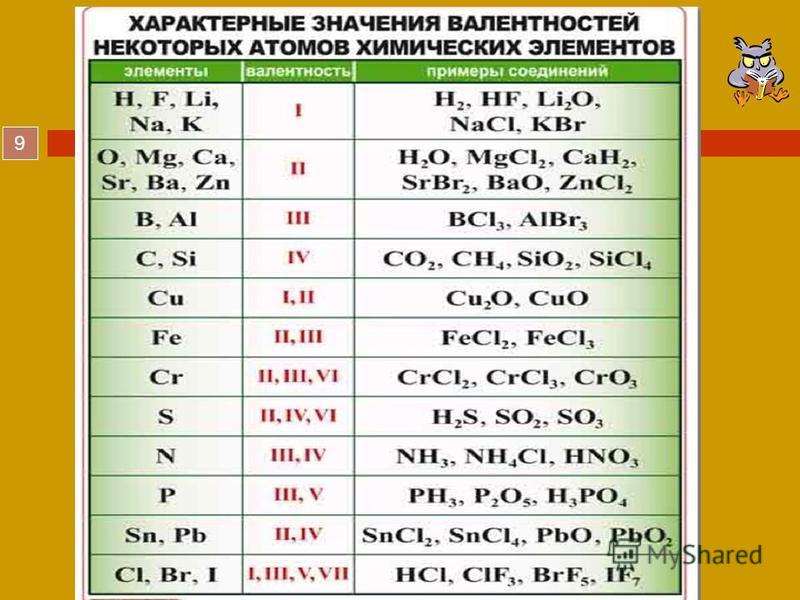 1406 G/MOL 9083 9083
1406 G/MOL 9083 9083 043 g/mol
043 g/mol 687 g/mol
687 g/mol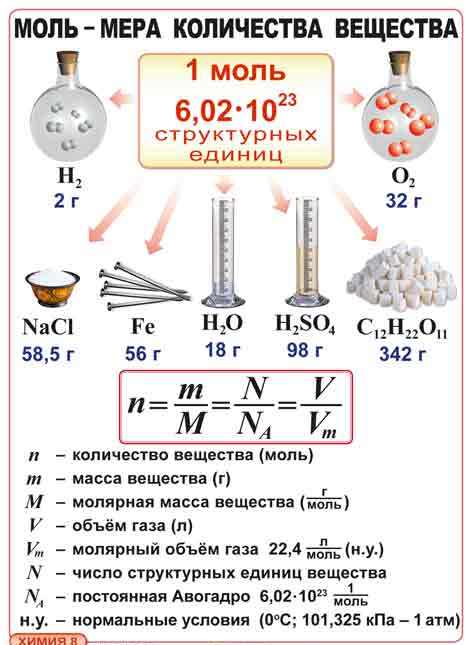 046 g/mol
046 g/mol 5513 g/mol
5513 g/mol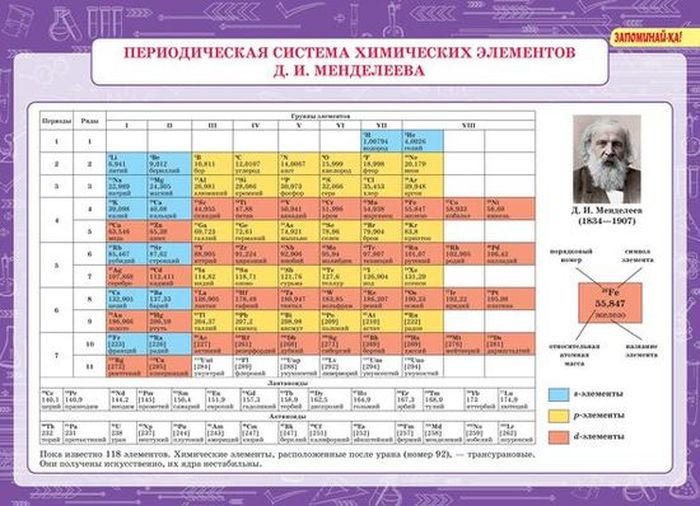 205 g/mol
205 g/mol 313 g/mol
313 g/mol 016 g/mol
016 g/mol 85 g/mol
85 g/mol 38 g/mol
38 g/mol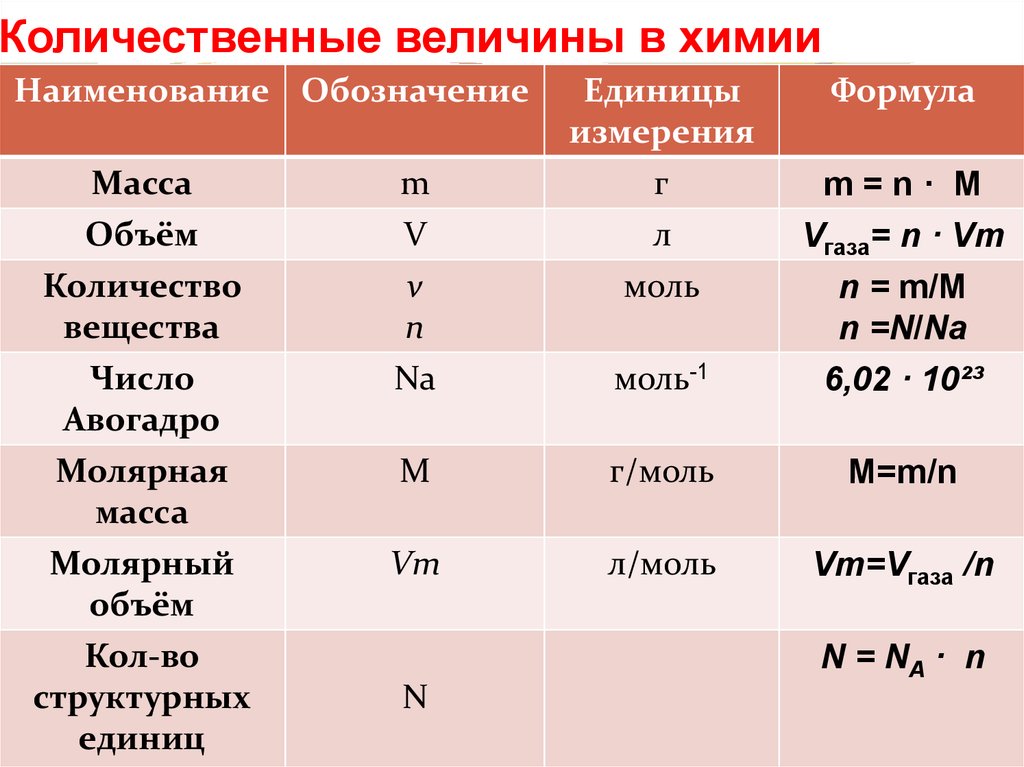 424 g/mol
424 g/mol 056 g/mol
056 g/mol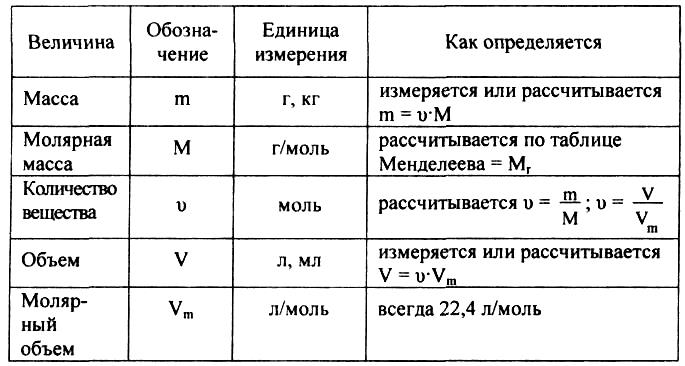 005 г/моль
005 г/моль 46 g/mol
46 g/mol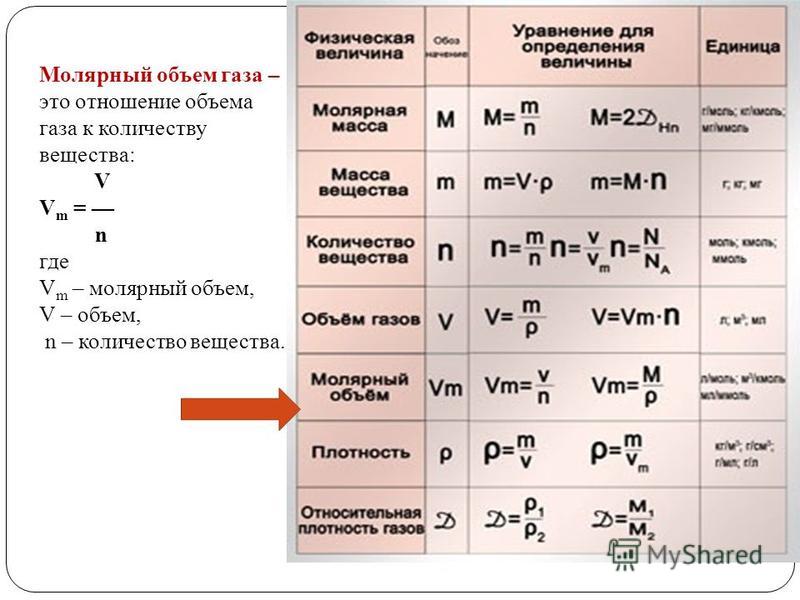 994 g/mol
994 g/mol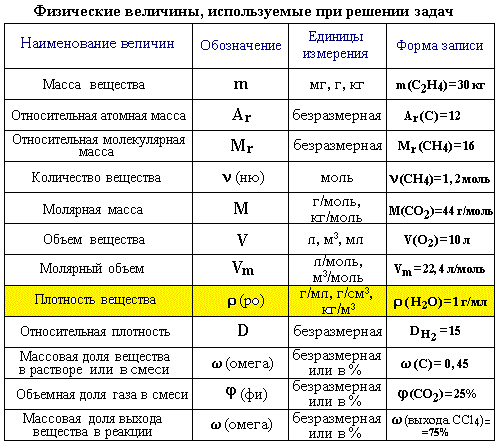 13 g/mol
13 g/mol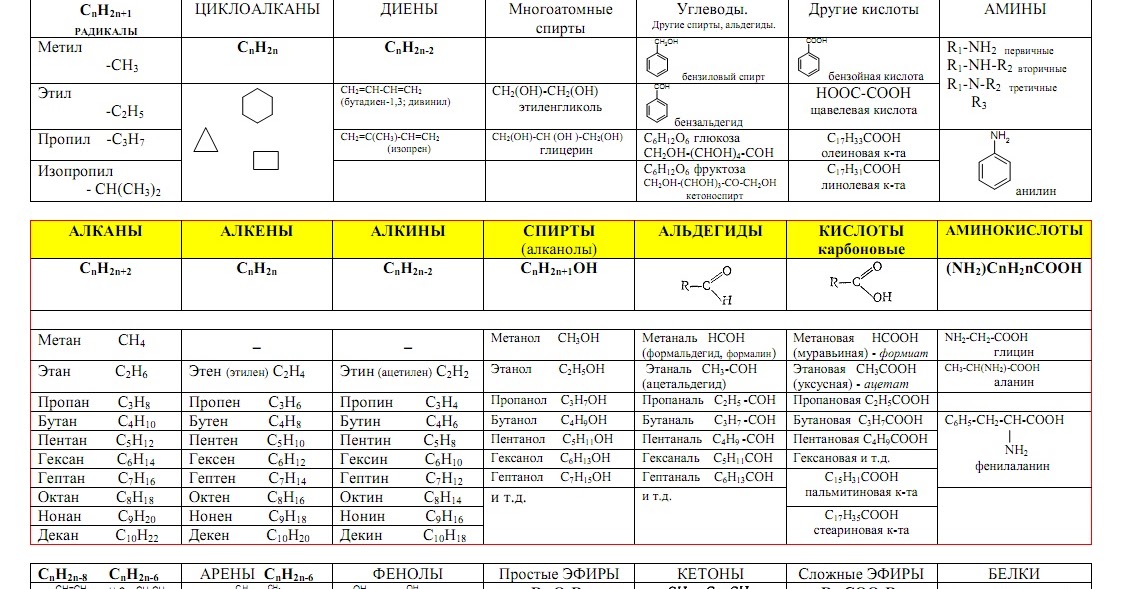 34 g/mol
34 g/mol 18 g/mol
18 g/mol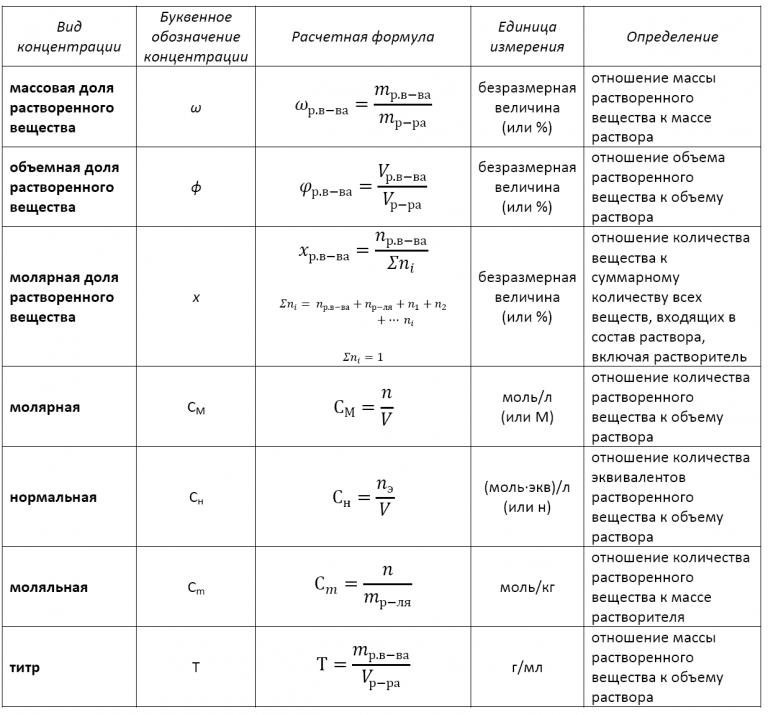 0028 g/mol
0028 g/mol 98 g/mol
98 g/mol 114 g/mol
114 g/mol 136 g/mol
136 g/mol 9714 g/mol
9714 g/mol 03 g/mol
03 g/mol 09382 g/mol
09382 g/mol 97 g/mol
97 g/mol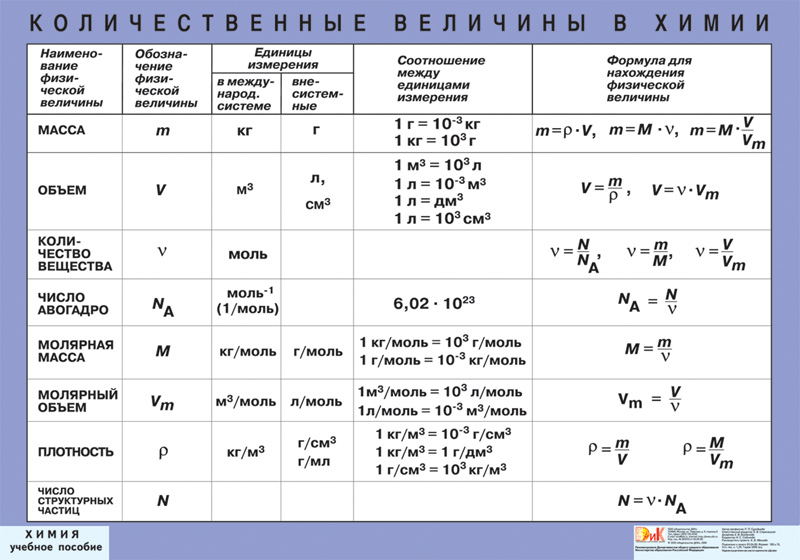 05 g/mol
05 g/mol 44 g/mol
44 g/mol 031 g/mol
031 g/mol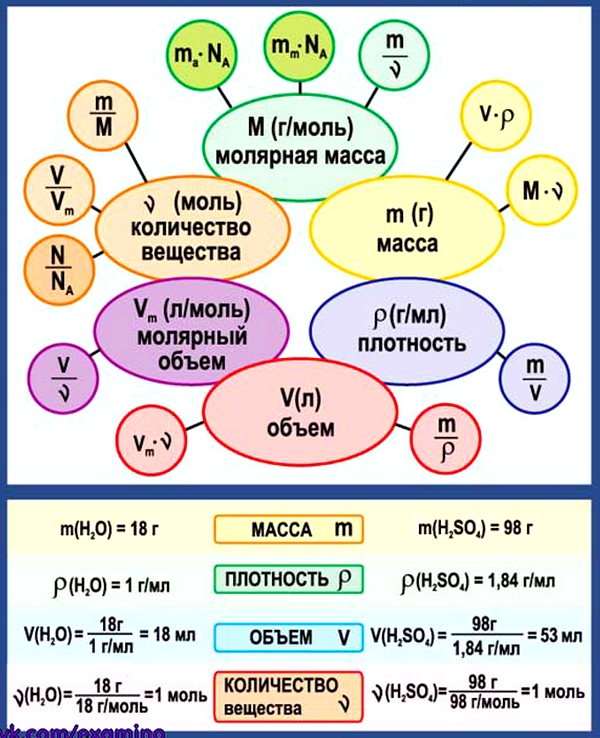 106 g /mol
106 g /mol
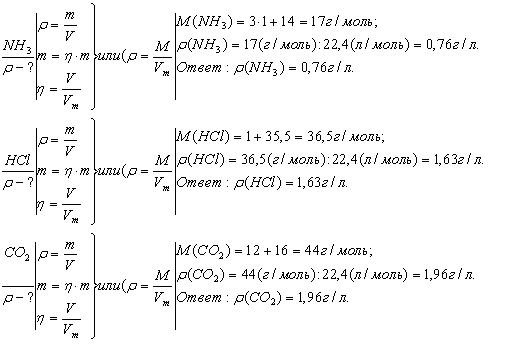 038 g/mol
038 g/mol Точность
Точность 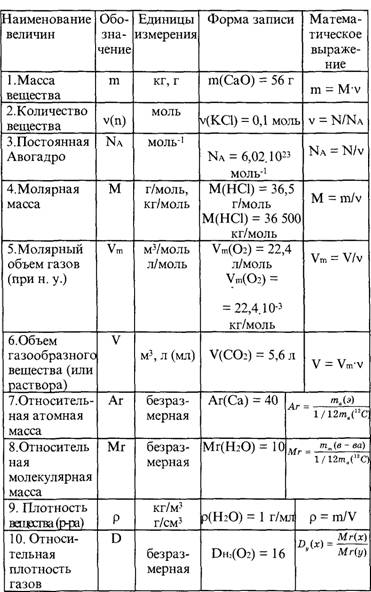 Сплав
Сплав 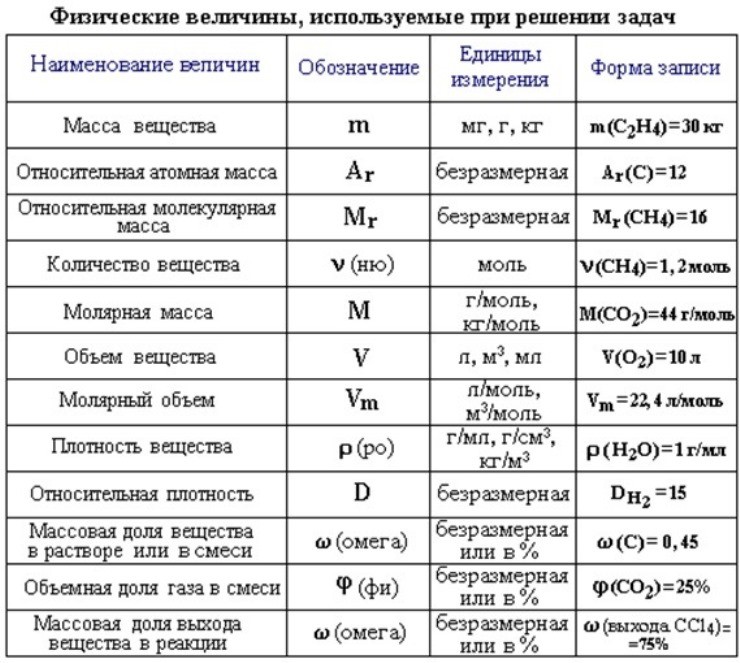 Число Авогадро
Число Авогадро 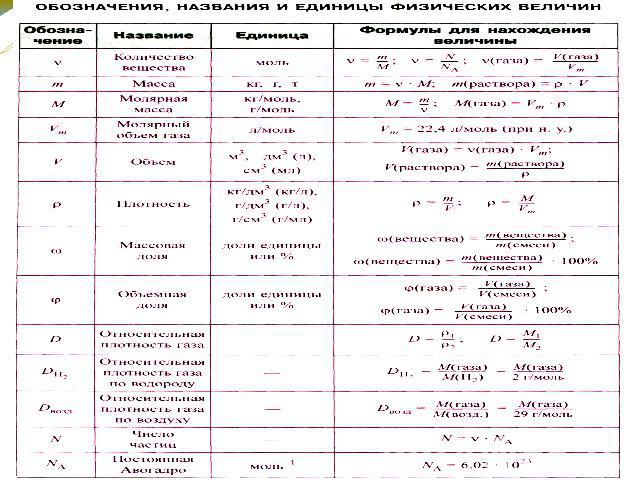 Калориметрия
Калориметрия 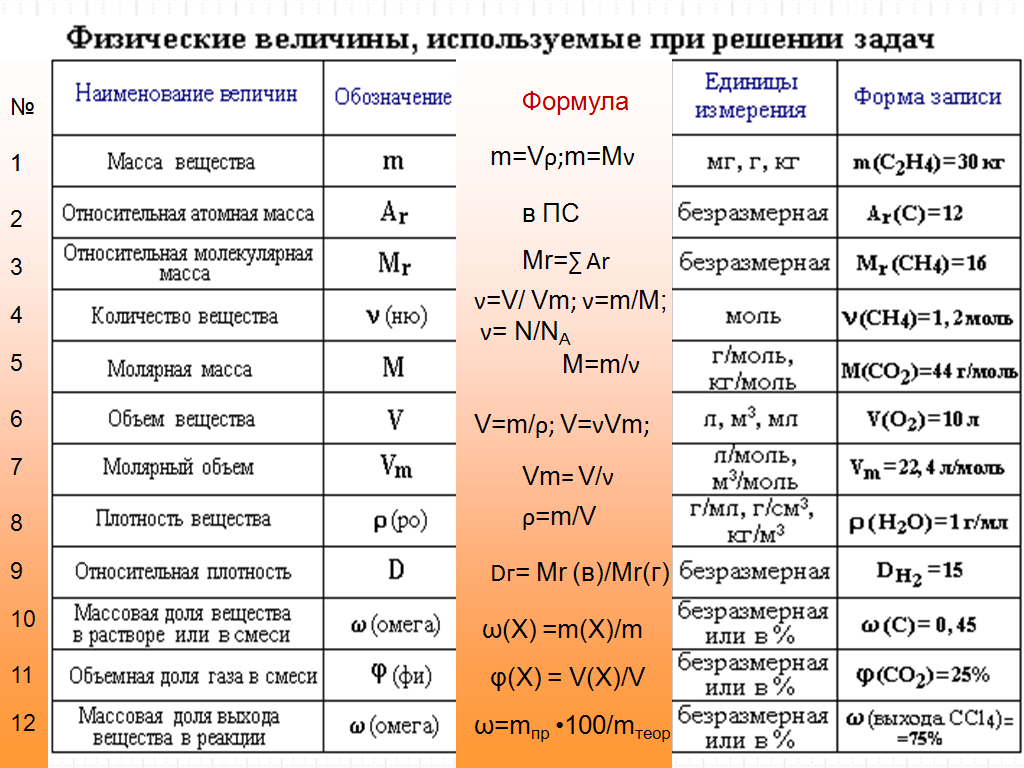 Химическая реакция
Химическая реакция  Проводимость
Проводимость  Опреснение
Опреснение 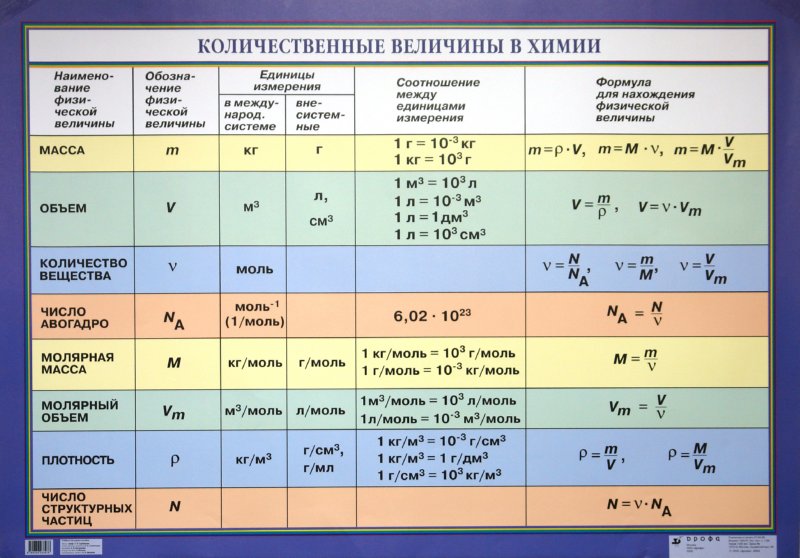 Электрон
Электрон  Фермент
Фермент 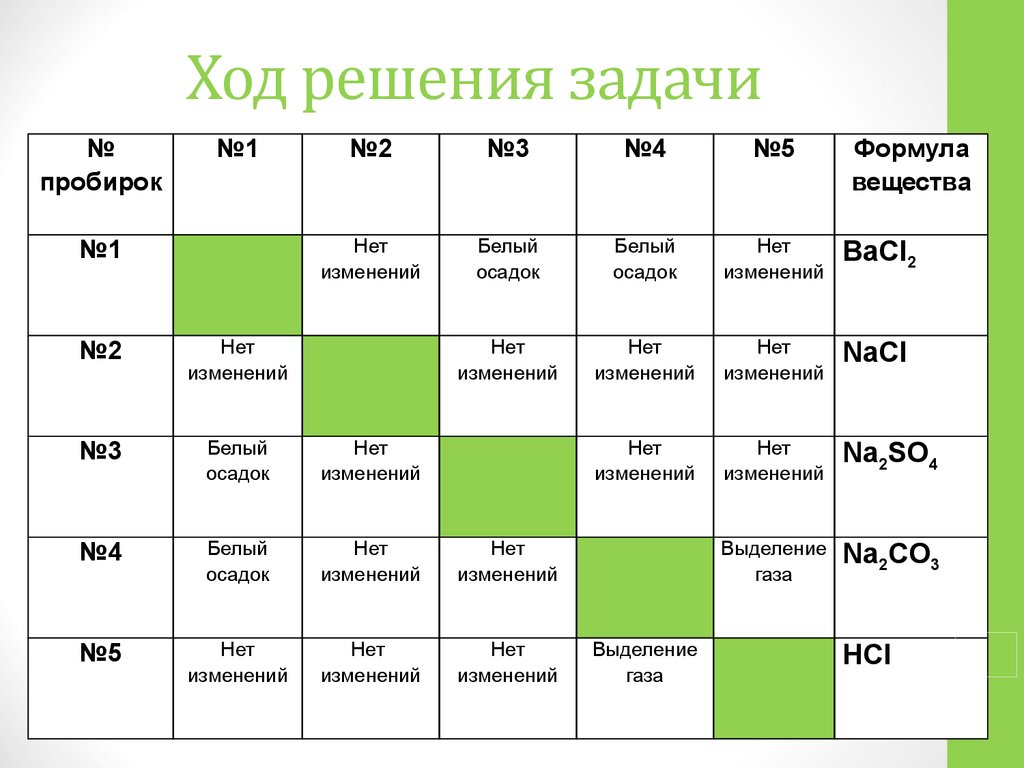 Свободная энергия
Свободная энергия