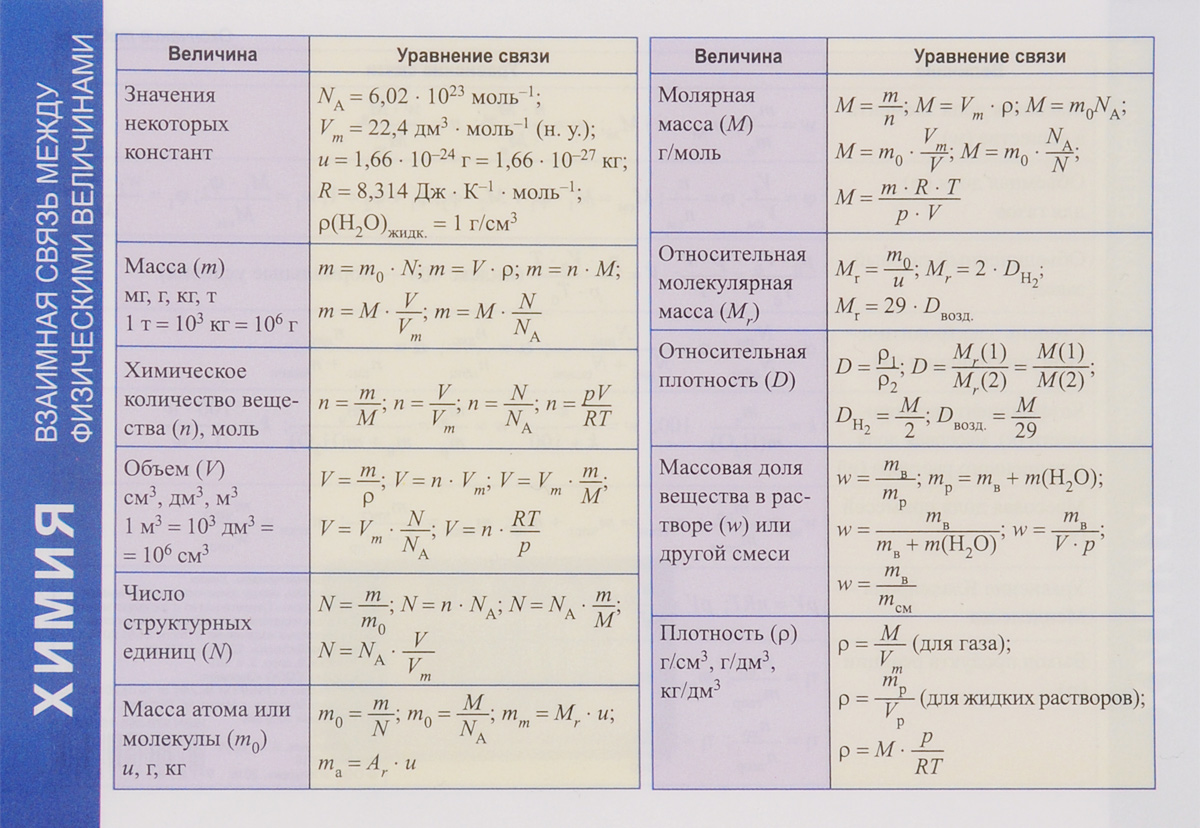
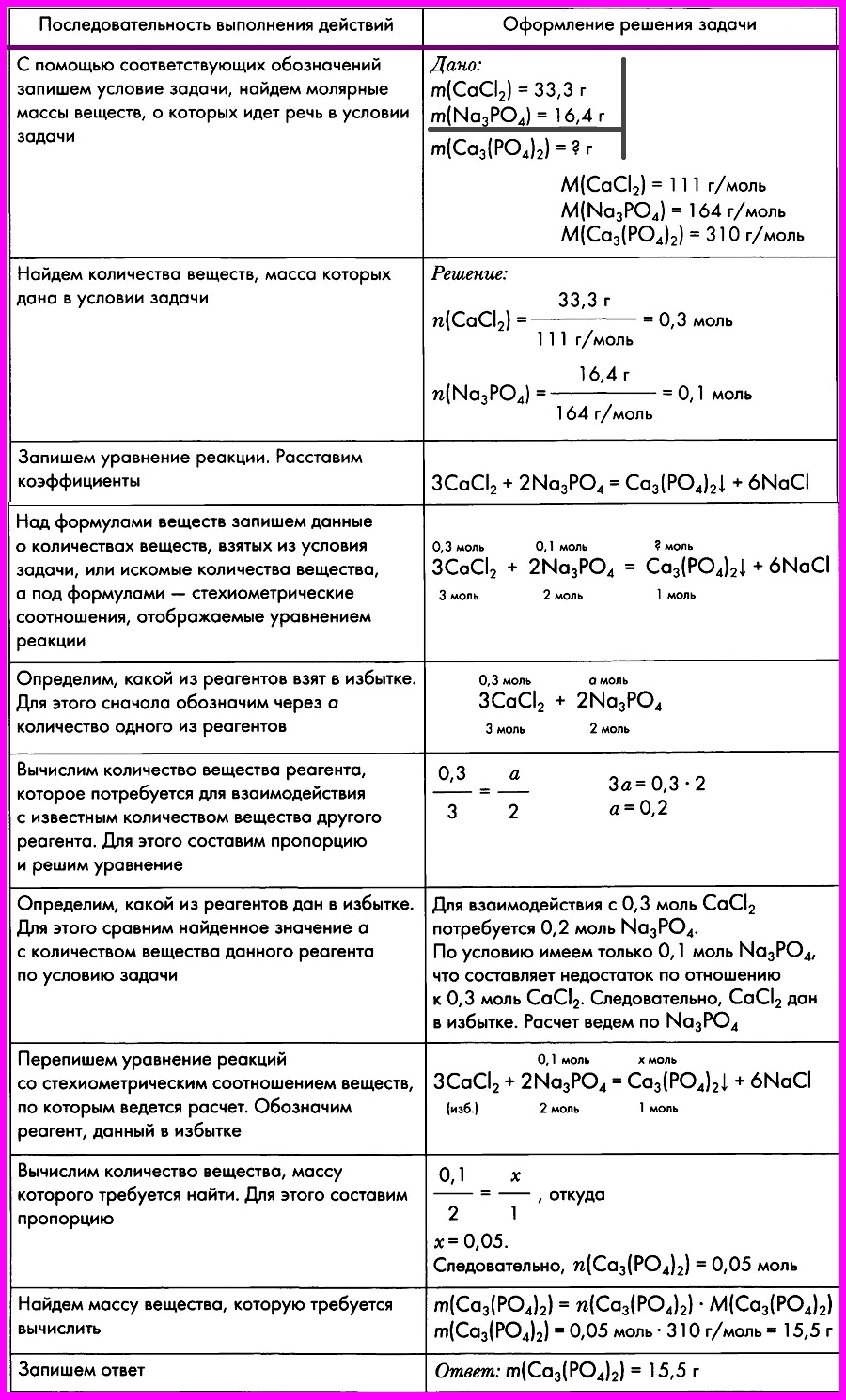
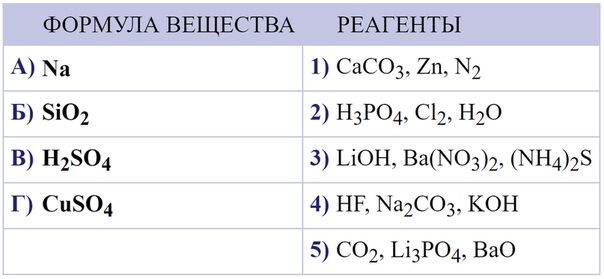
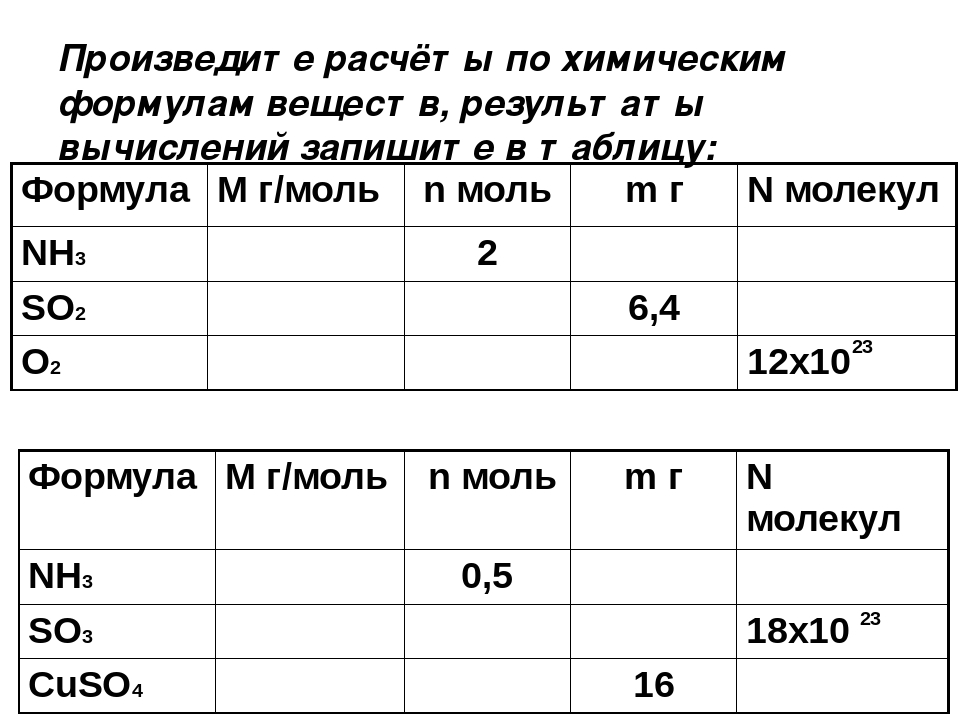
Картинки формулы по химии (56 фото)
Умение разбираться в формулах по химии весьма важно при решении задач, связанных с реакциями веществ. Часто требуется быстро рассчитать молекулярную массу, концентрацию или объем. Одной из основ формул по химии является число Авогадро. По сути это один моль вещества. Представляем вам красивые картинки про формулы по химии, которые тут можно посмотреть.
Находим массу одной молекулы.
Название величин в таблице.
Пронумерованные формулы по химии.
Молярная масса, количество вещества.
Задача из школьной программы.
Картинка формул по химии.
Углекислый газ, оксид азота, сероводород.
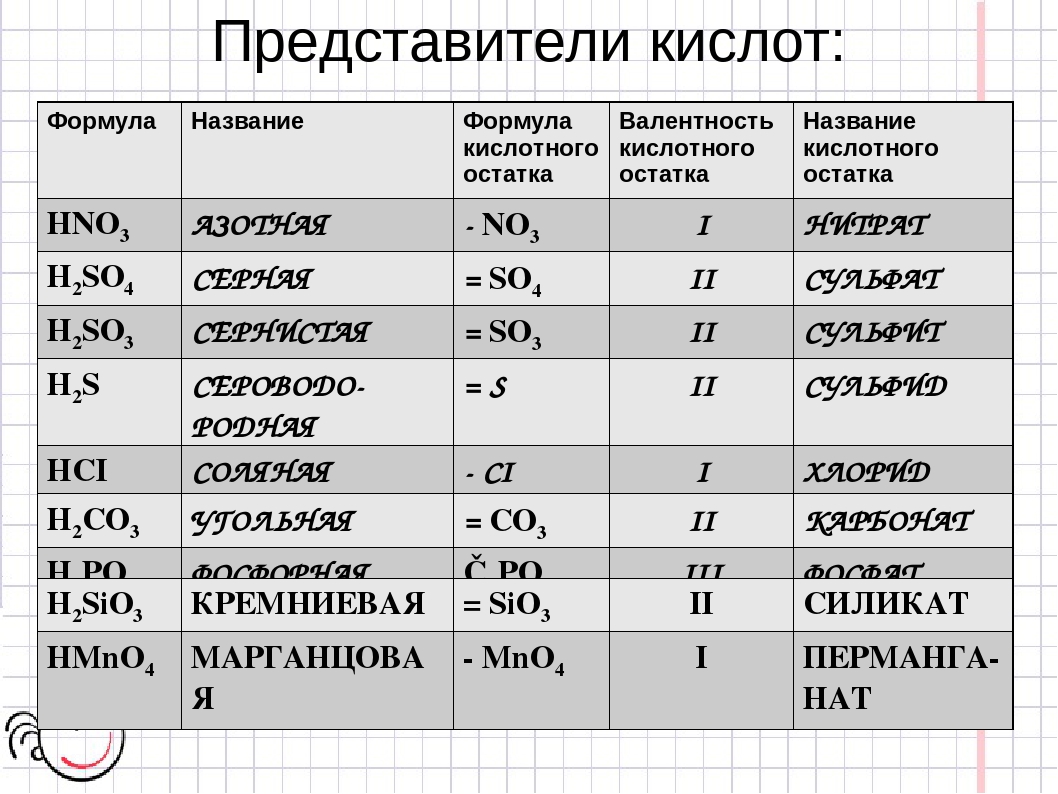
Структуры кислот.
Химические формулы с единицами измерения.
Наименования кислотных остатков.
Этилен, бензол, циклопропан.
Прикольная картинка формул по химии.
Известные элементы из таблицы Менделеева.
Интересные названия кислот.
Столбик с несколькими формулами по химии.
Число частиц, молярный объем.
Постоянная Авогадро, масса вещества.
Небольшая памятка с формулами по химии.
Нахождение числа структурных единиц.
Разбираем состав серной кислоты.
Простая картинка формул по химии.
Примеры в последнем столбике.
Задачи на тему «растворы».
Категории для формул по химии.
Величина с уравнением связи.
Относительная плотность.
Медь и алюминий в формулах по химии.
Объемная доля газа в таблице.
Молярная масса, количество вещества, объем.
Формула по химии из трех составляющих.
Атомная масса вещества.
Проверка знаний класса соединений.
Различные типы формул по химии.
Названия кислот и солей.
Небольшое закрепление знаний.
Красивая картинка формул по химии.
Ионы металлов и кислотных остатков.
Запись состава вещества символами.
Важные кислоты в формулах по химии.
Финальный результат эксперимента.
Узнаем число частиц.
Валентность кислотного остатка в формулах по химии.
Сложные химические соединения.
Вещество, растворенное в одном литре раствора.
Использование формул по химии в задачах.
Фосфористая кислота, нитрит.
Единица измерения в граммах на моль.
Правильное чтение формул по химии.
Получение величин в процентах.
Масса одной молекулы.
Четыре формулы по химии.
Распределение веществ по группам и признакам.
Масса сплава, объем смеси газов.
Формулы по химии с обозначениями.
Количественные величины в таблице.
Понравился пост? Оцените его:
Рейтинг: 5,00/5 (голосов: 1)
Поделитесь с друзьями!
ТОП-3 лучших приложения для решения химии, задач и реакций
На чтение 4 мин Просмотров 24.2к. Опубликовано
Google Play и Apple Store содержит много школьных и обучающих программ. Среди них можно выделить три приложения для решения задач, уравнений по химии. Они содержат полезную справочную информацию и помогут при обучении школьникам, студентам.
Все три мобильных сервиса для решения задач, уравнений по химии обладают четырьмя особенностями:
- Лаконичный, ненавязчивый дизайн;
- Удобное управление, система поиска;
- Программы занимают мало памяти, поэтому пользователь может установить на свой телефон три программных продукта;
- Наличие дополнительных инструментов, справочной информации, необходимой при решении задач, уравнений, контрольных работ.
Приложения разработаны с учетом классической учебной программы. Сервисы помогут справиться с заданием любой сложности, в значительной степени облегчат процесс обучения.
Химия от Denis Chaschin
Приложение предоставляет возможность решать уравнения по химии разной сложности с одним или несколькими неизвестными. В любой момент ученик может открыть таблицу Менделеева, растворимости веществ, воспользоваться специальным калькулятором высчитывания молярной массы.
Программа рассчитана на решение задач из разделов органической, неорганической химии.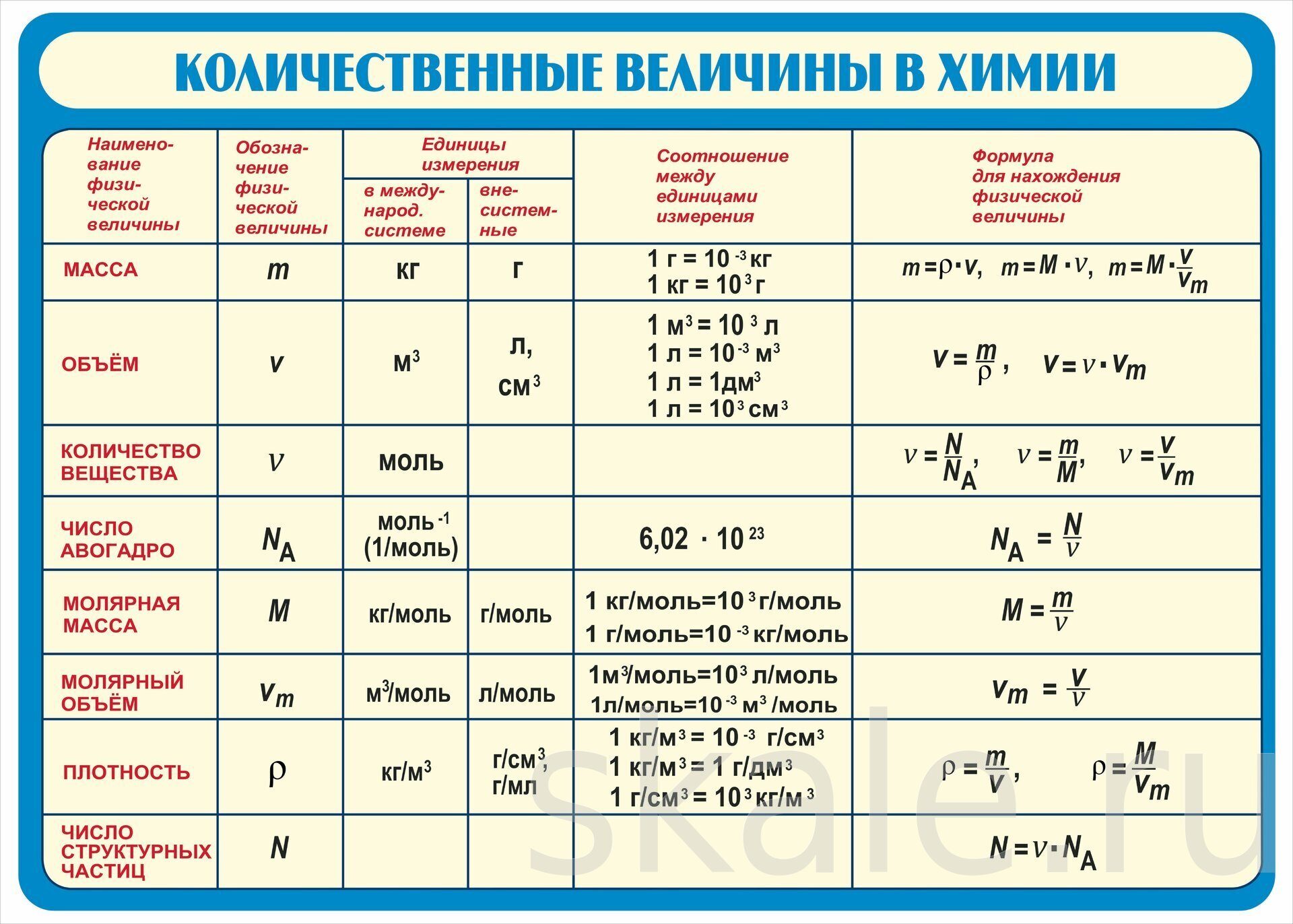 Пользователю предоставляются реакции в стандартном, ионном виде. Чтобы узнать сведения об элементе, достаточно нажать на него при просмотре удобной интерактивной таблицы Менделеева. Все необходимые данные для решения уравнений, лучшего усвоения материала содержит одно приложение. Это позволяет обойтись без учебников или справочников.
Пользователю предоставляются реакции в стандартном, ионном виде. Чтобы узнать сведения об элементе, достаточно нажать на него при просмотре удобной интерактивной таблицы Менделеева. Все необходимые данные для решения уравнений, лучшего усвоения материала содержит одно приложение. Это позволяет обойтись без учебников или справочников.
Сервис содержит таблицы электрической отрицательности элементов, молекулярной массы, электрохимического ряда активности металлов. Программа отличается удобным, понятным на интуитивном уровне интерфейсом. Пользователи отмечают при написании отзывов, что используют сервис для проверки заданий. Количество скачиваний в Google Play – более 1000 000.
Вам может быть интересно: ГДЗ приложения и решебники на Андроид: ТОП-3 полезных для школы
Химия X10 от AppCrab LLC
Бесплатное универсальное приложение для решения домашних заданий и контрольных работ по химии рассчитано на школьников, обучающихся в 7, 8, 9, 10, 11 классах. Программа обладает возможностями:
Программа обладает возможностями:
- Решение заданий. «Химия X10» решит упражнение разной сложности с предоставлением объяснений решения. Пользователю необходимо только правильно ввести данные из условия задачи.
- Шпаргалки. Сервис включает 150 шпаргалок с материалом из основных тем органической, неорганической химии. Удобная система поиска позволяет быстро найти нужные сведения.
- Калькулятор вычисления молярных масс. Инструмент предоставляет возможность узнать массу любого соединения, округлить результат или перевести его в другую единицу измерения.
- Таблица Менделеева. Она содержит подробные данные о каждом элементе.
- Конвертер. Удобный инструмент быстро переводит любую химическую величину.
Приложение работает без подключения к интернет-связи. Программа позволяет решить задачи по формулам, уравнению химической реакции, на растворы и других видов. «Химия X10» имеет защиту от преподавателя – «Звонок мамы». Эта функции позволяет замаскировать процесс списывания решения задания во время урока, когда учитель находится рядом.
Эта функции позволяет замаскировать процесс списывания решения задания во время урока, когда учитель находится рядом.
Сервис подходит ученикам, которые плохо разбираются или не понимают предмет. Приложение имеет платную подписку на «Pro-версию». Она предоставляет дополнительные функции для решения химических уравнений
Химические реакции от Chemical Reactions App
Программа разработана для школьников, которые обучаются в 7-11 классах. Сервис работает бесплатно, не требует обязательного подключения к интернету, включает три основные функции:
- Поиск реакций по реагентам или продуктам. Функция отличается возможностью автоматического дополнения, позволяющая быстро найти варианты.
- Балансировка реакций, включая сложные окислительно-восстановительные превращения.
- Вычисление молекулярной массы химических веществ.
Для максимального удобства пользователей разработан механизм ввода формул. Приложение предусматривает возможность введение формулы строчными буквами, что экономит время. Периодически база данных приложения обновляется, пополняется, редактируется.
Периодически база данных приложения обновляется, пополняется, редактируется.
Программы позволяют быстро и правильно решить задания, уравнения по сложному предмету. Они полезны ученикам, абитуриентам, студентам и преподавателям, людям, чья работа связана с химической отраслью, медициной, фармацевтикой.
Читайте также:
Решение задач на нахождение химической формулы органического вещества урок закрепления материала 10 класс химико-биологический профиль
РЕШЕНИЕ ЗАДАЧ НА НАХОЖДЕНИЕ ХИМИЧЕСКОЙ ФОРМУЛЫ ОРГАНИЧЕСКОГО ВЕЩЕСТВА
Урок закрепления материала
10 класс
химико-биологический профиль
Учитель химии
Тарасова Н.И.
Цель. Продолжить формирование
навыков решения задач на нахождение
химической формулы органического
вещества, довести умения решения задач
до оптимального уровня.
Задачи.
Закрепить знания о физических величинах: массе, объеме, количестве вещества, молярной массе, плотности и относительной плотности по газообразному веществу, массовой доле вещества.
Отработать умение пользоваться формулами определения физических величин для нахождения химической формулы органического вещества.
Довести умения решать задачи на нахождение химической формулы органического вещества до оптимального уровня.
Продолжить формировать умения логически мыслить.
Методы. Беседа, работа с формулами, решение задач, применение ИКТ, составление алгоритмов, самостоятельная работа.
Оборудование.
Интерактивная доска.
Таблица «Основные формулы для решения задач».
ПЛАН УРОКА
Организационный момент (тема и цели урока).

Повторение и обобщение изученного ранее материала
Решение задач, составление алгоритмов.
Индивидуальное задание.
ХОД УРОКА.
Организационный момент (тема и цели урока).
Повторение и обобщение изученного ренее материала.
Устный опрос:
Какие вещества органические вещества относят к кислородсодержащим углеводородам?
Что такое функциональная группа?
Как называют и каков состав функциональных групп спиртов, альдегидов, кетонов и карбоновых кислот?
Перечислить общие формулы кислородсодержащих углеводородов.
Как расчитывают молекулярны массы по общей формуле?
Повторение расчетных формул.
Вывод химической формулы вещества: | Расчетные формулы | Задачи для решения |
– ПЕРВЫЙ УРОВЕНЬ | АхВу (А)/Аr(А): (В)/Аr(В) (В) = х Аr(В)/ М(АхВу) Dвод. Dкисл.( АхВу) = М(АхВу)/32 | №1 Уровень А 1,2 В 1,2 С 1 |
– ВТОРОЙ УРОВЕНЬ по массе или объёму исходного вещества и продуктам горения или образования веществ | М =Vm·ρ V = m / ρ n = V/ Vm n = m / М Dвозд.( АхВу) = М(АхВу)/29 Dвод.( АхВу) = М(АхВу)/2 | №2 Уровень А 1,2 В 1,2 |
III. Решение задач учениками у доски и составление алгоритмов решения задач.
Задачи для решения:
ПЕРВЫЙ
УРОВЕНЬ.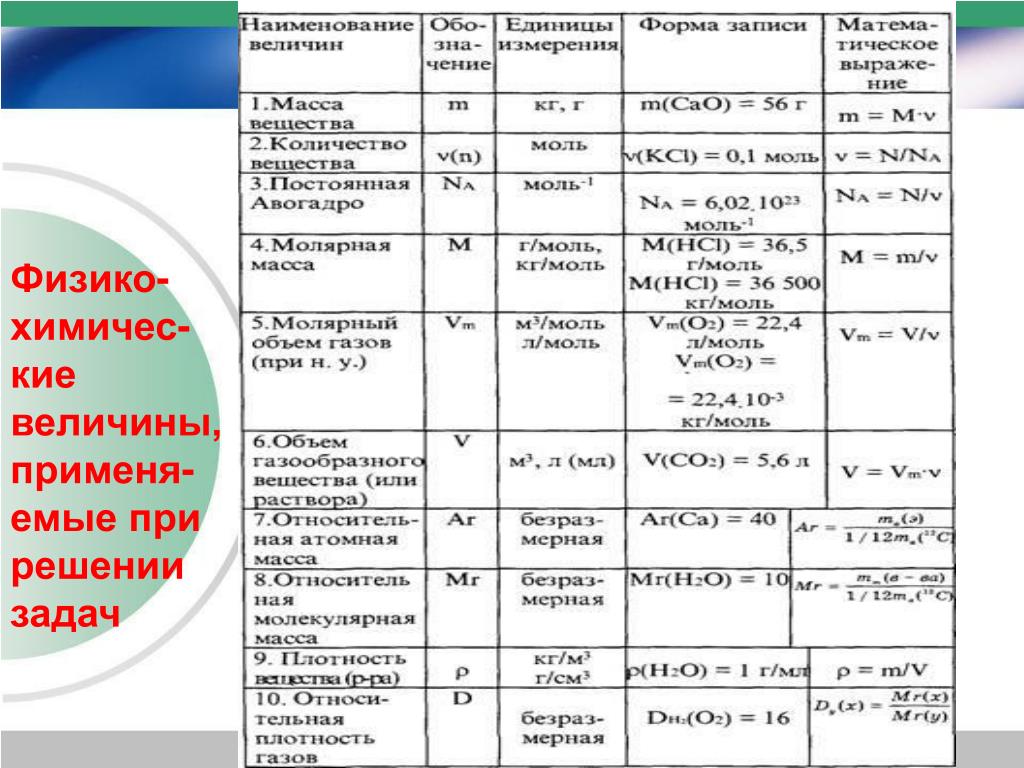
А.
1. Одноосновная карбоновая кислота имеет следующий состав: С – 26,1%, Н – 4,35%, О – 69,55%. Исходя из этих данных, найдите молекулярную формулу этой кислоты.
Решение:
СхНуОz
х : у : z = 26,1/12 : 4,35/1 : 69,55/16 = 2,175 : 4,35 : 4,35 = 1 : 2 : 2
Ответ: НСООН
2. По данным элементного анализа одноосновной карбоновой кислоты было установлено, что в ней 48,65% углерода, 8,11% водорода. Выведите молекулярную формулу этой кислоты. Напишите формулы строения изомерных соединений.
Решение:
СхНуОz
х : у : z = 48,65/12 : 8,11/1 : 43,24/16 = 4,05 : 8,11 : 2,7 = (1,5 : 3 : 1) 2 = 3 : 6 : 2
Ответ: С2Н5СООН
В.
1. При анализе вещества
нашли, что в его состав входят 40% углерода,
6,66% водорода. 53,34% кислорода. Найдите
молекулярную формулу и назовите это
вещество, если известно, что плотность
его паров по воздуху равна 2,07.
Решение:
СхНуОz
х : у : z = 40/12 : 6,66/1 : 53,34/16 = 3,33 : 6,66 : 3,33 = 1 : 2 : 1
Простейшая формула: СН2О
М(СхНуОz) = Dвозд.∙ М(возд.) = 2,07 ∙ 29 = 60г/моль
М(СН2О) = 30г/моль
М(СхНуОz)/ М(СН2О) = 60/30 = 2
СН2О ∙ 2 = С2Н4О2
Ответ: СН3 СООН
2. Плотность по водороду вещества, имеющего массовый состав: С – 54,55%, Н – 9,09%, О – 36,36%, равна 22. Выведите молекулярную формулу этого вещества.
Решение:
СхНуОz
х : у : z = 54,55/12 : 9,09/1 : 36,36/16 = 4.55 : 9,09 : 2,27 = 2 : 4 : 1
Простейшая формула: С2Н4О
М(СхНуОz) = Dвозд.∙ М(вод.) = 2∙ 22 = 44г/моль
М(С2Н4О) = 44г/моль
Ответ: СН3 СОН
С.
1. Установите молекулярную формулу предельной одноосновной карбоновой кислоты, натриевая соль которой содержит 33,82% металла.
Решение:
М(СnH2n+1COONa) = 14n + 68
0,3382 = 23/14n + 68
23 = 23 – 4,73 n
n = 0
С0Н1СООН
Ответ: НСООН
АЛГОРИТМ. Нахождение молекулярной формулы на основании массовых долей атомов элементов и относительной плотности его по другому газу.
Запишем формулу вещества, обозначив индексы х , у и z . СхНуОz
Найдем отношение х : у : z = (С)/Аr(С): (Н)/Аr(Н) : (О)/Аr(О)
Отношения находят до целых чисел: делят на наименьшее, если необходимо, учеличивают в 2 раза.
Полученные числа – это индексы в формуле.

ВТОРОЙ УРОВЕНЬ.
А.
1. При сгорании 4,6г органического вещества с плотностью его паров по воздуху 1,586 получено 5,4г воды и 4,48л углекислого газа (н.у.). определите формулу сгоревшего углеводорода.
Решение:
СхНуОz + О2 = х СО2 + у/2 Н2О
М(СхНуОz) = Dвозд.∙ М(возд.) = 1,586 ∙ 29 = 46г/моль
n = m / М
n = 4,6г :46г/моль = 0,1 моль
n = 5,4г :18г/моль = 0,3 моль
n = V/ Vm
n = 4,48л : 22,4 л/моль = 0,2 моль
0,1 : 0,2 : 0,3 = 1 : 2 : 3
х = 2 у = 6
С2Н6
М (С2Н6) = 30г/моль
М(СхНуОz) = 46г/моль – 30г/моль = 16 г/моль
Ответ: С2Н5ОН
2.При
сжигании 7,5г органического вещества
образуется 4,5г водяных паров и 11г оксида
углерода (IV).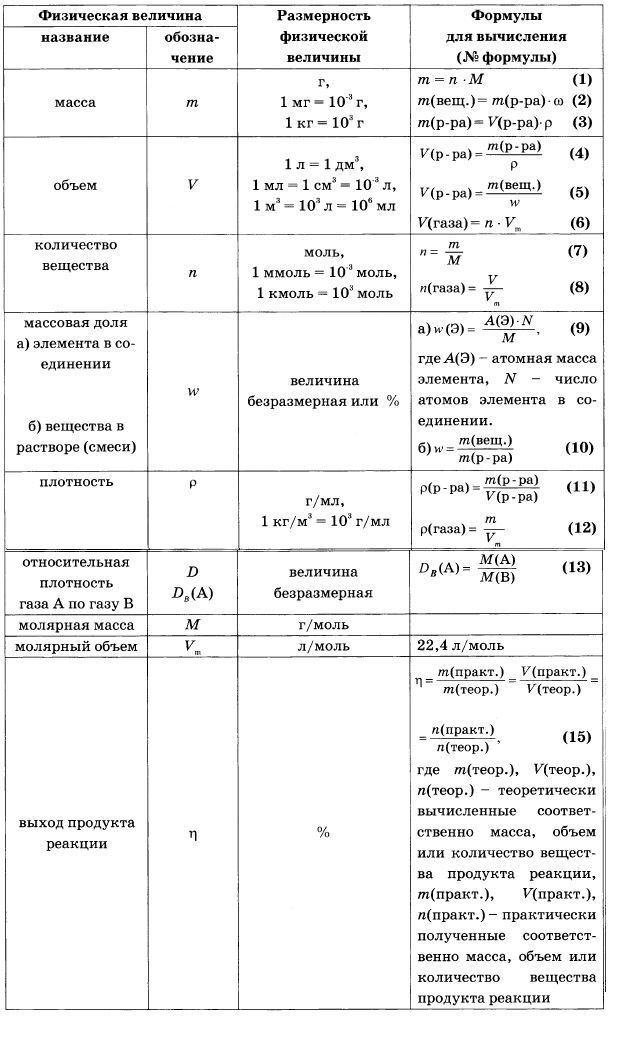 Найдите молекулярную формулу вещества
и назовите его, если известно, что
плотность его паров по водороду равна
15.
Найдите молекулярную формулу вещества
и назовите его, если известно, что
плотность его паров по водороду равна
15.
Решение:
СхНуОz + О
М(СхНуОz) = Dвод.∙ М(вод.) = 15 ∙ 2 = 30г/моль
n = m / М
n = 7,5г :30г/моль = 0,25 моль
n = 4,5г :18г/моль = 0,25моль
n = 11г :44г/моль = 0,25моль
0,25 : 0,25 : 0,25 = 1 : 1 : 1
х = 1 у = 2
СН2
М(СН2) = 14г/моль
М(СхНуОz) = 30г/моль – 14г/моль = 16 г/моль
Ответ: НСОН
В.
1. При взаимодействии предельного альдегида массой 5,8г с избытком гидроксида меди (II) при нагревании образовалось 14,4г осадка оксида меди (I). Установите молекулярную формулу альдегида.
Решение:
СnН2n+1 CОH + 2Cu(OH)2 = СnН2n+1 CОOH + Cu2O + 2H2O
n (СnН2n+1 CОH) = n (Cu2O) = 14,4/144 = 0,1 моль
М(СnН2n+1 CОH) = 5,8г/0,1моль = 58г/моль
М(СnН2n+1 CОH) = 14 n + 30
14 n + 30 = 58
n = 2
Ответ: С2Н5СОН
2. При
обработке некоторого количества
предельного одноатомного спирта натрием
выделилось 2.24л газа (н.у.), а при окислении
того же количества спирта образовалось
11,6г альдегида. Определите формулу
спирта.
При
обработке некоторого количества
предельного одноатомного спирта натрием
выделилось 2.24л газа (н.у.), а при окислении
того же количества спирта образовалось
11,6г альдегида. Определите формулу
спирта.
Решение:
2СnН2n+1 ОH+ 2Na → Н2 + 2 СnН2n+1 ОNa
n(Н2) = V(Н2) : Vm= 2,24 / 22,4 = 0,1моль
n(СnН2n+1 ОH) = n(Н2)∙2 = 2 ∙ 0,1 = 0,2 моль
СnН2n+1 ОH+ [О]→СnН2nО
n(СnН2nО) = n(СnН2n+1 ОH) =0,2 моль
М(СnН2nО) = 11,6/0,2 = 58г/моль
М(СnН2n+1 ОH) = М(СnН2nО) + 2 = 60г/моль
14 n + 18 = 60
n = 3
Ответ: С3Н7ОН
АЛГОРИТМ: Нахождение
молекулярной формулы по наличию продуктов
сгорания вещества.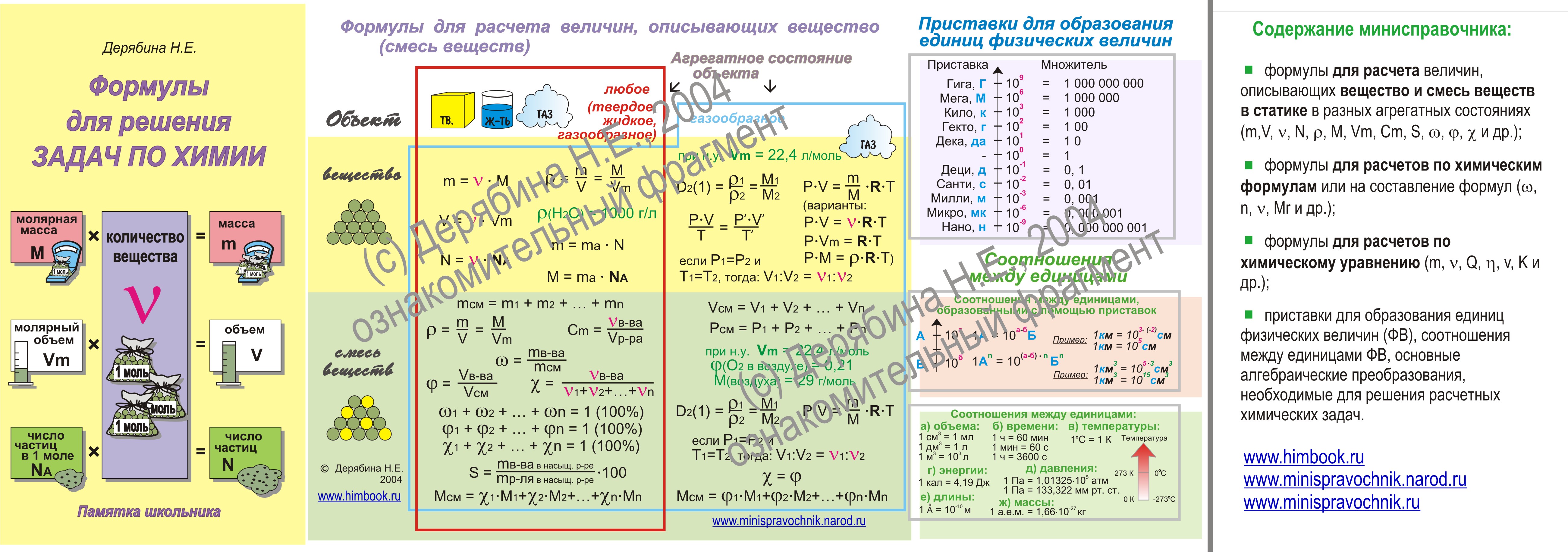
1.Определить простейшую формулу вещества: CXHYOZ= ?C😕Н😕О.
2. Определить истинную молярную массу.
3. Определить молярный фактор – отношение истинной молярной массы к простейшей p = Мист/Мпрост.
4.Найти молекулярную формулу вещества. Умножить индексы простейшей формулы на молярный фактор.
5. Найти структурную формулу. Выписать структурные формулы всех изомеров и выбрать тот, который удовлетворяет условию задачи.
IV. Индивидуальное задание:
Первый уровень (А). Вещество имеет следующий элементный состав: С – 19,4%; Н – 3,2%; О – 77,4% (по массе). Определите его формулу.

Первый уровень (В). Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения.
Второй уровень (А).Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.
Ответы:
Ответ: Н2СО3
Ответ: С6Н12О
Ответ: С6Н14О
13.4 Равновесные расчеты — химия
Цели обучения
К концу этого раздела вы сможете:- Написать уравнения, представляющие изменения концентрации и давления химических веществ в равновесных системах
- Использование алгебры для выполнения различных типов расчетов равновесия
Мы знаем, что в состоянии равновесия значение коэффициента реакции любой реакции равно ее константе равновесия. Таким образом, мы можем использовать математическое выражение для Q , чтобы определить ряд величин, связанных с реакцией, находящейся в равновесии или приближающейся к равновесию.Хотя мы научились определять, в каком направлении сместится реакция, чтобы достичь равновесия, мы хотим распространить это понимание на количественные расчеты. Мы делаем это, оценивая способы изменения концентраций продуктов и реагентов по мере того, как реакция приближается к равновесию, имея в виду стехиометрические отношения реакции. Этот алгебраический подход к расчетам равновесия будет рассмотрен в этом разделе.
Таким образом, мы можем использовать математическое выражение для Q , чтобы определить ряд величин, связанных с реакцией, находящейся в равновесии или приближающейся к равновесию.Хотя мы научились определять, в каком направлении сместится реакция, чтобы достичь равновесия, мы хотим распространить это понимание на количественные расчеты. Мы делаем это, оценивая способы изменения концентраций продуктов и реагентов по мере того, как реакция приближается к равновесию, имея в виду стехиометрические отношения реакции. Этот алгебраический подход к расчетам равновесия будет рассмотрен в этом разделе.
Изменения концентрации или давления реагентов и продуктов происходят по мере того, как реакционная система приближается к равновесию.В этом разделе мы увидим, что мы можем связать эти изменения друг с другом, используя коэффициенты в сбалансированном химическом уравнении, описывающем систему. В качестве примера возьмем разложение аммиака.
При нагревании аммиак обратимо разлагается на азот и водород по уравнению:
2Кh4(г)⇌К2(г)+3h3(г)2Кh4(г)⇌К2(г)+3h3(г) При разложении пробы аммиака в замкнутой системе и увеличении концентрации N 2 на 0,11 М изменение концентрации N 2 , Δ[N 2 ], конечная концентрация минус начальная концентрация, равна 0. 11 М . Изменение положительное, поскольку концентрация N 2 увеличивается.
11 М . Изменение положительное, поскольку концентрация N 2 увеличивается.
Изменение концентрации H 2 , Δ[H 2 ], также положительное – концентрация H 2 увеличивается по мере разложения аммиака. Химическое уравнение говорит нам, что изменение концентрации H 2 в три раза превышает изменение концентрации N 2 , потому что на каждый произведенный моль N 2 приходится 3 моля H 2 .
Δ[h3]=3×Δ[N2]Δ[h3]=3×Δ[N2] =3×(0,11М)=0,33М=3×(0,11М)=0,33МИзменение концентрации NH 3 , Δ[NH 3 ], вдвое больше, чем Δ[N 2 ]; уравнение показывает, что 2 моля NH 3 должны разложиться на каждый образовавшийся моль N 2 . Однако изменение концентрации NH 3 отрицательно, поскольку концентрация аммиака уменьшается по мере его разложения.
Δ[Nh4]=−2×Δ[N2]=−2×(0,11M)=−0,22MΔ[Nh4]=−2×Δ[N2]=−2×(0.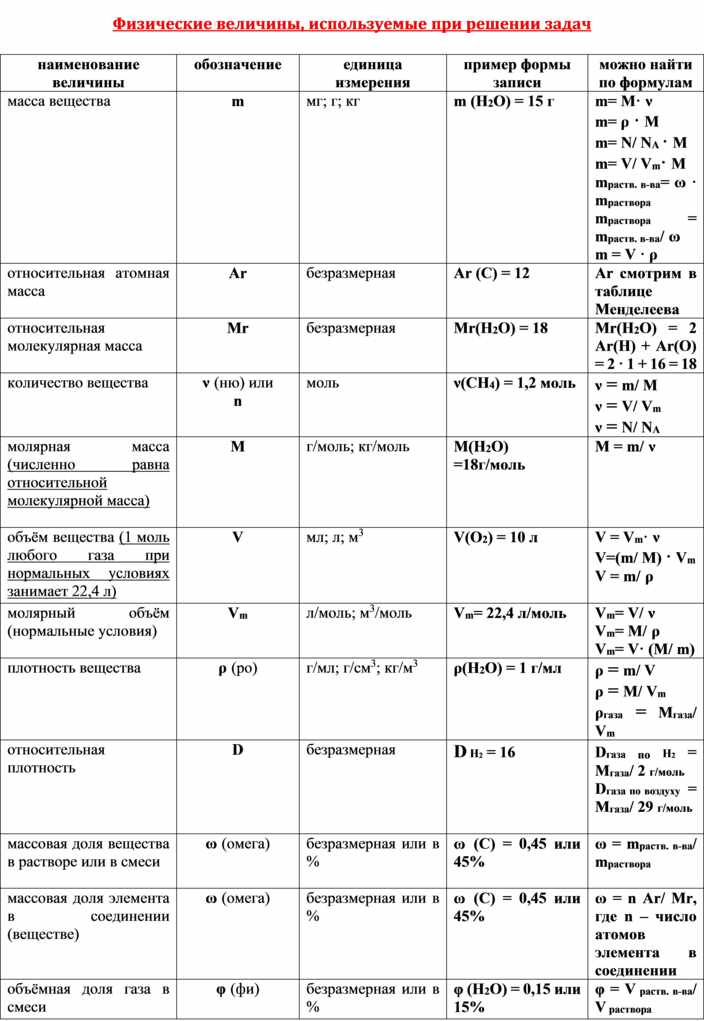 11М)=-0,22М
11М)=-0,22ММы можем напрямую связать эти отношения с коэффициентами в уравнении
2Nh4(г)⇌N2(г)+3h3(г)Δ[Nh4]=−2×Δ[N2]Δ[N2]=0,11MΔ[h3]=3×Δ[N2]2Nh4(г)⇌N2( g)+3h3(g)Δ[Nh4]=−2×Δ[N2]Δ[N2]=0,11MΔ[h3]=3×Δ[N2]Обратите внимание, что все изменения с одной стороны стрелок имеют один и тот же знак, а все изменения с другой стороны стрелок имеют противоположный знак.
Если бы мы не знали величину изменения концентрации N 2 , мы могли бы представить ее символом x .
Тогда изменения других концентраций будут представлены как:
Δ[h3]=3×Δ[N2]=3xΔ[h3]=3×Δ[N2]=3x Δ[Nh4]=−2×Δ[N2]=−2xΔ[Nh4]=−2×Δ[N2]=−2xКоэффициенты в членах Δ идентичны коэффициентам в сбалансированном уравнении реакции.
2Nh4(g)⇌N2(g)+3h3(g)−2xx3x2Nh4(g)⇌N2(g)+3h3(g)−2xx3x Самый простой способ найти коэффициенты для изменения концентрации в любой реакции — это использовать коэффициенты в сбалансированном химическом уравнении. Знак коэффициента положительный при увеличении концентрации; он отрицательный, когда концентрация уменьшается.
Пример 13,5
Определение относительных изменений концентрации
Заполните изменения концентраций для каждой из следующих реакций.(а) C2h3(г)+2Br2(г)⇌C2h3Br4(г)x__________C2h3(г)+2Br2(г)⇌C2h3Br4(г)x__________
(б) I2(вод)+I-(вод)⇌I3-(вод)__________xI2(вод)+I-(вод)⇌I3-(вод)__________x
(c) C3H8(г)+5O2(г)⇌3CO2(г)+4h3O(г)x_______________C3H8(г)+5O2(г)⇌3CO2(г)+4h3O(г)x_______________
Решение
(а) C2h3(g)+2Br2(g)⇌C2h3Br4(g)x2x−xC2h3(g)+2Br2(g)⇌C2h3Br4(g)x2x−x(б) I2(вод)+I-(вод)⇌I3-(вод)-x-xxI2(вод)+I-(вод)⇌I3-(вод)-x-xx
(в) C3H8(г)+5O2(г)⇌3CO2(г)+4h3O(г)x5x-3x-4xC3H8(г)+5O2(г)⇌3CO2(г)+4h3O(г)x5x-3x- 4x
Проверьте свои знания
Заполните изменения концентраций для каждой из следующих реакций:(а) 2SO2(г)+O2(г)⇌2SO3(г)_____x_____2SO2(г)+O2(г)⇌2SO3(г)_____x_____
(б) C4H8(г)⇌2C2h5(г)_____−2xC4H8(г)⇌2C2h5(г)_____−2x
(в) 4Nh4(г)+7h3O(г)⇌4NO2(г)+6h3O(г)________________________________4Nh4(г)+7h3O(г)⇌4NO2(г)+6h3O(г)____________________
Отвечать:
(а) 2 х , х , -2 х; (б) х , −2 х; (в) 4 x , 7 x , −4 x , −6 x или −4 x ,
Расчеты с использованием равновесных концентраций
Поскольку значение коэффициента любой реакции в состоянии равновесия равно ее константе равновесия, мы можем использовать математическое выражение для Q c (т. е., закон действующих масс ) для определения ряда величин, связанных с реакцией в состоянии равновесия. Это может помочь, если мы будем помнить, что Q c = K c (в равновесии) во всех этих ситуациях и что существует только три основных типа вычислений:
е., закон действующих масс ) для определения ряда величин, связанных с реакцией в состоянии равновесия. Это может помочь, если мы будем помнить, что Q c = K c (в равновесии) во всех этих ситуациях и что существует только три основных типа вычислений:
- Расчет константы равновесия . Если известны равновесные концентрации реагентов и продуктов, можно рассчитать значение константы равновесия реакции.
- Расчет отсутствующих равновесных концентраций . Если значение константы равновесия и все равновесные концентрации, кроме одной, известны, можно рассчитать оставшуюся концентрацию.
- Расчет равновесных концентраций по начальным концентрациям . Если известно значение константы равновесия и набор концентраций реагентов и продуктов, не находящихся в равновесии, можно рассчитать равновесные концентрации.

Аналогичный список можно создать, используя Q P , K P и парциальное давление. Рассмотрим решение каждого из этих случаев последовательно.
Расчет константы равновесия
Для расчета константы равновесия необходимо иметь достаточно информации для определения равновесных концентраций всех реагентов и продуктов. Вооружившись концентрациями, мы можем решить уравнение для K c , так как оно будет единственным неизвестным.
Пример 13.2 показал нам, как определить константу равновесия реакции, если мы знаем концентрации реагентов и продуктов при равновесии. В следующем примере показано, как использовать стехиометрию реакции и комбинацию начальных концентраций и равновесных концентраций для определения константы равновесия. Этот метод, обычно называемый диаграммой ICE (для I начального состояния, C изменения и E равновесия), будет полезен при решении многих задач равновесия.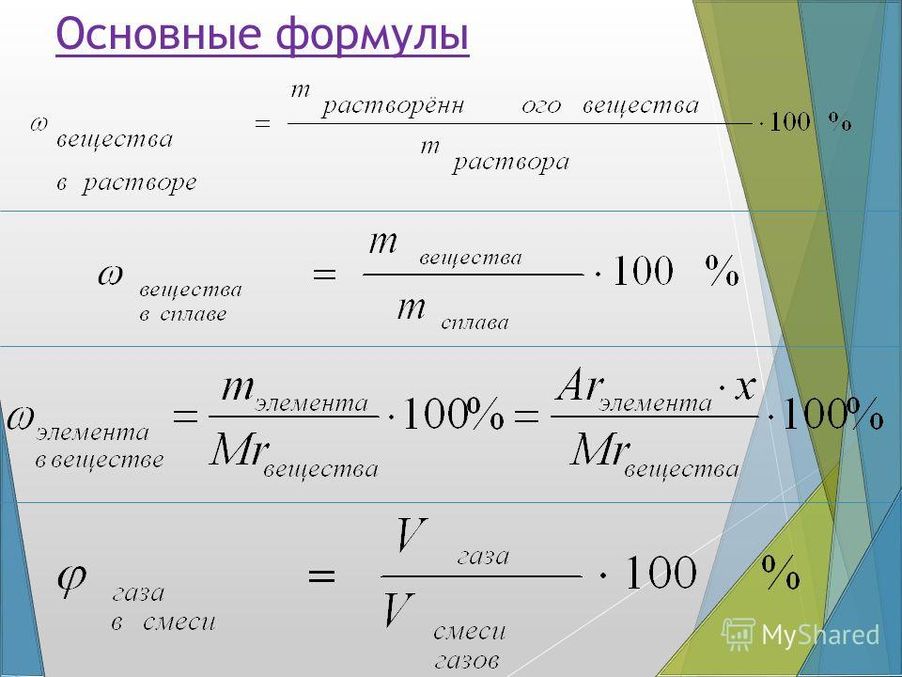 Диаграмма создается, начиная с рассматриваемой равновесной реакции. Начальные концентрации реагентов и продуктов приведены в первой строке таблицы ICE (эти концентрации, по сути, нулевые во времени, которые предполагают, что реакция не произошла). Следующая строка таблицы содержит изменения концентраций, происходящие при приближении реакции к равновесию (не забывайте учитывать стехиометрию реакции). Последняя строка содержит концентрации после достижения равновесия.
Диаграмма создается, начиная с рассматриваемой равновесной реакции. Начальные концентрации реагентов и продуктов приведены в первой строке таблицы ICE (эти концентрации, по сути, нулевые во времени, которые предполагают, что реакция не произошла). Следующая строка таблицы содержит изменения концентраций, происходящие при приближении реакции к равновесию (не забывайте учитывать стехиометрию реакции). Последняя строка содержит концентрации после достижения равновесия.
Пример 13,6
Расчет константы равновесия
Молекулы йода обратимо реагируют с ионами йодида с образованием ионов трийодида. I2(вод)+I-(вод)⇌I3-(вод)I2(вод)+I-(вод)⇌I3-(вод)Если раствор с концентрациями I 2 и I − , равными 1,000 × × 10 −3 M , до реакции дает равновесную концентрацию I 2 , равную 6,61 × × 10 −4 M , чему равна константа равновесия реакции?
Решение
Мы начнем эту задачу с расчета изменений концентрации по мере того, как система приходит в равновесие. Затем определяем равновесные концентрации и, наконец, константу равновесия. Во-первых, мы составили таблицу с начальными концентрациями, изменениями концентраций и равновесными концентрациями, используя – x как изменение концентрации I 2 .
Затем определяем равновесные концентрации и, наконец, константу равновесия. Во-первых, мы составили таблицу с начальными концентрациями, изменениями концентраций и равновесными концентрациями, используя – x как изменение концентрации I 2 .Поскольку равновесная концентрация I 2 задана, мы можем найти x . В равновесии концентрация I 2 равна 6,61 × × 10 −4 M , так что
1.000×10−3−x=6,61×10−41,000×10−3−x=6,61×10−4 х=1,000×10-3-6,61×10-4x=1,000×10-3-6,61×10-4 =3,39×10-4М=3,39×10-4МТеперь мы можем заполнить таблицу равновесными концентрациями.
Теперь вычислим значение константы равновесия.
Kc=Qc=[I3-][I2][I-]Kc=Qc=[I3-][I2][I-] =3,39×10-4М(6,61×10-4М)(6,61×10-4М)=776=3,39×10-4М(6,61×10-4М)(6,61×10-4М)=776Проверьте свои знания
Этанол и уксусная кислота вступают в реакцию и образуют воду и этилацетат, растворитель, ответственный за запах некоторых жидкостей для снятия лака. C2H5OH+Ch4CO2H⇌Ch4CO2C2H5+h3OC2H5OH+Ch4CO2H⇌Ch4CO2C2H5+h3O
C2H5OH+Ch4CO2H⇌Ch4CO2C2H5+h3OC2H5OH+Ch4CO2H⇌Ch4CO2C2H5+h3OКогда по 1 моль каждого из C 2 H 5 OH и CH 3 CO 2 H вступают в реакцию в 1 л растворителя диоксана, равновесие устанавливается, когда остается 1313 моль каждого из реагентов. Рассчитайте константу равновесия реакции. (Примечание: вода не является растворителем в этой реакции.)
Расчет недостающей равновесной концентрации
Если мы знаем константу равновесия реакции и знаем равновесные концентрации всех реагентов и продуктов, кроме одного, мы можем рассчитать недостающую концентрацию.
Пример 13,7
Расчет отсутствующей равновесной концентрации
Оксиды азота представляют собой загрязнители воздуха, образующиеся в результате реакции азота и кислорода при высоких температурах. При 2000 °С значение константы равновесия реакции N2(г)+O2(г)⇌2NO(г),N2(г)+O2(г)⇌2NO(г) составляет 4,1 × × 10 −4 . Рассчитайте равновесную концентрацию NO( г ) в воздухе при давлении 1 атм и температуре 2000°С. Равновесные концентрации N 2 и O 2 при этих давлении и температуре равны 0.036 М и 0,0089 М соответственно.
Рассчитайте равновесную концентрацию NO( г ) в воздухе при давлении 1 атм и температуре 2000°С. Равновесные концентрации N 2 и O 2 при этих давлении и температуре равны 0.036 М и 0,0089 М соответственно.Решение
Даны все равновесные концентрации, кроме NO. Таким образом, мы можем найти недостающую равновесную концентрацию, изменив уравнение для константы равновесия. Kc=Qc=[NO]2[N2][O2]Kc=Qc=[NO]2[N2][O2] [NO]2=Kc[N2][O2][NO]2=Kc[N2][O2] [NO]=Kc[N2][O2][NO]=Kc[N2][O2] =(4,1×10-4)(0,036)(0,0089)=(4,1×10-4)(0,036)(0,0089) =1,31×10-7=1,31×10-7Таким образом, [NO] составляет 3,6 × × 10 -4 моль/л в равновесии в этих условиях.
Мы можем проверить наш ответ, подставив все равновесные концентрации в выражение для коэффициента реакции, чтобы увидеть, равен ли он константе равновесия.
Qc=[NO]2[N2][O2]Qc=[NO]2[N2][O2] =(3,6×10−4)2(0,036)(0,0089)=(3,6×10−4)2(0,036)(0,0089) Qc=4,0×10-4=KcQc=4,0×10-4=Kc Проверка ответа; наше вычисленное значение дает константу равновесия в пределах погрешности, связанной со значащими цифрами в задаче.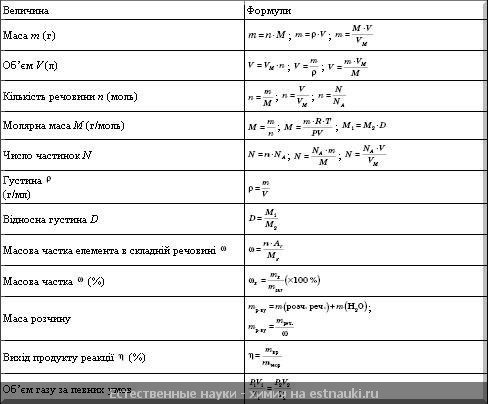
Проверьте свои знания
Константа равновесия реакции азота и водорода с образованием аммиака при определенной температуре равна 6.00 × × 10 −2 . Рассчитайте равновесную концентрацию аммиака, если равновесные концентрации азота и водорода равны 4,26 М и 2,09 М соответственно.Расчет равновесных концентраций по начальным концентрациям
Если мы знаем константу равновесия реакции и набор концентраций реагентов и продуктов, которые не находятся в равновесии , мы можем рассчитать изменения концентраций по мере того, как система приходит в равновесие, а также новые концентрации в равновесии.Типичная процедура может быть сведена к четырем этапам.
- Определите, в каком направлении протекает реакция, чтобы прийти к равновесию.
- Напишите сбалансированное химическое уравнение реакции.

- Если направление, в котором должна протекать реакция для достижения равновесия, неочевидно, рассчитайте Q c из начальных концентраций и сравните с K c , чтобы определить направление изменения.
- Напишите сбалансированное химическое уравнение реакции.
- Определите относительные изменения, необходимые для достижения равновесия, затем запишите равновесные концентрации в терминах этих изменений.
- Определите изменения начальных концентраций, необходимые для достижения равновесия реакции. Как правило, мы представляем наименьшее изменение с помощью символа x и выражаем другие изменения в терминах наименьшего изменения.
- Определить отсутствующие равновесные концентрации с точки зрения начальных концентраций и изменений концентрации, определенных в (а).
- Найдите изменение и равновесные концентрации.
- Подставьте равновесные концентрации в выражение для константы равновесия, найдите x и проверьте все допущения, использованные для нахождения x .

- Рассчитайте равновесные концентрации.
- Подставьте равновесные концентрации в выражение для константы равновесия, найдите x и проверьте все допущения, использованные для нахождения x .
- Проверьте арифметику.
- Проверьте рассчитанные равновесные концентрации, подставив их в выражение равновесия и определив, дают ли они константу равновесия.
Иногда конкретный шаг может отличаться от проблемы к проблеме — он может быть более сложным в одних задачах и менее сложным в других. Однако каждый расчет равновесных концентраций по набору начальных концентраций будет включать эти этапы.
При решении задач равновесия, связанных с изменением концентрации, иногда удобно составить таблицу ICE, как описано в предыдущем разделе.
- Проверьте рассчитанные равновесные концентрации, подставив их в выражение равновесия и определив, дают ли они константу равновесия.
Пример 13,8
Расчет изменения концентрации по мере того, как реакция достигает равновесия
При определенных условиях константа равновесия разложения PCl 5 ( г ) на PCl 3 ( г ) и Cl 2 ( г ) равна 0. 0211. Каковы равновесные концентрации PCl 5 , PCl 3 и Cl 2 , если начальная концентрация PCl 5 была 1,00 M ?
0211. Каковы равновесные концентрации PCl 5 , PCl 3 и Cl 2 , если начальная концентрация PCl 5 была 1,00 M ?Решение
Используйте пошаговый процесс, описанный ранее.- Шаг 1.
Определите направление реакции.
Сбалансированное уравнение разложения PCl 5 равно
PCl5(г)⇌PCl3(г)+Cl2(г)PCl5(г)⇌PCl3(г)+Cl2(г)Поскольку изначально у нас нет продуктов, Q c = 0 и реакция пойдет вправо.
- Шаг 2.
Определите относительные изменения, необходимые для достижения равновесия, затем запишите равновесные концентрации в терминах этих изменений.
Обозначим увеличение концентрации PCl 3 символом x . Другие изменения могут быть записаны в терминах x с учетом коэффициентов в химическом уравнении.
PCl5(г)⇌PCl3(г)+Cl2(г)-xxxPCl5(г)⇌PCl3(г)+Cl2(г)-xxx
Изменения концентрации и выражения для равновесных концентраций:
- Шаг 3.
Найдите изменение и равновесные концентрации.
Подстановка равновесных концентраций в уравнение константы равновесия дает
Kc=[PCl3][Cl2][PCl5]=0,0211Kc=[PCl3][Cl2][PCl5]=0,0211 = (х) (х) (1,00-х) = (х) (х) (1,00-х)Это уравнение содержит только одну переменную, x , изменение концентрации. Мы можем написать уравнение как квадратное уравнение и решить для x , используя квадратную формулу.
0,0211=(х)(х)(1.00−x)0,0211=(x)(x)(1,00−x) 0,0211(1,00-х)=х20,0211(1,00-х)=х2 х2+0,0211х-0,0211=0х2+0,0211х-0,0211=0Приложение B показывает нам уравнение формы x 2 + bx + c = 0 можно переставить, чтобы решить для x :
х=-b±b2-4ac2ax=-b±b2-4ac2aВ этом случае a = 1, b = 0,0211 и c = −0,0211.
х=-0.0211±(0,0211)2−4(1)(−0,0211)2(1)x=−0,0211±(0,0211)2−4(1)(−0,0211)2(1) =-0,0211±(4,45×10-4)+(8,44×10-2)2=-0,0211±(4,45×10-4)+(8,44×10-2)2 =-0,0211±0,2912=-0,0211±0,2912 Замена соответствующих значений на , b и c дает:
Замена соответствующих значений на , b и c дает:Отсюда
х=-0,0211+0,2912=0,135х=-0,0211+0,2912=0,135или
х=-0,0211-0,2912=-0,156х=-0,0211-0,2912=-0,156Квадратные уравнения часто имеют два различных решения, одно из которых физически возможно, а другое физически невозможно (посторонний корень). В этом случае второе решение (-0,156) физически невозможно, потому что мы знаем, что изменение должно быть положительным числом (иначе мы получили бы отрицательные значения концентраций продуктов).Таким образом, х = 0,135 М .
Равновесные концентрации
[PCl5]=1,00-0,135=0,87М[PCl5]=1,00-0,135=0,87М [PCl3]=x=0,135M[PCl3]=x=0,135M [Cl2]=x=0,135M[Cl2]=x=0,135M - Шаг 4.

Проверьте арифметику.
Подстановка в выражение для K c (для проверки расчета) дает
Kc=[PCl3][Cl2][PCl5]=(0,135)(0,135)0,87=0,021Kc=[PCl3][Cl2][PCl5]=(0,135)(0,135)0,87=0,021Константа равновесия, рассчитанная по равновесным концентрациям, равна значению K c , данному в задаче (при округлении до нужного числа значащих цифр).Таким образом, вычисленные равновесные концентрации проверяют.
Проверьте свои знания
Уксусная кислота, CH 3 CO 2 H, реагирует с этанолом, C 2 H 5 OH, с образованием воды и этилацетата, CH 3 CO 2 C 2 . Ch4CO2H+C2H5OH⇌Ch4CO2C2H5+h3OCh4CO2H+C2H5OH⇌Ch4CO2C2H5+h3O Константа равновесия для этой реакции с диоксаном в качестве растворителя равна 4,0. Каковы равновесные концентрации смеси, равной 0.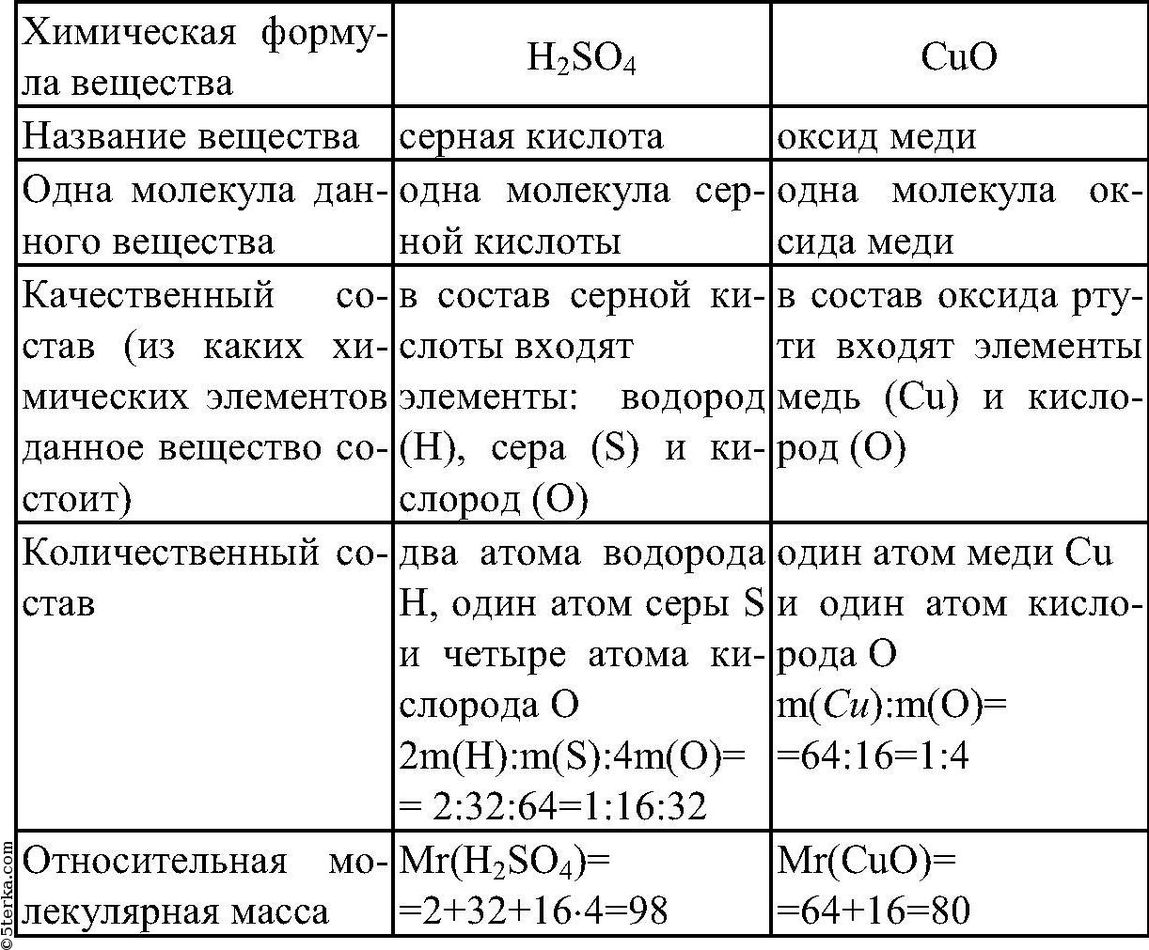 15 M в CH 3 CO 3 CO 2 H, 0.15 M в C 2 H 5 О, 0,40 м в CH 3 CO 2 C 2 H 5 и 0,40 M в H 2 O смешивают с достаточным количеством диоксана для получения 1,0 л раствора?
15 M в CH 3 CO 3 CO 2 H, 0.15 M в C 2 H 5 О, 0,40 м в CH 3 CO 2 C 2 H 5 и 0,40 M в H 2 O смешивают с достаточным количеством диоксана для получения 1,0 л раствора?
Отвечать:
[CH 3 CO 2 H] = 0,36 м , [C 2 H 5 OH] = 0,36 м , [CH 3 CO 2 C 2 H 5 ] = 0.17 М , [Н 2 О] = 0,17 М
Проверьте свои знания
В колбу объемом 1,00 л помещают 1,00 моль H 2 и 2,00 моль I 2 . Значение константы равновесия реакции водорода и йода, реагирующих с образованием йодистого водорода, в данных условиях равно 50,5.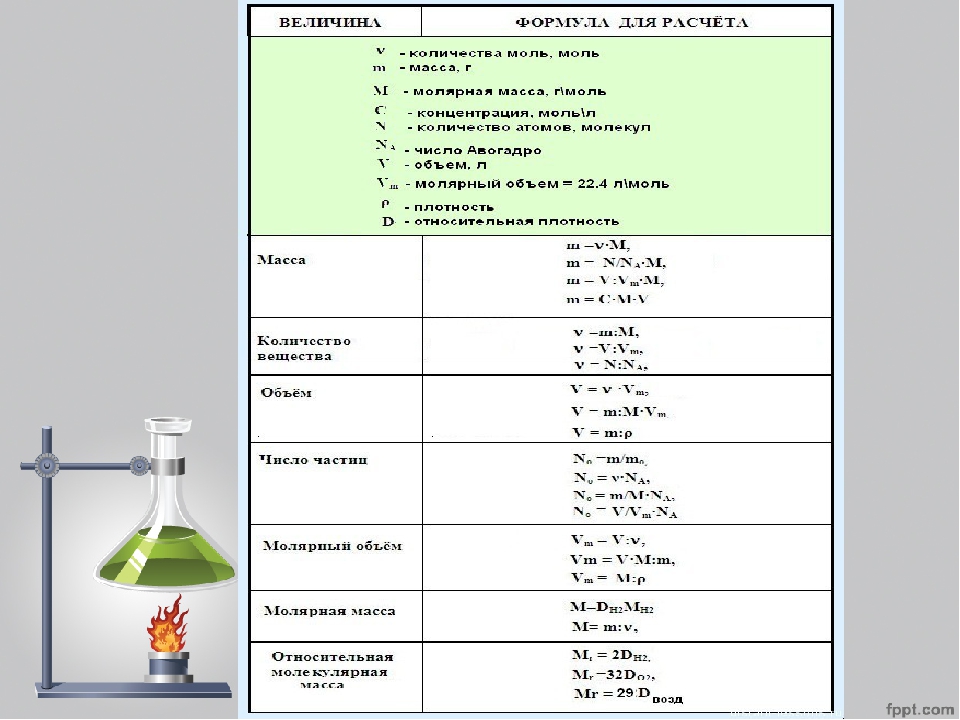 Каковы равновесные концентрации H 2 , I 2 и HI в молях/л?
h3(г)+I2(г)⇌2HI(г)h3(г)+I2(г)⇌2HI(г)
Каковы равновесные концентрации H 2 , I 2 и HI в молях/л?
h3(г)+I2(г)⇌2HI(г)h3(г)+I2(г)⇌2HI(г)Отвечать:
[Ч 2 ] = 0.06 М , [I 2 ] = 1,06 М , [HI] = 1,88 М
Иногда можно использовать химическую интуицию, чтобы найти решения проблем равновесия без фактического решения квадратного (или более сложного) уравнения. Однако сначала полезно проверить, что равновесие может быть достигнуто, исходя из двух крайностей: всех (или большей части) реагентов и всех (или большей части) продуктов (подобно тому, что показано на рис. 13.7).
Рассмотрим ионизацию 0.150 М HA, слабая кислота.
HA(водн.)⇌H+(водн.)+A-(водн.)Kc=6,80×10-4HA(водн.)⇌H+(водн.)+A-(водн.)Kc=6,80×10-4 Наиболее очевидный способ определения равновесных концентраций — начать только с реагентов. Это можно назвать отправной точкой «все реагенты». Используя x для количества ионизированной кислоты в равновесии, это таблица и решение ICE.
Используя x для количества ионизированной кислоты в равновесии, это таблица и решение ICE.
Составление и решение квадратного уравнения дает
Kc=[H+][A-][HA]=(x)(x)(0,150-x)=6,80×10-4Kc=[H+][A-][HA]=(x)(x)(0 .150-х)=6,80×10-4 x2+6,80×10−4x−1,02×10−4=0x2+6,80×10−4x−1,02×10−4=0x=−6,80×10−4±(6,80×10−4)2−(4)( 1)(−1,02×10−4)(2)(1)x=−6,80×10−4±(6,80×10−4)2−(4)(1)(−1,02×10−4)(2 )(1) х=0,00977Мор-0,0104Мх=0,00977Мор-0,0104МИспользуя положительный (физический) корень, равновесные концентрации равны
[ГА]=0,150-х=0,140М[ГА]=0,150-х=0,140М [H+]=[A-]=x=0,00977M[H+]=[A-]=x=0,00977MМенее очевидный способ решения проблемы состоит в том, чтобы предположить, что весь ГК сначала ионизируется, а затем система приходит в равновесие.Это можно назвать отправной точкой для «всех продуктов». Предполагая, что все HA ионизируется, получаем
[ГА]=0,150-0,150=0М[ГА]=0,150-0,150=0М [Н+]=0+0,150=0,150М[Н+]=0+0,150=0,150М [А-]=0+0,150=0,150М[А-]=0+0,150=0,150М Используя их в качестве начальных концентраций и « y » для представления концентрации ГК в равновесии, это таблица ICE для этой начальной точки.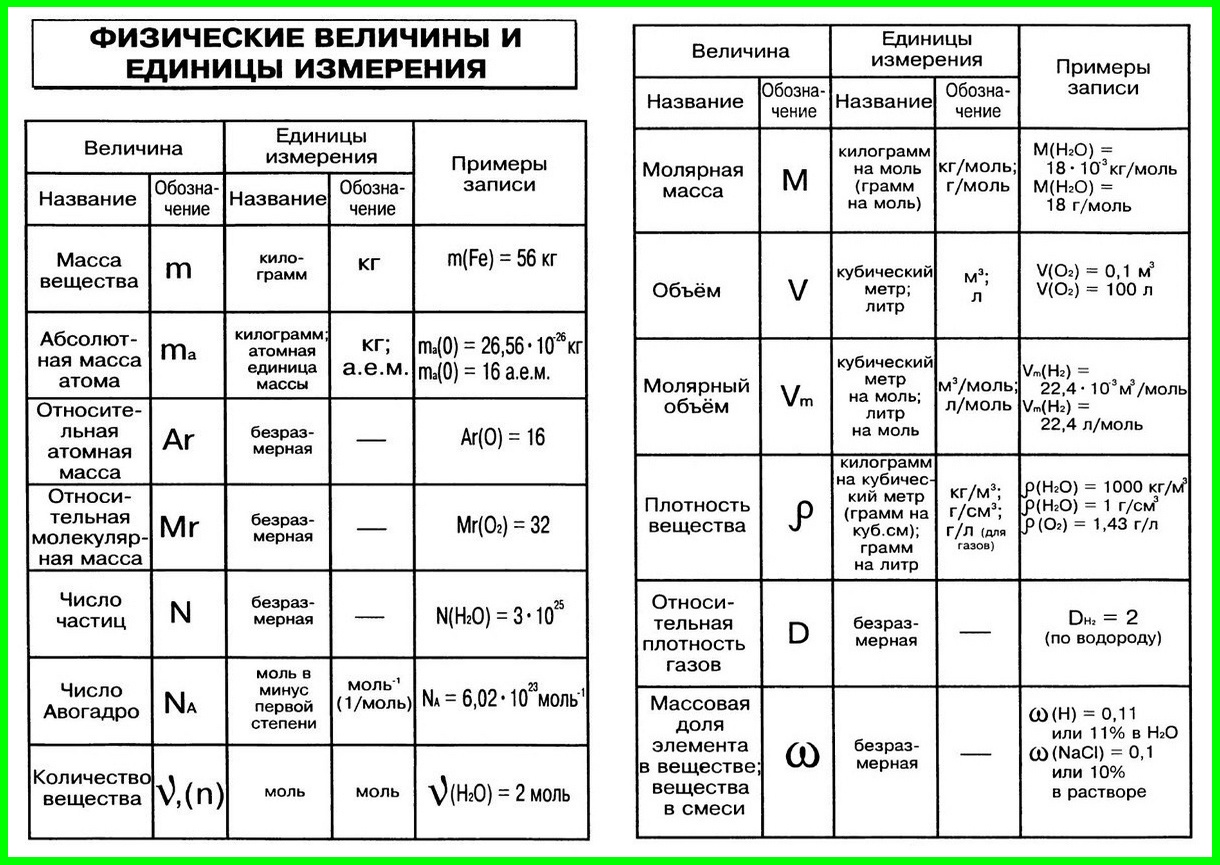
Составление и решение квадратного уравнения дает
Kc=[H+][A-][HA]=(0,150-y)(0,150-y)(y)=6,80×10-4Kc=[H+][A-][HA]=(0.150-у)(0,150-у)(у)=6,80×10-4 6,80×10−4y=0,0225−0,300y+y26,80×10−4y=0,0225−0,300y+y2Сохраните несколько лишних значащих цифр, чтобы свести к минимуму проблемы с округлением.
у2-0,30068у+0,022500=0у2-0,30068у+0,022500=0 у=0,30068±(0,30068)2-(4)(1)(0,022500)(2)(1)у=0,30068±(0,30068)2-(4)(1)(0,022500)(2)(1) у=0,30068±0,0202102у=0,30068±0,0202102Округление каждого решения до трех значащих цифр дает
у=0,160Мори=0,140Ми=0,160Мори=0,140МИспользование физически значимого корня (0,140 М) дает равновесные концентрации как
[ГА]=у=0.140M[HA]=y=0,140M [H+]=0,150-y=0,010M[H+]=0,150-y=0,010M [A-]=0,150-y=0,010M[A-]=0,150-y=0,010M Таким образом, два подхода дают одинаковые результаты (до трех знаков после запятой ) и показывают, что обе исходные точки приводят к одним и тем же условиям равновесия. Начальная точка «все реагенты» привела к относительно небольшому изменению ( х ), поскольку система была близка к равновесию, в то время как начальная точка «все продукты» имела относительно большое изменение ( х ), которое было почти размером исходные концентрации.Можно сказать, что системе, которая начинает «близко» к равновесию, потребуется лишь «небольшое» изменение условий ( x ), чтобы достичь равновесия.
Начальная точка «все реагенты» привела к относительно небольшому изменению ( х ), поскольку система была близка к равновесию, в то время как начальная точка «все продукты» имела относительно большое изменение ( х ), которое было почти размером исходные концентрации.Можно сказать, что системе, которая начинает «близко» к равновесию, потребуется лишь «небольшое» изменение условий ( x ), чтобы достичь равновесия.
Напомним, что небольшое число K c означает, что очень небольшое количество реагентов образует продукты, а большое значение K c означает, что большинство реагентов образуют продукты. Если систему можно устроить так, чтобы она начинала «близко» к равновесию, то если изменение ( x ) мало по сравнению с любыми исходными концентрациями, им можно пренебречь.Малый обычно определяется как приводящий к ошибке менее 5%. Следующие два примера демонстрируют это.
Следующие два примера демонстрируют это.
Пример 13,9
Приблизительное решение, начинающееся близко к равновесию
Каковы равновесные концентрации 0,15 М раствора HCN? HCN(водн.)⇌H+(водн.)+CN-(водн.)Kc=4,9×10-10HCN(водн.)⇌H+(водн.)+CN-(водн.)Kc=4,9×10-10Решение
Использование « x » для представления концентрации каждого продукта в равновесии дает эту таблицу ICE.Точное решение можно получить с помощью квадратичной формулы с
Кс=(х)(х)0,15-хКс=(х)(х)0,15-хрешение
x2+4,9×10−10−7,35×10−11=0x2+4,9×10−10−7,35×10−11=0 x=8,56×10-6M(3 знач.фиг.)=8,6×10-6M(2 знач.фиг.)x=8,56×10-6M(3 знач.фиг.)=8,6×10-6M(2 знач.фиг.) , фиг.) Таким образом, [H + ] = [CN – ] = x = 8,6 × × 10 –6 M и [HCN] = 0,15 – x = 0,115 M 90.
В этом случае химическая интуиция может дать более простое решение.Из константы равновесия и начальных условий x должно быть мало по сравнению с 0,15 M . Более формально, если x≪0,15,x≪0,15, то 0,15 – x ≈ 0,15. Если это предположение верно, то упрощается получение x
Kc=(x)(x)0,15−x≈x20,15Kc=(x)(x)0,15−x≈x20,15 4,9×10−10=x20,154,9×10−10=x20,15 x2=(0,15)(4,9×10-10)=7,4×10-11×2=(0,15)(4,9×10-10)=7,4×10-11 х=7,4×10-11=8,6×10-6Мх=7,4×10-11=8,6×10-6МВ этом примере решение точного (квадратного) уравнения и использование приближений дали один и тот же результат для двух значащих цифр.Хотя в большинстве случаев приближение немного отличается от точного решения, если ошибка составляет менее 5%, приближенное решение считается действительным. В этой задаче 5% относится к ЕСЛИ (0,15 – x ) ≈ 0,15 M , поэтому, если
x0,15×100%=8,6×10-60,15×100%=0,006%x0,15×100%=8,6×10-60,15×100%=0,006% меньше 5%, так как в этом случае предположение справедливо. Таким образом, приближенное решение является допустимым решением.
Таким образом, приближенное решение является допустимым решением.
Проверьте свои знания
Каковы равновесные концентрации в 0.25 M NH 3 раствор? Nh4(водн.)+h3O(ж)⇌Nh5+(водн.)+OH-(водн.)Kc=1,8×10-5Nh4(водн.)+h3O(ж)⇌Nh5+(водн.)+OH-(водн.)Kc=1,8× 10−5Предположим, что x намного меньше 0,25 М, и вычислите ошибку в вашем предположении.
Отвечать:
[OH-]=[Nh5+]=0,0021M; [OH-]=[Nh5+]=0,0021M; [NH 3 ] = 0,25 M , ошибка = 0,84%
Во втором примере требуется, чтобы исходная информация была немного обработана, но ее все же можно решить, используя небольшое приближение x .
Пример 13.10
Приблизительное решение после изменения начальной концентрации
Ионы меди(II) образуют комплексный ион в присутствии аммиака. Cu2+(водн.)+4Nh4(водн.)⇌Cu(Nh4)42+(водн.)Kc=5,0×1013=[Cu(Nh4)42+][Cu2+(водн.)][Nh4]4Cu2+(водн.)+4Nh4(водн. )⇌Cu(Nh4)42+(водн.)Kc=5,0×1013=[Cu(Nh4)42+][Cu2+(водн.)][Nh4]4
Cu2+(водн.)+4Nh4(водн.)⇌Cu(Nh4)42+(водн.)Kc=5,0×1013=[Cu(Nh4)42+][Cu2+(водн.)][Nh4]4Cu2+(водн.)+4Nh4(водн. )⇌Cu(Nh4)42+(водн.)Kc=5,0×1013=[Cu(Nh4)42+][Cu2+(водн.)][Nh4]4Если 0,010 моль Cu 2+ добавить к 1,00 л раствора, состоящего из 1,00 M NH 3 , при какой концентрации система придет в равновесие?
Решение
Начальная концентрация меди(II) равна 0.010 М . Константа равновесия очень велика, поэтому было бы лучше начать с как можно большего количества продукта, потому что «все продукты» намного ближе к равновесию, чем «все реагенты». Обратите внимание, что Cu 2+ является лимитирующим реагентом; если все 0,010 M его реагируют с образованием продукта, концентрации будут [Cu2+]=0,010-0,010=0M[Cu2+]=0,010-0,010=0M [Cu(Nh4)42+]=0,010M[Cu(Nh4)42+]=0,010M [Nh4]=1,00−4×0,010=0,96M[Nh4]=1,00−4×0,010=0,96M Использование этих «смещенных» значений в качестве начальных концентраций с x в качестве концентрации свободных ионов меди (II) в равновесии дает эту таблицу ICE.
Поскольку мы начинаем близко к равновесию, x должно быть небольшим, чтобы
0,96+4x≈0,96M0,96+4x≈0,96M 0,010−x≈0,010M0,010−x≈0,010M Kc=(0,010−x)x(0,96−4x)4≈(0,010)x(0,96)4=5,0×1013Kc=(0,010−x)x(0,96−4x)4≈(0,010)x(0,96)4= 5,0×1013 х=(0,010)Кс(0,96)4=2,4×10-16Мх=(0,010)Кс(0,96)4=2,4×10-16МВыберите наименьшую концентрацию для правила 5%.
2,4×10-160,010×100%=2×10-12%2,4×10-160,010×100%=2×10-12%Это намного меньше 5%, так что предположения верны.Равновесные концентрации
[Cu2+]=x=2,4×10-16M[Cu2+]=x=2,4×10-16M [Nh4]=0,96−4x=0,96M[Nh4]=0,96−4x=0,96M [Cu(Nh4)42+]=0,010−x=0,010M[Cu(Nh4)42+]=0,010−x=0,010M Начиная с максимального количества продукта, эта система была близка к равновесию, а изменение ( x ) было очень небольшим. С небольшим изменением, необходимым для достижения равновесия, уравнение для x было значительно упрощено и дало достоверный результат в пределах максимума ошибки 5%.
Проверьте свои знания
Каковы равновесные концентрации, когда 0.25 моль Ni 2+ добавляют к 1,00 л раствора 2,00 M NH 3 ? Ni2+(водн.)+6Nh4(водн.)⇌Ni(Nh4)62+(водн.)Kc=5,5×108Ni2+(водн.)+6Nh4(водн.)⇌Ni(Nh4)62+(водн.)Kc=5,5×108При такой большой константе равновесия сначала образовать как можно больше продукта, а затем предположить, что осталось лишь небольшое количество ( x ) продукта. Вычислите ошибку в вашем предположении.
Отвечать:
[Ni(Nh4)62+]=0,25М, [Ni(Nh4)62+]=0,25М, [NH 3 ] = 0,50 М , [Ni 2+ ] = 2.9 × × 10 –8 M , ошибка = 1,2 × × 10 –5 %
Переосмысление стехиометрии | Chemical Education Xchange
Стехиометрия, возможно, является одной из самых сложных концепций для учащихся на уроках общей химии. Стехиометрия требует, чтобы учащиеся синтезировали свои знания о молях, сбалансированных уравнениях и пропорциональных рассуждениях, чтобы описать процесс, который слишком мал, чтобы его увидеть. Часто учителя по умолчанию используют алгоритмический подход к решению задач на стехиометрию, что может помешать учащимся получить полное концептуальное понимание реакции, которую они описывают.
Стехиометрия требует, чтобы учащиеся синтезировали свои знания о молях, сбалансированных уравнениях и пропорциональных рассуждениях, чтобы описать процесс, который слишком мал, чтобы его увидеть. Часто учителя по умолчанию используют алгоритмический подход к решению задач на стехиометрию, что может помешать учащимся получить полное концептуальное понимание реакции, которую они описывают.
Инструкция по моделированию, разработанная в Университете штата Аризона Американской ассоциацией преподавателей моделирования (AMTA), имеет структуру решения проблем, которая помогает учащимся применять пропорциональные рассуждения, чтобы увидеть общую картину реакции, которую они анализируют. Эта структура использует таблицу для организации данных молей для всей реакции вместо того, чтобы просто изолировать одну часть проблемы.
Давайте воспользуемся реакцией между 5,0 молями магния и избытком газообразного кислорода для получения оксида магния.Учащиеся начинают с написания сбалансированного уравнения:
.
2Mg + O
2 ==> 2MgOКак только учащиеся составят сбалансированное уравнение, они могут начать заносить информацию в таблицу BCA. BCA означает до изменения после. Учащиеся начинают с заполнения количества реагентов, которые присутствуют до того, как произойдет химическая реакция. Если в вопросе не указано начальное количество реагента, учащиеся пишут «XS», чтобы показать, что реагента более чем достаточно для завершения реакции.До того, как реакция началась, продукты еще не образовались, поэтому учащиеся записывают нулями.
| 2Mg + O 2 => 2MgO
| ||
Б | 5,0 моль | XS | 0 моль |
С |
|
|
|
А |
|
|
|
Строка «изменить» — это место, где вступает в действие пропорциональное рассуждение.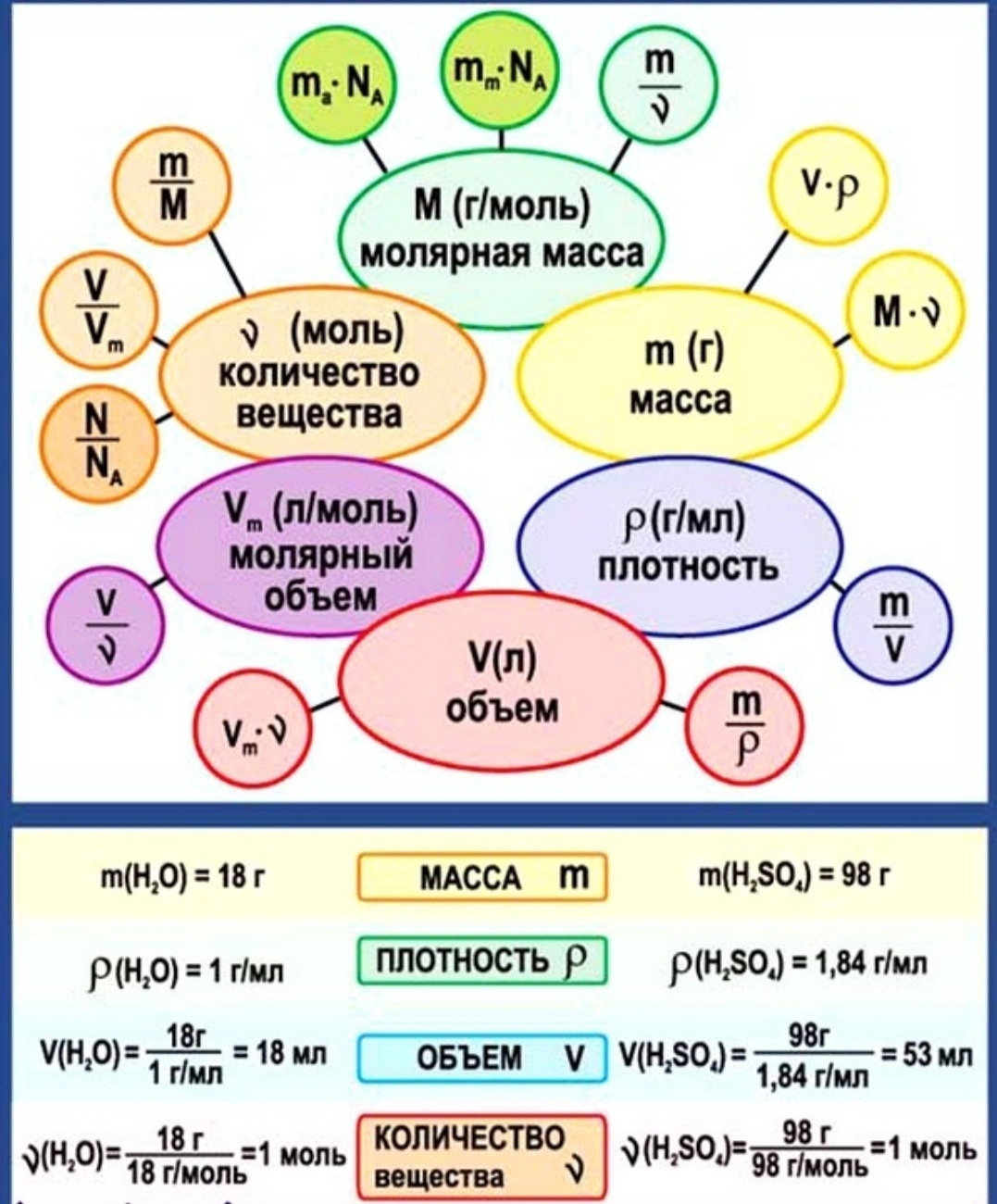 В этой задаче нет ограничивающего реагента, поэтому используются все 5,0 молей магния. Затем учащиеся используют коэффициенты из своего сбалансированного уравнения, чтобы заполнить оставшуюся часть строки изменений. Студент мог бы использовать такое рассуждение: «На каждые 2 моля магния приходится 1 моль кислорода, следовательно, для реакции необходимо вдвое меньше кислорода, чем магния». Чтобы найти произведение, студент может рассуждать так: «На каждые 2 моля магния образуется 2 моля оксида магния. Это соотношение 1:1, поэтому моли используемого магния равны молям произведенного оксида магния.
В этой задаче нет ограничивающего реагента, поэтому используются все 5,0 молей магния. Затем учащиеся используют коэффициенты из своего сбалансированного уравнения, чтобы заполнить оставшуюся часть строки изменений. Студент мог бы использовать такое рассуждение: «На каждые 2 моля магния приходится 1 моль кислорода, следовательно, для реакции необходимо вдвое меньше кислорода, чем магния». Чтобы найти произведение, студент может рассуждать так: «На каждые 2 моля магния образуется 2 моля оксида магния. Это соотношение 1:1, поэтому моли используемого магния равны молям произведенного оксида магния.
| 2Mg + O 2 => 2MgO
| ||
Б | 5,0 моль | XS | 0 моль |
С | -5,0 моль | -2,5 моль | +5,0 моль |
А |
|
|
|
Чтобы заполнить строку «после», учащийся выполняет несложные арифметические действия.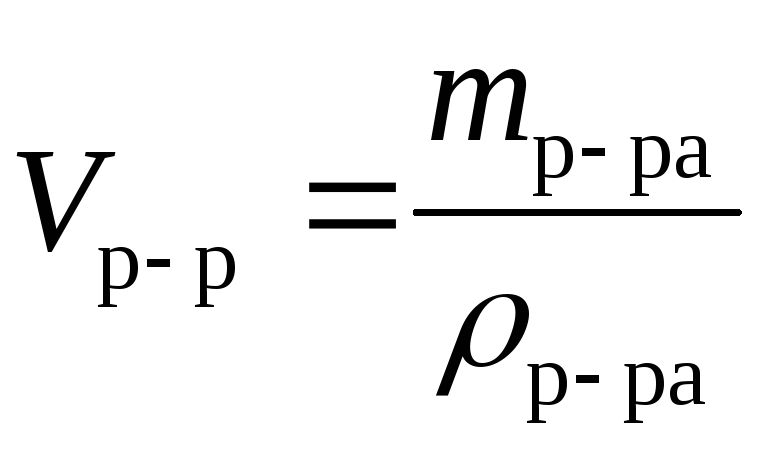 Если использовать все 5,0 молей магния, то после реакции магния не останется. Если изначально был избыток кислорода, то и после реакции он останется. Если образовалось 5,0 моль оксида магния, а оксида магния изначально не было, то после реакции останется 5,0 моль оксида магния.
Если использовать все 5,0 молей магния, то после реакции магния не останется. Если изначально был избыток кислорода, то и после реакции он останется. Если образовалось 5,0 моль оксида магния, а оксида магния изначально не было, то после реакции останется 5,0 моль оксида магния.
Теперь учащийся имеет полное представление о том, что происходит во время этой реакции, независимо от того, какое значение задавал вопрос. Это особенно полезно для ограничения проблем с реагентами.
| 2Mg + O 2 –> 2MgO
| ||
Б | 5,0 моль | XS | 0 моль |
С | -5,0 моль | -2,5 моль | +5,0 моль |
А | 0 моль | XS | 5. |
В приведенном ниже примере учащийся может легко увидеть, какой реагент является лимитирующим и сколько избыточного реагента осталось, не выполняя отдельных, казалось бы, не связанных расчетов.
| CH 4 + 2O 2 –> CO 2 + 2H 2 O
| |||
Б | 10.0 моль | 15,0 моль | 0 моль | 0 моль |
С | -7,5 моль | -15,0 моль | +7,5 моль | +15 моль |
А | 2,5 моль | 0 моль | 7,5 моль | 15 моль |
Таблица BCA также помогает учащимся быстро выбрать ограничивающий реагент, поскольку они преобразуют значения массы в значения молей на отдельном этапе от применения молярных отношений. Поскольку вся стехиометрия выполняется в таблице BCA, учащиеся могут легко преобразовывать массу, молярность, объем газа и моли вне таблицы, что делает ее универсальным инструментом.
Поскольку вся стехиометрия выполняется в таблице BCA, учащиеся могут легко преобразовывать массу, молярность, объем газа и моли вне таблицы, что делает ее универсальным инструментом.
В 2014 году Ларри Дюкерич опубликовал запись в блоге «Концептуальная химия» о таблицах BCA, к которой вы можете обратиться за дополнительной информацией.
Р.И.С.Е. Таблицы и K Расчеты Учебное пособие по химии
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Настройка R.ЛЕД. Таблица
Шаг 1: Напишите сбалансированное химическое уравнение для химической реакции в состоянии равновесия (включая состояния вещества):
| Пример: разложение A (g) | |||||
|---|---|---|---|---|---|
| АА (г) | ⇋ | бБ (г) | + | СС (г) | |
Шаг 2: Нарисуйте R.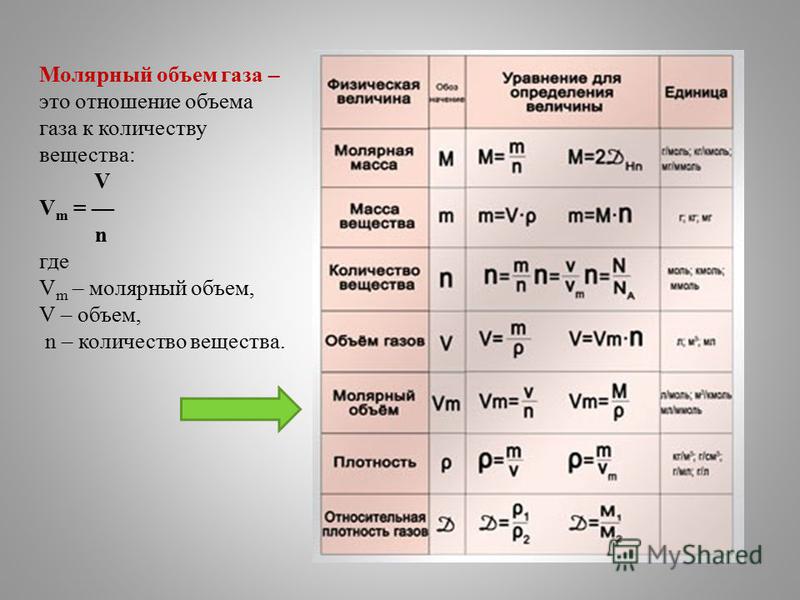 ЛЕД. Таблица, использующая химическую формулу каждого реагента и продукта в качестве заголовка вверху и использующая следующие заголовки вертикально вниз:
ЛЕД. Таблица, использующая химическую формулу каждого реагента и продукта в качестве заголовка вверху и использующая следующие заголовки вертикально вниз:
- R действие
- I начальная концентрация
- C изменение концентрации
- E равновесная концентрация
| Пример: разложение A (g) | |||||
|---|---|---|---|---|---|
| R реакция: | АА (г) | ⇋ | бБ (г) | + | СС (г) |
| I начальная концентрация: | |||||
| C изменение концентрации: | |||||
| E равновесная концентрация: | |||||
Шаг 3: Вставьте значения начальной концентрации для любых видов, для которых была дана начальная концентрация.
Обратите внимание, что может возникнуть необходимость рассчитать начальную концентрацию, если вам известны масса или количество молей вещества и объем (см. расчеты молярности).
| Пример: разложение A (g) дано: [A (исходный) ] = 1,0 моль л -1 | |||||
|---|---|---|---|---|---|
| R 1 действие 4: 1 | АА (г) | ⇋ | бБ (г) | + | СС (г) |
| I начальная концентрация: моль л -1 | 1.0 | 0 | 0 | ||
| C изменение концентрации: | |||||
| E равновесная концентрация: | |||||
Шаг 4: Пусть x будет общим фактором изменения концентрации.
Напишите выражение для изменения концентрации для каждого вида, используя стехиометрические коэффициенты (молярные отношения) в сбалансированном химическом уравнении:
для реакции, в которой разлагается известное количество А (г) :
аА (ж) ⇋ б В (ж) + в С (ж)
- концентрация А (г) изменится на а х х = а х
- концентрация B (г) изменится на b x x = b x
- концентрация С (г) изменится на с х х = с х
Введите значения изменения концентрации в R.ЛЕД. таблица:
| Пример: разложение A (g) дано: [A (исходный) ] = 1,0 моль л -1 | |||||
|---|---|---|---|---|---|
| R 1 действие 4: 1 | а А (г) | ⇋ | б Б (г) | + | с С (г) |
| I начальная концентрация: моль л -1 | 1. 0 0 | 0 | 0 | ||
| C изменение концентрации: моль л -1 | – а x | + б х | + с х | ||
| E равновесная концентрация: | |||||
Примечание: поскольку изначально присутствовал ТОЛЬКО реагент A (ни B, ни C), очевидно, что реакция должна идти в прямом направлении с образованием продуктов B и C.
Следовательно, концентрация А должна уменьшиться на величину ах (- a x ), а концентрации B и C должны увеличиться на величину bx (+ b x ) и cx (+ c x ) соответственно.
Шаг 5: Используйте выражения начальной концентрации и изменения концентрации, чтобы написать выражение для концентрации каждого вида в состоянии равновесия:
В нашем примере для разложения A (g) :
- концентрация А (г) уменьшится с 1.
 0 моль л -1 до (1,0 – a x ), поскольку А (г) расходуется в ходе реакции с образованием продуктов В (г) и С (г)
0 моль л -1 до (1,0 – a x ), поскольку А (г) расходуется в ходе реакции с образованием продуктов В (г) и С (г) - концентрация B (g) увеличится с 0 моль л -1 до (0 + b x ), потому что B (g) образуется при разложении A (g)
- концентрация C (g) увеличится с 0 моль л -1 до (0 + c x ), потому что C (g) образуется при разложении A (g)
Вставьте эти выражения для равновесных концентраций в форму R.ЛЕД. таблица:
| Пример: разложение A (g) дано: [A (исходный) ] = 1,0 моль л -1 | |||||
|---|---|---|---|---|---|
| R 1 действие 4: 1 | а А (г) | ⇋ | б Б (г) | + | с С (г) |
| I начальная концентрация: моль л -1 | 1. 0 0 | 0 | 0 | ||
| C изменение концентрации: моль л -1 | – а x | + б х | + с х | ||
| E равновесная концентрация: моль л -1 | 1.0 – а х | 0 + б х | 0 + с х | ||
Шаг 6: Вставьте значение равновесной концентрации любого вещества, для которого была указана равновесная концентрация, в форму R.I.C.E. таблица:
| Пример: Разложение A (g) дано: [A (исходный) ] = 1.0 моль л -1 и [C равновесие ] = 0,5 моль л -1 | |||||
|---|---|---|---|---|---|
| R реакция: | а А (г) | ⇋ | б Б (г) | + | с С (г) |
| I начальная концентрация: моль л -1 | 1. 0 0 | 0 | 0 | ||
| C изменение концентрации: моль л -1 | – а x | + б х | + с х | ||
| E равновесная концентрация: моль л -1 | 1.0 – а х | 0 + б х | 0,5 = 0 + с х | ||
Шаг 7: Определите значение x
В нашем примере у нас есть уравнение:
Поскольку 0 + c x совпадает с c x , мы можем написать:
Преобразуйте это уравнение, разделив обе его части на c :
позволит нам вычислить значение x :
Модифицируйте свой R.ЛЕД. , чтобы включить этот расчет:
| Пример: Разложение A (g) дано: [A (исходный) ] = 1,0 моль л -1 и [C (равновесный) ] = 0,1 моль 90 л 90 | |||||
|---|---|---|---|---|---|
| R действие: | а А (г) | ⇋ | б Б (г) | + | с С (г) |
| I начальная концентрация: моль л -1 | 1. 0 0 | 0 | 0 | ||
| C изменение концентрации: моль л -1 | – а x | + б х | + с х | ||
| E равновесная концентрация: моль л -1 | 1.0 – а х | 0 + б х | 0,5 | ||
Шаг 8: Используйте рассчитанное значение x для определения равновесных концентраций всех других веществ:
Завершите задание R.I.C.E. путем подстановки рассчитанного значения x в выражения для равновесной концентрации всех других видов.
Расчет константы равновесия, K
c Модель R.I.C.E. Таблица позволяет рассчитать концентрации всех веществ, присутствующих в реакции при равновесии.
Теперь вы можете использовать эти равновесные концентрации для расчета значения константы равновесия K c для этой реакции в данных условиях.
Шаг 1: Напишите выражение для константы равновесия, используя сбалансированное химическое уравнение:
| Для реакции: | а А (ж) ⇋ б В (ж) + в С (ж) | ||
| выражение для константы равновесия : |
|
Шаг 2: Подставьте значения равновесной концентрации каждого вида в уравнение и решите.
Равновесная концентрация каждого вида указана в нижней строке таблицы R.I.C.E. стол.
Как использовать пропорции с химическими соединениями
Химические соединения
Количество каждого элемента в химическом соединении зависит от количества электронов во внешней электронной оболочке элемента, называемой валентной оболочкой .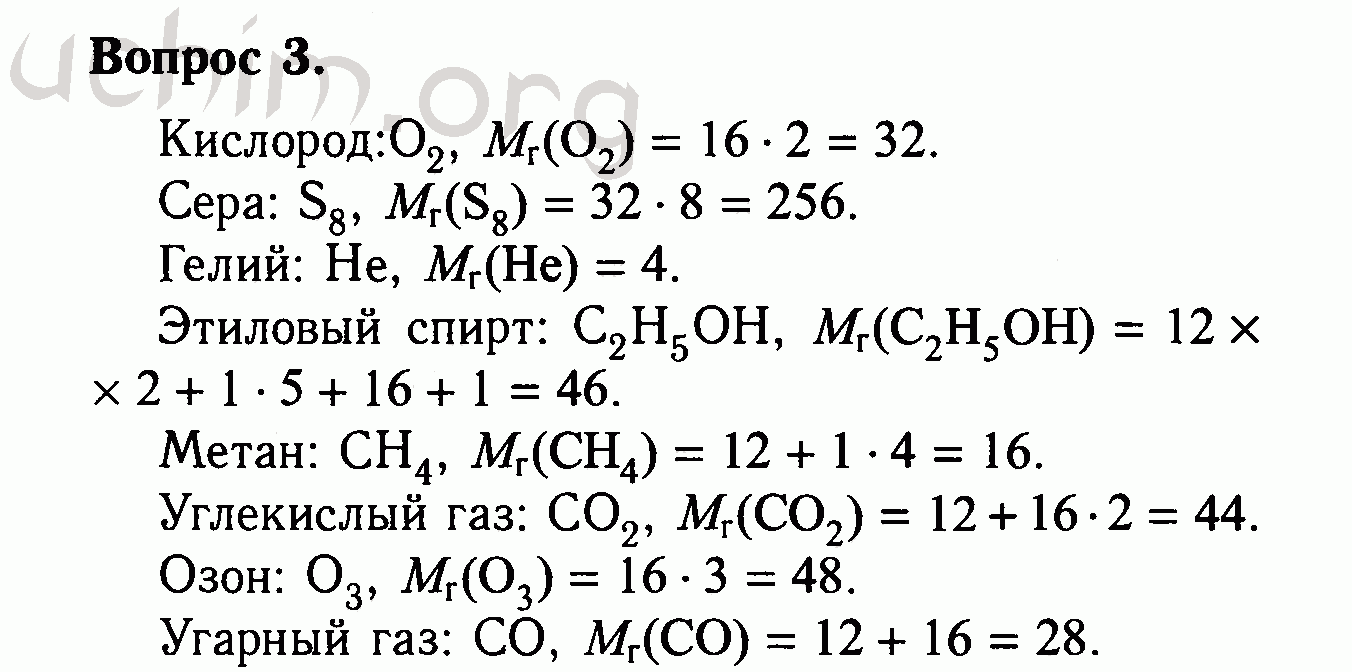 Нижний индекс после символа каждого элемента говорит нам, сколько атомов этого элемента находится в соединении.Давайте рассмотрим несколько примеров химических соединений и соотношения элементов в них.
Нижний индекс после символа каждого элемента говорит нам, сколько атомов этого элемента находится в соединении.Давайте рассмотрим несколько примеров химических соединений и соотношения элементов в них.
- Хлорид натрия имеет формулу NaCl. Имеется один атом натрия и один атом хлора, что дает соотношение хлорида натрия 1:1.
- Фосфид кальция имеет формулу Ca3 P2. Отношение кальция к фосфору в этом соединении составляет 3:2.
- Сахар имеет формулу C12 h32 O11. Соотношение этих элементов в соединении составляет 12:22:11.
Теперь, когда мы знаем, как определить соотношение каждого элемента в соединении, мы можем использовать это знание соотношений для нескольких приложений.Мы сосредоточимся на трех приложениях:
- Расчет молекулярной массы
- Расчет процентного состава
- Уравновешивание химических уравнений
Молярная масса
Молярная масса каждого элемента указана в периодической таблице.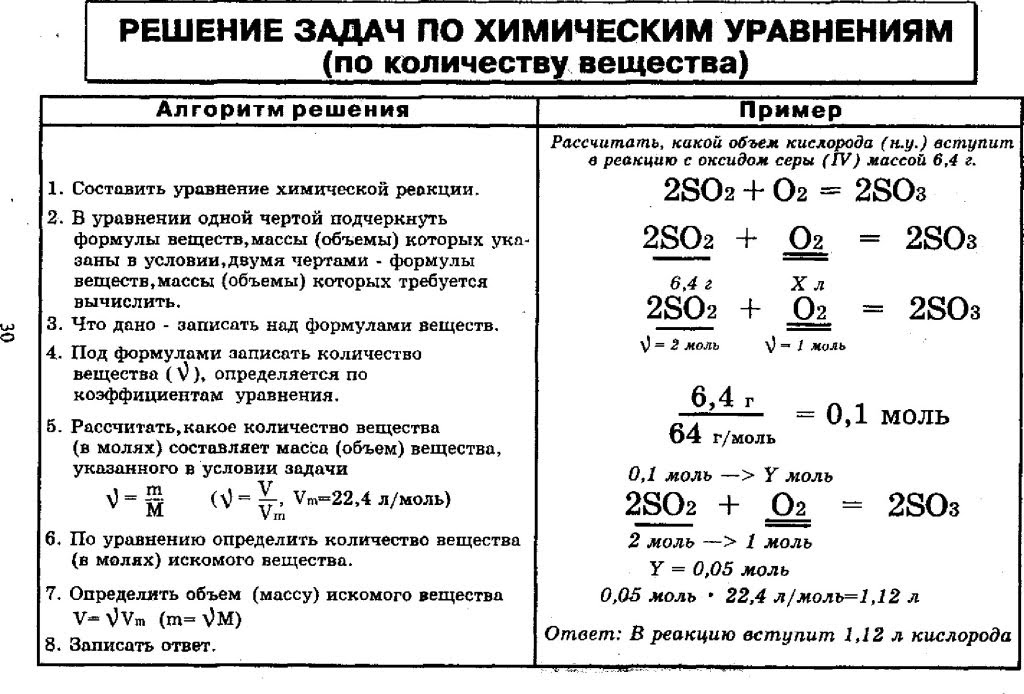 При определении молярной массы химического соединения нужно использовать соотношение элементов в соединении. Количество каждого элемента умножается на его молярную массу и суммы суммируются.Давайте работать пример.
При определении молярной массы химического соединения нужно использовать соотношение элементов в соединении. Количество каждого элемента умножается на его молярную массу и суммы суммируются.Давайте работать пример.
Давайте вернемся к соединению фосфида кальция, которое мы обсуждали ранее. Соотношение кальция и фосфора 3:2. Мы можем взять это соотношение и превратить в уравнение для определения молярной массы. Периодическая таблица говорит нам массу каждого элемента.
Поскольку у нас три атома кальция, запишем:
3(40.08 г/моль)
А затем мы прибавляем к этому произведение двух атомов фосфора, умноженное на его молярную массу, что равно:
2(30,97 г/моль)
Следующим шагом является сложение этих продуктов вместе.
3(40,08 г/моль) + 2(30,97 г/моль) = 120,24 г/моль + 61,94 г/моль = 182,18 г/моль
Это означает, что один моль фосфида кальция имеет массу 182,18 г/моль.
Процентный состав
Определение процентного состава химического соединения также включает соотношение элементов в соединении.Мы можем определить процент каждого элемента в соединении и процент по массе каждого элемента.
Проценты по каждому элементу
Давайте остановимся на нашем примере с фосфидом кальция. Для определения процента нам нужно использовать формулу:
Формула Ca3 P2, состоящая всего из 5 атомов.
Массовые проценты
Для определения массовых процентов каждого элемента требуется та же формула, но мы используем молярные массы каждого элемента в соединении.Мы определили эти значения ранее в уроке, поэтому все, что нам нужно сделать, это подставить эту информацию в уравнение процентов.
Балансирующие химические уравнения
Предположим, что хлорид натрия взаимодействует с фосфидом кальция в результате реакции:
NaCl + Ca3 P2 → Na3 P + CaCl2
Закон сохранения массы гласит, что масса не может быть создана или уничтожена.Это означает, что нам нужно сбалансировать уравнение, используя коэффициенты перед соединениями. Эти числа зависят от соотношения элементов в соединениях.
Сбалансированное уравнение имеет вид:
6NaCl + Ca3 P2 → 2Na3 P + 3CaCl2
Коэффициент умножается на индекс каждого элемента. Обратите внимание, что соотношение каждого элемента к элементу, с которым он был первоначально связан, одинаково и в продуктах. Например, реагент хлорид натрия (NaCl) представляет собой соотношение натрия и хлора 6:6, а в продуктах присутствует 6 атомов натрия и 6 атомов хлора.Это то самое соотношение 6:6.
Краткий обзор урока
Соотношения повсюду в химии. В химических соединениях нижние индексы после символов элементов говорят нам о количестве каждого элемента. Количество каждого элемента в соединении в основном зависит от количества электронов в его валентной оболочке . Используя соотношение элементов в соединении, мы можем сделать следующее:
В химических соединениях нижние индексы после символов элементов говорят нам о количестве каждого элемента. Количество каждого элемента в соединении в основном зависит от количества электронов в его валентной оболочке . Используя соотношение элементов в соединении, мы можем сделать следующее:
- Рассчитать молярную массу соединения, умножив количество каждого элемента на его молярную массу вне таблицы Менделеева, а затем просуммировав результаты.
- Определите процентное содержание каждого элемента в соединении по атомам или массе, используя формулу процентов.
- Сбалансируйте химическое уравнение, чтобы сохранить массу.
| Математическая справка по химии WTAMU > Виртуальная математическая лаборатория > Математика для естественных наук Введение
Основные математические вычисления
Средние значения
Экспоненты и научные обозначения
Решение линейных уравнений
Решение квадратных уравнений
Решение полиномиальных уравнений методом факторинга
Решение рациональных уравнений
Решение формул вообще
Логарифмы
|
Маленький х Успенский | Химия
14.7: Маленький x Успенский
Если реакция имеет небольшую константу равновесия, положение равновесия благоприятствует реагентам. В таких реакциях может произойти незначительное изменение концентрации, если начальные концентрации реагентов велики, а значение K c мало. В таких условиях равновесная концентрация примерно равна его начальной концентрации.Эту оценку можно использовать для упрощения расчетов равновесия, предполагая, что некоторые равновесные концентрации равны начальным концентрациям. Однако, чтобы сделать это предположение, изменение концентрации слабой кислоты или основания, т. е. х , должно быть менее 5% от его исходной концентрации. Если x больше 5%, то для решения уравнения равновесия необходимо использовать квадратичную формулу.
В таких условиях равновесная концентрация примерно равна его начальной концентрации.Эту оценку можно использовать для упрощения расчетов равновесия, предполагая, что некоторые равновесные концентрации равны начальным концентрациям. Однако, чтобы сделать это предположение, изменение концентрации слабой кислоты или основания, т. е. х , должно быть менее 5% от его исходной концентрации. Если x больше 5%, то для решения уравнения равновесия необходимо использовать квадратичную формулу.
Расчет равновесных концентраций с использованием предположения, упрощающего алгебру
Каковы равновесные концентрации 0.15 М раствор HCN?
Использование x для представления концентрации каждого продукта в равновесии дает эту таблицу ICE.
| HCN ( aq ) | H + ( водный ) | CN − ( aq ) | |
| Начальная концентрация (M) | 0.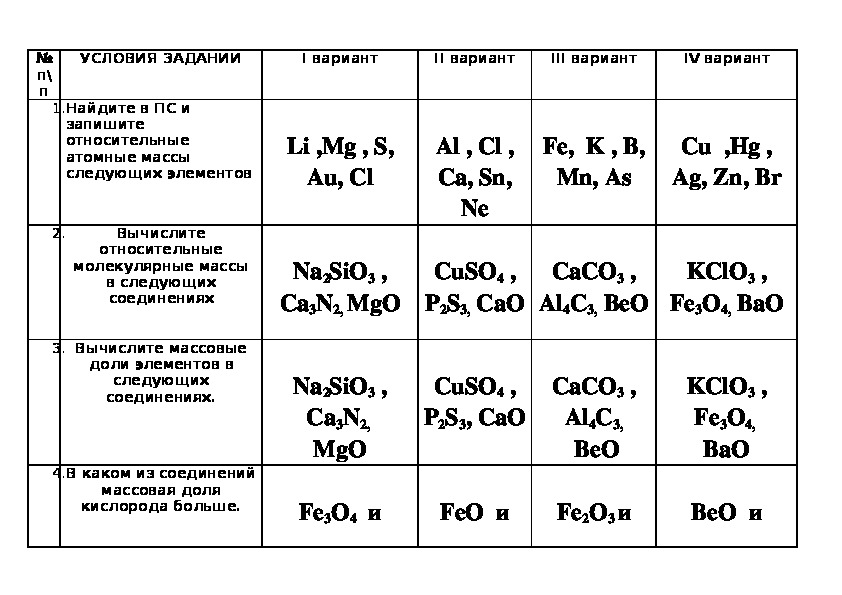 15 15 | 0 | 0 |
| Смена (М) | −x | +х | +х |
| Равновесная концентрация (M) | 0,15 − х | х | х |
Подставить условия равновесной концентрации в выражение K c
преобразовать в квадратичную форму и найти x
Таким образом, [H + ] = [CN – ] = x = 8.6 × 10 –6 М и [HCN] = 0,15 – х = 0,15 М.
Обратите внимание, что в этом случае изменение концентрации значительно меньше, чем исходная концентрация (следствие малого K ), поэтому исходная концентрация претерпевает незначительное изменение:
Это приближение позволяет использовать более целесообразный математический подход к вычислениям, который позволяет избежать необходимости находить корни квадратного уравнения:
Вычисленное значение x действительно намного меньше исходной концентрации
и так приближение было оправдано. Если бы этот упрощенный подход давал значение для x , которое не оправдывало бы аппроксимацию, расчет пришлось бы повторить без аппроксимации.
Если бы этот упрощенный подход давал значение для x , которое не оправдывало бы аппроксимацию, расчет пришлось бы повторить без аппроксимации.
Этот текст был адаптирован из Openstax, Химия 2e, Раздел 13.4 Расчеты равновесия .
Рекомендуемое чтение
| C.Расчет удельного веса -удельный вес зависит от (1) вида атомов, из которых состоит минерал, и (2) способ, которым эти атомы упакованы вместе- -удельный вес это плотность деленная на плотность воды (1 грамм/куб. см) — отсюда и конкретное число . гравитационное число не имеет связанные единицы – S.G.=(ZxM)/(NxV) , где Z – количество формульных весов или единиц на элементарную ячейку; Мы будем лечить характер числа Z в более поздней теме N — число Авагадро, 6.023×10 +23 ; V — объем элементарной ячейки, измеренный в угл.  stroms(), V представляет продукт длины 3-х кристаллографических осей мы рассмотрим позже; M – молекулярная масса химического вещества. формула минерала – позволяет вычислить удельную плотность для вейвелита, Al 3 (P O 4 ) 2 (OH) 3 .5Н 2 О- | З = 4; М = 412; В = (а = 9,62 А, б = 17,34 А, с = 6,99 А) = (116,6×10 -23 ) SG . =( (4×412)/(6,023×10 +23 )x(116,6×10 -23 )) = 2,34 Теперь давайте попрактикуемся в некоторых задачах, касающихся минеральной химии.
расчеты НАЖМИТЕ ЗДЕСЬ, ЧТОБЫ УЗНАТЬ БОЛЬШЕ ПРОБЛЕМ |



 (
АхВу)
= М(АхВу)/2
(
АхВу)
= М(АхВу)/2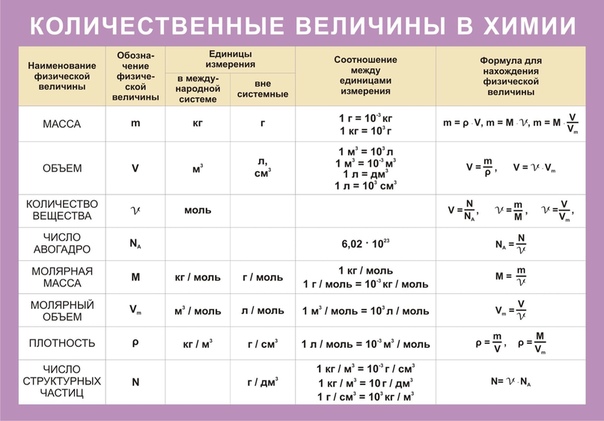





 Замена соответствующих значений на , b и c дает:
Замена соответствующих значений на , b и c дает:
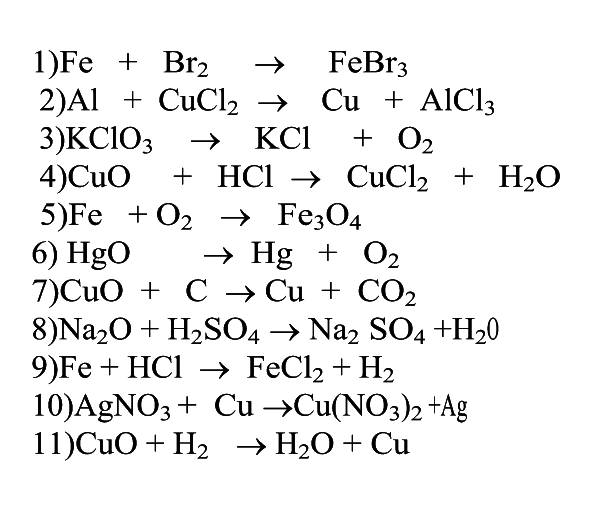 0 моль
0 моль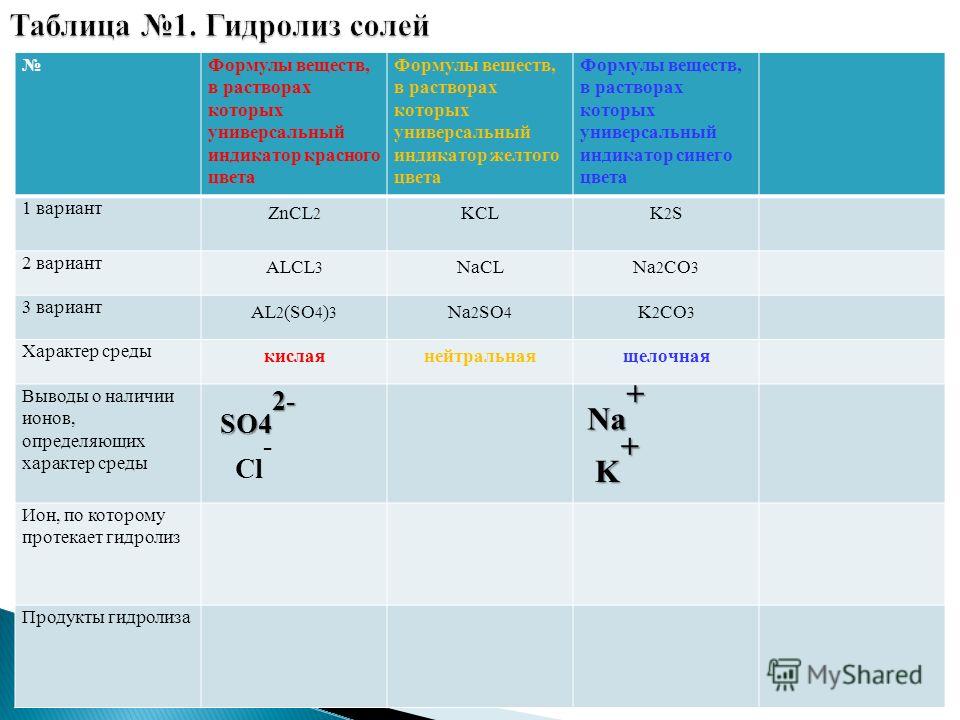 0 моль л -1 до (1,0 – a x ), поскольку А (г) расходуется в ходе реакции с образованием продуктов В (г) и С (г)
0 моль л -1 до (1,0 – a x ), поскольку А (г) расходуется в ходе реакции с образованием продуктов В (г) и С (г) 
 Мы планируем добавлять и улучшать контент. Не стесняйтесь использовать то, что у нас есть до сих пор.
Мы планируем добавлять и улучшать контент. Не стесняйтесь использовать то, что у нас есть до сих пор.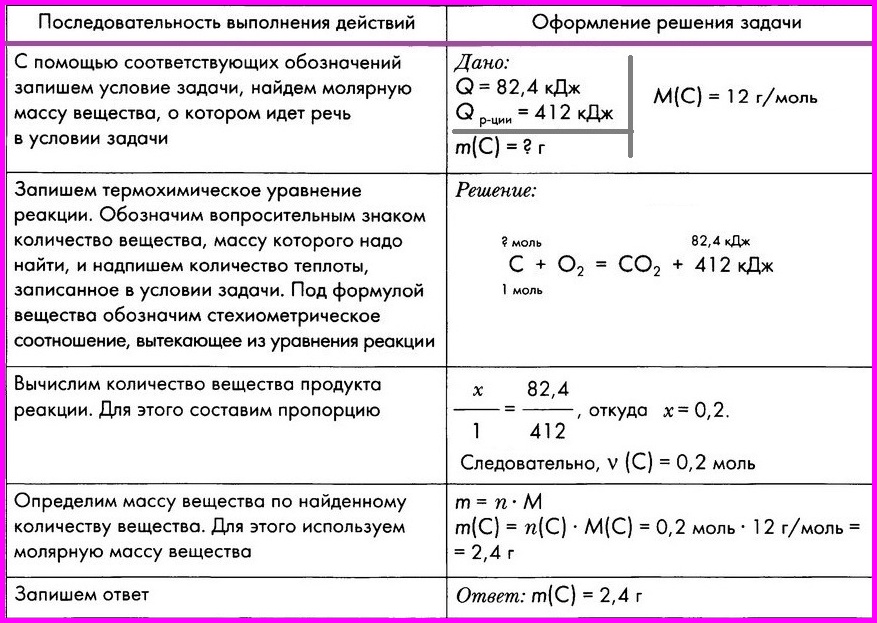 Вы можете выбирать, какие математические темы подходят к вашим конкретным задачам по химии.
Вы можете выбирать, какие математические темы подходят к вашим конкретным задачам по химии.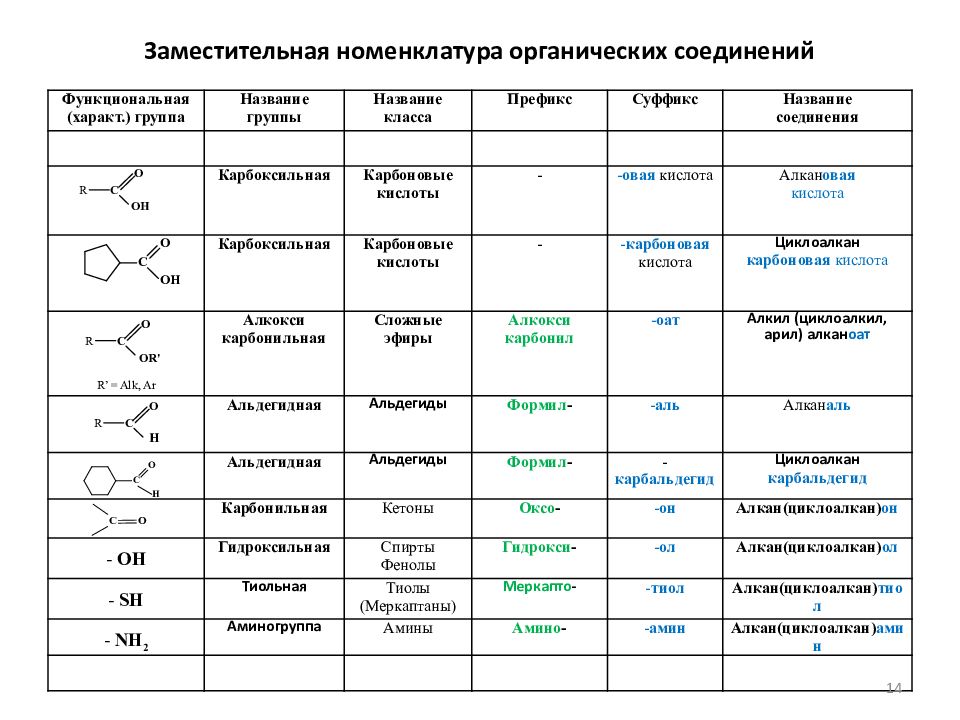 По некоторым категориям,
между различными уровнями (начальным, промежуточным,
и
колледж) учебных пособий. Найдите уровень алгебры, который согласуется
с участием
вы больше всего и делаете учебники под этим уровнем. Если вы
начните ниже уровня алгебры колледжа, убедитесь, что вы делаете свой путь
через алгебру колледжа.
По некоторым категориям,
между различными уровнями (начальным, промежуточным,
и
колледж) учебных пособий. Найдите уровень алгебры, который согласуется
с участием
вы больше всего и делаете учебники под этим уровнем. Если вы
начните ниже уровня алгебры колледжа, убедитесь, что вы делаете свой путь
через алгебру колледжа. 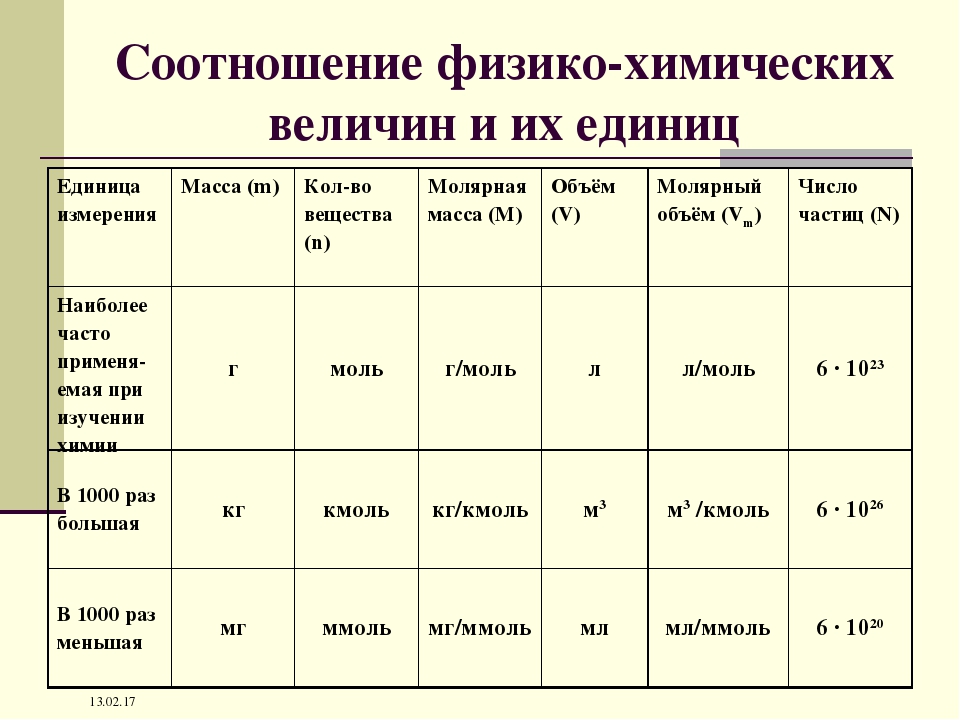 Ты
знаете, забавные вещи, такие как убедиться, что у вас есть минус в правильном
место
и помнить, когда вам нужно найти общий знаменатель ваших
дроби.
Не волнуйтесь, я абсолютно уверен, что вы
гораздо лучше справляется с арифметикой, чем Кальвин.
Ты
знаете, забавные вещи, такие как убедиться, что у вас есть минус в правильном
место
и помнить, когда вам нужно найти общий знаменатель ваших
дроби.
Не волнуйтесь, я абсолютно уверен, что вы
гораздо лучше справляется с арифметикой, чем Кальвин.  Иногда в химии нужно уметь найти среднее или среднее значение, которое является одной из центральных тенденций.
Иногда в химии нужно уметь найти среднее или среднее значение, которое является одной из центральных тенденций.

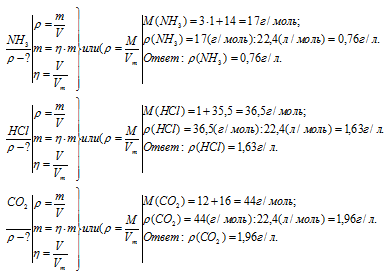
 Ты
знать лучше, чем кто-либо другой, каковы ваши навыки алгебры.
Ты
знать лучше, чем кто-либо другой, каковы ваши навыки алгебры.

 Ты
знать лучше, чем кто-либо другой, каковы ваши навыки алгебры.
Ты
знать лучше, чем кто-либо другой, каковы ваши навыки алгебры.



 Это чисто для
вы можете ссылаться на информацию или развлекаться, когда вы проходите исследование
сессия.
На каждом из этих веб-сайтов есть пункт об авторских правах, который вам необходимо прочитать.
внимательно
если вы хотите сделать что-то еще, кроме как зайти на сайт и прочитать
Это. Мы препятствуем любому незаконному использованию веб-страниц, найденных на этих
места.
Это чисто для
вы можете ссылаться на информацию или развлекаться, когда вы проходите исследование
сессия.
На каждом из этих веб-сайтов есть пункт об авторских правах, который вам необходимо прочитать.
внимательно
если вы хотите сделать что-то еще, кроме как зайти на сайт и прочитать
Это. Мы препятствуем любому незаконному использованию веб-страниц, найденных на этих
места.