Неорганическая химия — основа новых материалов
Юрий Дмитриевич Третьяков,
академик РАН
«Химия и жизнь» №5, 2007
Большая часть знаний, на которых базируется неорганическая химия, получена довольно давно, но во второй половине прошлого века она вдруг оказалась в тени фантастических достижений органической химии и химии живых систем. Практически у всех создалось ощущение, что неорганическая химия — в глубоком застое. Этому в немалой степени способствовали и университетские профессора, излагавшие предмет почти в неизменном виде на протяжении десятилетий. Между тем ситуация в последние годы существенно переменилась. Интенсивное развитие электроники, фотоники, сенсорики и спинтроники потребовало новых материалов со специальными свойствами, что привело к ренессансу неорганической химии.
Кстати, неорганика вообще гораздо сложнее органической химии. Последняя — это фактически химия одного элемента, а у неорганики их в арсенале почти сто. Именно это дает простор для создания самых разных материалов с разными свойствами.
В Периодической системе элементов уже почти исчезли «застойные» зоны, практически все элементы активно применяются в новых материалах. Пример тому — использование самых молодых (по времени открытия) химических элементов, таких, как рений, технеций и франций, не говоря уже о плутонии, америции и других актинидах.
Переход от химических элементов к материалам исключительно сложен, здесь не помогают даже методы комбинаторной химии, поскольку возможно множество сочетаний различных химических элементов. Например, только для элементов, имеющих стабильные изотопы, таких сочетаний больше 7·1023. Это число увеличится на много порядков, если учесть, что большинство современных материалов создают, используя метастабильные состояния веществ. Дело в том, что 99,9% неорганических материалов находятся в неравновесном состоянии, то есть с ними что-то происходит во времени (например, металл окисляется). Этот процесс превращения может быть очень медленным, поэтому кажется, что материал стабилен и неизменен. Чем отличается стабильное состояние от метастабильного? Если зафиксировать все параметры, которые характеризуют состояние системы, то только одно-единственное будет термодинамически стабильным, а множество других — метастабильными. Таких метастабильных состояний бесконечно много даже для одного вещества, имеющего фиксированный состав, а свойства у этих состояний разные.
Чем отличается стабильное состояние от метастабильного? Если зафиксировать все параметры, которые характеризуют состояние системы, то только одно-единственное будет термодинамически стабильным, а множество других — метастабильными. Таких метастабильных состояний бесконечно много даже для одного вещества, имеющего фиксированный состав, а свойства у этих состояний разные.
В этой ситуации метод случайного перебора композиций не может быть эффективным — надо с умом использовать закономерности неорганической химии. К сожалению, несмотря на славные традиции ее развития в России, в последние 10–20 лет фронт отечественных исследований значительно сузился из-за крайне ограниченных экспериментальных возможностей многих научных групп (нет современных электронных микроскопов, синхротронных источников излучения, сквид-магнетометров, ЯМР-спектрометров высокого разрешения и т. д.). Это тем более печально, что в прошлом российские ученые внесли существенный вклад в развитие неорганической химии, — достаточно вспомнить Д. И. Менделеева, И.С. Курнакова, Л.А. Чугаева, И.И. Черняева, а также А.В. Новоселову, И.В. Тананаева, В.И. Спицина.
И. Менделеева, И.С. Курнакова, Л.А. Чугаева, И.И. Черняева, а также А.В. Новоселову, И.В. Тананаева, В.И. Спицина.
Мы не будем пытаться охватить все направления современной неорганической химии, а ограничим круг научных проблем опытом, накопленным на кафедре неорганической химии химического факультета и на факультете наук о материалах МГУ за последние годы. Несмотря на неизбежную субъективность, этот выбор дает достаточно полное представление о современной неорганической химии. Возьмем только основные направления: химия ионных и молекулярных прекурсоров; кристаллохимический дизайн новых неорганических соединений; неорганическая супрамолекулярная химия; химия соединений переменного состава; химия элементов в аномальных степенях окисления; неорганическая химия биоматериалов; неорганический синтез материалов с использованием различных физических воздействий.
Химия прекурсоров
Прекурсор — это предшественник, а точнее, обычное в неорганике обозначение исходного вещества, вступающего в реакцию. Конечная цель исследователей — не синтез соединений, а создание на их основе материалов с определенным комплексом свойств. Свойства же материала зависят от его структуры. Ну, это понятно в общем смысле, а если копнуть глубже, то оказывается, что у каждого материала есть несколько уровней структуры, которые связаны между собой, и все они влияют на свойства материала.
Конечная цель исследователей — не синтез соединений, а создание на их основе материалов с определенным комплексом свойств. Свойства же материала зависят от его структуры. Ну, это понятно в общем смысле, а если копнуть глубже, то оказывается, что у каждого материала есть несколько уровней структуры, которые связаны между собой, и все они влияют на свойства материала.
Первый уровень структуры — кристаллический. Это структура на атомном и ионном уровне организации вещества, то, как расположены ионы, атомы или молекулы в кристаллической решетке относительно друг друга. Следующий уровень — более удаленный от атомного состояния, он связан с присутствием в твердом теле различных линейных дефектов. Третий уровень — это макроскопические дефекты (например, поры), которые возникают в твердых телах в процессе их формирования или использования.
Одно дело, когда у нас в руках монокристалл — в нем кристаллический порядок повторяется во всем объеме. Но чаще всего мы имеем дело с поликристаллическими телами, то есть такими, которые состоят из маленьких кристалликов (кристаллитов), по-разному ориентированных друг относительно друга. Здесь возникают дополнительные дефекты (дислокации, границы между кристалликами, поры, трещины), которые вносят важный вклад в формирование свойств. Например, железо, если его получить в виде монокристалла, будет в химическом отношении совершенно инертно. А если железо получить разложением карбонила или оксалата железа, то это будет поликристаллический материал, который сразу сгорает на воздухе, образуя оксиды. И то и другое — железо, а ведут они себя совершенно по-разному.
Здесь возникают дополнительные дефекты (дислокации, границы между кристалликами, поры, трещины), которые вносят важный вклад в формирование свойств. Например, железо, если его получить в виде монокристалла, будет в химическом отношении совершенно инертно. А если железо получить разложением карбонила или оксалата железа, то это будет поликристаллический материал, который сразу сгорает на воздухе, образуя оксиды. И то и другое — железо, а ведут они себя совершенно по-разному.
Чтобы управлять зависимостью свойств от уровней структуры, надо, чтобы исходные вещества были в определенном состоянии. А этого не всегда просто достичь. При получении многих материалов неэффективен, казалось бы, самый простой твердофазный синтез, который широко использовали раньше для получения магнитных диэлектриков и пьезокерамики. Например, марганец-цинковые ферриты синтезировали, осуществляя реакцию:
Оказалось, что традиционные механическое перемешивание, прессование смеси реагентов и их высокотемпературный обжиг (1200°С) во многих случаях не дают однофазного продукта. При повышении температуры теряется летучий оксид цинка и происходит диссоциация оксида железа (III). Все это изменяет состав и существенно ухудшает свойства материала.
При повышении температуры теряется летучий оксид цинка и происходит диссоциация оксида железа (III). Все это изменяет состав и существенно ухудшает свойства материала.
Шаг вперед — использование в качестве исходных реагентов твердых солевых растворов. Как показали наши исследования, наиболее удобны для этого соли типа шенитов — M2+A+(RO4)2·6Н20 (М = Mg, Mn, Ni, Co, Fe, Cu, Zn; A — щелочной металл или NH4+, R = S, Se, Те) или квасцов A+M3+(SO4)2·12Н20 (А — щелочной металл или NH4, М = Fe, Cr, Со).
Теперь сделаем маленькое отступление и поясним, что такое твердые солевые растворы. Для примера возьмем более простую соль, например NaCl. Если растворить хлорид натрия в воде, а потом понизить температуру, то раствор станет пересыщенным и выпадет осадок. Если мы в этот же раствор добавим еще и KCl, то из раствора по мере понижения температуры выделятся не индивидуальные соли NaCl и KCl, а кристаллиты твердого раствора. В твердом растворе, также как и в жидком, вещества смешаны на атомном уровне — в этом его ключевое отличие от механической смеси кристаллов.
В твердом растворе, также как и в жидком, вещества смешаны на атомном уровне — в этом его ключевое отличие от механической смеси кристаллов.
Твердые растворы широко используют в металлургии. Известно, что железо в процессе получения из руды растворяет углерод. Если железо не содержит углерода, то оно мягкое и пластичное, если углерода 1% — это прочная сталь, а если 4% — хрупкий чугун. Для любого человека это совершенно разные материалы, а для химика — твердый раствор железа с различным содержанием растворенного углерода. Другой пример — когда в меди растворяют олово и получается бронза. В зависимости от того, какое количество олова содержится в сплаве, материал будет иметь совершенно разные механические и прочностные свойства, и даже звучание колокола, который делают из меди, будет совершенно разным.
Так вот, оказалось, что шениты и квасцы могут образовывать твердые растворы при любых соотношениях компонентов и имеют хорошую растворимость в воде, резко уменьшающуюся при охлаждении. Это так называемые ионные (поскольку в солях ионная связь) прекурсоры, или исходные реагенты. Целевой продукт — феррит получают с помощью термолиза:
Это так называемые ионные (поскольку в солях ионная связь) прекурсоры, или исходные реагенты. Целевой продукт — феррит получают с помощью термолиза:
От того, в каких условиях проводится эта реакция, зависит, удастся ли получить поликристаллический материал с нужной керамической структурой и свойствами.
Несколько позже появилась криохимическая технология получения твердых солевых растворов, основанная на сбалансированном сочетании нагрева и охлаждения. Прежде чем применять новую технологию, надо было подробно изучить фундаментальные процессы криокристаллизации, сублимационного обезвоживания, криоосаждения, криоэкстракции и криодиспергирования. Криохимический синтез солеобразных исходных реагентов стал основой получения самых разных функциональных материалов. Например, высокопрочной керамики, пигментов, сорбентов, катализаторов и многого другого.
Важная особенность солеообразных ионных прекурсоров — так называемая топохимическая память, то есть способность помнить свое происхождение и передавать эту информацию в последующих реакциях, которые так и называются — топохимическими. Скорее всего, эту информацию в твердом теле хранит реальная структура, сформированная, как правило, в неравновесных условиях. В дальнейшем это сильно влияет на свойства функциональных материалов (особенно тех, которые получают в форме поликристаллической керамики).
Скорее всего, эту информацию в твердом теле хранит реальная структура, сформированная, как правило, в неравновесных условиях. В дальнейшем это сильно влияет на свойства функциональных материалов (особенно тех, которые получают в форме поликристаллической керамики).
Очень важны и интересны исследования молекулярных прекурсоров (исходных реагентов). Их используют, например, для создания тонкопленочных материалов методом молекулярного наслаивания. Известно, что уже давно назрела необходимость увеличить плотность записи информации в кремниевых микросхемах, а для этого придется заменить SiО2 на оксиды с большей величиной диэлектрической константы. Среди наиболее вероятных претендентов оказались НfO2, ZrO2, Ln203 (лантан и другие редкоземельные элементы). Чтобы получить пленки таких оксидов на поверхности кремния, надо создать исходные реагенты с высокой летучестью и относительной термической стабильностью, которые смогут легко гидролизоваться (или вступать в другие реакции разложения) с образованием аморфных оксидов на поверхности кремния. В лаборатории координационной химии МГУ синтезировали новые молекулярные прекурсоры на основе насыщенных комплексов металла с лигандами, образующими относительно слабые донорно-акцепторные связи.
В лаборатории координационной химии МГУ синтезировали новые молекулярные прекурсоры на основе насыщенных комплексов металла с лигандами, образующими относительно слабые донорно-акцепторные связи.
Комплексы с органическими лигандами использовали и для решения другой важнейшей проблемы — получения термозащитных покрытий на лопатках газотурбинных двигателей. Оказалось, что лучше всего покрытия, полученные осаждением ZrO2 (Y2O3) из паров бета-дикетонатов соответствующих металлов. Процесс недорогой, поскольку можно использовать недорогой ацетилацетат. То, что полимерный Y(AcAc)3 недостаточно летуч, легко устраняется его совместным испарением с летучим Zr(AcAc). — при этом испарение происходит гораздо полнее.
Кристаллохимический дизайн
Сотрудники кафедры неорганической химии МГУ разработали концепцию структур срастания и использовали ее для поиска новых материалов. Что такое структуры срастания?
Например, возьмем кристалл WO3. Его стабильная модификация (со структурой типа ReO3) получается в результате сочленения октаэдров, так что они имеют только общие вершины и больше ничего общего у них нет. Если представить, что одна часть структуры смещается относительно другой, то тогда общими становятся не только вершины, но и грани. Такое смещение происходит при переходе к нестехиометрическим составам. Практически это делают следующим образом. В WO3 на каждый атом вольфрама приходится три атома кислорода. Если отжигать такой кристалл при пониженном давлении кислорода, то он частично восстанавливается, теряя какую-то часть кислорода и сохраняя при этом кристаллическую структуру (на такое восстановление способны не все оксиды, например оксид никеля восстанавливается скачком, изменяя состав с образованием металлического никеля). Структура срастания — это фаза с нестехиометрическим соотношением атомов, и ее можно представить как сдвиг одной части кристаллов относительно другой. Этот сдвиг повторяется через определенное число октаэдров, а увидеть его можно на электронных микроскопах высокого разрешения.
Его стабильная модификация (со структурой типа ReO3) получается в результате сочленения октаэдров, так что они имеют только общие вершины и больше ничего общего у них нет. Если представить, что одна часть структуры смещается относительно другой, то тогда общими становятся не только вершины, но и грани. Такое смещение происходит при переходе к нестехиометрическим составам. Практически это делают следующим образом. В WO3 на каждый атом вольфрама приходится три атома кислорода. Если отжигать такой кристалл при пониженном давлении кислорода, то он частично восстанавливается, теряя какую-то часть кислорода и сохраняя при этом кристаллическую структуру (на такое восстановление способны не все оксиды, например оксид никеля восстанавливается скачком, изменяя состав с образованием металлического никеля). Структура срастания — это фаза с нестехиометрическим соотношением атомов, и ее можно представить как сдвиг одной части кристаллов относительно другой. Этот сдвиг повторяется через определенное число октаэдров, а увидеть его можно на электронных микроскопах высокого разрешения. Надо отметить, что структуры срастания оказались стабильны в довольно широком диапазоне температур.
Надо отметить, что структуры срастания оказались стабильны в довольно широком диапазоне температур.
Концепция структур срастания показала себя очень эффективной при синтезе новых высокотемпературных сверхпроводников на основе сложных оксидов меди. В них входит перовскит (ABO3) или его фрагмент, который становится одним из блоков структур срастания (рис. 1). Новые сверхпроводники синтезировали, перебирая различные структуры, подобно тому как это делается при синтезе органических соединений. Но в данном случае надо было рассматривать не изолированные группы атомов, как в органических молекулах, а бесконечные двумерные слои, объединенные в блоки.
Такое кристаллохимическое моделирование позволило Е.В. Антипову и С.Н. Путилину (кафедра неорганической химии МГУ) спрогнозировать существование и синтезировать новое семейство (рис. 2) сверхпроводников HgBa2Can–1CunO2n+2+δ, которое обладает рекордно высокими значениями критической температуры (у лучшего представителя 135 К). Температуры перехода в сверхпроводящее состояние у таких соединений сильно зависят от содержания кислорода и числа слоев (CuO2). Потом оказалось, что если добавить еще и атомы фтора, то это расширяет область поиска Cu-содержащих сверхпроводников (оксифторидов). Особенно надо отметить синтез HgBa2Ca2Cu3O8F0,32 — в этом веществе внедрение фтора вызвало анизотропное химическое сжатие и привело к возрастанию Тс до рекордно высокого значения 138 К.
Температуры перехода в сверхпроводящее состояние у таких соединений сильно зависят от содержания кислорода и числа слоев (CuO2). Потом оказалось, что если добавить еще и атомы фтора, то это расширяет область поиска Cu-содержащих сверхпроводников (оксифторидов). Особенно надо отметить синтез HgBa2Ca2Cu3O8F0,32 — в этом веществе внедрение фтора вызвало анизотропное химическое сжатие и привело к возрастанию Тс до рекордно высокого значения 138 К.
Принципиально новый подход к дизайну новых материалов (разработан А.Р. Каулем с сотрудниками) — эпитаксиальная стабилизация неустойчивых оксидов в виде тонких пленок. Эпитаксия — это когда одно вещество удается кристаллизовать на поверхности другого, заставляя его принять ту структуру, которую имеет подложка. Матрица как бы навязывает пленке свое строение.
Так, ученые МГУ синтезировали новые соединения RBО3 (R — редкоземельный элемент, В = Ni, Co, Mn, Fe, In) с различными свойствами: сегнетоэлектрики (RFeО3 и RMnО3), материалы с переходом «металл—диэлектрик» (RNiО3, RCоО3) и магнитные материалы (R3Fe5O12). Оказалось, что эпитаксиальную стабилизацию можно с успехом использовать в производстве тонкопленочных материалов для микроэлектроники.
Оказалось, что эпитаксиальную стабилизацию можно с успехом использовать в производстве тонкопленочных материалов для микроэлектроники.
Конечно, конструирование функциональных материалов не сводится только к кристаллохимическому дизайну. Можно использовать систему физико-химических принципов, достаточно давно сформулированных автором этой статьи. Ее с успехом применили для оптимизации свойств ферритов, магнитных полупроводников, электронно-ионных проводников, керамических электролитов, пьезокерамики и т. д.
Неорганическая нано
– и супрамолекулярная химияИнтерес к наноматериалам связан, в частности, с их необычными физическими свойствами. Принято, что наноматериалы, в отличие от обычных материалов, состоят из частиц меньше 100 нм — именно в этой области происходит резкое изменение свойств. Например, уменьшение размеров полупроводниковых частиц ниже некоторого критического значения может привести к изменению ширины запрещенной зоны, генерации второй гармоники, эффектам размерного квантования энергетических уровней.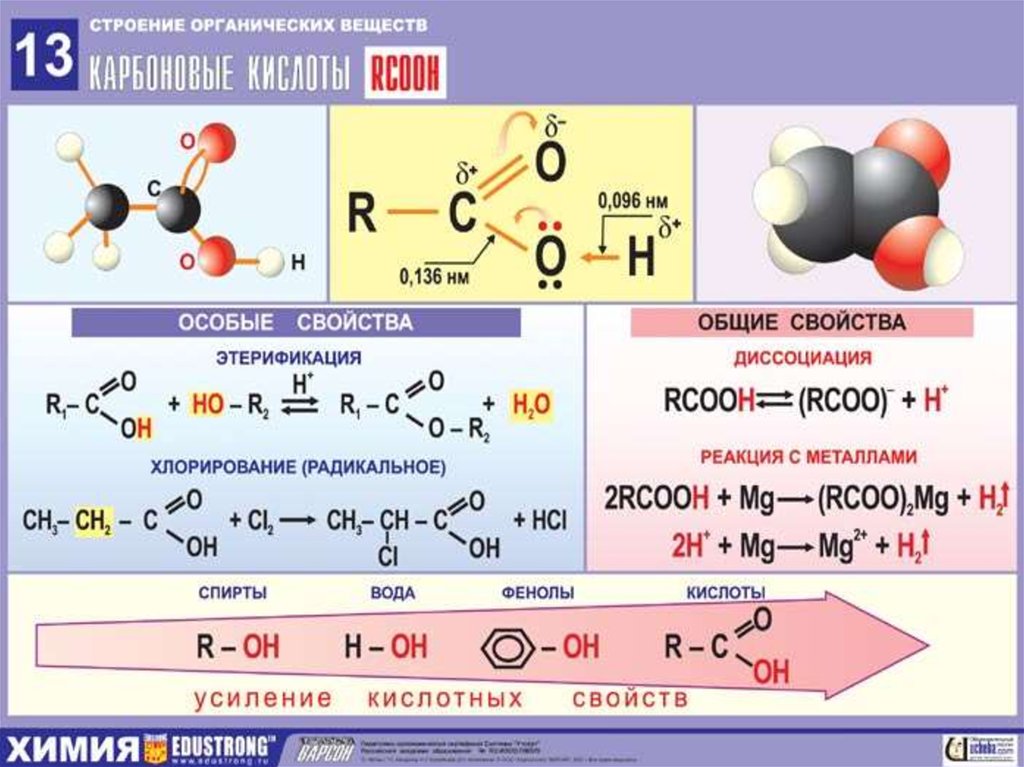 При этом, наверное, самая большая проблема — предрасположенность свободных наночастиц к агрегации: это сильно затрудняет их практическое применение. Один из путей решения этой проблемы — нанести наночастицы на инертную матрицу, которая защитит их от воздействия окружающей среды и предотвратит агрегацию. Методами получения таких нанокомпозитов тоже занимается неорганическая химия.
При этом, наверное, самая большая проблема — предрасположенность свободных наночастиц к агрегации: это сильно затрудняет их практическое применение. Один из путей решения этой проблемы — нанести наночастицы на инертную матрицу, которая защитит их от воздействия окружающей среды и предотвратит агрегацию. Методами получения таких нанокомпозитов тоже занимается неорганическая химия.
Как матрицу для нанокомпозитных материалов можно использовать кремнеземы. Их большое преимущество — высокоупорядоченные поры с диаметром от 20 до 100 А. Пористых материалов много, но кремнеземы в своем роде уникальны, поскольку у них довольно однородное распределение пор по размерам, а также очень высокая удельная поверхность (1000 м2/г). Пористый SiO2, можно использовать как матрицу для синтеза наночастиц металла, полупроводниковых соединений, а также полианилиновых и углеродных волокон.
Сегодняшний этап развития неорганической супрамолекулярной химии — это супрамолекулярные ансамбли, обладающие благодаря особенностям архитектуры особыми свойствами. Их строение определяется структурой каркаса «хозяина», а функциональные свойства — природой «гостя». Возьмем, к примеру, полупроводниковые клатраты. У них в полостях каркаса «хозяина» размещены атомы «гостя» с координационными числами 20 и 24. Гостевые атомы не связаны с каркасом ковалентными связями и могут колебаться с такими частотами, которые обеспечивают эффективное рассеяние теплопроводящих фононов. У таких материалов очень низкое (как у стекол) значение теплопроводности. В то же время каркас обеспечивает высокие концентрацию и подвижность носителей заряда. Все это делает клатраты перспективными веществами для создания термоэлектрических материалов.
Их строение определяется структурой каркаса «хозяина», а функциональные свойства — природой «гостя». Возьмем, к примеру, полупроводниковые клатраты. У них в полостях каркаса «хозяина» размещены атомы «гостя» с координационными числами 20 и 24. Гостевые атомы не связаны с каркасом ковалентными связями и могут колебаться с такими частотами, которые обеспечивают эффективное рассеяние теплопроводящих фононов. У таких материалов очень низкое (как у стекол) значение теплопроводности. В то же время каркас обеспечивает высокие концентрацию и подвижность носителей заряда. Все это делает клатраты перспективными веществами для создания термоэлектрических материалов.
Новое направление неорганической супрамолекулярной химии исследует контролируемую самосборку упорядоченных супрамолекулярных ансамблей в высокотемпературных реакциях, когда реакционная система сложна и не поддается анализу. Основой для таких процессов служит взаимная подстройка «гостя» и «хозяина». Первый служит шаблоном для формирования каркаса определенной топологии и геометрии, но при этом и сам изменяет свои параметры, подчиняясь требованиям «хозяина». Пример — структура [Hg6P4](TiCl6)Cl, сформированная за счет самосборки TiCl63– и Сl– в полостях каркаса [Hg6P4]4+ (рис. 3).
Пример — структура [Hg6P4](TiCl6)Cl, сформированная за счет самосборки TiCl63– и Сl– в полостях каркаса [Hg6P4]4+ (рис. 3).
Соединения переменного состава
Соединения переменного состава открыл более 100 лет назад Н.С. Курнаков и назвал их бертоллидами. Позднее оказалось, что практически все неорганические твердофазные соединения с ионным типом связи имеют непостоянный состав. Возьмем, к примеру, поваренную соль NaCl. Кажется, что это соединение постоянного состава, а на самом деле — переменного. Причем его кристаллическая структура будет сохраняться, даже если на один атом натрия придется больше (или меньше), чем один атом хлора. И хотя отклонение состава от стехиометрического очень невелико (порядка 10–5–10–7), это уже влияет на свойства вещества и потому становится очень важным в науке о материалах. Например, бесцветный (и стехиометрический) NaCl, обработанный парами натрия при высоких температурах, станет голубым и начнет проводить электрический ток. Если NaCl обработать парами хлора, то он позеленеет и тоже станет проводником, но не за счет движения электронов, а за счет подвижных дырок. Выходит, что можно получать вещества с различными свойствами, не изменяя кристаллической структуры.
Если NaCl обработать парами хлора, то он позеленеет и тоже станет проводником, но не за счет движения электронов, а за счет подвижных дырок. Выходит, что можно получать вещества с различными свойствами, не изменяя кристаллической структуры.
В зависимости от элементов, которые входят в состав соединений переменного состава, область их существования может быть широкой (моноксиды титана и железа) или, наоборот, крайне узкой (галогениды щелочных металлов, халькогениды цинка, свинца, кадмия). Если отклонения от стехиометрии невелики, то такой материал можно описывать как модель с точечными дефектами или внедренными атомами, не взаимодействующими друг с другом. Когда степень нестехиометрии возрастает, изменения, происходящие в кристаллах, имеют другую природу (например, образуются ассоциаты). Подробным исследованием структуры таких соединений занимаются многие исследователи, но тут пока не все ясно.
Есть немало систем с так называемой бесконечно адаптируемой структурой. Они сохраняют свою структурную организацию при непрерывном изменении состава и без участия точечных дефектов. Способностью адаптироваться, как оказалось, обладают фазы переменного состава Y(OF)2,13–2,22 и твердые растворы ТiO2(Cr2O3).
Способностью адаптироваться, как оказалось, обладают фазы переменного состава Y(OF)2,13–2,22 и твердые растворы ТiO2(Cr2O3).
Все уже полученные знания в этой области можно применить к любым вновь созданным материалам: сверхпроводящим купратам, манганитам с колоссальным магнитным сопротивлением или цератам с высокой протонной проводимостью. Но каждый из них имеет собственную специфику и потому требует проведения собственных исследований нестехиометрии.
Именно среди таких соединений с переменным составом удалось найти сверхпроводящий материал, сохраняющий высокий уровень критических токов в сильных магнитных полях, — например, неодим-бариевый купрат Nd1–xBa2–xCu3Oz.
А вот иттрий-бариевый купрат YBa2Cu3Oz со строгой катионной стехиометрией такими свойствами не обладает.
Элементы в аномальных степенях окисления
Идея создавать новые материалы на основе элементов в необычных степенях окисления пока кажется довольно странной. Очевидная причина — аномальная степень окисления равносильна нестабильному состоянию этого элемента. Получать подобные материалы можно только в том случае, когда такой необычный элемент существует достаточно долго. Но тем не менее исследования эти необычайно интересны.
Очевидная причина — аномальная степень окисления равносильна нестабильному состоянию этого элемента. Получать подобные материалы можно только в том случае, когда такой необычный элемент существует достаточно долго. Но тем не менее исследования эти необычайно интересны.
Большой вклад в химию элементов, находящихся в аномальной степени окисления, внесли исследователи из Института физической химии РАН и химического факультета МГУ. Они получили NpVII, PuVII, AmVII, CmVI, CmV, серию актинидов и лантанидов в низших степенях окисления, показали возможность существования TmIV.
С точки зрения материаловеда, наиболее интересны «матричные» системы. Их получают кристаллизацией из раствора или расплава, соосаждением или твердофазным синтезом. Так удалось синтезировать матричные системы, содержащие Fe(IV), Fe(V), Fe(VI) и Co(VI). Возможен и другой путь синтеза — когда легирующий ион замещает металл в матрице, свойства которой предопределяют состояние окисления этого легирующего иона. Так, в пентаоксиде ванадия стабилизируется Fe(V), причем это необычное окислительное состояние возникает просто при растворении в расплаве пентаоксида ванадия оксида трехвалентного железа. Правда, реально получить Fe(V) удалось только после быстрой закалки образцов. Известны также соединения висмута в низших степенях окисления (Bi53+, Bi85+ и Bi95+) и никеля.
Так, в пентаоксиде ванадия стабилизируется Fe(V), причем это необычное окислительное состояние возникает просто при растворении в расплаве пентаоксида ванадия оксида трехвалентного железа. Правда, реально получить Fe(V) удалось только после быстрой закалки образцов. Известны также соединения висмута в низших степенях окисления (Bi53+, Bi85+ и Bi95+) и никеля.
Со всеми подобными соединениями очень трудно работать, поскольку они малостабильны. Свойства их почти не изучены, и не очень понятна перспектива их применения.
Неорганические биоматериалы
У таких, казалось бы, прочных природных материалов, как костная и зубная ткани, тем не менее постоянно появляются проблемы. Кость, с точки зрения материаловеда, — это композиционный материал, состоящий из гидроксилапатита Ca10(PO4)6(OH)2 (63% вес.) и белка коллагена (20% вес.) (рис. 4). Кроме того, в кости есть заметные количества ионов Na+, Mg2+, К+, Сl–, F–, СО32–. Что обеспечивает высокую прочность кости, так до конца и непонятно. Поэтому даже самыми современными методами пока невозможно создать полный аналог костной ткани. Единственная альтернатива — имплантаты.
Что обеспечивает высокую прочность кости, так до конца и непонятно. Поэтому даже самыми современными методами пока невозможно создать полный аналог костной ткани. Единственная альтернатива — имплантаты.
Когда требуется восстановить участки, подверженные серьезным циклическим нагрузкам (например, тазобедренный сустав), используют металлические сплавы на основе малотоксичного титана. В остальных случаях предпочитают более похожую по составу на кость керамику или композиты с фосфатом кальция. Современная тенденция — «регенерационный» подход, то есть создание и использование материалов, которые взаимодействуют с организмом и стимулируют восстановление ткани. Такие имплантаты невозможно создать без глубокого понимания физиологических процессов.
Считают, что важен не только химический состав, но и структура кристаллов гидроксилапатита, поскольку это определяет отклик организма на чужеродный материал. С этой точки зрения идеально вещество, во всем подобное костному биоминералу. Этого добиться очень сложно, тем более в промышленных масштабах. Тем не менее химическое и структурное соответствие биоматериала костной ткани — один из основных принципов в этой области. Варьируя эти параметры, можно делать биоматериалы с заданной биоактивностью.
Тем не менее химическое и структурное соответствие биоматериала костной ткани — один из основных принципов в этой области. Варьируя эти параметры, можно делать биоматериалы с заданной биоактивностью.
Синтез, модификация и исследование фосфатов кальция с заданным составом и микроморфологией, оценка их будущей биоактивности — большая и неординарная задача для химиков. Уже известно, как образуется и гидролизуется гидроксилапатит. Увеличить его биологическую активность можно двумя путями: уменьшить размеры кристаллов (благодаря чему увеличивается удельная поверхность) и изменить физико-химические характеристики поверхности, то есть химически ее модифицировать. При втором подходе возможно создать материалы, которые активно рассасывались бы при контакте с жидкостями организма. Перспективными считают карбонатсодержащий гидроксилапатит Ca10–0,5x(PO4)6–x(CO3)·(OH)2, а также кремнийсодержащий гидроксилапатит:
То, что после полувекового активного применения биоматериалов исследователи пытаются сделать такой, который бы стимулировал регенерацию костной ткани, означает, что пришло понимание исключительной сложности задачи. Применение того или иного материала зависит и от характеристики костного дефекта, и от конкретного клинического случая. Поэтому надо иметь целый спектр искусственных заменителей, чтобы можно было выбрать то, что подходит конкретному больному.
Применение того или иного материала зависит и от характеристики костного дефекта, и от конкретного клинического случая. Поэтому надо иметь целый спектр искусственных заменителей, чтобы можно было выбрать то, что подходит конкретному больному.
Синтез с помощью физических воздействий
Каков бы ни был механизм химических превращений, чтобы они начались, смесь надо активизировать. Самое простое — нагрев, эффективность которого можно оценить величиной энергии активации в уравнении Аррениуса. Однако эта величина (ее можно экспериментально определить как температурный коэффициент скорости реакции) имеет физический смысл только тогда, когда ее можно связать с определенным элементарным процессом, лимитирующим реакцию в рассматриваемом температурном диапазоне.
В реальных же синтезах материалов химическое взаимодействие складывается по меньшей мере из двух фундаментальных процессов — собственно химической реакции и переноса вещества к реакционной зоне. Поскольку последний процесс зависит от диффузии, а в твердом теле подвижность составных частей определяется дефектностью его структуры, то в результате дефекты существенно влияют на условия твердофазного синтеза.
Начнем с ультразвука. Его эффективность зависит от фазового состояния системы. Если это жидкость (растворы, расплавы), то после ультразвукового воздействия происходит кавитация, то есть возникновение, осцилляции и коллапс микропузырьков. В результате формируются короткоживущие «горячие зоны», с температурой до 5000 К и давлением до 1000 атм. В некоторых случаях после схлопывания кавитационных пузырьков возникают интенсивные микропотоки жидкости и мощные локальные ударные волны, которые ускоряют массоперенос. Как следствие — разлагаются летучие соединения (карбонилы металлов), ускоряются окислительно-восстановительные реакции, образуются стабильные эмульсии и суспензии. Оказалось, что ультразвук очень эффективен в жидкофазных системах при проведении классических реакций неорганического синтеза, а также при получении нанопорошков металлов, оксидов и карбидов.
Если реакция идет в твердой фазе, то ультразвук увеличивает плотность дислокаций и эффективные коэффициенты диффузии, а также способствует новым межфазным контактам. Возможно даже, что изменится механизм реакции и снизится температура взаимодействия реагентов. Акустическая активация процессов в твердой фазе дала возможность синтезировать оксидные материалы, получить активные формы исходных реагентов, а иногда и направленно изменять конечные свойства продуктов.
В последние 10–12 лет исследователи предпринимали немало попыток микроволнового синтеза и спекания материалов. Но между тем физико-химическая природа происходящих при этом процессов так и осталась малоизученной. Микроволнами обрабатывали разнообразные оксиды, гидроокиси, соли или их смеси друг с другом, получая при этом самые разные материалы — ферриты, манганиты, кобальтиты, никелаты и купраты.
Согласно теории, для того чтобы микроволновое излучение взаимодействовало с веществом и последнее поглощало энергию, нужно, чтобы в нем были либо диполи, способные переориентироваться и вращаться под микроволновым воздействием, либо свободные носители зарядов, которые могут перемещаться при наложении микроволнового поля.
Экспериментально известно, что соединения, не содержащие химически связанной воды (карбонаты, нитраты, оксалаты щелочных и щелочно-земельных элементов), практически не поглощают микроволнового излучения. Напротив, кристаллогидраты неорганических солей взаимодействуют с микроволновым полем (рис. 5), причем то, как это происходит, зависит от химической природы катионов. В итоге — микроволновая обработка смеси солей довольно эффективна, поскольку после их разложения образуются высокодисперсные частицы оксидов, равномерно распределенные по реакционному объему, которые активно взаимодействуют друг с другом. Кроме того, при микроволновой обработке смеси не только увеличивается скорость реакции, но и понижается температура взаимодействия — это также наблюдали экспериментально.
Заключение
За последние два десятилетия неорганическая химия разительно изменилась благодаря тесному взаимодействию с физической химией, физикой твердого тела, органической химией, биохимией, а также применению современных инструментальных методов исследования. Необыкновенно расширился круг объектов неорганической химии. К ним теперь причисляют не только соединения, но и материалы, причем помимо неорганической составляющей они часто содержат органические, полимерные или биополимерные фрагменты.
Большинство объектов изучают на нескольких уровнях — кроме кристаллической или молекулярной структуры исследуют электронную и магнитную, структуру дефектов кристаллического строения, распределение микропримесей, структуру границ раздела в поликристаллических веществах, наноструктуру, структуру микро- и мезопор, поверхностей, а также влияние всех перечисленных уровней на свойства вещества. О каком кризисе можно говорить, когда перед химиками столь обширное поле деятельности?
То, что было упомянуто в статье, — далеко не все научные направления неорганической химии. Более того, здесь затронуты даже не все объекты, которые изучают на кафедре неорганической химии химического факультета и на факультете наук о материалах МГУ. Мы не рассказали о неорганических материалах для газовых сенсоров; барьерных материалах; люминесцентных нанокомпозитах на основе AIVBVI; низкоразмерных структурах и сверхрешетках; новых поколениях полупроводников и полупроводниковых гетероструктур; кислородпроводящих мембранах и твердых электролитах; материалах для литиевых источников тока; магнитных нанокомпозитах на основе стекломатриц; фотонных кристаллах; керамических пигментах на основе гидроксиапатитов и многом другом, чем активно занимаются исследователи в МГУ и за его пределами.
Более того, здесь затронуты даже не все объекты, которые изучают на кафедре неорганической химии химического факультета и на факультете наук о материалах МГУ. Мы не рассказали о неорганических материалах для газовых сенсоров; барьерных материалах; люминесцентных нанокомпозитах на основе AIVBVI; низкоразмерных структурах и сверхрешетках; новых поколениях полупроводников и полупроводниковых гетероструктур; кислородпроводящих мембранах и твердых электролитах; материалах для литиевых источников тока; магнитных нанокомпозитах на основе стекломатриц; фотонных кристаллах; керамических пигментах на основе гидроксиапатитов и многом другом, чем активно занимаются исследователи в МГУ и за его пределами.
Менделеев Дмитрий | Читать биографии известных личностей РФ для школьников и студентов
Дмитрий Иванович Менделеев (1834-1907) – русский ученый-энциклопедист. В 1869 г. открыл периодический закон химических элементов — один из основных законов естествознания. Он оставил свыше 500 печатных трудов, среди которых классические «Основы химии» — первое стройное изложение неорганической химии. Также Д.И. Менделеев является автором фундаментальных исследований по физике, метрологии, воздухоплаванию, метеорологии, сельскому хозяйству, экономике, народному просвещению, тесно связанных с потребностями экономического развития России. Организатор и первый директор Главной палаты мер и весов.
Также Д.И. Менделеев является автором фундаментальных исследований по физике, метрологии, воздухоплаванию, метеорологии, сельскому хозяйству, экономике, народному просвещению, тесно связанных с потребностями экономического развития России. Организатор и первый директор Главной палаты мер и весов.
Дмитрий Иванович Менделеев родился 8 февраля 1834 г. в Тобольске в семье Ивана Павловича Менделеева, в то время занимавшего должность директора Тобольской гимназии и училищ Тобольского округа. Дмитрий был в семье последним, семнадцатым ребёнком. В 1841-1849 гг. учился в Тобольской гимназии.
Высшее образование Менделеев получил на отделении естественных наук физико-математического факультета Главного педагогического института в Петербурге, курс которого окончил в 1855 г. с золотой медалью. В 1856 г. в Петербургском университете защитил в магистерскую диссертацию и с 1857 г. в качестве доцента читал там же курс органической химии. В 1859-1861 гг. он был в научной командировке в Гейдельберге, где подружился со многими находившимися там учёными, в том числе с А. П. Бородиным и И.М. Сеченовым. Там он работал в своей небольшой домашней лаборатории, а также в лаборатории Р. Бунзена в Гейдельбергском университете. В 1861 г. опубликовал учебник «Органическая химия», удостоенный Петербургской Академией Наук Демидовской премии.
П. Бородиным и И.М. Сеченовым. Там он работал в своей небольшой домашней лаборатории, а также в лаборатории Р. Бунзена в Гейдельбергском университете. В 1861 г. опубликовал учебник «Органическая химия», удостоенный Петербургской Академией Наук Демидовской премии.
В 1862 г. Менделеев женился на падчерице знаменитого автора «Конька-Горбунка» Петра Павловича Ершова Феозвой Никитичной Лещевой, уроженкой Тобольска. В этом браке у него родилось трое детей, но одна дочь умерла в младенчестве. В 1865 г. ученый приобрел имение Боблово в Московской губернии, где занимался агрохимией и сельским хозяйством. Ф.Н. Лещева с детьми большую часть времени проживала именно там.
В 1864-1866 гг. Д.И. Менделеев был профессором Петербургского технологического института. В 1865 г. защитил докторскую диссертацию «О соединении спирта с водой» и тогда же был утверждён профессором Петербургского университета. Преподавал Менделеев и в других высших учебных заведениях. Принимал активное участие в общественной жизни, выступая в печати с требованиями о разрешении чтений публичных лекций, протестовал против циркуляров, ограничивающих права студентов, обсуждал новый университетский устав.
Открытие Менделеевым периодического закона датируется 1 марта 1869 г., когда он составил таблицу, озаглавленную «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Оно явилось результатом долголетних поисков. Он составил несколько вариантов периодической системы и на её основе исправил атомные веса некоторых известных элементов, предсказал существование и свойства ещё неизвестных элементов. На первых порах сама система, внесённые исправления и прогнозы Менделеева были встречены сдержанно. Но после открытия предсказанных им элементов (галлий, германий, скандий), периодический закон стал получать признание. Периодическая система явилась своего рода путеводной картой при изучении неорганической химии и в исследовательской работе в этой области.
В 1868 г. Менделеев стал одним из организаторов Русского химического общества.
В конце 1870-х гг. Дмитрий Менделеев страстно влюбился в Анну Ивановну Попову, дочь донского казака из Урюпинска. Во втором браке у Д. И. Менделеева родилось четверо детей. Д.И. Менделеев был тестем русского поэта Александра Блока, женатого на его дочери Любови.
И. Менделеева родилось четверо детей. Д.И. Менделеев был тестем русского поэта Александра Блока, женатого на его дочери Любови.
С 1876 г. Дмитрий Менделеев – член-корреспондент Петербургской АН, в 1880 г. выдвигался в академики, но был забаллотирован, что вызвало резкий общественный протест.
В 1890 г. Менделеев будучи профессором Петербургского университета, ушел в отставку в знак протеста против притеснения студенчества. Почти насильно оторванный от науки, Дмитрий Менделеев посвящает все свои силы практическим задачам.
При его участии, в 1890 г. создается проект нового таможенного тарифа, в котором последовательно проводится покровительственная система, а в 1891 г. выходит в свет замечательная книга: «Толковый тариф», представляющая комментарий к этому проекту и вместе с тем глубоко продуманный обзор промышленности, с указанием на ее нужды и будущие перспективы. В 1891 году Морское и военное министерство поручают Менделееву разработку вопроса о бездымном порохе, и он (после заграничной командировки) в 1892 г. блестящим образом выполняет эту задачу. Предложенный им «пироколлодий» оказался превосходным типом бездымного пороха, притом универсальным и легко приспособляемым ко всякому огнестрельному оружию.
блестящим образом выполняет эту задачу. Предложенный им «пироколлодий» оказался превосходным типом бездымного пороха, притом универсальным и легко приспособляемым ко всякому огнестрельному оружию.
С 1891 г. Менделеев принимает деятельное участие в «Энциклопедическом словаре» Брокгауза-Ефрона, в качестве редактора химико-технического и фабрично-заводского отдела и автора многих статей служащих украшением этого издания. В 1900-1902 гг. Дмитрий Менделеев редактирует «Библиотеку промышленности» (изд. Брокгауза-Ефрона), где ему принадлежит выпуск «Учение о промышленности». С 1904 г. стали выходить «Заветные мысли» – историко-философский и социально-экономический трактат Менделеева, в котором содержится как бы его завещание потомству, итоги пережитого и передуманного по различным вопросам, касающимся экономической, государственной и общественной жизни России.
Дмитрий Иванович Менделеев умер 20 января 1907 г. от воспаления легких. Его похороны, принятые на счет государства, были настоящим национальным трауром. Отделение химии Русского Физико-Химического Общества учредило в честь Менделеева две премии за лучшие работы по химии. Библиотека Менделеева, вместе с обстановкой его кабинета, приобретена Петроградским университетом и хранится в особом помещении, когда-то составлявшем часть его квартиры.
Отделение химии Русского Физико-Химического Общества учредило в честь Менделеева две премии за лучшие работы по химии. Библиотека Менделеева, вместе с обстановкой его кабинета, приобретена Петроградским университетом и хранится в особом помещении, когда-то составлявшем часть его квартиры.
описание, возникновение и развитие. Краткий очерк истории развития химии
Зарождение науки о веществах можно отнести к эпохе античности. Древние греки знали семь металлов и еще несколько сплавов. Золото, серебро, медь, олово, свинец, железо и ртуть – вот вещества, которые были известны в то время. История химии началась с практических знаний. Их теоретическое осмысление было впервые предпринято различными учеными и философами – Аристотелем, Платоном и Эмпедоклом. Первый из них считал, что каждое из этих веществ может преобразовываться в другое. Он объяснял это существованием первоматерии, которая послужила началом всех начал.
Античная философия
Также распространенным было мнение о том, что в основе каждого вещества в мире лежит сочетание четырех стихий – воды, огня, земли и воздуха. Именно эти силы природы отвечают за трансмутацию металлов. Одновременно с этим в V в. до н. э. появилась теория атомизма, основоположниками которой были Левкипп и его ученик Демокрит. Это учение утверждало, что все предметы состоят из мельчайших частиц. Их назвали атомами. И хотя данная теория не нашла научного подтверждения в античности, именно это учение стало подспорьем современной химии в новейшее время.
Именно эти силы природы отвечают за трансмутацию металлов. Одновременно с этим в V в. до н. э. появилась теория атомизма, основоположниками которой были Левкипп и его ученик Демокрит. Это учение утверждало, что все предметы состоят из мельчайших частиц. Их назвали атомами. И хотя данная теория не нашла научного подтверждения в античности, именно это учение стало подспорьем современной химии в новейшее время.
Египетская алхимия
Примерно во II веке до н. э. новым центром науки стала египетская Александрия. Там же возникла алхимия. Эта дисциплина зародилась как синтез теоретических идей Платона и практических знаний эллинов. История химии этого периода характеризуется повышенным интересом к металлам. Для них было придумано классическое обозначение в виде известных тогда планет и небесных тел. Например, серебро изображалось в виде Луны, а железо – в виде Марса. Так как наука в то время была неотделима от религии, то и у алхимии, как у любой другой научной дисциплины, был свой бог-покровитель (Тот).
Одним из самых значимых исследователей того времени являлся Болос из Мендеса, который написал трактат «Физика и мистика». В нем он описал металлы и драгоценные камни (их свойства и ценность). Другой алхимик Зосим Панополит в своих работах исследовал искусственные способы получения золота. Вообще история возникновения химии началась с поиска этого благородного металла. Алхимики пытались получить золото с помощью экспериментов или магии.
Египетские алхимики изучали не только сами металлы, но и руды, из которых те добывались. Так была открыта амальгама. Это вид сплава металлов с ртутью, который занял особенное место в мировоззрении алхимиков. Некоторые считали его первичным веществом. К этому же периоду можно отнести открытие способа очистки золота с помощью свинца и селитры.
Арабские открытия
Если в эллинистических странах история химии началась, то продолжилась она несколько веков спустя во время арабского золотого века, когда ученые молодой исламской религии были в авангарде человеческой науки. Эти исследователи открыли множество новых веществ, например сурьму или фосфор. Большая часть уникальных знаний применялась в медицине и фармации для разработки лекарств и снадобий. Очерк истории развития химии без упоминания о философском камне – мифической субстанции, позволяющей превращать любое вещество в золото, невозможен.
Эти исследователи открыли множество новых веществ, например сурьму или фосфор. Большая часть уникальных знаний применялась в медицине и фармации для разработки лекарств и снадобий. Очерк истории развития химии без упоминания о философском камне – мифической субстанции, позволяющей превращать любое вещество в золото, невозможен.
Около 815 года арабский алхимик Джабир ибн Хайян сформулировал ртутно-серную теорию. Она по-новому объясняла происхождение металлов. Эти принципы стали основополагающими для алхимии не только арабской, но и европейской школы.
Европейские алхимики Средневековья
Благодаря Крестовым походам и большему соприкосновению Запада и Востока христианские ученые наконец узнали об открытиях мусульман. С XIII века именно европейцы заняли уверенную лидерскую позицию в исследованиях веществ. История химии Средневековья многим обязана Роджеру Бэкону, Альберту Великому, Раймунду Луллию и т. д.
В отличие от арабской науки европейские исследования были пропитаны духом христианской мифологии и религии. Основными центрами изучения веществ стали монастыри. Одним из первых серьезных достижений монахов стало открытие нашатыря. Его получил знаменитый теолог Бонавентура. Открытия алхимиков мало затрагивали общество до тех пор, пока не Роджер Бэкон не описал порох в 1249 году. Со временем это вещество произвело революцию на полях сражений и в амуниции армий.
Основными центрами изучения веществ стали монастыри. Одним из первых серьезных достижений монахов стало открытие нашатыря. Его получил знаменитый теолог Бонавентура. Открытия алхимиков мало затрагивали общество до тех пор, пока не Роджер Бэкон не описал порох в 1249 году. Со временем это вещество произвело революцию на полях сражений и в амуниции армий.
В XVI веке алхимия получила толчок в качестве медицинской дисциплины. Больше всего известны труды Паральцеса, который открыл множество лекарств.
Новое время
Реформация и наступление Нового времени не могло не затронуть и химию. Она все больше избавлялась от религиозных оттенков, становясь эмпирической и экспериментальной наукой. Пионером этого направления стал Роберт Бойль, который поставил перед химией конкретную цель – найти как можно больше химических элементов, а также изучить их состав и свойства.
В 1777 году Антуан Лавуазье сформулировал кислородную теорию горения. Она стала фундаментом для создания новой научной номенклатуры. История химии, кратко описанная в его учебнике «Элементарный курс химии», сделала рывок. Лавуазье составил новую таблицу простейших элементов, основываясь на законе сохранения массы. Изменились представления и понятия о природе веществ. Теперь химия стала самостоятельной рациональной наукой, основывающейся только на экспериментах и реальных доказательствах.
История химии, кратко описанная в его учебнике «Элементарный курс химии», сделала рывок. Лавуазье составил новую таблицу простейших элементов, основываясь на законе сохранения массы. Изменились представления и понятия о природе веществ. Теперь химия стала самостоятельной рациональной наукой, основывающейся только на экспериментах и реальных доказательствах.
XIX век
В начале XIX века Джон Дальтон сформулировал атомную теорию строения веществ. По сути, он повторил и углубил учение античного философа Демокрита. В обиходе появился такой термин, как атомная масса.
С открытием новых законов получила новый импульс история развития химии. Кратко говоря, на рубеже XVIII и XIX вв. появились математические и физические теории, которые легко и логично объясняли многообразие веществ на планете. Открытие Дальтона было подтверждено, когда шведский ученый Йенс Якоб Берцелиус связал атомы с полярностью электричества. Также он ввел в обиход привычные сегодня обозначения веществ в виде латинских литер.
Атомная масса
В 1860 году химики всего мира на конгрессе в Крлсруэ признали основополагающей атомно-молекулярную теорию, которую предложил Станислао Канниццаро. С ее помощью была вычислена относительная масса кислорода. Так история химии (кратко ее описать очень сложно) за несколько десятков лет прошла огромный путь.
Относительная атомная масса позволила систематизировать все элементы. В XIX веке было предложено множество вариантов того, как это сделать наиболее удобно и практично. Но лучше всего это удалось русскому ученому Дмитрию Менделееву. Его периодическая система элементов, предложенная в 1869 году, стала фундаментом для современной химии.
Современная химия
Через несколько десятков лет был открыт электрон и явление радиоактивности. Это подтвердило давние предположения о делимости атома. Кроме того, данные открытия дали толчок к развитию пограничной дисциплины между химией и физикой. Появились макеты строения атома.
Краткий очерк истории развития химии не может обойтись без упоминания о квантовой механике. Эта дисциплина повлияла на представления о связях внутри вещества. Появились новые методы анализа научных знаний и теорий. Это были различные вариации спектроскопии и использование рентгена.
Эта дисциплина повлияла на представления о связях внутри вещества. Появились новые методы анализа научных знаний и теорий. Это были различные вариации спектроскопии и использование рентгена.
В последние годы история развития химии, кратко описанная выше, ознаменовалась большими результатами в связке с биологией и медициной. Новые вещества активно используются в современных лекарствах и т. д. Была исследована структура белков, ДНК и других важных элементов внутри живых организмов. Краткий очерк истории развития химии можно закончить открытием все новых веществ в таблице Менделеева, которые получают экспериментальным путем.
ХИМИЯ ОРГАНИЧЕСКАЯ | Энциклопедия Кругосвет
Содержание статьи- Классификация органических соединений.
- Реакции органической химии.
- Методы исследования в органической химии.
ХИМИЯ ОРГАНИЧЕСКАЯ – раздел химической науки, изучающий углеводороды – вещества, содержащие углерод и водород, а также различные производные этих соединений, включающие атомы кислорода, азота и галогенов. Все такие соединения называют органическими.
Все такие соединения называют органическими.
Органическая химия возникла в процессе изучения тех веществ, которые добывались из растительных и животных организмов, состоящих в основной своей массе из органических соединений. Именно это определило чисто историческое название таких соединений (организм – органический). Некоторые технологии органической химии возникли еще в глубокой древности, например, спиртовое и уксуснокислое брожение, использование органических красителей индиго и ализарина, процессы дубления кожи и др. В течение долгого времени химики умели лишь выделять и анализировать органические соединения, но не могли получать их искусственно, в результате чего возникло убеждение, что органические соединения могут быть получены только с помощью живых организмов.
Начиная со второй половины 19 в. методы органического синтеза стали интенсивно развиваться, что позволило постепенно преодолеть устоявшееся заблуждение. Впервые синтез органических соединений в лаборатории удалось осуществить Фридриху Велеру (в период 1824–1828), при гидролизе дициана он получил щавелевую кислоту, выделяемую до этого из растений, а при нагревании циановокислого аммония за счет перестройки молекулы (см. ИЗОМЕРИЯ) получил мочевину – продукт жизнедеятельности живых организмов (рис. 1. Первые синтезы органических соединений).
ИЗОМЕРИЯ) получил мочевину – продукт жизнедеятельности живых организмов (рис. 1. Первые синтезы органических соединений).
Сейчас многие из соединений, присутствующих в живых организмах, можно получить в лаборатории, кроме того, химики постоянно получают органические соединения, не встречающиеся в живой природе.
Становление органической химии как самостоятельной науки произошло в середине 19 в., когда благодаря усилиям ученых-химиков, стали формироваться представления о строении органических соединений. Наиболее заметную роль сыграли работы Э.Франкланда (определил понятие валентности), Ф.Кекуле (установил четырехвалентность углерода и строение бензола), А. Купера (предложил используемый и поныне символ валентной черты, соединяющей атомы при изображении структурных формул), А.М.Бутлерова (создал теорию химического строения, в основе которой лежит положение, согласно которому свойства соединения определяются не только его составом, но и тем, в каком порядке соединены атомы).
Следующий важный этап в развитии органической химии связан с работами Я.Вант-Гоффа, который изменил сам способ мышления химиков, предложив перейти от плоского изображения структурных формул к пространственному расположению атомов в молекуле, в итоге химики стали рассматривать молекулы как объемные тела.
Представления о природе химической связи в органических соединениях впервые сформулировал Г.Льюис, предположивший, что атомы в молекуле связаны с помощью электронов: пара обобщенных электронов создает простую связь, а две или три пары образуют, соответственно, двойную и тройную связь. Рассматривая распределение электронной плотности в молекулах (например, ее смещение под влиянием электроотрицательных атомов O, Cl и др.) химики смогли объяснить реакционную способность многих соединений, т.е. возможность их участия в тех или иных реакциях.
Учет свойств электрона, определяемых квантовой механикой, привел к развитию квантовой химии, использующей представления о молекулярных орбиталях. Сейчас квантовая химия, показавшая на многих примерах свою предсказательную силу, успешно сотрудничает с экспериментальной органической химией.
Сейчас квантовая химия, показавшая на многих примерах свою предсказательную силу, успешно сотрудничает с экспериментальной органической химией.
Небольшую группу соединений углерода не относят к органическим: угольная кислота и ее соли (карбонаты), цианистоводородная кислота HCN и ее соли (цианиды), карбиды металлов и некоторые другие соединения углерода, которые изучает неорганическая химия.
Главная особенность органической химии – исключительное разнообразие соединений, которое возникло из-за способности атомов углерода соединяться друг с другом в практически неограниченном количестве, образуя молекулы в виде цепочек и циклов. Еще большее разнообразие достигается за счет включения между атомами углерода атомов кислорода, азота и др. Явление изомерии, благодаря которому молекулы, обладающие одинаковым составом, могут иметь различное строение, дополнительно увеличивает многообразие органических соединений. Сейчас известно свыше 10 млн. органических соединений, причем их количество ежегодно увеличивается на 200–300 тысяч.
Классификация органических соединений.
В качестве основы при классификации приняты углеводороды, их считают базовыми соединениями в органической химии. Все остальные органические соединения рассматривают как их производные.
При систематизации углеводородов принимают во внимание строение углеродного скелета и тип связей, соединяющих атомы углерода.
I. АЛИФАТИЧЕСКИЕ (aleiphatos. греч. масло) углеводороды представляют собой линейные или разветвленные цепочки и не содержат циклических фрагментов, они образуют две крупные группы.
1. Предельные или насыщенные углеводороды (названы так потому, что не способны что-либо присоединять) представляют собой цепочки атомов углерода, соединенных простыми связями и окруженных атомами водорода (рис. 1). В том случае, когда цепочка имеет разветвления, к названию добавляют приставку изо. Простейший насыщенный углеводород – метан, с него начинается ряд этих соединений.
Рис. 2. НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
Основные источники насыщенных углеводородов – нефть и природный газ. Реакционная способность насыщенных углеводородов очень низкая, они могут реагировать только с наиболее агрессивными веществами, например, с галогенами или с азотной кислотой. При нагревании насыщенных углеводородов выше 450 С° без доступа воздуха разрываются связи С-С и образуются соединения с укороченной углеродной цепью. Высокотемпературное воздействие в присутствии кислорода приводит к их полному сгоранию до СО2 и воды, что позволяет эффективно использовать их в качестве газообразного (метан – пропан) или жидкого моторного топлива (октан).
Реакционная способность насыщенных углеводородов очень низкая, они могут реагировать только с наиболее агрессивными веществами, например, с галогенами или с азотной кислотой. При нагревании насыщенных углеводородов выше 450 С° без доступа воздуха разрываются связи С-С и образуются соединения с укороченной углеродной цепью. Высокотемпературное воздействие в присутствии кислорода приводит к их полному сгоранию до СО2 и воды, что позволяет эффективно использовать их в качестве газообразного (метан – пропан) или жидкого моторного топлива (октан).
При замещении одного или нескольких атомов водорода какой-либо функциональной (т.е. способной к последующим превращениям) группой образуются соответствующие производные углеводородов. Соединения, содержащие группировку С-ОН, называют спиртами, НС=О – альдегидами, СООН – карбоновыми кислотами (слово «карбоновая» добавляют для того, чтобы отличить их от обычных минеральных кислот, например, соляной или серной). Соединение может содержать одновременно различные функциональные группы, например, СООН и NH2, такие соединения называют аминокислотами. Введение в состав углеводорода галогенов или нитрогрупп приводит соответственно к галоген- или нитропроизводным (рис. 3).
Введение в состав углеводорода галогенов или нитрогрупп приводит соответственно к галоген- или нитропроизводным (рис. 3).
Рис. 4. ПРИМЕРЫ НАСЫЩЕННЫХ УГЛЕВОДОРОДОВ с функциональными группами
Все показанные производные углеводородов образуют крупные группы органических соединений: спирты, альдегиды, кислоты, галогенпроизводные и т.д. Поскольку углеводородная часть молекулы имеет очень низкую реакционную способность, химическое поведение таких соединений определяется химическими свойствами функциональных групп –ОН, -СООН, -Cl, -NO2 и др..
2. Ненасыщенные углеводороды имеют те же варианты строения основной цепи, что и насыщенные, но содержат двойные или тройные связи между атомами углерода (рис. 6). Простейший ненасыщенный углеводород – этилен.
Рис. 6. НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
Наиболее характерно для ненасыщенных углеводородов присоединение по кратной связи (рис. 8), что позволяет синтезировать на их основе разнообразные органические соединения.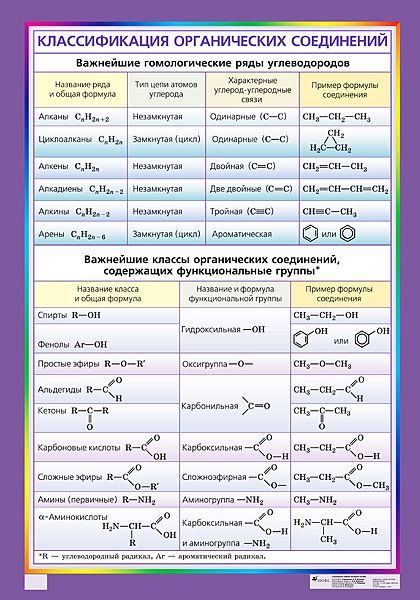
Рис. 8. ПРИСОЕДИНЕНИЕ РЕАГЕНТОВ к ненасыщенным соединениям по кратной связи
Другое важное свойство соединений с двойными связями – их способность полимеризоваться (рис. 9.), двойные связи при этом раскрываются, в результате образуются длинные углеводородные цепи.
Рис. 9. ПОЛИМЕРИЗАЦИЯ ЭТИЛЕНА
Введение в состав ненасыщенных углеводородов упомянутых ранее функциональных групп так же, как и в случае насыщенных углеводородов, приводит к соответствующим производным, которые также образуют крупные группы соответствующих органических соединений – ненасыщенные спирты, альдегиды и т.д. (рис. 10).
Рис. 10. НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ с функциональными группами
Для показанных соединений приведены упрощенные названия, точное положение в молекуле кратных связей и функциональных групп указывают в названии соединения, которое составляют по специально разработанным правилам.
Химическое поведение таких соединений определяется как свойствами кратных связей, так и свойствами функциональных групп.
II. КАРБОЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ содержат циклические фрагменты, образованные только атомами углерода. Они образуют две крупные группы.
1. Алициклические (т.е. и алифатические и циклические одновременно) углеводороды. В этих соединениях циклические фрагменты могут содержать как простые, так и кратные связи, кроме того, соединения могут содержать несколько циклических фрагментов, к названию этих соединений добавляют приставку «цикло», простейшее алициклическое соединение – циклопропан (рис. 12).
Рис. 12. АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ
Помимо показанных выше существуют иные варианты соединения циклических фрагментов, например, они могут иметь один общий атом, (так называемые, спироциклические соединения), либо соединяться таким образом, чтобы два или более атомов были общими для обоих циклов (бициклические соединения), при объединении трех и более циклов возможно также образование углеводородных каркасов (рис. 14).
Рис. 14. ВАРИАНТЫ СОЕДИНЕНИЯ ЦИКЛОВ в алициклических соединениях: спироциклы, бициклы и каркасы. В названии спиро- и бициклических соединений указывают тот алифатический углеводород, который содержит такое же общее число атомов углерода, например, в показанном на рисунке спироцикле содержится восемь атомов углерода, поэтому его название построено на основе слова «октан». В адамантане атомы расположены так же, как в кристаллической решетке алмаза, что определило его название (греч. adamantos – алмаз)
В названии спиро- и бициклических соединений указывают тот алифатический углеводород, который содержит такое же общее число атомов углерода, например, в показанном на рисунке спироцикле содержится восемь атомов углерода, поэтому его название построено на основе слова «октан». В адамантане атомы расположены так же, как в кристаллической решетке алмаза, что определило его название (греч. adamantos – алмаз)
Многие моно- и бициклические алициклические углеводороды, а также производные адамантана входят в состав нефти, их обобщенное название – нафтены.
По химическим свойствам алициклические углеводороды близки соответствующим алифатическим соединениям, однако, у них появляется дополнительное свойство, связанное с их циклическим строением: небольшие циклы (3–6-членные) способны раскрываться, присоединяя некоторые реагенты (рис. 15).
Рис. 15. РЕАКЦИИ АЛИЦИКЛИЧЕСКИХ УГЛЕВОДОРОДОВ, протекающие с раскрытием цикла
Введение в состав алициклических углеводородов различных функциональных групп приводит к соответствующим производным – спиртам, кетонам и т. п. (рис. 16).
п. (рис. 16).
Рис. 16. АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ с функциональными группами
2. Вторую крупную группу карбоциклических соединений образуют ароматические углеводороды бензольного типа, т.е содержащие в своем составе один или несколько бензольных циклов (существуют также ароматические соединения небензольного типа (см. АРОМАТИЧНОСТЬ). При этом они могут также содержать фрагменты насыщенных или ненасыщенных углеводородных цепей (рис. 18).
Рис. 18. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ.
Существуют группа соединений, в которых бензольные кольца как бы спаяны между собой, это так называемые конденсированные ароматические соединения (Рис. 20).
Рис. 20. КОНДЕНСИРОВАННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
Многие ароматические соединения, в том числе и конденсированные (нафталин и его производные) входят в состав нефти, второй источник этих соединений – каменноугольная смола.
Для бензольных циклов не характерны реакции присоединения, которые проходят с большим трудом и в жестких условиях, наиболее типичны для них реакции замещения атомов водорода (рис. 21).
21).
Рис. 21. РЕАКЦИИ ЗАМЕЩЕНИЯ атомов водорода в ароматическом ядре.
Помимо функциональных групп (галогена, нитро- и ацетильной группы), присоединенных к бензольному ядру (рис. 21), можно также ввести иные группы, в результате получаются соответствующе производные ароматических соединений (рис. 22), образующие крупные классы органических соединений – фенолы, ароматические амины и др.
Рис. 22. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ с функциональными группами. Соединения, в которых neгруппа -ОН соединена с атомом углерода в ароматическом ядре, называют фенолами, в отличие от алифатических соединений, где такие соединения называют спиртами.
III. ГЕТЕРОЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ содержат в составе цикла (помимо атомов углерода) различные гетероатомы: O, N, S. Циклы могут быть различного размера, содержать как простые, так и кратные связи, а также присоединенные к гетероциклу углеводородные заместители. Существуют варианты, когда гетероцикл «спаян» с бензольным ядром (рис.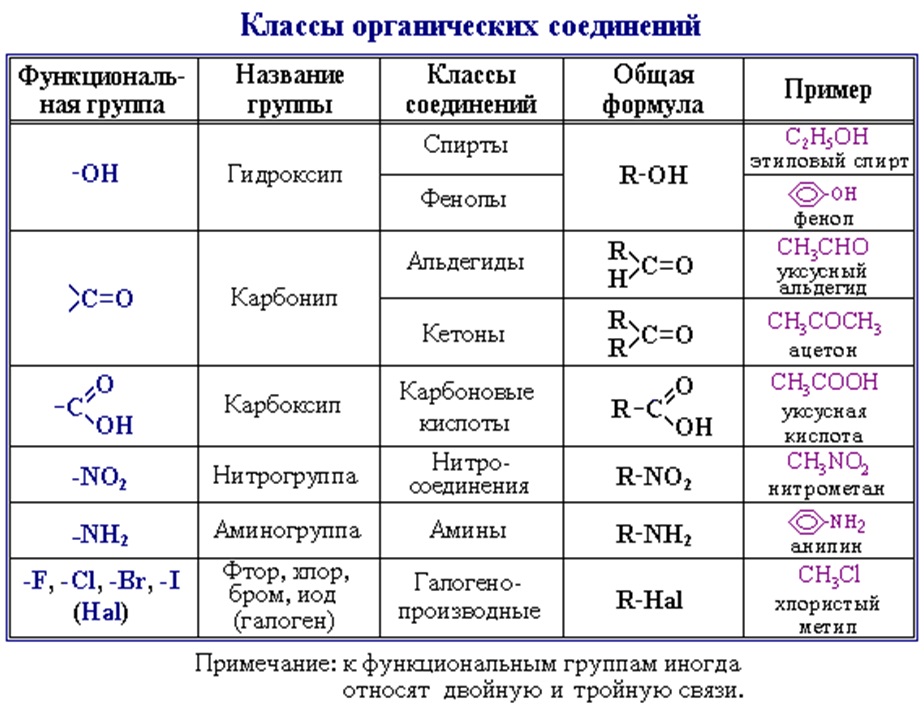 24).
24).
Рис. 24. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. Их названия сложились исторически, например, фуран получил название от фуранового альдегида – фурфурола, получаемого из отрубей (лат. furfur – отруби). Для всех показанных соединений реакции присоединения затруднены, а реакции замещения проходят достаточно легко. Таким образом, это ароматические соединения небензольного типа.
Разнообразие соединений этого класса увеличивается дополнительно за счет того, что гетероцикл может содержать два и более гетероатомов в цикле (рис. 26).
Рис. 26. ГЕТЕРОЦИКЛЫ с двумя и более гетероатомами.
Точно так же, как и рассмотренные ранее алифатические, алициклические и ароматические углеводороды, гетероциклы могут содержать в своем составе различные функциональные группы (-ОН, -СООН, -NH2 и др.), причем гетероатом в цикле в некоторых случаях также можно рассматривать как функциональную группу, поскольку он способен принимать участие в соответствующих превращениях (рис. 27).
27).
Рис. 27. ГЕТЕРОАТОМ N в роли функциональной группы. В названии последнего соединения буква «N» указывает, к какому атому присоединена метильная группа.
Реакции органической химии.
В отличие от реакций неорганической химии, где с высокой скоростью (иногда мгновенно) взаимодействуют ионы, в реакциях органических соединений обычно участвуют молекулы, содержащие ковалентные связи. В результате все взаимодействия протекают гораздо медленнее, чем в случае ионных соединений (иногда десятки часов), часто при повышенной температуре и в присутствии ускоряющих процесс веществ – катализаторов. Многие реакции протекают через промежуточные стадии или в нескольких параллельных направлениях, что приводит к заметному снижению выхода нужного соединения. Поэтому при описании реакций вместо уравнений с числовыми коэффициентами (что традиционно принято в неорганической химии) часто используют схемы реакций без указания стехиометрических соотношений.
Название крупных классов органических реакций часто связывают с химической природой действующего реагента или с типом вводимой в соединение органической группы:
а) галогенирование – введение атома галогена (рис. 8, первая схема реакции),
8, первая схема реакции),
б) гидрохлорирование, т.е. воздействие HCl (рис. 8, вторая схема реакции)
в) нитрование – введение нитрогруппы NO2 (рис. 21, второе направление реакции)
г) металлирование – введение атома металла (рис. 27, первая стадия)
а) алкилирование – введение алкильной группы (рис. 27, вторая стадия)
б) ацилирование – введение ацильной группы RC(O)- (рис. 27, вторая стадия)
Иногда название реакции указывает на особенности перестройки молекулы, например, циклизация – образование цикла, дециклизация – раскрытие цикла (рис.15).
Крупный класс образуют реакции конденсации (лат. condensatio – уплотнение, сгущение), при которых происходит формирование новых связей С-С с одновременным образованием легко удаляемых неорганических или органических соединений. Конденсацию, сопровождаемую выделением воды, называют дегидратацией. Конденсационные процессы могут также проходить внутримолекулярно, то есть, в пределах одной молекулы (рис. 28).
28).
Рис. 28. РЕАКЦИИ КОНДЕНСАЦИИ
В конденсации бензола (рис. 28) роль функциональных групп выполняют фрагменты С-Н.
Классификация органических реакций не имеет строгого характера, например, показанную на рис. 28 внутримолекулярную конденсацию малеиновой кислоты можно также отнести к реакциям циклизации, а конденсацию бензола – к дегидрированию.
Существуют внутримолекулярные реакции, несколько отличающиеся от конденсационных процессов, когда фрагмент (молекула) отщепляется в виде легко удаляемого соединения без очевидного участия функциональных групп. Такие реакции называют элиминированием (лат. eliminare – изгонять), при этом образуются новые связи (рис. 29).
Рис. 29. РЕАКЦИИ ЭЛИМИНИРОВАНИЯ
Возможны варианты, когда совместно реализуются несколько типов превращений, что показано далее на примере соединения, в котором при нагревании протекают разнотипные процессы. При термической конденсации слизевой кислоты (рис. 30) проходит внутримолекулярная дегидратация и последующее элиминирование СО2.
Рис. 30. ПРЕВРАЩЕНИЕ СЛИЗЕВОЙ КИСЛОТЫ (получаемой из желудевого сиропа) в пирослизевую кислоту, названную так потому, что получают ее нагреванием слизевой. Пирослизевая кислота представляет собой гетероциклическое соединение – фуран с присоединенной функциональной (карбоксильной) группой. В процессе реакции разрываются связи С-О, С-Н и образуются новые связи С-Н и С-С.
Существуют реакции, при которых происходит перестраивание молекулы без изменения состава (см. ИЗОМЕРИЗАЦИЯ).
Методы исследования в органической химии.
Современная органическая химия помимо элементного анализа использует многие физические методы исследования. Сложнейшие смеси веществ разделяют на составляющие компоненты с помощью хроматографии, основанной на перемещении растворов или паров веществ через слой сорбента. Инфракрасная спектроскопия – пропускание инфракрасных (тепловых) лучей через раствор или сквозь тонкий слой вещества – позволяет установить наличие в веществе определенных фрагментов молекулы, например, групп С6Н5, С=О, NH2 и др.
Ультрафиолетовая спектроскопия, называемая также электронной, несет информацию об электронном состоянии молекулы, она чувствительна к присутствию в веществе кратных связей и ароматических фрагментов. Анализ кристаллических веществ с помощью лучей рентгеновского диапазона (рентгеноструктурный анализ) дает объемную картину расположения атомов в молекуле, подобную тем, что показаны на приведенных выше анимированных рисунках, иными словами, позволяет как бы увидеть строение молекулы своими глазами.
Спектральный метод – ядерный магнитный резонанс, основанный на резонансном взаимодействии магнитных моментов ядер с внешним магнитным полем, дает возможность различить атомы одного элемента, например, водорода, расположенные в различных фрагментах молекулы (в углеводородном скелете, в гидроксильной, карбоксильной или аминогруппе), а также определить их количественное соотношение. Подобный анализ возможен также для ядер С, N, F и др. Все эти современные физические методы привели к интенсивным исследованиям в органической химии – стало возможным быстро решать те задачи, на которые ранее уходили долгие годы.
Некоторые разделы органической химии выделились в крупные самостоятельные области, например, химия природных веществ, лекарственных препаратов, красителей, химия полимеров. В середине 20 в. химия элементоорганических соединений стала развиваться как самостоятельная дисциплина, которая изучает вещества, содержащие связь С-Э, где символ Э обозначает любой элемент(кроме углерода, водорода, кислорода, азота и галогенов). Велики успехи биохимии, изучающей синтез и превращения органических веществ, происходящие в живых организмах. Развитие всех этих областей основано на общих законах органической химии.
Современный промышленный органический синтез включат в себя широкий набор различных процессов – это, прежде всего, крупнотоннажные производства – переработка нефти, газа и получение моторных топлив, растворителей, теплоносителей, смазочных масел, кроме того, синтез полимеров, синтетических волокон, разнообразных смол для покрытий, клеев и эмалей. К малотоннажным производствам относят получение лекарственных препаратов, витаминов, красителей, пищевых добавок и душистых веществ.
Михаил Левицкий
Как химия появилась в жизни человека
Сначала человек научился жарить мясо, чуть позже начал запивать его алкоголем (сперва — пивом, затем напитками покрепче), параллельно придумал духи, позолоту — и, не удовлетворяясь одними только практическими навыками, стремился проникнуть в суть вещей и веществ. Примерно так зародилась химия — и немалую роль в ее развитии сыграли женщины. T&P публикуют главу из книги научного журналиста, номинанта премии «Просветитель» Аркадия Курамшина — о месопотамской экспериментаторше Таппути Белатекалим, представителе александрийской алхимической школы Зосиме Панополитанском и Марии-Пророчице, стоявшей у истоков производства бренди.
Первые реакции и парфюмерия
Если под началом химии мы имеем в виду первые химические процессы, то они стартовали где-то через 400 тысяч лет после начала Большого Горячего взрыва, когда условия молодой Вселенной позволили существовать атомам водорода (до этого процессы связывания электронов протонами и процессы ионизации находились в равновесии, и стабильные атомы не могли существовать).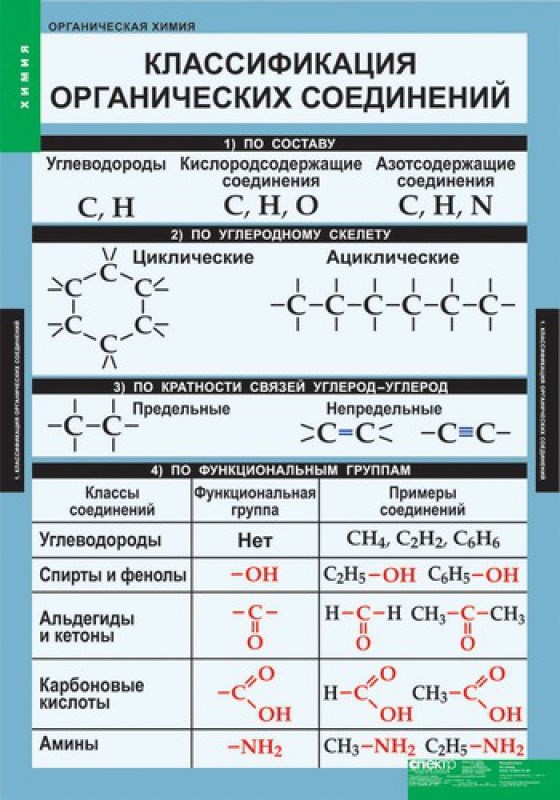 Атомы водорода стали вступать в процессы образования химических связей, образуя двухатомные молекулы Н2 и трехатомные ионы Н3+, запустились химические процессы, и, можно сказать, химия началась.
Атомы водорода стали вступать в процессы образования химических связей, образуя двухатомные молекулы Н2 и трехатомные ионы Н3+, запустились химические процессы, и, можно сказать, химия началась.
Если мы захотим узнать, когда впервые химия появилась в жизни человека, то на этот вопрос относительно легко дать ответ: тогда, когда человек подружился с огнем. Дружба эта началась с того, что наши далекие предки поняли: питаться пищей, приготовленной на огне, лучше, чем сырой. Для этого они стали заниматься самыми первыми химическими процессами — сперва готовкой пищи на «диких кострах», затем переносом огня в свое жилище и поддерживанием пламени в очаге, ну, а потом — искусством разведения огня. Возможно, что и в те времена были те, кто утверждал, что огонь изгоняет из туши мамонта добрых духов, делая жареную мамонтятину не такой полезной, как сырая, равно как и те, кто говорил о том, что батат, запеченный в углях «органического» лесного пожара вкуснее, чем такой же батат, запеченный в углях костра, зажженного собственноручно человеком, но тогда их судьба была очень печальна, так как во время палеолита фраза «Не нравится — не ешь!» была равнозначна фразе «Умри от голода!».
Роясь в источниках и хрониках, мы можем даже найти кандидата на роль «первого в мире химика», имя которого сохранила история. Кстати, правильнее было бы сказать «имя которой». На месопотамской клинописной табличке, датируемой тринадцатым веком до нашей эры, упоминается некая Таппути Белатекалим, последнее слово — не фамилия и не имя рода, а должность — блюстительница женской половины царского дворца. В свободное от управления женской половиной дворца Таппути занималась химическими экспериментами в области парфюмерии.
Судя по табличке, Таппути, нагревая, выделяла пахнущие экстракты цветов, смешивала разные эссенции, разбавляла полученные смеси водой в различных соотношениях, упорно и многократно повторяя все эти действия, пока результат не начинал ее удовлетворять. Возможно, что рассказывающая про Таппути глиняная табличка является еще и первым документированным описанием того химического процесса, который мы сейчас называем «перегонка» — выделение экстрактов, для которого требуется первоначальное нагревание и последующее охлаждение паров.
Гермест-Трисмегист. Начало XVII века
Изобретатель слова
Сложнее всего, как это ни странно, выяснить, кто первым придумал термин «химия», обозначая им уже привычную нам науку. Это обидно, особенно если вспомнить, что авторские права на термин «физика» принадлежат Аристотелю (хотя, конечно, наставник Александра Македонского и философ называл «физикой» далеко не то, что мы привыкли считать физикой сейчас), термин «биология» ввел Жан-Батист шевалье де Ламарк.
Довольно часто можно встретить мысль о том, что слово «химия» — редукция слова «алхимия», попавшего в европейские языки из арабского ءايميخ (’al-kīmiyā’). В какой-то степени это верно — европейская алхимия расцвела буйным цветом на почве, подготовленной персидскими и арабскими алхимиками. Однако развитию ближневосточной алхимии предшествовало появление того, что мы называем «александрийской алхимией», которую, наверное, правильнее было бы назвать «ромейской химией»: первые попытки заниматься химией как наукой, а не как ритуалом, предпринимались не только в «научной столице» Византии — Александрии, но и других ее городах […]. Таким образом, становление химии как науки, а не ритуализированного ремесла начинается на землях Византии, а первыми химиками, о которых имеется хоть какое-то упоминание в источниках того времени, можно считать представителей Александрийской алхимической (или ромейской химической) школы — Зосима Панополитанского и Марию-Пророчицу.
Таким образом, становление химии как науки, а не ритуализированного ремесла начинается на землях Византии, а первыми химиками, о которых имеется хоть какое-то упоминание в источниках того времени, можно считать представителей Александрийской алхимической (или ромейской химической) школы — Зосима Панополитанского и Марию-Пророчицу.
О жившем в более позднее время Зосиме Панополитанском известно больше. Этот философ родился в начале 4 века нашей эры в городе Панополис на территории Восточной римской империи […]. Зосим является автором самого первого руководства по практической химии, дошедшего до нас и в оригинале, и в переводах.
Написанный на греческом языке труд назывался «Хирокмета» (по-гречески — сделанное руками). «Хирокмета» Зосима и более поздние работы еще четырех десятков авторов, датируемые преимущественно V–VI веком нашей эры, в VII–VIII веке были объединены и растиражированы константинопольскими писцами в первую «коллективную монографию» по химии, повлиявшую на развитие алхимии (в VII–VIII — уже алхимии) и на Западе, и на Востоке. Сейчас фрагменты этой рукописи можно увидеть в музеях Парижа и Венеции. […]
Сейчас фрагменты этой рукописи можно увидеть в музеях Парижа и Венеции. […]
В дошедших до нас трудах Зосима описаны некоторые практические приемы: «фиксация» ртути (вероятно, изготовление ртутных амальгам), имитации золота и серебра. Именно в работах Зосима впервые в письменном виде формулируется идея о философском камне — гипотетическом веществе, способном превращать неблагородные металлы в совершенные — золото и серебро. Зосим описал ряд алхимических приборов, процесс образования ацетата свинца и указал на его сладкий вкус (хотя есть свидетельства, что ацетат свинца применялся в качестве консерванта и подсластителя еще тогда, когда Римская империя не распалась на восточную и западную).
Но самое главное — именно в рукописях, копиях рукописей и переводах рукописей Зосима впервые встречается слово «хема», наиболее вероятно и ставшее впоследствии знакомой всем нам «химией» (сам Зосим употребляет «хема» в понимании «священного тайного искусства»). Зосим считал, что искусство «хема» было передано людям падшими ангелами, которые после изгнания Адама и Евы из Рая сходились с «дщерями человеческими» и, в награду за любовь, раскрывали им приемы «тайного искусства» выплавки металлов, изготовления стекла и т. д.
д.
В другом тексте Зосим упоминает, что пишет «Хирокмету» как руководство для решения задач по «…определению состава вод, движению, росту, соединению и разъединению твердых тел, извлечению духов из твердых тел и заключению духов в твердые тела…», и хотя ни в сохранившихся рукописях на греческом, ни в переводах эти задачи и тайное знание «хема» не связываются между собой, вся дальнейшая логика развития алхимии как «тайного знания» позволяет специалистам по истории науки считать «хему» «химией», а Зосима Панополитанского — автором названия этой науки.
Мария-Пророчица. Начало XVII века
Мария-Пророчица
Из «Хирокметы» видно, что Зосим не считает себя первым носителем «тайного знания»: он многократно упоминает Гермеса Трисмегиста (Трижды величайшего) — божество мудрости, надолго ставшее мистическим покровителем алхимиков — и довольно часто цитирует труды персонажа не божественного, а человеческого происхождения — Марии-Пророчицы, которой тоже не было чуждо желание постичь тайные знания. Мария-Пророчица, Мария-еврейка или Мария-Мириам — сестра Моисея — упоминается и в других письменных источниках, что, в отличие от Гермеса Трижды величайшего, позволяет говорить о Марии, как о реально существовавшей исторической персоне.
Мария-Пророчица, Мария-еврейка или Мария-Мириам — сестра Моисея — упоминается и в других письменных источниках, что, в отличие от Гермеса Трижды величайшего, позволяет говорить о Марии, как о реально существовавшей исторической персоне.
Точные даты ее жизни неизвестны, наиболее вероятно, что она жила и работала на пару-тройку десятилетий ранее Зосима, возможно тоже на территории Египта, и, как и Зосим, была гречанкой или греко-египтянкой. Учитывая большую патриархатность иудейской культуры по сравнению с отношением к женщине в египетском или греческом обществе того времени, еврейское происхождение Марии маловероятно. Родственная связь Марии с ветхозаветным Моисеем абсолютно невероятна, но, как ни странно, именно эта деталь позволяет уверенно говорить о том, что Пророчица была реальным человеком: для искавших тайное знание в те времена и для алхимиков позже декларация родственных связей с библейскими персонажами или античными божествами было дело обычным — упоминание о наличии бога, полубога или пророка в родословной добавляло фигуре алхимика мистической значимости, подчеркивая, что тайное знание потому и называется тайным, что постичь его дано далеко не каждому.
В своем трактате Зосим приписывает Марии-Пророчице изобретение трех важных алхимических приборов, с некоторыми изменениями дошедших до наших времен. Первое изобретение — «balneum mariae» или «баня Марии» — представляло собой двойной контейнер с ножками, позволявшими поставить его на огонь костра или жаровни. Внешний контейнер заполняли водой, внутренний — материалом, который хотели нагреть, и, таким образом, тепло от источника нагрева (во времена Марии и Зосима таким источником могли быть только пламя или угли) нагревает воду, вода передает энергию нагреваемому материалу, который при этом не может нагреваться выше температуры кипения воды.
Принципиальная схема бани Марии надолго пережила память об изобретательнице, и в настоящее время в лабораторной практике повсеместно применяются нагревательные бани, задача которых та же, что и у бани Марии — не допускать перегрева вещества.
Конечно, костром в качестве источника тепла сейчас уже никто не пользуется, да и кроме воды в качестве теплоносителя применяются и другие вещества, но встретить фразу «…нагревали на водяной/силиконовой/металлической бане…» можно в описании методологии огромного количества химических экспериментов. Изобретение Марии-Пророчицы можно встретить не только в лаборатории, но и на кухне — опять же, чтобы избежать перегрева продукта, приготовление некоторых блюд и многие рецепты домашнего консервирования рекомендуют (а иногда и требуют) нагрева на водяной бане.
Изобретение Марии-Пророчицы можно встретить не только в лаборатории, но и на кухне — опять же, чтобы избежать перегрева продукта, приготовление некоторых блюд и многие рецепты домашнего консервирования рекомендуют (а иногда и требуют) нагрева на водяной бане.
Второе устройство, керотакис (греч. — κυροτακίς), было предназначено для нагрева веществ и для сбора паров. Оно представляло собой воздухонепроницаемый контейнер, верхняя часть которого была закрыта листом меди. При правильной подгонке деталей и при правильной работе все элементы керотакиса плотно прилегали друг к другу, не выпуская наружу пары нагреваемых в керотакисе веществ. Использование таких плотно запечатанных устройств в «ремесле Гермеса» в конечном итоге породило термин «герметично запечатанный». В 1879 году немецкий химик Франц фон Сокслет модифицировал устройство керотакиса, создав устройство для экстракции, которое сейчас мы знаем как «экстрактор Сокслета» или просто «Сокслет».
Третьим устройством, создание которого Зосим приписывает Марии, был трибикос (греч. — τριβικός) — своего рода перегонный аппарат с тремя отводами, который использовался для очистки жидких веществ с помощью перегонки. Зосим упоминал, что Мария и описывала наиболее оптимальный материал для отводов (медь или бронзу), и указывала на необходимость запечатывания сочленений между сосудом и отводами мучной пастой.
— τριβικός) — своего рода перегонный аппарат с тремя отводами, который использовался для очистки жидких веществ с помощью перегонки. Зосим упоминал, что Мария и описывала наиболее оптимальный материал для отводов (медь или бронзу), и указывала на необходимость запечатывания сочленений между сосудом и отводами мучной пастой.
Возможно, хотя прямых упоминаний об этом нет, а по рисункам алхимической посуды об этом судить сложно, отводы трибикоса располагались на различной высоте от слоя перегоняемой жидкости, что уже во времена ромейской химии позволяло проводить фракционную перегонку — через самый верхний отвод отгонялось самое легколетучее вещество, через нижний, самый близкий к источнику нагревания — то вещество, которое отличалось самой низкой летучестью. И баня Марии, и трибикос были существенным усовершенствованием (а может и изобретением) процесса разделения жидкостей с помощью перегонки-дистилляции, и послужили не только алхимикам и химикам для «…определения состава вод…», но и внесли свой вклад в разработку технологии крепких алкогольных напитков, известных сейчас под общим названием «бренди», получаемых в результате дистилляции виноградного вина, фруктовой или ягодной браги. В лаборатории в наше время потомком трибикоса Марии является трехногая кобылка — лабораторный прибор с тремя отводами для соединения с колбами, в которые собирается перегоняемая жидкость.
В лаборатории в наше время потомком трибикоса Марии является трехногая кобылка — лабораторный прибор с тремя отводами для соединения с колбами, в которые собирается перегоняемая жидкость.
Весь курс химии. Кратко – презентация онлайн
Весь курс химии. Кратко
•●Виды химической связи●•1. Металлическая. Учавствует один металл
(Fe)2. Ионная. Учавствует металл и неметалл (NaCl)3. Ковалентная
полярная связь. Учавствет один тип химичнского элемента (h3)4.
Ковалентная неполярная связь образуется между
неметаллами•●Таблица Менделеева●•Щелочны́ е мета́ллы — элементы
1-й группы.Щёлочноземе́льные мета́ллы — химические элементы 2-й
группы.Галогены — элементы главной подгруппы 7 группы.С 4 периода
и вниз побочные группы все металлы.•●Электронная формула
атома●•1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶•●Вещества●•1. Кислота –
это сложное вещество, в молекуле которого имеется один или
несколько атомов водорода и кислотный остаток.2. Оксид — бинарное
соединение химического элемента с кислородом в степени окисления
−2, в котором сам кислород связан только с менее
электроотрицательным элементом. 3. Солями называются вещества, в
3. Солями называются вещества, в
которых атомы металла связаны с кислотными остатками. Исключением
являются соли аммония, в которых с кислотными остатками связаны не
атомы металла, а частицы Nh5+.4. Основания – сложные вещества,
состоящие из металла и гидроксильной группы ОН.
•●Реакции●•1. Реакции соединения – химические реакции, в которых из двух или нескольких менее
сложных по элементному составу веществ получается более сложное вещество. Примеры реакций
соединения:C + O2 = CO2; (1)Na2O + CO2 = Na2CO3; (2)Nh4 + CO2 + h3O = Nh5HCO3. (3)2. Реакции
разложения – химические реакции, в которых из одного сложного по элементному составу вещества
получаются два или несколько менее сложных веществ. Примеры реакций разложения:2Ag2O = 4Ag +
O2 ; (1)CaCO3 = CaO + CO2 ; (2)(Nh5)2Cr2O7 = N2 + Cr2O3 + 4h3O . (3)3. Реакции замещения – химические
реакции, в которых атомы или группы атомов одного из исходных веществ замещают атомы или группы
атомов в другом исходном веществе. Примеры реакций замещения:CuSO4 + Fe = FeSO4 + Cu ; (1)2NaI +
Примеры реакций замещения:CuSO4 + Fe = FeSO4 + Cu ; (1)2NaI +
Cl2 = 2NaCl + I2; (2)CaCO3 + SiO2 = CaSiO3 + CO2 . (3)4. Реакции обмена – химические реакции, в которых
исходные вещества как бы обмениваются своими составными частями. Примеры реакций
обмена:Ba(OH)2 + h3SO4 = BaSO4 + 2h3O; (1)HCl + KNO2 = KCl + HNO2; (2)AgNO3 + NaCl = AgCl + NaNO3.
(3)•●Химические свойства●•1) Кислот: 1. С индикаторами: лакмус, метилоранж, фенолфталеин2.
Кислота + основание = соль + вода3. Кислота + оксид металла = соль + вода4. Кислота + металл = соль +
водород5. Кислота + соль = новая кислота + новая соль6. Разложение кислородосодержащих кислот:
h3CO3 = h3O + CO2, h3SO3 = h3O + SO22) Оснований: щелочей:1. С индикаторами: лакмус, метилоранж,
фенолфталеин. 2. С кислотами: Кислота + основание = соль + вода3. С солями: Щелочь + соль =
нерастворимое основание + соль4. С кислотными оксидами: Щелочь + кис. оксид = соль + водаХим.
свойства нерастворимых оснований:1. Разложение при нагревании на оксид и воду. 2. Реагируют с
2. Реагируют с
кислотами: Нераств. основание + кислота = соль + вода3) Основных оксидов: 1. Основный оксид + вода
→ основание. CaO+h3O→Ca(OH)2.2. Основный оксид + кислота → соль + вода.
CuO+h3SO4→CuSO4+h3O.3. Основный оксид + кислотный оксид → соль. MgO+CO2→MgCO3.4)
Химические свойства кислотных оксидов:1. Кислотный оксид + вода → кислота. SO3+h3O→h3SO4. Оксид
кремния SiO2 с водой не реагирует.2. Кислотный оксид + основание → соль + вода.
SO2+2NaOH→Na2SO3+h3O.3. Кислотный оксид + основный оксид → соль. CO2+CaO→CaCO3.5) Солей: 1. С
кислотами: Кислота + соль = кислота + соль2. С щелочами: Соль + щелочь = нераств. основание + соль3.
Соль + соль = соль + соль4. Соль + металл = металл + соль. Левый металл вытесняет правый соли.
• •●Физические свойства●•1. Металлов: металлический блеск, твердость, пластичность, ковкость и хорошая проводимость тепла и
электричества. Для всех металлов характерна металлическая кристаллическая решетка: в ее узлах находятся положительно
заряженные ионы, а между ними свободно перемещаются электроны. 2. Кислот: раств. и нераств., твердые и жидкие3. Оснований:
2. Кислот: раств. и нераств., твердые и жидкие3. Оснований:
твердые, нерастворимые разных цветов, растворимые и нерастворимые4. Оксидов: 5. Солей: •●Классификация оксидов●•Оксиды
делятся на две большие группы: солеобразующие и несолеобразующие. Последние, как вытекает из названия, не образуют
солей.Несолеобразующими называют оксиды, которые не вступают во взаимодействие ни с щелочами, ни с кислотами и не
образуют солей. Эти оксиды образованы неметаллами.Несолеобразующих оксидов немного, их
необходимо запомнить: N2O, NO, CO, SiO.Солеобразующими называют оксиды, способные взаимодействовать с кислотами или с
основаниями с образованием солей.Солеобразующие оксиды делятся на основные, кислотные и амфотерные оксиды.Основные
оксиды – оксиды, которым соответствуют основные гидроксиды (основания).Основные оксиды образованы типичными металлами
(щелочными, щелочноземельными, магнием), а также переходными металлами в низких степенях окисления (кроме ZnO).Примеры
основных оксидов: Li2O, Na2O, K2O, MgO, CaO, BaO, Fe+2O, Cr+2O, Cu2+1O, Cu+2O, Mn+2O и др. Кислотные оксиды – оксиды, которым
Кислотные оксиды – оксиды, которым
соответствуют кислотные гидроксиды (кислоты).Кислотные оксиды образованы неметаллами (за исключением несолеобразующих
оксидов CO, SiO, NO, N2O), а также переходными металлами в высоких степенях окисления.Примеры кислотных
оксидов: Cl2O7, SO3, SO2, N2O5, NO2, N2O3, P2O5, P2O3, CO2, SiO2, B2O3, Cr+6O3, Mn2+7O7 и
др.•●Электроотрицательность●•Электроотрицательность (ЭО) – количественная характеристика элемента, показывающая, с какой
силой притягиваются электроны ядром атома. ЭО также характеризует способность удерживать валентные электроны на внешнем
энергетическом уровне.Наименьшую ЭО (меньше двух) имеют металлы первой группы периодической таблицы.•●Электрическая
диссоциация●•Вещества делятся на электролиты и неэлектролиты. Электролиты проводят ттк, а неэлектролиты — нет.Электролиты
бывают сильные и слабые. Сильные разбиваются, слабые нет. Сильные электролиты:1. Все щелочи (раствтримые основания)2.
Кислоты, сильные: HCl (соляная), h3SO4 (серная), h3NO3 (азотная)3. Все соли (нерастворимые разбивать
Все соли (нерастворимые разбивать
нельзя)•●Моли●•Молярная масса вещества M — масса одного моль вещества, то есть масса 6⋅10**23 молекул (по закону
Авогадро), измеряется в г/моль.Молярная масса серной кислоты: M(h3SO4)= 1*2+32+16*4=98 г/мольn — кол-во вещества (моль)m
— масса (гр)N — кол-во молекулNa — число Авогардо (6.02*10**23)M — молярная масса (гр/моль)V — молярный объем (литр)Va —
молярный объем (22.4 л/моль)n=m/M=V/Va=N/Nam = n*M = N*NаM = m/nДоля элемента в веществе w = m в-ва / m рас-ра *
100%•●ОВР●•Металлы — элементы, атомы которых способны отдавать электроны.Неметаллы — элементы, атомы которых могут
принимать электроны.Окислительно-восстановительные реакции (ОВР) – химические реакции, в которых происходит изменение
степеней окисления атомов, входящих в состав реагирующих веществ.Атомы-окислители – атомы, принимающие электроны в ходе
данной ОВР.Атомы-восстановители – атомы, отдающие электроны в ходе данной ОВР.Вещество-окислитель – исходное вещество
данной реакции ОВР, содержащее атомы окислители. Вещество-восстановитель – исходное вещество данной реакции ОВР,
Вещество-восстановитель – исходное вещество данной реакции ОВР,
содержащее атомы восстановители.Пример:2Na + 2h3O = 2NaOH + h3 (1)Na (степень окисления 0) – 1ē = Na (степень окисления +1)
(2)2H (степень окисления +1) + 2ē = h3 (степень окисления 0) (3)(2) — окисление, (3) — восстановление
• •●Валентность и степень окисления●•Валентность элемента — число химических связей, которые образует один атом данного
элемента в данной молекуле.Валентные возможности атома определяются числом:1. неспаренных электронов (Если на
орбитали (электронный уровень) находится один электрон, то он называется неспаренным, а если два – то это спаренные электроны)2.
неподеленных электронных пар Правила определения валентности элементов в соединениях:Валентность водорода принимают за I
(единицу).Кислород в своих соединениях всегда проявляет валентность II.Высшая валентность равна номеру группы.Низшая
валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т. е.
е.
8 – № группы.Валентность может быть постоянной или переменной.Валентность простых веществ не равна нулю. Исключение VIII
группа главная подгруппа (благородные газы).В большинстве случаев валентность и степень окисления численно совпадают, хотя это
разные характеристики. Но!СО (монооксид углерода, угарный газ) – валентность атома углерода равна III, а степень окисления +2HNO3
(азотная кислота) – валентность атома азота равна IV, а степень окисления +5Н2О2 (пероксид водорода) – валентность водорода равна I,
валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во
всех пероксидах валентность кислорода равна II.N2h5 (гидразин) – валентность азота равна III, а степень окисления равна +2.h3 (I), N2
(III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.•●Степени окисления●•Степень окисления — это условный заряд
атома в соединении.Элементы с постоянной степенью окисления. Степень окисления = +№ группыI группа главная подгруппа степень
Степень окисления = +№ группыI группа главная подгруппа степень
окисления +1.II группа главная подгруппа степень окисления +2.III группа главная подгруппа (бор, алюминий) степень окисления равна
+3. Исключения:1. Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1 ( исключением
Si(+4)h5(-), B2(+3)H6(-), B(+3)h4(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет
степень окисления -1: Na(+)H(-), Ca(+2)h3(-))2. Кислород в большинстве соединений имеет степень окисления -2. Однако в составе
пероксидов его степень окисления равна -1 (например h3(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более
электроотрицательным элементом – фтором – степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).3. Фтор (F) как
наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной
подгруппе).Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе). Цинк (Zn) имеет
Цинк (Zn) имеет
постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).Элементы с переменной степенью окисленияВсе
остальные элементы (за исключением VIII группы главной подгруппы, у них нет валенстности).Для элементов главных подгрупп:Высшая
степень окисления = +№ группы.Низшая степень окисления = +№ группы – 8.Промежуточная степень окисления = +№ группы – 2.Если
молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее
электроотрицательный — положительную. При определении степени окисления в продуктах химических реакций исходят из правила
электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества,
должна быть равна нулю.
Спасибо за внимание
химия | Определение, темы, типы, история и факты
молекулярная структура
Посмотреть все СМИ
- Ключевые люди:
- Джордж П.
 Смит
Йошино Акира
Грегори П. Винтер
Бенджамин Лист
М. Стэнли Уиттингем
Смит
Йошино Акира
Грегори П. Винтер
Бенджамин Лист
М. Стэнли Уиттингем
- Похожие темы:
- химическая связь химический элемент химическое соединение биохимия химическая реакция
Просмотреть весь связанный контент →
Популярные вопросы
Что такое химия?
Химия — это область науки, изучающая свойства, состав и структуру элементов и соединений, их изменения и энергию, которая выделяется или поглощается при их изменении.
Как связаны химия и биология?
Химия изучает вещества, то есть элементы и соединения, а биология изучает живые существа. Однако эти две отрасли науки встречаются в дисциплине биохимии, изучающей вещества в живых существах и то, как они изменяются в организме.
Сводка
Прочтите краткий обзор этой темы
химия , наука, изучающая свойства, состав и структуру веществ (определяемых как элементы и соединения), превращения, которые они претерпевают, и энергию, которая высвобождается или поглощается в ходе этих процессов.
Большой проблемой в химии является разработка последовательного объяснения сложного поведения материалов, почему они выглядят так, а не иначе, что придает им устойчивые свойства и как взаимодействие между различными веществами может привести к образованию новых веществ и разрушение старых. С самых ранних попыток понять материальный мир в рациональных терминах химики изо всех сил пытались разработать теории материи, которые удовлетворительно объясняли бы как постоянство, так и изменение.
Химия также занимается использованием природных веществ и созданием искусственных. Кулинария, ферментация, производство стекла и металлургия — все это химические процессы, восходящие к зарождению цивилизации. Сегодня винил, тефлон, жидкие кристаллы, полупроводники и сверхпроводники представляют собой плоды химической технологии. В 20-м веке произошел значительный прогресс в понимании удивительной и сложной химии живых организмов, и молекулярная интерпретация здоровья и болезней имеет большие перспективы. Современная химия, с помощью все более сложных инструментов, изучает материалы, такие маленькие, как отдельные атомы, и такие большие и сложные, как ДНК (дезоксирибонуклеиновая кислота), которая содержит миллионы атомов.
С интеллектуальными задачами химии тесно связаны задачи, связанные с промышленностью. В середине 19 века немецкий химик Юстус фон Либих заметил, что богатство нации можно измерить по количеству произведенной ею серной кислоты. Эта кислота, необходимая для многих производственных процессов, остается сегодня ведущим химическим продуктом в промышленно развитых странах. Как признавал Либих, страна, производящая большое количество серной кислоты, имеет сильную химическую промышленность и сильную экономику в целом. Производство, распределение и использование широкого спектра химических продуктов характерны для всех высокоразвитых стран.
Викторина “Британника”
Так много химии, так мало времени Викторина
Какой французский химик первым выделил кодеин? Кому приписывают открытие урана? Проверьте свои знания. Пройди тест.
Давно прошли те времена, когда один человек мог надеяться на детальное знание всех областей химии. Те, кто преследует свои интересы в конкретных областях химии, общаются с другими людьми, разделяющими те же интересы. Со временем группа химиков со специализированными исследовательскими интересами становится основателями области специализации. Области специализации, возникшие в начале истории химии, такие как органическая, неорганическая, физическая, аналитическая и промышленная химия, наряду с биохимией, сохраняют наибольший общий интерес. Однако в 20-м веке произошел значительный рост в области полимерной, экологической и медицинской химии. Более того, продолжают появляться новые специальности, как, например, пестицидная, криминалистическая, компьютерная химия.
Более того, продолжают появляться новые специальности, как, например, пестицидная, криминалистическая, компьютерная химия.
Что такое химия? | Живая наука
Химик в лабораторном халате. Большинство людей думают, что химия — это что-то, что делается в лаборатории, но вы практикуете химические аспекты каждый день. (Изображение предоставлено Гетти)Вы можете думать о химии только в контексте лабораторных анализов, пищевых добавок или опасных веществ, но область химии включает в себя все, что нас окружает.
«Все, что вы слышите, видите, обоняете, пробуете на вкус и осязаете, связано с химией и химическими веществами (материей)», согласно данным Американского химического общества (ACS), некоммерческой научной организации, занимающейся продвижением химии, утвержденный Конгрессом США. «Слух, зрение, вкус и прикосновение — все это включает в себя сложную серию химических реакций и взаимодействий в вашем теле».
Итак, даже если вы не работаете химиком, вы занимаетесь химией или чем-то, что связано с химией, почти всем, чем вы занимаетесь. В повседневной жизни вы занимаетесь химией, когда готовите, когда протираете прилавок моющими средствами, когда принимаете лекарства или разбавляете концентрированный сок, чтобы вкус не был таким интенсивным.
В повседневной жизни вы занимаетесь химией, когда готовите, когда протираете прилавок моющими средствами, когда принимаете лекарства или разбавляете концентрированный сок, чтобы вкус не был таким интенсивным.
Связанный: Ого! Огромный взрыв «сахарной ваты» в детской химической лаборатории
Согласно ACS, химия — это изучение материи, определяемой как все, что имеет массу и занимает пространство, а также изменения, которые материя может претерпевать, когда она подвергается различным воздействиям. средах и условиях.
Химия стремится понять не только свойства материи, вроде массы или состава химического элемента, но и то, как и почему материя претерпевает те или иные изменения — трансформировалось ли что-то, потому что соединилось с другим веществом, застыло, потому что осталось на два недель в морозильной камере или изменил цвет из-за слишком большого количества солнечного света.
Основы химии
Причина, по которой химия затрагивает все, что мы делаем, заключается в том, что почти все существующее можно разбить на химические строительные блоки.
Основными строительными блоками в химии являются химические элементы, вещества, состоящие из одного атома. Каждое химическое вещество уникально, состоит из определенного количества протонов, нейтронов и электронов и идентифицируется по имени и химическому символу, например, «С» для углерода. Элементы, открытые учеными на данный момент, перечислены в периодической таблице элементов и включают в себя как элементы, встречающиеся в природе, такие как углерод, водород и кислород, так и созданные руками человека, такие как лавренций.
Родственный: Как элементы сгруппированы в периодической таблице?
Химические элементы могут соединяться друг с другом, образуя химические соединения, которые представляют собой вещества, состоящие из нескольких элементов, таких как диоксид углерода (который состоит из одного атома углерода, соединенного с двумя атомами кислорода), или нескольких атомов одного элемента, как газообразный кислород (который состоит из двух атомов кислорода, соединенных вместе). Затем эти химические соединения могут связываться с другими соединениями или элементами, образуя бесчисленное множество других веществ и материалов.
Затем эти химические соединения могут связываться с другими соединениями или элементами, образуя бесчисленное множество других веществ и материалов.
Химия как физическая наука
Химия обычно считается физической наукой, согласно определению Британской энциклопедии , поскольку изучение химии не связано с живыми существами. Большая часть химии, связанной с исследованиями и разработками, например, создание новых продуктов и материалов для клиентов, подпадает под эту сферу.
Но различие как физической науки становится немного размытым в случае биохимии, которая исследует химию живых существ, по данным Биохимического общества . Химические вещества и химические процессы, изучаемые биохимиками, технически не считаются «живыми», но их понимание важно для понимания того, как устроена жизнь.
Химия — это физическая наука, а это значит, что она не касается «живых» существ. Один из способов, которым многие люди регулярно практикуют химию, возможно, не осознавая этого, — это приготовление пищи и выпечка. (Изображение предоставлено Shutterstock)
(Изображение предоставлено Shutterstock)(открывается в новой вкладке)
Пять основных разделов химии
Традиционно химия разбита на пять основных разделов, согласно онлайн-учебнику по химии, опубликованному LibreText (открывается в новой вкладке). Существуют также более специализированные области, такие как пищевая химия, химия окружающей среды и ядерная химия, но этот раздел посвящен пяти основным поддисциплинам химии.
Аналитическая химия включает анализ химических веществ и включает в себя качественные методы, такие как изучение изменений цвета, а также количественные методы, такие как определение точной длины волны света, которую поглощает химическое вещество, что приводит к изменению цвета.
Эти методы позволяют ученым характеризовать множество различных свойств химических веществ и могут принести пользу обществу во многих отношениях. Например, аналитическая химия помогает пищевым компаниям делать более вкусные замороженные обеды, определяя, как меняются химические вещества в продуктах , когда они замораживаются с течением времени. Аналитическая химия также используется для мониторинга состояния окружающей среды, например, путем измерения химических веществ в воде или почве.
Аналитическая химия также используется для мониторинга состояния окружающей среды, например, путем измерения химических веществ в воде или почве.
Биохимия , как упоминалось выше, использует химические методы, чтобы понять, как биологические системы работают на химическом уровне. Благодаря биохимии исследователи смогли составить карту генома человека, понять, что разные белки делают в организме, и разработать лекарства от многих болезней.
Родственный: Аутоиммунные заболевания: определение и примеры
Неорганическая химия изучает химические соединения в неорганических или неживых объектах, таких как минералы и металлы. Традиционно в неорганической химии рассматриваются соединения, которые выполняют , а не содержат углерод (которые охватываются органической химией), но это определение не совсем точное, согласно ACS .
Некоторые соединения, изучаемые в неорганической химии, такие как «металлоорганические соединения», содержат металлы, которые связаны с углеродом — основным элементом, изучаемым в органической химии. Таким образом, такие соединения считаются частью обеих областей.
Таким образом, такие соединения считаются частью обеих областей.
Неорганическая химия используется для создания различных продуктов, включая краски, удобрения и солнцезащитные средства.
Органическая химия занимается химическими соединениями, содержащими углерод, элемент, который считается необходимым для жизни. Химики-органики изучают состав, структуру, свойства и реакции таких соединений, которые наряду с углеродом содержат другие неуглеродные элементы, такие как водород, сера и кремний. Органическая химия используется во многих областях, как описано ACS , таких как биотехнология, нефтяная промышленность, фармацевтика и пластмассы.
Физическая химия использует понятия из физики, чтобы понять, как работает химия. Например, выяснить, как атомы движутся и взаимодействуют друг с другом, или почему некоторые жидкости, включая воду, превращаются в пар при высоких температурах. Химики-физики пытаются понять эти явления в очень малых масштабах — на уровне атомов и молекул — чтобы сделать выводы о том, как протекают химические реакции и что придает конкретным материалам их собственные уникальные свойства.
Связанные: Нобелевская премия по химии присуждается тем, кто решил «проблему зеркального отображения»
Этот тип исследований помогает информировать другие области химии и важен для разработки продуктов, согласно ACS . Например, физико-химики могут изучать, как определенные материалы, такие как пластик, могут реагировать с химическими веществами, с которыми этот материал предназначен для контакта.
Чем занимаются химики?
Химики работают в различных областях, включая исследования и разработки, контроль качества, производство, защиту окружающей среды, консалтинг и юриспруденцию. Согласно ACS, они могут работать в университетах, в правительстве или в частном секторе (откроется в новой вкладке).
Вот несколько примеров того, чем занимаются химики:
Исследования и разработки
В научных кругах химики, проводящие исследования, стремятся углубить знания по определенной теме и не обязательно иметь в виду конкретное приложение. Однако их результаты все еще могут быть применены к соответствующим продуктам и приложениям.
Однако их результаты все еще могут быть применены к соответствующим продуктам и приложениям.
В промышленности химики, занимающиеся исследованиями и разработками, используют научные знания для разработки или улучшения конкретного продукта или процесса. Например, пищевые химики улучшают качество, безопасность, хранение и вкус продуктов питания; химики-фармацевты разрабатывают и анализируют качество лекарств и других медицинских препаратов; а агрохимики разрабатывают удобрения, инсектициды и гербициды, необходимые для крупномасштабного растениеводства.
Иногда исследования и разработки могут заключаться не в улучшении самого продукта, а скорее в производственном процессе, связанном с его изготовлением. Инженеры-химики и инженеры-технологи изобретают новые способы сделать производство своих продуктов более простым и экономичным, например, увеличить скорость и/или выход продукта при заданном бюджете.
Охрана окружающей среды
Химики-экологи изучают, как химические вещества взаимодействуют с природной средой, характеризуя химические вещества и химические реакции, присутствующие в естественных процессах в почве, воде и воздухе. Например, ученые могут собрать почву, воду или воздух в интересующем месте и проанализировать их в лаборатории, чтобы определить, загрязнила или загрязнит ли деятельность человека окружающую среду или повлияет ли она иным образом. По данным Бюро статистики труда США, некоторые химики-экологи также могут помочь восстановить или удалить загрязняющие вещества из почвы.
Например, ученые могут собрать почву, воду или воздух в интересующем месте и проанализировать их в лаборатории, чтобы определить, загрязнила или загрязнит ли деятельность человека окружающую среду или повлияет ли она иным образом. По данным Бюро статистики труда США, некоторые химики-экологи также могут помочь восстановить или удалить загрязняющие вещества из почвы.
Связанный: Остатки пестицидов связаны со снижением фертильности у женщин быть выполнено в соответствии с экологическими нормами.
Юриспруденция
Химики могут использовать свое академическое образование, чтобы давать советы или отстаивать научные интересы. Например, химики могут работать в области интеллектуальной собственности, где они могут применить свой научный опыт для решения вопросов авторского права в науке, или в области экологического права, где они могут представлять группы с особыми интересами и запрашивать одобрение регулирующих органов до того, как будут совершены определенные действия.
Химики также могут проводить анализы, которые помогают правоохранительным органам. Судебные химики собирают и анализируют вещественные доказательства, оставленные на месте преступления, чтобы помочь установить личности причастных к делу людей, а также ответить на другие важные вопросы, касающиеся того, как и почему было совершено преступление. Судебные химики используют широкий спектр методов анализа, таких как хроматография и спектрометрия, которые помогают идентифицировать и количественно определять химические вещества.
Дополнительные ресурсы:
- Более конкретные ответы на все вопросы о химии можно найти на веб-сайте Американского химического общества.
- Посмотрите это полезное видео «Введение в химию» от Академии Хана.
- Откройте для себя историю химии и известных химиков.
Эта статья была обновлена 5 ноября редактором How It Works Беном Биггсом
Алан Лим имеет докторскую степень. имеет степень бакалавра в области материаловедения и инженерии в Северо-Западном университете и степень бакалавра в области химии и когнитивных наук в Университете Джона Хопкинса. Она также имеет более чем пятилетний опыт написания статей о науке для различной аудитории. Ее работа появилась на научном канале YouTube SciShow, справочном веб-сайте ThoughtCo и Американском институте физики.
Она также имеет более чем пятилетний опыт написания статей о науке для различной аудитории. Ее работа появилась на научном канале YouTube SciShow, справочном веб-сайте ThoughtCo и Американском институте физики.
1.1: Что такое химия? – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 85131
- Элизабет Гордон
- Университет Фурмана
Цели обучения
- Осознать широту, глубину и охват химии.
- Дайте определение химии по отношению к другим наукам.
- Определите основные дисциплины химии.
Химия изучает материю, из чего она состоит, каковы ее свойства и как она изменяется. Способность описать ингредиенты в торте и то, как они меняются, когда торт выпекается, называется химией. Материя — это все, что имеет массу и занимает пространство, то есть все, что физически реально. Некоторые вещи легко идентифицируются как материя — например, эта книга. Другие не так очевидны. Поскольку мы так легко перемещаемся по воздуху, мы иногда забываем, что это тоже материя.
Способность описать ингредиенты в торте и то, как они меняются, когда торт выпекается, называется химией. Материя — это все, что имеет массу и занимает пространство, то есть все, что физически реально. Некоторые вещи легко идентифицируются как материя — например, эта книга. Другие не так очевидны. Поскольку мы так легко перемещаемся по воздуху, мы иногда забываем, что это тоже материя.
Химия — это одна из областей науки. Наука — это процесс, посредством которого мы узнаем о естественной вселенной, наблюдая, проверяя, а затем создавая модели, объясняющие наши наблюдения. Поскольку физическая вселенная так огромна, существует множество различных отраслей науки (рис. \(\PageIndex{1}\)). Таким образом, химия — это изучение материи, биология — это изучение живых существ, а геология — это изучение горных пород и земли. Математика — это язык науки, и мы будем использовать его для передачи некоторых идей химии.
Рисунок \(\PageIndex{1}\): Взаимосвязь между некоторыми основными отраслями науки. Химия находится примерно посередине, что подчеркивает ее важность для многих отраслей науки.
Химия находится примерно посередине, что подчеркивает ее важность для многих отраслей науки.Хотя мы разделяем науку на разные области, между ними много общего. Например, некоторые биологи и химики так много работают в обеих областях, что их работа называется биохимией. Точно так же геология и химия пересекаются в области, называемой геохимией. На рисунке \(\PageIndex{1}\) показано, сколько отдельных областей науки взаимосвязано.
Существует множество других областей науки, помимо перечисленных (биология, медицина и т. д.)
Алхимия никоим образом не химия!
По мере того, как со временем менялось наше понимание Вселенной, менялась и научная практика. Химия в ее современном виде, основанная на принципах, которые мы считаем актуальными и сегодня, была разработана в 1600-х и 1700-х годах. До этого изучение материи было известно как алхимия и практиковалось в основном в Китае, Аравии, Египте и Европе.
Алхимия была несколько мистическим и скрытным подходом к изучению того, как манипулировать материей. Практики, называемые алхимиками, думали, что вся материя состоит из различных пропорций четырех основных элементов — огня, воды, земли и воздуха — и верили, что если изменить относительные пропорции этих элементов в веществе, можно изменить вещество. . Одной из целей алхимии были давние попытки «превратить» обычные металлы в золото. Другой важной целью алхимии был синтез философского камня, материала, который мог дать долгую жизнь и даже бессмертие. Алхимики использовали символы для обозначения веществ, некоторые из которых показаны на прилагаемом рисунке. Это было сделано не для лучшего обмена идеями, как это делают современные химики, а для сохранения секретности алхимических знаний, чтобы другие не могли ими поделиться.
Практики, называемые алхимиками, думали, что вся материя состоит из различных пропорций четырех основных элементов — огня, воды, земли и воздуха — и верили, что если изменить относительные пропорции этих элементов в веществе, можно изменить вещество. . Одной из целей алхимии были давние попытки «превратить» обычные металлы в золото. Другой важной целью алхимии был синтез философского камня, материала, который мог дать долгую жизнь и даже бессмертие. Алхимики использовали символы для обозначения веществ, некоторые из которых показаны на прилагаемом рисунке. Это было сделано не для лучшего обмена идеями, как это делают современные химики, а для сохранения секретности алхимических знаний, чтобы другие не могли ими поделиться.
Несмотря на эту секретность, в свое время алхимия считалась серьезным научным занятием. Исаак Ньютон, великий математик и физик, был также алхимиком.
Исаак Ньютон, великий математик и физик, был также алхимиком.
Алхимия и ACS (Американское химическое общество)
Во время просмотра видео ниже ответьте на следующие вопросы.
Вопросы
- Какова была главная цель алхимика согласно видео?
- Что философский камень мог сделать с мочой?
- Является ли алхимия настоящей наукой?
- Когда моча превращается в белую пасту, какое название и символ получается у элемента?
- Перечислите некоторые свойства этого элемента, которые обсуждались в видео.
- Производили ли богатые люди больше этого элемента, чем бедные?
- К каким типам приложений (прикладной науки) привел нас этот элемент?
- Как можно вместо сбора мочи собирать более высокие концентрации этого элемента?
- В видео обсуждалась фосфорная кислота (формула: H 3 PO 4 ).
 Назовите все элементы в этом соединении.
Назовите все элементы в этом соединении. - Какие области применения фосфорной кислоты упоминались?
- Каковы некоторые из органических и биохимических применений элемента 13?
Области химии
Изучение современной химии имеет много направлений, но в целом может быть разбито на пять основных дисциплин или областей исследования:
- Физическая химия: Физическая химия — это изучение макроскопических свойств, атомных свойств и явления в химических системах. Химик-физик может изучать такие вещи, как скорость химических реакций, передачу энергии, происходящую в реакциях, или физическую структуру материалов на молекулярном уровне.
- Органическая химия: Органическая химия — это изучение химических веществ, содержащих углерод и водород. Углерод является одним из самых распространенных элементов на Земле и способен образовывать огромное количество химических веществ (на данный момент более двадцати миллионов).
 Большинство химических веществ, обнаруженных во всех живых организмах, основаны на углероде.
Большинство химических веществ, обнаруженных во всех живых организмах, основаны на углероде. - Неорганическая химия: Неорганическая химия — это изучение химических веществ, которые, как правило, не содержат углерода. Неорганические химические вещества обычно встречаются в горных породах и минералах. Одна из актуальных важных областей неорганической химии связана с дизайном и свойствами материалов, используемых в энергетических и информационных технологиях.
- Аналитическая химия: Аналитическая химия изучает состав вещества. Основное внимание уделяется разделению, идентификации и количественному определению химических веществ в образцах вещества. Химик-аналитик может использовать сложные инструменты для анализа неизвестного материала с целью определения его различных компонентов.
- Биохимия: Биохимия изучает химические процессы, происходящие в живых организмах. Исследования могут охватывать основные клеточные процессы вплоть до понимания болезненных состояний, чтобы можно было разработать более эффективные методы лечения.

На практике химические исследования часто не ограничиваются одной из пяти основных дисциплин. Конкретный химик может использовать биохимию для выделения определенного химического вещества, содержащегося в организме человека, такого как гемоглобин, переносящий кислород компонент эритроцитов. Затем он или она может приступить к анализу гемоглобина, используя методы, которые относятся к областям физической или аналитической химии. Многие химики специализируются в областях, представляющих собой комбинацию основных дисциплин, таких как бионеорганическая химия или физическая органическая химия.
Химики за работой
Американское химическое общество (ACS) разработало серию видеороликов, иллюстрирующих различные области, которыми может заниматься химик. Посмотрите это видео продолжительностью 2 минуты 23 секунды и ответьте на следующие вопросы:
- Какой тип химии изучает доктор Джейкобс (посмотрите на пять типов химиков, перечисленных выше).

- Как доктор Джейкобс и связанные с ней исследования применяют свою химию для решения реальных проблем?
- С какими специалистами сотрудничает доктор Джейкобс?
- Что труднее охарактеризовать и почему: белки или малые молекулы?
Резюме
- Химия изучает материю и изменения, которые она претерпевает, и рассматривает как макроскопическую , так и микроскопическую информацию.
- Материя — это все, что имеет массу и занимает пространство.
- Пять основных дисциплин химии: физическая химия, органическая химия, неорганическая химия, аналитическая химия и биохимия.
- Многие цивилизации способствовали развитию химии. Многие ранние химические исследования были сосредоточены на практическом использовании. Основные химические теории были разработаны в девятнадцатом веке. Новые материалы и батареи — лишь некоторые из продуктов современной химии.
Авторы и авторство
Эта страница под названием 1. 1: Что такое химия? распространяется по лицензии CC BY-NC-SA, автором, ремиксом и/или куратором выступила Элизабет Гордон.
1: Что такое химия? распространяется по лицензии CC BY-NC-SA, автором, ремиксом и/или куратором выступила Элизабет Гордон.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Элизабет Гордон
- Лицензия
- СС BY-NC-SA
- Показать страницу TOC
- нет на странице
- Метки
Краткая история химии
Это «Краткая история химии», раздел 1. 4 из книги «Основы общей химии» (т. 1.0). Для получения подробной информации об этом (включая лицензирование) нажмите здесь.
4 из книги «Основы общей химии» (т. 1.0). Для получения подробной информации об этом (включая лицензирование) нажмите здесь.
Для получения дополнительной информации об источнике этой книги или о том, почему она доступна бесплатно, посетите домашнюю страницу проекта. Там вы можете просматривать или скачивать дополнительные книги. Чтобы загрузить ZIP-файл с этой книгой для использования в автономном режиме, просто нажмите здесь.
Помогла ли вам эта книга? Рассмотрите возможность передачи:
Помощь Creative Commons
Creative Commons поддерживает свободную культуру от музыки до образования. Их лицензии помогли сделать эту книгу доступной для вас.
Помогите государственной школе
DonorsChoose.org помогает таким людям, как вы, помогать учителям финансировать их классные проекты, от художественных принадлежностей до книг и калькуляторов.
1.4 Краткая история химии
Цель обучения
- Понять развитие атомной модели.

Только в эпоху древних греков у нас не было никаких записей о том, как люди пытались объяснить химические изменения, которые они наблюдали и использовали. В то время считалось, что природные объекты состоят всего из четырех основных элементов: земли, воздуха, огня и воды. Затем, в четвертом веке до нашей эры, два греческих философа, Демокрит и Левкипп, предположили, что материя не бесконечно делится на более мелкие частицы, а состоит из фундаментальных неделимых частиц, называемых атомами. Фундаментальные, отдельные частицы, из которых состоит материя. ранние философы не имели технологии для проверки своей гипотезы. В любом случае они вряд ли сделали бы это, потому что древние греки не проводили экспериментов и не использовали научный метод. Они считали, что природа Вселенной может быть открыта только рациональным мышлением.
В течение следующих двух тысячелетий алхимиков , которые занимались химией и спекулятивной философией в средние века и эпоху Возрождения, добились многих успехов в химии. Их главная цель состояла в том, чтобы преобразовать одни элементы в другие с помощью процесса, который они назвали трансмутацией. Процесс преобразования одного элемента в другой. (Рисунок 1.13 «Алхимик за работой»). В частности, алхимики хотели найти способ превратить более дешевые металлы в золото. Хотя большинство алхимиков не подходили к химии систематически, и многие из них, по-видимому, были откровенными мошенниками, алхимики в Китае, арабских королевствах и средневековой Европе внесли большой вклад, включая открытие таких элементов, как ртуть (ртуть) и получение нескольких сильных кислот. .
Их главная цель состояла в том, чтобы преобразовать одни элементы в другие с помощью процесса, который они назвали трансмутацией. Процесс преобразования одного элемента в другой. (Рисунок 1.13 «Алхимик за работой»). В частности, алхимики хотели найти способ превратить более дешевые металлы в золото. Хотя большинство алхимиков не подходили к химии систематически, и многие из них, по-видимому, были откровенными мошенниками, алхимики в Китае, арабских королевствах и средневековой Европе внесли большой вклад, включая открытие таких элементов, как ртуть (ртуть) и получение нескольких сильных кислот. .
Рисунок 1.13 Алхимик за работой
Алхимия была одной из форм химии, которая процветала в Средние века и эпоху Возрождения. Хотя некоторые алхимики были мошенниками, другие внесли большой вклад, включая открытие нескольких элементов и получение сильных кислот.
Современная химия
В 16 и 17 веках зародилось то, что мы теперь называем современной химией. В этот период были достигнуты большие успехи в металлургии г. были проведены извлечение металлов из руд и первые систематические количественные опыты. В 1661 году англичанин Роберт Бойль (1627–1691) опубликовал книгу «Химик-скептик» , в которой описывалась взаимосвязь между давлением и объемом воздуха. Что еще более важно, Бойль определил элемент как вещество, которое не может быть разделено на два или более простых вещества химическими средствами. Это привело к идентификации большого количества элементов, многие из которых были металлами. По иронии судьбы, сам Бойль никогда не считал металлы элементами.
были проведены извлечение металлов из руд и первые систематические количественные опыты. В 1661 году англичанин Роберт Бойль (1627–1691) опубликовал книгу «Химик-скептик» , в которой описывалась взаимосвязь между давлением и объемом воздуха. Что еще более важно, Бойль определил элемент как вещество, которое не может быть разделено на два или более простых вещества химическими средствами. Это привело к идентификации большого количества элементов, многие из которых были металлами. По иронии судьбы, сам Бойль никогда не считал металлы элементами.
В 18 веке английский священник Джозеф Пристли (1733–1804) открыл газообразный кислород и обнаружил, что многие углеродсодержащие материалы энергично горят в кислородной атмосфере, процесс, называемый горением. Горение материала в кислородной атмосфере.. Пристли также обнаружил, что газ, образующийся при брожении пива, который, как мы теперь знаем, представляет собой углекислый газ, является таким же, как один из газообразных продуктов сгорания.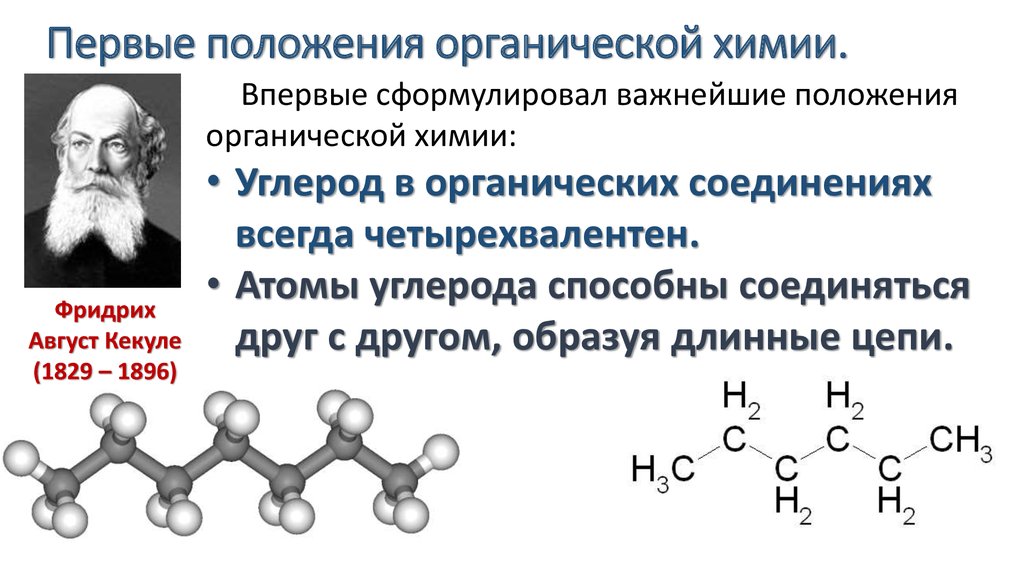 Однако исследования этого газа Пристли не продолжились, как ему хотелось бы. После того, как он упал в чан с бродящим пивом, пивовары запретили ему работать на своих заводах. Хотя Пристли не понял, что это такое, он обнаружил, что углекислый газ растворяется в воде, образуя сельтерскую воду. По сути, его можно считать основателем многомиллиардной индустрии газированных безалкогольных напитков.
Однако исследования этого газа Пристли не продолжились, как ему хотелось бы. После того, как он упал в чан с бродящим пивом, пивовары запретили ему работать на своих заводах. Хотя Пристли не понял, что это такое, он обнаружил, что углекислый газ растворяется в воде, образуя сельтерскую воду. По сути, его можно считать основателем многомиллиардной индустрии газированных безалкогольных напитков.
Джозеф Пристли (1733–1804)
Пристли был политическим теоретиком и ведущим унитарным священником. Он был назначен в Уоррингтонскую академию в Ланкашире, Англия, где разработал новые курсы по истории, науке и искусству. Во время визитов в Лондон Пристли встречался с ведущими учеными, в том числе с Бенджамином Франклином, который поощрял интерес Пристли к электричеству. Работа Пристли над газами началась, когда он жил рядом с пивоварней в Лидсе, где он заметил «неподвижный воздух», выходящий из чанов с бродящим пивом и элем. Его научные открытия включали взаимосвязь между электричеством и химическими изменениями, 10 новых «воздухов» и наблюдения, которые привели к открытию фотосинтеза. Из-за его поддержки принципов Французской революции дом, библиотека и лаборатория Пристли были разрушены толпой в 179 г.1. Он и его жена эмигрировали в Соединенные Штаты в 1794 году, чтобы присоединиться к своим трем сыновьям, которые ранее эмигрировали в Пенсильванию. Пристли так и не вернулся в Англию и умер в своем новом доме в Пенсильвании.
Из-за его поддержки принципов Французской революции дом, библиотека и лаборатория Пристли были разрушены толпой в 179 г.1. Он и его жена эмигрировали в Соединенные Штаты в 1794 году, чтобы присоединиться к своим трем сыновьям, которые ранее эмигрировали в Пенсильванию. Пристли так и не вернулся в Англию и умер в своем новом доме в Пенсильвании.
Несмотря на новаторские исследования Пристли и других, ясное понимание горения оставалось неуловимым. Однако в конце 18 века французский ученый Антуан Лавуазье (1743–1794) показал, что горение — это реакция углеродсодержащего вещества с кислородом с образованием углекислого газа и воды и что жизнь зависит от подобной реакции, которую мы сегодня наблюдаем. позвони дыхание . Лавуазье также написал первый современный текст по химии и широко известен как отец современной химии. Его наиболее важным вкладом был закон сохранения массы. В любой химической реакции масса реагирующих веществ равна массе образующихся продуктов, который гласит, что в любой химической реакции масса реагирующих веществ равна массе реагирующих веществ. массы образующихся продуктов. То есть в химической реакции масса не теряется и не разрушается. К сожалению, Лавуазье инвестировал в частную корпорацию, которая собирала налоги для короны, а королевские сборщики налогов не пользовались популярностью во время Французской революции. Он был казнен на гильотине в возрасте 51 года, преждевременно прекратив свой вклад в химию.
массы образующихся продуктов. То есть в химической реакции масса не теряется и не разрушается. К сожалению, Лавуазье инвестировал в частную корпорацию, которая собирала налоги для короны, а королевские сборщики налогов не пользовались популярностью во время Французской революции. Он был казнен на гильотине в возрасте 51 года, преждевременно прекратив свой вклад в химию.
Атомная теория материи
В 1803 г. английский школьный учитель Джон Дальтон (1766–1844) расширил разработку Прустом закона определенных пропорций (раздел 1.2 «Научный метод») и выводы Лавуазье о сохранении массы. в химических реакциях, чтобы предположить, что элементы состоят из неделимых частиц, которые он назвал атомами (взяв термин от Демокрита и Левкиппа). Атомная теория материи Дальтона содержит четыре фундаментальные гипотезы:
- Вся материя состоит из крошечных неделимых частиц, называемых атомами.
- Все атомы элемента одинаковы по массе и химическим свойствам, тогда как атомы разных элементов различаются по массе и основным химическим свойствам.

- Химическое соединение – это вещество, которое всегда содержит одни и те же атомы в одном и том же соотношении.
- В химических реакциях атомы одного или нескольких соединений или элементов перераспределяются или перестраиваются по отношению к другим атомам с образованием одного или нескольких новых соединений. Сами атомы не претерпевают изменения идентичности в химических реакциях.
Эта последняя гипотеза предполагала, что цель алхимиков по превращению других элементов в золото невозможна, по крайней мере, посредством химических реакций. Теперь мы знаем, что атомная теория Дальтона по существу верна, с четырьмя небольшими изменениями:
- Не все атомы элемента должны иметь одинаковую массу.
- Атомы одного элемента могут быть превращены в другой посредством ядерных реакций.
- Составы многих твердых соединений несколько различаются.
- При определенных обстоятельствах некоторые атомы могут делиться (расщепляться на более мелкие частицы).

Эти модификации иллюстрируют эффективность научного метода; более поздние эксперименты и наблюдения были использованы для уточнения первоначальной теории Дальтона.
Закон кратных пропорций
Несмотря на ясность своего мышления, Дальтон не мог использовать свою теорию для определения элементного состава химических соединений, потому что у него не было надежной шкалы атомных масс; то есть он не знал относительных масс таких элементов, как углерод и кислород. Например, он знал, что газ, который мы теперь называем окисью углерода, содержит углерод и кислород в соотношении 1:1,33 по массе, а второе соединение, газ, который мы называем двуокисью углерода, содержит углерод и кислород в соотношении 1:2,66 по массе. . Поскольку 2,66/1,33 = 2,00, второе соединение содержало в два раза больше атомов кислорода на один атом углерода, чем первое. Но какова была правильная формула для каждого соединения? Если первое соединение состояло из частиц, содержащих один атом углерода и один атом кислорода, то второе должно состоять из частиц, содержащих один атом углерода и два атома кислорода. Если первое соединение имело два атома углерода и один атом кислорода, то второе должно иметь два атома углерода и два атома кислорода. Если бы у первого был один атом углерода и два атома кислорода, у второго был бы один атом углерода и четыре атома кислорода и так далее. Дальтон не мог отличить эти или более сложные альтернативы. Однако эти данные привели к общему положению, известному сейчас как закон кратных пропорций. Когда два элемента образуют ряд соединений, почти всегда можно выразить отношения масс второго элемента, приходящихся на грамм первого элемента. как отношения целых чисел. (Тот же закон справедлив для массовых отношений соединений, образующих ряд, содержащий более двух элементов.): когда два элемента образуют ряд соединений, отношения масс второго элемента, которые присутствуют на грамм первого элемента почти всегда могут быть выражены как отношение целых чисел. (Тот же закон справедлив для массовых отношений соединений, образующих ряд, содержащий более двух элементов.
Если первое соединение имело два атома углерода и один атом кислорода, то второе должно иметь два атома углерода и два атома кислорода. Если бы у первого был один атом углерода и два атома кислорода, у второго был бы один атом углерода и четыре атома кислорода и так далее. Дальтон не мог отличить эти или более сложные альтернативы. Однако эти данные привели к общему положению, известному сейчас как закон кратных пропорций. Когда два элемента образуют ряд соединений, почти всегда можно выразить отношения масс второго элемента, приходящихся на грамм первого элемента. как отношения целых чисел. (Тот же закон справедлив для массовых отношений соединений, образующих ряд, содержащий более двух элементов.): когда два элемента образуют ряд соединений, отношения масс второго элемента, которые присутствуют на грамм первого элемента почти всегда могут быть выражены как отношение целых чисел. (Тот же закон справедлив для массовых отношений соединений, образующих ряд, содержащий более двух элементов. ) Пример 4 показывает, как можно применить закон кратных пропорций для определения идентичности соединения.
) Пример 4 показывает, как можно применить закон кратных пропорций для определения идентичности соединения.
Пример 4
Химик изучает ряд простых соединений углерода и водорода. В следующей таблице перечислены массы водорода, которые соединяются с 1 г углерода с образованием каждого соединения.
| Соединение | Масса водорода (г) |
|---|---|
| А | 0,0839 |
| Б | 0,1678 |
| С | 0,2520 |
| Д |
- Определите, подчиняются ли эти данные закону кратных пропорций.

- Рассчитайте массу водорода, который соединится с 1 г углерода с образованием D , четвертого соединения в ряду.
Дано: масс водорода на грамм углерода для трех соединений
Запрошено:
- отношения масс водорода к углероду
- масса водорода на грамм углерода для четвертого соединения в ряду
Стратегия:
A Выберите наименьшую массу для использования в качестве знаменателя, а затем рассчитайте отношение каждой из других масс к этой массе. При необходимости укажите другие коэффициенты.
B Если соотношения представляют собой небольшие целые числа, данные подчиняются закону кратных пропорций.
C Определите, образуют ли коэффициенты числовой ряд. Если да, то определите следующего члена этого ряда и предскажите соотношение, соответствующее следующему соединению в ряду.
Если да, то определите следующего члена этого ряда и предскажите соотношение, соответствующее следующему соединению в ряду.
D Используйте пропорции для расчета массы водорода на грамм углерода в этом соединении.
Решение:
A Соединение A имеет наименьшую массу водорода, поэтому мы используем его в качестве знаменателя. Соотношения оставшихся масс водорода, B и C , которые соединяются с 1 г углерода, следующие: 21CB=0,2520 g0,1678 g=1,502≈32
B Отношения масс водорода, которые соединяются с 1 г углерода, действительно состоят из небольших целых чисел (3/1, 2/1, 3/2) , как и предсказывает закон кратных пропорций.
C Отношения B / A и C / A образуют ряды 2/1, 3/1, поэтому следующим членом ряда должно быть D / A = 4/1.
D Таким образом, если соединение D существует, оно будет образовано путем соединения 4 × 0,0839 г = 0,336 г водорода с 1 г углерода. Такое соединение существует; это метан , основная составляющая природного газа.
Упражнение
Известны четыре соединения, содержащие только серу и фтор. В следующей таблице перечислены массы фтора, которые соединяются с 1 г серы с образованием каждого соединения.
| Соединение | Масса фтора (г) |
|---|---|
| А | 3,54 |
| Б | 2,96 |
| С | 2,36 |
| Д | 0,59 |
- Определите соотношения масс фтора, соединяющегося с 1 г серы в этих соединениях.
 Соответствуют ли эти данные закону кратных пропорций?
Соответствуют ли эти данные закону кратных пропорций? - Рассчитайте массу фтора, который соединится с 1 г серы с образованием следующих двух соединений в ряду: E и F .
Ответ:
- А / D = 6,0 или 6/1; B / D ≈ 5,0, или 5/1; С / D = 4,0 или 4/1; да
- Соотношения 3,0 и 2,0 дают 1,8 г и 1,2 г фтора/грамм серы соответственно. (Ни одно из этих соединений еще не известно.)
Гипотеза Авогадро
В очередной попытке установить формулы химических соединений французский химик Жозеф Гей-Люссак (1778–1850) провел серию экспериментов с использованием объемных измерений. В условиях постоянной температуры и давления он тщательно измерил объемы газов, которые вступали в реакцию с образованием данного химического соединения, а также объемы продуктов, если они были газами. Гей-Люссак обнаружил, например, что один объем газообразного хлора всегда реагирует с одним объемом газообразного водорода с образованием двух объемов газообразного хлороводорода. Точно так же один объем газообразного кислорода всегда реагировал с двумя объемами газообразного водорода с образованием двух объемов водяного пара (часть (а) на рис. 1.14 «Эксперименты Гей-Люссака с газообразным хлором и газообразным водородом»).
Гей-Люссак обнаружил, например, что один объем газообразного хлора всегда реагирует с одним объемом газообразного водорода с образованием двух объемов газообразного хлороводорода. Точно так же один объем газообразного кислорода всегда реагировал с двумя объемами газообразного водорода с образованием двух объемов водяного пара (часть (а) на рис. 1.14 «Эксперименты Гей-Люссака с газообразным хлором и газообразным водородом»).
Рис. 1.14 Эксперименты Гей-Люссака с газообразным хлором и газообразным водородом
(a) Один объем газообразного хлора реагировал с одним объемом газообразного водорода с образованием двух объемов газообразного хлороводорода, а один объем газообразного кислорода реагировал с двумя объемами газообразного водорода для получения двух объемов водяного пара. (b) Краткое изложение гипотезы Авогадро, которая интерпретировала результаты Гей-Люссака с точки зрения атомов. Обратите внимание, что самый простой способ получить две молекулы хлористого водорода – это если водород и хлор состоят из молекул, содержащих по два атома элемента.
Результаты Гей-Люссака сами по себе не выявили формул для хлористого водорода и воды. Итальянский химик Амадео Авогадро (1776–1856) разработал ключевую идею, которая привела к точным формулам. Он предположил, что при измерении газов при одинаковой температуре и давлении равные объемы различных газов содержат одинаковое количество частиц газа . Гипотеза Авогадро , которая объяснила результаты Гей-Люссака, резюмирована здесь и в части (b) на рис. 1.14 «Опыты Гей-Люссака с газообразным хлором и газообразным водородом»:
один объем (или частица) водорода + один объем (или частица) хлора → два объема (или частицы) хлористого водорода
Если теория атомов Дальтона была верна, то каждая частица водорода или хлора должна была содержать атомов водорода или хлора, поскольку образовались две частицы хлороводорода. Самое простое — но не единственное — объяснение заключалось в том, что водород и хлор содержат по два атома каждый (т. е. они были двухатомными ), а хлороводород содержит по одному атому водорода и хлора. Применение этого рассуждения к результатам Гей-Люссака с водородом и кислородом приводит к выводу, что вода содержит два атома водорода на один атом кислорода. К сожалению, из-за отсутствия данных, подтверждающих гипотезу Авогадро о том, что равные объемы газов содержат равное количество частиц, его объяснения и формулы для простых соединений не были общепринятыми более 50 лет. Дальтон и многие другие продолжали верить, что частицы воды содержат один атом водорода и один атом кислорода, а не два атома водорода и один атом кислорода. Историческое развитие концепции атома резюмировано на рис. 1.15 «Краткий обзор исторического развития концепции атома».
е. они были двухатомными ), а хлороводород содержит по одному атому водорода и хлора. Применение этого рассуждения к результатам Гей-Люссака с водородом и кислородом приводит к выводу, что вода содержит два атома водорода на один атом кислорода. К сожалению, из-за отсутствия данных, подтверждающих гипотезу Авогадро о том, что равные объемы газов содержат равное количество частиц, его объяснения и формулы для простых соединений не были общепринятыми более 50 лет. Дальтон и многие другие продолжали верить, что частицы воды содержат один атом водорода и один атом кислорода, а не два атома водорода и один атом кислорода. Историческое развитие концепции атома резюмировано на рис. 1.15 «Краткий обзор исторического развития концепции атома».
Рис. 1.15 Краткий обзор исторического развития концепции атома
Краткий обзор
Древние греки впервые предположили, что материя состоит из элементарных частиц, называемых атомами . Химия приняла свою нынешнюю научную форму в 18 веке, когда тщательные количественные эксперименты Лавуазье, Пруста и Дальтона привели к закону определенных пропорций, закону сохранения массы и закону кратных пропорций , который заложил основу атомной теории материи Дальтона.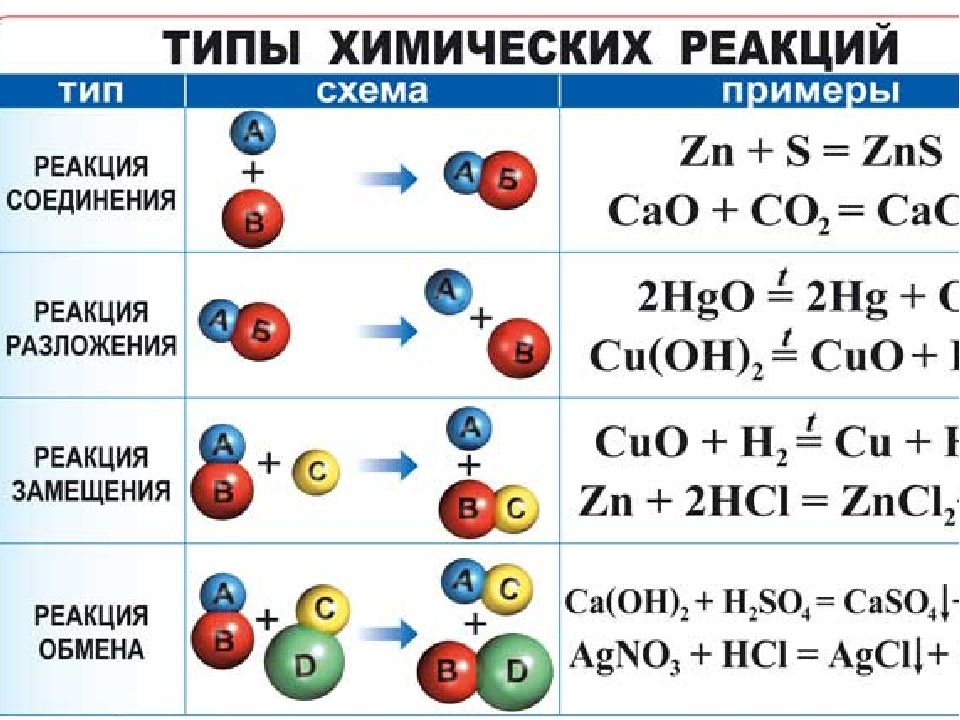 В частности, гипотеза Авогадро обеспечила первую связь между макроскопическими свойствами вещества (в данном случае объемом газа) и числом присутствующих атомов или молекул.
В частности, гипотеза Авогадро обеспечила первую связь между макроскопическими свойствами вещества (в данном случае объемом газа) и числом присутствующих атомов или молекул.
Key Takeaway
- Разработка атомной модели основывалась на применении научного метода на протяжении нескольких столетий.
Концептуальные проблемы
Дайте определение горению и обсудите вклад Пристли и Лавуазье в понимание реакции горения.
Инженеры-химики часто используют в своих расчетах понятие «массового баланса», согласно которому масса реагентов должна равняться массе продуктов. Какой закон поддерживает эту практику?
Применяется ли закон кратных пропорций как к отношениям масс, так и к отношениям атомов? Почему или почему нет?
Каковы четыре гипотезы атомной теории материи?
Большая часть энергии во Франции обеспечивается ядерными реакциями.
 Согласуются ли такие реакции с гипотезами Дальтона? Почему или почему нет?
Согласуются ли такие реакции с гипотезами Дальтона? Почему или почему нет?Содержит ли 1 л воздуха такое же количество частиц, как 1 л газообразного азота? Поясните свой ответ.
Численные задачи
Один из минералов, обнаруженных в почве, имеет атомное соотношение Al:Si:O 0,2:0,2:0,5. Соответствует ли это закону кратных пропорций? Почему или почему нет? Соответствует ли соотношение элементов атомной теории материи Дальтона?
Азот и кислород реагируют, образуя три различных соединения, которые содержат 0,571 г, 1,143 г и 2,285 г кислорода на грамм азота соответственно.
 Соответствует ли это закону кратных пропорций? Поясните свой ответ.
Соответствует ли это закону кратных пропорций? Поясните свой ответ.Известны три бинарных соединения ванадия и кислорода. В следующей таблице приведены массы кислорода, которые соединяются с 10,00 г ванадия с образованием каждого соединения.
Соединение Масса кислорода (г) А 4,71 Б 6,27 С - Определить отношение масс кислорода, соединяющегося с 3,14 г ванадия в соединениях А и В .

- Предскажите массу кислорода, который соединится с 3,14 г ванадия с образованием третьего соединения в ряду.
- Определить отношение масс кислорода, соединяющегося с 3,14 г ванадия в соединениях А и В .
Известны три соединения, содержащие титан, магний и кислород. В следующей таблице приведены массы титана и магния, которые реагируют с 5,00 г кислорода с образованием каждого соединения.
Соединение Масса титана (г) Масса магния (г) А 4,99 2,53 Б 3,74 3,80 С 905:50- Определите соотношения масс титана и магния, которые соединяются с 5,00 г кислорода в этих соединениях.

- Предскажите массы титана и магния, которые соединились бы с 5,00 г кислорода с образованием другого возможного соединения в ряду: C .
- Определите соотношения масс титана и магния, которые соединяются с 5,00 г кислорода в этих соединениях.
Убедитесь, что вы знакомы с темами, обсуждаемыми в разделе «Основные навыки 1» (раздел 1.9 «Основные навыки 1»), прежде чем переходить к числовым задачам.
Какие есть разделы химии и их определение?
ОРГАНИЧЕСКАЯ ХИМИЯ
Органическая химия включает изучение структуры, свойств и получения химических соединений, которые состоят в основном из углерода и водорода.
Органическая химия пересекается со многими областями, в том числе
- Медицинская химия — дизайн, разработка и синтез лекарственных препаратов. Он пересекается с фармакологией (изучением действия лекарств).
- Металлоорганическая химия — изучение химических соединений, содержащих связи между углеродом и металлом.
- Химия полимеров — изучение химии полимеров.

- Физическая органическая химия — изучение взаимосвязей между структурой и реакционной способностью в органических молекулах.
- Стереохимия — изучение пространственного расположения атомов в молекулах и их влияния на химические и физические свойства веществ.
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Неорганическая химия изучает свойства и поведение неорганических соединений.
Охватывает все химические соединения, кроме органических соединений.
Химики-неорганики изучают такие вещи, как кристаллические структуры, минералы, металлы, катализаторы и большинство элементов периодической таблицы.
Отрасли неорганической химии включают:
Бионеорганическая химия — изучение взаимодействия ионов металлов с живой тканью, главным образом путем их непосредственного влияния на активность ферментов.
Геохимия — изучение химического состава и изменений горных пород, минералов и атмосферы земли или небесного тела.

Ядерная химия — изучение радиоактивных веществ.
Металлоорганическая химия — изучение химических соединений, содержащих связи между углеродом и металлом.
Химия твердого тела — изучение синтеза, строения и свойств твердых материалов.
АНАЛИТИЧЕСКАЯ ХИМИЯ
Аналитическая химия включает качественное и количественное определение химических компонентов веществ.
Примеры областей, где используется аналитическая химия, включают:
Судебная химия — применение химических принципов, приемов и методов при расследовании преступлений.
Химия окружающей среды — изучение химических и биохимических явлений, происходящих в окружающей среде. Она в значительной степени опирается на аналитическую химию и включает химию атмосферы, воды и почвы.

Биоаналитическая химия — исследование биологических материалов, таких как кровь, моча, волосы, слюна и пот, на наличие специфических лекарств.
ФИЗИЧЕСКАЯ ХИМИЯ
Физическая химия — изучение влияния химического строения на физические свойства вещества.
Физико-химики обычно изучают скорость химической реакции, взаимодействие молекул с излучением и расчет структур и свойств.
Подразделы физической химии включают:
Фотохимия — изучение химических изменений, вызываемых светом.
Химия поверхности — изучение химических реакций на поверхности веществ. Он включает такие темы, как адсорбция, гетерогенный катализ, образование коллоидов, коррозия, электродные процессы и хроматография.
Химическая кинетика — изучение скоростей химических реакций, факторов, влияющих на эти скорости, и механизма, по которому протекают реакции.

Квантовая химия — математическое описание движения и взаимодействия субатомных частиц. Он включает в себя квантование энергии, корпускулярно-волновой дуализм, принцип неопределенности и их связь с химическими процессами.
Спектроскопия — использование поглощения, испускания или рассеяния электромагнитного излучения веществом для изучения вещества или химических процессов, которым оно подвергается.
БИОХИМИЯ
Биохимия — это изучение химических реакций, происходящих в живых организмах. Он пытается объяснить их химическими терминами.
Биохимические исследования включают рак и биологию стволовых клеток, инфекционные заболевания, клеточные мембраны и структурную биологию.
Он охватывает молекулярную биологию, генетику, биохимическую фармакологию, клиническую биохимию и сельскохозяйственную биохимию.
Молекулярная биология — изучение взаимодействий между различными системами клетки, такими как различные типы ДНК, РНК и биосинтез белков.

Генетика — изучение генов, наследственности и изменчивости живых организмов.
Фармакология — изучение механизмов действия лекарств и влияния лекарств на организм.
o Токсикология — подраздел фармакологии, изучающий действие ядов на живые организмы.Клиническая биохимия — изучение изменений, вызываемых болезнью, в химическом составе и биохимических процессах организма.
Сельскохозяйственная биохимия — изучение химии растений, животных и микроорганизмов.
Таким образом, хотя есть ПЯТЬ основных разделов химии, есть много подотраслей.
Между химией и биологией, медициной, физикой, геологией и многими другими дисциплинами много общего.
Химия действительно ЦЕНТРАЛЬНАЯ НАУКА .
Краткая история химической войны
Знай свою химическую войну во время Первой мировой войны
Три вещества были причиной большинства ранений и смертей от химического оружия во время Первой мировой войны: хлор, фосген и горчичный газ.
Газообразный хлор , использованный в печально известный день 22, 19 апреля15, производит зеленовато-желтое облако, которое пахнет хлоркой и немедленно раздражает глаза, нос, легкие и горло тех, кто подвергается воздействию. В достаточно высоких дозах он убивает от удушья.
Фосген , который пахнет заплесневелым сеном, также является раздражителем, но в шесть раз более смертоносным, чем газообразный хлор. Фосген также является гораздо более незаметным оружием: он бесцветный, и солдаты сначала не знали, что получили смертельную дозу. Через день или два легкие жертв заполнялись жидкостью, и они медленно задыхались в мучительной смерти. Хотя немцы первыми применили фосген на поле боя, он стал основным химическим оружием союзников. Фосген стал причиной 85 % смертей от применения химического оружия во время Первой мировой войны9.0003
Горчичный газ , сильнодействующее вещество, вызывающее образование волдырей, получил прозвище Король боевых газов.
Как и фосген, его действие не является немедленным. имеет сильный запах; некоторые говорят, что от него пахнет чесноком, бензином, резиной или дохлыми лошадьми. Через несколько часов после воздействия глаза жертвы наливаются кровью, начинают слезиться и становятся все более болезненными, при этом некоторые жертвы временно теряют зрение. Хуже того, кожа начинает покрываться волдырями, особенно во влажных местах, таких как подмышки и гениталии. Когда волдыри лопаются, они часто инфицируются. Горчичный газ также мог загрязнить землю, где он был развернут. Воздействие на сенсибилизированных жертв; дальнейшее воздействие даже в более низких дозах вызывало симптомы. Горчичный газ вызвал наибольшее число жертв от химического оружия – по некоторым оценкам, более 120 000 человек, – но он вызвал несколько прямых смертей, потому что открытый воздух поля боя поддерживал концентрации ниже смертельного порога.
Хронология
С самого начала войны люди искали новые способы убивать друг друга. Вот некоторые примечательные моменты ведения химической войны на протяжении веков.
Вот некоторые примечательные моменты ведения химической войны на протяжении веков.
600 г. до н.э.
г.Афинские военные заражают водоснабжение осажденного города Кирра ядовитыми растениями морозника.
479 г. до н.э.
г.Войска Пелопоннеса используют дымы серы против города Платеи.
1675
Франция и Германия подписывают Страсбургское соглашение, первое международное соглашение о запрещении химического оружия, в данном случае запрещающее использование отравленных пуль.
1845
Во время французского завоевания Алжира французские войска загоняют более 1000 членов берберского племени в пещеру, а затем убивают их дымом.
1861–1865
Во время Гражданской войны в США гражданские лица и солдаты обеих сторон предлагают использовать химическое оружие. Среди множества нереализованных идей школьный учитель из Нью-Йорка Джон Даути рекомендует стрелять снарядами с газообразным хлором по войскам Конфедерации, а солдат Конфедерации Ишам Уокер предлагает сбрасывать канистры с ядовитым газом с воздушных шаров.
1874–1907
Ряд международных договоров, подписанных большинством западных стран, запрещает использование яда и отравляющего оружия на войне.
1914
Август
В течение первого месяца Первой мировой войны французы применили гранаты со слезоточивым газом, впервые разработанные в 1912 году для использования полицией.Октябрь
Немецкие войска выпустили 3000 снарядов, содержащих дианизидинхлорсульфат, раздражающее легкие, по британской армии в Нев-Шапель. Британцы не знают, что они подверглись химической атаке, потому что химическое вещество испепелено зарядом взрывчатого вещества.
1915
Январь
Немцы выпустили 18 000 снарядов, снаряженных раздражающим ксилибромидом, по русским войскам в Болинове. Русские не пострадали, потому что сильный холод не дает жидкости испариться.22 апреля
Немецкие военные начали первое широкомасштабное применение химического оружия в войне в Ипре, Бельгия.Почти 170 метрических тонн газообразного хлора в 5730 баллонах захоронены на четырехмильном участке фронта. В результате теракта погибло более 1100 человек, 7000 получили ранения.
25 сентября
Британские военные впервые применили химическое оружие против немцев в битве при Лоосе. Они выпускают газообразный хлор из баллонов.19 декабря
За шесть дней до Рождества немцы впервые применили фосген против войск союзников. Более 1000 британских солдат ранены, 120 погибли.
1917
12 июля
Немецкие войска впервые применили горчичный газ; это приводит к более чем 2100 жертвам. В течение первых трех недель применения горчичного газа потери союзников равны прошлогодним потерям от применения химического оружия.
1918
Май
Исследование горчичного газа в США перемещается из лаборатории Американского университета в Мэриленде на сайт под названием Edgewood Arsenal, находящийся в ведении недавно созданной Службы химического оружия.Вскоре 10% американских артиллерийских снарядов содержат химическое оружие.
Июнь
Союзники начинают использовать горчичный газ против немецких войск.13–14 октября
Молодой Адольф Гитлер, рядовой посыльный в окопах Вервика близ Ипра, временно ослеп во время газовой атаки. Гитлера эвакуируют в военный госпиталь на востоке Германии, и остаток войны он выздоравливает.11 ноября
Первая мировая война закончилась 1,3 миллионами жертв от химического оружия, в том числе от 90 000 до 100 000 погибших, в основном от фосгена.
1925
Женевский протокол принят Лигой Наций. Договор запрещает использование химических и биологических агентов на войне, но не запрещает разработку, производство или накопление такого оружия. Многие страны подписывают договор с оговорками, позволяющими им ответить тем же в случае нападения с применением химического оружия.
1935–1936
Бенито Муссолини сбрасывает бомбы с горчичным газом в Эфиопии, чтобы уничтожить армию императора Хайле Селассие.
Несмотря на то, что Италия подписала Женевский протокол, Лига Наций не прекращает использование химического оружия.
1936
Немецкий химик Герхард Шрадер завершает синтез и очистку табуна, сильнодействующего нервно-паралитического яда. Его намерение состоит в том, чтобы создать пестицид, а не химическое оружие. Химическое вещество, которое он создает, настолько мощное, что армейские исследователи называют его табу, или табу на немецком языке, от которого оно и получило свое название.
1939–1945
Во время Второй мировой войны ядовитые газы использовались в нацистских концлагерях для уничтожения мирных жителей и японской армией в Азии. Нацисты хранят запасы нервно-паралитических веществ, но химическое оружие не используется на европейских полях сражений.
1943
Нацисты заставляют узников концлагеря Дихернфурт производить табуны. Рабочим часто отказывают в медицинской помощи при воздействии смертельных доз яда.
1953
Британский военнослужащий Рональд Мэддисон умирает от отравления зарином после целенаправленного воздействия токсина на военном объекте Портон-Даун.
1961–1971
Соединенные Штаты используют напалм и гербицид Agent Orange во время войны во Вьетнаме, что вызвало национальный и международный протест.
1963–1967
Египет использует горчичный газ и нервно-паралитическое вещество в Йемене для поддержки государственного переворота против йеменской монархии.
1972
Принятие Конвенции о биологическом и токсинном оружии завершено. В сочетании с Женевским протоколом 1925 года новое соглашение запрещает разработку, производство и хранение биологического оружия. Соглашение не имеет механизма для обеспечения соблюдения.
1980-е
Во время ирано-иракской войны Ирак применяет химическое оружие, в том числе табун, против Ирана и курдского меньшинства Ирака.
Эксперты ООН подтверждают факт применения Ираком химического оружия, но международное сообщество не вызывает возмущения. Иран в ответ запускает собственную программу химического оружия.
1993
Подписана Конвенция о химическом оружии. Начиная с 1997 года соглашение о разоружении запрещает разработку, производство, накопление и применение химического оружия.
2013
Сирийские военные применяют газ зарин против мирных жителей во время гражданской войны в Сирии; сотни убиты. Правительство Башара Асада отказывается от своего арсенала химического оружия после угроз авиаударов США.
Фриц Хабер, Жизнь и смерть
Ранним вечером 22 апреля 1915 года зеленовато-желтый туман окутал окопы близ Ипра, Бельгия, наводя ужас и удушая на неподготовленные французские войска. Этот первый акт химической войны планировался в течение нескольких месяцев и осуществлялся многими людьми: только для установки почти 6000 газовых баллонов потребовалось множество немецких рук.
И все же Фриц Габер — и только он один — человек, которого мы больше всего отождествляем с этим оружием, и это правильно. Хотя многие изобретали, разрабатывали или применяли химическое оружие на протяжении всей истории, Габер использовал свой значительный интеллект для милитаризации химии в Первой мировой войне; в апреле 1915 мая в Ипре он стал свидетелем первых плодов этого труда, первого крупномасштабного применения химического оружия в современной войне. Он оставался неизменным представителем такого оружия, до самой своей смерти в 1934 году утверждая, что это более гуманный вид оружия, чем современная артиллерия.
После Первой мировой войны союзники объявили Хабера военным преступником за его работу, и он ненадолго затаился в Швейцарии, пока его имя не было вычеркнуто из списка разыскиваемых. Габер продолжал исследовать и продвигать химическое оружие после войны. Как описывает Дитрих Столценберг в своей подробной биографии этого человека, после Первой мировой войны Габер помог улучшить одностадийный процесс производства горчичного газа; помог России в разработке ее первого завода по производству химического оружия, порекомендовав коллегу русским эмиссарам, ищущим совета; и до 1933 помогал немецким военным в их секретной программе создания химического оружия и исследований, что прямо противоречило мирному договору, подписанному в 1919 году. Его открытие реакции Габера-Боша лежит в основе зеленой революции: получившая Нобелевскую премию стратегия синтеза аммиака проложила путь к недорогим удобрениям, которые принесли огромную пользу сельскому хозяйству. Он также помог заложить основы электрохимии и физической химии 20-го века.
Его открытие реакции Габера-Боша лежит в основе зеленой революции: получившая Нобелевскую премию стратегия синтеза аммиака проложила путь к недорогим удобрениям, которые принесли огромную пользу сельскому хозяйству. Он также помог заложить основы электрохимии и физической химии 20-го века.
Научные достижения Габера с двуликим Янусом нашли отражение в его личных отношениях. Для некоторых он был большим другом. По словам одного из его ближайших доверенных лиц, химика и лауреата Нобелевской премии Рихарда Вильштеттера, Габер был верным, преданным и интересным человеком. «Самыми красивыми были путешествия, которые я совершил с Фрицем Габером, — писал Вильштеттер в своих мемуарах. «Это были часы дружбы, в течение которых я узнал и понял его индивидуальность, его благородный ум, доброту сердца, богатство идей и его безграничное, экстравагантное стремление». Габер также поддерживал тесные связи с Альбертом Эйнштейном, несмотря на их огромные различия во мнениях обо всем, от немецкой политики и национальной гордости до этики применения химического оружия. Во время своих путешествий он писал открытки Эйнштейна в стихах, как и для многих своих близких друзей, которые часто были юмористическими, ироничными или и тем, и другим.
Во время своих путешествий он писал открытки Эйнштейна в стихах, как и для многих своих близких друзей, которые часто были юмористическими, ироничными или и тем, и другим.
Однако сильное эго Хабера привело к двум неудачным бракам и непростым семейным отношениям. Второй брак Хабера с Шарлоттой Натан закончился разводом; его первая, Клара Иммервар, закончилась, когда она покончила жизнь самоубийством. Их сын Германн обнаружил свою мать в луже ее собственной крови, но вскоре после этого Габер оставил мальчика на восточном фронте, чтобы помочь развернуть изобретенное им химическое оружие. Таким образом, Габер часто ставил свое интеллектуальное потомство выше своего биологического потомства. Возможно, неудивительно, что, по словам историка Уте Дайхманн, годы спустя Германн и его жена отклонили приглашение посетить научный мемориал Габера. В письме жена Германна заметила: «Никто не имеет права прославлять человека мертвых , которых сегодня не потерпят живыми ».
Неудачи Хабера как семьянина могли быть связаны с его собственным трудным детством и плохим отцом. Как отмечает Столценберг, мать Габера умерла при родах, а отец обвинил сына в потере новой невесты. Отношения отца и сына так и не восстановились. Несмотря на склонность Габера к науке, его отец не одобрял «химические игры» сына и хотел, чтобы он присоединился к семейному бизнесу по торговле красителями. Хабер подчинился, но они просто не могли ужиться. В конце концов Габер освободился от влияния своего властного отца и позволил осуществить свою мечту.
Как отмечает Столценберг, мать Габера умерла при родах, а отец обвинил сына в потере новой невесты. Отношения отца и сына так и не восстановились. Несмотря на склонность Габера к науке, его отец не одобрял «химические игры» сына и хотел, чтобы он присоединился к семейному бизнесу по торговле красителями. Хабер подчинился, но они просто не могли ужиться. В конце концов Габер освободился от влияния своего властного отца и позволил осуществить свою мечту.
Жизнь Хабера оборвалась жестоко. Он глубоко идентифицировал себя как немец и использовал свои навыки и интеллект, чтобы принести пользу своей стране в войне и в мирное время. Его Нобелевская премия принесла ему известность, и он гордился своим статусом героя войны. Тем не менее к концу его жизни его страна считала его не более чем ненужным евреем, хотя Габер обратился в христианство в молодости.
В 1933 году Гитлер приказал убрать евреев с государственных должностей. После попытки помочь многим своим коллегам-евреям, но безуспешно, Габер ушел с поста основателя Института физической химии и электрохимии кайзера Вильгельма. Он провел последний год своей жизни, скитаясь по Европе с разбитым сердцем — и в прямом, и в переносном смысле. Он умер в Базеле в 1934 года, инфаркт.
Он провел последний год своей жизни, скитаясь по Европе с разбитым сердцем — и в прямом, и в переносном смысле. Он умер в Базеле в 1934 года, инфаркт.
Ужасная изобретательность
Немецкий солдат с тревожной историей был захвачен союзными войсками в Тунисе 11 мая 1943 года. Он сказал британским следователям, что он химик, живущий далеко от берлинской лаборатории, где он работал над новым химическое оружие с «поразительными свойствами». Яд был бесцветным и почти без запаха и мог удушить своих жертв менее чем за 15 минут — история, которая звучала прямо из криминального романа. Но следователи поверили этой истории и отправили секретный 10-страничный отчет британской военной разведке, отмечает Джонатан Такер в Война нервов: химическая война от Первой мировой войны до Аль-Каиды . Тем не менее представители британской разведки усомнились в правдивости сообщения и ничего не предприняли — ошибка, которая могла иметь смертельные последствия для союзников во Второй мировой войне.
Мало того, что немцы открыли новое семейство химического оружия — нервно-паралитические отравляющие вещества, называемые табуном, зарином и зоманом, — которые были гораздо более мощными, чем все, что было в распоряжении союзников; Гитлер уже был близок к тому, чтобы одобрить их использование против союзных войск после поражения немецкой армии под Сталинградом зимой 1919 года.43. Нацисты также переоборудовали исправительно-трудовой лагерь Дихернфурт на территории современной Польши для производства тысяч метрических тонн табуна.
Хотя многие высокопоставленные армейские офицеры поощряли Гитлера к развертыванию своего нового мощного химического оружия, он колебался, вероятно, по двум причинам. Во-первых, став жертвой отравления газом во время Первой мировой войны, Гитлер воздерживался от применения химических ядов против солдат, хотя он без колебаний применял яды к узникам концлагерей. Во-вторых, немецкая военная разведка не была уверена, что союзники также обнаружили нервно-паралитические вещества, поскольку некоторые фундаментальные исследования были проведены в Англии. Любое возмездие союзников немецкому гражданскому населению могло иметь катастрофические последствия. Президент Франклин Д. Рузвельт сказал 19 июня43, что «за любым применением газа какой-либо державой Оси немедленно последует самый полный возможный ответный удар по центрам вооружений, морским портам и другим военным объектам на всей территории такой страны Оси».
Любое возмездие союзников немецкому гражданскому населению могло иметь катастрофические последствия. Президент Франклин Д. Рузвельт сказал 19 июня43, что «за любым применением газа какой-либо державой Оси немедленно последует самый полный возможный ответный удар по центрам вооружений, морским портам и другим военным объектам на всей территории такой страны Оси».
Однако немцы переоценили возможности союзников: в их распоряжении не было нервно-паралитических ядов. Немцы приобрели новое семейство химического оружия только по счастливой случайности. В 1936 году химик Герхард Шредер впервые синтезировал табун в немецкой химической компании IG Farben. Он стремился создать инсектицид, который позволил бы Германии увеличить производство продуктов питания. Но после того, как Шредер чуть не отравил себя и своих коллег по лаборатории простыми каплями своего недавно синтезированного инсектицида, компания поняла, что табун лучше подходит для военных применений, и передала открытие немецким военным исследователям. Шредер испытывал раздражение глаз, зрачки сужались до точек, которые затемняли окружающий мир, насморк и одышка. К счастью для него, он избежал следующей стадии отравления нервно-паралитическим веществом: интенсивного потоотделения, спазмов желудка, подергивания мышц, потери сознания и удушья.
Шредер испытывал раздражение глаз, зрачки сужались до точек, которые затемняли окружающий мир, насморк и одышка. К счастью для него, он избежал следующей стадии отравления нервно-паралитическим веществом: интенсивного потоотделения, спазмов желудка, подергивания мышц, потери сознания и удушья.
К 1943 году группа немецких военных ученых, занимающихся разработкой табуна, также разработала другое нервно-паралитическое вещество под названием зарин, которое было в шесть раз более мощным, чем табун. Немецкий лауреат Нобелевской премии Рихард Кун был призван помочь понять, почему новые яды были такими смертельными. Вскоре он обнаружил, что эти нервно-паралитические агенты влияют на важнейший фермент, холинэстеразу. В процессе Кун также обнаружил третье нервно-паралитическое вещество: зоман.
Когда нацисты расширили производство табуна в Дихернфурте, они использовали 20 узников лагеря в качестве подопытных в экспериментах с нервно-паралитическими веществами; четверть из них умерла в мучениях. Заключенных Дихернфурта также заставляли путешествовать вместе с поездами с нервно-паралитическими отравляющими веществами, которые эффективно использовались в качестве человеческих канареек для обнаружения утечек ядовитого газа. В конце войны, после двух с половиной лет производства, завод в Дихернфурте произвел почти 12 000 метрических тонн табуна. Около 10 000 тонн было загружено в бомбы для люфтваффе, а еще 2 000 тонн — в артиллерийские снаряды. Тем временем Такер пишет, что сотни подневольных рабочих, работавших в Дихернфурте, «умерли от истощения, недоедания и токсического воздействия».
Заключенных Дихернфурта также заставляли путешествовать вместе с поездами с нервно-паралитическими отравляющими веществами, которые эффективно использовались в качестве человеческих канареек для обнаружения утечек ядовитого газа. В конце войны, после двух с половиной лет производства, завод в Дихернфурте произвел почти 12 000 метрических тонн табуна. Около 10 000 тонн было загружено в бомбы для люфтваффе, а еще 2 000 тонн — в артиллерийские снаряды. Тем временем Такер пишет, что сотни подневольных рабочих, работавших в Дихернфурте, «умерли от истощения, недоедания и токсического воздействия».
В феврале 1945 года, когда русские шли к Берлину, нацисты быстро покинули фабрику в Дихернфурте. Сотни подневольных рабочих были переведены пешком и в открытых фургонах в другой концлагерь, Маутхаузен. Две трети из них умерли от воздействия низких температур. Гестапо выследило выживших в Маутхаузене и убило их, чтобы избавиться от свидетелей.
Отчаявшись помешать Красной Армии захватить ноу-хау по производству нервно-паралитических отравляющих веществ, Люфтваффе безуспешно пытались уничтожить завод в Дихернфурте с воздуха. Советы обнаружили завод по производству табуна и опытный завод по производству зарина и увезли оборудование завода домой. Британские и американские военные запаниковали, когда узнали о существовании этих нервно-паралитических веществ и о том, что русские захватили целую фабрику по производству табунов. Они выследили немецких ученых, знакомых с производством нервно-паралитических веществ, и использовали их ноу-хау для создания и создания запасов этого нового оружия. Так началась гонка химических вооружений, которая на протяжении десятилетий будет параллельна гонке ядерных вооружений.
Советы обнаружили завод по производству табуна и опытный завод по производству зарина и увезли оборудование завода домой. Британские и американские военные запаниковали, когда узнали о существовании этих нервно-паралитических веществ и о том, что русские захватили целую фабрику по производству табунов. Они выследили немецких ученых, знакомых с производством нервно-паралитических веществ, и использовали их ноу-хау для создания и создания запасов этого нового оружия. Так началась гонка химических вооружений, которая на протяжении десятилетий будет параллельна гонке ядерных вооружений.
Темная сторона британских исследований химического оружия
Я считаю маловероятным, что какой-либо человек в здравом уме вызвался бы на такой эксперимент.
— Ульф Шмидт, исторический эксперт, назначенный на общественное расследование смерти Рональда Мэддисона в 1953 году
6 мая 1953 года Рональд Мэддисон, 20-летний британский солдат, согласился участвовать в медицинском эксперименте в военно-исследовательском центре Портон-Даун. Обещанная компенсация была заманчивой: пропуск на три дня и 15 шиллингов, на которые Мэддисон хотел купить обручальное кольцо для своей девушки. Но официальные лица Портон-Дауна не сообщили, что намеревались использовать его в качестве подопытного кролика для изучения действия смертельного нервно-паралитического вещества зарина.
Обещанная компенсация была заманчивой: пропуск на три дня и 15 шиллингов, на которые Мэддисон хотел купить обручальное кольцо для своей девушки. Но официальные лица Портон-Дауна не сообщили, что намеревались использовать его в качестве подопытного кролика для изучения действия смертельного нервно-паралитического вещества зарина.
Ученые поместили 200 миллиграммов чистого зарина на кусок фланели, прикрепленный к левому предплечью Мэддисона. Через полчаса Мэддисон весь вспотел и потерял слух; затем он потерял сознание. В этот момент ученые ввели ему атропин, лекарство от нервно-паралитических веществ, и отвезли его в больницу; но Мэддисон вскоре перестал дышать и был объявлен мертвым. Чиновники на самом высоком уровне поспешили скрыть смерть. Согласно расследованию, проведенному несколько десятилетий спустя, министр внутренних дел сообщил коронеру, что «следствие должно быть проведено в закрытом режиме [то есть в частном порядке] по соображениям национальной безопасности. Не подлежит публикации».
Мэддисон был лишь одним из тысяч людей, задействованных в экспериментах с химическим оружием в Портон-Дауне. Объект был основан британскими военными в сентябре 1915 года, всего через несколько месяцев после внезапной атаки с отравляющим газом в Ипре. Построенный на 3000 акрах сельской местности примерно в 85 милях к юго-западу от Лондона, Портон-Даун был предназначен для испытаний и исследований химического оружия. Ученые из Портон-Дауна, отчаянно пытаясь догнать своих немецких коллег, исследовали 200 веществ во время Первой мировой войны. Многие из этих экспериментов проводились на живых существах, включая собак, коз и людей.
По современным меркам испытания кажутся абсурдно безответственными: они часто проводились на открытом воздухе, и, учитывая природу газов, токсичные химические вещества имели тенденцию проникать за пределы объекта в жилые районы, отмечает Роб Эванс, автор книги Gassed . Другой тест требовал, чтобы быстроногий бегун по пересеченной местности стоял в поле рядом с облаком мышьякового дыма. Его работа заключалась в том, чтобы понюхать силу облака и, когда ветер меняет направление, бежать за облаком и опережать его.
Его работа заключалась в том, чтобы понюхать силу облака и, когда ветер меняет направление, бежать за облаком и опережать его.
Имеющиеся данные свидетельствуют о том, что многие люди были протестированы без согласия или без полного понимания того, что было вовлечено в испытания в Портон-Дауне. Генерал-майор Чарльз Ховард Фоулкс, командующий в Портон-Дауне, писал, что в первые шесть месяцев существования военной базы «испытывались самые большие трудности с набором достаточного количества людей для проведения экспериментальных работ». Эванс отмечает, что поваров, санитаров и клерков отвлекли от их обычной работы для участия в экспериментах.
К концу Первой мировой войны Великобритания изучила воздействие на человека 96 соединений. Но окончание войны не положило конец использованию человеческих морских свинок. Вместо этого их число быстро увеличивалось. В течение 1950-х годов более 18 000 человек — в основном солдаты, которых в официальных отчетах часто называют санированным эвфемизмом «наблюдатель», — подверглись воздействию широкого спектра проверенных и перспективных видов химического оружия, а также психоактивных препаратов. От этих испытуемых часто скрывали характер и риск экспериментов.
От этих испытуемых часто скрывали характер и риск экспериментов.
В 1970 году засекреченные записи Портон-Дауна начали выходить на свет. Мэддисон – единственная известная смерть, но многие подопытные люди страдали проблемами со здоровьем после воздействия либо сразу (например, впадая в кому), либо спустя годы (у субъектов был более высокий уровень рака). В 2004 году присяжные публичного расследования дела Мэддисона сочли, что молодой человек был «незаконно убит» в Портон-Даун. Спустя более полувека после его смерти семья Мэддисона получила компенсацию в размере 100 000 фунтов стерлингов.
«Смерть Мэддисона была ожидаемым несчастным случаем, произошедшим в результате неадекватного уровня раскрытия информации и занижения рисков, несмотря на то, что в Соединенном Королевстве был широко распространен консенсус в отношении того, что принципы Нюрнбергского кодекса должны регулировать такие типы экспериментов. », — отмечает Ульф Шмидт, исторический эксперт, назначенный для расследования.

 Смит
Йошино Акира
Грегори П. Винтер
Бенджамин Лист
М. Стэнли Уиттингем
Смит
Йошино Акира
Грегори П. Винтер
Бенджамин Лист
М. Стэнли Уиттингем Назовите все элементы в этом соединении.
Назовите все элементы в этом соединении. Большинство химических веществ, обнаруженных во всех живых организмах, основаны на углероде.
Большинство химических веществ, обнаруженных во всех живых организмах, основаны на углероде.





 Соответствуют ли эти данные закону кратных пропорций?
Соответствуют ли эти данные закону кратных пропорций? Согласуются ли такие реакции с гипотезами Дальтона? Почему или почему нет?
Согласуются ли такие реакции с гипотезами Дальтона? Почему или почему нет? Соответствует ли это закону кратных пропорций? Поясните свой ответ.
Соответствует ли это закону кратных пропорций? Поясните свой ответ.






 Как и фосген, его действие не является немедленным. имеет сильный запах; некоторые говорят, что от него пахнет чесноком, бензином, резиной или дохлыми лошадьми. Через несколько часов после воздействия глаза жертвы наливаются кровью, начинают слезиться и становятся все более болезненными, при этом некоторые жертвы временно теряют зрение. Хуже того, кожа начинает покрываться волдырями, особенно во влажных местах, таких как подмышки и гениталии. Когда волдыри лопаются, они часто инфицируются. Горчичный газ также мог загрязнить землю, где он был развернут. Воздействие на сенсибилизированных жертв; дальнейшее воздействие даже в более низких дозах вызывало симптомы. Горчичный газ вызвал наибольшее число жертв от химического оружия – по некоторым оценкам, более 120 000 человек, – но он вызвал несколько прямых смертей, потому что открытый воздух поля боя поддерживал концентрации ниже смертельного порога.
Как и фосген, его действие не является немедленным. имеет сильный запах; некоторые говорят, что от него пахнет чесноком, бензином, резиной или дохлыми лошадьми. Через несколько часов после воздействия глаза жертвы наливаются кровью, начинают слезиться и становятся все более болезненными, при этом некоторые жертвы временно теряют зрение. Хуже того, кожа начинает покрываться волдырями, особенно во влажных местах, таких как подмышки и гениталии. Когда волдыри лопаются, они часто инфицируются. Горчичный газ также мог загрязнить землю, где он был развернут. Воздействие на сенсибилизированных жертв; дальнейшее воздействие даже в более низких дозах вызывало симптомы. Горчичный газ вызвал наибольшее число жертв от химического оружия – по некоторым оценкам, более 120 000 человек, – но он вызвал несколько прямых смертей, потому что открытый воздух поля боя поддерживал концентрации ниже смертельного порога.
 Почти 170 метрических тонн газообразного хлора в 5730 баллонах захоронены на четырехмильном участке фронта. В результате теракта погибло более 1100 человек, 7000 получили ранения.
Почти 170 метрических тонн газообразного хлора в 5730 баллонах захоронены на четырехмильном участке фронта. В результате теракта погибло более 1100 человек, 7000 получили ранения. Вскоре 10% американских артиллерийских снарядов содержат химическое оружие.
Вскоре 10% американских артиллерийских снарядов содержат химическое оружие. Несмотря на то, что Италия подписала Женевский протокол, Лига Наций не прекращает использование химического оружия.
Несмотря на то, что Италия подписала Женевский протокол, Лига Наций не прекращает использование химического оружия.
 Эксперты ООН подтверждают факт применения Ираком химического оружия, но международное сообщество не вызывает возмущения. Иран в ответ запускает собственную программу химического оружия.
Эксперты ООН подтверждают факт применения Ираком химического оружия, но международное сообщество не вызывает возмущения. Иран в ответ запускает собственную программу химического оружия.