Карта сайта
Главная Обучение Библиотека Карта сайта
|
Органическая, биологическая и физколлоидная химия
Министерство образования и науки РФ
Государственное образовательное учреждение
высшего профессионального образования
«Хакасский
государственный университет имени Н. Ф. Катанова»
Ф. Катанова»
учебно-методический комплекс по дисциплине
конспект лекций
Часть I. Строение органических соединений
Абакан
2010
Издается по рекомендации Методического Совета
и по решению Редакционно-издательского совета
Хакасского государственного университета им. Н. Ф. Катанова
Рецензенты:
Ефремова И. Е., доктор химических наук, профессор кафедры органической химии Российского государственного педагогического университета им. А. И. Герцена.
Скрябина О. С., кандидат педагогических наук, доцент кафедры химии ХГУ им. Н. Ф. Катанова.
Органическая,
биологическая и физколлоидная химия:
учебно-методический комплекс по
дисциплине. Конспект лекций. Часть I.
Строение органических соединений /
сост. Бортников С. В. – Абакан: Издательство
Хакасского государственного университета
им. Н.Ф.Катанова, 2010.
Н.Ф.Катанова, 2010.
В данном УМКД представлен конспект лекций по биоорганической химии, раскрывающем особенности строения органических соединений. Сборник включает пять лекций по основным разделам биоорганической химии и предназначен для студентов, обучающихся по специальности 111201 – Ветеринария.
Пособие предназначено также для использования в учебной работе со студентами других специальностей, изучающих курс органической и биоорганической химии.
© Хакасский Государственный Университет им. Н. Ф. Катанова, 2010
© Бортников С. В., составление, 2010
Оглавление
ОГЛАВЛЕНИЕ 3
ПРЕДИСЛОВИЕ 4
Лекция 1. Предмет и задачи биоорганической химии 5
Лекция 2. Изомерия органических соединений 8
Лекция 3. Химическая связь в органических соединениях 18
Лекция 4. Концепция электронных смещений 21
Лекция 5. Методы исследования органических соединений 24
ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ 34
БИБЛИОГРАФИЧЕСКИЙ СПИСОК 36
Предисловие
«Органическая,
биологическая и физколлоидная химия»
является комплексной дисциплиной в
учебном плане специальности высшего
профессионального образования
«111201-Ветеринария» и составляет основу
нового направления в науке. Целью
дисциплины является формирование знаний
о взаимосвязи строения и химических
свойств биологически важных классов
органических соединений, биополимеров
и их структурных компонентов, т.е.
платформы для восприятия биологических
и медицинских знаний на молекулярном
уровне. Конечная цель изучения курса
состоит в формировании системных знаний
о закономерностях в химическом поведении
основных классов органических соединений
во взаимосвязи с особенностями их
строения.
Целью
дисциплины является формирование знаний
о взаимосвязи строения и химических
свойств биологически важных классов
органических соединений, биополимеров
и их структурных компонентов, т.е.
платформы для восприятия биологических
и медицинских знаний на молекулярном
уровне. Конечная цель изучения курса
состоит в формировании системных знаний
о закономерностях в химическом поведении
основных классов органических соединений
во взаимосвязи с особенностями их
строения.
Данный предмет в учебном плане представляет собой довольно объемную дисциплину, включающую самые разные направления химической науки. Представленное пособие является первой частью учебно-методического комплекса по дисциплине – конспект лекций по биоорганической химии, включающий раздел «Особенности строения органических соединений».
При
изучении органической химии основное
внимание необходимо уделять нахождению
соответствия между структурой вещества
и химическим содержанием его превращений.
Органическая химия относится к наукам
с хорошо развитым теоретическим
фундаментом, включающим строгие
представления об электронном, химическом
и пространственном строении веществ и
принципах их реагирования. Основы этого
теоретического фундамента и представлены
в настоящем пособии.
Основы этого
теоретического фундамента и представлены
в настоящем пособии.
Данное пособие может быть использовано студентами и преподавателями биологических, химических, сельскохозяйственных специальностей вузов, медицинских училищ и колледжей.
Настоящее пособие поможет студенту успешно подготовиться к экзаменам, осознанно приобрести необходимые знания и умения, которые помогут при изучении последующих дисциплин и в дальнейшей профессиональной деятельности.
Химический факультет | Токийский научный университет
Целью химического факультета является воспитание человеческих ресурсов, обладающих глубоким пониманием свойств и изменений веществ, обладающих способностью создавать и разрабатывать вещества и энергию, необходимые обществу, а также передовыми знаниями, касающимися глобального явления окружающей среды и жизни, как исследователи и инженеры, занимающиеся широкой областью химии.
| Основной | Имя | Титул | Зона исследований |
|---|---|---|---|
| Неорганическая и аналитическая химия | АКИТСУ Такасиро | Профессор | Физическая неорганическая химия, координационная химия |
| КУДО Акихико | Профессор | Каталитическая химия, неорганическая фотохимия | |
| КОМАБА Шиничи | Профессор | Электрохимия | |
| ТАДОКОРО Макото | Профессор | Супрамолекулярная координационная химия | |
| МИЯМУРА Казуо | Профессор | Координационная химия, аналитическая химия | |
| ЭНОМОТО Масая | Доцент | Физика твердого тела по координационной химии | |
| ХАРАГУТИ Томоюки | Младший доцент | Химия твердого тела, Координационная химия | |
| САДАКИО Масааки | Младший доцент | Химия твердого тела | |
| Органическая химия | КАВАИ Хидетоши | Профессор | Физическая органическая химия, супрамолекулярная химия |
| КАВАСАКИ Цунэоми | Профессор | Асимметричный синтез, хиральная химия | |
| САИТО Шиничи | Профессор | Металлоорганическая химия, химия органических реакций | |
| САТАКЕ Акихару | Профессор | Синтетическая органическая химия, супрамолекулярная химия | |
| ШИИНА Исаму | Профессор | Химия натуральных продуктов, органическая синтетическая химия | |
| СИМОНАКА Мотоюки | Профессор | Молекулярная и клеточная биология | |
| МАЦУДА Таканори | Профессор | Синтетическая химия, Элементарная органическая химия | |
| ЭНДО Кохей | Доцент | Химия молекулярных катализаторов, Металлоорганическая химия | |
| КИМУРА Цутому | Доцент | Органическая химия | |
| Физическая химия | Оцука Хиденори | Профессор | Межфазная/коллоидная химия, химия биополимеров |
| САСАКИ Такео | Профессор | Жидкие кристаллы, химия макромолекул | |
| ЦУКИЯМА Коити | Профессор | Лазерная спектроскопия, квантовая химия | |
| ТОРИГОЕ Хидэтака | Профессор | Биофизическая химия, структурная биология | |
| НЭГИСИ Юичи | Профессор | Химия наноматериалов, Кластерная химия | |
| ФУРУМИ Сэйити | Профессор | Химия органических материалов, химия наноматериалов | |
| Юи Хирохару | Профессор | Лазерная спектроскопия, химия растворов | |
| АОКИ Кеничи | Доцент | Самособирающиеся и многофункциональные полимерные материалы | |
| НАКА Юмико | Доцент | Химия полимеров, жидкокристаллическая химия | |
| ЮАСА Дзюнпей | Доцент | Функциональная химия твердого тела | |
| ВАТАНАБЭ Казуо | Доцент | Физическая химия поверхности, фотохимия, плазмоника |
11.
 5 Коллоиды – Химия 2e
5 Коллоиды – Химия 2eЦели обучения
К концу этого раздела вы сможете:
- Описать состав и свойства коллоидных дисперсий
- Перечислите и объясните несколько технологических применений коллоидов
В детстве вы, возможно, делали суспензии, такие как смеси грязи и воды, муки и воды, или суспензию твердых пигментов в воде, известную как темперная краска. Эти суспензии представляют собой гетерогенные смеси, состоящие из относительно крупных видимых (или видимых с помощью увеличительного стекла) частиц. Они мутные, взвешенные частицы оседают после перемешивания. С другой стороны, раствор представляет собой гомогенную смесь, в которой не происходит осаждения и в которой растворенные частицы представляют собой молекулы или ионы. Растворы ведут себя совершенно иначе, чем суспензии. Раствор может быть окрашен, но он прозрачен, молекулы или ионы невидимы и не оседают при стоянии. Другой класс смесей, называемый коллоидами (или коллоидными дисперсиями), обладает промежуточными свойствами между свойствами суспензий и растворов (рис. 11.29).). Частицы в коллоиде крупнее большинства простых молекул; однако коллоидные частицы достаточно малы, чтобы не оседать при стоянии.
11.29).). Частицы в коллоиде крупнее большинства простых молекул; однако коллоидные частицы достаточно малы, чтобы не оседать при стоянии.
Рисунок 11.29 (а) Раствор представляет собой гомогенную смесь, которая кажется прозрачной, например, соленая вода в этом аквариуме. б) в коллоиде, таком как молоко, частицы значительно крупнее, но остаются диспергированными и не оседают. (c) Взвесь, такая как ил, представляет собой гетерогенную смесь взвешенных частиц, которая кажется мутной и в которой частицы могут оседать. (фото a: модификация работы Адама Вимсатта; фото b: модификация работы Мелиссы Визе; фото c кредита: модификация работы Питера Берджесса)
Частицы в коллоиде достаточно велики, чтобы рассеивать свет, явление, называемое эффектом Тиндаля. Это может сделать коллоидные смеси мутными или непрозрачными, как, например, лучи прожектора, показанные на рис. 11.30. Облака представляют собой коллоидные смеси. Они состоят из капель воды, которые намного больше молекул, но достаточно малы, чтобы не оседать.
Рисунок 11.30 Траектории лучей прожекторов становятся видимыми при рассеянии света на частицах коллоидного размера в воздухе (туман, дым и т. д.). (кредит: «Бахман»/Wikimedia Commons)
Термин «коллоид» — от греческих слов kolla , что означает «клей», и eidos , что означает «подобный» — впервые был использован в 1861 году Томасом Грэмом для классификации таких смесей, как крахмал в воде и желатин. Многие коллоидные частицы представляют собой агрегаты из сотен или тысяч молекул, но другие (например, белки и полимерные молекулы) состоят из одной чрезвычайно большой молекулы. Белковые и синтетические полимерные молекулы, образующие коллоиды, могут иметь молекулярную массу от нескольких тысяч до многих миллионов атомных единиц массы.
Аналогично идентификации компонентов раствора как «растворенное вещество» и «растворитель», компоненты коллоида также классифицируются в соответствии с их относительными количествами. Компонент в виде частиц, обычно присутствующий в относительно небольшом количестве, называется дисперсной фазой, а вещество или раствор, в котором диспергированы частицы, называется дисперсионной средой. Коллоиды могут включать практически любую комбинацию физических состояний (газ в жидкости, жидкость в твердом состоянии, твердое тело в газе и т. д.), что иллюстрируется примерами коллоидных систем, приведенными в таблице 11.4.
Компонент в виде частиц, обычно присутствующий в относительно небольшом количестве, называется дисперсной фазой, а вещество или раствор, в котором диспергированы частицы, называется дисперсионной средой. Коллоиды могут включать практически любую комбинацию физических состояний (газ в жидкости, жидкость в твердом состоянии, твердое тело в газе и т. д.), что иллюстрируется примерами коллоидных систем, приведенными в таблице 11.4.
Примеры коллоидных систем
| Дисперсная фаза | Дисперсионная среда | Общие примеры | Имя |
|---|---|---|---|
| сплошной | газ | дым, пыль | — |
| сплошной | жидкость | крахмал в воде, некоторые чернила, краски, магнезиальное молоко | соль |
| сплошной | твердый | некоторые цветные камни, некоторые сплавы | — |
| жидкость | газ | облака, туманы, туманы, брызги | аэрозоль |
| жидкость | жидкость | молоко, майонез, масло | эмульсия |
| жидкость | твердый | желе, гели, жемчуг, опал (H 2 O в SiO 2 ) | гель |
| газ | жидкость | пена, взбитые сливки, взбитые яичные белки | пена |
| газ | твердый | пемза, плавающее мыло | — |
Стол
11. 4
4
Получение коллоидных систем
Коллоиды получают путем получения частиц коллоидных размеров и распределения этих частиц в дисперсионной среде. Частицы коллоидного размера образуются двумя способами:
- Методы диспергирования: разрушение более крупных частиц. Например, красочные пигменты получают путем диспергирования крупных частиц путем измельчения в специальных мельницах.
- Методы конденсации: рост из более мелких единиц, таких как молекулы или ионы. Например, облака образуются, когда молекулы воды конденсируются и образуют очень маленькие капли.
Некоторые твердые вещества при контакте с водой самопроизвольно диспергируются и образуют коллоидные системы. Так ведут себя желатин, клей, крахмал и сухое обезвоженное молоко. Частицы уже имеют коллоидный размер; вода просто рассеивает их. Частицы сухого молока коллоидного размера получают обезвоживанием молочного аэрозоля. Некоторые распылители производят коллоидные дисперсии жидкости в воздухе.
Эмульсия может быть приготовлена путем встряхивания или смешивания двух несмешивающихся жидкостей. Это разбивает одну жидкость на капли коллоидного размера, которые затем рассеиваются по всей другой жидкости. Разливы нефти в океане может быть трудно очистить, отчасти потому, что воздействие волн может привести к тому, что нефть и вода образуют эмульсию. Однако во многих эмульсиях дисперсная фаза склонна коалесцировать, образовывать крупные капли и разделяться. Поэтому эмульсии обычно стабилизируют эмульгатором — веществом, тормозящим коалесценцию дисперсной жидкости. Например, немного мыла стабилизирует эмульсию керосина в воде. Молоко представляет собой эмульсию молочного жира в воде, а протеин казеин служит эмульгирующим агентом. Майонез представляет собой эмульсию масла в уксусе с компонентами яичного желтка в качестве эмульгаторов.
Методы конденсации образуют коллоидные частицы путем агрегации молекул или ионов. Если размер частиц выходит за пределы коллоидного диапазона размеров, образуются капли или осадок, и коллоидная система не образуется.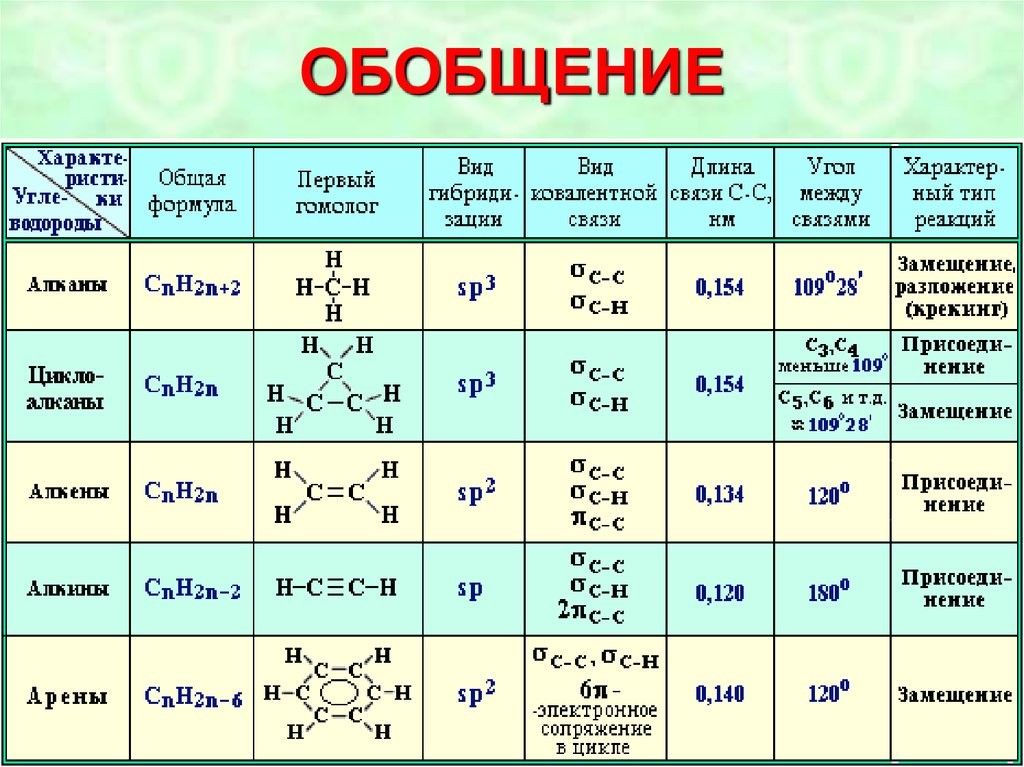 Облака образуются, когда молекулы воды объединяются и образуют частицы размером с коллоид. Если эти частицы воды сливаются, образуя достаточно большие капли жидкой воды или кристаллы твердой воды, они оседают с неба в виде дождя, мокрого снега или снега. Многие методы конденсации включают химические реакции. Красную коллоидную суспензию гидроксида железа (III) можно приготовить, смешав концентрированный раствор хлорида железа (III) с горячей водой:
Облака образуются, когда молекулы воды объединяются и образуют частицы размером с коллоид. Если эти частицы воды сливаются, образуя достаточно большие капли жидкой воды или кристаллы твердой воды, они оседают с неба в виде дождя, мокрого снега или снега. Многие методы конденсации включают химические реакции. Красную коллоидную суспензию гидроксида железа (III) можно приготовить, смешав концентрированный раствор хлорида железа (III) с горячей водой:
Fe3+(водн.)+3Cl-(водн.)+6h3O(ж)⟶Fe(OH)3(т)+h4O+(водн.)+3Cl-(водн.).Fe3+(водн.)+3Cl-(водн.)+6h3O( м)⟶Fe(OH)3(т)+h4O+(водн.)+3Cl-(водн.).
Коллоидный золь золота получается в результате восстановления очень разбавленного раствора хлорида золота (III) восстановителем, таким как формальдегид, хлорид олова (II) или сульфат железа (II):
Au3++3e-⟶AuAu3++3e-⟶Au
Некоторые золи золота, приготовленные в 1857 г., до сих пор не повреждены (частицы не срослись и не осели), что свидетельствует о долговременной стабильности многих коллоидов.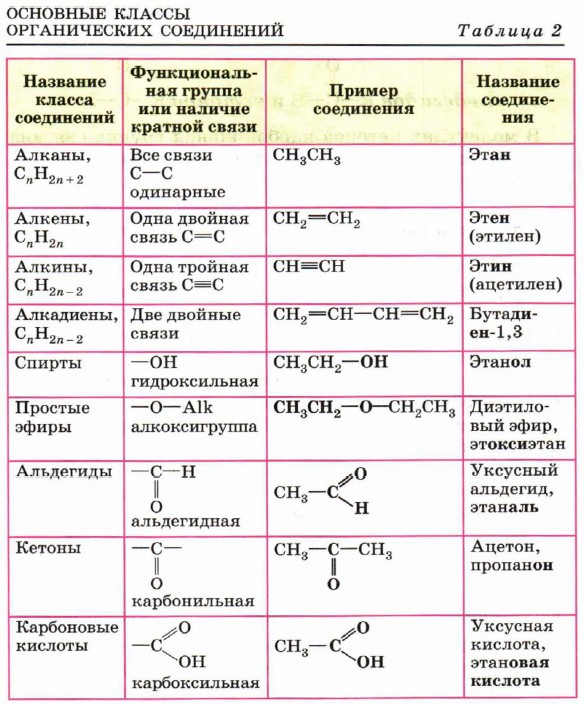
Мыло и моющие средства
Пионеры делали мыло путем кипячения жиров с сильнощелочным раствором, полученным путем выщелачивания карбоната калия, K 2 CO 3 , из древесной золы горячей водой. Животные жиры содержат сложные полиэфиры жирных кислот (длинноцепочечные карбоновые кислоты). Когда животные жиры обрабатываются основанием, таким как карбонат калия или гидроксид натрия, образуются глицерин и соли жирных кислот, таких как пальмитиновая, олеиновая и стеариновая кислоты. Соли жирных кислот называются мыло . Натриевая соль стеариновой кислоты, стеарат натрия, имеет формулу C 17 H 35 CO 2 Na и содержит незаряженную неполярную углеводородную цепь C 17 H 35 — звено и ионный карбоксилат. группа — блок —CO2−CO2− (рис. 11.31).
Рисунок
11.31
Мыла содержат неполярный углеводородный конец (синий) и ионный конец (красный).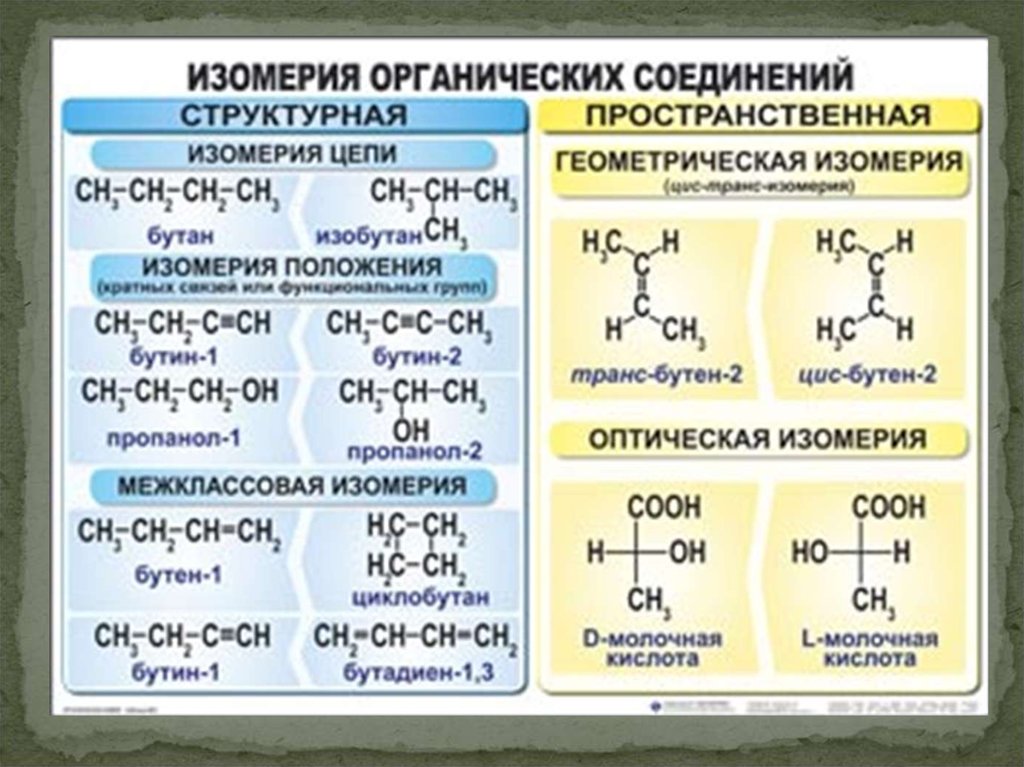 Ионный конец представляет собой карбоксилатную группу. Длина углеводородного конца может варьироваться от мыла к мылу.
Ионный конец представляет собой карбоксилатную группу. Длина углеводородного конца может варьироваться от мыла к мылу.
Моющие средства (заменители мыла) также содержат неполярные углеводородные цепи, такие как C 12 H 25 -, и ионную группу, такую как сульфат – OSO3-, OSO3- или сульфонат – SO3-SO3- (рис. 11.32). Мыла образуют нерастворимые соединения кальция и магния в жесткой воде; детергенты образуют водорастворимые продукты — несомненное преимущество детергентов.
Рисунок 11.32 Моющие средства содержат неполярный углеводородный конец (синий) и ионный конец (красный). Ионный конец может быть либо сульфатным, либо сульфонатным. Длина углеводородного конца может варьироваться от моющего средства к моющему средству.
Очищающее действие мыла и моющих средств можно объяснить с точки зрения структуры вовлеченных молекул. Углеводородный (неполярный) конец молекулы мыла или моющего средства растворяется в неполярных веществах, таких как масло, жир или частицы грязи, или притягивается к ним.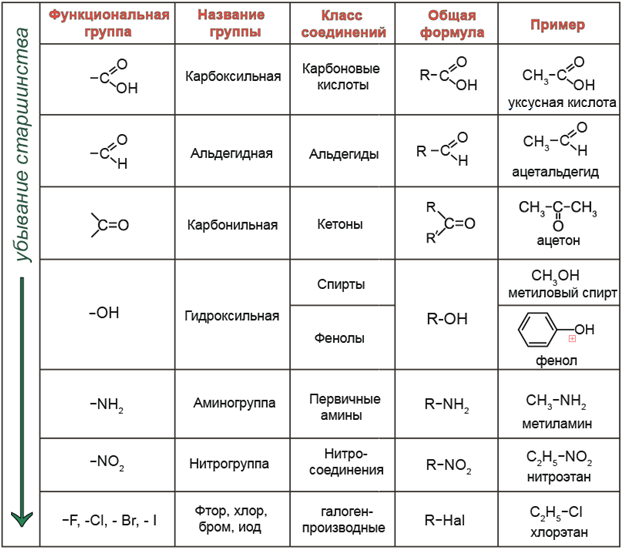 Ионный конец притягивается водой (полярной), как показано на рис. 11.33. В результате молекулы мыла или моющего средства ориентируются на границе раздела между частицами грязи и водой, поэтому они действуют как своего рода мост между двумя разными видами материи, неполярной и полярной. Молекулы, подобные этой, называются амфифильными, поскольку они имеют как гидрофобную («водобоязненную») часть, так и гидрофильную («водолюбивую») часть. Как следствие, частицы грязи становятся взвешенными в виде коллоидных частиц и легко смываются.
Ионный конец притягивается водой (полярной), как показано на рис. 11.33. В результате молекулы мыла или моющего средства ориентируются на границе раздела между частицами грязи и водой, поэтому они действуют как своего рода мост между двумя разными видами материи, неполярной и полярной. Молекулы, подобные этой, называются амфифильными, поскольку они имеют как гидрофобную («водобоязненную») часть, так и гидрофильную («водолюбивую») часть. Как следствие, частицы грязи становятся взвешенными в виде коллоидных частиц и легко смываются.
Рисунок 11.33 На этом схематическом поперечном сечении капли эмульгированного масла в воде показано, как мыло или моющее средство действуют как эмульгатор.
Химия в повседневной жизни
Разлив нефти Deepwater Horizon
Взрыв нефтяной буровой установки Deepwater Horizon 20 апреля 2010 года в Мексиканском заливе близ Миссисипи положил начало крупнейшему морскому разливу нефти в истории нефтяной промышленности. За 87 дней после взрыва из разорвавшейся скважины на глубине 5000 футов ниже поверхности воды вытекло около 4,9 миллиона баррелей (210 миллионов галлонов) нефти. Колодец был окончательно закрыт 19 сентября., 2010.
За 87 дней после взрыва из разорвавшейся скважины на глубине 5000 футов ниже поверхности воды вытекло около 4,9 миллиона баррелей (210 миллионов галлонов) нефти. Колодец был окончательно закрыт 19 сентября., 2010.
Сырая нефть не смешивается с водой и менее плотна, чем вода, поэтому разлитая нефть поднялась на поверхность воды. Плавучие боновые заграждения, скиммеры и управляемые сжигатели использовались для удаления нефти с поверхности воды в попытке защитить пляжи и водно-болотные угодья вдоль побережья Персидского залива. В дополнение к удалению нефти были также предприняты попытки уменьшить ее воздействие на окружающую среду, сделав ее «растворимой» (в широком смысле этого слова) и, таким образом, позволив разбавить ее до, как мы надеемся, менее вредных уровней огромным объемом океана. вода. В этом подходе использовалось 1,84 миллиона галлонов нефтяного диспергатора Corexit 9.527, большая часть которого была введена под воду в месте утечки, а небольшое количество было распылено поверх разлива. Corexit 9527 содержит 2-бутоксиэтанол (C 6 H 14 O 2 ), амфифильную молекулу, полярные и неполярные концы которой используются для эмульгирования масла в мелкие капли, увеличения площади поверхности масла и повышения его доступности. морским бактериям для пищеварения (рис. 11.34). Хотя этот подход позволяет избежать многих непосредственных опасностей, которые наливная нефть представляет для морских и прибрежных экосистем, он вводит возможность долгосрочных последствий в результате попадания сложных и потенциально токсичных компонентов нефти в пищевую цепь океана. Ряд организаций участвует в мониторинге продолжительного воздействия этого разлива нефти, в том числе Национальное управление океанических и атмосферных исследований (дополнительные сведения см. на этом веб-сайте).
Corexit 9527 содержит 2-бутоксиэтанол (C 6 H 14 O 2 ), амфифильную молекулу, полярные и неполярные концы которой используются для эмульгирования масла в мелкие капли, увеличения площади поверхности масла и повышения его доступности. морским бактериям для пищеварения (рис. 11.34). Хотя этот подход позволяет избежать многих непосредственных опасностей, которые наливная нефть представляет для морских и прибрежных экосистем, он вводит возможность долгосрочных последствий в результате попадания сложных и потенциально токсичных компонентов нефти в пищевую цепь океана. Ряд организаций участвует в мониторинге продолжительного воздействия этого разлива нефти, в том числе Национальное управление океанических и атмосферных исследований (дополнительные сведения см. на этом веб-сайте).
Рисунок
11.34
(a) На этом спутниковом снимке НАСА видно нефтяное пятно от разлива Deepwater Horizon. (b) Самолет ВВС США распыляет диспергатор Corexit. (в) Показана молекулярная структура 2-бутоксиэтанола. (кредит a: модификация работы «NASA, FT2, demis.nl»/Wikimedia Commons; кредит b: модификация работы «группы быстрого реагирования NASA/MODIS»/Wikimedia Commons)
(кредит a: модификация работы «NASA, FT2, demis.nl»/Wikimedia Commons; кредит b: модификация работы «группы быстрого реагирования NASA/MODIS»/Wikimedia Commons)
Электрические свойства коллоидных частиц
Рассеянные коллоидные частицы часто имеют электрический заряд. Например, коллоидная частица гидроксида железа (III) не содержит достаточного количества ионов гидроксида, чтобы точно компенсировать положительные заряды ионов железа (III). Таким образом, каждая отдельная коллоидная частица несет положительный заряд, а коллоидная дисперсия состоит из заряженных коллоидных частиц и некоторого количества свободных ионов гидроксида, которые сохраняют электрическую нейтральность дисперсии. Большинство коллоидов гидроксидов металлов имеют положительный заряд, тогда как большинство металлов и сульфидов металлов образуют отрицательно заряженные дисперсии. Все коллоидные частицы в любой системе имеют заряды одного знака. Это помогает сохранять их рассеянными, потому что частицы, содержащие одинаковые заряды, отталкиваются друг от друга.
Заряженная природа некоторых коллоидных частиц может быть использована для их удаления из различных смесей. Например, частицы, составляющие дым, часто коллоидно диспергированы и электрически заряжены. Фредерик Коттрелл, американский химик, разработал процесс удаления этих частиц. Заряженные частицы притягиваются к сильно заряженным электродам, где они нейтрализуются и осаждаются в виде пыли (рис. 11.36). Это один из важных методов, используемых для очистки дыма от различных промышленных процессов. Этот процесс также важен для извлечения ценных продуктов из дыма и колошниковой пыли плавильных печей, печей и печей. Существуют также аналогичные электростатические воздушные фильтры, предназначенные для домашнего использования для улучшения качества воздуха в помещении.
Портрет химика
Фредерик Гарднер Коттрелл
Рисунок
11.35
(а) Фредерик Коттрелл разработал (б) электростатический осадитель, устройство, предназначенное для ограничения загрязнения воздуха путем удаления коллоидных частиц из воздуха. (кредит b: модификация работы «SpLot»/Wikimedia Commons)
(кредит b: модификация работы «SpLot»/Wikimedia Commons)
Родившийся в Окленде, Калифорния, в 1877 году, Фредерик Коттрелл проглатывал учебники, как если бы они были романами, и окончил среднюю школу в возрасте 16 лет. Калифорнийский университет (UC), Беркли, получив степень бакалавра за три года. Он откладывал деньги из своей годовой зарплаты в 1200 долларов в качестве учителя химии в средней школе Окленда, чтобы финансировать свои исследования по химии в Берлине с лауреатом Нобелевской премии Якобусом Хенрикусом ван’т Хоффом и в Лейпциге с Вильгельмом Оствальдом, другим лауреатом Нобелевской премии. Получив докторскую степень по физической химии, он вернулся в Соединенные Штаты, чтобы преподавать в Калифорнийском университете в Беркли. Он также консультировал компанию DuPont, где разработал электростатический осадитель, устройство, предназначенное для ограничения загрязнения воздуха путем удаления коллоидных частиц из воздуха. Коттрелл использовал доходы от своего изобретения для финансирования некоммерческой исследовательской корпорации для финансирования научных исследований.
Рисунок 11.36 В электрофильтре Коттрелла положительно и отрицательно заряженные частицы притягиваются к сильно заряженным электродам, где они нейтрализуются и осаждаются в виде пыли.
Гели
Желатиновые десерты, такие как Jell-O, представляют собой тип коллоида (рис. 11.37). Желатин застывает при охлаждении, потому что горячая водная смесь желатина коагулирует при охлаждении, образуя чрезвычайно вязкое тело, известное как гель. Гель представляет собой коллоидную дисперсию жидкой фазы в твердой фазе. По-видимому, волокна дисперсионной среды образуют сложную трехмерную сеть, пустоты которой заполнены жидкой средой или разбавленным раствором дисперсионной среды.
Рисунок 11.37 Желатиновые десерты представляют собой коллоиды, в которых водный раствор подсластителей и ароматизаторов диспергирован в среде твердых белков. (кредитное фото: модификация работы Стивена Деполо)
Пектин, углевод из фруктовых соков, является гелеобразующим веществом, важным для приготовления желе.

 2.014.01
2.014.01