Обобщающая таблица по органической химии «Углеводороды»
Алканы | Алкены | Алкины | Алкадиены | Циклоалканы | Арены | |
Общая формула | Cnh3n+2 (n≥1) | Cnh3n (n≥2) | Cnh3n-2 (n≥2) | Cnh3n-2 (n≥3) | Cnh3n (n≥3) | Cnh3n-6 (n≥6) |
Особен-ности строения | Все связи одинарные С-С σ-связи | Есть двойная связь С=С (связи: σ,1-π) | Есть тройная связь С≡С (σ,2-π связи) | Есть две двойных связи между атомами углерода (σ,2-π связи) | Есть цикл σ-связи | /бензольное кольцо/ |
Тип гибриди-зации ключевых атомов углерода | sp3 тетраэдрическое строение угол связи 109, 28ₒ | sp2 плоское строение угол связи 120ₒ | sp линейное строение угол связи 180ₒ | sp2 или sp | sp3 | sp2 единая система сопряжённых связей, плоское строение угол связи 120ₒ |
Суффикс в названии | -ан | -ен (-илен) | -ин | -диен | Цикло-…. | Тривиальные названия ……бензол или фенил- |
Пример | C3H8 Ch4-Ch3-Ch4 пропан | C3H6 Ch3=CH-Ch4 пропен (пропилен) | C3h5 CH≡C-Ch4 пропин | C3h5 Ch3=C=Ch3 пропадиен | С6Н12 – циклогексан | С6Н6 – бензол С6Н5 СН3 – толуол /метилбензол/ |
Виды изомерии | -Углеродного скелета (с С4) | -Углеродного скелета (с С4) -Положения = связи (с С4) – Межклассовая с циклоалканами (с С3) -Геометрическая изомерия (цис, транс) | -Углеродного скелета (с С4) -Положения ≡ связи (с С4) -Межклассовая с алкадиенами (с С3) | -Углеродного скелета (с С5) -Взаимного положения = связей (с С4) -Межклассовая с алкинами (с С3) -Геометрическая изомерия (цис, транс) | -Углеродного скелета (размер цикла и положение заместителей) -Межклассовая с алкенами (с С3) Геометрическая- | У бензола и толуола – нет. У гомологов (с С8) –изомерия углеродного скелета (заместителей и их взаимного положения в кольце) |
Физичес-кие свойства | С1-С4-газы, С5-С15 –жидкости с запахом, с С16 –твёрдые вещества. | С2-С4-газы, С5-С16 –жидкости, с С17 –твёрдые вещества. малорастворимы в воде | С2-С4-газы, С5-С16 –жидкости, с С17 –твёрдые вещества. малорастворимы в воде | Бутадиен -1,3 – газ Изопрен – легкокипящая жидкость | С3-С4-газы, С5-С13 –жидкости, с С14 –твёрдые вещества. | Первые члены ряда – бесцветные легкокипящие жидкости |
Алканы | Алкены | Алкины | Алкадиены | Циклоалканы | Арены | |
Типичные химичес-кие реакции | 1. (с галогенами, азотной и серной кислотами) 2.Дегидрирование 3. Крекинг 4. Горение 5. Изомеризация | 1. Присоединение по двойной связи (водорода, галогенов, воды, галогеноводородов) 2. Полимеризация 3. Окисление (полное – горение, неполное окисление KMnO4) | 1. Присоединение (водорода, галогенов, воды, галогеноводородов) 2. Ди-, тримеризация 3. Окисление (полное – горение, неполное окисление KMnO4) 4. Замещение Н, стоящего у тройной связи на атомы металлов (слабые кислотные свойства) | 1. Присоединение (водорода, галогенов, воды, галогеноводородов) 2. Полимеризация (образуются синтетические каучуки) 3. | 1. Для малых циклов (С3-С4) характерны реакции присоединения (сходство с алкенами), для больших – реакции замещения (сходство с алканами). 2. Дегидрирование (образуются ароматические УВ) 3. Горение | 1. Электрофильное замещение (с галогенами, азотной и серной кислотами, галогеналканами) Возможно присоединение водорода 2. Возможно присоединение водорода 3. Окисление (полное – горение, неполное окисление KMnO4 (кроме бензола)) |
Отноше-ние к раствору KMnO4 | Не реагируют | Обесцвечивание | Обесцвечивание | Обесцвечивание | Не реагируют | Окисление заместителей в цикле (бензол не реагирует) |
Отноше-ние к бромной воде | Не реагируют | Обесцвечивание | Обесцвечивание | Обесцвечивание | Устойчивы | Не реагируют |
Взаимодействие с галогенами | Радикальное замещение | Присоединение | Присоединение | Присоединение | У малых – присоединение, у больших – замещение. | Электрофильное (по кольцу) или радикальное (по боковой цепи) замещение |
Каталити-ческое присоеди-нение водорода | Нет | Да | Да | Да | Да, для малых циклов | Да |
Возможность получения полимеров | Нет | Да | Да | Да | Нет | Нет |
Номенклатура органических соединений | CHEMEGE.
 RU
RUНоменклатура органических веществ – это система правил, которые позволяют дать уникальное название каждому химическому соединению.
Перед изучением номенклатуры органических веществ обязательно рекомендую познакомиться с темой Классификация органических соединений.
| Номенклатура органических соединений | ||
| Тривиальная | Систематическая | Рациональная |
В настоящее время используется номенклатура ИЮПАК (IUPAC) — Международный союз теоретической и прикладной химии (International Union of Pure and Applied Chemistry).
Основа названия органических соединений в зависимости от числа атомов углерода:
| Количество атомов С в цепи | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Корень | Мет- | Эт- | Проп- | Бут- | Пент- | Гекс- | Гепт- | Окт- | Нон- |
Наличие двойных или тройных связей в молекулах органических соединений обозначают, добавляя в конце слова суффикс -ен или -ин:
| Тип связей | Одинарная связь (С–С) | Двойная связь (С=С) | Тройная связь (СΞС) |
| Суффикс | -ан | -ен |
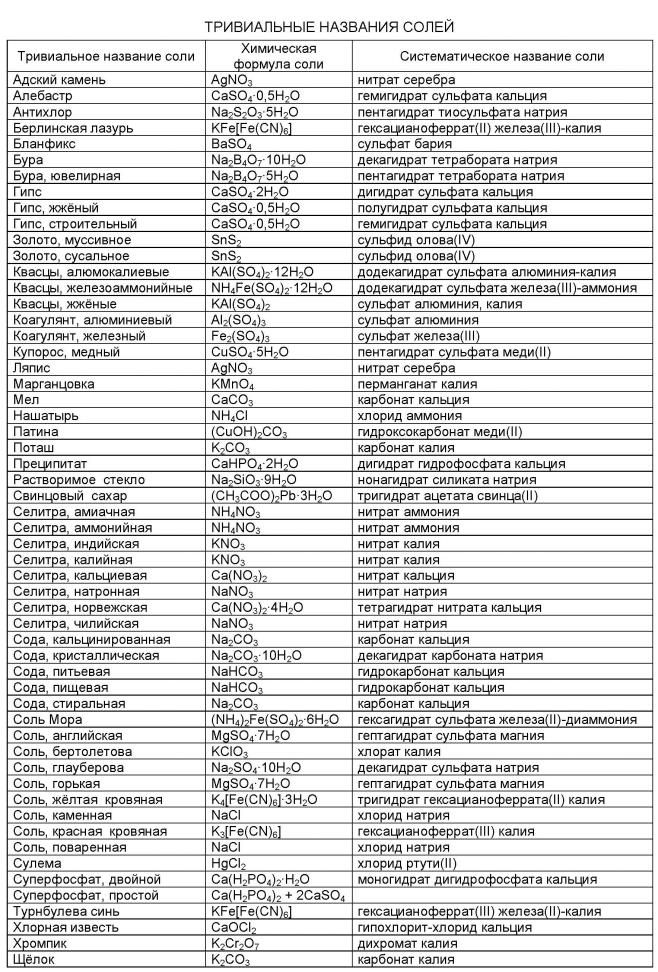
Наличие функциональных групп в органической молекуле обозначают добавлением в название приставки или суффикса:
| Функциональная группа | Приставка | Суффикс |
| –СООН | -карбокси | |
| –СООН | — овая кислота | |
| –SO3H | Сульфо- | -сульфокислота |
| –(С)Н=O | Оксо- | -аль |
| –ОН | Гидрокси- | -ол |
| –SН | Мерканто- | -тиол |
| –NH2 | Амино- | -амин |
| Нитро- | ||
| –OR | Алкокси- | |
| –F, –Cl, –Br, –I, –Hal | Фтор-, хлор-, бром-, йод- (галоген-) |
Для обозначения числа кратных связей и числа функциональных групп используют следующие числительные:
| Количество кратных связей и функциональных групп | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Числительное | Ди | Три | Тетра | Пента | Гекса | Гепта | Окта |
Название углеводородных радикалов:
| Название | Углеводородный радикал |
| Метил- | –CH3 |
| Этил- | –CH2CH3 |
| Пропил- | –CH2CH2CH3 |
| Изопропил- | –CH(CH3)CH3 |
| Бутил- | – CH2CH2CH2CH3
|
| Изобутил- | – CH2CH(CH3)CH3 |
| Втор-бутил | – CH(CH3)CH2CH3 |
| Трет-бутил | – C(CH |
1. Выбирают главную углеродную цепь
Выбирают главную углеродную цепь
Главная цепь — это самая длинная и самая разветвленная непрерывная последовательность углеродных атомов. При этом неважно, как нарисованы на схеме углеродные атомы (вверх, вниз, влево, вправо). При этом углеводородные радикалы, которые не входят в главную цепь, являются в ней заместителями. Главная цепь должна быть самой длинной.
| Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а |
2. Главная цепь должна быть самой разветвленной.
| Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от главной цепи на рисунке б – один: |
3. Нумеруют атомы углерода в главной цепи.
Нумерацию следует начинать с более близкого к старшей группе конца цепи.
При наличии двух и более заместителей цепь стараются пронумеровать так, чтобы заместителям принадлежали минимальные номера.
| Например, правильная нумерация в главной углеродной цепи |
Тривиальная номенклатура сложилась исторически по мере зарождения и развития исторической химии, до появления единой системы наименования органических веществ.
Многие тривиальные названия используются и сейчас. В таблице ниже приведены тривиальные названия основных органических веществ, а также их названия по систематической номенклатуре.
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
Углеводороды и галогенпроизводные | ||
| Изобутан | 2-метилпропан | CH3-CH(CH3)-CH3 |
| Этилен | Этен | |
| Пропилен | Пропен | CH2=CH-CH3 |
| Дивинил | Бутадиен-1,3 | CH2=CH-CH=CH2 |
| Изопрен | 2-Метилбутадиен-1,3 | CH2=C(СH3)-CH=CH2 |
| Винилацетилен | Бутен-1-ин-3 | CH≡C-CH=CH2 |
| Толуол | Метилбензол | |
| Кумол | Изопропилбензол | |
| орто-Ксилол, мета-ксилол, пара-ксилол | 1,2-Диметилбензол, 1,3-Диметилбензол, 1,4-Диметилбензол | |
| Стирол | Винилбензол | |
| Хлороформ | Трихлорметан | СHCl3 |
| Хлоропрен | 2-хлорбутадиен-1,3 | CH2=C(Cl)-CH=CH2 |
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
Кислородсодержащие и азотсодержащие вещества | ||
| Бензиловый спирт | Фенилметанол | |
| Этиленгликоль | Этандиол-1,2 | CH2OH-CH2OH |
| Глицерин | Пропантриол-1,2,3 | CH2OH-CHOH-CH2OH |
| орто-Крезол, мета-крезол, пара-крезол | 2-Метилфенол, 3-метилфенол, 4-метилфенол |
|
| Формальдегид | Метаналь | CH2=O |
| Ацетальдегид | Этаналь | |
| Анилин | Фениламин | |
| Название по тривиальной номенклатуре | Название по систематической номенклатуре | Формула вещества |
Карбоновые кислоты | ||
| Муравьиная кислота | Метановая кислота | HCOOH |
| Уксусная кислота | Этановая кислота | CH3COOH |
| Пропионовая кислота | Пропановая кислота | CH3CH2COOH |
| Масляная кислота | Бутановая кислота | |
| Щавелевая кислота | Этандиовая кислота | HOOC-COOH |
| Бензойная кислота | Фенилмуравьиная кислота | C6H5COOH |
Понравилось это:
Нравится Загрузка. ..
..
2.7 Периодическая таблица | Основы общей, органической и биологической химии
В 19 веке были открыты многие ранее неизвестные элементы, и ученые отметили, что определенные наборы элементов имеют сходные химические свойства. Например, хлор, бром и йод реагируют с другими элементами (такими как натрий) с образованием подобных соединений. Точно так же литий, натрий и калий реагируют с другими элементами (такими как кислород) с образованием подобных соединений. Почему это так?
В 1864 году Юлиус Лотар Мейер, немецкий химик, организовал элементы по атомной массе и сгруппировал их в соответствии с их химическими свойствами. Позднее в том же десятилетии русский химик Дмитрий Менделеев систематизировал все известные элементы по схожим свойствам. Он оставил пробелы в своей таблице для того, что, по его мнению, было неоткрытыми элементами, и сделал несколько смелых предсказаний относительно свойств этих неоткрытых элементов. Когда позже были обнаружены элементы, свойства которых точно соответствовали предсказаниям Менделеева, его версия таблицы завоевала популярность в научном сообществе. Поскольку определенные свойства элементов регулярно повторяются по всей таблице (то есть они периодические), она стала известна как 9.0005 периодическая таблица.
Поскольку определенные свойства элементов регулярно повторяются по всей таблице (то есть они периодические), она стала известна как 9.0005 периодическая таблица.
Примечание
Менделееву пришлось перечислить некоторые элементы в порядке их атомных масс, чтобы сгруппировать их с другими элементами, обладающими сходными свойствами.
Периодическая таблица является одним из краеугольных камней химии, поскольку в ней все известные элементы систематизированы на основе их химических свойств. Современная версия показана на рис. 2.7 «Современная периодическая таблица». Большинство периодических таблиц предоставляют дополнительные данные (например, атомную массу) в поле, содержащем символ каждого элемента. Элементы перечислены в порядке атомного номера. В современной периодической таблице элементы перечислены слева направо по атомному номеру.
Рисунок 2.7. Современная периодическая таблица
Элементы со сходными химическими свойствами сгруппированы в столбцы, называемые группами (или семействами) . Помимо нумерации, некоторые из этих групп имеют названия, например, щелочные металлы (первый столбец элементов), щелочноземельные металлы (второй столбец элементов), галогены (следующий за последний столбец элементов) и инертных газов (последний столбец элементов).
Помимо нумерации, некоторые из этих групп имеют названия, например, щелочные металлы (первый столбец элементов), щелочноземельные металлы (второй столбец элементов), галогены (следующий за последний столбец элементов) и инертных газов (последний столбец элементов).
Примечание
Слово галоген происходит от греческого слова «производитель соли», поскольку эти элементы объединяются с другими элементами, образуя группу соединений, называемых солями.
Для вашего здоровья: Радон
Радон — это невидимый благородный газ без запаха, который медленно выделяется из-под земли, особенно из горных пород и почв с высоким содержанием урана. Поскольку это благородный газ, радон химически неактивен. К сожалению, он радиоактивный, и повышенное воздействие его коррелирует с повышенным риском рака легких.
Поскольку радон поступает из земли, мы не можем полностью избежать его появления. Кроме того, поскольку он плотнее воздуха, радон имеет тенденцию накапливаться в подвалах, которые при неправильной вентиляции могут быть опасны для жителей здания. К счастью, специализированная вентиляция сводит к минимуму количество радона, который может накапливаться. Доступны специальные вентиляторно-вентиляционные системы, которые забирают воздух из-под цокольного этажа, прежде чем он попадет в жилое помещение, и выпускают его над крышей дома.
К счастью, специализированная вентиляция сводит к минимуму количество радона, который может накапливаться. Доступны специальные вентиляторно-вентиляционные системы, которые забирают воздух из-под цокольного этажа, прежде чем он попадет в жилое помещение, и выпускают его над крышей дома.
После курения радон считается вторым по величине предотвратимых причин рака легких в Соединенных Штатах. По оценкам Американского онкологического общества, 10% всех случаев рака легких связаны с воздействием радона. Существует неопределенность в отношении того, какие уровни воздействия вызывают рак, а также что может быть точным возбудителем (радон или один из продуктов его распада, многие из которых также радиоактивны и, в отличие от радона, не являются газами). Агентство по охране окружающей среды США рекомендует тестировать каждый этаж ниже третьего этажа на уровень радона, чтобы предотвратить долгосрочные последствия для здоровья.
Каждая строка элементов периодической таблицы называется периодом . Периоды имеют разную длину; в первом периоде всего 2 элемента (водород и гелий), а во втором и третьем периодах по 8 элементов. Четвертый и пятый периоды содержат по 18 элементов каждый, а более поздние периоды настолько длинные, что сегмент каждого из них удаляется и помещается под основную часть таблицы.
Периоды имеют разную длину; в первом периоде всего 2 элемента (водород и гелий), а во втором и третьем периодах по 8 элементов. Четвертый и пятый периоды содержат по 18 элементов каждый, а более поздние периоды настолько длинные, что сегмент каждого из них удаляется и помещается под основную часть таблицы.
Некоторые свойства элементов становятся очевидными при рассмотрении периодической таблицы в целом. Каждый элемент может быть классифицирован как металл, неметалл или полуметалл, как показано на рисунке 2.8 «Типы элементов». А металл — это блестящее вещество, обычно (но не всегда) серебристое, прекрасно проводящее электричество и тепло. Металлы также податливы (их можно бить в тонкие листы) и пластичны (их можно вытягивать в тонкие проволоки). Неметалл обычно тусклый и плохо проводит электричество и тепло. Твердые неметаллы также очень хрупкие. Как показано на рис. 2.8 «Типы элементов», металлы занимают три четверти левой таблицы Менделеева, а неметаллы (за исключением водорода) сгруппированы в правом верхнем углу таблицы Менделеева. Элементы со свойствами, промежуточными между металлами и неметаллами, называются 9.0005 полуметаллы (или металлоиды) . Элементы, расположенные рядом с жирной линией в правой части таблицы Менделеева, обладают свойствами полуметаллов.
Элементы со свойствами, промежуточными между металлами и неметаллами, называются 9.0005 полуметаллы (или металлоиды) . Элементы, расположенные рядом с жирной линией в правой части таблицы Менделеева, обладают свойствами полуметаллов.
Рисунок 2.8 Типы элементов. Элементы — это металлы, неметаллы или полуметаллы. Каждая группа расположена в другой части периодической таблицы.
Другой способ категоризации элементов таблицы Менделеева показан на рисунке 2.9 «Специальные названия разделов таблицы Менделеева». Первые два столбца слева и последние шесть столбцов справа называются 9.0005 Элементы основной группы. Блок из десяти столбцов между этими столбцами содержит переходных металлов. Две строки под основной частью периодической таблицы содержат внутренних переходных металлов. Элементы в этих двух рядах также называются, соответственно, металлами-лантанидами и металлами-актинидами .
F Рисунок 2.9 Специальные названия разделов Периодической таблицы. Некоторые разделы периодической таблицы имеют специальные названия. Элементы литий, натрий, калий, рубидий, цезий и франций вместе известны как щелочные металлы.
Для вашего здоровья: переходные металлы в организме
Согласно таблице 2.2 «Элементный состав тела человека», большую часть элементного состава тела человека составляют элементы основных групп. Первым элементом в списке, который не является элементом основной группы, является железо с содержанием 0,006 процента по массе. Поскольку железо имеет относительно массивные атомы, оно окажется еще ниже в списке, организованном в процентах на атомов , а не в процентах по массе.
Железо является переходным металлом. Переходные металлы обладают интересными химическими свойствами, отчасти потому, что некоторые из их электронов находятся в подоболочках d . (Дополнительную информацию об электронных оболочках см. в разделе 2.6 «Расположение электронов».) Химический состав железа делает его ключевым компонентом правильного функционирования эритроцитов.
в разделе 2.6 «Расположение электронов».) Химический состав железа делает его ключевым компонентом правильного функционирования эритроцитов.
Эритроциты — это клетки, которые переносят кислород от легких к клеткам тела, а затем переносят углекислый газ от клеток к легким. Без эритроцитов известного нам дыхания животных не существовало бы. Важнейшей частью эритроцита является белок под названием 9.0017 гемоглобин . Гемоглобин соединяется с кислородом и углекислым газом, транспортируя эти газы из одного места в другое в организме. Гемоглобин представляет собой относительно крупную молекулу с массой около 65 000 ед.
Ключевым атомом в белке гемоглобина является железо. Каждая молекула гемоглобина имеет четыре атома железа, которые действуют как центры связывания кислорода. Именно присутствие этого переходного металла в красных кровяных тельцах позволяет вам использовать кислород, который вы вдыхаете.
Другие переходные металлы выполняют важные функции в организме, несмотря на то, что присутствуют в небольших количествах. Цинк необходим для правильной работы иммунной системы организма, а также для синтеза белка и роста тканей и клеток. Медь также необходима для правильного функционирования некоторых белков в организме. Марганец необходим организму для правильного метаболизма кислорода. Кобальт является необходимым компонентом витамина B-12, жизненно важного питательного вещества. (Для получения дополнительной информации о белках и витаминах см. главу 18 «Аминокислоты, белки и ферменты».) Эти последние три металла не указаны явно в таблице 2.2 «Элементный состав человеческого тела», поэтому они присутствуют в организме. в очень малых количествах. Однако даже эти небольшие количества необходимы для нормального функционирования организма.
Цинк необходим для правильной работы иммунной системы организма, а также для синтеза белка и роста тканей и клеток. Медь также необходима для правильного функционирования некоторых белков в организме. Марганец необходим организму для правильного метаболизма кислорода. Кобальт является необходимым компонентом витамина B-12, жизненно важного питательного вещества. (Для получения дополнительной информации о белках и витаминах см. главу 18 «Аминокислоты, белки и ферменты».) Эти последние три металла не указаны явно в таблице 2.2 «Элементный состав человеческого тела», поэтому они присутствуют в организме. в очень малых количествах. Однако даже эти небольшие количества необходимы для нормального функционирования организма.
Периодическая таблица организована на основе сходства свойств элементов, но чем объясняется это сходство? Оказывается, форма таблицы Менделеева отражает заполнение подоболочек электронами, как показано на рисунке 2.10 «Форма таблицы Менделеева». Начиная с первого периода и слева направо таблица воспроизводит порядок заполнения электронных подоболочек в атомах. Кроме того, элементы в одном и том же столбце имеют одинаковую электронную конфигурацию валентной оболочки. Например, все элементы в первом столбце имеют одну цифру 9.0017 s электронов в своих валентных оболочках, поэтому их электронные конфигурации можно описать как нс 1 (где n представляет номер оболочки). Это последнее наблюдение имеет решающее значение. Химия во многом является результатом взаимодействия между валентными электронами разных атомов. Таким образом, атомы с одинаковой электронной конфигурацией валентной оболочки будут иметь сходный химический состав.
Кроме того, элементы в одном и том же столбце имеют одинаковую электронную конфигурацию валентной оболочки. Например, все элементы в первом столбце имеют одну цифру 9.0017 s электронов в своих валентных оболочках, поэтому их электронные конфигурации можно описать как нс 1 (где n представляет номер оболочки). Это последнее наблюдение имеет решающее значение. Химия во многом является результатом взаимодействия между валентными электронами разных атомов. Таким образом, атомы с одинаковой электронной конфигурацией валентной оболочки будут иметь сходный химический состав.
Рисунок 2.10 Форма периодической таблицы. Форма периодической таблицы отражает порядок, в котором электронные оболочки и подоболочки заполняются электронами.
Пример 9
Используя переменную n для представления номера оболочки валентного электрона, напишите конфигурацию электрона оболочки валентности для каждой группы.
- щелочноземельные металлы
- столбец элементов во главе с углеродом
Показать ответ
Упражнение для развития навыков
Используя переменную n для представления номера оболочки валентного электрона, напишите конфигурацию электрона оболочки валентности для каждой группы.
- галогены
- столбец элементов во главе с кислородом
Атомный радиус
Периодическая таблица полезна для понимания атомных свойств, которые показывают периодические тенденции. Одним из таких свойств является атомный радиус (рис. 2.11 «Тенденции в периодической таблице»). Как упоминалось ранее, чем выше номер оболочки, тем дальше от ядра могут находиться электроны в этой оболочке. Другими словами, размер атома обычно определяется числом валентных электронных оболочек. Следовательно, когда мы спускаемся вниз по столбцу периодической таблицы, атомный радиус увеличивается. Как мы идем через период периодической таблицы, однако электроны добавляются к той же валентной оболочке ; тем временем к ядру добавляется больше протонов, поэтому положительный заряд ядра увеличивается. Увеличивающийся положительный заряд сильнее притягивает электроны, притягивая их ближе к ядру. Следовательно, по мере прохождения периода атомный радиус уменьшается. Эти тренды хорошо видны на рис. 2.11 «Тренды периодической таблицы».
Эти тренды хорошо видны на рис. 2.11 «Тренды периодической таблицы».
Рисунок 2.11 Тенденции в периодической таблице. Относительные размеры атомов показывают несколько тенденций в отношении структуры периодической таблицы. Атомы становятся больше по мере продвижения вниз по столбцу и меньше по периоду.
Пример 10
Используя периодическую таблицу (а не рис. 2.11 «Тенденции в периодической таблице»), какой атом больше?
- Н или Би
- Mg или Cl
Показать ответ
Упражнение по развитию навыков
Используя периодическую таблицу (а не рис. 2.11 «Тенденции в периодической таблице»), какой атом больше?
- Li или F
- Na или K
Сфера деятельности: Клинический химик
Клиническая химия — это область химии, связанная с анализом биологических жидкостей для определения состояния здоровья человеческого организма. Клинические химики измеряют различные вещества, от простых элементов, таких как натрий и калий, до сложных молекул, таких как белки и ферменты, в крови, моче и других жидкостях организма. Отсутствие или присутствие, аномально низкое или повышенное количество вещества может быть признаком какого-либо заболевания или показателем здоровья. Многие клинические химики используют в своей работе сложное оборудование и сложные химические реакции, поэтому им необходимо не только разбираться в основах химии, но также уметь обращаться со специальными приборами и уметь интерпретировать результаты анализов.
Отсутствие или присутствие, аномально низкое или повышенное количество вещества может быть признаком какого-либо заболевания или показателем здоровья. Многие клинические химики используют в своей работе сложное оборудование и сложные химические реакции, поэтому им необходимо не только разбираться в основах химии, но также уметь обращаться со специальными приборами и уметь интерпретировать результаты анализов.
Упражнения по обзору концепции
Как элементы организованы в периодической таблице?
Глядя на периодическую таблицу, где появляются следующие элементы?
- металлы
- неметаллы
- галогены
- переходные металлы
Опишите тренды атомных радиусов в зависимости от положения элемента в периодической таблице.
Показать ответ
Ключевые выводы
- Химические элементы расположены в таблице, называемой периодической таблицей.

- Некоторые характеристики элементов связаны с их положением в периодической таблице.
Упражнения
Какие элементы имеют химические свойства, подобные свойствам магния?
- натрий
- фтор
- кальций
- барий
- селен
Какие элементы имеют химические свойства, подобные свойствам лития?
- натрий
- кальций
- бериллий
- барий
- калий
Какие элементы имеют химические свойства, подобные свойствам хлора?
- натрий
- фтор
- кальций
- йод
- сера
Какие элементы имеют химические свойства, подобные свойствам углерода?
- кремний
- кислород
- германий
- барий
- аргон
Какие элементы относятся к щелочным металлам?
- натрий
- магний
- алюминий
- калий
- кальций
Какие элементы относятся к щелочноземельным металлам?
- натрий
- магний
- алюминий
- калий
- кальций
Какие элементы являются галогенами?
- кислород
- фтор
- хлор
- сера
- углерод
Какие элементы относятся к благородным газам?
- гелий
- водород
- кислород
- неон
- хлор
Какие пары элементов расположены в одном периоде?
- Н и Ли
- H и He
- Na и S
- Na и Rb
Какие пары элементов расположены в одном периоде?
- В и №
- К и Бр
- Na и P
- Li и Mg
Какой атом в каждой паре атомов имеет больший атомный радиус?
- Н и Ли
- Н и Р
- Cl и Ar
- Алюминий и Кл
Какой атом в каждой паре атомов имеет больший атомный радиус?
- H и He
- Н и Ф
- Cl и Br
- Ал и В
Скандий является (металлом, неметаллом, полуметаллом) и входит в (элементы основной группы, переходные металлы).

Кремний представляет собой (металл, неметалл, полуметалл) и входит в (элементы основной группы, переходные металлы).
Показать ответ
Растворители, используемые в органической химии: Таблица свойств
Общие растворители, используемые в органической химии: таблица свойств| Растворитель | Формула | МВт | Температура кипения Точка кипения (°C) | точка плавления (°C) | плотность (г/мл) | Растворимость² | Диэлектрик Константа ³ | вспышка точка (°C) |
|---|---|---|---|---|---|---|---|---|
| уксусная кислота | С 2 Н 4 О 2 | 60.052 | 118 | 16,6 | 1. 0446 0446 | Смешивается | 6,20 | 39 |
| ацетон | С 3 Н 6 О | 58.079 | 56,05 | -94,7 | 0,7845 | Смешивается | 21.01 | -20 |
| ацетонитрил | С 2 Н 3 Н | 41.052 | 81,65 | -43,8 | 0,7857 | Смешивается | 36,64 | 6 |
| бензол | С 6 Н 6 | 78,11 | 80,1 | 5,5 | 0,8765 | 0,18 | Constant³”> 2,28 | -11 |
| 1-бутанол | С 4 Н 10 О | 74,12 | 117,7 | -88,6 | 0,8095 | 6,3 | 17,8 | 37 |
| 2-бутанол | С 4 Н 10 О | 74,12 | 99,5 | -88,5 | 0,8063 | 15 | 17,26 | 24 |
| 2-бутанон | С 4 Н 8 О | 72,11 | 79,6 | -86,6 | 0,7999 | 25,6 | Constant³”> 18,6 | -9 |
| т -бутиловый спирт | С 4 Н 10 О | 74.12 | 82,4 | 25,7 | 0,7887 | Смешивается | 12,5 | 11 |
| четыреххлористый углерод | ССl 4 | 153,82 | 76,8 | -22,6 | 1,594 | 0,08 | 2,24 | — |
| хлорбензол | С 6 Н 5 Класс | 112,56 | 131,7 | -45,3 | 1. 1058 1058 | 0,05 | 5,69 | 28 |
| хлороформ | CHCl 3 | 119,38 | 61,2 | -63,4 | 1,4788 | 0,795 | 4,81 | — |
| циклогексан | С 6 Н 12 | 84,16 | 80,7 | 6,6 | 0,7739 | 0,0055 | 2,02 | -20 |
| 1,2-дихлорэтан | С 2 Н 4 Класс 2 | 98,96 | 83,5 | -35,7 | 1,245 | 0,861 | Constant³”> 10,42 | 13 |
| диэтиленгликоль | С 4 Н 10 О 3 | 106,12 | 246 | -10 | 1.1197 | 10 | 31,8 | 124 |
| диэтиловый эфир | С 4 Н 10 О | 74,12 | 34,5 | -116,2 | 0,713 | 7,5 | 4,267 | -45 |
| диглим (диэтиленгликоль диметиловый эфир) | С 6 Н 14 О 3 | 134,17 | 162 | -68 | 0,943 | Смешивается | Constant³”> 7,23 | 67 |
| 1,2-диметокси- этан (глим, ДМЭ) | С 4 Н 10 О 2 | 90,12 | 84,5 | -69,2 | 0,8637 | Смешивается | 7,3 | -2 |
| диметил- формамид (ДМФА) | С 3 Н 7 НЕТ | 73,09 | 153 | -60,48 | 0,9445 | Смешивается | 38,25 | 58 |
| диметилсульфоксид (ДМСО) | С 2 Н 6 ОС | 78,13 | 189 | 18,4 | 1,092 | Смешивается | Constant³”> 47 | 95 |
| 1,4-диоксан | С 4 Н 8 О 2 | 88.11 | 101,1 | 11,8 | 1,033 | Смешивается | 2.21(25) | 12 |
| этанол | С 2 Н 6 О | 46,07 | 78,5 | -114,1 | 0,789 | Смешивается | 24,6 | 13 |
| этилацетат | С 4 Н 8 О 2 | 88. 11 11 | 77 | -83,6 | 0,895 | 8,7 | 6(25) | -4 |
| этиленгликоль | С 2 Н 6 О 2 | 62,07 | 195 | -13 | 1,115 | Смешивается | 37,7 | 111 |
| глицерин | С 3 Н 8 О 3 | 92,09 | 290 | 17,8 | 1,261 | Смешивается | Constant³”> 42,5 | 160 |
| гептан | С 7 Н 16 | 100,20 | 98 | -90,6 | 0,684 | 0,01 | 1,92 | -4 |
| гексаметилфосфорамид (HMPA) | C 6 H 18 N 3 OP | 179,20 | 232,5 | 7,2 | 1,03 | Смешивается | 31,3 | 105 |
| гексаметилфосфористый триамид (HMPT) | С 6 Н 18 Н 3 Р | 163. 20 20 | 150 | -44 | 0,898 | Смешивается | ?? | 26 |
| гексан | С 6 Н 14 | 86,18 | 69 | -95 | 0,659 | 0,0014 | 1,89 | -22 |
| метанол | СН 4 О | 32.04 | 64,6 | -98 | 0,791 | Смешивается | Constant³”> 32,6(25) | 12 |
| метил трет- бутил эфир (МТБЭ) | С 5 Н 12 О | 88,15 | 55,2 | -109 | 0,741 | 5,1 | ?? | -28 |
| метиленхлорид | CH 2 Класс 2 | 84,93 | 39,8 | -96,7 | 1,326 | 1,32 | 9,08 | — |
| N -метил-2-пирролидинон (NMP) | CH 5 H 9 НЕТ | 99,13 | 202 | -24 | 1. 033 033 | Смешивается | 32 | 91 |
| нитрометан | CH 3 НЕТ 2 | 61,04 | 101,2 | -29 | 1,382 | 9,50 | 35,9 | 35 |
| пентан | С 5 Н 12 | 72,15 | 36,1 | -129,7 | 0,626 | 0,04 | 1,84 | -49 |
| петролейный эфир (лигроин) | — | — | 30-60 | -40 | 0,656 | — | Constant³”> — | -30 |
| 1-пропанол | С 3 Н 8 О | 60,10 | 97 | -126 | 0,803 | Смешивается | 20.1(25) | 22 |
| 2-пропанол | С 3 Н 8 О | 60,10 | 82,4 | -88,5 | 0,785 | Смешивается | 18,3(25) | 12 |
| пиридин | С 5 Н 5 Н | 79.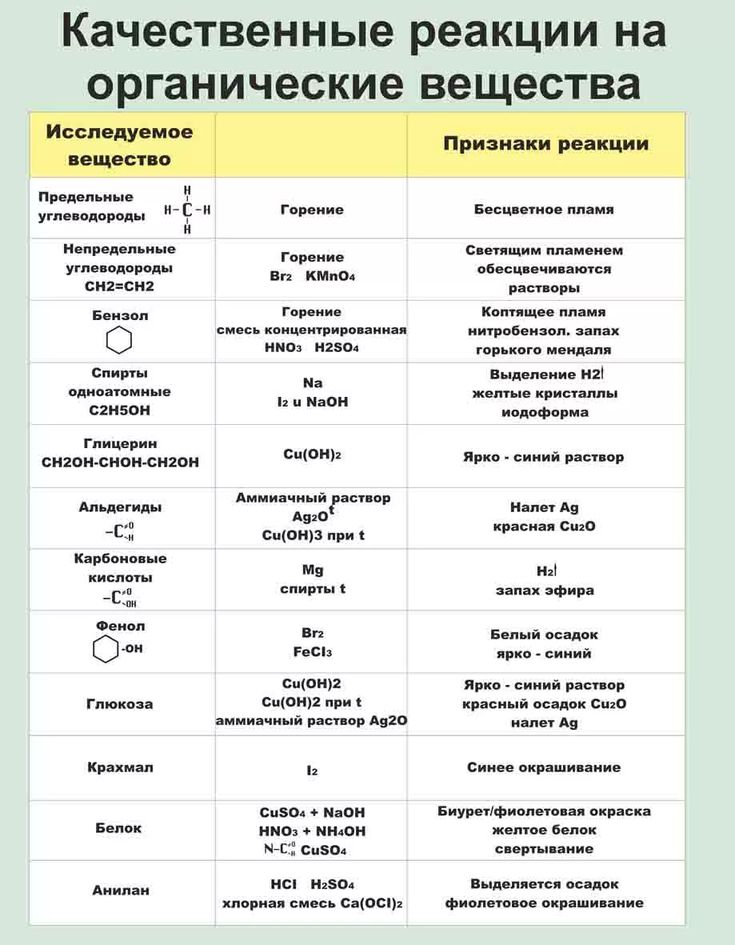 10 10 | 115,2 | -41,6 | 0,982 | Смешивается | 12,3(25) | 17 |
| тетрагидрофуран (ТГФ) | С 4 Н 8 О | 72,106 | 65 | -108,4 | 0,8833 | растворим² | 7,52 | -14 |
| толуол | С 7 Н 8 | 92,14 | 110,6 | -93 | 0,867 | 0,05 | Constant³”> 2,38(25) | 4 |
| триэтиламин | С 6 Н 15 Н | 101,19 | 88,9 | -114,7 | 0,728 | 0,02 | 2,4 | -11 |
| вода | Н 2 О | 18.02 | 100,00 | 0,00 | 0,998 | — | 78,54 | — |
| вода тяжелая | Д 2 О | 20. 03 03 | 101,3 | 4 | 1,107 | Смешивается | ?? | — |
| o -ксилол | С 8 Н 10 | 106,17 | 144 | -25,2 | 0,897 | Нерастворимый | 2,57 | 32 |
| м -ксилол | С 8 Н 10 | 106,17 | 139,1 | -47,8 | 0,868 | Нерастворимый | Constant³”> 2,37 | 27 |
| р -ксилол | С 8 Н 10 | 106,17 | 138,4 | 13,3 | 0,861 | Нерастворимый | 2,27 | 27 |
Примечания:
- В 2005 году эта таблица была адаптирована доктором Брайаном Дж. Майерсом, веб-мастером отдела органических растворителей ACS (DOC) из таблицы органических растворителей профессора Мурова. Значения были получены из CRC (87-е издание) или Vogel’s 9.0624 Практическая органическая химия (5-е изд.).
- Растворимость указана в воде и выражена в граммах растворителя/100 граммов воды. Водорастворимость ТГФ сложна. См.: Pubchem .


 .ан
.ан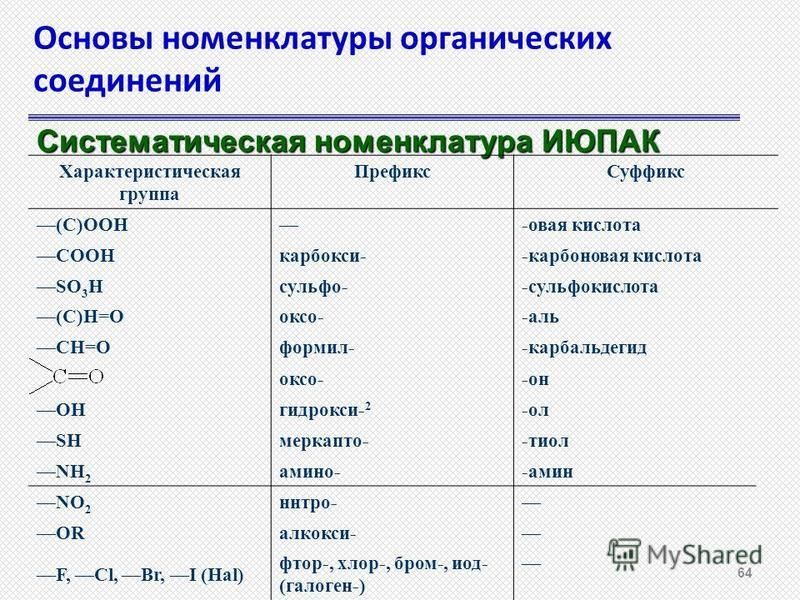
 Радикальное замещение
Радикальное замещение Окисление (полное – горение, неполное)
Окисление (полное – горение, неполное)