Растворы. Виды растворов – HimHelp.ru
Растворами называются гомогенные системы, содержащие не менее двух веществ. Могут существовать растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. Как правило, вещество, взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке — растворенным веществом.
В зависимости от агрегатного состояния растворителя различают газообразные, жидкие и твердые растворы.
Газообразными растворами являются воздух и другие смеси газов.
К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями.
Твердыми растворами являются многие сплавы, например, металлов друг с другом, стёкла. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Наиболее распространенным растворителем из неорганических веществ, конечно же, является вода.
В процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя в результате беспорядочного движения частиц качественно новую однородную систему. Способность к образованию растворов выражена у разных веществ в различной степени. Одни вещества способны смешиваться друг с другом в любых количествах (вода и спирт), другие — в ограниченных (хлорид натрия и вода).
Сущность процесса образования раствора можно показать на примере растворения твердого вещества в жидкости. С точки зрения молекулярно-кинетической теории растворение протекает следующим образом: при внесении в растворитель какого-либо твердого вещества, например, поваренной соли, частицы ионов Na Этот процесс распространяется на следующие слои частиц, которые обнажаются в кристалле после удаления поверхностного слоя. Так постепенно частицы, образующие кристалл (ионы или молекулы), переходят в раствор. На рис дана наглядная схема разрушения ионной кристаллической решетки NaСl при растворении в воде, состоящей из полярных молекул.
Этот процесс распространяется на следующие слои частиц, которые обнажаются в кристалле после удаления поверхностного слоя. Так постепенно частицы, образующие кристалл (ионы или молекулы), переходят в раствор. На рис дана наглядная схема разрушения ионной кристаллической решетки NaСl при растворении в воде, состоящей из полярных молекул.
Частицы, перешедшие в раствор, вследствие диффузии распределяются по всему объему растворителя. С другой стороны, по мере увеличения концентрации частицы (ионы, молекулы), находящиеся в непрерывном движении, при столкновении с твердой поверхностью еще не растворившегося вещества могут задерживаться на ней, т.е. растворение всегда сопровождается обратным явлением — кристаллизацией. Может наступить такой момент, когда одновременно выделяется из раствора столько же частиц (ионов, молекул), сколько их переходит в раствор — наступает равновесие.
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным.
Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества. Концентрация насыщенного раствора (растворимость) для данного вещества при строго определенных условиях (температура, растворитель) — величина постоянная.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние.
Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным. Разбавленные растворы — растворы с небольшим содержанием растворенного вещества; концентрированные растворы — растворы с большим содержанием растворенного вещества. Необходимо подчеркнуть, что понятие разбавленный и концентрированный растворы являются относительными, выражающими только соотношение количеств растворенного вещества и растворителя в растворе.
Сравнивая растворимость различных веществ, мы видим, что насыщенные растворы малорастворимых веществ являются разбавленными, а хорошо растворимых веществ — хотя и ненасыщенные, но довольно концентрированными.
В зависимости от того, электронейтральными или заряженными частицами являются компоненты раствора, их подразделяют на молекулярные (растворы неэлектролитов) и ионные (растворы электролитов). Одна из характерных особенностей растворов электролитов заключается в том, что они проводят электрический ток.
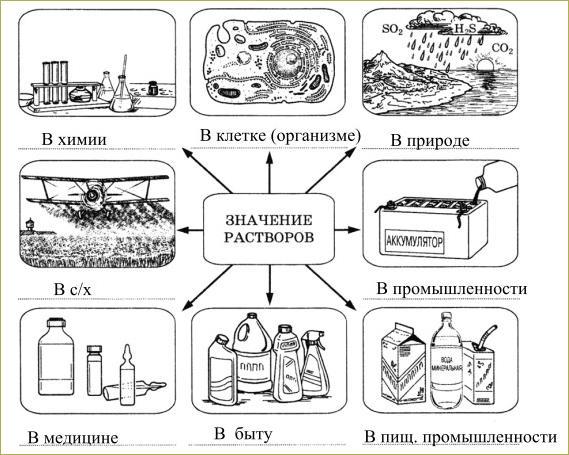
Значение растворов в природе и жизни человека
Значение растворов в природе и жизни человека
Растворы и сам процесс растворения имеют большое значение в природе, в нашей жизни, в науке и технике. Чаще всего мы имеем дело не с чистыми веществами, а со смесями или растворами. Воздух – это раствор газов. Вода морей, рек, озер, грунтовые воды, питьевая вода – это растворы. Большинство минералов – это твердые растворы.
Что такое растворы
При растворении
веществ происходит их измельчение и рассеивание
в объеме раствора. Растворимостью называется
способность вещества растворяться в
том или другом растворителе. Частицы
одного вещества равномерно распределены
между частицами другого. Если вещество
растворено до уровня молекул, то раствор
будет однородным, прозрачным и не будет
отстаиваться. Такой раствор является
истинным. Например, раствор соли в воде,
столовый уксус, раствор сахара.
 Вода – растворитель для многих веществ.
Хорошими растворителями так же являются
спирт, ацетон, бензин, эфиры.
Вода – растворитель для многих веществ.
Хорошими растворителями так же являются
спирт, ацетон, бензин, эфиры. Растворенное вещество может быть в любом агрегатном состоянии: твердом (сахар, соль), жидком (спирт), газообразном (углекислый газ). Одновременно в растворе может быть растворено несколько веществ, например, в минеральной воде растворены различные соли. Количество растворенного вещества может быть различной. Растворы не имеют постоянного состава, и в этом заключается их основное отличие от химических соединений.
Растворимость различных веществ обусловливается многими причинами. Растворимость большинства твердых веществ с увеличением температуры увеличивается, а растворимость газов, наоборот, уменьшается.

По количеству растворенного вещества растворы бывают разведены или концентрированные. Если в определенном объеме раствора находится относительно небольшое количество растворенного вещества, то раствор называется разведенным, а если растворено много вещества, то раствор называется концентрированным. Раствор, в котором данное вещество еще может растворяться, называется ненасыщенным.
Примеры растворов в природе
В строении всех живых организмов присутствуют растворы. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа, внутриклеточные жидкости и т.д.). Процессы усвоения пищи человеком и животными, так же связаны с переводом питательных веществ в раствор.
Примеры растворов в жизни человека
Растворы широко
применяют в быту, медицине, промышленности.
Чай, кофе, соусы, супы и многие другие
продукты являются растворами. Различные
косметические и частящие средства: мыло,
духи. Материалы для творчества: клей,
краски.
Различные
косметические и частящие средства: мыло,
духи. Материалы для творчества: клей,
краски.
Многие лекарственные вещества используются в медицине в виде растворов. Это перекись водорода, зеленка,
Растворы используют в строительстве: раствор штукатурки, затирки, бетона, монтажная пена.
Растворы играют исключительную роль в природе и жизнедеятельности. Все что нас окружает представляет собой растворы. Без них наша жизнь была бы невозможна.
Список литературы
13.1: Типы решений — немного терминологии
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 24253
Цели обучения
- Понять, как изменения энтальпии и энтропии влияют на образование раствора.

- Чтобы использовать величину изменений как энтальпии, так и энтропии, чтобы предсказать, будет ли данная комбинация растворенного вещества и растворителя спонтанно образовывать раствор.
Во всех растворах, газообразных, жидких или твердых, вещество, присутствующее в наибольшем количестве, является растворителем, а вещество или вещества, присутствующие в меньших количествах, являются растворенным(ыми) веществом(ями). Растворенное вещество не обязательно должно находиться в том же физическом состоянии, что и растворитель, но физическое состояние растворителя обычно определяет состояние раствора. Пока растворенное вещество и растворитель объединяются, образуя гомогенный раствор, говорят, что растворенное вещество растворимо в растворителе. В таблице \(\PageIndex{1}\) перечислены некоторые распространенные примеры газообразных, жидких и твердых растворов и указаны физические состояния растворенного вещества и растворителя в каждом из них.
| Раствор | Растворенное вещество | Растворитель | Примеры |
|---|---|---|---|
| газ | газ | газ | воздух, природный газ |
| жидкость | газ | жидкость | сельтерская вода (\(\ce{CO2}\) газ в воде) |
| жидкость | жидкость | жидкость | напиток алкогольный (этанол в воде), бензин |
| жидкость | твердый | жидкость | чай, соленая вода |
| сплошной | газ | твердый | \(\ce{h3}\) в \(\ce{Pd}\) (используется для хранения \(\ce{h3}\)) |
| сплошной | твердый | жидкость | ртуть в серебре или золоте (амальгама, часто используемая в стоматологии) |
Образование раствора из растворенного вещества и растворителя является физическим, а не химическим процессом. То есть как растворенное вещество, так и растворитель могут быть извлечены в химически неизмененные формы с использованием соответствующих методов разделения. Например, твердый нитрат цинка растворяется в воде с образованием водного раствора нитрата цинка: 9{-} (водн.) + H_2 (г) } \номер\]
То есть как растворенное вещество, так и растворитель могут быть извлечены в химически неизмененные формы с использованием соответствующих методов разделения. Например, твердый нитрат цинка растворяется в воде с образованием водного раствора нитрата цинка: 9{-} (водн.) + H_2 (г) } \номер\]
Растворение растворенного вещества в растворителе с образованием раствора, как правило, не связано с химическим превращением и в основном состоит из разрыва межмолекулярных сил, а не ковалентных связей.
Когда раствор испаряется, мы не извлекаем металлический цинк, поэтому мы не можем сказать, что металлический цинк растворим в водной соляной кислоте, потому что он химически трансформируется при растворении. Растворение растворенного вещества в растворителе с образованием раствора не связано с химическим превращением.
Амальгамы ртути: примеры твердых растворов
Амальгама представляет собой сплав ртути с другим металлом. Это может быть жидкость, мягкая паста или твердое вещество, в зависимости от доли ртути. Эти сплавы образуются за счет металлической связи, при этом сила электростатического притяжения электронов проводимости работает, чтобы связать все положительно заряженные ионы металла вместе в структуру кристаллической решетки. Почти все металлы могут образовывать амальгамы с ртутью, включая алюминий (видео \(\PageIndex{1}\)), заметными исключениями являются железо, платина, вольфрам и тантал. Амальгамы серебра и ртути имеют важное значение в стоматологии, а амальгамы золота и ртути используются при извлечении золота из руды.
Эти сплавы образуются за счет металлической связи, при этом сила электростатического притяжения электронов проводимости работает, чтобы связать все положительно заряженные ионы металла вместе в структуру кристаллической решетки. Почти все металлы могут образовывать амальгамы с ртутью, включая алюминий (видео \(\PageIndex{1}\)), заметными исключениями являются железо, платина, вольфрам и тантал. Амальгамы серебра и ртути имеют важное значение в стоматологии, а амальгамы золота и ртути используются при извлечении золота из руды.
Вещества, образующие единую однородную фазу во всех соотношениях, называются полностью смешиваемыми друг с другом. Этанол и вода смешиваются так же, как смешиваются смеси газов. Если два вещества практически нерастворимы друг в друге, например масло и вода, они несмешиваются. Примеры газообразных растворов, которые мы уже обсуждали, включают атмосферу Земли.
Примеры газообразных растворов, которые мы уже обсуждали, включают атмосферу Земли.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- смешиваемость
- твердый раствор
Типы растворов.
 Растворы в химии
Растворы в химииРастворы являются частью нашей повседневной жизни, поскольку они присутствуют во всех обычных вещах, которые вы обычно используете в повседневной жизни, таких как сода, дезодорант, который вы наносите, сахар, соль и т. д., являются некоторыми общими примерами решений. По сути, раствор — это тип смеси, в которой два или более вещества смешиваются вместе, образуя единый раствор; мы также можем сказать, что это просто и может изменить или не изменить их соответствующие свойства.
Компоненты раствора
Два компонента – растворитель и растворитель объединяются, образуя любой раствор в гомогенной смеси. Растворенное вещество – это вещество, состоящее из меньшего количества раствора, которое растворяется в растворителе, который присутствует в большем количестве, чем растворенное вещество. Состояние растворителя обычно определяет конечное состояние гомогенных растворов, хотя состояние растворенного вещества не имеет никакого значения в растворе, если оно растворимо в растворителе.
(Изображение будет загружено в ближайшее время)
Классификация растворов
Вещество в основном можно классифицировать как элементы, соединения, смеси, но раствор относится только к смесям. По характеру компонентов смеси можно разделить на два типа: гомогенные и гетерогенные смеси. Гомогенную смесь также можно назвать раствором. Смесь, имеющая компоненты любого состояния, которые проявляют одинаковые свойства во всем данном образце, известна как гомогенная смесь. Гетерогенными являются просто любые смеси, не основанные на едином составе.
Примерами гомогенных растворов являются чашка кофе, духи, соль или сахар в воде и т. д., а примерами гетерогенных растворов являются раствор масла и воды, раствор песка и воды, раствор мелового порошка , и вода и т. д. Вещества, имеющие одну и ту же однородную фазу по всем свойствам, называются вполне смешивающимися друг с другом, если же вещества нерастворимы друг в друге, то их называют несмешивающимися. Примером смешиваемого вещества является этанол и вода, а примером несмешиваемого вещества является масло и вода.
Примером смешиваемого вещества является этанол и вода, а примером несмешиваемого вещества является масло и вода.
Характеристики растворов
Характеристики растворов могут быть сформулированы следующим образом:
Раствор представляет собой гомогенную смесь двух или более веществ.
После образования раствора растворенное вещество не может быть отделено от раствора с помощью процесса фильтрации.
Луч света не должен проходить через раствор.
Человеческий глаз не может видеть частицы растворенного вещества внутри раствора.
Раствор стабилен и состоит только из одной фазы.
Формирование раствора: физический процесс
Сочетание растворенного вещества и растворителя для образования раствора является физическим, а не химическим процессом. Растворенное вещество и растворитель могут быть извлечены обратно с помощью методов разделения в химически неизменной форме, что можно показать на следующем примере растворения твердого нитрата цинка в воде с образованием водного раствора нитрата цинка.
Растворенное вещество и растворитель могут быть извлечены обратно с помощью методов разделения в химически неизменной форме, что можно показать на следующем примере растворения твердого нитрата цинка в воде с образованием водного раствора нитрата цинка.
Zn(NO 3 ) 2 (т) + H 2 O(ж) Zn 2+ (водн.) + 2NO 3 – (водн.) 902 В приведенной выше реакции 90, Zn(NO 3 ) 2 можно легко восстановить с помощью процесса выпаривания (выпаривания воды). Итак, мы можем сказать, что диссипация растворенного вещества в растворителе с образованием раствора не включает в себя химический процесс.
Типы растворов
Существуют различные типы растворов, которые можно классифицировать по разным основаниям, таким как разница в растворенном веществе и растворителе, количество критериев и т. д., которые можно представить следующим образом: –
1. Различные типы растворов на основе воды в качестве растворителя
Различные типы растворов на основе воды в качестве растворителя
Растворы можно разделить на два типа в зависимости от того, является раствор водой или нет.
Водный раствор
Раствор, в котором гомогенное соединение в любом состоянии полностью растворяется в воде, в котором вода действует как растворитель. Примерами таких растворов являются сахар/соль в воде, углекислый газ в воде.
Неводный раствор
Эти растворы в основном противоположны водному раствору, так как растворитель в них не является водой; это может быть что угодно, например, бензин, бензол, эфир и т. д. Примеры такого рода растворов включают фенолфталеин в бензоле, серу в сероуглероде и т. д.
2. Различные типы растворов в зависимости от количества добавленного растворенного вещества
Растворы можно разделить на три типа в зависимости от количества растворенного вещества, присутствующего в растворе.
Насыщенные растворы
Раствор считается насыщенным только в том случае, если он достигает своего предела растворения любого другого растворенного вещества в растворителе при определенной температуре.
Ненасыщенные растворы
Если раствор еще может растворять большее количество растворенного вещества в растворителе, то его называют ненасыщенным раствором.
Перенасыщенные растворы
Раствор, в котором растворенное вещество присутствует в избыточном количестве и принудительно растворяется в растворителе за счет повышения температуры, называется перенасыщенным раствором. Эти избыточные частицы растворенного вещества позже обнаруживаются в виде кристаллов с помощью процесса кристаллизации.
3. Различные типы растворов в зависимости от количества добавленного растворителя
Растворы можно разделить на два типа в зависимости от количества растворителя, присутствующего в растворе.
Концентрированные растворы
К данному растворителю добавляют большое количество растворенного вещества для получения концентрированных растворов.
Разбавленные растворы
Раствор, содержащий небольшое количество растворенного вещества в большом количестве растворителя, называется разбавленным раствором.
4. Различные типы растворов в зависимости от количества концентрации растворенного вещества в двух растворах
Растворы можно разделить на три типа в зависимости от концентрации растворителя в двух растворителях (в стакане и ячейке в нем) в растворе.
Гипертонические растворы
Гипертонические растворы – это такие типы растворов, в которых концентрация растворенного вещества в стакане выше, чем в клетке, поэтому вода выходит из клетки, вызывая плазмолиз/сжатие клетки .
Гипотонические растворы
Гипотонические растворы — это такие растворы, в которых концентрация растворенного вещества в стакане меньше по сравнению с клеткой, поэтому вода будет перемещаться в клетку, вызывая ее набухание и последующий разрыв.
Изотонические растворы
Эти изотонические растворы имеют одинаковую концентрацию растворенного вещества как в стакане, так и в ячейке, поэтому вода будет двигаться вокруг ячейки в обоих направлениях.
Растворы можно отличить по их способности проводить электрический ток, так как те растворы, которые содержат молекулы, называются непроводниками, а те растворы, которые содержат ионы, известны как проводники.
Вещества, растворяющиеся в воде и распадающиеся на ионы, называются электролитами, а вещества, растворяющиеся в воде, но не образующие ионов, называются неэлектролитами. Эти ионообразующие вещества, которые проводят электрический ток в растворах, известные как электролиты, можно далее разделить на сильные электролиты и слабые электролиты.
Сильный электролит
Сильные электролиты доступны только в виде ионов, так как это заставляет лампочку ярко светиться на приборе проводимости (который используется для проверки электрического тока в растворе). NaCl является хорошим примером сильного электролита.
Слабый электролит
Растворы, содержащие лишь небольшое количество ионов, известны как слабые электролиты, из-за чего лампочка на приборе для измерения проводимости тускло светится. Слабые кислоты и основания являются хорошими примерами слабых электролитов.
Слабые кислоты и основания являются хорошими примерами слабых электролитов.
Examples of solutions
Some Examples of the Solutions are Listed Below
S. No | Solute | Solvent | Referred Name of the Solution | Пласт | |
1 | Газ | Жидкость | 9 | Whipped cream | |
2 | Liquid | Liquid | Emulsion | Mayonnaise | |
3 | Liquid | Solid | Гель | Желатин | |
4 | Твердый | Solid Solution | Cranberry Glass | ||
5 | Solid | Gas | Solid Aero solution | Smoke |
Summary
Раствор представляет собой смесь двух или более веществ, которую называют гомогенной.