Химические реакции их классификация (Схема, Таблица)
Химическая реакция — это превращение одного или нескольких исходных веществ (реагентов) в другие вещества, при этом ядра атомов не меняются, происходит только перераспределение электронов и ядер, и образуются новые химические вещества. При химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов (в отличие от ядерных реакций).
Классификация химических реакций схема
Химические реакции классифицируются по тепловому эффекту, по изменению степени окисления атомов в реагирующих веществах, по числу и составу исходных и образующихся веществ, и по признаку обратимости.
Классификация химических реакций по числу и составу исходных и образующихся веществ
|
Химическая реакция |
Определение |
Примеры |
|
Разложения А → В + С + D |
Реакция, в которой из одного исходного вещества образуется несколько новых веществ |
2HgO →t→ 2Hg + O2 CaCO3 → CaO + CO2 4HNO3 → 2H2O + 4NO2 + O2 |
|
Замещения А + ВС → АВ + С |
Реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества |
Fe + CuSO4 → FeSO4 + Сu CuSO4 + Fe → FeSO 2KBr + Cl2 → 2KCl + Br2 |
|
Обмена АВ + CD → АС + BD |
Реакция, в результате которой два вещества обмениваются своими составными частями, образуя два новых вещества |
2AgNO3 + H2SO4 → Ag2SO4 + 2HNO3 NaOH + HCl → NaCl + H2O CH3COONa + H2O → CH3COOH + NaOH |
|
Соединения А + В + С → D |
Реакция, в результате которой из двух или нескольких веществ образуется одно новое |
HCl + NH3 → NH4Cl↓ CaO + H2O → Ca(OH)2 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3 |
Классификация химических реакций по тепловому эффекту
Тепловой эффект химической реакции — это количество теплоты (Q), которое выделяется или поглощается в химической реакции.
|
Реакция |
Определение |
Пример |
|
Эндотермическая |
Реакция, проходящая с поглощением теплоты |
N2 + O2 → 2NO – 90,4 кДж |
|
Экзотермическая |
Реакция, проходящая с выделением теплоты |
Н2 + Сl2 → 2НСl + 92,3 кДж |
Термохимическое уравнение — уравнение химической реакции, в котором указан тепловой эффект реакции:
2Н2 + 0 = 2Н2O + 484 кДж
2NH3 → N2 + ЗН2 – 46,36 кДж.
Термохимические расчеты основаны на законе Гесса:
– тепловой эффект химической реакции зависит от состояний исходных веществ и продуктов реакций, но не зависит от промежуточных стадий процесса
– тепловой эффект химической реакции равен сумме теплот образования продуктов реакции эа вычетом суммы теплот образования исходных веществ
Классификация химических реакций по признаку обратимости
|
Реакция |
Определение |
Примеры |
|
Обратимая |
Такая реакция, которая в данных условиях протекает одновременно в двух взаимно противоположных направлениях |
ЗН2 + N2 ↔ 2NH3 Вг2 + Н2O ↔ НВrО + НВr |
|
Необратимая |
Такая реакция, которая в данных условиях протекает до конца, т. |
2Н2(г) + O2(г) → 2Н2O(ж) СН4 + 2O2 → СO2 + 2Н2O |
Таблица признаки необратимости реакций
|
Признак |
Примеры |
|
Реакция идет с выделением большого количества теплоты |
2Mg + O2 → 2MgO + Q |
|
Хотя бы один продукт реакции покидает сферу реакции (выпадает в осадок или выделяется в виде газа) |
СаСl2 + Na2SO3 → CaSO3↓ + 2NaCl CaCO3 →t→ CaO + CO2↑ |
|
В результате реакции образуются малодиссоциируе-мые вещества |
(CH3COO)NH4 + H2O → CH3COOH + NH4OH HCl + NaOH → NaCl + H2O |
Классификация химических реакций по изменению степени окисления
|
Химическая реакция |
Определение |
Примеры |
|
Проходящая с изменением степени окисления атомов (окислительно-восстановительная) |
реакция, при которой происходит переход электронов от одних атомов, молекул или ионов к другим |
-2KI-1 + Сl20 → 2КСl-1 + I20 |
|
Проходящая без изменения степени окисления |
Реакция, в которой степень окисления каждого атома после реакции остается неизменной |
2АlСl3 + 3Na2S + 6Н2O → 2Аl(ОН)3↓ + 3H2S↑ + 6NaCl H2SO4 + NaOH → NaHSO4 + H2O |
Влияние изменения условий на положение химического равновесия
|
Изменение условий, при которых система находится в состоянии химического равновесия |
Изменение скоростей прямой и обратной реакции в начальный момент |
Направление смешения положения равновесия |
|
|
Температура |
повышается |
В большей степени возрастает скорость эндотермической реакции |
В сторону эндотермической реакции |
|
понижается |
В большей степени понижается скорость эндотермической реакции |
В сторону экзотермической реакции |
|
|
Давление |
повышается |
В большей степени возрастает скорость реакции, протекающей с уменьшением числа молей газообразных веществ |
В сторону уменьшения числа молей газообразных веществ в системе |
|
понижается |
В большей степени понижается скорость реакции протекающей с уменьшением числа молей газообразных веществ |
В сторону увеличения числа молей газообразных веществ в системе |
|
|
Концентрация |
повышается |
Возрастает скорость реакции, по которой вводимое вещество расходуется |
В сторону реакции, по которой вводимое вещество расходуется |
|
понижается |
Уменьшается скорость реакции, где реагентом является вещество, концентрация которого уменьшается |
В сторону реакции, по которой образуется вещество, концентрация которого уменьшается |
|
|
Введение катализатора |
Скорости прямой и обратной реакции изменяются одинаково |
— |
|
СХЕМА ХИМИОТЕРАПИИ AC (ДОКСОРУБИЦИН И ЦИКЛОФОСФАМИД) ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ ПРОФИЛАКТИКА ТОШНОТЫ И РВОТЫ | Королева
1. Злокачественные новообразования в России в 2014 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИРЦ» МЗ РФ. 2016. 250 с.
Злокачественные новообразования в России в 2014 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИРЦ» МЗ РФ. 2016. 250 с.
2. Состояние онкологической помощи населению России в 2014 году. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИРЦ» МЗ РФ, 2015. 236 с.
3. Bonadonna G, Brusamolino E, Valagussa P, Rossi A, Brugnatelli L, Brambilla C et al. Combination chemotherapy as an adjuvant treatment in operable breast cancer. N. Engl. J. Med., 1976, 294: 405-410.
4. Bonadonna G, Valagussa P, Moliterni A et al. Adjuvant cyclophos-phamide, methotrexate, and fluorouracil in node-positive breast cancer: the results of 20 years of follow up. New Engl. Med., 1995, 332: 901-906.
5. Bonadonna G, Moliterni A, Zambetti M, Daidone MG, Pilotti S. 30 years’ follow up of randomized studies of adjuvant CMF in operable breast cancer: cohort study. Br. Med. J., 2005, 330(7485): 217.
Br. Med. J., 2005, 330(7485): 217.
6. Fisher B, Brown AM, Dimitrov NV, Poisson R, Redmond C. Two months of doxorubicin-cyclophosphamide with and without interval reinduction therapy compared with 6 months of cyclophosphamide, methotrexate, and fluorouracil in positive-node breast cancer patients with tamoxifen-nonresponsive tumors: results from the National Surgical Adjuvant Breast and Bowel Project B-15. J. Clin. Oncol., 1990, 8(9): 1483-1496.
7. Fisher B, Anderson S, Wolmark N, Tan-Chiu E. Chemotherapy With or Without Tamoxifen for Patients with ER negative Breast Cancer and Negative Nodes: Results from NSABP B23. Proc. Am. Soc. Clin. Oncol., 2000: abstr. 277.
8. Martin M, Villar A, Sole-Calvo A, Gonzalez R, Massuti B. GEICAM Group (Spanish Breast Cancer Research Group), Spain. Doxorubicin in combination with fluorouracil and cyclophosphamide (i.v. FAC regimen, day 1, 21) versus methotrexate in combination with fluorouracil and cyclophosphamide (i.v. CMF regimen, day 1, 21) as adjuvant chemotherapy for operable breast cancer: a study by the GEICAM group.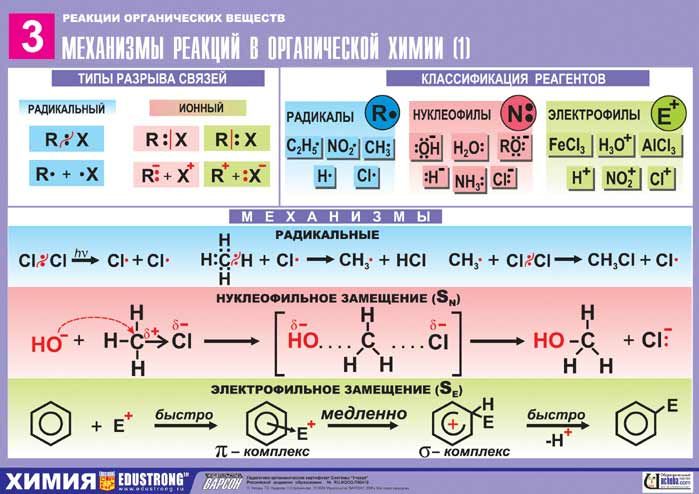 Ann. Oncol., 2003, 14: 833-842.
Ann. Oncol., 2003, 14: 833-842.
9. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomized trials. Lancet, 2005, 365: 1687-1717.
10. Early Breast Cancer Trialists’ Collaborative Group. Comparisons between different polychemotherapy regimens for early breast cancer: meta-analyses of long-term outcome among 100,000 women in 123 randomized trials. Lancet, 2012, 379(9814): 432-444.
11. Снеговой А.В., Абрамов М.Е., Булавина И.С. и соавт. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных. Злокачественные опухоли, 2015, 4(спецвыпуск): 327–337.
12. Cubeddu LX, Pendergrass K, Ryan T, et al. Efficacy of oral ondansetron, a selective antagonist of 5HT3 receptors, in the treatment of nausea and vomiting associated with cyclophosphamide-based chemotherapy. Am. J. Clin. Oncol., 1994, 17: 137–146.
13. Bloechl-Daum B, Deuson RR, Mavros P, Hansen M, Herrstedt J. Delayed nausea and vomiting continue to reduce patients’ quality of life after highly and moderately emetogenic chemotherapy despite antiemetic treatment. J. Clin. Oncol., 2006, 24: 4472-4478.
14. Warr DG, Hesketh PJ, Gralla RJ, et al. Efficacy and tolerability of aprepitant for the prevention of chemotherapy-induced nausea and vomiting in patients with breast cancer after moderately emetogenic chemotherapy. J. Clin. Oncol., 2005, 23: 2822-2830.
15. Kris MG, Hesketh PJ, Somerfield MR, et al. American Society of Clinical Oncology guideline for antiemetics in oncology: update 2006. J. Clin. Oncol., 2006, 24(18): 2932-2947.
16. The Antiemetic Subcommittee of the Multinational Association of Supportive Care in Cancer. PrrowEvention of chemotherapy and radiotherapy-induced emesis: results of the 2004 Perugia Consensus Conference. Ann. Oncol., 2006, 17: 20-28.
17. Common Terminology Criteria for Adverse Events, Version 3. 0: http://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcaev3.pdf.
0: http://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcaev3.pdf.
18. Rapoport BL, Jordan K, Boice JA et al. Aprepitant for the prevention of chemotherapy-induced nausea and vomiting associated with a broad range of moderately emetogenic chemotherapies and tumor types: a randomized, doubleblind study. Support Care Cancer, 2010, 18(4): 423-431.
19. Grote T, Hajdenberg J, Cartmell A, et al. Combination therapy for chemotherapy-induced nausea and vomiting in patients receiving moderately emetogenic chemotherapy: palonosetron, dexamethasone, and aprepitant. J Support Oncol, 2006, 4: 403–408.
20. Herrstedt J, Muss HB, Warr DG, et al. Aprepitant Moderately Emetogenic Chemotherapy Study Group Efficacy and tolerability of aprepitant for the prevention of chemotherapy-induced nausea and emesis over multiple cycles of moderately emetogenic chemotherapy. Cancer, 2005, 104: 1548–1555.
Схема химической реакции. Закон сохранения массы веществ при химической реакции.
 Химическое уравнение
Химическое уравнениеХимия. 7 класс. Попель
Материал параграфа поможет вам:
- выяснить, что такое схема химической реакции;
- понять суть закона сохранения массы веществ при химической реакции;
- научиться превращать схемы реакций в химические уравнения.
Схема химической реакции. Существует несколько способов записи химических реакций. С одним из них вы ознакомились в § 17. Приводим еще один пример:
сера + кислород —> сернистый газ.
Такая запись дает мало информации; в частности, она не указывает на химический состав реагентов и продуктов. Этого недостатка лишена другая запись, которую называют схемой реакции. В ней вместо названий веществ приведены их химические формулы
- Назовите химические элементы, которыми образованы исходное вещество и продукты этой реакции.
Это интересно
Схемы реакций у алхимиков выглядели так:
1 Для серы здесь и далее будем использовать формулу S, а не S8, которую в действительности имеет молекула этого вещества.
Михаил Васильевич Ломоносов (1711—1765)
Выдающийся русский ученый, первый русский академик Петербургской академии наук. Разработал одну из теорий строения веществ (40-е годы XVIII в.). Открыл закон сохранения массы веществ при химических реакциях и закон сохранения количества движения (1748—1760). Изучал химические свойства металлов, анализировал состав минералов, разработал способы изготовления минеральных красок, цветного стекла. Внес существенный вклад в развитие «химического языка». Автор книг по истории России, поэт, художник, геолог, географ, инженер, педагог. Один из основателей первого в России Московского университета.
Схема реакции дает возможность сделать важный вывод: все химические элементы во время реакции сохраняются.
Закон сохранения массы веществ при химической реакции. Общеизвестно, что после сгорания бумаги остается пепел, масса которого намного меньше массы бумаги. Если же сильно нагревать (прокаливать) медную пластину на воздухе, то обнаружим противоположное — масса пластины увеличится (металл покроется черным налетом).
Осуществим оба химических превращения в закрытых сосудах. Результаты опытов будут другими. Взвесив закрытые сосуды с веществами до и после каждого эксперимента, обнаружим, что суммарная масса веществ в результате реакций не изменяется. Соответствующую гипотезу выдвинул в 1748 г. русский ученый М. В. Ломоносов, а в 1756 г. подтвердил ее, выполнив ряд химических экспериментов. Не зная об открытии Ломоносова, к аналогичному выводу пришел в 1789 г. французский ученый А. Л. Лавуазье.
Антуан Лоран Лавуазье (1743—1794)
Выдающийся французский химик, один из основателей научной химии. Академик Парижской академии наук. Ввел в химию количественные (точные) методы исследования. Экспериментально определил состав воздуха и доказал, что горение — это реакция вещества с кислородом, а вода — соединение Гидрогена с Оксигеном (1774—1777). Составил первую таблицу простых веществ (1789), предложив фактически классификацию химических элементов. Независимо от М. В. Ломоносова открыл закон сохранения массы веществ при химической реакции.
Ломоносова открыл закон сохранения массы веществ при химической реакции.
Ломоносов и Лавуазье открыли закон сохранения массы веществ при химической реакции. Его формулируют так:
масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Объясним, почему массы пепла и прокаленной меди отличаются от масс бумаги и меди до ее нагревания.
В процессе горения веществ — компонентов бумаги — участвует кислород, имеющийся в воздухе (рис. 51, а). Во время реакции, кроме твердых веществ, входящих в состав пепла, образуются углекислый газ и вода (в виде пара). Эти два вещества поступают в воздух и рассеиваются. Поскольку их суммарная масса превышает массу кислорода, то масса пепла всегда будет меньше массы бумаги.
Рис. 51. Реакции веществ бумаги (а) и меди (б) с кислородом
При нагревании меди кислород воздуха «соединяется» с ней (рис. 51, б). Металл постепенно превращается в вещество черного цвета (его химическая формула — CuО, а название — купрум(II) оксид). Поэтому масса продукта реакции оказывается больше массы меди.
Поэтому масса продукта реакции оказывается больше массы меди.
- Прокомментируйте опыт, изображенный на рисунке 52, и сделайте вывод.
Химическое уравнение. Общая масса веществ при химическом превращении не изменяется, поскольку атомы химических элементов во время реакции не возникают и не исчезают. Другими словами, количество атомов каждого элемента до реакции равно количеству его атомов после реакции. На это указывают схемы реакций, приведенные в начале параграфа. Заменим в них стрелки между левыми и правыми частями на знаки равенства:
Такие записи называют химическими уравнениями.
Рис. 52. Опыт, подтверждающий закон Ломоносова — Лавуазье: а — начало опыта; б — окончание опыта
Химическое уравнение — это запись химической реакции с помощью формул реагентов и продуктов, которая соответствует закону сохранения массы веществ.
Схемы многих реакций не согласуются с законом Ломоносова — Лавуазье. Например, схема реакции образования воды из водорода и кислорода:
Например, схема реакции образования воды из водорода и кислорода:
В обеих частях схемы имеются одинаковые количества атомов Гидрогена, но разные количества атомов Оксигена.
Преобразуем схему в химическое уравнение. Для того чтобы в правой части, как и в левой, было два атома Оксигена, поставим перед формулой воды коэффициент 2:
Теперь атомов Гидрогена в правой части стало четыре. Чтобы такое же количество атомов Гидрогена было и в левой части, запишем перед формулой водорода коэффициент 2. Получаем химическое уравнение:
Таким образом, чтобы преобразовать схему реакции в химическое уравнение, нужно сопоставить количества атомов каждого элемента в левой и правой частях схемы, подобрать (в случае необходимости) коэффициенты для каждого исходного вещества и продукта реакции, записать их перед соответствующими химическими формулами и заменить стрелку на знак равенства.
Возможно, кто-то из вас составит уравнение 4Н2 + 2О2 = 4Н2О. В нем левая и правая части содержат одинаковые количества атомов каждого элемента, но все коэффициенты можно уменьшить, разделив на 2. Это и следует сделать.
В нем левая и правая части содержат одинаковые количества атомов каждого элемента, но все коэффициенты можно уменьшить, разделив на 2. Это и следует сделать.
УПРАЖНЕНИЕ. Преобразовать схему реакции
Al + H2SO4 —> Al2(SO4)3 + Н2↑
в химическое уравнение.
Решение
Сравниваем количества атомов Алюминия, Гидрогена, Сульфура, записанные в обеих частях схемы реакции. В левой части схемы имеется один атом Алюминия, а в правой — два. Запишем перед формулой металла коэффициент 2:
2Аl + H2SO4 —> Al2(SO4)3 + Н2↑.
Атомов Сульфура справа от стрелки в три раза больше, чем слева. Поставим в левой части схемы перед формулой соединения Сульфура коэффициент 3:
2Аl + 3H2SO4 —> Al2(SO4)3 + Н2↑.
Теперь слева количество атомов Гидрогена увеличилось до шести (3 • 2 = 6), а в правой части таких атомов только два. Для того чтобы и справа их было шесть, запишем перед формулой водорода коэффициент 3:
2Аl + 3H2SO4 —> Al2(SO4)3 + 3Н2↑.
Сопоставим количество атомов Оксигена в обеих частях схемы. Они одинаковы: 3 • 4 = 4 • 3. Заменим стрелку на знак равенства и получим химическое уравнение:
2Аl + 3H2SO4 = Al2(SO4)3 + 3Н2↑.
Выводы
Химические реакции записывают с помощью схем реакций и химических уравнений.
Схемы реакций содержат формулы реагентов и продуктов, а химические уравнения, как правило, — еще и коэффициенты.
Химическое уравнение соответствует закону сохранения массы веществ Ломоносова — Лавуазье: масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
Атомы химических элементов во время реакций не возникают и не исчезают.
139. Чем отличается химическое уравнение от схемы реакции?
140. Допишите пропущенные коэффициенты в химических уравнениях:
141. Преобразуйте в химические уравнения такие схемы реакций:
142. Составьте формулы продуктов реакций и соответствующие химические уравнения:
143. Вместо точек запишите формулы простых веществ и составьте химические уравнения:
Примите во внимание, что бор и углерод состоят из атомов, фтор, хлор, водород и кислород — из двухатомных молекул, а фосфор (белый) — из четырехатомных молекул.
144. Прокомментируйте дополнительные обозначения в схемах реакций и составьте соответствующие химические уравнения:
145. Какая масса негашеной извести была получена при длительном прокаливании 25 г мела, если, кроме извести, образовалось 11 г углекислого газа?
ГДЗ к учебнику можно найти тут.
Попередня
СторінкаНаступна
СторінкаЗміст
Цей контент створено завдяки Міністерству освіти і науки України
Chemistry Diagram – Bilder und Stockfotos
6.495Bilder
- Bilder
- Fotos
- Grafiken
- Vektoren
- Videos
Niedrigster Preis
SignatureBeste Qualität
Durchstöbern Sie 6.495
chemistry diagram Stock- Фотографии и фотографии. Oder starten Sie eine neuesuche, um noch mehr Stock-Photografie und Bilder zu entdecken. элемента хинтергрунд – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символElements Hintergrund
структура атомов – химическая диаграмма фондовая графика, -клипарт, -мультфильмы и -символСтруктура атомов
Periodensystem der Elemente – химическая диаграмма фондовая графика, -клипарт, -мультфильмы и -символPeriodensystem der Elemente
Periodensystem der Elemente mit Ordnungszahl, Symbol und Gewicht.
Ebenen der Proteinstruktur von Aminosäuren bis zum Komplex des…
schritte der dna-replikation – диаграмма химии stock-grafiken, -clipart, -cartoons und -symboleschritte der DNA-Replikation
DNA-Replikation. Шритт. Doppelhelix wird abgewickelt. Jeder getrennte Strang dient as Vorlage für die Replikation eines neuen Strangs. Vektordiagramm für wissenschaftliche, medizinische und pädagogische Zwecke
chemie schreibtafel – химическая диаграмма, графика, клипарт, мультфильмы и символыChemie Schreibtafel
Die Abbildung enthält eine Transparenz Mischungen/Farbverläufe. Zusätzliche .aiCS5-Datei enthalten. EPS 10
векторные абстрактные молекулы с 3D папиросной бумагой, интегрированные края. freiraum für inhalte – диаграмма химии стоковые графики, -клипарты, -мультфильмы и -символы Векторные абстрактные молекулы с 3D-бумагой, интегрированные. ..
..
Векторные абстрактные молекулы с 3D-бумагой, интегрированные Kreisen. Leerraum für Content, Business, Infografik-Template, Diagramm, Netzwerk, Webdesign. Хеллграуер Хинтергрунд. Konzept der Social-Media-Verbindungstechnologie
Arten von Biologischen Molekülen: Kohlenhydrate, lipide, nukleinsäuren und proteine - диаграмма химии stock-grafiken, -clipart, -cartoons und -symbole графика, клипарт, мультфильмы и символыDNA-Molekül-Struktur
Hintergrund der DNA-Molekülstrukturformel. Vektor-Illustration
химическая основа – химическая диаграмма, фото и изображенияChemical Hintergrund
Chemie-formeln von neurotransmitters und vergleichbare stoffe in menschlicher körper – chemie-formeln von neurotransmitters und vergleichbare stoffe in menschlicher körper – chemie-formeln von neurotransmitters und vergleichbare stoffe in menschlicher körper – chemie-formeln von neurotransmitters und vergleichbare stoffe in menschlicher körper – chemie-formeln von neurotransmitters und vergleichbare stoffe in menschlicher körper – chemie-formeln von neurotransmitters und vergleichbare stoffe in menschlicher körper – chemie-formeln von neurotransmitters und vergleichbare stoffe в. .. , Enzymen und ähnlichen Substanzen des menschlichen Körpers. фильтрация. физический эксперимент. trennung – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символ
.. , Enzymen und ähnlichen Substanzen des menschlichen Körpers. фильтрация. физический эксперимент. trennung – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символФильтрация. физический эксперимент. Trennung
cm curium element information – fakten, eigenschaften, Trends, verwendungen und vergleich Periodensystem der Elemente, schalenstruktur von curium – elektronen pro energieniveau – химическая диаграмма, графика, -клипарт, -мультфильмы и -символсм Curium Element Information – Fakten, Eigenschaften, Trends,…
абстрактный инфографический шаблон – химическая диаграмма, графика, клипарт, мультфильмы и символыАбстрактный инфографический шаблон
Abstrakte Infografikvorlage im Vektor
prozess-infografik-vorlage für schwer- und energieindustrie. prozesszeitachsendiagramm. workflow-layout mit linearen symbolen – диаграмма химии сток-график, -клипарт, -мультфильмы и -символ Prozess-Infografik-Vorlage für Schwer- und Energieindustrie. …
…
Vector-Logo filtern
vektor-molekül mit 3d papieretkett, integrierte sechseck-hintergrund – химическая диаграмма, графика, -клипарт, -мультфильмы и -символВектор-молекулярная структура с трехмерной бумажной этикеткой, интегрированной структурой Sechseck-Hintergr
триптофана. 3D-иллюстрация – химическая диаграмма, фото и изображенияСтруктура молекулы триптофана. 3D иллюстрация
Abstrakte Sechseck Hintergrund, polygonale Technologiekonzept
ändern den zustand der materie aus festen, flussigen und gasförmigen wegen der Temperature. вектор-иллюстрация. – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символÄndern den Zustand der Materie aus festen, flussigen und gasförmig
3d-isometrischer flacher vektor konzeptionelle illustration von bodenuntersuchungen – химия диаграмма сток-график, -клипарт, -мультфильмы и -symbole 3D-изометрический флачер Vektor Konzeptionelle Иллюстрация из. ..
..
Иконки химии — Monoline серия
дистилляциипроцесс векторные иллюстрации, треннпроцесс erklärungsschema – химия диаграмма сток-график, -клипарт, -мультфильмы и -символDestillationsprozess Vektor Illustration, Trennprozess Erklärungss
drei arten von kovalenten anleihen, einschließlich einzel-, doppel- und dreifachanleihen – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символDrei Arten von kovalenten Anleihen, einschließlich Einzel-,…
Modern gestylt Periodensystem der Elemente – химическая диаграмма Stock-grafiken, -clipart, -cartoons und -symboleModern gestylt Periodensystem der Elemente
milchsäure-molekülstruktur. 3D-иллюстрация – химическая диаграмма, фото и изображениеMilchsäure-Molekülstruktur. 3D-иллюстрация
filtationsprozess der mischung von feststoff- und flüssigkeitswissenschaft Experiment vektor illustration – химическая диаграмма, графика, клипарт, мультфильмы и символыFiltrationsprozess der Mischung von Feststoff- und Flussigkeitswis
h3o, wassermolekül, planetenmodell, chemische und strukturelle formel – химическая диаграмма, графика, -клипарт, -мультфильмы и -символ h3O, Wassermolekül, Planetenmodell, chemische und strukturelle. .. – химическая диаграмма фондовая графика, -клипарт, -мультфильмы и -символ
.. – химическая диаграмма фондовая графика, -клипарт, -мультфильмы и -символ
Verbindungsnetzwerk
auftriebskraft, иллюстративная pädagogische physik диаграмма. – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символAuftriebskraft, иллюстративный pädagogische Physik Diagramm.
Auftriebskraft, иллюстративная педагогическая диаграмма Physikdiagramm Poster.
молекулярная структура норадреналина. 3D-иллюстрация – химическая диаграмма, фото и изображениеНорадреналин-молекулярная структура. 3D-иллюстрация
Старая рукопись с первоначальным начертанием – химическая диаграмма стоковые фотографии и изображения0002 Eine alte Handschrift mit rituellen Zeichnungen Химический формальный медицинский эксперимент – химическая диаграмма фото и изображенияХимический формальный медицинский эксперимент
Структура ДНК-двойной спирали. дезоксирибонуклеиновые кислоты. основа stickstoffhaltige и цукерфосфат-рюкграт. тимин, аденин, цитозин, гуанин. – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символ
тимин, аденин, цитозин, гуанин. – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символStruktur der DNA-Doppelhelix. Desoxyribonukleinsäuren….
стресс-реакция векторная иллюстрация systemdiagramm нервно-импульсная схема. – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символStress Reaktion Vector Illustration Systemdiagramm Nervenimpulse…
Stress-Response-System Vector-Illustrationsdiagramm, Nervenimpuls-Schema. Medizinische Bildungsinformationen.
chemie-illustration zeigt formweise atomorbital, die die die elektronenverteilung beschreiben (s, p, d) – диаграмма химии stock-grafiken, -clipart, -cartoons und -symboleChemie-Illustration zeigt formweise Atomorbital, die die… набор символов – химическая диаграмма, графика, клипарт, мультфильмы и символы
Nahtlose Wissenschaft Symbole Muster
abstrakte sechseck hintergrund, polygonale technologiekonzept – chemistry diagram stock-grafiken, -clipart, -cartoons und -symboleAbstrakte Sechseck Hintergrund, polygonale Technologiekonzept
vektorwissenschaftliche chemische darstellung der verdünnung einer auf weiß isolierten lösung. verringerung der konzentration eines gelösten stoffes in einer lösung. konzentrierte und verdünnte lösung. – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символ
verringerung der konzentration eines gelösten stoffes in einer lösung. konzentrierte und verdünnte lösung. – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символVektorwissenschaftliche Chemische Darstellung der Verdünnung…
Vektor wissenschaftliche chemische Darstellung der Verdünnung einer auf weißem Hintergrund isolierten Lösung. Verringerung der Konzentration eines gelösten Stoffes in einer Lösung. Konzentrierte und verdünnte Lösung. с1V1 = c2V2. Vorführung в zwei Bechergläsern.
handgezeichnete illustration menschlicher niren auf dunkelgrünem hintergrund. – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символHandgezeichnete Illustration menschlicher Nieren auf dunkelgrünem
wissenschaftliches molekülmuster – химическая диаграмма фондовая графика, -клипарт, -мультфильмы и -символwissenschaftliches Molekülmuster
handgezeichnete illustration der menschlichen leber auf hinterdunkelblauem.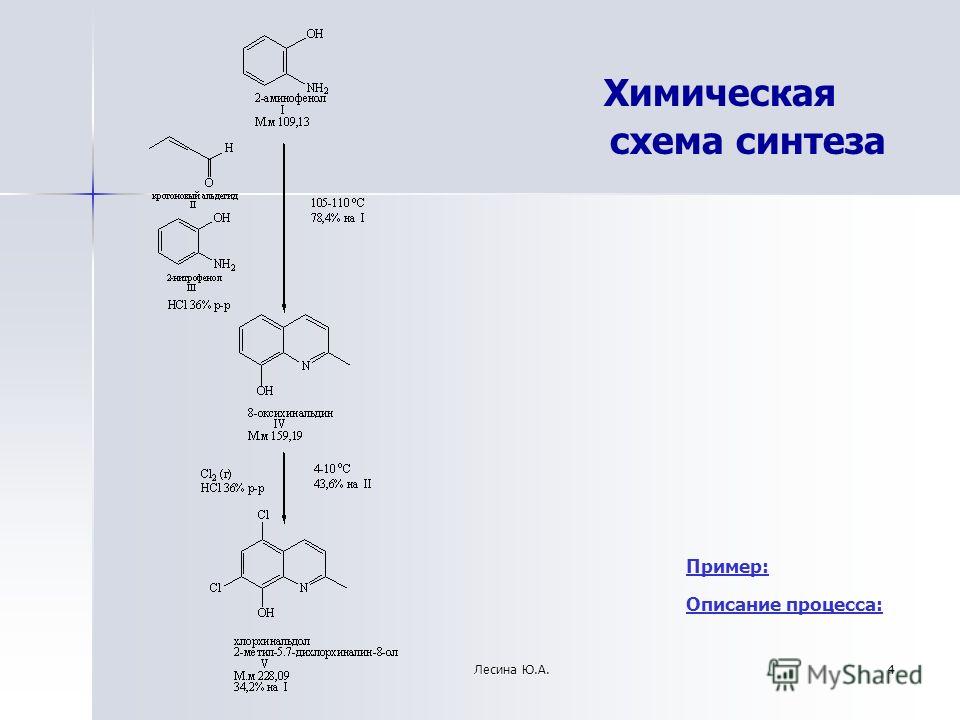 – химическая диаграмма фондовая графика, -клипарт, -мультфильмы и -символ
– химическая диаграмма фондовая графика, -клипарт, -мультфильмы и -символHandgezeichnete Illustration der menschlichen Leber auf…
Medizinisches, wissenschaftliches Set mit den wichtigsten menschlichen Organen mit leerem Kopierraum für Text or Infografik auf dunkelblauem Hintergrund
фотосинтез-диаграмма. prozess der pflanze produzieren sauerstoff. процесс фотосинтеза бессрочный. – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символФотосинтез-Диаграмма. Prozess der Pflanze produzieren…
Poster zur Botanik der wissenschaftlichen Bildung. Фотосинтез-Prozessposter mit Pflanze, Text und Pfeilen. Bestandsvektor-Illustration
ein kleines hud mit einem menschlichen körperbild und einem wissenschaftler oder einem arzt, der damit arbeitet – химическая диаграмма стоковые фотографии и изображенияEin kleines HUD mit einem menschlichen Körperbild und einem…
handgezeichnete illustration des menschlichen gehirns auf dunkelblauemhintergrund. – химическая диаграмма фондовая графика, -клипарт, -мультфильмы и -символ
– химическая диаграмма фондовая графика, -клипарт, -мультфильмы и -символHandgezeichnete Illustration des menschlichen Gehirns auf…
Medizinisches, wissenschaftliches Set mit den wichtigsten menschlichen Organen mit leerem Kopierraum für Text oder Infografik auf dunkeltorblauem Hintergrund 9003molund mit 3d papieretikett, integrierte sechseck-hintergrund – химическая диаграмма, графика, -клипарт, -мультфильмы и -символ
Вектор-молекул с 3D-бумагой, интегрированный Sechseck-Hintergr
Вектор-молекул с 3D-бумагой, интегрированный Hexagonhintergrund. Leerraum for Content, Business, Infografik, Diagramm, digitales Netzwerk, Flussdiagramm. Konzept der Netzwerkanbindungstechnologie
essentielle nährstoffe für die gesundheit der bauchspeicheldrüse einschließlich никель, хром, медь, манган. – химическая диаграмма, графика, клипарт, мультфильмы и символы Essentielle Nährstoffe für die Gesundheit der Bauchspeicheldrüse. ..
..
Entwerfen Sie einen Satz der wichtigsten menschlichen Organe mit molekularem Gitter, essentiellen Mikronährstoffen und Vitaminen auf dunkelgrünem Hintergrund.
vektordiagramm mit sich ändernden zuständen der materie, drei zuständen der materie mit unterschiedlichen molekularen anordnungen – fest, flussig, gasförmig. gefrieren, schmelzen, конденсация, verdampfung, сублимация, абшайдунг. – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символVektordiagramm mit sich ändernden Zuständen der Materie, drei…
junge schöne afroamerikanische sanitäterin in laborkittel und schutzhandschuhen arbeitet mit einem hud-bildschirm in einem futuristischen labor an einem späten abend – chemistry diagram stock-fotos und bilderJunge schöne afroamerikanische Sanitäterin in Laborkittel und…
dichte und zustände der materie. dichte ist eine masse einer volumeneinheit. – химическая диаграмма, графика, клипарт, мультфильмы и символы Dichte und Zustände der Materie.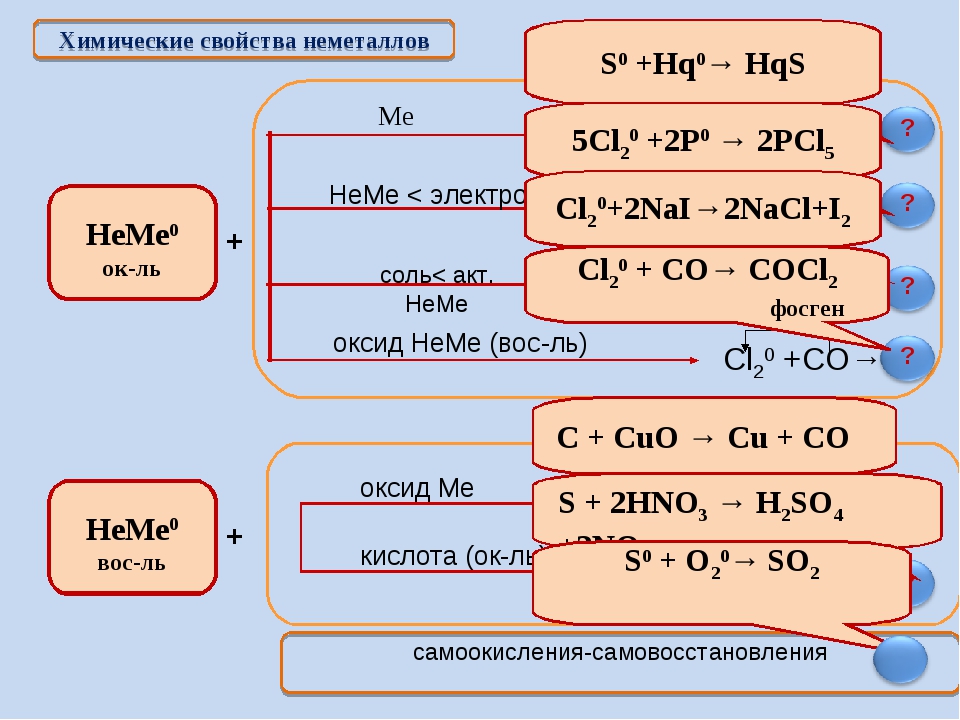 Dichte ist eine Masse einer…
Dichte ist eine Masse einer…
Verwendung von anabolen Steroiden. Männliche Hand mit Spritze…
ДНК-структура. – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символDNA-Struktur.
ДНК-Структур. Vektordiagramm for Ihr Design, Ihre Bildung, Wissenschaft und Medizin
антикварные иллюстрации, физические принципы и эксперименты, электричество и магнетизм: galvanis froschexperiment – химическая диаграмма, графика, клипарт, мультфильмы и символыAntike Illustration, physikalische Prinzipien und Experimente,…
essentielle nährstoffe für die gesundheit der bauchspeicheldrüse einschließlich никель, хром, медь, манган. – химическая диаграмма фондовая графика, -клипарт, -мультфильмы и -символEssentielle Nährstoffe für die Gesundheit der Bauchspeicheldrüse…
Entwerfen Sie ein Set der wichtigsten menschlichen Organe mit molekularem Gitter, essentiellen Mikronähr Symbolstoffen uenden aufblade Genesung.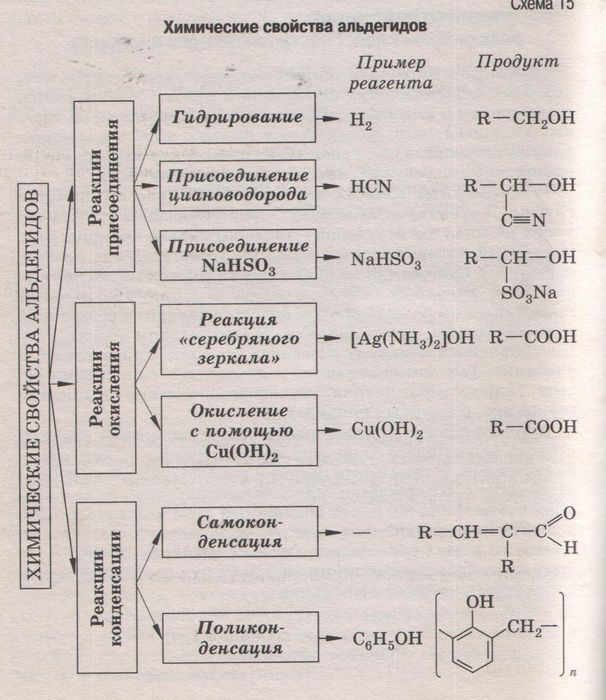
Vektorwissenschaftliche Darstellung einer auf Weiß isolierten Lösu
Vektorwissenschaftliche Darstellung einer auf weißem Hintergrund isolierten Lösung. Lösen von festen Partikeln oder Ionen in einer Flüssigkeit, Chemie. Becherglas oder Behälter mit gelöstem Stoff in einem Lösungsmittel. In einem Lösungsmittel gelöster Stoff.
biomasse-energielandschaftsplakat mit nützlichen infografiken – диаграмма химии stock-grafiken, -clipart, -cartoons und -symbole molekularen HintergrundWissenschaftliches Bakground mit komplizierten organischen Molekülen
chemische structur eines typeischen synapse. нейротрансмиттер-freisetzung механизм – химическая диаграмма сток-график, -клипарт, -мультфильмы и -символ Химическая структура типичных синапсов. Нейротрансмиттер-Фрайс
Нейротрансмиттер-Фрайс
1.12: Рисование химических структур – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31379
Цели
После завершения этого раздела вы сможете
- предложить одну или несколько приемлемых структур Кекуле (структурных формул) для любой заданной молекулярной формулы
- напишите молекулярную формулу соединения, учитывая его структуру Кекуле.
- нарисуйте сокращенную структуру соединения, учитывая его структуру Кекуле.
- интерпретировать сокращенные структуры и преобразовывать их в структуры Кекуле.
- напишите молекулярную формулу соединения, учитывая его сокращенную структуру.

Учебные заметки
Рисуя структуру нейтрального органического соединения, полезно помнить, что
- каждый атом углерода имеет четыре связи.
- каждый атом азота имеет три связи.
- каждый атом кислорода имеет две связи.
- каждый атом водорода имеет одну связь.
Изучая общую химию, вы, возможно, уже изучали молекулярные структуры, используя структуры Льюиса. Поскольку органическая химия может включать большие молекулы, было бы полезно, если бы структуры Льюиса можно было сокращать. Три различных способа рисования органических молекул включают формулы Кекуле, сокращенные формулы и скелетные структуры (также называемые структурами линейных связей или линейными формулами). В ходе этого курса вы увидите молекулы, записанные во всех трех формах. Будет полезнее, если вы привыкнете переходить от одного стиля рисования к другому, смотреть на рисунки и понимать, что они представляют. Развитие способности конвертировать между различными типами формул требует практики и в большинстве случаев помощи молекулярных моделей. Студентам и профессиональным химикам доступны многие виды наборов моделей, и начинающим студентам рекомендуется приобрести один из них.
Студентам и профессиональным химикам доступны многие виды наборов моделей, и начинающим студентам рекомендуется приобрести один из них.
Упрощение структурных формул может быть достигнуто без потери информации, которую они передают. Формулы Кекуле — это просто термин органической химии для структур Льюиса, с которыми вы уже сталкивались. В сокращенных структурных формулах связи с каждым углеродом опущены, но каждая отдельная структурная единица (группа) написана с цифрами в нижнем индексе, обозначающими несколько заместителей, включая атомы водорода. В формулах строк полностью опущены символы углерода и водорода (если только водород не связан с атомом, отличным от углерода). Каждый отрезок прямой линии представляет собой связь, концы и точки пересечения линий представляют собой атомы углерода, а правильное количество атомов водорода рассчитывается исходя из четырехвалентности углерода. Несвязывающие электроны валентной оболочки в этих формулах не учитываются.
Кекуле (также известный как структуры Льюиса)
Формула Кекуле или структурная формула отображает атомы молекулы в том порядке, в котором они связаны. Он также изображает, как атомы связаны друг с другом, например, одинарная, двойная и тройная ковалентная связь. Ковалентные связи показаны линиями. Число черточек указывает, является ли связь одинарной, двойной или тройной ковалентной связью. Показаны все метки атомов и все одинокие пары.
Краткая формула
Краткая формула состоит из символов элементов. Сокращенные структурные формулы показывают порядок атомов, как и структурные формулы, но записываются в одну строку, чтобы сэкономить место и сделать запись более удобной и быстрой. Порядок атомов предполагает связность в молекуле. Сокращенные структурные формулы также помогают показать, что группа атомов связана с одним атомом в соединении. Когда это происходит, вокруг группы атомов используются круглые скобки, чтобы показать, что они вместе. Кроме того, если к данному атому присоединено несколько одинаковых заместителей, это отображается номером в нижнем индексе. Пример – CH 4 , который представляет собой четыре атома водорода, присоединенные к одному и тому же углероду. Сокращенные формулы можно читать с любого направления, и H 3 C совпадает с CH 3 , хотя последнее встречается чаще.
Пример – CH 4 , который представляет собой четыре атома водорода, присоединенные к одному и тому же углероду. Сокращенные формулы можно читать с любого направления, и H 3 C совпадает с CH 3 , хотя последнее встречается чаще.
Посмотрите на приведенные ниже примеры и сопоставьте их с идентичными молекулами по структурам Кекуле и линейным формулам.
| СН 3 СН 2 ОН | ClCH 2 CH 2 CH(OCH 3 )СН 3 | CH 3 NHCH 2 COOH |
| А | Б | С |
Давайте внимательно посмотрим на пример B. Когда вы работаете с сокращенной формулой, вы хотите сосредоточиться на углероде и других элементах, которые не являются водородом. Водороды важны, но обычно они используются для завершения октетов. Также обратите внимание на -OCH 3 написано в скобках, что говорит вам, что это не часть основной цепи углерода. Когда вы читаете сокращенную формулу, если вы достигаете атома, который не имеет полного октета к тому времени, когда вы достигаете следующего водорода, то, возможно, существуют двойные или тройные связи. В примере C углерод имеет двойную связь с кислородом и одинарную связь с другим кислородом. Обратите внимание, что COOH означает C(=O)-OH вместо CH 3 -C-O-O-H, потому что углерод не имеет полного октета и кислорода.
Также обратите внимание на -OCH 3 написано в скобках, что говорит вам, что это не часть основной цепи углерода. Когда вы читаете сокращенную формулу, если вы достигаете атома, который не имеет полного октета к тому времени, когда вы достигаете следующего водорода, то, возможно, существуют двойные или тройные связи. В примере C углерод имеет двойную связь с кислородом и одинарную связь с другим кислородом. Обратите внимание, что COOH означает C(=O)-OH вместо CH 3 -C-O-O-H, потому что углерод не имеет полного октета и кислорода.
Формула линии
Поскольку органические соединения иногда могут быть сложными, формулы угла линии используются для более эффективного написания атомов углерода и водорода путем замены буквы «C» линиями. Атом углерода присутствует везде, где линия пересекает другую линию. Атомы водорода опущены, но предполагается, что они присутствуют для завершения каждой из четырех связей углерода. Показаны атомы водорода, присоединенные к другим элементам, кроме углерода. Показаны метки атомов для всех остальных элементов. Электроны неподеленной пары обычно не учитываются. Предполагается, что они присутствуют для завершения октета неуглеродных атомов. Линии формул помогают показать структуру и порядок атомов в соединении.
Показаны метки атомов для всех остальных элементов. Электроны неподеленной пары обычно не учитываются. Предполагается, что они присутствуют для завершения октета неуглеродных атомов. Линии формул помогают показать структуру и порядок атомов в соединении.
Эти молекулы соответствуют точно таким же молекулам, которые изображены для структур Кекуле и сокращенных формул. Обратите внимание, что углероды больше не нарисованы и заменены концами и изгибами линий. Кроме того, водороды были опущены, но их можно было легко втянуть (см. Практические задачи). Хотя мы обычно не рисуем Н, которые связаны с углеродом, мы рисуем их, если они связаны с другими атомами, помимо углерода (примером является группа ОН выше в примере А). Это делается потому, что не всегда ясно, окружен ли неуглеродный атом неподеленными парами или атомами водорода. Также в примере A обратите внимание, как ОН нарисован со связью со вторым углеродом, но это не означает, что на конце этой связи/линии есть третий углерод.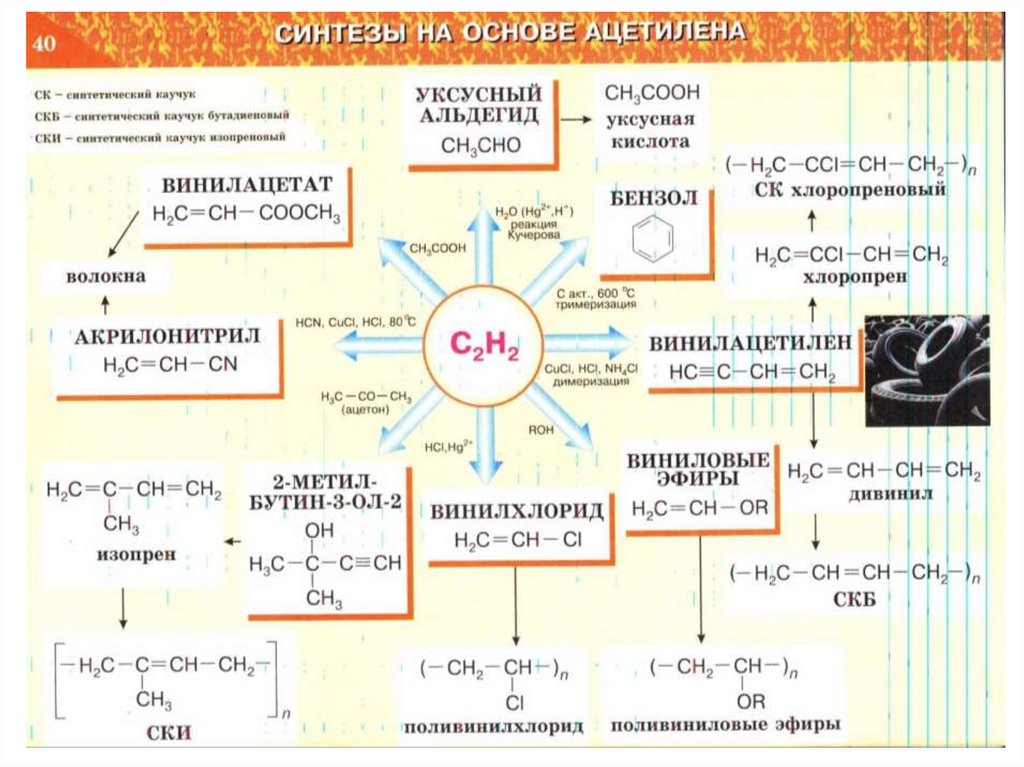
| Формула Кекуле | Концентрированная формула | Формула линии |
|---|---|---|
| СН 3 (СН 2 ) 3 ОН | ||
| СН 3 СН 2 СН(ОН)СН 3 | ||
| (СН 3 ) 2 СНСН 2 ОН | ||
| (CH 3 ) 3 COH | ||
| CH 3 CH 2 OCH 2 CH 3 | ||
| Таблица \(\PageIndex{1}\): Структурные формулы для C 4 H 10 О изомеры | ||
Пример: Преобразование между структурными формулами
Полезно преобразовывать соединения в различные структурные формулы (Кекуле, Линейная и Сокращенная) в зависимости от типа заданного вопроса. Стандартные экзамены часто включают большой процент сокращенных формул, потому что набирать буквы и цифры проще и дешевле, чем импортировать цифры. Первоначально может быть сложно написать структуру Line непосредственно из сокращенной формулы. Сначала напишите структуру Кекуле из сокращенной формулы, а затем нарисуйте структуру Линии из Кекуле.
Стандартные экзамены часто включают большой процент сокращенных формул, потому что набирать буквы и цифры проще и дешевле, чем импортировать цифры. Первоначально может быть сложно написать структуру Line непосредственно из сокращенной формулы. Сначала напишите структуру Кекуле из сокращенной формулы, а затем нарисуйте структуру Линии из Кекуле.
а) Сокращенная формула пропаналя: CH 3 CH 2 CHO. Нарисуйте структуру Кекуле.
Структура Кекуле для пропаналя показана ниже. Помните, что каждый углерод будет иметь четыре связи, а октет кислорода заполнен неподеленными парами.
Структура линии связи для пропаналя показана ниже. Во-первых, удалите водороды. Водород, присоединенный к альдегидной группе, остается, потому что он является частью функциональной группы. Удалите метки «C» со конструкции и оставьте линии на месте. Наконец, удалите все одинокие пары.
Все три структуры представляют собой одно и то же соединение, пропаналь.
б) Ниже приведена линейная структура молекулы триметиламина.
Чтобы преобразовать его в структуру Кекуле, сначала определите атомы углерода в молекуле. Будет в углах и концах строки без метки атома. Триметиламин имеет три атома углерода. Затем добавляйте атомы водорода к углероду, пока не появятся четыре связи. Каждый углерод в триметиламине одинарно связан с азотом. Это означает, что каждому углероду потребуются три дополнительные связи C-H, чтобы создать свой октет. Наконец, добавьте одиночные пары к другим элементам, чтобы заполнить их октеты. Азот в триметиламине связан с тремя атомами углерода. Это означает, что для завершения октета потребуется один из электронов неподеленной пары.
Упражнения
- Сколько атомов углерода на следующем рисунке? Сколько водородов?
- Сколько атомов углерода на следующем рисунке? Сколько водородов?
- Сколько атомов углерода на следующем рисунке? Сколько водородов?
- Посмотрите на следующую молекулу витамина А и нарисуйте скрытые атомы водорода и пары электронов.

(подсказка: все ли атомы углерода имеют 4 связи? Все ли атомы кислорода имеют полный октет?) - Draw ClCH 2 CH 2 CH(OCH 3 )CH 3 в форме Кекуле и линии.
- Запишите молекулярную формулу каждого из показанных здесь соединений.
Ответы:
- Помните правило октетов и сколько раз атомы углерода и водорода способны связываться с другими атомами.
- Электронные пары нарисованы синим цветом, а атомы водорода — красным.
6.
- C 7 H 7 N
- С 5 Н 10
- С 5 Н 4 О
- С 5 Н 6 Бр 2
Вопросы
Q1.12.1
Ниже представлена молекула кофеина. Назовите его молекулярную формулу.
Решения
S1.12.1
С 8 Н 10 О 2 Н 4
1.12: Drawing Chemical Structures распространяется под лицензией CC BY-SA 4.0, авторами, ремиксами и/или кураторами являются Стивен Фармер, Дитмар Кеннеполь, Криста Каннингем, Тим Содерберг, Уильям Рейш и Уильям Рейш.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СС BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- нет на странице
- Метки
- автор@Дитмар Кеннеполь
- автор@Криста Каннингем
- автор@Стивен Фармер
- автор @ Тим Содерберг
- автор@William Reusch
Химический поиск – нарисовать химическую структуру
- Структурный поиск
- Текстовый поиск
- Импорт файла
Полная коллекция химических строительных блоков
В Chemspace мы стремимся поставлять химические строительные блоки для удовлетворения потребностей ваших проектов. Поэтому мы собрали самую большую базу данных химических строительных блоков, чтобы вы могли удобно искать десятки миллионов соединений в течение нескольких секунд и получать наилучшие впечатления от покупки.
Поэтому мы собрали самую большую базу данных химических строительных блоков, чтобы вы могли удобно искать десятки миллионов соединений в течение нескольких секунд и получать наилучшие впечатления от покупки.
Имея более 582 миллионов химических строительных блоков от многочисленных поставщиков, Chemspace предлагает наиболее полный охват химического пространства из одного источника.
Благодаря мощной базе данных и различным параметрам поиска, включая точное совпадение, субструктуру и сходство, Chemspace предоставляет исследователям окончательный инструмент для принятия решений и закупки химикатов. Продукты в нашей базе данных варьируются от широко востребованных классов химических строительных блоков, таких как амины и карбоновые кислоты, до исключительно редких соединений, таких как сульфоксимины и фенилбиоизостеры.
При таком подходе Chemspace позволяет удовлетворить потребности различных программ медицинской химии и фармацевтических исследований, включая ориентированный на свинец комбинаторный синтез, проекты по оптимизации свинца и свинца, а также потребности синтетической химии в предоставлении реагентов для кликов. химия, сочетания и фотоокислительно-восстановительные превращения.
химия, сочетания и фотоокислительно-восстановительные превращения.
Разнообразные химические строительные блоки с упором на медицинскую химию
Медицинская химия и фармацевтические исследования по-прежнему зависят исключительно от методологий синтетической химии и, следовательно, требуют наличия разнообразных химических строительных блоков, отвечающих строгим требованиям не только с точки зрения физико-химических свойств, но и химической активности.
Чтобы удовлетворить этот спрос, Chemspace фокусируется на молекулах, содержащих менее 19 тяжелых атомов, что делает ее базу данных привлекательной для медицинских химиков и специалистов по разработке лекарств. База данных Chemspace содержит более 240 миллионов химических строительных блоков, включая широко используемые первичные и вторичные амины, карбоновые кислоты, производные аминокислот, алкилирующие и арилирующие агенты, сульфонилгалогениды, альдегиды и кетоны, алкилгидразины и арилгидразины, спирты, фенолы, тиолы, амидоксимы и амидины, арилбромиды и арилиодиды, бороновые кислоты, органические азиды, терминальные ацетилены, фторированные и спироциклические соединения и многие другие. База данных постоянно пополняется новыми разработками и нишевыми продуктами.
База данных постоянно пополняется новыми разработками и нишевыми продуктами.
С Chemspace вы получаете:
- Мгновенные котировки цен и наличия с возможностью онлайн-заказа;
- Дополнительная информация о соединениях, например. свойства, опасности при обращении и транспортировке и т. д.;
- Расширенные параметры фильтрации и сортировки, уточнение результатов поиска по параметру структуры;
- Индивидуальная поддержка клиентов и техническая поддержка по адресу [email protected] и с помощью кнопки справки в правом углу нижней части экрана.
Начальные этапы большинства современных проектов по поиску лекарств включают высокопроизводительный (HTS) или скрининг фрагментов. В то время как скрининг на основе фрагментов допускает относительно небольшую скрининговую колоду, содержащую до нескольких тысяч фрагментов, чтобы охватить большое химическое пространство, HTS обычно требует для успеха гораздо более крупного сбора соединений. Кроме того, скрининговая колода должна быть хорошо разработана, чтобы выявить новизну, разнообразие и возможность легкого последующего наблюдения за счет использования близких аналогов из собственных или коммерческих коллекций для создания отношения структуры и активности (SAR).
Кроме того, скрининговая колода должна быть хорошо разработана, чтобы выявить новизну, разнообразие и возможность легкого последующего наблюдения за счет использования близких аналогов из собственных или коммерческих коллекций для создания отношения структуры и активности (SAR).
На сайте Chemspace мы собрали более 6 миллионов имеющихся на складе и более 4,13 миллиардов материалов для скрининга, производимых по запросу, от разных поставщиков, включая Enamine, BLD Pharmatech, PharmaBlock Sciences и UORSY, и это лишь некоторые из них. Коллекция включает новые соединения с благоприятными физико-химическими профилями. Он послужит ценным дополнением к любой внутренней коллекции скрининговых соединений, а также послужит основой для создания новой.
Кроме того, мы разместили составные наборы: общий, целевой и целенаправленный. Наборы, предназначенные для включения молекул с определенными физико-химическими профилями или свойствами, т. е. фрагментоподобными, свинцовоподобными, или для нацеливания на класс биологических объектов, т. е. киназ, или интересующий белок, т. е. DYRK1A. Эти библиотеки доступны для скачивания в виде SD-файла. Вы можете дополнительно выбрать любое количество соединений на основе результатов поиска сходства или виртуального скрининга с вашей целью.
е. киназ, или интересующий белок, т. е. DYRK1A. Эти библиотеки доступны для скачивания в виде SD-файла. Вы можете дополнительно выбрать любое количество соединений на основе результатов поиска сходства или виртуального скрининга с вашей целью.
Экранирующие составы поставляются в виде твердых веществ, растворов или сухих пленок.
| Строительные блоки в наличии | |||
| Префикс | Цена | Доступность | Типичная сумма |
|---|---|---|---|
| CSSB | Перечислено | В наличии | грамм |
| Время выполнения | Доставляемость | Управление заказами | Спектральные данные |
| 2-5 рабочих дней | ~100% | Подтверждение заказа, информация об отслеживании | ЖХ-МС и/или 1 H ЯМР |
| В наличии Экранирующие составы | |||
| Префикс | Цена | Доступность | Типичная сумма |
| СССС | Перечислено | В наличии | мг |
| Время выполнения | Доставляемость | Управление заказами | Спектральные данные |
| 2-5 рабочих дней | ~100% | Подтверждение заказа, информация об отслеживании | ЖХ-МС и/или 1 H ЯМР |
| Строительные блоки по запросу | |||
| Префикс | Цена | Доступность | Типичная сумма |
| CSMB | Перечислен, может быть переоценен, если первоначальное испытание не удалось | Требуемый синтез из доступных исходных реагентов с помощью разработанных процедур, колб химии | грамм |
| Время выполнения | Доставляемость | Управление заказами | Спектральные данные |
| 4-6 недель, может быть проведена повторная оценка в случае, если первоначальная синтетическая схема не удалась или требуется повторная оценка | 70-75% (синтезировано в течение предложенного периода синтеза) | Подтверждение заказа, обновления статуса синтеза, информация об отслеживании | ЖХ-МС и/или 1 H ЯМР, другие спектры (по запросу) |
| Составы для скрининга, производимые по требованию | |||
| Префикс | Цена | Доступность | Типичная сумма |
| CSMS | Перечислен, может быть переоценен, если первоначальное испытание не удалось | Требуемый синтез из доступных исходных реагентов с помощью разработанных процедур, колб химии. Кроме того, запрещенные химические соединения Кроме того, запрещенные химические соединения | мг |
| Время выполнения | Доставляемость | Управление заказами | Спектральные данные |
| 3-4 недели (до 200 соединений). Для больших комплектов время выполнения необходимо пересчитывать. | 75-85% (синтезируется в течение 3-4 недель, до 200 соединений) | Подтверждение заказа, обновления статуса синтеза, информация об отслеживании | ЖХ-МС и/или 1 H ЯМР |
| Пользовательский запрос | |||
| Префикс | Цена | Доступность | Типичная сумма |
| CSCS | Перечисленный или POA (цена по запросу), необходимо рассчитать после оценки затрат | Может быть на складе или требуется синтез, необходимо оценить. Цена и время выполнения заказа требуют (пере)оценки Цена и время выполнения заказа требуют (пере)оценки | Любые |
| Время выполнения | Доставляемость | Управление заказами | Спектральные данные |
| Должен оцениваться при размещении заказа | 70-90% | Подтверждение заказа, обновления статуса, информация об отслеживании, окончательный отчет (по запросу) | ЖХ-МС и/или 1 H ЯМР, другие спектры (по запросу) |
Текстовый поиск: вставка структур
Введите ваши запросы в поле ниже.

 е. до полного превращения исходных реагирующих веществ в конечные продукты реакции
е. до полного превращения исходных реагирующих веществ в конечные продукты реакции
