Самостоятельная работа по теме: “Строение атома”
Самостоятельная работа. Строение атома.
Вариант 1.
1.Заполните таблицу. Определите элемент и его электронную формулу.
|
Распределение электронов по энергетическим уровням |
Элемент |
Электронная формула |
|
1) +5 Э 2,3 |
|
|
|
1) +1 Э 1 |
|
|
|
1) +13 Э 2,8,3 |
|
|
Атомы каких элементов будут обладать сходными свойствами? Почему?
2. Напишите электронные формулы элементов кислорода и натрия. Укажите для каждого элемента:
Напишите электронные формулы элементов кислорода и натрия. Укажите для каждого элемента:
а) общее число энергетических уровней в атоме,
б) число заполненных энергетических уровней в атоме,
в) число электронов на внешнем энергетическом уровне.
Напишите электронные формулы их ионов.
3. Выберите правильные утверждения:
а) максимальное число электронов на внешнем энергетическом уровне атомов любого элемента равно номеру группы,
б) максимальное число электронов во втором энергетическом уровне равно восьми,
в) общее число электронов в атомах любого элемента равно порядковому номеру элемента.
Самостоятельная работа.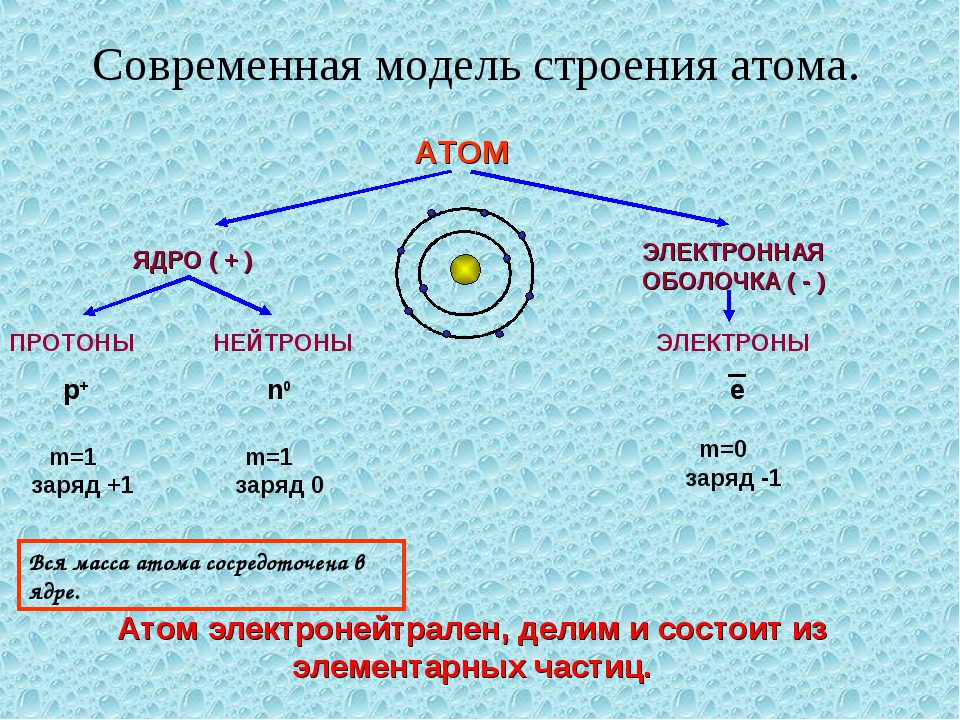 Строение атома.
Строение атома.
Вариант 2.
1.Заполните таблицу. Определите элемент и его электронную формулу.
|
Распределение электронов по энергетическим уровням |
Элемент |
Электронная формула |
|
1) +9 Э 2,7 |
|
|
|
1) +11 Э 2,8,1 |
|
|
|
1) +3 Э 2,1 |
|
|
Атомы каких элементов будут обладать сходными свойствами? Почему?
2. Напишите электронные формулы элементов углерода и алюминия. Укажите для каждого элемента:
Напишите электронные формулы элементов углерода и алюминия. Укажите для каждого элемента:
а) общее число энергетических уровней в атоме,
б) число заполненных энергетических уровней в атоме,
в) число электронов на внешнем энергетическом уровне.
3. Выберите правильные утверждения:
а) число энергетических уровней в атомах элементов равно номеру периода,
б) общее число электронов в атоме химического элемента равно номеру группы,
в) число электронов на внешнем уровне атомов элементов одной группы главной подгруппы одинаково.
Конспект урока по химии 8 класс Тема урока: Строение атома
Тема урока: Строение атома
Цели урока:
Образовательная: создать условия для формирования таких понятий,
как атом, орбиталь, изотопы, протон, нейтрон, электрон. Продолжать формировать
умение работать с Периодической системой, рассмотреть физический смысл
порядкового номера элемента. Познакомить с историей открытия строения атома.
Продолжать формировать
умение работать с Периодической системой, рассмотреть физический смысл
порядкового номера элемента. Познакомить с историей открытия строения атома.
Развивающая: Развивать умение сопоставлять новые научные данные с уже известной структурой периодической системы.
Воспитательная: Воспитательные: воспитывать личностные качества, обеспечивающие успешность исполнительной деятельности
Ход урока
1. Оргмомент
2. Изучение нового материала.
а) Вступительное слово учителя.
Быть может, эти электроны –
Миры, где пять материков,
Искусства, званья, войны, троны
И память сорока веков.
Еще, быть может, каждый атом –
Вселенная, где сто планет;
Там все, что здесь, в объеме сжатом,
Но также то, чего здесь нет.
(В. Брюсов «Мир электрона».)
– Как вы понимаете эти строки?
– Все ли мы с вами знаем о строении атома?
– Что вы можете сказать о строении атома водорода?
– А о строении атома франция или резерфордия?
– Итак, тема урока: «Строение электронных оболочек атома».
Электроны в атомах химических элементов располагаются на
Демокрит
В основе философии Демокрита лежит учение об атомах и пустоте
как двух принципах, порождающих многообразие космоса.
Модель Томсона
Гораздо позже в 1904 году Томсон представил свою новую модель атома. Она представляла собой также равномерно заряженную положительным электричеством сферу, внутри которой вращались отрицательно заряженные корпускулы, число и расположение которых зависело от природы атома. После открытия радиоактивности, эта модель не соответствовала действительности.
Опыт Резерфорда
Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки.
На основании этих опытов ученый предложил планетарную модель атома: в центре атома – ядро, вокруг которого вращаются электроны.
Планетарная модель Резерфорда
Положительный заряд сконцентрирован в ядре атома, а отрицательно заряженные электроны находятся вокруг него
А сейчас ребята, обсудим некоторые термины, запишите их в
словарик.
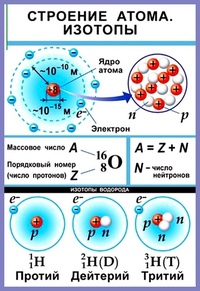
АТОМ – мельчайшая, химически неделимая, частица
ОРБИТАЛИ – место расположения электрона в атоме
Запись а.е.м. – означает атомную единицу массы
В ядре сосредоточена большая часть массы атома
Посмотрите на таблицу.
Строение атома
частица | место нахождения | масса | заряд |
Протон P+ | ядро | 1 а.е.м | +1 |
Нейтрон n0 | ядро | 1а.е.м. | 0 |
Электрон e- | орбиталь | 0 | -1 |
Порядковый номер элемента:
1. Число
протонов
Число
протонов
2. Число электронов
3. Заряд ядра (Z )
Число нейтронов N =A r -Z
ИЗОТОПЫ – это атомы одного химического элемента , имеющие одинаковое число протонов и электронов, но разное нейтронов и разные массовые числа.
Практическая часть
Закончи определения
· АТОМ –это …
· ПЛАНЕТАРНАЯ МОДЕЛЬ –это…
· ОРБИТАЛЬ –это…
· ПОРЯДКОВЫЙ НОМЕР –показывает …
· ИЗОТОПЫ – это…
Заполни таблицу
| Ca | Fe | Cu | Cl |
p+ |
|
|
|
|
e– |
|
|
|
|
n0 |
|
|
|
|
А сейчас ребята выполним небольшой тест
Тестовые задания
1. Заряд
ядра атома азота равен:
Заряд
ядра атома азота равен:
а) 7 б) 13 в) 4 г) 29 д) 11
2. Число
протонов в ядре атома криптона:
а) 36 б) 17 в) 4 г) 31 д) 6
3. Число
нейтронов в ядре атома цинка:
а) 8 б) 35 в)11 г)30 д)4
4. Число
электронов в атоме железа:
а) 11 б)8 в)56 г)26 д)30
5. Изотопы
водорода отличаются друг от друга:
а) числом e- б) числом n в) химическим знаком г) числом p д) массовым числом
Поменяйтесь заданиями с соседом по парте, проверим ответы:
1. Заряд
ядра атома азота равен:
а) 7 б) 13 в) 4 г) 29 д) 11
2. Число
протонов в ядре атома криптона:
а) 36 б) 17 в) 4 г) 31 д) 6
3. Число
нейтронов в ядре атома цинка:
а) 8 б) 35 в)11 г)30 д)4
4. Число
электронов в атоме железа:
а) 11 б)8 в)56 г)26 д)30
5. Изотопы
водорода отличаются друг от друга:
а) числом электронов б) числом нейтронов в) химическим знаком г) числом
p д) массовым числом
Вы справились. Желаю дальнейших успехов в изучении химии!
Желаю дальнейших успехов в изучении химии!
Домашние задание: §37 упр.1-3 с.138
Тест по химии на тему «Строение атома» — 4ЕГЭ
9 класс.stroenie-atoma.pdf
Вопрос №1
В периодической системе, химический элемент со строением электронной оболочки 2e, 8e, 8e, 1e находится
A) в 4-м периоде,IIA группе
B) в 3-м периоде, IIБ группе
C) во 2-м периоде, IV Б группе
D) в 4-м периоде, I А группе
Вопрос №2
Как будет распределение электронов по электронным слоям атома кремния?
A) 2e, 4e
B) 2e, 2e, 2e
C) 2e, 4e
D) 2e, 4e, 2e
Вопрос №3
Число электронных слоев и число электронов во внешнем слое в атоме хлора равны соответственно:
A) 6 и 4
B) 2 и 5
C) 3 и 7
D) 4 и 5
Вопрос №4
Химическому элементу, в атоме которого распределение электронов по слоям 2e, 8e, 5e соответствуют симол элемента, формула высшего оксида и водородного соединения:
A) Cl, Cl2O, HCl
B) N, N2O5, Nh4
C) P, P2O5, Ph4
D) C, CO2, Ch5
Вопрос №5
Химический элемент имеет распределение электронов в атоме: 2e, 8e, 4e Каково будет его водородное соединение?
A) Ch5
B) Nh4
C) Sih5
D) h3S
Вопрос №6
Химический элемент, в котором содержится 7 электронов:
A) неон
B) сера
C) азот
D) кремний
Вопрос №7
В атоме серы общее число электронов и число электронных слоев соответственно равны:
A) 14 и 3
B) 16 и 3
C) 16 и 2
D) 32 и 3
Вопрос №8
Химический элемент, в ядре которого содержится 13 протонов:
A) алюминий
B) натрий
C) азот
D) бор
Вопрос №9
Химический элемент, на внешнем электронном слое которого находится пять электронов, образует водородное соединение, формула которого
A) НЭ
B) Н2Э
C) Н3Э
D) Н4Э
Вопрос №10
Химический элемент, атом которого имеет распределение по электронным слоям 2е, 8е, 8е, 2е, в периодической системе Д. И.Менделеева находится в периоде, номер которого
И.Менделеева находится в периоде, номер которого
A) 1
B) 2
C) 3
D) 4
Ответы
Вопрос №1 — D
Вопрос №2 — C
Вопрос №3 — C
Вопрос №4 — A
Вопрос №5 — C
Вопрос №6 — C
Вопрос №7 — B
Вопрос №8 — A
Вопрос №9 — C
Вопрос №10 — D
Урок-обобщение по теме “Строение атома. Химическая связь” (игра-соревнование)
Цель: обобщение и систематизация знаний по вышеуказанной теме, повторение основных понятий, дальнейшее развитие умения работать с Периодической системой Д.И.Менделеева; развитие памяти, логического мышления; воспитание чувства ответственности, коллективизма, формирование соревновательного духа.
Форма урока: работа в группах
Предварительная подготовка: класс делится на команды в составе четырех человек, каждая команда выбирает капитана, придумывает название; для каждой команды готовятся карточки с заданиями.
Оборудование: таблицы «Схемы образования связи»,
чистые листы А4 для каждой команды, маркеры или фломастеры, карточки с
заданиями для конкурсов №2, 3, карточки для конкурса капитанов, оценочные лист,
презентация «Строение атома. Химическая связь».
Химическая связь».
Оценка каждого конкурса. Максимальное количество баллов, которое можно набрать в каждом конкурсе.
1 – 4 балла, 2 – 2 балла, 3 – 2 балла, физминутка – 1 балл, 5 – 3 балла, 6 – 4 балла + дополнительные баллы
Проводится индивидуальная оценка каждого ученика участниками команды по оценочным листам
|
Фамилия, имя |
№ конкурса |
Итог. Кол-во бал. |
Оценка |
|||||
|
1 |
2 |
физминутка |
4 |
6 |
Доп. баллы |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ход урока
1 конкурс. Разминка «Повторение основных понятий» (См.
приложение 1)
Разминка «Повторение основных понятий» (См.
приложение 1)
Вопросы задаются каждой команде по очереди. За каждый правильный ответ дается 1 балл. Если участники какой-либо команды затрудняются с ответом, вопрос переходит другой команде. Участник, правильно ответивший на вопрос, получает дополнительно 1 балл
Конкурс индивидуальный, оценивают сами участники команды.
- Атом состоит из
- Протоны заряжены
- Электроны заряжены
- Нейтроны
- Заряд ядра равен
- Число энергетических уровней равно
- Число протонов равно
- Число электронов равно
- Число нейтронов равно
- Изотопы – это
- Ионы – это
- Ионная связь – это
- Ковалентная связь – это
- Разновидности ковалентной связи
- Электроотрицательность – это
- Металлическая связь – это
2 конкурс. Запишите названия, символы, порядковый номер,
номера периода и группы, название подгруппы: главная или побочная,
относительную атомную массу химических элементов в атомах которых (См.
приложение 1)
Запишите названия, символы, порядковый номер,
номера периода и группы, название подгруппы: главная или побочная,
относительную атомную массу химических элементов в атомах которых (См.
приложение 1)
6 протонов, 6 нейтронов, 6 электронов
13 протонов, 14 нейтронов и 13 электронов
56 протонов, 81 нейтрон и 56 электронов
22 протона, 26 нейтронов и 22 электрона
Все участники команды выполняют задание на выданной карточке, затем сдают учителю.
Конкурс групповой, оценивается учителем.
3 конкурс. Соотнесите названия химических элементов с обозначениями их атомов. Из букв, соответствующих правильным ответам, вы составите название одного из изотопов водорода _ _ _ _ _ _ _ _
Буквы в таблице расположены не по порядку. (См. приложение 1)
Все участники команды выполняют задание на выданной карточке, затем сдают учителю.
Конкурс групповой, оценивается учителем.
|
Название химического элемента |
40 Э 20 |
32 Э 16 |
14 Э 7 |
24 Э 12 |
33 Э 16 |
15 Э 7 |
42 Э 20 |
25 Э 12 |
|
Азот |
С |
О |
Д |
И |
Г |
Е |
К |
С |
|
Кальций |
Й |
К |
Н |
Ц |
У |
С |
Т |
Н |
|
Магний |
Г |
О |
С |
Е |
О |
К |
О |
Р |
|
Сера |
О |
И |
М |
Н |
Й |
У |
С |
Ю |
Физминутка
Для каждого участника команды заранее на доске записывается
задание. Физминутка проводится в виде эстафеты. Эстафетной палочкой служит
кусочек мела. Участники по очереди напротив записи энергетических уровней
записывают символ химического элемента. Учитывается правильность ответов и, кто
быстрее выполнит задание.
Физминутка проводится в виде эстафеты. Эстафетной палочкой служит
кусочек мела. Участники по очереди напротив записи энергетических уровней
записывают символ химического элемента. Учитывается правильность ответов и, кто
быстрее выполнит задание.
Назовите химические элементы, зная распределение электронов по энергетическим уровням.
|
2,8,7 |
2,8,8 |
2,6 |
2,8,1 |
|
2,4 |
2,8,3 |
2,8,8,1 |
2, 8,4 |
|
2,8,8,2 |
2,1 |
2,8,6 |
2,8, 5 |
|
2,2 |
2,8,2 |
2,2 |
2,6 |
Конкурс оценивается участниками команды
4 конкурс – конкурс капитанов.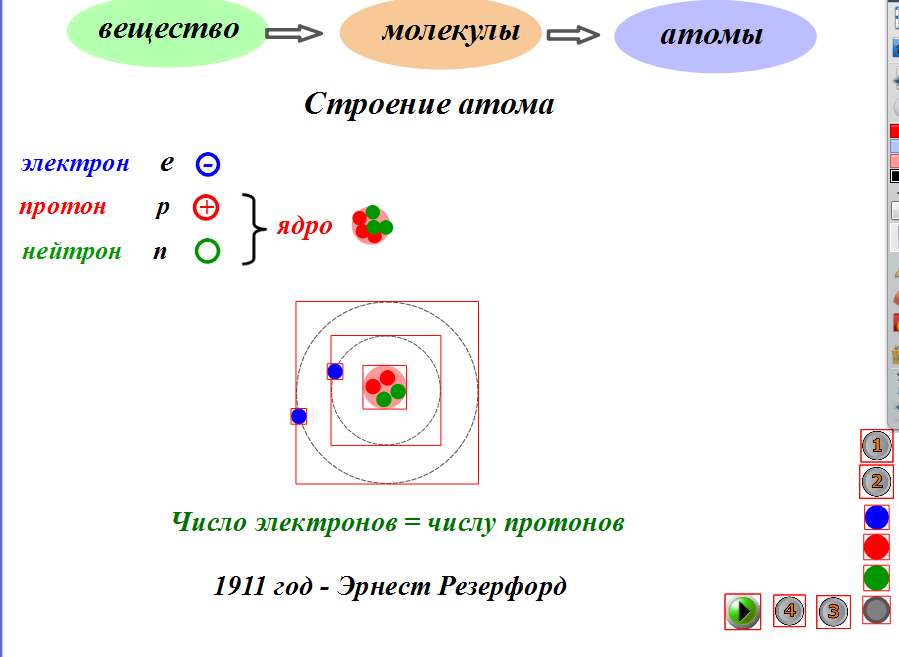 Назовите частицы, схемы
электронного строения которых
Назовите частицы, схемы
электронного строения которых
Карточки раздаются капитану каждой команды. Ответ оценивается учителем
+13 2,8
+9 2,8
+19 2,8,8
+16 2,8,8
5 конкурс. Определите вид химической связи для следующих веществ: (См. приложение 1)
Н2, Аl, К2S, h3O
Каждый участник группы записывает на листе А4 фломастером схему образования связи и вывешивает на доске. Затем проверяет весь класс
Подведение итогов
11 баллов и больше – отметка 5
8-10 баллов отметка 4
6-7 баллов – отметка 3
Список литературы
1. Габриелян О. С. Химия 8 класс. Москва, издательство «Дрофа», 2009
2. Габриелян О. С. Рабочая тетрадь по химии к учебнику 8 класса. Москва, издательство «Дрофа», 2009.
Викторина по химии «Строение атома»
Методическая разработка по химии учителя по химии ГБОУ СОШ №58
города Севастополя Борисовой Дианы Сергеевны .
Викторина по химии
на тему: Строение атома.
Аннотация.
Задачей данной методической разработки является активизация познавательного интереса детей к предмету химии, к устройству окружающего мира. Игра закрепляет знания о строении атома, распределении электронов по орбиталям, о связи химических свойств элементов в зависимости от строения атома.
С помощью игры ребенок расслабляется и не воспринимает химию как сложный предмет, а открывается навстречу новому знанию. Отстающая часть класса благодаря правильным ответам одноклассников на вопросы викторины лучше запоминает материал, а остальные учащиеся закрепляют полученные ранее знания, применяя их в действии, на практике.
Воспитательная цель методической разработки- сплотить класс, воспитать командный дух, умение всем коллективом активизировать свои знания и работать на благо команды.
Содержание
Викторина состоит из пяти конкурсов.
Первый конкурс «НАЗОВИ» на знание названий элементов Периодической системы химических элементов Д.И.Менделеева.
Второй конкурс «БЛИЦ» позволяет закрепить знания о порядковом номере, физическом смысле номера периода, номера группы, в которой расположен химический элемент в таблице Менделеева, свойствах химических элементов.
Третий конкурс «Собери таблицу» позволяет проверить, как ориентируются учащиеся в таблице Менделеева.
Четвертый конкурс «Верю- не верю» позволяет проверить общую эрудицию учащихся в вопросах естественно-научного образования. Вопросы четвертого конкурса показывают связь химии с другими науками-географией, биологией, физикой . Конкурс выводит ребят на уровень, когда даже слабый ученик по химии может проявить себя, свою точку зрения, выбрав позицию ВЕРЮ или НЕ ВЕРЮ на факты, излагаемые учителем, в команде и благодаря себе и команде отстоять свою точку зрения , повысить свою мотивацию к изучению химии и самооценку.
Пятый конкурс «Темная лошадка».
Учитель описывает, желательно в стихотворной форме, что в чёрном ящике. Этот предмет связан с химией. Учащиеся после описания учителем свойств и особенностей предмета могут задавать наводящие вопросы, раскрывающие суть предмета. Этот конкурс учит детей говорить, правильно ставить вопросы., общаться в учителем и сверстниками.
Введение.
Цель викторины:
-привить любовь к предмету
-научить детей работать в команде, прислушиваться к мнению в команде и озвучивать своё мнение
-развивать активность ребенка на уроке химии, развивать умение обобщать, извлекать из копилки знаний нужные знания и умения для решения поставленных задач, применять знания на практике
Викторина стимулирует интерес учащихся к предмету химии. Дети любят играть и в игровой форме легче усваивают и находят применение полученному знанию.
В начале викторины класс делится на две или три команды, с заранее продуманными названиями команд и девизом.
Учитель химии выполняет роль ведущего. Рекомендуется пригласить администрацию школы и учителей-предметников географии, физики, биологии в качестве судей в ЖЮРИ.
Каждый конкурс оценивается в 10 баллов.
Объявляются условия викторины. Наградой служит выставление оценок «5» за урок победителям, «4» за урок проигравшим. Самая слабая команда , как вариант, выполняет домашнее задание по химии.
Основная часть.
Конкурс первый. Блиц.
Задаем по десять вопросов каждой команде, думать разрешается на каждый вопрос не более 30 секунд.
Вопросы команде 1
1. Мельчайшая химически неделимая частица…
(Атом.)
2. Положительно заряженная частица в атоме…
(Протон.)
3. Назовите лишний оксид в ряду: оксид кальция, оксид калия, оксид cеры, оксид магния.
(Оксид серы.)
4. Формула максимального количества электронов на энергетическом уровне…
(2n2.)
5. На s-орбитали может находиться максимально…. электрона.
электрона.
(Два.)
6. Напишите формулу оксида элемента № 47
(Ag2О.)
7. Напишите формулу водородного соединения элемента № 52.
(Teh3.)
8. Закончите формулировку периодического закона 1869 г.: свойства элементов и их соединений находятся в периодической зависимости от…
(Атомного веса.)
9. Назовите число протонов у элемента № 13.
(13.)
10. Назовите число электронов у элемента № 102..
(102)
Вопросы команде 2
1. Элементы, имеющие одинаковый заряд ядра, но разное количество нейтронов называются…
(Изотопы.)
2. Мельчайшая частица вещества, обладающая всеми его свойствами, это…
(Молекула.)
3. На р-орбиталях могут находиться… электронов.
(Шесть.)
4. Отрицательно заряженная частица в атоме называется…
(Электрон.)
5. Закончите современную формулировку периодического закона: свойства элементов и их соединений находятся в периодической зависимости от…
(Заряда ядра.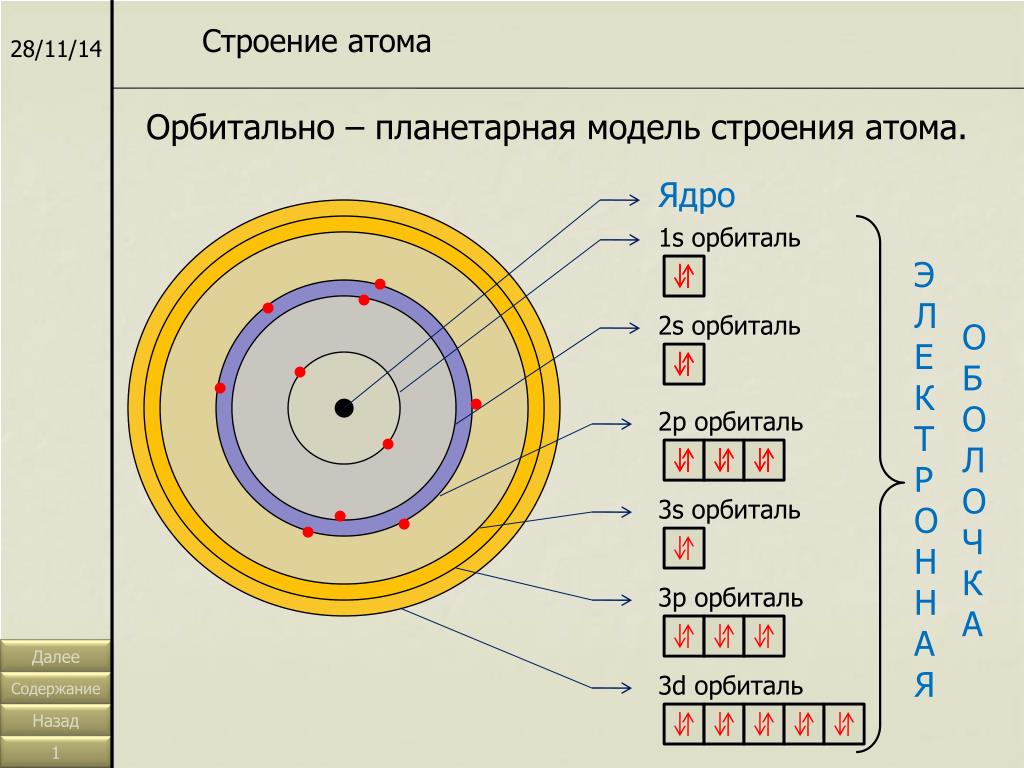 )
)
6. Какой элемент проявляет более сильные металлические свойства – К или Li?
(Калий.)
7. Напишите формулу оксида франция.
(Fr2O.)
8. Назовите число электронов у элемента магния.
(12)
9. Назовите число протонов у элемента натрия.
(11.)
10. Напишите формулу водородного соединения углерода
( Сh5)
Вопросы команде 3
1. Мельчайшая частица вещества, обладающая всеми его свойствами, это…
(Молекула.)
2. На s-орбитали водорода сколько электронов?.
(один)
3. Нейтрально заряженная частица в ядре называется
(нейтрон.)
4. Элементы, имеющие одинаковый заряд ядра, но разное количество нейтронов называются…
(Изотопы.)
5. Элемент второго периода 3 группы главной подгруппы это…?
(бор)
6. Какой элемент проявляет более сильные металлические свойства – Mg или Ca?
(Кальций.)
7. Составьте формулу оксида натрия (Na2O.)
8. Назовите число электронов у элемента серы.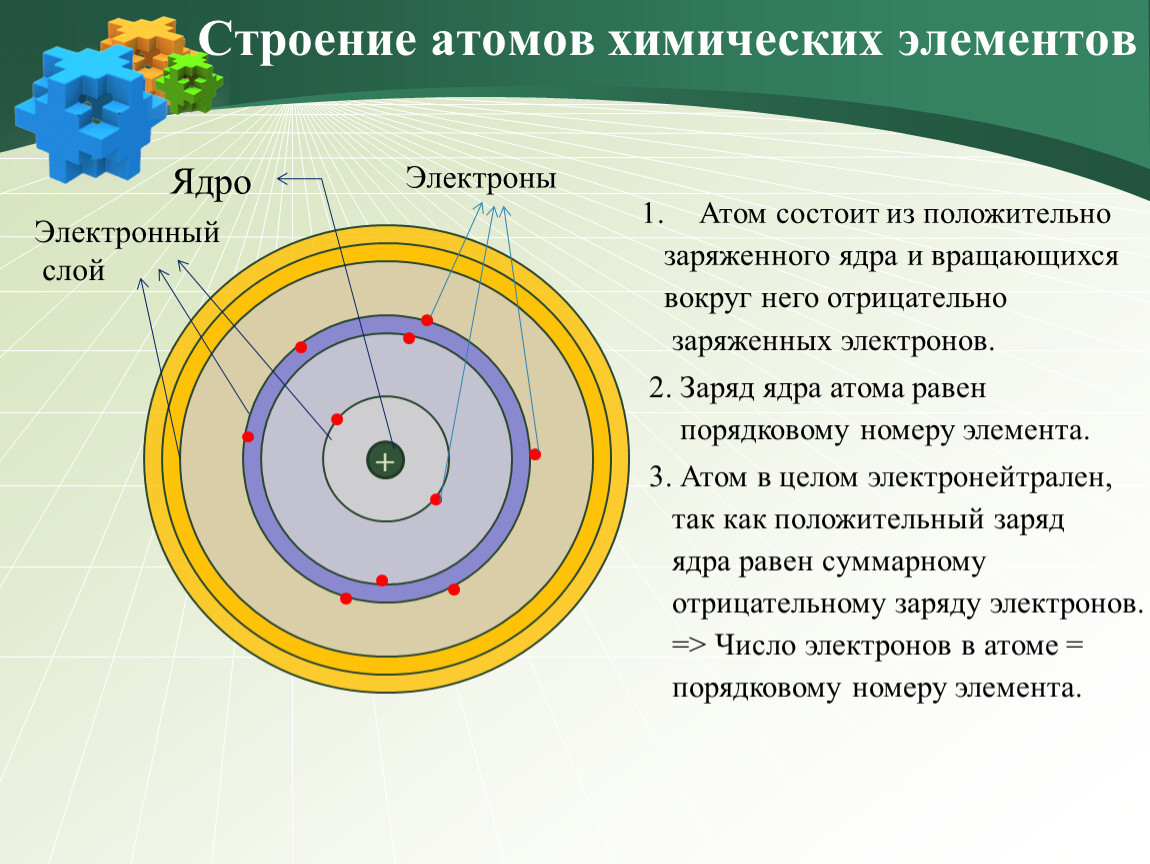
(16)
9. Назовите число протонов у элемента кальция
(20.)
10. Напишите формулу водородного соединения cеры.
( h3S)
За каждый правильный ответ команда получает один балл. Максимально в этом конкурсе можно набрать 10 баллов. У каждой команды может быть своя скорость ответа, поэтому справедливо задавать «свои» вопросы каждой команде. Это уравняет слабую и сильную команду. А это важно для самооценки учащихся..
Второй конкурс. «Назови элемент».
На доске пишем буквы алфавита, предлагаем командам составить из них слова- названия химических элементов. Кто придумает больше названий- та команда победила. Рекомендуется использовать таблицу Менделеева.
На выполнение заданий отводится 5 минут.
Буквы для составления названий элементов: А,С,Р,Г,Л,О, М,К,И,Й,Т, А,Н,У,Ф,Х,Е,Ю,Ь,О,В. одинаковые буквы можно использовать несколько раз)
(хлор, фтор,магний, алюминий, калий, кальций, олово, рутений, калифорний, таллий, иттрий, натрий, кремний, фосфор и т.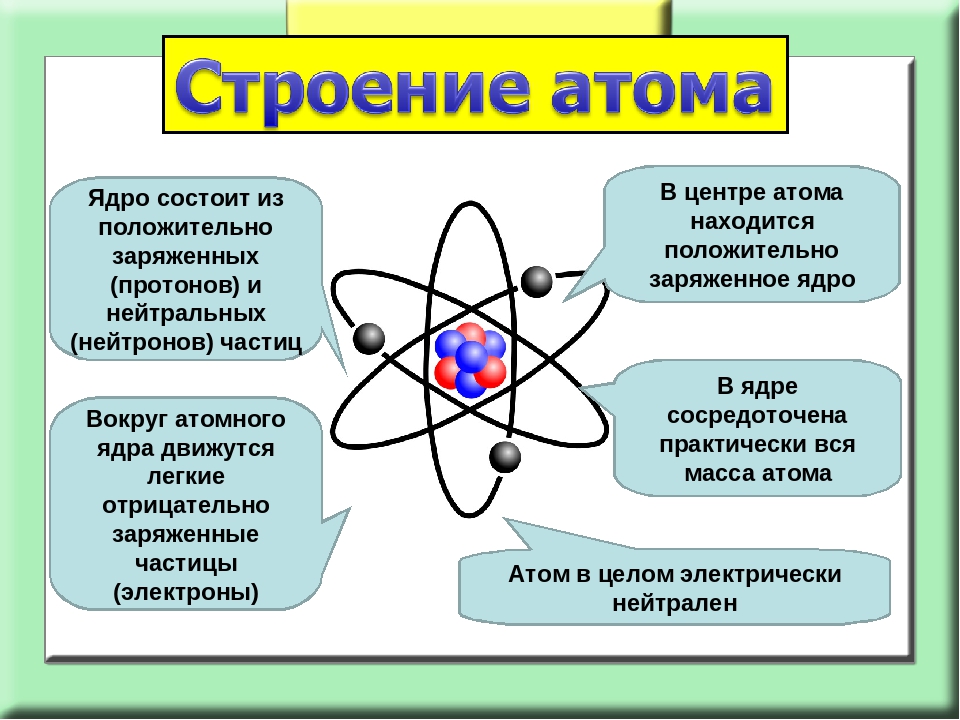 д.)
д.)
Максимальное количество баллов-10.
Химический кроссворд
-кто быстрее отгадает-10 баллов этой команде.
Вопросы: Из этого вещества на 72% состоит человек, на 99% состоит медуза.(ВОДА)
Элемент под номером 19 в таблице Менделеева, щелочной металл.(КАЛИЙ)
Какой газ поддерживает горение? (Самый распространенный на земле элемент)(КИСЛОРОД)
Наука, изучающая свойства веществ и их превращения(ХИМИЯ)
Самый распространённый элемент во Вселенной (ВОДОРОД)
Виды атомов, с определённым зарядом ядра (ЭЛЕМЕНТЫ)
Ключевое слово- оксиды.
Конкурс «Верю- не ВЕРЮ.»
Игрокам команд предлагается вопрос, а они сами должны прослушать и выбрать свой ответ- верить научному факту или не верить.
За всю историю люди добыли около 161 тысячи тонн золота, стоимость такого количества драгоценного металла составляет примерно 9 трлн долларов.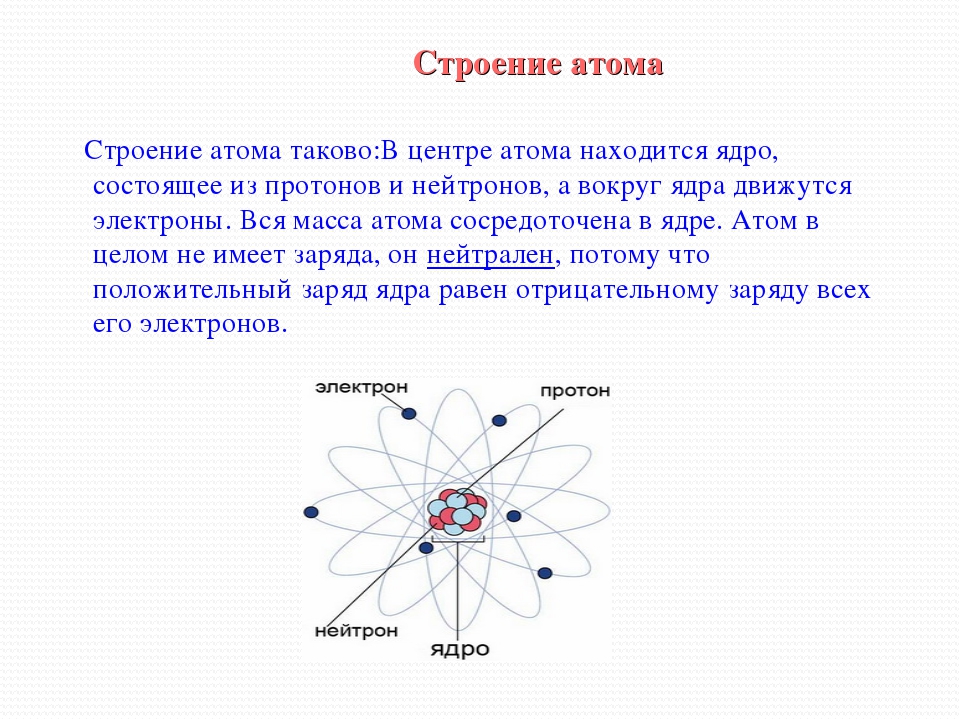 Внимание. Правда ли, что : Больше всего золота было обнаружено в РОССИИ .(Нет, больше всего золота добыто в Африке)
Внимание. Правда ли, что : Больше всего золота было обнаружено в РОССИИ .(Нет, больше всего золота добыто в Африке)
Люди каждые 45 минут извлекают из земных недр столько железа, сколько им удалось добыть золота за все время своего существования-160 тысяч тонн. (правда, каждые 45 минут-добыча железа 160 тысяч тонн).
Золотые ювелирные изделия изготавливаются из сплава золота с углеродом. ( нет, ювелирное золото-сплав золота с серебром)
Золотые олимпийские медали сделаны из чистого золота. (нет, медали покрыты тонким слоем золота. Олимпийская золотая медаль лишь на 1,2% состоит из золота, которое приходится лишь на покрытие награды. Внутри же неё — одно серебро. Со второй по достоинству наградой также не всё просто. Собственно серебра в серебряной медали около 92,5%, остальные 7,5% — это медь. И только бронзовая награда состоит из бронзы, которая является сплавом меди с цинком и оловом (97% меди, 2,5% цинка и 0,5% олова). )
)
Если разогнуть скрепку, а затем опустить её в горячую воду, она станет
скрепкой.
( да, если скрепка сделана из нитинола-некелида титана, сплава никеля и титана)
Края монет покрыты маленькими прорезями для красоты монет.
( нет, края делали ребристыми с 12 века, что позволяло исключить отщипывание золота и серебра от драгоценных монет, защитить целостность монеты. Нанесение на края монет насечек- такую идею предложил известный ученый Исаак Ньютон, он на то время был сотрудником Британского монетного двора. Она оказалась очень действенной, хоть и простой. Не зря ведь говорят, что все гениальное просто.
В 1684 году монеты с насечками начали изготавливать в Германии. В том же 16 веке французы придумали устройство, которое позволяло поверх насечек наносить еще и надпись, что дало возможность усовершенствовать и усложнить довольно простую защиту от мошенников, которые отрезали кусочки золотых и серебряных монет.
Современные монеты для широкого обихода уже не изготавливаются из благородных металлов, потребность в подобной защите практически отпала, но традиция делать насечки сохранилась. Ребристую поверхность сейчас называют «гурт».
Гурт на сегодняшний день может помогать различать монеты людям с дефектами зрения. Так, например, Монетный двор США выпускает 10-центовую монету с 118 насечками, 25-центовую – со 119, а 50-центовую – со 150 бороздками. Мелкие монеты как 1 и 5 центов делают без ребристых краев, это тоже традиционно, ведь они никогда не выпускались с содержанием драгоценных металлов.
Золото можно получить из пепла, являющегося продуктом сжигания сухих остатков канализационных стоков(да, уже есть в Японии цеха по переработке канализационных стоков и выделению драгоценных металлов)
Можно ли заменить человеческие кости при переломах на кораллы?
(да, можно, состав костей и кораллов похож, в состав входит карбонат калия и органические вещества).
Можно превратить олово в порошок, не прибегая ни к каким инструментам. ( Можно , ответ: охладить до -250С )
За каждый ответ команда получает два балла. Максимально можно заработать 18 баллов.
КОНКУРС «Темная лошадка».
Ответ на вопрос в черном ящике. За каждый правильный ответ 5 баллов. Максимально можно задать по одному вопросу каждой команде ( если три команды, если две команды-два вопроса, один-не использовать).
Залежи этого есть в Японии, в Доминиканской Республике, но примерно 95% разведанных мировых запасов находится в Калининградской области России. О залежах чего идет речь? Полудрагоценный камень, чтобы узнать его подлинность, проводят проверку. Чтобы отличить настоящий камень от подделки, нужно просветить его флуоресцентной лампой. Оттенок и цвет настоящего камня изменится, а у подделки останется прежним.
По химическому составу минерал– это органические кислоты, одна из которых названа в честь этого камня. (ответ: залежи янтаря в Калининградской области)
(ответ: залежи янтаря в Калининградской области)
По приказу Наполеона, для солдат долго находившихся в походе, было разработано дезинфицирующее средство с троекратным эффектом – лечебным, гигиеническим и освежающим. Ничего лучшего не было придумано и через 100 лет, поэтому в 1913году на выставке в Париже это средство получило «Гран – при». Дошло это средство и до наших дней. Под каким названием оно выпускается у нас в стране? (ответ: тройной одеколон)
Легенда гласит: чтобы доказать власть и могущество своему возлюбленному Марку Антонию, последняя царица Египта Клеопатра поспорила с ним, что приготовит очень дорогой напиток. Она сняла одну из своих огромных жемчужин, которые носила в ушах, растворила ее в тайной жидкости ( не в вине) и выпила коктейль. Об этом писал философ-естествоиспытатель Плиний еще в начале нашей эры. Более того, он уточнял, что жемчужина была уникальным произведением искусства и стоила 10 миллионов сестерциев.
 Вопрос:
Вопрос:
В чём растворила Клеопатра жемчужину? Ответ: в уксусе.
Подведение итогов.
Спасибо , ребята. Отличные результаты оказала команда… Число баллов у первой команды, у второй команды…. Теперь мы будет лучше знать химию, и стремиться знать ещё больше ! Широко простирает химия руки в дела человеческие!…-как говорил Максим Горький, знаменитый русский писатель.
Команде победителей- оценка в журнал за урок 5.
Команде проигравших –«4» в журнал.
Если класс делился на три команды: зрители-ученики, и две команды игроков, то отдельно даются вопросы и зрителям, или есть возможность зрителям высказать ответ на вопрос и зачесть его команде, которую укажет зритель-ученик. Приз «зрительских симпатий» – баллы любимой команде.
МЕТОДИЧЕСКАЯ разработка по химии
“Викторина по химии” , закрепит и углубит знания по химии по теме “Строения атома” и
“Периодическая система химических элементов Дмитрия Ивановича Менделеева”.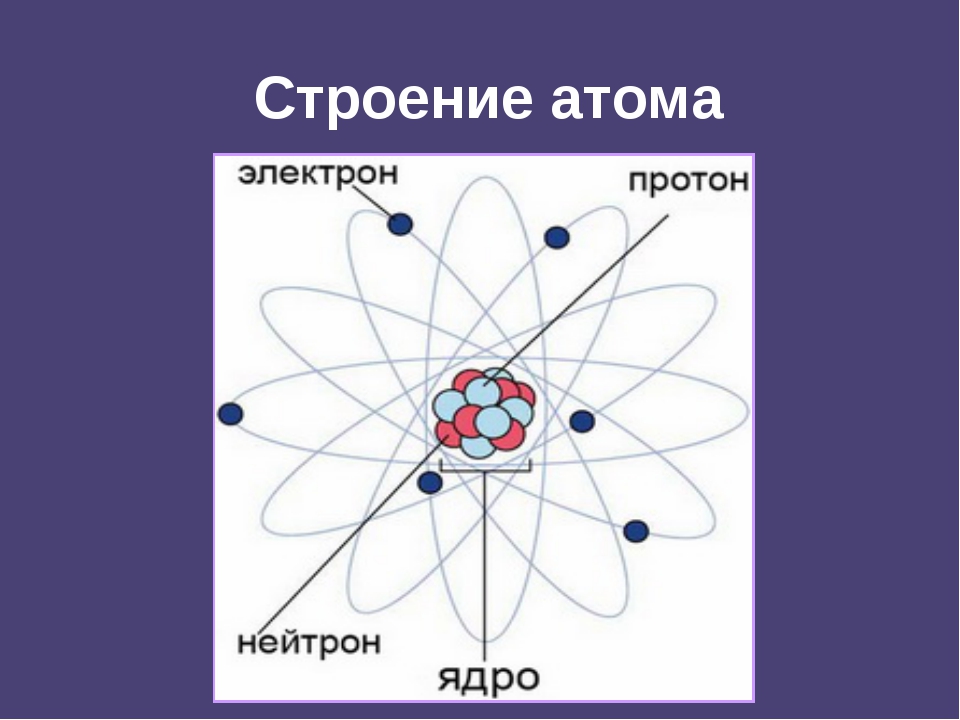 Воспитывает дух соревновательности у учащихся, умение высказывать и аргументировать свою точку зрения по научным вопросам.
Воспитывает дух соревновательности у учащихся, умение высказывать и аргументировать свою точку зрения по научным вопросам.
Рекомендована к проведению на уроках химии с 8 по 11 класс. В 8 и 11 классах как урок закрепления знаний и умений после прохождения темы “Строение атома. Периодическая система Д.И.Менделеева”. в 9-10 классах в конце учебного года по теме “Повторение”.
Начало урока | <p><b>I. Организационный момент</b>. Вот и прозвенел звонок, Начинается урок. Урок сегодня вроде и обычный, И в то же время от других отличный… Работы много предстоит, Никто без дела не сидит! Уважаемые ребята, я рада приветствовать вас. Для развития коммуникативных навыков, сплоченности внутри команды проводит игру «Шарики» </p><p><b>II. Ориентировочно-мотивационный этап.</b> Когда человек знакомится с чем-то новым, то всегда задается вопрос: ” Чем оно так интересно и значимо для меня?” Правда, ребята? Ответом на этот вопрос будут слова Козьмы Пруткова. Слайд 1 Учитель. Прежде чем приступить к уроку, заранее Приготовила я сегодня для вас задания. Вначале мы о пройденном Устно поговорим А потом письменно задания решим Не будь тороплив, будь памятлив! (девиз) 1. Игра «Кто быстрее?» 1. Что такое простые вещества? 2. Что такое сложные вещества? 3. Сформулируйте закон постоянства состава веществ. 4. Сформулируйте закон сохранения массы веществ. 5. Кто автор атомно-молекулярного учения? 2. Ориентировочно-мотивационный этап.</b> Когда человек знакомится с чем-то новым, то всегда задается вопрос: ” Чем оно так интересно и значимо для меня?” Правда, ребята? Ответом на этот вопрос будут слова Козьмы Пруткова. Слайд 1 Учитель. Прежде чем приступить к уроку, заранее Приготовила я сегодня для вас задания. Вначале мы о пройденном Устно поговорим А потом письменно задания решим Не будь тороплив, будь памятлив! (девиз) 1. Игра «Кто быстрее?» 1. Что такое простые вещества? 2. Что такое сложные вещества? 3. Сформулируйте закон постоянства состава веществ. 4. Сформулируйте закон сохранения массы веществ. 5. Кто автор атомно-молекулярного учения? 2. Письменные задания. 1. Составьте формулы оксида, хлорида, сульфида, иодида марганца(II) 2. В каком из веществ больше массовая доля кислорода: в оксиде бария (10,4%)или оксиде железа(II)(22,2%)? <br></p> Письменные задания. 1. Составьте формулы оксида, хлорида, сульфида, иодида марганца(II) 2. В каком из веществ больше массовая доля кислорода: в оксиде бария (10,4%)или оксиде железа(II)(22,2%)? <br></p> | <p>шарики</p><p><br></p><p><br></p><p><br></p><p>презентация<br></p> | Середина урока | <p><br></p><p><b>III. Операционно-исполнительский этап.</b> Мудрым никто не родился, а научился!(девиз) 1. Игра “Чёрный ящик” – Попробуйте с 3-х попыток угадать содержимое ящика: 1 попытка – «Отыщи всему начало и ты многое поймёшь» Слайд 3. 2 попытка – в переводе с греческого обозначает «химически неделимый» 3 попытка – из него состоит молекула Напомните, пожалуйста, определение «Химический элемент» Учитель: Вы догадались, о чём пойдёт сегодня речь? Ученики отвечают: об атоме. Итак, тема урока: “Состав и строение атома”. Запишите тему в тетрадь. Слайд 2. Каковы цели урока (ученики говорят о своих предположениях) Цель урока: Слайд 3 • Формирование знаний о строении атома, составе атомного ядра. 2 попытка – в переводе с греческого обозначает «химически неделимый» 3 попытка – из него состоит молекула Напомните, пожалуйста, определение «Химический элемент» Учитель: Вы догадались, о чём пойдёт сегодня речь? Ученики отвечают: об атоме. Итак, тема урока: “Состав и строение атома”. Запишите тему в тетрадь. Слайд 2. Каковы цели урока (ученики говорят о своих предположениях) Цель урока: Слайд 3 • Формирование знаний о строении атома, составе атомного ядра. • Развитие внимания, мышления, мотивации. • Умение работать в коллективе, группе. 2. Изучение темы «Состав и строение атома». Слайд 4. пауза Атом – наименьшая частица химического элемента, являющаяся носителем его свойств. Все ли элементы расположены в ПСХЭ в порядке возрастания атомных масс? Оказывается, нет. Почему? Ответ на этот вопрос нашли учёные – физики. Слайд 5. • Развитие внимания, мышления, мотивации. • Умение работать в коллективе, группе. 2. Изучение темы «Состав и строение атома». Слайд 4. пауза Атом – наименьшая частица химического элемента, являющаяся носителем его свойств. Все ли элементы расположены в ПСХЭ в порядке возрастания атомных масс? Оказывается, нет. Почему? Ответ на этот вопрос нашли учёные – физики. Слайд 5. Планетарная модель строения атома предложена Э.Резерфордом в 1911 году. В центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны. Слайд 6. Ядро-это центральная часть атома, в котором сосредоточена практически вся его масса. Ядро имеет положительный заряд, равный количеству протонов, находящихся в нем. Кроме протонов в ядре также находятся нейтроны-частицы, имеющие массу, но не обладающие зарядом Ar = m (p)+ m (n) Слайд 7. Планетарная модель строения атома предложена Э.Резерфордом в 1911 году. В центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны. Слайд 6. Ядро-это центральная часть атома, в котором сосредоточена практически вся его масса. Ядро имеет положительный заряд, равный количеству протонов, находящихся в нем. Кроме протонов в ядре также находятся нейтроны-частицы, имеющие массу, но не обладающие зарядом Ar = m (p)+ m (n) Слайд 7. Протоны и нейтроны имеют следующие характеристики: масса заряд p+ 1 +1 n0 1 0 Mасса атома складывается из суммы масс протонов и нейтронов Слайд 8. Протоны и нейтроны имеют следующие характеристики: масса заряд p+ 1 +1 n0 1 0 Mасса атома складывается из суммы масс протонов и нейтронов Слайд 8. Вокруг ядра движутся электроны (e-), образующие электронную оболочку, размеры которой определяют размеры самого атома. Заряд e- по величине равен заряду p+, но противоположен по знаку. Обобщим все полученные сведения Слайд 9. Вокруг ядра движутся электроны (e-), образующие электронную оболочку, размеры которой определяют размеры самого атома. Заряд e- по величине равен заряду p+, но противоположен по знаку. Обобщим все полученные сведения Слайд 9. пауза Основные характеристики элементарных частиц Частица и ее обозначение Масса Заряд Примечание Протон -p+ 1 +1 Число протонов равно порядковому номеру элемента Нейтрон –п0 1 0 Число нейтронов находят по формуле: N=Ar-Z Электрон е- 1/1837 -1 Число электронов равно порядковому номеру элемента Ребята, как вы думаете, в каком порядке стоят элементы в ПСХЭ? Ответы учащихся. пауза Основные характеристики элементарных частиц Частица и ее обозначение Масса Заряд Примечание Протон -p+ 1 +1 Число протонов равно порядковому номеру элемента Нейтрон –п0 1 0 Число нейтронов находят по формуле: N=Ar-Z Электрон е- 1/1837 -1 Число электронов равно порядковому номеру элемента Ребята, как вы думаете, в каком порядке стоят элементы в ПСХЭ? Ответы учащихся. Правильно. Итак, Слайд 10. Современная формулировка Периодического закона. Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов. Правильно. Итак, Слайд 10. Современная формулировка Периодического закона. Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов. Запись строения атома Слайд 11. Пример: показать строение атома цинка. Запись строения атома Слайд 11. Пример: показать строение атома цинка. 65 Zn (31 p+, 34 n0) 31e- 31 Заставка Слайд 12. 65 Zn (31 p+, 34 n0) 31e- 31 Заставка Слайд 12. Динамическая пауза « Периодическая система» Слоганы Упражнения Раз – два – руки в горизонтали, Обе руки в горизонтальной плоскости одновременно вправо – влево; Три – четыре – руки по вертикали. Обе руки одновременно резким движением поднимаются вверх и опускаются вниз. Помни, период – это горизонталь, Руки на пояс, наклоны туловища вправо и влево; Ну а группа – это вертикаль! Руки на пояс, прыжки на месте. </p><p>IV. Коррекция и первичная проверка знаний. 1. Загадки Он бежит по проводам, он бывает тут и там, Свет зажег, нагрел утюг, он, конечно, – лучший друг. Если в атом он попал – то, считай, почти пропал: Он с утра и до утра носится вокруг ядра. (Электрон) Очень положительный с массой внушительной. Динамическая пауза « Периодическая система» Слоганы Упражнения Раз – два – руки в горизонтали, Обе руки в горизонтальной плоскости одновременно вправо – влево; Три – четыре – руки по вертикали. Обе руки одновременно резким движением поднимаются вверх и опускаются вниз. Помни, период – это горизонталь, Руки на пояс, наклоны туловища вправо и влево; Ну а группа – это вертикаль! Руки на пояс, прыжки на месте. </p><p>IV. Коррекция и первичная проверка знаний. 1. Загадки Он бежит по проводам, он бывает тут и там, Свет зажег, нагрел утюг, он, конечно, – лучший друг. Если в атом он попал – то, считай, почти пропал: Он с утра и до утра носится вокруг ядра. (Электрон) Очень положительный с массой внушительной. А таких, как он – отряд, создают в ядре заряд. Лучший друг его – нейтрон. Догадались? Он … (Протон) Зарядом я похвастать не могу, А потому сижу в ядре, и ни гу-гу. А то еще подумают: шпион, А я нейтральный и зовусь … (Нейтрон) 2. А таких, как он – отряд, создают в ядре заряд. Лучший друг его – нейтрон. Догадались? Он … (Протон) Зарядом я похвастать не могу, А потому сижу в ядре, и ни гу-гу. А то еще подумают: шпион, А я нейтральный и зовусь … (Нейтрон) 2.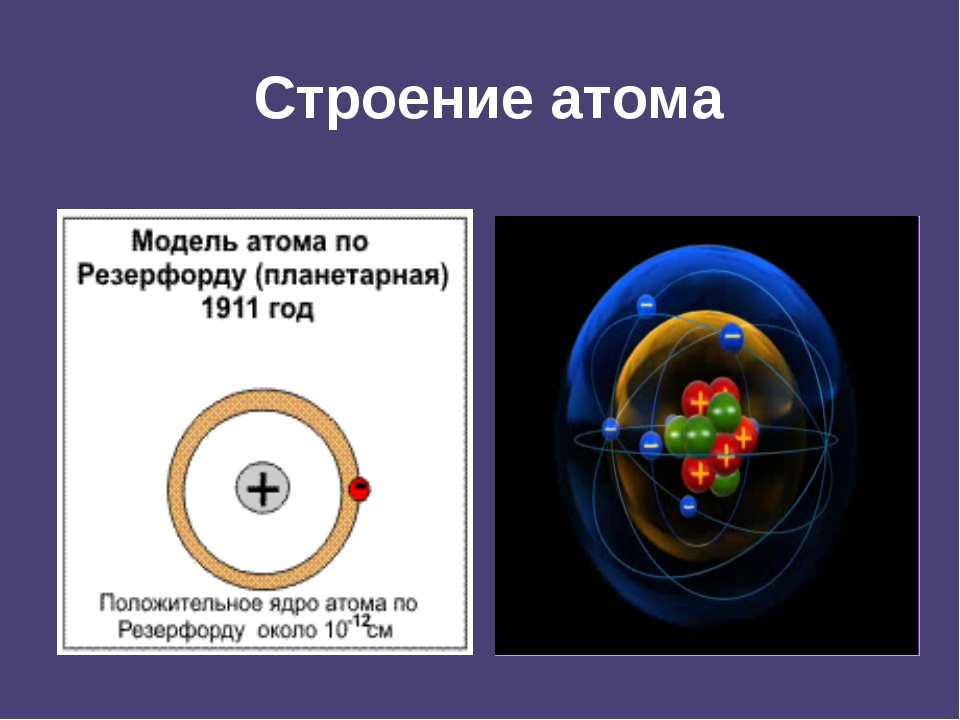 Конкурс “Светофор”. Не обдумав, не решай, а, решив, не передумай! Слайд 13. Для этого конкурса каждому ученику выдаётся “Светофор”. “Светофор” – это длинная полоска картона, с одной стороны – красная, с другой – зелёная. Во время конкурса по одному ученику выполняют задание на доске, а остальные учащиеся – в тетрадях. Когда задание выполнено, если ученик согласен с решением – поднимает зелёный сигнал “Светофора”, не согласен – красный. На второе задание выходит отвечать следующий учащийся. Заполните пропущенные клетки в таблице. Число Элемент протонов нейтронов электронов 1 6 6 6 С 2 26 30 26 Fe 3 53 74 53 I 3. Конкурс “Светофор”. Не обдумав, не решай, а, решив, не передумай! Слайд 13. Для этого конкурса каждому ученику выдаётся “Светофор”. “Светофор” – это длинная полоска картона, с одной стороны – красная, с другой – зелёная. Во время конкурса по одному ученику выполняют задание на доске, а остальные учащиеся – в тетрадях. Когда задание выполнено, если ученик согласен с решением – поднимает зелёный сигнал “Светофора”, не согласен – красный. На второе задание выходит отвечать следующий учащийся. Заполните пропущенные клетки в таблице. Число Элемент протонов нейтронов электронов 1 6 6 6 С 2 26 30 26 Fe 3 53 74 53 I 3. Работа в парах по алгоритму (он на доске) Слайд 14. Ум – хорошо, а два – лучше! Алгоритм 1. III период, V группа 2. Заряд ядра +15 3. Состав атома: (15 p+, 16 n0) 15 е-. Задания для групп Карточка №1 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Определите заряд ядра. 3. Каков состав атома? Карточка №2 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Работа в парах по алгоритму (он на доске) Слайд 14. Ум – хорошо, а два – лучше! Алгоритм 1. III период, V группа 2. Заряд ядра +15 3. Состав атома: (15 p+, 16 n0) 15 е-. Задания для групп Карточка №1 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Определите заряд ядра. 3. Каков состав атома? Карточка №2 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Определите заряд ядра. 3. Каков состав атома? Карточка №3 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Определите заряд ядра. 3. Каков состав атома? Карточка №4 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Определите заряд ядра. 3. Каков состав атома? Карточка №5 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Определите заряд ядра. 3. Каков состав атома? Карточка №6 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Определите заряд ядра. 3. Каков состав атома? Умелые руки – помощники науке! Карточка №7 В ядре атома химического элемента содержится 1 протон, 1 электрон. Определите элемент. Составьте формулу его оксида. Опытным путем докажите наличие его в пробирке. Определите заряд ядра. 3. Каков состав атома? Карточка №3 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Определите заряд ядра. 3. Каков состав атома? Карточка №4 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Определите заряд ядра. 3. Каков состав атома? Карточка №5 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Определите заряд ядра. 3. Каков состав атома? Карточка №6 1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева. 2. Определите заряд ядра. 3. Каков состав атома? Умелые руки – помощники науке! Карточка №7 В ядре атома химического элемента содержится 1 протон, 1 электрон. Определите элемент. Составьте формулу его оксида. Опытным путем докажите наличие его в пробирке. Карточка №8 В ядре атома химического элемента А содержится 11 протонов, а в ядре атома химического элемента В 17 электронов. Определите элементы. Составьте формулу соединения этих элементов. Получите раствор данного вещества. Карточка №9 В ядре атома химического элемента содержится 6 протонов, 6 электронов. Определите элемент. Составьте формулу его оксида. Охарактеризуйте оксид. Дополнительные задания: №3-4, стр. 50 учебника. <br></p> Карточка №8 В ядре атома химического элемента А содержится 11 протонов, а в ядре атома химического элемента В 17 электронов. Определите элементы. Составьте формулу соединения этих элементов. Получите раствор данного вещества. Карточка №9 В ядре атома химического элемента содержится 6 протонов, 6 электронов. Определите элемент. Составьте формулу его оксида. Охарактеризуйте оксид. Дополнительные задания: №3-4, стр. 50 учебника. <br></p> | чёрный ящик, презентация<br> | Конец урока | <p><b>V. Рефлексивно-оценочный этап.</b> Мало хотеть, надо уметь! (девиз) 1. «Крестики-нолики» Если согласны – руки вверх, не согласны – машем руками. Слайд 15. Вопросы: 1. Модель строения атома была предложена Э.Резерфордом в 1911 году. Х 2. В центре атома находится отрицательно заряженное ядро. О 3. Вокруг ядра вращаются положительно заряженные электроны. О 4. Заряд протона равен -1. О 5. Заряд нейтрона равен 0. Х 6. Величина и знак зарядов электрона и протона равны. О 7. Число протонов равно порядковому номеру элемента. Х 8. Число нейтронов находится по формуле N=Ar + Z. О 9. Всему начало – атом. Мы сегодня в этом убедились. Х 2. Творческий проект 3. Синквейн Слайд 16. Слайд 15. Вопросы: 1. Модель строения атома была предложена Э.Резерфордом в 1911 году. Х 2. В центре атома находится отрицательно заряженное ядро. О 3. Вокруг ядра вращаются положительно заряженные электроны. О 4. Заряд протона равен -1. О 5. Заряд нейтрона равен 0. Х 6. Величина и знак зарядов электрона и протона равны. О 7. Число протонов равно порядковому номеру элемента. Х 8. Число нейтронов находится по формуле N=Ar + Z. О 9. Всему начало – атом. Мы сегодня в этом убедились. Х 2. Творческий проект 3. Синквейн Слайд 16.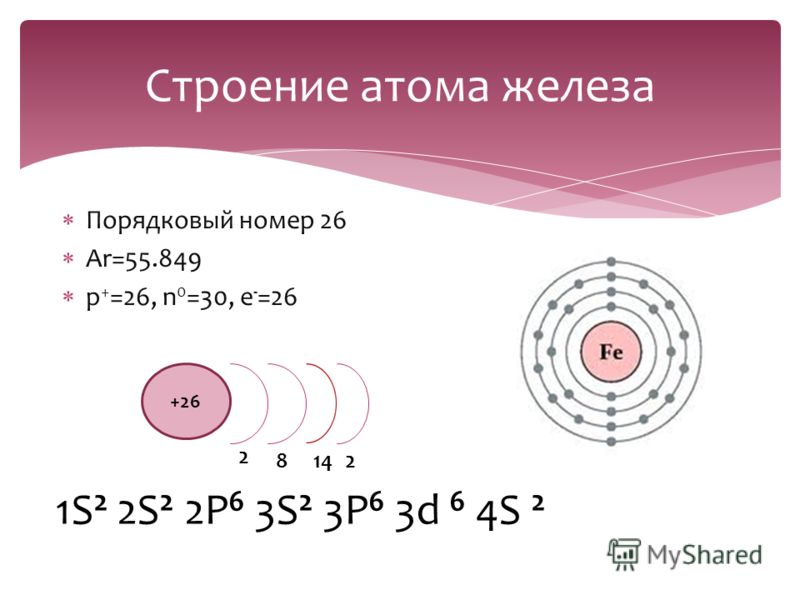 4. Сочинение. Как вы думаете, о чём идёт речь в сочинении?: “Атом мне представляется одной большой семьёй. В центре семьи, конечно же, родители: очень добрая, заботливая, положительная мама и строгий, но справедливый, словом нейтральный папа. А вокруг них вечные двигатели, вечные прыгатели – дети, которые не присядут ни на минутку. Они словно маленькие “энерджайзеры”, у них много-много дел, им хочется всё увидеть, всё услышать, всё узнать. И чем больше запас их энергии, тем дальше убегают они от родителей. Для того чтобы семья была гармоничной: чтобы дети могли получить хорошее образование, развивать свои способности в музыкальной школе, в изостудии, в танцевальных коллективах, в спортивных секциях и т.д.; чтобы папа и мама могли позволить себе посещать театры, концерты, путешествовать и прочие радости жизни, родители очень много трудятся. Папа выполняет нейтральные дела, а мама – только положительные, за каждое дело они получают единицу зарплаты. Поэтому общая зарплата папы и мамы составляет доход всей семьи. 4. Сочинение. Как вы думаете, о чём идёт речь в сочинении?: “Атом мне представляется одной большой семьёй. В центре семьи, конечно же, родители: очень добрая, заботливая, положительная мама и строгий, но справедливый, словом нейтральный папа. А вокруг них вечные двигатели, вечные прыгатели – дети, которые не присядут ни на минутку. Они словно маленькие “энерджайзеры”, у них много-много дел, им хочется всё увидеть, всё услышать, всё узнать. И чем больше запас их энергии, тем дальше убегают они от родителей. Для того чтобы семья была гармоничной: чтобы дети могли получить хорошее образование, развивать свои способности в музыкальной школе, в изостудии, в танцевальных коллективах, в спортивных секциях и т.д.; чтобы папа и мама могли позволить себе посещать театры, концерты, путешествовать и прочие радости жизни, родители очень много трудятся. Папа выполняет нейтральные дела, а мама – только положительные, за каждое дело они получают единицу зарплаты. Поэтому общая зарплата папы и мамы составляет доход всей семьи.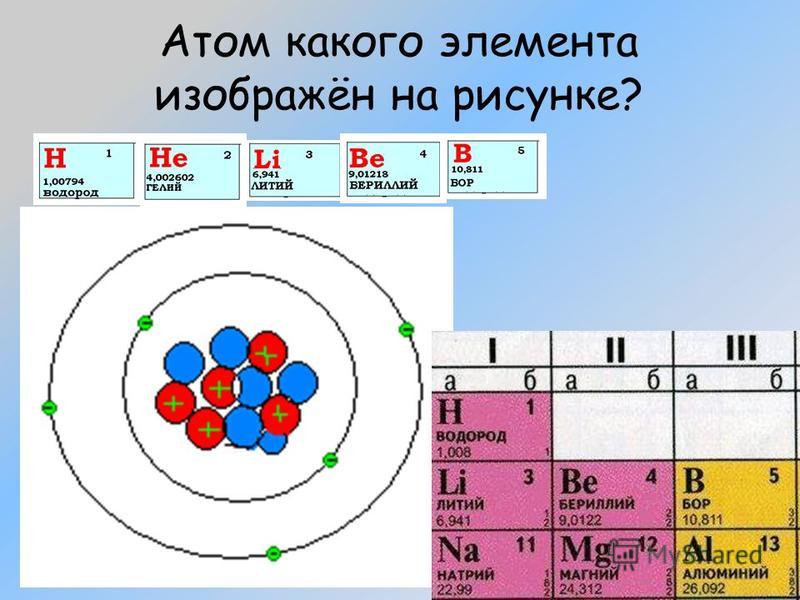 Чем больше в семье детей, тем больше трудятся родители. Вот такой он крошечный, невидимый, но сложный и интересный атом”. Как вам кажется ребята, какими научными терминами можно назвать положительная мама, нейтральный папа, дети, нейтральные дела, положительные дела, единица зарплаты, доход всей семьи. <br></p> Чем больше в семье детей, тем больше трудятся родители. Вот такой он крошечный, невидимый, но сложный и интересный атом”. Как вам кажется ребята, какими научными терминами можно назвать положительная мама, нейтральный папа, дети, нейтральные дела, положительные дела, единица зарплаты, доход всей семьи. <br></p> |
| 21 мая 2020 г. | |||
| Органические вещества. Углеводороды | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Органические вещества. Кислородосодержащие соединения | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
15 мая 2020 г.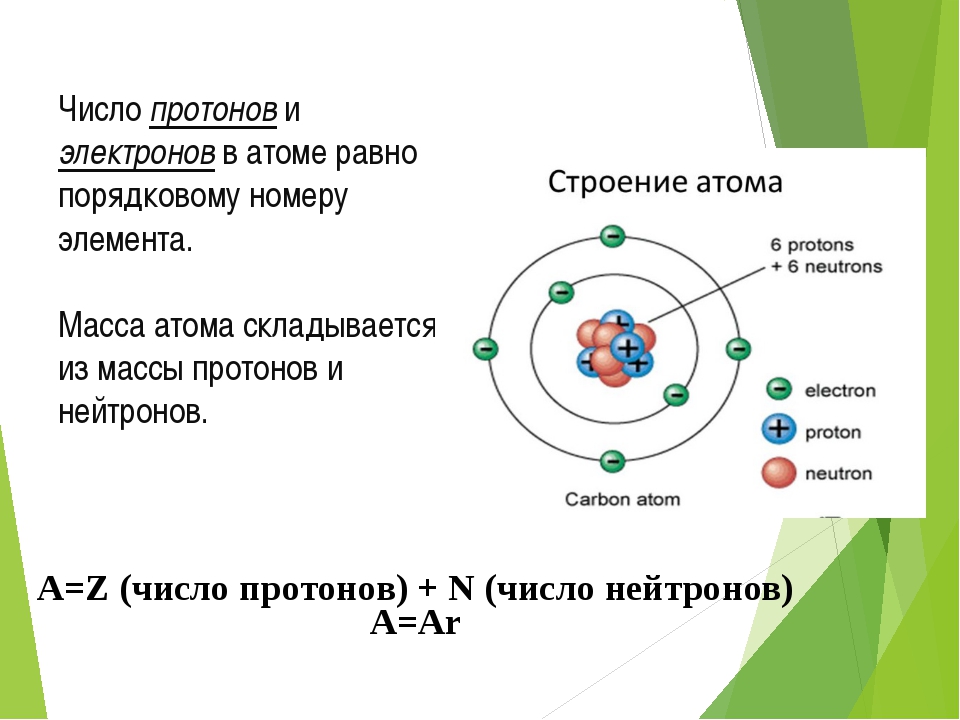 | |||
| Итоговая видеоконсультация по химии | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| 12 мая 2020 г. | |||
| Генетическая связь между классами неорганических соединений | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Кислоты неорганические и органические | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| 5 мая 2020 г. | |||
| Электролиз растворов и расплавов. Применение электролиза в промышленности | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Неметаллы | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
29 апреля 2020 г. | |||
| Окислительно-восстановительные реакции в природе, производственных процессах и жизнедеятельности организмов | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Свойства простых веществ – металлов главных и побочных подгрупп | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Урок 1. Обобщение знаний. Виды химических связей и типы кристаллических решеток | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Урок 2. Обобщение знаний. Электроотрицательность. Степень окисления | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
6 апреля 2020 г.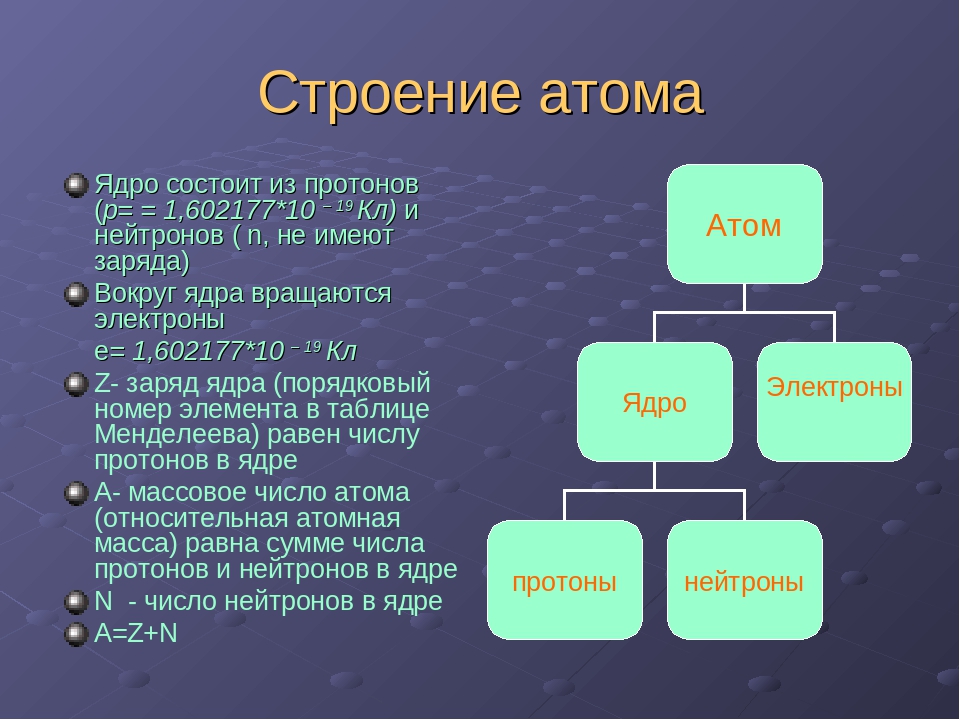 | |||
| Свойства, получение и применение углерода. Синтез-газ как основа современной промышленности | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Общая характеристика элементов IVА-группы | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Классификация химических реакций по различным признакам. Скорость химической реакции | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
Структура шаблона презентации Atom : MyFreeSlides
Бесплатный шаблон структуры Atom PowerPoint и тема Google Slides.

Перейти к просмотру и загрузке
Структура атома Шаблон PowerPoint представляет собой бесплатную тему PowerPoint, связанную с химией или бизнесом. Создайте потрясающий шаблон по химии для своих проектов в классе, который сэкономит вам много времени. Это также можно использовать в качестве темы слайдов Google. Эта тема на самом деле красного цвета, но вы можете изменить цвет темы, как указано в самой презентации.Проверьте наш другой бесплатный шаблон Powerpoint по химии. Обратная связь с вашей стороны высоко ценится :). Проверьте наличие новых версий здесь: MyFreeSlides
Атом — это наименьшая составная единица обычной материи, обладающая свойствами химического элемента. Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Атомы чрезвычайно малы; типичные размеры составляют около 100 пикометров. Атомы достаточно малы, чтобы попытаться предсказать их поведение с помощью классической физики.
Этот шаблон презентации представляет собой набор из 28 слайдов, которые содержат слайды с информационными стилями, слайды с различиями, стили описания, слайды с разрывами разделов для немедленного редактирования. Вы можете использовать их или изменить текст по своему усмотрению.
Этот простой, но привлекательный шаблон дополнен небольшими элементами. Я уверен, вам понравится! Вы также можете использовать эту презентацию для создания обучающих видеороликов! Просто замените текст и добавьте музыку!
9 Основные характеристики этого шаблона презентации:- Титульный слайд
- О вашей теме.
- Объясните свою тему
- Слайды с изображениями
- Слайды с различиями
- Слайды для сравнения по стилям таблиц (слайды с различиями)
- О разделе
- Слайд с концепцией обзора и многое другое
 Подпишитесь на нас, чтобы не пропустить ни одного обновления 🙂 . Кроме того, проверьте наши другие сообщения для MyFreeSlides.
Подпишитесь на нас, чтобы не пропустить ни одного обновления 🙂 . Кроме того, проверьте наши другие сообщения для MyFreeSlides.Спасибо! 🙏
Совет: чтобы привлечь внимание ваших пользователей к определенной теме, вы можете размыть изображения, которые больше повлияют на зрителей. Вы можете добиться такого же эффекта на любом изображении, а затем вставить изображение на слайды!
Бесплатные : Да
Анимированные : Нет
Размер : 16: 9 Размер : 16: 9 Win / Mac Готов : Да
Предварительный просмотр
Вот предварительный просмотр слайдов –атомная структура шаблонов PowerPoint и Google Slides Themes, фоны для презентаций
Актуальность Популярный Новейшие Неоткрытый
молекулярная структура powerpoint шаблон powerpoint
структура атома powerpoint шаблон
шаблон атомной решетки
аннотация фиолетовая молекулярная структура шаблона powerpoint
абстрактная зеленая молекулярная структура шаблона powerpoint
молекулярная решетка Toolboint
базовая физика PowerPoint шаблон
молекулярное скелет PowerPoint Шаблон
Молекулярная решетка в темно-желтых тонах Шаблон PowerPoint
Уроки физики Шаблоны презентаций PowerPoint
Двойная спираль Шаблоны презентаций PowerPoint
Молекулярная модель в темно-синих тонах Шаблоны презентаций PowerPoint
Сетевая модель Шаблоны презентаций PowerPoint
Корпоративные деловые связи Шаблоны презентаций PowerPoint
Диаграмма подключенных сфер
Атом углерода Шаблон PowerPoint
Модель молекулярного компьютера Шаблон PowerPoint
Столкновение двух сфер Аннотация Шаблоны презентаций PowerPoint
Молекулярная решетка в темно-синих тонах Шаблоны презентаций PowerPoint
Молекулярная решетка в темно-зеленых тонах Шаблоны презентаций PowerPoint
Молекулярная решетка в зеленых тонах Шаблоны презентаций PowerPoint
Блокчейн сети Шаблоны презентаций PowerPoint
Сияющая модель атома Шаблоны презентаций PowerPoint
Атом Диаграмма
Большие идеи Темы Свойства жизни Атомная структура
Большие идеи и темы
Свойства жизни
Атомная структура
Вода
Органические макромолекулы
Белки
Большие идеи Свойства и темы жизни Атомная структура Вода Органические макромолекулы Белки 100 долларов 100 долларов 200 долларов 200 долларов 300 долларов 300 долларов 400 долларов 400 долларов 500 долларов 500 долларов Двойная опасность!
Тема 1 Что такое гомеостаз $100
Тема 1 Устойчивое состояние «Поддержание стабильной внутренней среды» Назад $100
Тема 1 Какое ключевое слово в теме экологии? 200 долларов
Тема 1 «Взаимодействия» Назад $200
Тема 1 Структура коррелирует с ——- на всех уровнях биологической организации. $300
$300
Тема 1 Функция Назад $300
Тема 1 Укажите любые 2 различия между прокариотической и эукариотической клетками. 400 долларов
Тема 1 Эукариоты имеют определенное ядро и другие связанные с мембраной органеллы. Назад $400
Тема 1 Что такое «основная тема» и что она объясняет? 500 долларов
Тема 1 Эволюция Объясняет единство и разнообразие жизни. Назад $500
Тема 2 Что является основой жизни, которая требует эволюционных изменений? 100 долларов
Тема 2 Адаптация Назад $100
Тема 2 Все живые и неживые компоненты в данной области в совокупности называются….200 долларов
Тема 2 Экосистема Назад $200
Тема 2 Согласно клеточной теории, все живые организмы состоят из клеток. Приведите пример исключения из этого правила. $300
Тема 2 Вирусы Назад $300
Тема 2 Что будет дальше в уровнях иерархии? Нервная система, головной мозг, Нервная ткань; —— $400
Тема 2 Нервная клетка Задняя часть 400 долларов США
Тема 2 Назовите 2 основные части цветка? 500 долларов
Тема 2 Андроцей (мужской) и гинецей (женский) Назад $500
Тема 3 Вещество, состоящее из 2 или более элементов в фиксированном соотношении, называется ……… $100
Составная задняя часть Тема 3 $100
Тема 3 Реакционная способность элемента определяется ……. . ………. . 200 долларов
. ………. . 200 долларов
Тема 3 Валентные электроны Назад $200
Тема 3 Какие существуют два типа ионов? Объяснять. $300
Тема 3 Анионы заряжены отрицательно; Катионы заряжены положительно. Назад $300
Тема 3 Назовите любые три типа химической связи. 400 долларов
Тема 3 Ковалентные связи, Ионные связи, Водородные связи Назад $400
Тема 3 Почему изотопы имеют одинаковый атомный номер, но разную атомную массу? 500 долларов
Тема 3 Это потому, что изотопы представляют собой разные формы одного и того же элемента с разным количеством нейтронов.Назад $500
Тема 4 Какие связи разрываются при испарении воды? 100 долларов
Тема 4 Водородные связи Назад $100
Тема 4 Различие между растворителем, растворенным веществом и раствором. 200 долларов
Тема 4 Растворитель — это среда, в которой растворенное вещество растворяется для получения раствора. Назад $200
Тема 4 Объясните полярность молекулы воды. $300
$300
Тема 4 Кислородная сторона воды слегка отрицательна, а водородная сторона слегка положительна Назад $300
Тема 4 Объясните, как вы понимаете с.Шкала H $400
Тема 4 стр. Диапазон шкалы H: от 0 до 14 точек. Н 7 нейтрален; От 0 до 6,9 – кислотная среда, от 7,1 до 14 – щелочная (щелочная) Назад 400 долл. США
Тема 4 Какие свойства воды позволяют ей подниматься в ксилеме растений? 500 долларов
Тема 4 Когезия и адгезия Назад $500
Тема 5 Какое свойство углерода придает ему беспрецедентную способность образовывать сложные молекулы? 100 долларов
Тема 5 Тетравалентность Назад $100
Тема 5 Молекулы с одинаковой молекулярной формулой, но разной структурной формулой называются ….. 200 долларов
Тема 5 Изомеры Назад $200
Тема 5 Назовите любые 3 функциональные группы, связанные с углеродным скелетом. $300
Тема 5 Обратный гидроксил (OH), карбоксил (COOH), амино (NH 2), фосфат (PO 4), 300 долларов США сульфгидрил (SH)
Тема 5 Назовите реакцию образования мономеров из полимеров и наоборот. 400 долларов
400 долларов
Тема 5 Синтез гидролиза и дегидратации Назад $400
Тема 5 Каковы основные различия между насыщенными и ненасыщенными жирами и их значение? 500 долларов
Тема 5 При насыщении водородом они образуют прямые цепи с одинарными связями и, таким образом, Назад $500
Тема 6 Из чего состоят белки? 100 долларов
Тема 6 Аминокислоты Назад $100
Тема 6 Каковы важные функции белков? 200 долларов
Тема 6 Бодибилдинг и биокатализ Назад $200
Тема 6 В чем ключевое различие между аминокислотами и их значение в третичной структуре? $300
Тема 6 R-групп.Взаимодействия между ними создают сложную шаровидную форму. 300 долларов назад
Тема 6 Назовите четыре взаимодействия между R-группами. 400 долларов
Тема 6 Гидрофобные и ван-дер-ваальсовы взаимодействия; Водородные связи и дисульфидные мостики. Назад $400
Тема 6 Назовите строительные блоки всех макромолекул. 500 долларов
Тема 6 Моносахариды, триглицериды, аминокислоты и нуклеотиды. Назад $500
Назад $500
Атомы, молекулы и ионы Темы
Атомная бомба
Судя по тому, что мы знаем об атомах, на самом деле они не имеют формы (или размера) бомбы.Они не взрываются и являются строительными блоками всей химии. Так что там с атомной бомбой? Это мини-атомы углерода, которые взрываются при ударе? Неа. Давайте проясним всю путаницу.
Давным-давно, в 1930-х годах, жил итальянский физик по имени Энрико Ферми, который хотел попробовать создать новый элемент. Что уж тут говорить, некоторым нравится пробовать новые рецепты печенья, а другим нравится создавать новые элементы. Подход Ферми заключался в том, чтобы взять самый тяжелый известный элемент (на тот момент) и поразить его потоком нейтронов.Идея заключалась в том, что если в ядро атома урана встроить дополнительный нейтрон, то ядро может подвергнуться бета-распаду.
Не вдаваясь в подробности, бета-распад — это процесс превращения нейтрона в протон. Этот процесс высвобождает электрон. Если бы идея Ферми сработала, впервые был бы синтезирован новый элемент с атомным номером 93. У нас есть ощущение, что этот элемент назвали бы фермитунием, а не нептунием, если бы это сработало.
У нас есть ощущение, что этот элемент назвали бы фермитунием, а не нептунием, если бы это сработало.
Энрико Ферми: Модель костюма и ученый (1901-1954).(Изображение отсюда.)
Идея Ферми в форме уравнения:
Как и любой хороший ученый, Ферми быстро провел свой эксперимент. Он действительно обнаружил испускание бета-частиц, то есть быстро движущихся электронов, высвобождаемых во время бета-распада, но его результаты оказались неубедительными. Синтезировал ли он новый элемент? Неясно. Он никогда не исследовал химически продукты, чтобы определить их состав, и поэтому не мог с уверенностью сказать, было ли это у него или нет.Должно быть, в те выходные был очень важный футбольный матч.
Несколько лет спустя три исследователя из Германии, Лиза Мейтнер, Фриц Страсманн и Отто Ган решили, что эксперимент Ферми стоит повторить и проанализировать более тщательно. То, что они нашли, навсегда изменит мир, и мы определенно не драматизируем. Это были умопомрачительные вещи, изменяющие мир, о которых мы говорим.
После анализа продуктов они обнаружили несколько элементов легче урана, а не тяжелее, как предсказывал Ферми.6 января 1939 года они сообщили, что бомбардировка урана нейтронами привела к ядерному делению, то есть расщеплению атома. Все это время ученые думали, что атомы полностью неделимы, но это было не так. Удар по урану потоком нейтронов разбил атомы урана на барий, криптон и другие более мелкие продукты. Еще одним очень важным компонентом этой реакции было невероятное количество высвобождаемой энергии.
Выводы Мейтнер, Страсмана и Хана в форме уравнения:
Следует отметить одну интересную вещь: изотоп исходного урана, U-235, не является самой распространенной формой урана на планете.На самом деле U-235 составляет менее 1% всего встречающегося в природе урана. Самая распространенная форма, U-238, не подвергается делению. Сумасшедший, да? Следовательно, уран, используемый в качестве топлива в ядерных реакциях, должен быть обогащенным ураном-235, то есть он должен содержать больше урана-235, чем встречается в природе.
Вы, наверное, слышали термин «обогащение урана» в новостях или даже в своих классах. 2,3 Обогащение урана — строго (и глобально) регулируемый процесс, который увеличивает процентное содержание U-235 в образцах урана.Существует множество методов, но наиболее распространенным является гигантская газовая центрифуга, которая очень быстро вращает образцы урана и помогает отделить U-235 от других встречающихся в природе изотопов урана.
Газовая центрифуга для обогащения урана-235. (Изображение отсюда.)
После обогащения урана ураном-235 в нем может произойти цепная реакция, в которой нейтроны, образующиеся при делении одного ядра урана, могут вызывать деление других ядер урана. Процесс продолжается до тех пор, пока вся проба U-235 не исчезнет.Остается целая куча легких элементов и целая куча энергии.
Цепная реакция деления
Количество производимой энергии огромно. Он достаточно огромен, чтобы создать смертоносную и катастрофическую бомбу, или то, что мы знаем как атомную бомбу. Хотя произвести достаточное количество обогащенного урана-235, чтобы создать атомную бомбу, способную к массовому уничтожению, непросто, все мы знаем, что это возможно.
Хотя произвести достаточное количество обогащенного урана-235, чтобы создать атомную бомбу, способную к массовому уничтожению, непросто, все мы знаем, что это возможно.
В 1941 году, в разгар Второй мировой войны, правительство США начало сверхсекретное предприятие под названием «Манхэттенский проект».Его главная цель состояла в том, чтобы обогатить достаточное количество U-235 и создать атомную бомбу раньше, чем это сделали немцы. Проект возглавлял физик Дж. Р. Оппенгеймер, а его штаб-квартира находилась в Лос-Аламосе, штат Нью-Мексико. После четырех лет исследований первое в мире ядерное оружие было успешно взорвано на полигоне в Нью-Мексико. Эта первая бомба взорвалась с силой, эквивалентной 18 000 тонн динамита. 4
США не нужно было использовать свои новые навыки создания атомной бомбы против Германии. К тому времени, когда была сконструирована бомба, они уже были побеждены.Вместо этого атомная бомба была использована против Японии во время Второй мировой войны. Одна бомба была сброшена на город Хиросима, вторая бомба была сброшена на город Нагасаки. Вместе две бомбы убили около 200 000 человек и вынудили Японию сдаться. Вторая мировая война закончилась, но начался атомный век.
Одна бомба была сброшена на город Хиросима, вторая бомба была сброшена на город Нагасаки. Вместе две бомбы убили около 200 000 человек и вынудили Японию сдаться. Вторая мировая война закончилась, но начался атомный век.
Энергия атомной бомбы (ядерного деления) также использовалась во благо, включая производство огромного количества «чистой» энергии/электричества с помощью ядерных реакторов.Однако всегда важно помнить, что с большой силой приходит большая ответственность.
Создание атомарных компонентов для атомарной системы проектирования в Figma
Этот пост является частью серии: Создание системы проектирования с помощью Figma на littleBits. Прочитайте следующий пост о создании адаптивных макетов здесь.
В этом году команда разработчиков LittleBits столкнулась с проблемой: мы хотели обновить наше фирменное приложение littleBits для запуска трех новых наборов, и мы также были рады создать тематическое приложение Marvel для запуска с нашим новым набором Avengers Hero Inventor Kit. .
.
В целом мы собирались выпустить четыре новых приложения (два приложения, развернутых как для iOS, так и для Android, предназначенных для мобильных устройств и планшетов!), и у нас было — около 6 месяцев четкой дорожной карты с небольшой командой.
Когда мы обдумывали подход к созданию нашей дизайн-системы, мы обратили внимание на существующую методологию — в первую очередь на Atomic Design Брэда Фроста. Мы также рассмотрели популярные интерфейсные фреймворки, такие как Bootstrap. В этом посте рассказывается о том, как мы построили систему атомарного дизайна в Figma.
На уровне Atomic стили текста и цвета были определены с помощью стилей Figma.
Набор иконок (адаптированных из Modern Pictograms) был импортирован и преобразован в компоненты.
Мы взяли некоторые названия образцов из Bootstrap. Зная, что цвета в темах будут меняться, мы хотели использовать семантические имена для ключевых состояний пользовательского интерфейса, и Bootstrap был знакомой основой.
Мы расширили категории образцов пользовательского интерфейса и оттенков серого в Bootstrap, добавив более подробные наборы образцов брендов и специальные образцы для фона, наложений и контуров.
Когда мы разработали наши шаблоны, стало ясно, что для нас не так уж часто приходилось иметь сложные «молекулы» или «организмы», которые повторно использовались между несколькими шаблонами.
Итак, мы назвали все из этих категорий «Компоненты». Это была более простая структура, которая также хорошо соответствовала тому, что в конечном итоге стало нашими компонентами React Native.
Компоненты включали базовые элементы, такие как карточки и всплывающие подсказки, а также основные элементы, такие как кнопки.
Выпуск Figma Styles в середине нашего процесса позволил нам радикально упростить структуру слоев наших компонентов — это очень помогло с общим удобством использования и производительностью документа.
Поскольку смешивать и сочетать стили текста с образцами было очень просто, мы не стали создавать дополнительные компоненты для сочетаний цветов и стилей — мы создали руководство по стилю для справки и при необходимости применяли стили текста и образцы в шаблонах.
Семантические имена для образцов также помогают сохранить ясность шаблонов и их использования — например, в светлой теме образец «bg — светлый» используется для цветов фона, а «ui — темный» используется по умолчанию для элементов переднего плана. Когда образцы используются таким образом, в будущем легче редактировать дизайн цветов и быть уверенным, что это ничего не сломает.
Возможность смешивать и сочетать стили текста в одном текстовом поле дала нам гибкость при работе с текстом, длина копии которого была переменной.
Однако для основных стилей кнопок мы создали вложенные компоненты.
Некоторые из наших стилей кнопок имели контуры (которыми до сих пор не так просто централизованно управлять в Figma), и кнопки, конечно же, часто повторяются в дизайне.
Мы создали Первичную, Второстепенную и Третичную версии нашего компонента кнопки, а также вызвали некоторые другие пользовательские кнопки, которые будут часто повторяться в наших проектах.
И вот так.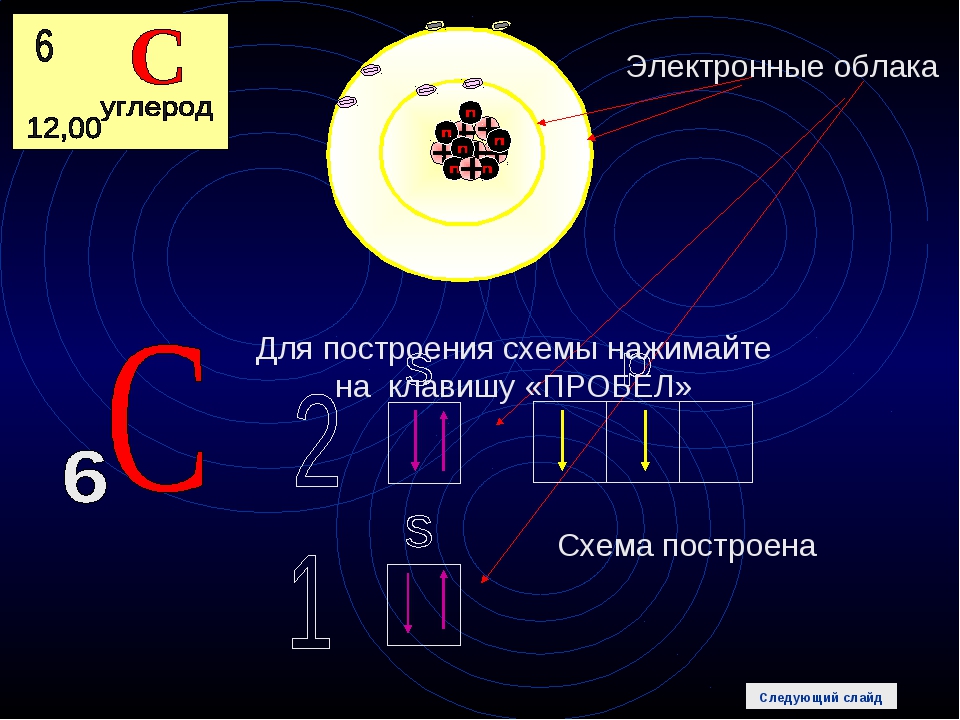 .. У нас была отличная база для системы, которая хорошо сопоставлялась с компонентами, которые будут определены в нашем приложении React Native.
.. У нас была отличная база для системы, которая хорошо сопоставлялась с компонентами, которые будут определены в нашем приложении React Native.
Следующим шагом было создание системы адаптивных шаблонов макетов.
Этот пост является частью серии «Создание дизайн-системы с помощью Figma» на littleBits. Прочитайте следующий пост Создание шаблонов адаптивного макета в Figma.
1: Атомная структура — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
Так же, как язык имеет алфавит, из которого строятся слова, химия имеет алфавит, с помощью которого описывается материя.Однако химический алфавит больше, чем тот, который мы используем для правописания. Возможно, вы уже поняли, что химический алфавит состоит из химических элементов. Их роль занимает центральное место в химии, поскольку они объединяются, образуя миллионы и миллионы известных соединений.
Возможно, вы уже поняли, что химический алфавит состоит из химических элементов. Их роль занимает центральное место в химии, поскольку они объединяются, образуя миллионы и миллионы известных соединений.
- 1.1: Элементы
- Вся материя состоит из элементов. Химические элементы обозначаются однобуквенным или двухбуквенным символом.
- 1.2: Теория атома
- Атомы — основные строительные блоки всей материи.Современная атомная теория устанавливает представления об атомах и о том, как они составляют материю.
- 1.3: Структура атомов
- Атомы состоят из трех основных субатомных частиц: протонов, нейтронов и электронов. Протоны и нейтроны группируются в ядре атома, а электроны вращаются вокруг ядра.
- 1.4: Ядра атомов
- Элементы можно идентифицировать по их атомному номеру и массовому числу.
 Изотопы — это атомы одного и того же элемента, имеющие разную массу.
Изотопы — это атомы одного и того же элемента, имеющие разную массу.
- 1.5: Масса атомов
- Масса атомов в значительной степени зависит от количества протонов и нейтронов в их ядре.
- 1.6: Расположение электронов
- Электроны организованы в оболочки и подоболочки вокруг ядра атома.
- 1.7: Периодическая таблица
- Химические элементы расположены в таблице, называемой периодической таблицей.Некоторые характеристики элементов связаны с их положением в периодической таблице. 1.8: Элементы, атомы и периодическая таблица (краткое содержание) темы в главе.
- 1.9: Элементы, атомы и таблица Менделеева (упражнения)
- Это домашнее задание к главе 2 Ball et al.Текстовая карта «Основы химии GOB».
Молвиев
Меню модели содержит некоторые общие функции для 3D-модели.
Сброс
Эта функция возвращает положение модели, масштабирование и вращение к значениям по умолчанию.
Представительство
Вы можете выбрать из списка различных представлений молекул, включая; мяч и палка, палка, сферы Ван-дер-Ваальса, каркас и линии.Макромолекулы автоматически рисуются с помощью лент.
Фон
Вы можете переключаться между черным, серым или белым фоном. Фон по умолчанию черный (экспортированные изображения из GLmol или ChemDoodle имеют прозрачный фон)
Двигатели
Вы можете выбрать один из трех различных движков рендеринга: GLmol , Jmol и ChemDoodle . GLmol используется как движок рендеринга по умолчанию. GLmol и ChemDoodle основаны на WebGL, технологии браузера для поддержки 3D-графики.Если WebGL недоступен в вашем браузере, для всего рендеринга будет использоваться Jmol.
MolView автоматически переключается на:
- Jmol если вы выполняете функции из меню Jmol
- GLmol при загрузке макромолекул (из-за значительно более высокой производительности)
- ChemDoodle , если вы загружаете кристаллическую структуру (GLmol не может отображать кристаллические структуры)
Вы можете вернуться к GLmol, когда вам больше не нужны Jmol или ChemDoodle, так как GLmol имеет более высокую производительность.
Обратите внимание, что макромолекулы нарисованы немного по-разному в каждом двигателе. ChemDoodle обеспечивает наилучшее отображение. Однако вам следует избегать использования ChemDoodle для очень больших макромолекул.
Трансформация модели
Вы можете вращать, панорамировать и масштабировать 3D-модель. Используйте правую кнопку для вращения, среднюю кнопку для перевода (кроме ChemDoodle) и колесо прокрутки для масштабирования. На сенсорных устройствах вы можете вращать модель одним пальцем и масштабировать модель двумя пальцами.
Кристаллография
Вы можете загрузить массив кристаллических ячеек (2x2x2 или 1x3x3) или одну элементарную ячейку при просмотре кристаллических структур.
Туман и обрезка
При просмотре больших структур, таких как белки, может быть полезно скрыть определенную часть с помощью тумана или плоскости отсечения. GLmol предлагает несколько вариантов для этого.
- Туман: вы можете переместить туман вперед, перетащив мышь вверх удерживая CTRL + SHIFT (перетащите в противоположном направлении, чтобы переместить туман назад)
- Плоскость отсечения: вы можете переместить фронтальную плоскость отсечения в структуру, перетащив мышь влево , удерживая CTRL + SHIFT (перетащите в противоположном направлении, чтобы переместить плоскость отсечения назад)



 Вопрос:
Вопрос: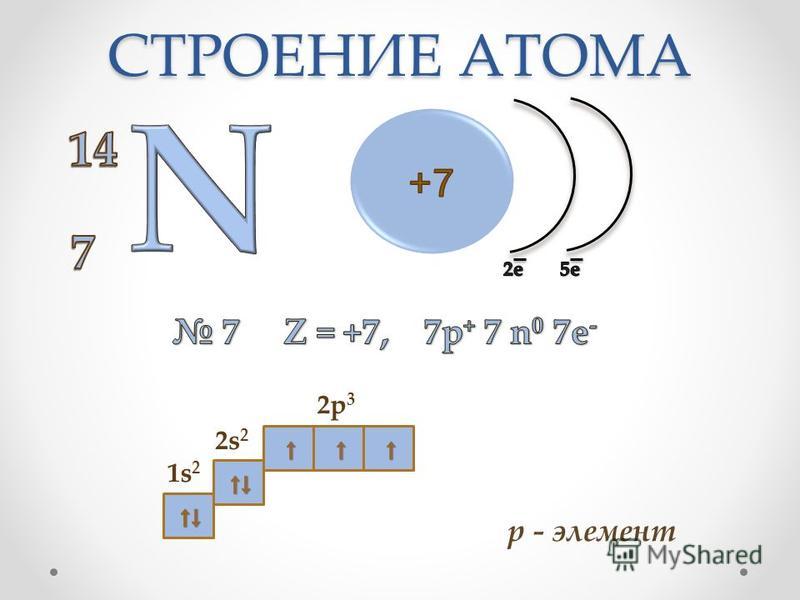 Изотопы — это атомы одного и того же элемента, имеющие разную массу.
Изотопы — это атомы одного и того же элемента, имеющие разную массу.