Строение атома
Развитие химии во второй половине XIX
века происходило на прочной основе
Периодического закона. Но в своем
основном труде “Основы химии”,
выдержившем много изданий,
Д.И.Менделеев писал: “Периодическая
изменяемость простых и сложных тел
подчиняется некоторому высшему
закону, природу которого, а тем более
причину еще нет средства охватить. По
всей вероятности, она кроется в
основных началах внутренней механики
атомов и частиц”. Установление
физиками сложного строения атомов
химических элементов, создание
физической теории (квантовой
механики), которая выяснила
электронное строение атомов, и
ядероной физики, которая объяснила
строение ядер атомов, все это
позволило понять причину
периодического изменения свойств
химических элементов, уточнить
формулировку Периодического закона
и структуру Периодической системы
химических элементов в ее короткой и
длинной формах.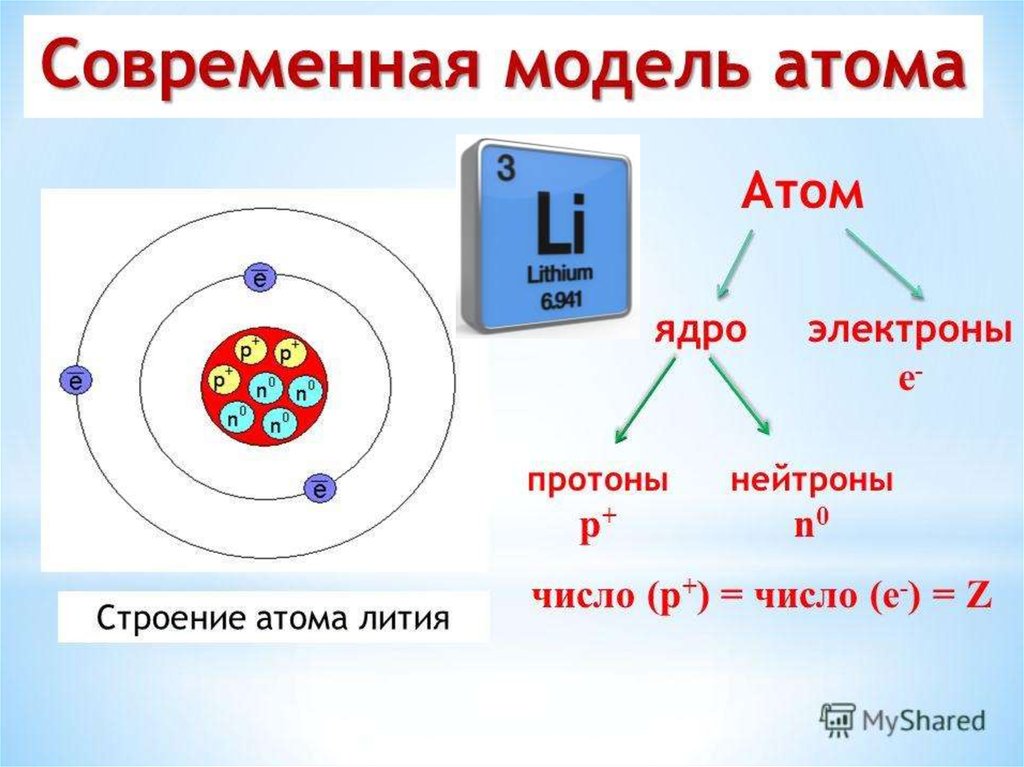
Модели строения атомов в XIX и начале XX века
Химия – наука о веществах и закономерностях их превращений. Молекула – мельчайшая частица вещества, которая обладает его основными химическими свойствами, состоящая из атомов, связанных между собой химическими связями. А из чего состоят атомы? Сейчас это знают все старшеклассники. Атомы химических элементов состоят из положительно заряженного ядра и электронов. Как же наука пришла к такому выводу?
То, что тела могут приобретать
положительный или отрицательный
заряд в результате трения, люди
узнали очень давно. Если опустить
электроды, к которым приложена
разность потенциалов, в раствор
какой-либо соли, то через раствор
может протекать электрический ток и
на отрицательном электроде (катоде)
будет осаждаться, например медь (если
это был раствор медного купороса), а
на аноде будет выделяться кислород.

Простейшая модель атома была предложена английским ученым Дж.Дж.Томсоном и напоминала сильно уменьшенную “калорийную булочку”.
Предполагалось, что положительный заряд равномерно распределен по всему объему атома, а электроны подобны изюминкам, вкрапленным в тело булочки. Атом в целом является электронейтральным, так как положительные и отрицательные заряды уравновешивают друг друга.
В 1895 г. было открыто явление
радиоактивности: некоторые вещества
(названные радиоактивными) способны
излучать невидимые “лучи”, которые
обладают большой проникающей
способностью и могут “засвечивать”
завернутую в темную бумагу
фотопластинку. Было установлено, что
природа этих “лучей” у разных веществ
может отличаться, и их
классифицировали на a-, b- и g-лучи.
Позже было установлено, что a-лучи –
это ядра атомов He, b-лучи – поток
электронов, а g-лучи – очень “жесткое”
рентгеновское излучение.
По закону всемирного тяготения Ньютона на планету со стороны Солнца действует сила притяжения:
Все тела, которые не обладали
орбитальной скоростью движения по
отношению к Солнцу, под действием
силы тяготения упали на Солнце.
Если теперь рассмотреть простейший одноэлектронный атом – атом водорода, то на электрон со стороны ядра действует не только гравитационная сила:
по закону всемирного притяжения масс, но и кулоновская сила:
Зная массы протона и электрона, зная
заряды электрона и протона, легко
сравнить эти силы.
Итак, Э.Резерфорд доказал
существование ядра атома на основе
анализа статистического
распределения a-частиц после их
прохождения через золотую фольгу. Как доказательство статистические
закономерности использовались
впервые и поэтому вызывали большие
сомнения. Планетарная модель
строения атома противоречила
законам классической
электродинамики. Нужны были новые
доказательства.
Как доказательство статистические
закономерности использовались
впервые и поэтому вызывали большие
сомнения. Планетарная модель
строения атома противоречила
законам классической
электродинамики. Нужны были новые
доказательства.
В 1913 г. в лабораторию к Э.Резерфорду приехал стажер из Дании – Нильс Бор. Он ознакомился с работами Э.Резерфорда и вернулся на родину, ему попался на глаза школьный учебник физики, на обложке которого был изображен спектр атомарного водорода. Более того, школьному учителю физики Бальмеру удалось в аналитической форме выразить закономерность расположения линий в спектре атомарного водорода:
-константа Ридберга, а m –
принимает значения 3, 4, 5…
Почему спектр дискретный? К этому
времени ученые накопили очень
большое количество зарисованных и
заснятых на фотопластинку
линейчатых (атомарных) и полосатых
(молекулярных) спектров, но никто не
знал, как расшифровать эти спектры,
какую информацию о строении атомов
и молекул они несут.
Где еще ученые встречались с дискретностью? В 1900 г. немецкий ученый Макс Планк вывел формулу, для характеристики излучения абсолютно черного тела (АЧТ – тело, которое поглощает все падающие на него лучи, а все излучение, которое от него исходит, оно генерирует само). Поскольку излучение АЧТ не зависело от материала, из которого оно было сделано, то М.Планк предположил, что генерируют излучение электроны, входящие в состав любых материалов, при этом колеблющиеся с частотой n электроны могут находиться лишь в состояниях, набор которых определяет квантовое число n, принимающее целочисленные значения 1, 2, 3, 4 и т.д.:
,
Поэтому Нильс Бор предположил, что при движении электрона по орбите вокруг ядра его момент количества движения (произведение массы me на скорость v в физике называют импульсом или количеством движения, а при умножении этой величины на радиус окружности r получают момент количества движения) является величиной квантованной:
Решая совместно систему из уравнения всемирного тяготения и последнего уравнения, Н.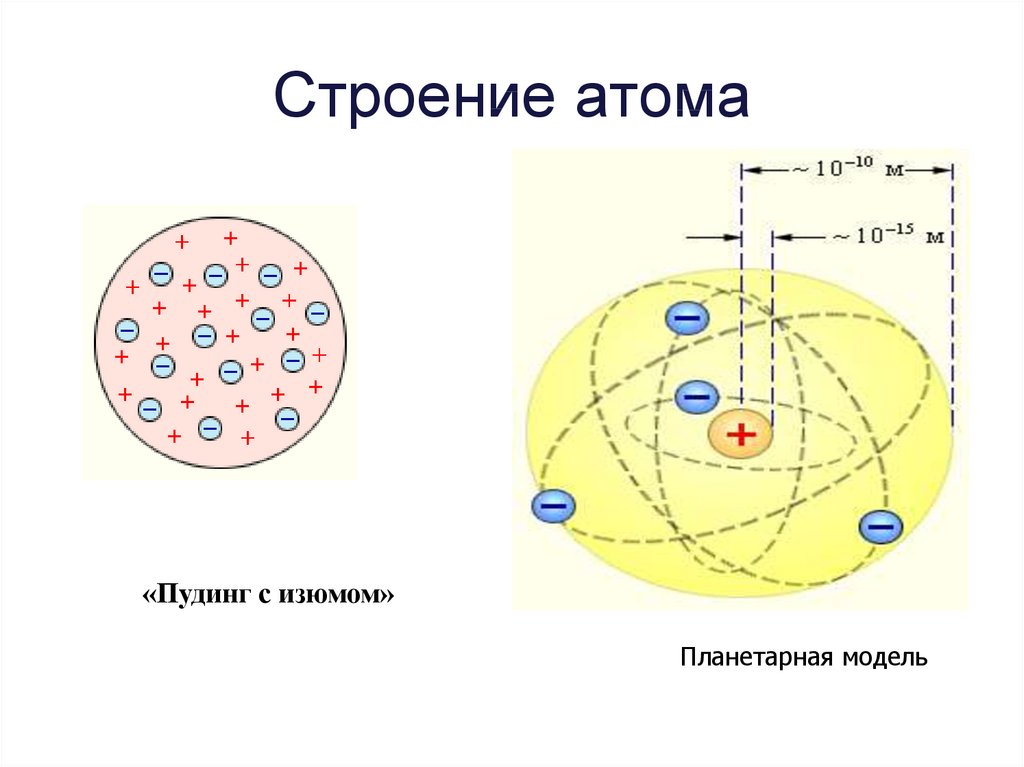 Бор не
только получил “дозволенные” орбиты
для электрона в атоме водорода, но и
вычислил радиусы этих орбит,
орбитальную скорость электрона,
потенциальную, кинетическую и
полную энергии электрона на этих
орбитах. Если электрон перескакивает
с одной дозволенной орбиты на
другую, то, например, избыток энергии
он излучает в виде фотона
(электромагнитной волны) с частотой n
или длиной волны l=1/n. В результате
Н.Бор не только вывел формулу
Бальмера, но и получил выражение для
константы Ридберга через
фундаментальные физические
константы.
Бор не
только получил “дозволенные” орбиты
для электрона в атоме водорода, но и
вычислил радиусы этих орбит,
орбитальную скорость электрона,
потенциальную, кинетическую и
полную энергии электрона на этих
орбитах. Если электрон перескакивает
с одной дозволенной орбиты на
другую, то, например, избыток энергии
он излучает в виде фотона
(электромагнитной волны) с частотой n
или длиной волны l=1/n. В результате
Н.Бор не только вывел формулу
Бальмера, но и получил выражение для
константы Ридберга через
фундаментальные физические
константы.
Конечно, главное противоречие
планетарной модели в теории Бора так
и не было преодолено, но на ее
сторону были привлечены очень
точные для того времени спектральные
данные для атомарного водорода.
Исследуя спектр солнечного света,
удалось найти не только линейчатый
спектр атомарного водорода, но и
обнаружить “смещенные” линии,
которые были отнесены к изотопу
водорода – дейтерию, масса ядра
которого почти в два раза больше, чем
у водорода, и к ионизированному
гелию He+, масса которого в четыре
раза больше, чем у водорода. Когда-то
в споре философов о познаваемости
окружающего нас мира как пример
того, что человек никогда не сможет
узнать, приводили качественный и
количественный состав Солнца. Сейчас
его ученые знают гораздо лучше, чем
качественный и количественный состав
Земли, особенно ее глубинных слоев –
ядра.
Когда-то
в споре философов о познаваемости
окружающего нас мира как пример
того, что человек никогда не сможет
узнать, приводили качественный и
количественный состав Солнца. Сейчас
его ученые знают гораздо лучше, чем
качественный и количественный состав
Земли, особенно ее глубинных слоев –
ядра.
Таким образом, переход от модели строения атома, предложенной Дж.Дж.Томсоном, к планетарной модели большой вклад внесли Э.Резерфорд и Н.Бор. Эту модель называют “Моделью Резерфорда-Бора”. Попытки Н.Бора расшифровать атомные спектры многоэлектронных атомов не увенчались успехом.
другие статьи:
- Агрегатные состояние вещества
- Строение атома – развитие моделей
- Квантовая механика и строение атома водорода
- Электронные конфигурации атомов и периодический закон
- Ядра атомов.
 Радиоактивность и изотопы
Радиоактивность и изотопы - Строение молекул. Типы химической связи
- Квантовая механика молекул и теория химической связи. Метод молекулярных орбиталей. Теория спин-валентности
- Окислительно-восстановительные реакции
- Химическая термодинамика
- Химическая кинетика и катализ
- Химическое равновесие. Обратимые и необратимые реакции
- Электрохимия. Свойства электролитов. Электролиз
Химия. 8 класс. Строение атомов
Разработка урока химии в 8 классе по теме «Строение атомов» по программе О.С. Габриеляна.
Содержание: Атомы как форма существования химических элементов. Основные сведения о строении атомов. Доказательства сложности строения атомов. Опыты Резерфорда. Планетарная модель строения атома. Состав атомных ядер: протоны, нейтроны. Относительная атомная масса. Взаимосвязь понятий «протон», «нейтрон», «относительная атомная масса».
Задачи урока: организовать деятельность учащихся по изучению и первичному закреплению состава и строения атомов химических элементов;
обеспечить понимание сложности вопроса строения атома;
создать условия для развития у школьников представлений об исторической эволюции понятий.
Оборудование: персональный компьютер, мультимедийный проектор, экран.
Лабораторная работа “Анализ содержимого “черного ящика”.
План урока:
1. Постановка цели и задач урока, составление плана работы.
2. Актуализация знаний учащихся:
а) что изучает химия?
б) что называют химической реакцией?
в) перечислите формы существования химического элемента.
г) дайте определение понятия «атом».
3. Изучение нового материала.
Выдающийся физик современности, лауреат Нобелевской премии Роберт Фейнман говорил: «Если бы в результате какой-то мировой катастрофы все накопленные знания вдруг оказались уничтоженными, и к грядущим поколениям живых существ перешла только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это атомная гипотеза: все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому».
Почему утверждение об атомном строении веществ так высоко оценено? Попробуем ответить на этот вопрос.
Вспомним, что понятие «атом» впервые появилось в работах древнегреческих философов Демокрита и Левкипта. Под атомом они понимали мельчайшую частицу вещества (atomos – неделемый). К атомной гипотезе они пришли только на основании размышлений, т.к. в то время люди не владели современными физическими методами исследования.
Если считать атом неделимой частицей, тогда невозможно объяснить образование химических связей в веществах. В ходе химических реакций атомы элементов не изменяются. Сущность химической реакции заключается в разрыве связей в исходных веществах и образовании связей в продуктах реакции. Как атомы соединяются в молекулы? Ответить на этот вопрос можно только в том случае, если изучим строение атомов.
Лабораторная работа “Анализ содержимого “черного ящика”.
Группам учащихся выдаются закрытые “черные ящики”, содержащие некоторую геометрическое тело.
Задание: определить какое тело находится в ящике, его размеры, цвет.
Данная работа показывает сложность познания строения атома.
Предположение о сложном строении атома было высказано на основании результатов нескольких экспериментов. В первую очередь это открытие электрона – частицы, которая переносит электрический ток. Масса электрона оказалась в 1840 раз меньше массы самого легкого атома – атома водорода. Исследования показали, что электрон несет на себе электрический заряд (–1,6∙10–19 Кл), который принят за единицу (–1), т.к. является наименьшим отрицательным зарядом. Условное обозначение электрона .
Следующим шагом в познании атома стало открытие явления радиоактивности. Анри Беккерель обнаружил, что соли урана излучают невидимые лучи, которые вызывают засвечивание фотопластинки. Позднее были установлены три вида радиоактивных лучей. a–лучи представляют собой частицы, масса которых в 4 раза больше массы атома водорода и несущие положительный заряд (+2). b–лучи представляют собой поток электронов, а g–лучи –коротковолновое электромагнитное излучение.
b–лучи представляют собой поток электронов, а g–лучи –коротковолновое электромагнитное излучение.
В 1911 году английский физик Эрнест Резерфорд проводил опыты с a–лучами. Он направил поток a–частиц на очень тонкую золотую фольгу, за которой поместил экран. Было установлено, что большая часть a–частиц проходила через фольгу, не изменяя своего направления движения, т.е. не встречая на своем пути препятствий. Но небольшая доля a–частиц отклонялась от прямолинейного пути на различные углы. Самым интересным оказалось то, что приблизительно одна из 10000 a–частиц отскакивала от металлической фольги обратно почти под углом 180°.
Какие выводы сделал Резерфорд? Он предположил, что в атомах большая часть «пустая», а отлетающие обратно a–частицы встречают на своем пути «сгусток» положительно зараженной массы. Этот сгусток был назван ядром атома.
Проанализировав результаты проведенных экспериментов, Резерфорд сделал ряд выводов, которые составили основу планетарной модели строения атома. В центре атома находится положительно заряженное ядро, которое имеет достаточно малые размеры, но в нем заключена почти вся масса, приходящаяся на атом. Вокруг ядра по круговым орбитам двигаются отрицательно заряженные электроны, подобно планетам вокруг Солнца.
В центре атома находится положительно заряженное ядро, которое имеет достаточно малые размеры, но в нем заключена почти вся масса, приходящаяся на атом. Вокруг ядра по круговым орбитам двигаются отрицательно заряженные электроны, подобно планетам вокруг Солнца.
Ядро – внутренняя часть атома, имеет положительный заряд и весьма малый объем, но невероятно высокую плотность вещества: 1014–1015 г/см3 (в 1 см3 ~ 100 млн т). Электроны образуют электронную оболочку, которая определяет размеры атома, имеет отрицательный заряд.
Позднее было установлено, что ядро атома состоит из частиц двух видов – протонов ( или р+) и нейтронов ( или n°). Массы этих частиц почти одинаковы, но протон несет на себе единичный положительный заряд, а нейтрон не имеет заряда.
Протоны, нейтроны и электроны определяют важнейшие свойства атома: массу, заряд ядра и заряд электронной оболочки.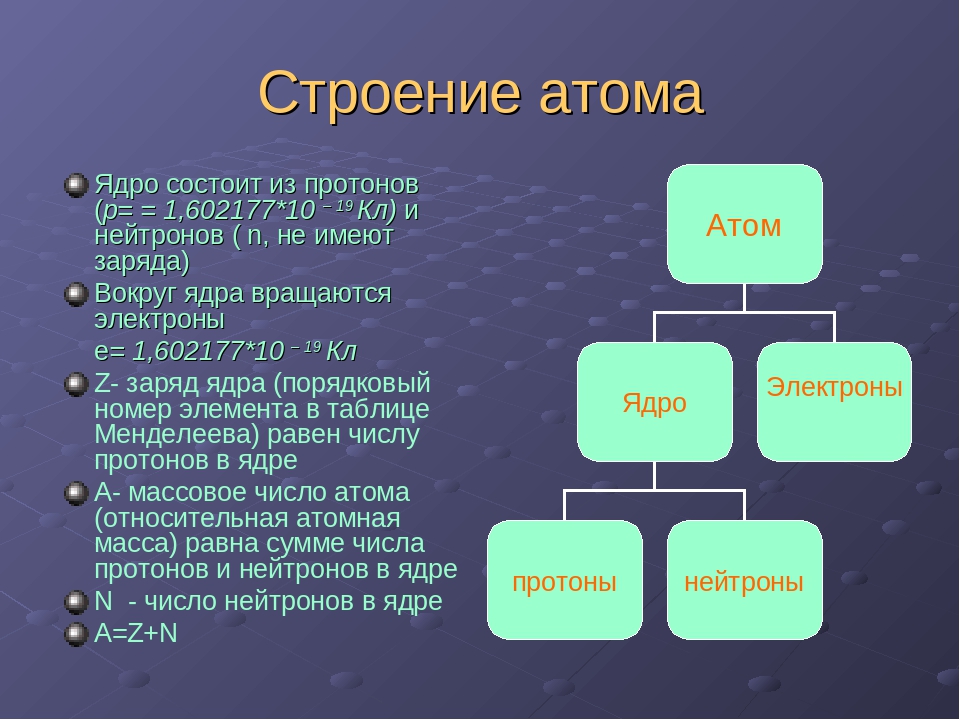 Масса атома имеет очень маленькое значение. Например, масса атома водорода равна 1,674∙10–24 г, атома кислорода – 2,667∙10–23 г. Принято использовать не абсолютные, а относительные атомные массы, показывающие сколько единиц массы содержит данный атом. В качестве атомной единицы массы (а.е.м.) была выбрана 1/12 массы атома углерода, в ядре которого содержится 6 протонов и 6 нейтронов.
Масса атома имеет очень маленькое значение. Например, масса атома водорода равна 1,674∙10–24 г, атома кислорода – 2,667∙10–23 г. Принято использовать не абсолютные, а относительные атомные массы, показывающие сколько единиц массы содержит данный атом. В качестве атомной единицы массы (а.е.м.) была выбрана 1/12 массы атома углерода, в ядре которого содержится 6 протонов и 6 нейтронов.
1 а.е.м. = 1,661∙10–24 г
Наряду с относительной атомной массой используют так называемое массовое число (А) – сумму протонов и нейтронов, входящих в состав ядра атома.
Заряд ядра (зарядовое число) обозначается Z. Величина заряда ядра равна числу протонов в атоме. Заряд электронной оболочки равен числу электронов.
Массовое и зарядовое числа используют при обозначении атома: . Например, обозначение говорит о том, что масса атома водорода равна 1, а ядро имеет заряд +1.
Как определить состав атома? Оказалось, что число протонов в ядре атома равно порядковому (атомному) номеру химического элемента в Периодической системе. Так как атом электронейтрален (не имеет заряда), то число протонов равно числу электронов. Число нейтронов равно разности между массой атома и порядковым номером химического элемента в Периодической системе. Например, определим состав и характеристики атома кислорода : 6р+, 6n0, 6е–; Z(ядра) = + 6, Z(эл.об.) = – 6.
Так как атом электронейтрален (не имеет заряда), то число протонов равно числу электронов. Число нейтронов равно разности между массой атома и порядковым номером химического элемента в Периодической системе. Например, определим состав и характеристики атома кислорода : 6р+, 6n0, 6е–; Z(ядра) = + 6, Z(эл.об.) = – 6.
Обобщим полученные сведения о частицах, входящих в состав атома:
Название частиц | |||
протоны | нейтроны | электроны | |
| обозначение | р+ | n0 | е– |
| масса | 1 | 1 | 0 |
| заряд | +1 | 0 | –1 |
число протонов равно порядковому номеру элемента. | число нейтронов находят по формуле: N=A–Z | число электронов равно порядковому номеру элемента | |
4. Закрепление изученного на уроке. Коррекция знаний учащихся.
5. Итоги урока.
.pdf (1 130 КБ)
Реферат по химии на тему “Строение атома”. Сборник рефератов по литературе
Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе, наталкивает на мысль о том, что в основе всех атомов лежит нечто общее, что все они находятся в близком родстве друг с другом. Однако до конца 19 в. в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. При всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части.
Но все эти предположения в то время еще не
могли быть подтверждены какими либо
экспериментальными данными. Лишь в конце 19в. были
сделаны открытия, показавшие сложность строения атома
и возможность превращения при известных условиях
одних атомов в другие. На основе этих открытий начало
быстро развиваться учение о строении атома. Первые
указания на сложную структуру атомов были получены
при изучении катодных лучей, возникающих при
электрическом разряде в сильно разреженных газах. Для
наблюдения этих лучей из стеклянной трубки, в которую
впаяны два металлических электрода, выкачивается по
возможности весь воздух и затем пропускается сквозь
нее ток высокого напряжения. При таких условиях от
катода трубки перпендикулярно к его поверхности
распространяются “невидимые” катодные лучи, вызывающие
яркое зеленое свечение в том месте, куда они
попадают.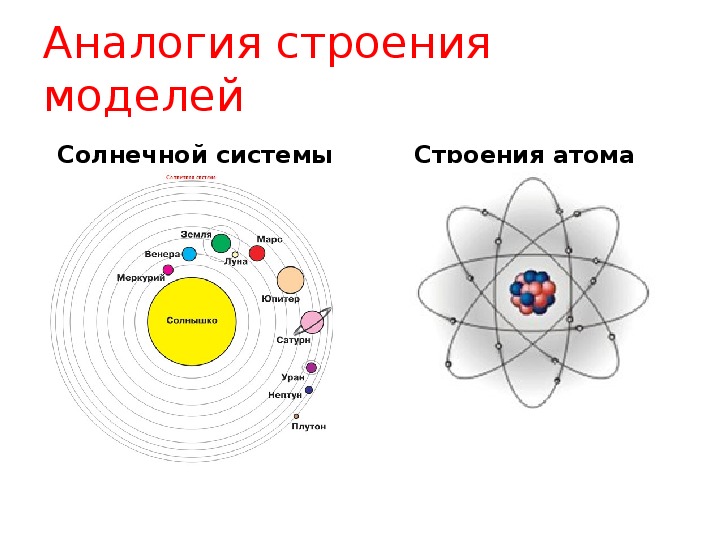
Катодные лучи обладают способностью
приводить в движение на их пути легко подвижные тела и
откланяются от своего первоначального пути в
магнитном и электрическом поле (в последнем в сторону
положительно заряженной пластины). Действие катодных
лучей обнаруживается только внутри трубки, так как
стекло для них непроницаемо. Изучение свойств
катодных лучей привело к заключению, что они
представляют собой поток мельчайших частиц, несущих
отрицательный электрический заряд и летящих со
скоростью, достигающей половины скорости света.
Особыми приемами удалось определить массу катодный
частицы и величину их заряда. Оказалось, что масса
каждой частицы равняется 0,00055 углеродной единицы,
что составляет всего 1.1840 часть массы водорода,
самого легкого из всех атомов. Заряд катодной частицы
равняется 1,602 10 кулона, или 4,803 10
электростатических единиц. Особенно замечательно, что
Особенно замечательно, что
масса частиц и величина их заряда не зависит ни от
природы газа, остающегося в трубке, ни от вещества из
которого сделаны электроды, ни от прочих условий
опыта. Кроме того, катодные частицы известны только в
заряженном состоянии и не могут быть лишены своих
зарядов, не могут быть превращены в
электронейтральные частицы: электрический заряд
составляет, самую сущность их природы.
Эти частицы
получили название электронов. По современным
воззрениям, заряд электрона есть наименьший
электрический заряд, наименьшее кол-во электричества,
какое только может существовать. В катодных трубках
электроны отделяются от катода под влиянием
электрического заряда. однако они могут возникать и
вне всякой связи с электрическим зарядом. Так,
например, все металлы испускают электроны при
накаливании; в пламени горелки также присутствуют
электроны; многие вещества выбрасывают электроны при
освещении ультрафиолетовыми, рентгеновскими или
лучами света (фотоэффект). Выделение электронов
Выделение электронов
самыми разнообразными веществами указывает на то, что
эти частицы входят в состав всех атомов;
следовательно атомы являются сложными образованиями,
построенными из более мелких структурных единиц.
Изучение строение атома практически началось в
1897-1898 гг., после того как была окончательно
установлена природа катодных лучей как потока
электронов и были определены величина заряда и масса
электрона.
Факт выделения электронов самыми
разнообразными веществами приводил к выводу, что
электроны входят в состав всех атомов. Но атом в
целом электрически нейтрален; следовательно, он
должен содержать в себе еще другую составную часть,
заряженную положительно, причем ее заряд должен
уравновешивать сумму отрицательных зарядов
электронов, Эта положительно заряженная часть атома
была открыта в 1911 г. Резерфордом при исследовании
Резерфордом при исследовании
движения -частиц в газах и других веществах. -частицы
выбрасываемые атомами радиоактивных элементов,
представляют собой положительно заряженные ионы
гелия, скорость движения которых достигает 20000
км/сек. Благодаря такой огромной скорости -частицы,
пролетая через воздух и сталкиваясь с молекулами
газов, выбивают из них электроны. Молекулы,
потерявшие электроны, становятся заряженные
положительно, выбитые же электроны тотчас
присоединяются к другим молекулам , заряжая их
отрицательно. Таким образом, в воздухе на пути
-частиц образуются положительно и отрицательно
заряженные ионы газа.
Способность -частиц
ионизировать воздух была использована английским
физиком Вильсоном для того, чтобы сделать видимыми
пути движения отдельных частиц и сфотографировать их.В
последствии аппарат для фотографирования -частиц был
назван камерой Вильсона. Рассматривая пути движения
-частиц в камере Вильсона, мы видим, что они
прямолинейны.В то же время, как показывает теория,
каждая частица на протяжении своего пути. а он
достигает в воздухе 11см, должна встретить сотни
тысяч атомов. Если тем не менее путь ее остается
прямолинейным, то это можно объяснить только тем, что
-частица пролетает сквозь атомы. Более тщательное
исследование этого явления показало, что при
прохождении пучка параллельных лучей сквозь слой газа
или тонкую металлическую пластинку выходят уже не
параллельны, а несколько расходятся: происходит
рассеяние -частиц, т.е. отклонение от их
первоначального пути.
Углы отклонения невелики, но
всегда имеется небольшое число частиц (1/8000),
которые отклоняются очень сильно, некоторые частицы
отбрасываются назад, как если бы на пути встретилось
что-то твердое непроницаемое. (добавить о том, что
это не электроны их масса в 7500 раз меньше массы
-частиц, отклонение из-за положительных частиц того
же порядка, что и -частицы) Исходя из этих
соображений, Резерфорд предложил следующую схему
строения атома. В центре атома находится положительно
заряженное ядро, вокруг которого по разным орбитам
вращаются электроны. Возникающая при их вращении
центробежная сила уравновешивается притяжением между
ядром и электронами, вседствии этого остаются на
определенных расстояниях от ядра.
Так как масса
электрона ничтожна мала, то почти вся масса
сосредоточена в его ядре. Размеры атома и его
отдельных частей выражается следующими числами:
диаметр атома – 10 см., диаметр электрона – 10 см и
диаметр ядра от 10 до 10 см. Отсюда ясно, что на долю
ядра и электронов, число которых, как увидим дальше,
сравнительно невелико, приходиться лишь, ничтожная
часть всего пространства, занятого атомной системой.
Предложенная Резерфордом схема строения атома или,
как обыкновенной говорят, модель атома, легко
объясняет явления отклонение -частиц. Действительно,
размеры ядра и электронов очень малы по сравнению с
размерами всего атома, которые определяются орбитами
наиболее удаленных от ядра электронов; поэтому
большинство -частиц пролетает через атомы без
заметного отклонения.
Только в тех случаях, когда
-частицы очень близко подходит к ядру, электрическое
отталкивание вызывает резкое отклонение ее от
первоначального пути. Таким образом, изучение
рассеяние -частиц положило начало ядерной теории
атома. Одной из задач, стоявших перед теорией
строения атома в начале ее развития, было определение
величины заряда ядра различных атомов. Так как атом в
целом электрически нейтрален, то, определив заряд
ядра, можно было бы установить и число окружающих ядро
электронов. В решении этой задачи этой большую помощь
оказало изучение спектров рентгеновских лучей.
Рентгеновские лучи возникают при ударе быстро летящих
электронов о какое-либо твердое тело и отличаются от
лучей видимого света только значительно меньшей длиной
волны. В то время как короткие световые волны имеют
длину около 4000 ангстремов (фиолетовые лучи), длины
волн рентгеновских лучей лежат в пределах от 20 до
0,1 ангстрема. Чтобы получить спектр рентгеновских
лучей, нельзя пользоваться обыкновенной призмой или
дифракционной решеткой. Теоретически для лучей с
такой короткой длиной волны, как рентгеновские лучи,
нужно было приготовить дифракционную решетку с
1000000 делений на 1 мм.
Так как искусственно
приготовить такую решетку невозможно, то долгое время
спектр рентгеновских лучей не удавалось получить. В
1912 г. швейцарского физика Лауэ возникла мысль
использовать кристаллы в качестве дифракционной
решетки для рентгеновских лучей. Закономерное
расположение атомов в кристаллах и весьма малые
расстояния между ними давали основание предполагать,
что кристалл как раз и может сыграть роль требуемой
дифракционной решетки. Опыт блестяще подтвердил
предположение Лауэ, вскоре удалось построить приборы,
которые давали возможность получать спектры
рентгеновских лучей почти всех элементов. Для
получения рентгеновских спектров антикатод в
рентгеновских трубках делают из того металла, спектр
которого хотят получить, или же наносят соединение
исследуемого элемента. Экраном для спектра служит
фотографическая пластинка или бумага; после
проявления на ней видны все линии спектра. В 1913 г.
английский ученый Мозли, изучая рентгеновские спектры
нашел соотношение между длинами волн рентгеновских
лучей и порядкового номерами соответствующих
элементов – это носит название закона Мозли и может
быть сформулированно следующим образом: Корни
квадратные из обратных значений длин волн находятся в
линейной зависимости от порядковых номеров элементов.
Еще до работ Мозли некоторые теоретические
соображения позволяли предположить, что порядковый
номер элемента указывает число положительных зарядов
ядра его атома. В тоже время Резерфорд, изучая
рассеивание -частиц при прохождении через тонкие
металлические пластинки, нашел, что если заряд
электрона принять за единицу, то выражаемый в
таких единицах заряд ядра приблизительно равен
половине атомного веса элемента. Порядковый номер, по
крайне мере более легких элементов, тоже равняется
примерно половине атомного веса. Все вместе взятое
привело к выводу, что Заряд ядра численно равен
порядковому номеру элемента. Таким образом, закон
Мозли позволил определить заряды атомных ядер. Тем
самым, ввиду нейтральности атомов, было установлено и
число электронов, вращающихся вокруг ядра в атоме
каждого элемента. Ядерная модель атома
Резерфорда получила свое дальнейшее развитие
благодаря работам Нильс Бора, в которых учение о
строении атома неразрывно связывается с учением о
происхождении спектров. Линейчатые спектры получаются
при разложении света испускаемого раскаленными парами
или газами. Каждому элементу отвечает свой спектр,
отличающийся от спектров других элементов.
Большинство металлов дает очень сложные спектры,
содержащие огромное число линий (в железе до 5000),
но встречаются и сравнительно простые спектры.
Развивая ядерную теорию Резерфорда, ученые пришли к
мысли, что сложная структура линейчатых спектров
обусловлена происходящими внутри атомов колебаниями
электронов.
По теории Резерфорда, каждый электрон
вращается вокруг ядра, причем сила притяжения ядра
уравновешивается центробежной силой, возникающей при
вращении электрона. Вращение электрона совершенно
аналогично его быстрым колебаниям и должно вызвать
испускание электромагнитных волн. Поэтому можно
предположить, что вращающийся электрон излучает свет
определенной длины волны, зависящий от частоты
обращения электрона по орбите. Но, излучая свет,
электрон теряет часть своей энергии, в следствие чего
нарушается равновесие между ним и ядром; для
восстановления равновесия электрон должен постепенно
Страницы: 1 2
Больше сочинений по этой теме
Больше рефератов этого автора
Презентация “Строение атома” 8 класс, химия
библиотека
материалов
Содержание слайдов
Номер слайда 1
Основные сведения о строении атома. Автор: Пермякова Марфа Александровна. Преподаватель химии и биологии. ГБПОУ РС(Я) «Жатайский техникум»
Номер слайда 2
ядроатомэлектронынейтроныпротоны
Номер слайда 3
Номер слайда 4
Электронная оболочка атома – совокупность всех электронов в атоме Электроны, обладающие близкими значениями энергии, образуют единый электронный слой(энергетический уровень)= номеру периода Электронное облако (атомная орбиталь, энергетический подуровень) – пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона валентные электроны – количество электронов, находящиеся на внешней (валентной) оболочке атома= номеру группы
Номер слайда 5
Число p+ равно порядковому номеру химического элемента, электрону, заряду ядра Число ē порядковому номеру химического элемента, протону, заряд ядра Число n° N = A – Z (массовое число минус порядковый номер химического элемента) p+=6№=6e=6 Z= 6e=14№=14p=14 Z= 14 N= 9-4=5
Номер слайда 6
Графически любая орбиталь изображается в виде клетки (квантовой ячейки):
Номер слайда 7
Номер слайда 8
Определите заряд ядра, атомную массу, количество электронов, протонов и нейтронов
Номер слайда 9
Номер слайда 10
3s12p62s21s2+11218sspspd1s22s23s12p6
Номер слайда 11
Неспаренные электроны. Валентные электроны
Строение атома | himiyaklas.ru
Содержание статьи:
- Почему у атомов разных веществ разные свойства?
- Из чего “сделан” атом?
- Чем отличаются друг от друга атомы разных химических элементов?
- Масса атома.
- Строение электронной оболочки (электронные орбитали, основное и возбужденное состояние, электронные конфигурации атома и электрона).
Тем, какой состав имеет молекула. То есть какими атомами образована молекула, в каком количестве, какими связями соединены эти атомы. Все это определяет свойство молекулы, и соответственно свойство вещества, которое эти молекулы образуют.
Например, свойства воды: прозрачность, текучесть, способность вызывать ржавчину обусловлено именно наличием двух атомов водорода и одного атома кислорода.
Поэтому прежде, чем приступить к изучению свойств молекул (то есть свойств веществ), нужно рассмотреть «кирпичики», которыми эти молекулы образованы. Разобраться в строении атома.
Как устроен атом?Атомы – это частицы, которые, соединяясь друг с другом, образуют молекулы.
Сам атом состоит из положительно заряженного ядра (+) и отрицательно заряженной электронной оболочки (-). В целом атом электронейтрален. То есть заряд ядра равен по модулю заряду электронной оболочки.
Ядро образовано следующими частицами:
- Протоны. Один протон несет заряд +1. Масса его равна 1 а.е.м (атомная единица массы). Эти частицы обязательно присутствуют в ядре.
- Нейтроны. Нейтрон не имеет заряда (заряд = 0). Масса его равна 1 а.е.м. Нейтронов может не быть в ядре. Это не обязательный компонент атомного ядра.
Таким образом за общий заряд ядра отвечают протоны. Поскольку один нейтрон имеет заряд +1, то заряд ядра равен числу протонов.
Электронная оболочка, как видно из названия образована частицами, которые называются электронами. Если сравнивать ядро атома с планетой, то электроны – это ее спутники. Вращаясь вокруг ядра (пока представим, что по орбитам, а на самом деле по орбиталям), они образуют электронную оболочку.
- Электрон – это очень маленькая частица. Ее масса на столько мала, что принимается за 0. А вот заряд у электрона -1. То есть по модулю равен заряду протона, отличается знаком. Поскольку один электрон несет заряд -1, то общий заряд электронной оболочки равен числу электронов в ней.
Чем отличаются атомы разных химических элементов друг от друга?Одно важное следствие, раз атом – частица, не имеющая заряда (заряд ядра и заряд электронной оболочки равны по модулю, но противоположены по знаку), то есть электронейтральная, следовательно, число электронов в атоме равно числу протонов.
Атомы разных химических элементов отличаются друг от друга зарядом ядра (то есть числом протонов, и, следовательно, числом электронов).
Как узнать заряд ядра атома элемента? Гениальный отечественный химик Д. И. Менделеев, открыв периодический закон, и разработав таблицу, названную его именем, дал нам возможность сделать это. Его открытие забегало далеко вперед. Когда еще не было известно о строении атома, Менделеев расположил элементы в таблице в порядке возрастания заряда ядра.
То есть порядковый номер элемента в периодической системе – это заряд ядра атома данного элемента. Например, у кислорода порядковый номер 8, соответственно заряд ядра атома кислорода равен +8. Соответственно число протонов равно 8, и число электронов равно 8.
Именно электроны в электронной оболочке определяют химические свойства атома, но об этом чуть позже.
Теперь поговорим о массе.Один протон – это одна единица массы, один нейтрон – это тоже одна единица массы. Поэтому сумма нейтронов и протонов в ядре называется массовым числом. (Электроны на массу никак не влияют, так как мы пренебрегаем его массой и считаем ее равной нулю).
Атомная единица массы (а. е. м.) – специальная физическая величина для обозначения малых масс частиц, образующих атомы.
Все эти три атома – атомы одного химического элемента – водорода. Поскольку у них одинаковый заряд ядра.
Чем они будут отличаться? У этих атомов разные массовые числа (из-за разного числа нейтронов). У первого атома массовое число равно 1, у второго 2, у третьего 3.
Атомы одного элемента, различающиеся количеством нейтронов (и, следовательно, массовыми числами) называются изотопами.
У представленных изотопов водорода даже есть свои названия:
- Первый изотоп (с массовым числом 1) называется протий.
- Второй изотоп (с массовым числом 2) называется дейтерий.
- Третий изотоп (с массовым числом 3) называется тритий.
Ответ: у элемента есть несколько изотопов, они отличаются друг от друга массовыми числами. Поэтому атомная масса в периодической таблице – это среднее значение атомных масс всех изотопов элемента с учетом их встречаемости в природе. Эта масса, указанная в периодической системе, называется относительной атомной массой.
Для химических расчетов используются показатели именно такого «усредненного атома». Атомная масса округляется до целого.
Строение электронной оболочки.Химические свойства атома определяются строением его электронной оболочки. Электроны вокруг ядра располагаются не абы как. Электроны локализуются на электронных орбиталях.
Электронная орбиталь – пространство вокруг атомного ядра, где вероятность нахождения электрона наибольшая.
У электрона есть один квантовый параметр, который называется спин. Если брать классическое определение из квантовой механики, то спин – это собственный момент импульса частицы. В упрощенном виде это можно представить, как направление вращения частицы вокруг своей оси.
Электрон – это частица с полуцелым спином, у электрона спин может быть либо +½ либо -½. Условно это можно представить, как вращение по часовой и против часовой.
На одной электронной орбитали могут находиться не более двух электронов с противоположенными спинами.
Общепринятым обозначением электронной обитали является клетка либо черточка. Электрон обозначается стрелкой: стрелка вверх ↑ – электрон с положительным спином +½, стрелка вниз ↓ – электрон с отрицательным спином -½.
Электрон, одинокий на орбитали называется неспаренным. Два электрона, располагающиеся на одной орбитали, называются спаренными.
Электронные орбитали подразделяются в зависимости от формы на четыре вида: s, p, d, f. Орбитали одинаковой формы формируют подуровень. Число орбиталей на подуровне определяется числом возможных вариантов расположения в пространстве.
- s-орбиталь.
s-орбиталь имеет форму шара:
В пространстве s-орбиталь может располагаться только одним способом:
Поэтому s-подуровнь формируется только одной s-орбиталью.
- р-орбиталь.
p-орбиталь имеет форму гантели:
В пространстве p-орбиталь может располагаться только тремя способами:
Поэтому p-подуровнь формируется тремя p-орбиталями.
- d-орбиталь.
d-орбиталь имеет сложную форму:
В пространстве d-орбиталь может располагаться пятью разными способами. Поэтому d-подуровнь формируется пятью d-орбиталями.
- f-орбиталь
f-орбиталь имеет еще более сложную форму. В пространстве f-орбиталь может располагаться семью разными способами. Поэтому f-подуровнь формируется семью f-орбиталями.
Электронная оболочка атома похожа на слоеное кондитерское изделие. В нем тоже есть слои. Электроны, находящиеся на разных слоях, имеют разную энергию: на слоях ближе ядру – меньше, на удаленных от ядра – бо̀льшую. Слои эти называются энергетическими уровнями.
Заполнение электронных орбиталей.Первый энергетический уровень имеет только s-подуровень:
На втором энергетическом уровне есть s-подуровень и появляется p-подуровень:
На третьем энергетическом уровне есть s-подуровень, p-подуровень и появляется d-подуровень:
На четвертом энергетическом уровне, в принципе, прибавляется f-подуровень. Но в школьном курсе f-орбитали не заполняются, поэтому мы можем не изображать f-подуровень:
Число энергетических уровней в атоме элемента равно номеру периода. При заполнении электронных орбиталей нужно следовать следующим принципам:
- Каждый электрон старается занять в атоме то положение, где его энергия будет минимальной. То есть сначала идет заполнение первого энергетического уровня, потом второго и так далее.
Для описания строения электронной оболочки так же используется электронная формула. Электронная формула – это краткая запись в одну строку распределения электронов по подуровням.
- На подуровне сначала каждый электрон заполняет свободную орбиталь. И каждый имеет спин +½ (стрелка вверх).
И только после того как на каждой орбитали подуровня будет по одному электрону, следующий электрон становится спаренным – то есть занимает орбиталь, на которой уже есть электрон:
- d-подуровень заполняется по-особому.
Дело в том, что энергия d-подуровня выше, чем энергия s-подуровня СЛЕДУЮЩЕГО энергетического слоя. А как мы знаем, электрон старается занять то положение в атоме, где его энергия будет минимальной.
Поэтому после заполнения 3p-подуровня, заполняется сначала 4s-подуровень, после чего заполняется 3d-подуровень.
И только после того как 3d-подуровень заполнен полностью, заполняется 4p-подуровень.
Так же и с 4 энергетическим уровнем. После заполнения 4p-подуровня, следующим заполняется 5s-подуровень, после него 4d-подуровень. И после него только 5p.
- И есть еще один момент, одно правило касаемо заполнения d-подуровня.
То происходит явление, называемое провалом. При провале один электрон с s-подуровня следующего энергетического уровня, в прямом смысле проваливается на d-электрон.
Основное и возбужденное состояния атома.Атомы, электронные конфигурации которых мы сейчас строили, называются атомами в основнóм состоянии. То есть, это обычное, естественное, если угодно, состояние.
Когда атом получает энергию извне, может произойти возбуждение.
Возбуждение – это переход спаренного электрона на пустую орбиталь, в пределах внешнего энергетического уровня.
Например, у атома углерода:
Возбуждение характерно для многих атомов. Это необходимо помнить, потому как возбуждение определяет способность атомов связываться друг с другом. Главное помнить условие, при котором может произойти возбуждение: спаренный электрон и пустая орбиталь на внешнем энергетическом уровне.
Есть атомы, у которых несколько возбужденных состояний:
Электронная конфигурация иона.Ионы – это частицы, в которые превращаются атомы и молекулы, приобретая или теряя электроны. Эти частицы имеют заряд, так как у них либо «не хватает» электронов, либо их избыток. Положительно заряженные ионы называются катионами, отрицательные – анионами.
Атом хлора (не имеет заряда) приобретает электрон. У электрона заряд 1- (один минус), соответственно образуется частица, имеющая избыточный отрицательный заряд. Анион хлора:
Cl0 + 1e → Cl–
Атом лития (тоже не имеющий заряда) теряет электрон. У электрона заряд 1+ (один плюс), образуется частица, с недостатком отрицательного заряда, то есть заряд у нее положительный. Катион лития:
Li0 – 1e → Li+
Превращаясь в ионы, атомы приобретают такую конфигурация, что внешний энергетический уровень становится «красивым», то есть полностью заполненным. Такая конфигурация наиболее термодинамически стабильная, поэтому атомам есть резон превращаться в ионы.
И поэтому атомы элементов VIII-A группы (восьмой группы главной подгруппы), как сказано в следующем параграфе это благородные газы, такие химически малоактивны. У них в основном состоянии такое строение: внешний энергетический уровень полностью заполнен. Другие атомы, как бы стремятся приобрести конфигурацию этих самых благородных газов, поэтому и превращаются в ионы и образуют химические связи.
Строение атома реферат по химии
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ИНСТИТУТ МЕЖДУНАРОДНЫХ ОТНОШЕНИЙ (УНИВЕРСИТЕТ) МИД РФ РЕФЕРАТ на тему “СТРОЕНИЕ АТОМА И АТОМНОГО ЯДРА” студента 12-ой ак. группы 2-ого курса фак-та МИ Козловского А.А. Научный руководитель: проф. Иванов-Шиц А.К. Москва – 1997 СОДЕРЖАНИЕ: 1. Зарождение теории строения вещества 2 2. Атомистическая теория Дальтона 4 3. Катодные лучи и электроны 6 4. Ядерная модель строения атомов 9 5. Состав атомных ядер 11 6. Изотопы 14 7. Электронные оболочки атомов. Теория Бора 17 8. Квантовая (волновая) механика. Характеристика поведения электронов в атомах 22 Список использованной литературы 25 сведения о том, как химические вещества реагируют друг с другом, и разрабатывались более количественные методы изучения химических реакций. Это подготовило почву для новых, более содержательных формулировок в рамках атомистической теории. 2. Атомистическая теория Дальтона Джон Дальтон (1766 – 1844) большую часть своей жизни преподавал в школе и колледже в Манчестере. Возможно потому, что сам Дальтон не был химиком, он подошел к ее проблемам с иных позиций, чем химики его времени. Его атомистическая теория, опубликованная в период 1803-1807 гг., прочно основывалась на экспериментальных наблюдениях. Она оказалась столь успешной, что с этого времени заняла господствующее положение в науке и почти не потребовала дальнейшего пересмотра. Основные постулаты теории Дальтона заключались в следующем: Каждый элемент состоит из чрезвычайно мелких частиц, называемых атомами. 2. Все атомы одного элемента одинаковы. 3. Атомы различных элементов обладают разными свойствами, в том числе имеют разные массы. 4. Атомы одного элемента не превращаются в атомы других элементов в результате химических реакций; атомы не создаются и не разрушаются в химических реакциях. 5. Соединения образуются в результате комбинации атомов двух или нескольких элементов. 6. В данном соединении относительные количества атомов разных сортов и сорта этих атомов всегда постоянны. Теория Дальтона позволяет мысленно нарисовать картину строения материи. Мы представляем себе элемент состоящим из мельчайших частиц, называемых атомами. Атомы являются основными структурными единицами материи, это мельчайшие частицы элемента, которые могут соединяться с другими элементами. Соединения состоят из атомов двух или нескольких элементов, образующих определенные сочетания друг с другом. 3. Катодные лучи и электроны До конца XIX века в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. Дальтон и его современники рассматривали атом как неделимый объект. Считалось, что при всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части. Но все эти предположения в то время еще не могли быть подтверждены какими-либо экспериментальными данными. Лишь в конце XIX века были сделаны открытия, показавшие сложность строения атома и возможность превращения при известных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома. Первые указания на сложную структуру атомов были получены при изучении катодных (исходящих от отрицательно заряженного электрода, или катода) лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения (порядка 1000 вольт). При таких условиях от катода трубки перпендикулярно к его поверхности распространяются “невидимые” катодные лучи, вызывающие яркое зеленое свечение в том месте, электронов и были определены величина заряда и масса электрона. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электроны входят в состав всех атомов. Но атом в целом электрически нейтрален, следовательно, он должен содержать в себе еще другую составную часть, заряженную положительно, причем ее заряд должен уравновешивать сумму отрицательных зарядов электронов. Эта положительно заряженная часть атома была открыта в 1911 г. Эрнестом Резерфордом (1871-1937). Резерфорд предложил следующую схему строения атома. В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Суммарный отрицательный заряд электронов численно равен положительному заряду ядра, так что атом в целом электронейтрален. Так как масса электронов ничтожно мала, то почти вся масса атома сосредоточена в его ядре. Наоборот, размер ядер чрезвычайно мал даже по сравнению с размером самих атомов: диаметр атома – величина порядка 10 см, а диаметр ядра – порядка 10 – 10 см. Отсюда ясно, что на долю ядра и электронов, число которых, как увидим дальше, сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой. 5. Состав атомных ядер Таким образом, открытия Резерфорда положили начало ядерной теории атома. Со времен Резерфорда физики узнали еще очень многие подробности о строении атомного ядра. Самым легким атомом является атом водорода (Н). Поскольку почти вся масса атома сосредоточена в ядре, естественно было бы предположить, что ядро атома водорода представляет собой элементарную частицу положительного электричества, которая была названа протоном от греческого слова “протос”, что означает “первый”. Таким образом, протон обладает массой, практически равной массе атома водорода (точно 1,00728 углеродных единиц) и электрическим зарядом, равным +1 (если за единицу отрицательного электричества принять заряд электрона, равный -1,602*10 Кл). Атомы других, более тяжелых элементов содержат ядра, обладающие большим зарядом и, очевидно, большей массой. Измерения заряда ядер атомов показали, что заряд ядра атома в указанных условных единицах численно равен атомному, или порядковому, номеру элемента. Однако невозможно было допустить, так как последние, будучи одноименно заряженными, неизбежно отталкивались бы друг от друга и, следовательно, такие ядра оказались бы неустойчивыми. К тому же масса атомных ядер оказалась больше суммарной массы протонов, обуславливающих заряд ядер атомов соответствующих элементов, в два раза и более. Тогда было сделано предположение, что ядра атомов содержат протоны в числе, превышающем атомный номер элемента, а создающийся таким образом четверти существующих в природе атомов хлора имеют массу 35, а одна четверть – 37. Таким образом, существующие в природе элементы состоят из смеси атомов, имеющих разные массы, но, очевидно, одинаковые химические свойства, т. е. существуют разновидности атомов одного элемента с разными и притом целочисленными массами. Ф. Астону удалось разделить такие смеси на составные части, которые были названы изотопами (от греческих слов “изос” и “топос”, что означает “одинаковый” и “место” (здесь имеется в виду, что разные изотопы одного элемента занимают одно место в периодической системе)). С точки зрения протонно-нейтронной теории, изотопами называются разновидности элементов, ядра атомов которых содержат различное число нейтронов, но одинаковое число протонов. Химическая природа элемента обусловлена числом протонов в атомном ядре, которому равно и число электронов в оболочке атома. Изменение же числа нейтронов (при неизменном числе протонов) не сказывается на химических свойствах атома. Все это дает возможность сформулировать понятие химического элемента как вида атомов, характеризующихся определенным зарядом ядра. Среди изотопов различных элементов были найдены такие, которые содержат в ядре при разном числе протонов одинаковое общее число нуклонов, то есть атомы которых обладают одинаковой массой. Такие изотопы были названы изобарами (от греческого слова “барос”, что означает “вес”). Различная химическая природа изобаров убедительно подтверждает то, что природа элемента обуславливается не массой его атома. Для различных изотопов применяются названия и символы самих элементов с указанием массового числа, которое следует за названием элемента или обозначается в виде индекса вверху слева от символа, например : хлор – 35 или Cl. Различные изотопы отличаются друг от друга устойчивостью. 26 элементов имеют лишь по одному устойчивому изотопу – такие элементы называются моноизотопными (они характеризуются преимущественно нечетными атомными номерами), и атомные массы их приблизительно равны целым числам. У 55 элементов имеется по несколько устойчивых изотопов – они называются полиизотопными (большое число изотопов характерно преимущественно для элементов с четными номерами). У остальных элементов известны только неустойчивые, радиоактивные изотопы. Это все тяжелые элементы, начиная с элемента №84 (полоний), а из относительно легких – №43 (технеций) и №61 (прометий). Однако радиоактивные изотопы некоторых элементов относительно устойчивы (характеризуются большим периодом полураспада), и поэтому эти элементы, например торий, уран, встречаются в природе. В большинстве же радиоактивные изотопы получают искусственно, в том числе и многочисленные радиоактивные изотопы устойчивых элементов. 7. Электронные оболочки атомов. Теория Бора. По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона. Вращение электрона совершенно аналогично его быстрым колебаниям и должно вызвать испускание электромагнитных волн. Поэтому можно предположить, что вращающийся электрон излучает свет определенной длины волны, зависящий от частоты обращения электрона по орбите. Но, излучая свет, электрон теряет часть своей энергии, вследствие чего нарушается равновесие между ним и ядром. Для восстановления равновесия электрон должен постепенно передвигаться ближе к ядру, причем так же постепенно будет изменяться частота обращения электрона и характер испускаемого им света. В конце концов, исчерпав всю энергию, электрон должен квантов. Эти орбиты получили название устойчивых, стационарных или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает электромагнитной энергии. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Обозначив запас энергии атома при положении электрона на более удаленной от ядра орбите через Е F 0E D, а на более близкой через Е F 0E A и разделив потерянную атомом энергию Е F 0E D – Е F 0E A на постоянную Планка, получим искомую частоту: = (Е F 0E D – Е F 0E A ) / h Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения. Простейшим из атомов является атом водорода, вокруг ядра которого вращается только один электрон. Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1 : 2 : 3 : …: n . Величина n получила название главного квантового числа. В дальнейшем теория Бора была распространена и на атомную структуру других элементов, хотя это было связано с некоторыми трудностями из-за ее новизны. Она позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов. В настоящее время разработаны схемы строения атомов всех химических элементов. Однако надо иметь в виду, что все эти схемы – это лишь более или менее достоверная гипотеза, позволяющая объяснить многие физические и химические свойства элементов. Как было уже сказано раньше, число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе. Электроны расположены по слоям, т.е. каждому слою принадлежит определенное заполняющее или как бы насыщающее его число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т.е. находятся примерно на одинаковом энергетическом уровне. Вся оболочка атома распадается на несколько энергетических уровней. Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Наибольшее число электронов N, имеющих возможность находиться на данном энергетическом уровне, равно удвоенному квадрату номера слоя: N=2n где n – номер слоя. Таким образом на 1-2, на 2-8, на 3-18 и т.д. Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем – восемнадцати. Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся положительно заряженными, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот, атомы, присоединившие электроны становятся отрицательно заряженными. Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов, называются ионами. Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при орбиталей. Энергетические подуровни обозначаются следующим образом: 0 1 2 3 s p d f 3) Магнитное квантовое число m определяет положение плоскости орбиты электрона в пространстве или, в соответствии с представлениями волновой механики, то направление, в котором вытянуто электронное облако. Может принимать целые значения от -l до l (включая 0), всего (2*l+1) значений. Число значений m определяет число орбиталей данного (s-, p-, d-, f- типа). 4) Спиновое квантовое число s определяет направление вращения электрона, может принимать только два значения: 1/2 и -1/2. Изучению распределения электронов в атомах уделяется большое внимание, так как поведение атомов в химических реакциях в значительной мере зависит от того, насколько прочно их электроны удерживаются на своих орбиталях. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ: 1. Бердоносов С.С. “Химия” М., 1994. 2. Браун Т., Лемей Г.Ю. “Химия – в центре наук”, часть 1, М., 1983. 3. “Введение в общую химию”. Под редакцией проф. Г. П. Лучинского. M., 1980. 4. Глинка Н.Л. Общая химия Л., 1985. 5. Г. П. Лучинский “Курс химии”. М., 1985.
Первоначальные сведения о строении атомов. Химические элементы
Все вещества образованы мельчайшими частицами, которые называются атомами.
Атомы имеют сложное строение.
В центре любого атома находится ядро. Ядро атома состоит из протонов и нейтронов, которые имеют общее название — нуклоны (от англ. nucleus — ядро).
Протон — это частица, которая имеет положительный заряд. Заряд протона в условных единицах равен +1. Символ протона – 1р.
Нейтрон — нейтральная частица, заряд нейтрона равен 0. Символ нейтрона — оn.
Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтральных нейтронов.
Вокруг ядра движутся электроны, которые имеют отрицательный заряд. Заряд электрона в условных единицах равен -1. Символ электрона – ē.
Протоны, нейтроны и электроны называются элементарными частицами.
Любой атом содержит равное число протонов и электронов, поэтому сумма положительных зарядов в атоме равна сумме отрицательных зарядов. Следовательно, атомы являются электронейтральными частицами.
Ядра различных атомов содержат разное число протонов и нейтронов.
Главной характеристикой любого атома является заряд ядра, который обозначается буквой Z и равен числу протонов.
Вид атомов с одинаковым зарядом ядер называется химическим элементом.
Каждый элемент имеет свое название и свой символ (знак).
В настоящее время известно более 100 химических элементов. Среди них есть элементы, которые встречаются в природе (примерно 90), и элементы, которые получают искусственным путем (около 20).
Каждый элемент имеет свое название и свой символ (химический знак). Символы элементов состоят из одной или двух букв латинского названия элементов и являются интернациональными. Названия элементов в каждом языке различны.
Например, элемент с русским названием водород имеет символ Н (читается «аш»), который является первой буквой латинского названия этого элемента — Hydrogenium. Элемент с русским названием хлор имеет символ Сl (читается «хлор»), который образован первой и третьей буквами латинского названия — Chlorum.
В данной таблице содержатся русские и латинские названия важнейших химических элементов, их символы и произношение символов в химических формулах.
Рассмотрим примеры произношения символов в химических формулах:
Н2О — «аш-два-о»
Ca3(PO4)2 — «кальций-три-пэ-о-четыре-дважды»
NaCl — «натрий-хлор»
Al2(SO4)3— «алюминий-два-эс-о-четыре-трижды»
AgNO3 — «аргентум-эн-о-три»
Все химические элементы делятся на металлы и неметаллы. Причиной этого деления являются различия в строении атомов. Они будут рассматриваться при изучении соответствующей темы. Однако уже сейчас следует запомнить, какие элементы относятся к металлам и какие — к неметаллам.
Распространенность различных химических элементов в природе неодинаковая.
В земной коре наиболее распространенными элементами являются: кислород О (= 49%), кремний Si(= 27%), алюминий Al(= 8%), железо Fe(= 5%), кальций Са, натрий— Na, калий K, магний Mg, титан Ti, водород Н. Эти десять элементов составляют более 99% массы земной коры. Важнейшими элементами морской воды являются О, Н, Na, Cl, а живого вещества — О, С и Н.
Похожее
Атомная теория – Введение в химию – 1-е канадское издание
- Изложите современную атомную теорию.
- Узнайте, как устроены атомы.
Наименьший кусок элемента, который поддерживает идентичность этого элемента, называется атомом. Отдельные атомы чрезвычайно малы. Чтобы построить линию длиной 1 см, потребуется около пятидесяти миллионов атомов подряд. Точка в конце печатного предложения состоит из нескольких миллионов атомов. Атомы настолько малы, что трудно поверить, что вся материя состоит из атомов, но это так.
Представление о том, что атомы играют фундаментальную роль в химии, формализовано современной атомной теорией, впервые изложенной английским ученым Джоном Далтоном в 1808 году. Она состоит из трех частей:
- Вся материя состоит из атомов.
- Атомы одного и того же элемента одинаковы; атомы разных элементов разные.
- Атомы объединяются в целочисленных отношениях с образованием соединений.
Эти концепции составляют основу химии.
Хотя слово атом происходит от греческого слова, означающего «неделимый», теперь мы понимаем, что сами атомы состоят из более мелких частей, называемых субатомными частицами .Первым был обнаружен электрон, крошечная субатомная частица с отрицательным зарядом. Его часто обозначают как e – , с правым надстрочным индексом, показывающим отрицательный заряд. Позже были обнаружены две более крупные частицы. Протон – более массивная (но все же крошечная) субатомная частица с положительным зарядом, представленная как p + . Нейтрон – это субатомная частица с массой примерно такой же, как у протона, но без заряда. Он представлен либо как n, либо как n 0 .Теперь мы знаем, что все атомы всех элементов состоят из электронов, протонов и (за одним исключением) нейтронов. Таблица 3.7 «Свойства трех субатомных частиц» суммирует свойства этих трех субатомных частиц.
| Имя | Символ | Масса (прибл. В кг) | Заряд |
|---|---|---|---|
| Протон | п. + | 1.6 × 10 −27 | 1+ |
| нейтрон | n, n 0 | 1,6 × 10 −27 | нет |
| Электрон | e – | 9,1 × 10 −31 | 1− |
Как эти частицы расположены в атомах? Они не расположены случайным образом. Эксперименты Эрнеста Резерфорда в Англии в 1910-х годах указали на ядерную модель атома.Относительно массивные протоны и нейтроны собираются в центре атома, в области, называемой ядром атома (множество ядер , ). Электроны находятся вне ядра и проводят время, вращаясь в космосе вокруг ядра. (См. Рисунок 3.4 «Структура атома».)
Рисунок 3.4 «Структура атома». У атомов есть протоны и нейтроны в центре, образующие ядро, а электроны вращаются вокруг ядра.Современная атомная теория утверждает, что атомы одного элемента одинаковы, а атомы разных элементов различны.Что отличает атомы разных элементов? Фундаментальной характеристикой, которой обладают все атомы одного и того же элемента, является число протонов . Все атомы водорода имеют в ядре один и только один протон; все атомы железа имеют в ядре 26 протонов. Это количество протонов настолько важно для идентичности атома, что его называют атомным номером элемента. Таким образом, атомный номер водорода равен 1, а атомный номер железа – 26. Каждый элемент имеет свой собственный характерный атомный номер.
Однако атомы одного и того же элемента могут иметь разное количество нейтронов. Атомы одного и того же элемента (то есть атомы с одинаковым числом протонов) с разным числом нейтронов называются изотопами. Большинство природных элементов существуют в виде изотопов. Например, большинство атомов водорода имеют в своем ядре единственный протон. Однако небольшое количество (примерно один из миллиона) атомов водорода имеет в своих ядрах протон и нейтрон. Этот конкретный изотоп водорода называется дейтерий.Очень редкая форма водорода имеет в ядре один протон и два нейтрона; этот изотоп водорода называется тритием. Сумма количества протонов и нейтронов в ядре называется массовым числом изотопа.
У нейтральных атомов такое же количество электронов, как и у протонов, поэтому их общий заряд равен нулю. Однако, как мы увидим позже, так будет не всегда.
- Наиболее распространенные атомы углерода содержат шесть протонов и шесть нейтронов в своих ядрах.Каковы атомный номер и массовое число этих атомов углерода?
- Изотоп урана имеет атомный номер 92 и массовое число 235. Каково количество протонов и нейтронов в ядре этого атома?
Решения
- Если в ядре атома углерода шесть протонов, его атомный номер равен 6. Если у него также шесть нейтронов в ядре, то массовое число равно 6 + 6, или 12.
- Если атомный номер урана 92, то это количество протонов в ядре.Поскольку массовое число равно 235, то количество нейтронов в ядре равно 235 – 92, или 143.
Число протонов в ядре атома олова – 50, а число нейтронов в ядре – 68. Каковы атомный номер и массовое число этого изотопа?
Ответ
Атомный номер = 50, массовое число = 118
Обращаясь к атому, мы просто используем название элемента: термин натрия относится к элементу, а также к атому натрия.Но постоянно использовать имя элемента может быть неудобно. Вместо этого химия определяет символ для каждого элемента. Атомарный символ – это одно- или двухбуквенное сокращение имени элемента. По соглашению первая буква символа элемента всегда заглавная, а вторая буква (если есть) – строчная. Таким образом, символ водорода – H, символ натрия – Na, а символ никеля – Ni. Большинство символов происходит от английского названия элемента, хотя некоторые символы происходят от латинского названия элемента.(Символ натрия Na происходит от его латинского названия natrium .) В таблице 3.8 «Названия и символы общих элементов» перечислены некоторые общие элементы и их символы. Вам следует запомнить символы в Таблице 3.8 «Имена и символы общих элементов», так как именно так мы будем представлять элементы в химии.
| Имя элемента | Символ |
|---|---|
| Алюминий | Al |
| Аргон | Ar |
| мышьяк | As |
| Барий | Ba |
| Бериллий | Be |
| висмут | Bi |
| Бор | B |
| Бром | Br |
| Кальций | Ca |
| Углерод | С |
| Хлор | Класс |
| Хром | Cr |
| Кобальт | Co |
| Медь | Cu |
| фтор | F |
| Галлий | Ga |
| Германий | Ge |
| Золото | Au |
| Гелий | He |
| Водород | H |
| Йод | I |
| Иридий | Ir |
| Утюг | Fe |
| Криптон | Кр |
| Свинец | Pb |
| Литий | Li |
| Магний | мг |
| Марганец | Mn |
| Меркурий | Hg |
| молибден | Пн |
| Неон | Ne |
| Никель | Ni |
| Азот | N |
| Кислород | O |
| Палладий | Pd |
| фосфор | P |
| Платина | Pt |
| Калий | К |
| Радий | Ra |
| Радон | Rn |
| Рубидий | руб. |
| Скандий | Sc |
| Селен | SE |
| Кремний | Si |
| Серебро | Ag |
| Натрий | Na |
| Стронций | Sr |
| сера | S |
| Тантал | Ta |
| Олово | Sn |
| Титан | Ti |
| Вольфрам | Вт |
| Уран | U |
| Ксенон | Xe |
| цинк | Zn |
| цирконий | Zr |
Элементы сгруппированы вместе в специальной таблице, называемой периодической таблицей.Простая периодическая таблица показана на рисунке 3.5 «Простая периодическая таблица», а более обширная представлена в «Приложении A: Периодическая таблица элементов». Элементы в периодической таблице перечислены в порядке возрастания атомного номера. Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы рассмотрим организацию электронов в атомах (см. Главу 8 «Электронная структура»). Одно немедленное использование таблицы Менделеева помогает нам идентифицировать металлы и неметаллы. Неметаллы находятся в правом верхнем углу таблицы Менделеева, на одной стороне жирной линии, разделяющей правую часть таблицы.Все остальные элементы – металлы.
Рисунок 3.5 «Простая периодическая таблица». Просмотрите доступную таблицу Менделеева в Интернете.Есть простой способ представить изотопы с помощью атомных символов. Используем конструкцию:
, где X – это символ элемента, A – массовое число, а Z – атомный номер. Таким образом, для изотопа углерода, который имеет 6 протонов и 6 нейтронов, символ будет:
, где C – символ элемента, 6 – атомный номер, а 12 – массовое число.
- Какой символ у изотопа урана с атомным номером 92 и массовым числом 235?
- Сколько протонов и нейтронов внутри?
Решения
- Обозначение этого изотопа.
- В этом атоме железа 26 протонов и 56 – 26 = 30 нейтронов.
Сколько протонов внутри?
Ответ
11 протонов
Также принято указывать массовое число после названия элемента, чтобы указать на конкретный изотоп. Углерод-12 представляет собой изотоп углерода с 6 протонами и 6 нейтронами, а уран-238 представляет собой изотоп урана с 146 нейтронами.
- Химия основана на современной атомной теории, которая утверждает, что вся материя состоит из атомов.
- Сами атомы состоят из протонов, нейтронов и электронов.
- Каждый элемент имеет свой атомный номер, равный количеству протонов в его ядре.
- Изотопы элемента содержат разное количество нейтронов.
- Элементы представлены атомным символом.
- Периодическая таблица – это таблица, в которой упорядочены все элементы.
Атрибуция в СМИ
Упражнения
Что такое атом? – Определение с сайта WhatIs.com
Атом – это частица материи, которая однозначно определяет химический элемент. Атом состоит из центрального ядра, которое обычно окружено одним или несколькими электронами. Каждый электрон заряжен отрицательно. Ядро заряжено положительно и содержит одну или несколько относительно тяжелых частиц, известных как протонов и нейтронов .
Протон заряжен положительно. Число протонов в ядре атома – это атомный номер для химического элемента . Протон имеет массу покоя, обозначенную m p , приблизительно 1,673 x 10 -27 килограмм (кг). Нейтрон электрически нейтрален и имеет массу покоя, обозначенную m n , приблизительно 1,675 x 10 -27 кг. Масса протона или нейтрона увеличивается, когда частица достигает экстремальной скорости, например, в циклотроне или линейном ускорителе.
Ранняя модель атома была разработана физиком Эрнестом Резерфордом в 1912 году. Он был первым, кто предположил, что атомы подобны миниатюрным солнечным системам, за исключением того, что сила притяжения вызывается не гравитацией, а противоположными электрическими зарядами. В так называемом атоме Резерфорда электроны вращаются вокруг ядра по круговым траекториям. Нильс Бор пересмотрел теорию Резерфорда в 1913 году. В атоме Бора () отрицательно заряженные электроны вращаются вокруг ядра на определенных средних расстояниях.Эти расстояния представлены сферами, называемыми оболочками , окружающими ядро. Электроны могут переходить от оболочки к оболочке. Когда электрон поглощает достаточно энергии, он перемещается в большую или более высокую оболочку. Когда он теряет определенное количество энергии, он падает на меньшую или более низкую оболочку.
Полная масса атома, включая протоны, нейтроны и электроны, равна атомной массе или атомной массе . Электроны составляют лишь крошечную часть этой массы.Для большинства практических целей атомный вес можно представить как количество протонов плюс количество нейтронов. Поскольку количество нейтронов в атоме может варьироваться, для большинства элементов может быть несколько различных атомных весов.
Атомы, имеющие одинаковое количество протонов, но разное количество нейтронов, представляют один и тот же элемент, но известны как разные изотопы этого элемента. Изотоп для элемента определяется суммой количества протонов и нейтронов.Примерами различных изотопов элемента являются углерод 12 (наиболее распространенный нерадиоактивный изотоп углерода) и углерод 14 (менее распространенный радиоактивный изотоп углерода).
Протоны и электроны имеют равный и противоположный заряд, и обычно в анатоме их обоих одинаковое количество. Таким образом, атомы обычно нейтральны. Ион – это атом с лишними электронами или с недостатком электронов, в результате чего он электрически заряжен. Ион с дополнительными электронами заряжен отрицательно и называется анионом ; Ион с дефицитом электронов заряжен положительно и называется катионом .
3.1: Теория атома – Chemistry LibreTexts
Цели обучения
- Изложите современную атомную теорию.
- Узнайте, как устроены атомы.
Наименьший кусок элемента, который поддерживает идентичность этого элемента, называется атомом. Отдельные атомы чрезвычайно малы. Чтобы построить линию длиной 1 см, потребуется около пятидесяти миллионов атомов подряд. Точка в конце печатного предложения состоит из нескольких миллионов атомов.Атомы настолько малы, что трудно поверить, что вся материя состоит из атомов, но это так.
Представление о том, что атомы играют фундаментальную роль в химии, формализовано современной атомной теорией, впервые изложенной английским ученым Джоном Далтоном в 1808 году. Она состоит из трех частей:
- Вся материя состоит из атомов.
- Атомы одного и того же элемента одинаковы; атомы разных элементов разные.
- Атомы объединяются в целочисленных отношениях с образованием соединений.
Эти концепции составляют основу химии. Хотя слово атом происходит от греческого слова, которое означает «неделимый», теперь мы понимаем, что сами атомы состоят из более мелких частей, называемых субатомными частицами . Первым был обнаружен электрон, крошечная субатомная частица с отрицательным зарядом. Его часто обозначают как e – , с правым надстрочным индексом, показывающим отрицательный заряд. Позже были обнаружены две более крупные частицы.Протон – более массивная (но все же крошечная) субатомная частица с положительным зарядом, представленная как p + . Нейтрон – это субатомная частица с массой примерно такой же, как у протона, но без заряда. Он представлен либо как n, либо как n 0 . Теперь мы знаем, что все атомы всех элементов состоят из электронов, протонов и (за одним исключением) нейтронов. Таблица \ (\ PageIndex {1} \) суммирует свойства этих трех субатомных частиц.
| Имя | Символ | Масса (прибл.; кг) | Заряд |
|---|---|---|---|
| Протон | п. + | 1,6 × 10 −27 | 1+ |
| нейтрон | n, n 0 | 1,6 × 10 −27 | нет |
| Электрон | e – | 9.1 × 10 −31 | 1− |
Как эти частицы расположены в атомах? Они не расположены случайным образом. Эксперименты Эрнеста Резерфорда в Англии в 1910-х годах указали на ядерную модель с атомами, в которой протоны и нейтроны находятся в центральном ядре, а электроны находятся на орбите вокруг ядра. Относительно массивные протоны и нейтроны собираются в центре атома, в области, называемой ядром атома (множество ядер , ).Электроны находятся вне ядра и проводят время, вращаясь в космосе вокруг ядра. (Рисунок \ (\ PageIndex {1} \)).
Рисунок \ (\ PageIndex {1} \): Структура атома. В центре атомов есть протоны и нейтроны, образующие ядро, а электроны вращаются вокруг ядра.Современная атомная теория утверждает, что атомы одного элемента одинаковы, а атомы разных элементов различны. Что отличает атомы разных элементов? Фундаментальной характеристикой, которой обладают все атомы одного и того же элемента, является число протонов .Все атомы водорода имеют в ядре один и только один протон; все атомы железа имеют в ядре 26 протонов. Это количество протонов настолько важно для идентичности атома, что его называют атомным номером. Число протонов в атоме – это атомный номер элемента. Таким образом, атомный номер водорода равен 1, а атомный номер железа – 26. Каждый элемент имеет свой собственный характерный атомный номер.
Однако атомы одного и того же элемента могут иметь разное количество нейтронов.Атомы одного и того же элемента (то есть атомы с одинаковым числом протонов) с разным числом нейтронов называются изотопами. Большинство природных элементов существуют в виде изотопов. Например, большинство атомов водорода имеют в своем ядре единственный протон. Однако небольшое количество (примерно один из миллиона) атомов водорода имеет в своих ядрах протон и нейтрон. Этот конкретный изотоп водорода называется дейтерий. Очень редкая форма водорода имеет в ядре один протон и два нейтрона; этот изотоп водорода называется тритием.Сумма количества протонов и нейтронов в ядре называется массовым числом изотопа.
У нейтральных атомов такое же количество электронов, как и у протонов, поэтому их общий заряд равен нулю. Однако, как мы увидим позже, так будет не всегда.
Пример \ (\ PageIndex {1} \):
- Наиболее распространенные атомы углерода содержат шесть протонов и шесть нейтронов в своих ядрах. Каковы атомный номер и массовое число этих атомов углерода?
- Изотоп урана имеет атомный номер 92 и массовое число 235.Какое количество протонов и нейтронов в ядре этого атома?
Решение
- Если в ядре атома углерода шесть протонов, его атомный номер равен 6. Если он также имеет шесть нейтронов в ядре, то массовое число равно 6 + 6, или 12.
- Если атомный номер урана 92, то это количество протонов в ядре. Поскольку массовое число равно 235, то количество нейтронов в ядре равно 235 – 92, или 143.
Упражнение \ (\ PageIndex {1} \)
Число протонов в ядре атома олова – 50, а число нейтронов в ядре – 68.Каковы атомный номер и массовое число этого изотопа?
- Ответ
Атомный номер = 50, массовое число = 118
Обращаясь к атому, мы просто используем название элемента: термин натрия относится к элементу, а также к атому натрия. Но постоянно использовать имя элемента может быть неудобно. Вместо этого химия определяет символ для каждого элемента. Атомарный символ – это одно- или двухбуквенное представление имени элемента.По соглашению первая буква символа элемента всегда заглавная, а вторая буква (если есть) – строчная. Таким образом, символ водорода – H, символ натрия – Na, а символ никеля – Ni. Большинство символов происходит от английского названия элемента, хотя некоторые символы происходят от латинского имени элемента. (Символ натрия Na происходит от его латинского названия natrium .) Таблица \ (\ PageIndex {2} \) перечисляет некоторые общие элементы и их символы. Вы должны запомнить символы в таблице \ (\ PageIndex {2} \), так как именно так мы будем представлять элементы в химии.
| Имя элемента | Символ | Имя элемента | Символ |
|---|---|---|---|
| Алюминий | Al | Меркурий | Hg |
| Аргон | Ar | молибден | Пн |
| мышьяк | как | Неон | Ne |
| Барий | Ba | Никель | Ni |
| Бериллий | Be | Азот | N |
| висмут | Bi | Кислород | O |
| Бор | B | Палладий | Pd |
| Бром | руб. | фосфор | -П, |
| Кальций | Ca | Платина | Pt |
| Углерод | С | Калий | К |
| Хлор | Класс | Радий | Ra |
| Хром | Cr | Радон | Rn |
| Кобальт | Co | Рубидий | руб. |
| Медь | Cu | Скандий | SC |
| фтор | F | Селен | SE |
| Галлий | Ga | Кремний | Si |
| Германий | Ge | Серебро | Ag |
| Золото | Au | Натрий | Na |
| Гелий | He | Стронций | Sr |
| Водород | H | Сера | S |
| Йод | I | Тантал | Ta |
| Иридий | Ir | Олово | Sn |
| Утюг | Fe | Титан | Ti |
| Криптон | Кр | Вольфрам | Вт |
| Свинец | Пб | Уран | U |
| Литий | Li | Ксенон | Xe |
| Магний | мг | Цинк | Zn |
| Марганец | Mn | Цирконий | Zr |
Элементы сгруппированы вместе в специальной таблице, называемой периодической таблицей всех элементов.Простая таблица Менделеева показана на рисунке \ (\ PageIndex {2} \), в то время как можно просмотреть более обширную таблицу Менделеева из другого источника. Элементы в периодической таблице перечислены в порядке возрастания атомного номера. Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы рассмотрим организацию электронов в атомах (глава 8). Одно немедленное использование таблицы Менделеева помогает нам идентифицировать металлы и неметаллы. Неметаллы находятся в верхнем правом углу таблицы Менделеева, на одной стороне жирной линии, разделяющей правую часть таблицы.{23} Na} \)
- Ответ
11 протонов
Также принято указывать массовое число после названия элемента, чтобы указать на конкретный изотоп. Углерод-12 представляет собой изотоп углерода с 6 протонами и 6 нейтронами, а уран-238 представляет собой изотоп урана с 146 нейтронами.
Основные выводы
- Химия основана на современной атомной теории, которая утверждает, что вся материя состоит из атомов.
- Сами атомы состоят из протонов, нейтронов и электронов.
- Каждый элемент имеет свой атомный номер, равный количеству протонов в его ядре.
- Изотопы элемента содержат разное количество нейтронов.
- Элементы представлены атомным символом.
- Периодическая таблица – это таблица, в которой упорядочены все элементы.
Теория и структура атома
Далее следует вспомогательное содержание лекции 4 по общей химии I.Эта лекция будет охватывать историю развития теории атома, строение атома, химический символизм и расчет атомной массы.
Начнем с обзора шагов, предпринятых для создания теории атома:
Теперь, когда мы рассмотрели, как мы пришли к теории атома, давайте посмотрим на атомную структуру, которую мы теперь считаем истинной.
Атомная структура довольно проста. Его часто описывают как похожий на солнечную систему с ядром, представляющим солнце, и электронами, действующими как планеты:
Атом состоит из трех типов частиц, расположенных в двух областях. протонов и нейтронов расположены в ядре , а электронов расположены на энергетических уровнях, окружающих ядро.
Теперь, когда вы знакомы с частицами, составляющими каждый атом элемента, давайте рассмотрим, как эти частицы представлены в периодической таблице. Другими словами, информация, которая дана в символике, используемой в периодической таблице, позволяет определить протоны, нейтроны и электроны, содержащиеся в каждом атоме или элементе.
Мы можем представить элемент или атом элемента его символом.
- C = углерод
- O = кислород
- B = бор
- Pb = свинец
Мы также используем эти символы, чтобы показать, как атомы (в молекулах) меняют партнеров в химической реакции.
- CO + PbO → CO2 + Pb
- Nh4 + HCl → Nh5Cl
Как существуют сами элементы?
Одноатомные элементы
He, Ne, Ar, Kr, Xe, Rn
(называемые благородными газами, раньше их называли инертными газами)
Двухатомные элементы
h3, O2, N2, F2, Cl2, Br2, I2
(Кислород также существует как O3 = озон.Это называется аллотропной формой; многие элементы существуют в нескольких аллотропных формах.)
Элементы других форм
P4, S8, C60 и т. Д.
Алмаз, графит и бакминстерфуллерен («бакиболл», C60) – все формы одного и того же элемента – углерода.
В периодической таблице каждому элементу дана коробка, содержащая его химический символ, а также несколько других частей информации:
Посмотрев на символ магния, вы увидите несколько цифр: 24, 12 и 2+.Каждое из этих чисел дает представление об атомной структуре этого конкретного атома магния.
Начнем с самого важного из трех: числа 12. Оно называется атомным числом и соответствует количеству протонов в атоме. Количество протонов уникально для каждого элемента, поэтому, если вы измените количество протонов, вы измените элемент. Другими словами, КАЖДЫЙ атом магния будет иметь в своем ядре ровно 12 протонов.
Следующее число, на которое стоит обратить внимание, – 24.Это называется атомным массовым числом и представляет собой округленное значение атомной массы атома. Эта масса определяется сложением всех масс протонов и нейтронов в ядре. Итак, если вы знаете массовое число атома и атомный номер, вы можете легко вычислить количество нейтронов в атоме:
Атомное массовое число – атомный номер = количество нейтронов
24 (протоны и нейтроны) – 12 протонов = 12 нейтронов
Последняя цифра в символе может использоваться для расчета количества электронов в элементе или ионе, если есть заряд + или -.Мы знаем, что протоны несут заряд +1, а электроны несут заряд -1 из атомной теории. Таким образом, если в атоме присутствует равное количество протонов и электронов, общий заряд равен 0 или нейтрален.
Протоны + электроны = состояние заряда или ионизации
Итак, если показан заряд, как в примере выше, 2+, это означает, что протонов на два больше, чем электронов, и
(12+) – (? E-) = 2+, таким образом, количество электронов равно 10.
Давайте попрактикуемся:
Наконец, нам нужно более подробно обсудить атомное массовое число , а затем атомную массу .
Изотопы
Поскольку нам нужно рассчитать количество нейтронов, присутствующих в атоме, исходя из атомного массового числа, это означает, что существует более одного атомного массового числа. Если бы в случае с массой атома было только одно, нам не понадобились бы вычисления для определения количества нейтронов, это было бы просто известно, верно? Итак, поскольку мы можем вычислить количество нейтронов, присутствующих в каждом атоме, это означает, что даже атомы одного и того же элемента могут иметь разное количество нейтронов, и это действительно так. Мы называем атомы элементов с разным числом нейтронов Изотопами.
Для каждого элемента существует множество известных изотопов, за очень немногими исключениями, имеющими только один. Вы можете найти эти элементы только с одним изотопом, посмотрев на их атомную массу, указанную в периодической таблице. Вы можете догадаться, как это сделать? Что ж, позвольте мне дать вам подсказку. Атомная масса, указанная в периодической таблице для каждого элемента, рассчитывается путем умножения «процентного содержания» каждого изотопа на его массу.По сути, это средневзвешенная масса. НО, если бы был только один изотоп, масса была бы только одна, верно? Таким образом, вы могли бы выяснить, какие элементы имеют только один изотоп.
Атомная масса
Итак, я использовал пару терминов выше, которые я обнаружил ранее причины такой математической паники у студентов, поэтому позвольте мне привести пример, который может сделать «средневзвешенную атомную массу» и ее использование «процентного содержания» более понятным.
Предположим, вы хотите вычислить среднюю массу группы из 25 человек.13 человек – женщины, а остальные 12 – мужчины (да). Поскольку большинство мужчин весят больше, чем большинство женщин, присвоение одного веса всем не дает очень точного среднего веса. Но если каждый мужчина весит ~ 180 фунтов, а каждая женщина – ~ 130 фунтов, вы можете взять процент каждого (женщины 13/25 = 0,52 или 52%, а мужчины 12/25 = 0,48 или 48%) и умножить эти проценты на массу и получить довольно близко к средней массе группы.
Итак (0,52 x 130 фунтов) + (0,48 x 180 фунтов) = 154 фунта
Это именно то, что мы делаем, чтобы получить средневзвешенную атомную массу.Мы берем процентное содержание каждого изотопа и умножаем его на массу изотопа, чтобы получить его индивидуальный вклад в общую массу элемента:
Пример:
Вот несколько практических задач:
Химия биологии: Атомная теория
Атомная теория
Для биологических целей простейшей формой чистого вещества, которое сохраняет все свойства этого вещества, является атом .Атомы также являются самой простой формой элемента . Элемент состоит только из одного типа атомов. Например, углерод – это элемент. Все атомы углерода выглядят одинаково, и только они являются атомами углерода. Другая атомная структура была бы другим атомом и, следовательно, другим элементом. Полный список более 100 элементов можно найти в таблице Менделеева (например, pearl1.lanl.gov/periodic/default.htm). Все атомы состоят из трех компонентов: протонов, нейтронов и электронов.Первый элемент, водород, имеет один протон, обычно один нейтрон, и один электрон. (Водород существует в природе как комбинация трех изотопов, каждый из которых имеет разное количество нейтронов. Обычно рассматривается наиболее известный изотоп, имеющий один протон.) Все атомы водорода по большей части выглядят одинаково.
Протоны имеют положительный заряд и вместе с нейтронами, которые не несут заряда (нейтральные), находятся в центральном ядре атома . Электроны заряжены отрицательно и вращаются вокруг ядра в трехмерном облаке энергетических уровней.Положительно-отрицательное притяжение (магнетизм) не дает электронам улетать от ядра. И наоборот, кинетическая энергия (энергия, связанная с движением) электрона обеспечивает его энергией движения и не дает электрону врезаться в ядро. Баланс между этими двумя силами, магнетизмом и кинетической энергией, определяет орбитальные пути всех электронов. Если нейтральный атом теряет или приобретает один электрон (или более), что может произойти во время химической реакции, полученный атом имеет дисбаланс между существующими зарядами.Этот дисбаланс создает либо избыточный положительный (+) заряд, если атом потерял электрон, либо избыточный отрицательный (-) заряд, если атом получил электрон. Атомы, которые имеют заряд, называются ионами , и они очень реактивны и принципиально важны в химических реакциях.
Выдержка из The Complete Idiot’s Guide to Biology 2004 Глен Э. Моултон, редактор Д. Все права защищены, включая право на полное или частичное воспроизведение в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу напрямую у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476. Вы также можете приобрести эту книгу на Amazon.com и Barnes & Noble.
Атомная и ядерная химия – 1-е издание
Предисловие
Предисловие
1 Классическая атомная теория
Происхождение атомной теории
Дальтон
Противоречие Пруста и Бертолле, дальтонид и бертоллидные соединения
Законы химического соединения Теория
Гей-Люссак
Авогадро
Берцелиус
Дюма
Каннисаро
2 Классификация элементов
Дёберейнер и закон триад
Ньюлендс и закон октав
Периодический закон, Менделееф и Лотар Мейер из «Сравнение
» с атомным объемом германия
Периодическая таблица Менделеефа
Обсуждение основных характеристик таблицы
Состояние окисления
3 атома и электроны
Броуновское движение
Проведение электричества через газы
Катодные лучи и рентгеновские лучи
Положительные лучи
Работа Томсона по определению E / M для катодных лучей
E / M с трансвером se Только магнитное поле
E / M с тонкой лучевой трубкой
Масса электрона
Определение Таунсенда e
Определение Милликена e
Измерение молекулярных и атомных радиусов
(i) Уравнение Ван-де-Ваальса
(ii) Работа Ленгмюра с поверхностными пленками
(iii) Дифракция рентгеновских лучей
Определение числа Авогадро
4 Атомная структура
Модель Томсона
Рассеяние A-частиц золотой фольгой
Ядерная модель Резерфорда
Работа Мозли по измерению X -Лучевые спектры
Значение атомного номера
Оптические спектры
Возбуждение спектров
Спектры излучения и поглощения
Спектр водорода
Спектральная серия
Тонкая структура
Излучение черного тела
Квантовая теория Планка
Наблюдение Ленарда фотоэффекта Эйнштейна
Постулат фотона
Теория атома Резерфорда-Бора
5 Развитие волны M механическая модель атома
Расширение теории Бёра
Электронная структура атома Резерфорда-Бёра-Зоммерфельда, принцип исключения Паули, квантовые числа, уровни энергии
Потенциалы ионизации
Кривые энергии ионизации
Энергии ионизации и химические свойства
Слабые стороны -Лечение Зоммерфельда
Теория Де Бройля о двойственной природе материи
Принцип неопределенности Гейзенберга
Волновой механический атом
Теория Шредингера и расширение Борна
6 Определение атомных масс
Разработка стандартов атомной массы
Постоянство атома
Постоянство Физические методы определения атомного веса, методы определения плотности пара
Предельная плотность
Определение атомности
Измерения плотности газа Рейно
Разработка баланса плавучести Уайтлоу-Грея
Определение Томсона и Уитлоу-Грея атомного веса
Радомсона
Поз Реактивный лучевой анализ
Разработка масс-спектрографа Aston
Масс-спектрометры
Фракция упаковки Aston
Энергия ядерной связи
Химические методы определения атомного веса
Анализ воды по Дюма
Анализ воды по Морли
Определение атомного веса Стаса
Определение атомного веса по Ричардсу
Приложение 1 для определения потенциальной энергии электрона на заданной орбите радиуса r.
Приложение 2 Измерение шага решетки.
Разные вопросы
Ответы на числовые вопросы
Элементы, расположенные в алфавитном порядке их химического символа
Периодическая таблица элементов
Указатель
1.1. Чтобы проиллюстрировать закон множественных пропорций путем образования двух хлоридов меди
1.2. Иллюстрация закона Гей-Люссака путем взаимодействия аммиака с заданным объемом хлора и измерения остаточного объема азота
2.1. Свойства переходных элементов
2.2. Парамагнетизм жидкого кислорода
2.3. Свойства хлористого водорода в безводном состоянии
3.1. Обзор броуновского движения
3.2. Эксперимент Милликена
3.3. Измерение поперечного сечения молекулы олеиновой кислоты
5.1. Измерение потенциала первой ионизации ксенона
6.1. Строительство и использование противовесов плавучести
6.2. Определение атомных масс серебра, хлора и азота гравиметрическим анализом
Упорядоченное управление гибридизацией графена с помощью фотоциклоприсоединения на атомном уровне
Гейм А.К. Графен: состояние и перспективы. Наука 324 , 1530–1534 (2009).
CAS PubMed Google ученый
Patera, L. L. et al. Визуализация в реальном времени роста графена на никеле под действием адатомов. Наука 359 , 1243–1246 (2018).
CAS PubMed Google ученый
Schwierz, F. Графеновые транзисторы. Nat. Nanotechnol. 5 , 487–496 (2010).
CAS PubMed Google ученый
Yan, L. et al. Химия и физика одного атомного слоя: стратегии и проблемы функционализации графена и материалов на его основе. Chem. Soc. Ред. 41 , 97–114 (2012).
CAS PubMed Google ученый
Zhao, L. Y. et al. Визуализация отдельных примесей азота в однослойном графене. Наука 333 , 999–1003 (2011).
CAS PubMed Google ученый
Ки, L. J. et al. Атомные слои гибридизированных доменов нитрида бора и графена. Nat. Матер. 9 , 430–435 (2010).
CAS PubMed Google ученый
Nair, M. N. et al. Расширение сингулярности высокого уровня Ван Хова и увеличение скорости Ферми в эпитаксиальном графене, функционализированном интеркалированными кластерами золота. Phys. Ред. B 85 , 245421–245426 (2012).
Google ученый
Bai, J. W. et al. Графен наномеш. Nat. Nanotechnol. 5 , 190–194 (2010).
CAS PubMed PubMed Central Google ученый
Treier, M. et al. Циклодегидрирование с помощью поверхности обеспечивает синтетический путь к легко обрабатываемым и химически адаптированным нанографенам. Nat. Chem. 3 , 61–67 (2011).
CAS PubMed Google ученый
Пальма, К. А. и др. Фотоиндуцированные C – C-реакции на изоляторах в направлении фотолитографии графеновых наноархитектур. J. Am. Chem. Soc. 136 , 4651–4658 (2014).
CAS PubMed Google ученый
Нарита А. и др. Синтез структурно четко определенных и жидкофазных графеновых нанолент. Nat. Chem. 6 , 126–132 (2014).
CAS PubMed Google ученый
Cai, J. M. et al. Гетеропереходы графеновых нанолент. Nat. Nanotechnol. 9 , 896–900 (2014).
CAS PubMed Google ученый
Chen, Y.C. et al. Молекулярная зонная инженерия гетеропереходов синтезированных восходящих графеновых нанолент. Nat. Nanotechnol. 10 , 156–160 (2015).
CAS PubMed Google ученый
Han, P. et al. Стратегия самосборки для изготовления связанных графеновых нанолент. ACS Nano 9 , 12035–12044 (2015).
CAS PubMed Google ученый
Ruffieux, P. et al. Поверхностный синтез графеновых нанолент с зигзагообразной топологией края. Природа 531 , 489–492 (2016).
CAS PubMed Google ученый
Chen, Z. P. et al. Синтез графеновых нанолент путем химического осаждения из паровой фазы при атмосферном давлении и интеграции устройств. J. Am. Chem. Soc. 138 , 15488–15496 (2016).
CAS PubMed Google ученый
Nguyen, G.D. et al. Атомарно точные гетеропереходы графеновых нанолент из одного молекулярного предшественника. Nat. Нанотехнологии. 12 , 1077–1082 (2017).
CAS Google ученый
Moreno, C. et al. Восходящий синтез многофункционального нанопористого графена. Наука 360 , 199–203 (2018).
CAS PubMed Google ученый
Elias, D.C. et al. Контроль свойств графена путем обратимого гидрирования: данные о графане. Наука 323 , 610–613 (2009).
CAS PubMed Google ученый
Balog, R. et al. Открытие запрещенной зоны в графене, вызванное структурированной адсорбцией водорода. Nat. Матер. 9 , 315–319 (2010).
CAS PubMed Google ученый
Jørgensen, J. H. et al. Инженерия запрещенной зоны на основе симметрии в графене, функционализированном водородом. ACS Nano 10 , 10798–10807 (2016).
PubMed Google ученый
Li, H. et al. Сайт-селективное локальное фторирование графена, индуцированное облучением сфокусированным ионным пучком. Sci. Отчет 6 , 19719 (2016).
CAS PubMed PubMed Central Google ученый
Альтенбург, С. Дж., Латтеле, М., Ван, Б., Боке, М. Л., Берндт, Р. Реакция фталоцианинов с графеном на Ir (111). J. Am. Chem. Soc. 137 , 9452–9458 (2015).
CAS PubMed Google ученый
Greenwood, J. et al. Ковалентная модификация графена и графита с использованием химии диазония: настраиваемая прививка и наноманипуляции. ACS Nano 9 , 5520–5535 (2015).
CAS PubMed Google ученый
He, Y.Q. et al. Сплавление тетрапирролов с краями графена за счет ковалентного сцепления с помощью поверхности. Nat. Chem. 9 , 33–38 (2017).
CAS PubMed Google ученый
Даукия Л. и др. Ковалентная функционализация по реакциям циклоприсоединения чистого бездефектного графена. ACS Nano 11 , 627–634 (2017).
CAS PubMed Google ученый
Криадо А., Мельчионна М., Марчезан С. и Прато М. Ковалентная функционализация графена на подложках. Angew. Chem. Int. Эд. 54 , 10734–10750 (2015).
CAS Google ученый
Bian, S. et al. Ковалентно структурированные поверхности графена с помощью ускоренной реакции Дильса – Альдера. J. Am. Chem. Soc. 135 , 9240–9243 (2013).
CAS PubMed Google ученый
Цао, Ю., Осуна, С., Лян, Ю., Хаддон, Р. К. и Хоук, К. Н. Реакции Дильса – Альдера графена: расчетные предсказания продуктов и участков реакции. J. Am. Chem. Soc. 135 , 17643–17649 (2013).
CAS PubMed Google ученый
Navarro, J. J. et al. Органическое ковалентное формирование наноструктурированного графена с селективностью на атомном уровне. Nano Lett. 16 , 355–361 (2016).
CAS PubMed Google ученый
Наварро, Дж. Дж., Каллеха, Ф., Миранда, Р. Э., Перес, М. и Васкес де Парга, А. Л. Высокодоходная и чрезвычайно сайт-селективная ковалентная функционализация графена. Chem. Commun. 53 , 10418–10421 (2017).
CAS Google ученый
Лю Л. Х., Лернер М. М. и Ян М. Деривитизация нетронутого графена с четко определенными химическими функциями. Nano Lett. 10 , 3754–3756 (2010).
CAS PubMed PubMed Central Google ученый
Денис П.A. & Iribarne, F. Кооперативное поведение в функционализированном графене: объяснение возникновения 1,3-циклоприсоединения азометин-илидов к графену. Chem. Phys. Lett. 550 , 111–117 (2012).
CAS Google ученый
Маклеод Дж. М. и Рози Ф. Самосборка молекул на графене. Малый 10 , 1038–1049 (2014).
CAS PubMed Google ученый
Келли Р. Э. и Канторович Л. Плоские суперструктуры оснований нуклеиновых кислот. J. Mater. Chem. 16 , 1984–1905 (2006).
Google ученый
Wang, Q.H. et al. Понимание и контроль влияния подложки на химию переноса электронов графена с помощью литографии с отпечатками реактивности. Nat. Chem. 4 , 724–732 (2012).
CAS PubMed Google ученый
Хомяков П.А. и др. Изучение из первых принципов взаимодействия и переноса заряда между графеном и металлами. Phys. Ред. B 79 , 195425–195436 (2009).
Google ученый
Laegsgaard, E. et al. Сканирующий туннельный микроскоп высокого давления. Rev. Sci. Instrum. 72 , 3537–3542 (2001).
CAS Google ученый
Шен К. и др. Изготовление квазисвободного графена на поверхности SiC (0001) путем управляемого интеркалирования железа. J. Phys. Chem. C 122 , 21484–21492 (2018).
CAS Google ученый
Kresse, G. et al. Эффективные итерационные схемы для ab initio расчетов полной энергии с использованием базиса плоских волн. Phys. Ред. B 54 , 11169–11186 (1996).
CAS Google ученый
Perdew, J. P. et al. Обобщенное приближение градиента стало проще. Phys. Rev. Lett. 77 , 3865–3868 (1996).
CAS Google ученый
Grimme, S. et al. Последовательная и точная неэмпирическая параметризация коррекции дисперсии функциональной плотности (DFT-D) для 94 элементов H – Pu. J. Chem. Phys. 132 , 154104 (2010).
PubMed PubMed Central Google ученый
Vande Vondele, J. et al. Quickstep: быстрые и точные расчеты функционала плотности с использованием подхода смешанных гауссовых и плоских волн. Comput. Phys. Commun. 167 , 103–128 (2005).
CAS Google ученый
Hutter, J. et al. CP2K: атомистическое моделирование систем конденсированного состояния. ПРОВОДА Comput. Мол. Sci. 4 , 15–25 (2014).
CAS Google ученый

 Радиоактивность и изотопы
Радиоактивность и изотопы