Разбор всех типов задачи 22 ОГЭ по химии | ОГЭ – Химия
https://ds02.infourok.ruЗадача 22.
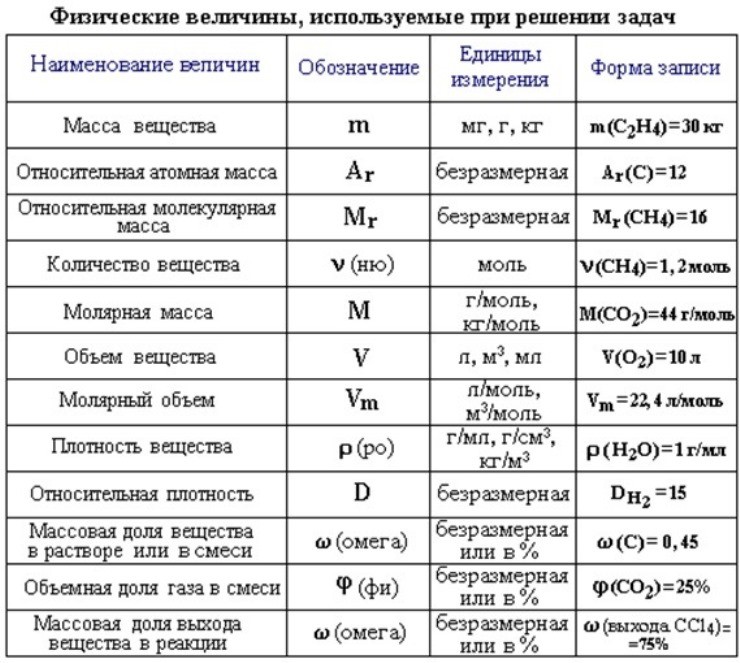
Существует всего три типа задач, которые встречаются в этом задании, но все они решаются по уравнению реакции, в вычислениях используют определенный набор формул:
основные формулы для решения задачи 22Для каждого из типов представлен алгоритм решения задач.
Первый тип задач.
Дана масса раствора исходного вещества и его массовая доля. Определить массу образовавшегося осадка.
1. Составить уравнение реакции, т.е. записать формулы веществ вступающих в реакцию и продуктов, образующихся в результате реакции. Расставить коэффициенты!
2. По таблице растворимости определить в правой части реакции осадок, обозначить его ↓.
3. Рассчитать массу вещества в растворе по формуле:
m(ве-ва) = m(ра-ра)∙ω.
4. Рассчитать количество вещества по формуле: n = m/M.
5. По уравнению реакции определить количество вещества того вещества, которое выпало в осадок.
6. Рассчитать массу осадка по формуле: m =M·n.
Пример 1. К 60 г раствора с массовой долей гидроксида калия 15% добавили избыток раствора нитрата меди (II). Определите массу выпавшего осадка.
Решение: 1. Записываем уравнение реакции, пользуясь таблицей растворимости устанавливаем вещество, которое выпадает в осадок:
2. Найдем массу гидроксида калия (m(ве-ва)):
m(ве-ва) = m(ра-ра)∙ω
m(КОН) = 60*15/100% = 9 г
3. Найдем количество вещества КОН:
n = m/M
nКОН = 9/56 = 0, 16 моль
4. По уравнению реакции найдем количество вещества Cu(OH)2:
2 моль КОН – 1 моль Cu(OH)2
0,16 моль КОН – х моль Cu(OH)2
х = 0,16*1/2 = 0,8 моль
5. Найдем массу осадка:
m =M·n
mCu(OH)2 = 98*0,8 = 78,4 г
Ответ: 78,4 г.
Второй тип задач.
Дана масса раствора вещества или продукта реакции. Вычислить массовую долю вещества или продукта реакции.
1. Составить уравнение реакции, т.е. записать формулы веществ, вступающих в реакцию и продуктов, образующихся в результате реакции. Расставить коэффициенты!
2. Вычисляем количество исходного вещества (или продукта) реакции по формуле: n = m/M, если дан объем газа, то по формуле: n =V*Vm .
3. Вычисляем массу исходного вещества (или продукта) реакции по формуле: m = n*M.
4.Знаем массу исходного вещества (продукта) – нашли в предыдущем действии. Знаем массу раствора – дана в условии. Находим массовую долю по формуле: ω = m(вещества)/m(раствора)∙.
Пример2: К 85 г раствора серной кислоты добавили порцию карбоната калия. При этом выделилось 0,896 л газа. Вычислите массовую долю исходного раствора серной кислоты.
Решение: 1. Записываем уравнение реакции:
2. Найдем количество вещества CO2:
n = V/Vm
nCO2 = 0,896/22,4 = 0, 04 моль
3.По уравнению реакции найдем количество вещества Н2SO4:
nCO2 = nН2SO4 = 0,04 моль
1. Найдем массу серной кислоты (m(ве-ва)):
Найдем массу серной кислоты (m(ве-ва)):
m(Н2SO4) = n*M
m(Н2SO4) = 0,04*98 = 3,92 г
5. Найдем массовую долю серной кислоты в растворе:
ω (Н2SO4) = 3,92/85*100% = 4,6%
Ответ: 4,6%
Третий тип задач.
Дана массовая доля раствора исходного вещества. Определить массу исходного вещества в растворе.
1. Составить уравнение реакции, т.е. записать формулы веществ вступающих в реакцию и продуктов, образующихся в результате реакции. Расставить коэффициенты!
2. Рассчитать количество вещества образовавшегося осадка или выделившегося газа по формуле:
n = m/M или n = V/Vm
3. По уравнению реакции рассчитать количество вещества, массу которого необходимо найти в вопросе задачи.
4. Рассчитать массу вещества в растворе по формуле:
m(Na2SO4) = n*M
5. Найдем масcу растворa:
m(ра-ра) = m(ве-ва) /ω.
Пример 3: К раствору сульфата натрия с массовой долей 9% добавили избыток раствора нитрата бария. В результате образовался осадок массой 9,85г. Определите массу исходного раствора сульфата натрия.
В результате образовался осадок массой 9,85г. Определите массу исходного раствора сульфата натрия.
Решение: 1. Записываем уравнение реакции, пользуясь таблицей растворимости устанавливаем вещество, которое выпадает в осадок:
2. Найдем количество вещества BaSO4:
n = m/M
nBaSO4 = 9,85/230 = 0,04 моль
3.По уравнению реакции найдем количество вещества Na2SO4:
n BaSO4 = nNa2SO4 = 0,04 моль
4. Найдем массу вещества сульфата натрия (m(ве-ва)):
m(Na2SO4) = n*M
m(Н2SO4) = 0,04*119 = 4,76 г
5. Найдем масcу растворa сульфата натрия:
m(ра-ра) = m(ве-ва) /ω.
m(ра-ра) = 4,76*100% /9 = 52,89 г
Ответ: 52,89 г
Задачи для самостоятельного решения.
1. К 160 г раствора с массовой долей нитрата серебра 5% добавили избыток раствора хлорида натрия. Определите массу выпавшего осадка.
2. К 80 г раствора с массовой долей нитрата бария 9% добавили избыток раствора серной кислоты. Определите массу выпавшего осадка.
Определите массу выпавшего осадка.
3. К 180 г раствора с массовой долей гидроксида натрия 10% добавили избыток раствора хлорида железа (III). Определите массу выпавшего осадка.
4. К 150 г раствора соляной кислоты добавили раствор сульфида калия. При этом выделилось 8,96 л газа. Вычислите массовую долю исходного раствора соляной кислоты.
5. К 75 г раствора серной кислоты добавили порцию карбоната кальция. При этом выделилось 2, 24 л газа. Вычислите массовую долю исходного раствора серной кислоты.
6. К 125 г раствора соляной кислоты добавили порцию сульфита калия. При этом выделилось 4,48 л газа. Вычислите массовую долю исходного раствора соляной кислоты.
7. К раствору сульфата калия с массовой долей 6% добавили избыток раствора хлорида бария. В результате образовался осадок массой 8,95г. Определите массу исходного раствора сульфата калия.
8. К раствору фосфата натрия с массовой долей 12% добавили избыток раствора нитрата серебра. В результате образовался осадок массой 12,45г. Определите массу исходного раствора фосфата натрия.
В результате образовался осадок массой 12,45г. Определите массу исходного раствора фосфата натрия.
9. К раствору хлорида кальция с массовой долей 8% добавили избыток раствора нитрата серебра. В результате образовался осадок массой 9,85г. Определите массу исходного раствора хлорида кальция.
все формулы для 8 класса
Автор fast12v0_vseproh На чтение 5 мин Просмотров 7 Опубликовано
Содержание
- Алгоритм решения задач по химии
- Молярная масса вещества
- Расчет по уравнениям химических реакций с использованием понятия количества вещества
Алгоритм решения задач по химии
- Ознакомьтесь с условиями задачи (если есть). Да, все знают — как решить проблему без условий — но в любом случае для полноты инструкции мы не могли не указать этот момент.
- Записывайте данные о деятельности. Мы не будем заострять внимание на этом моменте, так как требования разных учебных заведений, учителей и профессоров могут существенно различаться.

- Напишите уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть осторожным! Обязательно правильно ставить коэффициенты перед формулами веществ. Если вы забудете это сделать, все наши усилия окажутся напрасными.
- Выполните соответствующие расчеты в соответствии с химическим уравнением. Далее мы рассмотрим, как произвести эти самые вычисления.
Для этого у нас есть два пути, как решить проблему в химии. Условно назовем их правильными (используя понятие количества вещества) и неправильными (используя пропорции). Конечно, мы рекомендуем вам правильно решать проблемы. Поскольку у неправильного пути много противников. Как правило, учителя считают, что ученики, решающие задачи пропорциями, не понимают самой сути процессов химических реакций и решают задачи просто математически.
Молярная масса вещества
Молярная масса — это масса 1 моля вещества, выраженная в граммах. Молярная масса моля любого химического элемента может быть легко найдена из периодической таблицы, поскольку молярная масса численно равна атомной массе, но их размеры разные (молярная масса имеет размер г / моль).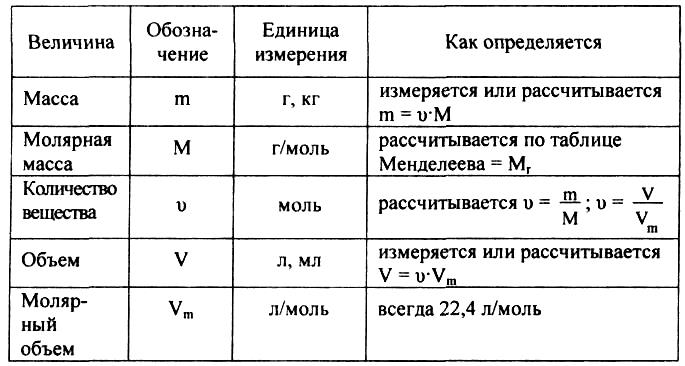 Запишите и запомните формулы для расчета молярной массы, количества вещества и количества молекул:
Запишите и запомните формулы для расчета молярной массы, количества вещества и количества молекул:
- Формула молярной массы M = m / n
- Количество вещества формулы n = m / M
- Формула числа молекул N = NA n
где m — масса вещества, n — количество вещества (число молей), M — молярная масса, N — количество молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут считать атомы и молекулы в лаборатории, просто взвесив их. Это позволяет удобно использовать концепцию крота.
На рисунке изображены четыре колбы с разными веществами, но каждая из них содержит только 1 моль вещества. Вы можете дважды проверить, используя приведенные выше формулы.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть этого метода в том, что вещества реагируют друг с другом в строгой взаимосвязи. И уравнение реакции, которое мы написали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам необходимые данные для расчетов.
Например, напишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_ {2} SO_ {4} + NaOH → Na_ {2} SO_ {4} + H_ {2} O
Зафиксируем коэффициенты:
H_ {2} SO_ {4} + 2NaOH → Na_ {2} SO_ {4} + 2H_ {2} O
Основываясь на этом уравнении, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Теперь мы сделаем небольшой шаг назад от анализа проблем, чтобы ознакомиться с основными концепциями, которые будут полезны для решения задач по химии.
Подсчитать количество молекул, например, в 98 граммах серной кислоты — не самое удобное занятие. Цифры получатся огромными (≈ 6,022140857⋅1023 молекул в 98 граммах серной кислоты). Для этого в химии были введены понятия количества вещества (моль) и молярной массы.
1 моль (единица измерения количества вещества) — это количество атомов, молекул или любой другой структурной единицы, содержащейся в 12 граммах изотопа углерода-12.
Впоследствии было обнаружено, что 12 граммов вещества углерода-12 содержат 6,022140857⋅1023 атома. Следовательно, можно сказать, что 1 моль — это масса вещества, содержащего 6,022140857⋅1023 атомов (или молекул) этого вещества. Но ведь молекулы и атомы имеют разный состав и структуру. Разные атомы содержат разное количество протонов и нейтронов. В результате 1 моль для разных веществ будет иметь разную массу, несмотря на одинаковое количество молекул (атомов). Эта масса называется молярным.
Молярная масса — это масса 1 моля вещества.
Используя эти концепции, мы можем сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моля воды.
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам нужно второго вещества для полного протекания реакции и сколько конечных продуктов образуется.
Например, мы решаем несколько задач, используя одно и то же уравнение.
Проблема: сколько граммов гидроксида натрия (NaOH) необходимо, чтобы 49 граммов серной кислоты (h3SO4) полностью прореагировали?
Итак, наши действия: запишите уравнение химической реакции, расставьте коэффициенты. Для наглядности запишем эти задачи на уравнение реакции. Возьмем неизвестное значение для X.
Для наглядности запишем эти задачи на уравнение реакции. Возьмем неизвестное значение для X.
Нет необходимости записывать данные по каждому веществу. Достаточно будет на интересующие нас вещества, из состояния проблемы. Приведенная выше запись предоставляется в качестве примера.
Примерно так должны выглядеть записанные данные в зависимости от состояния проблемы. Мы не претендуем на единственно правильный дизайн, требования у всех разные. Но, как нам кажется, все кажется достаточно ясным и информативным.
Наше первое действие — пересчитать массу известного вещества в молях. Для этого делим известную массу вещества (49 грамм) на молярную массу:
49 = 98 = 0,5 моль серной кислоты
Как упоминалось выше, согласно уравнению реакции 1 моль серной кислоты реагирует с 2 молями гидроксида натрия. В результате 1 моль гидроксида натрия будет реагировать с 0,5 моль серной кислоты.
n (NaOH) = 0,5 * 2 = 1 моль гидроксида натрия
Найдите массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г / моль = 40 граммов гидроксида натрия.
Ответ: 40 граммов NaOH
Как видите, в решении задачи с помощью уравнения реакции нет ничего сложного. Задача решается за 2-3 действия, с которыми придется столкнуться младшим школьникам. Вам просто нужно запомнить несколько концепций.
Формулы для решения задач, связанных с кислотами и основаниями
Кислотно-щелочные реакции и связанные с ними расчеты играют основную роль во многих химических, биологических и экологических системах. Определяете ли вы концентрацию ионов водорода [H + ]; концентрация ионов гидроксида, [OH ˗ ]; рН; или pOH, уравнение и калькулятор — важные инструменты, которые должны быть в вашем наборе инструментов. Ниже приведены некоторые удобные формулы для решения кислотно-основных задач.
Расчет концентрации ионов водорода или гидроксида
Следующее уравнение позволяет рассчитать концентрацию ионов водорода, [H + ], при 25°C, если известна концентрация ионов гидроксида, [OH – ]; вы также можете найти [OH –
 .
.Расчет концентрации ионов водорода или гидроксида по pH или pOH
Знайте, как вычислять [H + ] или [OH – ], зная pH или pOH (или наоборот). Используйте следующие формулы:
Многие научные и графические калькуляторы различаются тем, как они обрабатывают ввод значений и логарифмирование, поэтому знайте правильный порядок нажатия клавиш для своего калькулятора. Обязательно просмотрите руководство к калькулятору или поищите его в Интернете.
Расчет pH при заданном значении pOH
Вычисление pH, когда вы знаете pOH (или наоборот), вероятно, является самым простым из вычислений кислотно-щелочного баланса. Вот формула:
рН + рОН = 14
Просто вычтите заданное значение из 14 (не забывая о значащих цифрах), чтобы получить нужное значение.
Выполнение расчетов титрования с соотношением кислот и оснований 1:1
Когда вам даны расчеты титрования, в которых кислота и основание реагируют в соотношении 1:1 в соответствии с сбалансированным уравнением, следующее уравнение предлагает быстрый и простой способ решить либо концентрацию одного из веществ, либо объем необходимо для завершения титрования:
М А В А = М В В В
Если кислота и основание не реагируют в соотношении 1:1, используйте стехиометрию (или размерный анализ), чтобы найти неизвестное количество.
Об этой статье
Эта статья взята из книги:
- Химия: 1001 практические задачи для чайников (+ бесплатная онлайн-практика),
и химия на уровне колледжа за более чем 30 лет обучения.
Ричард Х. Лэнгли, доктор философии, работает на факультете Государственного университета Стивена Ф. Остина в Накогдочесе, штат Техас, где он преподает химию.
Хизер Хаттори преподавала химию как в средней школе, так и в колледже за более чем 30 лет обучения.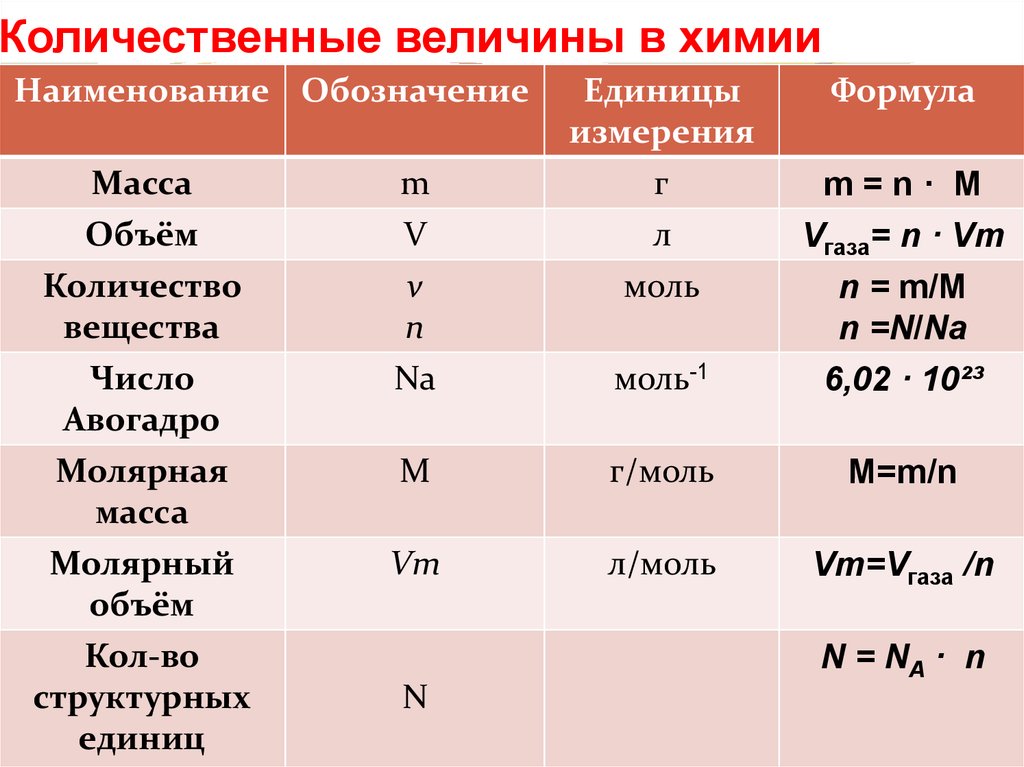
Ричард Х. Лэнгли, доктор философии, работает на факультете Государственного университета Стивена Ф. Остина в Накогдочесе, штат Техас, где он преподает химию.
Эту статью можно найти в категории:
- Химия,
4.3: Формулы и их значение
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3605
- Стивен Лоуэр
- Университет Саймона Фрейзера
Цели обучения
Убедитесь, что вы полностью понимаете следующие основные понятия, которые были представлены выше.
- Объясните, почему символ элемента часто отличается от формулы элемента.
 .
. - Дайте определение иона и объясните значение его формулы.
- Найдите простейшую («эмпирическую») формулу вещества из более сложной молекулярной формулы. Объясните значение формулы ионного твердого вещества, такого как NaCl.
- Определить молекулярную массу , формульную массу и молярную массу . Вычислите любой из них по любой химической формуле.
- Для заданной химической формулы выразите мольных отношений любых двух элементов или мольных долей одного из его элементов.
- Найдите процентный состав соединения по его формуле.
- Рассчитайте массовое отношение любых двух элементов, присутствующих в соединении, по его формуле.
- Найдите эмпирическую формулу бинарного соединения из молярное отношение двух его элементов, выраженное десятичным числом.
- Найдите эмпирическую формулу бинарного соединения, исходя из соотношения масс двух его элементов.

- Найдите эмпирическую формулу соединения по его массовому или процентному составу.
В основе химии лежат вещества — элементы или соединения — которые имеют определенный состав который выражается химической формулой . В этом разделе вы научитесь писать и интерпретировать химические формулы как в молях, так и в массах, а также двигаться в обратном направлении, в котором мы используем экспериментальную информацию о составе соединения для разработки формулы.
Формула соединения указывает количество атомов каждого вида, присутствующих в одной молекулярной единице соединения. Поскольку каждое уникальное химическое вещество имеет определенный состав, каждое такое вещество должно описываться химической формулой.
Пример \(\PageIndex{1}\): Написание молекулярной формулы
Хорошо известный спирт этанол состоит из молекул, содержащих два атома углерода, пять атомов водорода и один атом кислорода. Какова его молекулярная формула?
Какова его молекулярная формула?
Решение
Просто напишите символ каждого элемента, а затем нижний индекс, указывающий количество атомов, если присутствует более одного. Таким образом: C 2 H 5 O
Обратите внимание, что:
- Число атомов каждого элемента в молекулярной формуле записывается в виде нижнего индекса;
- Если в молекулярной формуле присутствует только один атом элемента, нижний индекс опускается.
- В случае органических (углеродсодержащих) соединений в формуле принято располагать символы элементов С, Н, (а при наличии) О, N в таком порядке.
Формулы элементов и ионов
Символ элемента представляет собой комбинацию из одной или двух букв, обозначающую атом определенного элемента, например Au (золото) или O (кислород). Символ может использоваться как аббревиатура для названия элемента (проще писать «Mb» вместо «молибден»!) В более формальном химическом использовании символ элемента может также обозначать один атом или, в зависимости от контекста, один моль атомов элемента.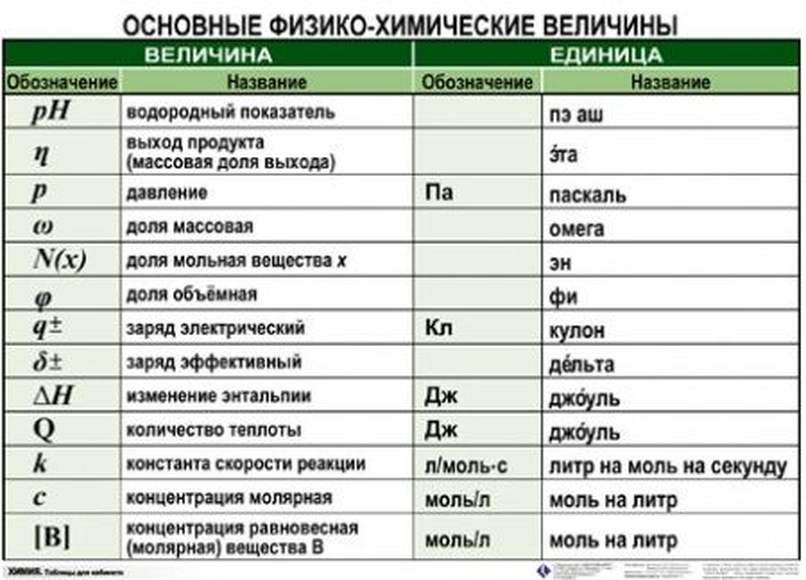
Некоторые неметаллические элементы существуют в виде молекул, содержащих два или более атомов элемента. Эти молекулы описываются формулами , такими как N 2 , S 6 и P 4 . Некоторые из этих элементов могут образовывать молекулы более чем одного типа; наиболее известным примером этого является кислород, который может существовать в форме O 2 (обычная форма, составляющая 21% молекул в воздухе), а также как O 3 , нестабильная и высокореактивная молекула, известная как озон . Молекулы углерода в форме футбольного мяча, иногда называемые бакиболами , имеют формулу C 60 .
Аллотропы
Различные молекулярные формы одного и того же элемента (например, \(\ce{O_2}\) и \(\ce{O_3})\) называются аллотропами.
Ионы — это атомы или молекулы, несущие электрический заряд. Эти заряды представлены в виде надстрочных индексов в ионных формулах. Таким образом: 9{+}}\)
Обратите внимание, что количество зарядов (в единицах заряда электрона) всегда должно предшествовать положительному или отрицательному знаку, но это число опускается, когда заряд равен ±1.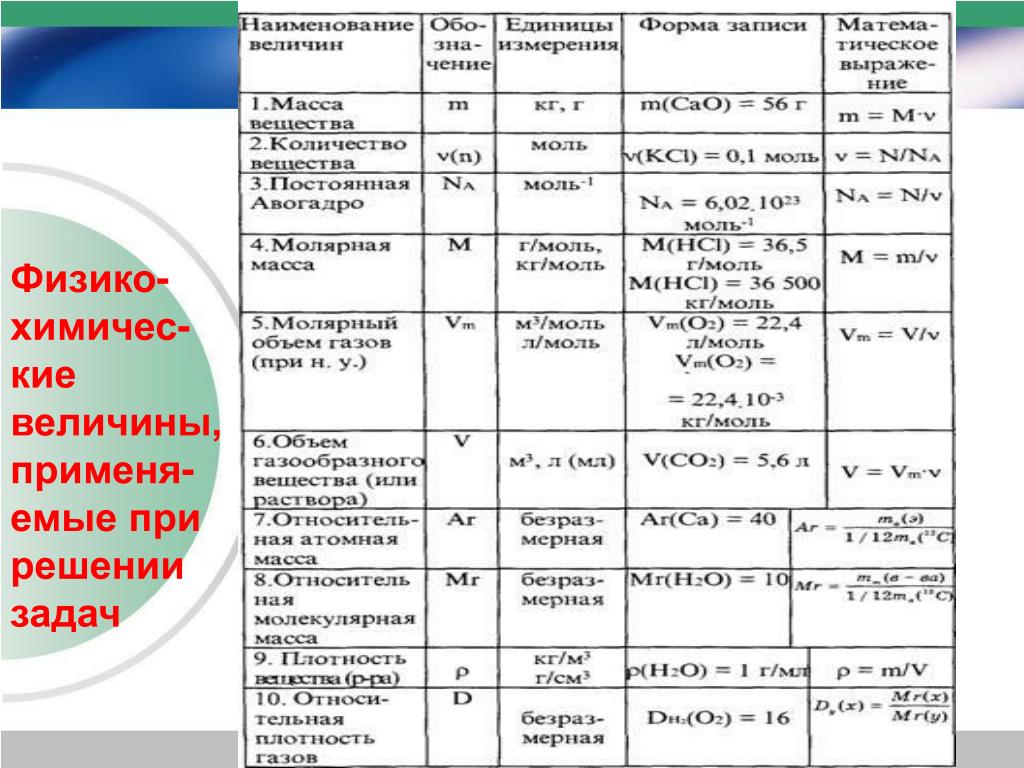
Формулы протяженных твердых тел
В твердом CdCl 2 атомы Cl и Cd организованы в слои, которые простираются до бесконечности. Каждый атом окружен шестью атомами противоположного типа, поэтому в качестве «молекулярной единицы» можно произвольно выбрать любой Cl–Cd–Cl. Один из таких CdCl 9Единица 0051 2 обозначена двумя красными связями на диаграмме, но она не представляет собой дискретную «молекулу» CdCl 2 .
Многие кажущиеся «простыми» твердые вещества существуют только в виде ионных твердых веществ (таких как NaCl) или протяженных твердых веществ (таких как CuCl 2 ), в которых невозможно идентифицировать отдельные молекулы. Формулы, которые мы пишем для этих соединений, просто выражают относительное количество различных видов атомов в соединении в наименьших возможных целых числах. Они идентичны эмпирическим или «простейшим» формулам, которые мы обсудим далее.
Многие минералы и большинство горных пород содержат различные соотношения определенных элементов и могут быть точно охарактеризованы только на структурном уровне. Поскольку обычно это не чистые вещества, «формулы», обычно используемые для их описания, имеют ограниченное значение. Например, обычный каменный оливин, который можно рассматривать как твердый раствор Mg 2 SiO 4 и Fe 2 SiO 4 , может быть представлен как (Mg,Fe) 2 SiO 4 . Это означает, что отношение металлов к SiO 4 является постоянным, и что магний обычно присутствует в большем количестве, чем железо.
Поскольку обычно это не чистые вещества, «формулы», обычно используемые для их описания, имеют ограниченное значение. Например, обычный каменный оливин, который можно рассматривать как твердый раствор Mg 2 SiO 4 и Fe 2 SiO 4 , может быть представлен как (Mg,Fe) 2 SiO 4 . Это означает, что отношение металлов к SiO 4 является постоянным, и что магний обычно присутствует в большем количестве, чем железо.
Эмпирические формулы
Эмпирические формулы дают относительных чисел различных элементов в образце соединения, выраженных в наименьших возможных целых числах. Термин эмпирический относится к тому факту, что формулы такого рода определяются экспериментально; такие формулы также обычно называют эмпирическими формулами .
Пример \(\PageIndex{2}\): Эмпирическая формула из молекулярной формулы
Глюкоза («топливо», на котором работает ваше тело) состоит из молекулярных единиц, имеющих формулу C 6 H 12 O 6 . Какова эмпирическая формула глюкозы?
Какова эмпирическая формула глюкозы?
Раствор
Молекула глюкозы содержит вдвое больше атомов водорода, чем атомов углерода или кислорода, поэтому мы делим на 6, чтобы получить CH 2 O .
Примечание: эта эмпирическая формула, применимая ко всем 6-углеродным сахарам, показывает, что эти соединения «состоят» из углерода и воды, что объясняет, почему сахара известны как углеводы .
Некоторые твердые соединения не существуют в виде дискретных молекулярных единиц, а состоят из протяженных двух- или трехмерных решеток атомов или ионов. Составы таких соединений обычно описываются их эмпирическими формулами. В очень распространенном случае ионных твердых веществ такая формула также выражает минимальное количество положительных и отрицательных ионов, необходимое для образования электрически нейтральной единицы, как в NaCl или CuCl9.0051 2 .
Пример \(\PageIndex{3}\): Молекулярная формула по зарядам ионов
- Напишите формулу бромида трехвалентного железа, учитывая, что ион трехвалентного железа (железо-III) представляет собой Fe 3 + , а ион брома несет один отрицательный заряд.

- Напишите формулу сульфида висмута, образующегося при соединении ионов Bi 3 + и S 2– .
Решение:
- Три рубля – ионов требуется, чтобы сбалансировать три положительных заряда Fe 3 + , отсюда и формула FeBr 3 .
- Единственный способ получить одинаковое количество противоположных зарядов — это иметь по шесть зарядов каждого, поэтому формула будет выглядеть так: Bi 2 S 3 .
О чем не говорят нам формулы
Формулы, которые мы обычно пишем, не несут никакой информации о структуре соединения , то есть о порядке, в котором атомы соединены химическими связями или расположены в трехмерном пространстве. Это ограничение особенно важно для органических соединений, в которых сотни, если не тысячи различных молекул могут иметь одну и ту же эмпирическую формулу.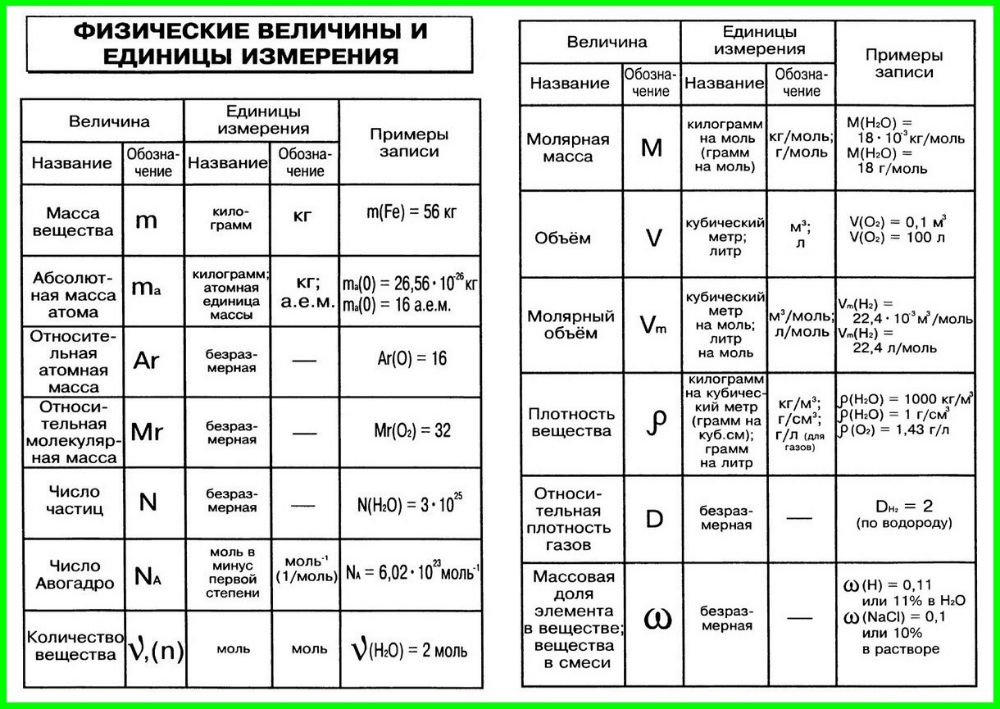 Например, и этанол, и диметиловый эфир имеют эмпирическая формула C 2 H 6 O, однако структурные формулы раскрывают очень разную природу этих двух молекул:
Например, и этанол, и диметиловый эфир имеют эмпирическая формула C 2 H 6 O, однако структурные формулы раскрывают очень разную природу этих двух молекул:
Более сложные формулы
чтобы передать хоть какую-то информацию о структуре соединения. Например, формула твердого вещества (NH 4 ) 2 CO 3 сразу идентифицируется как карбонат аммония и, по существу, представляет собой соединение ионов аммония и карбоната в соотношении 2:1, тогда как простейший или эмпирический формула N 2 H 8 CO 3 скрывает эту информацию.
Точно так же различие между этанолом и диметиловым эфиром можно провести, написав формулы как C 2 H 5 OH и CH 3 –O–CH 3 соответственно. Хотя ни одна из этих формул не определяет структуры точно, любой, кто изучал органическую химию, может их вычислить и сразу узнает группу –ОН (гидроксил), которая является определяющей характеристикой большого класса органических соединений, известных как 9. 0140 спирты . Атом –O–, связывающий два атома углерода, также является определяющей чертой простых эфиров .
0140 спирты . Атом –O–, связывающий два атома углерода, также является определяющей чертой простых эфиров .
Несколько родственных терминов используются для выражения массы одного моля вещества.
- Молекулярный вес : Аналогичен атомному весу: это относительный вес одной формульной единицы соединения, основанный на шкале углерода-12. Молекулярная масса находится путем сложения атомных масс всех атомов, присутствующих в формульной единице. Молекулярные веса, как и атомные веса, безразмерны; т. е. у них нет единиц.
- Масса формулы : То же, что и молекулярная масса. Этот термин иногда используется в связи с ионными твердыми телами и другими веществами, в которых не существует дискретных молекул.
- Молярная масса: Масса (в граммах, килограммах или любых других единицах) одного моля частиц или формульных единиц. При выражении в граммах молярная масса численно совпадает с молекулярной массой, но должна сопровождаться единицей массы.

Пример \(\PageIndex{4}\): Масса формулы и молярная масса
- Рассчитайте формулу хлорида меди(II), \(\ce{CuCl2}\).
- Как бы вы выразили это же количество как молярную массу ?
Раствор
- Атомные массы Cu и Cl соответственно 63,55 и 35,45; сумма каждого атомного веса, умноженная на количество атомов каждого вида в формуле единицы, дает: \[ 63,55 + 2(25,35) = 134,45.\]
- Массы одного моля атомов Cu и Cl равны соответственно 63,55 г и 35,45 г; масса одного моля CuCl 2 единиц: \[(63,55 г) + 2(25,35 г) = 134,45 г.\]
Интерпретация формул с точки зрения мольных отношений и мольных долей
Информацию, содержащуюся в формулах, можно использовать для сравнения составов родственных соединений, как в следующем примере:
Пример \(\PageIndex{5}\): молярное отношение расчет
Отношение водорода к углероду часто представляет интерес при сравнении различных видов топлива.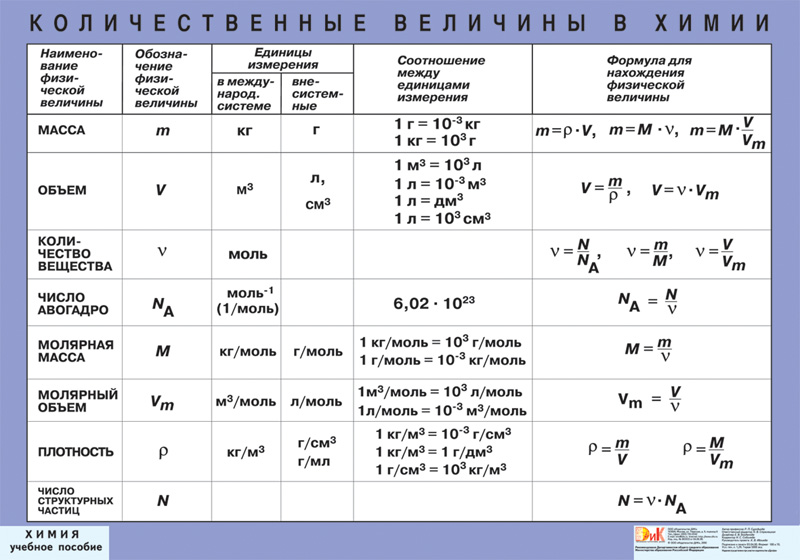 Рассчитайте эти соотношения для метанола (CH 3 OH) и этанола (C 2 H 5 OH).
Рассчитайте эти соотношения для метанола (CH 3 OH) и этанола (C 2 H 5 OH).
Раствор
Соотношение H:C для двух спиртов составляет 4:1 = 4,0 для метанола и 6:2 (3,0) для этанола.
В качестве альтернативы иногда используют мольные доли для выражения того же самого. Мольная доля элемента М в соединении — это просто число атомов М, деленное на общее число атомов в формульной единице.
Пример \(\PageIndex{6}\): мольная доля и мольный процент
Рассчитайте мольную долю и мольный процент углерода в этаноле (C 2 H 5 OH).
Раствор
Формульная единица содержит девять атомов, два из которых — углерод. Мольная доля углерода в соединении составляет 2/9 = 0,22. Таким образом, 22 процента атомов в этаноле представляют собой углерод.
Интерпретация формул с точки зрения масс элементов
Поскольку формула соединения выражает отношение числа составляющих его атомов, формула также передает информацию об относительных массах содержащихся в нем элементов.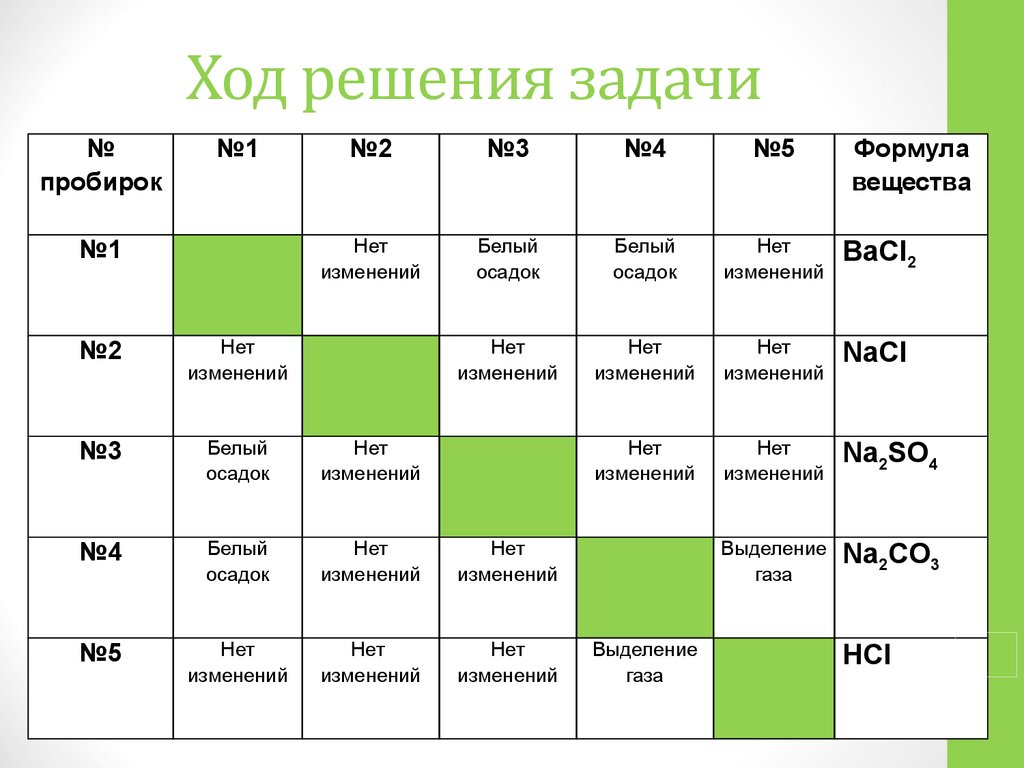 Но чтобы установить эту связь, нам нужно знать относительные массы различных элементов.
Но чтобы установить эту связь, нам нужно знать относительные массы различных элементов.
Пример \(\PageIndex{7}\): масса каждого элемента в данной массе соединения
Найдите массы углерода, водорода и кислорода в одном моле этанола (C 2 H 5 OH) .
Раствор
Используя атомные веса (молярные массы) этих трех элементов, мы имеем
- углерода: (2 моль)(12,0 г моль –1 ) = 24 г C
- водород: (6 моль)(1,01 г моль –1 ) = 6 г H
- кислород: (1 моль)(16,0 г моль –1 ) = 16 г O
Массовая доля элемента в соединении — это просто отношение массы этого элемента к массе всей формульной единицы. Массовые доли всегда находятся между 0 и 1, но часто выражаются в процентах.
Пример \(\PageIndex{8}\): Массовая доля и массовый процент элемента в соединении
Найдите массовую долю и массовый процент кислорода в этаноле (C 2 H 5 OH)
Раствор
Используя информацию, полученную в предыдущем примере, молярная масса этанола составляет (24 + 6 + 16)г моль –1 = 46 г моль –1 . Из них 16 г приходится на кислород, поэтому его массовая доля в соединении составляет (16 г)/(46 г) = 0,35, что соответствует 35%.
Из них 16 г приходится на кислород, поэтому его массовая доля в соединении составляет (16 г)/(46 г) = 0,35, что соответствует 35%.
Нахождение процентного состава соединения по его формуле является фундаментальным расчетом, которым вы должны овладеть; техника точно такая же, как показано выше. Нахождение массовой доли часто является первым шагом в решении родственных задач:
Пример \(\PageIndex{9}\): Масса элемента в заданной массе соединения
Сколько тонн калия содержится в 10 тоннах KCl?
Раствор
Массовая доля K в KCl составляет 39,1/74,6=0,524; 10 тонн KCl содержат (39,1/74,6) × 10 тонн K, или 5,24 тонны K. (Атомный вес: K = 39,1, Cl = 35,5. )
Обратите внимание, что нет необходимости явно рассматривать моли , что потребовало бы преобразования тонн в кг.
Пример \(\PageIndex{10}\): Масса соединения, содержащего заданную массу элемента
Сколько граммов KCl будет содержать 10 г калия?
Раствор
Массовое соотношение KCl/K составляет 74,6 ÷ 39,1; 10 г калия будет содержаться в (74,6/39,1) × 10 г KCl, или 19 г .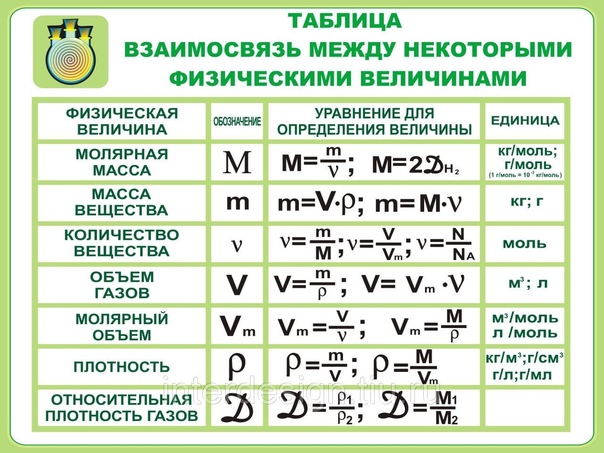
Массовые отношения двух элементов в соединении могут быть найдены непосредственно из молярных соотношений, выраженных в формулах.
Пример \(\PageIndex{11}\): Массовое соотношение элементов формулы
Расплавленный хлорид магния (MgCl 2 ) можно разложить на элементы, пропуская через него электрический ток. Сколько кг хлора выделится при образовании 2,5 кг магния? (Mg = 24,3, Cl = 35,5)
Раствор
Массовое отношение Cl/Mg составляет (35,5 × 2)/24,3 или 2,9; таким образом, на каждый кг Mg будет произведено 2,9 кг хлора, или (2,9 × 2,5) = 7,2 кг хлора на 2,5 кг Mg. (Обратите внимание, что для решения этой задачи не обязательно знать формулу элементарного хлора (Cl 2 ).)
Эмпирические формулы из экспериментальных данных
Как было объяснено выше, эмпирическая формула ( эмпирическая формула ) – это формула, в которой относительные количества различных элементов выражены в наименьших возможных целых числах. Хлорид алюминия, например, существует в виде структурных единиц, имеющих состав Al 2 Cl 6 ; эмпирическая формула этого вещества: AlCl 3 . Некоторые методы анализа предоставляют информацию об относительном количестве различных видов атомов в соединении. Процесс нахождения формулы соединения на основе анализа его состава зависит от вашей способности распознавать десятичные эквиваленты обычных целочисленных соотношений, таких как 2:3, 3:2, 4:5 и т. д.
Хлорид алюминия, например, существует в виде структурных единиц, имеющих состав Al 2 Cl 6 ; эмпирическая формула этого вещества: AlCl 3 . Некоторые методы анализа предоставляют информацию об относительном количестве различных видов атомов в соединении. Процесс нахождения формулы соединения на основе анализа его состава зависит от вашей способности распознавать десятичные эквиваленты обычных целочисленных соотношений, таких как 2:3, 3:2, 4:5 и т. д.
Пример \(\PageIndex{12}\): Эмпирическая формула из молярного отношения
Анализ соединения алюминия показал, что 1,7 моль Al соединяется с 5,1 моль хлора. Напишите эмпирическую формулу этого соединения.
Раствор
Формула Al 1,7 Cl 5,1 выражает относительное количество молей двух элементов в соединении. Его можно преобразовать в эмпирическую формулу, разделив оба нижних индекса на меньший, что даст AlCl 3 .
Чаще всего обнаруживается, что произвольная масса соединения содержит определенные массы его элементов. Их нужно преобразовать в моли, чтобы найти формулу.
Их нужно преобразовать в моли, чтобы найти формулу.
Пример \(\PageIndex{13}\): Эмпирическая формула для масс сгорания
В лабораторном эксперименте студентов было обнаружено, что 0,5684 г магния сгорают на воздухе с образованием 0,9426 г оксида магния. Найдите эмпирическую формулу этого соединения. Атомные массы: Mg = 24,305, O = 16,00.
Раствор
Выразите это соотношение как 0,375 г С на 1,00 г О.
- молей углерода: (0,375 г)/(12 г/моль) = 0,03125 моль С;
- моль кислорода: (1,00 г)/(16 г/моль) = 0,0625 моль O 90×106 мольное отношение C/O = 0,03125/0,0625 = 0,5;
это соответствует формуле C 0,5 O, которую мы выражаем целыми числами как CO 2 .
Пример \(\PageIndex{14}\): Эмпирическая формула для масс элементов
Было обнаружено, что образец соединения алюминия весом 4,67 г содержит 0,945 г Al и 3,72 г Cl. Найдите эмпирическую формулу этого соединения. Атомные массы: Al = 27,0, Cl = 35,45.
Атомные массы: Al = 27,0, Cl = 35,45.
Раствор
Образец содержит (0,945 г)/(27,0 г моль –1 ) = 0,035 моль алюминия и (3,72 г)(35,45) = 0,105 моль хлора. Формула Al .035 Cl .105 выражает относительное количество молей двух элементов в соединении. Его можно преобразовать в эмпирическую формулу, разделив оба нижних индекса на меньший, что даст AlCl 3 .
Состав бинарного (двухэлементного) соединения иногда выражается массовым отношением. Самый простой подход здесь состоит в том, чтобы рассматривать числа, выражающие отношение, как массы, таким образом превращая задачу в вид, описанный непосредственно выше.
Пример \(\PageIndex{15}\): Эмпирическая формула из отношения масс элементов
Соединение, состоящее только из углерода и кислорода, содержит эти два элемента в массовом отношении C:H, равном 0,375. Найдите эмпирическую формулу.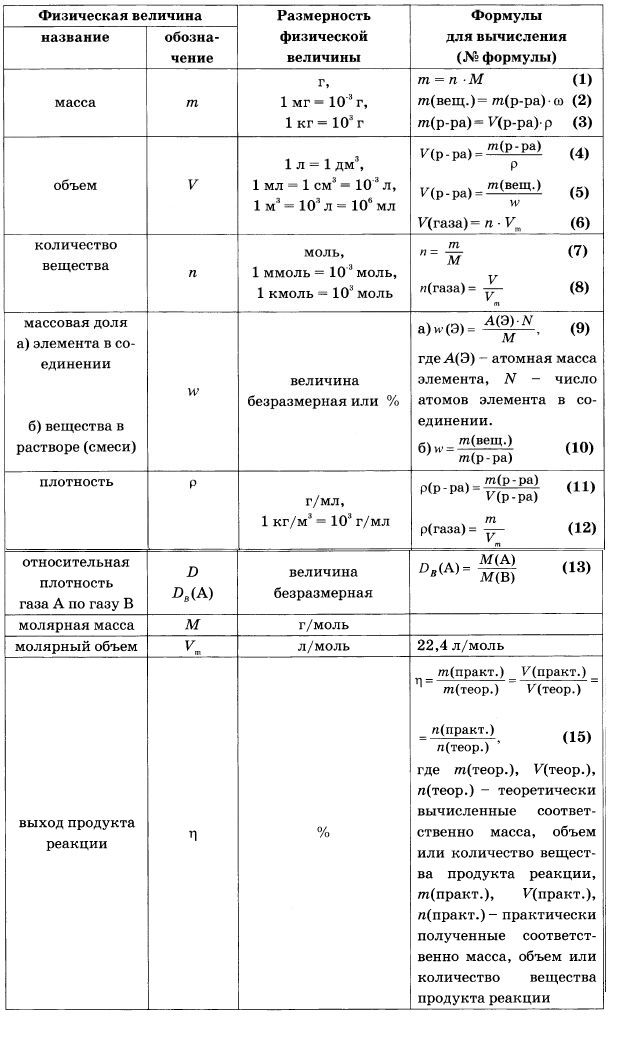
Раствор
Выразите это соотношение как 0,375 г C на 1,00 г O.
- молей углерода: (0,375 г)/(12 г/моль) = 0,03125 моль C;
- моль кислорода: (1,00 г)/(16 г/моль) = 0,0625 моль O молярное отношение С/О 90×106 = 0,03125/0,0625 = 0,5;
это соответствует формуле C 0,5 O, которую мы выражаем целыми числами как CO 2 .
Массовый состав соединения чаще всего выражается в весовых процентах (граммы на 100 граммов соединения). Первым шагом снова является преобразование их в относительные количества молей каждого элемента в фиксированной массе соединения. Хотя эта фиксированная масса совершенно произвольна (в 100 граммах нет ничего особенного!), отношения молярных количеств различных элементов не произвольны: эти отношения должны быть выражены целыми числами, поскольку они представляют отношения целых чисел атомов.
Пример \(\PageIndex{16}\)
: Эмпирическая формула из состава в процентах по массе Найдите эмпирическую формулу соединения, имеющего следующий состав в процентах по массе. В скобках указаны атомные массы: 36,4 % Mn (54,9), 21,2 % S (32,06), 42,4 % O (16,0)
В скобках указаны атомные массы: 36,4 % Mn (54,9), 21,2 % S (32,06), 42,4 % O (16,0)
Раствор
100 г этого соединения содержит:
- Mn: (36,4 г) / (54,9 г моль –1 ) = 0,663 моль
- S: (21,2 г) / (32,06 г моль –1 ) = 0,660 моль
- O: (42,4 г) / (16,0 г моль –1 ) = 2,65 моль
Формула Mn .663 S .660 O 2,65 выражает относительное количество молей трех элементов в соединении. Его можно преобразовать в эмпирическую формулу, разделив все индексы на наименьший, что даст Mn 1.00 S 1.00 O 4.01 который мы записываем как MnSO 4 .
Примечание: так как экспериментально определенные массы подвержены небольшим ошибкам, обычно необходимо пренебречь небольшими отклонениями от целых значений.
Пример \(\PageIndex{17}\): Эмпирическая формула из состава в процентах по массе
Найдите эмпирическую формулу соединения, имеющего следующий состав в процентах по массе.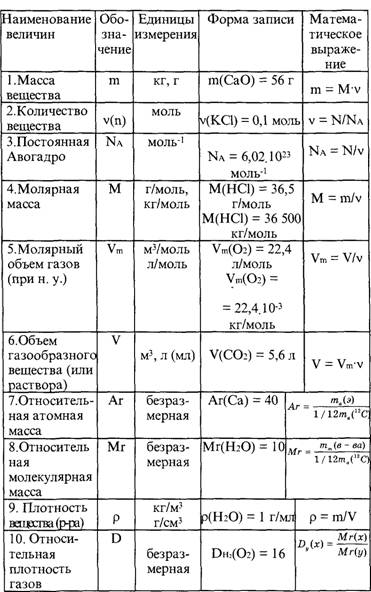 В скобках указаны атомные массы: 27,6 % Mn (54,9), 24,2 % S (32,06), 48,2 % O (16,0).
В скобках указаны атомные массы: 27,6 % Mn (54,9), 24,2 % S (32,06), 48,2 % O (16,0).
Решение
Предварительная формула, основанная на 100 г этого соединения, может быть записана как
или
MN .503 S .754 O 3,01
Дирация на Ship MAND Shipcript Shipcript 10052
Дирация на малой. S 1,5 O 6 . Изучение этой формулы показывает, что умножение каждого нижнего индекса на 2 дает полностью целочисленную формулу Mn 2 S 3 O 12 .
Заметки об экспериментальных методах
Одна из самых фундаментальных операций в химии состоит в разложении соединения на его элементы (процесс, известный как анализ ) и последующем определении эмпирической формулы из относительных количеств каждого вида присутствующих атомов в соединении. Только в очень немногих случаях целесообразно проводить такой процесс напрямую: так, нагревание сульфида ртути(II) приводит к его прямому разложению:
\[\ce{2 HgS -> 2Hg + O2}. \]
\]
Аналогично, при электролизе воды образуются газы H 2 и O 2 в объемном соотношении 2:1.
Однако большинство элементных анализов необходимо проводить косвенно. Наиболее широко из этих методов традиционно применялся анализ сжигания органических соединений. Неизвестный углеводород C a H b O c можно охарактеризовать, нагревая его в токе кислорода так, чтобы он полностью разложился на газообразный CO 2 и H 2 O. Эти газы пропускаются через трубки, содержащие вещества, которые избирательно поглощают каждый газ. Путем тщательного взвешивания каждой трубки до и после процесса сжигания можно рассчитать значения a и b для углерода и водорода соответственно. Нижний индекс c для кислорода находится путем вычитания расчетных масс углерода и водорода из массы исходного образца.
С 1970-х годов стало возможным проводить анализ горения с помощью автоматизированного оборудования. Этот также может определять азот и серу:
Этот также может определять азот и серу:
Измерения массы или веса долгое время были основным инструментом для количественного понимания химических изменений. Весы и весы использовались в коммерческих и фармацевтических целях с самого начала письменной истории, но этим устройствам не хватало точности 0,001 г, необходимой для количественной химии и элементного анализа, проводимого в лабораторных масштабах.
Только в середине 18 века шотландский химик Джозеф Блэк изобрел равноплечие аналитические весы . Ключевой особенностью этого изобретения была легкая жесткая балка, поддерживаемая остроконечной точкой опоры; дополнительные лезвия ножей поддерживали чаши для взвешивания. Края ножа значительно уменьшили трение, которое ограничивало чувствительность предыдущих конструкций; не случайно примерно в это время начались точные измерения комбинирования весов и атомных весов.
Аналитические весы заключены в стеклянный корпус, чтобы избежать помех от потоков воздуха, а калиброванные гири берутся с помощью щипцов, чтобы предотвратить впитывание влаги или масел с голых пальцев.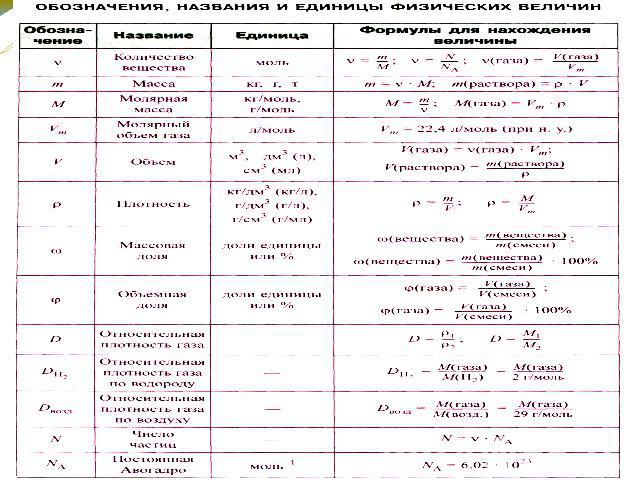
Любой, кто изучал общую химию в колледже в 1960-х годах, помнит обучение (и утомление), связанное с этими устройствами. Они могут считывать прямо до 1 миллиграмма и позволяют оценивать до ± 0,1 мг. Более поздние технические усовершенствования добавили магнитное демпфирование качания балки, панорамные тормоза и встроенные наборы грузов, управляемые ручками. Самые лучшие весы исследовательского класса достигли точности 0,001 мг.
Начиная с 1970-х годов широкое распространение получили электронные весы , особенно популярны одночашечные весы. Одночашечные весы избавляют от необходимости сравнивать вес образца с весом калиброванных гирь. Добавление образца в кювету вызывает смещение на нагрузка ячейка , которая создает компенсирующее электромагнитное поле достаточной величины, чтобы поднять поддон в исходное положение. Ток, необходимый для этого, измеряется и преобразуется в измерение веса. Лучшие электронные весы исследовательского класса могут показывать до 1 микрограмма, но чувствительность 0,1 мг более распространена для использования в студенческих лабораториях.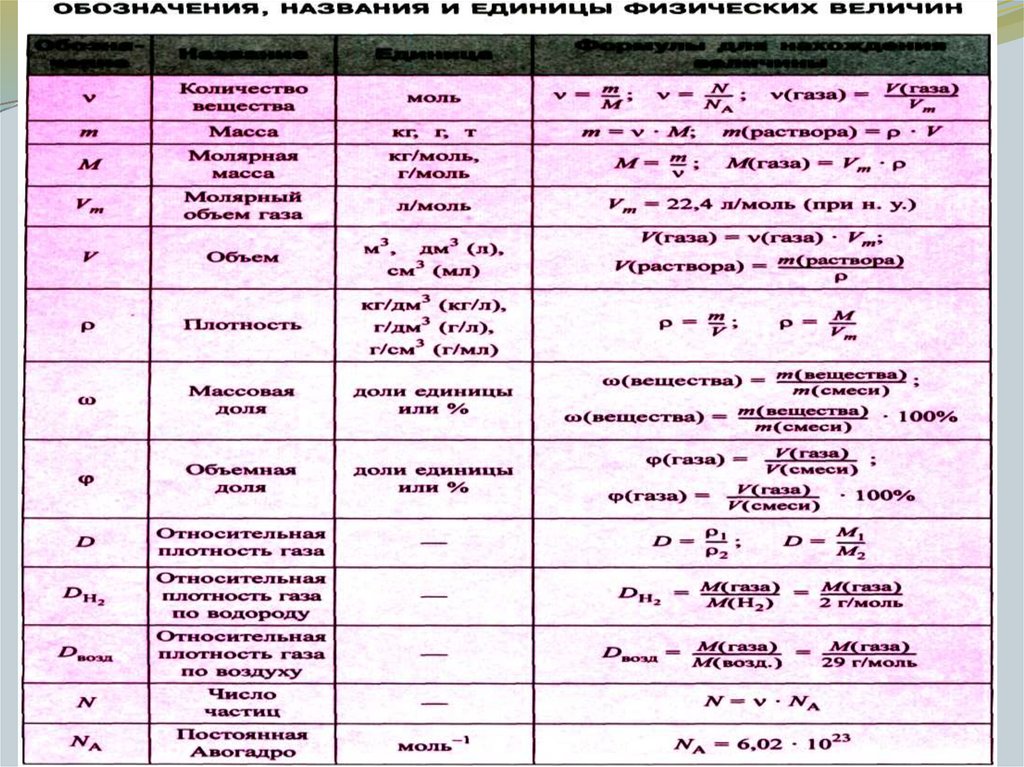
Эта страница под названием 4.3: Формулы и их значение распространяется под лицензией CC BY 3.0 и была создана, изменена и/или курирована Стивеном Лоуэром с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Стивен Лоуэр
- Лицензия
- СС BY
- Версия лицензии
- 3,0
- Показать страницу TOC
- нет на стр.




 .
.