Органическая химия в схемах и таблицах
Справочное пособие предназначено учащимся общеобразовательных школ. В наглядных таблицах и схемах изложен материал школьной программы по органической химии, который можно использовать для подготовки к урокам, контрольным и самостоятельным работам.А также для абитуриентов при подготовке к экзаменам.
Теория химического строения органических веществ А.М. Бутлерова
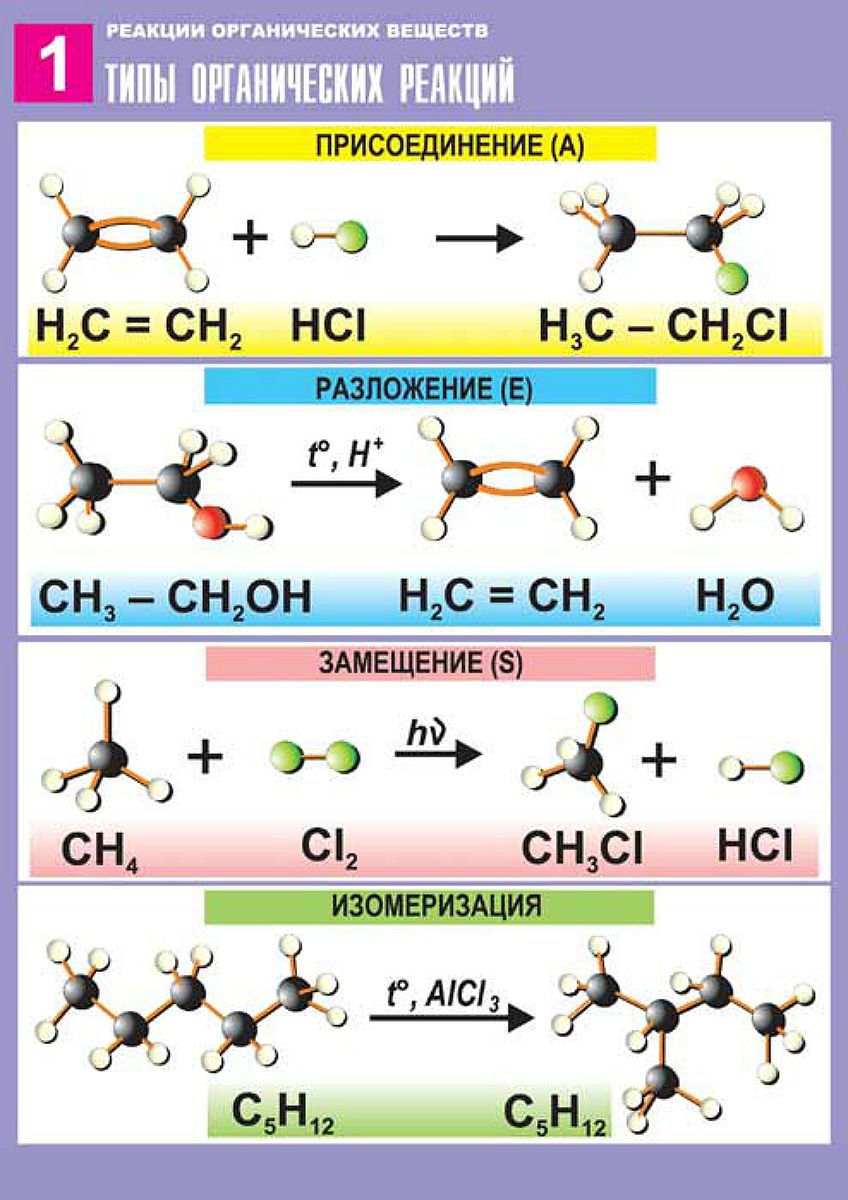
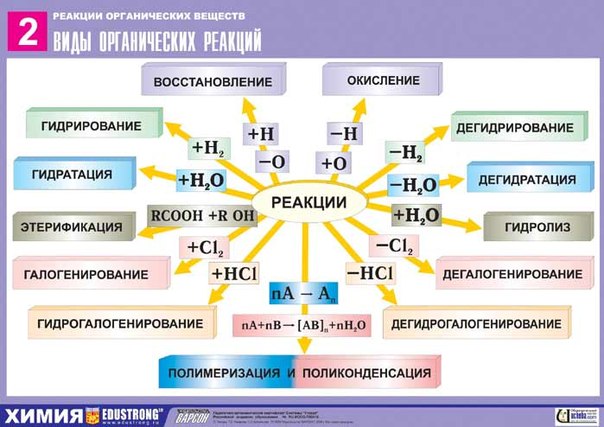
Типы химических реакций в органической химии
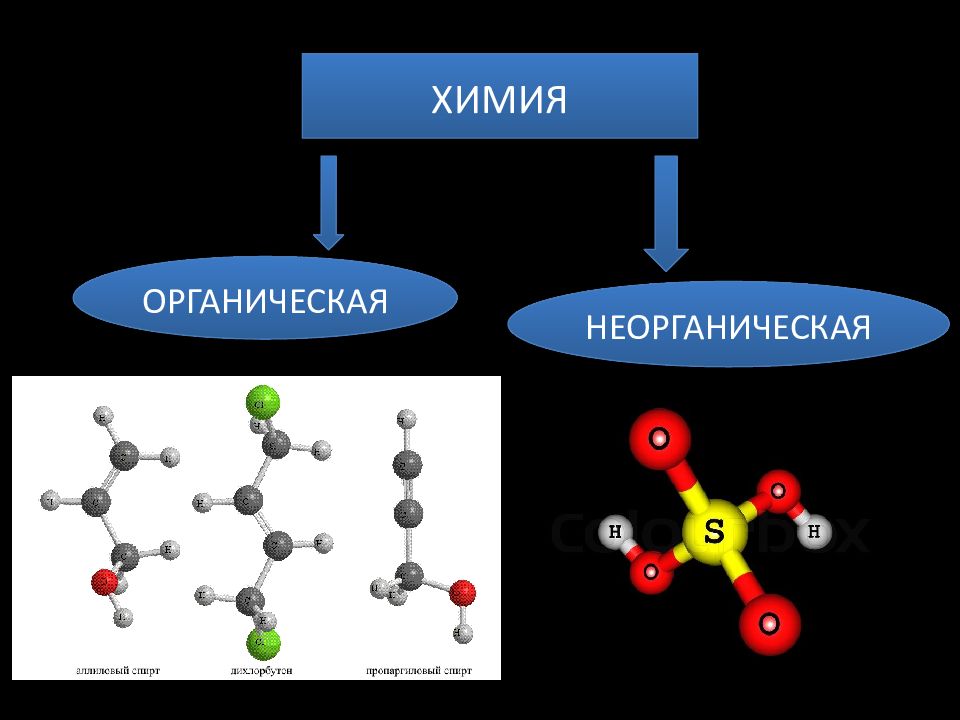
Органические вещества
Классификация органических веществ
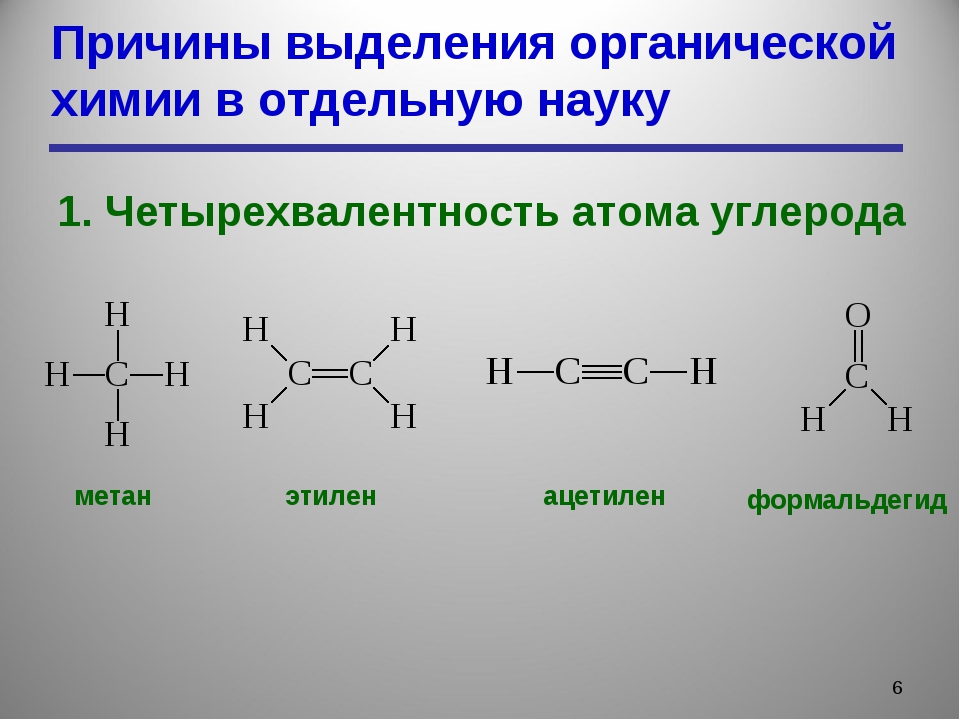
Валентные состояния атома углерода
Изомерия органических веществ
Природные источники углеводородов
Алканы. Химические свойства. Получение. Применение
Алканы. Номенклатура. Изомерия. Физические свойства
Алкены. Номенклатура. Изомерия.
Алкены.
Алкины. Номенклатура. Изомерия
Алкины. Химические свойства. Получение. Применение
Алкадиены. Классификация. Номенклатура. Изомерия
Алкадиены. Химические свойства. Получение. Применение
Арены
Толуол
Спирты. Номенклатура. Классификация. Изомерия
Спирты. Физические и химические свойства. Получение Применение
Фенолы
Альдегиды
Карбоновые кислоты. Номенклатура. Классификация. Изомерия. Физические свойства
Карбоновые кислоты. Химические свойства. Получение. Применение
Сложные эфиры. Жиры
Углеводы
Моносахариды
Полисахариды
Амины
Аминокислоты
Белки
Нуклеиновые кислоты
Полимеры
По материалам учебного пособия авторов-составителей: Коноплева О.
Теория и практика по химии
В этой статье собраны ссылки на самые важные материалы.
При проверке тестов не забывайте заглядывать в комментарии к постам: там можно найти ответы на интересные вопросы или информацию об опечатках, если они были.
Хэштеги
#vopros_1_ege@chem4you и #vopros_1_ege@chem4you— теория и практика к №1 ЕГЭ
#vopros_2_ege_Dacuk_Stepenin и #vopros_2_ege@chem4you— теория и практика к №2 ЕГЭ
#vopros_3_ege_Dacuk_Stepenin — теория и практика к №3 ЕГЭ
#vopros_4_ege_Dacuk_Stepenin — теория и практика к №4 ЕГЭ
#vopros_5_ege_Dacuk_Stepenin — теория и практика к №5 ЕГЭ
#vopros_6_ege_Dacuk_Stepenin — теория и практика к №6 ЕГЭ
#vopros_7_ege_Dacuk_Stepenin — теория и практика к №7 ЕГЭ
#vopros_10_ege_Dacuk_Stepenin — теория и практика к №10 ЕГЭ
#vopros_19_ege_Dacuk_Stepenin — теория и практика к №19 ЕГЭ
#vopros_25_ege_Dacuk_Stepenin — теория и практика к №25 ЕГЭ
#vopros_27_ege_Dacuk_Stepenin — задачи №27
#vopros_28_ege_Dacuk_Stepenin — задачи №28
#vopros_29_ege_Dacuk_Stepenin — задачи №29
#vopros_30_ege_Dacuk_Stepenin — теория и практика к №30 ЕГЭ
#vopros_31_ege_Dacuk_Stepenin — теория и практика к №31 ЕГЭ
#task@chem4you — задания-опросы на разные темы
#neorg_Dacuk_Stepenin — полезности по неорганике
#test_Dacuk_Stepenin — подборки тестов
#infographic_Dacuk_Stepenin — схемы и иллюстрации
Тренировочные варианты ЕГЭ
В 2019/2020 году тренировочные варианты выходят раз в две недели.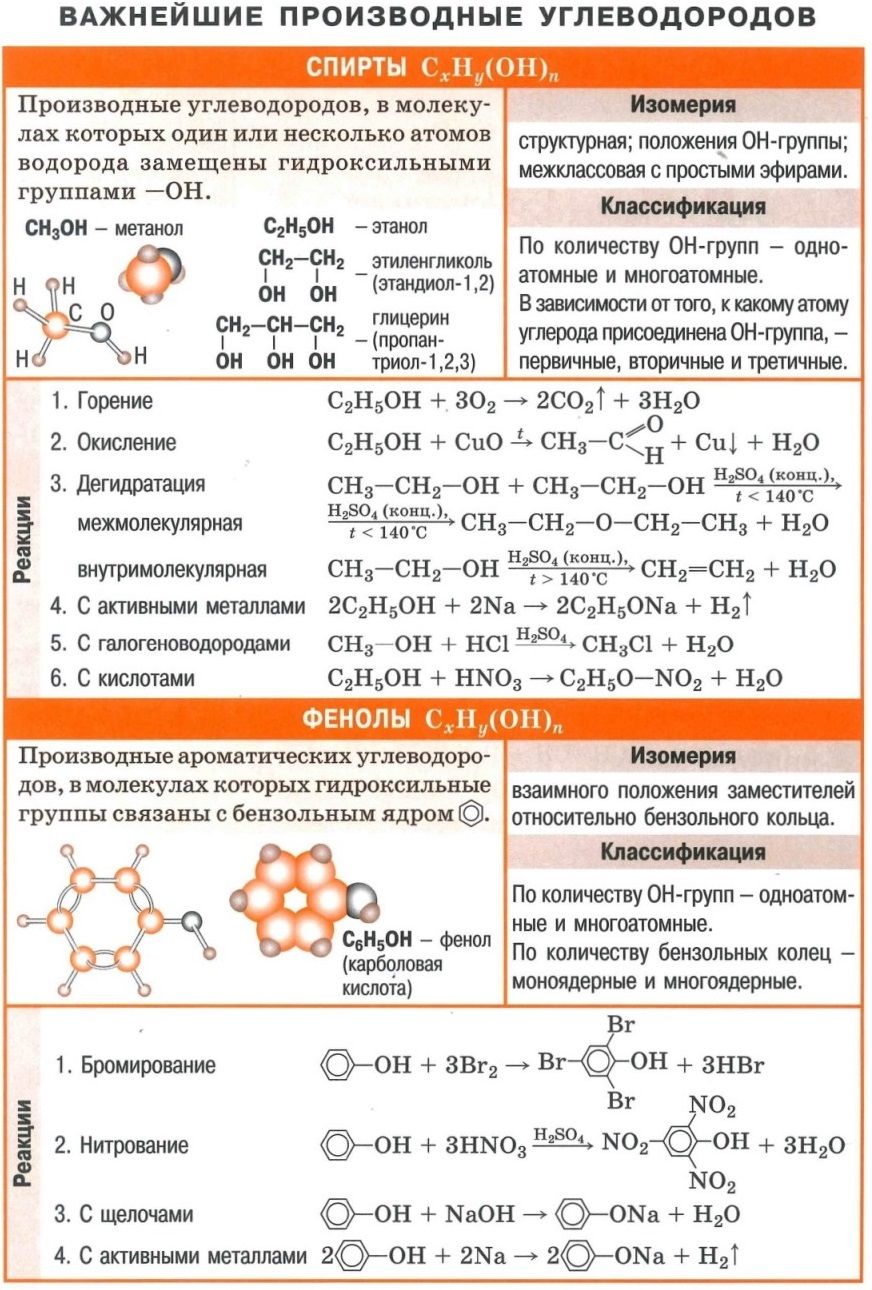 По средам выкладываем задания, по субботам — ответы.
По средам выкладываем задания, по субботам — ответы.
2020 — #kim2020@chem4you
2019 — https://vk.com/topic-52582503_39485203
34 задача ЕГЭ
ОВР-МАРАФОН
- Видео + тесты «Степень окисления»
35 задача ЕГЭ
Сказка про медведей, которые формулу выводили — https://vk.com/wall-52582503_669
Тренируем округления — https://vk.com/wall-52582503_684
Просто подборка — https://vk.com/wall-52582503_945
Задачи с азотом — https://vk.com/wall-52582503_959
Полимеры и мономеры — https://vk.com/wall-52582503_1219
Свойства основных классов веществ
Кислые и основные соли — https://vk.com/wall-52582503_3338
Тренажер «Свойства кислот, получение солей» — https://vk.com/wall-52582503_2723
Всякое полезное
Допущения на ЕГЭ — https://vk.com/wall-52582503_3304
Ошибки во втором задании ЕГЭ — https://vk.
Коварный иодоводород — https://vk.com/wall-52582503_2879
Чего нет в таблице растворимости: Cu(+) — https://vk.com/wall-52582503_3499
Суровые сульфиды — https://vk.com/wall-52582503_3368
Соответствие кислотный оксид — кислота — https://vk.com/wall-52582503_3568
Шпаргалка по металлам — https://vk.com/wall-52582503_3442
Реакция Вюрца — https://vk.com/wall-52582503_3591
Шпаргалка по пероксидам — https://vk.com/wall-52582503_3655
Реакции декарбоксилирования — https://vk.com/wall-52582503_3675
Важное про оформление и задания ЕГЭ — https://vk.com/@chem4you-faq-ege
Шпаргалка по циклоалканам — https://vk.com/wall-52582503_3697
Опасные места в таблице растворимости -https://vk.com/wall-52582503_3622
Качественная реакция на галогенсодержащую органику — https://vk.com/wall-52582503_3942
Растворение и среда раствора — https://vk. com/wall-52582503_4091
com/wall-52582503_4091
Гидроксид меди (II) и органика — https://vk.com/wall-52582503_3815
Сила кислот — https://vk.com/wall-52582503_3750
Гидролиз в органике — https://vk.com/wall-52582503_4281
Расстановка коэффициентов в реакции горения — https://vk.com/wall-52582503_4106
Откуда взялись гомологические формулы — https://vk.com/wall-52582503_4124
ОВР в органике в нейтральной среде — https://vk.com/wall-52582503_4222
Базовые задачи
Массовая доля элемента в веществе, часть 1 — https://vk.com/wall-52582503_15
Массовая доля элемента в веществе, часть 2 — https://vk.com/wall-52582503_16
Массовая доля вещества в растворе — https://vk.com/wall-52582503_18
Задачи на избыток и недостаток — https://vk.com/wall-52582503_70
Тесты по органике
Алканы, алкены, циклы, диены, алкины — https://vk. com/wall-52582503_3897
com/wall-52582503_3897
Арены — https://vk.com/wall-52582503_4048
Спирты, фенолы — https://vk.com/wall-52582503_4297
Альдегиды, кетоны — https://vk.com/wall-52582503_4534
Карбоновые кислоты, сложные эфиры — https://vk.com/wall-52582503_5271
Химия элементов
Таблица по свойствам неметаллов — https://vk.com/wall-52582503_2685
Современная органическая химия – Справочник химика 21
В первой части учебного пособия обосновывается предлагаемая структура изложения учебного материала курса. Систематически изложены основы современной органической химии (указанные разделы), рассмотрены органические соединения, их свойства, реакции с привлечением необходимых теоретических представлений, достаточных для понимания химизмов и механизмов органических реакций.Сфера влияния современной органической химии чрезвычайно широка и простирается от крупнотоннажных производств метанола и полимеров до синтеза витаминов, биополимеров, генов и других сложнейших биологических систем.
 При этом проникновение ее в смежные области науки и практики — материаловедение, биологию, медицину, сельское хозяйство — постоянно углубляется.
При этом проникновение ее в смежные области науки и практики — материаловедение, биологию, медицину, сельское хозяйство — постоянно углубляется. Огромное влияние на формирование правильных представлений о природе химической валентности и химическом строении вещества оказали работы Александра Михайловича Бутлерова (1828— 1886). Он является создателем теории химического строения (1861), на основе которой развилась современная органическая химия. Эта теория позволяет установить взаимное влияние атомов в молекуле, в том числе и тех, которые связаны между собой не непосредственно, а через другие атомы. [c.16]
Развитие электронных представлений о строении атома и молекулы (начало XX в. Н. Бор, В. Коссель, Г. Льюис) привело к поискам решения этой проблемы на электронном уровне, а разработка в 30-х годах основ квантовой механики (В. Гейзенберг, Э. Шредингер, Э. Хюккель) послужила толчком для развития в теории строения и реакционной способности качественно нового метода — метода молекулярных орбиталей.
В современной органической химии все более широкое применение находят соотношения, которые устанавливают связь между строением органических соединений, с одной стороны, и их реакционной способностью и физическими характеристиками —с другой. Определение форм таких соотношений, области действия и методов применения было и остается одной из важнейших проблем теоретической органической химии. [c.165]
В результате использования данного метода сформировались три понятия, имеющие большое значение в современной органической химии,— представления о порядке связи, о г -электронном заряде и свободной валентности. Сейчас мы в самых общих чертах охарактеризуем эти понятия и покажем их применимость строгая формулировка будет дана ниже, после изложения существа метода. [c.193]
Конечно, нельзя игнорировать тот факт, что структурные теории в XIX в. стали фундаментом почти всего здания современной органической химии, ибо именно они через разработанный на их основе препаративный органический синтез обеспечили получение научной информации о сотнях тысяч (а в XX в. [c.105]
стали фундаментом почти всего здания современной органической химии, ибо именно они через разработанный на их основе препаративный органический синтез обеспечили получение научной информации о сотнях тысяч (а в XX в. [c.105]
Книга написана так, чтобы, насколько это возможно, дать читателю объективное представление о современной органической химии и ее применениях—быть может, в очень упрощенной форме. Читатель постепенно знакомится с основными общими закономерностями органической химии, с реакциями отдельных групп соединений, природными соединениями, основами промышленного производства важнейших органических веществ и с применениями органической химии в повседневной жизни, в том числе и с потенциальными опасностями, которые таят в себе органические соединения. [c.6]
Другая важная черта развития современной органической химии — расширяющееся применение достижений электроники, прежде всего микропроцессорной техники, что позволяет как миниатюризировать различные устройства и аппараты и автоматизировать процессы, так и организовать хранение разнообразной информации (например, литературных данных или спектров) с возможностью мгновенного доступа к ней. Были также разработаны программы для определения оптимальных путей синтеза органических соединений. [c.13]
Были также разработаны программы для определения оптимальных путей синтеза органических соединений. [c.13]
Конформационные представления — важнейшая часть теоретического фундамента современной органической химии. С учетом конформации строятся, например, все объяснения механизмов реакций органических веществ. [c.72]
Кроме приведенной выше классификации, в современной органической химии появилась возможность классифицировать органические реакции также по их механизмам, т, е. по скрытым от непосредственного наблюдения деталям химического превращения, по способам образования и разрыва химических связей. Изучение механизмов реакций — одна из быстро развивающихся ветвей теоретической органической химии. Понимание механизма реакции вместе с тем важно и для успешного ее практического осуществления в лаборатории и в промышленности. [c.88]
Изложенные в данной главе теоретические положения современной органической химии должны помочь значительно глубже понять протекание многих органических реакций, рассматривать целые группы их с общей точки зрения. Подобно тому как понятие гомологического ряда позволяет заменить изучение большого числа индивидуальных соединений знакомством со свойствами всего гомологического ряда в целом, так современная теория органических реакций позволяет подходить к ним не как к набору случайных превращений, а как к стройной системе, в которой имеются строгие закономерности. [c.91]
Подобно тому как понятие гомологического ряда позволяет заменить изучение большого числа индивидуальных соединений знакомством со свойствами всего гомологического ряда в целом, так современная теория органических реакций позволяет подходить к ним не как к набору случайных превращений, а как к стройной системе, в которой имеются строгие закономерности. [c.91]
Оставаясь в основе своей химией синтетической, создающей, органическая химия наших дней приобрела также и новые черты, отличающие ее от классической органической химии конца XIX — начала XX в. Задумываясь над вопросом о главной характерной черте современной органической химии, невозможно ограничиться указанием какого-то одного признака. По крайней мере пять фак торов создают ее современное лицо [c.363]
Для современной органической химии характерны такие особенности, как, во-первых, непрерывный и прогрессируюп1ий рост фактического материала (синтез новых соедииений, открытие новых типов соединений) во-вторых, бурное развитие теории, дающее возможность понимать и предсказывать свойства органических соединений. В современной органической химии широко используются физические методы исс 1едованкя, позволяющие проникать в детали структуры соединений и хода реакций. Характерно также развитие связей органической химии со смежными областями химии, а также с биологией. Успехи органической химии дали возможность расширить прикладную iopony этой науки, что привело к росту обТ)Сма соответствующих производств и к проникновению синтетических органических ве цеств в различные отрасли промышленности, сельского хозяйства и медицины. [c.141]
В современной органической химии широко используются физические методы исс 1едованкя, позволяющие проникать в детали структуры соединений и хода реакций. Характерно также развитие связей органической химии со смежными областями химии, а также с биологией. Успехи органической химии дали возможность расширить прикладную iopony этой науки, что привело к росту обТ)Сма соответствующих производств и к проникновению синтетических органических ве цеств в различные отрасли промышленности, сельского хозяйства и медицины. [c.141]
Изложенные авторами материалы, посвященные гид-рогенизационным процессам, обработаны с теоретических позиций современной органической химии, химической технологии, прикладной макрокинетики и химической термодинамики. В предлагаемой монографии рассмотрены химическая термодинамика и превращение углеводородов при гидрогенизационной переработке нефтяного сырья. Описаны катализаторы и способы их производства, получение водорода, технологические основы ведения гидрогенизационных процессов и, наконец, наиболее важные их варианты гидроочистка, гидрокрекинг, гидродеалкилирование, гидрирование и гидроизомеризация. Специальная глава посвящена перспективам дальнейшего промышленного применения гидрогенизации в нефтепереработке. [c.5]
Специальная глава посвящена перспективам дальнейшего промышленного применения гидрогенизации в нефтепереработке. [c.5]
Сложность состава и строения нефтяных углеводородов требует от исследователей, работающих в этой области, глубоких современных знаний вопросов стереохимии и конформациопного анализа циклических соединений. Столь же необходимо умение разбираться в сложных вопросах термодинамической и кинетической реакционной способности углеводородов. Надо иметь в виду, что только высокий научный уровень исследований, базирующийся на использовании всех достижений современной органической химии, позволил добиться больших успехов в изучении различных природных объектов. Столь же высокий научный уровень необходим, очевидно, и для исследования химии нефти. Предлагаемая монография разбита фактически на две части. Первая из них (главы 1—6) посвящена описанию свойств индивидуальных углеводородов, вторая часть (главы 7 и 8) — исследованию нефтяных углеводородов. Впрочем, оба эти вопроса так тесно между собой связаны, что автор предпочел не проводить формального разделения монографии па части. [c.4]
[c.4]
Однако, несмотря на ишрокую известность и несомненную общность, эти реакции (за исключением присоединения брома) в своем классическом виде не вошли в арсенал методов современной органической химии по очень простой причине — им не хватало именно чистоты. Так, например, даже простейшая реа1 ция гидратации — присоединение воды к этилену в присутствии серной кислоты — приводит к образованию пе только этилового спирта, но и диэтилового эфира, этилсульфата и ряда других продуктов. [c.63]
В соответствии с оригинальным названислг содержит исчерпывающие обзоры по основным вопросам органической химии, включая, разумеется, с иптетические методы и их использование в полных синтезах, В книге удачно подобрана библиография, состоящая в основном из нове11ших обзорных работ. Это подлинная энциклопедия современной органической химии. [c.300]
Как отмечают сами авторы, книга посвящена обсунадению лишь отдельных аспектов биоорганической химии. Однако рассмотренные проблемы анализируются достаточно глубоко и детально, давая представление о границах и возможностях современной органической химии при изучении биологических процессов и биоактивных молекул. [c.6]
Однако рассмотренные проблемы анализируются достаточно глубоко и детально, давая представление о границах и возможностях современной органической химии при изучении биологических процессов и биоактивных молекул. [c.6]
Обогащенная теоретическими представлениями, современная органическая химия выступает как логическая система экспериментально обоснованных фундаментальных знаний. По этой причине понятна т трудность, которая стояла перед автором, стремившимся в небольшом по объему учебном пособии изложить содержание основных разделоЕ органической химии в доступной, но научно аргументированной форме. [c.9]
Развитие современной органической химии немыслимо без использования новейших физических методов, позволяющих исследовать структуру индивидуальных веществ и состав сложных многокомпонентных смесей. Только с помощью этих методов возможно решить одну из основных задач органической химии установить количественную зависимость между структурой вещества и его реакционной способностью, что позволяет не только объяснить, но и предсказывать разнообразные свойства органических веществ. Поэтому, несмотря на сложность, высокую стоимость и все еще недостаточную надежность, физические приборы играют все большую роль в исследованиях химика-органлка и часто только применение их обеспечивает успешное решение поставленной проблемы. [c.3]
Поэтому, несмотря на сложность, высокую стоимость и все еще недостаточную надежность, физические приборы играют все большую роль в исследованиях химика-органлка и часто только применение их обеспечивает успешное решение поставленной проблемы. [c.3]
Химическая связь в ферроцене между двумя пентадентатными лигандами и атомом железа осуществляется за счет того, что тг-электроны лигандов (по 5 от каждого лиганда) и 8 валентных электронов атома железа заполняют связывающие и несвязывающие МО комплекса, обеспечивая его устойчивость. Хром имеет на два ва тентных электрона меньше, поэтому необходимые 18 суммарных электронов для заполнения МО в соответствующем комплексе хрома достигаются, если в качестве лигандов взять бензольные кольца. Дибензолхром (СбНб)2Сг так же, как и ферроцен, относится к тт-комплексам, называемым ио причине участия в образовании комплекса лигандов с тг-электронными системами, О важности таких соединений говорит то, что большую часть современной органической химии переходных элементов составляет химия тг-комплексов. [c.369]
[c.369]
Для современной органической химии при решении структурных проблем все большее значение приобретают физические методы исследования. Теплоты сгорания, парахор, дипольные моменты, изучение кинетики, магнитная проницаемость, метод меченых атомов, константы хроматографии и электрофореза, скорость осаждения при центрифугировании, люминесцентный анализ, нефелометрия, по-ляриметрия, масс-спектроскопия, рентгеноструктурный анализ, но особенно, — спектроскопия в видимой, инфракрасной, ультрафиолетовой областях, изучение спектров электронного парамагнитного и ядернОго магнитного резонанса открыли необыкновенно широкие возможности для решения задач установления строения молекул. Физические исследования все чаще оказываются решающими для понимания структуры соединения. [c.19]
В современной органической химии наряду с собственно химическими методами — анализом и синтезом — находят широкое применение физические и физико-химические методы исследованпя.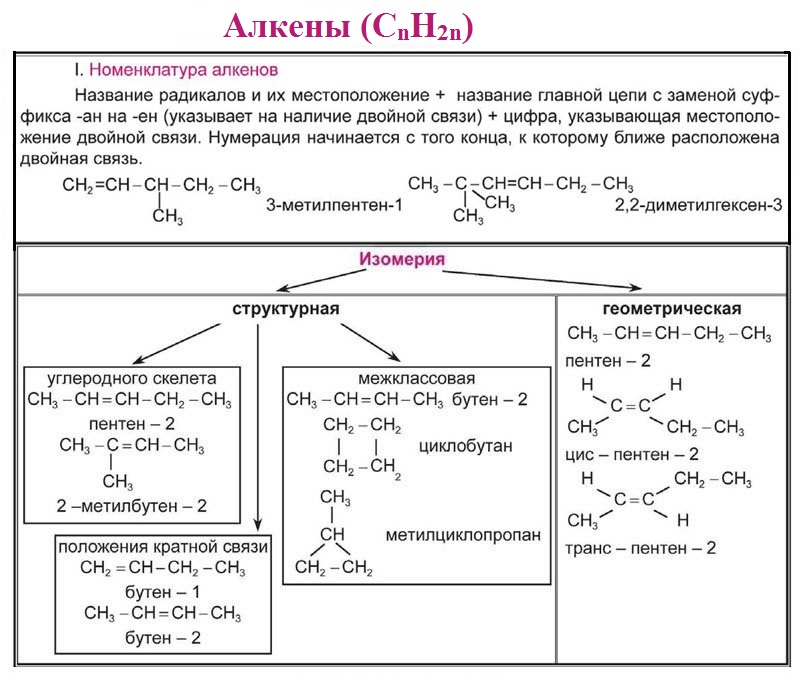 Они применяются как для очистки веществ, так и для определения их строения. Многие задачи органической химии, требовавшие от ученых прошлого столетия длительной, кропотливой работы, могут быть решены современными методами в короткий срок, с минимальным количеством вещества. [c.354]
Они применяются как для очистки веществ, так и для определения их строения. Многие задачи органической химии, требовавшие от ученых прошлого столетия длительной, кропотливой работы, могут быть решены современными методами в короткий срок, с минимальным количеством вещества. [c.354]
Вся совокупность современных физико-химических методов позволяет получить точные количественные данные, характеризующие как молекулу в целом, так и отдельные связи в молекуле. Эти экспериментальные данные служат для химика-органика основой при создании теоретических представлений о строении веществ, о механизмах реакций. Поэтому при изложении современной органической химии ннкак нельзя обойтись без создания понятия об этой стороне исследований, для того чтобы в самом общем виде показать возможности применения физико-химических и физических методов, указать на получаемую этими методами информацию. [c.362]
Алканы, подготовка к ЕГЭ по химии
Органическая химия
Мы приступаем к новому разделу – органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ;)
В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы
Алканы (парафины) – насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями – содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда – CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen – имя + calare – созывать) – совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса “ан”: метан, этан, пропан, бутан и т.д.
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos -
соответственный).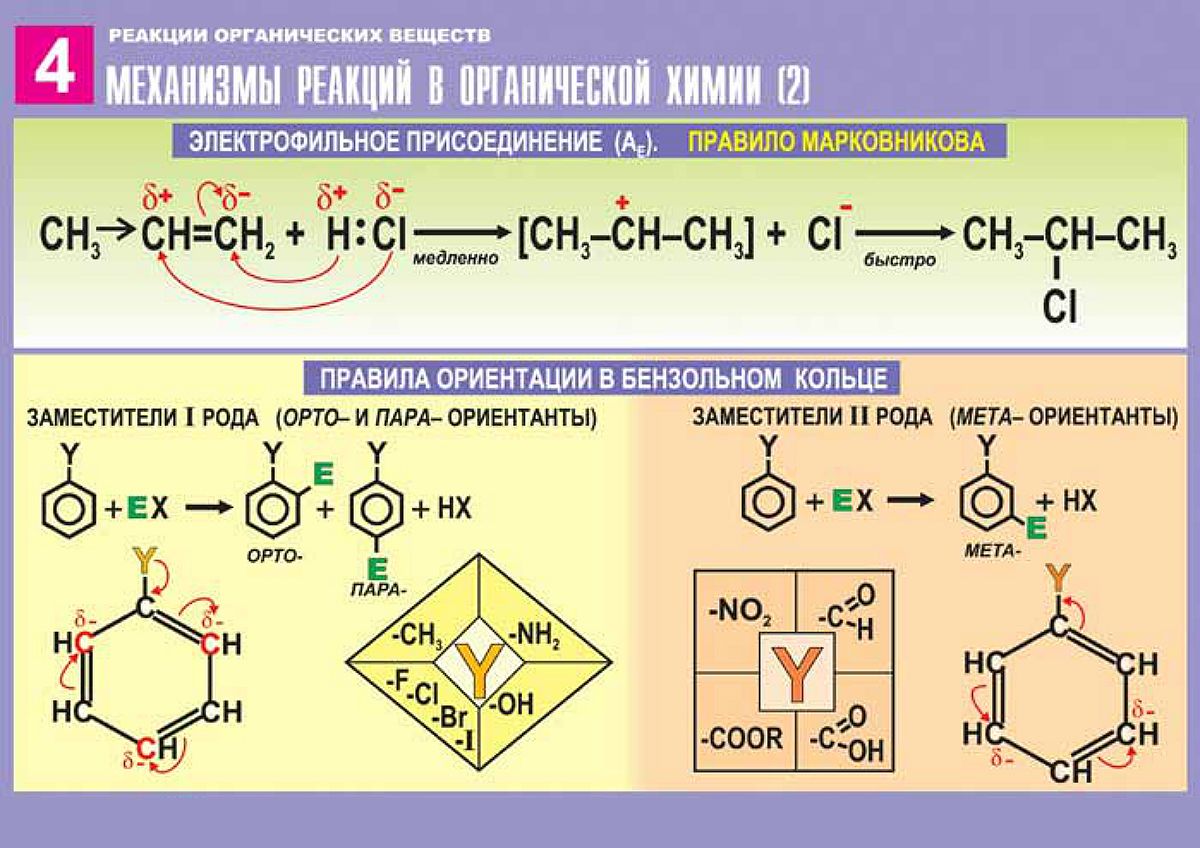
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.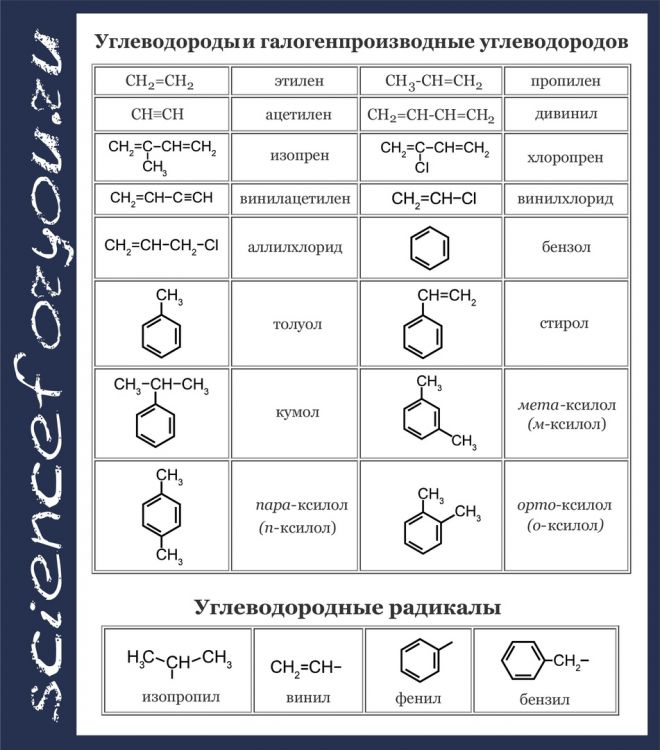
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерами (греч. isomeros – составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.
Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.
Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода – sp3
- Валентный угол (между химическими связями) составляет 109°28′
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем
крекинга из нефти получают алканы.
Путем
крекинга из нефти получают алканы.
Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Гриньяра
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы – насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Пиролиз
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее – у вторичного и значительно труднее – у первичного.
Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее – у вторичного и значительно труднее – у первичного.
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту – HNO3 – можно представить как HO-NO2.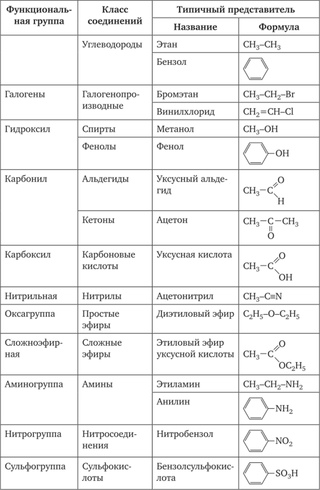
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)
Пиролиз (греч. πῦρ – огонь + λύσις – разложение) – термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения – в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат.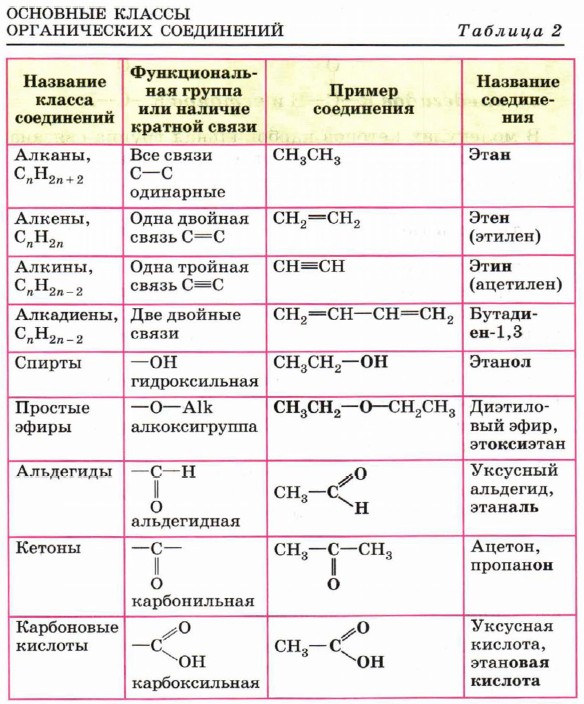 ) CH2=CH2 + H2↑
) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат.) CH2=CH2 + H2↑
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью.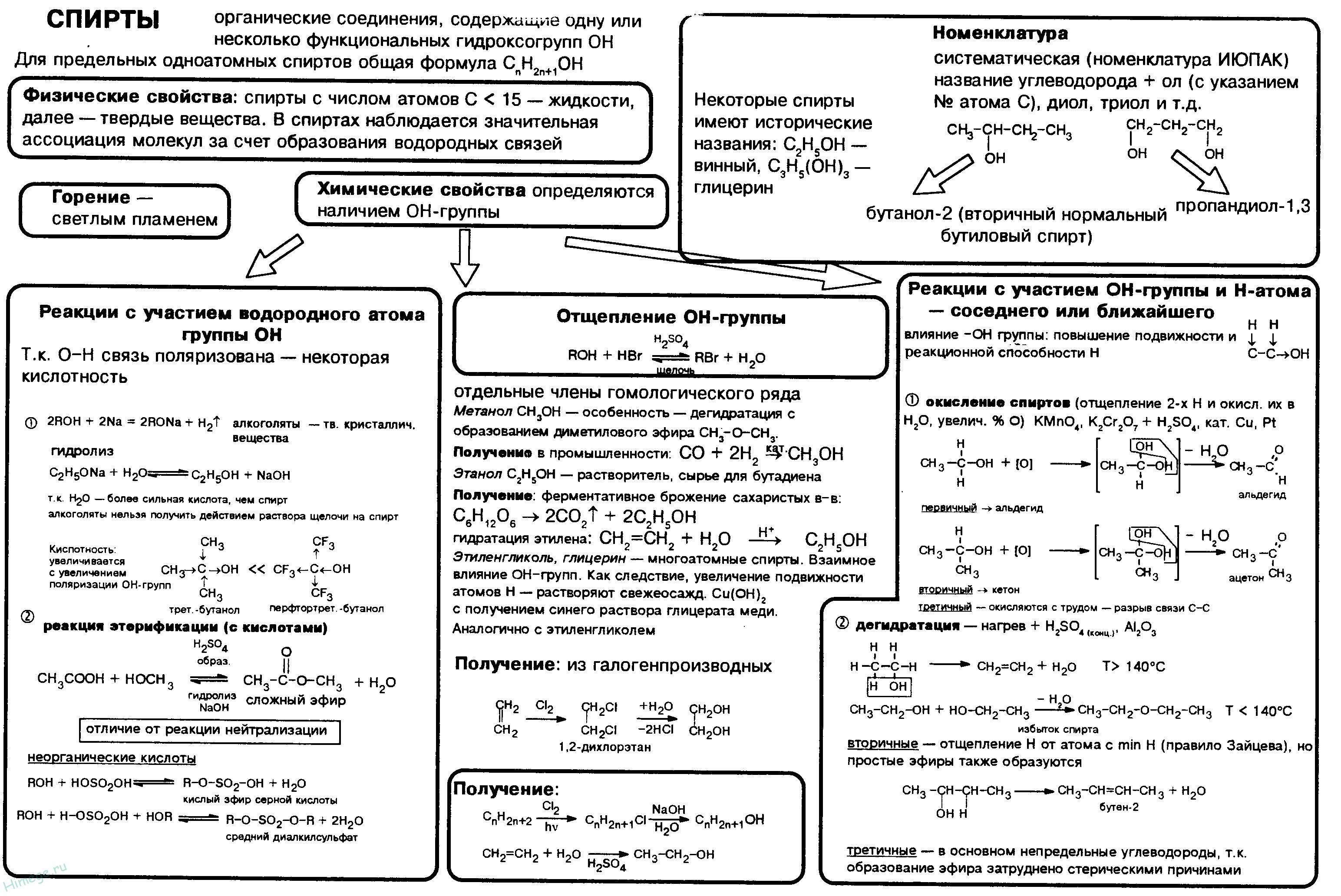 Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
26.1: Органические соединения и структуры: обзор
Цели обучения
- Распознавать состав и свойства, типичные для органических и неорганических соединений.
- Определять и называть простые (прямоцепочечные) алканы по данным формулам и писать формулы для прямоцепочечных алканов по их названиям.
- Напишите сокращенные структурные формулы алканов, зная полные структурные формулы.
- Нарисуйте формулы линейного угла по структурным формулам.
- Давать названия алканам по системе IUPAC и писать формулы для алканов, которым присвоены названия IUPAC
- Чтобы описать функциональные группы и объяснить, почему они полезны при изучении органической химии.

Ученые 18-го и начала 19-го веков изучали соединения, полученные из растений и животных, и обозначили их как органические , потому что они были выделены из «организованных» (живых) систем. Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были обозначены как неорганические .Многие годы ученые считали, что органические соединения могут образовываться только живыми организмами, потому что они обладают жизненной силой, присущей только живым системам. Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Вёлер синтезировал мочевину из неорганических исходных материалов. Он провел реакцию с цианатом серебра (AgOCN) и хлоридом аммония (NH 4 Cl), рассчитывая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
\[AgOCN + NH_4Cl \rightarrow AgCl + NH_4OCN \label{Eq1}\]
Вместо этого он обнаружил, что продукт представляет собой мочевину (NH 2 CONH 2 ), хорошо известное органическое вещество, легко выделяемое из мочи.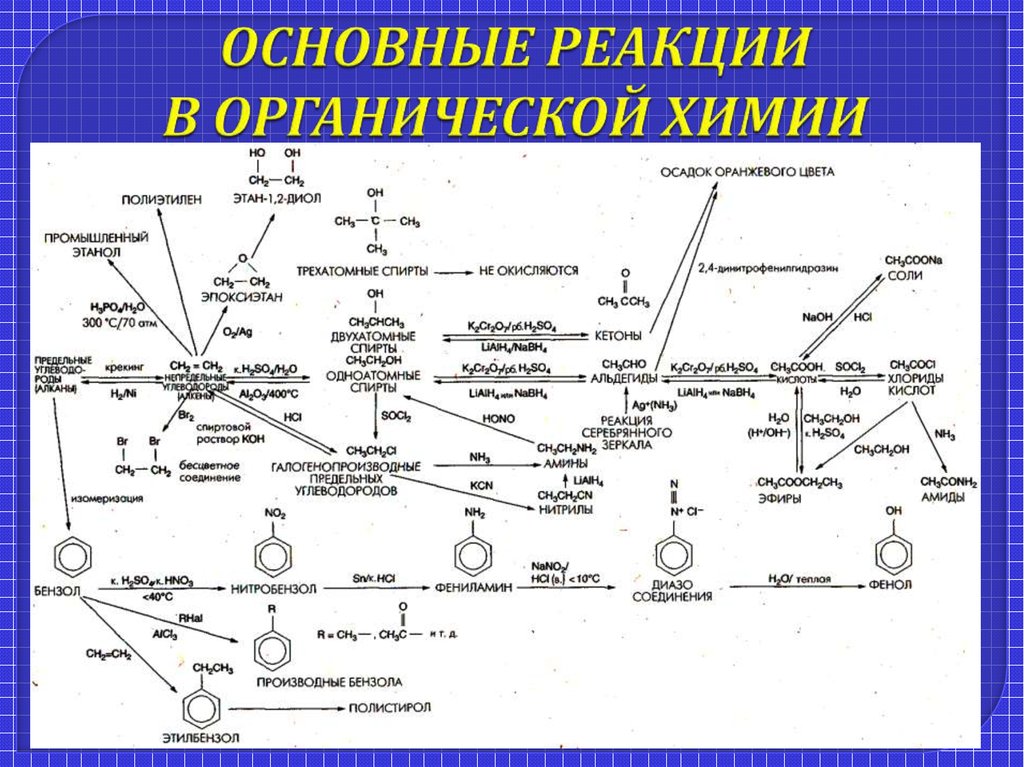 Этот результат привел к серии экспериментов, в которых большое разнообразие органических соединений было получено из неорганических исходных материалов. Теория жизненной силы постепенно ушла в прошлое, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Этот результат привел к серии экспериментов, в которых большое разнообразие органических соединений было получено из неорганических исходных материалов. Теория жизненной силы постепенно ушла в прошлое, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Сегодня органическая химия изучает химию соединений углерода, а неорганическая химия изучает химию всех остальных элементов. Может показаться странным, что мы делим химию на две ветви — одну, которая рассматривает соединения только одного элемента, и другую, которая охватывает более 100 остальных элементов.Однако такое деление представляется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.
Примечание
Слово органический имеет разные значения. Органические удобрения, такие как коровий навоз, являются органическими в первоначальном смысле; он получен из живых организмов. Органические продукты – это продукты, выращенные без синтетических пестицидов или удобрений. Органическая химия – это химия соединений углерода.
Органические продукты – это продукты, выращенные без синтетических пестицидов или удобрений. Органическая химия – это химия соединений углерода.
Углерод уникален среди других элементов тем, что его атомы могут образовывать стабильные ковалентные связи друг с другом и с атомами других элементов во множестве вариаций. Образовавшиеся молекулы могут содержать от одного до миллионов атомов углерода. Ранее мы рассмотрели органическую химию, разделив ее соединения на семейства на основе функциональных групп. Мы начнем с простейших членов семейства, а затем перейдем к молекулам, которые являются органическими в первоначальном смысле, то есть они производятся живыми организмами и находятся в них.Эти сложные молекулы (все содержащие углерод) определяют формы и функции живых систем и являются предметом биохимии.
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах органических и неорганических молекул. Тем не менее полезно сравнить типичные члены каждого класса, как в таблице \(\PageIndex{1}\).
Тем не менее полезно сравнить типичные члены каждого класса, как в таблице \(\PageIndex{1}\).
| Органический | Гексан | Неорганический | NaCl | |
|---|---|---|---|---|
| низкая температура плавления | −95°С | высокие температуры плавления | 801°С | |
| низкая температура кипения | 69°С | высокие точки кипения | 1413°С | |
| низкая растворимость в воде; высокая растворимость в неполярных растворителях | нерастворим в воде; растворим в бензине | большая растворимость в воде; низкая растворимость в неполярных растворителях | растворим в воде; нерастворим в бензине | |
| легковоспламеняющиеся | легковоспламеняющийся | негорючий | негорючий | |
| водные растворы не проводят электричество | непроводящий | водные растворы проводят электричество | проводящий в водном растворе | |
| имеют ковалентную связь | ковалентные связи | проявляют ионную связь | ионные связи |
Однако имейте в виду, что для каждой категории в этой таблице есть исключения.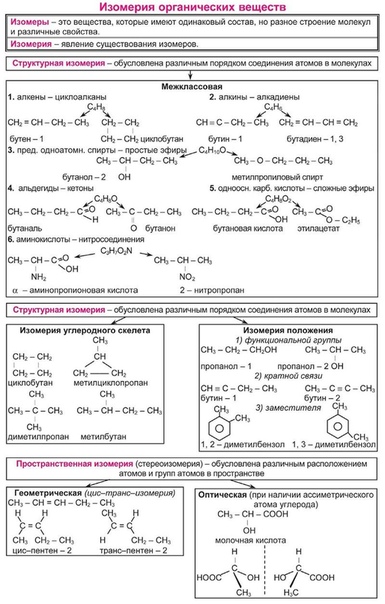 Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, в таблице \(\PageIndex{1}\) также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14). ), растворитель, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в таблице \(\PageIndex{1}\).
Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, в таблице \(\PageIndex{1}\) также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14). ), растворитель, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в таблице \(\PageIndex{1}\).
Углеводороды
Начнем изучение органической химии с углеводородов, простейших органических соединений, которые состоят только из атомов углерода и водорода. Как мы уже отмечали, существует несколько различных видов углеводородов. Они различаются по типу связи между атомами углерода и по свойствам, возникающим в результате этой связи. Углеводороды, имеющие только углерод-углеродные одинарные связи (С-С) и существующие в виде непрерывной цепи атомов углерода, также связанных с атомами водорода, называются алканы (или насыщенные углеводороды). Насыщенный в данном случае означает, что каждый атом углерода связан с четырьмя другими атомами (водорода или углерода) — максимально возможное; в молекулах отсутствуют двойные и тройные связи.
Насыщенный в данном случае означает, что каждый атом углерода связан с четырьмя другими атомами (водорода или углерода) — максимально возможное; в молекулах отсутствуют двойные и тройные связи.
Примечание
Слово насыщенный имеет то же значение для углеводородов, что и для пищевых жиров и масел: молекула не имеет углерод-углеродных двойных связей (C=C).
Ранее мы ввели три простейших алкана — метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ), и они снова показаны на рисунке \( \ИндексСтраницы{1}\).
Рисунок \(\PageIndex{1}\): Три простейших алкана Показанные плоские представления не точно отображают валентные углы или молекулярную геометрию. Метан имеет тетраэдрическую форму, которую химики часто изображают клиньями, обозначающими связи, выходящие к вам, и пунктирными линиями, обозначающими связи, отходящие от вас. Обычная сплошная линия указывает на связь в плоскости страницы. Напомним, что теория VSEPR правильно предсказывает тетраэдрическую форму молекулы метана (рис. \(\PageIndex{2}\)).
Напомним, что теория VSEPR правильно предсказывает тетраэдрическую форму молекулы метана (рис. \(\PageIndex{2}\)).
Метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются началом ряда соединений, в которых любые два члена в последовательности различаются. одним атомом углерода и двумя атомами водорода, а именно единицей CH 2 . Первые 10 членов этой серии приведены в таблице \(\PageIndex{2}\).
| Имя | Молекулярная формула (C n H 2 n + 2 ) | Концентрированная структурная формула | Число возможных изомеров |
|---|---|---|---|
| метан | СН 4 | СН 4 | — |
| этан | С 2 Н 6 | CH 3 CH 3 | — |
| пропан | С 3 Н 8 | CH 3 CH 2 CH 3 | — |
| бутан | С 4 Н 10 | CH 3 CH 2 CH 2 CH 3 | 2 |
| пентан | С 5 Н 12 | CH 3 CH 2 CH 2 CH 2 CH 3 | 3 |
| гексан | С 6 Н 14 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 | 5 |
| гептан | С 7 Н 16 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 | 9 |
| Октан | С 8 Н 18 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 | 18 |
| нонан | С 9 Н 20 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 4 CH 2 4 | 35 |
| декан | С 10 Н 22 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 | 75 |
Рассмотрим серию на рисунке \(\PageIndex{3}\).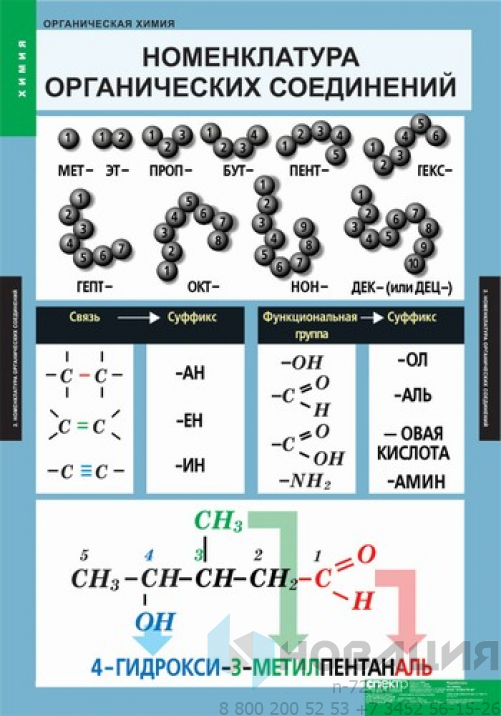 Последовательность начинается с C 3 H 8 , и на каждом шаге вверх по последовательности добавляется единица CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа СН 2 ), называется гомологическим рядом. Члены такого ряда, называемые гомологами , обладают свойствами, которые изменяются регулярным и предсказуемым образом. Принцип гомологии дает организацию органической химии почти так же, как таблица Менделеева дает организацию неорганической химии.Вместо сбивающего с толку множества отдельных соединений углерода мы можем изучить несколько членов гомологического ряда и вывести из них некоторые свойства других соединений этого ряда.
Последовательность начинается с C 3 H 8 , и на каждом шаге вверх по последовательности добавляется единица CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа СН 2 ), называется гомологическим рядом. Члены такого ряда, называемые гомологами , обладают свойствами, которые изменяются регулярным и предсказуемым образом. Принцип гомологии дает организацию органической химии почти так же, как таблица Менделеева дает организацию неорганической химии.Вместо сбивающего с толку множества отдельных соединений углерода мы можем изучить несколько членов гомологического ряда и вывести из них некоторые свойства других соединений этого ряда.
Принцип гомологии позволяет написать общую формулу для алканов: C n H 2 n + 2 . Используя эту формулу, мы можем написать молекулярную формулу любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Используя эту формулу, мы можем написать молекулярную формулу любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Мы используем несколько видов формул для описания органических соединений. Молекулярная формула показывает только виды и количество атомов в молекуле. Например, молекулярная формула C 4 H 10 говорит нам о том, что в молекуле 4 атома углерода и 10 атомов водорода, но не различает бутан и изобутан.Структурная формула показывает все атомы углерода и водорода и связывающие их связи. Таким образом, структурные формулы идентифицируют конкретные изомеры, показывая порядок присоединения различных атомов. К сожалению, структурные формулы трудно напечатать/записать и они занимают много места. Химики часто используют сокращенные структурные формулы, чтобы облегчить эти проблемы. В сокращенных формулах атомы водорода показаны рядом с атомами углерода, к которым они присоединены, как показано для бутана:
.
Окончательная сокращенная формула представляет собой формулу линейного угла, в которой атомы углерода подразумеваются в углах и концах линий, и понимается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи.Например, мы можем представлять пентан (CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 ) и изопентан [(CH 3 ) 2 CHCH 2 CH 3 ] следующим образом:
Примечание
Скобки в сокращенных структурных формулах указывают на то, что заключенная группа атомов присоединена к соседнему атому углерода.
Номенклатура
Как отмечено в Таблице \(\PageIndex{2}\): число изомеров быстро увеличивается по мере увеличения числа атомов углерода.Имеется 3 пентана, 5 гексанов, 9 гептанов и 18 октанов. Было бы трудно присвоить уникальные индивидуальные имена, которые мы могли бы запомнить. Систематический способ именования углеводородов и других органических соединений был разработан Международным союзом теоретической и прикладной химии (IUPAC). Эти правила, используемые во всем мире, известны как Система номенклатуры IUPAC. (Некоторые из названий, которые мы использовали ранее, такие как изобутан, изопентан и неопентан, не следуют этим правилам и называются общими именами .) Название основы (таблица \(\PageIndex{3}\)) указывает количество атомов углерода в самой длинной непрерывной цепи (LCC). Атомы или группы, присоединенные к этой углеродной цепи, называемые заместителями , затем называются, а их положения обозначаются цифрами. Сейчас мы будем рассматривать только те заместители, которые называются алкильными группами.
Систематический способ именования углеводородов и других органических соединений был разработан Международным союзом теоретической и прикладной химии (IUPAC). Эти правила, используемые во всем мире, известны как Система номенклатуры IUPAC. (Некоторые из названий, которые мы использовали ранее, такие как изобутан, изопентан и неопентан, не следуют этим правилам и называются общими именами .) Название основы (таблица \(\PageIndex{3}\)) указывает количество атомов углерода в самой длинной непрерывной цепи (LCC). Атомы или группы, присоединенные к этой углеродной цепи, называемые заместителями , затем называются, а их положения обозначаются цифрами. Сейчас мы будем рассматривать только те заместители, которые называются алкильными группами.
| Стержень | Номер |
|---|---|
| мет- | 1 |
| эт- | 2 |
| опора- | 3 |
| а- | 4 |
| отложен- | 5 |
| шестигранник- | 6 |
| гепт- | 7 |
| окт- | 8 |
| не | 9 |
| дек- | 10 |
Алкильная группа представляет собой группу атомов, образующуюся при удалении одного атома водорода из алкана. Группа названа путем замены суффикса -ane исходного углеводорода на -yl . Например, группа СН 3 , полученная из метана (СН 4 ), получается в результате вычитания одного атома водорода и называется метильной группой . Алкильные группы, которые мы будем использовать чаще всего, перечислены в таблице \(\PageIndex{4}\). Алкильные группы не являются независимыми молекулами; это части молекул, которые мы рассматриваем как единое целое, чтобы систематически называть соединения.
Группа названа путем замены суффикса -ane исходного углеводорода на -yl . Например, группа СН 3 , полученная из метана (СН 4 ), получается в результате вычитания одного атома водорода и называется метильной группой . Алкильные группы, которые мы будем использовать чаще всего, перечислены в таблице \(\PageIndex{4}\). Алкильные группы не являются независимыми молекулами; это части молекул, которые мы рассматриваем как единое целое, чтобы систематически называть соединения.
Упрощенные правила ИЮПАК для обозначения алканов следующие (показаны в примере \(\PageIndex{1}\)).
- Назовите алканы в соответствии с LCC атомов углерода в молекуле (а не общим числом атомов углерода). Этот LCC, считающийся материнской цепью, определяет название основания, к которому мы добавляем суффикс – ан , чтобы указать, что молекула является алканом.
- Если углеводород разветвлен, пронумеруйте атомы углерода LCC.
 Номера присваиваются в том направлении, которое дает наименьшие номера атомам углерода с присоединенными заместителями.Дефисы используются для отделения чисел от названий заместителей; запятые отделяют числа друг от друга. (LCC не нужно писать прямой линией; например, LCC в следующем примере имеет пять атомов углерода.)
Номера присваиваются в том направлении, которое дает наименьшие номера атомам углерода с присоединенными заместителями.Дефисы используются для отделения чисел от названий заместителей; запятые отделяют числа друг от друга. (LCC не нужно писать прямой линией; например, LCC в следующем примере имеет пять атомов углерода.)
- Расположите названия групп заместителей в алфавитном порядке перед названием исходного соединения. Если одна и та же алкильная группа встречается более одного раза, то указываются номера всех атомов углерода, к которым она присоединена.Если одна и та же группа появляется более одного раза у одного и того же атома углерода, номер этого атома углерода повторяется столько раз, сколько появляется группа. Причем количество одинаковых групп обозначается греческими приставками ди -, три -, тетра – и так далее. Эти префиксы , а не учитываются при определении алфавитного порядка заместителей.
 Например, этил указан перед диметилом; di- просто игнорируется. Последняя названная алкильная группа ставится перед названием исходного алкана, образуя одно слово.
Например, этил указан перед диметилом; di- просто игнорируется. Последняя названная алкильная группа ставится перед названием исходного алкана, образуя одно слово.
При соблюдении этих правил каждое уникальное соединение получает собственное эксклюзивное имя. Правила позволяют нам не только называть соединение по заданной структуре, но и рисовать структуру по заданному имени. Лучший способ научиться пользоваться системой IUPAC — это заставить ее работать, а не просто запомнить правила. Это проще, чем кажется.
Пример \(\PageIndex{1}\)
Назовите каждое соединение.
Решение
- LCC имеет пять атомов углерода, поэтому исходным соединением является пентан (правило 1).Ко второму атому углерода пентановой цепи присоединена метильная группа (правило 2). Поэтому название 2-метилпентан.
- LCC имеет шесть атомов углерода, поэтому исходным соединением является гексан (правило 1).
 Метильные группы (правило 2) присоединены ко второму и пятому атомам углерода. Название 2,5-диметилгексан.
Метильные группы (правило 2) присоединены ко второму и пятому атомам углерода. Название 2,5-диметилгексан. - LCC имеет восемь атомов углерода, поэтому исходным соединением является октан (правило 1). Имеются метильная и этильная группы (правило 2), обе присоединены к четвертому атому углерода (если считать от вправо, то дает этому атому углерода меньший номер; правило 3).Таким образом, правильное название – 4-этил-4-метилоктан.
Упражнение \(\PageIndex{1}\)
Назовите каждое соединение.
Пример \(\PageIndex{2}\)
Нарисуйте структуру каждого соединения.
- 2,3-диметилбутан
- 4-этил-2-метилгептан
Решение
При рисовании структур всегда начинайте с родительской цепочки.
- Исходной цепью является бутан, что указывает на четыре атома углерода в LCC.
Затем добавьте группы на свои места.
 Вы можете нумеровать родительскую цепочку в любом направлении, если вы непротиворечивы; просто не меняйте направление до того, как структура будет готова. Название указывает на две метильные (CH 3 ) группы, одну на втором атоме углерода и одну на третьем.
Вы можете нумеровать родительскую цепочку в любом направлении, если вы непротиворечивы; просто не меняйте направление до того, как структура будет готова. Название указывает на две метильные (CH 3 ) группы, одну на втором атоме углерода и одну на третьем.Наконец, заполните все атомы водорода, имея в виду, что каждый атом углерода должен иметь четыре связи.
- В данном случае исходной цепью является гептан, что указывает на семь атомов углерода в LCC.
–С–С–С–С–С–С–С–
Добавление групп в соответствующие позиции дает
Заполнение всех атомов водорода дает следующие сокращенные структурные формулы:
Обратите внимание, что облигации (тире) могут быть показаны или нет; иногда они необходимы для расстановки.
Упражнение \(\PageIndex{2}\)
Нарисуйте структуру каждого соединения.
- 4-этилоктан
- 3-этил-2-метилпентан
- 3,3,5-триметилгептан
Функциональные группы
Функциональные группы представляют собой атомы или небольшие группы атомов (от двух до четырех), которые проявляют характерную реакционную способность. Конкретная функциональная группа почти всегда будет демонстрировать свое характерное химическое поведение, когда она присутствует в соединении. Из-за их важности для понимания органической химии функциональные группы имеют характерные названия, которые часто переносятся в названия отдельных соединений, включающих определенные группы.При изучении органической химии чрезвычайно важно уметь быстро распознавать наиболее распространенные функциональные группы, поскольку они являются ключевыми структурными элементами, определяющими реакции органических молекул. На данный момент мы будем беспокоиться только о рисовании и распознавании каждой функциональной группы, как показано Льюисом и линейными структурами. Большая часть оставшейся части вашего изучения органической химии будет посвящена изучению поведения различных функциональных групп в органических реакциях.
Конкретная функциональная группа почти всегда будет демонстрировать свое характерное химическое поведение, когда она присутствует в соединении. Из-за их важности для понимания органической химии функциональные группы имеют характерные названия, которые часто переносятся в названия отдельных соединений, включающих определенные группы.При изучении органической химии чрезвычайно важно уметь быстро распознавать наиболее распространенные функциональные группы, поскольку они являются ключевыми структурными элементами, определяющими реакции органических молекул. На данный момент мы будем беспокоиться только о рисовании и распознавании каждой функциональной группы, как показано Льюисом и линейными структурами. Большая часть оставшейся части вашего изучения органической химии будет посвящена изучению поведения различных функциональных групп в органических реакциях.
Ранее мы рассмотрели несколько видов углеводородов. Теперь мы рассмотрим некоторые из множества органических соединений, содержащих функциональные группы. Сначала мы ввели понятие функциональной группы, особого структурного расположения атомов или связей, которое придает молекуле характерную химическую активность. Если вы понимаете поведение конкретной функциональной группы, вы многое узнаете об общих свойствах этого класса соединений. В этой главе мы проводим краткое, но систематическое исследование некоторых семейств органических соединений.Каждое семейство основано на общей простой функциональной группе, содержащей атом кислорода или атом азота. Некоторые распространенные функциональные группы перечислены в таблице \(\PageIndex{5}\), а более полный список можно найти здесь.
Сначала мы ввели понятие функциональной группы, особого структурного расположения атомов или связей, которое придает молекуле характерную химическую активность. Если вы понимаете поведение конкретной функциональной группы, вы многое узнаете об общих свойствах этого класса соединений. В этой главе мы проводим краткое, но систематическое исследование некоторых семейств органических соединений.Каждое семейство основано на общей простой функциональной группе, содержащей атом кислорода или атом азота. Некоторые распространенные функциональные группы перечислены в таблице \(\PageIndex{5}\), а более полный список можно найти здесь.
Сводка
- Простые алканы существуют в виде гомологического ряда, в котором соседние члены отличаются единицей CH 2 .
- Сокращенные химические формулы показывают атомы водорода (или другие атомы или группы) рядом с атомами углерода, к которым они присоединены.
- Формулы линейного угла подразумевают наличие атома углерода на углах и концах линий.
 Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи.
Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи. - Алканы имеют как общие названия, так и систематические названия, установленные IUPAC.
- Функциональная группа, структурное расположение атомов и/или связей, в значительной степени отвечает за свойства семейств органических соединений.
Авторы и авторство
Реакции и механизмы – Магистр органической химии
Я разработал Руководство по реакциям и механизмам по реакциям и механизмам , чтобы помочь вам понять более 185 наиболее распространенных реакций, встречающихся на курсах органической химии.
Руководство охватывает все необходимые реакции от начала организации 1 (структура и связывание) до конца организации 2 (аминокислоты) и все, что находится между ними (стереохимия, алкеновые и алкиновые реакции, SN1/SN2/E1/E2). , диены, спирты, альдегиды и кетоны…).
Для каждой реакции я включил пошаговые объяснения, реагенты, механизмы, многочисленные примеры, нюансы, особые случаи и правила, а также практические тесты из реальных экзаменов.
Любой может получить доступ к реакциям, выделенным красным .
Если вы хотите разблокировать неограниченный доступ к всем реакциям в руководстве, ознакомьтесь с членством Master Organic Chemistry, где вы также получите полный доступ к более чем 1500 практическим тестам по органической химии из реальных экзаменов, а также более 200 печатных карточек, которые помогут вам выявить и заполнить пробелы в ваших знаниях.
«Руководство по реакции было моим ключевым ресурсом для экзаменов. Краткий, последовательный формат для каждой реакции, в которой я нуждался, означал, что я мог запоминать реакции и автоматически выплевывать их на экзаменах.Это сработало, я сам удивился и получил пятерку в организации 1». – Кэтлин Н., Городской колледж, CUNY, NY.
вернуться к началу
вернуться к началу
вернуться к началу
реакции замещения (S N 2) [нуклеофил в скобках]
вернуться к началу
реакции замещения (S 9002) Brackets]
Назад к началу
Назад к началу
Назад к началу
Реакции металлоретализации
Назад к началу
Назад к началу
Реакции спиртов и тиолов
Назад к началу
Назад к началу
Реакции ароматики ( Arenes)
Вернуться к началу
Реакции альдегидов и кетонов
Вернуться к началу
Реакции карбоновых кислот
Вернуться к началу
Назад к началу
Реакции ациллогенов
Назад к началу
Реакции α,β-ненасыщенные кетоны [еноны]
к началу страницы
Реакции аминов и амидов
к началу страницы
к началу страницы
900 02 наверхОрганическая номенклатура
Наименование органических соединений
Увеличивающееся число органических соединений, идентифицируемых с каждым днем, а также тот факт, что многие из этих соединений являются изомерами других соединений, требуют разработки системы систематической номенклатуры. Точно так же, как каждое отдельное соединение имеет уникальную молекулярную структуру, которая может быть обозначена структурной формулой, каждому соединению должно быть присвоено характерное и уникальное имя.
Точно так же, как каждое отдельное соединение имеет уникальную молекулярную структуру, которая может быть обозначена структурной формулой, каждому соединению должно быть присвоено характерное и уникальное имя.
По мере того как органическая химия росла и развивалась, многим соединениям были даны тривиальные названия, которые сейчас широко используются и признаются. Некоторые примеры:
| Имя | Метан | Бутан | Ацетон | Толуол | Ацетилен | Этиловый спирт |
|---|---|---|---|---|---|---|
| Формула | CH 4 | C 4 H 10 | CH 3 Coch 3 | CH 3 C 6 H 5 | C 2 H 2 | С 2 Н 5 ОХ |
Такие общеупотребительные названия часто берут свое начало в истории науки и природных источниках конкретных соединений, но отношение этих названий друг к другу произвольно, и в их присвоении нет никаких рациональных или систематических принципов.
Систематический подход ИЮПАК к номенклатуре
Рациональная номенклатурная система должна делать как минимум две вещи. Во-первых, он должен указать, как атомы углерода данного соединения связаны друг с другом в характерной решетке цепей и колец. Во-вторых, он должен идентифицировать и локализовать любые функциональные группы, присутствующие в соединении. Поскольку водород является таким распространенным компонентом органических соединений, его количество и расположение можно предположить по четырехвалентности углерода, и в большинстве случаев его не нужно указывать.
Система номенклатуры IUPAC представляет собой набор логических правил, разработанных и используемых химиками-органиками для обхода проблем, вызванных произвольной номенклатурой. Зная эти правила и зная структурную формулу, можно написать уникальное название для каждого отдельного соединения. Точно так же, имея имя IUPAC, можно написать структурную формулу. Как правило, имя IUPAC будет иметь три основные характеристики:
• Корень или основание, указывающее на основную цепь или кольцо атомов углерода в молекулярной структуре.
• Суффикс или другой элемент(ы), обозначающие функциональные группы, которые могут присутствовать в соединении.
• Названия групп-заместителей, кроме водорода, которые завершают молекулярную структуру.
В качестве введения в систему номенклатуры IUPAC мы сначала рассмотрим соединения, не имеющие определенных функциональных групп. Такие соединения состоят только из атомов углерода и водорода, связанных друг с другом сигма-связями (все атомы углерода sp 3 гибридизованы).
Отличное представление органической номенклатуры представлено на странице номенклатуры. созданный Дэйвом Вудкоком.
Также доступна полная презентация Правил IUPAC.
Алканы
Углеводороды, не имеющие функциональных групп двойной или тройной связи, классифицируются как алканы или циклоалканы в зависимости от того, расположены ли атомы углерода в молекуле только в виде цепей или также в виде колец. Хотя эти углеводороды не имеют функциональных групп, они составляют каркас, на котором располагаются функциональные группы других классов соединений, и являются идеальной отправной точкой для изучения и обозначения органических соединений. Алканы и циклоалканы также являются членами более крупного класса соединений, называемых алифатическими . Проще говоря, алифатические соединения — это соединения, которые не содержат ароматических колец в своей молекулярной структуре.
Алканы и циклоалканы также являются членами более крупного класса соединений, называемых алифатическими . Проще говоря, алифатические соединения — это соединения, которые не содержат ароматических колец в своей молекулярной структуре.
В следующей таблице перечислены названия IUPAC, присвоенные простым алканам с непрерывной цепью от C-1 до C-10. Общий суффикс «ан» идентифицирует эти соединения как алканы. Алканы с более длинной цепью хорошо известны, и их названия можно найти во многих справочниках и учебниках.Названия метан – декан следует запомнить, так как они составляют корень многих названий ИЮПАК. К счастью, для обозначения цепочек из пяти и более атомов углерода используются обычные числовые префиксы.
| Имя | Молекулярных Формула | Структурные Формула | Изомеров | Имя | Молекулярных Формула | Структурных Формула | Изомеров | ||
|---|---|---|---|---|---|---|---|---|---|
| мет аны | 2CH 4 | CH 4 | 1 | ||||||
| Hex | 1 AneC 6 H 14 | CH 3 (CH 2 ) 4 CH 3 | 5 | 5 | |||||
| 1 Ane | C 2 H 6 | CH | CH 3 CH 3 | 1 | Hept | 1 AneC 7 ч 16 | CH 3 (CH 2 ) 5 CH 3 | 9 | |
| 7 Ane | C 3 H 8 | CH 3 CH 2 CH 3 | 1 | Окт | |||||
| OCT | 1 ANEC 8 H 18 | CH 3 (CH 2 ) 6 CH 3 | 18 | C 4 H 10 | CH 3 CH 2 CH 2 CH 3 | 2 | 2 | C 9 H 20 | CH | CH 3 (CH 2 ) 7 CH 3 | 35 | Pent Ane | C 5 H 5 H 12 | CH 3 (CH 2 ) 3 CH 3 3 | 3 | Dec | 1 Ane C 10 ч 22 | канал 9 0023 3 (CH 2 ) 8 CH 3 | 75 | |
Некоторые важные тенденции поведения и терминология:
(i) Формулы и структуры этих алканов равномерно возрастают
с шагом CH 2 .
(ii) Единая вариация такого рода в ряду соединений называется гомологичен .
(iii) Все эти формулы подходят для C n H 2n+2 правило. Это также максимально возможное соотношение H/C для стабильного углеводорода.
(iv) Поскольку соотношение H/C в этих соединениях максимально, мы называем их насыщенный (с водородом).
Начиная с бутана (C 4 H 10 ), и становится более многочисленным с более крупными алканами, мы отмечаем существование изомеров алканов.Например, есть пять C 6 H 14 изомеры, показанные ниже в виде сокращенных строк формул (от A до E ):
Хотя все эти разные соединения имеют одинаковую молекулярную формулу, только одно из них ( A ) можно назвать гексаном. Как же тогда назвать остальных?
Система IUPAC требует, во-первых, чтобы у нас были названия для простых неразветвленных цепей, как отмечалось выше, и, во-вторых, чтобы у нас были названия для простых алкильных групп, которые могут быть присоединены к цепям. Примеры некоторых общих алкильных групп приведены в следующей таблице. Обратите внимание, что суффикс «ane» заменен на « yl » в группах именования. Символ R используется для обозначения общей (неопределенной) алкильной группы.
Примеры некоторых общих алкильных групп приведены в следующей таблице. Обратите внимание, что суффикс «ane» заменен на « yl » в группах именования. Символ R используется для обозначения общей (неопределенной) алкильной группы.
| Группа | CH 3 – | С 2 Н 5 – | CH 3 CH 2 CH 2 – | (CH 3 ) 2 CH– | CH 3 CH 2 CH 2 CH 2 – | (CH 3 ) 2 CHCH 2 – | CH 3 CH 2 CH(CH 3 )– | (CH 3 ) 3 C– | Р– |
| Имя | Метил | Этил | Пропил | Изопропил | Бутил | Изобутил | сек -Бутил | трет -Бутил | Алкил |
Правила ИЮПАК для номенклатуры алканов 1. |
Для вышеуказанных изомеров гексана названия IUPAC: B 2-метилпентан C 3-метилпентан D 2,2-диметилбутан E 2,3-диметилбутан
Галогеновые заместители легко сочетаются с использованием названий: фтор (F-), хлор (Cl-), бром (Br-) и йод (I-).Например, (CH 3 ) 2 CHCH 2 CH 2 Br будет называться 1-бром-3-метилбутан. Если галоген связан с простой алкильной группой, можно использовать альтернативное название «алкилгалогенид». Таким образом, C 2 H 5 Cl может быть назван хлорэтаном (для двухуглеродной цепи не требуется номер локатора) или этилхлоридом. Галогенированные алкильные заместители, такие как бромметил, BrCH 2 – и трихлорметил, CCl 3 -, могут быть перечислены и расположены в алфавитном порядке в соответствии с их полными названиями.
Если галоген связан с простой алкильной группой, можно использовать альтернативное название «алкилгалогенид». Таким образом, C 2 H 5 Cl может быть назван хлорэтаном (для двухуглеродной цепи не требуется номер локатора) или этилхлоридом. Галогенированные алкильные заместители, такие как бромметил, BrCH 2 – и трихлорметил, CCl 3 -, могут быть перечислены и расположены в алфавитном порядке в соответствии с их полными названиями.
Дополнительные примеры того, как эти правила используются при наименовании разветвленных алканов, и некоторые подправила номенклатуры .
Циклоалканы
Циклоалканы имеют один или несколько
кольца атомов углерода. Простейшие примеры этого класса состоят из
одиночное незамещенное углеродное кольцо, и они образуют гомологический ряд, подобный
к неразветвленным алканам. Имена IUPAC первых пяти членов
эта серия представлена в следующей таблице. Последний (желтый) столбец дает
общая формула циклоалкана любого размера. Если простой неразветвленный
алкан превращается в циклоалкан с двумя атомами водорода, по одному с каждого конца
цепи, должны быть потеряны. Отсюда общая формула циклоалкана
состоит из n атомов углерода C n H 2n . Хотя циклоалкан имеет на два атома водорода меньше, чем эквивалентный алкан, каждый углерод связан с четырьмя другими атомами, поэтому такие соединения по-прежнему считаются насыщенными водородом.
Последний (желтый) столбец дает
общая формула циклоалкана любого размера. Если простой неразветвленный
алкан превращается в циклоалкан с двумя атомами водорода, по одному с каждого конца
цепи, должны быть потеряны. Отсюда общая формула циклоалкана
состоит из n атомов углерода C n H 2n . Хотя циклоалкан имеет на два атома водорода меньше, чем эквивалентный алкан, каждый углерод связан с четырьмя другими атомами, поэтому такие соединения по-прежнему считаются насыщенными водородом.
Замещенные циклоалканы называются так же, как и разветвленные алканы. Основное различие в правилах и процедурах заключается в системе нумерации. Поскольку все атомы углерода в кольце эквивалентны (кольцо не имеет концов, как цепь), нумерация начинается с замещенного кольцевого атома.
Правила ИЮПАК для номенклатуры циклоалканов 1. Для монозамещенного циклоалкана кольцо дает корневое название (таблица выше), а замещающая группа называется как обычно. |
Примеры того, как эти правила используются при присвоении названий замещенным циклоалканам.
Маленькие кольца, такие как три и четырехчленные кольца, имеют значительную угловую деформацию в результате деформации углов связи углерода sp 3 от идеального 109,5º до 60º и 90º соответственно. Эта угловая деформация часто увеличивает химическую активность таких соединений, что приводит к образованию продуктов разрыва кольца.Это также важно признать, что, за исключением циклопропана, циклоалкильные кольца не являются плоскими (плоскими). Трехмерные формы, принятые общим кольца (особенно циклогексановые и более крупные кольца) описаны и обсуждены в разделе «Конформационный анализ».
Углеводороды, имеющие более одного кольца, широко распространены и называются бициклическими (два кольца), трициклическими (три кольца) и вообще полициклическими соединениями. Молекулярные формулы таких соединений имеют отношения H/C, которые уменьшаются с числом
колец. В общем, для углеводорода, состоящего из n атомов углерода, с м колец связана формула: C n H (2n + 2 – 2m) . Структурное соотношение колец в полициклическом соединении может варьироваться. Они могут быть отдельными и независимыми или иметь один или два общих атома. Некоторые примеры этих возможных компоновок показаны в следующей таблице.
Молекулярные формулы таких соединений имеют отношения H/C, которые уменьшаются с числом
колец. В общем, для углеводорода, состоящего из n атомов углерода, с м колец связана формула: C n H (2n + 2 – 2m) . Структурное соотношение колец в полициклическом соединении может варьироваться. Они могут быть отдельными и независимыми или иметь один или два общих атома. Некоторые примеры этих возможных компоновок показаны в следующей таблице.
Примеры изомерных C
8 H 14 Бициклоалканы| Изолированные кольца | Кольца Spiro | Плавкие кольца | Кольца с мостиками |
|---|---|---|---|
| Без общих атомов | Один общий атом | Одна обыкновенная облигация | Два обычных атома |
Алкены и алкины
Алкены и алкины представляют собой углеводороды, которые имеют соответственно углерод-углеродную двойную связь и углерод-углеродную тройную связь функциональных групп. Молекулярные формулы этих ненасыщенных углеводородов отражают множественное связывание функциональных групп:
Молекулярные формулы этих ненасыщенных углеводородов отражают множественное связывание функциональных групп:
| Алкан | R–CH 2 –CH 2 –R | C n H 2n+2 | This is |
|---|---|---|---|
| Алкен | R–CH=CH–R | С Н Н 2 Н | Каждая двойная связь уменьшает количество атомов водорода на 2. |
| Алкин | R–C≡C–R | С Н Н 2н-2 | Каждая тройная связь уменьшает число атомов водорода на 4. |
Как отмечалось ранее в разделе «Анализ молекулярных формул», молекулярная формула углеводорода предоставляет информацию о возможных структурных типах, которые он может представлять. Например, рассмотрим соединения, имеющие формулу C 5 H 8 . Формула пятиуглеродного алкана пентана C 5 H 12 , поэтому разница в содержании водорода равна 4. Это различие предполагает, что такие соединения могут иметь тройную связь, две двойные связи, кольцо плюс двойную связь или два кольца. Некоторые примеры показаны здесь, а есть как минимум четырнадцать других!
Это различие предполагает, что такие соединения могут иметь тройную связь, две двойные связи, кольцо плюс двойную связь или два кольца. Некоторые примеры показаны здесь, а есть как минимум четырнадцать других!
Правила ИЮПАК для номенклатуры алкенов и циклоалкенов 1. Суффикс ene (окончание) указывает на алкен или циклоалкен. |
Правила ИЮПАК для номенклатуры алкинов 1. Суффикс yne (окончание) указывает на алкин или циклоалкин. |
Примеры того, как эти правила используются для обозначения алкенов, алкинов и циклических аналогов .
Номенклатура соединений с замещенным бензольным кольцом менее систематична, чем номенклатура алканов, алкенов и алкинов. Несколько монозамещенных соединений названы с использованием названия группы в качестве префикса к «бензолу», как показано комбинированными названиями, перечисленными ниже. Однако большинство этих соединений называют уникальными именами в единственном числе. Нет простой альтернативы запоминанию в освоении этих имен.
Двумя обычно встречающимися группами заместителей, которые включают бензольное кольцо, являются фенил , сокращенно Ph-, и бензил , сокращенно Bn-.Они показаны здесь с примерами их использования. Будьте осторожны, чтобы не перепутать фенильную группу (произносится как фенил ) с составным фенолом (произносится как фенол ). Общее и полезное общее обозначение, которое дополняет использование R- для алкильной группы, представляет собой Ar- для арильной группы (любое ароматическое кольцо).
Если в бензольном кольце присутствует более одного заместителя, относительное расположение заместителей должно быть обозначено нумерацией атомов углерода в кольце или каким-либо другим обозначением. В случае дизамещенных бензолов префиксы орто, мета и пара обычно используются для обозначения 1,2-, 1,3- или 1,4-соотношений соответственно. В следующих примерах первый ряд соединений показывает это использование красным цветом. Некоторые дизамещенные толуолы имеют названия в единственном числе (например, ксилол, крезол и толуидин), а их изомеры обычно обозначаются префиксом или rtho, m eta или p ara. Несколько дизамещенных бензолов имеют особые названия, данные изомерам (например,г. салициловая кислота и резорцин). Наконец, если есть три или более групп заместителей, кольцо нумеруется таким образом, чтобы присвоить заместителям наименьшие возможные номера, как показано в последнем ряду примеров. Заместители перечислены в алфавитном порядке в окончательном названии. Если замена симметрична (третий пример слева), нумерация соответствует алфавитному порядку.
В случае дизамещенных бензолов префиксы орто, мета и пара обычно используются для обозначения 1,2-, 1,3- или 1,4-соотношений соответственно. В следующих примерах первый ряд соединений показывает это использование красным цветом. Некоторые дизамещенные толуолы имеют названия в единственном числе (например, ксилол, крезол и толуидин), а их изомеры обычно обозначаются префиксом или rtho, m eta или p ara. Несколько дизамещенных бензолов имеют особые названия, данные изомерам (например,г. салициловая кислота и резорцин). Наконец, если есть три или более групп заместителей, кольцо нумеруется таким образом, чтобы присвоить заместителям наименьшие возможные номера, как показано в последнем ряду примеров. Заместители перечислены в алфавитном порядке в окончательном названии. Если замена симметрична (третий пример слева), нумерация соответствует алфавитному порядку.
Журналы органической химии — Отделение органической химии ACS
Основные издатели журналов по органической химии
| Публикации ACS | Поиск |
| Публикации Elsevier | Поиск |
| Публикации RSC | Поиск |
| Публикации Тиме | Поиск |
| Публикации Wiley | Поиск |
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
А
Отчеты о химических исследованиях
ACS Combinatorial Science (ранее называвшийся Journal of Combinatorial Chemistry)
ACS Medicinal Chemistry Letters
ACS Sustainable Chemistry and Engineering
Advanced Synthesis and Catalysis
Aldrichimica Acta
Angewandte Chemie, International Edition
Annual Reports on the Progress of Chemistry , Раздел B: Органическая химия
Азиатский журнал органической химии
Австралийский химический журнал
В
Beilstein Journal of Organic Chemistry
Биоорганическая и медицинская химия
Письма по биоорганической и медицинской химии
Бюллетень Химического общества Японии
С
Canadian Journal of Chemistry
Исследование углеводов
ChemBioChem
Chemistry & Biology
Chemical Communications
Chemical & Pharmaceutical Bulletin
Chemical Reviews
Chemical Science
Chemical Society Reviews
Chemistry Letters
Chemistry: A European Journal
Chirality
Д
Далтон Транзакции
Е
Экологические науки и технологии
Европейский журнал органической химии
Г
Зеленая химия
Н
Helvetica Chimica Acta
Heteroatom Chemistry
Heterocycles
Дж
Журнал Американского химического общества
Журнал биологической химии
Журнал катализа
Журнал химической информации и моделирования
Журнал химических исследований
Журнал химического общества, Perkin Transactions 1 (Публикация прекращена в 2002 г. , см. Органическая и биомолекулярная химия)
, см. Органическая и биомолекулярная химия)
Журнал Журнал химии фтора
Журнал химии гетероциклов
Журнал медицинской химии
Журнал молекулярного катализа A
Журнал молекулярного катализа B
Журнал натуральных продуктов
Журнал органической химии
Журнал металлоорганической химии
Журнал физической органической химии 908 Наука Часть А
М
Макромолекулы
Менделеевские сообщения
Молекулы
N
Nature
Отчеты о натуральных продуктах
New Journal of Chemistry
О
Органическая и биомолекулярная химия
Organic Chemistry Frontiers
Organic Letters
Органические препараты и процедуры International
Исследования и разработки в области органических процессов
Органические синтезы
Металлоорганические соединения
Р
Труды Национальной академии наук
Чистая и прикладная химия
Р
Российские химические обзоры
S
Science
Synfacts by Thieme
Synlett
Synthesis
Т
Тетраэдр
Тетраэдр Асимметрия
Тетраэдр Буквы
Отказ от ответственности: Эти ссылки предоставлены для удобства пользователей этого веб-сайта. Ссылки на журналы, содержащие статьи по органической химии.
Ссылки на журналы, содержащие статьи по органической химии.
Chem4Kids.com: Биохимия: органическая химия
Некоторые из вас, возможно, слышали об органической химии. Это гораздо более широкая область, чем биохимия. Он рассматривает каждую молекулу, которая может иметь атом углерода. Вы можете изучать пластмассы, целлюлозу, бензин, жиры в своих клетках или краску. Органическая химия изучает многие углеродсодержащие соединения помимо тех, которые встречаются в живых системах. Аааа, битва тяжеловесов.Это правда, что почти все соединения в биохимии имеют атомы углерода. Но на Земле существует гораздо больше видов деятельности, использующих углерод и не имеющих ничего общего с жизнью. Посмотрите на ряд минералов, называемых карбонатами (-CO 3 ). Все они имеют соединения углерода, которые смешиваются с микроэлементами. Некоторыми примерами карбонатов являются кальцит, доломит и смитсонит. Даже геологам нужно разбираться в химии.
Нам нравится биохимия, потому что мы узнаем о вещах, которые находятся внутри нас. Мы можем понять, что происходит, когда мы едим, и как устроено наше тело.Мы можем представить себе, как молекулы движутся по митохондриям или хлоропластам, в отличие от химических изменений, которые делают природный газ. Если вы выберете карьеру в области биологии или химии, вам нужно будет понимать информацию как в биохимии, так и в органической химии. Почему? Потому что движение атомов в биохимическом мире подчиняется тем же правилам, которые вы изучите в о-химии.
Мы можем понять, что происходит, когда мы едим, и как устроено наше тело.Мы можем представить себе, как молекулы движутся по митохондриям или хлоропластам, в отличие от химических изменений, которые делают природный газ. Если вы выберете карьеру в области биологии или химии, вам нужно будет понимать информацию как в биохимии, так и в органической химии. Почему? Потому что движение атомов в биохимическом мире подчиняется тем же правилам, которые вы изучите в о-химии.
 Вот и вся органическая химия. Органическая химия может быть развита только на нашей планете. Жизнь на Земле основана на соединениях углерода. O-chem проникает почти во все области химии (кроме неорганической химии).Так что, когда мы говорим, что здесь много, мы действительно имеем это в виду. На других планетах может быть жизнь на основе кремния (Si) или среда на основе серы (S). Знаете ли вы, что некоторые организмы могут выжить при реакциях, включающих сероводород (H 2 S) вместо воды (H 2 O)? Ученые ищут подобные организмы на дне океана и в акваториях без кислорода (бескислородных).
Вот и вся органическая химия. Органическая химия может быть развита только на нашей планете. Жизнь на Земле основана на соединениях углерода. O-chem проникает почти во все области химии (кроме неорганической химии).Так что, когда мы говорим, что здесь много, мы действительно имеем это в виду. На других планетах может быть жизнь на основе кремния (Si) или среда на основе серы (S). Знаете ли вы, что некоторые организмы могут выжить при реакциях, включающих сероводород (H 2 S) вместо воды (H 2 O)? Ученые ищут подобные организмы на дне океана и в акваториях без кислорода (бескислородных). Chalk Talk: Полимеры (видео US-NSF)
Approaching Organic Chemistry (от человека, который ненавидел органическую химию) – Library Voices
Органическая химия (также известная как «о химия»), как известно, является одним из самых сложных предметов, который должен пройти любой студент-химик/биолог.Одна из главных причин, по которой я сразу возненавидел химию, заключалась в том, что все вокруг меня и их лучший друг ненавидели химию.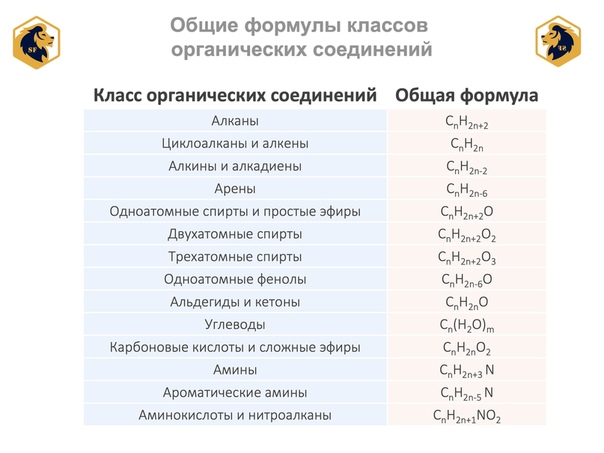 О химия известна как предмет, с которым сталкиваются многие премедики (студенты, находящиеся на пути к поступлению в медицинскую школу), или как класс, который отсеивает «меньших» премедов от «более достойных». ЭТО ОБМАН!
О химия известна как предмет, с которым сталкиваются многие премедики (студенты, находящиеся на пути к поступлению в медицинскую школу), или как класс, который отсеивает «меньших» премедов от «более достойных». ЭТО ОБМАН!
Органическая химия не обязательно должна быть худшим курсом, который вы когда-либо посещали, все в ваших руках. К сожалению, мне пришлось усвоить этот урок на собственном горьком опыте во время моей первой четверти органической химии в UWB.Я решил поделиться несколькими вещами, которые я узнал о том, как подходить к изучению органической химии (некоторые из них могут быть применимы даже к другим предметам), а также некоторыми глупыми химическими мемами, которые могут рассмешить любого студента-химика.
Прежде чем перейти к советам, я дам очень краткое объяснение того, что такое органическая химия, для тех, кто не слышал о ней раньше. Органическая химия — это раздел химии, изучающий органические реакции и способы их «создания» (построения). Органические соединения – это любые вещества, содержащие атом углерода. Атом углерода очень уникален, потому что он очень специфичен, когда дело доходит до связи, углерод любит иметь четыре связи, из-за этого особого свойства возможны многие реакции. Углерод присутствует во всех живых существах, мы почти на 99% состоим из углерода, это настолько важно, что мы посвятили целый год/серию занятий только реакциям, связанным с ним. Как вы можете себе представить, органическая химия играет очень большую роль в понимании того, что происходит внутри нас и вокруг нас (вот почему я думаю, что она есть в MCAT, и почему медицинские и стоматологические школы хотели бы, чтобы их новые студенты прошли этот курс). /ряд).
Органические соединения – это любые вещества, содержащие атом углерода. Атом углерода очень уникален, потому что он очень специфичен, когда дело доходит до связи, углерод любит иметь четыре связи, из-за этого особого свойства возможны многие реакции. Углерод присутствует во всех живых существах, мы почти на 99% состоим из углерода, это настолько важно, что мы посвятили целый год/серию занятий только реакциям, связанным с ним. Как вы можете себе представить, органическая химия играет очень большую роль в понимании того, что происходит внутри нас и вокруг нас (вот почему я думаю, что она есть в MCAT, и почему медицинские и стоматологические школы хотели бы, чтобы их новые студенты прошли этот курс). /ряд).
А теперь… Вот несколько советов, которые я придумал, которые помогли мне лучше учиться на химии:
- Составьте список – тем, которые вы выучили, и тех, которые вы еще не понимаете. Это очень помогло, когда дело дошло до учебы. Мне нравится просматривать списки и отмечать что-то во время учебы, чтобы я мог сосредоточиться на других темах, которые я, возможно, не понимаю.

- ПРАКТИКА!! – Не ленись, просто делай. Снова и снова и снова.Это станет утомительным и повторяющимся, и вам, возможно, захочется немного покричать после того, как вы отработаете так много механизмов (пошаговая последовательность основных/элементарных реакций, посредством которых происходят общие химические изменения), но это один из лучших способов понять и улучшить свои навыки. способности с темой.
- Измените свою точку зрения – Мне часто казалось, что нет смысла ходить на этот курс. Почему я посещаю этот странный курс, когда на самом деле все, что я хочу, это быть врачом и помогать своим пациентам с любыми проблемами, которые у них могут возникнуть? Я не осознавал, что органическая химия на самом деле изменит мой образ мышления, обучения и решения проблем.Если вы сравните органическую химию с медициной, то обе они немного похожи в том смысле, что (как только вы избавитесь от запоминания реакций) вы будете постоянно решать головоломки и применять все, что знаете, чтобы получить ответ.

- Обратитесь за помощью — ваш профессор готов вам помочь! Не бойтесь обращаться к ним или посещать их рабочие часы, профессора ОБОЖАЮТ, когда студенты делают это. Или найдите нескольких студентов, с которыми вы хорошо работаете, и учитесь в группе, это сработало на удивление хорошо для меня.Посетите QSC (Центр количественных навыков) для решения особенно сложных задач или вопросов, которые могут у вас возникнуть. Там есть преподаватели, которые являются студентами, которые ранее посещали занятия и понимают, через что вы проходите.
Органическая химия может быть очень сложной темой, потому что нужно многому научиться, но все зависит от того, как вы преподаете эти темы себе и своей организации. Сделайте большую часть своего обучения, сосредоточившись на синтезе (Органический синтез — это особая ветвь химического синтеза, связанная с преднамеренным построением органических соединений с помощью органических реакций, или, по-английски… синтез — это набор органических реакций, которые, если правильно выразить в определенном порядке приведет к проблемам с желаемым соединением(ями) органического продукта. А еще лучше, придумайте свои собственные проблемы синтеза или измените лишь небольшую его часть (одна дополнительная двойная связь может иметь ОГРОМНОЕ значение)! Я счастлив сказать, что после почти завершения всей серии о химии (в настоящее время я принимаю o химию 3), что о химия управляема, и это изменило то, как я изучаю и даже подхожу к проблемам. Органическая химия очень наглядна и должна включать в себя рисование соединений и любых идей, которые могут у вас возникнуть для решения проблемы ретросинтеза (обратного синтеза).
А еще лучше, придумайте свои собственные проблемы синтеза или измените лишь небольшую его часть (одна дополнительная двойная связь может иметь ОГРОМНОЕ значение)! Я счастлив сказать, что после почти завершения всей серии о химии (в настоящее время я принимаю o химию 3), что о химия управляема, и это изменило то, как я изучаю и даже подхожу к проблемам. Органическая химия очень наглядна и должна включать в себя рисование соединений и любых идей, которые могут у вас возникнуть для решения проблемы ретросинтеза (обратного синтеза).
Тысячи студентов, прежде чем вы смогли пройти курс, хотя химия может показаться концом хорошего среднего балла, вы будете чувствовать себя потрясающе, когда закончите ее! Удачной учебы всем студентам-химикам!
… о чем мемы!
Фото https://me.me/t/organic-chemistryФото: https://me.me/t/organic-chemistryФото: https://me.me/t/organic-chemistryФото: Organic Chemistry Memes на Facebook
Organic | Химия | Университет Колорадо в Боулдере
Органическая химия имеет давние традиции в Университете Колорадо. На самом деле кафедра назвала свое здание в честь одного из наших бывших химиков-органиков, покойного профессора Стэнли Кристола. Это подразделение отличается исключительной широтой: девять преподавателей и около 40 аспирантов и постдоков работают в традиционных областях органической химии, включая полный синтез, разработку методов, катализ и механистическую органическую химию, а также в междисциплинарных областях, таких как химическая биология, химия материалов и физическая органическая химия.Преподаватели отделения активно сотрудничают с биохимиками, неврологами, атмосферными химиками, физиками и физико-химиками, и у студентов есть возможность работать над проектами, затрагивающими практически все области химии. Недавние статьи, опубликованные синтетическими органическими группами в CU, регулярно появлялись среди 10 самых скачиваемых статей в Журнале Американского химического общества и Angewandte Chemie, а трое из наших нынешних и бывших преподавателей являются членами Национальной академии наук.
На самом деле кафедра назвала свое здание в честь одного из наших бывших химиков-органиков, покойного профессора Стэнли Кристола. Это подразделение отличается исключительной широтой: девять преподавателей и около 40 аспирантов и постдоков работают в традиционных областях органической химии, включая полный синтез, разработку методов, катализ и механистическую органическую химию, а также в междисциплинарных областях, таких как химическая биология, химия материалов и физическая органическая химия.Преподаватели отделения активно сотрудничают с биохимиками, неврологами, атмосферными химиками, физиками и физико-химиками, и у студентов есть возможность работать над проектами, затрагивающими практически все области химии. Недавние статьи, опубликованные синтетическими органическими группами в CU, регулярно появлялись среди 10 самых скачиваемых статей в Журнале Американского химического общества и Angewandte Chemie, а трое из наших нынешних и бывших преподавателей являются членами Национальной академии наук.
Факультет по данному направлению:
Douglas Gin : органический, возобновляемая энергия, физический органический
Оана Лука : неорганическая химия и металлоорганические соединения, физическая неорганическая химия, преобразование солнечного топлива
Михаил Маршак : Катализ переходных металлов, возобновляемая энергия, материалы и нанонаука, неорганические, органические
Йозеф Михл : неорганическая, физическая, фотохимия, металлоорганическая химия, органическая, физико-органическая
Jihye Park : Неорганический; Нанотехнологии/Материалы; Фотохимические реакции и многоэлектронная химия; физико-органическая химия; Возобновляемая энергия
Тарек Саммакия : Органический синтез
Дэвид Вальба : Супермолекулярная стереохимия и хиральность материалов в контексте науки и технологии жидких кристаллов
Мацей Вальчак : Синтез, Химическая биология, Физико-органическая
Сян Ван : Химическая биология, синтез
Вэй Чжан : динамическая ковалентная химия, накопление энергии, нанотехнологии/материалы, самосборка, самовосстановление, синтез
.


 Номера присваиваются в том направлении, которое дает наименьшие номера атомам углерода с присоединенными заместителями.Дефисы используются для отделения чисел от названий заместителей; запятые отделяют числа друг от друга. (LCC не нужно писать прямой линией; например, LCC в следующем примере имеет пять атомов углерода.)
Номера присваиваются в том направлении, которое дает наименьшие номера атомам углерода с присоединенными заместителями.Дефисы используются для отделения чисел от названий заместителей; запятые отделяют числа друг от друга. (LCC не нужно писать прямой линией; например, LCC в следующем примере имеет пять атомов углерода.) Например, этил указан перед диметилом; di- просто игнорируется. Последняя названная алкильная группа ставится перед названием исходного алкана, образуя одно слово.
Например, этил указан перед диметилом; di- просто игнорируется. Последняя названная алкильная группа ставится перед названием исходного алкана, образуя одно слово.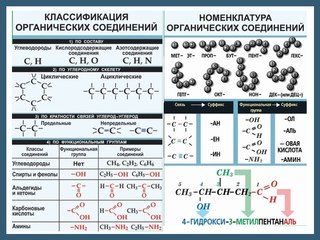 Метильные группы (правило 2) присоединены ко второму и пятому атомам углерода. Название 2,5-диметилгексан.
Метильные группы (правило 2) присоединены ко второму и пятому атомам углерода. Название 2,5-диметилгексан. Вы можете нумеровать родительскую цепочку в любом направлении, если вы непротиворечивы; просто не меняйте направление до того, как структура будет готова. Название указывает на две метильные (CH 3 ) группы, одну на втором атоме углерода и одну на третьем.
Вы можете нумеровать родительскую цепочку в любом направлении, если вы непротиворечивы; просто не меняйте направление до того, как структура будет готова. Название указывает на две метильные (CH 3 ) группы, одну на втором атоме углерода и одну на третьем. Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи.
Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи. Найдите и назовите самую длинную непрерывную углеродную цепь.
Найдите и назовите самую длинную непрерывную углеродную цепь.  Номер места необязателен.
Номер места необязателен.  д., используемые для обозначения нескольких однотипных групп, при алфавитном расположении не учитываются.
д., используемые для обозначения нескольких однотипных групп, при алфавитном расположении не учитываются.