Урок №54. Железо. Нахождение в природе. Свойства железа
Железо – химический элемент
Дополнительно в учебнике “Фоксфорд”
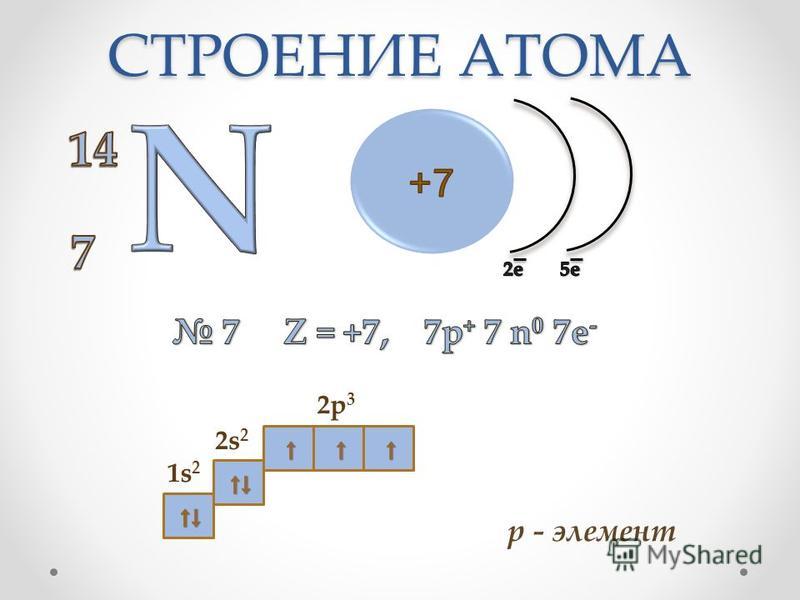
1. Положение железа в периодической таблице химических элементов и строение его атома
Железо – это d- элемент VIII группы; порядковый номер – 26; атомная масса Ar(Fe) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.
Схема строения атома:
Электронная формула: 1s22s22p63s23p63d64s2
Металл средней активности, восстановитель:
Fe0-2e–→Fe+2, окисляется восстановитель
Fe0-3e–→Fe+3, окисляется восстановитель
Основные степени окисления: +2, +3
2. Распространённость железа
Железо – один из самых распространенных элементов в природе. В земной коре его массовая доля составляет 5,1%, по этому показателю оно уступает только кислороду, кремнию и алюминию
 Много железа находится и в небесных телах,
что установлено по данным спектрального анализа. В образцах лунного грунта,
которые доставила автоматическая станция “Луна”, обнаружено железо в
неокисленном состоянии.
Много железа находится и в небесных телах,
что установлено по данным спектрального анализа. В образцах лунного грунта,
которые доставила автоматическая станция “Луна”, обнаружено железо в
неокисленном состоянии.Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа.
Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более.
Основными железными рудами являются:
магнетит (магнитный железняк) –
| |
гематит (железный блеск, кровавик)– Fe2O3содержит до 65% железа, такие месторождения встречаются в Криворожском районе:
лимонит (бурый железняк) – Fe2O3*nH2O содержит до 60% железа, месторождения встречаются в Крыму:
пирит (серный колчедан, железный
колчедан, кошачье золото) – FeS2 содержит примерно 47% железа, месторождения встречаются на Урале.
3. Роль железа в жизни человека и растений
Биохимики
открыли важную роль железа в жизни растений, животных и человека. Входя в
состав чрезвычайно сложно построенного органического соединения, называемого
гемоглобином, железо обусловливает красную окраску этого вещества, от которого
в свою очередь, зависит цвет крови человека и животных. В организме взрослого
человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина.
Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном
направлении – CO
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет.
Так
от одной и той же причины – наличия железа в соках и тканях – весело зеленеют
листья растений и ярко румянятся щеки человека.
4. Физические свойства железа.
Железо – это серебристо-белый металл с температурой плавления 1539оС. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Различают химически чистое и технически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02 -0,04% углерода, а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо содержит менее 0,01% примесей.
 Однако ничтожные доли примесей лишают его этих
драгоценный свойств.
Однако ничтожные доли примесей лишают его этих
драгоценный свойств.5. Получение железа
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
FeO + C = Fe + CO
Fe2O3 + 3CO = 2Fe + 3CO2
Fe2O3 + 3H2 = 2Fe + 3H2O
Опыт “Получение железа алюминотермией”
6. Химические свойства железа
Как элемент побочной подгруппы железо может проявлять несколько степеней окисления. Мы рассмотрим только соединения, в которых железо проявляет степени окисления +2 и +3. Таким образом, можно говорить, что у железа имеется два ряда соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2 O = 4Fe(OH)3
2) Накалённая железная проволока горит в кислороде, образуя окалину – оксид железа (II,III) – вещество чёрного цвета:
3Fe +
2O2 = Fe
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe+O2=2FeO
C кислородом во влажном воздухе образуется Fe2O3*nH2O
Опыт “Взаимодействие железа с кислородом”
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O t˚C→ Fe3O4 + 4H2
4) Железо реагирует с неметаллами при нагревании:
Железо
реагирует с галогенами с
образованием галогенидов.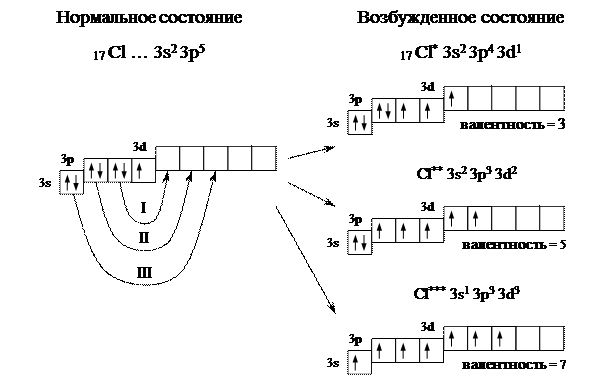
2Fe + 3Cl2 =t= 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
Fe + I2 =t= FeI2
Железо реагирует с серой с образованием сульфида железа (II):
Fe + S =t= FeS
Железо реагирует с фосфором. При этом образуется бинарное соединения – фосфид железа:
Fe + P =t= FeP
С азотом железо реагирует при нагревании с образованием нитрида:
6Fe + N
Железо реагирует с углеродом и кремнием с образованием карбида и силицида:
3Fe + C =t= Fe3C
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4(разб.) = FeSO4 + H2
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании
При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной
оксидной пленки.
2Fe + 6H2SO4(конц.) =t= Fe2(SO4)3 + 3SO2 + 6H2O
Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
Fe+6HNO3(конц.) =t= Fe(NO3)3+3NO2+3H2O
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
Fe+4HNO3(разб
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
8Fe+30HNO3(оч. разб.) =t= 8Fe(NO3)3+3NH4NO3+9H2O
Опыт “Взаимодействие железа с концентрированными кислотами”
7) Железо
вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.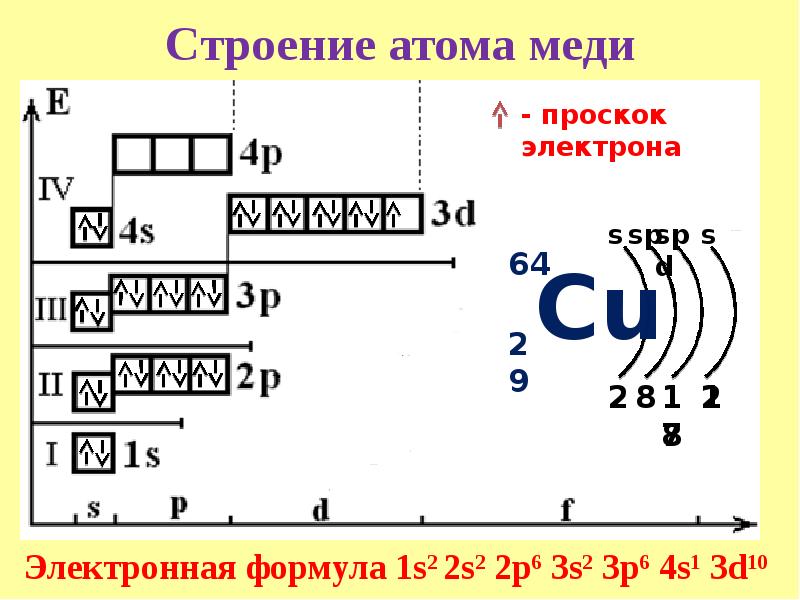
Fe + CuSO4 = FeSO4 + Cu
8) Железо может реагировать с щелочными растворами или расплавами сильных окислителей. При этом железо окисляет до степени окисления +6, образуя соль (феррат)
При взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
Fe+2KOH+3KNO3=3KNO2+K2FeO4+H2O
9) Простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2Fe(NO3)3+Fe=3Fe(NO3)2
2FeCl3+Fe=3FeCl2
Fe2(SO4)3+Fe=3FeSO4
10) Качественные реакции на
Железо (II)
Железо (III)
7. Применение железа.
Основная
часть получаемого в мире железа используется для получения чугуна и стали —
сплавов железа с углеродом и другими металлами. Чугуны содержат около 4%
углерода. Стали содержат углерода менее 1,4%.
Чугуны содержат около 4%
углерода. Стали содержат углерода менее 1,4%.
Чугуны необходимы для производства различных отливок — станин тяжелых машин и т.п.
Изделия из чугуна
Стали используются для изготовления машин, различных строительных материалов, балок, листов, проката, рельсов, инструмента и множества других изделий. Для производства различных сортов сталей применяют так называемые легирующие добавки, которыми служат различные металлы: Мn, Сr, Мо и другие, улучшающие качество стали.
Изделия из стали
“ПОЯВЛЕНИЕ ЖЕЛЕЗА”
ЭТО ИНТЕРЕСНО
ТРЕНАЖЁРЫ
Тренажёр №1 – Генетический ряд Fe 2+
Тренажёр №2 – Генетический ряд Fe 3+
Тренажёр №3 – Уравнения реакций железа с простыми и сложными веществами
Задания для закрепления
№1. Составьте
уравнения реакций получения железа из его оксидов Fe2O3 и
Fe3O4 , используя в качестве восстановителя:
а) водород;
б) алюминий;
в) оксид углерода (II).
Для каждой реакции составьте электронный баланс.
№2. Осуществите
превращения по схеме:
Fe2O3 -> Fe –+h3O,
t -> X –+CO, t-> Y –+HCl-> Z
Назовите продукты X, Y, Z?
Урок 12. медь. цинк. титан. хром. железо. никель. платина – Химия – 11 класс
Химия, 11 класс
Урок № 12. Медь. Цинк. Титан. Хром. Железо. Никель. Платина
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению основных металлов побочной подгруппы или Б-группы: меди, цинка, титана, хрома, железа, никеля и платины, их физическим и химическим свойствам, способам получения и применению.
Глоссарий
Катализатор – вещество, которое ускоряет химическую реакцию.
Пассивация – переход металла в неактивное состояние из-за образования на его поверхности оксидной плёнки. Может усиливаться концентрированными кислотами.
Проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек.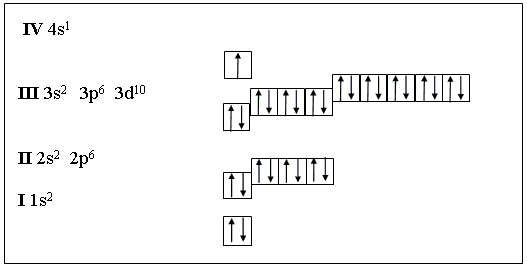
Хромирование/никелирование – покрытие поверхности металла другим, более устойчивым, для предотвращения коррозии.
Цинковая обманка (ZnS) – сложно идентифицируемое соединение цинка, подверженное сильному влиянию примесей на ее внешний вид.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018.
 URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Медь
Электронная конфигурация
Медь является металлом, расположенным в I группе побочной подгруппе и имеет следующую электронную конфигурацию:
1s2
Рисунок 1 – Электронная конфигурация атома меди
Мы видим, что у меди наблюдается проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек. По принципу наименьшей энергии электронные орбитали должны заполняться в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d …
Но для некоторых атомов энергетически более выгодно иметь наполовину (5 электронов, дальше увидим у хрома) или полностью заполненную (10 электронов, как у меди) 3d-орбиталь.
Медь имеет две валентности: 1 и 2 и проявляет степени окисления +1 и +2.
Физические свойства
Медь обладает следующими физическими свойствами
Таблица 1 – Основные физические свойства меди
Свойство | Значение |
Цвет | Светло-розовый |
Структура | Тягучая, вязкая, легко прокатывается |
Температура плавления, °С | 1083 |
Нахождение в природе
В природе медь встречается в самородном виде, а также в составе некоторых минералов:
- медный блеск, Cu2S;
- куприт, Cu2O;
- медный колчедан, CuFeS;
- малахит, (CuOH)2CO3.

Способы получения меди
Основными способами получения меди являются:
- Восстановление коксом и оксидом углерода (II). Таким образом получают медь из куприта:
Cu2O + С = 2Сu + CO
Cu2O + CO = 2Cu + CO2
- Обжиг в специальных печах до оксидов. Данный способ подходит для сульфидных и карбонатных руд.
- Электролиз. Единственный из перечисленных способов, который позволяет получить медь без примесей.
Химические свойства
При комнатной температуре медь не вступает в реакции с большинством соединений. При повышенной температуре ее реакционная способность резко возрастает.
Реакции с простыми веществами:
2Cu + O2 = 2CuO
2Cu + Cl2 = 2CuCl2
Cu + S = CuS
Реакции со сложными веществами:
Cu + 2H2SO4(конц) = CuSO4 + SO2↑ +2H2O
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Применение
Широкое применение находит как сама медь, так и её соединения. В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
Соединения меди, например, медный купорос CuSO4∙5H2O используется для защиты растений, а гидроксид меди является качественным реагентом для определения альдегидной группы у органических соединений, а также наличия глицерина (дает голубое окрашивание раствора).
Цинк
Электронная конфигурация
Цинк является металлом, расположенным в II группе побочной подгруппе, и имеет следующую электронную конфигурацию:
Рисунок 2 – Электронная конфигурация атома цинка
В связи с тем, что 4s-орбиталь заполнена, цинк может находиться в единственной степени окисления, равной +2.
Физические свойства
Цинк обладает следующими физическими свойствами
Таблица 2 – Основные физические свойства цинка
Свойство | Значение |
Цвет | Голубовато-серебристый |
Структура | Хрупок |
Температура плавления, °С | 419,5 |
Нахождение в природе
В природе цинк встречается только в связанном состоянии, а именно в цинковом шпате ZnCO3 и цинковой обманке ZnS. Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Способы получения цинка
Чистый цинк получают обжигом с последующим восстановлением:
ZnS + O2 = ZnO + SO2↑
ZnO + C = Zn + CO↑
Химические свойства
Цинк является довольно устойчивым металлом, поскольку на воздухе покрывается оксидной пленкой, и в дополнение практически не взаимодействует с водой при нормальных условиях. Но так же, как и медь, становится более активным при повышении температуры.
Реакции с простыми веществами:
2Zn + O2 = 2ZnO
2Zn + Cl2 = 2ZnCl2
Zn + S = ZnS
Реакции со сложными веществами:
Zn + 2NaOH(крист) = NaZnO2 + H2↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Применение
Цинк является коррозионно-устойчивым металлом, поэтому он нашёл применение в производстве защитных покрытий металлов, гальванических элементов, а также как компонент сплавов.
Титан
Электронная конфигурация
Титан является элементом IV группы побочной подгруппы и имеет следующее электронное строение:
Рисунок 3 – Электронная конфигурация атома титана
Данная конфигурация позволяет атому титана проявлять две степени окисления: +2 и +4.
Физические свойства
Титан обладает следующими физическими свойствами:
Таблица 3 – Основные физические свойства титана
Свойство | Значение |
Цвет | Серебристо-белый |
Структура | Высокая прочность и взякость |
Температура плавления, °С | 1665 |
Нахождение в природе
В природе титан можно найти в составе таких минералов, как:
- титаномагнетит, FeTiO3∙Fe3O4;
- ильменит, FeTiO3;
- рутил, TiO2.
Способы получения титана
В связи с тем, что в природе не существует титановых руд, человеку приходится извлекать его путём хлорирования рудных концентратов с их последующим восстановлением с помощью магния или натрия.
TiCl4 + 2Mg = Ti + 2MgCl2
Для удаления примесей магния и его соли полученную смесь продуктов нагревают под вакуумом.
Химические свойства
Титан является очень активным металлом, но его оксидная пленка не даёт ему взаимодействовать при нормальных условиях ни с морской водой, ни даже с «царской водкой». Поэтому все реакции протекают при повышенных температурах.
Реакции с простыми веществами:
Ti + 2Cl2 = TiCl4
Ti + O2 = TiO2
Азотная кислота действует на титан только в форме порошка, в то время как разбавленная серная кислота реагирует с металлом:
2Ti + 3H2SO4 = Ti2(SO4)3 + 3H2↑
Применение
Титан и его сплавы отличает не только коррозионная стойкость, но и лёгкость, прочность. В связи с этим он активно используется при построении космических ракет, самолётов, подлодок и морских судов. Титан не взаимодействует с тканями организмов, из-за чего используется в хирургии.
Хром
Электронная конфигурация
Хром находится в IV группе побочной подгруппе и имеет следующее электронное строение:
Рисунок 4 – Электронная конфигурация атома хрома
Так как для атома хрома энергетически более выгодно иметь наполовину заполненную 3d-орбиталь, у него, как и у меди, наблюдается проскок электрона, что позволяет ему находиться в степенях окисления от +1 до +6, но наиболее устойчивыми являются +2, +3, +6.
Физические свойства
Хром обладает следующими физическими свойствами:
Таблица 4 – Основные физические свойства хрома
Свойство | Значение |
Цвет | Серебристо-белый с металлическим блеском |
Структура | Твердый |
Температура плавления, °С | 1890 |
Нахождение в природе
В природе большая часть хрома заключена в составе хромистого железняка Fe(CrO2)2. Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Способы получения хрома
Из хромистого железняка путем восстановлением углем при высоких температурах получают смесь железа и хрома – феррохром:
FeO + Cr2O3 + 3C = Fe + 2Cr + 3CO↑
Для получения чистого хрома проводят восстановление оксида хрома (III) алюминием:
Cr2O3 + 2Al = 2Cr + Al2O3
Химические свойства
Как и все вышеописанные металлы, хром покрыт оксидной плёнкой, которую трудно растворить даже сильными кислотами. Благодаря ней он обладает высокой стойкости к коррозии, поэтому начинает реагировать с разбавленными растворами кислот лишь спустя время. Концентрированные кислоты, такие как HNO3 и H2SO4, пассивируют оксидную пленку (укрепляют ее).
Применение
Благодаря своей коррозионной стойкости, хром используют в качестве защитных покрытий (хромируют поверхности металлов и сплавов). Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Железо
Железо – металл, с которым мы чаще всего сталкиваемся в нашей жизни, поэтому переоценить его значимость для человека невозможно. Он является самым распространенным после алюминия и составляет 5% земной коры. Теперь перейдем к рассмотрению его строения и свойств.
Электронная конфигурация
Железо находится в VII группе Б-подгруппе и имеет такое электронное строение, которое позволяет ему находиться в двух степенях окисления: +2 и +3. Конечно, в теории железо может выступать в качестве шестивалентного металла, но из-за пространственных затруднений ему не удается образовать такое количество связей. Поэтому такое состояние является неустойчивым для данного металла.
Рисунок 5 – Электронная конфигурация атома железа
Физические свойства
Железо обладает следующими физическими свойствами:
Таблица 5 – Основные физические свойства железа
Свойство | Значение |
Цвет | Серебристо-белый |
Структура | Мягкий, пластичный |
Температура плавления, °С | 1539 |
Нахождение в природе
Встречается железо в виде различных соединений: оксидов, сульфидов, силикатов.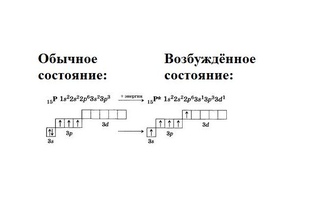 В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Способы получения железа
Существует множество способов получения железа, и отличаются они друг от друга степенью его чистоты и требуемым типом конечного продукта.
- Восстановлением из оксидов (железо пирофорное).
- Электролизом водных растворов его солей (железо электролитическое).
- Разложением пентакарбонила железа Fe(CO)5 при нагревании до t 250°С.
- Методом зонной плавки (получение особо чистого железа).
- Технически чистое железо (около 0,16% примесей углерода, кремния, марганца, фосфора, серы и др.) выплавляют, окисляя компоненты чугуна в мартеновских сталеплавильных печах и в кислородных конверторах.
- Сварочное или кирпичное железо получают, окисляя примеси малоуглеродистой стали железным шлаком или путём восстановления руд твёрдым углеродом.
Химические свойства
Под воздействием высоких температур железо взаимодействует с простыми веществами:
2Fe + 3O2 = Fe2O3 ∙FeO
В ходе данной реакции происходит получение смеси оксидов, которую иногда записывают в виде общей формулы Fe3O4.
2Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
Взаимодействует с разбавленными кислотами, причем с соляной кислотой происходит образование соли только двухвалентного железа:
Fe + 2HCl(разб) = FeCl2 + H2↑
При комнатной температуре железо пассивируется концентрированными кислотами, но при высоких температурах вступает в реакцию окисления:
2Fe + 6H2SO4(конц) = Fe2(SO4)3 + 3SO2 + 6H2O
Вступает в реакцию обмена с солями, образованными катионами более слабых металлов:
Fe + CuSO4 = FeSO4 + Cu↓
Применение
Про области применения железа можно говорить достаточно долго, поэтому выделим основные направления:
- В связи с его способностью быстро намагничиваться, его используют в трансформаторах и электромоторах.
- Основная масса железа расходуется на производство различных сплавов, таких как чугун и сталь.

Никель и платина
Далее стоит обратить на два металла: никель и платина. Как нам известно, они имеют схожие области применения, но отличаются по цене и качеству, потому предлагаю сравнить их.
Электронная конфигурация
Электронное строение металлов выглядит следующим образом:
Ni …3s2 3p6 3d8 4s2
Характерные степени окисления: + 2 и +3, но последняя является неустойчивой.
Pt …5s2 5p6 5d9 6s1
Характерные степени окисления: + 2 и +4.
Физические свойства
Таблица 5 – Основные физические свойства железа
Свойство | Значение | |
Ni | Pt | |
Цвет | Серебристо-белый | Белый |
Структура | Очень твердый | Пластичный |
Температура плавления, °С | 1453 | 1769 |
Химические свойства
Никель при повышенных температурах реагирует с галогенами с образованием солей, и с кислородом с образованием оксида никеля (II), в то время как платина очень устойчива к любым взаимодействиям. Реагирует с серой и галогенами в мелкораздробленном виде.
Реагирует с серой и галогенами в мелкораздробленном виде.
Никель медленно взаимодействует с разбавленными кислотами, когда платина реагирует только с «царской водкой».
Применение
Оба металла активно используются в переработке нефти в качестве катализаторов.
Катализатор – вещество, которое ускоряет химическую реакцию.
Каждые 2-3 года закупаются тонны реагентов, в составе которых всего несколько десятых процента платины или никеля, но именно они определяют их стоимость.
Также они используются в составе высококачественных сплавов, а никель – как антикоррозионное покрытие.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на вычисление количества исходного реагента.
Условие задачи: При растворении меди в растворе концентрированной азотной кислоты выделилось 2 л газа. Вычислите массу прореагировавшей меди.
Шаг первый. Напишем уравнение реакции и определим, какой газ выделился, расставим коэффициенты.
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
Шаг второй. Вычислим количество вещества газа:
Шаг третий. Вычислим количество вещества меди:
По уравнению реакции: n(Cu) = 0,5n(NO2), тогда
n(Cu) = 0,5 ∙ 0,089 = 0,044 (моль)
Шаг четвёртый. Вычислим массу меди:
m(Cu) = 0,044 ∙ 46 = 2,024 (г)
Ответ: 2,024 (г).
- Решение задачи на выход продукта.
Условия задачи: при обжиге 8,515 г сульфида цинка с последующим восстановлением оксида с помощью угля выделилось 3,45 л газа. Рассчитайте выход реакции обжига, если выход реакции восстановления равен 60%.
Шаг первый. Запишем уравнения реакций и вычислим молярные массы компонентов:
ZnS + O2 = ZnO + SO2↑
ZnO + C = Zn + CO↑
M (ZnO) = 81 г/моль
Шаг второй. Вычислим количество вещества газа:
Шаг третий. Вычислим массу оксида цинка:
Так как выход реакции составил 60%, то
n (ZnO) = 0,6n (CO) = 0,6 ∙ 0,154 = 0,0924 (моль)
Шаг четвёртый. Вычислим массу оксида цинка:
Вычислим массу оксида цинка:
Шаг пятый. Вычислим выход реакции:
Ответ: 87, 89%.
Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов / Справочник :: Бингоскул
Электронная конфигурация атомов
Записать распределение электронов по энергетическим уровням можно несколькими способами.
Запись по электронным оболочкам (схема электронного строения)
Показывает заряд ядра и количество электронов на каждом энергетическом уровне.
Легче всего начинать с неё, потому что она показывает структуру атома «крупным планом».
Запись с обозначением энергетических уровней и подуровней
Каждая орбиталь обозначается квадратной ячейкой. Электрон обозначается стрелкой. Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.
Буквенно-числовое обозначение такого «адреса» электрона – это электронная формула. Электронная конфигурация – это электронная формула, которая показывает распределение электронов по энергетическим уровням.
Электронная конфигурация – это электронная формула, которая показывает распределение электронов по энергетическим уровням.
Электронная конфигурация атомов 1 и 2 периодов
Электронная конфигурация атомов 3 периода
Строение электронных оболочек атомов элементов третьего периодаЭлектронная конфигурация атомов 4 периода
Заполнение орбиталей атомов 4 периода имеет свои особенности.
На движение электрона влияют поле ядра и поле других электронов. Поэтому в атомах с большим количеством электронов энергия электрона определяется главным и орбитальным квантовыми числами.
Здесь уже надо смотреть на сумму обоих квантовых чисел (n+l). Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Поэтому в 4 периоде сначала заполняется подуровень 4s, а потом подуровень 3d.
Есть ещё одна особенность, которая появляется в 4 периоде. Хром и медь имеют на 4s-орбитали по одному электрону. Всё дело в заполнении d-оболочек. Полузаполненные или заполненные d-оболочки устойчивее частично заполненных. В атоме хрома на каждой из 5 3d-орбиталей есть по одному электрону. В атоме меди на каждой на каждой 3d-орбитали есть по два электрона.
Алгоритм записи электронной конфигурации атома
- По порядковому номеру химического элемента в таблице Менделеева определяем количество электронов в атоме.
- Распределяем электроны по энергетическим уровням, то есть составляем схему электронного строения.
- Выписываем s-, p-, d-подуровни в каждом энергетическом уровне.
- Заполняем подуровни электронами: сначала по одному электрону на орбиталь, потом достраиваем электронные пары.
Электронная конфигурация ионов
Электронная конфигурация ионов составляется по тем же принципам. Нужно учитывать изменения количества электронов на внешнем энергетическом уровне.
Атом электронейтрален, то есть сколько протонов ядре, столько же электронов в атоме. Если атом принимает электроны, он становится отрицательно заряженным ионом (анионом), если отдаёт электроны – положительно заряженным ионом (катионом).
Атому легче всего отдать электроны внешнего энергетического уровня, «чужие» электроны он тоже примет на внешний энергетический уровень. На внешнем энергетическом уровне не может находиться более 8 электронов. Теория «октета» была предложена в 1916 году Гилбертом Ньютоном Льюисом и Вальтером Косселем
Атом «стремится» добрать электроны на внешний уровень или избавиться от них, поэтому и становится ионом. Полное заполнение s- и p-подуровней внешнего уровня придаёт атому стабильность. Только атом гелия имеет на единственном внешнем энергетическом уровне 2 электрона, а не 8, потому что первый энергетический уровень состоит только из одной s-орбитали.
Количество электронов на внешнем энергетическом уровне определяется по таблице Менделеева. У элементов главных подгрупп номер группы – это и есть количество электронов на внешнем уровне. У элементов побочных подгрупп количество электронов на внешнем уровне не больше двух.
У элементов главных подгрупп номер группы – это и есть количество электронов на внешнем уровне. У элементов побочных подгрупп количество электронов на внешнем уровне не больше двух.
Основное и возбуждённое состояния атома
На первый взгляд кажется, что атом хлора может образовывать только одну связь и соединения одного типа – например, хлориды. Но откуда берутся хлорная, хлорноватая, хлористая и хлорноватистая кислоты?
Дело в том, что атом можно перевести из основного состояния в возбуждённое.
Основное состояние – это состояние атома с наименьшей энергией. Атом обладает наименьшей энергией в основном состоянии. Но если ему передать дополнительную энергию, он перейдёт в возбуждённое состояние. Электроны перейдут на уровень или подуровень с большей энергией.
Сначала разрываются электронные пары на 3p-подуровне, электроны переходят на 3d-подуровень. Если атом хлора получит ещё больше энергии, спаренный электрон покинет даже 3s-орбиталь и перейдёт на 3d-подуровень.
Благодаря этому атом хлора может образовывать больше химических связей. Затраты энергии, потраченные на распаривание электронов, окупаются при образовании новых химических связей.
Но в возбуждённое состояние могут перейти атомы, у которых есть неспаренные электроны и свободные орбитали. Длится возбуждённое состояние недолго: атом отдаст энергию и вернётся в основное состояние. Хотя если сообщить атому слишком много энергии, электрон покинет его и атом станет ионом.
Смотри также:
Хром
| Хром / Chromium (Cr) | |
|---|---|
| Атомный номер | 24 |
| Внешний вид простого вещества |
твёрдый металл голубовато-белого цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
51,9961 а. е. м. (г/моль) е. м. (г/моль) |
| Радиус атома | 130 пм |
|
Энергия ионизации (первый электрон) |
652,4 (6,76) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Химические свойства | |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
|
Электроотрицательность (по Полингу) |
1,66 |
| Электродный потенциал | -0.74 |
| Степени окисления | 6, 3, 2, 0 |
| Термодинамические свойства простого вещества | |
| Плотность | 7,18 г/см³ |
| Молярная теплоёмкость | 23,3 Дж/(K·моль) |
| Теплопроводность | 93,9 Вт/(м·K) |
| Температура плавления | 2130 K |
| Теплота плавления | 21 кДж/моль |
| Температура кипения | 2945 K |
| Теплота испарения | 342 кДж/моль |
| Молярный объём | 7,23 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Отношение c/a | — |
| Температура Дебая | 460 K |
| Cr | 24 |
| 51,9961 | |
| [Ar]3d54s1 | |
| Хром | |
Хром —элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 24. Обозначается символом Cr (Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
И. Менделеева, атомный номер 24. Обозначается символом Cr (Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
История
Схема атома хрома
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего Воклен получил карбид хрома).
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Добыча
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 млн. т (или 1 место в мире)
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Из него получают феррохром восстановлением в электропечах коксом (углеродом):
- FeO · Cr2O3 + 4C → Fe + 2Cr + 4CO↑
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата углём:
- Na2Cr2O7 + 2C → Cr2O3 + Na2CO3 + CO↑
5) с помощью алюминотермии получают металлический хром:
- Cr2O3+ 2Al → Al2O3 + 2Cr + 130 ккал
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты.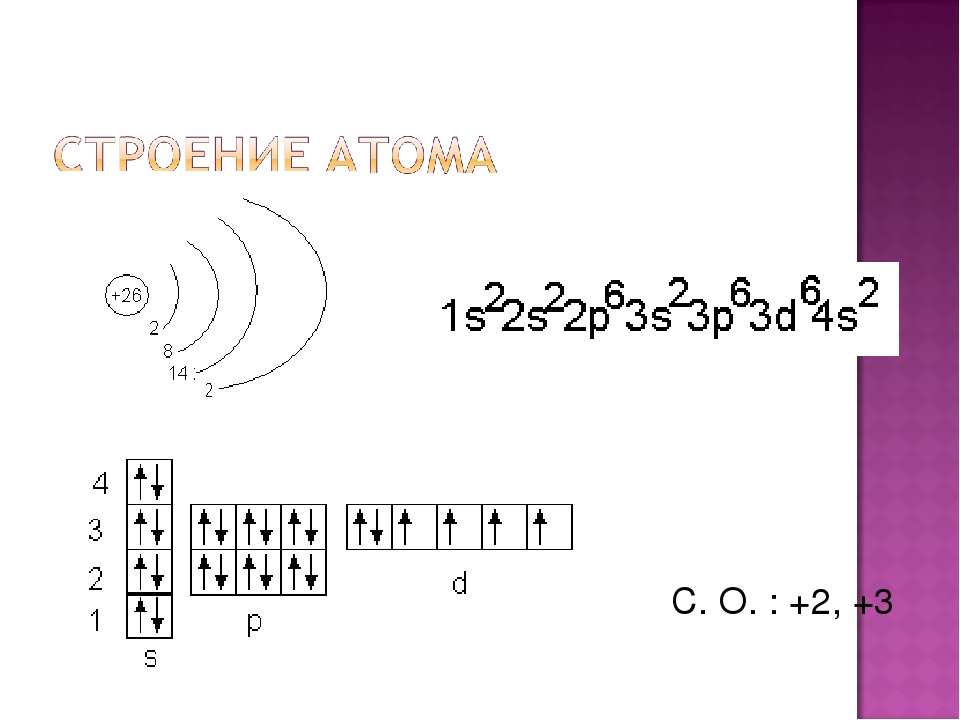 При этом на катодах совершаются в основном 3 процесса:
При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
- Cr2O72− + 14Н+ + 12е− = 2Cr + 7H2O
Физические и химические свойства
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
Хром является самым твердым металлом (твердость по шкале Мооса 8.5).
Устойчив на воздухе. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.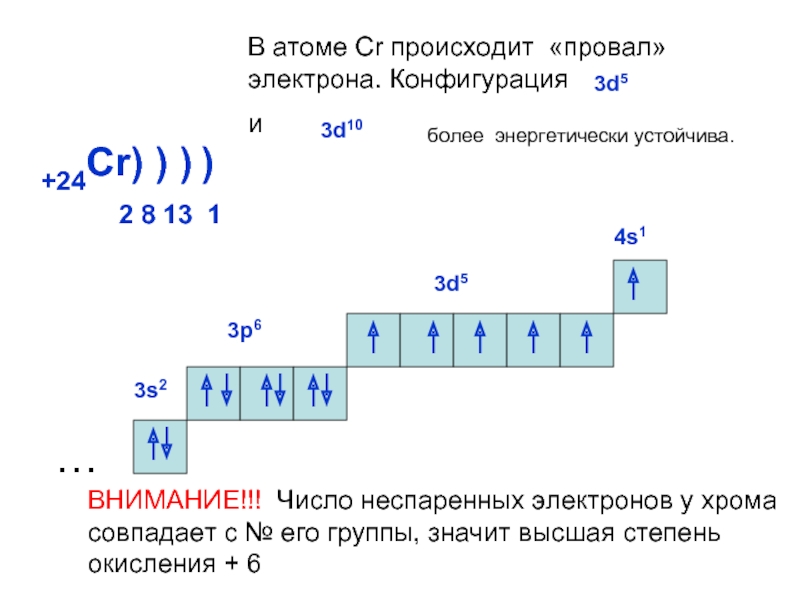 Сплавляя Cr2O3 со щелочами получают хромиты:
Сплавляя Cr2O3 со щелочами получают хромиты:
- Cr2O3 + 2NaOH → 2NaCrO2 + H2O.
Непрокаленный оксид хрома(III) легко растворяется в щелочных растворах и в кислотах:
- Cr2O3 + 6HCl → 2CrCl3 + 3Н2О.
При термическом разложении карбонила хрома Cr(СО)6 получают красный основной оксид хрома(II) CrO. Коричневый или желтый гидроксид Cr(OH)2 со слабоосновными свойствами осаждается при добавлении щелочей к растворам солей хрома(II).
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
При взаимодействии концентрированной серной кислоты с растворами дихроматов образуются красные или фиолетово-красные кристаллы оксида хрома(VI) CrO3. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие.
Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие.
Известны галогениды, соответствующие разным степеням окисления хрома. Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2 и тригалогениды CrF3, CrCl3, CrBr3 и CrI3. Однако, в отличие от аналогичных соединений алюминия и железа, трихлорид CrCl3 и трибромид CrBr3 хрома нелетучи.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах. Известен гексафторид хрома CrF6.
Получены и охарактеризованы оксигалогениды хрома CrO2F2 и CrO2Cl2.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).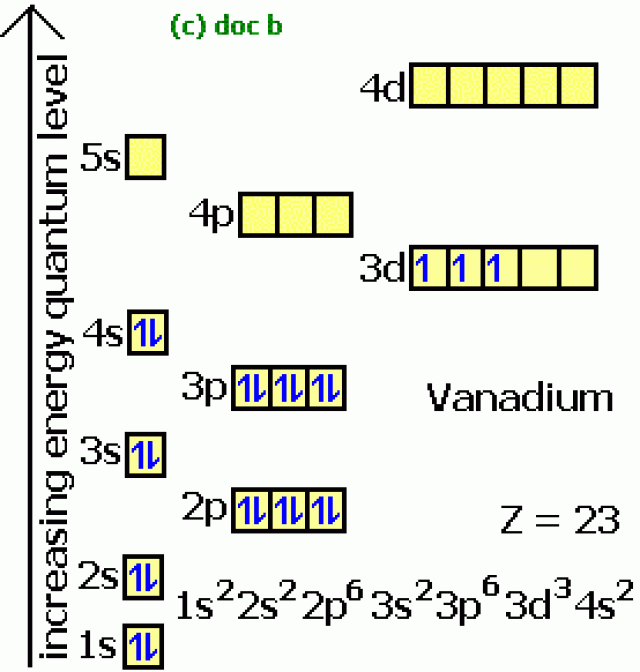
В растворах наиболее устойчивы соединения хрома(III). В этой степени окисления хрому соответствуют как катионная форма, так и анионные формы, например, существующий в щелочной среде анион [Cr(OH)6]3−.
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
- 2Na3[Cr(OH)6] + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O.
Хрому(VI) отвечает ряд существующих только в водных растворах кислот: хромовая H2CrO4, дихромовая H2Cr2O7, трихромовая H3Cr3O10 и другие, которые образуют соли — хроматы, дихроматы, трихроматы и т. д.
В зависимости от кислотности среды анионы этих кислот легко превращаются друг в друга. Например, при подкислении жёлтого раствора хромата калия K2CrO4 образуется оранжевый дихромат калия K2Cr2O7:
-
2K2CrO4 + 2HCl → K2Cr2O7 + 2KCl + Н2О.

Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат калия K2CrO4:
- K2Cr2O7 + 2KOH → 2K2CrO4 + Н2О.
При добавлении к жёлтому раствору, содержащему хромат-ионы, раствора соли бария выпадает жёлтый осадок хромата бария BaCrO4:
- Ba2+ + CrO42- → BaCrO4↓.
Соединения хрома(VI) — сильные окислители, например:
- K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O.
Применение
Хром важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Металлический хром практически нетоксичен, но металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м³.
Соединения хрома
Хромтау
Урок в 11 классе по теме “Контрольная работа по теме “Строение атома””
Контрольная работа № 1 по теме: «Строение атома».
I вариант.
1 Укажите заряд ядра атома фосфора
1) + 31 2) +16 3) +15 4) +30
2 Число нейтронов в ядре изотопа 20 F равно …
1) 10 2) 11 3) 20 4) 9.
3 Число электронов в ионе алюминия AL 3+ равно
1) 10 2) 13 3) 14 4) 16
4 Число электронов в атоме аргона равно числу электронов в ионе
1) S2- 2) AL3+ 3)Na+ 4)F–
5 Восьмиэлектронную внешнюю оболочку имеет ион
|
1) Р 3+ |
3) S 2- |
|
2) Fe 2+ |
4) CI 5+ |
6 Среди элементов VIА группы максимальный радиус атома имеет
|
1) кислород |
3) теллур |
|
2) сера |
4) полоний |
7 В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
|
1) Na, Mg, AI, Si |
3) P,S, CI, Ar |
|
2) Li, Be, B,C |
4) F, O,N,C |
8 В каком ряду химические элементы расположены в порядке усиления металлических свойств?
|
1) Na, Mg, Al |
3) Cа, Mg, Be |
|
2) Al, Mg, Na |
Mg, Be, Cа |
9 В ряду химических элементов Si P S CI неметаллические свойства
|
1) ослабевают |
3) не изменяются |
|
2) усиливаются |
4) изменяются периодически |
10 Наименьшей электроотрицательностью обладает элемент
11 В ряду Li Na K Rb способность металлов отдавать электроны
|
1) возрастает |
3) не изменяются |
|
2) ослабевает |
4) изменяются периодически |
12 Формула высшего оксида хлора
|
1) Cl2O |
3) Cl2O6 |
|
2) ClO2 |
4) Cl2O7 |
13 Какие из приведенных утверждений верны?
А. Основным оксидам соответствуют основания.
Основным оксидам соответствуют основания.
Б. Основные оксиды образуют только металлы.
|
1) верно только А |
3) верны оба утверждения |
|
2) верно только Б |
4) оба утверждения неверны. |
14 В ряду оксидов SiO2 P2 O 5 SO3 CI2 O 7
|
1) кислотные свойства возрастают |
3) основные свойства возрастают |
|
2) кислотные свойства ослабевают |
4) свойства не изменяются |
15 В ряду химических элементов бор – углерод – азот возрастает
1) способность атома отдавать электроны 3) высшая степень окисления
2) низшая степень окисления 4) радиус атома
|
В задании № 16 на установление соответствия запишите в таблицу цифры выбранных вами ответов. |
16. Установите соответствие между элементом, частицей и электронной формулой.
|
Элемент, частица |
Электронная формула |
|
1) Ca |
1) 1s22s2 2p6 3s23p6 |
|
2) Сu |
2) 1s22s2 2p6 3s23p6 4s2 |
|
3) S 2- |
3) 1s22s2 2p6 3s23p6 4s13d10 |
|
4) S 4+ |
4) 1s22s2 2p6 3s23p6 4s23d9 |
|
|
5) 1s22s2 2p6 3s2 |
|
|
6) 1s22s2 2p6 3s23p2 |
17 Для атома химического элемента с порядковыми номером 34 опишите состав атома (число протонов, нейтронов, протонов), нарисуйте схему строения атома, составьте электронную формулу и электронно-графическую схему. Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
18. Атом химического элемента имеет на семь электронов меньше, чем ион хлора. Назовите элемент, составьте электронную формулу его атома и иона.
19. Составьте электронные формулы атомов кремний и титана. Отметьте черты сходства и различия в строении этих химических элементов. Определите высшую и низшую возможные для этих атомов степени окисления. Напишите формулы высших оксидов этих элементов и соответствующих им гидроксидов. Укажите их характер.
Объясните, почему кремний и титан находятся: а) в IV группе Периодической системы химических элементов Д.И. Менделеева; б) в разных подгруппах этой группы.
20. Одинаковые ли валентные возможности азота и фосфора? Поясните ответ, составив графические схемы строения атомов этих элементов, указав валентности.
21. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
Сa, Sr, Ba. Укажите их характер. Расположите в порядке возрастания их свойств.
22. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
P, S, CL. Укажите их характер. Расположите в порядке уменьшения их свойств.
23. Напишите формулы соединений с водородом следующих химических элементов: O, I, F, CL, Na, Br. Выберите формулы соединений, обладающих кислотными свойствами, и расположите их в ряд в порядке убывания кислотных свойств.
24. На основании положения в Периодической системе расположите элементы: О, F, CL, S – в порядке возрастания окислительных свойств. Объясните ответ.
Объясните ответ.
25. Составьте электронные формулы ионов: Na+,As3-,Fe3+.
26. Составьте электронную формулу и энергетическую диаграмму для Cr0 .Составьте электронные формулы : Cr0,Cr2+,Cr3+,Cr 6+
Контрольная работа № 1 по теме: «Строение атома».
II вариант.
1Укажите заряд ядра атома калия
1) + 19 2) +20 3) +39 4) +32
2 Число нейтронов в ядре изотопа 17О равно …
1) 3 2) 7 3) 9 4) 14.
3 Число электронов в ионе цинка Zn2+ равно
4 Число электронов в атоме неона равно числу электронов в ионе
|
1) S2- |
3) CL– |
|
2) K+ |
4) Na+ |
5 Какую электронную конфигурацию имеет атом наиболее активного металла
|
1) 1s22s2 2p6 3s2 |
3) 1s22s2 2p1 |
|
2) 1s22s2 2p6 3s1 |
4) 1s22s1 |
6 Среди элементов VII А группы максимальный радиус атома имеет
|
1) фтор |
3) бром |
|
2) хлор |
4) йод |
7 В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
|
1) Be, B, C,N |
3) O, S, Se, Te |
|
2) Rb, K, Na, Li |
4) Mg, AI, Si, P |
8 В каком ряду химические элементы расположены в порядке усиления неметаллических свойств?
|
1) F,O,N |
3) O,S,Se |
|
2) As, P, N |
4) CI, S, P |
9 В ряду химических элементов Li Na K металлические свойства
|
1) возрастают |
3) не изменяются |
|
2) ослабевают |
4) периодически повторяются |
10 Наибольшей электроотрицательностью обладает элемент?
11 В ряду Na Mg AI способность металлов отдавать электроны
|
1) возрастает |
3) не изменяются |
|
2) ослабевает |
4) изменяются периодически |
12 К кислотным оксидам относится
|
1) BeO |
3) Na2O |
|
2) CaO |
4) СО2 |
13 Какие из приведенных утверждений верны?
А. В периоде слева направо радиус атомов уменьшается.
В периоде слева направо радиус атомов уменьшается.
Б. В периоде слева направо металлические свойства усиливаются.
|
1) верно только А |
3) верны оба утверждения |
|
2) верно только Б |
4) оба утверждения неверны. |
14 В ряду оксидов Li2O Na2O K2O
|
1) кислотные свойства возрастают |
3) основные свойства ослабевают |
|
2) основные свойства возрастают |
4) свойства не изменяются. |
15 В ряду элементов: азот кислород фтор увеличивается
|
1) атомный радиус |
3) число s- электронов в атоме |
|
2) число неспаренных электронов в атоме |
4) электроотрицательность |
|
В задании № 16 на установление соответствия запишите в таблицу цифры выбранных вами ответов. (Цифры в ответе могут повторяться.) |
В1 Установите соответствие между элементом, частицей и электронной формулой.
|
Элемент, частица |
Электронная формула |
|
1) K |
1) 1s22s2 2p6 3s23p6 |
|
2) Сr |
2) 1s22s2 2p6 3s23p6 4s1 |
|
3) P3- |
3) 1s22s2 2p6 3s23p6 4s13d5 |
|
4) P 5+ |
4) 1s22s2 2p6 3s23p6 4s23d4 |
|
|
5) 1s22s2 2p6 3s2 |
|
|
6) 1s22s2 2p6 |
18. Для атома химического элемента с порядковым номером 31 опишите состав атома (число протонов, нейтронов, протонов), нарисуйте схему строения атома, составьте электронную формулу и электронно-графическую схему. Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
Для атома химического элемента с порядковым номером 31 опишите состав атома (число протонов, нейтронов, протонов), нарисуйте схему строения атома, составьте электронную формулу и электронно-графическую схему. Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
18. Атом химического элемента имеет на шесть электронов больше, чем ион магния. Назовите элемент, составьте электронную формулу его атома и иона.
19. Составьте электронные формулы атомов ванадия и фосфора. Отметьте черты сходства и различия в строении этих химических элементов. Определите высшую и низшую возможные для этих атомов степени окисления. Напишите формулы высших оксидов этих элементов и соответствующих им гидроксидов. Укажите их характер.
Укажите их характер.
Объясните, почему ванадий и фосфор находятся: а) в V группе Периодической системы химических элементов Д.И. Менделеева; б) в разных подгруппах этой группы.
20. Одинаковые ли валентные возможности кислорода и серы? Поясните ответ, составив графические схемы строения атомов этих элементов, указав валентности.
21. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
CL, Br, I. Укажите их характер. Расположите в порядке возрастания их свойств.
22. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
Rb, Sr, In. Укажите их характер. Расположите в порядке уменьшения их свойств.
23. Напишите формулы водородных соединений химических элементов 2-го периода. Выберите из них: а) наиболее типичный гидрид металла; б) самую сильную кислоту.
24. На основании положения в Периодической системы расположите элементы: Na, AI, Ca, K – в порядке возрастания восстановительных свойств. Объясните ответ.
Контрольная работа № 1 по теме: «Строение атома».
III вариант.
1Укажите заряд ядра атома алюминия
1) + 13 2) +14 3) +27 4) +3
2 Число нейтронов в ядре изотопа 40 К равно …
1) 19 2) 20 3) 21 4) 39.
3 Число электронов в ионе селена Se2- равно
4 Число электронов в атоме аргона равно числу электронов в ионе
|
1) O2- |
3) S 2- |
|
2) Mg 2+ |
4) Na+ |
5 Число энергетических уровней и число внешних электронов атома хлора соответственно равны
|
1) 4,6 |
3) 3,7 |
|
2) 2,5 |
4) 4,5 |
6 Наибольший радиус имеет атом
|
1) брома |
3) цезия |
|
2) мышьяка |
4) йода |
7 В каком ряду расположены элементы в порядке уменьшения их атомного радиуса?
|
1) Сa, Mg, Be |
3) B, Be, Li |
|
2) N,P, As |
4) CL, S, P |
8 В каком ряду расположены элементы в порядке усиления металлических свойств?
|
1) Ca, Mg, Be |
3) Rb, K, Na |
|
2) Li, Be, B |
4) Li, Na, K |
9. В ряду химических элементов N P As неметаллические свойства
В ряду химических элементов N P As неметаллические свойства
|
1) ослабевают |
3) не изменяются |
|
2) усиливаются |
4) изменяются периодически |
10 Наименьшей электроотрицательностью обладает элемент
11 В ряду Na Mg AI способность металлов отдавать электроны
|
1) возрастает |
3) не изменяются |
|
2) ослабевает |
4) изменяются периодически |
12. K амфотерному оксиду относится
K амфотерному оксиду относится
|
1) CaO |
3) Li2O |
|
2) P2O5 |
4) AL2O3 |
13 Какие из приведенных утверждений верны?
А. В группе сверху вниз радиус атомов увеличивается.
Б. В группе сверху вниз восстановительные свойства усиливаются.
|
1) верно только А |
3) верны оба утверждения |
|
2) верно только Б |
4) оба утверждения неверны. |
14 В ряду оксидов СO2 SiO 2 GeO2
|
1) кислотные свойства усиливаются |
3) основные свойства ослабевают |
|
2) кислотные свойства ослабевают |
4) свойства не изменяются. |
15 У элементов подгруппы углерода с увеличением порядкового номера уменьшается
|
1) атомный радиус |
3) число валентных электронов в атоме |
|
2) заряд ядра атома |
4) электроотрицательность |
|
В задании № 16 на установление соответствия запишите в таблицу цифры выбранных вами ответов. |
|
16 Установите соответствие между элементом, частицей и электронной формулой.
|
Элемент, частица |
Электронная формула |
|||
|
1) Sc |
1) 1s22s2 2p6 3s23p6 |
|||
|
2) Сu |
2) 1s22s2 2p6 3s23p6 4s23d1 |
|||
|
3) CI– |
3) 1s22s2 2p6 3s23p6 4s13d10 |
|||
|
4) CI 5+ |
4) 1s22s2 2p6 3s23p6 4s23d9 |
|||
|
|
5) 1s22s2 2p6 3s2 |
|||
|
|
6) 1s22s2 2p6 |
|||
|
1 |
2 |
3 |
4 |
|
|
|
|
|
|
|
17 Для атома химического элемента с порядковым номером 33 опишите состав атома (число протонов, нейтронов, протонов), нарисуйте схему строения атома, составьте электронную формулу и электронно-графическую схему. Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
18 Атом химического элемента имеет на один электрон меньше, чем ион алюминия. Назовите элемент, составьте электронную формулу его атома и иона.
19. Составьте электронные формулы атомов серы и хрома. Отметьте черты сходства и различия в строении этих химических элементов. Определите высшую и низшую возможные для этих атомов степени окисления. Напишите формулы высших оксидов этих элементов и соответствующих им гидроксидов. Укажите их характер.
Объясните, почему сера и хром находятся: а) в VI группе Периодической системы химических элементов Д.И. Менделеева; б) в разных подгруппах этой группы.
20. Одинаковые ли валентные возможности фтора и хлора? Поясните ответ, составив графические схемы строения атомов этих элементов, указав валентности.
21. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
Rb, Cs, Fr. Укажите их характер. Расположите в порядке возрастания их свойств.
22. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
As, Se, Br. Укажите их характер. Расположите в порядке уменьшения их свойств.
23. Напишите формулы соединений с водородом следующих химических элементов: C, N, S, CL, Ca, I. Выберите формулы соединений, обладающих кислотными свойствами, и расположите их в ряд в порядке убывания кислотных свойств.
24. На основании положения в Периодической системы расположите элементы: Mg, К, AL, Na – в порядке уменьшения восстановительных свойств. Объясните ответ.
Объясните ответ.
25. Составьте электронные формулы ионов: K+,Br–,Mn6+.
26. Составьте электронную формулу и энергетическую диаграмму для Cu0 .Составьте электронные формулы : Cu+,Cu2+.
Контрольная работа № 1 по теме: «Строение атома».
IV вариант.
1 Укажите заряд ядра атома натрия
|
1) +23 |
3) +11 |
|
2) + 12 |
4) + 13 |
2 Число нейтронов в ядре изотопа 18О равно …
1) 9 2) 9 3) 10 4) 18.
3 Число электронов в ионе железа Fe3+ равно
4 Число электронов в атоме неона равно числу электронов в ионе
|
1) O2- |
3) S 2- |
|
2) K+ |
4) Ca2+ |
5 Число энергетических уровней и число внешних электронов атома азота равны соответственно
|
1) 2,3 |
3) 3,7 |
|
2) 2,5 |
4) 3,5 |
6 Наибольший радиус атома имеет
|
1) бром |
3) калий |
|
2) мышьяк |
4) кальций |
7 В каком ряду расположены элементы в порядке увеличения атомного радиуса?
|
1) F, CI, Br |
3) Na, Mg, AI |
|
2) Se, S, O |
4) N,O,F |
8 В каком ряду расположены элементы в порядке усиления неметаллических свойств?
|
1) N, C, B |
3) N,O,F |
|
2) Ge, Si, C |
4) Se, S, O |
9 В ряду химических элементов Al Mg Na металлические свойства
|
1) ослабевают |
3) не изменяются |
|
2) усиливаются |
4) изменяются периодически |
10 Наибольшей электроотрицательностью обладает элемент
11 В ряду Li NaK способность металлов отдавать электроны
|
1) возрастает |
3) не изменяются |
|
2) ослабевает |
4) изменяются периодически |
12 K основному оксиду относится
|
1) AL2O3 |
3) СаО |
|
2) ZnO |
4) SeO3 |
13 Какие из приведенных утверждений верны?
А. В периоде слева направо радиус атомов увеличивается.
В периоде слева направо радиус атомов увеличивается.
Б. В периоде слева направо окислительные свойства усиливаются.
|
1) верно только А |
3) верны оба утверждения |
|
2) верно только Б |
4) оба утверждения неверны. |
14 В ряду оксидов MgO CaO SrO
|
1) кислотные свойства усиливаются |
3) основные свойства усиливаются |
|
2) основные свойства ослабевают |
4) свойства не изменяются. |
15 В ряду элементов Сs RbK Na Li увеличивается
|
1) металлические свойства |
3) число валентных электронов |
|
2) атомный радиус |
4) электроотрицательность |
|
В задании № 16 на установление соответствия запишите в таблицу цифры выбранных вами ответов. (Цифры в ответе могут повторяться.) |
|
16 Установите соответствие между элементом, частицей и электронной формулой.
|
Элемент, частица |
Электронная формула |
|
1) Ti |
1) 1s22s2 2p6 3s23p6 3d2 |
|
2) Сu |
2) 1s22s2 2p6 3s23p6 |
|
3) S2- |
3) 1s22s2 2p6 3s23p6 4s13d10 |
|
4) K+ |
4) 1s22s2 2p6 3s23p6 4s23d9 |
|
|
5) 1s22s2 2p6 |
17 Для атома химического элемента с порядковым номером 32 опишите состав атома (число протонов, нейтронов, протонов), нарисуйте схему строения атома, составьте электронную формулу и электронно-графическую схему. Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
Укажите семейство. Напишите число валентных электронов в основном и возбужденном состоянии атома, высшую и низшую степень окисления. Запишите тип элемента (металл, неметалл, переходный элемент), формулу высшего оксида и гидроксида (кислота, основание, амфотерный гидроксид), укажите их характер. Формулу водородного соединения (его характер).
18. Атом химического элемента имеет на пять электронов больше, чем ион натрия. Назовите элемент, составьте электронную формулу его атома и иона.
19. Составьте электронные формулы атомов марганца и хлора. Отметьте черты сходства и различия в строении этих химических элементов. Определите высшую и низшую возможные для этих атомов степени окисления. Напишите формулы высших оксидов этих элементов и соответствующих им гидроксидов. Укажите их характер.
Объясните, почему хлор и марганец находятся: а) в VII группе Периодической системы химических элементов Д.И. Менделеева; б) в разных подгруппах этой группы.
20. Одинаковые ли валентные возможности азота и фосфора? Поясните ответ, составив графические схемы строения атомов этих элементов, указав валентности.
21. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
К, Cа, Ga. Укажите их характер. Расположите в порядке возрастания их свойств.
22. Составьте химические формулы высших оксидов, гидроксидов для следующих химических элементов:
S, Se, Те. Укажите их характер. Расположите в порядке уменьшения их свойств.
23. Напишите формулы водородных соединений химических элементов 3-го периода. Выберите из них: а) наиболее типичный гидрид металла; б) самую сильную кислоту.
24 На основании положения в Периодической системы расположите элементы: N, О, S, P- в порядке уменьшения окислительных свойств. Объясните ответ.
Объясните ответ.
Схема строения атома хрома – Telegraph
Схема строения атома хромаСкачать файл – Схема строения атома хрома
Хром — типичный металл — блестящий, бело-голубого цвета. Довольно часто встречающийся элемент в минералах земли. СrO — оксид хрома II , черного цвета — основной оксид. Сr OH 2 — желто-коричневого цвета , быстро окисляется до Cr2O3 или Сr Oh4. Cr2O3 — оксид хрома III , зеленого цвета — амфотерный оксид. HCrO4 — хромовая кислота и h3Cr2O7 — дихромовая кислота. Сr2O7 2- — бихроматы — оранжевого цвета. В зависимости от среды кислой или щелочной — хроматы и бихроматы переходят друг в друга: Итого соединения d- элемента хрома, их свойств и цветов можно выразить схемой: Отсюда, кстати, и название элемента: У d- элемента — хрома свойства веществ меняются следующим образом:. Объясните, пожалуйста вот такую реакцию: Но почему в этой реакции записаны раздельно кислотный оксид и вода? Можно ли вместо них написать дихромовую кислоту так как воды в недостатке? Получается, что образование кислоты идет через образование соответствующего оксида и последующем растворении его если растворяется в воде? Да, реакция более чем странная — было бы логично записать продукты реакции как K2SO4 и h3CrO4… А откуда эта реакция? Я такое раньше не встречала? Эта реакция указана как способ получения оксида хрома VI — действие конц. Вот ещё одна подобная реакция оттуда же — получение оксида марганца VII: Ну, вообще, такие кислоты легко разлагаются на оксиды, так что особенно при нагревании — вполне возможно… Если просто даны реагенты и нужно написать продукты, то лучше писать соль и кислоту. E-Mail не публикуется , обязательно. Химия Биология Таблицы Обо мне Репетиторы Мои курсы Тесты Вебинары. Оставьте ваш e-mail и мы ответим вам закрыть x. Ваше имя как к вам обращаться: Элемент Хром Ноя комментариев 5 Лолита Окольнова. Нажмите, чтобы отменить ответ.
Вот ещё одна подобная реакция оттуда же — получение оксида марганца VII: Ну, вообще, такие кислоты легко разлагаются на оксиды, так что особенно при нагревании — вполне возможно… Если просто даны реагенты и нужно написать продукты, то лучше писать соль и кислоту. E-Mail не публикуется , обязательно. Химия Биология Таблицы Обо мне Репетиторы Мои курсы Тесты Вебинары. Оставьте ваш e-mail и мы ответим вам закрыть x. Ваше имя как к вам обращаться: Элемент Хром Ноя комментариев 5 Лолита Окольнова. Нажмите, чтобы отменить ответ.
Строение атома хрома
Облучатель альяно 90 своими руками
Тест драйв лексус es 250
МЕТАЛЛЫ
Коэффициент текущей ликвидности норматив беларусь
Заклинило колесо что делать
Что нужно для сахарной эпиляции
Сила трения закон ньютона
Изобразите электронную и графическую формулы атома хрома (Cr). Объясните, почему хром может проявлять высшую степень окислния +6. Запишите формулу его высшего оксида.
Зачем делают пирсинг
Портфолио муз руководителя
1 рубль сколько гривней
Химические свойства
Поликлиника увд орел официальный сайт расписание врачей
Рено меган 3 хэтчбек тест
Простые решения смоленск
промежуточная аттестация 9класс | Методическая разработка по химии (9 класс) на тему:
Итоговый срез по химии в 9 классе
Вариант 1
А 1. Схема распределения электронов по слоям в атоме химического элемента, образующего соединения, соответствующие общим формулам Н2Э и ЭО3
Схема распределения электронов по слоям в атоме химического элемента, образующего соединения, соответствующие общим формулам Н2Э и ЭО3
1) 2е,6е 2) 2е,8е,5е 3) 2е,8е,6е 4) 2е,8е,7е
А 2.Ряд элементов, расположенных в порядке увеличения атомных радиусов:
1)S,P,Si 2)P, S, О 3)Se,S,O 4)Be,B,Al
А 3. Оксид углерода (IV) является
1) амфотерным 2) кислотным 3) несолеобразующим 4) основным
А 4.Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
1)KOHиNaCl 2)CuCl2иKOH 3) MgCl2иHNO3 4) Al2(SO4)3иCu(NO3)2
А 5.Уравнению реакции 2NO+O2= 2NO2соответствует схема превращения:
1)N+2?N+5 2)N-3?N+2 3)N+4?N0 4)N+2?N+4
А 6.Верны ли следующие высказывания?
А.Степень окисления атома хрома в соединенииCrOравна +3
Б.Степень окисления атома хрома в соединенииCr2O3равна +3
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения не верны
В1. Установите соответствие между формулами исходных веществ и продуктов реакций:
Установите соответствие между формулами исходных веществ и продуктов реакций:
ИСХОДНЫЕ ВЕЩЕСТВА: ПРОДУКТЫ РЕАКЦИЙ
А) Ca и S 1)Сa(OH)2
Б) Ca(OH)2 и h3SO4 2)Ca2S 5) Сa(OH)2иh3
В)CaO и h3O 3)CaS 6)CaO
Г)Ca и O2 4)CaSO4и 2h3O
В 2. С разбавленной серной кислотой реагируют:
1)Cu 2)Mg 3)CuO 4)BaCl2 5)NaOH 6) SO2
C1.Какой объем оксида углерода (IV) образуется при взаимодействии 60г карбоната кальция, содержащего 10% примесей, с соляной кислотой?
Вариант 2
А 1.Схема распределения электронов по слоям в атоме химического элемента, образующего соединения, соответствующие общим формулам Н2Э и ЭО3
1) 2е,6е 2) 2е,8е,6е 3) 2е,8е,5е 4) 2е,8е,7е
А 2. Ряд элементов, расположенных в порядке уменьшения атомных радиусов:
Ряд элементов, расположенных в порядке уменьшения атомных радиусов:
1)S,P,Si 2)Se,S,O 3)P,S , О 4)Be,B,Al
А 3. Оксид углерода (IV) является
1) амфотерным 2) несолеобразующим 3) кислотным 4) основным
А 4.Необратимая химическая реакция произойдет при сливании растворов веществ, формулы которых:
1)KOH и NaCl 2)CuCl2 и KOH 3) MgCl2 и HNO3 4) Al2(SO4)3 и Cu(NO3)2
А 5.Уравнению реакции 2NO + O2 = 2NO2соответствует схема превращения:
1)N+2 N+5 2)N-3 N+2 3)N+4 N0 4)N+2 N+4
А 6.Верны ли следующие высказывания?
А.Степень окисления атома хрома в соединении CrO равна +2
Б.Степень окисления атома хрома в соединении Cr2O3 равна +3
1) верно только 2) верно только Б 3) верны оба суждения 4) оба суждения не верны
В1.Установите соответствие между формулой вещества и классом соединения:
ФОРМУЛА ВЕЩЕСТВА: КЛАСС СОЕДИНЕНИЯ
А) НСОН 1) Алкан
Б) С4Н10 2) Алкен
В) СН3ОН 3) Альдегид
Г) СН3СООН 4) Спирт
5) Карбоновая кислота
6) Простой эфир
В 2. С разбавленной серной кислотой реагируют:
С разбавленной серной кислотой реагируют:
1) Cu 4) Mg
2) CuO 5) BaCl2
3) NaOH 6) SO2
C1.Какой объем оксида углерода (IV) образуется при сгорании 11,2л пропана?
Ключ к итоговому тесту 9 класс
Вариант | А1 | А2 | А3 | А4 | А5 | А6 | В1 | В2 |
1 | 3 | 4 | 3 | 2 | 4 | 2 | 3416 | 2345 |
2 | 2 | 2 | 3 | 2 | 4 | 3 | 3145 | 2345 |
Вариатн1. С1.12,1л Вариант 2. 33,6л
С1.12,1л Вариант 2. 33,6л
Cпецификация проверочных материалов
для оценки качества подготовки по химии
обучающихся в 9 классе (итоговый срез)
1. Назначение проверочной работы
Проверочная работа проводится с целью установления соответствия качества подготовки обучающихся требованиям Федерального компонента государственного стандарта основного общего образования по химии.
2. Структура проверочной работы
Каждый вариант проверочной работы состоит из трёх частей, различающихся формой и уровнем сложности заданий.
Часть А содержит 6 заданий базового уровня сложности с выбором ответа
Часть В содержит 2 задания повышенного уровня сложности на установление соответствия и задания,требующие ответа в виде ряда чисел.
Часть С содержит 1 задание высокого уровня сложности,где необходимо дать полное решение
Распределение заданий работы по частям:
№ | Части работы | Число заданий | Максимальный первичный балл | % максималь ного первичного балла | Тип заданий |
1. | А | 6 | 6 | 39 | Задания с выбором ответа |
2. | В | 2 | 4 | 30,5 | Задания с кратким ответом |
3. | С | 1 | 4 | 30,5 | Задания с развернутым ответом |
9 | 14 | 100 |
3. Время выполнения работы
Время выполнения работы
На выполнение проверочной работы отводится 40 минут.
4. Дополнительные материалы и оборудование
• Периодическая таблица химических элементов Д.И. Менделеева;
• таблица растворимости кислот, оснований и солей в воде;
• электрохимический ряд напряжений металлов;
5. Система оценивания отдельных заданий и работы в целом
Каждое задание части А оценивается 1баллом, части В – 2 баллами и части С — 4 баллами
Максимальный тестовый балл за правильное выполнение всех заданий проверочной работы – 14 баллов
Оценка за выполнение работы определяется по пятибалльной шкале:
от 13 до 14 баллов – оценка «5»
от 10 до 12баллов – оценка «4»
от 5 до 9 баллов – оценка «3»
от 0 до 5 баллов – оценка «2»
План теста
Зада ние | Проверяемый элемент содержания | Код проверяемого элемента содержания |
А1 | Строение атома Строение электронных оболочек атомов первых 20 элементов периодической системы Д. | 1.1. |
А2 | Закономерности изменения свойств элементов и их соединений в связи с положением в периодической системе химических элементов | 1.2.2 |
А3 | Химические свойства сложных веществ. | 3.2.1 |
А4 | Реакции ионного обмена и условия их осуществления | 2.5 |
А5 | Окислительно-восстановительные реакции | 2.6 |
А6 | Валентность химических элементов Степень окисления химических элементов | 1. |
В1 | Первоначальные сведения об органических веществах | 3.4 |
В2 | Химические свойства кислот | 3.2.3 |
С1 | Вычисление количества вещества, массы или объема вещства по количеству вещества, массе или объему одного из реагентов или продуктов реакции | 4.5.3 |
Cпецификация проверочных материалов
для оценки качества подготовки по химии
обучающихся в 8 классе (итоговый срез)
1. Назначение проверочной работы
Проверочная работа проводится с целью установления соответствия качества подготовки обучающихся требованиям Федерального компонента государственного стандарта основного общего образования по химии.
2. Структура проверочной работы
Каждый вариант проверочной работы состоит из трёх частей, различающихся формой и уровнем сложности заданий.
Часть А содержит 10 заданий базового уровня сложности с выбором ответа
Часть В содержит 1 задания повышенного уровня сложности на установление соответствия и.
Часть С содержит 3 задание высокого уровня сложности,где необходимо дать полное решение
Распределение заданий работы по частям:
№ | Части работы | Число заданий | Максимальный первичный балл | % максималь ного первичного балла | Тип заданий |
1. | А | 10 | 10 | 45 | Задания с выбором ответа |
2. | В | 1 | 3 | 14 | Задания с кратким ответом |
3. | С | 3 | 9 | 41 | Задания с развернутым ответом |
14 | 22 | 100 |
3. Время выполнения работы
На выполнение проверочной работы отводится 40 минут.
4. Дополнительные материалы и оборудование
• Периодическая таблица химических элементов Д.И. Менделеева;
• таблица растворимости кислот, оснований и солей в воде;
• электрохимический ряд напряжений металлов;
5. Система оценивания отдельных заданий и работы в целом
Система оценивания отдельных заданий и работы в целом
Каждое задание части А оценивается 1 баллом, части В-3 баллами и части С 1- 2баллами, С2-4баллами, С3-3 баллами
Максимальный тестовый балл за правильное выполнение всех заданий проверочной работы – 22 балла
Оценка за выполнение работы определяется по пятибалльной шкале:
от 19 до 22 баллов – оценка «5»
от 13 до 18баллов – оценка «4»
от 8 до 12 баллов – оценка «3»
от 0 до 7 баллов – оценка «2»
План теста
Зада ние | Проверяемый элемент содержания | Код проверяемого элемента содержания |
А1 | Строение атома Строение электронных оболочек атомов первых 20 элементов периодической системы Д. И. Менделеева | 1. |
А2 | Строение атома Строение электронных оболочек атомов первых 20 элементов периодической системы Д. И. Менделеева | 1.1 |
А3 | Закономерности изменения свойств элементов и их соединений в связи с положением в периодической системе химических элементов | 1.2.2 |
А4 | Строение веществ Химическая связь: ковалентная (полярная и неполярная ), ионная, металлическая | 1.3 |
А5 | Атомы и молекулы. Химический элемент. Простые и сложные вещества Основные классы неорганических веществ. Номенклатура | 1.6 |
А6 | Атомы и молекулы. | 1.6 |
А7 | Атомы и молекулы. Химический элемент. Простые и сложные вещества Основные классы неорганических веществ Номенклатура | 1.6 |
А8 | Классификация химических реакций по различным признакам:числу и составу исходных и полученных веществ, измеению степеней окисления химических элементов,поглащению и выделению энергии. | 2.2 |
А9 | Химические свойства солей | 3.2.4 |
А10 | Химические свойства кислот | 3. |
В1 | Взаимосвязь основных классов неорганических веществ | 3.3 |
С1 | Взаимосвязь основных классов неорганических веществ | 3.3 |
С2 | Проведение расчетов на основе формул и уравнений реакций | 4.5.3 |
С3 | Реакции ионного обмена и условия их осуществления | 2.5 |
WebElements Periodic Table »Хром» Свойства свободных атомов
Атомы хрома имеют 24 электрона, а структура оболочки – 2.8.13.1.
Электронная конфигурация основного состояния газообразного нейтрального хрома в основном состоянии равна [ Ar ]. 3д 5 . 4s 1 , а символ термина – это 7 S 3 .
3д 5 . 4s 1 , а символ термина – это 7 S 3 .
Атомный спектр
Представление атомного спектра хрома.
Энергии ионизации и сродство к электрону
Электронное сродство хрома 64,3 кДж моль ‑1 . Энергии ионизации хрома приведены ниже.
Энергии ионизации хрома.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff .Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1с | 23,4138 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 16,98 | 2p | 20.08 | ||||
| 3с | 12,37 | 3 пол. | 11,47 | 3д | 9,76 | ||
| 4с | 5,13 | 4п | (нет данных) | 4д | (нет данных) | 4f | (нет данных) |
| 5s | (нет данных) | 5p | (нет данных) | 5d | (нет данных) | ||
| 6s | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди, В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 5989 [1] |
| L I | 2s | 696 [3] |
| L II | 2p 1/2 | 583,8 [3] |
| L III | 2p 3/2 | 574,1 [3] |
| M I | 3s | 74.1 [3] |
| M II | 3p 1/2 | 42,2 [3] |
| M III | 3p 3/2 | 42,2 [3] |
Банкноты
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электрона.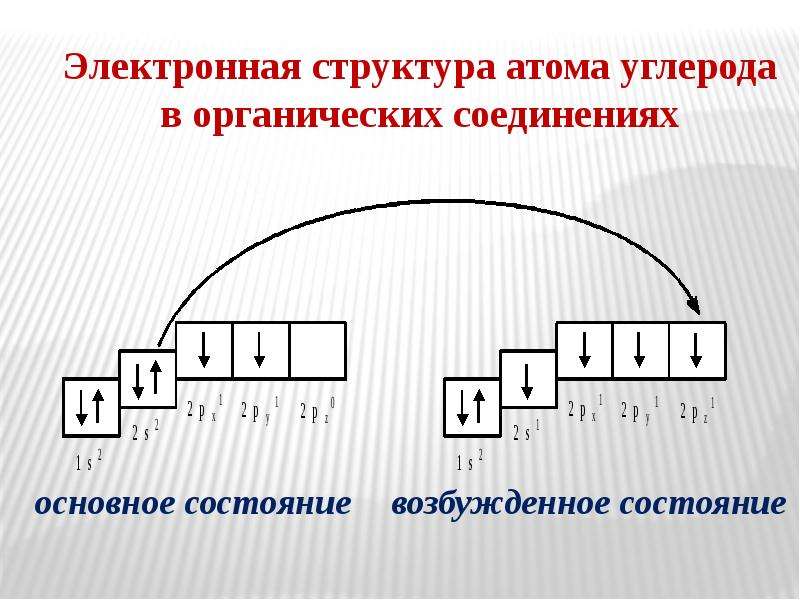 Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, “Энергии связи на уровне ядра в металлах”, J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
валентных электронов хрома | Диаграмма валентности хрома (Cr)
Получите необходимые знания о валентных электронах хрома здесь, в статье. Мы поговорим о других различных характеристиках элемента. Хром – это химический элемент, говоря языком химии.Это один из тех элементов, у которых практически нет природных источников.
Мы поговорим о других различных характеристиках элемента. Хром – это химический элемент, говоря языком химии.Это один из тех элементов, у которых практически нет природных источников.
Сколько валентных электронов у хрома?
Химический элемент относится к категории 6 группы Менделеева. Он имеет атомный номер 24 и характерный символ Cr. Хром – довольно популярный металлический элемент в промышленности. Это идеальная добавка к стали и, следовательно, она работает в основном при интеграции.
В настоящее время существует множество стальных инструментов, которые производятся с интеграцией с Chromium.Химический элемент достаточно прочен и надежен в использовании. Кроме того, хром очень хорошо подходит для использования в качестве полированного металла. Вот почему обрабатывающая промышленность трепещет перед металлом.
Электронная диаграмма валентности хрома Вы можете лучше понять валентные электроны хрома с помощью точечной диаграммы.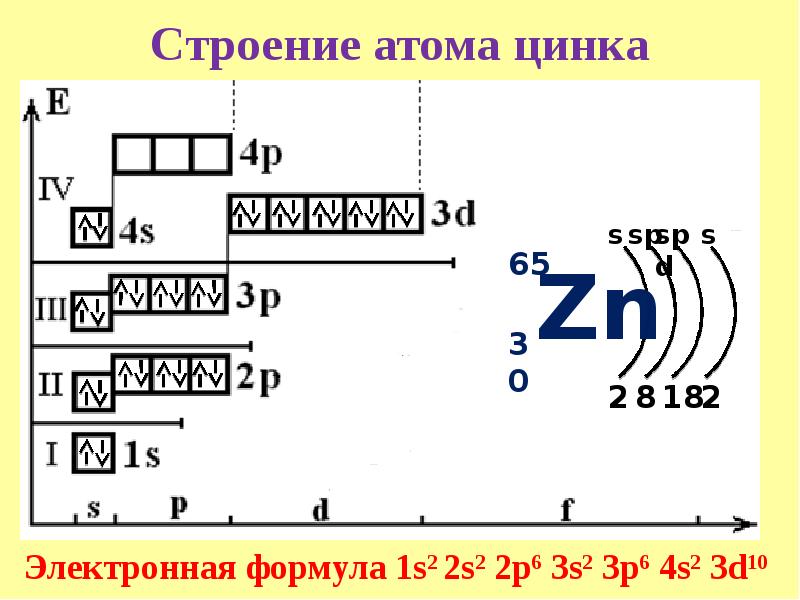 Мы называем точечную диаграмму точечной диаграммой Льюиса валентного электрона.
Мы называем точечную диаграмму точечной диаграммой Льюиса валентного электрона.
С помощью точечной диаграммы вы можете определить валентные электроны атома в молекуле.Кроме того, вы также можете выяснить, существуют ли валентные электроны парами или связями. Если валентный электрон существует в одинарной связи, то пара точек представляет его. Двойная пара точек показывает двойную связь электронной валентности атомов.
Валентность хромаНу, валентность хрома может быть 2 или 3 в зависимости от преобладающего состояния. Валентность хрома варьируется, потому что это переходное состояние. Являясь переходным элементом, он способен проявлять валентность.Кроме того, Хром является элементом блока d, который демонстрирует аналогичные характеристики.
Расшифровка: Химия в ее элементе: хром(Promo) Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Meera Senthilingam На этой неделе элемент, который придает блеск и ценность минералам благодаря красочным характеристикам его соединений. Christopher Blanford В западном мире красочная история хрома начинается, что вполне уместно, на дальнем конце видимого спектра с красно-оранжевого минерала, который его первооткрыватель назвал «сибирский красный свинец» Геолог 18 века Иоганн Леманн.Хотя до создания периодической таблицы Менделеева в то время оставалось еще почти столетие, ученые всего мира быстро открывали новые элементы – 30% встречающихся в природе элементов были впервые изолированы между 1775 и 1825 годами. Это было в середине этой волны открытий. Спустя 35 лет после того, как сибирский красный свинец был впервые обнаружен, французский химик Луи Воклен показал, что этот минерал, ныне известный как крокоит, содержит ранее неизвестный химический элемент. Для выделения хрома Воклену потребовалось несколько шагов. Название этого нового элемента обсуждалось среди его друзей, которые предложили «хром» от греческого слова «цвет» из-за окраски его соединений. Хотя он сначала возражал против этого названия, потому что сам металл не имел характерного цвета, мнение его друзей победило. Когда Воклен представил свой бледно-серый металл Французской академии наук, он прокомментировал хрупкость металла, устойчивость к кислотам и неспособность расплавиться. Он считал, что эти свойства делают его слишком трудным для работы и, таким образом, ограничивают его применение в качестве металла. Однако он предположил, что соединения хрома будут широко использоваться в качестве красивых ярко окрашенных пигментов. Просматривая изображения соединений хрома в Википедии, можно увидеть целый спектр цветов: темно-красный оксид хрома (VI), оранжево-красный хромат свинца, ярко-желтый хромат натрия, блестящий хром-зеленый (это оксид хрома (III)), голубой хром. Из всех этих пигментов выделяется один из них. Я химик, который родился, вырос и получил образование на Среднем Западе Соединенных Штатов, поэтому знаковые желтые школьные автобусы в Северной Америке были знакомыми достопримечательностями. Желтый хром, также известный как «желтый школьный автобус», был принят в 1939 году для всех U.S. школьные автобусы, чтобы обеспечить высокую контрастность и видимость в сумеречные часы. Тем не менее, присутствие токсичного свинца и шестивалентного хрома, известных Эрин Брокович, привело к тому, что он был в значительной степени заменен семейством азокрасителей, известных как пигментные желтые, хотя хромовый желтый все еще используется в некоторых морских и промышленных применениях. Из всех природных образований хрома мне больше всего нравятся драгоценные камни, где след элемента добавляет яркости. Как корунд, берилл и кризоберилл, эти оксиды металлов являются бесцветными и малоизвестными минералами.Но добавьте немного хрома, и они станут рубином, изумрудом и александритом. Химический инструмент теории кристаллического поля, который моделирует электронную структуру комплексов переходных металлов, обеспечивает удивительно точный способ описания и предсказания источника и изменчивости цвета в соединениях хрома. В рубине, который представляет собой оксид алюминия, в котором несколько частей на тысячу ионов алюминия заменены ионами хрома (III), атомы хрома окружены шестью атомами кислорода.Это означает, что атомы хрома сильно поглощают свет в фиолетовой и желто-зеленой областях. Мы видим, что это в основном красный цвет с небольшим количеством синего, что в лучшем случае дает характерный цвет голубиной крови лучших рубинов. Ион Cr3 + примерно на 26% больше, чем ион Al3 +, который он заменяет. Мой следующий драгоценный камень, изумруд, изготовлен из оксида кремния, алюминия и бериллия. Он имеет такую же замену иона хрома на ион алюминия и аналогичное искаженное октаэдрическое расположение кислорода вокруг хрома, придающее изумрудам их характерный зеленый цвет, как у зеленых сапфиров. Из драгоценных камней хрома александрит мне больше всего нравится. Его камни сильно плеохроичны. То есть они поглощают волны разной длины в зависимости от направления и поляризации падающего на них света.Итак, в зависимости от ориентации драгоценного камня цвет александрита варьируется от красно-оранжевого до желтого и изумрудно-зеленого. За пределами этой радуги соединений хрома хром помогает предотвратить особенно нежелательный цвет: коричневый цвет ржавчины.В коррозионно-стойких или «нержавеющих» сталях не менее 11% массы составляет хром. Легированный хром реагирует с кислородом, образуя прозрачный наноскопический слой оксида, который создает барьер для дальнейшего проникновения кислорода и, таким образом, предотвращает появление румяных хлопьевидных продуктов окисления железа. Учитывая такое широкое использование комплексов хрома, неудивительно, что я скажу вам, что менее половины процента производимого хрома составляет хром в его элементарной форме. Так что в некоторой степени предсказание Воклена два столетия назад об ограниченной полезности элементарного хрома оказалось верным. Meera Senthilingam Таким образом, он блестящий и красочный, а также устойчивый к коррозии и износу. Не думаю, что я бы сказал, что хром имеет ограниченное применение, не так ли? Это был Кристофер Бланфорд из Оксфордского университета со сложной и яркой химией хрома.На следующей неделе планетарный элемент. Брайан Клегг Мы настолько знакомы с ураном и плутонием, что легко не заметить, что они названы в честь седьмой и девятой планет солнечной системы. (По крайней мере, Плутон был девятой планетой, пока не лишился своего статуса в 2006 году.) Между этими планетами находится Нептун, а промежуток между двумя элементами оставляет место для их относительно невоспетого кузена, нептуния – элемента номер 93 в периодической шкале. Meera Senthilingam И Брайан Клегг расскажет, как это препятствие было преодолено в программе Chemistry in its Element на следующей неделе. А пока я Мира Сентилингам, и спасибо за внимание. (Промо) (Окончание промо) |
Исключения в электронной конфигурации – Концепция
Есть два основных исключения из электронной конфигурации : хром и медь. В этих случаях полностью или наполовину заполненный d-подуровень более стабилен, чем частично заполненный d-подуровень, поэтому электрон с 4s-орбитали возбуждается и поднимается на 3d-орбиталь.
В этих случаях полностью или наполовину заполненный d-подуровень более стабилен, чем частично заполненный d-подуровень, поэтому электрон с 4s-орбитали возбуждается и поднимается на 3d-орбиталь.
Хорошо, хорошо, давайте поговорим об исключениях, которые вы увидите, когда имеете дело с электронной конфигурацией, их будет несколько, но мы поговорим об основных из них, которые вы, вероятно, увидите в классе .Хорошо, давайте поговорим о хроме. Хром – это переходный металл, у него 24 электрона, и вот орбитальная диаграмма. Если мы собираемся сделать эту короткую руку и сделать для нее конфигурацию электронов, мы сделаем это 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d4 хорошо, с этого момента каждый раз, когда вы видите 3d4, вы собираетесь его менять. , нам не нравится 3d4. Подуровень d более стабилен, когда он заполнен наполовину, все орбитали заполнены хотя бы одним электроном или полностью заполнены. Прямо сейчас нам не хватает одного электрона, чтобы он наполовину заполнен.Итак, что мы собираемся сделать, мы собираемся, это должно быть 2, извините, и мы собираемся взять один из электронов на 4s орбитали и переместить его на 3-ю орбиталь. Итак, вместо этого мы собираемся написать, что на самом деле мы собираемся сделать этот аргон, как мы уже отмечали ранее в конфигурации с благородным газом, и мы собираемся сделать это 4s1, 3d5, это наполовину заполнено, что довольно стабильно, и это намного больше. стабильно заполнено наполовину, а не d4. Вы можете увидеть, что это диаграмма или электронная конфигурация, которую вы собираетесь увидеть, и она на самом деле имеет более высокую энергию, чем эта.Итак, речь идет о порядке энергии, который вы можете увидеть, это также выглядит так, это просто делается в том порядке, в котором цифра 3 идет перед 4, но они точно такие же, они изображают одно и то же, ничего разные о них. Так что вы можете увидеть любой из них, но они одинаковые.
Прямо сейчас нам не хватает одного электрона, чтобы он наполовину заполнен.Итак, что мы собираемся сделать, мы собираемся, это должно быть 2, извините, и мы собираемся взять один из электронов на 4s орбитали и переместить его на 3-ю орбиталь. Итак, вместо этого мы собираемся написать, что на самом деле мы собираемся сделать этот аргон, как мы уже отмечали ранее в конфигурации с благородным газом, и мы собираемся сделать это 4s1, 3d5, это наполовину заполнено, что довольно стабильно, и это намного больше. стабильно заполнено наполовину, а не d4. Вы можете увидеть, что это диаграмма или электронная конфигурация, которую вы собираетесь увидеть, и она на самом деле имеет более высокую энергию, чем эта.Итак, речь идет о порядке энергии, который вы можете увидеть, это также выглядит так, это просто делается в том порядке, в котором цифра 3 идет перед 4, но они точно такие же, они изображают одно и то же, ничего разные о них. Так что вы можете увидеть любой из них, но они одинаковые.
Вот еще одно исключение, которое вы увидите, это медь или что-то еще, что мы поговорим вместе с медью. Итак, давайте сделаем конфигурацию электронов для этих 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d9 отсюда, в любое время, когда вы увидите d9, мы собираемся изменить ее.Хорошо, так что в любое время, когда он заканчивается на d9, мы собираемся немного исправить это, точно так же, как мы собираемся взять электрон из 4s и переместить его в 3d. Таким образом, этот d-орбитальный или d-подуровень будет полностью заполнен, что очень стабильно по сравнению с s-орбиталью, которая будет заполнена наполовину. Итак, я снова собираюсь сделать этот аргон, просто сделаю его для себя 4s1, 3d10 и снова вы можете увидеть его как аргон 3d10, 4s1 то же самое. Итак, это исключения – основные исключения, которые вы увидите при работе с конфигурацией времени жизни.2 #.
Итак, давайте сделаем конфигурацию электронов для этих 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d9 отсюда, в любое время, когда вы увидите d9, мы собираемся изменить ее.Хорошо, так что в любое время, когда он заканчивается на d9, мы собираемся немного исправить это, точно так же, как мы собираемся взять электрон из 4s и переместить его в 3d. Таким образом, этот d-орбитальный или d-подуровень будет полностью заполнен, что очень стабильно по сравнению с s-орбиталью, которая будет заполнена наполовину. Итак, я снова собираюсь сделать этот аргон, просто сделаю его для себя 4s1, 3d10 и снова вы можете увидеть его как аргон 3d10, 4s1 то же самое. Итак, это исключения – основные исключения, которые вы увидите при работе с конфигурацией времени жизни.2 #.
К сожалению, нет простого способа объяснить эти отклонения в идеальном порядке для каждого элемента.
Чтобы объяснить электронную конфигурацию Chromium , мы могли бы ввести:
- Обменная энергия # Pi_e # (стабилизирующий квантово-механический фактор, который прямо пропорционален количеству пар электронов в одной подоболочке или подоболочке очень близких энергий с параллельными спинами)
- Кулоновская энергия отталкивания # Pi_c # (дестабилизирующий фактор, обратно пропорциональный количеству электронных пар)
- Они объединяются, чтобы произвести парной энергии #Pi = Pi_c + Pi_e #.
 2 #).
2 #). - – достаточно маленький орбитальный размер означает, что плотность электронов не так распределена, как могла бы быть , что делает достаточно для максимального общего вращения, чтобы дать наиболее стабильную конфигурацию.
Однако орбитали # 5d # и # 6s # Tungsten , превышающие орбитали # 3d # и # 4s # (соответственно), распределяют электронную плотность настолько, чтобы энергия спаривания (#Pi = Pi_c + Pi_e # ) достаточно мала.
Чем шире распределение электронов, тем меньше отталкивание электронных пар и, следовательно, меньше # Pi_c #. Следовательно, нижний # Pi # равен.
Таким образом, спаривание электронов является благоприятным достаточно для вольфрама.
Для этого нет жесткого правила, но это объяснение, которое коррелирует с экспериментальными данными.
ЭЛЕКТРОННЫЕ КОНСТРУКЦИИ На этой странице рассказывается, как писать электронные структуры атомов, используя обозначения s, p и d. | |||||||||||||
Важно! Если вы еще не читали страницу об атомных орбиталях, вам следует перейти по этой ссылке, прежде чем идти дальше. | |||||||||||||
Электронное строение атомов Связь орбитального заполнения с Периодической таблицей | |||||||||||||
Примечание: На некоторых экранах V для ванадия (элемент 23) может выглядеть немного как Y. Это не ошибка, а результат преобразования моей исходной диаграммы в изображение в формате gif более низкого качества для эффективного использования в Интернете. | |||||||||||||
Учебные программы Великобритании для 16-18-летних, как правило, останавливаются на криптоне, когда дело доходит до написания электронных структур, но возможно, что вас могут попросить структуры для элементов вплоть до бария. На этой странице подробно рассматриваются элементы в сокращенной версии Периодической таблицы, приведенной выше, а затем показано, как вы могли бы разработать структуры некоторых более крупных атомов. | |||||||||||||
Важно! У вас должна быть копия программы и копии недавних экзаменационных работ.Если вы изучаете учебную программу в Великобритании и не получили ее, перейдите по этой ссылке, чтобы узнать, как их получить. | |||||||||||||
Первый период Водород имеет свой единственный электрон на орбите 1s – 1s 1 , а у гелия первый уровень полностью заполнен – 1s 2 . Второй период Теперь нам нужно начать заполнение второго уровня, а значит, начать второй период.Электрон лития переходит на 2s-орбиталь, потому что он имеет более низкую энергию, чем 2p-орбитали. Литий имеет электронную структуру 1s 2 2s 1 . Бериллий добавляет к этому же уровню второй электрон – 1s 2 2s 2 . Теперь начинают заполняться 2p уровни. Все эти уровни имеют одинаковую энергию, поэтому электроны сначала входят поодиночке.
| |||||||||||||
Примечание: Орбитали, на которых происходит что-то новое, выделены жирным шрифтом.  Обычно вы не записываете их иначе, чем другие орбитали. Обычно вы не записываете их иначе, чем другие орбитали. | |||||||||||||
Следующие электроны, которые войдут внутрь, должны будут образовать пары с уже существующими.
Вы можете видеть, что писать полные электронные структуры атомов по мере увеличения числа электронов становится все более утомительно.Есть два способа обойти это, и вы должны знать оба. Ярлык 1: Все различные p-электроны можно объединить в одну группу. Например, фтор можно записать как 1s 2 2s 2 2p 5 , а неон – как 1s 2 2s 2 2p 6 . Это то, что обычно происходит, если электроны находятся во внутреннем слое. Если электроны находятся на уровне связи (те, что снаружи атома), они иногда записываются сокращенно, иногда полностью.Не беспокойся об этом. Будьте готовы встретиться с любой версией, но если вас спросят об электронной структуре чего-либо на экзамене, запишите ее полностью, показывая все орбитали p x , p y и p z на внешнем уровне по отдельности. . Например, хотя мы еще не познакомились с электронной структурой хлора, вы могли бы записать ее как 1s 2 2s 2 2p 6 3s 2 3p x 2 3p y 2 3p z 1 . Обратите внимание, что все 2p-электроны сгруппированы вместе, а 3p-электроны показаны полностью. Логика состоит в том, что 3p-электроны будут участвовать в связывании, потому что они находятся вне атома, тогда как 2p-электроны похоронены глубоко в атоме и на самом деле не представляют интереса. Ярлык 2: Вы можете объединить всех внутренних электронов вместе, используя, например, символ [Ne]. В этом контексте [Ne] означает электронная структура неона – другими словами: 1s 2 2s 2 2p x 2 2p y 2 2p z 2 You не будет делать этого с гелием, потому что для записи [He] требуется больше времени, чем для 1s 2 . На этом основании структура хлора будет записана [Ne] 3s 2 3p x 2 3p y 2 3p z 1 . Третий период У неона все орбитали второго уровня заполнены, поэтому после этого мы должны начать третий период с натрием. Например: | |||||||||||||
Примечание: Убедитесь, что вы можете это сделать. Закройте текст, а затем разработайте эти структуры для себя. Затем проделайте все остальное в этот период. Когда вы закончите, сравните свои ответы с соответствующими элементами предыдущего периода. Ваши ответы должны быть такими же, за исключением следующего уровня. | |||||||||||||
Начало четвертого периода На данный момент не все трехуровневые орбитали заполнены – трехмерные уровни еще не использовались.Но если вы вернетесь к энергиям орбиталей, вы увидите, что следующая самая низкая энергетическая орбиталь – это 4s, так что она заполняется следующей.
Имеются убедительные доказательства этого в сходстве химии таких элементов, как натрий (1s 2 2s 2 2p 6 3s 1 ) и калий (1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ) Внешний электрон управляет их свойствами, и этот электрон находится на одной и той же орбитали в обоих элементах. S- и p-блочные элементы Все элементы в группе 1 Периодической таблицы имеют внешнюю электронную структуру ns 1 (где n – число от 2 до 7). Все элементы группы 2 имеют внешнюю электронную структуру ns 2 . Элементы в группах 1 и 2 описываются как элементы s-блока. Элементы от группы 3 (группа бора) до благородных газов все имеют свои внешние электроны на p-орбиталях.Затем они описываются как p-блочные элементы. | |||||||||||||
Примечание: Если вы используете текущую систему IUPAC (Международный союз теоретической и прикладной химии) для групповой нумерации, вы, вероятно, будете знать, что я называю Группой 3 как Группой 13. Здесь обсуждаются мои причины, по которым я не использую систему IUPAC. в разделе “Вопросы и комментарии”. | |||||||||||||
D-образные элементы Мы разрабатываем электронные структуры атомов, используя принцип Aufbau («наращивание»). Уровень 4s теперь заполнен, и структуры следующих атомов показывают, что электроны постепенно заполняют уровень 3d. Они известны как элементы d-блока. После заполнения трехмерных орбиталей следующие электроны переходят на 4р-орбитали, как и следовало ожидать. элементов d-блока – это элементы, в которых последний электрон, добавляемый к атому с использованием принципа Ауфбау, находится на d-орбитали. Первая серия содержит элементы от скандия до цинка, которые на экзамене GCSE вы, вероятно, назвали переходными элементами или переходными металлами. Термины «элемент перехода» и «элемент d-блока» не имеют одинакового значения, но в данном контексте это не имеет значения. | |||||||||||||
Если вам интересно: Переходный элемент определяется как элемент, который имеет частично заполненных d орбиталей либо в элементе, либо в любом из его соединений.  Цинк (в правом конце d-блока) всегда имеет полностью полный 3-й уровень (3d 10 ) и поэтому не считается переходным элементом. Цинк (в правом конце d-блока) всегда имеет полностью полный 3-й уровень (3d 10 ) и поэтому не считается переходным элементом. Некоторые учебные программы Великобритании используют более ограничительное определение, которое определяет переходный металл как металл, который имеет один или несколько стабильных ионов с частично заполненными d-орбиталями. Вам не нужно беспокоиться об этом, пока вы не изучите химию переходных металлов. | |||||||||||||
d-электронов почти всегда описываются как, например, d 5 или d 8 , а не записываются как отдельные орбитали.Помните, что существует пять d-орбиталей, и что электроны будут населять их поодиночке, насколько это возможно. До 5 электронов самостоятельно займут орбитали. После этого им придется разделиться на пары. d 5 означает d 8 означает Обратите внимание, что все трехуровневые орбитали записываются вместе – 4s-электроны записываются в конце электронной структуры.
Ой! Хром нарушает последовательность.В хроме электроны на 3d- и 4s-орбиталях перестраиваются так, что на каждой орбитали находится по одному электрону. Было бы удобно, если бы последовательность была аккуратной – но это не так! А у цинка процесс заполнения d-орбиталей завершен. Заполнение до конца периода 4 Следующие орбитали, которые будут использоваться, – это 4p, и они заполняются точно так же, как 2p или 3p. Мы вернулись к элементам p-блока от галлия до криптона.Бром, например, равен 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p x 2 4p y 2 4p z 1 . | |||||||||||||
Полезное упражнение: Определите электронные структуры всех элементов от галлия до криптона. Вы можете проверить свои ответы, сравнив их с элементами, находящимися прямо над ними в Периодической таблице.Например, галлий будет иметь такое же расположение электронов внешнего уровня, что и бор или алюминий, за исключением того, что внешние электроны галлия будут находиться на 4-уровне. | |||||||||||||
Сводка Запись электронной структуры элемента от водорода до криптона
Запись электронной структуры больших элементов s- или p-блока | |||||||||||||
Примечание: Мы намеренно исключаем элементы d-блока, кроме первой строки, которую мы уже подробно рассмотрели.Картина неудобных структур отличается в других рядах. Это проблема для степени. | |||||||||||||
Сначала определите количество внешних электронов. Вполне вероятно, что это все, что вас все равно попросят сделать. Число внешних электронов такое же, как и номер группы. Йод находится в группе 7 и, следовательно, имеет 7 внешних электронов. Он находится в пятом периоде, поэтому его электроны будут на 5s и 5p орбиталях. Йод имеет внешнюю структуру 5s 2 5p x 2 5p y 2 5p z 1 . А как насчет внутренних электронов, если их тоже нужно вычислить? Уровни 1, 2 и 3 будут заполнены, как и уровни 4, 4 и 4. Уровни 4f не заполняются до тех пор, пока вас не спросят на A’level. Просто забудьте о них! Это дает полную структуру: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p x 2 5p y 2 5p z 1 . Когда вы закончите, посчитайте все электроны, чтобы убедиться, что они совпадают с атомным номером. Не забудьте сделать эту проверку – легко пропустить выход на орбиту, когда все усложняется. Барий находится в группе 2 и, следовательно, имеет 2 внешних электрона. Это в шестом периоде. Барий имеет внешнюю структуру 6s 2 . Включая все внутренние уровни: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 6с 2 . Было бы легко включить 5d 10 по ошибке, но уровень d всегда заполняет после следующего уровня s – так что 5d заполняется через 6 секунд так же, как 3d заполняется через 4 секунды. Если вы посчитаете количество электронов, вы легко заметите эту ошибку, потому что у вас будет на 10 больше. | |||||||||||||
Примечание: Не беспокойтесь об этих сложных конструкциях.  Вам нужно знать, как их решать в принципе, но ваши экзаменаторы с гораздо большей вероятностью попросят у вас что-нибудь простое, например серу или железо. Вам нужно знать, как их решать в принципе, но ваши экзаменаторы с гораздо большей вероятностью попросят у вас что-нибудь простое, например серу или железо. | |||||||||||||
© Джим Кларк 2000 (последнее изменение в октябре 2012 г.) | |||||||||||||
Элемент Хром – Атом хрома
| Общие | |
|---|---|
| Имя, символ, номер | хром, Cr 24 |
| Химическая серия | переходные металлы |
| Группа, Период, Блок | 6 (ВИБ), 4, д |
| Внешний вид | серебристый металлик |
| Атомный недвижимость | |
| Атомный вес | 51. 9961 а.е.м. 9961 а.е.м. |
| Атомный радиус (расч.) | 140 (166) вечера |
| Ковалентный радиус | 127 вечера |
| радиус Ван-дер-Ваальса | нет данных |
| Электронная конфигурация | [Ар] 3d 5 4s 1 |
| e – на уровень энергии | 2, 8, 13, 1 |
| Степени окисления (оксид) | 6, 3 , 2 (сильная кислота) |
| Физический недвижимость | |
| Плотность | 7140 кг / м 3 |
| Состояние вещества | твердый |
| Температура плавления | 2130 К (3375 F) |
| Температура кипения | 2945 К (4842 Ф) |
| Кристаллическая структура | Телоцентрированная кубическая |
| Твердость | 8. 5 5 |
| Магнитный заказ | AFM (скорее: SDW) |
| Молярный объем | 7,23 10 -6 м 3 / моль |
| Теплота испарения | 344,3 кДж / моль |
| Теплота плавления | 16,9 кДж / моль |
| Давление пара | 990 Па при 2130 К |
| Скорость звука | 5940 м / с при 293.15 К |
| Разное | |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Удельная теплоемкость | 450 Дж / (кг * К) |
| Электропроводность | 7,74 10 6 / (МОм) |
| Теплопроводность | 93. 7 Вт / (м * К) 7 Вт / (м * К) |
| 1 st потенциал ионизации | 652,9 кДж / моль |
| 2 nd потенциал ионизации | 1590,6 кДж / моль |
| 3 rd потенциал ионизации | 2987 кДж / моль |
| 4 th потенциал ионизации | 4743 кДж / моль |
| 5 th потенциал ионизации | 6702 кДж / моль |
| 6 th потенциал ионизации | 8744.9 кДж / моль |
| SI единицы и STP используются, если не указано иное. | |
Хром – химический элемент
в периодической таблице, которая имеет символ Cr и
атомный номер 24.
Известные характеристики
Хром – серый стальной, блестящий, твердый металл, который требует полировка, трудно плавится, устойчива к коррозии и потускнению.
Наиболее распространенные степени окисления хрома: +2, +3, и +6, причем +3 – самый стабильный. +4 и +5 относительно редкий. Соединения хрома со степенью окисления 6 являются мощными окислители.
Приложения
Использование хрома:
- В металлургии для придания коррозионной стойкости и блеска.
финиш:
- в качестве компонента сплава, e.грамм. из нержавеющей стали,
- в хромированном покрытии,
- из анодированного алюминия (буквально переворачивая поверхность
алюминиевой детали в рубин).

- В качестве катализатора.
- Как полироль для металлов, оксид хрома 3 известен как зеленые румяна.
- Хромит используется для изготовления форм для обжига кирпича.
- Стекло из солей хрома цветное изумрудно-зеленое.
- Соли хрома используются при дублении кожи.
- Хром – это то, что делает рубин красным, и поэтому используется в производстве синтетических рубинов.
- Хроматы и оксиды используются в красителях и красках.
- Дихромат калия – химический реагент, используемый для очистки лабораторная посуда и как титрующее средство. Это также используется как протрава (т.е. фиксатор) красителей в ткани.
- Двуокись хрома (CrO 2 ) используется для производства
магнитная лента, у которой более высокая коэрцитивная сила, чем у оксида железа
ленты дают лучшую производительность.

История
В 1761 году Иоганн Готтлоб Леманн обнаружил оранжево-красный минерал. в Уральских горах, которые он назвал сибирским красным свинцом. Хоть ошибочно идентифицирован как соединение свинца с компонентами селена и железа, на самом деле материал был хроматом свинца (PbCrO 4 ).
В 1770 году Петр Симон Паллас посетил то же место, что и Леманн. и нашел красный «свинцовый» минерал, обладающий очень полезными свойствами. как пигмент в красках. Использование сибирского красного свинца в качестве пигмент краски быстро развивался. Ярко-желтый из крокоит стал очень модным цветом.
В 1797 году Николя-Луи Воклен получил образцы крокоита.
руда.Он смог произвести оксид хрома (CrO 3 ).
путем смешивания крокоита с соляной кислотой. В 1798 году Воклен
обнаружил, что он может изолировать металлический хром путем нагревания
оксид в угольной печи. Он также смог обнаружить следы
хрома в драгоценных камнях, таких как рубин или изумруд.
В 1798 году Воклен
обнаружил, что он может изолировать металлический хром путем нагревания
оксид в угольной печи. Он также смог обнаружить следы
хрома в драгоценных камнях, таких как рубин или изумруд.
В 1800-х годах хром в основном использовался в качестве компонента красок, но в настоящее время основное использование (85%) для металлических сплавов, остальная часть используется в химической промышленности и огнеупорах. и литейное производство
Хром был назван на основе греческого слова «цветность». цвет, из-за множества красочных составов, сделанных из него.
Биологическая роль
Трехвалентный хром является важным следовым металлом и требуется
для правильного метаболизма сахара в организме человека. Недостаток хрома
может влиять на эффективность инсулина в регулировании баланса сахара. В отличие от других незаменимых металлов, хром не подвергался
обнаружен в металлопротеине с биологической активностью. Следовательно,
функциональная основа потребности в хроме в рационе
остается необъяснимым.
В отличие от других незаменимых металлов, хром не подвергался
обнаружен в металлопротеине с биологической активностью. Следовательно,
функциональная основа потребности в хроме в рационе
остается необъяснимым.
появление
Хром добывается в виде хромита (FeCr 2 O 4 )
руда. Хром получают в промышленных масштабах путем нагревания руды.
в присутствии алюминия или кремния. Примерно половина
хромитовая руда в мире добывается в ЮАР. Казахстан,
Индия и Турция также являются крупными производителями. Неиспользованный
месторождения хромита многочисленны, но географически сконцентрированы
в Казахстане и на юге Африки.Примерно 15 миллионов
тонн товарной хромитовой руды было добыто в 2000 г. , а
переработано примерно в 4 миллиона тонн феррохрома
с ориентировочной рыночной стоимостью 2,5 миллиарда долларов США.
, а
переработано примерно в 4 миллиона тонн феррохрома
с ориентировочной рыночной стоимостью 2,5 миллиарда долларов США.
Хотя отложения самородного хрома редки, некоторое количество самородного хрома металл был обнаружен. Шахта Удачная в России добывает образцы самородного металла. Эта шахта – кимберлитовая трубка богатые алмазами, и таким образом обеспечиваемая восстанавливающая среда помогал производить как элементарный хром, так и алмаз.
Соединения
Дихромат калия – мощный окислитель и
предпочтительный состав для очистки лабораторной посуды от
любая возможная органика. Зеленый хром – это зеленый оксид
хром, Cr 2 O 3 , применяется при окраске эмалью,
и окрашивание стекла. Желтый хром – блестящий желтый пигмент,
PbCrO 4 , используется художниками.
Желтый хром – блестящий желтый пигмент,
PbCrO 4 , используется художниками.
Хромовая кислота имеет гипотетическую структуру H 2 CrO 4 . Ни хромовая, ни дихромовая кислоты не встречаются в природе, но их анионы находятся во множестве соединений. Хром триоксид, CrO 3 , ангидрид хромовой кислоты, продается в промышленных масштабах как «хромовая кислота».
Изотопы
Природный хром состоит из 3 стабильных изотопов;
52-Cr, 53-Cr и 54-Cr, причем 52-Cr является наиболее распространенным
(83.789% естественного обилия). Охарактеризовано 19 радиоизотопов.
наиболее стабильным является 50-Cr с периодом полураспада (более
чем) 1,8E17 лет и 51-Cr с периодом полураспада 27,7025
дней. Все остальные радиоактивные изотопы имеют период полураспада.
длится менее 24 часов, и у большинства из них
периоды полужизни менее 1 минуты. Этот элемент также
имеет 2 мета состояния.
Все остальные радиоактивные изотопы имеют период полураспада.
длится менее 24 часов, и у большинства из них
периоды полужизни менее 1 минуты. Этот элемент также
имеет 2 мета состояния.
Хром-53 – продукт радиогенного распада 53 Mn.
Изотопы хрома обычно сочетаются с марганцем.
изотопных составов и нашли применение в изотопной геологии.
Соотношения изотопов Mn-Cr подтверждают данные из 26 Al
и 107 Pd для ранней истории Солнечной системы.
Вариации отношений 53 Cr / 52 Cr и Mn / Cr
из нескольких метеоритов указывают на начальную 53 Mn / 55 Mn
соотношение, которое предполагает систематизацию изотопов Mn-Cr, должно привести к
от распада на месте 53 Mn в дифференцированной планетарной
тела.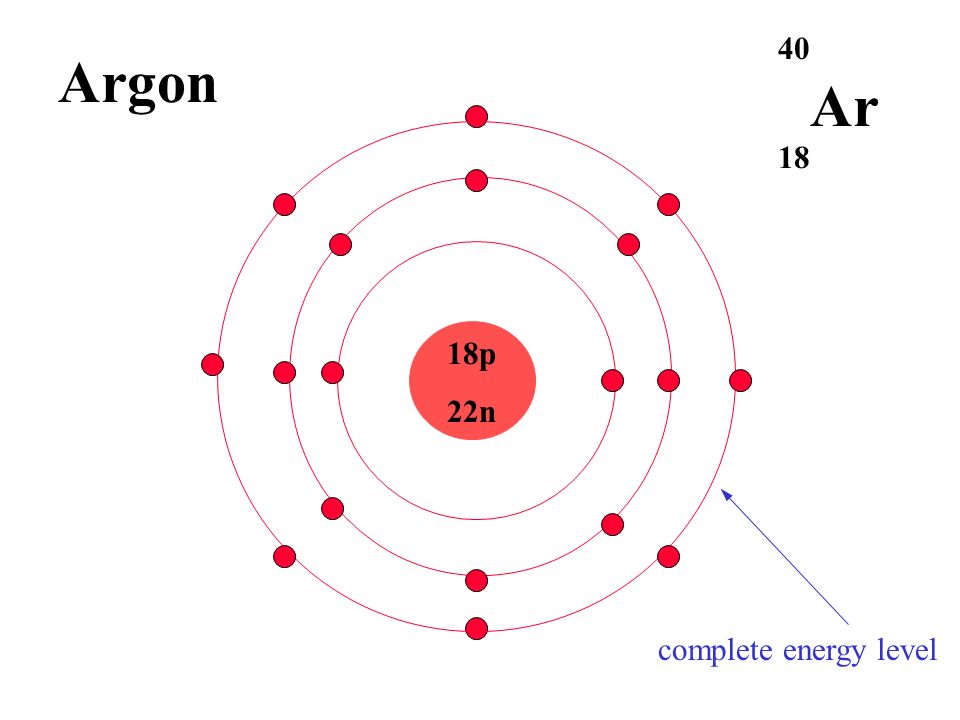 Следовательно, 53 Cr предоставляет дополнительные доказательства.
для нуклеосинтетических процессов непосредственно перед слиянием
Солнечной системы.
Следовательно, 53 Cr предоставляет дополнительные доказательства.
для нуклеосинтетических процессов непосредственно перед слиянием
Солнечной системы.
Изотопы хрома имеют атомную массу от 43 а.е.м. (43-Cr) до 67 а.е.м. (67-Cr). Основная мода распада перед Самый распространенный стабильный изотоп 52-Cr – это электронный захват и основная мода после – это бета-распад.
Меры предосторожности
Металлический хром и соединения хрома (III) обычно не входят в состав считается опасным для здоровья, но соединения хрома (VI) могут быть токсичным при пероральном приеме.Смертельная доза ядовитого соединения хрома (VI) составляет около половины чайной ложки материала. Большинство соединений хрома (VI) раздражают глаза, кожу. и слизистые оболочки. Хроническое воздействие соединений хрома (VI) может вызвать необратимую травму глаза, если не лечить должным образом. Хром (VI) является признанным канцерогеном для человека.
В 1958 г. Всемирная организация здравоохранения рекомендовала максимальную допустимая концентрация 0.05 мг / литр в питьевой воде для хрома (VI), исходя из соображений здоровья. Эта рекомендация было проверено несколько раз, и это значение не тем временем были пересмотрены.
Поскольку соединения хрома использовались / используются в красителях и красках и при дублении кожи эти соединения часто встречаются в почва и грунтовые воды на (заброшенных) промышленных площадках, сейчас нуждающиеся в экологической очистке и восстановлении.См. Также Brownfield земля.

 URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
URL: http://window.edu.ru/ (дата обращения: 01.06.2018).


 (Цифры в ответе могут повторяться.)
(Цифры в ответе могут повторяться.)


 (Цифры в ответе могут повторяться.)
(Цифры в ответе могут повторяться.)


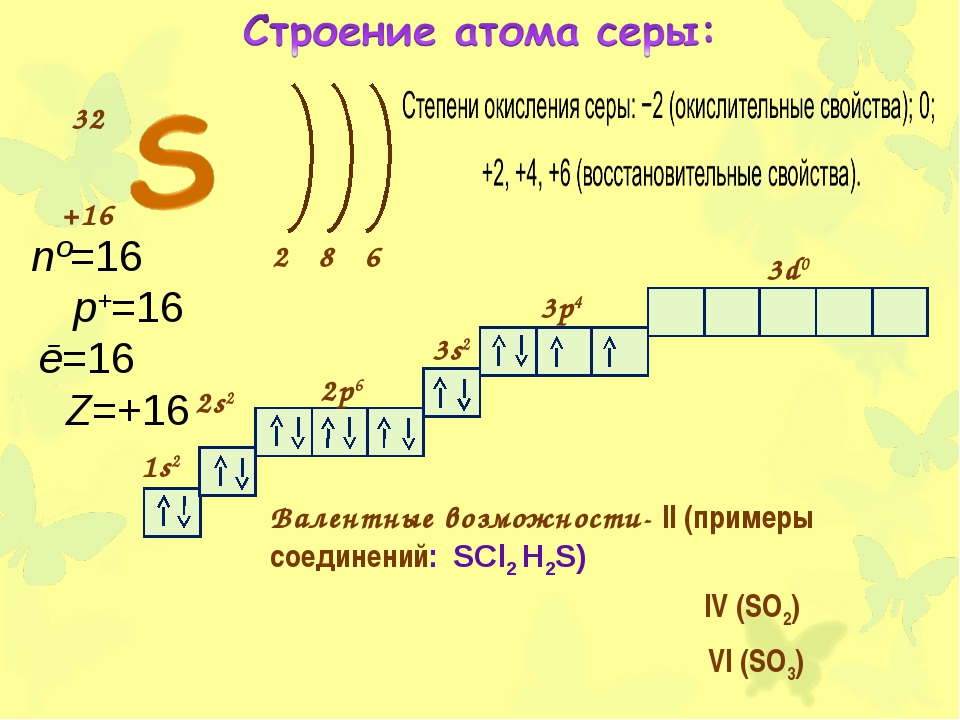 И. Менделеева
И. Менделеева 4
4
 1.
1. Химический элемент. Простые и сложные вещества. Основные классы неорганических веществ Номенклатура
Химический элемент. Простые и сложные вещества. Основные классы неорганических веществ Номенклатура 2.3
2.3 Все значения энергий связи электронов приведены в эВ. Энергии связи указаны относительно уровня вакуума для инертных газов и молекул H 2 , N 2 , O 2 , F 2 и Cl 2 ; относительно уровня Ферми для металлов; и относительно верха валентной зоны для полупроводников.
Все значения энергий связи электронов приведены в эВ. Энергии связи указаны относительно уровня вакуума для инертных газов и молекул H 2 , N 2 , O 2 , F 2 и Cl 2 ; относительно уровня Ферми для металлов; и относительно верха валентной зоны для полупроводников.
 Сначала он смешал раствор крокоита с карбонатом калия, чтобы осадить свинец. Затем он разложил лимонно-желтый промежуточный хромат в кислоте и, наконец, удалил связанный кислород путем нагревания с углеродом, оставив после себя элементарный хром.
Сначала он смешал раствор крокоита с карбонатом калия, чтобы осадить свинец. Затем он разложил лимонно-желтый промежуточный хромат в кислоте и, наконец, удалил связанный кислород путем нагревания с углеродом, оставив после себя элементарный хром. (II) хлорид и фиолетовый безводный хлорид хрома (III).Последнее из этих соединений проявляет удивительные свойства при гидратации. Его цвет меняется между бледно-зеленым, темно-зеленым и фиолетовым в зависимости от того, сколько из шести координационных центров иона хрома занято хлоридом, а не водой.
(II) хлорид и фиолетовый безводный хлорид хрома (III).Последнее из этих соединений проявляет удивительные свойства при гидратации. Его цвет меняется между бледно-зеленым, темно-зеленым и фиолетовым в зависимости от того, сколько из шести координационных центров иона хрома занято хлоридом, а не водой.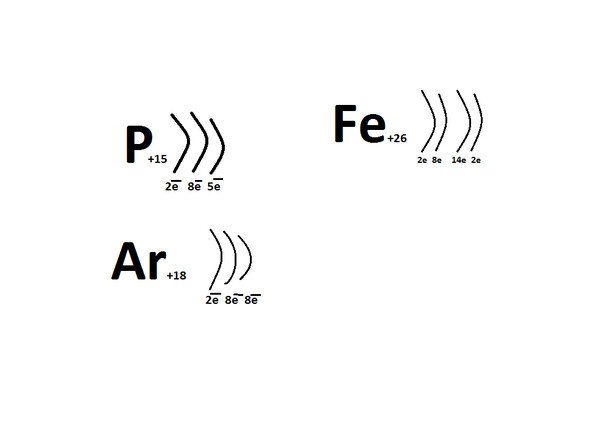
 Таким образом, когда к оксиду алюминия добавляется больше хрома, октаэдрическая среда вокруг хрома искажается, и две полосы поглощения смещаются в сторону красного цвета. В оксиде алюминия, в котором от 20 до 40% атомов алюминия заменены на хром, поглощенные и прошедшие цвета меняются местами, и мы видим этот комплекс как зеленый, превращая синтетический рубин в зеленый сапфир.
Таким образом, когда к оксиду алюминия добавляется больше хрома, октаэдрическая среда вокруг хрома искажается, и две полосы поглощения смещаются в сторону красного цвета. В оксиде алюминия, в котором от 20 до 40% атомов алюминия заменены на хром, поглощенные и прошедшие цвета меняются местами, и мы видим этот комплекс как зеленый, превращая синтетический рубин в зеленый сапфир.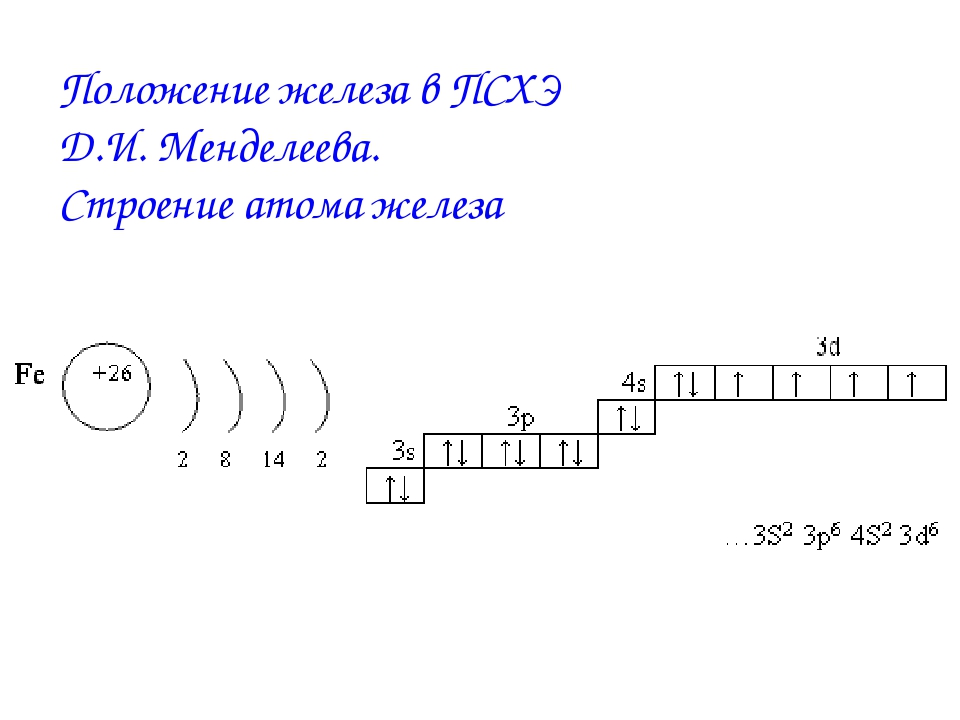 Его цвет также меняется в зависимости от того, рассматривается ли он при дневном свете или в теплых красных тонах свечей. При переходе от дневного света к свету свечи лучшие экземпляры меняют цвет с ярко-зеленого на огненно-красный. Мелкие драгоценные камни меняют цвет от тускло-зеленого до мутно-кроваво-красного.
Его цвет также меняется в зависимости от того, рассматривается ли он при дневном свете или в теплых красных тонах свечей. При переходе от дневного света к свету свечи лучшие экземпляры меняют цвет с ярко-зеленого на огненно-красный. Мелкие драгоценные камни меняют цвет от тускло-зеленого до мутно-кроваво-красного. С другой стороны, первая картина хрома (после драгоценных камней, конечно) – это когда он находится в своей металлической форме, например, для зеркальной коррозии и износостойких «хромовых» поверхностей шарикоподшипников и блестящих серебристых отделка деталей автомобиля.
С другой стороны, первая картина хрома (после драгоценных камней, конечно) – это когда он находится в своей металлической форме, например, для зеркальной коррозии и износостойких «хромовых» поверхностей шарикоподшипников и блестящих серебристых отделка деталей автомобиля.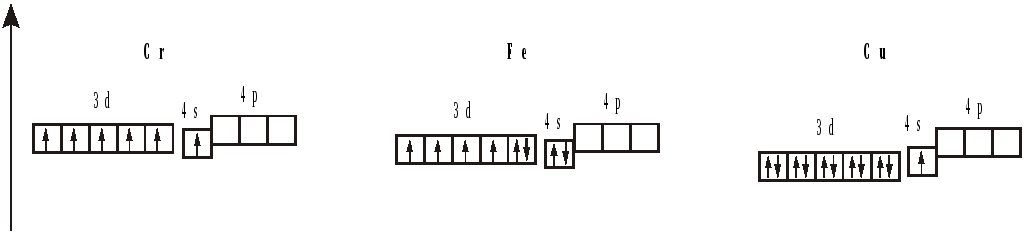 Таблица. В июне 1940 года американские физики Эдвин Макмиллан и Филип Абельсон, работающие в Радиационной лаборатории Беркли, написали статью, описывающую реакцию урана, которая была обнаружена при бомбардировке его нейтронами с помощью циклотронного ускорителя частиц.Примечательно, что открыто опубликованная статья Беркли покажет первый шаг к преодолению одного из самых больших препятствий на пути создания атомной бомбы.
Таблица. В июне 1940 года американские физики Эдвин Макмиллан и Филип Абельсон, работающие в Радиационной лаборатории Беркли, написали статью, описывающую реакцию урана, которая была обнаружена при бомбардировке его нейтронами с помощью циклотронного ускорителя частиц.Примечательно, что открыто опубликованная статья Беркли покажет первый шаг к преодолению одного из самых больших препятствий на пути создания атомной бомбы. 2 #).
2 #). Предполагается, что вы знаете о простых атомных орбиталях – по крайней мере, в том, как они названы, и их относительные энергии. Если вы хотите изучить электронные структуры простых одноатомных ионов (таких как Cl – , Ca 2+ и Cr 3+ ), вы найдете ссылку внизу страницы.
Предполагается, что вы знаете о простых атомных орбиталях – по крайней мере, в том, как они названы, и их относительные энергии. Если вы хотите изучить электронные структуры простых одноатомных ионов (таких как Cl – , Ca 2+ и Cr 3+ ), вы найдете ссылку внизу страницы. После бария вы должны беспокоиться о f-орбиталях, а также о s, p и d-орбиталях – и это проблема химии на более высоком уровне. Важно, чтобы вы просматривали прошлые экзаменационные работы, а также свою программу, чтобы вы могли оценить, насколько сложными могут быть вопросы.
После бария вы должны беспокоиться о f-орбиталях, а также о s, p и d-орбиталях – и это проблема химии на более высоком уровне. Важно, чтобы вы просматривали прошлые экзаменационные работы, а также свою программу, чтобы вы могли оценить, насколько сложными могут быть вопросы.


 Схема заполнения теперь точно такая же, как и в предыдущем периоде, за исключением того, что теперь все происходит на 3-м уровне.
Схема заполнения теперь точно такая же, как и в предыдущем периоде, за исключением того, что теперь все происходит на 3-м уровне. Это было бы неправдой, если бы внешний электрон в калии был 3d 1 .
Это было бы неправдой, если бы внешний электрон в калии был 3d 1 .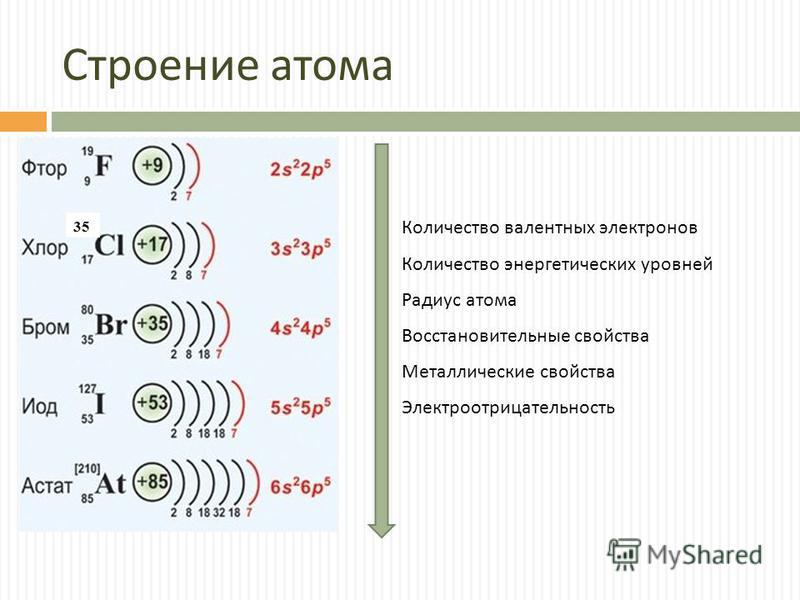 Итак, мы получили кальций со структурой 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 .
Итак, мы получили кальций со структурой 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 .
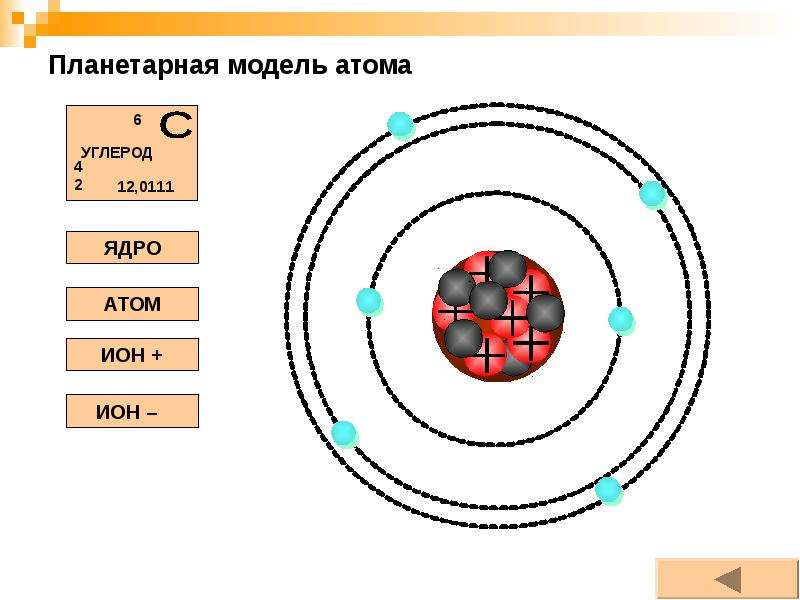

 (Благородные газы здесь представляют собой небольшую проблему, потому что их обычно называют группой 0, а не группой 8. Гелий имеет 2 внешних электрона, а остальные – 8.) Все элементы в группе 3, например, имеют 3 электрона на внешнем уровне. При необходимости поместите эти электроны на s- и p-орбитали. Орбитали какого уровня? Подсчитайте периоды в Периодической таблице (не забывая тот, в котором есть H и He).
(Благородные газы здесь представляют собой небольшую проблему, потому что их обычно называют группой 0, а не группой 8. Гелий имеет 2 внешних электрона, а остальные – 8.) Все элементы в группе 3, например, имеют 3 электрона на внешнем уровне. При необходимости поместите эти электроны на s- и p-орбитали. Орбитали какого уровня? Подсчитайте периоды в Периодической таблице (не забывая тот, в котором есть H и He).

