3.2.1. Строение атома – Энергетика: история, настоящее и будущее
3.2.1. Строение атома
Все в мире состоит из молекул, которые представляют собой сложные комплексы взаимодействующих атомов. Молекулы — это наименьшие частицы вещества, сохраняющие его химические свойства. Молекула состоит из одинаковых (в простом веществе) или разных (в химическом соединении) атомов, объединенных химическими связями.
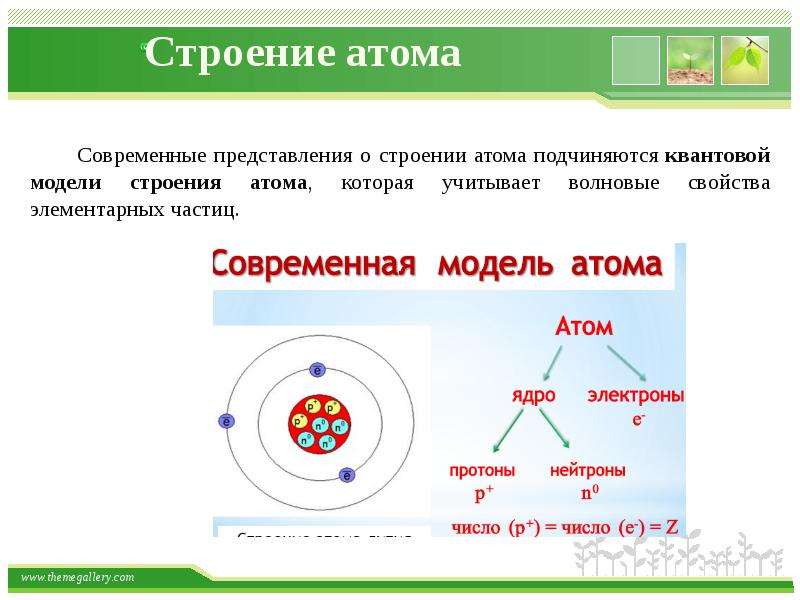
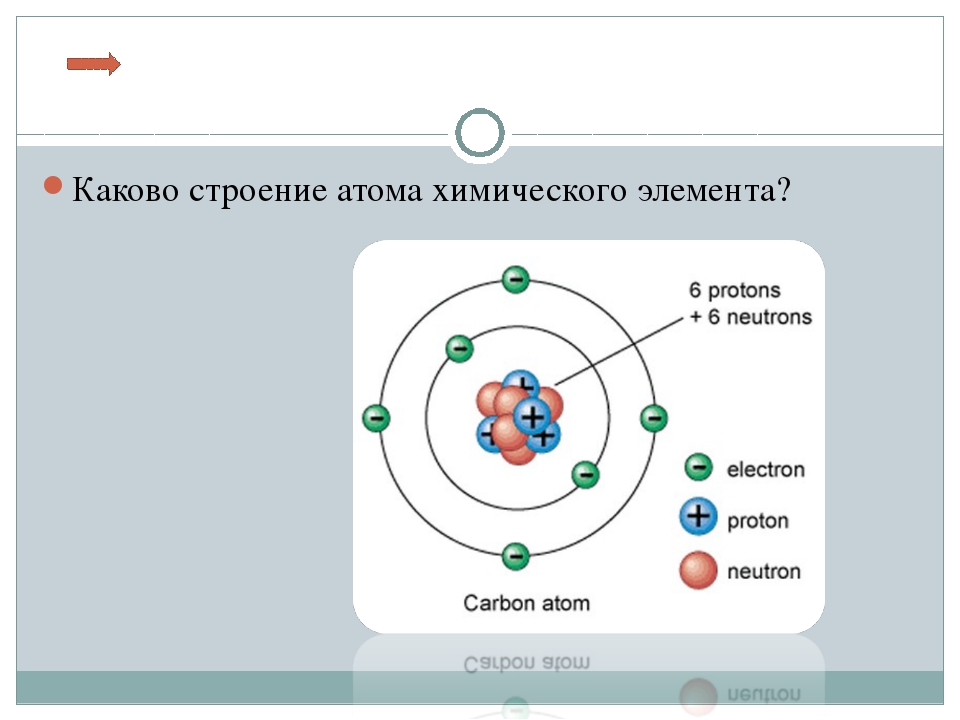
Атом – наименьшая частица химического элемента, которая является носителем его химических свойств. Все атомы химических элементов имеют одинаковую структуру. Их линейный размер в диаметре составляет примерно 10-10м. Атом состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов, которые размещены на электронных орбитах атома.
Электроны в атоме сгруппированы по оболочкам (слоям), которые принято обозначать буквами К, L, М, N, O, P, Q. Строение электронных оболочек подчинено строгому физическому закону – «в одном атоме не может быть двух электронов, находящихся в одном и том же энергетическом состоянии».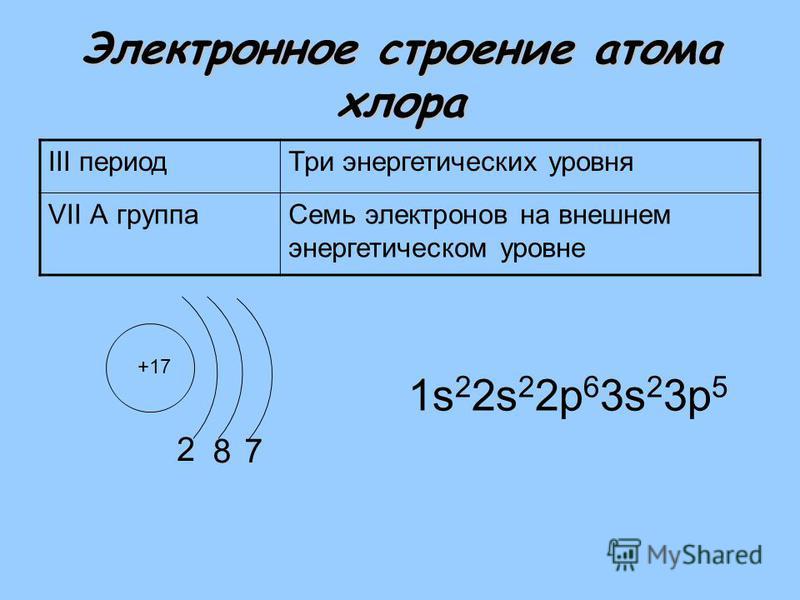
Ядро – центральная часть атома, состоящая из положительно заряженных протонов и нейтральных нейтронов. Эти частицы, называемые нуклонами, удерживаются в ядрах короткодействующими силами притяжения, возникающими за счет обмена квантами так называемого «сильного» взаимодействия. Размеры ядра примерно в 10–100 тысяч раз меньше линейных размеров атома (диаметр ядра порядка 10-14м). Несмотря на относительно малые размеры ядра, в нем сосредоточена практически вся масса атома, что обусловливает очень высокую плотность ядерного вещества. Масса ядра несколько ниже суммы масс составляющих его протонов и нейтронов в свободном состоянии. Эта разница называется «дефектом массы».
Размеры ядра примерно в 10–100 тысяч раз меньше линейных размеров атома (диаметр ядра порядка 10-14м). Несмотря на относительно малые размеры ядра, в нем сосредоточена практически вся масса атома, что обусловливает очень высокую плотность ядерного вещества. Масса ядра несколько ниже суммы масс составляющих его протонов и нейтронов в свободном состоянии. Эта разница называется «дефектом массы».
Ядро элемента X принято обозначать как илиX7A, где Z – заряд ядра, равный числу протонов, определяющий атомный номер ядра;A– массовое число ядра, равное суммарному числу протонов и нейтронов.
Протон – элементарная частица, носящая единичный положительный заряд, равный по абсолютной величине заряду электрона. Он является ядром атома простейшего водорода.
Нейтрон – незаряженная элементарная частица с массой покоя, несколько превышающей массу протона. В свободном состоянии нейтрон – неустойчивая частица и претерпевает превращения. Большая проникающая способность нейтронов объясняется тем, что эти частицы не заряжены.
Протон и нейтрон обозначаются соответственно и, где нижние индексы обозначают заряд, а верхние – массу в атомных единицах массы (а. е. м.), которая округляется до единицы. В качестве а. е. м. принята 1/12 часть массы атома углерода. Масса протона и нейтрона в 1840 раз больше массы электрона. Для протонов и нейтронов существует общее название нуклоны. Положительный заряд ядра определяется количеством протонов в нем. Атом любого химического элемента характеризуется двумя главными параметрами: массовым числом и атомным номером элемента в Периодической системе химических элементов Д.И. Менделеева. Массовое число А– суммарное число протонов и нейтронов в ядре данного атома. Атомный номер Z–число протонов, входящих в состав ядра. Исходя из этих определений, число нейтронов в ядре равно N=A–Z.
Ядра элементов с одинаковым числом протонов, но разным числом нейтронов называются изотопами.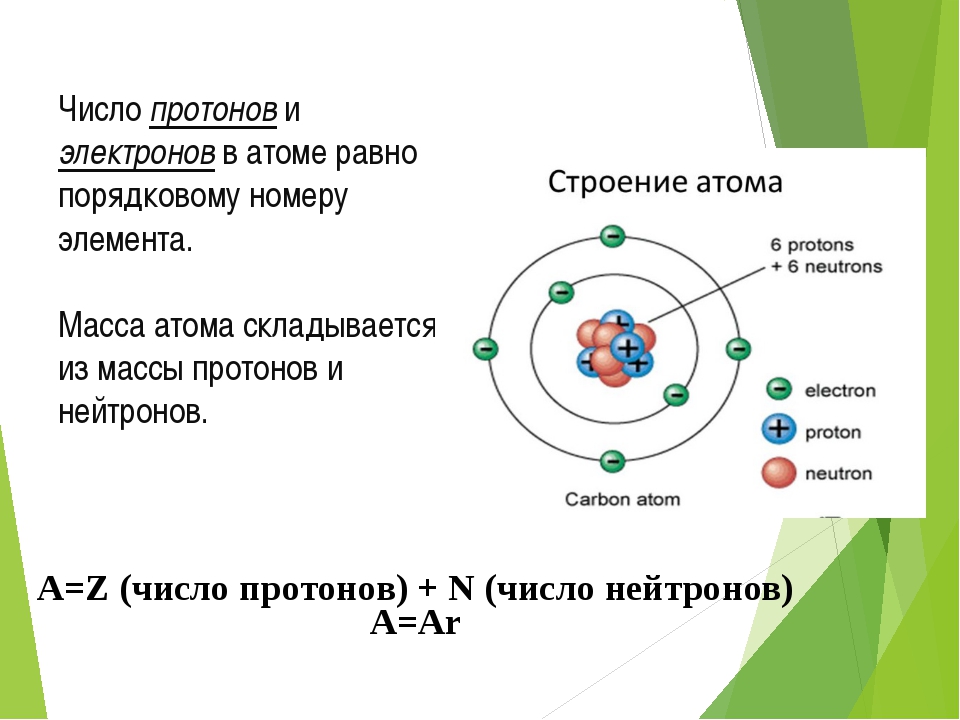 В качестве примера можно привести природный уран, который имеет три изотопа:В настоящее время известно около 1500 изотопов. Одни из них устойчивые (стабильные), другие – неустойчивые, радиоактивные.
В качестве примера можно привести природный уран, который имеет три изотопа:В настоящее время известно около 1500 изотопов. Одни из них устойчивые (стабильные), другие – неустойчивые, радиоактивные.
Заряд и массовое число являются основными характеристиками атомных ядер. Разновидности атомов, характеризующиеся определенным массовым числом и атомным номером, называют нуклидами и обозначают символом элемента с указанием атомного номера (внизу слева) и массового числа (вверху слева), например:В периодической системе элементы расположены строго последовательно в порядке возрастания заряда ядер их атомов. При этом свойства элементов находятся в периодической зависимости от заряда ядер их атомов. В каждом периоде системы химических элементов Д.И. Менделеева идет построение нового электронного слоя, а в больших периодах также достройка внутренних слоев. Поэтому число электронных слоев в атоме обычно равно номеру периода, в котором находится соответствующий элемент.
При нормальном состоянии атома количество его электронов, движущихся вокруг ядра, соответствует количеству протонов в ядре, что приводит к нейтрализации суммарных отрицательных зарядов электронов и положительного заряда ядра. В этом состоянии атом является электрически нейтральной системой.
Устойчивость атомных ядер обусловлена ядерными силами притяжения, удерживающими нуклоны в ядре. Особенность их заключается в том, что они достаточно велики на расстояниях, сопоставимых с размерами ядра (в 2–3 раза превосходят силы отталкивания Кулона, действующие между заряженными частицами, входящими в состав ядра). Эта особенность ядерных сил обусловлена энергией связи, которая составляет несколько миллионов электрон-вольт, что от нескольких сотен до нескольких тысяч раз превышает энергию связи электрона в атоме. При этом важно подчеркнуть, что устойчивость ядер атомов обеспечивается лишь при вполне определенных соотношениях протонов и нейтронов. Для легких ядер их число почти одинаково, для тяжелых – доля нейтронов возрастает. Ядра атомов, которые находятся в конце таблицы Менделеева (с атомным номером Z>82), как правило, неустойчивы. При увеличении суммарного числа нуклонов уменьшается сила ядерных притяжений и эффект кулоновских сил отталкивания начинает превалировать.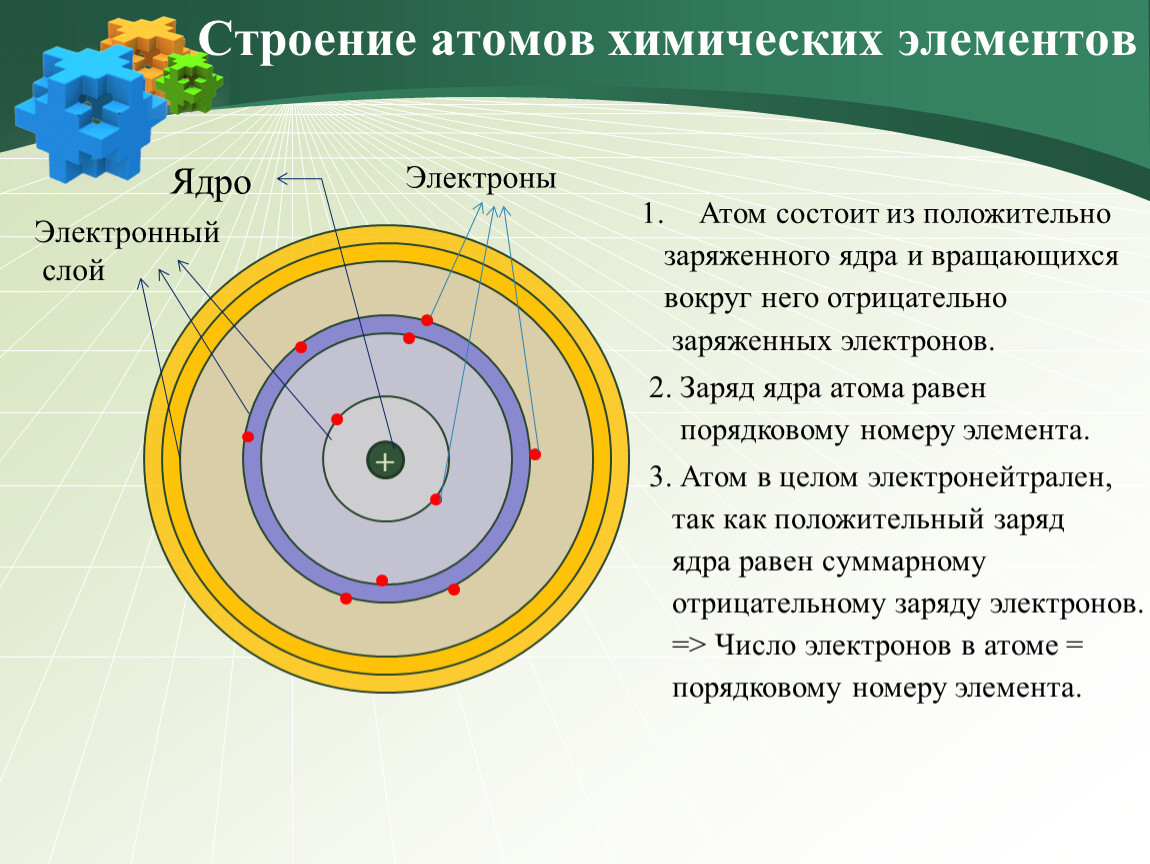
Процесс спонтанного перехода атомного ядра в другое ядро или ядра с испусканием при этом различных частиц называется радиоактивным распадом, или радиоактивностью.
Строение атома
В далёком прошлом философы Древней Греции предполагали, что вся материя едина, но приобретает те или иные свойства в зависимости от её «сущности». Некоторые из них утверждали, что вещество состоит из мельчайших частиц, называемых атомами. Научные основы атомно-молекулярного учения были заложены позднее в работах русского учёного М. В. Ломоносова, французских химиков Л. Лавуазье и Ж. Пруста, английского химика Д. Дальтона, итальянского физика А. Авогадро и других исследователей.
В. Ломоносова, французских химиков Л. Лавуазье и Ж. Пруста, английского химика Д. Дальтона, итальянского физика А. Авогадро и других исследователей.
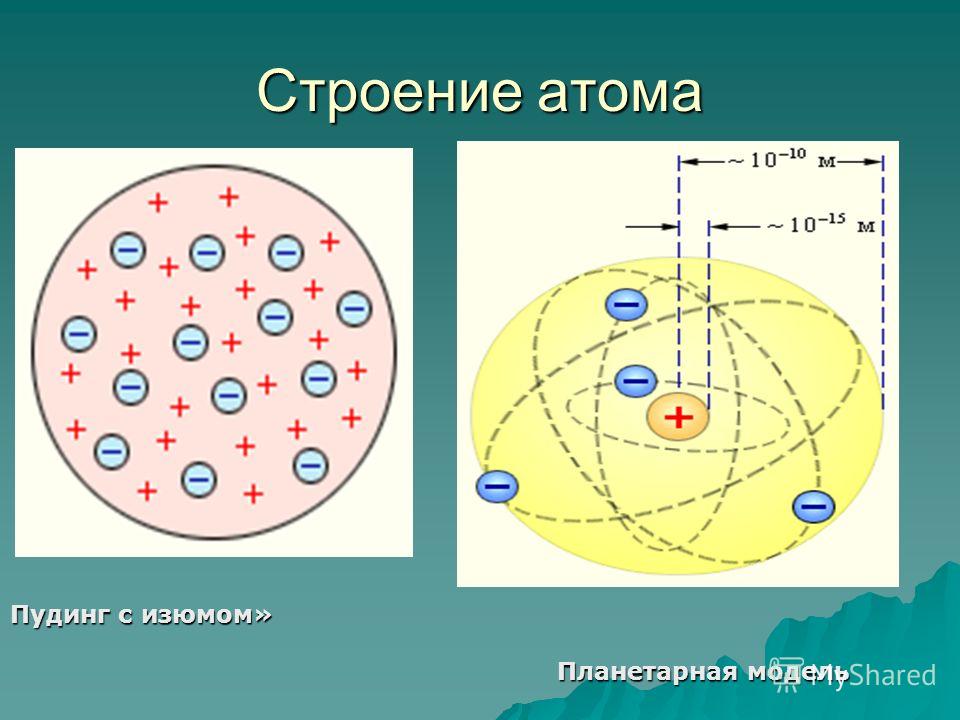
Периодический закон Д.И. Менделеева показывает существование закономерной связи между всеми химическими элементами. Это говорит о том что в основе всех атомов лежит нечто общее. До конца XIX века в химии царило убеждение, что атом есть наименьшая неделимая частица простого вещества. Считалось, что при всех химических превращениях разрушаются и создаются только молекулы, атомы же остаются неизменными и не могут дробиться на части. И наконец в конце XIX века были сделаны открытия, показавшие сложность строения атома и возможность превращения одних атомов в другие.
Это послужило толчком к образованию и развитию нового раздела химии «Строение атома». Первым указанием на сложную структуру атома – были опыты по изучению катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения.

Изучение строения атома практически началось в 1897-1898 гг., после того как была окончательно установлена природа катодных лучей как потока электронов и были определены величина заряда и масса электрона. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электроны входят в состав всех атомов.
 Но атом, как известно, электрически нейтрален, из этого следовало, что в его состав должна была входить ещё одна составная часть, уравновешивавшая сумму отрицательных зарядов электронов. Эта положительно заряженная часть атома была открыта в 1911 г. Резерфордом при исследовании движения
Но атом, как известно, электрически нейтрален, из этого следовало, что в его состав должна была входить ещё одна составная часть, уравновешивавшая сумму отрицательных зарядов электронов. Эта положительно заряженная часть атома была открыта в 1911 г. Резерфордом при исследовании движенияa-частиц в газах и других веществах.
Резерфорд Эрнест (1871-1937)
a- частицы, выбрасываемые веществами активных элементов представляют собой положительно заряженные ионы гелия, скорость движения которых достигает 20000 км/сек. Благодаря такой огромной скорости a-частицы, пролетая через воздух и сталкиваясь с молекулами газов, выбивают из них электроны. Молекулы, потерявшие электроны, становятся заряженными положительно, выбитые же электроны тотчас присоединяются к другим молекулам, заряжая их отрицательно. Таким образом, в воздухе на пути a-частиц образуются положительно и отрицательно заряженные ионы газа. Способность a-частиц ионизировать воздух была использована английским физиком Вильсоном для того, чтобы сделать видимыми пути движения отдельных частиц и сфотографировать их.
Впоследствии аппарат для фотографирования частиц получил название камеры Вильсона. (Первый трековый детектор заряженных частиц. Изобретена Ч. Вильсоном в 1912. Действие Вильсона камеры основано на конденсации пересыщенного пара (образовании мелких капелек жидкости) на ионах, возникающих вдоль следа (трека) заряженной частицы. В дальнейшем вытеснена другими трековыми детекторами.)
Исследуя пути движения частиц с помощью камеры, Резерфорд заметил, что в камере они параллельны (пути), а при пропускании пучка параллельных лучей через слой газа или тонкую металлическую пластинку, они выходят не параллельно, а несколько расходятся, т.е. происходит отклонение частиц от их первоначального пути. Некоторые частицы отклонялись очень сильно, некоторые вообще не проходили через тонкую пластинку.
Модель атома Бор-Резерфорд
Исходя из этих наблюдений, Резерфорд предложил свою схему строения атома: в центре атома находится положительное ядро, вокруг которого по разным орбиталям вращаются отрицательные электроны.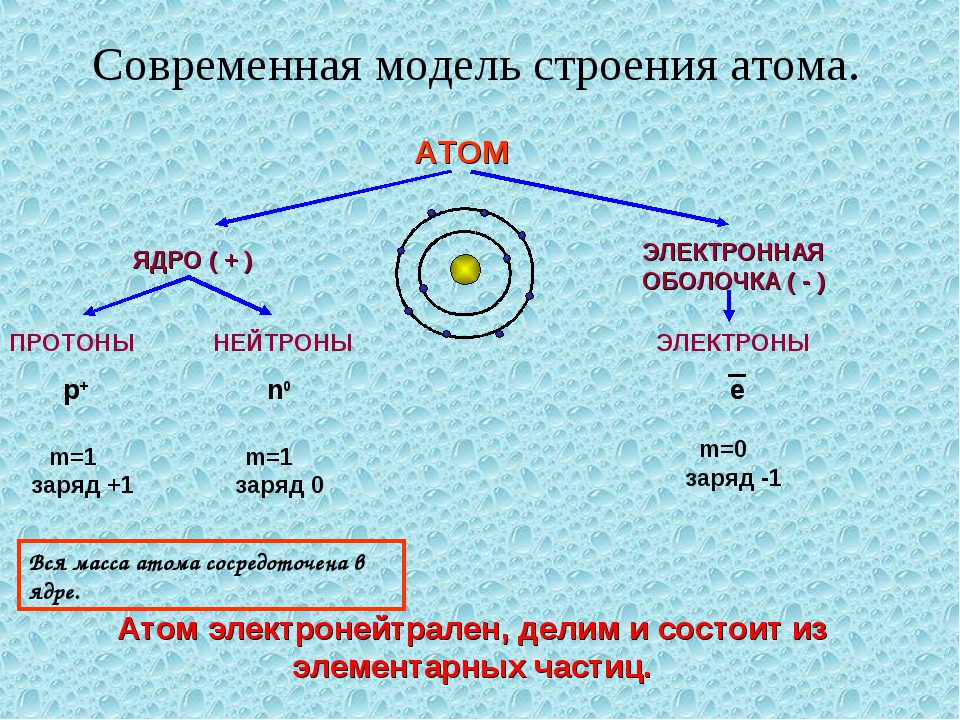 Центростремительные силы, возникающие при их вращении удерживают их на своих орбиталях и не дают им улететь. Эта модель атома легко объясняет явление отклонения a- частиц. Размеры ядра и электронов очень малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов; поэтому большинство a-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда a-частицы очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяние a-частиц положило начало ядерной теории атома. Одной из задач, стоявших перед теорией строения атома в начале ее развития, было определение величины заряда ядра различных атомов. Так как атом в целом электрически нейтрален, то, определив заряд ядра, можно было бы установить и число окружающих ядро электронов. В решении этой задачи этой большую помощь оказало изучение спектров рентгеновских лучей. Рентгеновские лучи возникают при ударе быстро летящих электронов о какое-либо твердое тело и отличаются от лучей видимого света только значительно меньшей длиной волны.
Центростремительные силы, возникающие при их вращении удерживают их на своих орбиталях и не дают им улететь. Эта модель атома легко объясняет явление отклонения a- частиц. Размеры ядра и электронов очень малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов; поэтому большинство a-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда a-частицы очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяние a-частиц положило начало ядерной теории атома. Одной из задач, стоявших перед теорией строения атома в начале ее развития, было определение величины заряда ядра различных атомов. Так как атом в целом электрически нейтрален, то, определив заряд ядра, можно было бы установить и число окружающих ядро электронов. В решении этой задачи этой большую помощь оказало изучение спектров рентгеновских лучей. Рентгеновские лучи возникают при ударе быстро летящих электронов о какое-либо твердое тело и отличаются от лучей видимого света только значительно меньшей длиной волны. В то время как короткие световые волны имеют длину около 4000 ангстремов (фиолетовые лучи), длины волн рентгеновских лучей лежат в пределах от 20 до 0,1 ангстрема. Чтобы получить спектр рентгеновских лучей, нельзя пользоваться обыкновенной призмой или дифракционной решеткой. (Дифракционная РЕШЕТКА, оптический прибор; совокупность большого количества параллельных щелей в непрозрачном экране или отражающих зеркальных полосок (штрихов), равноотстоящих друг от друга, на которых происходит дифракция света. Дифракционная решетка разлагает падающий на нее пучок света в спектр, что используется в спектральных приборах. )
В то время как короткие световые волны имеют длину около 4000 ангстремов (фиолетовые лучи), длины волн рентгеновских лучей лежат в пределах от 20 до 0,1 ангстрема. Чтобы получить спектр рентгеновских лучей, нельзя пользоваться обыкновенной призмой или дифракционной решеткой. (Дифракционная РЕШЕТКА, оптический прибор; совокупность большого количества параллельных щелей в непрозрачном экране или отражающих зеркальных полосок (штрихов), равноотстоящих друг от друга, на которых происходит дифракция света. Дифракционная решетка разлагает падающий на нее пучок света в спектр, что используется в спектральных приборах. )
Для рентгеновских лучей требовалась решётка с очень большим количеством делений на один миллиметр (примерно 1млн./1мм.). Такую решётку искусственно приготовить было невозможно. В 1912 г. у швейцарского физика Лауэ возникла мысль использовать кристаллы в качестве дифракционной решетки для рентгеновских лучей.
Модель кристалла
Упорядоченное расположение атомов в кристалле и малое расстояние между ними давало повод предполагать что как раз кристаллы и подойдут на роль требуемой дифракционной решётки.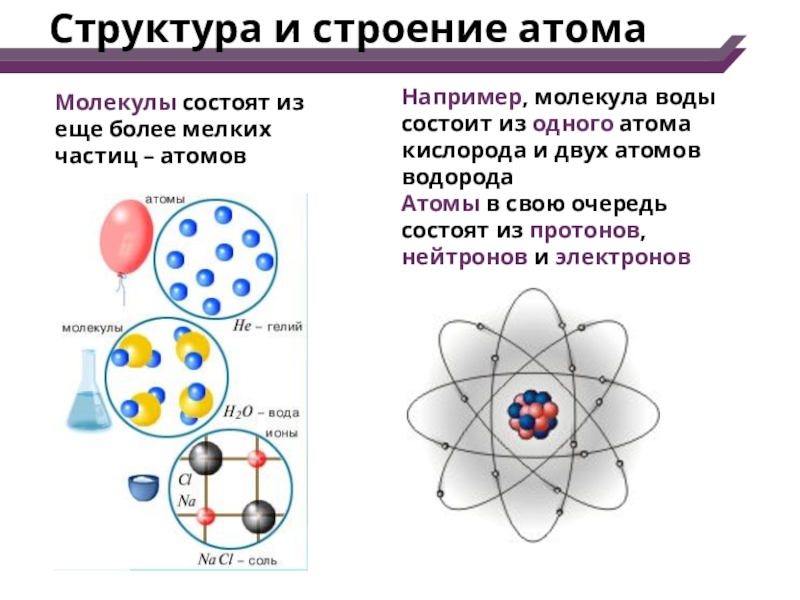
Опыт блестяще подтвердил предположение Лауэ, вскоре удалось построить приборы, которые давали возможность получать спектр рентгеновских лучей почти всех элементов. Для получения рентгеновских спектров антикатод в рентгеновских трубках делают из того металла, спектр которого хотят получить, или же наносят соединение исследуемого элемента. Экраном для спектра служит фотобумага; после проявления на ней видны все линии спектра. В 1913 г. английский ученый Мозли, изучая рентгеновские спектры нашел соотношение между длинами волн рентгеновских лучей и порядкового номерами соответствующих элементов – это носит название закона Мозли и может быть сформулировано следующим образом: Корни квадратные из обратных значений длин волн находятся в линейной зависимости от порядковых номеров элементов.
Еще до работ Мозли некоторые учёные предполагали, что порядковый номер элемента указывает число зарядов ядра его атома. В тоже время Резерфорд, изучая рассеивание a-частиц при прохождении через тонкие металлические пластинки, выяснил, что если заряд электрона принять за единицу, то выражаемый в таких единицах заряд ядра приблизительно равен половине атомного веса элемента. Порядковый номер, по крайне мере более легких элементов, тоже равняется примерно половине атомного веса. Все вместе взятое привело к выводу, что Заряд ядра численно равен порядковому номеру элемента. Таким образом, закон Мозли позволил определить заряды атомных ядер. Тем самым, ввиду нейтральности атомов, было установлено и число электронов, вращающихся вокруг ядра в атоме каждого элемента. Ядерная модель атома Резерфорда получила свое дальнейшее развитие благодаря работам Нильс Бора, в которых учение о строении атома неразрывно связывается с учением о происхождении спектров.
Порядковый номер, по крайне мере более легких элементов, тоже равняется примерно половине атомного веса. Все вместе взятое привело к выводу, что Заряд ядра численно равен порядковому номеру элемента. Таким образом, закон Мозли позволил определить заряды атомных ядер. Тем самым, ввиду нейтральности атомов, было установлено и число электронов, вращающихся вокруг ядра в атоме каждого элемента. Ядерная модель атома Резерфорда получила свое дальнейшее развитие благодаря работам Нильс Бора, в которых учение о строении атома неразрывно связывается с учением о происхождении спектров.
Бор (Bohr) Нильс Хенрик Давид (1885-1962)
Линейчатые спектры получаются при разложении света испускаемого раскаленными парами или газами. Каждому элементу отвечает свой спектр, отличающийся от спектров других элементов. Большинство металлов дает очень сложные спектры, содержащие огромное число линий (в железе до 5000), но встречаются и сравнительно простые спектры.
Развивая ядерную теорию Резерфорда, ученые пришли к мысли, что сложная структура линейчатых спектров обусловлена происходящими внутри атомов колебаниями электронов. По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона. Вращение электрона совершенно аналогично его быстрым колебаниям и должно вызвать испускание электромагнитных волн. Поэтому можно предположить, что вращающийся электрон излучает свет определенной длины волны, зависящий от частоты обращения электрона по орбите. Но, излучая свет, электрон теряет часть своей энергии, в следствие чего нарушается равновесие между ним и ядром; для восстановления равновесия электрон должен постепенно передвигаться ближе к ядру, причем так же постепенно будет изменяться частота обращения электрона и характер испускаемого им света. В конце концов, исчерпав всю энергию, электрон должен “упасть” на ядро, и излучение света прекратится. Если бы на самом деле происходило такое непрерывное изменение движения электрона, то и спектр получался бы всегда непрерывный, а не с лучами определенной длины волны. Кроме того, “падение” электрона на ядро означало бы разрушение атома и прекращения его существования.
По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона. Вращение электрона совершенно аналогично его быстрым колебаниям и должно вызвать испускание электромагнитных волн. Поэтому можно предположить, что вращающийся электрон излучает свет определенной длины волны, зависящий от частоты обращения электрона по орбите. Но, излучая свет, электрон теряет часть своей энергии, в следствие чего нарушается равновесие между ним и ядром; для восстановления равновесия электрон должен постепенно передвигаться ближе к ядру, причем так же постепенно будет изменяться частота обращения электрона и характер испускаемого им света. В конце концов, исчерпав всю энергию, электрон должен “упасть” на ядро, и излучение света прекратится. Если бы на самом деле происходило такое непрерывное изменение движения электрона, то и спектр получался бы всегда непрерывный, а не с лучами определенной длины волны. Кроме того, “падение” электрона на ядро означало бы разрушение атома и прекращения его существования. Таким образом, теория Резерфорда была бессильна объяснить не только закономерности в распределении
Таким образом, теория Резерфорда была бессильна объяснить не только закономерности в распределении
Планк (Planck) Макс
(1858-1947)
линий спектра, ни и само существование линейчатых спектров. В 1913 г. Бор предложил сою теорию строения атома, в которой ему удалось с большим искусством согласовать спектральные явления с ядерной моделью атома, применив к последней так называемую квантовую теорию излучения, введенную в науку немецким ученым-физиком Планком. Сущность теории квантов сводится к тому, что лучистая энергия испускается и поглощается не непрерывно, как принималось раньше, а отдельными малыми, но вполне определенными порциями – квантами энергии. Запас энергии излучающего тела изменяется скачками, квант за квантом; дробное число квантов тело не может ни испускать, ни поглощать. Величина кванта энергии зависит от частоты излучения: чем больше частота излучения, тем больше величина кванта. Кванты лучистой энергии называются также фотонами. Применив квантовые представления к вращению электронов вокруг ядра, Бор положил в основу своей теории очень смелые предположения, или постулаты.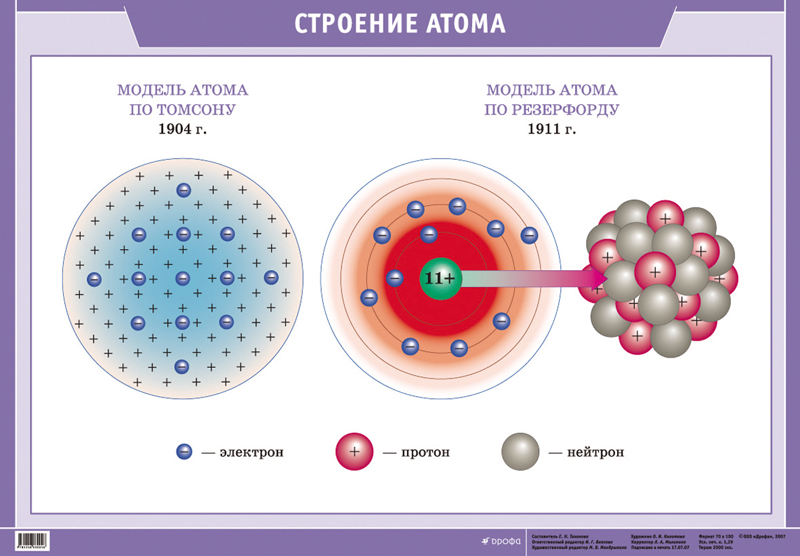 Хотя эти постулаты и противоречат законам классической электродинамики, но они находят свое оправдание в тех поразительных результатах, к которым приводят, и в том полнейшем согласии, которое обнаруживается между теоретическими результатами и огромным числом экспериментальных фактов. Постулаты Бора заключаются в следующем: Электрон может двигаться вокруг не по любым орбитам, а только по таким, которые удовлетворяют определенными условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения.
Хотя эти постулаты и противоречат законам классической электродинамики, но они находят свое оправдание в тех поразительных результатах, к которым приводят, и в том полнейшем согласии, которое обнаруживается между теоретическими результатами и огромным числом экспериментальных фактов. Постулаты Бора заключаются в следующем: Электрон может двигаться вокруг не по любым орбитам, а только по таким, которые удовлетворяют определенными условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения. Простейшим из атомов является атом водорода; вокруг ядра которого вращается только один электрон. Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1 : 2 : 3 : … n Величина n получила название главного квантового числа. Радиус ближайшей к ядру орбиты в атоме водорода равняется 0,53 ангстрема. Вычисленные отсюда частоты излучений, сопровождающих переходы электрона с одной орбиты на другую, оказались в точности совпадающими с частотами, найденными на опыте для линий водородного спектра .Тем самым была доказана правильность расчета устойчивых орбит, а вместе с тем и приложимость постулатов Бора для таких расчетов. В дальнейшем теория Бора была распространена и на атомную структуру других элементов, хотя это было связанно с некоторым трудностями из-за ее новизны.
Простейшим из атомов является атом водорода; вокруг ядра которого вращается только один электрон. Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1 : 2 : 3 : … n Величина n получила название главного квантового числа. Радиус ближайшей к ядру орбиты в атоме водорода равняется 0,53 ангстрема. Вычисленные отсюда частоты излучений, сопровождающих переходы электрона с одной орбиты на другую, оказались в точности совпадающими с частотами, найденными на опыте для линий водородного спектра .Тем самым была доказана правильность расчета устойчивых орбит, а вместе с тем и приложимость постулатов Бора для таких расчетов. В дальнейшем теория Бора была распространена и на атомную структуру других элементов, хотя это было связанно с некоторым трудностями из-за ее новизны.
Теория Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов. В настоящее время разработаны схемы строения атомов всех химических элементов. Однако, иметь ввиду, что все эти схемы это лишь более или менее достоверная гипотеза, позволяющая объяснить многие физические и химические свойства элементов. Как раньше уже было сказано, число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе. Электроны расположены по слоям, т.е. каждому слою принадлежит определенное заполняющие или как бы насыщающее его число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т.е. находятся примерно на одинаковом энергетическом уровне. Вся оболочка атома распадается
В настоящее время разработаны схемы строения атомов всех химических элементов. Однако, иметь ввиду, что все эти схемы это лишь более или менее достоверная гипотеза, позволяющая объяснить многие физические и химические свойства элементов. Как раньше уже было сказано, число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе. Электроны расположены по слоям, т.е. каждому слою принадлежит определенное заполняющие или как бы насыщающее его число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т.е. находятся примерно на одинаковом энергетическом уровне. Вся оболочка атома распадается
на несколько энергетических уровней. Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Наибольшее число электронов N, могущих находиться на данном энергетическом уровне, равно удвоенному квадрату номера слоя:
N=2n*n
где n-номер слоя. Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем – восемнадцати. Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженные положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот атомы присоединившие электроны становятся заряженные отрицательно. Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов. называются ионами. Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при этом или в электронейтральные атомы, или в новые ионы с другим зарядом. Теория Бора оказала огромные услуги физике и химии, подойдя, с одной стороны, к раскрытию законов спектроскопии и объяснению механизма лучеиспускания, а с другой – к выяснению структуры отдельных атомов и установлению связи между ними. Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла.
Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженные положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот атомы присоединившие электроны становятся заряженные отрицательно. Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов. называются ионами. Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при этом или в электронейтральные атомы, или в новые ионы с другим зарядом. Теория Бора оказала огромные услуги физике и химии, подойдя, с одной стороны, к раскрытию законов спектроскопии и объяснению механизма лучеиспускания, а с другой – к выяснению структуры отдельных атомов и установлению связи между ними. Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла.
Движение электронов в атомах Бор представлял как простое механическое, однако оно является сложным и своеобразным. Это своеобразие было объяснено новой квантовой теорией. Отсюда и пошло: «Карпускулярно-вролновой дуализм».
И так, электрон в атоме характеризуется:
1. Главным квантовым числом n, указывающим на энергию электрона;
2. Орбитальным квантовым числом l , указывающим на характер орбиты;
3. Магнитным квантовым числом, характеризующим положение облаков в пространстве;
4. И спиновым квантовым числом, характеризующим веретенообразное движение электрона вокруг своей оси.
… В далёком прошлом философы Древней Греции предполагали, что вся материя едина, но приобретает те или иные свойства в зависимости от её «сущности». А сейчас, в наше время, благодаря великим учёным, мы точно знаем, из чего на самом деле она состоит.
Используемая литература:
1) Курс общеё химии (Н.В. Коровин)
2) Курс общей химии (А.Н. Харин )
3) Строение вещества (В. К. Васильев, А.Н. Шувалова)
К. Васильев, А.Н. Шувалова)
4) Физическая химия ( А.Л. Дайнэко )
Строение атома – это… Что такое Строение атома?
- Строение атома
Wikimedia Foundation. 2010.
- Строение атмосферы
- Строение клетки
СТРОЕНИЕ АТОМА — (см.) построен из элементарных частиц трёх видов (см.), (см.) и (см.), образующих устойчивую систему. Протон и нейтрон входят в состав атомного (см.), электроны образуют электронную оболочку. В ядре действуют силы (см.), благодаря которым… … Большая политехническая энциклопедия
строение атома — atomo sandara statusas T sritis fizika atitikmenys: angl. atom structure; structure of atom vok.
 Atomaufbau, m; Atombau, m; Atomstruktur, f rus. строение атома, n; структура атома, f pranc. structure d’atome, f … Fizikos terminų žodynas
Atomaufbau, m; Atombau, m; Atomstruktur, f rus. строение атома, n; структура атома, f pranc. structure d’atome, f … Fizikos terminų žodynasстроение атома — atomo sandara statusas T sritis chemija apibrėžtis Atomą sudarančių dalelių ir jų ryšių visuma. atitikmenys: angl. atomic structure rus. строение атома … Chemijos terminų aiškinamasis žodynas
строение — сущ., с., употр. сравн. часто Морфология: (нет) чего? строения, чему? строению, (вижу) что? строение, чем? строением, о чём? о строении; мн. что? строения, (нет) чего? строений, чему? строениям, (вижу) что? строения, чем? строениями, о чём? о… … Толковый словарь Дмитриева
строение — СТРОЕНИЕ1, я, ср Системность, взаиморасположение частей, частиц в составе чего л.; внутреннее устройство чего л.; Син.: структура. Строение атома. Строение глаза. СТРОЕНИЕ2, я, ср То же, что здание; Син.: постройка. Быстрее стали выступать из… … Толковый словарь русских существительных
АТОМА СТРОЕНИЕ — раздел физики, изучающий внутреннее устройство атомов.
 Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы. Они имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся… … Энциклопедия Кольера
Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы. Они имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся… … Энциклопедия Кольерастроение — я; ср. 1. Здание, постройка. Бревенчатое, каменное с. Ветхое с. Двухэтажное с. Полуразрушенное с. Жилые, хозяйственные строения. 2. Взаимное расположение частей, частиц в составе чего л.; внутреннее устройство чего л.; структура. С. вещества. С.… … Энциклопедический словарь
строение — я; ср. см. тж. строеньице 1) Здание, постройка. Бревенчатое, каменное строе/ние. Ветхое строе/ние. Двухэтажное строе/ние. Полуразрушенное строе/ние … Словарь многих выражений
Орбитальная модель атома — Атомная орбиталь одноэлектронная волновая функция в сферически симметричном электрическом поле атомного ядра, задающаяся главным n, орбитальным l и магнитным m квантовыми числами. Название «орбиталь» (а не орбита) отражает геометрическое… … Википедия
ЯДРО АТОМА — (атомное ядро) внутренняя центральная часть (см.
 ), в которой сосредоточена почти вся его масса. Состоит из (см.) протонов и нейтронов (за исключением Я. а. водорода, состоящего всего лишь из единственного протона), связанных ядерными силами и… … Большая политехническая энциклопедия
), в которой сосредоточена почти вся его масса. Состоит из (см.) протонов и нейтронов (за исключением Я. а. водорода, состоящего всего лишь из единственного протона), связанных ядерными силами и… … Большая политехническая энциклопедия
Смотреть что такое “Строение атома” в других словарях:
2.1A: Обзор атомной структуры
Атомы состоят из частиц, называемых протонами, нейтронами и электронами, которые отвечают за массу и заряд атомов.
Задачи обучения
- Обсудить электронные и структурные свойства атома
Ключевые моменты
- Атом состоит из двух областей: ядра, которое находится в центре атома и содержит протоны и нейтроны, и внешней области атома, которая удерживает свои электроны на орбите вокруг ядра.
- Протоны и нейтроны имеют примерно одинаковую массу, около 1,67 × 10-24 грамма, которую ученые определяют как одну атомную единицу массы (а.е.м.) или один Дальтон.
- Каждый электрон имеет отрицательный заряд (-1), равный положительному заряду протона (+1).
- Нейтроны – это незаряженные частицы, находящиеся в ядре.
Ключевые термины
- атом : Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, состоящее из ядра, окруженного электронами.
- протон : положительно заряженная субатомная частица, составляющая часть ядра атома и определяющая атомный номер элемента. Он весит 1 а.е.м.
- нейтрон : субатомная частица, составляющая часть ядра атома. Это бесплатно. По массе он равен протону или весит 1 а.е.м.
Атом – это наименьшая единица вещества, которая сохраняет все химические свойства элемента. Атомы объединяются в молекулы, которые затем взаимодействуют с образованием твердых тел, газов или жидкостей.Например, вода состоит из атомов водорода и кислорода, которые объединились в молекулы воды. Многие биологические процессы посвящены расщеплению молекул на составляющие их атомы, чтобы из них можно было собрать более полезную молекулу.
Атомные частицы
Атомы состоят из трех основных частиц: протонов, электронов и нейтронов. Ядро (центр) атома содержит протоны (положительно заряженные) и нейтроны (без заряда). Внешние области атома называются электронными оболочками и содержат электроны (отрицательно заряженные).Атомы имеют разные свойства в зависимости от расположения и количества их основных частиц.
Атом водорода (H) содержит только один протон, один электрон и не содержит нейтронов. Это можно определить, используя атомный номер и массовое число элемента (см. Понятие атомных номеров и массовых чисел).
Рисунок \ (\ PageIndex {1} \): Структура атома : Изображенные здесь элементы, такие как гелий, состоят из атомов. Атомы состоят из протонов и нейтронов, расположенных внутри ядра, а электроны находятся на орбиталях, окружающих ядро.Атомная масса
Протоны и нейтроны имеют примерно одинаковую массу, примерно 1,67 × 10 -24 грамма. Ученые определяют это количество массы как одну атомную единицу массы (а. е.м.) или один дальтон. Протоны схожи по массе, но заряжены положительно, а нейтроны не имеют заряда. Следовательно, количество нейтронов в атоме существенно влияет на его массу, но не на его заряд.
е.м.) или один дальтон. Протоны схожи по массе, но заряжены положительно, а нейтроны не имеют заряда. Следовательно, количество нейтронов в атоме существенно влияет на его массу, но не на его заряд.
Электроны намного меньше по массе, чем протоны, всего 9,11 × 10 -28 грамма, или примерно 1/1800 атомной единицы массы.Следовательно, они не вносят большой вклад в общую атомную массу элемента. При рассмотрении атомной массы принято игнорировать массу любых электронов и вычислять массу атома, исходя только из числа протонов и нейтронов.
Электроны вносят большой вклад в заряд атома, поскольку каждый электрон имеет отрицательный заряд, равный положительному заряду протона. Ученые определяют эти обвинения как «+1» и «-1». В незаряженном нейтральном атоме количество электронов, вращающихся вокруг ядра, равно количеству протонов внутри ядра.В этих атомах положительный и отрицательный заряды нейтрализуют друг друга, в результате чего получается атом без чистого заряда.
Исследование свойств электрона : Сравните поведение электронов с поведением других заряженных частиц, чтобы обнаружить такие свойства электронов, как заряд и масса.
Объем атомов
С учетом размеров протонов, нейтронов и электронов большая часть объема атома – более 99 процентов – фактически является пустым пространством. Несмотря на все это пустое пространство, твердые объекты не проходят сквозь друг друга. Электроны, окружающие все атомы, заряжены отрицательно и заставляют атомы отталкиваться друг от друга, не позволяя атомам занимать одно и то же пространство. Эти межмолекулярные силы не позволяют вам провалиться сквозь такой объект, как стул.
Interactive: создайте атом : создайте атом из протонов, нейтронов и электронов и посмотрите, как изменяются элемент, заряд и масса. Тогда сыграйте в игру, чтобы проверить свои идеи!
Тогда сыграйте в игру, чтобы проверить свои идеи!
Структура атома
В письме в этот журнал на прошлой неделе г-н Содди обсудил влияние моей теории атома ядра на радиоактивные явления, и, похоже, у меня сложилось впечатление, что я придерживаюсь мнения, что ядро должно полностью состоять из положительного электричества.Фактически, я не обсуждал подробно вопрос о строении ядра, кроме утверждения, что оно должно иметь положительный заряд. Мне кажется, нет сомнений в том, что α-частица действительно возникает из ядра, и в течение некоторого времени я думал, что данные указывают на вывод о том, что частица имеет аналогичное происхождение. Этот момент довольно подробно обсуждался в недавней статье Бора ( Phil. Mag. , сентябрь 1913 г.). На мой взгляд, самым убедительным доказательством в поддержку этой точки зрения является (1) то, что β-луч, как и α-луч, превращения не зависят от физических и химических условий, и (2) что энергия, излучаемая в форме β и γ-лучи при преобразовании атома радия C намного больше, чем можно было бы ожидать, накапливается во внешней электронной системе. В то же время я считаю весьма вероятным, что значительная часть лучей, испускаемых радиоактивными веществами, исходит от внешних электронов. Однако это, вероятно, вторичный эффект, возникающий в результате первичного выброса β-частицы из ядра.
В то же время я считаю весьма вероятным, что значительная часть лучей, испускаемых радиоактивными веществами, исходит от внешних электронов. Однако это, вероятно, вторичный эффект, возникающий в результате первичного выброса β-частицы из ядра.
Первоначальное предположение ван дер Брука о том, что заряд ядра равен атомному номеру, а не половине атомного веса, кажется мне очень многообещающим. Эта идея уже использовалась Бором в его теории строения атомов.Наиболее убедительные и убедительные доказательства в поддержку этой гипотезы можно найти в статье Мозли в The Philosophical Magazine за этот месяц. Там он показывает, что частоту Х-излучения ряда элементов можно просто объяснить, если количество единичных зарядов ядра равно атомному номеру. Казалось бы, заряд ядра является фундаментальной константой, определяющей физические и химические свойства атома, в то время как атомный вес, хотя он приблизительно соответствует порядку заряда ядра, вероятно, является сложной функцией последнего в зависимости от детальная структура ядра.
Структура атома – Атомная структура – AQA – GCSE Combined Science Revision – AQA Trilogy
Субатомные частицы
Ядра всех атомов содержат субатомные частицы, называемые протонами. Ядра большинства атомов также содержат нейтроны.
Структура атома углерода, не в масштабеМасса субатомных частиц очень мала. Вместо того, чтобы записывать их фактическую массу в килограммах, мы часто используем их относительную массу. Относительная масса протона равна 1, а частица с относительной массой меньше 1 имеет меньшую массу.
| Субатомная частица | Относительная масса | Относительный заряд |
|---|---|---|
| Протон | 1 | +1 |
| Нейтрон | 1ekv3i0nm24.0.0.0.1:0.1.0.$0.$2.$4.$2.$1.$1″> 1 | 0 |
| -1 |
Масса электрона очень мала по сравнению с протоном или нейтроном. Поскольку ядро содержит протоны и нейтроны, большая часть массы атома сосредоточена в его ядре.
Протоны и электроны имеют одинаковые и противоположные электрические заряды.
Помните, что P ротоны являются P положительными, а N эвтронами 1ekv3i0nm24.0.0.0.1:0.1.0.$0.$2.$7.1.$7″> N эвтральными.
4.4 Строение атома | Атом
В результате работы, проделанной предыдущими учеными над атомными моделями, ученые теперь имеют хорошее представление об атомных моделях. как выглядит атом. Эти знания важны, потому что они помогают нам понять, почему материалы имеют разные свойства и почему одни материалы сцепляются с другими.Давайте теперь подробнее рассмотрим микроскопическая структура атома (как атом выглядит внутри).
До сих пор мы обсуждали, что атомы состоят из положительно заряженного ядра окружен одним или несколькими отрицательно заряженными электронами . Эти электроны вращаются вокруг ядро.
Прежде чем мы рассмотрим некоторые полезные концепции, нам сначала нужно понять, какие электроны, протоны и нейтроны
находятся.{- \ text {19}} \) \ (\ text {C} \)).
Ядро (ESABB)
В отличие от электрона, ядро может быть разбито на на более мелкие строительные блоки. назвал протонов и нейтронов . Вместе протоны и нейтроны называются нуклонами .
Ученые считают, что электрон можно рассматривать как точечную частицу или элементарная частица означает, что ее нельзя ни на что разложить
меньше.{- \ text {19}} \) \ (\ text {C} \)). Поскольку мы знаем, что атомы электрически нейтральный , т.е.не несут наценки, тогда номер
протонов в атоме должно быть таким же, как количество электронов, чтобы уравновесить
положительный и отрицательный заряд до нуля.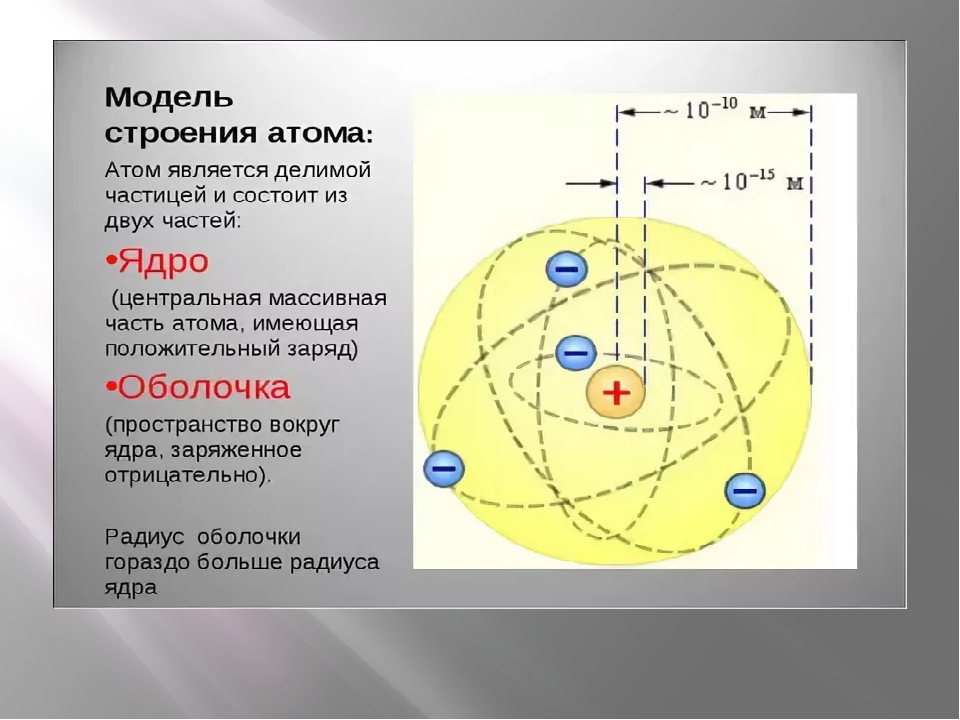 {- \ text {27}} \) \ (\ text {kg} \) (немного тяжелее протона).
{- \ text {27}} \) \ (\ text {kg} \) (немного тяжелее протона).
протон | нейтрон | электрон | |
Масса (\ (\ text {kg} \)) | \ (\ text {1,6726} \ times \ text {10} ^ {- \ text {27}} \) | \ (\ text {1,6749} \ times \ text {10} ^ {- \ text {27}} \) | \ (\ text {9,11} \ times \ text {10} ^ {- \ text {31}} \) |
Единицы заряда | \ (\ text {+1} \) | \ (\ text {0} \) | \ (- \ text {1} \) |
Заряд (\ (\ text {C} \)) | \ (\ text {1,6} \ times \ text {10} ^ {- \ text {19}} \) | \ (\ text {0} \) | \ (- \ text {1,6} \ times \ text {10} ^ {- \ text {19}} \) |
Таблица 4. 2: Краткое описание частиц внутри атома.
2: Краткое описание частиц внутри атома.
Атомный номер и атомное массовое число (ESABC)
Химические свойства элемента определяются зарядом его ядра, т.е. число протонов . Это число называется атомным номером и обозначается буквой Z .
- Атомный номер (Z)
Число протонов в атоме.
Вы можете найти атомный номер в таблице Менделеева (см. Таблицу Менделеева в начале книги). В атомный номер является целым числом от 1 до 118.
Масса атома зависит от того, сколько нуклонов содержит его ядро. Число нуклонов, т.е.
общее количество протонов плюс нейтронов называется атомной массой номер и обозначается буквой А .
В настоящее время элемент 118 – это наивысший атомный номер элемента. Элементы высокой атомной числа (примерно от 93 до 118) не существуют до тех пор, пока они распадаются за секунды формируется. Ученые считают, что после 118-го элемента может быть «остров стабильность », в которой присутствуют элементы с более высоким атомным номером, которые не распадаются на части в считанные секунды.
Нуклид – это особый вид атома или ядра, характеризующийся числом протонов и нейтроны в атоме. Чтобы быть абсолютно правильным, когда мы представляем атомы, как здесь, тогда мы должны называть их нуклидами.
- Атомное массовое число (A)
Число протонов и нейтронов в ядре атома.
 {56} \ text {Fe} \), где атомный номер \ (Z = 26 \), а массовое число \ (A = 56 \).
Количество нейтронов – это просто разница \ (N = A – Z = 30 \).
{56} \ text {Fe} \), где атомный номер \ (Z = 26 \), а массовое число \ (A = 56 \).
Количество нейтронов – это просто разница \ (N = A – Z = 30 \).Не путайте использованные здесь обозначения с тем, как эта информация отображается на периодическая таблица. В периодической таблице атомный номер обычно появляется вверху. левый угол блока или непосредственно над символом элемента.Номер ниже символ элемента – его относительная атомная масса . Это не совсем то то же, что и атомное массовое число. Это будет объяснено в разделе «Изотопы». Пример железа показано ниже.
Для нейтрального атома количество электронов такое же, как и количество протонов, так как заряд на атоме должен уравновеситься.
 Но что произойдет, если атом получит или потеряет электроны? Значит ли это
что атом по-прежнему будет частью того же элемента? Изменение количества электронов
атом не меняет тип атома, которым он является. Однако заряд атома изменится. нейтралитет атома изменился. Если электронов добавлено , то атом
станет более отрицательным .{-} \), которая приобрела один электрон и теперь имеет 10 электронов вместо 9.
Но что произойдет, если атом получит или потеряет электроны? Значит ли это
что атом по-прежнему будет частью того же элемента? Изменение количества электронов
атом не меняет тип атома, которым он является. Однако заряд атома изменится. нейтралитет атома изменился. Если электронов добавлено , то атом
станет более отрицательным .{-} \), которая приобрела один электрон и теперь имеет 10 электронов вместо 9.Рабочий пример 1: Стандартное обозначение
Используйте стандартные обозначения для обозначения натрия и укажите количество протонов, нейтронов и электроны в элементе.
Дайте элементу символ
\ (\ text {Na} \)
Найдите число протонов
Натрий состоит из 11 протонов, поэтому мы имеем: \ (_ {11} ^ {23} \ text {Na} \)
Найдите количество электронов
Натрий нейтрален, поэтому у него такое же количество электронов, как и у протонов.
 Количество
электронов есть \ (\ text {11} \).
Количество
электронов есть \ (\ text {11} \).Найти \ (A \)
Из периодической таблицы мы видим, что \ (A = 23 \).
Вычислить количество нейтронов
Мы знаем \ (A \) и \ (Z \), поэтому можем найти \ (N \): \ (N = A – Z = 23-11 = 12 \).{23} \ text {Na} \). Число протонов 11, количество нейтронов 12 и количество электронов 11.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.
 Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Структура атома | Протоны, нейтроны, электроны
Основные понятия:
Что такое атом? В этом руководстве по атомной структуре вы узнаете о различных частях атома, а также о субатомных частицах, обнаруженных в каждой области.Вы также узнаете о свойствах субатомных частиц. Эти свойства включают в себя атомный номер , атомную массу и чистый заряд . Вы также узнаете атомные определения – что такое электрон, что такое протон и что такое нейтрон.
Обсуждается в других статьях:
Что такое атом?
Итак, , каково определение атома ? Атом – это строительный блок материи, используемый для определения характеристик элемента.Атомы могут взаимодействовать друг с другом посредством связывания, образуя более сложные вещества, также известные как молекулы. Эти взаимодействия определяют состояние вещества, в котором находятся атомы, поскольку их можно найти в виде твердых тел, жидкостей или газов.
Какие части атома?
Атомы состоят из 3 основных компонентов, известных как субатомные частицы, состоящих из протонов, (положительно заряженных), нейтронов, (без заряда) и электронов, (отрицательно заряженных).Это части атома.
Атомная структура этих строительных блоков очень интересна. Протоны и нейтроны расположены в центре атома, а электроны довольно далеко от центра. Давайте посмотрим на эти атомные частицы более подробно.
Важные понятия:
- Атомы состоят из очень маленьких частиц, называемых протонами, нейтронами и электронами – частями атома.
- Протоны и нейтроны находятся в центре атома, и они составляют ядро.
- Протоны имеют положительный заряд.
- Нейтроны имеют нейтральный заряд (без заряда).
- Электроны имеют отрицательный заряд и находятся далеко от ядра.
- Заряды протона и электрона абсолютно одинаковы по величине, но противоположны по знаку.
- Протоны и электроны притягиваются друг к другу, потому что у них противоположные заряды.
Что такое протоны?
Протон Определение: Протоны – это положительно заряженные субатомные частицы, находящиеся в ядрах всех атомов.Заряд протона +1. Атомный номер элемента равен количеству протонов в ядре. Протоны состоят из двух верхних кварков и одного нижнего кварка. Он имеет массу 1,007277 а.е.м. (атомные единицы массы).
Что такое нейтроны?
Определение нейтрона: Итак, что такое нейтрон? Нейтрон – это нейтрально заряженная субатомная частица, находящаяся в ядрах всех атомов, кроме водорода. Нейтрон имеет массу немного больше, чем протон.
Нейтрон – это тип адрона, который состоит из одного верхнего кварка и двух нижних кварков.Он имеет массу 1,008665 а.е.м. (атомные единицы массы). В бета-распаде нейтрон может превращаться в протон, электрон и антинейтрино. Протоны и нейтроны называются нуклонами .
Нейтроны важны, потому что они определяют изотоп элемента. Например, углерод с 6 нейтронами – это углерод-12, но добавив еще два нейтрона, вы получите углерод-14, присутствие которого в органическом материале используется при радиоуглеродном датировании, также известном как датирование по углероду-14.
Что такое электроны?
Определение электрона: Электроны – это субатомные частицы, которые вращаются вокруг ядра атома.Они имеют отрицательный заряд и намного меньше протонов или нейтронов. На самом деле они в 1800 раз меньше. Они также переносят электричество. Заряд электрона -1. Электрон несет заряд 1,6 х 10-19 кулонов. У них нет известных компонентов или подструктуры. У них масса 0,000549 а.е.м.
Что такое ядро
Давайте поговорим подробнее об атомной структуре. Центр атома называется ядром и состоит как из протонов, так и из нейтронов. Эта часть атома способна определять широкий спектр свойств, таких как атомный номер и атомная масса .
Атомный номер элемента определяется числом протонов, присутствующих в ядре. Пример: в ядре углерода 6 протонов, что делает его также шестым элементом в периодической таблице.
Как найти атомную массу
Самый простой способ определить атомную массу элемента – это посмотреть на таблицу Менделеева. Атомная масса также может быть вычислена путем сложения количества нейтронов и протонов. Это происходит из-за того, что электроны имеют очень маленькую массу, поэтому не вносят значительного вклада в атомную массу.Пример: атом кислорода, содержащий 8 протонов и 8 нейтронов, имеет атомную массу 16 а.е.м. (протоны и нейтроны имеют массу примерно 1 а.е.м.). Вы также можете рассчитать среднюю атомную массу, известную как атомный вес, если знаете содержание каждого изотопа.
Вы можете узнать о том, как было открыто ядро.
Что такое электронные оболочки
Электронные оболочки расположены во внешней области атома, окружающего ядро. Эта область содержит только электроны и может определить общий заряд атома.
Чистый заряд атома определяется разницей в общем количестве электронов и протонов. Если в атоме протонов больше, чем электронов, итоговый заряд положительный, и наоборот. Пример: атом, содержащий 5 протонов и 3 электрона, имеет чистый заряд +2.
Части атома – Словарные определения:
Протоны : положительно заряженные субатомные частицы, которые находятся в ядре.
Нейтроны : нейтрально заряженные субатомные частицы, находящиеся в ядре.
Электроны : отрицательно заряженные субатомные частицы, обнаруженные в электронных оболочках, окружающих ядро.
Ядро : область в центре атома, содержащая как протоны, так и нейтроны.
Электронные оболочки : Область, расположенная во внешней части атома, содержащая только электроны.
Структура атома: Как протоны, нейтроны и электроны расположены в атоме
Frontiers | Простой подход к характеристике атомной структуры для машинного обучения моделей граничной структуры и свойств зерен
1.Введение
Границы зерен (GB) играют важную роль для многих свойств материала, таких как водородная хрупкость (Bechtle et al., 2009), ползучесть (Gertsman and Tangri, 1997; Watanabe et al., 2009), коррозионная стойкость (Shimada et al., 2009). ., 2002; Tan et al., 2008) и проводимости (Zhang et al., 2006). Хотя структура ГЗ чаще всего экспериментально характеризуется пятью макроскопическими кристаллографическими степенями свободы (Ashby et al., 1978), именно атомная структура в основном определяет их свойства (Katritzky and Fara, 2005).Атомистическое моделирование использовалось для исследования атомной структуры ГБ и того, как она соотносится с их наблюдаемыми свойствами (Zhang et al., 2009). Однако атомная структура ГБ намного сложнее, чем их кристаллографическая структура, и традиционные дескрипторы идентификации кристаллов не предназначены для классификации структуры подавляющего большинства атомов, присутствующих в ГБ. В качестве примера мы проанализировали 388 ГБ, построенные Olmsted et al. (2009), используя общие методы идентификации кристаллической структуры: анализ угловых связей (BAA) (Ackland and Jones, 2006), анализ общих соседей (CNA) (Faken and Jónsson, 1994) и сопоставление многогранных шаблонов (PTM) (Larsen et al. ., 2016). В таблице 1 представлен процент атомов ГБ, которые были неклассифицированы (т. Е. Классифицированы как «другие» / неизвестные структуры) каждым методом по всем 388 ГБ и по подмножеству из 41 Σ3 ГБ. Тот факт, что 50–98% атомов ГБ остаются неклассифицированными, затрудняет определение отношений атомная структура-свойства для ГБ и предполагает острую необходимость в новых методах, которые могут описывать сложную атомную структуру ГБ.
Таблица 1 . Сравнение методов характеризации, примененных к набору данных Olmsted GB (Olmsted et al., 2009).
Из-за сложной и многомерной природы атомных структур ГБ, машинное обучение и связанные с ним статистические подходы обеспечивают привлекательный путь для разработки моделей атомной структуры и свойств. Однако неспособность разрешить атомную структуру внутри ГБ усложняет такие усилия, потому что эффект отдельных атомарных сред не может быть извлечен, если эти среды не могут быть различимы. Если бы было возможно полностью охарактеризовать атомарную структуру ГБ, методы уменьшения размерности, такие как выбор признаков (например,g., деревья решений) и преобразование признаков (например, анализ основных компонентов) могут применяться для идентификации атомарных сред, которые управляют интересующими свойствами. Помеченные данные из симуляций затем могут быть предоставлены для обучения контролируемых алгоритмов машинного обучения, и могут быть разработаны прогнозные модели, которые значительно расширили бы наше понимание отношений атомарной структуры и свойств для ГБ.
Как показано выше, обычных методов идентификации кристаллической структуры недостаточно для этой задачи.Следовательно, несколько авторов разработали методы идентификации произвольных некристаллических атомных структур для таких приложений, как разработка межатомных потенциалов (Bartók et al., 2013), анализ коллоидной кристаллизации (Reinhart et al., 2017) и определение границ зерен (Banadaki и Patala, 2017; Rosenbrock et al., 2017; Priedeman et al., 2018). Краткое описание их работы приведено в разделе 2. Хотя эти методы эффективны, они также значительно сложнее, чем простые методы идентификации кристаллической структуры, которые широко используются.Главный вклад настоящей работы – восполнить этот пробел.
Используя простую версию анализа общих соседей (CNA) и информацию, которая уже доступна, но обычно отбрасывается, мы разрабатываем подход, который (i) может охарактеризовать произвольные атомные среды, а также (ii) прост для реализовать, и (iii) построенный на дескрипторе, который уже знаком сообществу атомистического моделирования. Мы демонстрируем, что, несмотря на его простоту, его можно использовать в целях прогнозирования как часть стратегии машинного обучения для разработки моделей структуры и свойств ГБ.Мы ожидаем, что простота и эффективность этого подхода будет способствовать развитию прогнозных моделей структурных свойств для ГЗ, а также других приложений, которые включают атомные структуры с более низкой симметрией, такие как те, что присутствуют в металлических стеклах.
2. Справочная информация
В последнее время и в последнее десятилетие наблюдается большой интерес к характеристике атомных структур, и в литературе имеется несколько обзоров (Stukowski, 2012; Priedeman, 2018), поэтому здесь дается только краткое описание.
2.1. Идентификация кристаллических атомных сред
Общие методы, используемые для идентификации кристаллических структур, включают параметр центросимметрии (Kelchner et al., 1998), анализ общих соседей (CNA) (Faken and Jónsson, 1994), сопоставление многогранных шаблонов (PTM) (Larsen et al., 2016), и методы анализа клеток Вороного (Bernal, 1959; Rahman, 1966; Bernal, Finney, 1967; Finney, 1970; Hsu, Rahman, 1979; Sheng et al., 2006; Lazar et al., 2015).
Параметр центросимметрии – это мера расстояния до n ближайших соседей атома, позволяющая определить, находится ли атом внутри объемного кристалла или является дефектом.Методы анализа CNA, PTM и Вороного классифицируют атомную структуру атома путем сравнения его локального окружения с библиотекой известных структур, обычно гранецентрированной кубической (FCC), гексагональной плотноупакованной (HCP), объемно-центрированной кубической. (BCC), икосаэдрический (ICO) и, для некоторых из этих методов, простой кубический (SC).
Эти методы предоставляют ценные инструменты для определения местоположения, а в некоторых случаях и типов дефектов, присутствующих в атомистической модели. Однако, как и все инструменты (включая те, которые мы представляем в этой статье), каждый метод имеет определенные недостатки и ограничения.Основные недостатки параметра центросимметрии заключаются в том, что количество соседей, n , является параметром, определяемым пользователем, а параметр центросимметрии не дает никакого представления о том, что такое локальная структура, если она является частью дефекта. Хотя некоторые ограничения CNA были уменьшены за счет введения адаптивного радиуса отсечки (Stukowski, 2012), этот метод обычно используется только для определения принадлежности атома к одному из небольшого набора предопределенных сред. PTM использует более надежный метод Вороного для идентификации соседей, но он также полагается на сравнение с небольшой библиотекой известных сред.Анализ Вороного обычно характеризует локальные среды по количеству граней с определенным числом ребер, но этот подход не позволяет различить некоторые общие среды (FCC и HCP) (Bernal, 1959; Rahman, 1966; Bernal and Finney, 1967; Finney, 1970; Сюй, Рахман, 1979; Шенг и др., 2006). Недавно разработанная методика топологии Вороного (VoroTop) (Lazar et al., 2015) использует представления плоских графов для решения этой проблемы, включая информацию о расположении граней, но требует большой базы данных почти вырожденных вариантов известных ячеек Вороного для сравните с, так как небольшие атомные смещения могут существенно повлиять на топологию ячейки Вороного.Как и в случае с другими методами идентификации кристаллической структуры, в методе VoroTop в основном используется небольшая библиотека известных структур. К этим библиотекам можно добавить дополнительные среды, но это нужно делать вручную.
2.2. Идентификация некристаллических атомных сред
Чтобы адекватно проанализировать локальную атомную структуру дефектов, таких как ГБ, необходим метод, который может классифицировать атомы без a priori знания имеющихся структур (т.е., не полагаясь на небольшой предварительно вычисленный список известных структур). В нескольких недавних публикациях представлены методы определения произвольной локальной среды (Bartók et al., 2013; Banadaki and Patala, 2017; Reinhart et al., 2017; Rosenbrock et al., 2017; Priedeman et al., 2018), а также краткое изложение описание каждого дано здесь.
Bartók et al. (2013) разработали дескриптор атомной структуры, основанный на суперпозиции гауссовых ядер с центрами в атомных позициях, называемый ядром / дескриптором SOAP.SOAP уникален тем, что представляет собой непрерывный дескриптор (что делает его устойчивым к небольшим изменениям атомных позиций) в отличие от большинства других дескрипторов, которые являются дискретными по своей природе. SOAP недавно был применен для характеристики ГБ Розенброком и др. (2017) и Priedeman et al. (2018).
Банадаки и Патала (2017) представили модель многогранных единиц, которая сравнивает окрестности вокруг пустот в атомных структурах (в которых центрируются вершины мозаики Вороного) с исчерпывающей библиотекой конфигураций плотноупакованных сфер до 12 сфер.Преимущество модели многогранных единиц состоит в том, что значение RMSD может быть рассчитано для количественной оценки того, насколько близки определенные структуры к их эталонным структурам, но результирующие многогранники центрируются в пустоте, а не на атоме, который является более распространенным представлением. атомной среды.
Reinhart et al. (2017) разработали алгоритм под названием Neighborhood Graph Analysis (NGA), который реализовал CNA с адаптивным радиусом отсечки для создания сигнатур CNA для произвольных сред, присутствующих в моделировании коллоидной кристаллизации.Однако адаптивное обрезание создает асимметричный граф соседства (т. Е. Атом B может быть соседом с атомом A, но это не означает, что атом A будет находиться в множестве окрестностей атома B), что может искусственно увеличить количество уникальных сред ( т.е. происходит чрезмерное разбиение конфигурационного пространства). Это компенсируется использованием алгоритма машинного обучения для определения взаимосвязей между дискретными сигнатурами и консолидации аналогичных сред, имеющих разные сигнатуры.Reinhart et. впоследствии он разработал модифицированную версию своего исходного алгоритма, который они назвали алгоритмом «быстрого NGA» (fNGA) (Reinhart and Panagiotopoulos, 2018), который определяет соседей с использованием триангуляции Делоне (аналогично PTM) и который использует графлеты для значительного снизить вычислительные затраты на этапе консолидации. Настоящую работу можно рассматривать как упрощенную версию оригинального подхода Рейнхарта.
Хотя все эти методы эффективны при классификации некристаллических атомных сред, они сложны и в некоторых случаях требуют больших вычислительных ресурсов.В этой статье мы представляем сравнительно простую альтернативу, основанную на CNA, для идентификации произвольных локальных сред без использования заранее определенной библиотеки структур. Благодаря своей простоте и тому факту, что для этого требуется лишь небольшая пост-обработка (код, приведенный в дополнительном материале) традиционных данных CNA, которые уже повсеместно доступны в существующих пакетах программного обеспечения, наш подход может быть легко принят. Хотя наш метод, как и другие, страдает чрезмерным разделением пространства уникальных атомных сред, мы показываем, что, тем не менее, возможно проникнуть в суть важных взаимосвязей структура-свойство.Мы демонстрируем полезность этого метода, охарактеризовав уникальные атомные среды (UAE), присутствующие в 388 ГБ набора данных Olmsted (Olmsted et al., 2009). Мы также проверяем недавнюю гипотезу (Banadaki and Patala, 2016) о том, что структуры Σ3 ГБ могут распадаться на грани ГБ, занимающие углы соответствующей фундаментальной зоны (ФЗ) плоскости ГБ. Наконец, мы даем краткий пример того, как ОАЭ, идентифицированные с помощью нашего подхода, могут служить исходными данными для стратегий машинного обучения для разработки моделей атомарной структуры и свойств для ГБ.
3. Методы
3.1. Традиционный анализ общего соседа
В традиционном методе CNA определяется набор из трех индексов ( j, k, l ), который описывает топологию графа, образованного ближайшими соседними атомами (см. Рисунок 1). Для каждого соседнего атома вычисляются три индекса, чтобы определить их отношение к центральному атому. Первый индекс j перечисляет количество общих ближайших соседей (например, на рисунке 1 четыре светло-фиолетовых атома являются ближайшими соседями как центрального атома, так и темно-фиолетового атома, поэтому для темно-фиолетового атома j = 4) .Индекс k перечисляет количество связей между общими ближайшими соседями (например, на рисунке 1 есть две пунктирные фиолетовые линии, обозначающие две различные связи между общими ближайшими соседями, поэтому для темно-фиолетового атома k = 2). Наконец, индекс l перечисляет количество связей в самой длинной цепочке связей, образованной общими соседями (например, на рисунке 1 пунктирные фиолетовые линии не имеют общего атома, поэтому самая длинная цепочка связей между общими ближайшими соседями равна 1 , что дает l = 1 для темно-пурпурного атома).Индексы CNA рассчитываются для каждой пары атомов. Локальное окружение (то есть «атомная структура») конкретного атома затем определяется набором индексов CNA всех его ближайших соседей. Как было сделано в предшествующей литературе (Stukowski, 2012; Reinhart et al., 2017), мы называем это сигнатурой CNA атома, чтобы отличить ее от индексов CNA атома. Например, сигнатура CNA атома, локальная структура которого соответствует решетке FCC, будет обозначена {12 × (4, 2, 1)}, что указывает на то, что у него есть 12 ближайших соседей, каждый с индексом CNA (4, 2, 1).Атом с менее симметричным локальным окружением, например принадлежащим ГБ, может иметь сигнатуру CNA {2 × (3, 1, 1), 3 × (4, 2, 1), 2 × (4, 2, 2), 2 × (4, 3, 3),} {1 × (4, 4, 4), 2 × (5, 4, 4)}, что указывает всего двенадцать ближайших соседей, но которые имеют разные индексы CNA. .
Рисунок 1 . Иллюстрация процесса определения индексов CNA и сигнатуры CNA, концепция, вдохновленная Reinhart et al. (2017). В (A) показан атом (центральный желтый атом, размер которого был уменьшен для визуальной ясности) вместе с его ближайшими соседями.Соответствующее графическое представление представлено в (B) . Светлые символы представляют ближайших соседей, общих с центральным атомом (четыре для фиолетового соседа и четыре для зеленого соседа). Сплошные линии представляют связи между соседями центрального атома, а пунктирные линии представляют связи между общими соседями (по два для пурпурных и зеленых соседей). Для фиолетового соседа общие связи (пунктирные линии) не соединены, поэтому k = 1, но для зеленого соседа общие связи соединены, так что k = 2.Из-за симметрии этого графа есть шесть соседей с такими же индексами (4, 2, 1), что и фиолетовый атом (представлен кружками), и шесть с такими же индексами (4, 2, 2), что и зеленый (представлен квадратами). Следовательно, сигнатура CNA для центрального атома равна {6 × (4, 2, 1), 6 × (4, 2, 2)}, что представляет атомное окружение HCP.
Отметим, что соседей можно идентифицировать с помощью различных методов, основными из которых являются фиксированный радиус обрезания или адаптивное обрезание (Stukowski, 2012; Reinhart et al., 2017). В этой работе мы решили использовать фиксированное значение отсечки 3,5 Å (которое находится между первым и вторым ближайшими соседями для решетки ГЦК, см. , рис. 3A, ). Фиксированное отсечение было выбрано как из-за его простоты, так и потому, что оно приводило к меньшему количеству уникальных сигнатур, чем адаптивные методы (2205 против 3716) для структур, которые мы анализировали.
После вычисления CNA-сигнатуры каждого атома атомные структуры идентифицируются путем сравнения с CNA-сигнатурами предопределенной библиотеки известных структур, обычно ограниченных FCC, HCP, BCC и ICO.При стандартном использовании любой атом, чья подпись CNA не соответствует сигнатуре одного из предопределенных структурных шаблонов, остается неклассифицированным и помечается как «другой». Этого достаточно для идентификации местоположения дефектов, потому что «другие» атомы обычно находятся в дефектах. Однако, как правило, этого недостаточно для устранения структуры и этих дефектов. Поскольку ГБ состоят в основном из «других» атомов, их внутренняя атомная структура обычно не может быть разрешена. Более того, если оба ГБ содержат все «другие» атомы, их трудно различить.
3.2. CNA
с полной долей заемных средствЧтобы решить эту проблему, отметим, что информация, необходимая для различения «других» атомов друг от друга, уже доступна и закодирована в их соответствующих сигнатурах CNA, просто обычно игнорируется в стандартной практике. Чтобы использовать эту информацию, нужно просто идентифицировать все уникальные подписи CNA; они определяют отдельные классы атомарной структуры; в некотором смысле этот список представляет собой библиотеку расширенной структуры. Затем атомы классифицируются с использованием этой расширенной библиотеки структур.Однако он конструируется во время анализа и совместим с произвольными атомными структурами (не нужно знать, какие структуры они ищут a priori ). Кроме того, категория «другие» полностью исключается, поскольку все атомы классифицируются и принадлежат к одному из идентифицированных UAE.
Для извлечения полных сигнатур CNA для каждого атома в структурах, которые мы проанализировали, есть встроенные функции, которые можно запускать как часть конвейера в Open Visualization Tool (OVITO) (Stukowski, 2010), и пример Python Скрипт доступен в онлайн-документации OVITO.Мы изменили этот сценарий для нашего конкретного приложения, и мы предоставляем нашу измененную версию в сопроводительных дополнительных материалах. После извлечения уникальные подписи CNA были затем идентифицированы в MATLAB, и каждой был назначен уникальный числовой идентификатор класса (мы также предоставляем этот код в дополнительном материале), который впоследствии был импортирован в OVITO как настраиваемое свойство частицы, позволяющее использовать цветовое кодирование. и визуализация.
4. Результаты и обсуждение
4.1. Классификация «других» атомов в ГБ
Мы применили полностью расширенный подход CNA для характеристики всех атомов в 388 ГБ из набора данных Олмстеда (Olmsted et al., 2009), который содержит атомные структуры в общей сложности 388 ГБ в Al с вариациями по всем пяти кристаллографическим степеням свободы, включая 41 Σ3 ГБ. Здесь мы представляем результаты этого анализа. Подавляющее большинство атомов принадлежат внутренним слоям зерна и являются ГЦК, и их можно легко охарактеризовать существующими методами. Поэтому мы сосредотачиваемся на атомах GB, которые обычно классифицируются как «другие» / неидентифицированные структуры с помощью методов, основанных на эталонных структурах. Мы определяем атом как принадлежащий GB, если хотя бы один из ближайших соседей не является FCC.Это приводит к тому, что все не-ГЦК-атомы, а также многие ГЦК-атомы внутри или рядом с ГЗ отождествляются с ней (для некоторых наклонных ГЗ, если расстояние между дислокациями достаточно велико, в плоскости ГЦК будут атомы ГЦК, которые полностью окружены другими атомами FCC, которые не будут считаться атомами GB согласно этому определению.). Используя это определение, имеется в общей сложности 462 955 атомов ГБ из общего количества 11 922 451 атома, содержащихся в наборе данных Олмстеда (атомы, не являющиеся ГБ, принадлежат объемному кристаллу и все являются ГЦК).Хотя некоторые ГБ должным образом содержат атомы ГЦК внутри себя (например, малоугловые ГБ имеют атомы ГЦК между дислокациями), основное внимание в этой работе уделяется характеристике атомов, не являющихся ГЦК. Следовательно, мы представим наши результаты двумя способами: (i) относительно всех 462 955 GB атомов (FCC и не-FCC), и (ii) относительно только не-FCC GB атомов (из которых 227 401).
На рис. 2A показано распределение атомарных сред ГБ по всем 388 ГБ для полностью задействованного подхода CNA. Это показывает, что из почти 500 000 атомов ГБ (на всех 388 ГБ) имеется 2205 уникальных сигнатур CNA.Однако, учитывая логарифмический масштаб по оси ординат, необходимо только 448 сигнатур, чтобы составить примерно 90% не-ГЦК-атомов ГЗ (см. Рис. 2В), и только 167 необходимо, если бы ГЦК-атомы со структурой ГЦК были включены. Хотя это все еще представляет собой немалое количество уникальных сред, это значительное уменьшение размерности для общего набора границ зерен, что в противном случае потребовало бы в общей сложности не менее 682, 203 параметров для описания атомных конфигураций (3 параметра для каждый атом Rosenbrock et al., 2017).
Рисунок 2. (A) Гистограмма ОАЭ, обнаруженных в 388 ГБ Омстеда. Обратите внимание, что это в логарифмическом масштабе, и имеется приблизительно 5 × 10 5 ГБ атомов. (B) Кумулятивная сумма доли атомов, которую можно описать с помощью заданного числа UAE. Приблизительно 90% атомов ГБ, не являющихся ГЦК, могут быть описаны одним из 448 наиболее распространенных UAE (требуется только 167 UAE, если включены атомы ГБ со структурой FCC).
Отметим, что при использовании альтернативного пространственно непрерывного дескриптора плавное перекрытие атомных позиций (SOAP) (Bartók et al., 2013), Rosenbrock et al. первоначально было найдено 800000 UAE для тех же 388 ГБ в Ni, используя расстояние отсечения соседства 5Å (Rosenbrock et al., 2017). В методе SOAP, а также в других методах, таких как PTM, используется мера сходства, позволяющая классифицировать две структуры, которые отличаются лишь небольшим возмущением, как одну и ту же среду, что является одним из способов исправить явление чрезмерного разделения. После использования метрики сходства в рамках машинного обучения исходные 800000 ОАЭ были объединены только в 145 различных ОАЭ.Отметим, что, как и при любом подходе к консолидации на основе подобия, результирующее количество уникальных сред зависит от заданного пользователем порога подобия.
Простой подход к идентификации ОАЭ, воплощенный в CNA с полным использованием заемных средств, не использует порог подобия, поэтому ожидается, что пространство ОАЭ будет чрезмерно разделено. Это проявляется в относительно длиннохвостом распределении UAE на Рисунке 2, которое вызывается небольшими отклонениями в атомном положении, которые заставляют одну среду производить несколько сигнатур CNA (т.е., ОАЭ, которые не часто наблюдаются, скорее всего, являются слегка искаженными версиями других ОАЭ). Основная причина этого явления – сложность однозначного определения соседей атомов в некристаллических областях. Чтобы проиллюстрировать это, сравните функцию радиального распределения (RDF) для объемной ГЦК с функцией границы зерен, как показано на рисунке 3. Четкое разделение первого и второго пиков – соответствующих первому и второму ближайшим соседям соответственно – в RDF решетки FCC (рис. 3A) облегчает выбор подходящего радиуса отсечки соседей.Однако, как и ожидалось, RDF для граничных атомов (рис. 3B) не показывает четкого разделения между первым и вторым соседями, что делает CNA чувствительным к небольшим возмущениям положения атомов и изменениям радиуса отсечки. Это также означает, что количество UAE, идентифицированных с помощью полностью задействованного подхода CNA в настоящей работе, зависит от выбранного пользователем радиуса отсечки. Эта проблема существует для любого метода, который пытается охарактеризовать атомы ГБ, потому что нет четкого выбора относительно того, какие атомы должны быть включены в соседство, и полученные структуры, вероятно, чрезмерно разделят пространство UAE.
Рис. 3. (A) Функция радиального распределения (RDF) для ГЦК-решетки, рассчитанная в OVITO, и (B) RDF для межзеренных атомов (Σ63 [51¯3¯] GB использовалась в качестве Отчетливые пики в массивной FCC позволяют легко выбрать подходящее расстояние отсечки для идентификации соседей, однако более непрерывный характер GB RDF заставляет CNA быть более чувствительным к небольшим возмущениям в положении атомов и изменениям отсечки. .
Как упоминалось ранее, работа была проделана Reinhart et al. (2017), чтобы установить подход машинного обучения для выявления сред, которые имеют схожую структуру, но разные сигнатуры CNA, и объединить их в единую среду (то есть кластеризацию в пространстве ОАЭ). Это эффективно реализует метрику подобия для CNA и было успешно применено к поверхности коллоидных кристаллов. Однако этот процесс требует больших вычислительных ресурсов и не приводит к единому универсальному разделению пространства ОАЭ, поэтому повторное разделение необходимо пересчитывать (или, по крайней мере, обновлять) для каждого нового набора данных, который необходимо охарактеризовать.Несмотря на чрезмерное разделение, которое является результатом простого подхода CNA с полным использованием заемных средств, и в отсутствие консолидации среды, мы обнаруживаем, что полезный анализ все еще может быть выполнен для оценки моделей структуры-свойств GB, как будет описано в разделе 4.3.
Для подмножества Σ3 ГБ количество ОАЭ значительно сокращается. На рисунке 4 показано распределение атомных окружений, обнаруженных в подмножестве 41 Σ3 ГБ, для которых было всего 117 уникальных сигнатур CNA. Более того, подавляющее большинство атомов ГБ (примерно 90%) соответствует одному из всего 44 UAE (или только 29 UAE, если включены атомы GB со структурой FCC).Такой вид уменьшения размерности для описания атомной структуры ГБ может сделать вывод моделей атомной структуры-свойств ГБ значительно более гибким. Кроме того, эту информацию можно использовать для сравнения структурного сходства различных ГБ, как будет обсуждаться в разделе 4.3.
Рисунок 4. (A) Гистограмма UAE, обнаруженных в Σ3 ГБ. Большой всплеск в окружении 1 соответствует структурному типу ГЦК и обусловлен включением первого слоя атомов ГЦК в состав ГЗ. (B) Кумулятивная сумма доли атомов Σ3 GB, которые могут быть описаны с использованием заданного числа UAE. Примерно 90% атомов Σ3 соответствуют одному из 44 наиболее распространенных UAE.
4.2. Визуализация
Не прибегая к более продвинутому механизму SOAP или подходу Рейнхарта к машинному обучению, большая часть анализа атомных структур опирается на более простые методы идентификации кристаллических структур на основе эталонных структур. Поскольку они были разработаны для идентификации кристаллических областей, а не ГБ, 50% -98% атомов ГБ в наборе данных Олмстеда, что неудивительно, классифицируются как «другие» методами, основанными на эталонной структуре, что делает атомную структуру этих ГБ в значительной степени непрозрачно для классического анализа.Как показал наш полностью задействованный метод CNA, тот факт, что только 44 UAE доминируют над изученными здесь Σ3 GB, предполагает возможность обнаружения новой структурной информации GB с очень небольшими вычислительными усилиями и в рамках знакомой структуры CNA. Мы проиллюстрируем это с помощью визуализации, раскрасив атомы GB в соответствии с их идентификатором UAE. В качестве примера на рисунках 5A, B представлен рендеринг Σ3 [5-12̄] ГБ с атомами, окрашенными в соответствии со стандартной практикой (с использованием традиционного подхода CNA).Атомы FCC (отмечены зеленым) идентифицированы, но все атомы в GB классифицируются как «другие» / неидентифицированные среды. Напротив, на рис. 5C показаны те же самые атомы GB, окрашенные с использованием классов атомного окружения, определенных с помощью нашей полностью задействованной техники CNA. Очевидно, что эта ГБ содержит структурированное расположение атомных окружений и является квазидвумерным. Этот новый подход выявляет структуру, которая ранее была неразрешима с использованием обычных методов идентификации кристаллической структуры, и требует гораздо меньших вычислительных затрат, чем более продвинутые методы.
Рис. 5. (A) Визуализация OVITO Σ3 [521̄] ГБ с атомами, окрашенными традиционным CNA. Зеленые атомы – это ГЦК, белые – «прочие». Обратите внимание, что все атомы GB остаются неидентифицированными. (B) Все атомы ГЦК удалены. (C) Атомы, окрашенные идентификаторами ОАЭ, полученными в результате нашей процедуры CNA с полным использованием заемных средств.
Помимо возможности легко получить важную структурную информацию для одного ГБ, окраска каждого атома в соответствии с его локальным окружением облегчает идентификацию структурного сходства между различными ГБ.В случае Σ3 ГБ была выдвинута гипотеза, что ГБ могут образовывать грани, структура которых соответствует структуре ГБ, которые занимают углы соответствующей фундаментальной зоны (FZ) граничной плоскости (Banadaki and Patala, 2016). Однако проверка этой гипотезы потребовала бы сравнения атомных структур различных ГБ, что было бы затруднительно с использованием дескрипторов на основе эталонных структур, которые оставляют почти все эти атомы неклассифицированными. Например, в верхнем ряду Рисунка 6 показаны три разных Σ3 GB, которые находятся рядом друг с другом в FZ.Хотя террасообразные особенности очевидны, неясно, представляют ли они грани одной и той же структуры. Используя полностью задействованную процедуру CNA, нижний ряд рисунка 6 дает понять, что каждый из этих GB действительно содержит очень похожие среды, что дает некоторые свидетельства в поддержку гипотезы фасетирования. Более полный анализ фасетирования в Σ3 ГБ, реализованный с помощью полностью задействованной техники CNA, представлен в разделе 4.3.
Рисунок 6 . Визуализация трех Σ3 GB (граничная плоскость указана в скобках), (вверху) с атомами, окрашенными с использованием традиционного CNA, доступного в OVITO, и (ниже), окрашенных UAE, обнаруженными во время процедуры CNA с полным использованием рычагов.
Визуализация границы зерен таким образом также позволяет выявить дефекты более высокого порядка или дефекты внутри других дефектов (обратите внимание на темно-пурпурную среду, которая украшает выступы на Рисунке 6).
4.3. Приложение
Здесь мы применяем полностью задействованную технику CNA для исследования взаимосвязи между атомной структурой и свойствами GB. Как упоминалось ранее, недавно Банадаки и Патала (2016) выдвинули гипотезу, что Σ3 ГБ могут состоять из фасетов, структура которых соответствует структуре 3 ГБ, которые определяют углы плоскости FZ Σ3 GB.Основываясь на этой гипотезе, Банадаки и Патала разработали модель структурных свойств для прогнозирования энергии ГБ произвольного Σ3 ГБ как средневзвешенного значения энергий ГБ углов FZ. Эта модель показала хорошее согласие с энергиями ГЗ, рассчитанными методом МД для многих случаев. Однако структуры GB никогда не анализировались, чтобы проверить, действительно ли произошло предполагаемое структурное фасетирование. Представленный здесь подход CNA с полной отдачей дает возможность проверить эту гипотезу.
Общее количество UAE, обнаруженных в каждом из GB, которые определяют углы плоскости FZ Σ3 GB, представлено в таблице 2.Примечательно, что UAE, появляющиеся в каждом из угловых GB, образуют непересекающиеся множества. Это означает, что они в некотором смысле являются ортогональными структурами, которые на первый взгляд могут показаться поддерживающими возможность фасетирования. Однако общее количество сред (117), обнаруженных во всех 41 Σ3 ГБ, больше, чем общее количество сред, обнаруженных в углах FZ (12), и, как показано на рисунке 7, эти дополнительные среды не сконцентрированы в выступы между гранями, но составляют значительную часть неугловых ГБ.
Таблица 2 . Сводка ОАЭ, обнаруженных в фундаментальной зоне Σ3.
Рисунок 7 . Рендеринг 41 Σ3 ГБ из набора данных Олмстеда с атомами, окрашенными в соответствии с их идентификаторами ОАЭ. Положение в FZ является относительным и приблизительным (точное размещение может привести к наложению некоторых изображений). Цвета были выбраны вручную для наиболее часто встречающихся ОАЭ, чтобы максимизировать визуальные различия между атомами с разными идентификаторами ОАЭ, которые находятся рядом друг с другом; однако некоторые реже наблюдаемые ОАЭ имеют один и тот же цвет.
Несколько ключевых наблюдений можно сделать из рисунка 7. Во-первых, на самом деле есть некоторые области FZ, где GB сделаны из граней угловых GB. В частности, ГЗ вблизи когерентного двойника [111] (θ = ϕ = 0) демонстрируют очевидные грани, структура которых аналогична структуре когерентного двойника. Кроме того, ГБ вдоль правой границы ЗФ (θ = 90 °) демонстрируют некоторые признаки фасетирования (такое поведение вблизи угла [21̄1̄] также было отмечено Banadaki and Patala, 2017), хотя для многих из этих ГБ структура эти грани не соответствуют ни одному из углов FZ.Что касается остальной части ФЗ, то нет явных свидетельств огранки ГБ Олмстед Аль. Однако важно отметить, что способность ГБ к фасетированию в атомистической модели может зависеть от размера ячейки моделирования, которая использовалась для ее построения (см. Race et al., 2014; Humberson and Holm, 2017, для обсуждения влияния размера ячейки моделирования), так что возможно, что если бы ячейки моделирования были большего размера, фасетирование можно было бы наблюдать в более общем плане. Более того, было показано, что для одной и той же ГБ может быть много метастабильных атомных структур (Han et al., 2017), некоторые из которых имеют почти вырожденную энергию. Таким образом, также возможно, что существуют различные изоэнергетические конфигурации, или что атомные структуры в этом наборе данных могут не быть конфигурациями с самой низкой энергией, которые в противном случае могли бы демонстрировать предполагаемую структуру огранки. Действительно, Банадаки и Патала обнаружили атомные структуры для ГБ Σ3 со значительно более низкими энергиями во многих случаях (Banadaki and Patala, 2016), которые, возможно, демонстрируют огранку в более общем плане, и это может быть одним из объяснений лучшего соответствия энергии модели граней. предсказания к их данным, чем к данным Олмстеда (см. рис. 9 ).Независимо от того, являются ли атомные структуры в наборе данных Олмстеда структурами основного состояния или (по крайней мере, в некоторых случаях) метастабильными структурами, полностью задействованный подход CNA может применяться для характеристики присутствующей атомной структуры, что бы это ни случилось с быть. Более того, если бы были доступны структуры основного состояния, наш полностью задействованный подход CNA мог бы легко выявить более общие аспекты, если бы они возникли в этих структурах.
Хотя структурная огранка в атомных структурах Олмстеда обычно не наблюдается, в пределах ФЗ наблюдаются относительно плавные тенденции в составе UAE.На рис. 8 показана доля атомов в каждом ГБ, атомное окружение которых совпадает с окружением каждого из углов FZ. Для всех трех углов наблюдаются плавные тренды в составе атомной среды вдоль θ = 90 ° от [21̄1̄] до [101̄] (для угла [21̄1̄] он плавный, но не монотонный, см. Рисунок 8B). Плавные тренды также наблюдаются вдоль ϕ = 0 от [111] до [21̄1̄] и вблизи когерентного двойника. Кроме того, по мере того, как кристаллографическое расстояние до одного из угловых ГБ увеличивается, доля атомных окружений, принадлежащих этому углу, уменьшается.Это говорит о том, что в отсутствие фасетирования (которое представляет собой своего рода поведение структурной сегрегации) может иметь место своего рода поведение перемешивания атомных сред из каждого из углов FZ для этих структур GB.
Рис. 8. (A – C) Доля атомов GB, локальное окружение которых принадлежит набору UAE, присутствующих в каждом из соответствующих углов фундаментальной зоны, и (D) фракция сред, не присутствующих ни в одном из Углы ФЗ.
Поскольку мы не наблюдаем структурную фасетку в целом, неудивительно, что модель фасетирования плохо предсказывает энергии набора данных Олмстеда.Однако для некоторых областей ФЗ также имеются отклонения между предсказаниями модели фасетирования и расчетными энергиями ГЗ для атомных структур с более низкими энергиями, полученными Банадаки и Патала. Примечательно, что там, где эти отклонения действительно случаются, они почти всегда являются заниженными. Наши наблюдения здесь могут частично объяснить такое поведение. Модель фасетирования предсказывает энергию ГЗ как средневзвешенное значение энергий ГЗ в углах ЗФ, игнорируя энергетический вклад линейных дефектов, которые, вероятно, будут существовать на стыке отдельных фасеток, и поэтому заниженные прогнозы согласуются с этим упущением.Эти линейные дефекты, вероятно, состоят из атомных окружений, которые отсутствуют в углах FZ, и которые могут иметь более высокие энергии когезии. Фактически, мы обнаруживаем, что неугловые атомные среды имеют среднюю энергию когезии, которая на 3,5 × 10 −21 Дж (0,022 эВ) выше, чем в среднем для атомных сред, принадлежащих углам FZ. Это может показаться небольшой разницей, но поскольку многие ГБ содержат большую часть неугловой среды (в среднем 49% атомов ГБ), совокупный эффект может быть значительным.Примерная оценка является иллюстративной: если 50% атомов ГБ (например, 500 из 1000) являются неугловыми средами и обладают средней энергией когезии неугловых сред (−5,30 × 10 −19 Дж или −3,31 эВ) тогда с площадью GB 1800 Å 2 (среднее поперечное сечение для ячейки моделирования Олмстеда) неугловые среды будут вносить примерно 0,097 Дж / м 2 в энергию GB, которая аналогична величине занижение прогнозов, показанное на Рисунке 9.
Рисунок 9 .Сравнение рассчитанных энергий ГЗ для ГЗ, лежащих по краям фундаментальной зоны Σ3, с предсказаниями модели фасетирования Банадаки и Паталы (Banadaki and Patala, 2016). Включены два набора данных рассчитанных энергий ГЗ: (белые квадраты) данные Olmsted et al. (2009) и (полупрозрачные закрашенные кружки) из Банадаки и Патала (2016). Также включены прогнозы модели ОАЭ (закрашенные квадраты) для сравнения с симуляциями Олмстеда (светлые квадраты).
4.4. Простая модель
для ОАЭ.Это говорит о том, что модель, основанная на атомных средах, может обеспечить улучшенные прогнозы энергии GB. Отметим, что важная работа в этой области уже проделана Rosenbrock et. al в рамках SOAP (Rosenbrock et al., 2017). Строгое развитие такой модели выходит за рамки настоящей работы, основной целью которой было представить простой метод описания атомной структуры (полностью задействованный подход CNA), который позволяет охарактеризовать атомную структуру ГБ, которая была неразрешима с использованием кристаллической структуры. идентификационные подходы.Тем не менее, мы приводим простой и краткий пример того, как полученные ОАЭ могут быть включены в машинное обучение или другие подходы к разработке моделей.
Мы рассматриваем долю каждого UAE как предсказывающую (независимую) переменную, а энергию GB как переменную отклика (зависимую). Это подразумевает 2205-мерное пространство (соответствует 2205 UAE, наблюдаемым во всех 388 ГБ). Мы используем PCA для преобразования и выбора признаков и обнаруживаем, что только 84 основных компонента (линейные комбинации исходных переменных) необходимы для объяснения 95% дисперсии данных.Таким образом, мы снизили размерность задачи с 2205 до 84 измерений. Используя эти 84 преобразованных переменных, мы применяем 5-кратную перекрестную проверку для обучения простой модели линейной регрессии. Сравнение полученной модели с рассчитанными энергиями ГБ для всех 388 ГБ представлено на рисунке 10, где выделено подмножество Σ3 ГБ. Сравнение прогнозов модели с моделированиями Олмстеда для подмножества Σ3 ГБ в зависимости от ориентации граничной плоскости также представлено на рисунке 9 (сравните заполненные иоткрытые квадраты). Полученные в результате прогнозы модели хорошо согласуются с расчетными значениями, и модель предсказывает правильную энергию ГБ с ошибкой менее 10% для 89,69% из 388 ГБ (и 92,68% для Σ3 ГБ). В частности, отметим улучшенные прогнозы модели UAE по дуге θ = 90 ° FZ от [21̄1̄] до [101̄] (зеленые закрашенные квадраты хорошо согласуются с зелеными пустыми квадратами на правой панели рисунка 9). ) по сравнению с моделью огранки (сплошная зеленая линия).
Рисунок 10 .Сравнение прогнозов модели, обученной с использованием фракций UAE в качестве переменных, с истинными рассчитанными энергиями GB из набора данных Olmsted (Olmsted et al., 2009).
5. Заключение
В этой работе мы представили метод характеризации атомной структуры (полностью задействованный подход CNA), который (i) может характеризовать произвольное атомное окружение, а также (ii) прост в реализации и (iii) построен на дескрипторе. это уже знакомо сообществу атомистического моделирования.Это позволяет охарактеризовать атомную структуру ГБ, которая ранее была неразрешима с использованием методов идентификации кристаллической структуры, и для меньших вычислительных затрат, чем более продвинутые методы. Мы показываем, что можно описать атомную структуру ГБ с точки зрения доли уникальных атомных сред (UAE), возникающих в результате использования нашего метода.
Мы обнаружили, что относительно небольшое количество UAE объясняет большую часть атомов GB, что указывает на возможность значительного уменьшения размерности описания атомной структуры GB.В частности, мы обнаружили, что для описания 90% не-FCC-атомов GB, присутствующих в 388 GB набора данных Olmsted, требуется только 448 UAE (сигнатуры CNA), а для подмножества 41 Σ3 GB необходимо только 44 UAE. . Это уменьшение размерности предполагает, что эти UAE могут действовать как дескрипторы атомарной структуры, которые могут быть включены в подходы машинного обучения для разработки улучшенных моделей структурных свойств GB.
Мы продемонстрировали, как визуализация ОАЭ выявляет важную структурную информацию ГБ.В качестве примера мы исследовали возможное описание ГБ Σ3 как составных из граней ГБ, занимающих углы соответствующей фундаментальной зоны (ФЗ) граничной плоскости. Мы обнаружили, что для набора данных Олмстеда такое фасетирование действительно происходит в определенных регионах ФЗ, но не в целом. Вместо этого наблюдалось очевидное смешение атомных сред из ГБ, определяющих углы FZ, вместе с появлением многочисленных сред, отсутствующих в углах FZ. Эти наблюдения согласуются с хорошим согласием модели огранки с рассчитанными энергиями ГЗ для некоторых областей ФЗ, а также наблюдаемым заниженным прогнозом в других областях.
Наконец, мы представили краткий пример, чтобы проиллюстрировать, как фракции ОАЭ могут использоваться в качестве дескрипторов атомной структуры ГБ, которые могут служить входными данными для подходов к машинному обучению для разработки моделей атомной структуры-свойств ГБ.
Доступность данных
Наборы данных для этого исследования не будут опубликованы, поскольку некоторые данные были использованы с разрешения. Все остальные данные доступны по запросу соответствующему автору.
Авторские взносы
OJ разработал проект и обучил окончательную модель.BS и DD разработали все коды анализа и выполнили расчеты и анализ. Все авторы внесли свой вклад в подготовку рукописи.
Финансирование
Эта работа была поддержана кафедрой машиностроения Университета Бригама Янга.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарны доктору Эрику Р. Гомеру и доктору Сриканту Патале за плодотворные обсуждения, а также доктору Дэвиду Олмстеду за разрешение использовать структуры Al GB.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmats.2019.00120/full#supplementary-material
Сноски
Список литературы
Экленд, Г. Дж., И Джонс, А.П. (2006). Применение мер локальной кристаллической структуры в эксперименте и моделировании. Phys. Ред. B 73: 054104. DOI: 10.1103 / PhysRevB.73.054104
CrossRef Полный текст | Google Scholar
Эшби, М. Ф., Спапен, Ф., и Уильямс, С. (1978). Структура границ зерен описывается как упаковка многогранников. Акта Металл. 26, 1647–1663. DOI: 10.1016 / 0001-6160 (78)-5
CrossRef Полный текст | Google Scholar
Банадаки, А.Д., и Патала, С. (2016). Простая модель огранки для межфазной энергии и энергии скола границ зерен Σ3 в полном пространстве ориентации граничной плоскости. Comput. Матер. Sci. 112, 147–160. DOI: 10.1016 / j.commatsci.2015.09.062
CrossRef Полный текст | Google Scholar
Банадаки А. Д. и Патала С. (2017). Трехмерная модель полиэдрического элемента для зернограничной структуры в ГЦК-металлах. npj Comput. Матер. 3:13. DOI: 10.1038 / s41524-017-0016-0
CrossRef Полный текст | Google Scholar
Барток, А.П., Кондор, Р., Чаньи, Г. (2013). О представлении химических сред. Phys. Ред. B Конденс. Matter Mater. Phys. 87, 1–16. DOI: 10.1103 / PhysRevB.87.184115
CrossRef Полный текст | Google Scholar
Бехтл, С., Кумар, М., Сомердей, Б., Лони, М., и Ричи, Р. (2009). Инженерия границ зерен заметно снижает предрасположенность металлических материалов к межкристаллитному водородному охрупчиванию. Acta Mater. 57, 4148–4157. DOI: 10.1016 / J.ACTAMAT.2009.05.012
CrossRef Полный текст | Google Scholar
Бернал, Дж. Д., и Финни, Дж. Л. (1967). Модель случайных плотноупакованных твердых сфер. II. геометрия случайной упаковки твердых сфер. Обсудить. Faraday Soc. 43, 62–69. DOI: 10.1039 / DF9674300062
CrossRef Полный текст | Google Scholar
Факен Д. и Йонссон Х. (1994). Систематический анализ локальной атомной структуры в сочетании с трехмерной компьютерной графикой. Comput. Матер. Sci. 2, 279–286.DOI: 10.1016 / 0927-0256 (94)-0
CrossRef Полный текст | Google Scholar
Финни, Дж. Л. (1970). Случайные упаковки и структура простых жидкостей. I. Геометрия случайной плотной упаковки. Proc. R. Soc. Лондон. Сер. Математика. Phys. Sci. 319, 479–493. DOI: 10.1098 / RSPA.1970.0189
CrossRef Полный текст | Google Scholar
Герцман В. и Тангри К. (1997). Моделирование распространения межкристаллитных повреждений. Acta Mater. 45, 4107–4116.DOI: 10.1016 / S1359-6454 (97) 00083-9
CrossRef Полный текст | Google Scholar
Хан, Дж., Витек, В., и Сроловиц, Д. Дж. (2017). Модель зернограничных структурных единиц redux. Acta Mater. 133, 186–199. DOI: 10.1016 / J.ACTAMAT.2017.05.002
CrossRef Полный текст | Google Scholar
Hsu, C. S., and Rahman, A. (1979). Потенциалы взаимодействия и их влияние на зарождение кристаллов и симметрию. J. Chem. Phys. 71, 4974–4986. DOI: 10.1063 / 1.438311
CrossRef Полный текст | Google Scholar
Хамберсон, Дж., И Холм, Э. А. (2017). Антитепловая подвижность на границе зерен Σ3 [111] 60 {11 8 5} в никеле: механизм и вычислительные соображения. Scripta Mater. 130, 1–6. DOI: 10.1016 / J.SCRIPTAMAT.2016.10.032
CrossRef Полный текст | Google Scholar
Катрицки А. Р. и Фара Д. К. (2005). Как химическая структура определяет физические, химические и технологические свойства: обзор, иллюстрирующий потенциал количественных соотношений структурных свойств для науки о топливе. Energy Fuels 19, 922–935. DOI: 10.1021 / ef040033q
CrossRef Полный текст | Google Scholar
Кельхнер, К. Л., Плимптон, С. Дж., И Гамильтон, Дж. К. (1998). Зарождение дислокаций и дефектная структура при вдавливании поверхности. Phys. Ред. B 58, 11085–11088. DOI: 10.1103 / PhysRevB.58.11085
CrossRef Полный текст | Google Scholar
Ларсен П. М., Шмидт С. и Шиётц Дж. (2016). Надежная структурная идентификация посредством сопоставления многогранного шаблона. Модель. Simul. Матер. Sci. Англ. 24: 055007. DOI: 10.1088 / 0965-0393 / 24/5/055007
CrossRef Полный текст | Google Scholar
Лазар, Э.А., Хан, Дж., И Сроловиц, Д. Дж. (2015). Топологическая основа для анализа локальной структуры в конденсированных средах. Proc. Natl. Акад. Sci. США 112, E5769 – E5776. DOI: 10.1073 / pnas.1505788112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю X., Эрколесси Ф. и Адамс Дж. (2004).Межатомный потенциал алюминия из расчетов теории функционала плотности с улучшенной энергией дефекта упаковки. Модель. Simul. Матер. Sci. Англ. 12, 665–670. DOI: 10.1088 / 0965-0393 / 12/4/007
CrossRef Полный текст | Google Scholar
Олмстед Д. Л., Фойлз С. М. и Холм Э. А. (2009). Обзор расчетных свойств границ зерен в гранецентрированных кубических металлах: I. Энергия границ зерен. Acta Mater. 57, 3694–3703. DOI: 10.1016 / j.actamat.2009.04.007
CrossRef Полный текст | Google Scholar
Плимптон, С.(1995). Быстрые параллельные алгоритмы для ближней молекулярной динамики. J. Comput. Phys. 117, 1–19. DOI: 10.1006 / jcph.1995.1039
CrossRef Полный текст | Google Scholar
Приедеман, Дж. Л. (2018). Количественная оценка граничных атомных структур зерен с использованием плавного перекрытия атомных позиций (магистерская диссертация). Университет Бригама Янга, США.
Google Scholar
Приедеман, Дж. Л., Розенброк, К. У., Джонсон, О. К., и Гомер, Э. Р.(2018). Количественная оценка и соединение атомной и кристаллографической структуры границ зерен с использованием методов представления локальной среды и уменьшения размерности. Acta Mater. 161, 431–443. DOI: 10.1016 / j.actamat.2018.09.011
CrossRef Полный текст | Google Scholar
Рэйс, К. П., Фон Пезольд, Дж., И Нойгебауэр, Дж. (2014). Роль мезоуровня в кинетике миграции плоских границ зерен. Phys. Ред. B 89: 214110. DOI: 10.1103 / PhysRevB.89.214110
CrossRef Полный текст | Google Scholar
Рейнхарт, W.Ф., Лонг, А. В., Ховард, М. П., Фергюсон, А. Л., и Панагиотопулос, А. З. (2017). Машинное обучение для идентификации автономных кристаллических структур. Soft Matter 13, 4733–4745. DOI: 10.1039 / C7SM00957G
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рейнхарт, В. Ф., и Панагиотопулос, А. З. (2018). Автоматическое определение характеристик кристаллов с помощью метода анализа графов быстрой окрестности. Мягкое вещество 14, 6083–6089. DOI: 10.1039 / C8SM00960K
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Розенброк, К.У., Гомер, Э. Р., Чаньи, Г., и Харт, Г. Л. У. (2017). Обнаружение строительных блоков атомарных систем с помощью машинного обучения: применение к границам зерен. npj Comput. Матер. 3:29. DOI: 10.1038 / s41524-017-0027-x
CrossRef Полный текст | Google Scholar
Шенг, Х., Луо, В., Аламгир, Ф. М., Бай, Дж. М., и Ма, Э. П. (2006). Атомная упаковка и ближний и средний порядок в металлических стеклах. Природа 439, 419–425. DOI: 10.1038 / nature04421
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шимада, М., Кокава, Х., Ван, З., Сато, Ю., и Карибе, И. (2002). Оптимизация распределения характеристик границ зерен для нержавеющей стали 304, стойкой к межкристаллитной коррозии, с помощью проектирования границ зерен с двойным индуцированием. Acta Mater. 50, 2331–2341. DOI: 10.1016 / S1359-6454 (02) 00064-2
CrossRef Полный текст | Google Scholar
Стуковски, А. (2010). Визуализация и анализ данных атомистического моделирования с помощью OVITO – Open Visualization Tool. Модель. Simul. Матер.Sci. Англ. 18: 015012. DOI: 10.1088 / 0965-0393 / 18/1/015012
CrossRef Полный текст | Google Scholar
Стуковский А. (2012). Методы идентификации структуры для атомистического моделирования кристаллических материалов. Модель. Simul. Матер. Sci. Англ. 20: 045021. DOI: 10.1088 / 0965-0393 / 20/4/045021
CrossRef Полный текст | Google Scholar
Тан, Л., Шридхаран, К., Аллен, Т., Нанстад, Р., и Макклинток, Д. (2008). Адаптация микроструктуры для улучшения свойств с помощью зернограничной инженерии. J. Nucl. Матер. 374, 270–280. DOI: 10.1016 / J.JNUCMAT.2007.08.015
CrossRef Полный текст | Google Scholar
Ватанабэ, Т., Цурекава, С., Чжао, X., и Цзуо, Л. (2009). «Приход зернограничной инженерии в 21 веке», в Microstructure and Texture in Steels (Лондон: Springer), 43–82.
Google Scholar
Чжан Х., Сроловиц Д. Дж., Дуглас Дж. Ф. и Уоррен Дж. А. (2009). Границы зерен демонстрируют динамику стеклообразующих жидкостей. Proc. Natl. Акад. Sci. США 106, 7735–7740. DOI: 10.1073 / pnas.0
7106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, К.
