Два новых химических элемента получили «российские» имена – Hi-Tech – Коммерсантъ
Международный союз теоретической и прикладной химии (IUPAC) официально одобрил названия четырех новых элементов таблицы Менделеева — 113-го, 115-го, 117-го и 118-го: нихоний (Nh), московий (Mc), теннессин (Tn), оганессон (Og) соответственно. Первый элемент синтезировали японские ученые, остальные открыты группой российских и американских ученых.
«Следуя традиции, новые элементы названы по географическим названиям или именам ученых (также элементы могут быть названы в честь небесных тел.— “Ъ”)»,— отмечается в сообщении IUPAC. Процедура признания предложенных учеными названий для открытых ими элементов заняла около пяти месяцев. При этом IUPAC официально подтвердил открытие новых элементов (относящихся к седьмому периоду периодической системы) 30 декабря 2015 года.
115-й, 117-й и 118-й элементы были созданы группой ученых российского Объединенного института ядерных исследований (ОИЯИ) в Дубне, Ливерморской национальной лаборатории им.
113-й элемент синтезирован учеными японского института RIKEN и получил название нихоний (от «Nihon» — «Япония»). Отметим, что о создании 113-го элемента сообщала в 2014 году коллаборация российско-американских ученых, но Международный союз теоретической и прикладной химии не признал, что открытие элементов состоялось. При этом японские ученые предлагали назвать элемент японием, нисинанием (в честь физика Ёсио Нисины) или рикением (в честь института RIKEN), однако IUPAC рекомендовал нихоний.
Господин Оганесян сообщил “Ъ”, что работа над 115-м, 117-м и 118-м элементами шла более 15 лет: «Только в 1999 году мы увидели первый результат, а заявили об открытии в 2015 году».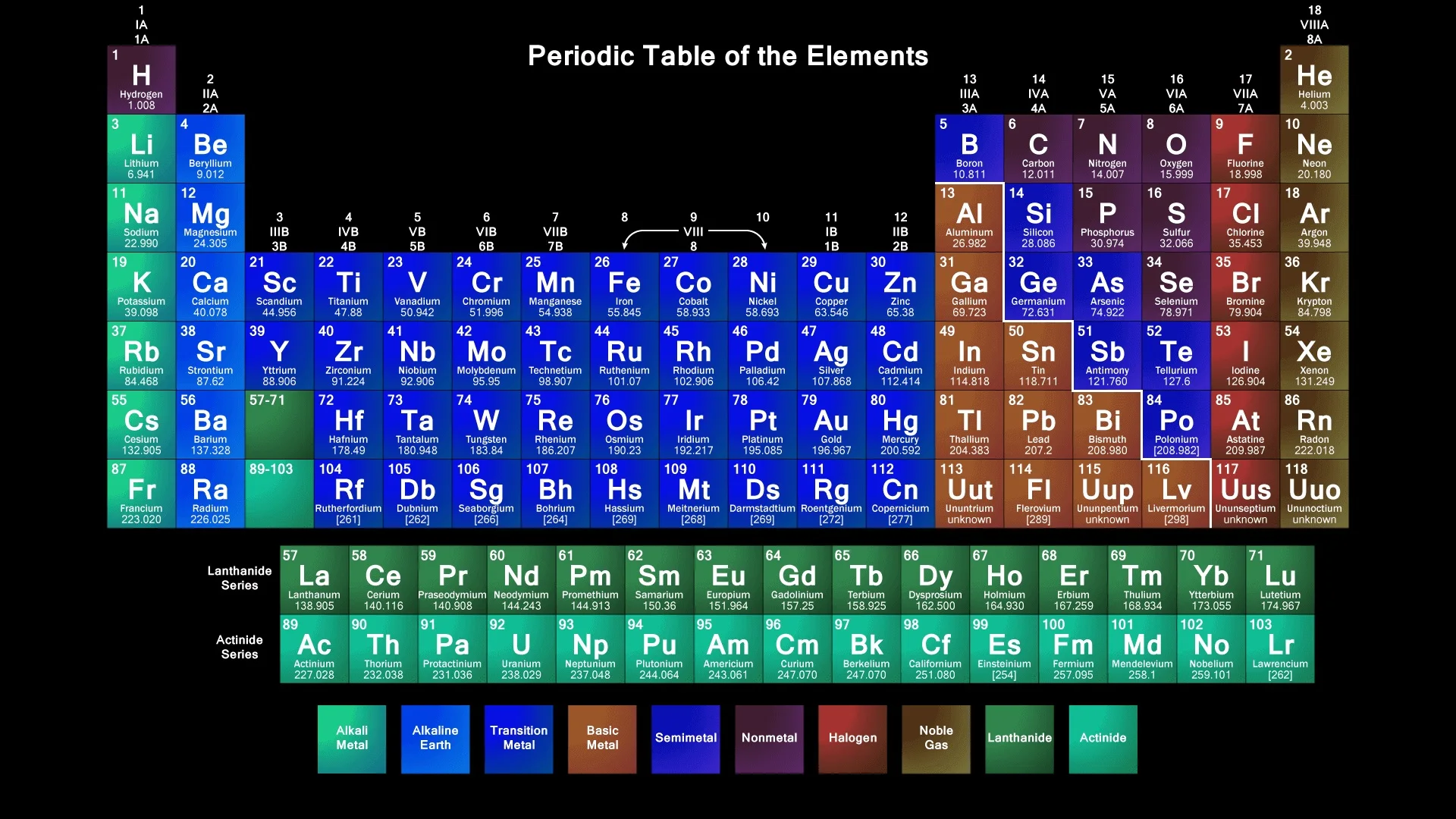 «Это сверхтяжелые элементы,— объяснил он.— Всегда предполагалось, что в природе таких тяжелых не должно быть, но в 1969 году появилась новая ядерная теория, которая допустила существование очень тяжелых и весьма стабильных элементов».
«Это сверхтяжелые элементы,— объяснил он.— Всегда предполагалось, что в природе таких тяжелых не должно быть, но в 1969 году появилась новая ядерная теория, которая допустила существование очень тяжелых и весьма стабильных элементов».
Говоря о современной процедуре появления названий элементов в таблице Менделеева, Юрий Оганесян объяснил, что она делится на несколько этапов: сначала создается комиссия экспертов (физиков и химиков), которые должны подтвердить факт открытия и определить, каким ученым принадлежит его приоритет, после этого они публикуют информацию об открытии, и в течение полугода это обсуждается в научных кругах. Далее факт открытия официально подтверждается. «Поскольку это касается химических элементов, то далее нужно определить название — этим занимается номенклатурная комиссия IUPAC, которая запрашивает авторов об их предложениях»,— рассказал господин Оганесян И отметил: «Не факт, что название еще одобрят», так как «оно должно одинаково произноситься на всех 130 языках мира, легко должны произноситься и названия химических соединений с этим элементом», а также «символ должен быть удобным».
Валерия Мишина
Таблица Менделеева – универсальный и безграничный язык общения ученых
АМ: Это инициатива, которая поддержана ЮНЕСКО и ООН. Изначально год Периодического закона, год 150-летия открытия Периодического закона, это инициатива, с которой выступила Российская академия наук при поддержке Министерства иностранных дел Российской Федерации.
Таблица Менделеева – универсальный язык общения ученых, прежде всего химиков. Хотя, если мы посмотрим шире, Менделеев был не только химиком. И открытие Периодического закона – это открытие, которое связывает очень многих ученых.
Для чего нужен этот год? Для того, чтобы еще раз напомнить всему миру, поскольку это международное событие, что мир наш развивается за счет открытий ученых, и что наука — это двигатель, драйвер прогресса человечества.
Во Франции, в ЮНЕСКО, 29 января будет торжественное открытие празднования Международного года Периодического закона. В России такое открытие пройдет 6 февраля в здании Российской академии наук.
Фото РХТУ
Александр Мажуга, ректор Российского химико-технологического университета им. Д.И. Менделеева
АМ: Сегодня, как и многие другие науки, химия выходит на междисциплинарный уровень. И все больше востребованных направлений находятся на стыке наук. Это химия, биология и медицина, биомедицина, биохимия, биоорганическая химия. Надо понимать, что химия — это вообще все, что есть вокруг нас: то, чем мы дышим, что мы едим, к чему мы прикасаемся. Но наиболее востребованные направления сейчас, это – биомедицина, использование новых материалов в медицине; все, что связано с созданием новых конструкционных материалов – это, естественно, тоже химия. А конструкционные материалы – это различные аппараты новые, это различные строительные материалы, материалы для сельского хозяйства. Конечно же химия – это основа наших лекарств. Фармацевтическая химия – синтез новых терапевтических, диагностических агентов. Если химия – все, что вокруг нас, то химическая технология – это то, что позволяет получать те или иные продукты.
Надо понимать, что химия — это вообще все, что есть вокруг нас: то, чем мы дышим, что мы едим, к чему мы прикасаемся. Но наиболее востребованные направления сейчас, это – биомедицина, использование новых материалов в медицине; все, что связано с созданием новых конструкционных материалов – это, естественно, тоже химия. А конструкционные материалы – это различные аппараты новые, это различные строительные материалы, материалы для сельского хозяйства. Конечно же химия – это основа наших лекарств. Фармацевтическая химия – синтез новых терапевтических, диагностических агентов. Если химия – все, что вокруг нас, то химическая технология – это то, что позволяет получать те или иные продукты.
АУ: Что интересует молодежь, на какие факультеты и специальности самый высокий конкурс? Куда хотят пойти учиться абитуриенты?
АМ:
 И факультет нефтегазохимии и полимеров – все, что связано с созданием новых конструкционных материалов, прежде всего полимерного строения.
И факультет нефтегазохимии и полимеров – все, что связано с созданием новых конструкционных материалов, прежде всего полимерного строения.АУ: Вы упомянули сейчас переработку отходов при помощи различных новых соединений. Это направление, которое очень востребовано, потому что загрязнение окружающей среды – тема, которая постоянно на повестке дня и ООН, и всего мира. Такая научная работа идет обычно закрыто – в институтах и университетах – или же она предполагает международное сотрудничество и есть какие-то крупные проекты?
Такие работы ведутся в рамках международного сотрудничества и, конечно же, вместе с нашими партнерами из химической и биотехнологической промышленности. И тут нужен не только биотехнологический подход, чтобы решить техногенные проблемы, но и направление, связанное с созданием новых «зеленых» химических производств, производств, которые экологичны, требуют небольшого количества ресурсов – например, замкнутые циклы. Такие химические фабрики будущего – тоже важное направление работы нашего университета.
АУ: Зачастую образование бывает очень академичным, научным… Есть ли практика связи образования с навыками и работой в отрасли, с работой на практический результат?
Основной залог успеха образования в нашей области, в области химической технологии, это непосредственный контакт с предприятиями, с конечными потребителями наших технологий, с компаниями, куда идут работать наши выпускники. Мы стараемся максимально изменять образовательные «траектории» наших студентов так, чтобы они были синхронизированы с предприятиями отрасли.
Фото РХТУ
Новый учебный комлекс РХТУ
АУ: Участвуют ли студенты в каких-то научных разработках, которые потом претворяются в жизнь?
АМ: Да, конечно. Студенты во время обучения в нашем университете занимаются наукой, как и во многих других университетах в нашей стране. Мы рассматриваем сейчас возможность так называемого «проектного» обучения, когда начиная с первого курса студенты – мы можем также готовить проектные группы – выполняют тот или иной проект, связанный с отраслью химической технологии, и на выходе они получают технологию, которую можно реализовать.
АУ: Возвращаясь к теме таблицы Менделеева… Говорят, оформляя свой Периодический закон в таблицу, Менделеев предусмотрительно оставил свободные места – «на будущее». Как происходит открытие новых элементов, как часто приходится обновлять таблицу?
АМ: Периодическая таблица – это не просто графическое представление элементов. До Менделеева были более ранние варианты, когда элементы располагались по мере увеличения их атомного номера или веса (те элементы, что были открыты на момент той или иной таблицы). Но только Менделеев увидел в расположении элементов периодичность. Так появился Периодический закон: свойства элементов изменяются в рядах, и они повторяются. То есть самое его главное открытие – не просто расположение элементов в ячейках в таблице, а закон периодичности.
Сейчас элементы, которые были совсем недавно открыты – три новых элемента, – являются сверхтяжелыми, радиоактивными и короткоживущими. На момент открытия таблицы такого количества элементов как сейчас известно не было. Что самое главное, Менделеев своим законом предсказывал существование элементов. В его первоначальной таблице были пустые ячейки – он показывал, что в этой ячейке должен появиться новый элемент. Само доказательство закона происходило позднее, когда эти новые элементы открывались и попадали уже в ячеечку Периодической таблицы. Мало того, Менделеев мог предсказывать и массу этого элемента, причем совпадения были порой с точностью до десятой в атомной массе!
На момент открытия таблицы такого количества элементов как сейчас известно не было. Что самое главное, Менделеев своим законом предсказывал существование элементов. В его первоначальной таблице были пустые ячейки – он показывал, что в этой ячейке должен появиться новый элемент. Само доказательство закона происходило позднее, когда эти новые элементы открывались и попадали уже в ячеечку Периодической таблицы. Мало того, Менделеев мог предсказывать и массу этого элемента, причем совпадения были порой с точностью до десятой в атомной массе!
Что касается новых элементов и пустых ячеек, то, как говорят, таблица Менделеева не окончена и, на самом деле, бесконечна. Сейчас мы находимся на таком «минимуме стабильности» химических элементов, но благодаря предсказаниям физиков мы должны будем выйти на элементы, которые будут опять же стабильны. То есть, чем тяжелее элемент, чем больше у него масса, тем менее стабильным он становится. Часто такие элементы – короткоживущие и радиоактивные. Но через какой-то период мы должны выйти опять на более стабильные элементы.
АУ: Есть ли страны-лидеры в открытии новых элементов, которые открыли их больше всего?
АМ: Нельзя сказать, что какая-то одна страна имеет лидерство. И в России было открыто шесть элементов, и в США было открыто достаточно большое количество. Достаточно сложно сказать, в какой стране больше или меньше было открыто. Чаще всего сейчас открытие новых элементов – как последних трех – происходит в коллаборации. Так, последние три были открыты при сотрудничестве России и США вместе: кто-то делает мишень, кто-то ее облучает, кто-то выделяет. И, соответственно, и один из элементов был назван в честь известного российского ученого, академика Юрия Оганесяна. Кстати, это единственный пример в Периодической таблице, когда элемент назван в честь живущего сейчас ученого.
АУ: То есть выдающийся ученый получил таким образом «памятник при жизни»?
АМ: Да, при жизни. Есть еще ряд элементов, которые названы «московий» – в честь Москвы, «дубний» – в честь г. Дубны, где находится Объединенный институт ядерных исследований, и конечно же «рутений», названный в честь России. Поэтому, ждем новых элементов – в коллаборации с другими странами, другими научными и учебными организациями.
Дубны, где находится Объединенный институт ядерных исследований, и конечно же «рутений», названный в честь России. Поэтому, ждем новых элементов – в коллаборации с другими странами, другими научными и учебными организациями.
Как легко определять свойства элементов и их соединений — Российская газета
Не так уж часто удается написать заметку о том, что не просто войдет в школьные учебники будущего, а станет одной из базовых картинок-иллюстраций. Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, “Коту” рассказал профессор Сколтеха Артем Оганов.
Артем Оганов – кристаллограф-теоретик, создатель ряда новых материалов, а главное, методов, которые позволяют открывать новые материалы. Решил считавшуюся нерешаемой задачу предсказания кристаллической структуры вещества на основе его химического состава. Создал программу USPEX, способную предсказывать устойчивые химические соединения по набору исходных элементов. Один из самых цитируемых в мире ученых.
Решил считавшуюся нерешаемой задачу предсказания кристаллической структуры вещества на основе его химического состава. Создал программу USPEX, способную предсказывать устойчивые химические соединения по набору исходных элементов. Один из самых цитируемых в мире ученых.
Я хорошо помню, как мне пришло в голову решение этой задачи. Мы с семьей садились в самолет. У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
Эта проблема волновала меня последние 15 лет. В 1984 году британский физик Дэвид Петтифор опубликовал работу, в которой ввел понятие менделеевских чисел, – с их помощью он сгруппировал элементы в порядке изменения их химических свойств. В таблице Менделеева свойства элементов меняются скачками. Так, после самого химически активного неметалла фтора идет инертный неон, а сразу за ним – активнейший металл натрий. Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
В 1984 году британский физик Дэвид Петтифор опубликовал работу, в которой ввел понятие менделеевских чисел, – с их помощью он сгруппировал элементы в порядке изменения их химических свойств. В таблице Менделеева свойства элементов меняются скачками. Так, после самого химически активного неметалла фтора идет инертный неон, а сразу за ним – активнейший металл натрий. Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Петтифор предложил решение – выстроил элементы в некоторой последовательности, приписав им некие числа Менделеева. Но как приписал, не объяснил. И тем более не объяснил, какой у них физический смысл. Эти числа не расчет, а произвол, хотя и основанный на наблюдениях за свойствами бинарных соединений – веществ, состоящих из двух разных атомов. Скажем, если NaCl и KCl похожи, то и натрий с калием должны стоять рядом. Все это время ученые модифицировали и улучшали менделеевские числа, но что это такое, так никто и не объяснил.
У химических элементов есть разные характеристики, которые влияют на их свойства. Прежде всего размер атома (его радиус), валентность, поляризуемость*, электроотрицательность**. Но валентность – параметр непостоянный, у разных элементов могут быть разные валентности, а мы неоднократно открывали химические соединения, которые с точки зрения привычных представлений о валентности не могли бы существовать. Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
Прежде всего размер атома (его радиус), валентность, поляризуемость*, электроотрицательность**. Но валентность – параметр непостоянный, у разных элементов могут быть разные валентности, а мы неоднократно открывали химические соединения, которые с точки зрения привычных представлений о валентности не могли бы существовать. Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
*Поляризуемость – способность атома или молекулы становиться электрически полярными во внешнем электромагнитном поле. Поляризуемость показывает, насколько легко может возникнуть заряженная частица (ион) или новая химическая связь.
**Электроотрицательность – способность атома оттягивать электроны других атомов в химических соединениях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), низкая – у активных металлов (Li, Na, K).
Получается, что для определения фундаментальных свойств атомов можно использовать только атомный радиус и электроотрицательность. И если по оси Х – радиус, а по оси Y – электроотрицательность, мы получаем плоскость, на которой сильно вытянутым облаком располагаются элементы. Внутри этого облака, воспользовавшись несложным математическим приемом, можно провести линию, вдоль которой элементы встанут в порядке максимально плавного изменения свойств.
И если по оси Х – радиус, а по оси Y – электроотрицательность, мы получаем плоскость, на которой сильно вытянутым облаком располагаются элементы. Внутри этого облака, воспользовавшись несложным математическим приемом, можно провести линию, вдоль которой элементы встанут в порядке максимально плавного изменения свойств.
Так мы открыли физический и химический смысл менделеевских чисел: это наилучшее представление всех химических свойств атома одним числом. Но мы предложили не только объяснение, но и улучшенную версию чисел Менделеева, в которой нет места субъективности – только расчеты на основе фундаментальных характеристик атомов. Мы назвали это “Универсальной последовательностью элементов”, по-английски Universal Sequence Of Elements, сокращенно USE. И действительно, наша последовательность удобна в применении: она предсказывает свойства химических соединений лучше, чем петтифоровские менделеевские числа и их позднейшие модификации.
Если расположить элементы на осях, то на плоскости будут бинарные соединения – молекулы и кристаллы, состоящие из двух типов атомов. Мы обнаружили, что на этом поле – его можно назвать химическим пространством – возникают области соединений с близкими свойствами, например твердостью кристаллов, магнетизмом, энергией связи. Известно, например, что алмаз, состоящий только из углерода, – самый твердый из кристаллов. А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
Мы обнаружили, что на этом поле – его можно назвать химическим пространством – возникают области соединений с близкими свойствами, например твердостью кристаллов, магнетизмом, энергией связи. Известно, например, что алмаз, состоящий только из углерода, – самый твердый из кристаллов. А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
Улучшенные менделеевские числа помогут находить новые соединения с полезными свойствами и смогут прояснить некоторые вопросы, связанные с привычной таблицей Менделеева. Например, уже сейчас можно ставить точку в споре, где должен находиться водород: над литием или над фтором. Согласно менделеевским числам, водород ближе к галогенам, чем к щелочным металлам.
Ссылка: Zahed Allahyari and Artem R. Oganov, Nonempirical Definition of the Mendeleev Numbers: Organizing the Chemical Space: J. Phys. Chem. C 2020, 124, 43, 23867-23878.
Универсальная последовательность элементов (USE)
Журнал “Кот Шрёдингера”
Как вычисляются числа Менделеева
Универсальная последовательность элементов определяется их проекцией на линию, обозначенную синим цветом. Журнал “Кот Шрёдингера”
Журнал “Кот Шрёдингера”
Селфи на фоне Таблицы Менделеева
«Периодическая таблица – это одно из величайших достижений в науке во все времена», – заявил президент Академии наук Франции Пьер Корволь на открытии Международного года Периодической таблицы химических элементов. В Москве и в Париже дали старт длинной череде мероприятий, смысл которых очень прост – напомнить человечеству, чем оно обязано Дмитрию Менделееву, открывшему 150 лет назад Периодический закон.
«ООН намеревается таким образом донести мысль о том, как химия способна в современном мире способствовать устойчивому развитию и выдвинуть решения для вызовов планетарного масштаба в таких разных областях, как энергия, образование, сельское хозяйство или здравоохранение», – пишет портал physicsworld.com.
Любопытно, что нынешний год также провозглашен Годом Леонардо в честь 500-летия со дня смерти великого флорентийца. Если иметь в виду широту научных интересов и вклад в различные области знаний, Менделеев – это и есть русский Леонардо.
Эсперанто для ученых
«Мы, ученые, высоко ценим Периодическую таблицу, потому что она представляет собой общий язык, на котором мы все говорим», – подчеркнул Нобелевский лауреат по химии 2016 г. голландец Бен Феринга. Как известно, самого Менделеева трижды выдвигали на Нобелевскую премию, но он так и не получил ее.
Первый квартал иннограда Сколково носит имя Дмитрия Менделеева. Фото: Sk.ru
В Москве на заседании комитета по проведению Международного года Периодической таблицы химических элементов глава Российской академии наук Александр Сергеев сказал: «Мы в РАН считаем, что есть три основные цели, которые страна наша должна решить в этот год. Первое, чтобы Периодическую таблицу химических элементов все стали называть таблицей Менделеева, чтобы мы получили, наконец, Нобелевскую премию в этом году, и третье – чтобы мы выиграли олимпиаду по химии в Париже», – заявил он.
«Периодическая таблица есть попытка познать природу всех вещей», – сформулировала свое отношение к открытию Менделеева генеральный секретарь ЮНЕСКО, выступая в Париже в штаб-квартире этой организации Одри Азуле.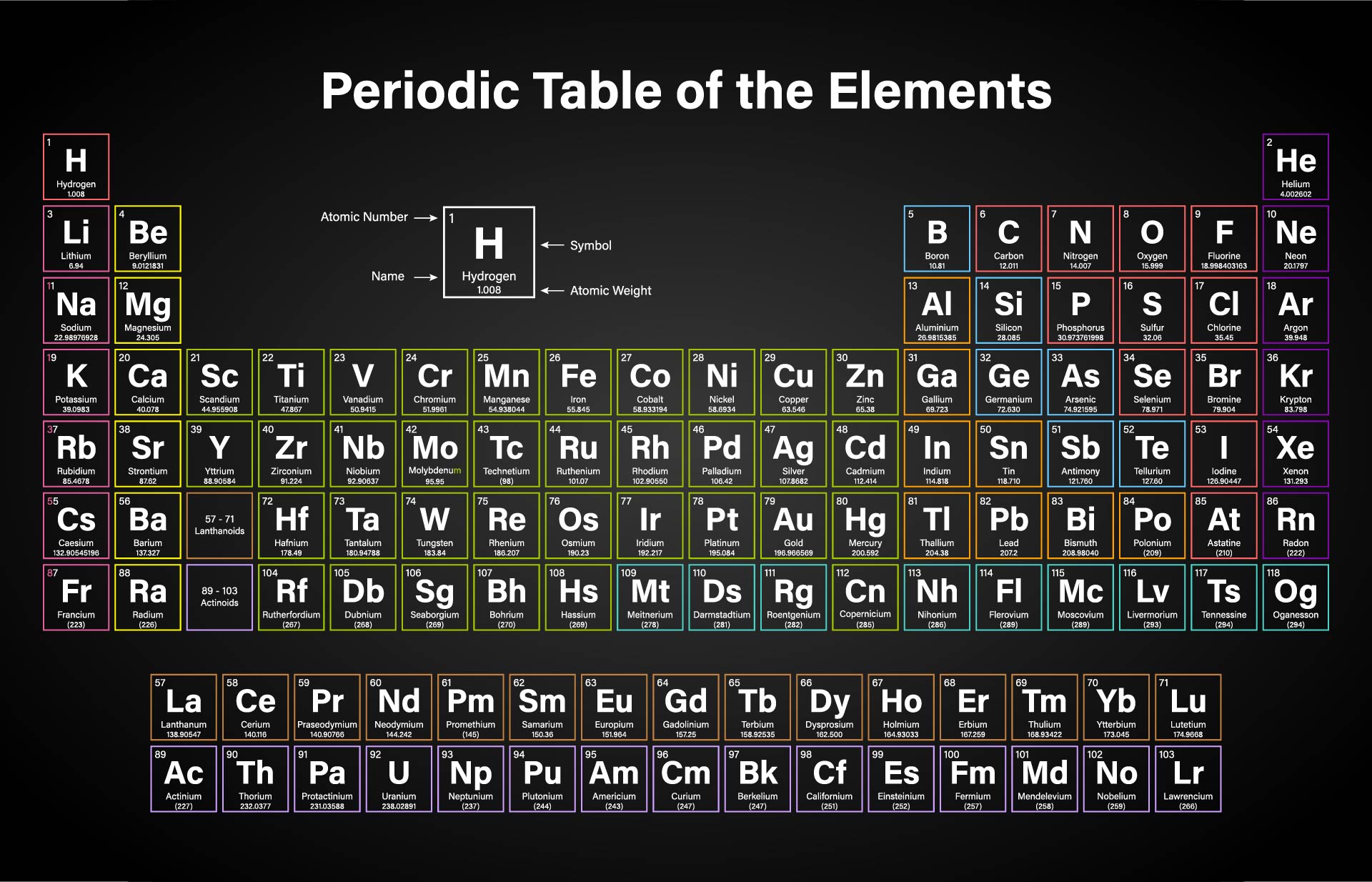 Министр науки и высшего образования РФ Михаил Котюков там же выразил мнение, что наследие Менделеева принадлежит всему человечеству. С чем участники торжественного собрания вполне согласились.
Министр науки и высшего образования РФ Михаил Котюков там же выразил мнение, что наследие Менделеева принадлежит всему человечеству. С чем участники торжественного собрания вполне согласились.
Помимо того, что Менделеев открыл Периодический закон, выходец из Тобольской губернии, 17-й сын в семье, конструировал летательные аппараты (его называют изобретателем аэростата) и занимался кораблестроением, в том числе, принимал участие в строительстве первого в мире арктического ледокола «Ермак». К числу его изобретений относят бездымный порох и нефтепровод, а на досуге ученый занимался тем, что делал чемоданы, которые сегодня назвали бы «дизайнерскими».
«Мы, ученые, высоко ценим Периодическую таблицу, потому что она представляет собой общий язык, на котором мы все говорим»
При этом сам Дмитрий Менделеев считал своей главной заслугой не Периодический закон, а введенный в России таможенный тариф, необходимость которого он сформулировал в книге «Разумный тариф». «Какой я химик, я — политэконом; что там «Основы» [химии], вот «Толковый тариф» — это другое дело», — писал он.
И был великий эконом
«Если говорить о широте его научных интересов, то Менделеев по большому счету был не только великим химиком, но и выдающимся экономистом, выстраивавшим тесную связь между наукой и индустрией», – считает вице-президент Фонда «Сколков» по науке и образованию Николай Суетин. – И это один из важных уроков, которые представляет для «Сколково» наследие Менделеева.
Я бы назвал его научно-экономическим гением страны. Прежде всего, он был практикующим ученым, который не сидел в башне из слоновой кости и использовал научные достижения в реальной жизни». Да и вообще был очень «приземленным» ( в лучшем смысле этого слова) человеком.
Как раз в этом и заключается смысл деятельности «Сколково». Неслучайно, первый квартал иннограда назван именем Менделеева, а фасады его зданий стилизованы под Периодическую таблицу.
Самый известный пример – когда он буквально в течение нескольких месяцев оптимизировал технологию производства керосина в Баку. «Злые языки» говорят, что это в итоге и поссорило его с семейством Нобилей, которые активно там работали, и как следствие – закрыло ему путь к Нобелевской премии.
«Злые языки» говорят, что это в итоге и поссорило его с семейством Нобилей, которые активно там работали, и как следствие – закрыло ему путь к Нобелевской премии.
Вице-президент Фонда “Сколково” по науке и образованию Николай Суетин: “Я бы назвал Менделеева научно-экономическим гением страны”. Фото: Sk.ru
Или взять введение по инициативе Менделеева таможенного тарифа. «В России все очень гордились строительством железных дорог, но при этом все железо закупали за рубежом за золото; благодаря строительству российских железных дорог в Германии металлургия получила дополнительное развитие, – напоминает вице-президент «Сколково». Благодаря введению таможенных тарифов начали развивать собственную металлургию. То же самое – с угольной промышленностью. За что ни возьмись, Менделеев всегда делал упор на связь между наукой и экономикой».
Сама история создания Периодического закона преподносит нам еще один урок, продолжает Николай Суетин: «Почему вообще появилась таблица Менделеева? В 1869 году, к тому моменту, когда Менделеев создал Периодическую таблицу, было известно только 60 элементов, причем массы ряда элементов были определены неправильно, а о существовании атома не догадывались. Не было никакой квантовой механики. Были некие вещества, которые считались фундаментальными, и из них, как полагали, состояла вся природа.
Не было никакой квантовой механики. Были некие вещества, которые считались фундаментальными, и из них, как полагали, состояла вся природа.
«Если говорить о широте его научных интересов, то Менделеев по большому счету был не только великим химиком, но и выдающимся экономистом, выстраивавшим тесную связь между наукой и индустрией»
Менделеев сформулировал свой закон, когда писал учебник «Основы химии». Он обнаружил, что если элементы выстроить по увеличению их веса, то возникает некая периодичность, которую можно представить в виде таблицы с заполненными и пустующими клетками. В ней по горизонтали выстроены элементы по возрастанию их массы, а по вертикали – с одинаковыми химическими свойствами. Были какие-то элементы, масса которых не соответствовала закономерности, в следствие чего ее впоследствии скорректировали. И были дырки, где элементов не было, но было ясно, что они должны там быть, и эти элементы потом нашли. В том числе, три – еще при жизни самого Менделеева. Т.е. многие элементы были открыты потому, что они были предсказаны Таблицей Менделеева, и их искали целенаправленно, хотя в природе они встречаются редко.
Вот так написание учебника, т.е. образовательная деятельность, дала выдающийся научный результат. Соединение науки и образования всегда важно, и это один из главных уроков, которые дает нам Менделеев», – считает Н.Суетин.
Сегодня в Таблице Менделеева почти в два раза больше элементов, чем 150 лет назад. Фото: Sk.ru
Судьба некоторых изобретений Менделеева тоже представляет собой определенный урок для дня сегодняшнего. Состав и метод производства бездымного пороха, разработанный Менделеевым, был запатентован не в России, а в Америке, вследствие чего Россия закупала «менделеевский порох» из-за океана. Что еще раз подчеркивает важность международной защиты, создаваемой интеллектуальной собственности.
В юбилейный год не принято вспоминать о проблемах, но Дмитрий Менделеев не был принят в Императорскую академию наук, хотя был членом множества зарубежных. Более того, когда из-за нарушения властями академических свобод ученый покинул петербургский университет, коллеги не стали его удерживать, хотя студенты и выходили на акции протеста.
Более того, когда из-за нарушения властями академических свобод ученый покинул петербургский университет, коллеги не стали его удерживать, хотя студенты и выходили на акции протеста.
«Есть такая беда: во все времена в стране было что-то неладное с признанием собственных гениев, – говорит Николай Суетин. – «Нет пророка в своем отечестве»: на Нобелевскую премию Менделеева выдвигали иностранцы, а члены Императорской академии наук при тайном голосовании неоднократно отвергали его кандидатуру. Хотя к Менделееву с очень большим уважением относились промышленники, и предприниматели, да и многие члены правительства, министры».
Тусовка длиною в год
По прошествии 150 лет Менделееву с лихвой воздают должное и на Родине, и далеко за ее пределами.
«Периодическая таблица есть попытка познать природу всех вещей»
Портал physicsworld.com в репортаже из штаб-квартиры ЮНЕСКО обращает внимание на то, что старт международного года в ЮНЕСКО был обставлен как веселая тусовка. В зале звучали музыкальные интерлюдии в исполнении знаменитой пианистки Миры Евтич. В кулуарах посетители толпились в молекулярном баре, выстраиваясь в очередь за мороженым, приготовленным с помощью жидкого азота. Можно было даже сделать селфи в интерьерах воссозданного для этой цели в Париже кабинета Менделеева.
В зале звучали музыкальные интерлюдии в исполнении знаменитой пианистки Миры Евтич. В кулуарах посетители толпились в молекулярном баре, выстраиваясь в очередь за мороженым, приготовленным с помощью жидкого азота. Можно было даже сделать селфи в интерьерах воссозданного для этой цели в Париже кабинета Менделеева.
Месседж вполне прозрачен: перефразируя Пушкина, быть можно важным в науке человеком и при этом делать селфи с Менделеевым. И, конечно, это нетривиальный способ популяризации науки.
Фото: Sk.ru.
В России наука также нуждается в творческой популяризации, и «Сколтех, как никто другой, сейчас выполняет эту роль», – считает вице-президент Фонда «Сколково» по науке и образованию. Именно здесь выпустили первый сборник комиксов, основанных на реальных научных исследованиях российских ученых. Научно-просветительский проект Сколтеха «Это точно. Чертова дюжина комиксов о науке и ученых» отмечен дипломом в специальной номинации «Прорыв года» V Всероссийской премии «За верность науке».
«Сколтех проникся идеей, что науку надо популяризировать, – утверждает Николай Суетин. – Благодаря академику Александру Кулешову профессора активно участвуют в «Сириусах», других научно-популярных мероприятиях для детей. На мой взгляд, лучший популяризатор науки в России сейчас – профессор Сколтеха Константин Северинов: никто лучше него не рассказывает о том, что такое генетика, редактирование генома».
В этом смысле стартовавший в феврале Международный год Периодической таблицы химических элементов дает хороший шанс для популяризации наследия Менделеева, о котором миллениалы знают по преимуществу то единственное, чего он никогда не делал: да, Менделеев не изобретал водку.
Периодическая таблица через 150 лет
Ю. Ц. Оганесян
По материалам доклада на Научной сессии Общего собрания членов РАН, посвященной закрытию Международного года Периодической таблицы 14 ноября 2019 г. В варианте статьи журнала «Вестник Российской академии наук» № 4 2020 г.
К началу 2019 г., провозглашенного ООН и ЮНЕСКО Международным годом Периодической таблицы химических элементов, 7-й период таблицы был уже заполнен новыми, самыми тяжелыми элементами. Согласно предсказаниям теории, изотопы сверхтяжелых элементов, обладающие повышенной стабильностью, образуют на карте нуклидов большую зону в виде острова с вершиной, расположенной вблизи «магических» чисел протонов Z=114 и нейтронов N=184. Новые элементы с атомными номерами от 114 до 118 были синтезированы в Лаборатории ядерных реакций им. Г.Н. Флёрова Объединённого института ядерных исследований (ОИЯИ) в Дубне в 2000–2012 гг. в реакциях слияния ядер мишени – тяжёлых изотопов актиноидов (Z = 94–98) – с бомбардирующими ионами кальция-48. Из полученных экспериментальных результатов следует, что могут существовать ядра/элементы с атомными номерами более 118 и массами более 300 а.е.м. Для исследования ядерной и электронной структур новых элементов, а также их химических свойств, равно как и синтеза элементов начала 8-го периода Периодической таблицы, в Дубне создан новый экспериментальный комплекс Фабрика сверхтяжелых элементов (Фабрика СТЭ), где уже состоялся пуск нового ускорителя DC-280 и в ближайшее время начнутся эксперименты. Вводная и заключительная части моего выступления на Научной сессии Общего собрания членов РАН относились к открытию периодического закона, опубликованного Д.И. Менделеевым 150 лет назад. Действие этого закона в свойствах тяжелейших элементов представляет и сегодня одну из актуальных и интересных задач естествознания.
Вводная и заключительная части моего выступления на Научной сессии Общего собрания членов РАН относились к открытию периодического закона, опубликованного Д.И. Менделеевым 150 лет назад. Действие этого закона в свойствах тяжелейших элементов представляет и сегодня одну из актуальных и интересных задач естествознания.
Ключевые слова: Периодическая таблица Д.И. Менделеева, сверхтяжёлые элементы, “остров” стабильности, Фабрика сверхтяжёлых элементов, спонтанное деление.
ПРОЛОГ
Предание гласит, что всё началось с письма, которое сэр Мартин Поляков, профессор Ноттингемского университета (Великобритания) и иностранный член РАН, направил 28 июля 2016 г. президенту Международного союза чистой и прикладной химии (ИЮПАК) члену-корреспонденту РАН Наталии Павловне Тарасовой:
«Уважаемая Наталия,
надеюсь, что Вы в порядке.
Как я понимаю, 2019 год станет 150-й годовщиной публикации Менделеевым Периодической таблицы. Было бы интересно знать, можно ли поднять вопрос о том, чтобы объявить 2019 год Международным годом Периодической таблицы. Чувствую, что это предложение может получить большую поддержку. Как Вы думаете?
Было бы интересно знать, можно ли поднять вопрос о том, чтобы объявить 2019 год Международным годом Периодической таблицы. Чувствую, что это предложение может получить большую поддержку. Как Вы думаете?
С наилучшими пожеланиями,
Мартин Поляков»
Н.П. Тарасова поставила этот вопрос на заседании Исполнительного комитета ИЮПАК, который, как ей показалось, со здоровым скептицизмом поддержал идею Международного года Периодической таблицы и предложил России воплотить её в жизнь через ЮНЕСКО. Начиная с этого момента, вся деятельность по данному вопросу, проводимая Международным союзом чистой и прикладной химии в течение 18 месяцев, легла на плечи президента ИЮПАК и её коллег.
Российская академия наук и российские химики с большим воодушевлением взялись за дело: написали обращение Менделеевского съезда (2016) и Российского химического общества к мировой научной общественности, президент РАН академик В.Е. Фортов направил письмо министру иностранных дел России С.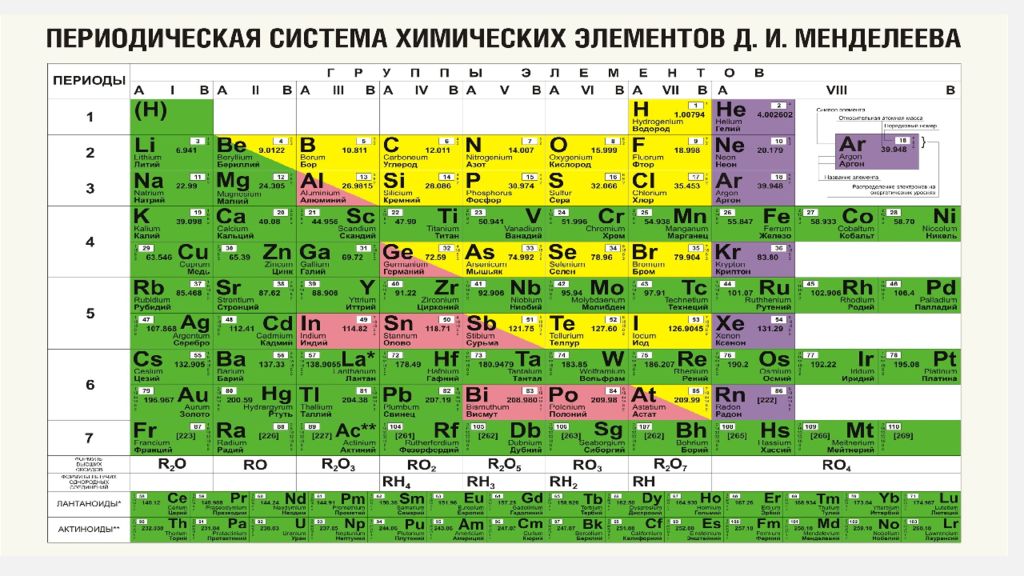 В. Лаврову, РАН обратилась в ИЮПАК, Н.П. Тарасова написала письмо Генеральному директору ЮНЕСКО и пр. К этому времени подошло другое событие, непосредственно связанное с Периодической таблицей химических элементов. После включения в 2012 г. в таблицу 114-го и 116-го элементов ИЮПАК принял название и утвердил символы ещё четырех химических элементов, в их числе двух самых тяжёлых. Это случилось 28 ноября 2016 г. Все четыре элемента со своими названиями и символами заполнили и замкнули 7-й период Периодической таблицы Д.И. Менделеева. На инаугурации новых химических элементов, состоявшейся 2 марта 2017 г. в Доме учёных РАН, три директора сотрудничающих лабораторий – академик РАН Виктор Матвеев (ОИЯИ, Дубна, Россия), профессор Томас Мейсон (Ок-Риджская национальная Лаборатория, Oк-Ридж, США) и профессор Вильям Гольдштейн (Ливерморская национальная лаборатория, Ливермор, США) – направили совместное письмо в ЮНЕСКО в поддержку юбилейного года Периодической таблицы. И это далеко не полный перечень шагов, предпринятых научным сообществом в преддверии 2018 г.
В. Лаврову, РАН обратилась в ИЮПАК, Н.П. Тарасова написала письмо Генеральному директору ЮНЕСКО и пр. К этому времени подошло другое событие, непосредственно связанное с Периодической таблицей химических элементов. После включения в 2012 г. в таблицу 114-го и 116-го элементов ИЮПАК принял название и утвердил символы ещё четырех химических элементов, в их числе двух самых тяжёлых. Это случилось 28 ноября 2016 г. Все четыре элемента со своими названиями и символами заполнили и замкнули 7-й период Периодической таблицы Д.И. Менделеева. На инаугурации новых химических элементов, состоявшейся 2 марта 2017 г. в Доме учёных РАН, три директора сотрудничающих лабораторий – академик РАН Виктор Матвеев (ОИЯИ, Дубна, Россия), профессор Томас Мейсон (Ок-Риджская национальная Лаборатория, Oк-Ридж, США) и профессор Вильям Гольдштейн (Ливерморская национальная лаборатория, Ливермор, США) – направили совместное письмо в ЮНЕСКО в поддержку юбилейного года Периодической таблицы. И это далеко не полный перечень шагов, предпринятых научным сообществом в преддверии 2018 г.
А 20 декабря 2017 г. с интересной и необычной формулировкой – “признавая важность глобального расширения знаний о том, как химия способствует устойчивому развитию в области энергетики, образования, сельского хозяйства и здоровья,” – Генеральная Ассамблея ООН, затем и ЮНЕСКО провозгласили 2019-й Международным годом Периодической таблицы химических элементов – IYPT-2019.
НОВЫЕ ОБИТАТЕЛИ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
В 1928 г. Георгий Антонович Гамов, наш соотечественник, выпускник Ленинградского государственного университета, уже известный к тому времени советский физик, предложил первую теоретическую модель атомного ядра в виде капли заряженной жидкости с плотностью, на 15 порядков превышающей плотность воды [1]. В новой науке, ядерной физике, этой работе суждено было сыграть большую роль. На основе капельной модели ядра Гамов создал теорию альфа-распада (1928) [2], Карл Фридрих фон Вайцзеккер предложил свою знаменитую формулу для расчёта энергии связи ядер (1935) [3], а Нильс Бор и Джон А.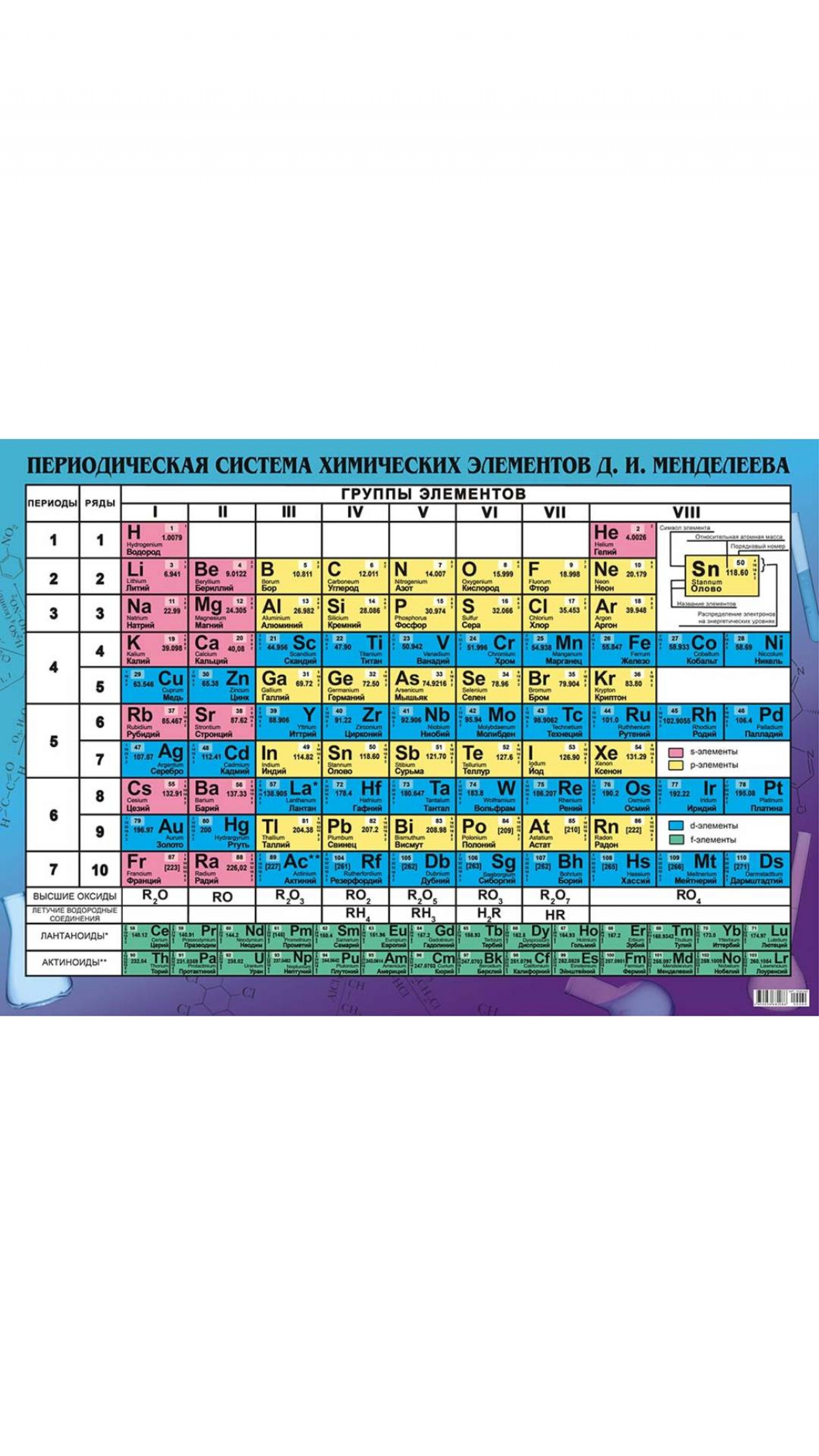 Уилер создали теорию ядерного деления (1939) [4]*.
Уилер создали теорию ядерного деления (1939) [4]*.
Согласно Бору и Уилеру, тяжёлое ядро предохраняет от разделения на две части потенциальный барьер. Высота барьера деления ядра урана составляет 6 МэВ. Поэтому если в ядро внести энергию более чем 6 МэВ (например, энергию захвата ядром нейтрона), оно моментально разделится на две части. В этом процессе выделяется энергия около 200 МэВ, что используется в атомных электростанциях. Однако ядро урана может разделиться самопроизвольно (спонтанно) без вноса в ядро дополнительной энергии. Для этого, как было впервые измерено Г.Н. Флёровым и К.А. Петржаком (1940) [6], потребуется огромное время: 1016 лет! По мере удаления от урана в область более тяжелых ядер, высота барьера деления быстро уменьшается, что приводит к резкому увеличению вероятности спонтанного деления. При исчезновении барьера деления ядро будет испытывать спонтанное деление за время около 10-19 с. В теории Бора и Уилера подобная критическая ситуация наступает при подходе к элементам с атомным номером 100. По сути, это и есть предел существования ядер.
По сути, это и есть предел существования ядер.
Ещё 60 лет назад такое макроскопическое, и в этом смысле классическое, описание процесса деления не вызывало сомнений. Особенно после синтеза первых искусственных элементов тяжелее урана, прекрасно подтверждающих капельную теорию деления: от урана (Z = 92) до калифорния (Z = 98) период полураспада относительно спонтанного деления уменьшился в 1014 раз [7]! Сомнения в прогнозах капельной модели деления возникли позже, после открытия в Лаборатории ядерных реакций им. Г.Н. Флёрова ОИЯИ спонтанно-делящихся изомеров (1962) [8]. Оказалось, что внутренняя структура ядра, наблюдаемая в основных состояниях, сохраняется и в сильно деформированных конфигурациях на пути к делению, продолжая играть важную роль в вероятности спонтанного деления тяжёлых ядер. Теперь уже более сложное описание коллективного движения в новой микроскопической теории давало одновременно также и новые предсказания границы масс ядер. Результаты оказались весьма неожиданными. Согласно прогнозам, резкое падение стабильности трансурановых нуклидов относительно спонтанного деления должно смениться резким подъёмом в области сверхтяжёлых элементов при подходе к “магическим” ядрам с числом протонов Z = 114 и нейтронов N = 184. Эти нуклиды, обладающие большим избытком нейтронов, более связаны. Они отделены от известной области ядер. Их достаточно много. На карте ядер они представляют собой подобие некого “острова” весьма тяжёлых (сверхтяжёлых) элементов, у которых могут быть очень долгоживущие изотопы. В научных статьях и докладах начала 1970-х годов можно найти различные иллюстрации, подобные той, что представлена на рис. 1.
Согласно прогнозам, резкое падение стабильности трансурановых нуклидов относительно спонтанного деления должно смениться резким подъёмом в области сверхтяжёлых элементов при подходе к “магическим” ядрам с числом протонов Z = 114 и нейтронов N = 184. Эти нуклиды, обладающие большим избытком нейтронов, более связаны. Они отделены от известной области ядер. Их достаточно много. На карте ядер они представляют собой подобие некого “острова” весьма тяжёлых (сверхтяжёлых) элементов, у которых могут быть очень долгоживущие изотопы. В научных статьях и докладах начала 1970-х годов можно найти различные иллюстрации, подобные той, что представлена на рис. 1.
Рис. 1. Периоды полураспада ядер с Z ≥ 96 относительно спонтанного деления. Черные кружки – экспериментальные значения для актиноидов и изотопов 104 элемента. Открытые кружки – один из вариантов предсказаний для ядер c Z ≥ 106 и N ≥ 150.  С правой стороны: периоды спонтанного деления изотопов 114-го элемента, рассчитанные в макро – микроскопической модели ядра. С правой стороны: периоды спонтанного деления изотопов 114-го элемента, рассчитанные в макро – микроскопической модели ядра. |
Многие лаборатории мира буквально ринулись на поиски этих долгоживущих тяжеловесов. Но, к сожалению, все экстенсивные попытки найти их в природе, космических лучах и даже путём искусственного синтеза сверхтяжёлых элементов, предпринятые в течение 15 лет (1970–1985), не дали результатов. Оставляя пока вопрос о вероятности образования ядер с массой около 300 в процессах природного ядерного синтеза, отметим, что время жизни сверхтяжёлых долгожителей заметно меньше возраста Солнечной системы (4.5∙109 лет) и они не дожили до наших дней. Что же касается искусственного синтеза, то все методы синтеза двадцати известных к тому времени искусственных элементов тяжелее урана, к сожалению, не пригодны для этих целей. Они “не дотягивают” до “острова” стабильности прежде всего из-за дефицита нейтронов в системе сливающихся ядер.
После 1985 г. мы кардинально изменили подход к синтезу сверхтяжёлых элементов. Для того чтобы добраться до “острова” и увидеть резкий подъём стабильности, предсказанный теорией, пришлось существенно усложнить эксперимент. Теперь вместо использования стабильных ядер в качестве материала мишени были выбраны тяжёлые изотопы трансурановых элементов (такие как плутоний-244 или кюрий-248), полученные в высокопоточном ядерном реакторе. Мишени из этих материалов подвергались бомбардировке ускоренными ионами кальция-48, исключительно редкого и дорогого изотопа природного кальция. Содержание кальция-48 в естественной смеси по отношению к основному изотопу кальцию-40 составляет всего 0.2%. Преимущества этой реакции прямо следуют из сравнения результатов экспериментов по синтезу 113-го элемента Nh, проведённого в RIKEN (Япония) и 114-го элемента Fl – в ОИЯИ (Дубна). Элемент Nh был синтезирован при слиянии ядер висмута-209 и цинка-70 [9]. Составная система после слияния двух атомных ядер содержит 113 протонов и 165 нейтронов. В этой реакции в течение девяти лет были получены три атома 113-го элемента. Элемент Fl (Z = 114), полученный в Дубне в реакции плутоний-244 + кальций-48, имел в составном ядре 114 протонов и 178 нейтронов [10] – на 13 нейтронов больше, чем в предыдущем случае. Эти 13 нейтронов, как следует из дальнейшего, и сыграли решающую роль.
В этой реакции в течение девяти лет были получены три атома 113-го элемента. Элемент Fl (Z = 114), полученный в Дубне в реакции плутоний-244 + кальций-48, имел в составном ядре 114 протонов и 178 нейтронов [10] – на 13 нейтронов больше, чем в предыдущем случае. Эти 13 нейтронов, как следует из дальнейшего, и сыграли решающую роль.
Высадка на берег “острова” в северо-западной его части была действительно впечатляющей. Вероятность образования тяжёлого изотопа 114-го элемента оказалась примерно в 500 раз выше, чем 113-го элемента, полученного в RIKEN. Еще более сильное отличие наблюдалось в свойствах ядер, в частности, во временах жизни, измеряемых обычно периодами полураспада. Повышение числа нейтронов на 8 единиц в ядрах, синтезированных с ионами кальция-48, увеличило их период полураспада примерно в 100 тысяч раз! Оба фактора: рост вероятности образования и стабильности ядер демонстрируют сильный эффект “магической” структуры N = 184, даже несмотря на то, что синтезированный изотоп 114-го элемента содержит всего 175 нейтронов. После первых результатов по исследованию изотопов 114-го и 116-го элементов в реакциях с ионами кальция-48 (2000–2002) последующие эксперименты по синтезу других элементов с атомными номерами 115, 117 и 118 были проведены по той же методике с мишенями из америция-243, берклия-249 и калифорния-249 соответственно [11-13]. За 15 лет работы (около 100 тыс. часов облучения мишеней пучком ионов кальция-48) были синтезированы 52 новых изотопа [14] от 104-го до 118-го элементов (рис. 2, а). На карте нуклидов они простираются до ядер массой 294 а.е.м. (рис. 2, б). Это предельно тяжёлое ядро было получено в виде двух изобар: как чётно-чётный изотоп 118-го элемента с периодом полураспада около 0.5 миллисекунд и как нечётно-нечётный изотоп 117-го элемента с периодом полураспада около 50 миллисекунд. Оба периода полураспада в ядерном масштабе – огромные времена! Учитывая, что после образования нового ядра за время 10-14–10-13 секунды вокруг него выстраивается вся электронная система атома, то подобный вывод можно сделать и о существовании элементов.
После первых результатов по исследованию изотопов 114-го и 116-го элементов в реакциях с ионами кальция-48 (2000–2002) последующие эксперименты по синтезу других элементов с атомными номерами 115, 117 и 118 были проведены по той же методике с мишенями из америция-243, берклия-249 и калифорния-249 соответственно [11-13]. За 15 лет работы (около 100 тыс. часов облучения мишеней пучком ионов кальция-48) были синтезированы 52 новых изотопа [14] от 104-го до 118-го элементов (рис. 2, а). На карте нуклидов они простираются до ядер массой 294 а.е.м. (рис. 2, б). Это предельно тяжёлое ядро было получено в виде двух изобар: как чётно-чётный изотоп 118-го элемента с периодом полураспада около 0.5 миллисекунд и как нечётно-нечётный изотоп 117-го элемента с периодом полураспада около 50 миллисекунд. Оба периода полураспада в ядерном масштабе – огромные времена! Учитывая, что после образования нового ядра за время 10-14–10-13 секунды вокруг него выстраивается вся электронная система атома, то подобный вывод можно сделать и о существовании элементов. Из данных экспериментов следует, что мы не дошли до предела масс ядер. Определённо, ядра могут иметь массу более 300 а.е.м., а количество элементов может быть свыше 118.
Из данных экспериментов следует, что мы не дошли до предела масс ядер. Определённо, ядра могут иметь массу более 300 а.е.м., а количество элементов может быть свыше 118.
Рис. 2, а. Таблица Менделеева (площадь 150 м2). на фасаде химического факультета Университета в городе Мурсия (Испания, 2017). В красной рамке показаны элементы, полученные с пучком кальция-48. |
Рис. 2, б. Область конца карты нуклидов: показаны изотопы от свинца до элемента 118. Красными квадратами обозначены самые тяжелые ядра: с массой 252 а.е.м. (No, 1962) и 294 а.е.м. (Og, 2004), полученные впервые в Лаборатории ядерных реакций ОИЯИ. Желтым цветом показана область ядер, полученных в реакциях с использованием мишеней из свинца и висмута. Розовое поле – область ядер синтезированных в реакциях с пучком ионов кальция-48.  Фон – карта потенциальной энергии ядер в зависимости от содержания протонов и нейтронов, полученная в расчетах макро-микроскопической модели. Цифры и цвет указывают амплитуду структурной поправки (в МэВ) к жидко-капельной энергии ядра. Фон – карта потенциальной энергии ядер в зависимости от содержания протонов и нейтронов, полученная в расчетах макро-микроскопической модели. Цифры и цвет указывают амплитуду структурной поправки (в МэВ) к жидко-капельной энергии ядра. |
Заключая краткий экскурс в мир сверхтяжёлых, можно отметить, что уйдя от висмута, последнего стабильного элемента, в область больших масс и зарядов, мы наблюдаем удивительную живучесть атомных ядер. В области предельных кулоновских сил дополнительные связи протонов и нейтронов структурного свойства создают в тяжёлом ядре барьер деления и делают тем самым возможным существование сверхтяжёлых элементов.
Эксперименты проводились в Дубне на ускорителе У400 Лаборатории ядерных реакций им. Г.Н. Флерова (ОИЯИ) в сотрудничестве с ВНИИЭФ (Саров, Россия), НИИАР (Димитровград, Россия), а также с Ливерморской и Ок-Риджской национальными лабораториями (США), взявшими на себя труд по наработке мишенного материала и участвовавшими в ряде экспериментов.
ТЯЖЕЛЕЙШИЕ АТОМЫ И ХИМИЯ СВЕРХТЯЖЁЛЫХ ЭЛЕМЕНТОВ
На фотографии (см. рис. 2, а) изображена самая большая (150 м2) Периодическая таблица химических элементов, встроенная в фасад химического факультета Университета г. Мурсия (Испания).** На ней красной рамкой выделены сверхтяжёлые элементы от 112-го до 118-го, полученные в реакциях с кальцием-48, когда в качестве материала мишени использовались тяжёлые изотопы от урана (Z = 92) до калифорния (Z = 98), соответственно***.
В белой рамке находятся дочерние нуклиды – продукты альфа-распада ядер из красной рамки. Они заполняют практически все оставшиеся клетки 7-го периода, вплоть до резерфордия (Z = 104). Дочерние ядра, берущие начало от нейтронно-избыточных материнских изотопов сверхтяжёлых элементов, тоже обогащены нейтронами, что значительно повышает их период полураспада и открывает широкие возможности для исследования химических свойств транс-актиноидов. Подобные исследования элементов, особенно конца 7-го периода, представляют большой интерес. Их химическое поведение может отличаться от более лёгких гомологов из-за релятивистского возрастания массы электронов с ростом заряда ядра. В более лёгких элементах релятивистский эффект проявляется в свойствах благородных металлов: золото – мягкий металл жёлтого цвета – не окисляется, ртуть тоже металл, но жидкий при комнатной температуре. Благородные металлы способны взаимодействовать друг с другом и создавать соединения типа ртуть/золото (амальгама ртути и золота). С увеличением атомного номера элемента и приближением скорости электронов к скорости света эффект будет быстро возрастать, вследствие чего химическое поведение сверхтяжёлых элементов, например, 112-го элемента (Cn), может отличаться от своего лёгкого гомолога – ртути (Hg). В первом эксперименте, проведённом в Дубне (2007), исследовалась именно эта пара гомологов [15]. Измерялась адсорбция Cn и Hg на поверхности золота (Au) при различной температуре на предмет наблюдения различия в образовании соединений [Au-Hg] и [Au-Cn].
Подобные исследования элементов, особенно конца 7-го периода, представляют большой интерес. Их химическое поведение может отличаться от более лёгких гомологов из-за релятивистского возрастания массы электронов с ростом заряда ядра. В более лёгких элементах релятивистский эффект проявляется в свойствах благородных металлов: золото – мягкий металл жёлтого цвета – не окисляется, ртуть тоже металл, но жидкий при комнатной температуре. Благородные металлы способны взаимодействовать друг с другом и создавать соединения типа ртуть/золото (амальгама ртути и золота). С увеличением атомного номера элемента и приближением скорости электронов к скорости света эффект будет быстро возрастать, вследствие чего химическое поведение сверхтяжёлых элементов, например, 112-го элемента (Cn), может отличаться от своего лёгкого гомолога – ртути (Hg). В первом эксперименте, проведённом в Дубне (2007), исследовалась именно эта пара гомологов [15]. Измерялась адсорбция Cn и Hg на поверхности золота (Au) при различной температуре на предмет наблюдения различия в образовании соединений [Au-Hg] и [Au-Cn]. Наблюдаемое смещение пика адсорбции в область более низких температур было первым прямым экспериментальным наблюдением релятивистского эффекта в транс-актиноидах. В целом, 112-ый элемент продемонстрировал свою принадлежность 12-й группе Таблицы Менделеева. Но из результатов этого эксперимента и проведенных недавно расчетов [16] были выявлены также отличия физико-химических свойств Cn и Hg, в частности, в температурах их фазовых переходов. Как известно, температура плавления ртути составляет -38.8 °С, температура кипения 353.7 °С, в то время как расчетные значения для Сn заметно отличаются: 10 °С и 67 °С, соответственно. При комнатной температуре, с учетом погрешности измерений, 112-ый элемент будет либо сильно летучей жидкостью, либо газообразным.
Наблюдаемое смещение пика адсорбции в область более низких температур было первым прямым экспериментальным наблюдением релятивистского эффекта в транс-актиноидах. В целом, 112-ый элемент продемонстрировал свою принадлежность 12-й группе Таблицы Менделеева. Но из результатов этого эксперимента и проведенных недавно расчетов [16] были выявлены также отличия физико-химических свойств Cn и Hg, в частности, в температурах их фазовых переходов. Как известно, температура плавления ртути составляет -38.8 °С, температура кипения 353.7 °С, в то время как расчетные значения для Сn заметно отличаются: 10 °С и 67 °С, соответственно. При комнатной температуре, с учетом погрешности измерений, 112-ый элемент будет либо сильно летучей жидкостью, либо газообразным.
Но это первый звонок. Дальнейшее увеличение заряда ядра будет более ощутимым. Поэтому, спустя 100 лет после открытия Вильямом Рамзаем радона (1904) [17], последнего до 2004 года представителя семейства благородных газов 18 группы таблицы, мы задаемся сегодня вопросом: а будет ли 118-ый элемент благородным газом? Релятивистский эффект сильнее проявляется на ближайших к ядру электронах, скорость которых максимальна [18-20], что приводит к сжатию внутренних орбит (рис. 3, а). Для внешних электронов “релятивистское сжатие” приводит к экранированию положительного заряда ядра. В этой ситуации необходимо учитывать (пока в виде малых поправок) взаимодействие внешних электронов друг с другом, которое мало в природных элементах и которым пренебрегают в нерелятивистских расчётах. Нетрудно предвидеть, что роль этих поправок будет быстро возрастать с увеличением атомного номера в сверхтяжёлых элементах. Сам расчёт поправок – по сути, задача многих тел – требует огромных вычислительных мощностей. Большие надежды здесь связаны с квантовым компьютером. А пока доступными средствами в различном приближении отрабатываются методы расчёта на известных атомах, которые затем используются для предельно тяжёлых систем. Релятивистский расчёт элементов 18-й группы показывает, что пространственное распределение внешних электронов 118-го элемента [21] существенно размыто по сравнению с радоном и тем более с ксеноном (рис. 3, б). Подобная картина воспроизводится в расчётах В.М.
 Шабаева и его коллег [22], но указывается одновременно, что 118-й элемент на 94% будет благородным газом. Возможно, и не газом, а твёрдым телом при комнатной температуре [16,23].
Шабаева и его коллег [22], но указывается одновременно, что 118-й элемент на 94% будет благородным газом. Возможно, и не газом, а твёрдым телом при комнатной температуре [16,23].
Рис. 3, а. Расчетная плотность электронов 118-го элемента (Og) в зависимости от радиуса (логарифмическая шкала) в двух вариантах расчета: в релятивистском (синяя кривая) и не релятивистском (красный пунктир) приближениях. Цифрами на графике указаны электронные оболочки (периоды). Видно сильное сжатие внутренних электронных оболочек, в то время как средний радиус внешних (валентных) электронов мало меняется |
Рис. 3, б. Пространственные распределения (функции локализации) электронов 118-го элемента (Og), полученные в работе [20]. Хорошо видно размытие внешних электронов в сравнении с его гомологами — радоном и ксеноном |
На примере 118-го элемента можно видеть, что в конце 7-го периода у элементов, именуемых сегодня сверхтяжёлыми, появляются отличные от лёгких гомологов признаки. Экспериментальные данные, к сожалению, весьма скудны прежде всего из-за малого количества сверхтяжёлых элементов и короткого времени их жизни. Одно из направлений будущих исследований нацелено на изучение атомной структуры и химических свойств уже синтезированных сверхтяжёлых элементов на новом оборудовании (см. далее).
Экспериментальные данные, к сожалению, весьма скудны прежде всего из-за малого количества сверхтяжёлых элементов и короткого времени их жизни. Одно из направлений будущих исследований нацелено на изучение атомной структуры и химических свойств уже синтезированных сверхтяжёлых элементов на новом оборудовании (см. далее).
Пока не видно принципиальных ограничений для синтеза 119-го и 120-го элементов – начала 8-го периода таблицы. Несмотря на то, что попытки их получения на старых установках в реакциях с ионами титана, хрома и даже железа, предпринятые в разных лабораториях, не увенчались успехом [24-26], это остаётся делом техники. Сложнее будет изучать их химические свойства из-за короткого периода полураспада, исчисляемого долями миллисекунды. Но здесь не ожидается сюрпризов. Большой скачок в химии будет иметь место при переходе от 118-го к 119-му элементу (от последней колонки таблицы к первой). По всей вероятности, 120-й элемент также в целом будет следовать своим лёгким гомологам второй колонки. Отклонения начнутся, скорее всего, после 121-го элемента с различными сценариями дальнейшего продолжения таблицы (рис. 4). Элемент 122 либо откроет новую серию так называемых супер-актиноидов [27], включающую ещё 33 элемента вплоть до 155-го, либо 122-й элемент и все последующие продолжат 8-й период. Но в этом случае групповое различие элементов начнёт быстро исчезать (размываться). Пока же остается только гадать, как будет выглядеть химия атомных гигантов за пределами периодического закона.
Рис. 4. Таблица Д.И. Менделеева с различными вариантами релятивистских расчетов. В синей рамке – сверхтяжёлые элементы, полученные в реакциях с пучком ионов кальция-48. |
ФАБРИКА СВЕРХТЯЖЁЛЫХ ЭЛЕМЕНТОВ
После открытия новых элементов, расположенных на “острове” стабильности, дальнейшее развитие исследований в этой области связано прежде всего с получением сверхтяжёлых нуклидов в значительно бóльших количествах. Спустя 10 лет после первых экспериментов по синтезу 114-го и 116-го элементов по результатам, полученным в опытах с пучком ионов кальция-48, а также в связи с общим прогрессом в смежных областях науки и техники стало ясно, что светимость экспериментов может быть существенно увеличена. Поэтому с 2012 г. мы сильно сократили экспериментальную программу на действующих установках и стали строить новую лабораторию – Фабрику cверхтяжёлых элементов, которая пока не имеет мировых аналогов. Она определяет и тем самым отражает технический уровень всех этапов работы по получению сверхтяжёлых элементов от создания мишеней из трансурановых элементов до доставки сверхтяжёлых нуклидов к экспериментальным физическим и химическим установкам. По достижению проектных параметров возможности Фабрики СТЭ будут превосходить современный уровень в 50–100 раз.
Новый комплекс с инфраструктурой для работы с высокорадиоактивными материалами расположен в отдельном строении (рис. 5, а). Там же находится новый сильноточный ускоритель тяжелых ионов – циклотрон DC-280 [28], пуск которого состоялся в марте 2019 года (рис. 5, б). Ускоритель доставляет пучки ионов в три экспериментальных зала, где размещаются сепарирующие каналы, химические и физические установки, а также другое экспериментальное оборудование. В настоящее время идет наладка нового сепаратора и подготовка первого эксперимента.
Рис. 5, а. Строение ускорительного комплекса «Фабрики СТЭ» |
Рис. 5, б. Ускоритель тяжелых ионов — циклотрон DC-280 |
ЭПИЛОГ
За прошедшие 80 лет после открытия нептуния и плутония (1940) – первых искусственных элементов – Периодическая таблица пополнилась ещё 24 рукотворными элементами. Пять самых тяжёлых из них заняли своё место в таблице в последние семь лет. Искусственных элементов, как известно, в природе нет. А сверхтяжёлых элементов, скорее всего, не было и при зарождении Солнечной системы. Они получены в лабораториях в совершенно других условиях (реакциях), чем природные химические элементы. Однако все известные сегодня 118 элементов располагаются в единой таблице в строгом соответствии с периодическим законом, открытым Дмитрием Ивановичем Менделеевым 150 лет назад.
Между тем Международный год Периодической таблицы — IYPT2019, начавший своё шествие в ЮНЕСКО 29 января 2019 г., закончился в Токио (Япония) 5 декабря. Огромное количество статей в научных, научно-популярных и совсем не научных изданиях, удивительный всплеск очень интересных работ в области ядерной физики, химии, атомной физики, астрофизики, истории науки – все посвященные 150-летию открытия Периодической таблицы химических элементов. Год был встречен с невероятным энтузиазмом не только научным миром, но и широкой общественностью. Форумы, конференции, симпозиумы, лекции, собрания научных обществ, академий наук многих стран мира, везде по-разному, но всегда одухотворенно и очень интересно.
Что-то объединяет людей. Быть может, также великие открытия и любовь к науке.
* В то же время в нашей стране теорию ядерного деления независимо развивал Я.И. Френкель [5].
** С 2019 года самая большая периодическая Таблица элементов (660 м2) находится в Австралии в государственном университете Эдит Коуэн (ECU) в г. Перт.
*** К сожалению, калифорний – самый тяжёлый элемент, который может быть получен в ядерном реакторе в количестве, необходимом для изготовления мишени. Для синтеза 119 элемента и более тяжелых придется увеличивать массу и заряд бомбардирующих ионов.
Литература
1. Gamov G. Discussion оn the structure of atomic nuclei// Proc. of the Royal Society A. 1929. № 123. P. 386–387.
2. Gamov G. Zur Quantentheorie des Atomkernes // Zeitschrift fur Physik. 1928. V. 51. № ¾. P. 204–212.
3. Von Weizsäcker C.F. Zur Theorie der Kernmassen// Zeitschrift fur Physik. 1935. V. 96. P. 431.
4. Bohr N., Weeler J.A. The Mechanism of Nuclear Fission // Phys. Rev. 1939. V. 56. P. 426–450.
5. Френкель Я.И. Электрокапиллярная теория расщепления тяжёлых ядер медленными нейтронами // ЖЭТФ. 1939. № 6. С. 641–653.
6. Flerov , Petrjak . Spontaneous Fission of Uranium // Phys. Rev. 1940. V. 58. Р. 89.
7. Seaborg G.T., Loveland W.D. Transuranium Nuclei // Treatise on Heavy-Ion Science / Edited by D.A. Bromley. V. 4. P. 289. N.Y.: Plenum Press, 1985.
8. Polikanov S.M., Druin A.V., Karnaukhov V.A. et al. Spontaneous fission with an anomalously short period // Soviet Physics JETP-USSR. 1962. № 15(6). P.1016–1021.
9. Morita K., Morimoto K., Kaji D. et al. Experiment on the Synthesis of Element 113 in the Reaction 209Bi (70Zn,n)278113 // J. Phys. Soc. Jpn. 2004. V.73. P. 2593–2596.
10. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al., Synthesis of Superheavy Nuclei in the 48Ca+244Pu Reaction // Phys. Rev. Lett. 1999. V. 83. P. 3154–3157.
11. Oganessian Yu.Ts., Utyonkoy V.K., Lobanov Yu.V. et al. Experiments on the synthesis of element 115 in the reaction 243Am(48Ca,xn)291−x115 // Phys. Rev. C. 2004. V. 69. № 021601(R).
12. Oganessian Yu.Ts., Abdullin F.Sh., Bailey P.D. et al. Synthesis of a New Element with Atomic Number Z=117 // Phys. Rev. Lett. 2010. V. 104. № 142502.
13. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al. Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions // Phys. Rev. C. 2006. V. 74. № 044602.
14. Oganessian Yu.Ts., Utyonkov V.K. Super-heavy element research // Rep. Prog. Phys. 2015. V. 78. № 036301.
15. Eichler R., Aksenov N.V., Belozerov A.V. et al. Chemical characterization of element 112 // Nature. 2007. V. 447. P. 72–75.
16. Mewes J.-M., Smits O. R., Kresse G. et al. Copernicium: A Relativistic Noble Liquid // Angew. Chem. Int. Ed.2019. V.58, P.17964 – 17968
17. Ramsay W., Soddy F. Further Experiments on the Production of Helium from Radium // Proceedings of the Royal Society of London (1854–1905). 1904. V. 73. P. 346–358.
18. Pershina V. Relativity in the electronic structure of the heaviest elements and its influence on periodicities in properties // Radiochimica Acta. 2019. V. 107. Р. 833–864.
19. Eliav E., Borschevsky A., Kaldor U. Electronic Structure at the Edge of the Periodic Table // Nuclear Physics News. 2019. V. 29. Р. 16–20.
20. Lackenby B.G.C., Dzuba V.A, Flambaum V.V. Atomic structure calculations of superheavy noble element oganesson (Z=118) // Phys.Rev. A. 2018. V. 98. P. 042512.
21. Jerabek P., Schuetrumpf B., Schwerdtfeger P., Nazarewicz W. Electron and Nucleon Localization Functions of Oganesson: Approaching the Thomas-Fermi Limit// Phys. Rev. Lett. 2018. V. 120. Р. 053001.
22. Shabaev V.M., Tupitsyn I.I., Kaygorodov M.Y., Kozhedub Y.S. Localisation of electron states of Oganesson atoms // The 4th International Symposium on Superheavy Elements (SHE2019). Hakone, Japan. Dec.1–5, 2019
23. Giuliani S. A., Matheson Z., Nazarewicz W. et al., Colloquium: Superheavy elements: Oganesson and beyond// Rev. Mod. Phys. 2019. V. 91. No. 1. P.01100.
24. Düllmann C.E. Superheavy Element Research at TASCA at GSI // Fission and Properties of Neutron-Rich Nuclei. 2013. V. 44. Р. 271–277.
25. Hofmann S., Heinz S., Mann R. et al. Review of even element super-heavy nuclei and search for element 120 // Eur. Phys. J. A. 2016. V. 52. Р. 180.
26. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al. Attempt to produce element 120 in the 244Pu+58Fe reaction // Phys. Rev. C. 2009. V. 79. Р. 024603.
27. Borschevsky A., Pershina V., Eliav E., Kaldor U. Ab initio predictions of atomic properties of element 120 and its lighter group-2 homologues // Phys. Rev. A. 2013. V. 87. P. 022502.
28. Gulbekian G.G., Dmitriev S.N., Itkis M.G. et al. Start-Up of the DC-280 Cyclotron, the Basic Facility of the Factory of Superheavy Elements of the Laboratory of Nuclear Reactions at the Joint Institute for Nuclear Research // Physics of Particles and Nuclei Letters. 2019. V. 16(6). Р. 866–875.
Таблица Менделеева: проверено временем
Этот год объявлен ЮНЕСКО Международным годом Периодической таблицы химических элементов в честь 150-летнего юбилея со дня открытия Дмитрием Ивановичем Менделеевым периодического закона, определившего дальнейшее развитие химии, физики и других наук. О том, как Периодическая таблица Менделеева помогает химикам сегодня, нам рассказали сотрудники кафедры физической химии – одной из старейших кафедр университета.
04.04.2019 3318
Первое обнародование Периодической таблицы Дмитрия Ивановича Менделеева состоялось 6 марта 1869 года на заседании Русского физико-химического общества. Множество последующих открытий и новых концепций в физике, химии и других науках опиралось на закономерности Периодической таблицы. Кафедра химии в ЛЭТИ была создана почти через три десятка лет после великого открытия Дмитрия Ивановича. Её основал в 1891 году доктор химических наук, профессор Александр Александрович Кракау. Курс «Физическая химия» ввёл основатель физико-химического анализа академик Николай Семёнович Курнаков. В разные годы здесь работали: создатель отечественной электрометаллургической промышленности проф. Максимилиан Степанович Максименко, проф. Николай Антонович Пушин, впервые получивший электролитическим способом алюминий из отечественного сырья, создатель термодинамической шкалы твёрдости профессор Борис Филиппович Ормонт, при котором кафедра была переименована в кафедру физической химии.
С приходом на заведование члена-корреспондента РАН Виктора Владимировича Гусарова кафедра после почти 80-летнего перерыва опять стала выпускающей. На ней осуществляется подготовка магистров по программе «Биосовместимые материалы» в рамках направления «Биотехнические системы и технологии», а также аспирантов по специальности «Физическая химия». Образовательную и научную деятельность осуществляют как преподаватели ЛЭТИ, так и учёные из ведущих научно-исследовательских институтов Санкт-Петербурга и Ленинградской области. Так, сотрудни- ками кафедры под руководством В.В. Гусарова в рамках совместной работы с коллективами НИТИ имени А.П. Александрова, СПб АЭП и проектно-конструкторского филиала концерна «Росэнергоатом» по разработке и обоснованию работоспособности отечественного устройства локализации расплава активной зоны ядерного реактора (ловушки расплава) был создан новый класс функциональных материалов – жертвенный материал. Он призван именно «пожертвовать собой», чтобы минимизировать последствия тяжёлых аварий на атомных станциях. Впервые в мире он был внедрён при строительстве АЭС в Китае, затем – в Индии, потом – в России.
На кафедре ведутся работы над созданием оксидных катализаторов (в том числе, для нужд атомной энергетики), нанокомпозиционных материалов (группа доцента А.Н. Бугрова), изучаются механизмы формирования наночастиц, свойства и области применения фуллеренов и фуллеренолов (группа профессора Н.А. Чарыкова). Об этом нам рассказала заведующая кафедрой физической химии ЛЭТИ, доктор химических наук Оксана Владимировна Альмяшева. Сама она принимала участие в разработке новых катализаторов окисления водорода для пассивной системы безопасности АЭС, позволяющих понизить вероятность образования и взрыва гремучей смеси в реакторном пространстве. В итоге разработанный научной группой химического конструирования материалов нанокомпозиционный катализатор превзошёл по ключевым параметрам более дорогие, используемые в настоящее время платино-палладиевые катализаторы.
По словам сотрудников кафедры, без использования периодического закона Д.И. Менделеева невозможно себе представить процесс конструирования новых материалов с требуемым набором свойств. Вот что рассказал начальник отдела исследований тяжёлых аварий НИТИ имени А.П. Александрова, преподаватель спецкурса для магистрантов кафедры физической химии Вячеслав Исхакович Альмяшев, принимавший непосредственное участие в разработке жертвенных материалов:
– После техногенной катастрофы на Чернобыльской АЭС стало понятно, что атомные станции помимо активных систем безопасности должны иметь такие системы, которые на уровне физико-химических процессов без участия оперативного персонала существенно понижали бы вероятность выхода радиоактивных материалов за пределы реакторного пространства, даже в случае таких серьёзных аварий, как тяжелая авария с расплавлением активной зоны. К таким системам (пассивным системам безопасности) относится и ловушка расплава, в качестве функционального наполнителя которой выступает разработанный нами жертвенный материал. Его назначение – изменить свойства поступающего в ловушку расплава таким образом, чтобы обеспечить благоприятные условия его охлаждения и кристаллизации в корпусе ловушки. Разработка любого материала начинается с выбора элементного состава, то есть с анализа Периодической системы Д.И. Менделеева. Далее осуществляется термодинамический анализ и выбор оптимальной композиции. В курсе «Физико-химическое конструирование биосовместимых материалов» я прививаю студентам навыки обоснования выбора элементного состава и структуры материалов для направленного получения совокупности свойств, требуемых для решения поставленной задачи. В иных курсах программы «Биосовместимые материалы» ребята получают опыт синтеза материалов.
Сегодня происходит смена технологического уклада. Наиболее важные и заметные открытия происходят на стыке наук и опираются на использование новых материалов, конструирование которых начинается с атомного уровня. Оно немыслимо без понимания Периодической таблицы Менделеева.
Лидия Березнякова
«Все имеет начало, и все имеет конец. Атомы тоже». Юрий Оганесян о том, как получают короткоживущие изотопы, соблюдении предсказанных Менделеевым закономерностей и о прикладном значении элементов с «острова стабильности»
Элементы, и почему их сложно собрать в таблицу
Химический элемент — это множество атомов с одинаковым числом протонов в ядре (а вот число нейтронов может отличаться). Число протонов определяет число электронов, которые расположены вокруг ядра, а число электронов, в свою очередь, задает свойства атома и то, как он будет взаимодействовать с другими атомами. С точки зрения квантовой механики, которая описывает поведение электронов в атоме, периодическая таблица устроена очень просто и логично, вот только во времена Менделеева об электронах и квантовой механике еще никто даже не слышал.
Сложности, которые стояли перед ученым, были не только в отсутствии теоретической базы. Сегодня можно было бы сказать, что закономерности в свойствах элементов очевидны. Так, щелочные металлы — литий, натрий и калий, к примеру, — все как один реагируют с водой и легко вступают в химические реакции. Инертные газы столь же дружно отказываются реагировать с чем-либо, по крайней мере, в нормальных условиях. Фтор, хлор и прочие галогены — все окислители, а идущие подряд лантаноиды и актиноиды (две нижние строчки в стандартной школьной таблице) — металлы. Заметить это кажется несложным, но вот только в 1869 году половина мест в таблице пустовала. Впрочем, и самой-то таблицы не было: первый известный экземпляр изготовили в 1876 году. Сейчас она находится в Большой химической аудитории СПбГУ.
Самая старая в мире таблица Менделеева, висящая на стене Большой химической аудитории СПбГУ. Пресс-служба СПбГУ
Не было ни информации об инертных газах, ни даже понятного метода определения порядкового номера элемента (это сейчас мы знаем, что он равен числу протонов). Существовала путаница с лантаноидами, редкоземельными металлами: их часто путали, не могли разделить за неимением должных технологий. Даже сам лантан, благодаря которому вся эта группа элементов получила свое название, в чистом виде получили лишь в 1923 году.
Работа в условиях неполной информации и отсутствия атомной теории была гораздо сложнее, так что открытие Менделеевым периодического закона стало настоящей сенсацией.
Дальше и больше
Сейчас ученым известно 118 идущих подряд элементов — от водорода до оганесона. На тему расширения таблицы «Чердак» поговорил с исследователем, который непосредственно связан даже не с одним, а сразу со многими новыми элементами. Юрий Цолакович Оганесян, научный руководитель Лаборатории ядерных реакций имени Г.Н. Флёрова в Объединенном институте ядерных исследований в Дубне, человек, в честь которого назван 118-й элемент, рассказал о том, зачем нужно расширять таблицу Менделеева.
Профессор Объединенного института ядерных исследований (ОИЯИ), академик Юрий Оганесян перед началом заседания организационного комитета по проведению в 2019 году Международного года Периодической таблицы химических элементов в здании Президиума РАН. Фото: Сергей Бобылев / ТАСС
[Ch.]: Вряд ли в позапрошлом столетии кто-то себе представлял, на что будут похожи новые элементы в нижней части таблицы. А они всё появляются и появляются. Есть ли вообще теоретический верхний предел для размера атома?
[ЮО]: Все имеет начало, и все имеет конец. Атомы тоже. Согласно строгой теории квантовой электродинамики, мир атомов (элементов) кончается на атомных номерах 172-174. На самом деле, из-за релятивистского эффекта «роста массы» электрона при скорости, близкой скорости света, предел может наступить гораздо раньше. Сейчас этот вопрос исследуют теоретики. Потом последуют эксперименты.
[Ch.]: Обычному человеку сложно себе представить, как получают и изучают короткоживущие изотопы, ведь иногда они живут крохотные доли секунды. А существует ли теоретическая вероятность, что когда-нибудь будут получены более стабильные изотопы тяжелых элементов?
[ЮО]: Изотопы новых элементов получают в ядерных реакциях, посредством слияния их ядер. Изучают новые нуклиды с помощью экспрессных методик, способных выделить новое сверхтяжелое ядро из триллиона других ядер — побочных продуктов реакции. Современная техника эксперимента применима к изотопам, время жизни которых — не более микросекунды.
По всей вероятности, новые элементы получены будут. Синтезированные в последние годы сверхтяжелые элементы от 114-го до 118-го находятся на берегу так называемого острова стабильности. В вершине этого острова изотопы, обогащенные нейтронами, могут жить, согласно теории, сотни тысяч и даже миллионы лет. Путь к вершине будет знаменоваться резким подъемом стабильности. Не исключено, что «долгожители» будут найдены в космосе. Сейчас на эту тему много дискуссий.
[Ch.]: Мы легко можем себе представить железо или кремний, потому что они существуют в привычном нам большом количестве и потому тоже кажутся «представимыми». Но как представить себе тяжелые элементы, если они не образуют вещество в привычном нам виде?
[ЮО]: Под «привычным видом» подразумевается, видимо, большое количество вещества. На самом деле, в этом нет острой необходимости. И хотя представить себе эти элементы в очень большом количестве нельзя, штучные атомы уже дают нам такие характеристики, как температура плавления или температура кипения. Для этого не нужны миллиарды (а если говорить про видимые количества, то это даже не миллиарды, а триллионы) атомов. Принятые в макромире критерии прямо в микромире, основе основ, не работают. Но в современной науке субатомных количеств вполне достаточно для определения физических и химических свойств вещества. Электронная структура самого атома, соединение атомов в молекулы и далее — все это происходит под действием электромагнитных сил и описывается квантовой электродинамикой. Это строгая теория, с ее помощью можно рассчитать и большую электростанцию, и крошечный микрочип, и она позволяет сначала рассчитать, а потом сделать. К сожалению, в ядерной физике, где работают ядерные силы, нам пока неизвестные, мы вынуждены использовать различные модели. Области их применения ограничены, а предсказания иногда противоречивы.
[Ch.]: Соблюдаются ли закономерности, обнаруженные Менделеевым, в последних элементах? Что вообще будет дальше, как вы думаете? Как будет заполняться знаменитая таблица?
[ЮО]: Химические свойства вещества определяются характеристиками последнего электрона в атоме, характер взаимодействия которого с другими атомами, или химическое поведение элемента, можно отнести, согласно Менделееву, к одной из восьми групп. Насколько выполняется это правило, когда число элементов со времен Менделеева возросло с 63 до 118? Этим по сей день занимаются исследователи во многих лабораториях мира.
Менделееву были известны только природные элементы. Все элементы тяжелее 92-го, урана, рукотворны, созданы человеком. Химическое поведение всех последующих 20 искусственных элементов до 112-го включительно следует их легким гомологам, полученным в природном синтезе. Некоторые отличия начинают наблюдаются у 112-го и сильнее — у 114-го элемента. Эти отличия связывают с влиянием так называемого релятивистского эффекта, обусловленного релятивистским ростом массы электрона в сильном электрическом поле тяжелейших атомов. С ростом атомного номера релятивистский эффект быстро возрастает. Согласно теории, это обстоятельство приведет к размытию периодичности в этих элементах, а потом и к исчезновению групповых различий.
[Ch.]: Можно ли будет говорить о прикладном значении элементов с острова стабильности?
[ЮО]: Нет, к счастью или к сожалению. Для прямого применения наших результатов может быть важно не то, что искали, а то, что мы находим по пути к заветной цели. Сами элементы в своих штучных количествах не имеют практического применения. Но они непредсказуемо меняют наши представления, наше мировоззрение, если угодно, и это их основное назначение.
Редакция «Чердака»
Актиний – (Ac) – Химические свойства, воздействие на здоровье и окружающую среду
Актиний
Актиний – это серебристый радиоактивный металлический элемент. Актиний светится в темноте из-за своей высокой радиоактивности синим светом.
Актиний был открыт в 1899 году французским химиком Андре-Луи Дебьерном, который отделил его от урановой обманки. Фридрих Отто Гизель независимо открыл актиний в 1902 году.Химическое поведение актиния сходно с поведением редкоземельного лантана.
Слово «актиний» происходит от греческого «актис», «актинос», что означает луч или луч.
Приложения
Он примерно в 150 раз радиоактивнее радия, что делает его ценным источником нейтронов. В остальном он не имеет значительного промышленного применения.
Актиний-225 используется в медицине для производства Bi-213 в многоразовом генераторе или может использоваться отдельно в качестве агента для радиоиммунотерапии.
Актиний в окружающей среде
Он обнаруживается только в следовых количествах в урановых рудах в виде 227-Ac, альфа- и бета-эмиттера с периодом полураспада 21,773 года. Одна тонна урановой руды содержит около десятой грамма актиния. Актиний содержится в следовых количествах в урановой руде, но чаще всего его получают в миллиграммах путем нейтронного облучения 226-Ra в ядерном реакторе. Металлический актиний был получен восстановлением фторида актиния парами лития при температуре от 1100 до 1300 ° C.
Актиний, встречающийся в природе, состоит из 1 радиоактивного изотопа; наиболее распространенным является 227-Ас (100% естественное содержание). Было охарактеризовано 27 радиоизотопов, наиболее стабильным из которых является 227-Ас с периодом полураспада 21,773 года, 225-Ас с периодом полураспада 10 дней и 226-Ас с периодом полураспада 29,37 часа. Все оставшиеся радиоактивные изотопы имеют период полураспада менее 10 часов, а у большинства из них период полураспада менее 1 минуты.Этот элемент также имеет 2 мета-состояния.
Очищенный актиний-227 приходит в равновесие со своими продуктами распада в конце 185 дней, а затем распадается в соответствии со своим периодом полураспада 21,773 года.
Изотопы актиния имеют атомный вес от 206 а.е.м. (206-актиний) до 234 а.е.м. (234-актиний).
Актиний-227 чрезвычайно радиоактивен, и с точки зрения его способности оказывать радиационно-индуцированное воздействие на здоровье актиний-227 примерно так же опасен, как плутоний.Проглатывание даже небольшого количества актиния-227 представляет серьезную опасность для здоровья.
Самая большая угроза радиоактивности для жизни, как мы знаем, – это повреждение генофонда, генетической структуры всех живых существ. Генетический ущерб от радиационного воздействия накапливается в течение жизни и поколений.
Даже низкие дозы являются канцерогенными после длительного воздействия. Нынешнее поколение, живущее в матке, и все последующие могут страдать от рака, иммунной системы, лейкемии, выкидышей, мертворождений, уродств и проблем с фертильностью.Хотя многие из этих проблем со здоровьем растут, люди не могут доказать, что причиной является увеличение «фоновой» радиации или конкретное облучение. Только эпидемиологические данные приемлемы с научной точки зрения для определения причины. Возможно, самым экстремальным результатом со временем будет просто полное прекращение способности к воспроизводству. Радиация – известная причина бесплодия.
Развитие ядерных технологий сопровождалось значительными, а также незначительными выбросами радиоактивности в атмосферу, почву, океаны, моря и грунтовые воды, проявляющиеся во всем мире в виде животных, растений и растений. инертное вещество.Радиация пересекает виды и концентрируется по пищевой цепочке, подвергая других животных и людей своим разрушительным воздействиям.
Актиний-227 чрезвычайно радиоактивен. Радиоактивность повреждает генофонд не только людей, но и всех живых существ, вызывая рак, повреждение иммунной системы, лейкемию, выкидыши, мертворождения, уродства и проблемы с фертильностью. Более того, генетический ущерб от радиационного воздействия накапливается в течение жизни и поколений.
Источники таблицы Менделеева.
Вернемся к периодической таблице элементов .
Йод – Информация об элементе, свойства и применение
Расшифровка:
Химия в ее элементе: йод
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе кретины, крекеры с огнем и чистая вода. История начинается в Италии, а вот и Андреа Селла.
Андреа Селла
Когда я был ребенком, каждое лето я проводил пару недель высоко в итальянских Альпах в идиллической маленькой деревушке под названием Конь, которая тихо приютилась между высокими покрытыми льдом пиками. Для большинства итальянцев это имя ассоциируется с сенсационным убийством.Другие знают, что зимой в долине одни из лучших мест для ледолазания в Альпах. Но для меня Конь всегда будет связан с йодом.
Однажды днем, когда мне было около 10 лет, возвращаясь с отцом из долгой прогулки, мы миновали унылое серое здание на окраине деревни. Он был окружен высоким металлическим забором и выглядел как учреждение. На скамейке в одиночестве сидел странно выглядящий старик – у него были взлохмаченные волосы, пустой взгляд и большой вздутый мешочек кожи на месте шеи.Я был совершенно потрясен этим странным существом. Я приставал к отцу вопросами. Кто он был? Что с ним не так? Почему он выглядел таким грустным?
Мой отец, чье терпение перед шквалом вопросов было почти безграничным, объяснил, что бедняк вырос с недостаточным содержанием йода в рационе. Йод, продолжал он, необходим для правильного развития щитовидной железы шеи, и что, если человек не будет есть правильную соль, особенно в детстве, у него может развиться зоб, а также пострадает умственное развитие. .Позже я читал об английских путешественниках, проходящих через Альпы, о Кретинских долинах – путевые книги того периода часто содержат мрачные иллюстрации этих несчастных. Цифры ошеломляют; Наполеоновская перепись населения кантона Вале в 1800 году обнаружила 4000 кретинов при населении 70 000 человек – более чем у 50% был бы зоб.
Болезнь была известна писателям-медикам на протяжении веков. Гален, например, рекомендовал лечение морскими губками. В 1170 году Роже Салерно рекомендовал морские водоросли.Аналогичные предложения были сделаны и в Китае.
Парацельс, великий целитель, алхимик и писатель эпохи Возрождения, был одним из первых, кто заметил связь между зобом и кретинизмом, и первым предположил, что минералы в питьевой воде могут играть роль в возникновении этого состояния. Но что это за загадочные минералы, оставалось загадкой.
В 1811 году молодой французский химик Бернар Куртуа, работая в Париже, наткнулся на новый элемент. Фирма его семьи производила селитру, необходимую для производства пороха для наполеоновских войн.Для этого использовали древесную золу. Нехватка древесины во время войны вынудила их вместо этого сжигать водоросли, которых было много на побережье северной Франции. Добавив к золе концентрированную серную кислоту, Куртуа получил удивительный фиолетовый пар, который кристаллизовался на стенках контейнера. Пораженный этим открытием, он запаковал кристаллы в бутылки и отправил их одному из ведущих химиков своего времени Жозефу Гей-Люссаку, который подтвердил, что это новый элемент, и назвал его иодом – йод – в честь греческого слова, обозначающего фиолетовый.Куртуа продолжал играть с элементом и был довольно шокирован, обнаружив, что при смешивании с аммиаком он дает твердое вещество шоколадного цвета, которое сильно взрывается при малейшей провокации. Его современнику, Пьеру Дюлонгу, повезло меньше: он потерял глаз и часть руки при изучении материала, став первым в длинном списке жертв из-за этого неприятного материала.
Ядовитые качества йода вскоре были осознаны, и настойка в виде желтовато-коричневого раствора стала широко использоваться в качестве дезинфицирующего средства.Даже сегодня самые распространенные таблетки для очистки воды, которые можно купить в туристических магазинах, основаны на йоде.
Спустя всего два года после его открытия врач из Женевы Франсуа Коиндэ начал задаваться вопросом, не является ли йод в водорослях отсутствующим минералом, ответственным за зоб. Поэтому он начал давать своим пациентам настойку йода перорально, что было неприятным занятием, но, по его словам, это привело к исчезновению опухоли через 6-10 недель. Однако его коллеги обвинили его в том, что он отравил своих пациентов, и в какой-то момент он, как говорят, не мог выходить на улицу из-за страха подвергнуться нападению.
Но, хотя элементарный йод явно был токсичен , Коиндет был на правильном пути, и в течение 19 -го века, сделав один шаг вперед на два шага назад, гипотеза постепенно завоевала доверие по мере экспериментов с более вкусной солью. , йодид калия, показал, что зоб можно вылечить. К началу 1920-х годов швейцарские кантоны начали вводить йодированную соль, и в последующие десятилетия многие страны, страдающие от зоба, последовали их примеру, и эта политика была настолько эффективной, что многие из нас в развитом мире не осознавали, насколько серьезной была эта болезнь слово кретин во многом потеряло свое значение.
Когда я вернулся в Конь прошлым летом, я попытался вспомнить, где был институт. Все, что я смог найти, это летний лагерь для отдыха, где дети весело играли за воротами, где я видел старика. Я позвонил отцу, чтобы спросить его, и мы поговорили о былых временах – плохих старых временах кретинов – и о призраках, изгнанных этим уникальным пурпурным элементом – йодом.
Крис Смит
Призраки, которые явно живут среди британской аристократии. Это химик из Калифорнийского университета в Лос-Анджелесе Андреа Селла рассказывал историю о йоде, элементе номер 53.На следующей неделе мы направим внимание на вещество, которое вообще не нуждается в освещении, потому что оно излучает собственный свет.
Брайан Клегг
Его считали источником энергии и яркости, его использовали в зубных пастах и патентованных лекарствах – его даже втирали в кожу головы как средство для восстановления волос.
Но применение радия, которое принесло ему известность, заключалось в его использовании в светящейся в темноте краске. Жуткое синее свечение радия, часто используемое для обеспечения световых индикаторов на часах, переключателях самолетов и циферблатах приборов, рассматривалось как безвредный и практичный источник ночного освещения.И только когда несколько рабочих, которые красили светящиеся циферблаты, начали страдать от язв, анемии и рака вокруг рта, стало ясно, что что-то не так.
Крис Смит
И вы можете услышать историю радия от Брайана Клегга на следующей неделе в «Химии в его элементе». Надеюсь, вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания.
(Промо)
(Окончание промо)
Частей Периодической таблицы
Периодическая таблица элементов содержит большой объем информации. о свойствах химических элементов.
- Группы: вертикальные столбцы в таблице. Они определяют “семейство” элементов, имеющих сходные химические свойства
- Периоды: горизонтальные строки в таблице с элементами расположены в порядке возрастания атомного номера.
Традиционно в США более высокие группы на столе ( элементы основной группы ) пронумерованы от IA / 1A до VIIIA / 8A.Более короткие группы ( переходные металлы ) пронумерованы. от IB / 1B до VIIIB / 8B. (Использование римских цифр более традиционный, но в этой периодической таблице я решил использовать арабские цифры вместо этого, потому что они могут быть сжаты в периодический HTML-код разумного размера стол проще.)
К сожалению, это не единственный способ пронумеровать столбцы. (Химики например, попробуйте , чтобы все было единообразно, но они часто этого не делают получится!) В Европе традиционная нумерация имеет левую половину таблица пронумерована от Группы IA (H) до VIIIA (Ni), а правая половина периодическая таблица пронумерована от Группы IB (Cu) до VIIB (F), с благородные газы как Группа 0.
Чтобы разрешить эту путаницу, Международный Союз Чистых и Прикладная химия (IUPAC) предложила, чтобы столбцы в периодической таблице были нумеруются последовательно арабскими цифрами от 1 до 18. Хотя это система была принята Американским химическим обществом (ACS), многие химики вместо этого используйте традиционные обозначения A / B, поскольку это более точно отражает валентность элементов в химической связи.
В периодических таблицах этого раздела я использовал традиционную систему, пронумеровав основные группы от 1A до 8A, а переходные металлы как 1B через 8Б.Система нумерации, утвержденная IUPAC, указана в скобках. ниже традиционной нумерации столбцов. Я сместил метки для группы переходных металлов на пару пробелов, чтобы улучшить читаемость Таблица.
Периодическая таблица | Химия [Магистр]
Периодическая таблица
В периодической таблице показаны все элементы и их физические свойства; он устроен на основе атомных номеров и электронных конфигураций.
Цели обучения
Определите общие периодические тенденции, которые можно вывести из периодической таблицы элементов
Основные выводы
Ключевые моменты
- В периодической таблице перечислены все элементы с информацией об их атомном весе, химических символах и атомных номерах.
- Расположение таблицы Менделеева позволяет нам визуализировать определенные тенденции среди атомов.
- Вертикальные столбцы (группы) таблицы Менделеева расположены так, что все ее элементы имеют одинаковое количество валентных электронов.Таким образом, все элементы в определенной группе обладают схожими свойствами.
Ключевые термины
- атомный номер : Число, равное количеству протонов в атоме, которое определяет его химические свойства. Символ: Z .
- группа : Вертикальный столбец в периодической таблице, который обозначает количество электронов валентной оболочки в атоме элемента.
- период : горизонтальная строка в периодической таблице, которая обозначает общее количество электронных оболочек в атоме элемента.
Символы элементов
Периодическая таблица Менделеева представляет собой сетку 18 X 7, расположенную над меньшим двойным рядом элементов. В периодической таблице перечислены только химические элементы, включая каждый изотоп каждого элемента в одной ячейке. В типичной периодической таблице каждый элемент указан по его символу элемента и атомному номеру. Например, «H» обозначает водород, «Li» обозначает литий и так далее. Большинство элементов представлены первой или двумя первыми буквами своего английского названия, но есть некоторые исключения.Два заметных исключения включают серебро и ртуть. Символ серебра – «Ag» от латинского « argentum», «», что означает «серый» или «сияющий». Символ ртути – «Hg» от латинизированного греческого слова hydrargyrum, , что означает «вода-серебро». Многие периодические таблицы также включают полное название элемента и цветовую кодировку элементов в зависимости от их фазы при комнатной температуре (твердое, жидкое или газообразное).
Таблица Менделеева : Таблица Менделеева представляет собой табличное отображение всех химических элементов.Атомы сгруппированы в порядке возрастания атомного номера.
Строки и периоды
Символ элемента почти всегда сопровождается другой информацией, такой как атомный номер и атомный вес. Атомный номер описывает количество протонов в одном атоме этого элемента. Например, атом кислорода содержит 8 протонов. Элементы перечислены в порядке возрастания атомного номера слева направо. Каждая строка периодической таблицы называется периодом, а каждый столбец периодической таблицы называется группой (или семьей).У некоторых групп есть особые названия, такие как галогены или благородные газы. Элементы, относящиеся к одному периоду или группе, имеют схожие свойства.
Определение химических свойств по Периодической таблице
Химические свойства каждого элемента определяются его электронной конфигурацией и, в частности, его внешними валентными электронами. Расположение элемента в периодической таблице в значительной степени зависит от его электронов; количество электронов валентной оболочки определяет его группу, а тип орбитали, на которой находятся валентные электроны, определяет блок элемента.Кроме того, общее количество электронных оболочек атома определяет, к какому периоду он принадлежит. Из-за своей структуры периодическая таблица стала чрезвычайно полезным инструментом для оценки и предсказания тенденций изменения содержания элементов и химии.
Химия 3.1 Введение в Периодическую таблицу – YouTube : Введение в таблицу Менделеева, которая определяет металлы, неметаллы и металлоиды по местоположению, а также сравнивает и сравнивает физические свойства металлов и неметаллов.
Молекулы
Молекулы представляют собой электрически нейтральные соединения, состоящие из нескольких атомов, связанных друг с другом химическими связями.
Цели обучения
Распознавать общие свойства молекул
Основные выводы
Ключевые моменты
- Молекулы нейтральны и не несут заряда.
- Молекула может состоять из неметаллических атомов одного химического элемента, как в случае кислорода (O 2 ), или из различных элементов, как в случае воды (H 2 O).
- Геометрия и состав молекулы будут определять ее химические и физические свойства.
- Изомеры – это молекулы с одинаковыми атомами в разном геометрическом расположении.
Ключевые термины
- ковалентный : когда 2 или более неметаллических атома связаны вместе за счет общих электронов.
- изомер : молекулы с одинаковым числом атомов в разных геометрических формах.
- соединение : когда два или более разных атома удерживаются вместе ковалентной связью.Все соединения являются молекулами, но не все молекулы являются соединениями.
- молекула : два или более атома, которые удерживаются вместе химической ковалентной связью.
Атомы и молекулы
Атом определяется как основная единица материи, которая содержит централизованное плотное ядро, окруженное электронным облаком. Когда два или более атома удерживаются вместе химической ковалентной связью, этот новый объект известен как молекула. Слово «молекула» – это расплывчатый термин, который в разговорной речи имеет разные значения в разных областях исследований.Например, термин «молекулы» используется в кинетической теории газов и относится к любой газовой частице независимо от ее состава.
Чаще всего термин «молекулы» относится к нескольким атомам; молекула может состоять из одного химического элемента, например кислорода (O 2 ), или из нескольких элементов, таких как вода (H 2 O). Молекулы нейтральны и не несут заряда; это свойство отличает их от многоатомных ионов, например нитрата (NO 3 – ).
молекула кофеина : Кофеин – сложная молекула, состоящая из множества атомов, связанных друг с другом определенным образом.
Размер молекулы варьируется в зависимости от количества атомов, составляющих молекулу. Большинство молекул слишком малы, чтобы их можно было увидеть невооруженным глазом. Самая маленькая молекула – двухатомный водород (H 2 ) с длиной связи 0,74 ангстрем. Макромолекулы – это большие молекулы, состоящие из более мелких субъединиц; этот термин из биохимии относится к нуклеиновым кислотам, белкам, углеводам и липидам.Некоторые макромолекулы можно наблюдать в специализированные микроскопы.
Часто состав соединения также может быть обозначен эмпирической формулой, которая представляет собой простейшее целочисленное соотношение составляющих его химических элементов. Однако эта эмпирическая формула не всегда описывает конкретную молекулу, о которой идет речь, поскольку она дает только соотношение и ее элементов. Полный элементный состав молекулы может быть точно представлен ее молекулярной формулой, которая указывает точное количество атомов в молекуле.
Пример
- C 6 H 12 O 6 = молекулярная формула глюкозы
- CH 2 O = эмпирическая (упрощенное соотношение) формула для глюкозы
Изомеры
Изомеры – это молекулы с одинаковыми атомами в разном геометрическом расположении. Из-за такого разного расположения изомеры часто имеют очень разные химические и физические свойства. На рисунке ниже 1-пропанол в основном используется в синтезе других соединений и имеет менее неприятный запах, тогда как 2-пропанол является обычным бытовым спиртом.
структурные изомеры пропанола : Химическая формула пропанола (C 3 H 7 OH) описывает несколько различных молекул, которые различаются положением спирта (OH). Каждая молекула является структурным изомером другой.
Ионы
Ион – это атом или молекула, которые имеют чистый электрический заряд, потому что их общее количество электронов не равно количеству протонов.
Цели обучения
Сравните разные классы ионов
Основные выводы
Ключевые моменты
- Ионы образуются, когда количество протонов в атоме не равно количеству электронов.Если присутствует больше протонов, ион положительный и известен как катион; если присутствует больше электронов, ион отрицательный и называется анионом.
- Ионы – это высокореактивные частицы. Обычно они находятся в газообразном состоянии и не встречаются на Земле в изобилии. Они отталкиваются одинаковыми электрическими зарядами и притягиваются к противоположным зарядам.
- Электронное облако атома определяет размер атома; добавленные электроны (анионы) увеличивают отталкивание электронов, увеличивая размер иона, в то время как катионы (с меньшим количеством электронов) меньше атома, потому что в облаке меньше электронов, которые отталкивают друг друга.
Ключевые термины
- ион : атом или группа атомов, несущих электрический заряд, например атомы натрия и хлора в солевом растворе.
- анион : отрицательно заряженные ионы, потому что у них больше электронов, чем протонов.
- катион : ионы, которые заряжены положительно, потому что в них больше протонов, чем электронов.
Атом – это основная единица материи, состоящая из плотного ядра, состоящего из положительно заряженных протонов и нейтральных нейтронов, окруженного облаком отрицательно заряженных электронов.Если в атоме одинаковое количество протонов и электронов, он электронно нейтрален. Однако, если общее количество электронов не равно количеству протонов, атом имеет чистый электрический заряд.
Любой атом или молекула с чистым зарядом, положительным или отрицательным, называется ионом. Ион, состоящий из одного атома, является одноатомным ионом; Ион, состоящий из двух или более атомов, называется многоатомным ионом. Положительный электрический заряд протона равен по величине отрицательному заряду электрона; следовательно, чистый электрический заряд иона равен количеству протонов минус количество электронов.
Ионы являются высокореактивными частицами. Обычно они находятся в газообразном состоянии и не встречаются на Земле в изобилии. Ионы в жидком или твердом состоянии образуются при взаимодействии солей со своими растворителями. Они отталкиваются одинаковыми электрическими зарядами и притягиваются к противоположным зарядам.
Типы ионов
Есть специализированные типы ионов. Анионы имеют больше электронов, чем протонов, и поэтому имеют отрицательный заряд. Катионы имеют больше протонов, чем электронов, и поэтому имеют чистый положительный заряд.Цвиттерионы нейтральны и имеют как положительные, так и отрицательные заряды в разных местах молекулы. Анионы обычно больше, чем исходная молекула или атом, потому что избыточные электроны отталкиваются друг от друга и увеличивают физический размер электронного облака. Катионы обычно меньше их родительского атома или молекулы из-за меньшего размера их электронных облаков.
Ионы водорода : показана взаимосвязь между молекулой, ее катионом и анионом.
Ион обозначается путем написания его отрицательного заряда в верхнем индексе сразу после химической структуры атома / молекулы. Обычно размер нетто записывается с величиной перед знаком; величина однозарядных молекул / атомов обычно не указывается. Одноатомные ионы иногда также представлены римскими цифрами, которые обозначают формальную степень окисления элемента, тогда как цифры с надстрочным индексом обозначают чистый заряд. Например, Fe 2+ можно обозначать как Fe (II).Эти представления можно рассматривать как эквивалентные для одноатомных ионов, но римские цифры нельзя применять к многоатомным ионам.
Ионы образования
Ионы могут быть образованы путем ионизации, которая представляет собой процесс потери или приобретения нейтральным атомом электронов. Обычно электроны либо добавляются, либо теряются на валентной оболочке атома; электроны внутренней оболочки более тесно связаны с положительно заряженным ядром и поэтому не участвуют в этом типе химического взаимодействия.
Ионизация обычно включает перенос электронов между атомами или молекулами. Этот процесс мотивирован достижением более стабильных электронных конфигураций, таких как правило октетов, которое гласит, что наиболее стабильные атомы и ионы имеют восемь электронов на своей внешней (валентной) оболочке. Многоатомные и молекулярные ионы также могут быть образованы, как правило, за счет приобретения или потери элементарных ионов, таких как H + , в нейтральных молекулах. Многоатомные ионы обычно очень нестабильны и реакционноспособны.
Типичный пример иона – Na + . У натрия есть заряд +1, потому что у натрия одиннадцать электронов. Однако, согласно правилу октетов, натрий был бы более стабильным с 10 электронами (2 в самой внутренней оболочке, 8 в самой внешней оболочке). Следовательно, натрий имеет тенденцию терять электрон, чтобы стать более стабильным. С другой стороны, хлор имеет тенденцию приобретать электрон, чтобы стать Cl – . Хлор, естественно, имеет 17 электронов, но он был бы более стабильным с 18 электронами (2 в самой внутренней оболочке, 8 во второй оболочке и 8 в валентной оболочке).Следовательно, хлор заберет электрон у другого атома, чтобы стать отрицательно заряженным.
Periodic Properties: Part 3, Ionic Radius, Predicting Ionic Charges – YouTube : Продолжение обсуждения периодических свойств, включая ионный радиус и способы прогнозирования ионных зарядов.
Периодическая таблица – краткое объяснение основ химии
Периодическая таблица Менделеева наглядно показывает элементы, из которых состоит все, что мы видим вокруг нас.Это ключевая концепция химии, которую необходимо преподавать нашим студентам. Фактически, мы рекомендуем вам вводить периодическую таблицу в элементарные годы.
{Послушайте эту серию ниже}
Но это может немного сбивать с толку, потому что кажется, что существует так много разных визуальных опций …
Одна таблица Менделеева будет полна цветов, разделяя элементы на семейства и давая им имена, как показано ниже.
В одной таблице Менделеева будет только три цвета, как показано ниже.
В одной таблице Менделеева будет четыре разных блока, как показано ниже.
И еще одна таблица Менделеева будет иметь столбцы или группы разного цвета, как показано ниже.
И есть еще больше вариантов визуального представления таблицы Менделеева, чем четыре, которыми мы здесь поделились.
Добавьте к этому различия в том, где и как показаны внутренние переходные металлы – лантаноиды и актиниды.Кроме того, элементы добавлялись и назывались на протяжении многих лет, бедный водород, кажется, не знает, к какой группе он принадлежит, а селен иногда является неметаллом, иногда металлоидом!
Возникает простой вопрос – какая таблица Менделеева правильная?
Хорошо. . . каким-то образом . . . они все есть.
Я знаю – это прозрачно, как мутная вода !!
Но помните, что периодическая таблица Менделеева – это способ визуально показать взаимосвязь между элементами.Как и наши человеческие отношения, эти элементарные отношения можно определить или показать по-разному.
Кроме того, по мере развития технологий растет и наша способность более четко определять эти отношения. И когда мы экспериментируем с элементами, мы открываем новые вещи, которые помогают формировать таблицу Менделеева.
Итак, хотя новая таблица Менделеева может отображать новые элементы, которые мы создали, и более глубокое понимание отношений между элементами, она не делает более старую версию неправильной.Это просто другой снимок нашего понимания элементов.
Если подумать, это нормально смотреть на разные версии и ценить то, чем они могут с нами поделиться. Каждая «картинка» помогает нам больше узнать о том, как элементы связаны друг с другом.
Итак, с этой идеей «моментального снимка» в качестве фона, как мы, преподаватели, подходим к тому, чтобы делиться таблицей Менделеева с нашими учениками?
Давайте начнем с краткого объяснения того, что нам сообщает таблица Менделеева…
Как я уже сказал, периодическая таблица Менделеева показывает взаимосвязь между элементами.
Это систематическое расположение известных и созданных элементов в порядке возрастания атомного номера. И он разработан таким образом, что элементы с одинаковыми свойствами вместе группируются.
Другими словами, вы можете с первого взгляда сказать, какие элементы будут вести себя одинаково, а какие будут сильно отличаться по своей реакции.
Периодическая таблица обычно дает следующую информацию для каждого элемента…
- Атомный номер , – количество протонов, которые могут быть найдены в ядре атома.
- Атомная масса , которая представляет собой общий вес протонов, нейтронов и электронов в данном атоме. Иногда это может измениться, если есть изотопы элемента, поэтому атомная масса, указанная в периодической таблице, является средним значением этих различных весов. (Примечание – Обычно атомные массы в скобках означают, что число является приблизительным. Элементы в этих скобках очень нестабильны или обнаружены недавно .)
- химическое вещество s символ , который представляет собой одно- или двухбуквенный код, который ученые используют для обозначения элемента.Этот кодекс принят во всем мире для устранения языковых барьеров при обсуждении химических соединений. Некоторые из них просты, например, O для кислорода; некоторые имеют меньший смысл, например Pb вместо свинца. Это связано с тем, что символ обычно основан на латинском названии элемента, которое в случае свинца – plumbum . Химики используют символ элемента, когда ссылаются на него в соединении или уравнении, поэтому это важно знать.
При перемещении слева направо по таблице атомный номер и атомная масса элемента увеличиваются.То же самое верно, когда вы путешествуете по таблице Менделеева.
История Периодической таблицы МенделееваПервоначальная таблица Менделеева была создана русским химиком Дмитрием Менделеевым. Он написал это почти за 30 лет до того, как Томсон открыл электрон, почти за 45 лет до того, как Резерфорд нашел ядро атома, и более чем за 50 лет до того, как ученые определили, что протон и нейтрон составляют ядро атома!
Менделеев предложил примитивную версию современной таблицы Менделеева, когда писал учебник по общей химии.В ходе своих исследований он был поражен тем фактом, что химические свойства элементов меняются в зависимости от атомной массы, поэтому он составил таблицу, чтобы показать эти отношения.
Гениальным ходом он оставил пробелы для элементов, которые еще не были обнаружены, и даже зашел так далеко, что предсказал свойства этих недостающих элементов. И что удивительно, когда эти элементы были наконец обнаружены, их свойства были очень похожи на то, что предсказывал Менделеев!
Несмотря на то, что наша современная таблица выглядит несколько иначе, чем то, что нарисовал Менделеев, мы все же отдаем ему должное за первоначальную идею таблицы Менделеева.
Вот как мы разделяем периодическую таблицу Менделеева на протяжении многих лет:
- В начальные годы я предлагаю идею периодической таблицы, а также упрощенный вид групп.
- В средней школе я учу основным взаимосвязям, которые может показать нам таблица Менделеева, а также периодам и группам.
- И, наконец, в старших классах школы ученик может сосредоточиться на изучении химических принципов и математики, которые показывает нам таблица Менделеева.
Такое преподавание основ химии позволяет нашим студентам узнать об элементах и периодической таблице на уровне, который они поймут, опираясь на нее на протяжении многих лет.
Вы можете неформально представить периодическую таблицу Менделеева через книги, а затем использовать игры, чтобы помочь своим ученикам изучить включенные элементы, или вы можете выбрать более формальное изучение химии, используя заранее запланированную программу. Ниже приведены несколько вариантов, которые мы использовали в процессе обучения естественным наукам на дому.
Следующие книги являются одними из моих любимых, чтобы больше узнать о таблице Менделеева:
* ( Указанные выше ссылки являются партнерскими. )
Вот две игры, которые помогут вашим ученикам больше узнать об элементах таблицы Менделеева:
И чтобы помочь вашим детям запомнить таблицу Менделеева, вот песня:
Наконец, если вы решите использовать программу, чтобы узнать больше о таблице Менделеева, мы предлагаем следующие программы, которые помогут вам:
Независимо от того, как вы решите поделиться своей таблицей Менделеева со своими учениками, это поможет им улучшить их понимание химии, углубить понимание элементов, из которых состоит мир вокруг нас!
Прославьте женщин за периодической таблицей
История о том, как десятки элементов были заключены в таблицу Менделеева, выходит за рамки одного человека и одного момента времени.Ученые классифицировали и предсказали элементы до и после концепции Дмитрия Менделеева 1869 года. И многие другие работали над поиском и объяснением этих новых веществ. Благородные газы, радиоактивность, изотопы, субатомные частицы и квантовая механика были неизвестны в середине девятнадцатого века.
Здесь мы обращаем внимание на некоторых женщин, которые произвели революцию в нашем понимании элементов. Мария Кюри наиболее известна благодаря своим исследованиям радиоактивности, дважды удостоенным Нобелевской премии, а также за открытие полония и радия 1 .Истории о других женских ролях немногочисленны. То же самое относится и к признанию требуемых навыков, включая упорство и усердие в проведении экспериментов, анализе данных и переоценке теорий.
Доказать открытие нового элемента сложно. Первым шагом является обнаружение необычной активности – химического поведения или физических свойств, которые нельзя приписать известным элементам, например, необъяснимые радиоактивные выбросы или спектроскопические линии. Затем элемент или его соединение должны быть изолированы в достаточно больших количествах, чтобы их можно было взвесить, протестировать и использовать для убеждения других.
Поиск и сортировка
Мария Кюри не искала элементы, когда в 1897 году начинала свою докторскую диссертацию по «урановым лучам». Она хотела исследовать радиоактивность, которую только что открыл Анри Беккерель в 1896 году. Она наткнулась на урановую обманку. , руда с радиоактивностью, слишком сильной, чтобы ее можно было объяснить одним только ураном. Она заподозрила присутствие других элементов и пригласила на помощь своего мужа Пьера.
В 1898 году они идентифицировали спектральные линии двух новых элементов – радия и полония.Тем не менее, им потребовалось более трех лет, чтобы измельчить, растворить, вскипятить, отфильтровать и кристаллизовать тонны минерала, чтобы извлечь всего 0,1 грамма соединения радия. (Они изо всех сил пытались сделать то же самое с полонием из-за его короткого периода полураспада.) Затем последовали Нобелевские премии – первая разделили пару и Беккерель в 1903 году за открытие радиоактивности, а вторая – одной Марией в 1911 году за открытия полония и радия. , а также для выделения и изучения радия.
Аннетт Ликкнес рассказывает нам больше о некоторых женщинах, стоящих за периодической таблицей
Ваш браузер не поддерживает аудио элементы.Для размещения элемента в таблице Менделеева необходимо установить его атомный вес и химические свойства. Например, радий во многом похож на барий и имеет более тяжелый атомный вес, поэтому он находится чуть ниже бария в периодической таблице. Определение атомного веса затруднено, потому что для этого требуются чистые вещества.
Элементы одинакового веса и характера трудно различить. Сразу после того, как Менделеев приготовил свой стол, российский химик Юлия Лермонтова взялась – вероятно, по указанию Менделеева – усовершенствовать процессы разделения металлов платиновой группы (рутения, родия, палладия, осмия, иридия и платины) 2 .Это было предпосылкой для следующего шага по их наведению. Единственный отчет о ее работе (насколько нам известно) находится в архивах Менделеева вместе с их перепиской. Лермонтова изучала химию в Гейдельберге, Германия, под руководством Роберта Бунзена (который открыл цезий и рубидий в 1860 году вместе с Густавом Кирхгофом с помощью недавно изобретенного спектроскопа) и была первой женщиной, получившей докторскую степень по химии в Германии в 1874 году.
Обеспечение значений атомных весов также имело решающее значение для разработки рядов радиоактивных распадов и для отличия новых элементов от неизвестных версий существующих – изотопов.Это решило проблему, заключающуюся в том, что, казалось, появлялось много новых элементов, но в периодической таблице оставалось лишь несколько пробелов. Хотя британский химик Фредерик Содди представил понятие изотопов в 1913 году, именно врач Маргарет Тодд предложила этот термин (что по-гречески означает «то же место») на званом обеде.
Экспериментальное доказательство наличия изотопов вскоре было предоставлено Стефани Горовиц, польско-еврейским химиком. Работая в Радиевом институте в Вене, она показала, что даже обычный элемент, такой как свинец, может иметь разный атомный вес в зависимости от того, является ли он результатом радиоактивного распада урана или тория 3 .
Стефани Горовиц, польско-еврейский химик, предоставила экспериментальное доказательство существования изотопов в 1914 году, работая в Радиевом институте в Вене. Фото: Центральная физическая библиотека Австрии, Вена
Другой проблемой была природа любопытного «излучения» радия. Это была частица или газ? Канадская аспирантка по физике Харриет Брукс решила эту задачу вместе со своим научным руководителем Эрнестом Резерфордом из Университета Макгилла в Монреале, Канада 4 .В 1901 году Брукс и Резерфорд показали, что эманация распространяется как тяжелый газ, предоставив первое свидетельство того, что новый элемент может образовываться во время радиоактивного распада. В 1907 году Уильям Рамзи предположил, что газ, позже названный радоном, принадлежал к «гелиевой группе элементов», которая теперь называется благородными газами 5 .
В 1902 году Резерфорд и Содди объявили о своей теории радиоактивного распада: атомы спонтанно распадаются на новые атомы, испуская лучи. Резерфорд был удостоен Нобелевской премии по химии в 1908 году за свои исследования; Внесение радона в Брукс было первым решающим шагом.Ей редко приписывают. Хотя первая статья была написана Бруксом и Резерфордом 6 , следующая в Nature содержала только имя Резерфорда – с кредитной линией, которую Брукс помог ему 7 . Будучи женщиной, Брукс было трудно получать постоянные встречи (особенно после замужества) и проводить постоянные исследования.
Более глубоко в вопросе
Понимание физики атомного ядра продолжало появляться. В 1917–18 годах физик Лиз Мейтнер и химик Отто Хан открыли в Берлине 91 элемент протактиний 8 .Мейтнер была австрийкой и уехала в Германию после получения докторской степени, чтобы улучшить свои карьерные возможности. В 1907 году она была принята в качестве безвозмездного сотрудника Хана на химический факультет Берлинского университета. Ей приходилось работать в подвале – женщин не было видно. В 1913 году, после того как Хан переехала в Химический институт кайзера-Вильгельма в Берлине-Далеме, она стала его «сотрудником».
Хан и Мейтнер открыли протактиний, когда искали «материнское вещество» актиния в серии радиоактивных распадов.Они были частью более широкой гонки за поиском элемента, и неизбежно следовали споры о приоритетах. Открытие пары в конечном итоге было признано первым, потому что Мейтнер и Хан собрали больше вещества и охарактеризовали его более полно, чем у их конкурентов.
Другой элемент, номер 75 – рений – был совместно открыт в 1925 году немецкими химиками Идой Ноддак и ее мужем Вальтером Ноддаком в Берлине вместе с Отто Бергом в электротехнической компании Siemens – Halske (позднее входившей в состав фирмы Siemens) 9 .Ида Ноддак, урожденная Тэке, была инженером-химиком, оставившая промышленность в поисках недостающих элементов. В 1925 году она начала в качестве бесплатного приглашенного исследователя в Physikalisch-Technische Reichsanstalt (Императорский физико-технический институт) в Берлине, где Вальтер возглавлял химическую лабораторию. Ноддаки изо всех сил пытались произвести весовые количества рения, который они назвали в честь Рейна; это один из самых редких элементов на Земле, и он не радиоактивен.
Ноддаки также утверждали, что нашли элемент 43, который они назвали мазурием (в честь Мазурского региона, ныне Польши).Но им так и не удалось воспроизвести его спектральные линии или выделить материал. Фактически, использование методов «влажной химии» для этого элемента было безнадежным. В 1937 году элемент 43 стал первым искусственно произведенным элементом, получившим название технеций.
В отличие от Марии Кюри, которая получила признание и заняла кафедру Пьера в Парижском университете после его смерти, Ида Ноддак большую часть жизни проработала гостем в лаборатории своего мужа. Это была одна из причин, по которой ее не приняли всерьез, когда в 1934 году она предположила, что ядро может расщепляться – процесс, который мы теперь называем делением.
Открытие нейтрона в 1932 году и наведенной радиоактивности в 1934 году открыло новое направление исследований – производство элементов в лаборатории путем бомбардировки атомов частицами. В 1934 году физик Энрико Ферми и его сотрудники из Римского университета объявили, что они получили элементы 93 и 94, стреляя нейтронами по урану. Ида Ноддак указала в статье в Angewandte Chemie 10 , что Ферми не смог показать, что никаких других химических элементов, включая более легкие, не производилось.«Возможно, – утверждала она, – что ядро распадается на несколько крупных фрагментов». Физики ее проигнорировали.
Затем, в 1938 году, Мейтнер и Хан поняли, что одним из элементов, созданных Ферми, был барий, и что ядро урана действительно раскололо. К тому времени, накануне Второй мировой войны, Мейтнер, еврейка, бежала в Швецию. Хотя именно ее расчеты убедили Хана, что ядро раскололось, он не включил имя Мейтнер в публикации результатов 1939 года и не установил рекорд, приняв Нобелевскую премию по химии 1944 года в 1945 году.
Маргарита Перей (слева), открывшая франций, и ее коллега Соня Котель в Радиевом институте в Париже в 1930 г. Фото: Musée Curie / ACJC
Большинство этих женщин-пионеров работали с сотрудниками-мужчинами, и их вклад трудно отделить друг от друга. 11 . Маргарита Перей является исключением: французский физик считается единственным открывателем 87-го элемента, франция, в 1939 году 12 . Перей присоединился к институту Марии Кюри в Париже в возрасте 19 лет в качестве лаборанта под руководством Ирен Жолио-Кюри и Андре Дебьерна.Оба независимо друг от друга попросили ее указать точное значение периода полураспада изотопа актиния-227. Это деликатная техническая процедура, в ходе которой она определила новый элемент. Поскольку ни один из них не мог прийти к единому мнению о том, на кого в то время работал Перей, каждый не мог претендовать на роль в открытии. Перей продолжала руководить кафедрой ядерной химии в Страсбургском университете и в 1962 году стала первой женщиной, избранной во Французскую академию наук в качестве члена-корреспондента.(Хотя не существовало правил, запрещающих прием женщин, первая женщина-полноправный член не была избрана до 1979 года.)
Франций был последним элементом, обнаруженным в природе. Сегодня такое открытие требует больших команд с ускорителями частиц и больших бюджетов. Значение химического элемента изменилось: от концепции Менделеева о стабильном и непревращаемом веществе до изотопных видов, которые существуют только миллисекунды 13 .
Используя эти методы, американский химик Дарлин Хоффман совершил грандиозный скачок в начале 1970-х годов.Она показала, что изотоп фермия-257 может расщепляться спонтанно – не только после бомбардировки нейтронами. Первая женщина, возглавившая научное подразделение Лос-Аламосской национальной лаборатории в Нью-Мексико, Хоффман также обнаружила плутоний-244 в природе. Она подготовила поколения женщин-ученых. Одна из них – Дон Шонесси, ныне главный исследователь проекта тяжелых элементов (и нескольких других) в Ливерморской национальной лаборатории Лоуренса в Калифорнии, который помог открыть шесть новых элементов (номера 113–118).
Использование элементов
Многие женщины расширили наши знания об элементах. После того, как французский химик Анри Муассан выделил фтор в 1886 году, группа женщин (в частности, Кармен Бруггер Романи и Тринидад Салинас Феррер) работала с Хосе Касаресом Хилем в Мадридском университете в 1920-х и начале 1930-х годов, чтобы изучить его влияние на здоровье и присутствие в минералах. воды. Когда им пришлось оставить исследования после гражданской войны в Испании 1936–1939 годов, их работа попала в библиографию Касареса.
В 1979 году американский химик Дарлин Хоффман стала первой женщиной, возглавившей научное подразделение Лос-Аламосской национальной лаборатории в Нью-Мексико.Предоставлено: Рой Кальчмидт / Национальная лаборатория Лоуренса Беркли
.Химик Реата Кларк Кинг была первой афроамериканской женщиной-ученым, работавшей в Национальном бюро стандартов в Вашингтоне, округ Колумбия. 14 . В 1960-х годах она изучала горение газовых смесей фтора, кислорода и водорода: высокая реакционная способность фтора дала ему возможность использовать его в ракетном топливе. Некоторые смеси были настолько взрывоопасными, что требовали специального оборудования и методов, которые она разработала и приняло в НАСА.
В 1910-х годах американский врач и исследователь Элис Гамильтон доказала токсичность свинца и его вред для населения и рабочих-металлистов 15 . Она заставила страховые компании и производителей принять меры безопасности и выплатить компенсацию пострадавшим. Она также организовала социальные акции по выявлению профессиональных заболеваний у людей, работающих с другими тяжелыми металлами, такими как ртуть. В 1919 году она стала первой женщиной, назначенной на факультет Гарвардского университета в Кембридже, штат Массачусетс.Она выступила против использования свинца в бензине еще в 1925 году.
Японско-американский техник Тошико «Тош» Майеда освоил измерение радиоизотопов кислорода в 1950-х годах. Ее назначили мыть посуду в лаборатории Гарольда К. Юри в Чикагском университете, штат Иллинойс, и вскоре ее назначили ответственным за масс-спектрометры 16 . Она помогла измерить соотношение изотопов кислорода в окаменелых раковинах, чтобы определить температуру доисторических океанов, и распространила этот метод на метеориты.
Как и все американцы японского происхождения, Майеда была отправлена в лагеря для интернированных после нападения на Перл-Харбор 7 декабря 1941 года и столкнулась с дискриминацией. Имея только степень бакалавра химии, она могла быть одной из многих женщин-техников, которые оставались в основном невидимыми, но вносили важный вклад. К счастью, Майеду поддержало начальство, и ее имя появилось в публикациях наравне с обладателями докторских степеней и профессорскими званиями.
Более широкое изображение
Как и в случае с самими открытиями, для раскрытия этих историй женщин-ученых потребовалось много совместной работы, в том числе со стороны авторов Гизелы Бек, Джона Хадсон, Клэр Мюррей, Джессики Уэйд, Мэри Марк Окерблум, Марелин Райнер-Кэнхэм, Джеффри Райнер-Кэнхэм, Ксавье Роке, Мэтт Шинделл и Игнасио Суай-Маталлана.
Поиск женщин в истории химии открывает более полную картину всех людей, работающих над научными открытиями, от неоплачиваемых помощников и техников до руководителей великих лабораторий. В этот праздничный год периодической таблицы Менделеева важно понять, как она была построена – и продолжает формироваться – этими индивидуальными усилиями и широким сотрудничеством.
Пришло время перевернуть таблицу Менделеева?
Лотар Мейер, немецкий химик, создал частичную таблицу Менделеева в 1864 году и более полную версию в 1869 году.«Структурно таблицы Мейера и Менделеева были очень похожи», – сказал Алан Рок, историк науки из Университета Кейс Вестерн Резерв, который выступал с докладом о Мейере в A.C.S. юбилейный симпозиум.
Изначально периодичность таблицы и ее замечательная предсказательная сила казались «нумерологической загадкой», – сказал доктор Рок. В 20 веке периодичность стала объяснять квантовая физика – в частности, физика того, как электроны вращаются вокруг ядра. Литий, натрий и калий, которые хорошо совпадают в первом вертикальном столбце таблицы – группа первая, щелочные металлы, рубидий, цезий и франций – все имеют по одному электрону на своей внешней электронной оболочке.
Оба химика за многие годы построили множество таблиц, изменяя их в ответ на новые открытия и более точные данные. В конце концов Менделеев победил. Когда в шаблонах его таблиц появлялись пробелы, он предсказывал, что должно появиться. Некоторые ошибались, но он точно предсказал существование трех элементов: галлия, германия и скандия.
«Предсказания психологически драматичны», – сказал доктор Шерри. «Если ученый что-то предсказывает, и это сбывается, в некотором смысле этот ученый знает секреты природы или почти знает будущее.
Но наука редко развивается революционным путем, сказал доктор Шерри: «Наука – это деятельность, осуществляемая сотнями тысяч исследователей, и все они вносят свой вклад в общую картину, которая в конечном итоге вырисовывается».
Это была тема юбилейного симпозиума. Бриджит Ван Тиггелен, историк химии из Института истории науки в Филадельфии, обсудила работу Иды Ноддак, немецкого химика, открывшего рений, и Лизы Мейтнер, австрийско-шведского физика, которая вместе с Отто Ганом открыла протактиний.Доктор Ван Тиггелен – редактор новой книги «Женщины в их стихии», в которой исследуется более 30 подобных историй, включая, конечно же, историю Марии Кюри, которая открыла два элемента, радий и полоний, и дважды выиграла приз. Нобелевская премия.
«Мы представляем историю как коммунальное предприятие», – сказал д-р Ван Тиггелен.
So long, alchemy
Среди множества достижений периодическая таблица Менделеева позволила химии, наконец, избавиться от привкуса алхимии. Ньютон в этом отношении мало помог: он был одержим «химией» – синонимом алхимии, согласно Оксфордскому словарю английского языка – и поиском философского камня, который мог бы преобразовывать неблагородные металлы в золото.
.