ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ | Кафедра загальної та неорганічної хімії
Периодическая классификация элементов была предложена в 1869 году Дмитрием Ивановичем Менделеевым, выдающимся ученым — химиком. Он предположил, что если расставить известные элементы в порядке увеличения относительной атомной массы, их химические и другие свойства будут регулярно повторяться. Он разработал удобную и компактную таблицу которая, к тому же, позволяла предвидеть свойства еще неизвестных элементов. В 1871 году он разработал более адекватную версию таблицы, где оставил пробелы, надеясь, что они будут в свое время заполнены элементами, еще неизвестными и предсказал с чрезвычайной точностью свойства таких элементов, как галлий, скандий и германий.
Он также предсказал отсутствующий элемент с относительной атомной массой около 100. Это оказался технеций — самый легкий элемент, не имеющий устойчивых изотопов. Предсказания Менделеева были подтверждены бельгийским химиком-аналитиком Жаном Севре Стасом, который выполнил наиболее точные в то время измерения относительных атомных масс некоторых элементов.
За это открытие Менделеев, вместе с Лотаром Майером, получил медаль Дэви — награду Лондонского Королевского Общества.
В 2016 году стало известно об официальном внесении четырех новых химических элементов в периодической таблице Менделеева, о чем извещает Международный союз теоретической и прикладной химии (IUPAC).
После того, как в январе 2016 официально подтвердили существование этих элементов, исследовательские команды, их открывшие, предложили свои названия и условное обозначение из двух букв. Традиционно химические элементы называют по имени мифологического существа, минерала, геологической формации, страны или местности, в честь ученого или по их свойствам.
Элемент 113 предложили назвать нихонием (до его временной названием был унунтрий). Его синтезировала команда Косуке Мориты в лаборатории RIKEN путем бомбардировки висмутовых мишеней ядрами цинка-70 (эксперименты поставили в 2004 и 2012). Назван в честь Японии, этот элемент впервые может увековечить Восточную Азию в периодической таблице.
Ученые из России и США, открывшие элементы 115 и 117 (до сих пор — унунпентий и унунсептий), предложили для них названия московий (Mc) и теннессин (Ts). Оба элемента получили благодаря сотрудничеству между Институтом ядерных исследований (Россия) и Ок-Риджськой и Ливерморской национальной лабораторией (США) в 2010 году.
Российская команда также предложила название «оганессон» и условное обозначение Og для элемента 118 (временно — унуноктий). Его предлагают в честь академика Юрия Оганесяна, который возглавлял эксперимент по его синтезу.
Ученые получили считанные атомы каждого из этих элементов. Они существовали лишь доли секунды и сразу распались на меньшие, более стабильные ядра. Однако ученых не покидает надежда, что среди группы транфермиевих элементов, то есть элементов с атомным номером> 100, существует так называемый «островок стабильности» — стабильный, долговременный элемент, который может существовать даже в природе. «Островок стабильности» — прямое следствие из оболочечной теории строения атомного ядра, за которую Мария Гелперт-Майер и Ганс Йенсен были удостоены Нобелевской премии по физике 1963 года.
Исследовательские команды, которые открывают новые элементы, вносят предложения относительно названий. Однако официально элементы называет только IUPAC. Международный союз ждет пять месяцев, чтобы получить отзывы на названия от общественности и научных сообществ. Если не будет массовых протестов, то их, скорее всего, утвердят в ноябре. Последний раз периодическая таблица пополнилась флеровием (Fl, 114) и ливерморием (Lv, 116).
Таким образом, седьмой период периодической системы теперь полностью завершен.
Расположение металлов и неметаллов в Периодической системе
Черным цветом изображены металлы,
красным цветом — неметаллы,
зеленым — элементы с амфотерными свойствами.
Расположение семей элементов в Периодической системе
s-элементы — малиновый цвет,
p-элементы — желтый цвет,
d-элементы — голубой цвет,
f-элементы — зеленый цвет.
Пирамидальное расположение элементов
Области применения элементов
Окислительные и восстановительные свойства
Новые элементы периодической таблицы Менделеева получили официальные названия
Международный союз теоретической и прикладной химии (IUPAC) утвердил названия четырех новых элементов периодической таблицы Менделеева. Ни один из них «в живой природе» не встречается.
Ни один из них «в живой природе» не встречается.
По порядку рассчитайсь!
Отличить элемент естественного происхождения от синтезированного можно по атомному номеру (числу протонов в ядре). Элементы с числом меньше 92 (уран) можно наблюдать в природе, элементы с номерами 93-100 получают в реакторах. Если атомный номер больше 100 – значит, такой элемент можно синтезировать с помощью ускорителей частиц. Именно так родились на свет нихоний (Nihonium, Nh), московий (Moscovium, Mc), теннессин (Tennessine, Ts) и оганессон (Oganesson, Og).
Соответственно, новые элементы получили 113-й, 115-й, 117-й и 118-й атомные номера. После того, как Международный союз в январе 2016-го года официально их верифицировал, командам исследователей дали 5 месяцев на то, чтобы определиться с именами и двухбуквенными обозначениями новых химических элементов.
И наконец, 8 июня миру огласили весь список.
Японий? Нихоний!
«Нихон» (Nihon) по-японски означает то самое поэтическое словосочетание «Страна восходящего солнца».
Первооткрыватели нихония – группа ученых из Института физико-химических исследований (RIKEN), возглавляемая профессором Коскэ Моритой. Эксперименты по «выведению» нихония проводились в 2004-м, 2005-м, 2012-м годах. Пожалуй, описание опытов мало кто поймет, но ясно, что работа проделана колоссальная: получить японий исследователи смогли «бомбардируя на ускорителе мишень из висмута-209 пучком ионов цинка-70, разогнанных до одной десятой скорости света и висмута. В результате им удалось зафиксировать три цепочки распада, соответствующие событию рождения 113-го элемента – 23 июля 2004 года, 2 апреля 2005 года и 12 августа 2012 года. Время жизни ядра нового элемента составило от 4,9 до 0,3 миллисекунды»
Авторство, кстати, оспаривали также физики России и США, пришлось подключать международную комиссию из представителей теоретической и прикладной химии и физики. Эксперты пришли к выводу, что японцы все-таки синтезировали новый элемент раньше остальных своих коллег.
Эксперты пришли к выводу, что японцы все-таки синтезировали новый элемент раньше остальных своих коллег.
Как много в этом звуке
Согласно правилам IUPAC, вновь открытые элементы могут быть названы в честь мифологических понятий или персонажей (в том числе астрономических объектов), минералов или аналогичных веществ, географических регионов, свойств самого элемента или в честь какого-либо ученого.
При выборе названия для элемента №115 был использован именно географический принцип. Элемент получил имя «московий» – поскольку впервые был синтезирован специалистами Объединенного института ядерных исследований в Дубне, который расположен в Московской области. Почему не дубний? А потому что дубний к этому времени был уже открыт.
Согласно вердикту IUPAC, приоритет в открытии московия принадлежит ученым из ОИЯИ в Дубне, Окриджской национальной лаборатории и Ливерморской национальной лаборатории (США). При этом рабочая группа IUPAC отдельно отметила, что достоверные результаты, подтверждающие открытие элемента, были получены только в экспериментах, проведенных в ОИЯИ в 2010 году.
По теме
1885
Первые пять месяцев после открытия элемент провел, кстати, под именем «унунпентий» – по своему порядковому, 115-му, номеру.
16-й штат, но 117-й элемент
Номер нового элемента по имени «теннессин» – 117. Унунсептий («один-один-седьмой») был открыт последним из элементов седьмого периода таблицы Менделеева.
Широкие массы о нем узнали задолго до официального признания: из 10-й серии 7-го сезона фантастического мультсериала «Футурама», показанной в августе 2012-го года.
В сериале унунсептий назвали «фарнсием» (Farnsium, Fa) – предположительно, в честь одного из главных героев «Футурамы», профессора Хьюберта Фарнсворта.
В реальной жизни синтезом этого элемента занимались все те же три объединившие усилия научные команды – из Дубны, Ок-Риджа и Ливермора, впервые он был получен ОИЯИ в Дубне в 2009 году. IUPAC, однако, порекомендовал дать элементу название «теннессин», чтобы отметить таким образом вклад ученых штата Теннесси (из Национальной лаборатории Ок-Ридж, Университета Вандербильта и Университета Теннесси в Ноксвилле) в дело изучения сверхтяжелых элементов.
Теннессин чуть не стал фарнсием…
В честь профессора
В названии еще одного элемента мерещится что-то скандинавское – оганессон… На самом деле, 118-й элемент назван в честь российского ученого, специалиста в области экспериментальной ядерной физики Юрия Оганесяна, академика РАН, научного руководителя лаборатории ядерных реакций им. Флерова в ОИЯИ в Дубне, заведующий кафедрой ядерной физики университета «Дубна».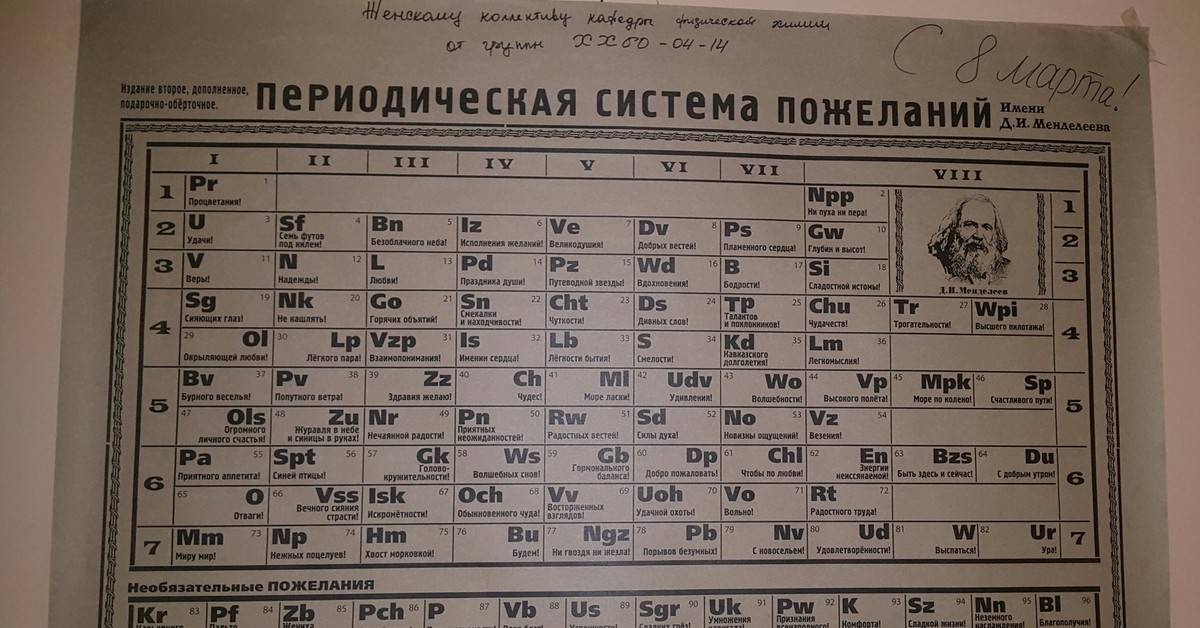
Предложение назвать новый элемент именем российского ученого, как отмечают в пресс-релизе ОИЯИ, «следует традиции оказания чести и отражает признание новаторского вклада профессора Юрия Оганесяна в исследование трансактинидных элементов. В числе его многих достижений – открытие сверхтяжелых элементов и значительный прогресс в ядерной физике сверхтяжелых элементов, включая экспериментальное подтверждение существования «острова стабильности».
Юрий Оганесян – «родитель» не одного химического элемента, а пяти, он открыл также (в соавторстве) резерфордий, дубний, сиборгий и борий. За открытие новой области стабильности сверхтяжелых элементов награжден Государственной премией Российской Федерации в области науки и технологий 2010 года.
На этом пока всё
Напомним, систему периодизации химических элементов по их атомной массе разработал в 1869 году русский ученый Дмитрий Менделеев. Согласно распространенной легенде, свою знаменитую таблицу он увидел во сне – хотя сам ученый эту версию так и не подтвердил, сказав: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
На сегодняшний день полная версия таблицы состоит из 126 элементов, при этом элементы 121-126 пока еще не удалось синтезировать. В предыдущий раз пустые места в периодической таблице Менделеева заполняли 5 лет назад: в 2011-м в нее добавили флеровий (114-й элемент) , названный в честь одного из основателей ОИЯИ Георгия Флёрова, и ливерморий (116-й) – получивший свое название в честь Ливерморской лаборатории.
Настольная игра Банда умников УМ212 Ихний Ихниевич
Количество игроков: 2-5 человек
Русский язык учить тяжело. Это неудивительно: столько разных правил, скучные учебники! “Ихний Ихниевич” — это уникальная настольная игра, которая помогает понять и запомнить самые важные термины из курса русского языка с 1 по 6 классы. Ведь играть намного интереснее, чем читать очередной параграф:)
Больше никакой скучной зубрежки!
В этой веселой и полезной настолке все термины располагаются на карточках с яркими и запоминающимися персонажами. Именно поэтому все части речи, падежи и склонения становятся предельно понятными и прочно закрепляются в памяти. А чтобы научиться их замечать и понимать, в игре используются карты с забавными словосочетаниями и предложениями — с ними точно не соскучишься!
Именно поэтому все части речи, падежи и склонения становятся предельно понятными и прочно закрепляются в памяти. А чтобы научиться их замечать и понимать, в игре используются карты с забавными словосочетаниями и предложениями — с ними точно не соскучишься!
От простых понятий к сложным терминам
В “Ихний Ихниевич” можно играть даже с первоклашками! В игре есть три уровня сложности: можно выбирать карточки в соответствии с пройденными темами и уровнем подготовки ребенка. Кроме того, предусмотрено 4 варианта правил: как скоростные, так и “на подумать”, с большим количеством игровых элементов. В результате изучение русского языка становится простым, приятным и увлекательным занятием.
Соревнуемся в грамотности
Базовый вариант правил легкий, но азартный. А чтобы победить, нужны знания и воображение! Задача игроков придумать как можно больше фраз, соответствующих выложенным картам с терминами.
Каждый игрок ставит свою фишку на старт игрового поля, а в центр стола кладется колода, кубик и часы.
Игроки ходят по очереди. Ходящий бросает кубик — выпавшее число показывает, из скольких слов нужно будет придумывать фразы.
После этого игрок открывает 2 карты из колоды и переворачивает песочные часы.
За 30 секунд нужно придумать как можно больше фраз, в каждой из которых будут оба термина.
Сколько фраз назвал игрок, столько шагов делает фишкой по игровому полю.
Игра заканчивается, когда один из игроков доберется до отметки “50” на игровом поле. Этот игрок и становится победителем!
В комплекте
81 карта с терминами
69 карт с примерами
Кубик с количеством
Песочные часы
5 игровых фишек
Иллюстрированные правила
Шпаргалка по русскому языку
Посмотреть правила игры
Этот товар ещё называют: H-УМ212
The Evolution of the Periodic System
Примечание редактора: Ниже приводится текстовая версия. Полную версию с иллюстрациями можно приобрести здесь (PDF).
Периодическая таблица элементов – один из самых ярких символов в науке: единый документ, который обобщает большую часть наших знаний по химии. Версия висит на стене почти каждой химической лаборатории и лекционного зала в мире. Действительно, ничего подобного не существует в других научных дисциплинах.
Версия висит на стене почти каждой химической лаборатории и лекционного зала в мире. Действительно, ничего подобного не существует в других научных дисциплинах.
История периодической системы классификации элементов насчитывает более 200 лет. На протяжении своей долгой истории периодическая таблица оспаривалась, изменялась и улучшалась по мере развития науки и открытия новых элементов [см. «Создание новых элементов» Питера Армбрастера и Фрица Питера Хессбергера]. Но, несмотря на драматические изменения, произошедшие в науке за последнее столетие, а именно развитие теорий относительности и квантовой механики, не произошло революции в основной природе периодической системы.В некоторых случаях первоначально казалось, что новые открытия ставят под сомнение теоретические основы периодической таблицы Менделеева, но каждый раз ученым в конечном итоге удавалось учесть результаты, сохранив при этом фундаментальную структуру таблицы. Примечательно, что периодическая таблица Менделеева примечательна как своими историческими корнями, так и актуальностью в современном мире.
Термин «периодический» отражает тот факт, что элементы проявляют закономерности в своих химических свойствах через определенные регулярные промежутки времени. Если бы не упрощение, представленное в этой таблице, студентам-химикам пришлось бы изучить свойства всех 112 известных элементов.К счастью, периодическая таблица Менделеева позволяет химикам работать, усваивая свойства горстки типичных элементов; все остальные попадают в так называемые группы или семейства со схожими химическими свойствами. (В современной периодической таблице группа или семья соответствуют одному вертикальному столбцу.)
Открытие периодической системы классификации элементов представляет собой кульминацию ряда научных достижений, а не внезапный мозговой штурм со стороны одного человека.Тем не менее, историки обычно считают одно событие официальным рождением современной таблицы Менделеева: 17 февраля 1869 года русский профессор химии Дмитрий Иванович Менделеев завершил первую из своих многочисленных периодических таблиц. В него вошли 63 известных элемента, расположенных в соответствии с возрастающим атомным весом; Менделеев также оставил места для еще неоткрытых элементов, для которых он предсказал атомный вес.
В него вошли 63 известных элемента, расположенных в соответствии с возрастающим атомным весом; Менделеев также оставил места для еще неоткрытых элементов, для которых он предсказал атомный вес.
Однако до открытия Менделеева другие ученые активно разрабатывали какую-то организационную систему для описания элементов.Например, в 1787 году французский химик Антуан Лавуазье, работая с Антуаном Фуркроем, Луи-Бернаром Гайтоном де Морво и Клодом-Луи Бертолле, составил список из 33 элементов, известных в то время. Однако такие списки – это просто одномерные представления. Сила современной таблицы заключается в ее двух- или даже трехмерном отображении всех известных элементов (и даже тех, которые еще предстоит обнаружить) в логической системе точно упорядоченных строк и столбцов.
Немецкий химик Иоганн Дёберейнер в 1817 году в своей ранней попытке организовать элементы в осмысленную совокупность указал, что многие известные элементы могут быть организованы по их сходству в группы по три, которые он назвал триадами. Доберейнер выделил триады элементов лития, натрия и калия, а также хлора, брома и йода. Он заметил, что если три члена триады были упорядочены в соответствии с их атомным весом, свойства среднего элемента попадали между свойствами первого и третьего элементов. Например, литий, натрий и калий активно взаимодействуют с водой. Но литий, самый легкий из триад, реагирует более мягко, чем два других, тогда как самый тяжелый из трех, калий, взрывается сильно.Кроме того, Доберейнер показал, что атомный вес среднего элемента близок к среднему весу первого и третьего членов триады. Работа Доберейнера побудила других искать корреляции между химическими свойствами элементов и их атомным весом. Одним из тех, кто в 19 веке продолжал развивать триадный подход, был Питер Кремерс из Кельна, который предположил, что определенные элементы могут принадлежать двум перпендикулярно расположенным триадам. Таким образом, Кремерс открыл новые горизонты, сравнив элементы в двух направлениях, что впоследствии оказалось важным аспектом системы Менделеева.
Доберейнер выделил триады элементов лития, натрия и калия, а также хлора, брома и йода. Он заметил, что если три члена триады были упорядочены в соответствии с их атомным весом, свойства среднего элемента попадали между свойствами первого и третьего элементов. Например, литий, натрий и калий активно взаимодействуют с водой. Но литий, самый легкий из триад, реагирует более мягко, чем два других, тогда как самый тяжелый из трех, калий, взрывается сильно.Кроме того, Доберейнер показал, что атомный вес среднего элемента близок к среднему весу первого и третьего членов триады. Работа Доберейнера побудила других искать корреляции между химическими свойствами элементов и их атомным весом. Одним из тех, кто в 19 веке продолжал развивать триадный подход, был Питер Кремерс из Кельна, который предположил, что определенные элементы могут принадлежать двум перпендикулярно расположенным триадам. Таким образом, Кремерс открыл новые горизонты, сравнив элементы в двух направлениях, что впоследствии оказалось важным аспектом системы Менделеева.
В 1857 году французский химик Жан-Батист-Андре Дюма отказался от идеи триад и вместо этого сосредоточился на разработке набора математических уравнений, которые могли бы объяснить увеличение атомного веса нескольких групп химически похожих элементов. Но, как теперь признают химики, любая попытка создать структуру организации на основе атомного веса элемента не увенчается успехом, потому что атомный вес не является фундаментальным свойством, характеризующим каждый из элементов.
Периодические свойства
Важнейшей характеристикой системы Менделеева было то, что она иллюстрировала периодичность или повторяемость свойств элементов через определенные регулярные промежутки времени.Эта особенность наблюдалась ранее в расположении элементов по атомному весу, разработанном в 1862 году французским геологом Александром-Эмилем Бегуайе де Шанкуртуа. Система опиралась на довольно сложную геометрическую конфигурацию: де Шанкуртуа располагал элементы в соответствии с возрастающим атомным весом по спирали, начертанной на поверхности цилиндра и наклоненной под углом 45 градусов от основания.![]()
Первый полный оборот спирали совпал с кислородом элемента, а второй полный оборот произошел с серой.Элементы, расположенные вертикально на поверхности цилиндра, как правило, имели аналогичные свойства, поэтому такое расположение позволило уловить некоторые из узоров, которые впоследствии стали центральными в системе Менделеева. Тем не менее, по ряду причин система де Шанкуртуа не оказала большого влияния на ученых того времени: в его оригинальную статью не входила диаграмма таблицы, система была довольно сложной, а химическое сходство между элементами не отображалось очень убедительно. .
Несколько других исследователей выдвинули свои собственные версии таблицы Менделеева в 1860-х годах. Используя новые стандартизованные значения атомного веса, английский химик Джон Ньюлендс в 1864 году предположил, что, когда элементы расположены в порядке атомного веса, любой из элементов проявляет свойства, аналогичные свойствам элементов на восемь позиций впереди и на восемь позиций позади в списке. – особенность, которую Ньюлендс назвал «законом октав».
– особенность, которую Ньюлендс назвал «законом октав».
В своей исходной таблице Ньюлендс оставил пустые места для отсутствующих элементов, но его более разрекламированная версия 1866 года не включала эти открытые места.Другие химики сразу же высказали возражения против таблицы, потому что она не сможет вместить какие-либо новые элементы, которые могут быть обнаружены. Фактически, некоторые исследователи открыто высмеивали идеи Ньюлендса. На собрании Химического общества в Лондоне в 1866 году Джордж Кэри Фостер из Университетского колледжа Лондона спросил Ньюлендса, рассматривал ли он возможность упорядочения элементов в алфавитном порядке, потому что любое расположение элементов может привести к случайным совпадениям. В результате встречи Химическое общество отказалось опубликовать статью Ньюлендса.
Однако, несмотря на плохой прием, работа Ньюлендса действительно представляет собой первый случай, когда кто-либо использовал последовательность порядковых чисел (в данном случае, основанную на последовательности атомных весов) для организации элементов. В этом отношении Ньюлендс предвосхитил современную организацию периодической таблицы Менделеева, которая основана на последовательности так называемых атомных чисел. (Понятие атомного номера, которое указывает количество протонов, присутствующих в ядре атома, не существовало до начала 20 века.)
В этом отношении Ньюлендс предвосхитил современную организацию периодической таблицы Менделеева, которая основана на последовательности так называемых атомных чисел. (Понятие атомного номера, которое указывает количество протонов, присутствующих в ядре атома, не существовало до начала 20 века.)
Современная периодическая таблица
Химик Юлиус Лотар Мейер из Университета Бреслау в Германии, в процессе пересмотра своего учебника химии в 1868 году, создал периодическую таблицу, которая оказалась удивительно похожей на знаменитую версию Менделеева 1869 года, хотя Лотар Мейер не смог правильно классифицировать все элементы. Но таблица не появлялась в печати до 1870 года из-за задержки издателя – фактор, который способствовал ожесточенному спору о приоритете, который последовал между Лотаром Мейером и Менделеевым.
Примерно в то же время Менделеев составил свою собственную таблицу Менделеева, в то время как он тоже писал учебник химии. В отличие от своих предшественников, Менделеев достаточно доверял своей периодической таблице, чтобы использовать ее для предсказания нескольких новых элементов и свойств их соединений. Он также исправил атомный вес некоторых уже известных элементов. Интересно, что Менделеев признался, что видел некоторые более ранние таблицы, например, из Newlands, но утверждал, что не знал о работе Лотара Мейера при разработке своей таблицы.
Он также исправил атомный вес некоторых уже известных элементов. Интересно, что Менделеев признался, что видел некоторые более ранние таблицы, например, из Newlands, но утверждал, что не знал о работе Лотара Мейера при разработке своей таблицы.
Несмотря на то, что прогностический аспект таблицы Менделеева был большим достижением, кажется, что историки переоценили его, которые обычно предполагали, что таблица Менделеева была принята именно из-за этой особенности. Эти ученые не заметили, что цитата Лондонского королевского общества, сопровождавшая медаль Дэви (которую Менделеев получил в 1882 году), вообще не упоминает о его предсказаниях. Вместо этого способность Менделеева приспособиться к уже известным элементам, возможно, способствовала принятию периодической системы не меньше, чем его поразительные предсказания.Хотя многочисленные ученые помогли разработать периодическую систему, Менделеев получил большую заслугу в открытии химической периодичности, потому что он возвысил это открытие до уровня закона природы и провел остаток своей жизни, смело исследуя его последствия и отстаивая его обоснованность.
Защита периодической таблицы Менделеева была непростой задачей – ее точность часто подвергалась сомнению в ходе последующих открытий. Один примечательный случай произошел в 1894 году, когда Уильям Рамзи из Университетского колледжа Лондона и лорд Рэлей (Джон Уильям Струтт) из Королевского института в Лондоне обнаружили элемент аргон; В течение следующих нескольких лет Рамзи объявил об идентификации четырех других элементов – гелия, неона, криптона и ксенона – известных как благородные газы.(Последний из известных благородных газов, радон, был открыт в 1900 году немецким физиком Фридрихом Эрнстом Дорном.)
Название «благородный» происходит от того факта, что все эти газы, кажется, стоят отдельно от других элементов, редко взаимодействуя с ними, образуя соединения. В результате некоторые химики предположили, что благородные газы даже не входят в периодическую таблицу. Эти элементы не были предсказаны Менделеевым или кем-либо еще, и только после шести лет напряженных усилий химики и физики смогли успешно включить благородные газы в таблицу.В новом устройстве была введена дополнительная колонка между галогенами (газообразные элементы фтор, хлор, бром, йод и астат) и щелочными металлами (литий, натрий, калий, рубидий, цезий и франций).
Вторым предметом разногласий был точный порядок элементов. В оригинальной таблице Менделеева элементы располагались в соответствии с атомным весом, но в 1913 году голландский физик-любитель Антон ван ден Брук предположил, что принцип упорядочения периодической таблицы лежит в ядерном заряде каждого атома.Физик Генри Мозли, работающий в Манчестерском университете, проверил эту гипотезу также в 1913 году, незадолго до своей трагической гибели в Первой мировой войне. Мозли начал с фотографирования рентгеновского спектра 12 элементов, 10 из которых занимали последовательные места в таблице. периодическая таблица. Он обнаружил, что частоты особенностей, называемых K-линиями в спектре каждого элемента, прямо пропорциональны квадратам целых чисел, представляющих положение каждого последующего элемента в таблице. Как
Мозли сказал, что это доказательство того, что «в атоме есть фундаментальная величина, которая увеличивается регулярными шагами при переходе от одного элемента к другому.Эта фундаментальная величина, впервые названная атомным номером в 1920 году Эрнестом Резерфордом, работавшим тогда в Кембриджском университете, теперь определяется как число протонов в ядре.
Работа Мозли предоставила метод, с помощью которого можно было точно определить, сколько пустых мест осталось в периодической таблице. После этого открытия химики обратились к использованию атомного номера в качестве фундаментального принципа упорядочения периодической таблицы вместо атомного веса. Это изменение решило многие давние проблемы в расположении элементов.Например, когда йод и теллур были упорядочены в соответствии с атомным весом (сначала йод), два элемента оказались неправильно расположены с точки зрения их химического поведения. Однако при заказе по атомному номеру (сначала теллур) два элемента находились на своих правильных позициях.
Знакомство с Atom
Таблица Менделеева вдохновила не только химиков, но и физиков-атомщиков, пытающихся понять структуру атома.В 1904 году, работая в Кембридже, физик Дж. Дж. Томсон (который также открыл электрон) разработал модель атома, уделяя пристальное внимание периодичности элементов. Он предположил, что атомы определенного элемента содержат определенное количество электронов, расположенных концентрическими кольцами. Кроме того, согласно Томсону, элементы с подобными конфигурациями электронов будут иметь аналогичные свойства; Таким образом, работа Томсона дала первое физическое объяснение периодичности элементов.Хотя Томсон представлял кольца электронов лежащими внутри основного тела атома, а не циркулирующими вокруг ядра, как считается сегодня, его модель действительно представляет собой первый раз, когда кто-либо рассмотрел расположение электронов в атоме, концепцию, которая пронизывает весь мир. вся современная химия.
Датский физик Нильс Бор, первым применивший квантовую теорию к структуре атома, также был мотивирован расположением элементов в периодической системе.В модели атома Бора, разработанной в 1913 году, электроны населяют серию концентрических оболочек, окружающих ядро. Бор рассуждал, что элементы в одной и той же группе периодической таблицы могут иметь идентичные конфигурации электронов в их внешней оболочке и что химические свойства элемента будут в значительной степени зависеть от расположения электронов во внешней оболочке его атомов.
Модель атома Бора также служила для объяснения того, почему благородные газы не обладают реакционной способностью: благородные газы обладают полной внешней оболочкой из электронов, что делает их необычайно стабильными и маловероятными для образования соединений.Действительно, большинство других элементов образуют соединения, чтобы получить полные внешние электронные оболочки. Более поздний анализ того, как Бор пришел к этим электронным конфигурациям, показывает, что он действовал больше как химик, чем это обычно считается. Бор не выводил электронные конфигурации из квантовой теории, но получил их из известных химических и спектроскопических свойств элементов.
В 1924 году другой физик, австрийский Вольфганг Паули, попытался объяснить длину каждой строки или периода в таблице.В результате он разработал принцип исключения Паули, который гласит, что никакие два электрона не могут существовать в одном и том же квантовом состоянии, которое определяется тем, что ученые называют квантовыми числами. Длина различных периодов определяется экспериментальными данными о порядке заполнения электронной оболочки и квантово-механическими ограничениями на четыре квантовых числа, которые могут принимать электроны.
Модификации квантовой теории, внесенные Вернером Гейзенбергом и Эрвином Шредингером в середине 1920-х годов, привели к появлению квантовой механики в той форме, которая используется по сей день.Но влияние этих изменений на таблицу Менделеева было довольно минимальным. Несмотря на усилия многих физиков и химиков, квантовая механика не может больше объяснить периодическую таблицу. Например, он не может объяснить из первых принципов порядок, в котором электроны заполняют различные электронные оболочки. Электронные конфигурации атомов, на которых основано наше современное понимание периодической таблицы, не могут быть получены с помощью квантовой механики (это потому, что фундаментальное уравнение квантовой механики, уравнение Шредингера, не может быть решено точно для других атомов, кроме водорода).В результате квантовая механика может воспроизвести первоначальное открытие Менделеева только с помощью математических приближений – она не может предсказать периодическую систему.
Вариации на тему
В последнее время исследователи предложили различные подходы к отображению периодической системы. Например, Фернандо Дюфур, профессор химии на пенсии из Коллеж Ахунтик в Монреале, разработал трехмерную периодическую таблицу, которая демонстрирует фундаментальную симметрию периодического закона, в отличие от обычной двумерной формы таблицы, которая широко используется.То же самое достоинство также проявляется в версии периодической таблицы в форме пирамиды, форма которой предлагалась много раз, но совсем недавно была усовершенствована Уильямом Б. Дженсеном из Университета Цинциннати.
Еще одним отличием было изобретение периодических систем, нацеленных на обобщение свойств соединений, а не элементов. В 1980 году Рэй Хефферлин из Южного адвентистского университета в Колледдейле, штат Теннеси, разработал периодическую систему для всех мыслимых двухатомных молекул, которые могли образоваться между первыми 118 элементами (на сегодняшний день обнаружено только 112).
ДиаграммаХефферлина показывает, что определенные свойства молекул – например, расстояние между атомами и энергия, необходимая для ионизации молекулы – проявляются в регулярных формах. Эта таблица позволила ученым успешно предсказать свойства двухатомных молекул.
В аналогичных усилиях Джерри Р. Диас из Университета Миссури в Канзас-Сити разработал периодическую классификацию типа органических молекул, называемых бензоидными ароматическими углеводородами. Нафталин (C10H8), содержащийся в нафталиновых шариках, является самым простым примером.Система классификации Диаса аналогична триадам элементов Дёберейнера: любая центральная молекула триады имеет общее количество атомов углерода и водорода, которое является средним значением фланкирующих записей, как в нижнем, так и в поперечном направлении таблицы. Эта схема была применена к систематическому изучению свойств бензоидных ароматических углеводородов и, с использованием теории графов, привела к предсказаниям стабильности и реакционной способности некоторых из этих соединений.
Тем не менее, именно периодическая таблица элементов оказала самое широкое и устойчивое влияние.Периодическая таблица Менделеева, эволюционировавшая в течение более 200 лет благодаря работе многих людей, остается в центре изучения химии. Она считается одной из самых плодотворных идей в современной науке, сравнимой, возможно, с теорией эволюции Чарльза Дарвина. В отличие от таких теорий, как механика Ньютона, она не была фальсифицирована или революционизирована современной физикой, но адаптировалась и созрела, оставаясь по существу невредимой.
Дополнительная литература
Периодическая система химических элементов: история первых ста лет.J. W. van Spronsen. Эльзевир, 1969.
Удивительная таблица Менделеева: десять примечательных фактов. Деннис Х. Руврей в журнале Chemical Intelligencer, Vol. 2, № 3, страницы 39–47; Июль 1996 г.
Классификация, симметрия и периодическая таблица. Уильям Б. Дженсен в “Вычислительной технике и математике с приложениями”, Vol. 12B, №№ 1–2, страницы 487–510; 1989.
Plus ça Change. Э. Р. Скерри по химии в Великобритании, Vol. 30, № 5, страницы 379–381; Май 1994.
Электрон и Периодическая таблица.Эрик Р. Скерри в American Scientist, Vol. 85, страницы 546–553; Ноябрь – декабрь 1997 г.
История Периодической таблицы
Развитие Периодической таблицы
Периодическая таблица Менделеева представляет собой систематическое расположение химических элементов, организованное на основе их электронных конфигураций.
Цели обучения
Обсудите происхождение и историю периодической таблицы Менделеева.
Основные выводы
Ключевые моменты
- Хотя работа алхимиков изначально была ошибочной попыткой превратить свинец в серебро и золото, их исследования заложили основу, которая помогла более позднему фундаментальному пониманию материи.
- Современная таблица Менделеева была разработана Дмитрием Менделеевым и представляет собой полезную основу для организации и анализа химического и физического поведения элементов.
- Обозначения в периодической таблице включают ссылки на атомную массу и атомный номер.
Ключевые термины
- протон : положительно заряженная субатомная частица, составляющая часть ядра атома и определяющая атомный номер элемента; ядро наиболее распространенного изотопа водорода, состоящее из двух верхних кварков и нижнего кварка.
- элемент : любое одно из простейших химических веществ, которое не может быть разложено в химической реакции или каким-либо химическим способом, состоящее из атомов, имеющих одинаковое количество протонов.
- алхимия : Древние поиски универсальной панацеи и философского камня. В конечном итоге этот процесс перерос в химию.
В современной периодической таблице известные элементы организованы несколькими способами: они перечислены в порядке атомного веса, электронной конфигурации, реакционной способности и электроотрицательности.Это настолько хороший метод организации и представления известных элементов, что его использовали для успешного прогнозирования существования определенных элементов. Сегодня он применяется не только химиками, но и во всех смежных науках, чтобы понять свойства и реакционную способность атомов и молекул. Стол известен своим происхождением из 17 века и основан на знаниях и опыте средневековья и более ранних эпох.
Краткая история периодической таблицы – YouTube : От древнегреческих философов до Дмитрия Менделеева профессор Дэвис описывает, как человечество понимало элементы и как их каталогизировать с течением времени.
История Периодической таблицы
Атомная теория восходит к древнегреческим философам и философам эллинистического Египта. Они предположили, что все вещества состоят из фундаментальных строительных блоков; однако природа этих блоков была предметом ожесточенных споров.
Основные блоки были названы атомами, от греческого слова «атмосфера», что означает «неделимый». Ранняя атомная теория пыталась объяснить свойства материи, приписывая атомам атрибуты, которые могли бы соответствовать атрибутам различной материи, которую они объединяли в форму, например скользкость, текучесть, цвет и сплоченность.Философы классифицировали мир вокруг себя по свойствам и функциям – тип подхода, который позже привел к разработке периодической таблицы элементов.
В средние века практикующие алхимию стремились сделать золото и серебро из свинца. Хотя их усилия были напрасными, их исследование в конечном итоге привело к систематическому пониманию химического мира. Это также установило образ мышления, который дал нам периодическую таблицу элементов.
Алхимики находились под влиянием международной торговли, особенно вдоль Великого шелкового пути между Китаем и Европой.Химические знания распространились по культурам, и примерно к середине 18 века было уже 33 известных элемента. В начале XIX века Джозеф Пруст и другие экспериментально демонстрировали закон определенных пропорций. Это предоставило фундаментальное свидетельство того, что вещество существует в чистых соединениях, а не в смесях любых пропорций. Эти наблюдения укрепили атомную теорию и потребовали систематического метода организации элементов.
Обозначения в периодической таблице Менделеева : Обозначения в периодической таблице Менделеева включают ссылки на атомную массу и атомный номер.
Современный взгляд на Периодическую таблицу
Ученые начали замечать сходства и закономерности среди известных элементов, и большой исследовательский интерес XIX века заключался в разработке систематического метода их определения и классификации. Русский профессор химии Дмитрий Менделеев и немецкий химик Юлиус Мейер независимо друг от друга представили свои собственные версии таблицы Менделеева в 1869 и 1870 годах. В конечном итоге подход Менделеева был принят по нескольким причинам: во-первых, он оставил пробелы для элементов, которые еще не были обнаружены.При этом он предсказал элементы галлий и германий. Он также разместил атомы, основываясь в основном на их химических свойствах, а не на атомной массе. Как оказалось, организация по химическому семейству правильно сортирует большинство элементов по их атомным номерам; атомная масса не совсем коррелирует с атомным номером.
Периодическая таблица элементов : Современное представление периодической таблицы, показывающее организацию по атомному номеру и валентности. Обратите внимание, что атомные массы не включены в эту конкретную таблицу Менделеева, однако они обычно указываются под символом элемента.
Современная версия периодической таблицы Менделеева теперь содержит около 118 различных элементов. В периодической таблице число над символом элемента – это атомный номер, который представляет количество протонов в ядре. Атомная масса определяется суммой нейтронов и протонов.
Периоды с 1 по 3
Элементы одного периода имеют одинаковое количество электронных оболочек.
Цели обучения
Обсудите взаимосвязь между электронной структурой атома и его периодом (строкой) в периодической таблице.
Основные выводы
Ключевые моменты
- По мере того, как вы перемещаетесь через период (через таблицу справа), электронные оболочки элементов в этот период заполняются, приближаясь к стабильной конфигурации благородного газа в конце этой строки.
- Для любого элемента в периодах 1, 2 и 3 элементы непосредственно над и под ним являются членами одной группы и имеют аналогичные химические свойства, основанные на аналогичном расположении валентных электронов.
- Принцип Ауфбау описывает, как электроны помещаются на орбитали в определенном порядке для заполнения.
Ключевые термины
- атом : Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, теперь известно, что оно состоит из ядра, окруженного электронами.
- электрон : субатомная частица, имеющая отрицательный заряд и вращающаяся вокруг ядра; поток электронов в проводнике составляет электричество.
- электронная оболочка : Коллективные состояния всех электронов в атоме с одинаковым главным квантовым числом (визуализируются как орбита, по которой движутся электроны).
Ранние философы и ученые понимали, что материя состоит из атомов и что многие элементы реагируют друг с другом в предсказуемых пропорциях. Периодическая таблица была создана для того, чтобы организовать эти наблюдения и измерения. Возник принцип валентности, связанный с наличием или отсутствием электронов и энергией этих электронов в объеме вокруг ядра атома. Электроны, отрицательно заряженные субатомные частицы, определяют химическую реакционную способность атома.Электроны организованы в энергетические уровни или электронные оболочки, которые соответствуют периодам в периодической таблице.
Атом Бора
Нилс Бор предложил упрощенную картину атома с центральным ядром, окруженным электронами на определенных энергетических уровнях (n). Таблица Менделеева систематизирует уровни энергии в периодах, строках таблицы. Самые простые атомы, водород и гелий, находятся в строке 1 или первом периоде. Эти атомы имеют электроны, занимающие уровень энергии n = 1.Спускаясь вниз, строка 2 или период 2 содержит элементы от Li (литий) до Ne (неон). Элементы в периоде 2 полностью заполнены энергией уровня n = 1; они продолжают заполнять свои n = 2 уровня, перемещаясь по таблице вправо. Аналогичным образом, переходя на один период вниз к строке 3, появляются элементы от Na (натрий) до Ar (аргон). Атомы периода-3 имеют заполненные уровни n = 1 и n = 2; они заполняют уровень n = 3, перемещаясь по таблице.
Упрощенное изображение атомной структуры : С ядром в центре с положительным зарядом электроны «организованы» в энергетические уровни или оболочки на увеличивающихся расстояниях от ядра.Расстояние между оболочками n = 2 и n = 3 на этом рисунке – это разница в энергии между ними.
Важно помнить, что периодическая таблица представляет собой представление атомов с нулевым чистым зарядом; у них столько электронов вокруг ядра, сколько протонов в ядре.
Таблица Менделеева : Элементы расположены в соответствии с электронной конфигурацией с периодичностью по валентности.
Принцип Ауфбау
На энергетических уровнях n = 1, n = 2 и n = 3 электроны организованы в орбитали, обозначенные как s, p, d и f.Например, атомный номер Ne (неон) равен 10 и содержит 5 орбиталей (1s, 2s, 2p x , 2p y и 2p z ). На каждой полной орбитали есть 2 электрона, что в сумме дает 10 для уравновешивания положительного заряда, обеспечиваемого 10 протонами в ядре.
Заполненные орбитали атома неона : Изображение орбиталей и их симметрии для атома неона (Ne). Уровни 1s и 2s показаны сфероидами, а три орбитали 2p показаны как разделенные сфероиды.Каждая полная орбиталь имеет 2 электрона, что дает всего 10 для этого элемента.
В периодической таблице есть 2 электрона в периоде 1, в то время как периоды 2 и 3 имеют 8 электронов на заполненном уровне. Для атомов с атомными номерами менее 20 применяется правило октетов добавления электронов и заполнения орбиталей. Это просто означает, что уровни n = 2 и n = 3, в частности, заполнены, когда есть 8 электронов. Принцип Ауфбау описывает, как электроны помещаются на орбитали в определенном порядке для заполнения.
Принцип Ауфбау : Принцип Ауфбау описывает постепенное заполнение орбиталей и построение атомов с известными электронными конфигурациями.
Переходные металлы
Элементы d-блока широко известны как переходные металлы или переходные элементы.
Цели обучения
Определяет отличительные и характерные свойства переходных металлов.
Основные выводы
Ключевые моменты
- Переходные металлы – это элементы в десяти средних группах четвертого, пятого, шестого и седьмого периодов периодической таблицы.
- Переходные металлы и их соединения могут проявлять цвет из-за внутренних переходов электронов d-d.
- Переходные металлы и их соединения могут проявлять ферромагнетизм, парамагнетизм и диамагнетизм.
- Переходные металлы и их соединения хорошо известны своей каталитической активностью.
Ключевые термины
- парамагнитный : проявляющий парамагнетизм; тенденция магнитных диполей выравниваться с внешним магнитным полем.
- Состояние окисления : Состояние атома с определенной степенью окисления.
- диамагнитный : проявляющий диамагнетизм; отталкивается магнитом.
D-блок Периодической таблицы
Переходные металлы также известны как переходные элементы или элементы d-блока. Как следует из названия, химический состав этой группы определяется степенью заполнения суборбитальных уровней d-электронов. Химическое сходство и периодичность можно легко увидеть по горизонтали через d-блок периодической таблицы.
D-блок периодической таблицы : D-блок состоит из групп 3-12 и периодов 4-7.
Однако химия далеко не проста, и есть много исключений из упорядоченного заполнения электронной оболочки. Принцип Ауфбау обеспечивает методическую основу для предсказания порядка, в котором большинство атомов будет заполнять свои электронные оболочки.
Принцип Ауфбау : Это иллюстрирует порядок, в котором большинство атомов заполняют свои электронные оболочки.
Химические свойства в периодической таблице сгруппированы по схожим химическим и физическим свойствам по вертикали по группам. Например, металлы в группе 11 имеют схожие характеристики электропроводности, блеска, кристаллической структуры, пластичности и прочности на разрыв. При движении по горизонтали через периодическую таблицу наблюдаются тенденции таких свойств, как атомный радиус, электроотрицательность и сродство к электрону.
Характерные свойства переходных металлов
Переходные металлы, можно сказать, обладают следующими характеристиками, которые обычно не встречаются в основной группе периодической таблицы.В основном это связано с неполным заполнением электронных d-уровней:
- Образование соединений, цвет которых обусловлен d – d электронными переходами.
- Образование соединений во многих степенях окисления из-за относительно низкой реакционной способности неспаренных d электронов.
- Образование многих парамагнитных соединений из-за наличия d неспаренных электронов. Некоторые соединения элементов основной группы также являются парамагнитными (например,г., оксид азота, кислород).
Переход лиганда с переносом заряда на металл (LMCT)
Цвет в соединениях металлов переходного ряда обычно возникает из-за электронных переходов двух основных типов переходов с переносом заряда. Электрон может перескакивать с орбитали, в которой преобладает лиганд, на орбиталь, в которой преобладает металл, что приводит к переходу с переносом заряда лиганда на металл (LMCT). Это наиболее легко может произойти, когда металл находится в высокой степени окисления. Например, цвет ионов хромата, дихромата и перманганата обусловлен переходами LMCT.Другой пример – йодид ртути (HgI 2 ) имеет красный цвет из-за перехода LMCT.
Комплексы с переносом заряда : I 2 • PPh 3 Комплексы с переносом заряда в CH 2 Cl 2 . Слева направо: (1) I 2 , растворенный в дихлорметане – нет комплекса CT. (2) Через несколько секунд после добавления избытка PPh 3 – образуется комплекс CT. (3) Через минуту после добавления избытка PPh 3 образовался комплекс CT [Ph 3 PI] + I – .(4) Сразу после добавления избытка I 2 , который содержит [Ph 3 PI] + [I 3 ] – .
Переход с переносом заряда металл-лиганд (MLCT) наиболее вероятен, когда металл находится в низкой степени окисления, а лиганд представляет собой легко восстанавливаемый переход d – d . Электрон перескакивает с одной d-орбитали на другую. В комплексах переходных металлов не все орбитали d имеют одинаковую энергию.
Парамагнитные и диамагнитные соединения
Соединения переходных металлов являются парамагнитными, если они имеют один или несколько неспаренных d электронов. Некоторые соединения диамагнитны. К ним относятся октаэдрические, низкоспиновые, d 6 и квадратно-плоские d 8 комплексы. В этих случаях расщепление кристаллического поля таково, что все электроны спарены. Ферромагнетизм возникает, когда отдельные атомы парамагнитны, а векторы спинов выровнены параллельно друг другу в кристаллическом материале.Металлическое железо и сплав альнико являются примерами ферромагнитных материалов, содержащих переходные металлы. Антиферромагнетизм – еще один пример магнитного свойства, возникающего из-за определенного выравнивания отдельных спинов в твердом состоянии.
Переходные металлы и их соединения известны своей гомогенной и гетерогенной каталитической активностью. Эта активность объясняется их способностью принимать несколько степеней окисления и образовывать комплексы.
Нижняя часть периодической таблицы
Периодическая таблица Менделеева в настоящее время содержит 7 периодов, но теоретики предсказывают, что могут существовать два дополнительных периода.
Цели обучения
Определите ключевые характеристики элементов f-блока.
Основные выводы
Ключевые моменты
- Ряды лантаноидов и актинидов получают свойства от электронов f-блока.
- Четыре элемента из ряда актинидов встречаются в природе, пять изотопов других иногда образуются при распаде урана, а остальные трансурановые соединения были произведены синтетическим путем.
- Наибольший синтезированный на сегодняшний день атомный номер 118, элемент унунокций (Uuo).
Ключевые термины
- лантаноид : Любой из 14 редкоземельных элементов от лантана до лютеция в периодической таблице. Поскольку их внешние орбитали пусты, у них очень похожий химический состав. Под ними – актиниды.
- актинид : Любой из 14 радиоактивных элементов периодической таблицы, которые расположены под лантаноидами, с которыми они имеют схожий химический состав.
- трансуран : трансурановый.Трансурановый элемент – это любой синтетический элемент, атомный номер которого больше, чем у урана (92).
Есть несколько способов подойти к этой конкретной теме, и все они относятся к тому, как представлены элементы в самой таблице.
Самое классическое представление таблицы Менделеева показывает взаимное расположение известных элементов в таблице. Сама таблица состоит из 7 периодов и 18 групп, из которых самым последним известным элементом является номер 118, ununoctium.Однако в таблице наблюдается явный разрыв. В строке 6, столбце 3, пустое пространство появляется между Ba и Hf. Атомный номер, который должен быть здесь, 57, находится внизу таблицы в строке, называемой лантаноидами. Непосредственно под пространством в строке 6 в строке 7 находится еще одно пустое пространство, которое заполнено строкой, называемой актинидами, также видимой в нижней части диаграммы.
Периодическая таблица : это стандартное представление элементов в таблице с относительным расположением, знакомым химикам и физикам.
Расширение измерений Периодической таблицы
Увеличивая горизонтальные размеры стола, ряды актинидов и лантаноидов могут быть размещены в их правильных относительных положениях. Поскольку химический состав этой группы в основном основан на электронах f-оболочки и взаимодействиях на этом уровне энергии, это называется f-блоком. Это неуклюжее представление правильно показывает элементы, известные на сегодняшний день, вплоть до z = 118, unonoctium. Фактически, это представление является предсказательным, поскольку оно показывает химические семейства (группы) и периодичности (периоды) в их правильных относительных положениях.
Расширенная таблица Менделеева : лантаноиды и актиниды добавляются в виде отдельных, но связанных строк, образуя так называемый f-блок.
Если продолжить расширение периодической таблицы, рассмотрим элемент с атомным номером 92 в ряду актинидов, называемый ураном. Когда в конце 19 века были обнаружены элементы этого диапазона атомных номеров, изотопы урана были самыми крупными и тяжелыми элементами, известными в природе. В 1934 году Энрико Ферми предсказал существование трансурановых элементов – элементов с атомным номером (z) больше или равным 93.В 1934 году было известно только 4 актинида, все меньше урана, поэтому не было известно, образуют ли они период или семейство, подобное лантаноидам. Первый трансурановый элемент, Np (нептуний), был синтезирован в 1940 году путем бомбардировки урана медленными нейтронами. В течение следующих двух десятилетий было произведено очень много изотопов актинидов, как правило, путем бомбардировки другими атомами или субатомными частицами. Актиниды добавляли вместе с лантаноидами.
Два новых периода
Используя предсказательные свойства периодической таблицы, наряду с растущим опытом в атомной и субатомной теории, были предсказаны два совершенно новых периода.По совету Гленна Сиборга и других, периоды 8 и 9 были добавлены в таблицу Менделеева, включая g-блок. Расположение g-блока в таблице (слева от f-блока, справа или между ними) является предположительным. Позиции в таблице соответствуют предположению, что правило Маделунга (что орбитали с более низким значением суммы квантовых чисел n и l будут заполнены раньше, чем орбитали с более высокими значениями n + l) будет продолжать выполняться для более высоких атомных номеров. В элементе 118 предполагается, что заполнены орбитали 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s и 7p, с незаполненными оставшимися орбиталями.Орбитали восьмого периода будут заполнены в порядке 8s, 5g, 6f, 7d, 8p. Однако после элемента 120 близость электронных оболочек делает проблематичным размещение в простом столе.
Расширенная периодическая таблица с предсказанными периодами 8 и 9 : Периодическая таблица со всеми группами и периодами. Размещение неоткрытого G-блока является спекулятивным.
Существование элементов с такими высокими атомными номерами является спекулятивным, и ожидается, что изотопы будут иметь очень короткие периоды полураспада.Различные эксперты предсказывают, что z = приблизительно 130 является максимумом, в то время как другие считают, что эффективного верхнего предела нет. Эксперименты по синтезу трансурановых элементов продолжаются.
Положение таблицы Менделеева и электронная конфигурация
Положение элементов в периодической таблице напрямую связано с их электронной конфигурацией.
Цели обучения
Используйте периодическую таблицу для определения свойств атомов, таких как группы и электронные конфигурации.
Основные выводы
Ключевые моменты
- Элементы организованы по периоду и группе, причем период соответствует основному уровню энергии, а группа – степени заполнения подоболочек.
- Свойства атома напрямую связаны с количеством электронов на различных орбиталях, и периодическая таблица очень похожа на дорожную карту для этих орбиталей, так что химические свойства могут быть выведены по положению элемента на таблице.
- Электроны во внешней или валентной оболочке особенно важны, потому что они могут участвовать в совместном использовании и обмене, который отвечает за химические реакции.
Ключевые термины
- квантовое число : Одно из определенных целых или полуцелых чисел, которые определяют состояние квантово-механической системы (например, электрона в атоме).
- орбитальный : Спецификация энергии и плотности вероятности электрона в любой точке атома или молекулы.
- электронная оболочка : Коллективные состояния всех электронов в атоме с одинаковым главным квантовым числом (визуализируются как орбита, по которой движутся электроны).
Основные деления Периодической таблицы Менделеева
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Элементы представлены в возрастающем атомном номере. Основная часть таблицы представляет собой сетку 18 × 7.Элементы с одинаковым числом валентных электронов хранятся вместе в группах, таких как галогены и благородные газы. Есть четыре различных прямоугольных области или блока. F-блок обычно не включается в основную таблицу, а размещается ниже, поскольку встроенный f-блок часто делает таблицу непрактично широкой. Используя периодические тенденции, таблица Менделеева может помочь предсказать свойства различных элементов и отношения между свойствами. Таким образом, он обеспечивает полезную основу для анализа химического поведения и широко используется в химии и других науках.
Атомные орбитали
Электроны в частично заполненной самой внешней оболочке (или оболочках) определяют химические свойства атома; ее называют валентной оболочкой. Каждая оболочка состоит из одной или нескольких подоболочек, а каждая подоболочка состоит из одной или нескольких атомных орбиталей.
Свойства атома зависят в конечном итоге от числа электронов на различных орбиталях и от заряда ядра, который определяет компактность орбиталей. Чтобы связать свойства элементов с их расположением в периодической таблице, часто удобно использовать упрощенный вид атома, в котором ядро окружено одной или несколькими концентрическими сферическими «оболочками», каждая из которых состоит из орбиталей с наивысшим главным квантовым числом, содержащих по крайней мере один электрон; это s- и p-орбитали и могут включать d- или f-орбитали, которые зависят от атома.Модель оболочки, как и любая научная модель, – это не столько описание мира, сколько упрощенный взгляд на него, который помогает нам понимать и соотносить различные явления.
Мы рассмотрим несколько визуализаций таблицы Менделеева. Однако сначала было бы поучительно посмотреть, как это устроено с логической точки зрения. Таблица сегодня является результатом непрерывных усилий более чем 100 лет наблюдений, измерений, предсказаний и доказательств взаимосвязи химических и физических явлений с электронными конфигурациями и зарядами.
Периоды 1, 2 и 3
Начиная с простых элементов, первые три строки периодической таблицы, называемые периодами 1, 2 и 3, соответствуют уровням n = 1, n = 2 и n = 3.
Конфигурации электронных оболочек первых 18 элементов : Конфигурации электронных оболочек первых 18 элементов периодической таблицы. Соответствующие уровни энергии (n) указаны зелеными цифрами слева. Число электронов внешней оболочки представлено крайней правой цифрой в номерах групп.
Водород имеет 1 электрон на уровне 1s, а справа, гелий в Группе 18, имеет 2 электрона на уровне 1s, полностью заполненная оболочка, правило дуэта. Гелий – первый из благородных газов. Переходя к периоду 2, литий является первым элементом в строке с заполненной конфигурацией единиц. В течение периода сначала заполняются 2s, а затем 2p орбитали, достигая конфигурации для неона, следуя правилу октетов. Период 3 следует аналогичной схеме. Обратите внимание, что количество электронов внешней оболочки является основным фактором, определяющим валентность элемента.
Конфигурации электронных оболочек элементов : Положение в периодической таблице на основе конфигурации электронных оболочек. На этом изображении показана вся таблица Менделеева с диаграммами атомов и электронных оболочек, заполняемых движением по таблице. На этом изображении численно показана электронная конфигурация, показывающая населенность электронов в каждой подоболочке, начиная каждый период с полностью заполненного благородного газа.
Периодическая таблица с указанием электронных оболочек : Элементы в этой таблице расположены в стандартной конфигурации периодов и групп.Каждый блок включает представление структуры электронной оболочки элемента.
Электронная конфигурация катионов и анионов
Элементы периодической таблицы демонстрируют разные уровни реактивности в зависимости от количества электронов в их оболочках с наивысшей энергией.
Цели обучения
Предсказать, подвергнется ли атом ионизации с образованием аниона или катиона, на основе его электронной конфигурации валентной оболочки.
Основные выводы
Ключевые моменты
- Электронная конфигурация многих ионов – это ближайший к ним благородный газ в периодической таблице.
- Анион – это ион, который приобрел один или несколько электронов и приобрел отрицательный заряд.
- Катион – это ион, который потерял один или несколько электронов и приобрел положительный заряд.
Ключевые термины
- анион : отрицательно заряженный ион, в отличие от катиона
- ионизация : Любой процесс, который приводит к диссоциации нейтрального атома или молекулы на заряженные частицы (ионы).
- катион : положительно заряженный ион, в отличие от аниона.
Катионы и анионы образуются из нейтральных атомов
Каждый атом в основном состоянии незаряжен. В соответствии с его атомным номером, он имеет такое же количество протонов и электронов. Однако электроны довольно лабильны, и атом часто приобретает или теряет их в зависимости от своей электроотрицательности. Движущей силой для такого увеличения или уменьшения количества электронов является энергетически оптимальное состояние наличия полной валентной (самой внешней) оболочки электронов. В таком состоянии образующийся заряженный атом имеет электронную конфигурацию благородного газа.
Добавление электрона нарушит протон-электронный баланс и оставит атом с отрицательным зарядом. Удаление электрона, наоборот, оставит атом положительно заряженным. Эти заряженные атомы известны как иона .
Образование одноатомных ионов
Одноатомные ионы образуются путем добавления или удаления электронов из валентной оболочки атома. Внутренние оболочки атома заполнены электронами, которые прочно связаны с положительно заряженным атомным ядром и поэтому не участвуют в таком химическом взаимодействии, но валентная оболочка может быть очень реактивной в зависимости от атома и его электронной конфигурации.Процесс получения или потери электронов нейтральным атомом или молекулой называется ионизацией .
Атомы можно ионизировать путем бомбардировки излучением, но более чисто химический процесс ионизации – это перенос электронов между атомами или молекулами. Этот перенос осуществляется за счет стабилизации, которая достигается за счет получения стабильных (полностью оболочковых) электронных конфигураций. Атомы будут получать или терять электроны в зависимости от того, какое действие требует наименьшей энергии.
Например, элемент натрия группы 1 (Na) имеет один электрон в валентной оболочке с полными оболочками из 2 и 8 электронов под ним.Удаление этого одного электрона делает натрий стабильным: его внешняя оболочка теперь содержит восемь электронов, что придает натрию электронную конфигурацию неона. Получив положительный заряд, ион натрия называется катионом . Ионизацию натрия можно химически проиллюстрировать следующим образом:
Na → Na + + e –
Натрий может получать электроны, но для достижения полной валентной оболочки потребуется еще семь. Удалить один электрон намного проще, чем получить семь, и поэтому натрий в каждом химическом сценарии достигнет своего октета, превратившись в катион.
С другой стороны, атом хлора (Cl) имеет семь электронов в валентной оболочке, что на один меньше стабильной полной оболочки с 8 электронами. Таким образом, атом хлора стремится к , получить дополнительных электронов и достичь стабильной 8-электронной конфигурации (такой же, как у аргона), становясь при этом отрицательным анионом хлорида :
Cl + e− → Cl –
Сочетая склонность натрия терять электрон и хлорида приобретать электрон, мы наблюдаем дополнительную реакционную способность.При объединении незаряженные атомы могут обмениваться электронами и при этом достигать полных валентных оболочек. Образующиеся ионы слипаются за счет ионных связей (притягиваются противоположные заряды), образуя структуру кристаллической решетки NaCl, более известную как каменная соль. Реакция следующая:
Na + + Cl – → NaCl
Многоатомные и молекулярные ионы
Ионизация не ограничивается отдельными атомами; также могут образовываться многоатомные ионы. Многоатомные и молекулярные ионы часто создаются добавлением или удалением элементарных ионов, таких как H + , в нейтральных молекулах.Например, когда аммиак NH 3 принимает протон H + , он образует ион аммония NH 4 + . Аммиак и аммоний имеют одинаковое количество электронов в одной и той же электронной конфигурации, но у аммония есть дополнительный протон (H + ), который дает ему чистый положительный заряд.
Химическое обозначение
При написании химической формулы иона его суммарный заряд записывается в верхнем индексе сразу после химической структуры молекулы или атома.Чистый заряд записывается с величиной перед знаком , то есть двухзарядный катион обозначается как 2 + вместо +2 . Однако величина заряда не указана для однозарядных молекул или атомов; например, катион натрия обозначается как Na + и , а не Na 1+ .
Альтернативный способ показать молекулу или атом с несколькими зарядами – это нарисовать знаки несколько раз; это часто наблюдается с переходными металлами.Химики иногда обводят знак; это просто орнамент и не меняет химического значения. Дважды положительно заряженный атом железа можно также выразить как Fe 2+ или Fe ++ .
В случае переходных металлов степени окисления могут быть указаны римскими цифрами; например, Fe 2+ иногда называют Fe (II) или Fe II . Римская цифра обозначает формальную степень окисления элемента, а цифры с надстрочным индексом обозначают чистый заряд.Таким образом, эти два обозначения можно заменить на одноатомные ионы, но римские цифры не могут применяться к многоатомным ионам. Однако можно смешивать обозначения для отдельного металлического центра с многоатомным комплексом, как показано на примере уранилового иона (UO 2 ).
Следует отметить, что из атома можно удалить много электронов. Энергия, необходимая для этого, может быть записана на диаграмме последовательной энергии ионизации.
Первая энергия ионизации : Периодические тенденции для энергии ионизации (IE) vs.атомный номер: обратите внимание, что в каждом из семи периодов IE (цветные кружки) элемента начинается с минимума для первого столбца Периодической таблицы (щелочные металлы) и увеличивается до максимума для последнего столбца (благородный газы), которые обозначены вертикальными линиями и помечены символом элемента благородного газа, а также служат линиями, разделяющими 7 периодов. Обратите внимание, что максимальная энергия ионизации для каждой строки уменьшается по мере перехода от строки 1 к строке 7 в данном столбце из-за увеличения расстояния внешней электронной оболочки от ядра по мере добавления внутренних оболочек.
| 7 | 87 223,02 Франций | 88 226,03 Радий | ** | 103 262,11 Лоуренсий | 104 267.12 Резерфордий | 105 270,13 Дубний | 106 269,13 Сиборгий | 107 270,13 Бориум | 108 269.13 Калий | 109 278,16 Мейтнерий | 110 281,17 Дармштадтиум | 111 281,17 Рентгений | 112 285.18 Copernicium | 113 286,18 Нихоний | 114 289,19 Флеровий | 115 289,20 Московий | 116 293.20 Ливерморий | 117 293,21 Теннессин | 118 294,21 Оганессон | ** Актиноиды | ** | 89 227,03 Актиний | 90 232.04 Торий | 91 231,04 Протактиний | 92 238,03 Уран | 93 237,05 Нептуний | 94 244,06 Плутоний | 95 243.06 Америций | 96 247,07 Кюрий | 97 247,07 Беркелиум | 98 251,08 Калифорний | 99 252,08 Эйнштейний | 100 257.10 Фермий | 101 258,10 Менделевий | 102 259,10 Нобелий |
|---|
Бериллий – информация об элементе, свойства и применение
Расшифровка:
Химия в ее элементе: бериллий
(Promo)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, на этой неделе элемент, который забыл Big Bang, но который вернулся обратно как материал, из которого сделаны лучшие в мире пружины. Он также дал нам великолепные драгоценные камни, искробезопасные инструменты для нефтяной промышленности и смертельное заболевание легких.
Ричард Ван Норден
Во время Большого взрыва образовались только водород, гелий и литий. Следующий элемент, бериллий, относительно редко встречается во Вселенной, потому что он также не образуется в ядерных топках звезд.Чтобы получить этот металл, требуется сверхновая, в которой распадаются более тяжелые ядра.
Ранее планы по использованию бериллия в больших количествах в аэрокосмической промышленности не реализовались, хотя его легкость и прочность делали его идеальным металлом для таких целей. Одно время даже предполагалось, что бериллиевый порошок будет использоваться в качестве топлива для ракет из-за колоссального количества тепла, которое он выделяет при сгорании. Сейчас ежегодно очищается менее 500 тонн металла, поскольку он опасно токсичен.
Бериллий не имеет известной биологической роли, а его пыль вызывает хроническое воспаление легких и одышку. Кратковременное воздействие большого количества бериллия или длительное воздействие небольшого количества вызывает это заболевание легких, известное как бериллиоз. Заболевание может проявиться в течение пяти лет, и около трети заболевших умирают преждевременно, а остальные становятся инвалидами. Наибольшему риску подвергались рабочие в отраслях, использующих бериллиевые сплавы, например, те, кто производил люминесцентные лампы ранних типов, которые были покрыты изнутри оксидной пленкой, содержащей бериллий.В 1950 году производство этого типа ламп было прекращено.
Минералы берилл и изумруд являются силикатами бериллия и были известны древнему миру; Император Нерон использовал большой изумруд, чтобы лучше видеть гладиаторские бои в этом районе. Их красивый зеленый цвет обусловлен следами хрома. Анализ кислорода в этих драгоценных камнях позволяет идентифицировать их источник, поскольку соотношение изотопов кислорода-18 и кислорода-16 варьируется в зависимости от того, где находится минерал. Римляне получали изумруды в основном из Австрии, хотя некоторые из них были доставлены даже из Пакистана.Более удивительным было открытие, что могольские правители Индии получали некоторые из них из Колумбии в Южной Америке, вероятно, через торговлю через Тихий океан. Основные руды бериллия – берилл и бертрандит, который также является силикатом. Иногда обнаруживаются действительно огромные кристаллы бертранида: один экземпляр, найденный в штате Мэн в США, имел длину более 5 метров и весил почти 20 тонн.
В том, что берилл и изумруд могут содержать новый элемент, подозревалось 18, -м, веком, и Николас Луи Воклен проанализировал их, и 15 февраля 1798 года он объявил, что они содержат новый элемент, но не смог отделить его от его окись.Металлический бериллий был выделен в 1828 году из хлорида бериллия (BeCl 2 ) реакцией его с калием.
Бериллий должен был сыграть историческую роль в развитии наших знаний в области теории атома, поскольку он помог открыть фундаментальную частицу – нейтрон. Это было обнаружено в 1932 году Джеймсом Чедвиком, который бомбардировал образец бериллия альфа-лучами (которые являются ядрами гелия), исходящими от радия. Он заметил, что затем он испустил субатомную частицу нового типа, которая имела массу, но не имела заряда.Комбинация радия и бериллия до сих пор используется для генерации нейтронов в исследовательских целях, хотя миллион альфа-частиц способен произвести только 30 нейтронов.
Бериллий – серебристо-белый, блестящий, относительно мягкий металл второй группы периодической таблицы. На металл не действуют ни воздух, ни вода, даже при нагревании до красного. Когда медь и никель сплавлены с бериллием, они не только лучше проводят электричество и тепло, но и демонстрируют замечательную эластичность. По этой причине из их сплавов получаются хорошие пружины, а медный сплав используется для изготовления искробезопасных инструментов, которые разрешены только в таких чувствительных областях, как нефтеперерабатывающие заводы.
Бериллий имеет только один изотоп, бериллий-9, который не является радиоактивным, но бериллий-10, который космические лучи производят в верхних слоях атмосферы, является радиоактивным с периодом полураспада 1,5 миллиона лет. Радиоактивный бериллий-10 был обнаружен в ледяных кернах и морских отложениях Гренландии, и количество, которое было измерено в ледяных кернах, отложенных за последние 200 лет, увеличивается и уменьшается в соответствии с активностью Солнца, о чем свидетельствует частота появления солнечных пятен. Количество этого изотопа в морских отложениях, отложившихся в последний ледниковый период, было на 25% выше, чем в послеледниковых отложениях.Это говорит нам о том, что магнитное поле Земли тогда было намного слабее, чем сейчас.
Крис Смит
Ричард Ван Норден с историей о бериллии. В следующий раз мы расскажем историю о паре близнецов, которые могут сделать жизнь стеклодува намного безопаснее.
Андреа Селла
Однажды, когда он стоял у токарного станка, и перед ним бушевал оранжевый ад, я спросил его, в каких очках он был одет. «Didymium», – загадочно ответил он, а затем, заметив мой пустой взгляд, добавил: «Гасит свет.Попробуйте их ». Он передал мне свои очки, линзы странного зеленовато-серого цвета. Я надел их, и внезапно пламя исчезло. Все, что я мог видеть, это раскаленный кусок вращающегося стекла, не заслоненный ярким светом. удивленно таращился, пока Джефф не снял очки с моего лица, сказав: «Верни их, дурак», и вернулся к своей работе. химия с Андреа Селла на следующей неделе на Chemistry in its Element, я очень надеюсь, что вы присоединитесь к нам.Я Крис Смит, спасибо за внимание и до свидания.
(Промо)
(Окончание промо)
местоположение, местоположение, местоположение ›Bernie’s Basics (ABC Science)
Основы Берни
Периодическая таблица Менделеева может выглядеть как наполовину законченная игра в Тетрис, но ее расположение объясняет, почему жизнь основана на углероде, почему железо ржавеет и почему Дэн Браун стал бестселлером.
Берни Хоббс
Элементы в периодической таблице упорядочены по количеству протонов и электронов, которые у них есть. (Источник: istockphoto)
Периодическая таблица Менделеева представляет собой список всех известных элементов – от кислорода до неона и от эйнштейния до урана. Для такой важной таблицы это выглядит неоднозначно. Но причудливый макет не потому, что наука не могла позволить себе приличного специалиста по графике – он изложен таким образом, чтобы показать нам две самые важные вещи об атомах любого элемента:
- , сколько протонов находится в ядре, и
- сколько электронов гудит во внешней оболочке.
Может показаться, что это не так уж много, но один протон и один электрон – единственное различие между атомами углерода в алмазе и атомами азота, которые составляют 80 процентов воздуха, которым мы дышим.
Протоны решают, каким элементом является атом, в то время как внешние электроны решают, как атом ведет себя химически. И между ними они определяют, какие элементы могут проводить тепло и электричество, какие являются газами, а какие могут быть основой жизни. в начало
Строки и электронные оболочки
Электроны не летают вокруг ядра атома, как мухи вокруг навоза – они существуют в разных энергетических «оболочках».Каждая оболочка может содержать только определенное количество электронов, и оболочки необходимо заполнять в порядке от ближайшей к ядру.
Начиная с ближайшей к ядру оболочки, электронные оболочки атома могут содержать два, восемь, восемь, 18, 18, 32 и 32 электрона. И в порядке сверху вниз, строки периодической таблицы содержат два, восемь, восемь, 18, 18, 32 и 32 элемента. Поэтому, когда вы видите положение элемента в таблице, вы сразу можете сказать, насколько заполнена его внешняя электронная оболочка.
Водород в строке 1, столбце 1 имеет один электрон в оболочке 1. Натрий (Na, строка 3, столбец 1) имеет один электрон в своей третьей оболочке. Магний (Mg) имеет два внешних электрона, кислород (O) – 6, а углерод (C) и кремний (Si) – четыре. А в крайнем правом столбце – шесть известных элементов с полной внешней оболочкой, благородные газы.
А для атомов полная внешняя оболочка – это то, где она находится. Атомы с полной внешней оболочкой химически стабильны – они могут оставаться без изменений до конца вечности (или, по крайней мере, до тех пор, пока их не проглотит солнце или не засосет в черную дыру и не сольется с другими атомами).Но в то время как только благородные газы «рождаются» таким образом, все остальные элементы могут фальсифицировать свой путь к более стабильному существованию. Их атомы могут делиться, красть или выгружать электроны, образуя химические связи с другими атомами, так что каждый из них может получить полную внешнюю оболочку.
И вот здесь раскладка стола действительно проявляет себя. Подобно руководству по подбору совпадений для элементов, которые не совсем благородны, вы можете с первого взгляда сказать, что с чем сочетается и сколько раз.
Снаряды? Ладно ладно! На самом деле электронов нет в оболочках; они находятся в облаках вероятности с разными уровнями энергии.наверх
Колонны и спичечные, солено-водные
Атомы, стремящиеся к партнерству с другими атомами, чтобы создать полную внешнюю электронную оболочку, просто должны следовать нескольким периодическим правилам «датировки».
- Все, что находится слева от таблицы (металлы, выделено синим цветом), должно потерять электроны.
- Все, что справа (неметаллы, отмечено зеленым), должно получить электроны.
Неметаллы могут получать электроны, похищая их у металлов (ионная связь, например, соль) или разделяя часть своих электронов с некоторыми электронами другого атома (ковалентная связь, например, вода).
И причина правил сводится к тому, сколько энергии притяжения электронов имеют ваши протоны.
Единственное, что не дает электронам атома улететь в космос, – это сила притяжения протонов. Протоны положительны, электроны отрицательны – это классика: мальчик встречает девушку и встречает субатомную теорию.
Каждый электрон удерживается на своем месте благодаря объединенной силе притяжения всех протонов в ядре. Но чем дальше от ядра удаляются электроны, тем менее эффективной становится сила притяжения протонов.
Натрий (Na) состоит из одиннадцати протонов и одиннадцати электронов. Все электроны ощущают притяжение 11 протонов, но оно сильнее всего для двух внутренних и немного менее сильно для восьми во второй оболочке. Одинокий электрон во внешней оболочке настолько далеко от ядра, что его почти не тянет.
В столбце VII того же ряда хлор (Cl) имеет 17 протонов и 17 электронов. Два электрона в его первой оболочке удерживаются даже сильнее, чем во внутренней оболочке натрия, потому что они чувствуют воздействие всех 17 протонов.Электроны второй оболочки расположены немного ближе к ядру, чем электроны натрия по той же причине. И эти 17 протонов очень прочно удерживают семь электронов внешней оболочки. Внешний электрон никак не может вырваться из атома хлора (если не считать того, что его ткнул бы эквивалентом атомного шкворня). Фактически, их притягивающей силы достаточно, чтобы протоны хлора могли захватить и удержать случайный внешний электрон натрия.
Большинство элементов имеют внешние электроны, которые так же слабо связаны, как электроны натрия.Мы называем их металлами. Не потому, что из них получаются отличные сковороды или автомобильные детали, потому что свободные электроны делают их отличными проводниками тепла и электричества.
Но неметаллам не нужно красть электрона, чтобы заполнить свои внешние оболочки. В отличие от металлов они могут делиться электронами друг с другом благодаря всем этим протонам в своих ядрах и создавать внешнюю оболочку «меньше значит больше».
Кислород существует в виде молекул O2, где два атома кислорода объединяют два своих внешних электрона в общую структуру, поэтому каждый атом имеет восемь внешних электронов в своей внешней оболочке.Намного стабильнее, чем одинокая жизнь…
Но кислород может выходить за пределы своего вида, что для нас удачно, потому что без воды – кислорода, разделяющего электроны с водородом – жизнь на этой и любой другой планете не могла бы существовать.
Вода – не единственный элемент, необходимый для жизни. Все формы жизни, о которых мы знаем, основаны на углероде, и именно поэтому он находится в периодической таблице.
Четвертый элемент во втором ряду, внешняя оболочка углерода, имеет четыре из восьми возможных электронов – она либо наполовину пуста, либо наполовину полна, в зависимости от вашего расположения.Чтобы заполнить эту оболочку, атом углерода должен делить электроны с четырьмя другими атомами. Если он связывается с атомом углерода, этот углерод может связываться с тремя другими атомами углерода. И эта способность образовывать молекулы, которые могут иметь разветвленные цепи, делает углерод идеальным элементом для построения сложных молекул, таких как белки, жиры и углеводы, на которых основана жизнь.
Единственный другой элемент, который может строить сложные молекулы, – это кремний, расположенный прямо под углеродом в столбце IV, с четырьмя собственными внешними электронами, которыми он может поделиться.наверх
Колонны, ряды, размер и тяговое усилие
Элементы в одном столбце имеют одинаковое количество электронов во внешних оболочках, поэтому химически они реагируют одинаково.
По мере того, как вы проходите через ряд, элементы имеют больше протонов в ядрах, поэтому их электроны удерживаются более прочно. Эта улучшенная сила притяжения электронов (электроотрицательность на научном жаргоне) означает, что элементы становятся менее металлическими по мере прохождения ряда. Это также означает, что они становятся меньше (меньший атомный радиус), потому что с каждым дополнительным протоном электроны удерживаются более плотно.
Обратное происходит, когда вы спускаетесь вниз по столбцу – атомы, расположенные ниже, имеют больше протонов, притягивающих свои электроны, но у них также больше электронных оболочек, поэтому атомы немного крупнее (больший атомный радиус). И даже самый харизматичный пучок протонов не может притягивать проходящие электроны на таком большом расстоянии (более низкая электроотрицательность). в начало
Опубликовано 27 апреля 2010 г.
Электронная почта ABC Science
Используйте эти ссылки в социальных сетях, чтобы поделиться. Периодическая таблица Менделеева: расположение, расположение, расположение .
Используйте эту форму, чтобы отправить электронное письмо «Периодическая таблица: местонахождение, местонахождение, местонахождение» тому, кого вы знаете:
https://www.abc.net.au/science/articles/2010/04/27/2883938. htm?
Периодическая таблица элементов (с именами, символами, атомной массой и числом)
Это полное руководство по Периодической таблице.
Plus , вы также получите;
Периодическая система элементов с;- Имена, символы,
- Атомная масса, атомный номер,
- Электронная конфигурация,
- Блоки (s, p, d и f блок),
- Металлы, неметаллы и металлоиды,
- Электроотрицательность,
- Энергия ионизации ,
- Сродство к электрону, И многое другое…
- История Периодической таблицы
- Периодическая таблица с…
- Символ
- Имена
- Атомный номер
- Атомная масса
- Атомный радиус
- Металлы, неметаллы и металлоиды
- Тенденции в Периодической таблице
- Блоки (s, p, d и f)
- Типы элементов в Периодической таблице
- И многое другое с помощью советов и приемов …
Итак, если вы хотите узнать что-нибудь о Периодической таблице, это руководство для вас.
Давайте приступим к делу.
Периодическая таблица элементов————– Номер группы———————————————————————————————— —————————————————————————————————
————– Период 1 ———————— ————————————————————————————————————————————————————————————————————————————————— ———————
————– Период 2 —————————————————————————————————— ———————————————————————————————
————– Период 3 ——————————— ————————————————————————————————————————————————————————————————————————————————— —————
————– Период 4 ————————————————————————————————————— —————————————————————————————
————– Период 5 ———————————— ————————————————————————————————————————————————————————————————————————————————— ———
————– Период 6 ———————————————————————————————————————————————— ————————————————————————————
————– Период 7 ——————————————— —————————————————————————————————————————————————————————————— –
————– Пустое пространство ————————————————————————————————————————— ——————————————————————————
————— Лантаноиды —————————————————————————— ————————————————————————————————————————————————
————– А цтиноиды ——————————————————————————————————————————————————————————————— ————————————————
| → | 1 | 305 45 45 | 2 | 13 | | 14 96000 000 | 17 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | 37 | 7737 | 7773 | 5 9 0005 | 6 | 7 | 8 | 9 | 10 6 | ||||||||||||||||||||||||||
| | |||||||||||||||||||||||||||||||||||
Еще много удивительных вещей на вашем пути.
Не волнуйтесь, вы также получите HD-изображение указанной таблицы Менделеева только из этой статьи.
Просто дайте мне несколько минут, и я дам вам все знания + HD-изображение Периодической таблицы (с хитростями и советами, которые нужно запомнить).
Переходите к интересующим вас темам снизу.
# 1 Что такое классификация? А зачем нам классификация?
# 2 Краткая история периодической таблицы Менделеева
# 3 Как элементы расположены в периодической таблице Менделеева?
# 4 Строки и столбцы периодической таблицы Менделеева
# 5 Основы периодической таблицы Менделеева
# 6 Как читать элементы таблицы Менделеева?
# 7 Что обозначают номер группы и номер периода в периодической таблице?
# 8 Блоки в периодической таблице
# 9 Тенденции в периодической таблице (Периодические тенденции)
Что такое классификация? А зачем нам классификация?
Что, если кто-то попросит вас найти одну конкретную книгу из этой огромной стопки книг.
Сможете ли вы легко найти эту книгу?
Ответ: NO
Посмотрите на это изображение, вы увидите, что все книги расположены на определенной полке в соответствии с их сходством.
(Другими словами, книги сгруппированы или отсортированы в соответствии с их сходством.)
А что, если вам нужно найти конкретную книгу на этой правильно расположенной полке?
Вам будет легко найти именно эту книгу, , не так ли?
То же и с элементами.
Всего на данный момент открыто 118 элементов.
Эти элементы также необходимо классифицировать или сгруппировать в соответствии с их сходством.
Теперь эта таблица выглядит потрясающе и хорошо классифицирована. Не правда ли?
Что ж, позвольте мне перейти к главному.
Зачем нужна классификация элементов?Большой вопрос. Зачем нужно классифицировать все элементы?
Все элементы обладают своими физическими и химическими свойствами.
Эти элементы имеют различное применение, применение, химические реакции, атомную структуру, электронную конфигурацию и т. Д.
Таким образом, необходимо классифицировать (или сгруппировать, или отсортировать) все эти 118 элементов в соответствии с их сходством.
После правильной классификации элементов любому человеку становится очень легко найти конкретный элемент в таблице.
Кроме того, изучение каждого элемента становится легким, если обратиться к хорошо классифицированным элементам.
Краткая история периодической таблицы МенделееваНа этом рисунке показано, как развивалась Периодическая таблица Менделеева.
История Периодической таблицы:
| Discovery | Год |
| Триады Доберейнера | 1829 |
| Современный периодический закон | 1913 |
Позвольте мне дать вам краткое введение о том же.
1).Триады Доберейнера (1829)Иоганн Вольфганг Доберейнер (Человек, стоящий за открытием триад)
Но подождите. Что такое триады?
Вот смысл, скрытый в самом названии.
Tri означает 3
Во времена Доберейнера было открыто около 30+ элементов.
Доберейнер расположил некоторые из этих известных элементов в группу из трех элементов.
Позвольте мне показать вам пример.
Он устроил;
литий (Li), натрий (Na) и калий (K) в одной триаде (группа из трех элементов),
кальций (Ca), стронций (Sr) и барий (Ba) в другой триаде и,
хлор (Cl), бром (Br) и йод (I) в другой триаде.
Главное, что я хочу вам сказать, это то, что он расположил эти элементы в порядке возрастания их АТОМНОЙ МАССЫ .
Теперь позвольте мне напомнить вам атомные массы лития, натрия и калия.
Триада 1
| Элемент | Атомная масса | ||
| Литий (Li) | 7 | ||
| Натрий (Na) | |||
| Натрий (Na) | 23 950 К | 23 950 | 39 |
В этих триадах Доберейнер обнаружил, что атомная масса среднего элемента является средней атомной массой первого и третьего элементов.
Я объясню.
Престижность, большая магия !!
Точно так же это сходство было замечено для второй триады, а также для третьей триады.
Утверждение триад Доберейнера:
Когда элементы расположены в порядке возрастания их атомной массы в группе из трех (триады), то среднее арифметическое массы 1-го и 3-го элементов оказывается примерно равным к массе центрального элемента.
Он также заявил, что элементы одной и той же триады обладают схожими свойствами.(Означает, что литий, натрий и калий находятся в одной триаде и поэтому обладают схожими свойствами)
Ограничения триад Доберейнера
- Триады Доберейнера применимы только для нескольких элементов. Это не было применимо для всех 30+ известных элементов.
Надеюсь, вы это поняли, а теперь перейдем к следующему открытию.
2). Закон октав Ньюленда (1864)Человек, стоящий за открытием закона октав Ньюленда: Джон Ньюлендс
Основной вопрос.Что такое октава?
Окт означает 8
(Примечание: это не октябрь, но если вы знаете о номенклатуре ИЮПАК, то вы, возможно, слышали, что октава используется для представления 8)
Джон Ньюлендс открыл свой закон октав в году 1864.
За это время было открыто 56 элементов. Он расположил эти известные элементы в порядке возрастания их АТОМНОЙ МАССЫ .
Он обнаружил, что после такого расположения каждый 8-й элемент показывает свойства, аналогичные свойствам его соответствующих 1-го элемента.
Приведу пример.
Здесь водород (H) – 1-й элемент, а фтор (F) – 8-й элемент.
Итак, Ньюлендс обнаружил, что эти два элемента обладают схожими свойствами.
Другой пример;
Здесь литий (Li) – это первый элемент, а натрий (Na) – восьмой элемент.
Итак, оба эти элемента обладают схожими свойствами.
Таким образом, Ньюлендс обнаружил, что если все элементы расположены в порядке возрастания их атомной массы, то каждые восемь элементов проявляют аналогичное свойство.
Следовательно, название этого закона – закон октав Ньюленда.
Утверждение закона Ньюленда :
Если элементы расположены в порядке возрастания их атомной массы, то свойство каждых восьми элементов (начиная с первого) повторяется.
Ограничения октавного закона Ньюлендса
- Сходство свойств по закону наблюдалось только до кальция.
- Он заявил, что в природе существует всего 56 элементов.Но позже было доказано, что он ошибался, и было обнаружено гораздо больше элементов.
- Разные элементы были помещены в одну и ту же прорезь.
- Подобные элементы были размещены в разных гнездах.
Ух, какая личность !!!
Удивительно.
Закон Менделеева:
Свойства элементов являются периодическими функциями их атомных масс
Дмитрий Иванович Менделеев открыл этот закон, известный как закон Менделеева.
Что ж, позвольте мне объяснить вам это простой историей.
Это история 1869 года.
За это время было известно 63 элемента.
Манделеев подготовил карты (как и карты пасьянса) из всех этих 63 элементов с их индивидуальными свойствами, написанными на каждой карте.
Он взял доску и расположил все эти 63 элемента в порядке возрастания их атомной массы.
Сначала он взял элемент с наименьшей атомной массой и начал размещать другие элементы помимо него.
Если свойства какого-либо из элементов были одинаковыми, то он помещал их в тот же столбец. И если свойство элементов не совпадало, то он оставил его в строке.
Таким образом он заполнил всю таблицу и, наконец, таблица была подготовлена, как показано ниже.
Эта таблица известна как периодическая таблица элементов Менделеева.
В периодической таблице Менделеева всего 8 вертикальных столбцов, которые известны как группы.
Есть 7 горизонтальных рядов, которые называются точками.
Но подождите.
Вы заметили, что многие блоки содержат более одного элемента в периодической таблице Менделеева? Почему?
Краткий ответ: Эти элементы показывают аналогичные свойства. Поэтому Менделеев поместил эти элементы в один блок.
Еще один вопрос.
Почему некоторые блоки в приведенной выше периодической таблице Менделеева пусты?
Теперь посмотрите, располагая элементы в соответствии с атомными массами, Менделеев обнаружил, что свойства нескольких элементов не совпадают ни с одним из предыдущих, поэтому он не поместил такие элементы в этот конкретный столбец.
Итак, в периодической таблице Менделеева было несколько пустых блоков.
Понятно?
Я знаю, что это кажется вам немного трудным, поэтому вы можете обратиться к этому подробному руководству по «Периодической таблице Менделеева », где я объяснил все эти вещи с соответствующими изображениями для вашего лучшего понимания. Я также обсуждал достоинства и недостатки периодической таблицы Менделеева. Так что обязательно посетите эту статью.
4). Современный периодический закон (1913 г.)В предыдущем разделе мы видели, что закон Доберейнера, закон Ньюленда, а также закон Менделеева основывались на расположении элементов в соответствии с их возрастающими атомными массами.
Но единственная разница в современном периодическом законе;
Да, все элементы в современной таблице Менделеева расположены на основе их АТОМНОГО НОМЕРА .
Современный периодический закон :
Свойства элементов являются Периодической функцией их АТОМНЫХ ЧИСЕЛ.
Современный периодический закон был дан Генри Мозли в 1913 году.
Этот закон в точности аналогичен закону Менделеева, но с той лишь разницей, что;
- Менделеев расположил элементы в соответствии с возрастающей атомной массой . В то время как,
- Генри Мозли расположил элементы в соответствии с возрастающим атомным номером .
Другими словами;
- Закон Манделеева гласит, что свойства элементов являются функциями их атомной массы. While,
- Современный периодический закон гласит, что свойства элементов являются Периодической функцией их атомного номера .
В соответствии с современным периодическим законом, данным Генри Мозли, элементы должны быть расположены в таблице на основе их АТОМНОГО ЧИСЛА.
Вот и все!
После того, как все элементы были упорядочены по атомным номерам, появилась современная периодическая таблица Менделеева.
Как элементы расположены в периодической таблице?Здесь вы точно узнаете, как Генри Мозли расположил элементы в периодической таблице на основе современного периодического закона.
Как сказано в его современном периодическом законе, элементы должны быть расположены в соответствии с возрастающим атомным номером.
Итак, минимальный атомный номер (т.е.e 1) был помещен в левый верхний угол таблицы.
Далее элементы с атомными номерами 2, 3, 4, 5, 6 и т. Д. Были помещены в блоки периодической таблицы.
Аналогичным образом были заполнены все элементы в этой таблице элементов.
Но вот что важно знать.
См. Изображение выше. Фактическая таблица Менделеева такая. Эта таблица Менделеева также известна как длинная форма таблицы Менделеева.
Но он представлен таким образом, что идеально подходит и не искажает форму таблицы Менделеева.Также элементы, лежащие в этом блоке, имеют разную электронную конфигурацию и разные свойства. Что ж, не беспокойтесь об этом, я объясню вам об электронной конфигурации и свойствах позже.
Все еще не уверены?
Посмотрите, элемент с атомным номером 57 находится здесь, как показано на рисунке ниже.
Теперь элемент 58 не размещается рядом с ним, а помещается в отдельный блок, как показано ниже. И это повторяется до номера элемента 71.
Таким образом, элементы с порядковыми номерами от 58 до 71 помещаются в отдельный блок под основной таблицей.
Аналогичным образом элементы с порядковыми номерами от 90 до 103 также помещаются в отдельный блок, как показано ниже.
Подождите несколько секунд, и вы обязательно узнаете причину, по которой эти элементы помещены в отдельный блок.
Продолжайте читать…
Строки и столбцы в периодической таблицеЯ хочу объяснить вам основы периодической таблицы, но перед этим давайте продолжим со строками и столбцами периодической таблицы.
1).Строки в периодической таблице (Периоды)Всего 7 строк в периодической таблице.
Вопрос: У вас может возникнуть вопрос: «Что такое периоды в Периодической таблице?»
Ответ: Строки в Периодической таблице известны как периоды.
Первая строка называется 1-м периодом, вторая строка называется 2-м периодом, и аналогично вы можете видеть на изображении ниже до 7-й строки.
Теперь перейдем к столбцам Периодической таблицы.
2). Столбцы в периодической таблице (Группы)Посмотрите ниже, всего 18 столбцов в Периодической таблице.
Если у вас возник вопрос «Что такое группы в Периодической таблице?», То вот вам короткий и приятный ответ.
Ответ: Столбцы в Периодической таблице известны как группы.
Первый столбец известен как 1-я группа, второй столбец известен как 2-я группа, и аналогично вы можете видеть на изображении ниже до 18-го столбца.
А теперь пора посмотреть всю таблицу Менделеева. Ура!!!
Основы периодической таблицы МенделееваВ этом разделе вы узнаете все основные вещи, связанные с современной периодической таблицей;
- Группы и периоды таблицы Менделеева
- Блоки периодической таблицы Менделеева
- Типы элементов таблицы Менделеева
- Как читать таблицу Менделеева? И т.д ..
В предыдущем разделе мы уже видели, что вертикальные столбцы в современной периодической таблице известны как группы.
В современной периодической таблице всего 18 вертикальных столбцов. (Другими словами, в современной таблице Менделеева 18 групп)
Теперь я расскажу вам удивительные вещи о периодах таблицы Менделеева.
Мы видели, что горизонтальные ряды таблицы Менделеева известны как периоды.
Всего в таблице Менделеева 7 горизонтальных строк. Это означает, что в периодической таблице всего 7 периодов.
Теперь вы можете видеть, что в 1-м периоде всего 2 элемента.Таким образом, период 1 известен как самый короткий период .
Итак, 2-й период и 3-й период имеют 8 элементов, поэтому период 2 и период 3 известны как короткий период .
4-й и 5-й периоды всего 18 элементов. Таким образом, существует длительный период .
А теперь обратите на это внимание.
Посмотрите на 6-й и 7-й периоды, сколько там элементов?
18 элементов + 14 элементов в нижнем блоке.Таким образом, всего 32 элемента присутствуют в периоде 6 и периоде 7.
Таким образом, 6-й период и 7-й период известны как самый длинный период .
2). Блоки таблицы МенделееваНу, это 4 блока таблицы Менделеева.
Позвольте мне дать вам краткий обзор этих 4 блоков один за другим (вкратце)
s блок
Вы можете увидеть s-блок элементов периодической таблицы на изображении выше.Блок
s включает следующие группы:
Список элементов группы 1 с их символом приведен ниже:
| Имя элемента | Символ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Литий | Li | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Li | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Li Натрий | Na | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Калий | K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рубидий | Rb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цезий | Cs | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | 2 9002 930Франций | 2 F30 F30 их символы приведены ниже:
Также прочтите: Почему эти элементы известны как элементы s-block? p-блок Теперь вот ваш p-блок в Периодической таблице. Следующие группы включены в блок p периодической таблицы.
Список группы 13 элементов с их символами приведен ниже:
Список из 14 элементов группы с их символом приведен ниже:
Список групп 15 элементов с их символом приведены ниже: 41 | 41 Название элементаСимвол | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Азот | N | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фосфор | P | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мышьяк | As | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| As | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мосут | Сурьма | Мосут 9207 | Mc |
Список элементов группы из 16 с их символом приведен ниже:
| Название элемента | Символ |
| Кислород | 0 Oulfur57S |
| Селен | Se |
| Теллур | Te |
| Полоний | Po |
| Ливерморий | Lv |
Список элементов группы 17 2 с символом 9 представлен ниже 91: 91 имя Символ Фтор F Хлор Cl Бром Br 9173 9173 Tennessine Ts
Список элементов группы 18 с их символом приведен ниже:
| Название элемента | Символ | ||||||||
| Neon | Neon | Neon | Neon | Neon | Аргон | Ar | |||
| Kr | |||||||||
| Xenon | Xe | ||||||||
| Radon | Rn | ||||||||
| Oganesson | Og |
| 3-я группа | 4-я группа | 5-я группа | 6-я группа | 7-я группа | 8-я группа | 9-я группа 90 | 11-я группа | 12-я группа | |
| Скандий (Sc) | Титан (Ti) | Ванадий (V) | Хром (Cr) | Марганец (Mn) Железо (Mn) | Fe)Кобальт (Co) | Никель (Ni) | Медь (Cu) | Цинк (Zn) | |
| Иттрий (Y) | Цирконий (Zr) | Ниобий (Nb6) | денТехнеций (Tc) | Рутений (Ru) | Родий (Rh) | Палладий (Pd) | Серебро (Ag) | Кадмий (Cd) | |
| Лантан 90 (La) 90 (La) 90 мкм (Hf) | Тантал (Ta) | Вольфрам (W) | Рений (Re) | Осмий (Os) | Иридий (Ir) | Платина (Pt) | Золото (Au) | Hg) | |
| Актиний (Ac) | Резерфордий (Rf) | Дубний (Db) | Сиборгий (Sg) | Борий (Bh) | Калий (Hs) | Meitenium (Hs) | 9064 Mt Ds)Roentgenium (Rg) | Copernicium (Cn) |
Также прочтите: Почему эти элементы известны как элементы d-блока?
f block
У многих из вас может возникнуть вопрос;
«Какие две строки находятся внизу периодической таблицы?»
Они известны как лантаноиды и актиниды.
Первый ряд элементов в блоке f известен как лантаноидов , а второй ряд элементов в блоке f известен как актиниды .
Элементы блока f также известны как внутренние переходные элементы.
Также читайте: Почему эти элементы известны как элементы f-блока?
3). Типы элементов в таблице МенделееваТеперь я покажу вам, какие типы элементов присутствуют в таблице Менделеева.
У вас могут возникнуть вопросы;
«Где металлов в Периодической таблице?»
«Где неметаллов расположены в Периодической таблице?»
0004 «Где находятся металлоиды , расположенные в Периодической таблице? «« Где галогены в Периодической таблице? »
« Где Благородные газы “
И многое другое…
Где металлы в Периодической таблице?
Посмотрите, прежде всего вы должны знать некоторые свойства металла, неметалла и полуметалла (металлоида).
Но вы поймете это положение элементов, даже если вы ничего не знаете. Я постараюсь объяснить это просто.
Просто помните, что в левой части таблицы Менделеева указаны лучшие металлы.
Далее, в зависимости от наличия, они снова классифицируются как щелочные металлы и щелочноземельные металлы.
См. Также:
1). Сколько металлов в таблице Менделеева?
2). Почему металлы находятся в левой части таблицы Менделеева?
Щелочные металлы:
Элементы группы 1 известны как щелочные металлы.
Все элементы группы 1 при взаимодействии с водой образуют щелочной раствор (или щелочной раствор). (Другими словами, когда они реагируют с водой, они образуют соединения, которые являются основными по своей природе)
Вот почему эти элементы 1-й группы известны как щелочные металлы.
См. Также:
1). Почему щелочные металлы так реактивны?
2). Электронная конфигурация щелочных металлов
Щелочноземельные металлы:
Элементы группы 2 известны как щелочноземельные металлы.
Все эти элементы группы 2 имеют те же свойства, что и элементы группы 1, но в основном эти элементы находятся в земной коре . Следовательно, они названы щелочноземельными металлами.
См. Также:
1). Что общего у щелочноземельных металлов?
2). Список щелочноземельных металлов с электронной конфигурацией
Где неметаллы в Периодической таблице?
Вот неметаллы Периодической таблицы.
Подробнее о неметаллах из здесь .
Где металлоиды (полуметаллы) в Периодической таблице?
Вот полуметаллы или металлоиды Периодической таблицы.
Зигзагообразная линия, показанная в Периодической таблице, включает элементы, которые имеют как металлическую, так и неметаллическую природу.
Таким образом, они известны как полуметаллы или металлоиды.
См. Также: Физико-химические свойства металлоидов .
Где галогены в Периодической таблице?
Вы знаете, почему так называются галогены?
Слово галогены произошло от двух греческих слов;
«Hal» означает «соли» и
«Gen» означает «производить».
Таким образом, «галогены» означает «солеобразование».
Таким образом, все элементы 17-й группы образуют соли при взаимодействии с металлами.
Например;
2Na + Cl 2 ——-> 2NaCl
Которая является солью.
Таким образом, элементы группы 17 известны как галогены.
См. Также:
1). Какой галоген наиболее реактивный?
2). Свойства галогенов.
Где благородные газы в таблице Менделеева?
Элементы группы 18 не участвуют ни в каких химических реакциях. (Другими словами, эти элементы химически инертны)
Плюс все элементы 18 группы находятся в газообразном состоянии.
Таким образом, элементы 18-й группы таблицы Менделеева известны как Благородные газы или инертные газы.
См. Также:
1). Электронная конфигурация благородных газов
2). Использование благородных газов в повседневной жизни
Где переходные элементы в таблице Менделеева?
Переходные металлы (также известные как переходные металлы) образуют мост между химически активными металлами элементов s-блока и менее активными элементами групп 13 и 14.
Таким образом, эти элементы d-блока известны как «переходные элементы» .
См. Также: Список + Электронная конфигурация переходных металлов .
Где внутренние переходные элементы в таблице Менделеева?
Это очень просто.
Как следует из названия, «внутренний». Означает, что эти элементы являются только переходными элементами, но они размещаются во внутренней части переходных элементов.
Следовательно, эти элементы блока f известны как «внутренние переходные элементы».
См. Также: Почему внутренние переходные металлы находятся внизу периодической таблицы?
Где находится семейство бора в периодической таблице?
Очень просто !!
Первым элементом группы 13 является бор.
Следовательно, группа 13 известна как семейство бора или группа бора.
Где находится группа углерода в периодической таблице?
Это тоже просто !!!
Первый элемент 14 группы – углерод.
Следовательно, группа 14 известна как углеродное семейство или углеродная группа.
Где находится семейство азота в таблице Менделеева?
Элементы группы 15 содержат первый элемент «Азот».
Итак, группа 15 известна как семейство азота или группа азота.
Эти 15 элементов группы также известны как пниктогены.
Где халькогены в таблице Менделеева?
Элементы 16 группы включают кислород, серу, селен, теллур и полоний.
Эти элементы обычно присутствуют в земной коре в виде руд.
Халькогенс – это греческое слово, означающее «рудообразование».
Поскольку эти элементы группы 16 присутствуют в рудах, они известны как «халькогены».
Нравится?
Если нет, то также
Продолжайте читать….Потому что сейчас самое важное.
Как читать элементы таблицы Менделеева?Вот ваша милая, милая, красивая, красочная современная таблица Менделеева. Хехехе…
Теперь вам может быть интересно;
- Что написано в каждой квадратной рамке?
- Что это за числа 1, 2, 3, 4 и т. Д.?
- Что это за число написано под каждым элементом?
- Почему столбцы имеют разные цвета?
- Что это за две строки внизу периодической таблицы?
- Как запомнить таблицу Менделеева?
- И многое другое…
Ничего страшного, я все объясню пошагово.
Я дам вам очень короткое и простое объяснение чтения элементов таблицы Менделеева на примере углеродного элемента.
Атомный номер:
Общее количество протонов, присутствующих в ядре атома, известно как Атомный номер. Или
Число электронов, которыми обладает нейтральный атом, называется Атомным номером.
Здесь число, написанное в верхней части каждого квадрата, представляет собой атомный номер этого элемента.
Например, углерод имеет всего 6 электронов. Таким образом, атомный номер углерода равен 6.
Символ элемента:
Алфавит, используемый для упоминания элементов, известен как символ элементов .
Символ элементов представлен с использованием одного алфавита в верхнем регистре (например, C, O, N, F, H и т. Д.) Или иногда первая буква в верхнем регистре, за которой следует нижний алфавит (например, Li, Na, Si , Ne, Ar и т. Д.…)
Имя элемента:
Имя, отображаемое в каждом отдельном квадратном блоке, представляет имя этого элемента.
Атомная масса:
Атомная масса – это сумма масс протонов и нейтронов, присутствующих в ядре атома.
Атомная масса в периодической таблице отображается, как показано на рисунке ниже. (Обычно это десятичное значение)
( Примечание: В некоторых периодических таблицах вы можете обнаружить, что атомные массы записаны в левом верхнем углу или правом верхнем углу каждой ячейки, но помните, что это десятичное значение .Так что, если вы найдете это десятичное значение в ячейках периодической таблицы, это атомная масса этого элемента)
Теперь самая важная тема приближается к …
Если вы все еще со мной, то вы собираетесь Rock сейчас.
Продолжайте читать…
Что означает номер группы и номер периода в периодической таблице?Поверьте, это очень просто.
Разрешите пояснить прямо на примере.
Пример 1:
Давайте возьмем пример магния (Mg)
А теперь скажите мне, где находится магний (Mg).
Это 3 период и 2 группа. Верно?
Круто… Этот период 3 указывает на то, что атомы магния обладают 3 орбитами или 3 оболочками.
Вот 3 орбиты магния.
Итак, магний (Mg) находится в группе 2. Это означает, что на его внешней орбите находится 2 электрона .
Вот 2 электрона на внешней орбите магния. Эти два электрона известны как валентные электроны.
И вы могли знать, что каждая орбита имеет различную способность удерживать электроны.
Из приведенной ниже таблицы вы узнаете, «сколько электронов может удерживать определенная орбита».
Число электронов в оболочках :
| Орбита / Оболочка (n) | Макс. электронов на этой орбите может находиться |
| K-оболочка, n = 1 | 2 × 1² = 2 |
| L-оболочка, n = 2 | 2 × 2² = 8 |
| M-оболочка, n = 3 | 2 × 3² = 18 |
| N оболочка, n = 4 | 2 × 4² = 32 |
Таким образом,
- 1-я оболочка может удерживать 2 электрона.
- 2-я оболочка может содержать 8 электронов.
- 3-я оболочка может содержать 18 электронов.
- 4-я оболочка может содержать 32 электрона.
Вернемся к магнию. У него атомный номер 12. Это означает, что у него всего 12 электронов.
Из приведенной выше таблицы мы можем сказать, что первая орбита будет содержать 2 электрона, вторая орбита будет содержать 8 электронов и, наконец, оставшиеся 2 электрона будут на третьей орбите.
( Примечание: Фактические орбиты не двумерные, а трехмерные.Чтобы изобразить на бумаге, мы рисуем двумерную орбиту)
Пример 2:
Давайте возьмем другой пример хлора (Cl).
Хлор находится в 3-м периоде и 17-й группе.
3-й период указывает, что хлор имеет 3 орбиты и;
17-я группа указывает, что она имеет 7 электронов на самой внешней орбите.
Атомный номер хлора 17. (Другими словами, у хлора 17 электронов).
И теперь вы очень хорошо знаете, что 2-я орбита содержит максимум 8 электронов.
Таким образом, расположение электронов на орбите атома хлора такое, как показано выше.
Помните:
Группа 13 указывает 3 валентных электрона, а не 13.
Группа 14 указывает 4 валентных электрона, а не 14.
Группа 15 указывает 5 валентных электронов, а не 15.
Группа 16 указывает 6 валентных электронов, а не 16.
Группа 17 указывает на 7 валентных электронов, а не на 17.
Группа 18 указывает на 8 валентных электронов, а не на 18.
Я объяснил концепцию валентных электронов для d-блочных и f-блочных элементов в отдельных статьях «d-блочные элементы», и «f-блочные элементы». (Потому что он немного отличается, и сначала вам нужно узнать о концепции орбиталей)
Ты все еще со мной…?
Тогда не будем терять время зря.
Грядет самое важное и удивительное понятие о периодической таблице…
Тенденции в периодической таблице (Периодические тенденции)Я буду краток и по существу.(Потому что эта статья сейчас очень длинная). Если вам нужна подробная информация по этой теме, посетите: Основная статья о периодических тенденциях.
Давайте погрузимся в это.
Прежде всего, что означают тенденции в Периодической таблице?
Тренды: Изменение свойств элементов по группам (сверху вниз) и по периодам (слева направо) известно как тенденции.
Обычно мы измеряем эти тенденции (изменение свойств элементов) по группе и за период.
Вкратце я расскажу вам об изменении следующих свойств в периодической таблице.
Периодические тенденции: ВалентностьПо мере продвижения по периоду (слева направо) валентность элементов сначала увеличивается, а затем уменьшается. При движении вниз по группе (сверху вниз) валентность элементов остается прежней.
Не волнуйтесь, я скажу вам причину, по которой это происходит.
Видите ли, прежде всего валентность – это не что иное, как количество электронов, необходимых для завершения октета.
Например, атомный номер кислорода равен 8. Это означает, что у кислорода всего 8 электронов.
Итак, электронное расположение (2, 6).
Он имеет 2 электрона на первой орбите и 6 электронов на второй орбите.
Как видите, у кислорода на внешней орбите 6 электронов.
Таким образом, для завершения октета требуется 2 электрона.
Следовательно, валентность кислорода равна 2.
По мере того, как мы перемещаемся по периоду (слева направо), валентность элементов сначала увеличивается, а затем уменьшается.
И по группе валентность остается постоянной, потому что вы очень хорошо знаете, что количество электронов на самой внешней орбите остается одинаковым для всех элементов одной и той же группы.
Периодические тенденции: размер атомаПо мере того, как мы перемещаемся по периоду (слева направо), атомный размер элементов уменьшается. При движении вниз по группе (сверху вниз) размер атома увеличивается.
Хотите знать, почему размер атома уменьшается через период и почему он увеличивается вниз по группе?
Тогда ознакомьтесь с отдельной статьей о Тенденции размеров атома .(Где я объяснил причину с помощью изображений и примеров).
Периодические тенденции: металлический характерПо мере того, как мы движемся по периоду (слева направо), металлический характер элементов уменьшается. При движении вниз по группе (сверху вниз) металлический характер увеличивается.
Чтобы узнать причину этой тенденции, я настоятельно рекомендую вам посетить отдельную статью: Тенденция металлического характера в Периодической таблице.
Периодические тенденции: неметаллический характерПо мере того, как мы движемся по периоду (слева направо), неметаллический характер элементов увеличивается.При движении вниз по группе (сверху вниз) неметаллический характер уменьшается.
Я дал немного больше информации о тенденциях в области неметаллических характеров. Так что, если вы хотите увидеть это, посетите эту статью: Неметаллический характер тенденции в Периодической таблице.
Периодические тренды: электроотрицательностьВниз по группе (сверху вниз) размер атома увеличивается. Значит, электроотрицательность уменьшается.
И в течение периода (слева направо) размер атома уменьшается, поэтому электроотрицательность увеличивается.
Но если вы не знаете, что такое электроотрицательность, вы можете обратиться к в этой статье (где я объяснил простое простое объяснение на английском языке об электроотрицательности и еще несколько вещей о тенденции электроотрицательности в Периодической таблице).
Периодические тенденции: сродство к электронуПо мере того, как мы перемещаемся по периоду (слева направо), размер атома уменьшается, поэтому сродство к электрону увеличивается по периоду (слева направо.)
И по мере того, как мы движемся вниз по группе (сверху вниз), размер атома увеличивается, поэтому сродство к электрону уменьшается вниз по группе (сверху вниз). Теперь, если вы не знаете о концепции сродства к электрону, а также если вы хотите узнать причину, по которой сродство к электрону увеличивается с течением времени и почему оно уменьшается по группе, посетите эту статью: Тенденция сродства к электрону в периодической Таблица.
Периодические тренды: энергия ионизацииЗа период (слева направо) размер атома уменьшается, поэтому энергия ионизации увеличивается через период (слева направо.)
И вниз по группе (сверху вниз), размер атома увеличивается, поэтому энергия ионизации уменьшается вниз по группе (сверху вниз.)
Хотите узнать, почему такая тенденция ?, затем посетите Руководство по тенденции энергии ионизации , где я объяснил концепцию энергии ионизации с помощью изображений + Я также объяснил причину, по которой эта тенденция такова?
Сводка периодических тенденцийИтак, в качестве сводки, вы можете запомнить все тенденции в периодической таблице с помощью этого единственного изображения.
Престижность… !!
Фактов о Tennessine (Элемент 117)
Теннессин – это искусственно созданный радиоактивный элемент, о котором мало что известно. Ожидается, что он будет твердым, но его классификация неизвестна. Он входит в группу галогенов.
Элемент № 117 в Периодической таблице элементов ранее назывался ununseptium, замещающее имя, которое на латыни означает «один-один-семь». В ноябре 2016 года Международный союз теоретической и прикладной химии (IUPAC) утвердил название теннессин для элемента 117.
ИЮПАК также утвердил названия для элементов 113 (нихоний, с атомным символом Nh), 115 (московий, Mc) и 118 (оганессон, Og).
Названия элементов 115 и 117 были предложены их первооткрывателями в Объединенном институте ядерных исследований в Дубне, Россия; Национальная лаборатория Ок-Ридж в Теннесси; Университет Вандербильта в Теннесси; и Ливерморская национальная лаборатория Лоуренса в Калифорнии. Оба названия элементов, moscovium и tennessine, чтят регионы, где проводились эксперименты, связанные с созданием элементов.
Только факты
Атомный номер : 117 Атомный символ : Ts Атомный вес : [294] Точка плавления : Неизвестно Точка кипения : Неизвестно
Открытие
Элемент 117 был обнаружен в 2010 году и совместно объявлено 5 апреля того же года учеными Объединенного института ядерных исследований в Дубне, Россия, и учеными Ливерморской национальной лаборатории Лоуренса в Калифорнии.
Свойства теннессина
Теннессин имеет два изотопа с известным периодом полураспада и два с неизвестным периодом полураспада.Самый стабильный изотоп – 294 Ts с периодом полураспада около 80 миллисекунд. Он распадается через альфа-распад. Предполагается, что другие изотопы теннессина распадаются как в результате альфа-распада, так и спонтанного деления.
Атомный вес антропогенных трансурановых элементов основан на самом долгоживущем изотопе. Эти атомные веса следует рассматривать как предварительные, поскольку в будущем может быть получен новый изотоп с более длительным периодом полураспада.
