Индуктивный эффект
Индуктивный эффект (I-эффект)
Известно, что полярная ковалентная связь образуется между атомами с различной электроотрицательностью. Наличие в молекуле полярной σ-связи вызывает поляризацию ближайших двух–трех σ-связей и ведет к возникновению частичных зарядов δ+ (дельта плюс) или δ (дельта минус) на соседних атомах. Направление смещения электронной плотности всех σ-связей обозначается прямыми стрелками (по линии связи) и символами частичных зарядов (δ), индуцируемых заместителем (X или Y):
Таким образом, заместители вызывают поляризацию не только “своей”, но и соседних связей. Такой вид передачи влияния атомов, приводящий к поляризации ковалентных связей и индуцированию зарядов на атомах, называется индуктивным (индукционным) электронным эффектом.
Индуктивный эффект (I-эффект) — смещение электронной плотности по цепи σ-связей, обусловленное различием электроотрицательностей атомов.
Из-за слабой поляризуемости σ-связей I-эффект быстро затухает с удалением от заместителя и через 3-4 связи становится практически равным 0.
Влияние заместителя на реакционный центр может передаваться не только по цепи σ-связей, но и непосредственно через пространство или через молекулы растворителя по механизму диполь-дипольного взаимодействия.
- Передача влияния заместителя через пространство или через растворитель называется эффектом поля (F-эффектом).
Как правило, эффект влияния заместителя через σ-связи и эффект поля действуют совместно и определить вклад каждого из них практически невозможно. Поэтому принято считать
Индуктивный эффект называют отрицательным (–I), если заместитель уменьшает электронную плотность на атоме углерода, с которым связан этот заместитель. При этом заместитель приобретает частичный отрицательный заряд (δ-), а атом углерода частичный положительный заряд (δ+).
При этом заместитель приобретает частичный отрицательный заряд (δ-), а атом углерода частичный положительный заряд (δ+).
Например:
Индуктивный эффект называется
Направление (знак) I-эффекта заместителя качественно оценивается путем сравнения со стандартом атомом водорода, индуктивный эффект которого принят равным 0.
- –I-эффект проявляют заместители, которые содержат более электроотрицательные атомы, чем атом водорода. К ним относятся многие функциональные группы (галогены, -OH, -OR, -NH2, -NO2, >C=O, -COOH и др.), ненасыщенные группировки (например, -СH=CHR, -C≡CR) и катионы. Такие заместители в целом снижают электронную плотность на остальной части молекулы, то есть являются
- Величина –I-эффекта растёт с увеличением положительного заряда заместителя. Поэтому катионы индуцируют наиболее сильные и дальнодействующие эффекты:
- –I-эффект тем сильнее, чем больше электроотрицательность соответствующего гетероатома:
–NR2 < –OR < –F; –F > –Cl > –Br > –I; - Непредельные заместители вызывают –I-эффект, который увеличивается с ростом степени их ненасыщенности:
–CR=CR2 < –CR=CR–CH=CH2 < –C6H5 < –C≡CR;
–CR=NR < –C≡N. - Величина +I-эффекта растет с увеличением отрицательного заряда заместителя. Поэтому анионы проявляют наиболее сильные и дальнодействующие эффекты:
- +I-эффект заместителя тем сильнее, чем меньше электроотрицательность соответствующего гетероэлемента:
- Алкильные группы проявляют относительно слабый +I-эффект, обусловленный суммарным действием слабополярных связей С–Н(Сδ–←Нδ+). C увеличением числа С–Н-связей +
-СН3 < -CH2-CH3 < -CH(CH3)2 < -C(CH3)3 В +I-эффекте трет-бутильной группы -C(CH3)3 суммируются полярности 9 связей С–Н.

+I-эффект характерен для заместителей, содержащих атомы с относительно низкой электроотрицательностью: металлов (например, -Mg-, -Li), алкильных радикалов (-CH3, -C2H5 и т.п.) и анионов.
Заместители, проявляющие +I-эффект, ведут к повышению электронной плотности в цепи и проявляют электронодонорные свойства.
-Na > -MgR > -AlR2 > -SiR3
Электронные эффекты в молекулах органических соединений.
 | Учебно-методический материал по химии (10 класс) на тему:
| Учебно-методический материал по химии (10 класс) на тему:Электронные эффекты в молекулах органических соединений
Замещение атомов водорода в молекулах алканов на любой гетероатом (галоген, азот, серу, кислород и т.д.) или группу вызывает перераспределение электронной плотности. Природа этого явления различна. Она зависит от свойств гетероатома (его электроотрицательности) и от типа связей, по которым это влияние распространяется.
Индуктивный эффект
Если влияние заместителя передается при участии -связей, то происходит постепенное изменение электронного состояния связей. Такая поляризация называется индуктивным эффектом (I), изображается стрелкой в направлении смещения электронной плотности:
СН3-СН2Cl,
HOСН2-СН2Cl,
СН3-СН2COOH,
СН3-СН2NO2 и т.д.
Индуктивный эффект обусловлен стремлением атома или группы атомов подавать или оттягивать на себя электронную плотность, в связи с чем он может быть положительным или отрицательным. Отрицательный индуктивный эффект проявляют элементы, более электроотрицательные, чем углерод, т. е. галогены, кислород, азот и другие, а также группы с положительным зарядом на элементе, связанном с углеродом. Отрицательный индуктивный эффект уменьшается справа налево в периоде и сверху вниз в группе периодической системы:
е. галогены, кислород, азот и другие, а также группы с положительным зарядом на элементе, связанном с углеродом. Отрицательный индуктивный эффект уменьшается справа налево в периоде и сверху вниз в группе периодической системы:
F > O > N,
F > Cl > Br > J.
В случае заместителей с полным зарядом отрицательный индуктивный эффект увеличивается с возрастанием электроотрицательности атома, связанного с углеродом:
>O+- >> N+
В случае сложных заместителей отрицательный индуктивный эффект определяется природой атомов, составляющих заместитель. Кроме этого, индуктивный эффект зависит от характера гибридизации атомов. Так, электроотрицательность атомов углерода зависит от гибридизации электронных орбиталей и изменяется в следующем направлении:
sp3
Положительный индуктивный эффект проявляют элементы, менее электроотрицательные, чем углерод; группы с полным отрицательным зарядом; алкильные группы. +I-эффект уменьшается в ряду:
(СН3)3С- > (Ch4)2CH- > Ch4-Ch3- > Ch4- > H-.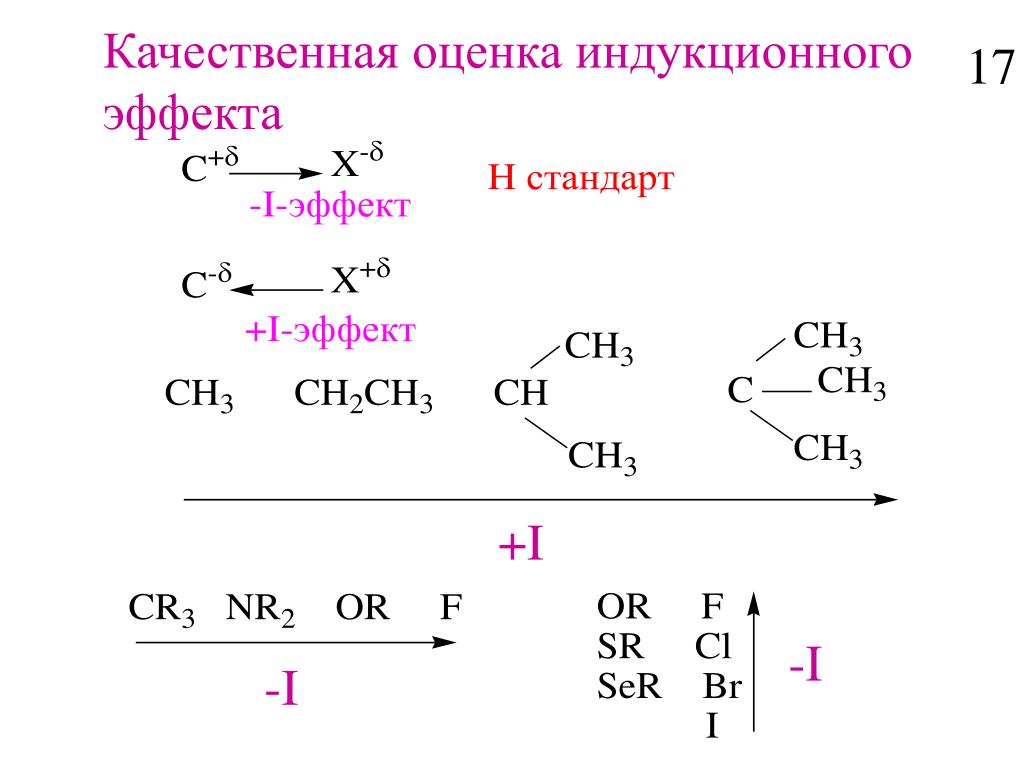
Индуктивный эффект заместителя быстро затухает по мере увеличения длины цепи.
Таблица 1. Сводная таблица заместителей и их электронных эффектов
Заместитель или группа атомов (X- галоген) | Эффекты |
-СН3 > Ch4-Ch3- > (Ch4)2CH- >> Ch3X | +I, +M |
(Ch4)3C- | +I, M = 0 |
Атом, присоединенный к -системе, имеет неподеленную пару электронов: X- (галоген), -O-, -OH, -OR, -Nh3, -NHR, -NR2, -SH, -SR, | –I, +M |
присоединенный к -системе атом, в свою очередь, связан с более электроотрицательным атомом: -N=O, -NO2, -SO3H, -COOH, -CO-H, -CO-R, -CO-OR, -CN, -СНХ2, -CX3, -C=N=S | –I, –M |
Более электроотрицательный углерод: -СН=СН-, -С=СН (этинил), -С6Н4- (фенилен) (но легко передают М-эффект в любом направлении) | –I, M = 0 |
Атом, не имеющий р-орбиталей, но с полным положительным зарядом -Nh4+, -NR3+ | –I, M = 0 |
Мезомерный эффект
Наличие заместителя со свободной парой электронов или вакантной р-орбиталью, присоединенного к системе, содержащей p-электроны, приводит к возможности смешения р-орбиталей заместителя (занятых или вакантных) с p-орбиталями и перераспределению электронной плотности в соединениях.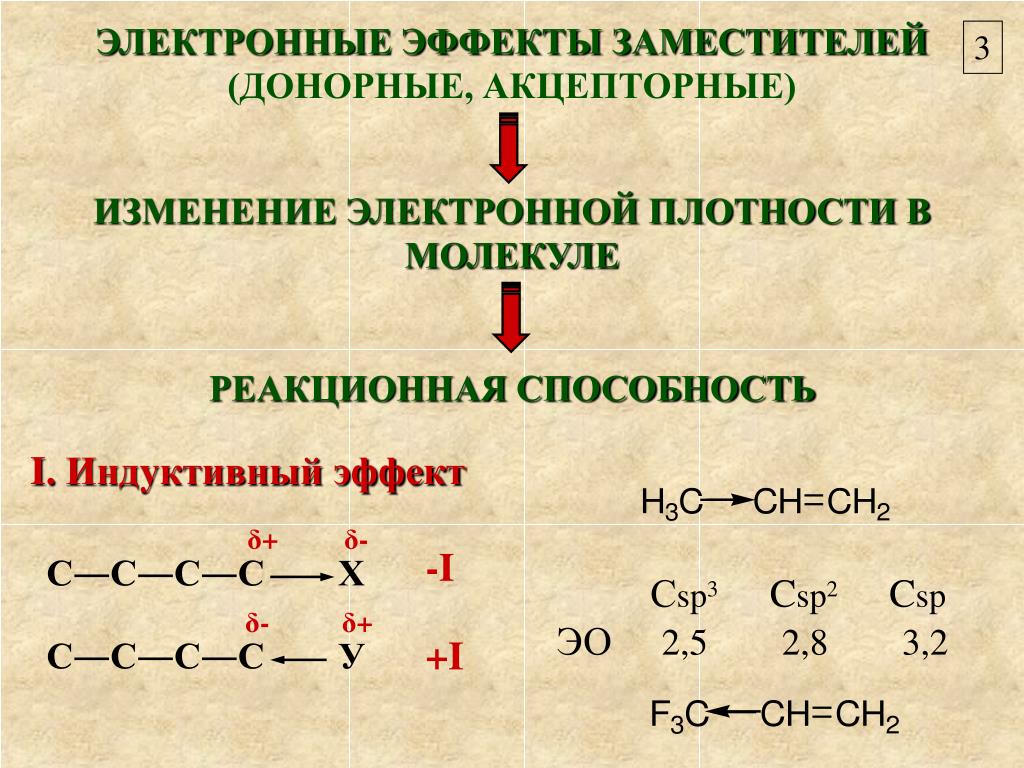 Такой эффект называется мезомерным.
Такой эффект называется мезомерным.
Смещение электронной плотности обычно незначительно и длины связей практически не меняются. О незначительном смещении электронной плотности судят по дипольным моментам, которые даже в случае больших эффектов сопряжения на крайних атомах сопряженной системы невелики.
Мезомерный эффект изображают изогнутой стрелкой, направленной в сторону смещения электронной плотности:
В зависимости от направления смещения электронного облака мезомерный эффект может быть положительным (+М):
и отрицательным (-М):
Положительный мезомерный эффект (+М) уменьшается при увеличении электроотрицательности атома, несущего неподеленную пару электронов, вследствие снижения тенденции отдавать ее, а также при увеличении объема атома. Положительный мезомерный эффект галогенов изменяется в следующем направлении:
F > Cl > Br > J (+M-эффект).
Положительным мезомерным эффектом обладают группировки с неподеленными парами электронов на атоме, присоединенном к сопряженной пи-системе:
-Nh3 (NHR, NR2) > OH (OR) > X (галоген) (+М-эффект).
Положительный мезомерный эффект уменьшается в том случае, если атом связан с группой-акцептором электронов:
-Nh3 > -NH-CO-Ch4.
Отрицательный мезомерный эффект возрастает с увеличением электроотрицательности атома и достигает максимальных значений, если атом-акцептор несет заряд:
>C=O+H >> >C=O.
Уменьшение отрицательного мезомерного эффекта наблюдается в случае, если группа- акцептор сопряжена с донорной группой:
-CO-O-
Таблица 2. Сводная таблица заместителей и их электронных эффектов
Заместитель или группа атомов (X- галоген) | Эффекты |
-СН3 > Ch4-Ch3- > (Ch4)2CH- >> Ch3X | +I, +M |
(Ch4)3C- | +I, M = 0 |
Атом, присоединенный к -системе, имеет неподеленную пару электронов: X- (галоген), -O-, -OH, -OR, -Nh3, -NHR, -NR2, -SH, -SR, | –I, +M |
присоединенный к -системе атом, в свою очередь, связан с более электроотрицательным атомом: -N=O, -NO2, -SO3H, -COOH, -CO-H, -CO-R, -CO-OR, -CN, -СНХ2, -CX3, -C=N=S | –I, –M |
Более электроотрицательный углерод: -СН=СН-, -С=СН (этинил), -С6Н4- (фенилен) (но легко передают М-эффект в любом направлении) | –I, M = 0 |
Атом, не имеющий р-орбиталей, но с полным положительным зарядом -Nh4+, -NR3+ | –I, M = 0 |
Гиперконъюгация или сверхсопряжение
Эффект, подобный положительному мезомерному, возникает при замещении водорода у кратной связи алкильной группой. Этот эффект направлен в сторону кратной связи и называется гиперконъюгацией (сверхсопряжением):
Этот эффект направлен в сторону кратной связи и называется гиперконъюгацией (сверхсопряжением):
Эффект напоминает положительный мезомерный, поскольку отдает электроны в сопряженную -систему:
Сверхсопряжение уменьшается в последовательности:
СН3 > Ch4-Ch3 > (Ch4)2CH > (Ch4) 3C.
Для проявления эффекта гиперконъюгации необходимо наличие хотя бы одного атома водорода при атоме углерода, соседствующем с – системой. Трет-бутильная группировка не проявляет этого эффекта, а потому мезомерный эффект ее равен нулю.
Таблица 3. Сводная таблица заместителей и их электронных эффектов
Заместитель или группа атомов (X- галоген) | Эффекты |
-СН3 > Ch4-Ch3- > (Ch4)2CH- >> Ch3X | +I, +M |
(Ch4)3C- | +I, M = 0 |
Атом, присоединенный к -системе, имеет неподеленную пару электронов: X- (галоген), -O-, -OH, -OR, -Nh3, -NHR, -NR2, -SH, -SR, | –I, +M |
присоединенный к -системе атом, в свою очередь, связан с более электроотрицательным атомом: -N=O, -NO2, -SO3H, -COOH, -CO-H, -CO-R, -CO-OR, -CN, -СНХ2, -CX3, -C=N=S | –I, –M |
Более электроотрицательный углерод: -СН=СН-, -С=СН (этинил), -С6Н4- (фенилен) (но легко передают М-эффект в любом направлении) | –I, M = 0 |
Атом, не имеющий р-орбиталей, но с полным положительным зарядом -Nh4+, -NR3+ |
5.
 Электронные эффекты в органических молекулах
Электронные эффекты в органических молекулахВсе атомы, составляющие органическую молекулу, находятся во взаимосвязи и испытывают взаимное влияние. Это влияние передается в основном через систему ковалентных связей с помощью электронных эффектов.
Электронный эффект – смещение электронной плотности в молекуле под влиянием отдельных атомов или групп атомов.
Смещение электронов, приводящее к поляризации связи, определяется разностью электроотрицательностей атомов, образующих химическую связь. Атомы, связанные полярной связью, несут частичные заряды:
| δ+ δ−
—C → Cl (χC = 2,5; χCl = 3,0)
|
Смещение электронной плотности по цепи σ-связей называется индуктивным эффектом и обозначается I. Индуктивный эффект передается по цепи с затуханием, что объясняется малой подвижностью электронов σ-связи:
CH3 → CH2 → CH2 → Cl δ+ >> δ/+ >> δ//+
В зависимости от
того, удаляется ли электронная плотность
от рассматриваемого атома углерода или
приближается к нему, индуктивный эффект
называют отрицательным (−I)
или положительным (+I).
Электроноакцепторные заместители,
смещающие электронную плотность σ-связи
от атома углерода к себе, проявляют
отрицательный индуктивный эффект (−I):
галогены, NH
Электронодонорные заместители, смещающие электронную плотность к атому углерода от себя, проявляют положительный индуктивный эффект (+I): атомы металлов, углеводородные радикалы.
Индуктивный эффект проявляется и в случае, когда связанные между собой атомы углерода различаются по типу гибридизации:
δ+ δ−
H3C → CH = CH2
Мезомерным эффектом, или эффектом сопряжения, называется перераспределение электронной плотности, происходящее с участием негибридных
. .
.
CH2=CH−CH=CH2 CH2=CH−O−CH=CH2
π−π – сопряжение p−π − сопряжение
Мезомерный эффект, как и индуктивный, может быть как отрицательным, так и положительным. Благодаря большей подвижности электронов π-связи M-эффект практически не ослабевает при передаче по сопряженной цепи. По этой причине |M| > | I |.
Особенности органических реакций
Реакции органических соединений в принципе подчиняются тем же законам, что и реакции неорганических веществ, хотя и имеют некоторые специфические особенности.
В неорганических
реакциях обычно участвуют ионы; реакции
протекают быстро (10−10 – 10−7 с) при достаточно низких температурах.
В реакциях органических соединений
участвуют молекулы, при этом разрываются
одни малополярные ковалентные связи и
образуются другие.
Органические реакции редко приводят к высокому выходу продукта. Наличие в молекуле нескольких идентичных или близких по энергии связей приводит к тому, что реакции происходят одновременно по нескольким направлениям. Это обстоятельство определяет способ записи органических реакций: как правило, используют не химические уравнения, а схемы реакций, в которых обычно не приводятся стехиометрические отношения:
CH3 CH3 CH3
NO2
H2SO4
+ HNO3 +
NO2
Любая химическая
реакция сопровождается разрывом одних
связей между атомами и образованием
других. Разрыв ковалентных связей может
осуществляться следующими способами:
Разрыв ковалентных связей может
осуществляться следующими способами:
а) гомолитический разрыв – при этом пара электронов делится таким образом, что каждая из образующихся частиц получает по одному электрону:
R : X → R· + ·X
Нейтральный атом или частица с неспаренным электроном называется свободным радикалом, а реакции с их участием – радикальными.
б) гетеролитический разрыв – при этом оба электрона связи остаются с одной из ранее связанных частиц:
B−
R3C : X R3C : + BX
частица R3C: заряжена отрицательно и называется карбанионом.
А+
R3C : X R3C+ + AX
в этом случае
образуется карбкатион.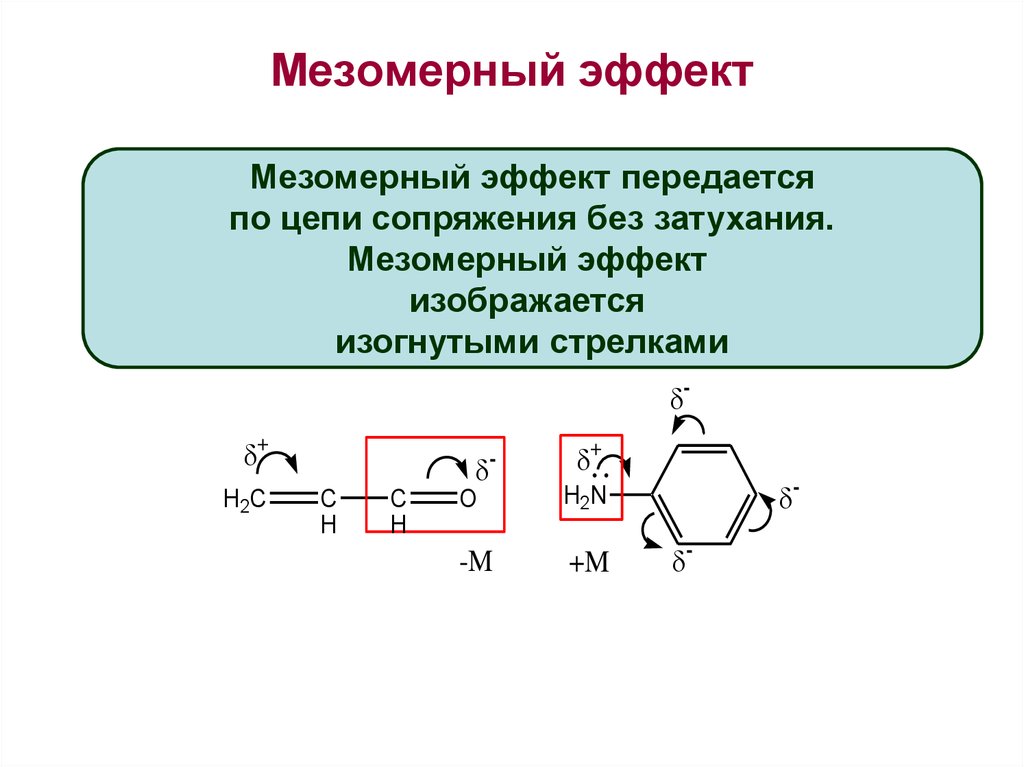
Реакции, идущие с гетеролитическим разрывом ковалентных связей, относят к ионным реакциям.
Разрыв химической связи происходит при нагревании, облучении, а чаще при действии на молекулу вещества активной частицы – реагента. Активная частица может быть ионом, нейтральной молекулой или радикалом.
Если реагент – отрицательный ион (OH−, Cl−) или нейтральная молекула с неподеленной электронной парой (:NH3, H2O:), то его называют нуклеофильным, т.е. обладающим сродством к ядру. Реакции с участием таких реагентов называют нуклеофильными.
Если реагент – положительный ион (H+, Cl+, NO2+, H3C+), готовый принять неподеленную пару электронов для образования новой связи, то его называют электрофильным, а реакции с участием таких реагентов – электрофильными.
Классификация органических веществ
Основными
структурными признаками, положенными
в основу классификации органических
соединений, являются углеродный скелет
и функциональная группа.
Классификация по типу углеродного скелета
В зависимости от строения углеродного скелета органические соединения разделяют на ациклические – соединения с открытой (незамкнутой) углеродной цепью и циклические.
Ациклические соединения могут быть как насыщенными (алканы), так и ненасыщенными (алкены, алкины).
Циклические соединения – соединения с замкнутой цепью – в зависимости от природы атомов, составляющих цикл, делят на карбоциклические и гетероциклические. Карбоциклические соединения содержат в цикле только атомы углерода и делятся на две существенно различающиеся по химическим свойствам группы: алифатические циклические (сокращенно алициклические) и ароматические. Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов – гетероатомов.
Классификация по типу функциональной группы
В большинстве
органических соединений, кроме атомов
углерода и водорода, содержатся атомы
других элементов (не входящие в скелет). Эти атомы или их группировки, во многом
определяющие физические и химические
свойства органических соединений,
называют функциональными
группами.
Эти атомы или их группировки, во многом
определяющие физические и химические
свойства органических соединений,
называют функциональными
группами.
Функциональная группа оказывается окончательным признаком, по которому соединения относятся к тому или иному классу. Важнейшие группы приведены в табл. 1.1.
Соединения, которые содержат несколько функциональных групп, называют полифункциональными.
Соединения, имеющие одинаковые функциональные группы, но различающиеся числом атомов углерода, обладают похожими физическими и химическими свойствами. Такие соединения называются гомологами. Совокупность всех гомологов образует гомологический ряд.
Таблица 1.1. Важнейшие функциональные группы
Функциональная группа | Класс соединения | |
Обозначение | Название | |
−F, −Cl, −Br, −I | галоген | галогенопроизводные |
−OH | гидроксил | спирты, фенолы |
>C=O | карбонил | альдегиды, кетоны |
−COOH | карбоксил | карбоновые кислоты |
−NH2, >NH, >N− | аминогруппа | амины |
−NO2 | нитрогруппа | нитросоединения |
−SO3H | сульфогруппа | сульфокислоты |
ИНДУКТИВНЫЙ ЭФФЕКТ-Положительный-Отрицательный-Определение-Примеры-Применения
Поляризация σ-связи из-за электрона
акцепторный или электронодонорный эффект соседних групп или атомов относится к
к как индуктивный эффект .
Сигма-связь между двумя атомами, различающимися по своей электроотрицательности, поляризуется за счет смещения пары связей в сторону более электроотрицательный атом. В этом процессе электроотрицательный атом частично отрицательный заряд, в то время как другой атом получает частичный положительный заряд. Таким образом индуцированная полярность передается через сигма-связи в молекуле создание постоянного диполя. Это явление называется индуктивным эффект.
Обозначается стрелкой, указывающей на более электроотрицательный атом, несущий частичный отрицательный заряд.
Характерные особенности индуктивного эффекта
* Возникает из-за разницы электроотрицательностей между двумя атомами, образующими сигма-связь.
* Передается через сигма-связей . Пи-связей нет вовлеченный.
* Величина индуктивного эффекта уменьшается при удалении от группы, его вызывающие.
* Это постоянный эффект . Это может создать постоянный диполь в молекуле.
* В целом индуктивный эффект относительно слабый и затмевается другими электронными эффектами, такими как резонанс эффект, гиперконъюгация и др.
* Влияет на химические и физические свойства соединений.
Связь C-Cl в бутилхлориде, CH 3 -CH 2 -CH 2 -CH 2 -Cl поляризуется из-за разницы в электроотрицательности. Электроны оттягиваются атом хлора. Таким образом, первый атом углерода получает частичный положительный заряд. В В свою очередь, этот атом углерода частично увлекает электронную плотность от соседнего углерода, который также получает частичный положительный заряд. Это будет продолжаться и дальше, и именно так проявляется индуктивный эффект. передается по углеродной цепи.
Следует отметить, что индуктивный эффект ослабевает по цепочке и не
настолько значительно
за 3-м атомом углерода.
Также обратите внимание, что индуктивный эффект является постоянным эффектом и присущ молекула, в то время как электромерный эффект является временным эффектом только создается в присутствии атакующих электрофильных или нуклеофильных реагентов.
Индуктивный эффект делится на два типа в зависимости от электроноакцепторная или электроноотдающая природа атома/группы, индуцирующей его. сила индуктивного эффекта измеряется путем сравнения с силой водорода.
1) Отрицательный индуктивный эффект (-I):Электроноакцепторная природа групп или атомов называется отрицательным индуктивным эффектом. Обозначается -I. Ниже приведены примеры групп в порядке убывания их эффекта -I:
NH 3 + > NO 2 > CN > SO 3 H > CHO > CO > COOH > COCl > CONH 2 > F > Cl > Br > I > OH > OR > NH 2 > С 6 Н 5 > H
2) Положительный индуктивный эффект (+I): Относится к высвобождению электронов
природа групп или атомов и обозначается +I. Ниже приведены примеры
групп в порядке убывания их эффекта +I.
Ниже приведены примеры
групп в порядке убывания их эффекта +I.
C(CH 3 ) 3 > CH(CH 3 ) 2 > CH 2 CH 3 > канал 3 > H
Почему алкильные группы проявляют положительный индуктивный эффект?
Хотя связь C-H практически считается неполярной, существует частичная положительный заряд на атоме водорода и частичный отрицательный заряд на атоме углерода. Поэтому каждый атом водорода действует как электронодонорная группа. Этот совокупный донорство превращает алкильный фрагмент в электронодонорную группу.
Устойчивость карбокатионов (ионы карбония): Стабильность карбокатионов увеличивается, когда группы +I, такие как алкил
группы присутствуют рядом с положительно заряженным углеродом. Группы +I уменьшают
положительный заряд на углероде, пожертвовав отрицательную плотность заряда через
положительный индуктивный эффект. Это приводит к
большая стабильность карбокатиона.
Группы +I уменьшают
положительный заряд на углероде, пожертвовав отрицательную плотность заряда через
положительный индуктивный эффект. Это приводит к
большая стабильность карбокатиона.
Принимая во внимание, что группы -I дестабилизируют карбокатионы, поскольку они увеличивают положительный заряд за счет уменьшения электронной плотности.
Обратите внимание, что любой фактор, увеличивающий заряд (как отрицательный, так и положительный) на ион приводит к дестабилизации, в то время как любой фактор, уменьшающий заряд приводит к стабилизации этого иона.
Например, порядок стабильности некоторых карбокатионов, содержащих алкильные группы, следующий: следующим образом:
Третичный карбокатион, содержащий три алкильные группы, более стабилен, чем вторичный карбокатион с двумя алкильными группами, который, в свою очередь, более стабилен чем первичный карбокатион. Метилкарбокатион наименее стабилен среди данный.
Стабильность свободных радикалов: Таким же образом стабильность свободных радикалов увеличивается с увеличением
количество алкильных групп.
Таким образом, устойчивость различных свободных радикалов равна:
Стабильность карбанионы:
Однако группы +I снижают стабильность карбанионов, в то время как группы -I групп повышает их устойчивость.
Например, алкильные группы (+I) отдают электронную плотность отрицательно заряженный углерод приводит к дестабилизации карбаниона.
Таким образом, порядок устойчивости следующих карбанионов:
Теперь порядок обратный. Третичный карбанион наименее стабилен, а метилкарбанион наиболее стабилен среди приведенных.
Кислотная сила карбоновых кислот и фенолов:Протонная кислота всегда находится в равновесии со своим сопряженным основанием, т.е. образуется при потере протона. Любой фактор, стабилизирующий отрицательно заряженный сопряженное основание способствует большей ионизации кислоты. то есть увеличивает кислотность прочность.
Электроноакцепторные группы, проявляющие отрицательный индуктивный эффект (-I), уменьшают отрицательный заряд на
сопряженное основание (например, карбоксилат-ион), увеличивая плотность электронов и, таким образом, стабилизируя ее. Следовательно, кислотная сила увеличивается
когда -I группы присутствуют.
Следовательно, кислотная сила увеличивается
когда -I группы присутствуют.
Наоборот, группы +I уменьшают кислотную силу, так как они дестабилизировать сопряженное основание кислоты (анионное), высвобождая электронную плотность что, в свою очередь, увеличивает отрицательный заряд аниона и тем самым дестабилизирует Это.
i) Кислотная сила увеличивается с увеличением количества электронов удаление атомов фтора, как показано ниже.
CH 3 COOH < CH 2 FCOOH < CHF 2 COOH < CF 3 COOH
ii) Муравьиная кислота является более сильной кислотой, чем уксусная кислота, поскольку –CH 3 группа дестабилизирует карбоксилат-ион.
Аналогичным образом кислотная сила фенолов увеличивается, когда -I группы присутствуют на ринге.
П-нитрофенол является более сильной кислотой, чем фенол, поскольку -NO 2 группа представляет собой группу -I, которая забирает электронную плотность. Принимая во внимание, что пара-крезол является более слабой кислотой, чем фенол, поскольку -CH 3 группа показывает положительный индуктивный эффект (+I).
Например, порядок кислотной силы после фенолов следующий:
- Основная сила аминов:
Электронодонорные группы, такие как алкильные группы, увеличивают основную силу амины, тогда как электроноакцепторные группы, такие как арильные группы, уменьшают основная природа. Следовательно, алкиламины являются более сильными основаниями Льюиса, чем аммиак. тогда как ариламины слабее аммиака.
Таким образом, порядок основной силы алкил- и ариламинов по отношению к Аммиак: CH 3 NH 2 > NH 3 > C 6 H 5 NH 2
Реактивность карбонило группы увеличивают электронную плотность у карбонильного углерода. Отсюда их реактивность в сторону нуклеофилов уменьшается. Таким образом, формальдегид более реакционноспособен, чем ацетальдегида и ацетона к реакциям нуклеофильного присоединения.Таким образом, порядок реактивности следующий:
Вопрос: Что из следующего является применением индуктивный эффект?
1) Устойчивость карбокатионов
2) Основная сила аминов
3) Кислотная сила карбоновых кислот
4) Все вышеперечисленное
Ответ: 4
эффект на меньше влияет на , чем другие эффекты, такие как эффект резонанса и гиперконъюгация.
Напр. Электроноакцепторная природа нитрогруппы, -NO 2 , в основном из-за резонансного эффекта, а не индуктивного эффекта.
Но есть и исключения. Например, в случае галогенов отрицательный индуктивный эффект преобладает над положительным резонансным эффектом.
Вопрос-1) Индуктивный эффект лучше всего можно описать как:
а) сопряжение σ-связывающей орбитали с соседней π-орбиталью.
б) способность атома или группы вызывать поляризацию связи
в) перенос неподеленной пары электронов от более электроотрицательного атома к менее электроотрицательному атому в молекуле.
г) Все вышеперечисленное.
Ответ: b
Вопрос-2) Какое из следующих утверждений об индуктивном эффекте неверно?
а) Это постоянный эффект
б) Он уменьшается с увеличением
на расстоянии от полярной группы, вызывающей индуктивный эффект.
c) Включает делокализацию π-электронов
d) Включает смещение σ-электронов
Ответ: d
Вопрос-3) Что из следующего показывает положительный (+I) индуктивный эффект?
A)-№ 2
B) –OCH 3
C) –COOH
D) –CH 3
ОТВЕТ: D
Вопрос-4) Какую из следующей группы показывают. отрицательный (-I) индуктивный эффект ?
а) –СН 2 CH 3
B) – C (Ch 3 ) 3
C) –C 6 H 5
D) –CH 3
.Вопрос-5) Какой из следующих порядков является правильным относительно -I влияние заместителей?
a) –NH 2 < –OR > –F
b) -CR 3 < –NR 2 < –OR < –F
c) -CR 3 > –9 NR 29003 > –ИЛИ > –F
d) – + NR 3 > – + ИЛИ 2
Ответ: b
6) Правильный порядок относительно величины отрицательного индуктивный эффект для данных групп:
а) –SO 3 H > –SO 2 R > –SR > –SOR
б) –SR > –SO 2 R > – SOR > –SO 3 H
c) –SO 3 H > –SO 2 R > –SOR > –SR
d) –SR > –SOR > –SO 2 R > –SO 3 H
Ответ: c
Вопрос-7) Наиболее устойчивым ионом карбония является:
a) CH 3 + 3 900 b) CH 309 2 + в) (СН 3 ) 2 СН + г) (СН 3 ) 3 С +
а) СН 3 • б) СН 3 Ч 2 • c) (CH 3 )CH• d) (CH 3 ) 3 C•
Ответ: d
Вопрос-9) Правильный порядок кислотной силы данных кислот:
а) Муравьиная кислота > Уксусная кислота > Пропановая кислота
b) Муравьиная кислота > Уксусная кислота < Пропановая кислота
c) Муравьиная кислота < Уксусная кислота > Пропановая кислота
d) Муравьиная кислота < Уксусная кислота < Пропановая кислота
Ответ: a
Вопрос-10) Правильный порядок кислотной силы:
a) CH 3 CH 2 CHFCOOH > CH 3 CHFCH 2 COOH > FCH 2 CH 2 CH 2 COOH
b) CH 3 CH 2 CHFCOOH < CH 3 CHFCH 4 2 COOH 90 < FCH 2 CH 2 CH 2 COOH
c) CH 3 CH 2 CHFCOOH > CH 3 CHFCH 4 2 COOH 90 < ФЧ 2 CH 2 CH 2 COOH
d) CH 3 CH 2 CHFCOOH < CH 3 CHFCH 2 CO > FCH 2 CH 2 CH 2 COOH
фторы и их удаленность от группы -COOH.
Вопрос-11) Какая из перечисленных кислот является самой сильной?
a) Cl 3 CCOOH
b) Cl 2 CHCOOH
c) ClCH 2 COOH
d) CH 3 COOH
Ответ: a
Вопрос-12) Какой из следующих карбанионов более стабилен?
а) СН 3 – б) СН 3 СН 2 – c) CF 3 CH 2 – d) (CH 3 ) 2 CH –
Ответ: c
Правильный порядок кислотной силы Вопрос-13 замещенных фенолов:
Ответ: 2
Вопрос-14) Каков характер %s при гибридизации углерода, когда он показывает сильнейший эффект -I ?
а) 25% б) 50% в) 75% г) 66,6%
Ответ: в
Информация: Электроотрицательность углерода увеличивается с
% s-орбитального признака в гибридизации. Таким образом, порядок
электроотрицательность: sp >sp 2 > sp 3 . Следовательно
углерод с sp-гибридизацией (как в алкинах) проявляет наибольшую индукционную
эффект.
Вопрос-15) Какой из следующих приказов является правильным в отношении кислотность карбоновых кислот?
а) (CH 3 ) 3 CCOOH > (CH 3 ) 2 CHCOOH > CH 3 CH 2 COOH
b) (CH 3 ) 3 CCOOH > (CH 3 ) 2 CHCOOH < CH 3 CH 2 COOH
c) (CH 3 ) 3 CCOOH < (CH 3 ) 2 СНСООН > CH 3 CH 2 COOH
d) (CH 3 ) 3 CCOOH < (CH 3 ) 2 CHCOOH
Вопрос-16) Самая сильная база Льюиса среди следующих:
A) CH 3 NH 2
B) (Ch 3 ) 2 7
B) (Ch 3 ) 2 7. NH
c) (CH 3 ) 3 N
d) C 6 H 5 NH 2
Вопрос-17) Укажите правильные утверждения об электроотрицательности
групп, указанных ниже: (CSIR NET ИЮНЬ 2018 г. )
)
(A) CF 3 Группа имеет большее значение, чем значение группы NF 2
(B) NH 2 Группа имеет более низкое значение, чем значение группы NF 2
(C) Группа OH имеет большую ценность, чем группа NF 2
(D) CH 3 и C 2 похожие ценности
Правильный ответ:
1) A, B и D
2) B и C
3) B, C и D
4) B и D
Ответ: 4
Вопрос-18) Какой из следующее неверное утверждение о индуктивный эффект?
А) Электроноакцепторный индуктивный эффект (-I) группы ослабляет Связь O-H в -COOH и способствует ионизации карбоновой кислоты
B) Действует через пространство.
C) Анилин является более слабым основанием, чем аммиак, из-за отрицательного индукционного эффекта показано фенильной группой.
D) Алкильные группы являются хорошими примерами положительного индуктивного эффекта.
Ответ: B
Вопрос-19) Выберите правильное утверждение относительно индуктивного эффекта.
а) Усиливается с увеличением расстояния от атома или группы вызывая поляризацию.
b) Включает смещение одиночной пары.
c) Включает делокализацию пи-электронов.
d) Действует через σ-связи.
Ответ: d
Вопрос-20) Какая из следующих групп имеет наибольший индуктивный эффект.
а) Кл
б) Бр
в) Ф
г) И
Ответ: в
Вопрос-21) Какое из следующих утверждений об индуктивных эффект правильный?
а) Также известен как гиперконъюгация.
b) Величина индуктивного эффекта увеличивается с увеличением расстояния из группы, вызывающей поляризацию.
в) с делокализацией π-электронов
г) с перемещением σ-электронов
Ответ: d
Вопрос-22) Какая из следующих групп показывает электрон снятие индукционного эффекта ?
A) —CH 2 CH 3
B) – NO 2
C) –C 6 H 5
D) – SCH 3
: B777777 70007 D) – SCH 3 77777777777777 гг.
Вопрос-23) индуктивный эффект в молекуле возникает за счет:
а) наличия неполярной связи
б) поляризации сигма-связи, примыкающей либо к электроноакцепторной, либо электроноотдающая группа.
в) делокализация π-электронов
г) делокализация сигма-электронов.
Ответ: b
Вопрос-24) Какой из следующих эффектов может дестабилизировать 3 o бутилкарбоанион? :
а) положительный индуктивный эффект
б) отрицательный индуктивный эффект.
c) нейтральный индуктивный эффект
d) Ничего из вышеперечисленного.
Ответ: а
CSIR NET – GATE – SET Учебный материал и онлайн-коучинг
| Органическая химия: Домашняя страница | Резонанс > |
Индуктивные эффекты алкильных групп
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 929
Заместитель в бензольном кольце может влиять на размещение дополнительных заместителей в этом кольце во время электрофильного ароматического замещения. Как узнать, где вероятнее всего будет размещен дополнительный заместитель? Ответ на этот вопрос заключается в индуктивных и резонансных эффектах. Индуктивные эффекты напрямую связаны с электроотрицательностью. Заместители могут быть либо метанаправленными, либо орто-паранаправленными.
Как узнать, где вероятнее всего будет размещен дополнительный заместитель? Ответ на этот вопрос заключается в индуктивных и резонансных эффектах. Индуктивные эффекты напрямую связаны с электроотрицательностью. Заместители могут быть либо метанаправленными, либо орто-паранаправленными.
Введение
Три основных положения дизамещенного бензольного кольца: орто , мета и пара .
Fi рисунок 1 : Влияние электронодонорных групп на бензольное кольцо
Первый сценарий добавления электрофила к монозамещенному бензольному кольцу – когда заместителем является электронодонорная группа . Электронодонорные группы представляют собой алкильные группы, фенильные группы или заместители, которые имеют неподеленную пару электронов на атоме, непосредственно связанном с кольцом. Электронодонорные группы отдают по индукции (активация и деактивация бензольных колец) и резонансу. Примеры электронодонорных групп: -СН 3 , -OCH 3 , -OH, -NH 2
Примеры электронодонорных групп: -СН 3 , -OCH 3 , -OH, -NH 2
Электронодонорные группы вызывают присоединение второго заместителя к пара или орто положению бензольного кольца. Причину этого можно объяснить различными карбокатионными резонансными структурами орто-, мета- и пара-положений.
Некоторые электронодонорные группы имеют экстрарезонансную форму, в которой имеется двойная связь между атомом и углеродом бензола. Это очень стабильная резонансная форма. Это связано с направляющими эффектами заместителей при сопряжении с бензольным кольцом.
Когда электрофил добавляется в орто-положение, возможны три различные формы резонанса. Карбкатионные формы 1 и 2 являются вторичными карбокатионами, но положение 3 образует третичный карбокатион, и положительный заряд находится на углероде, непосредственно присоединенном к электронодонорной группе, которая является наиболее стабильной.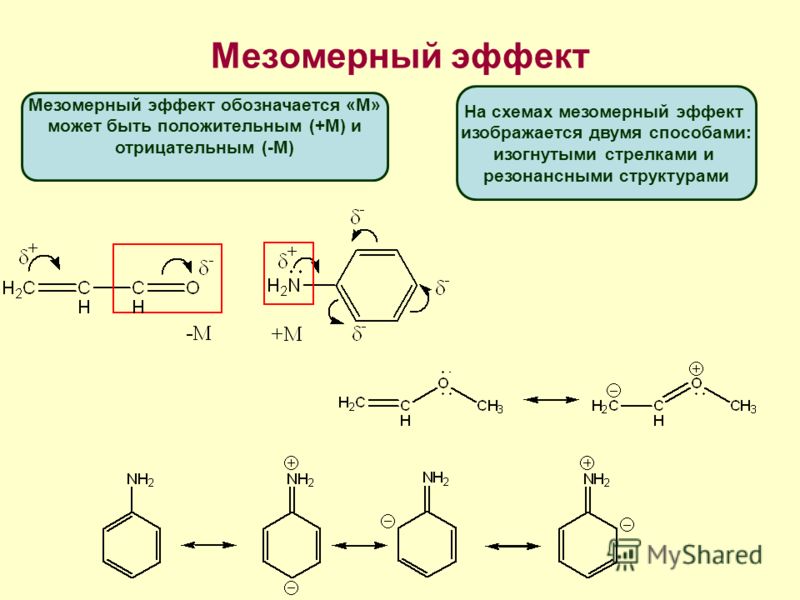 Этот карбокатион также стабилизируется электронами из электронодонорной группы. Более стабильные промежуточные продукты (карбокатион) имеют более низкую энергию переходного состояния и, следовательно, более высокую скорость реакции, образуя больше этого продукта. Это причина того, что орто-положение является одним из основных продуктов.
Этот карбокатион также стабилизируется электронами из электронодонорной группы. Более стабильные промежуточные продукты (карбокатион) имеют более низкую энергию переходного состояния и, следовательно, более высокую скорость реакции, образуя больше этого продукта. Это причина того, что орто-положение является одним из основных продуктов.
Если к монозамещенному бензольному кольцу в пара-положении добавить электрофил, то одной из трех резонансных форм карбокатионов будет третичный карбокатион, который очень стабилен из-за эффекта +I, если три -CH 3 . Этот промежуточный карбокатион такой же, как тот, который образуется в результате орто-замещения.
Для резонансных структур метазамещенных карбокатионов существует три возможных резонанса от вторичных карбокатионов. Эти формы не так стабильны, как форма третичного карбокатиона в орто- и паразамещенных карбокатионах.
Таким образом, двумя основными продуктами реакции монозамещенного бензольного кольца с электронодонорной группой и дополнительным электрофилом являются положения орто и пара .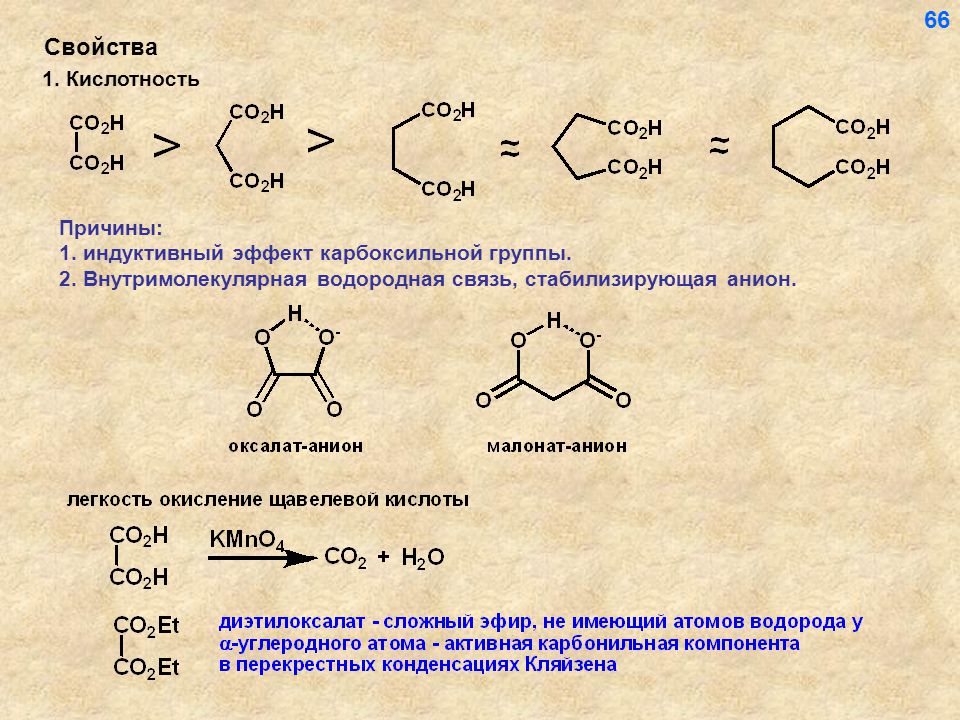 Важно отметить, что пара-продукт немного более распространен, чем орто-продукт из-за стерических затруднений.
Важно отметить, что пара-продукт немного более распространен, чем орто-продукт из-за стерических затруднений.
Спектроскопия Н-ЯМР может использоваться для определения того, имеет ли соединение второй заместитель в орто- или пара-положении. В орто-положении есть четыре различных сигнала, но в пара-положении есть только два сигнала, потому что молекула симметрична. Электронодонорные группы в бензольном кольце называются 9.0848 активирует , потому что они увеличивают скорость второго замещения, так что она выше , чем у стандартного бензола.
Электронодонорные группы называются орто/пара-направляющими и являются активаторами.
Влияние электроноакцепторной группы на бензольное кольцо
Другое обстоятельство – добавление дополнительного электрофила к монозамещенному бензольному кольцу с электроноакцепторной группой в теме. Электроноакцепторные группы имеют атом со слабым положительным или полным положительным зарядом, непосредственно присоединенный к бензольному кольцу. Примеры электроноакцепторных групп: -CF 3 , – COOH, -CN. Электроноакцепторные группы имеют только один основной продукт, второй заместитель добавляется в положение мета . Опять же, это можно объяснить резонансными формами промежуточных карбокатионов.
Примеры электроноакцепторных групп: -CF 3 , – COOH, -CN. Электроноакцепторные группы имеют только один основной продукт, второй заместитель добавляется в положение мета . Опять же, это можно объяснить резонансными формами промежуточных карбокатионов.
При присоединении второго электрофила к бензольному кольцу в орто-положении образуются те же три резонансные формы карбокатиона. Опять же, одна форма представляет собой третичный карбокатион с положительным зарядом углерода, непосредственно присоединенным к электроноакцепторной группе. В отличие от случая с электронодонорной группой эта форма резонанса гораздо менее стабилен . Это связано с тем, что электроноакцепторная группа оттягивает электроны от углерода, создавая еще более сильный положительный заряд. Это положение справедливо и для резонансной формы паразамещенного третичного карбокатиона.
Для мета-положения все образующиеся карбокатионы являются вторичными. Хотя они не совсем стабильны, они более предпочтительны, чем резонансные формы орто- и пара-положений.
Хотя они не совсем стабильны, они более предпочтительны, чем резонансные формы орто- и пара-положений.
Основным продуктом монозамещенного бензольного кольца с электроноакцепторной группой и дополнительным электрофилом является продукт с 9Замена 0848 на . В отличие от электронодонорных групп электроноакцепторные группы деактивируют . Это означает, что скорость второго замещения ниже, чем у стандартного бензола.
| Орте- и пара-направление | Мета-режиссура | ||||
|---|---|---|---|---|---|
| Сильная активация | Умеренная активация | Слабая активация | Слабая деактивация | Умеренная деактивация | Сильно деактивирует |
| -NH 2 -NHR -OH -OCH 3 | -NHCOR -ОКОР | -СН 3 -фенил | -F -Cl -Br -I | -COH -COCH 3 -COOCH 3 -SO 3 H | -NO 2 -CF 3 -CCl 3 |
Галогены: особый случай
Галогены очень электроотрицательны. Это означает, что они индуктивно являются электроноакцепторными. Однако из-за их способности отдавать неподеленную пару электронов в резонансных формах они являются активаторами и направляющими орто/пара. Резонансные формы побеждают в режиссуре. Поскольку они являются электроноакцепторными, галогены являются очень слабыми активаторами.
Это означает, что они индуктивно являются электроноакцепторными. Однако из-за их способности отдавать неподеленную пару электронов в резонансных формах они являются активаторами и направляющими орто/пара. Резонансные формы побеждают в режиссуре. Поскольку они являются электроноакцепторными, галогены являются очень слабыми активаторами.
Электроноакцепторные группы являются метадиректорами и деактиваторами.
Ссылки
- Bohm, S., and O. Exner. «Взаимодействие двух функциональных групп через бензольное кольцо: теория и эксперимент». Журнал вычислительной химии (2008 г.) (стр. 1) http://www.lib.berkeley.edu
- Браун, Уильям Х., Фут, Кристофер С., Айверсон, Брент Л. Органическая химия. 4-е изд. Белмонт, Калифорния: Thomson Learning Inc./ Brooks/Cole, 2005. (стр. 868-872) 908:30
- Шор, Нил Э., Фоллхардт, Питер К. Органическая химия, структура и функции . 5-е изд. Нью-Йорк: WH Freeman & Company, 2007. (стр.
 724-728)
724-728)
Проблемы
Участники
- Лорен Райс и Саманта Спрэгг (UCD)
Inductive Effects of Alkyl Groups распространяется по незаявленной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- нет на странице
- Теги
- Электронодонорная группа
- Индуктивные эффекты
Индуктивный эффект, электромерный эффект, резонансные эффекты и гиперконъюгация
Гаутам Шарма, Джордан Калмс, Ананду Радж, а также
способствовал
Содержание
- Полярность органических молекул
- Примеры электронных эффектов
- Индуктивный эффект
- Резонанс
- Мезомерный эффект
- Электромерный эффект
- Гиперконъюгация
Частичная полярность внутри молекулы приводит к переносу электронов между атомами в молекуле, что приводит к поведению, отличному от того, что можно было бы ожидать в неполярной версии соединения, где нет участков, богатых электронами или дефицитных по электронам.
Насыщенные углеводороды нереакционноспособны, потому что нет полярности связи С-С и практически нет полярности связи С-Н. Углерод и водород имеют почти одинаковую электроотрицательность, поэтому электроны, участвующие в связи между двумя атомами, в равной степени притягиваются к каждому ядру и проводят примерно одинаковое количество времени, вращаясь вокруг одного и другого.
Электронная плотность равномерно распределяется между двумя атомами в неполярной связи, что предотвращает атаку или изменение связи заряженными частицами. Напротив, заряженные частицы (электрофилы и нуклеофилы) реагируют с полярными органическими молекулами из-за дисбаланса электронной плотности или полярности.
Элементы с более высокой электроотрицательностью, включая кислород и галогенидную группу, могут изменить плотность электронов вокруг органической молекулы и сделать молекулу более реакционноспособной.
Электронные эффекты усложняют химические реакции, и они могут стабилизировать молекулу, сделать соединение менее летучим, повысить вероятность реакции молекулы желаемым образом или повлиять на кислотность или щелочность. Понимание факторов, связанных с электронным дисбалансом, жизненно важно для понимания основных механизмов химической реакции, предсказания продуктов реакции и поведения органических молекул.
Понимание факторов, связанных с электронным дисбалансом, жизненно важно для понимания основных механизмов химической реакции, предсказания продуктов реакции и поведения органических молекул.
Индуктивный эффект
Резонанс
Мезомерный эффект
Электромерный эффект
Гиперконъюгация
Индуктивный эффект представляет собой постоянное состояние поляризации. Электронная плотность в σ\sigmaσ-связи между двумя разноименными атомами неоднородна. Электронная плотность более плотная по направлению к более электроотрицательному из двух атомов.
Индуктивный эффект зависит от расстояния: 9{\ delta-} Cδ+-Xδ-
Атом XXX выше приобретает слегка отрицательный заряд (δ-), (\ delta-), (δ-), а атом углерода слегка положительный заряд (δ+), (\delta+),(δ+), что означает, что связь поляризована:
Если электроотрицательный атом XXX соединяется с цепочкой атомов углерода, то положительный заряд передается другим атомам углерода. \text{rd}.3-го.
\text{rd}.3-го.
Индуктивный эффект постоянный, но относительно слабый, и его легко затмить электронными эффектами, обсуждаемыми позже.
Существует две категории индуктивных эффектов: электроноакцепторный (-I эффект) и электроновысвобождающий (+I эффект). Последний также называют электронодонорным эффектом . На изображении выше XXX является электроноакцепторным, а YYY — электронодонорным.
Эти относительные индуктивные эффекты измерены по отношению к водороду: 9-.NO2>COOH>F>Cl>Br>I>OR>OH>C6H5(бензол)>H>Me3C->Me2CH->MeCh3->Ch4-.
Эффект -I:
Эффект -I наблюдается вокруг более электроотрицательного атома или группы, и электронная плотность там выше, чем где-либо еще в молекуле. Электроноакцепторные группы включают галоген, нитро (-NO2), (-\text{NO}_2), (-NO2), циано (-CN), (-\text{CN}), (-CN), карбокси (-COOH), (-\text{COOH}),(-COOH), сложный эфир (-COOR),(-\text{COOR}),(-COOR) и арилокси (-OAr). (-\text {OAr}).(-OAr).
(-\text {OAr}).(-OAr).
Эффект +I:
Эффект +I наблюдается среди менее электроотрицательных атомов молекулы по электроноотдающим (или электронодонорным) группам. Алкильные группы обычно считаются электроноотдающими (или электронодонорными) группами.
Иногда для данной молекулы существует несколько правильных структур Льюиса. Одним из примеров является озон (O3)(O_3)(O3). Соединение представляет собой цепочку из трех атомов кислорода, и минимизация зарядов при предоставлении каждому атому октета электронов требует, чтобы центральный атом кислорода образовывал одинарную связь с одним концевым кислородом и двойную связь с другим концевым кислородом.
При построении структуры Льюиса выбор места двойной связи произволен, и любой из вариантов одинаково верен. Несколько правильных способов рисования структуры Льюиса называются резонансными формами .
Основываясь на резонансных формах, начинающий студент-химик может задаться вопросом, есть ли у озона связи двух разных длин, поскольку одинарные связи обычно длиннее двойных. Однако молекула озона совершенно симметрична, а связи имеют одинаковую длину. Ни одна из резонансных форм не представляет истинной структуры молекулы. Скорее, отрицательный заряд электронов, образующих двойную связь, равен 9.0848 делокализовано или равномерно распределено по трем атомам кислорода. Истинная структура представляет собой композит, в котором связи короче, чем можно было бы ожидать для одинарных связей, но длиннее, чем ожидаемые двойные связи.
Однако молекула озона совершенно симметрична, а связи имеют одинаковую длину. Ни одна из резонансных форм не представляет истинной структуры молекулы. Скорее, отрицательный заряд электронов, образующих двойную связь, равен 9.0848 делокализовано или равномерно распределено по трем атомам кислорода. Истинная структура представляет собой композит, в котором связи короче, чем можно было бы ожидать для одинарных связей, но длиннее, чем ожидаемые двойные связи.
Резонансный гибрид для озона находится путем идентификации множественных резонансных структур молекулы.
Таким образом, для O3{ O }_{ 3 }O3 две структуры (I и II), показанные выше, составляют канонические структуры или резонансные структуры, а их гибрид (т.е. структура III) представляет собой структуру O3{ O }_{ 3 }O3 точнее. Резонанс представлен двунаправленной стрелкой между резонансными структурами, как показано выше.
(1)
(2)
Резонансный гибрид более стабилен, чем его канонические формы, т. е. реальное соединение (гибрид) находится в более низком энергетическом состоянии, чем его канонические формы. Резонансная устойчивость увеличивается с увеличением количества резонансных структур.
е. реальное соединение (гибрид) находится в более низком энергетическом состоянии, чем его канонические формы. Резонансная устойчивость увеличивается с увеличением количества резонансных структур.
Разница между экспериментальной и расчетной энергиями представляет собой количество энергии, при которой соединение стабильно. Эта разница известна как резонансная энергия или энергия делокализации.
Все резонансные структуры не эквивалентны. Следующие правила помогают определить, будет ли резонансная структура вносить значительный вклад в гибридную структуру.
Правила резонанса
Правило 1 : Самый значительный источник резонанса имеет наибольшее количество полных октетов (или, если применимо, расширенных октетов).
Правило 2 : Самый значительный вклад в резонанс имеет наименьшее количество атомов с формальными зарядами.
Правило 3 : Если нельзя избежать формальных зарядов, наиболее значительный вклад в резонанс вносят отрицательные формальные заряды на наиболее электроотрицательных атомах и положительные формальные заряды на наименее электроотрицательных атомах.
Правило 4 : Самый значительный вклад в резонанс имеет наибольшее количество ковалентных связей.
Правило 5 : Если присутствует пи-связь, наиболее значительный резонансный вклад вносит эта пи-связь между атомами одной и той же строки периодической таблицы (обычно углерод пи-связан с бором, углеродом, азотом, кислородом или фтором).
Правило 6 : Вкладчики ароматического резонанса более значительны, чем вкладчики резонанса, которые не являются ароматическими.
Постоянная поляризация группы, сопряженной π\piπ-связью или набором чередующихся π\piπ-связей, передается через π\piπ-электроны системы, что приводит к различному распределению электронов в ненасыщенной цепи. Такое распределение электронов в ненасыщенных соединениях, сопряженных с электроноотдающими или отщепляющими группами или атомами, называется мезомерный эффект .
Как показано выше, полярность в соединениях индуцируется за счет переноса электронов через π\piπ-связи. Этот эффект является следствием резонанса и наблюдается в соединениях, содержащих двойную связь, которая отделена от другой двойной связи или неподеленной пары электронов одинарной связью.
Этот эффект является следствием резонанса и наблюдается в соединениях, содержащих двойную связь, которая отделена от другой двойной связи или неподеленной пары электронов одинарной связью.
Электромерный эффект представляет собой внутримолекулярное перемещение электронов от пи-связи к другому атому в молекуле вследствие атаки реагентом. Это временно и обратимо.
Существует два различных типа электромерных эффектов:
(i) Положительный электромерный эффект (+E эффект) : При этом π\pi π-электронов кратной связи переходят к тому атому, к которому присоединяется реагент. Например:
(ii) Отрицательный электромерный эффект (-E эффект) : В этом эффекте π\pi π-электроны кратной бомбы переносятся на тот атом, к которому атакующие реагенты не присоединяются. Например:
Гиперконъюгация помогает объяснить стабильность алкильных радикалов.

 724-728)
724-728)