История открытия атома – презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Влияния состава и размера зерна аустенита на температуру фазового превращения и физико-механические свойства сплавов
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Геофизические исследования скважин
Хроматографические методы анализа
Искусственные алмазы
Трансформаторы тока и напряжения
Транзисторы
Титриметрические методы анализа
1. ИСТОРИЯ ОТКРЫТИЯ АТОМА
2. ЦЕЛИ:
изучить гипотезы строения атома.изучить опыт Э.Резерфорда.
Рассмотреть зарождение квантовой
физики.
3. Как все начиналось 2 тысячи лет назад.
Гипотеза о том, что все вещества состоят избольшого числа атомов, зародилась свыше двух
тысячелетий тому назад. Сторонники
атомистической теории рассматривали атом как
мельчайшую неделимую частицу и считали, что
все многообразие мира есть не что иное, как
сочетание неизменных частиц- атомов.

4. ИСТОРИЧЕСКАЯ СПРАВКА
АристотельДелимость вещества
бесконечна
Аристотель был крестным отцом физической науки.
Название его книги, посвященной исследованию
природы(«Физика»), стала названием физической науки.
Физика Аристотеля, основанная на принципе
целесообразности природы,
между тем отвергала
некоторые прогрессивные идеи предшественников,
гелиоцентризма и атомизма.
—
Аристотель (384-322 до н.э.) – древнегреческий
философ и ученный. Родился в Стагире. В 367-347 до н. э.
Учился в академии Платона в Афинах\,в 343-355 у царя
Македонии Филиппа был воспитателем его сына Александра.
5. ИСТОРИЧЕСКАЯ СПРАВКА
ДемокритСуществует предел
деления атома
Демокрит (ок. 460-370гг. до н. э.)древнегреческий ученый, философматериалист, главный представитель
древней атомистики.
Демокрит был родом из фракийского
города Абдера.
Не существует ничего, кроме
атомов и чистого пространства, все
другое только воззрение.

Атомы бесконечны по числу и
бесконечно
разнообразны
по
форме.
Различие между вещами
происходит от различия их атомов в
числе, величине, форме и порядке;
качественного различия между
атомами не существует.
Душа состоит из тонких, гладких и
круглых
атомов,
подобных
атомам огня.
6. Зарождение квантовой теории.
В КОНЦЕ 19 ВЕКА МНОГИЕ УЧЕНЫЕ СЧИТАЛИ ЧТО РАЗВИТИЕ ФИЗИКИ ЗАВЕРШИЛОСЬПО СЛЕДУЮЩИМ ПРИЧИНАМ:
1.
Больше 200 лет существуют законы классической механики, эаконы
всемирного тяготения.
2.
Разработана МКТ.
3.
Подведен прочный фундамент под термодинамику.
4.
Завершена максвелловская теория электромагнетизма.
5.
Открыты фундаментальные законы сохранения(энергии, импульса,
массы и электрического заряда)
7. Планетарная модель Хантаро Нагаока
В 1904 г. появилисьпубликации о строении атома,
принадлежащие японскому
физику Хантаро Нагаока.
Нагаока исходил из
исследований Максвелла об
устойчивости колец Сатурна
и представил строение атома
аналогичным строению
солнечной Системы:роль солнца
играет положительно
заряженная центральная часть
атома, вокруг которой по
установленным кольцеобразным
орбитам движутся «планеты»электроны.

8. Хантаро Нагаоко
Хантаро Нагаока – японский физик(18.08.1865-11.12.1950),член Японской
А.Н., президент в 1939-48 родился в
городе Нагасаки.
Окончил Токийский университет(1887), там
же работал до 1926 (с 1896- профессор и с
1916-директор Ин – та физики при ун-те).
В 1917-46 работал в Ин-те физических и
химический исследований (Токио), в1920-39
возглавлял отдел физики Национального
исследовательского
Совета Японии, в 1931-34 президент
ун-та в Осаке.
Работы Хантаро Нагаока посвящены
магнетизму, атомной и ядерной физике,
оптике.
9. Зарождение квантовой теории.
В КОНЦЕ 19 ВЕКА МНОГИЕ УЧЕНЫЕ СЧИТАЛИ ЧТО РАЗВИТИЕ ФИЗИКИ ЗАВЕРШИЛОСЬПО СЛЕДУЮЩИМ ПРИЧИНАМ:
1.
Больше 200 лет существуют законы классической механики, эаконы
всемирного тяготения.
2.
Разработана МКТ.
3.
Подведен прочный фундамент под термодинамику.
4.
Завершена максвелловская теория электромагнетизма.
5.

Открыты фундаментальные законы сохранения(энергии, импульса,
массы и электрического заряда)
В конце 19- начале 20 века открыты В.Рентгеном-Х
лучи,А.Беккерелем- явление радиоактивности,Дж.Томсоном- электрон.
Однако классическая физика не сумела объяснить эти явления.
10. Опыты Эрнеста Резерфорда
Ядерная модель атомаЭкспериментальная проверка модели Томсона была осуществлена в 1911 г английским
физиком Резерфордом. Пропуская пучок а-частиц (заряд +2е, масса 6,64-10-27 кг)
через тонкую золотую фольгу, Э. Резерфорл обнаружил, что какая-то часть частиц
отклоняется на довольно значительный угол от своего первоначального направления, а
небольшая часть а-частиц отражается от фольги. Но согласно модели атома Томсона эти
а-частицы при взаимодействии с атомами фольги отклоняются на малые углы, порядка
2°. Резерфорд показал, что модель Томсона находится в противоречии с его опытами.
Обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель
строения атома: том
имеет ядро, размеры которого малы по сравнению
с размерами самого атома.

В ядре сконцентрирована почти вся масса атома.
Отрицательный заряд всех электронов распределен по всему объему атома.
11. Эрнест Резерфорд
Резерфорд Эрнест (1871 —1937) —великийанглийский физик, уроженец Новой
Зеландии. Своими экспериментальными
открытиями Резерфорд заложил основы
современного учения о строении атома и
радиоактивности. Он первым исследовал
состав излучение радиоактивных
веществ. Резерфорд открыл
существование атомного ядра и впервые
осуществил искусственное превращение
атомных ядер. Все поставленные им
опыты носили фундаментальный характер,
отличались исключительной простотой и
ясностью.
12. Выводы
Ядерная модель атома оказалась в противоречии склассической физикой.
1.Электроны,обращающиеся вокруг ядра ,движутся с
центростремительным ускорением и , согласно классической
физике, должны непрерывно излучать электромагнитные волны.
Между тем в нормальном состоянии атомы не излучают.

2. Благодаря излучению электромагнитных волн энергия
электронов должна непрерывно уменьшатся и они должны
приближаться к ядру и в конце концов «упасть» на него.
Расчеты показывают, что процесс «падения» электронов на
ядро должен завершиться за 10 -8 с.
13. Вихревая модель Кельвина
Таким образом ,факт длительного существования атомовнесовместим с планетарной моделью атома Резерфорда, если
ее рассматривать с точки зрения классической физики.
Кельвин предложил модель: вихревой
атом в виде микроскопичес-кого
колечка дыма (1902)
14. Лорд Кельвин
Уильям Томсон (Лорд Кельвин) родился 26июня 1824году в городе Белфасте в семье преподавателя
математики.
22-лет Томсон становится профессором в Глазго и
занимает кафедру до 1899 года в течении 53 лет.
В 1892 году Томсону за большие научные заслуги
был присвоен титул Лорда Кельвина (по имени речки
Кельвин, протекающей в близи университета в городе
Глазго)
У Томсон – один из основоположников
термодинамики, основатель одной из первых
физических лабораторий в 1846 году.

У Томсон выдвинул (1902) гипотезу о строение
атомов, осуществил расчет размеров молекул.
50-летний юбилей его научной деятельности в 1896
году отмечали физики всего мира, в том числе
русский физик Н.А. Умов.
У Томсон умер в 1907 года.
15. Дж. Дж. Томсон
Джозеф Джон Томсон родился 18 декабря1856 года в городе Манчестере. Учился в
Кембриджском университете. В 27 лет
стал профессором Кавендишской
лаборатории, а затем ее директором.
В 1903 году им был открыт электрон
(Нобелевская премия 1906 год).
В 1906 году выдвинул гипотезу об
электроном составе атомов
(внутриатомных электронах).
В 1907 году предложил принцип действия
масс-спектрометра.
Умер 30 августа 1940 года.
Томсон был великолепным педагогом.
Пятеро его учеников стали лауреатами
Нобелевской премии, 22 человека были
избраны действительными членами
английской академии наук, 50заведовали кафедрами в университетах.
Его учеником был Э.
 Резерфорд.
Резерфорд.16. Модель « кекса» Дж. Дж. Томсона
Дж.модель
Томсон
атома
заряженной
в 1898 году предложил
в
виде
положительно
сферы
радиусом
10-10 м, с
вкрапленными в нее электронами, суммарный
отрицательный
заряд
которых
равен
положительному заряду сферы.
Эта модель была усовершенствована в
1903г.Дж.ДЖ.
Томсон
считал,
что
периодическая
повторяемость
химических
свойств
атомов
и
спектральные
закономерности получат свое объяснение,
если будут найдены радиусы концентрических
электронных оболочек внутри положительно
заряженного шара, число электронов на
каждой
оболочке
и
закономерности
их
заполнения.
17. Информационные ресурсы
Луппов Г.Д. Опорные конспекты и тестовыезадания: Книга для учителя. -М.:
Просвещение,1996,-105с.
Буравихин В.А., Егоров В.А.Биография
электрона. -М.: Знание ,1985,-25с.
Кудрявцев П.
 С. Курс Истории Физики. –М.:
С. Курс Истории Физики. –М.:Просвещение,1982,17,19,350с.
Москалев А.Н., Никулова Г.А.Готовимся к едином
English Русский Правила
Строение атома. История открытия атома
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. «Строение атома»
«СТРОЕНИЕ АТОМА»2. История открытия атома
ИСТОРИЯ ОТКРЫТИЯ АТОМАДемокрит
М.В. Ломоносов
Джон Дальтон
3. 1904г. Джозеф Томсон предложил одну из первых модель строения атома.
1904Г. ДЖОЗЕФ ТОМСОНПРЕДЛОЖИЛ ОДНУ ИЗ ПЕРВЫХ
МОДЕЛЬ СТРОЕНИЯ АТОМА.

.
Атом – шар, по всему объёму которого
равномерно распределён положительный
заряд. Внутри шара находятся электроны.
4. Открытие явления радиоактивности.
ОТКРЫТИЕ ЯВЛЕНИЯ РАДИОАКТИВНОСТИ.Эрнест Резерфорд
Антуан Анри Беккерель.
Резерфорд предложил
ядерную (планетарную)
модель атома, и сумел
оценить размеры атомных
ядер. В зависимости от массы
атома его ядро имеет диаметр
порядка:
14
15
10
10
м
т.е. оно в десятки или даже в
сотни тысяч раз меньше
атома.
6. Атом
АТОМЯдро
нуклоны
Протоны – p+
Электронная
оболочка
Электроны – е
Нейтроны – n0
7. Таблица элементарных частиц
ТАБЛИЦА ЭЛЕМЕНТАРНЫХ ЧАСТИЦНазвание
частицы
Обозначен
ие
Местонахо Масса
ждение
частицы
Заряд
Протон
р+
Ядро
1а.е.м
+1
Нейтрон
n0
Ядро
1а.е.м.
0
Электрон
е
Орбиталь
1/1836
а.е.м
(≈0)
-1
Z – порядковый номер химического элемента
М – массовое число, М =Ar
n – число нейтронов
Z – указывает на заряд ядра, а следовательно на
число протонов (p), а так как атом
нейтрален, то число протонов равно числу
электронов (e).

Ar – сумма протонов и нейтронов в ядре атома
Ar = p + n
1) Z = заряд ядра (+), число электронов и
протонов;
2) n= Ar – Z
Атом – это микрочастица, которая имеет форму
шара.
Атом – это сложная система, состоящая из ядра
и электронов.
Ядро находится в центре атома и имеет очень
маленький размер, но почти вся масса
сосредоточена в ядре.
Ядро имеет положительный заряд, величина
которого определяется числом протонов в нём.
Электроны движутся вокруг ядра, имеют
ничтожно малую массу и размеры, обладают
отрицательным зарядом.
Атом электронейтрален, поэтому число
протонов и нейтронов в атоме одинаково.
Вставьте попущенные слова
В центре атома находится положительно
заряженное …., которое состоит из
элементарных частиц …. и …. . Заряд
ядра равен числу …. в нем. Вокруг ядра
с
большой скоростью движутся
отрицательно заряженные …. .
11. Заполни таблицу
ЗАПОЛНИ ТАБЛИЦУЭлементы
Число
протонов и
электронов
p+, eЧисло
нейтронов
n0
K
Ca
S
Mn
Si
Al
12.
 Заполни таблицуЗАПОЛНИ ТАБЛИЦУ
Заполни таблицуЗАПОЛНИ ТАБЛИЦУЭлементы
K
Ca
S
Mn
Si
Al
Число
протонов и
электронов
p+, eЧисло
нейтронов
n0
19
20
16
25
14
13
20
20
16
30
14
14
13. 1. Заряд ядра атома азота равен: а) 7 б) 13 в) 4 г) 29 д) 11 2. Число протонов в ядре атома криптона: а) 36 б) 17 в) 4 г) 31 д)
Тестовые задания1. ЗАРЯД ЯДРА АТОМА АЗОТА РАВЕН:
А) 7 Б) 13 В) 4 Г) 29 Д) 11
2. ЧИСЛО ПРОТОНОВ В ЯДРЕ АТОМА КРИПТОНА:
А) 36 Б) 17 В) 4 Г) 31
Д) 6
3. ЧИСЛО НЕЙТРОНОВ В ЯДРЕ АТОМА ЦИНКА:
А) 8 Б) 35 В)11 Г)30 Д)4
4. ЧИСЛО ЭЛЕКТРОНОВ В АТОМЕ ЖЕЛЕЗА:
А) 11 Б)8 В)56 Г)26
Д)30
14. Спасибо за урок!
СПАСИБО ЗА УРОК!English Русский Правила
Открытие строения атома
Многие исследователи и мыслители, в частности Ньютон, Галилей, Лавуазье и Бойль, исследовали и расширили понятие строения атома и атомов. Однако английский ученый, метеоролог и физик по имени Джон Дальтон впервые упомянул, что все состоит из атомов в книге, опубликованной им в 1808 году. Более того, общеизвестная атомная теория Дальтона является одним из его вкладов. А если говорить об атоме, то Демокрит, греческий философ, был первым человеком, употребившим термин атом.
Более того, общеизвестная атомная теория Дальтона является одним из его вкладов. А если говорить об атоме, то Демокрит, греческий философ, был первым человеком, употребившим термин атом.
Здесь, в этой статье, мы рассмотрим атомную структуру Дальтона и то, как он нашел атомную структуру с помощью моделей некоторых других ученых, таких как атомная модель Дж. Дж. Томпсона, атомная модель Резерфорда и т. д.
Атомная теория Дальтона С 1743 по 1794 год Дальтон создал свою теорию, опираясь на теорию Антуана Лавуазье, используя закон сохранения массы и определенную пропорцию. Позже он стал фундаментальным строительным блоком атомной или химической структуры. Дальтон утверждал, что каждое соединение состоит из атомов уникального, отличного вида, которые могут объединяться для создания более сложных структур, даже если они не могут быть преобразованы или повреждены химически или физически. Это была первая научная гипотеза об атоме, учитывая, что Дальтон пришел к своим выводам путем проверки и эмпирического исследования данных.
Дальтон пришел к такому выводу, изучая различные массы различных элементов, таких как олово, кислород и их комбинации. И обнаружил, что они демонстрируют общую закономерность в их формировании или комбинациях. А также гипотезы о разнице масс из-за разницы в атомном строении элементов.
Основные постулаты атомной теории Дальтона:-
- Материя состоит из различных мельчайших невидимых частиц, обычно известных как атомы
- Элемент имеет сходные или идентичные атомы
- Состав соединения состоит из комбинации атомов одного или разных атомов.
- Химическая реакция — это просто комбинация или перегруппировка различных атомов в различных условиях.
JJ Thompson провел эксперимент с электронно-лучевой трубкой (ЭЛТ), в ходе которого обнаружил существование электронов в атоме.
Электронно-лучевая трубка представляет собой упакованную трубку, имеющую вакуум внутри нее с достаточно необходимым потоком электронно-лучевого излучения внутри нее, используемую Томпсоном. Подобно разряду молнии. В своем эксперименте Томпсон использовал анод и катод, где катод испускал луч, а анод его принимал. И он поместил две противоположно заряженные электрические пластины, чтобы лучи отклонялись. Он обнаружил, что лучи отклоняются в сторону положительно заряженной пластины или от отрицательно заряженной пластины (отображая отклонение электроники).
Подобно разряду молнии. В своем эксперименте Томпсон использовал анод и катод, где катод испускал луч, а анод его принимал. И он поместил две противоположно заряженные электрические пластины, чтобы лучи отклонялись. Он обнаружил, что лучи отклоняются в сторону положительно заряженной пластины или от отрицательно заряженной пластины (отображая отклонение электроники).
Чтобы проверить это, он затем использовал магниты вместо пластин, в которых он нашел отношение массы к заряду отклоненных частиц, которое показало, что отклоненные частицы имеют очень меньшую массу, чем атом. После чего он постулировал модель атома сливового пудинга, в которой электроны и протоны (положительно заряженная материя) размещены в пудинге неравномерно.
Модель Эрнеста Резерфорда (модель из золотой фольги) В своем эксперименте Эрнест Резерфорд использовал золотую фольгу, на которую он пропускал альфа-лучи, являющиеся лучами ядер гелия. В эксперименте Резерфорд полагал, что согласно модели Томпсона все альфа-частицы пройдут сквозь фольгу.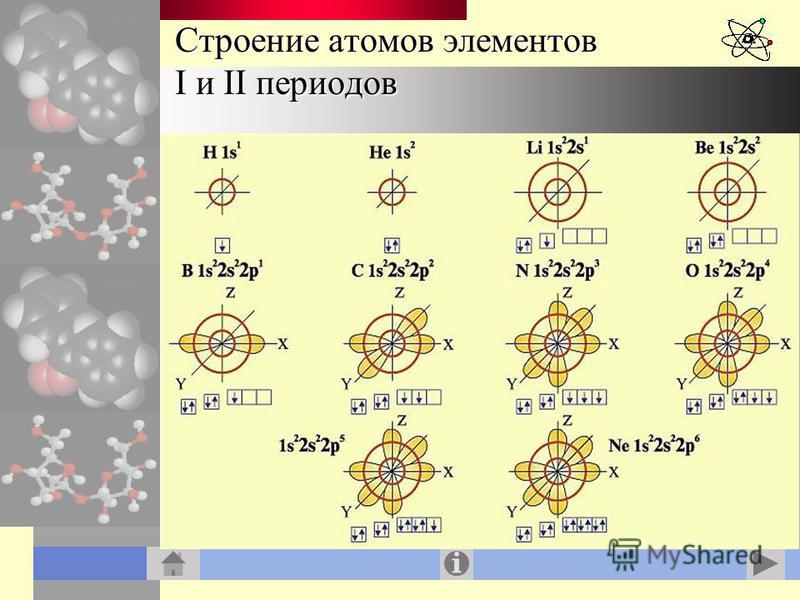 Однако он обнаружил, что большинство альфа-частиц прошло. Однако немногие частицы отразились за 90 градусов, что указывает на наличие очень плотного материала в центре. И на основании этого он постулировал:
Однако он обнаружил, что большинство альфа-частиц прошло. Однако немногие частицы отразились за 90 градусов, что указывает на наличие очень плотного материала в центре. И на основании этого он постулировал:
- В атоме есть положительный заряд (ядро), который содержит большую часть массы атома. Кроме того, положительный заряд имеет очень малый размер в атоме.
- Атом может иметь большое пространство, так как большинство частиц прошло через него с небольшими отклонениями.
В своей модели Нил Бор сравнил модель атома с моделью планет и Солнца. Где он заявил, что электроны движутся центрично по отношению к ядру на вращательной основе, как планеты вокруг Солнца, и их путь известен как орбита. И каждая орбита имеет свой энергетический уровень или постоянную энергию.
Более того, каждый электрон может захватить энергию и перейти на более высокий энергетический уровень или орбиту большего радиуса, а может потерять энергию и вернуться на более низкую энергетическую орбиту, также они могут находиться только на энергетических уровнях орбит, имеющих дискретные значения.
Согласно этой модели атома, электрон находится вокруг ядра подобно электронному облаку, в котором находится большая часть электронов. Облако произвольно, и точное местоположение электрона неизвестно, поскольку они быстро движутся вокруг ядра.
Заключение Подводя итог, можно сказать, что первое фундаментальное открытие в отношении структуры атома было сделано Джоном Дальтоном. И он сказал, что атомы являются фундаментальными строительными блоками любого соединения, а химические реакции — это просто перегруппировка атомов. Затем, в более поздние годы, Дж. Дж. Томпсон, играя с ЭЛТ, обнаружил существование электронов и положительно заряженных частиц (нейтронов), встроенных в модель сливового пудинга. Кроме того, в последующие годы Резерфорд, ссылаясь на модель Томпсона, нашел местоположение ядра и электронов, используя эксперимент с золотой фольгой. И далее проводились все новые и новые эксперименты, и нынешняя структура атома развивалась и характеризовалась современной таблицей Менделеева.
Открытие атомов и приборов для их наблюдения
ПОДЕЛИТЬСЯ:
Узнайте об открытии атомов и инструментах, которые ученые используют для наблюдения за ними…
© Американское химическое общество (партнер-издатель Britannica)Трудно представить, насколько крошечными являются атомы. Один лист бумаги имеет толщину примерно в полмиллиона атомов. По объему один атом так же мал по сравнению с яблоком, как это яблоко по сравнению со всей землей. Поэтому вы можете быть удивлены, узнав, что химики действительно могут видеть атомы не глазами, а с помощью невероятно точных инструментов.
Идея атомов восходит к Древней Греции, когда философ Демокрит заявил, что вся материя состоит из мельчайших частиц. Философ Платон даже ошибочно решил, что разные вещества имеют атомы разной формы, например, пирамиды или кубы. Первые современные доказательства существования атомов появились в начале 1800-х годов, когда британский химик Джон Дальтон обнаружил, что химические вещества всегда содержат целые числовые соотношения атомов. Вот почему это h3O, а не h30,4O или H квадратный корень из 17O.
Первые современные доказательства существования атомов появились в начале 1800-х годов, когда британский химик Джон Дальтон обнаружил, что химические вещества всегда содержат целые числовые соотношения атомов. Вот почему это h3O, а не h30,4O или H квадратный корень из 17O.
Причиной этих целых чисел, как предположил Дальтон, было то, что у вас не может быть половины атома или 0,2 атома, только целые атомы. На самом деле трудно представить себе химию сегодня без понимания Дальтона, но в свое время она вызывала споры. Почему? Потому что химики не могли видеть атомы. Многие считали их отрицательными числами — полезными для вычислений, но не существующими в реальном мире. Даже Дмитрий Менделеев, отец периодической таблицы, много лет отказывался верить в атомы.
Так почему же химики просто не искали атомы под микроскопом? Чтобы увидеть что-то под микроскопом, длина волны света, проходящего через микроскоп, не может быть больше, чем то, на что вы смотрите. К сожалению, видимый свет в тысячи раз больше атомов.
Рентгеновские лучи были открыты в 1890-х годах немецким ученым Вильгельмом Рентгеном, который понял, что фотографии, сделанные с помощью рентгеновских лучей, позволяют ему видеть сквозь предметы. Рентген подумал, что сошел с ума, когда увидел это. Но сегодня мы все знакомы с рентгеном по походам к стоматологу и врачу.
Однако химики не используют рентгеновские лучи, чтобы видеть сквозь вещи. Вместо этого они отражают рентгеновские лучи от таких вещей, как кристаллы, которые представляют собой твердые тела со слоями атомов. Когда рентгеновские лучи попадают на атом в кристалле, они отскакивают назад. Другие проскальзывают и отскакивают от второго слоя вниз, от третьего слоя или еще глубже. После отражения эти рентгеновские лучи попадают на экран детектора, как мячик, отскакивающий назад в игре Pong. И, основываясь на том, где они ударяются о стену, ученые могут работать в обратном направлении и выяснять трехмерное расположение атомов в кристалле.
Дифракция рентгеновских лучей, иногда называемая рентгеновской кристаллографией, позволила химикам с 1920-х годов получить десятки Нобелевских премий. Это также привело к одному из величайших открытий в истории науки — структуре ДНК. Джеймс Уотсон и Фрэнсис Крик сегодня получают признание. Но они основывали свою работу на работах Розалинды Франклин, кристаллографа из Англии.
Она начала делать рентгеновские снимки ДНК в 1952 году. Взгляд Уотсон на одну фотографию, фотографию 51, стал важным ключом к пониманию того, что ДНК представляет собой двойную спираль. Этот инцидент на самом деле остается спорным сегодня, потому что Франклин никогда не давал Уотсону разрешения просмотреть фотографию 51.
Если рентгеновские лучи позволили химикам заглянуть в структуру атомов, то сканирующие туннельные микроскопы, наконец, открыли сами атомы. Вместо того, чтобы отражать свет от чего-либо, СТМ проводит по поверхности острой иглой.
И вот, атомы были не кубами и пирамидами Платона, а сферами разных размеров. К 1989, несколько ученых даже адаптировали технологию СТМ для манипулирования атомами ксенона и составления слов. Мы позволим вам угадать, в какой компании они работали. В том же 1989 году химик Ахмед Зевайл вышел за рамки наблюдения за неподвижными атомами и разработал инструменты, позволяющие увидеть атомы в действии.
Зевайл хотел изучить, как атомы разрывают связи и меняются партнерами во время реакций. Поэтому он разработал самую быструю в мире камеру, которая снимает импульсы лазерного света длительностью в несколько фемтосекунд, несколько миллиардных долей микросекунды. Пока лазер Зевейла вспыхивал, как стробоскоп, его камера делала снимки.
