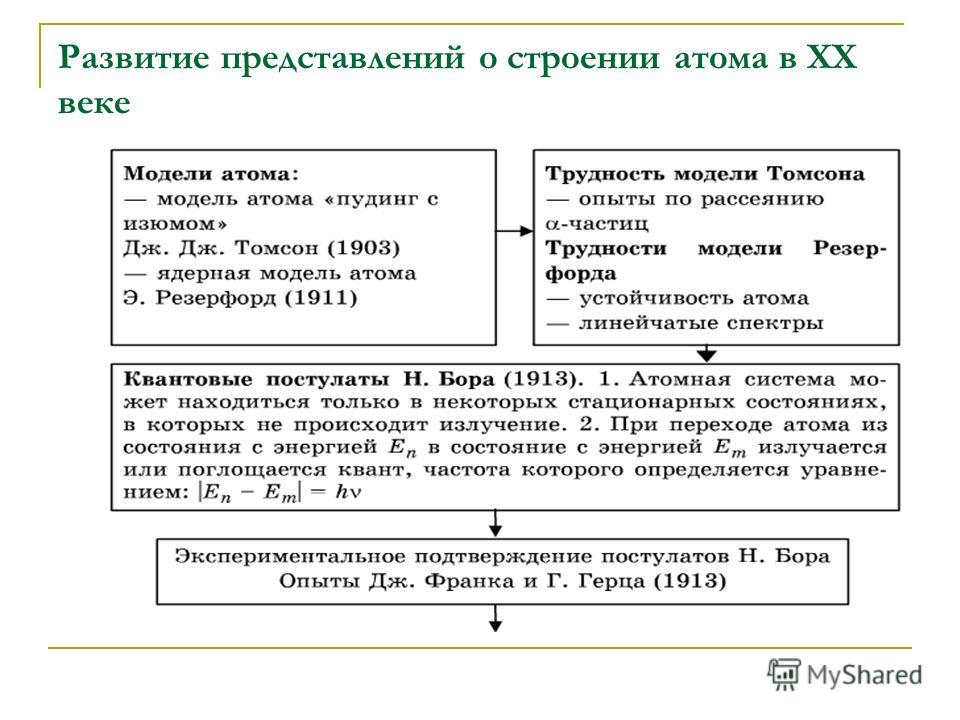
2.2. Развитие представлений о строении атома
До конца 19 века большинство учёных представляло атом как неразложимую и неделимую частицу элемента – “конечный узел” материи. Считалось также, что атомы неизменны: атом данного элемента ни при каких условиях не может превращаться в атом какого – либо другого элемента.
Конец 19 и начало 20 веков характеризуется новыми открытиями в физике и химии, изменившими взгляд на атом, как на неизменимую частицу, свидетельствовавшими о сложном составе атомов и о возможности их взаимопревращений.
Сюда относится, прежде всего, открытие электрона английским физиком Томсоном в 1897 г., открытие и изучение радиоактивности в конце 90 – х годов 19 в. А. Беккерелем, Марией и Пьером Кюри, Э. Резерфордом.
Примерно
в начале ХХ в. исследования ряда явлений
(излучений раскалённых тел, фотоэффект,
атомные спектры) привели к выводу, что
энергия распространяется и передаётся,
поглощается и испускается не непрерывно,
а дискретно, отдельными порциями –
квантами.
Предположение о квантовой энергии впервые было высказано М. Планком (1900). Энергия кванта Е пропорциональна частоте излучения ν:
Е=h·ν,
где h– постоянная Планка (6,626 10-34Джс), ν=, с – скорость света,– длина волны.
В 1905 г. А. Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фотонами. Из теории Эйнштейна следует, что свет имеет двойственную природу.
В 1911 г. Резерфорд предложил ядерную планетарную модель атома, состоящего из тяжёлого ядра, вокруг которого двигаются по орбитали электроны, подобно планетам солнечной системы. Однако, как показывает теория электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро.
Датский
учёный Н. Бор, используя модель Резерфорда
и теорию Планка, предложил первую
квантовую модель (1913г.) строения атома
водорода, согласно которой электроны
двигаются вокруг ядра не по любым, а
лишь по разрешённым орбитам, на которых
электрон обладает определёнными
энергиями. При переходе электрона с
одной орбиты на другую атом поглощает
или испускает энергию в виде квантов.
Теория Бора позволила рассчитать энергию
электронов, значения квантов энергии,
испускаемых при переходе электрона с
одного уровня на другой. Она не только
объяснила физическую природу атомных
спектров как результат перехода
электронов с одних стационарных орбит
на другие, но и впервые позволила
рассчитывать спектры. Расчёт спектра
простейшего атома – атома водорода,
выполненный Бором, дал блестящие
результаты: вычисленное положение
спектральных линий в видимой части
спектра совпало с их действительным
местоположением в спектре. Но теория
Бора не смогла объяснить поведение
электрона в магнитном поле и все атомные
спектральные линии, оказалась непригодной
для многоэлектронных атомов.
Бор, используя модель Резерфорда
и теорию Планка, предложил первую
квантовую модель (1913г.) строения атома
водорода, согласно которой электроны
двигаются вокруг ядра не по любым, а
лишь по разрешённым орбитам, на которых
электрон обладает определёнными
энергиями. При переходе электрона с
одной орбиты на другую атом поглощает
или испускает энергию в виде квантов.
Теория Бора позволила рассчитать энергию
электронов, значения квантов энергии,
испускаемых при переходе электрона с
одного уровня на другой. Она не только
объяснила физическую природу атомных
спектров как результат перехода
электронов с одних стационарных орбит
на другие, но и впервые позволила
рассчитывать спектры. Расчёт спектра
простейшего атома – атома водорода,
выполненный Бором, дал блестящие
результаты: вычисленное положение
спектральных линий в видимой части
спектра совпало с их действительным
местоположением в спектре. Но теория
Бора не смогла объяснить поведение
электрона в магнитном поле и все атомные
спектральные линии, оказалась непригодной
для многоэлектронных атомов.
В 1924г. Луи де Бройль (Франция) выдвинул предположение, что электрон, как и другие микрочастицы, характеризуется корпускулярно – волновым дуализмом. Де Бройль предложил уравнение, связывающее длину волны (λ) электрона или любой другой частицы с массой (m) и скоростью (v):
λ=h/(mv).
Волны
частиц материи де Бройль назвал
материальными волнами. Они свойственны
всем частицам или телам, но, как следует
из уравнения, для макротел длина волны
настолько мала, что в настоящее время
не может быть обнаружена. Так, для тела
с массой 1000 кг, двигающегося со скоростью
108 км/ч (30 м/с), λ=2,21 10
Гипотеза
де Бройля была экспериментально
подтверждена обнаружением дифракционного
и интерференционного эффектов потока
электронов. В настоящее время дифракция
потоков электронов, нейтронов, протонов
широко используется для изучения
структуры веществ.
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопределённости, согласно которому положение и импульс движения субатомной частицы (микрочастицы) принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств. Э. Шредингер (Австрия) в 1926 г. вывел математическое описание поведения электрона в атоме. Сущность его заключается в том, что движение электронов в атоме описывается волновым уравнением, а определение местоположения электрона производится по вероятностным принципам. Уравнение Шредингера, являющееся основой современной квантово–механической теории строения атома, имеет вид (в простейшем случае):
– (++) +U=E,
где h– постоянная Планка;m– масса частицы;U– потенциальная энергия; Е – полная энергия;x,y,z– координаты; ψ – волновая функция.
Для
характеристики состояния электрона
особо важное значение имеет волновая
функция ψ. Определённый физический
смысл имеет её квадрат – ψ2.
Величина ψ2dv
выражает вероятность нахождения
электрона в объёме пространства dv,
окружающего атомное ядро. В настоящее
время уравнение имеет точное решение
только для водорода и водородоподобных
частиц Не+,
Li2+,
т.е. для одноэлектронных частиц. Решение
этого уравнения –задача
сложная и рассмотрение её выходит за
рамки данного курса.
Определённый физический
смысл имеет её квадрат – ψ2.
Величина ψ2dv
выражает вероятность нахождения
электрона в объёме пространства dv,
окружающего атомное ядро. В настоящее
время уравнение имеет точное решение
только для водорода и водородоподобных
частиц Не+,
Li2+,
т.е. для одноэлектронных частиц. Решение
этого уравнения –задача
сложная и рассмотрение её выходит за
рамки данного курса.
Работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга, Шредингера заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц. Она основывается на представлении о квантовой энергии, волновом характере движения микрочастиц и вероятностном (статистическом) методе описания микрообъектов.
Развитие представлений о строении атома
Похожие презентации:
Влияния состава и размера зерна аустенита на температуру фазового превращения и физико-механические свойства сплавов
Газовая хроматография
Геофизические исследования скважин
Искусственные алмазы
Трансформаторы тока и напряжения
Транзисторы
Воздушные и кабельные линии электропередач
Создание транспортно-энергетического модуля на основе ядерной энергодвигательной установки мегаваттного класса
Магнитные аномалии
Нанотехнологии
Сергеева Л. Ф.
Ф.
Профессиональный лицей № 21
Г. Георгиевск
2. Как развивалось учение о строении атома?
Строение атома Дж. Дж. ТомсонаОпыт Резерфорда
Планетарная модель Резерфорда
Квантовые постулаты Бора
3. Атом по теории древних ученых
Слово «атом» по – греческиозначает неделимый.
Древнегреческие ученые
считали атомы неделимыми
частицами, своеобразными
кирпичиками из которых
построены все тела природы.
4. Атом – сложная частица
Открытия конца XIX, начала XX века.Дж.Томсон,
1897 г. – природа
катодных лучей
А.Г.Столетов 1889
г. – явление
фотоэффекта
А.Беккерель.
Э.Резерфорд
1889-1900 г. –
природа a-частиц
М.,Складовская-Кюри,
1896-1900г. – радиоактивность химических элементов.
Электрон(e)
+
Нейтрон(n) Протон(p) –
Представление о неделимости атома утверждалось в
физике почти до конца 19 века. Дальнейшее развитие
физики в корне изменило это представление.
 Изучение
Изучениеэлектромагнитных явлений в конце 19 – начале 20 века
показало, что атомы вещества представляют сложные
образования: они состоят из частиц, являющихся
носителями положительного и отрицательного
электричества. Из атома вещества удалось выделить
сначала мельчайшие (элементарные) отрицательно
заряженные частицы – электроны. Затем были обнаружены
входящие в состав атома элементарные положительно
заряженные частицы – протоны.
Перед учеными возникли важнейшие вопросы:
Как построен атом?
Что представляют собой отдельные части
атома?
Как они взаимно расположены?
6. Теории строения атома
–Гипотеза Дж.Томсона 1904 г.
«Сливовый пудинг»
+
–
–
е
Планетарная модель атома
Э.Резерфорда 1911г.
+
е
е
Квантовые
постулаты Н. Бора
+
е
1. Е=0
е
е
е
е
+
2. Е>0
7. Дж.Дж. Томсон
Английский физик, член Лондонского королевского общества.
Его работы посвящены изучению катодных и рентгеновских
лучей, атомной физике. В 1897 году, исследуя отклонение
катодных лучей в магнитном и электрических полях, открыл
электрон. В 1903 году предложил одну из первых атомных
моделей
8. Строение атома по представлениям Томсона
В 1903 г. Томсон предложил модель атома, в которой положительныйзаряд считался распределенным в некоторой небольшой области
пространства сферической формы, тогда как электроны вкраплены в этот
заряд подобно изюму в пироге.
Каждый электрон может совершать колебательные движения около
своего положения равновесия.
Положительный заряд шара равен по модулю отрицательному заряду
электронов.
Поэтому электрический заряд атома в целом равен нулю.:
9. Почему модель Томсона нуждалась в проверке?
Модель строения атома,предложенная Томсоном, нуждалась
в экспериментальной проверке так
как явления радиоактивности,
фотоэффекта нельзя было
объяснить, применив модель атома
Томсона.
 Важно было проверить,
Важно было проверить,действительно ли положительный
заряд распределен по всему объему
атома с постоянной плотностью.
Поэтому в 1911 году Эрнест
Резерфорд провел ряд опытов по
исследованию состава и строения
атомов
10. Схема опыта Резерфорда
Основная идея опыта:Узкий пучек а-частиц,
испускаемых радиоактивным
веществом ,направлялся на
тонкую золотую фольгу, за
которой помещался экран,
способный светиться под
ударами быстрых частиц.
Если на а- пути частиц нет
никаких препятствий, то они
падают на экран узким пучком.
Если на их пути поместить
тонкую золотую фольгу, то ачастицы рассеиваются по всем
направлениям на разные углы,
а некоторые в результате
взаимодействия с фольгой
были отброшены назад.
11. Чем же объяснить рассеяние а-частиц при прохождении ими вещества?
Напряженность(E) создаваемогоядром
электрического поля, а значит, и сила
действия на а-частицу довольно быстро
убывает с увеличением расстояния от
ядра.

Поэтому
направление
полета
частицы
сильно
меняется,
если
эта проходит очень близко к ядру.
Поскольку диаметр ядра значительно
меньше диаметра атома, то большая часть
из числа всех а-частиц проходит сквозь
атом на таких расстояниях от ядра где сила
отталкивания создаваемого им поля
слишком
мала,
чтобы
существенно
изменить направление движения а-частиц.
И только очень немногие частицы
пролетают рядом с ядром, т. е. в области
сильного поля, и отклоняются на большие
углы.
12. Модель Резерфорда
Планетарнаямодель
атома,
предложенная Резерфордом, –
это
попытка
применения
классических представлений о
движении
тел
к
явлениям
атомных масштабов. Эта попытка
оказалась
несостоятельной.
Классический атом неустойчив.
Электроны,
движущиеся
по
орбите с ускорением, должны
неизбежно упасть на ядро,
растратив всю энергию на
излучение
электромагнитных
волн.
 Впервые прозвучало, что
Впервые прозвучало, чтозаконы классической механики не
могут
объяснить
явления,
происходящие
на
атомном
уровне.
13. Как же устроен атом?
Проанализировав результаты опытов, Резерфорд в 1911 годупредложил следующую модель атома:
Атом состоит из положительно заряженного ядра, которое занимает
ничтожно малый объем атома. Вокруг ядра расположены
электроны.
Электроны вращаются вокруг
ядра на достаточно больших
расстояниях от него.
Совокупность этих электронов
называют электронной
оболочкой.
Таким образом, Атом
представляется в виде
планетной системы в
маленьком масштабе(поэтому
такую модель назвали
планетарной)
14. Как Нильс Бор помог Резерфорду?
В 1913 году датский физик НильсБор развил теорию квантовых
представлений о процессах в
природе. Он сформулировал в
виде постулатов основные
положения новой теории,
которые налагали некоторые
ограничения на допускаемые
классической физикой движения.

Нильс Бор применил свои
постулаты для простейшей
атомной системы – атома
водорода.
15. Почему атомы излучают?
Согласно постулатам Бораэлектрон может
находиться на нескольких
определенных орбитах
.Каждой орбите электрона
соответствует
определенная энергия.
При переходе электрона с
ближней орбиты на более
удаленную атомная
система поглощает квант
энергии.
При переходе с более
удаленной орбиты
электрона на ближнюю
орбиту по отношению к
ядру, атомная система
излучает квант энергии.
16. На пороге квантовой механики
Выбранный Нильсом Боромпуть привел к созданию
стройной теории движения
микрочастиц – квантовой
механики.
17. Литература
Физика для всех / Купер Л.- «Мир»1974гФизики / Храмов Ю.А.- «Наука» 1983 г.
Физика –9,11 / Перышкин А.В.- «Дрофа»
2004 г.
Интернет-ресурсы
http://www.rcio.rsu.ru/
English Русский Правила
Mystery of the Atom – 1900-1939
Цитаты:
“Вероятно, вся тяжелая материя обладает – скрытой и связанной со структурой атома – таким же количеством энергии, как и радий.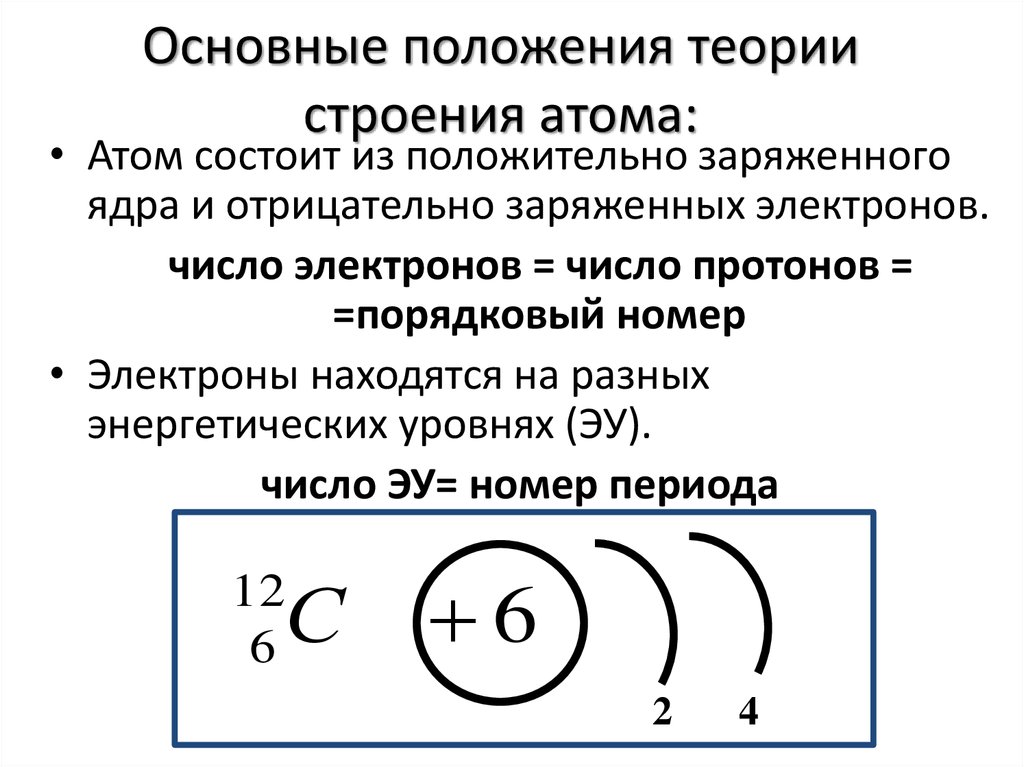 Если бы она могла быть задействованным и контролируемым, каким агентом он мог бы изменить судьбу мира!Человек, положивший руку на рычаг, с помощью которого скупая натура так ревностно регулирует выпуск этого запаса энергии, будет обладать оружием, которым он мог бы разрушить мир. земля, если он захочет». – Фредерик Содди; Читал лекции по радию в Корпорации Королевских инженеров; 1904
Если бы она могла быть задействованным и контролируемым, каким агентом он мог бы изменить судьбу мира!Человек, положивший руку на рычаг, с помощью которого скупая натура так ревностно регулирует выпуск этого запаса энергии, будет обладать оружием, которым он мог бы разрушить мир. земля, если он захочет». – Фредерик Содди; Читал лекции по радию в Корпорации Королевских инженеров; 1904
“Когда свет сменился на зеленый, и я перешел улицу, мне вдруг пришло в голову, что если бы мы могли найти элемент, который расщепляется нейтронами и который испускает два нейтрона при поглощении одного нейтрона, такой элемент, если собранные в достаточно большую массу, могли бы выдержать цепную реакцию” – Лео Силард; Прогулка по центру Лондона; Сентябрь 1933 года.
В начале двадцатого века несколько физиков и химиков обдумывали идею получения энергии из атомов. Однако из-за того, что о реальной структуре атома было известно так мало (Резерфорд считал ядро твердым, как бильярдный шар, а Бор думал, что оно упруго, как поверхностное натяжение капли воды), доказать было трудно. . Однако это не мешало ученым того времени «постулировать будущее».
. Однако это не мешало ученым того времени «постулировать будущее».
В 1920-х и начале 30-х годов ученые со всего мира работали над разгадкой тайны атома. От Эрнеста Резерфорда и Джеймса Чедвика в Англии; от Нильса Бора, Эдварда Теллера, Отто Фриша и других в Копенгагене; от Отто Гана, Лизы Мейтнер и Фрица Штрассмана из Германии; от Энрико Ферми и Эмилио Сегре в Италии; от Ганса Бете, Эрнеста О. Лоуренса, Роберта Оппенгеймера, Артура Комптона и Джона Даннинга из США; Фредерику Жолио и Ирен Кюри-Жолио во Франции — все они стремились объяснить противоречивые результаты, полученные в результате сотен инновационных экспериментов. Это было время неустанного сотрудничества между учеными всего мира; выводы публиковались почти ежедневно.
В знаменитой книге Роберта Юнга « Ярче тысячи солнц. Личная история ученых-атомщиков » г-н Юнг называет период с 1923 по 1932 год «прекрасными годами». Международное сотрудничество между научным сообществом было на рекордно высоком уровне, особенно в Германии.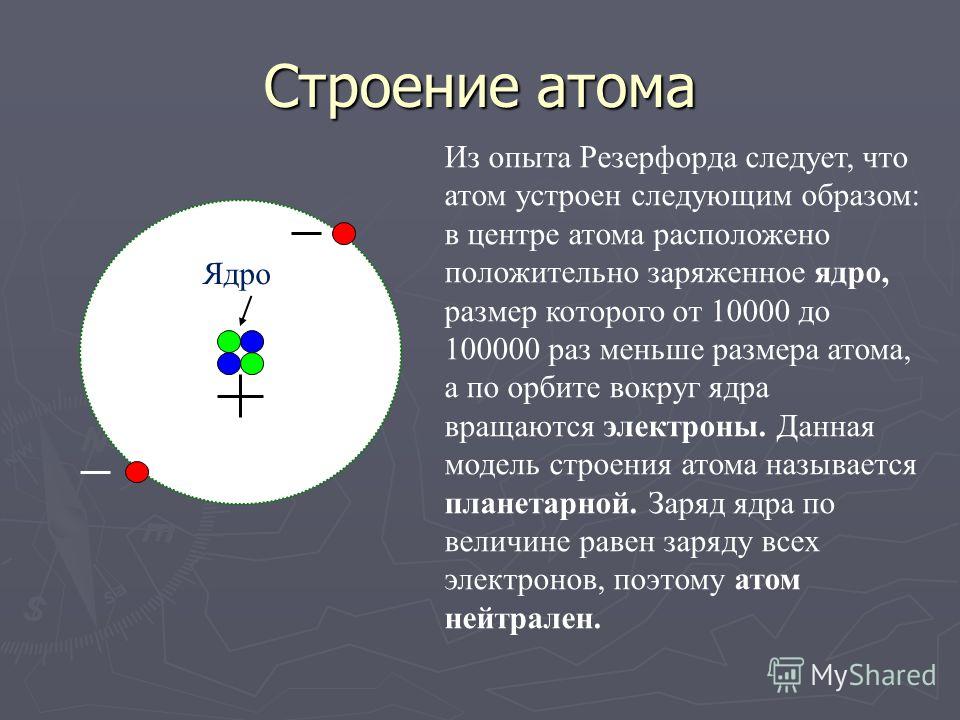
В рамках атомных исследований ученые и студенты сблизились, чтобы решить новые возникающие вопросы. Например, Джеймс Франк, уже получивший Нобелевскую премию по физике (тот самый Джеймс Франк, который работал над Манхэттенским проектом в лаборатории Мет Лаборатории Чикагского университета), мог отвернуться от доски, на которой он заблудился в трудных вычислениях. и спросите одного из своих учеников: «Может быть, вы видите следующий шаг?» Знания свободно текли через университетские залы, и американские ученые и студенты приезжали, чтобы принять участие, в том числе Дж. Роберт Оппенгеймер, который ездил в Геттинген в течение зимнего семестра 1919 года.26. Многие американцы получали образование за счет финансистов, таких как Фонд Рокфеллера, приток средств, который приветствовался испытывающими финансовые затруднения немцами.
Когда в Европе начал нарастать политический кризис, копенгагенская лаборатория Нильса Бора приняла многих ссыльных ученых. В конце концов, многие из этих выдающихся ученых оказались в Соединенных Штатах, став участниками Манхэттенского проекта.
История атома — наука в вашей повседневной жизни
Цели урока:
- Изложить идеи Демокрита об атоме.
- Изложить теорию атома Дальтона.
- Объясните, как Томсон открыл электроны.
- Опишите, как Резерфорд нашел ядро.
Введение
Как мы уже говорили в классе, атомы крошечные и слишком малы, чтобы их можно было увидеть невооруженным глазом и в большинство микроскопов. Лишь сканирующий туннельный микроскоп (разработан в 1981 г.) позволил нам почти «увидеть» атомы, а затем ученые увидели электронную орбиталь атома водорода в мае 2013 г. Однако еще до разработки сканирующего туннельного микроскопа и фотоионизационного микроскопа многие ученые на протяжении веков проводили эксперименты, чтобы дать нам все больше и больше понимания того, как выглядят атомы.
В следующих абзацах и видео вы узнаете об ученых, которые сделали важные открытия, которые привели к нашему нынешнему пониманию атома.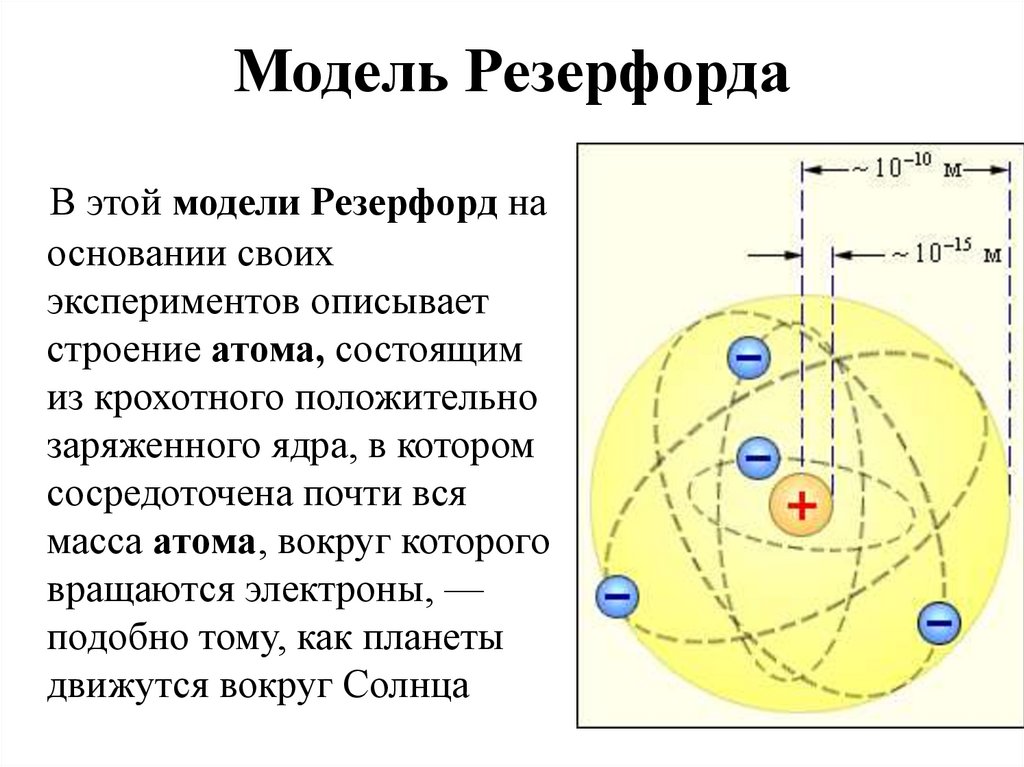
Демокрит
Чему мы научились у Демокрита? (Подсказка: помните задание «Сможете ли вы разделить поцелуй?».)
История атома начинается около 450 г. до н.э. с греческим философом по имени Демокрит. Демокрит задавался вопросом, что произойдет, если разрезать кусок материи, например яблоко, на все более мелкие кусочки. Он думал, что наступит момент, когда материю нельзя будет разрезать на еще более мелкие кусочки. Он назвал эти «неразрезаемые» куски атомос, , что означает «неделимый». Отсюда и происходит современный термин «атом».
Демокрит был выдающимся философом. Однако он был менее влиятельным, чем греческий философ Аристотель, живший примерно через 100 лет после Демокрита. Аристотель отверг идею Демокрита об атомах. Фактически, Аристотель считал идею атомов нелепой. К сожалению, идеи Аристотеля были приняты более 2000 лет назад. В то время идеи Демокрита были более или менее забыты.
Дальтон возвращает атом
 Он зарабатывал на жизнь преподаванием и просто занимался исследованиями в свободное время. Тем не менее, по результатам своих исследований он разработал одну из самых важных теорий в науке.
Он зарабатывал на жизнь преподаванием и просто занимался исследованиями в свободное время. Тем не менее, по результатам своих исследований он разработал одну из самых важных теорий в науке.Дальтон провел множество экспериментов, доказавших существование атомов. Например, он изучал давление газов. Он пришел к выводу, что газы должны состоять из мельчайших частиц, находящихся в постоянном движении. Дальтон также исследовал свойства соединений. Он показал, что соединение всегда состоит из одних и тех же элементов в одном и том же соотношении. С другой стороны, разные соединения всегда состоят из разных элементов или соотношений. Это может произойти, рассуждал Дальтон, только если элементы состоят из крошечных частиц, которые могут комбинироваться бесконечным разнообразием способов. На основе своих исследований Дальтон разработал теорию атома.
Атомная теория, разработанная Дальтоном, состоит из трех идей:
- Все вещества состоят из атомов. Атомы – мельчайшие частицы материи.
 Их нельзя разделить на более мелкие частицы. Они также не могут быть созданы или уничтожены.
Их нельзя разделить на более мелкие частицы. Они также не могут быть созданы или уничтожены. - Все атомы одного и того же элемента одинаковы и имеют одинаковую массу. Атомы разных элементов различны и имеют разную массу.
- Атомы объединяются, образуя соединения. Данное соединение всегда состоит из одних и тех же видов атомов в одном и том же соотношении.
Теория Дальтона вскоре получила широкое признание. Большая часть из них до сих пор принимается. Единственная часть, которая больше не принимается, — это его идея о том, что атомы — это мельчайшие частицы. Ученые теперь знают, что атомы состоят из еще более мелких частиц.
Дальтон ошибочно полагал, что атомы — это крошечные твердые частицы материи. Для их моделирования он использовал твердые деревянные шары. На рисунке ниже показано, как выглядели модели атомов Дальтона. Он сделал отверстия в шарах, чтобы их можно было соединить крючками. Таким образом, шары можно было использовать для моделирования соединений.
Томсон добавляет электроны
Следующим крупным достижением в истории атома было открытие электронов. Это были первые идентифицированные субатомные частицы. Они были открыты в 1897 году британским физиком Дж. Дж. Томсоном.
Томсон интересовался электричеством. Он проводил эксперименты, в которых пропускал электрический ток через вакуумную трубку.
Это электронно-лучевая трубка (вакуумная трубка), которую использовал Томсон. Пунктирная линия указывает ожидаемый путь электронов, как он обнаружил, что электроны на самом деле следуют пути сплошной линии на картинке о. Он пришел к выводу, что атомы должны иметь отрицательные субатомные частицы, которые мы теперь знаем как электроны. |
Модель сливового пудинга Томсона
Томсон знал, что атомы нейтральны в отношении электрического заряда. Так как же атомы могут содержать отрицательные частицы? Томсон считал, что остальная часть атома должна быть положительной, чтобы компенсировать отрицательный заряд. Он сказал, что атом подобен сливовому пудингу, в котором разбросаны сливы. Вот почему модель атома Томсона называется моделью сливового пудинга. На ней атом изображен как сфера с положительным зарядом (пудинг) с рассеянными по ней отрицательными электронами (сливы). Здесь, в Америке, мы обычно не едим сливовый пудинг, поэтому вы можете думать о его модели как о модели «Шоколадное печенье». Шоколадная крошка — это электроны, а печенье состоит из положительно заряженных частиц, позже известных как протоны.
Резерфорд находит ядро
Физик из Новой Зеландии по имени Эрнест Резерфорд сделал следующее крупное открытие об атомах. Он открыл ядро.
Он открыл ядро.
В 1899 году Резерфорд обнаружил, что некоторые элементы испускают положительно заряженные частицы. Он назвал их альфа-частицами. В 1911 году он использовал альфа-частицы для изучения атомов. Он направил пучок альфа-частиц на очень тонкий лист золотой фольги. Снаружи фольги он поместил экран из материала, который светился, когда в него попадали альфа-частицы.
Если модель сливового пудинга Томсона верна, то альфа-частицы должны немного отклоняться при прохождении через фольгу. Почему? Положительная «пудинговая» часть атомов золота будет слегка отталкивать положительные альфа-частицы. Это заставит альфа-частицы изменить курс. Но Резерфорд получил сюрприз. Большинство альфа-частиц прошли прямо сквозь фольгу, как если бы они двигались в пустом пространстве. Что еще более удивительно, несколько альфа-частиц отскочили от фольги, как будто они ударились о стену. Это называется обратным рассеянием. Это произошло только на очень малых участках в центрах атомов золота.
Что еще более удивительно, несколько альфа-частиц отскочили от фольги, как будто они ударились о стену. Это называется обратным рассеянием. Это произошло только на очень малых участках в центрах атомов золота.
Основываясь на своих результатах, Резерфорд пришел к выводу, что весь положительный заряд атома сосредоточен в небольшой центральной области. Он назвал эту область ядром. Позже Резерфорд обнаружил, что ядро содержит положительно заряженные частицы. Положительные частицы он назвал протонами. Резерфорд также предсказал существование нейтронов в ядре. Однако найти их ему не удалось. Один из его учеников, физик по имени Джеймс Чедвик, в 1932 году открыл нейтроны.
Нильс Бор
Нильс Бор предложил модель атома Бора в 1915 году. Поскольку модель Бора является модификацией более ранней модели Резерфорда, некоторые люди называют модель Бора моделью Резерфорда-Бора. Современная модель атома основана на квантовой механике, использованной для создания его модели. По сути, он обнаружил, что электроны существуют в разных «оболочках» или уровнях вокруг ядра в зависимости от их энергетических уровней. В нашем классе мы не будем заставлять вас рисовать разные энергетические уровни, но вы это сделаете, когда перейдете в старшую школу.
По сути, он обнаружил, что электроны существуют в разных «оболочках» или уровнях вокруг ядра в зависимости от их энергетических уровней. В нашем классе мы не будем заставлять вас рисовать разные энергетические уровни, но вы это сделаете, когда перейдете в старшую школу.
Можем ли мы увидеть атом?
- http://io9.gizmodo.com/the-first-image-ever-of-a-hydrogen-atoms-orbital-struc-509684901
- physicsworld.com/cws/article/news/2013/ may/23/quantum-microscope-peers-into-the-hydrogen-atom
- http://www.foxnews.com/science/2013/05/28/amazing-first-ever-photograph-inside-hydrogen-atom .html
Краткий обзор урока
- Около 450 г. до н. э. греческий философ Демокрит представил идею атома. Однако идея была по существу забыта более чем на 2000 лет.
- В 1800 году Джон Дальтон вновь открыл атом. Он представил доказательства существования атомов и разработал атомную теорию.


 Их нельзя разделить на более мелкие частицы. Они также не могут быть созданы или уничтожены.
Их нельзя разделить на более мелкие частицы. Они также не могут быть созданы или уничтожены.