История развития представлений о строении вещества 10 класс онлайн-подготовка на Ростелеком Лицей
Возникновение органической химии
В конце XVIII в. начались исследования органических веществ. Из растений были выделены и изучены органические кислоты – щавелевая, лимонная, яблочная, молочная и др. Исследовались продукты жизнедеятельности животных организмов, например, были выведены и изучены мочевина и мочевая кислота.
По мере изучения органических веществ, были установлены факты, доказывающие, что между веществами растительного и животного происхождения нет принципиальной разницы. Например, при окислении растительного вещества – сахара – получается муравьиная кислота – вещество животного происхождения; жиры содержатся и в животных, и в растительных организмах.
Накопленные факты заставили пересмотреть представления о веществах растительного и животного происхождения и ввести общее понятие «органические вещества».
Химия, занимающаяся изучением этих веществ, была названа органической. Такое предложение было сделано в 1807 г. шведским химиком Иенсом Берцелиусом (Jens Jakob Berzelius; 1779–1848). По его мнению и мнению других ученых, выделение химии органических веществ в отдельную науку объясняется не только их сложностью по сравнению с неорганическими (минеральными) веществами, но и тем, что органические вещества образуются только в живых организмах под влиянием «жизненной силы».
Такое предложение было сделано в 1807 г. шведским химиком Иенсом Берцелиусом (Jens Jakob Berzelius; 1779–1848). По его мнению и мнению других ученых, выделение химии органических веществ в отдельную науку объясняется не только их сложностью по сравнению с неорганическими (минеральными) веществами, но и тем, что органические вещества образуются только в живых организмах под влиянием «жизненной силы».
Крах идеалистического учения о «жизненной силе»
В 1824 г. ученик Берцелиуса немецкий ученый Фридрих Вёлер (Wöhler Friedrich, 1800–1882) синтезировал щавелевую кислоту – вещество растительного происхождения – из неорганического вещества – газа дициана (CN)2.
В 1828 г. Вёлер провел второй синтез: нагревая неорганическое вещество цианат аммония NH4OCN, он получил органическое вещество – продуют жизнедеятельности животного организма – мочевину (NH2)2CO.
В 1845 г. немецкий химик Герман Кольбе (Adolph Wilhelm Hermann Kolbe; 1818–1884) синтезировал из неорганических веществ уксусную кислоту; в 1854 г. французский химик М. Бертло (Berthelot, Pierre-Eugene-Marcellin, 1827- 1907) синтезировал жир; а в 1861 г. русскому химику А. М. Бутлерову удалось синтезировать сахаристое вещество. Как известно, жиры и сахара играют большую роль в процессах жизнедеятельности организма.
Эти открытия привели к краху идеалистического учения о «жизненной силе».
Предпосылки теории, объясняющей многообразие органических веществ
Чтобы объяснить многообразие органических веществ, состоящих всего из нескольких элементов, в истории органической химии выдвигались всевозможные гипотезы и теории.
Возможность описать строение органических молекул появилась после того, как в 1852 г. английский химик Эдуард Франкланд (Edward Frankland, 1825–1899) ввел понятие «валентность». Он считал, что каждый атом обладает способностью соединяться с другими атомами посредством определенного, характерного для этого атома, числа связей. Это число он назвал валентностью (от латинского valentia – «сила»).
английский химик Эдуард Франкланд (Edward Frankland, 1825–1899) ввел понятие «валентность». Он считал, что каждый атом обладает способностью соединяться с другими атомами посредством определенного, характерного для этого атома, числа связей. Это число он назвал валентностью (от латинского valentia – «сила»).
Атом водорода обычно образует одну связь, т. е. он одновалентен, атом кислорода в большинстве соединений двухвалентен и т. д.
Предположения Ф. Кекуле
Немецкий ученый Фридрих Кекуле (Friedrich August Kekulé von Stradonitz, 1829–1896) предположил, что в органических соединениях валентность углерода равна четырем. Четырехвалентные атомы углерода способны, по Кекуле, соединяться друг с другом и образовывать цепи.
Однако многие химики того времени считали, что с помощью химических формул нельзя отразить строение соединения, и тем более невозможно на основании формулы предсказать свойства вещества.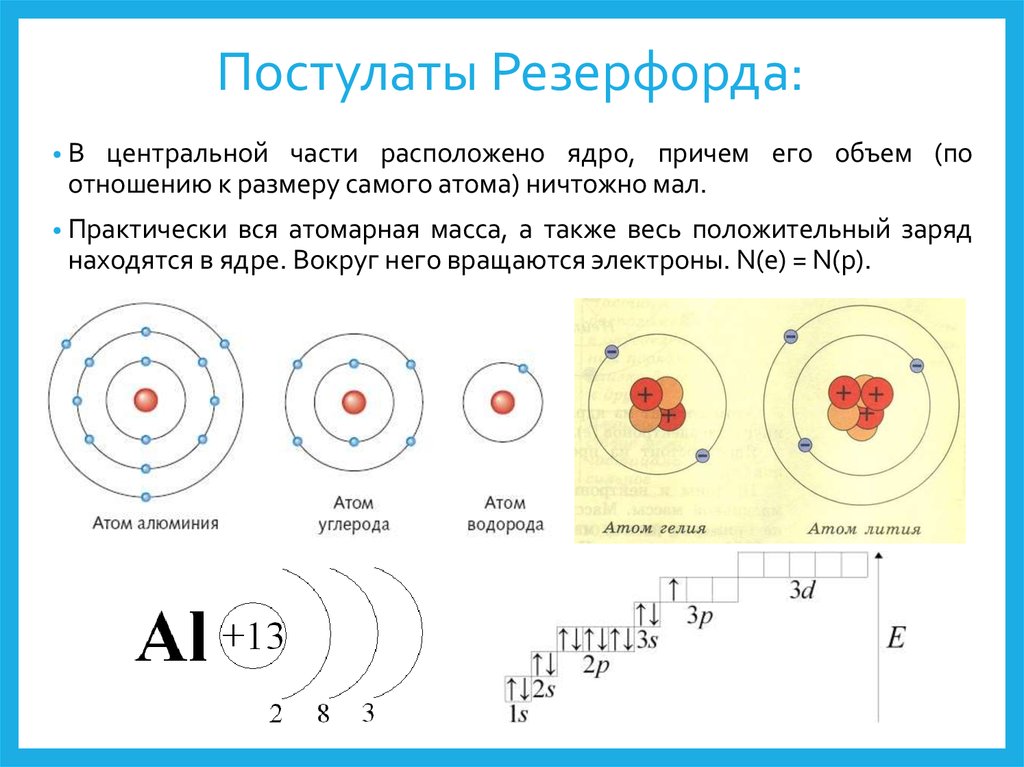
Тот же Кекуле утверждал: «Конституции тела они (формулы) не представляют, являясь лишь выражением для метаморфоз тела и для сравнения различных тел».
Нам это может показаться странным, но в середине XIX века для ученых не была очевидна реальность существования атомов и молекул.
Для того чтобы связать строение и свойства органических соединений, нужно было критически обобщить все созданные гипотезы.
Главные положения теории химического строения А. М. Бутлерова
Человеком, который преодолел заблуждения тогдашних авторитетов, стал молодой русский ученый Александр Михайлович Бутлеров (1828–1886) (рис. 1).
Рис. 1. А. М. Бутлеров
Главные положения своей теории химического строения Бутлеров впервые изложил в докладе «О химическом строении вещества», прочитанном в химической секции Съезда немецких естествоиспытателей и врачей в Шпейере (сентябрь 1861 г.).
Основы этой теории сформулированы таким образом:
- «Полагая, что каждому химическому атому свойственно лишь определённое и ограниченное количество химической силы (сродства), с которой он принимает участие в образовании тела, я назвал бы химическим строением эту химическую связь, или способ взаимного соединения атомов в сложном теле»
- «… химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением»
С этими основными постулатами связаны и все остальные положения классической теории химического строения.
Бутлеров впервые объяснил явление изомерии тем, что изомеры – это соединения, обладающие одинаковым элементарным составом, но различным химическим строением. В свою очередь, зависимость свойств изомеров и вообще органических соединений от их химического строения объясняется существованием в них передающегося вдоль связей «взаимного влияния атомов», в результате которого атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Самим Бутлеровым и особенно его учениками В. В. Марковниковым и А. Н. Поповым это общее положение было конкретизировано в виде многочисленных «правил». Уже в XX в. эти правила, как и вся концепция взаимного влияния атомов, получили электронную интерпретацию.
Современные формулировки основных положений теории химического строения
- Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям.
 Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения). - Химическое строение можно устанавливать химическими методами. В настоящее время используются также физические методы.
- Свойства веществ зависят от их химического строения.
- По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы – предвидеть свойства.
- Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Значение теории химического строения А. М. Бутлерова
Научная теория может считаться справедливой только в том случае, если с ее помощью можно не только объяснить известные факты, но и предсказать неизвестные явления.
Большое значение для становления теории химического строения имело её экспериментальное подтверждение в работах как самого Бутлерова, так и его школы.
| Рис. 2. Получение веществ, подтверждающих теорию строения | |
В настоящее время обычно употребляют термин «строение молекулы», не используя определение «химическое». Во время Бутлерова строение вещества исследовали только химическими методами, сейчас основные методы исследования – физические, прежде всего различные виды спектроскопии.
Разработанная Бутлеровым теория строения была создана для органических соединений, однако она справедлива для всех веществ с ковалентной связью.
Теория строения органических соединений дала толчок бурному развитию органической химии. С тех пор представления о строении молекул значительно углубились, однако эта теория не потеряла своего значения до настоящего времени.
С тех пор представления о строении молекул значительно углубились, однако эта теория не потеряла своего значения до настоящего времени.
Подведение итога урока
В ходе урока вы изучили тему «История развития представлений о строении вещества». Познакомились с учением о строении вещества, истории его становления и развития. Большая часть урока посвящена основным положениям теории Бутлерова и значении этой теории. Было уделено особое внимание химическим системам и их особенностям, приведены основные сведения о строении вещества от древности до современности.
Список литературы
- Рудзитис Г. Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
- Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений / В. В. Еремин, Н. Е. Кузьменко, В. В. Лунин и др. – М.: Дрофа, 2008.
 – 463 с.
– 463 с. - Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений / В. В. Еремин, Н. Е. Кузьменко, В. В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
- Хомченко Г. П., Хомченко И. Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «interneturok.ru» (Источник)
- Интернет-портал «Органическая химия» (Источник)
- Интернет-портал «Химик» (Источник)
Домашнее задание
- №№ 13, 15 (с. 11) Рудзитис Г. Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
- Перечислите открытия, которые явились предпосылками создания теории химического строения.
- Кто и когда впервые синтезировал уксусную кислоту?
Строение атома – конспект урока – Корпорация Российский учебник (издательство Дрофа – Вентана)
авторы:
Внимание! Администрация сайта rosuchebnik. ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
Цели урока:
обучающие:
- сформировать знания о строении атома, познакомить с планетарной моделью атома по Резерфорду;
- дать понятия отрицательного и положительного иона;
- научить изображать атом и ион химического элемента.
развивающие:
- развить интерес учащихся к предмету с помощью различных составляющих;
- расширение кругозора в области исторических знаний об изучении электрических зарядов;
- развитие навыков выделять электрические явления в природе и технике.
- сформировать элементы творческого поиска на основе приёма обобщения, продолжить работу по формированию умений составлять, анализировать, делать выводы.
воспитательные:
- воспитать умения и навыки коллективной работы;
- содействовать формированию мировоззренческой идеи познаваемости явлений и свойств окружающего мира.

Оборудование(демонстрационное) мультимедийный компьютерный класс.
Лабораторное оборудование (для практической работы) полиэтиленовые пленки (2 шт.), бумажная полоска; пластмассовая линейка, комочек ваты.
Раздаточный материал: таблица Менделеева.
Тип урока: изучение и первичное закрепление новых знаний.
Форма урока: урок с использованием ИКТ.
План урока:
Этапы урока |
Деятельность учителя |
Деятельность ученика |
Время |
1. Актуализация знаний и мотивация деятельности |
Показ слайда по изученной теме, вопрос по рисунку. |
Отвечают на вопросы учителя после просмотра слайда |
1 мин |
2. |
Объяснение цели выполнения работы, совместный анализ результатов деятельности. |
Выполнение практической работы, демонстрация опыта, ответы на вопросы. |
5мин |
3. Открытие нового знания |
Обеспечить усвоения новых знаний |
Формулируют цель. Участвуют в диалоге с учителем, отвечают на вопросы, делают выводы, делают краткие записи в тетради. |
15 мин |
Динамическая пауза |
Создать атмосферу и обеспечить выполнение |
Выполняют под счет ученика |
2 мин |
4. |
Закрепление изученного материала при разборе задач, вопросов. |
Решают задачи в группах и отвечают на вопросы учителя. |
8 мин |
5. Самостоятельная работа за компьютерами |
Контроль за выполнением теста |
Учащиеся выполняют тест за компьютерами |
5 мин |
6. Рефлексия деятельности (итог урока) |
Анализ и оценка успешности работы на уроке. |
Записывают д/з, считают жетоны и работают со своим листом самооценки, чтобы определить отметку за урок по критериям учителя. |
4 мин |
Организационный момент.

Эпиграф урока.
Науку все глубже постигнуть стремись,
Познанием вечного жаждой томись.
Лишь первых познаний блеснет тебе свет,
Узнаешь; предела для знания нет.ФИРДОУСИ (Персидский и таджикский поэт)
Сегодня на уроке мы продолжим разговор об электризации тел и выясним, почему при взаимодействии одно тело заряжается положительно, другое – отрицательно.
Не забывайте, для того, чтобы получить сегодня хорошую оценку, набирайте жетоны за правильные ответы.
(Жетоны используются на каждом уроке, за пять набранных жетонов ставится оценка «5»).
Презентация «Строение атома»
1 слайд: Объясните, что вы видите на картинке?
(Ответы учащихся).
Работа в группах:
Серия экспериментов «Электрическое поле»
Каждое задание проделывает группа учащихся и дают ответы на вопросы.
Получают жетоны.
1. Изучение зависимости силы взаимодействия заряженных тел от абсолютного значения зарядов и расстояния между ними
Приборы и материалы: полиэтиленовые пленки (2 шт.), бумажная полоска.
Порядок выполнения работы
1. Положите две полиэтиленовые пленки рядом на стол (параллельно друг другу) и проведите по ним один раз рукой. Поднимите пленки за концы, разведите их и, медленно сближая, наблюдайте за их взаимодействием.
2. Повторите опыт с этими же пленками, натерев их рукой. Как изменилась сила взаимодействия пленок?
3. Проделайте аналогичные опыты с полиэтиленовой пленкой и бумажной полоской. Для их электризации положите на бумажную полоску полиэтиленовую пленку и потрите их рукой (первый раз – слегка, второй раз – сильнее). Каждый раз разводите полоски и, медленно поднося друг к другу, наблюдайте за их взаимодействием.
4. Ответьте на вопросы:
- По какому признаку вы судите о силе взаимодействия заряженных тел?
- Как взаимодействуют заряженные полиэтилен с полиэтиленом и полиэтилен с бумагой?
- На оба ли заряженных тела действует электрическая сила?
- От чего зависит сила взаимодействия заряженных тел?
- Как зависит сила взаимодействия заряженных тел от значения зарядов и расстояния между ними?
2.
 Наблюдение парения заряженной пушинки в электрическом поле
Наблюдение парения заряженной пушинки в электрическом полеПриборы и материалы: пластмассовая линейка, комочек ваты.
Порядок выполнения работы
1. Положите пластмассовую линейку на стол и натрите ее бумагой.
2. Распушите очень маленький комочек ваты и положите его на линейку.
3. Поднимите наэлектризованную линейку и легонько сдуйте с нее пушинку вверх.
4. Поместите быстро линейку снова к пушинке и наблюдайте за ее движением в электрическом поле заряженной линейки. (Если пушинка прилипнет к линейке, сдуйте ее и снова повторите опыт.)
5. Ответьте на вопросы:
- Какие силы действуют на пушинку во время ее парения?
- Почему пушинка не падает в электрическом поле?
Комментарий учителя (после разбора опыта).
Этот опыт показывает возможность уравновешивания силы тяжести, действующей на тело, силой электрического поля
2 слайд:
Учащиеся отвечают на вопросы:
Подумайте:
- Зачем при перевозке горючих жидкостей к корпусу автоцистерны прикрепляют цепь, которая при движении волочится по земле?
- Для заземления цистерны бензовоза к ней прикрепляют стальную цепь, нижний конец которой несколькими звеньями касается земли.
 Почему такой цепи нет у железнодорожной цистерны?
Почему такой цепи нет у железнодорожной цистерны? - Может ли одно и тоже тело, например эбонитовая палочка, при трении электризоваться то отрицательно, то положительно?
Открытие нового знания
Что такое физическое тело? (Ответ учащихся – это предметы, которые нас окружают.)
Что такое вещество? (Ответ учащихся – это то, из чего состоит физическое тело.)
Любое вещество состоит из молекул, молекулы из атомов.
О чем сегодня мы говорим на уроке? (версии учащихся)Постановка цели.
3 слайд: Итак, тема урока «Строение атома» (запишите в тетрадь)
4 слайд: (из истории)
Нас интересует строение одной очень маленькой частички – атома. Слово “атом” придумал очень давно более 2500 лет назад древнегреческий философ Демокрит. С греческого “атом” – “неделимый”.
В истории развития физики одна из самых интересных и увлекательных страниц – это история открытия сложного строения атома.
В конце XIX- начале XX в. идеи о строении атома витали в воздухе, различные догадки ученых создавали духовную атмосферу, в которой, в конце концов, и рождалось открытие, ведь в то время ничего о внутреннем строении атома не было известно.
5 слайд: Ученые Джозеф Томсон и Эрнест Резерфорд предложили свои модели строения атома. Кто же был прав?
6 слайд: В 1903 году Джозеф Томсон предложил одну из первых моделей «Кекс с изюминкой», т. е. атом представляет собой шар, по всему объему которого равномерно распределен положительный заряд. Внутри этого шара находятся электроны.
7 слайд: В 1911 году Резерфорд провел ряд опытов по исследованию состава и строения атома. В центре атома находится положительно заряженное ядро, вокруг ядра движутся электроны. Эту модель назвал «планетарной моделью», схожей с нашей Солнечной системой.
Запишите в тетрадь: Резерфорд – планетарная модель атома.
8 слайд: Атом состоит: из положительно заряженного ядра, в котором протоны – положительные частицы, нейтроны – без заряда (имеют только массу), вокруг ядра движутся отрицательные электроны. Сколько положительных частиц в атоме, столько и отрицательных, поэтому атом в целом нейтрален.
Сколько положительных частиц в атоме, столько и отрицательных, поэтому атом в целом нейтрален.
Зарисуйте в тетрадь схему.
Строение всех атомов зашифровано в периодической системе химических элементов, которую создал Менделеев. Порядковый номер химического элемента показывает электрический заряд ядра атома.
Положите перед собой листочки с таблицей Менделеева.
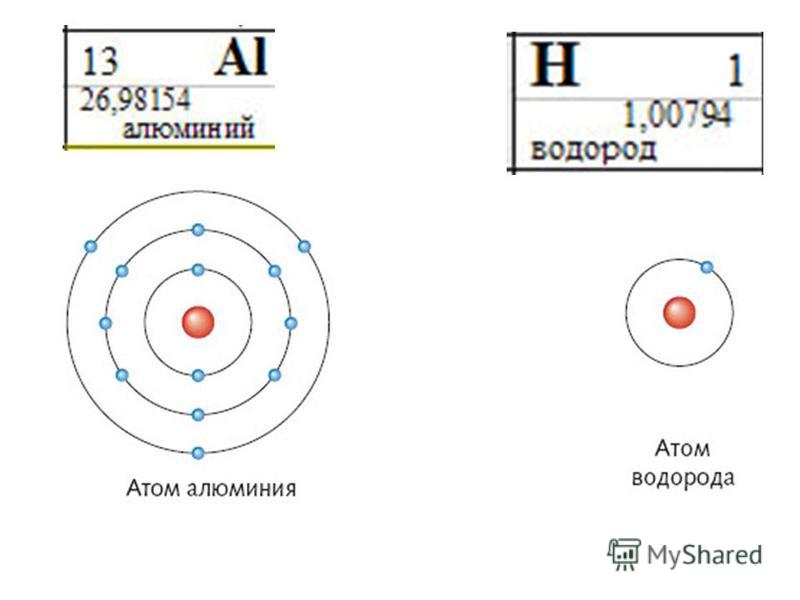
Рассмотрим химический элемент водород:
Какой у него порядковый номер?
Ученик: (предполагаемый ответ)у него первый порядковый номер,
Чему равен заряд ядра?
Ученик: (предполагаемый ответ) Заряд ядра равен 1
Сколько в атоме протонов, электронов?
Ученик: (предполагаемый ответ) число протонов в ядре 1, но т.к. атом нейтрален, то и на оболочках 1 отрицательный электрон.
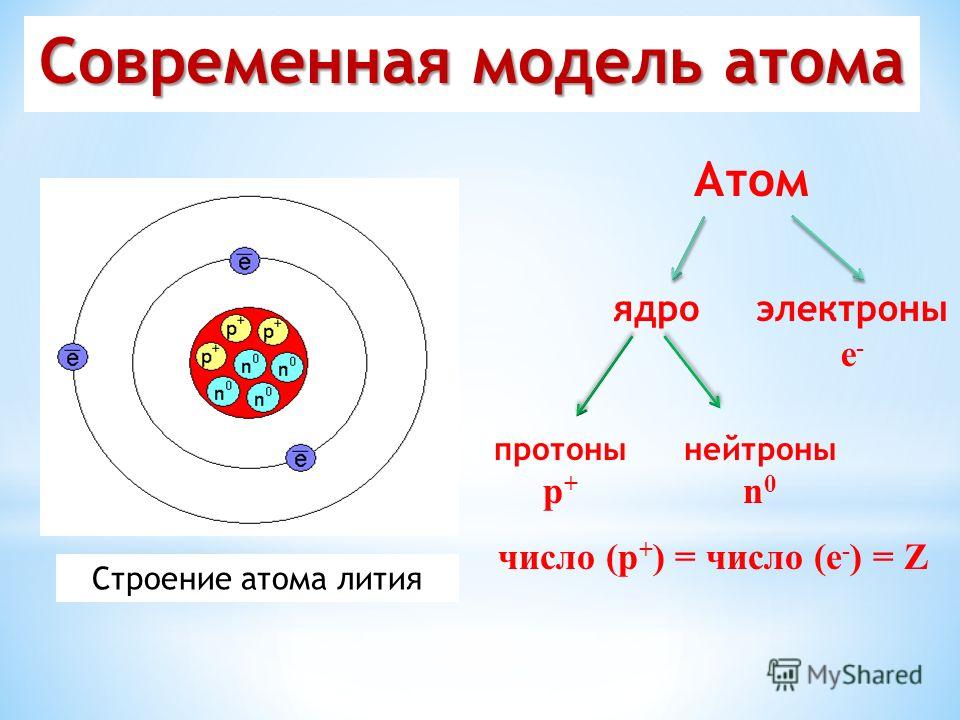
9 слайд: Атом – электрически нейтральная частица, суммарный положительный заряд ядра равен суммарному отрицательному заряду электронов. Общее число протонов и нейтронов в ядре выражается массовым числом:
A = Z + N.
А – атомная масса, Z – число электронов, N – число нейтронов
(Аналогично, для гелия, железа.)
10 слайд:
Собрать, сколько надо, частиц всех сортов,
И атом – пожалуйста – вот он, готов!
Но в общее дело их вклады неравны…
Так кто же из этих частиц самый главный –
Пузатый протон, флегматичный нейтрон,
А может быть, юркий малец электрон?
Итак, какая задача стоит перед нами?
Выяснить, какие частицы в атоме главные?
Изменяем число электронов
Если при электризации тело получает положительный заряд, это значит, что от атома отделился отрицательный электрон. Какой заряд данной частицы? (ответы учащихся).
11 слайд: Если при электризации тело получает отрицательный заряд, это значит, что к атому присоединился отрицательный электрон. Как станет называться частица? (отрицательным ионом).
12 слайд: Какой сделаем вывод? Запишите его в тетрадь:
(Частица, которая получилась при отдаче (потере) электрона, называется положительным ионом.
Частица, которая получилась при принятии (присоединении) электрона, называется отрицательным ионом.)
Вывод: вид атома не изменился.
13 слайд: Изменим число нейтронов в атоме.
Запишите в тетрадь:
Атомы одного вида, но имеющие разные числа нейтронов (разные массы), называются изотопами.
Сделайте вывод. (вид атома не изменился).
14 слайд: Изменим число протонов в атоме.
Вывод: (вид атома изменился). Получили новый химический элемент.
Запишите в тетрадь:
Вывод: Главная характеристика химического элемента не число электронов, а заряд ядра.
Динамическая пауза
Пока занимались мы, тихо, но прытко
В класс к нам пробралась сеньора ошибка.
Чтоб убралась она без оглядки
Сделать придется физическую зарядку.
Правильно – вверх, неверно – вперед,
Ответ посчитаем – ошибка уйдет.
Первичное закрепление изученного материала. (карточки на столах)
Упражнение 1. (устно)
(устно)
В ядре атома бора 10 частиц. Вокруг ядра движутся 5 электронов. Сколько в ядре протонов и сколько нейтронов?
(Учащиеся получают жетоны)
Упражнение 2. (в группе)
Изобразить атом лития
Вопросы: От атома отделили один электрон, как будет называться данная частица? (изобразить).
Каков ее заряд?
(За верно выполненное задание получает жетон)
Упражнение 3. (в группе)
Изобразить атом бериллия
К атому присоединился один электрон, как будет называться данная частица? (изобразить)
Каков ее заряд?
(За верно выполненное задание получает жетон)
Самостоятельная работа
ТЕСТ (Учащиеся рассаживаются за компьютеры).
Тест на проверку знаний по теме: “Электризация тел” |
|
|||||
Вопрос 1. |
||||||
Ответ: |
|
|
|
|
|
|
Вопрос 2. Как наэлектризовать тела? |
|
|
|
|||
Ответ: |
|
|
|
|
|
|
Вопрос 3. |
|
|
|
|
||
Ответ: |
|
|
|
|
|
|
Вопрос 4. Бесконечно ли можно делить заряд? |
|
|
|
|||
Ответ: |
|
|
|
|
|
|
Вопрос 5. |
|
|||||
Ответ: |
|
|
|
|
|
|
Вопрос 6. Как образуется из атома положительный ион? |
|
|||||
Ответ: |
|
|
|
|
|
|
Вопрос 7. |
|
|
|
|||
Ответ: |
|
|
|
|
|
|
Вопрос 8. В каких единицах измеряется заряд? |
|
|
|
|||
Ответ: |
|
|
|
|
|
|
Вопрос 9. |
|
|||||
Ответ: |
|
|
|
|
|
|
Вопрос 10. Как называется прибор для обнаружения электрического заряда? |
|
|||||
Ответ: |
|
|
|
|
|
|
|
ВАШ РЕЗУЛЬТАТ |
|
|
|
|
|
Жетоны за тест
Итог урока
Подводя итог урока, ответьте на вопосы:
- Каков состав атома?
- Каков состав атомного ядра?
- Электрический заряд электрона?
- Как называется частица, присоединившая электрон?
- Как называется частица, потерявшая электрон?
- Назовите ученого, предложившего планетарную модель атома?
Рефлексия
(За ответы – жетоны). Подсчет жетонов. Выставление оценок
Подсчет жетонов. Выставление оценок
Домашнее задание
Д/з: § 30, ответить на вопросы, упр. 11
Урок заканчивается стихотворением поэта Валерия Брюсова, в 1922 году написал стихотворение, в котором провел аналогию между строением атома и Солнечной системой.
“Мир электрона”
Быть может, эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков.
Еще, быть может, каждый атом –
Вселенная, где сто планет,
Там все, что здесь, в объеме сжатом,
Но так же то, чего здесь нет.
Их мудрецы, свой мир бескрайний
Поставив центром бытия,
Спешат проникнуть в искры тайны
И умствуют, как ныне я.
А в миг, когда из разрушенья
Творятся точки новых сил.
Кричат, в мечтах самовнушенья.
Что Бог свой светоч загасил.
Историческое развитие атомной структуры – 1230 слов
Историческое развитие атомной структуры
Язан Фахмави
30 сентября 1995 г.
T3 IBS Chemistry
Г-жа Редман
Идея «атома» восходит к древнегреческому обществу , где ученые считали, что вся материя состоит из более мелких, более фундаментальных частиц, называемых элементами. Они назвали эти частицы атомами, что означает «неделимые». Затем пришли химики и физики 16-го и 17-го веков, которые открыли различные формулы различных солей и воды, тем самым открыв идею молекулы.
Затем, в 1766 году родился человек по имени Джон Далтон, родившийся в Англии. Он известен как отец атомной теории, потому что он был тем, кто сделал ее количественной, то есть он открыл множество масс различных элементов и, соответственно, открыл различные пропорции, в которых образуются молекулы (т.е. на каждую молекулу воды приходится один атом). кислорода и две молекулы водорода). Он также открыл благородные или инертные газы и их неспособность реагировать с другими веществами. В 1869 г.русский химик, наиболее известный своей разработкой периодического закона свойств химических элементов
В 1869 г.русский химик, наиболее известный своей разработкой периодического закона свойств химических элементов
(в котором говорится, что элементы проявляют регулярную закономерность («периодичность»), когда они расположены в соответствии с их атомными массами), опубликовал свою первую попытку классифицировать известные элементы. Его звали Менделеев, и он был известным учителем. Поскольку в то время не было хорошего учебника по химии, он написал двухтомные «Основы химии» (1868–1870), которые впоследствии стали классикой. При написании этой книги Менделеев пытался классифицировать элементы по их химическим свойствам. В 1871 году он опубликовал улучшенную версию периодической таблицы, в которой оставил пробелы для еще не известных элементов. Его схема и теории получили признание в научном мире, когда впоследствии были обнаружены три элемента, которые он «предсказал» — галлий, германий и скандий. В 1856 году родился еще один важный деятель атомной теории: сэр Джозеф Джон Томсон. В 1906, после преподавания в Кембриджском университете
и Тринити-университете в Англии, он получил Нобелевскую премию по физике за свою работу о проводимости электричества через газы. Он открыл, что такое электрон, используя катодные лучи. Электрон — это наименьшая частица в атоме, масса которой ничтожно мала по сравнению с остальной частью атома и заряд которой отрицателен. Хотя в то время ученые этого не знали, электроны находились в электронном облаке, вращающемся вокруг ядра или центра атома. Другой выдающейся фигурой в ядерной физике является человек по имени Эрнест Резерфорд, родившийся в 1871 году. Он также был профессором Кембриджского университета,
Он открыл, что такое электрон, используя катодные лучи. Электрон — это наименьшая частица в атоме, масса которой ничтожно мала по сравнению с остальной частью атома и заряд которой отрицателен. Хотя в то время ученые этого не знали, электроны находились в электронном облаке, вращающемся вокруг ядра или центра атома. Другой выдающейся фигурой в ядерной физике является человек по имени Эрнест Резерфорд, родившийся в 1871 году. Он также был профессором Кембриджского университета,
University of Manchester (оба в Англии) и в McGill College
В этом эссе автор
- рассказывает, как в 1766 году родился человек по имени Джон Далтон, родившийся в Англии.
- Рассказывает, как он переехал в Нью-Мексико и провел большую часть своего времени, исследуя Лос-Анджелес.
- Объясняет, что Бор пошел работать на правительство в Лос-Аламосе, Нью-Мексико, вместе с Джеймсом.
- Рассказывает, как Эрвин Шрёдингер родился в Австрии в 1887 году.
- Объясняет, что атомная масса, равная единице, не имеющая положительного или отрицательного заряда (т.
 е. нейтральная), находится в ядре атомов вместе с протоном.
е. нейтральная), находится в ядре атомов вместе с протоном.
Получить доступ
Проверить качество письма
- Проявление
- Атом
- Нейтрон
- Электрон
Джозеф Джон «Дж. Дж.” Томсон
Главная / Узнать / Исторические биографии
Британский физик Джозеф Джон (Дж. Дж.) Томсон (1856–1819 гг.)40) выполнил в 1897 г. серию экспериментов, направленных на изучение природы электрического разряда в высоковакуумной электронно-лучевой трубке, область, которой в то время занимались многие ученые.
Томсон интерпретировал отклонение лучей электрически заряженными пластинами и магнитами как свидетельство наличия «тел, намного меньших, чем атомы» (электроны), которые, как он вычислил, имеют очень большое значение отношения заряда к массе. Позже он оценил стоимость самого заряда.
com/embed/WH-U_qCEzT0?wmode=opaque&controls=” name=”The Early Life of J.J. Thomson: Computational Chemistry and Gas Discharge Experiments” frameborder=”0″ allowfullscreen=””> Структура атома и масс-спектрографияВ 1904 г. Томсон предложил модель атома как сферы положительной материи, в которой электроны располагаются под действием электростатических сил. Его усилия по оценке числа электронов в атоме по измерениям рассеяния света, Х-, бета- и гамма-лучей положили начало исследовательской траектории, по которой двигался его ученик Эрнест Резерфорд. Последняя важная экспериментальная программа Томсона была сосредоточена на определении природы положительно заряженных частиц. Здесь его методы привели к развитию масс-спектрографа. Его ассистент, Фрэнсис Астон, усовершенствовал прибор Томсона и с помощью улучшенной версии смог обнаружить изотопы — атомы одного и того же элемента с разным атомным весом — в большом количестве нерадиоактивных элементов.
Дж. Дж. Томсон (слева) и Эрнест Резерфорд в 1930-е годы.
Из книги сэра Джеймса Хопвуда Джинса «Рост физических наук» (Кембридж: издательство Кембриджского университета, 1948 г.)
Ранняя жизнь и образование
По иронии судьбы, Томсон — великий ученый и наставник физики — стал физиком по умолчанию. Его отец хотел, чтобы он стал инженером, что в те дни требовало ученичества, но его семья не могла собрать необходимую плату. Вместо этого юный Томсон поступил в Оуэнс-колледж в Манчестере, где был превосходный научный факультет. Затем его рекомендовали в Тринити-колледж в Кембридже, где он стал математическим физиком. В 1884 году он был назначен на престижную Кавендишскую профессуру экспериментальной физики в Кембридже, хотя лично он проделал очень мало экспериментальной работы. Несмотря на то, что у него были неуклюжие руки, у него был талант проектировать аппараты и диагностировать их проблемы. Он был хорошим лектором, поощрял своих студентов и уделял значительное внимание более широким проблемам преподавания естественных наук в университетах и средних школах.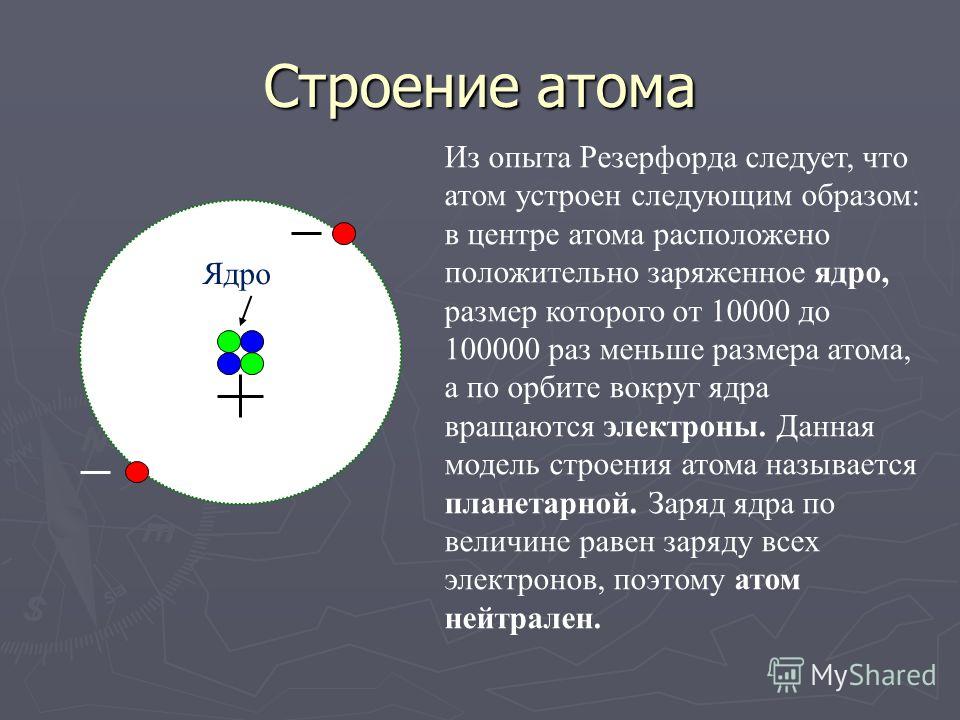

 Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения). – 463 с.
– 463 с.
 Работа в группах. Выполнение практической работы
Работа в группах. Выполнение практической работы Первичное закрепление изученного материала
Первичное закрепление изученного материала Почему такой цепи нет у железнодорожной цистерны?
Почему такой цепи нет у железнодорожной цистерны? Что такое диэлектрик?
Что такое диэлектрик? Какие частицы в атоме движутся вокруг ядра?
Какие частицы в атоме движутся вокруг ядра?
 е. нейтральная), находится в ядре атомов вместе с протоном.
е. нейтральная), находится в ядре атомов вместе с протоном.