Способы изменения внутренней энергии тела – таблица, формула
4
Средняя оценка: 4
Всего получено оценок: 134.
4
Средняя оценка: 4
Всего получено оценок: 134.
Понятие внутренней энергии было сформулировано физиками прежде всего для построения теории, объясняющей тепловые явления. Для объяснения процессов теплопередачи, физическое тело рассматривается как система, состоящая из большого количества частиц (атомов и молекул). Сумма энергий всех частиц, составляющих тело (кинетическая и потенциальная), по определению является внутренней энергией физического тела. Рассмотрим основные способы изменения внутренней энергии.
Первый закон термодинамики и внутренняя энергия
Когда работа A совершается в результате механического движения тела как целого, или его взаимодействия с другими телами, то знание величины внутренней энергии U не требуется для расчетов. Напротив, когда работа сопровождается передачей тепла Q, то без знания закономерности, отражающей связь этих величин между собой, уже не обойтись.
$ ΔU = { Q + A } $ (1).
Если же сама термодинамическая система, получив тепло Q, совершает работу А, то формула (1) принимает следующий вид:
$ ΔU = { Q – A } $ (2).
Представления о внутренней энергии сложились далеко не сразу. В течение ХIХ века существовала теория теплорода, предложенная французским ученым Лавуазье. Считалось, что теплород — это некая субстанция (особый вид материи), при втекании которой в тело, его температура увеличивается, а при вытекании происходит уменьшение температуры. Многочисленные эксперименты, проведенные в начале ХIХ века, полностью опровергли эту теорию и развеяли миф о теплороде.
Изменение величины внутренней энергии с помощью работы
Итак, в соответствии с первым законом термодинамики внутренняя энергия вещества, из которого состоит данное тело, изменится если над ним будет совершена работа внешними силами, либо само тело совершит работу. Приведем ряд примеров:
Приведем ряд примеров:
Изменение величины внутренней энергии с помощью передачи тепла
Количество теплоты Q, полученное телом извне или, наоборот, переданное от себя другому телу — второй механизм, приводящий к изменению внутренней энергии
Существует три основных механизма теплопередачи: теплопроводность, конвекция и излучение:
- Механизм теплопроводности связан с передачей тепла от более нагретого тела к менее нагретому. Например, когда кастрюля с холодной водой ставится на разогретую газовую или электроплиту, то нагрев происходит за счет этого механизма, суть которого заключается в передаче энергии “горячих” молекул газового пламени или молекул раскаленной электрической спирали;
- Конвекция представляет собой перенос внутренней энергии в газах и жидкостях в результате циркуляции потоков вещества и последующего перемешивания.
 Простым примером для понимания характера этого механизма служит работа кондиционера в помещении, когда поток охлажденного им воздуха начинает перемешиваться с более теплым, что приводит к общему понижению температуры в квартире или офисе;
Простым примером для понимания характера этого механизма служит работа кондиционера в помещении, когда поток охлажденного им воздуха начинает перемешиваться с более теплым, что приводит к общему понижению температуры в квартире или офисе; - Передача тепла с помощью излучения происходит в виде электромагнитных волн. Этот механизм может проистекать даже в вакууме. Часть внутренней энергии преобразуется в электромагнитную энергию, которая распространяется в пространстве и после попадания на другое тело, поглощается им. Таким образом происходит изменение внутренней энергии обоих тел. Чем больше температура тела, тем больше энергии передается с помощью излучения.
Изменение внутренней энергии с помощью химических реакций
Внутренняя энергия системы, представляющая собой смесь разных веществ, может изменяться в результате химических реакций, в которые эти вещества вступают между собой. При этом в результате тепло Q может либо выделяться (экзотермическая реакция), либо поглощаться (эндотермическая реакция).
Примером реакции с выделением тепла Q может служить реакция горения метана в кислороде:
$ СH_4 + 2O_2 = CO_2 + 2*H_2O + Q $ (3).
Пример реакции с поглощением тепла — разложение карбоната кальция СaCO3 на углекислый газ CO2 и оксид кальция (негашеная известь) CaO:
$ СaCO_3 = CaO + CO_2 – Q $ (4).
Все перечисленные способы изменения внутренней энергии можно представить в виде следующей таблицы:.
Физики научились регистрировать и измерять тепловое излучение, что позволило создать удивительные приборы, которые называются тепловизорами. Этими устройствами можно бесконтактно (на расстоянии) измерять температуру на поверхности различных тел, в том числе на теле человека. Тепловизоры применяются в медицине, в военной технике, в промышленности.
Что мы узнали?
Итак, мы узнали, что внутреннюю энергию тела можно изменить либо с помощью совершения работы
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Александр Коновалов
10/10
Оценка доклада
4
Средняя оценка: 4
Всего получено оценок: 134.
А какая ваша оценка?
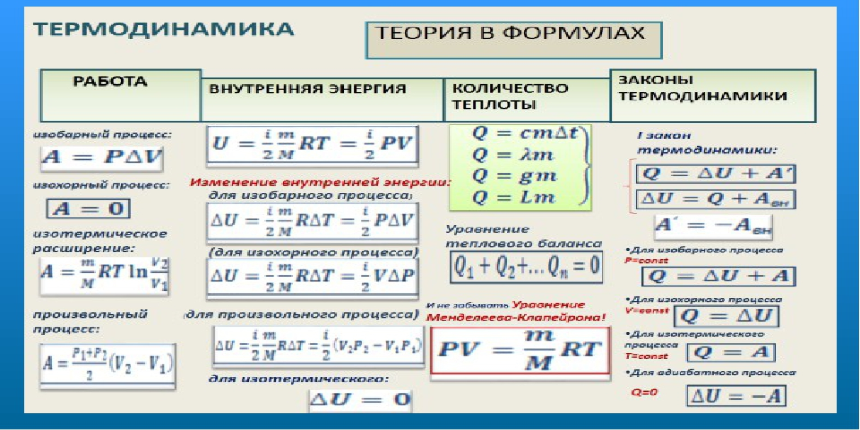
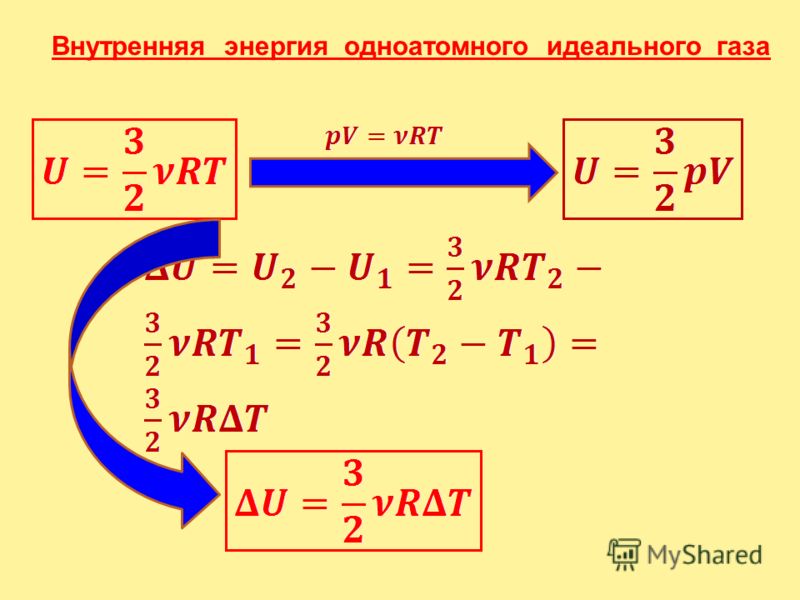
Наряду с механической энергией, любое тело (или система) обладает внутренней энергией. Внутренняя энергия – энергия покоя. Она складывается из теплового хаотического движения молекул, составляющих тело, потенциальной энергии их взаимного расположения, кинетической и потенциальной энергии электронов в атомах, нуклонов в ядрах и так далее. В термодинамике важно знать не абсолютное значение внутренней энергии, а её изменение. В термодинамических процессах изменяется только кинетическая энергия движущихся молекул (тепловой энергии недостаточно, чтобы изменить строение атома, а тем более ядра). Следовательно, фактически под внутренней энергией в термодинамике подразумевают энергию теплового хаотического движения молекул. Внутренняя энергия U одного моля идеального газа равна: Таким образом, внутренняя энергия зависит только от температуры. Внутренняя энергия U является функцией состояния системы, независимо от предыстории. Понятно, что в общем случае термодинамическая система может обладать как внутренней, так и механической энергией, и разные системы могут обмениваться этими видами энергии. Обмен механической энергией характеризуется совершенной работой А, а обмен внутренней энергией – количеством переданного тепла Q. Например, зимой вы бросили в снег горячий камень. За счёт запаса потенциальной энергии совершена механическая работа по смятию снега, а за счёт запаса внутренней энергии снег был растоплен. Итак, работа и теплота не есть особые формы энергии. Нельзя говорить о запасе теплоты или работы. Это мера переданной другой системе механической или внутренней энергии. Вот о запасе этих энергий можно говорить. Кроме того, механическая энергия может переходить в тепловую энергию и обратно. Например, если стучать молотком по наковальне, то через некоторое время молоток и наковальня нагреются (это пример диссипации энергии). Можно привести ещё массу примеров превращения одной формы энергии в другую. Опыт показывает, что во всех случаях, превращение механической энергии в тепловую и обратно совершается всегда в строго эквивалентных количествах. В этом и состоит суть первого начала термодинамики, следующего из закона сохранения энергии. Количество теплоты, сообщаемой телу, идёт на увеличение внутренней энергии и на совершение телом работы:
– это и есть первое начало термодинамики , или закон сохранения энергии в термодинамике. Правило знаков: если тепло передаётся от окружающей среды данной системе, и если система производит работу над окружающими телами, при этом . Учитывая правило знаков, первое начало термодинамики можно записать в виде: В этом выражении U – функция состояния системы; dU – её полный дифференциал, а δQ и δА таковыми не являются. В каждом состоянии система обладает определенным и только таким значением внутренней энергии, поэтому можно записать:
Важно отметить, что теплота Q и работа А зависят от того, каким образом совершен переход из состояния 1 в состояние 2 (изохорически, адиабатически и т.д.), а внутренняя энергия U не зависит. При этом нельзя сказать, что система обладает определенным для данного состояния значением теплоты и работы. Из формулы (4.1.2) следует, что количество теплоты выражается в тех же единицах, что работа и энергия, т.е. в джоулях (Дж). Особое значение в термодинамике имеют круговые или циклические процессы, при которых система, пройдя ряд состояний, возвращается в исходное. На рисунке 4.1 изображен циклический процесс 1–а –2–б –1, при этом была совершена работа А.
Так как U – функция состояния, то
Это справедливо для любой функции состояния. Если то согласно первому началу термодинамики , т.е. нельзя построить периодически действующий двигатель, который совершал бы бóльшую работу, чем количество сообщенной ему извне энергии. Иными словами, вечный двигатель первого рода невозможен. Это одна из формулировок первого начала термодинамики. Следует отметить, что первое начало термодинамики не указывает, в каком направлении идут процессы изменения состояния, что является одним из его недостатков. |
Не только горючие , но и горячие тела обладают внутренней энергией, которую легко превратить в механическую работу. Проделаем опыт. Нагреем в кипятке гирю и поставим на жестяную коробочку, присоединённую к манометру. По мере того как воздух в коробочке будет прогреваться, жидкость в манометре начнёт двигаться (см. рисунок).
Проделаем опыт. Нагреем в кипятке гирю и поставим на жестяную коробочку, присоединённую к манометру. По мере того как воздух в коробочке будет прогреваться, жидкость в манометре начнёт двигаться (см. рисунок).
Расширяющийся воздух совершает над жидкостью работу. За счёт какой энергии это происходит? Разумеется, за счёт внутренней энергии гири. Следовательно, в этом опыте мы наблюдаем превращение внутренней энергии тела в механическую работу. Заметим, что механическая энергия гири в этом опыте не меняется – она всё время равна нулю.
Итак, внутренняя энергия – это такая энергия тела, за счёт которой может совершаться механическая работа, при этом не вызывая убыли механической энергии этого тела.
Внутренняя энергия любого тела зависит от множества причин: рода и состояния его вещества, массы и температуры тела и других. Внутренней энергией обладают все тела: большие и маленькие, горячие и холодные, твёрдые, жидкие и газообразные.
Наиболее легко на нужды человека может быть использована внутренняя энергия лишь, образно говоря, горячих и горючих веществ и тел. Это нефть, газ, уголь, геотермальные источники вблизи вулканов и так далее. Кроме того, в XX веке человек научился использовать и внутреннюю энергию так называемых радиоактивных веществ. Это, например, уран, плутоний и другие.
Это нефть, газ, уголь, геотермальные источники вблизи вулканов и так далее. Кроме того, в XX веке человек научился использовать и внутреннюю энергию так называемых радиоактивных веществ. Это, например, уран, плутоний и другие.
Взгляните на правую часть схемы. В популярной литературе нередко упоминаются тепловая, химическая, электрическая, атомная (ядерная) и другие виды энергии. Все они, как правило, являются разновидностями внутренней энергии, так как за счёт них может совершаться механическая работа, не вызывая при этом убыли механической энергии. Понятие внутренней энергии мы рассмотрим более подробно при дальнейшем изучении физики.
Формула внутренней энергии: вывод, единица измерения, примеры
- Автор Павитра ВГ
- Последнее изменение 15-11-2022
Формула внутренней энергии: Раздел науки, который занимается изучением различных форм энергии и количественных отношений между ними, известен как термодинамика. Хорошо известно, что большинство физических и химических изменений сопровождаются энергетическими изменениями. Эти энергетические изменения могут происходить в виде теплоты, света, работы, электрической энергии и т. д. Все эти виды энергии обратимы друг в друга и, следовательно, количественно связаны друг с другом.
Хорошо известно, что большинство физических и химических изменений сопровождаются энергетическими изменениями. Эти энергетические изменения могут происходить в виде теплоты, света, работы, электрической энергии и т. д. Все эти виды энергии обратимы друг в друга и, следовательно, количественно связаны друг с другом.
В этой статье вы узнаете все о внутренней энергии, ее значении, примерах, формуле внутренней энергии, ее единице СИ, внутренней энергии как функции состояния, внутренней энергии как экстенсивном свойстве и т. д.
Каждое вещество обладает определенной величиной энергии, которая зависит от таких факторов, как химическая природа вещества, температура и давление. Это известно как внутренняя энергия или внутренняя энергия. Он представлен символом \(\rm{U}\). Ранее он был представлен символом \(\rm{E}\).
Внутренняя энергия состоит из кинетической энергии и потенциальной энергии составляющих частиц. Кинетическая энергия возникает из-за движения его частиц, таких как поступательная энергия, энергия вращения, колебательная энергия и т. Д. Потенциальная энергия возникает из-за различных типов взаимодействия между частицами и включает электронную энергию, ядерную энергию, энергию из-за молекулярного взаимодействия. и т.д.
Д. Потенциальная энергия возникает из-за различных типов взаимодействия между частицами и включает электронную энергию, ядерную энергию, энергию из-за молекулярного взаимодействия. и т.д.
Полная энергия вещества или системы называется внутренней энергией. Это сумма электронной энергии \((\rm{U}_\rm{e})\), ядерной энергии \((\rm{U}_\rm{n})\), энергии химической связи \( (\rm{U}_\rm{c})\), потенциальная энергия \((\rm{U}_\rm{p})\) и кинетическая энергия \((\rm{U}_\rm {к})\). 97\) эрг.
Единицей внутренней энергии СГС является эрг.
Одинаково ли количество внутренней энергии во всех системах или веществах?
Различные вещества имеют разную внутреннюю энергию в зависимости от природы составляющих их атомов, связей и других условий, таких как температура, давление и т. д. Например, внутренняя энергия одного моля двуокиси углерода будет отличаться от внутренней энергии одного моль диоксида серы при аналогичных условиях температуры и давления.
Внутренняя энергия одного моля воды при \(300\,\rm{K}\) отличается от энергии одного моля воды при \(310\,\rm{K}\) при том же атмосферном давлении .
Что такое функция состояния?
Температура одного литра воды может быть изменена путем нагревания или охлаждения. Здесь изменение температуры более важно, чем путь, по которому это изменение происходит.
На основе этого примера можно определить функцию состояния как физическую величину, в которой ее значение зависит только от состояния системы и не зависит от пути, по которому это состояние было достигнуто.
Другими словами, говорят, что физическая величина является функцией состояния, если изменение ее значения в процессе зависит только от начального состояния и конечного состояния системы и не зависит от пути или маршрута, по которому это произошло изменение.
Как внутренняя энергия является функцией состояния?
Внутренняя энергия является функцией состояния, поскольку внутренняя энергия системы зависит от состояния системы, а не от того, как система достигает этого состояния.
Изменение внутренней энергии \((\rm{ΔU})\) зависит только от начального и конечного состояний системы, но не от промежуточных состояний.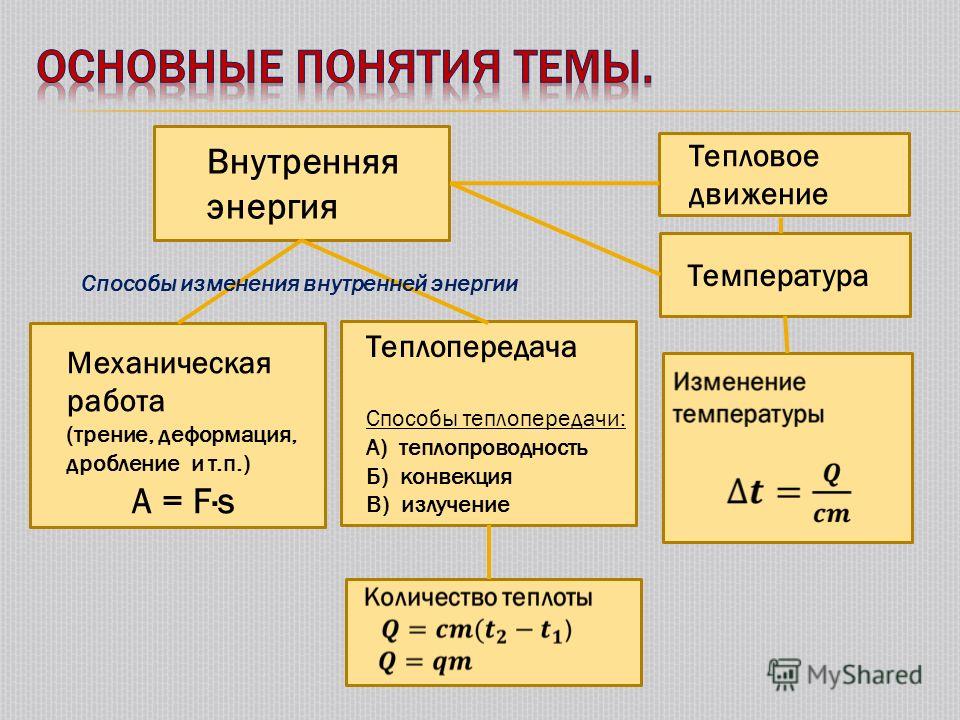
\(\rm{∆U = U}_{\rm{final}\,\rm{state}}-\rm{U}_{\rm{initial}\,\rm{State}}\)
\(\rm{∆U = U}_2 – \rm{U}_1\)
Изменение внутренней энергии в химической реакции определяется выражением
\(\rm{∆U = U}_ {\rm{продукты}} – \rm{U}_{\rm{реагенты}}\)
\(\rm{∆U = U}_\rm{p} – \rm{U}_\rm {г}\)
Если внутренняя энергия продуктов меньше внутренней энергии реагентов, то \(\rm{∆U}\) отрицательно.
\(\rm{∆U=U}_\rm{p}-\rm{U}_\rm{r}= -\rm{ve}\) \((∵ \rm{U}_\ rm{p} < \rm{U}_\rm{r})\)
Если внутренняя энергия продуктов больше внутренней энергии реагентов, то \(\rm{∆U}\) было бы будь позитивным.
\(\rm{U}\rm{p}-\rm{U}\rm{r}= +\rm{ve}\) \((∵ \rm{U}\rm{p} > \rm {U}\rm{r})\)
Таким образом, внутренняя энергия \(\rm{U}\) является функцией состояния. Это означает, что \(\rm{∆U}\) зависит только от начального и конечного состояний и не зависит от пути. Другими словами, \(\rm{∆U}\) будет одинаковым, даже если изменение будет произведено по-разному.
Однако абсолютное значение внутренней энергии, которой обладает вещество, не может быть рассчитано, потому что невозможно найти точные значения различных типов энергий, таких как поступательная, колебательная, вращательная, химическая энергия и т. д., в системе.
Первый закон термодинамики
Первый закон термодинамики, то есть закон сохранения массы, гласит, что энергия не может быть создана или уничтожена, хотя одна форма энергии может быть преобразована в другую форму и наоборот.
Рассмотрим систему, внутренняя энергия которой равна \(\rm{U}_1\). Если он поглощает тепловую энергию \((\rm{q})\) из окружающей среды, то его внутренняя энергия увеличится и станет \({{\rm{U}}_1}{\rm{ + q}}.\ )
Если над системой совершена работа \((\rm{w})\), то ее конечная внутренняя энергия \((\rm{U}_2)\) равна
\(\rm{U}_2 =\rm{U}_1+\rm{q+w}\)
\(\rm{U}_2-\rm{U}_1=\rm{q+w}\)
\(\rm{ ∆U = q + w}\)
Таким образом, изменение внутренней энергии \(=\) Тепловая энергия, подведенная к системе \(+\) Работа, совершенная системой.
Если \(\rm{w}\) работа, совершаемая системой, то
\(\rm{∆U = q – w}\)
\(\rm{q = ∆U + w }\)
Знак \(\rm{w}\) и \(\rm{q}\) связан с изменением внутренней энергии \(\rm{∆U}\). В общем, «\(\rm{q}\)» положительно, если система поглощает энергию из окружения, и «\(\rm{q}\)» отрицательно, если система выделяет энергию в окружение. Значение w положительно, если над системой совершается работа, и \(\rm{w}\) отрицательно, если работа выполняется системой.
Является ли внутренняя энергия экстенсивным или интенсивным свойством?
Два наиболее важных момента, касающихся внутренней энергии:
- Внутренняя энергия зависит только от количества вещества, содержащегося в системе. Следовательно, это обширное свойство.
- Внутренняя энергия идеальных газов зависит только от температуры. Следовательно, в изотермических процессах при постоянной температуре внутренняя энергия идеального газа не изменяется, т. е. \(\rm{∆U = 0}\). Это связано с тем, что межмолекулярные силы притяжения в молекулах идеального газа пренебрежимо малы.
 Таким образом, при расширении идеального газа работа по преодолению межмолекулярных сил не совершается. Следовательно, его внутренняя энергия остается постоянной при постоянной температуре.
Таким образом, при расширении идеального газа работа по преодолению межмолекулярных сил не совершается. Следовательно, его внутренняя энергия остается постоянной при постоянной температуре.
Как хранится внутренняя энергия в системе или веществе?
Внутренняя энергия хранится в системе или веществе в различных формах, таких как переходная энергия \((\rm{U}_\rm{t})\), электронная энергия \((\rm{U}_\rm{ e})\), ядерная энергия \((\rm{U}_\rm{n})\), энергия химической связи \((\rm{U}_\rm{c})\), потенциальная энергия \ ((\rm{U}_\rm{p})\) и кинетической энергии \((\rm{U}_\rm{k})\).
Внутренний запас энергии у автотрофов есть?
Автотрофы — это организмы, которые производят себе пищу. Запасом внутренней энергии (клеточной энергии) у автотрофов является крахмал. Крахмал — это разновидность углеводов, состоящая из мономеров глюкозы.
Резюме Из статьи Формула внутренней энергии вы поняли, что такое внутренняя энергия? Его формула, Единицы. Вы также можете объяснить, как внутренняя энергия является функцией состояния. Почему это обширное свойство? Как внутренняя энергия связана с первым законом термодинамики? и т.д. Эта статья будет полезна при дальнейших исследованиях и расчетах теплоемкости, теплоемкости, выполненной работы и т.д.
Вы также можете объяснить, как внутренняя энергия является функцией состояния. Почему это обширное свойство? Как внутренняя энергия связана с первым законом термодинамики? и т.д. Эта статья будет полезна при дальнейших исследованиях и расчетах теплоемкости, теплоемкости, выполненной работы и т.д.
FAQs
Q.1. Что вы понимаете под внутренней энергией?
Ответ: Полная энергия вещества или системы называется внутренней энергией. Это сумма всех типов энергий, таких как электронная энергия \((\rm{U}_\rm{e})\), ядерная энергия \((\rm{U}_\rm{n})\), энергия химической связи \((\rm{U}_\rm{c})\), потенциальная энергия \((\rm{U}_\rm{p})\) и кинетическая энергия \((\rm{ U}_\rm{k})\).
\(\rm{U} = \rm{U}_\rm{e}+\rm{U}_\rm{n}+\rm{U}_\rm{c}+\rm{U} _\rm{p}+\rm{U}_\rm{k}\)
Q.2. Каковы две основные формы внутренней энергии?
Ответ: Две основные формы внутренней энергии — это кинетическая энергия и потенциальная энергия. Кинетическая энергия возникает из-за движения его частиц, таких как поступательная энергия, энергия вращения, колебательная энергия и т. Д. Потенциальная энергия возникает из-за различных типов взаимодействия между частицами и включает электронную энергию, ядерную энергию, энергию из-за молекулярного взаимодействия. и т.д.
Кинетическая энергия возникает из-за движения его частиц, таких как поступательная энергия, энергия вращения, колебательная энергия и т. Д. Потенциальная энергия возникает из-за различных типов взаимодействия между частицами и включает электронную энергию, ядерную энергию, энергию из-за молекулярного взаимодействия. и т.д.
Q.3. Какова внутренняя энергия газа?
Ответ: Внутренняя энергия газа определяется как сумма кинетической и потенциальной энергии, которой обладает газ.
Q.4. Что такое внутренняя энергетическая функция?
Ответ: Внутренняя энергия помогает рассчитать различные виды энергии веществ. По известному значению внутренней энергии, теплоты или выполненной работы значение неизвестной величины можно вычислить из уравнения \(\rm{∆U = q + w}.\)
Q.5. Изменяется ли внутренняя энергия при изменении давления?
Ответ: Внутренняя энергия не зависит от давления. Внутренняя энергия идеальных газов зависит только от температуры.
Внутренняя энергия идеальных газов зависит только от температуры.
В.6. Как запасается внутренняя энергия?
Ответ: Внутренняя энергия хранится в системе или веществе в различных формах, таких как переходная энергия \((\rm{U}_\rm{t})\), электронная энергия \((\rm{U}_ \rm{e})\), ядерная энергия \((\rm{U}_\rm{n})\), энергия химической связи \((\rm{U}_\rm{c})\), потенциальная энергия \((\rm{U}_\rm{p})\) и кинетическая энергия \((\rm{U}_\rm{k}).\)
Мы надеемся, что эта статья о «Формуле внутренней энергии» помогла вам. Если у вас есть какие-либо вопросы, оставьте комментарий ниже, и мы свяжемся с вами.
Как рассчитать внутреннюю энергию, работу и теплоту
Внутренняя энергия, работа и теплота >Два ключевых определения, прежде чем мы начнем:
– Термодинамика = изучение энергии и ее взаимопревращений.
– 1-й закон термодинамики = полная энергия Вселенной постоянна.
==========
Думайте о «системе» как о «химической реакции».
Внутренняя энергия системы = сумма кинетической и потенциальной энергий всех «частиц» в системе (реакция).
➞ эта внутренняя энергия (E) может быть изменена потоком работы (w) , тепла (q) , или обоих:
ΔE = q + w
Внутренняя энергия, работа, и ТеплотаКак следует из изображения выше, давайте рассмотрим особенности теплоты (q) и работы (w)…
… знаки (+ или -) теплоты (q) и работы (w) идентифицируются с точки зрения системы :
A. если реакция эндотермическая , тепловые потоки в систему и, следовательно, теплота (q) положительна (+) ➞ q > 0
B. если реакция экзотермическая , теплота течет из системы и, следовательно, теплота (q) отрицательна ( -) ➞ q < 0
— — — — —
С. если реакция ( система ) совершает работу (w) над окружением, энергия течет из системы, поэтому работа (w) отрицательна (-) ➞ w < 0
если реакция ( система ) совершает работу (w) над окружением, энергия течет из системы, поэтому работа (w) отрицательна (-) ➞ w < 0
D. если окружение совершает работу ( w) в системе , энергия течет в систему, поэтому работа (w) положительна (+) ➞ w > 0
— — — — —
ex: ΔE для системы, протекающей в эндотермическом процессе, в которой протекает 15,6 кДж тепла и где над системой совершается работа 1400 Дж.
Внутренняя энергия, работа, тепло Пример задачи==========
«Работа» , связанная с химическими процессами, обычно представляет собой работу , совершаемую газами (через расширение ) или работу сделано на газы (через компрессию ).
Рассмотрим 2 СЛУЧАЯ (ниже) и следующую зависимость между работой, внешним давлением и объемом:0125 = Обычно постоянная в этих типах задач, поэтому W зависит от ΔV
Работа, давление, объемная формула , 1 ➞ Воб система увеличивает , поэтому изменение объема (ΔV) положительно (+).
Поскольку давление (P) всегда положительно (+), то работа (w) должна быть отрицательной (-).
➞ это хорошо коррелирует с «C» выше, потому что реакция выполняет работу на окрестности, чтобы расширить объем.
— значит, w < 0 (-) потому что энергия течет из системы.
СЛУЧАЙ 2 ➞ Если газ сжимается , объем системы уменьшается , поэтому изменение объема (ΔV) отрицательно (-).
Так как давление (P) всегда положительное (+), то согласно «w = -PΔV», работа (w) должен быть положительным (+).
➞ это хорошо коррелирует с «D» выше, потому что окружение выполняет работу над системой, чтобы сжать объем.
— значит, w > 0 (+), потому что энергия течет в систему.
==========
пример: Рассчитайте работу, связанную с расширением газа от 46 л до 64 л при постоянном внешнем давлении 15 атм.

 Простым примером для понимания характера этого механизма служит работа кондиционера в помещении, когда поток охлажденного им воздуха начинает перемешиваться с более теплым, что приводит к общему понижению температуры в квартире или офисе;
Простым примером для понимания характера этого механизма служит работа кондиционера в помещении, когда поток охлажденного им воздуха начинает перемешиваться с более теплым, что приводит к общему понижению температуры в квартире или офисе;
 U = Eк + En.
U = Eк + En. 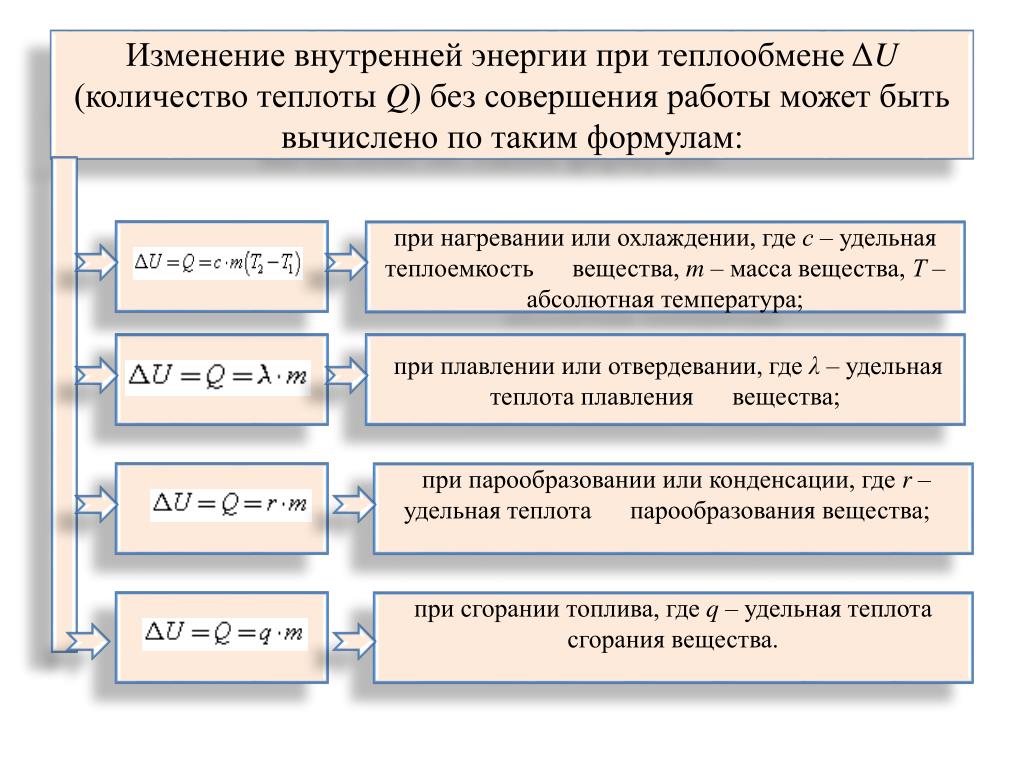
 Если же камень был холодный, т.е. температура камня равна температуре среды, то будет совершена только работа, но не будет обмена внутренней энергией.
Если же камень был холодный, т.е. температура камня равна температуре среды, то будет совершена только работа, но не будет обмена внутренней энергией. 1.1)
1.1)
 Поэтому для кругового процесса полное изменение внутренней энергии равно нулю и ΔQ=А. При адиабатическом процессе (ΔQ = 0) изменение внутренней энергии равно работе, совершаемой системой при бесконечно медленном, квазистатическом процессе.
Поэтому для кругового процесса полное изменение внутренней энергии равно нулю и ΔQ=А. При адиабатическом процессе (ΔQ = 0) изменение внутренней энергии равно работе, совершаемой системой при бесконечно медленном, квазистатическом процессе. Если в термодинамическую систему входит электромагнитное поле, то его энергию также включают во внутреннюю энергию. Кинетическая энергия движения тела как целого не входит во внутреннюю энергию.
Если в термодинамическую систему входит электромагнитное поле, то его энергию также включают во внутреннюю энергию. Кинетическая энергия движения тела как целого не входит во внутреннюю энергию.
 При соединении соляной кислоты с цинком выделится водород, а в результате горения водорода выделится водяной пар.
При соединении соляной кислоты с цинком выделится водород, а в результате горения водорода выделится водяной пар. Внутренняя энергия – это функция состояния.
Внутренняя энергия – это функция состояния. Таким образом, при расширении идеального газа работа по преодолению межмолекулярных сил не совершается. Следовательно, его внутренняя энергия остается постоянной при постоянной температуре.
Таким образом, при расширении идеального газа работа по преодолению межмолекулярных сил не совершается. Следовательно, его внутренняя энергия остается постоянной при постоянной температуре.