| 1. |
Металлические свойства
Сложность: лёгкое |
1 |
| 2. |
Элементы одного периода
Сложность: лёгкое |
1 |
3.
|
Свойства металлов и неметаллов
Сложность: среднее |
1 |
| 4. |
Изменение свойств в периоде
Сложность: среднее |
1 |
5.
|
Относительные атомные массы
Сложность: среднее |
2 |
| 6. |
Сущность и значение Периодического закона
Сложность: среднее |
2 |
7.
|
Высшие валентности элементов
|
3 |
| 8. |
Установи последовательность элементов
Сложность: сложное |
3 |
9.
|
Общие формулы высших оксидов и водородных соединений
|
3 |
| 1. |
Электронная оболочка атома
|
1 |
2.
|
Определи химический элемент
|
1 |
| 3. |
Электронная схема атома
|
1 |
4.
|
Элементы с одинаковым внешним электронным слоем
|
2 |
| 5. |
Внешний электронный слой
|
2 |
6.
|
Верные утверждения о строении атома
Сложность: среднее |
2 |
| 7. |
Электроны в атоме
Сложность: среднее |
2 |
8.
|
Энергетические уровни
Сложность: сложное |
3 |
| 9. |
Масса нуклида
Сложность: сложное |
3 |
10.
|
Массовая доля нейтронов
Сложность: сложное |
4 |
изобразите строение атома калия. – Школьные Знания.com
Отметь свойства нитратов: образованы атомами неметаллов легкоплавкие состоят из ионов продукты реакции между азотной кислотой и металлами
Выбери особенности строения молекулы аммиака: в молекуле нет сдвига электронной плотности молекула полярная все связи одинарные между атомами — двойна … я связь атомы соединены ковалентной неполярной связью
Укажи характеристику азота: при комнатной температуре реагирует с литием бурый газ с неприятным запахом в реакции с соляной кислотой образует хлорид а … ммония содержание в воздухе составляет 21 %
Помогите пожалуста с заданиєм
Срочно допоможіть!!!!!!!!!!!!!!
Обчисліть масу K NO3 , яку необхідно розчинити у 120 грамах води,для одержання розчину з масовою часткою речовини 10%. … Якщо можна будьласка обчисліть задачку на листку!
… Якщо можна будьласка обчисліть задачку на листку!
Чи можливо створити літієві батареї нового покоління з кращими властивостями, ніж існуючі літій-іонні? (а) так, акумулятори на основі літію та фтору … будуть у 4 рази легшими і даватимуть більше енергії (б) за існуючих технологій, єдиним можливим варіантом можуть бути Li-S батареї, легші за існуючі літієві акумулятори на 30% (в) літій-кисневі акумулятори з платиновими електродами можуть стати безпечними джерелами живлення, що матимуть вищу ємність і в 4 рази меншу масу, ніж сучасні літієві акумулятори (г) ні, існуючі літій-іонні акумулятори є межею теоретичних можливостей хімічних джерел струму
Задача 2 Вариант 1 Вариант 2 Рассчитайте массу бромида Рассчитайте масу бромира калия Кеr и воды, для алия KBr и воды, спя приготовления 200 г 15% при
… готовления 1500 r5% раствора. раствора Задача 3 Стоповый уксус представляет собой 6% раствор уксусной кислоты в воде. Сколько кислоты потребуется для приготовления 200 г такого раствора. Задача 4 Для приготовления 400 г раствора использовали 34 г соли. Найдите массовую долю сопи в растворе.
Задача 4 Для приготовления 400 г раствора использовали 34 г соли. Найдите массовую долю сопи в растворе.
Допоможіть будь ласка терміново!!!!
На основе закона сохранения массы веществ расставить коэффициенты в данных уравнениях и указать тип реакций : 1. Al + O2 = Al2O3 2. Fe(OH)3 = Fe2O3+ H … 2O 3. SO3+ h3O = h3SO4 4. CuO + HCl = CuCl2+ h3O 5. Fe3O4+ h3 = Fe + h3O 6. P2O5 + h3O= h4PO4 7. Fe2O3+ Al = Fe + Al2O3 8. Au2O3 = Au + O2 9. Na + h3O= NaOH + h3 10. Ca + O2 = CaO
Помогите мне пожалуйста!Определи агрегатное состояние воды. При 150° С вода: 1)жидкая 2)твёрдая 3)представляет собой пар
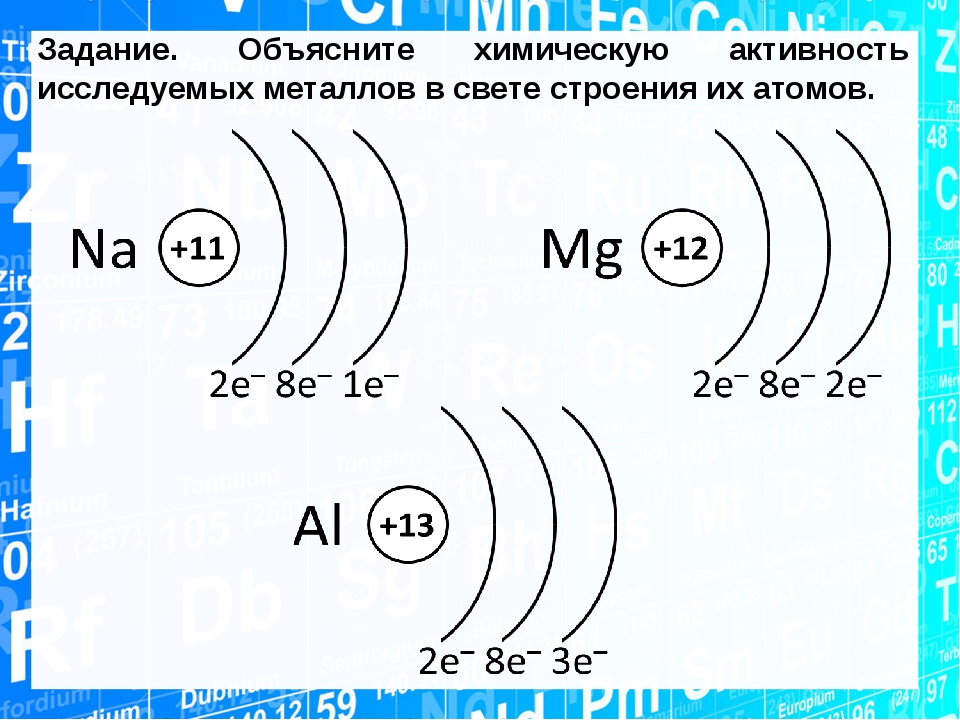
Строение атома Атом — сложная система
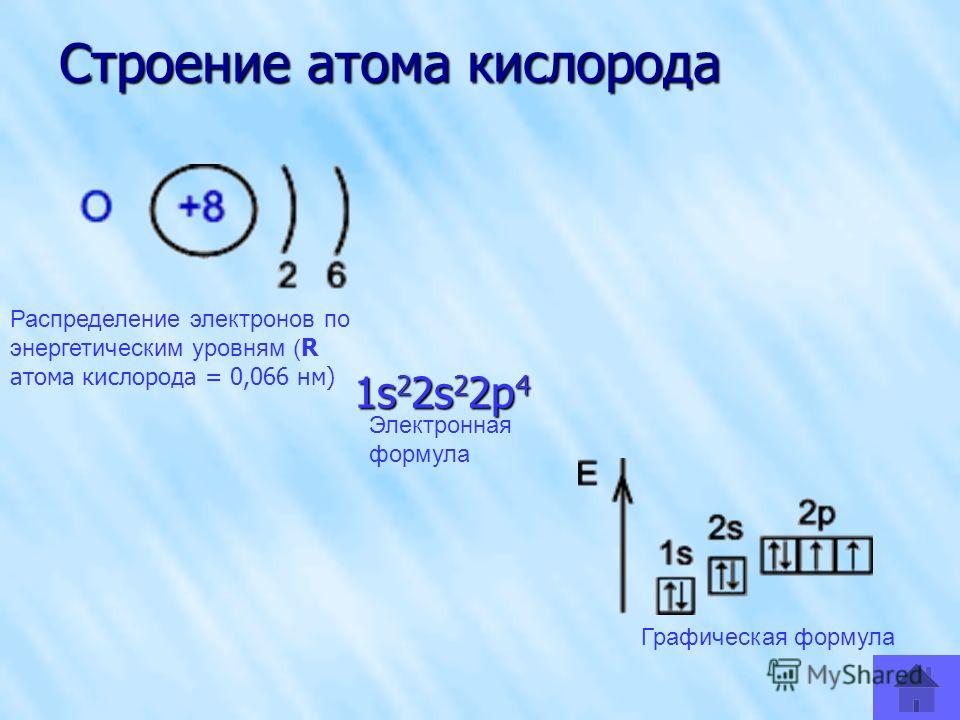
На рис. 2 схематически изображено строение атомов водорода, гелия и лития. Атом самого легкого элемента — водорода состоит из двух частиц. Вокруг ядра вращается один электрон. Вокруг ядра гелия вращаются уже два электрона, вокруг ядра лития — три. Чем тяжелее атом, тем сложнее его строение.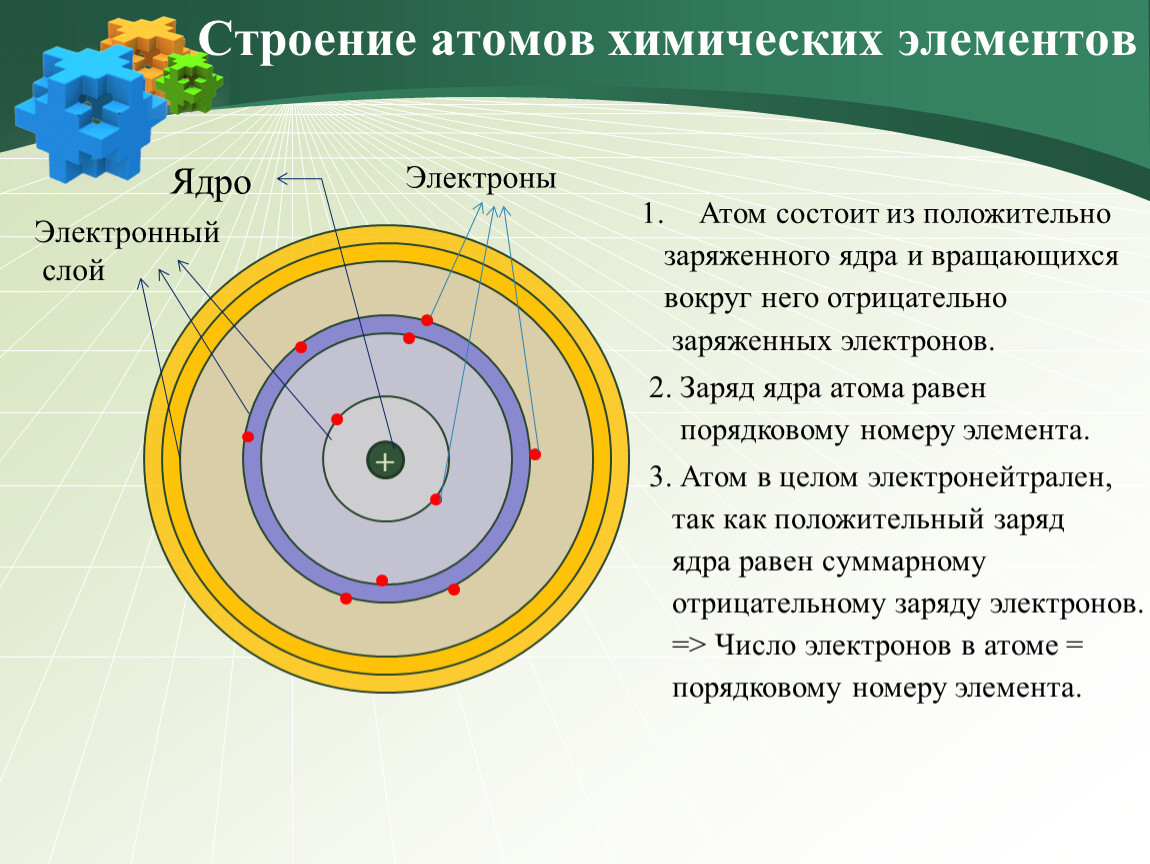 Например, кислород, занимающий восьмое место в периодической системе элементов, имеет восемь электронов два из них вращаются на /С-оболочке, остальные шесть— на -оболочке. Конечно, приведенные модели атомов отражают их строение весьма схематично. На самом деле прост- [c.18]
Например, кислород, занимающий восьмое место в периодической системе элементов, имеет восемь электронов два из них вращаются на /С-оболочке, остальные шесть— на -оболочке. Конечно, приведенные модели атомов отражают их строение весьма схематично. На самом деле прост- [c.18]
Периодический закон был гениальным обобщением всего накопленного в химии материала. Химия превратилась из сборища разрозненных рецептурных данных в единую научную систему. Периодическая система побуждала к заключению о генетическом единстве элементов, ставила вопрос о едином принципе строения атомов и, следовательно, о делимости самого атома. Однако этой мысли Менделеев не разде тял. В его время еще безраздельно господствовало представление, что атом неделим, хотя уж давно раздавались отдельные голоса о сложности атомной структуры химических элементов. Эту идею защищал еще в 1811 году известный химик П р о у т. Твердое убеждение о делимости атома высказывал выдающийся русский химик А.
 М. Бутлеров (1886 г.). Однако в те времена не было никаких фактов, которые подтверждали бы эту мысль. И только к концу XIX века были получены данные о сложном строении атома. [c.37]
М. Бутлеров (1886 г.). Однако в те времена не было никаких фактов, которые подтверждали бы эту мысль. И только к концу XIX века были получены данные о сложном строении атома. [c.37]В дальнейшем понятие химического элемента получило уточнение в соответствии с современным учением о строении атомов. Как известно, атом является сложной системой, состоящей из положительно заряженного ядра и электронной оболочки — совокупности элементарных отрицательно заряженных частиц — электронов. Ядро [c.6]
На грани XIX и XX столетий свершилась революция в естествознании. Атом оказался сложной системой. В сложности атома Я. И. Михайленко усмотрел то принципиально новое, что должно революционизировать химическую науку и привести к более глубокому проникновению в тайны строения вещества. Я. И. Михайленко принялся за разработку новых методов преподавания химии на ее электронном этапе развития. [c.4]
Строение атома. Окружающий нас мир построен из разнообразных химических элементов.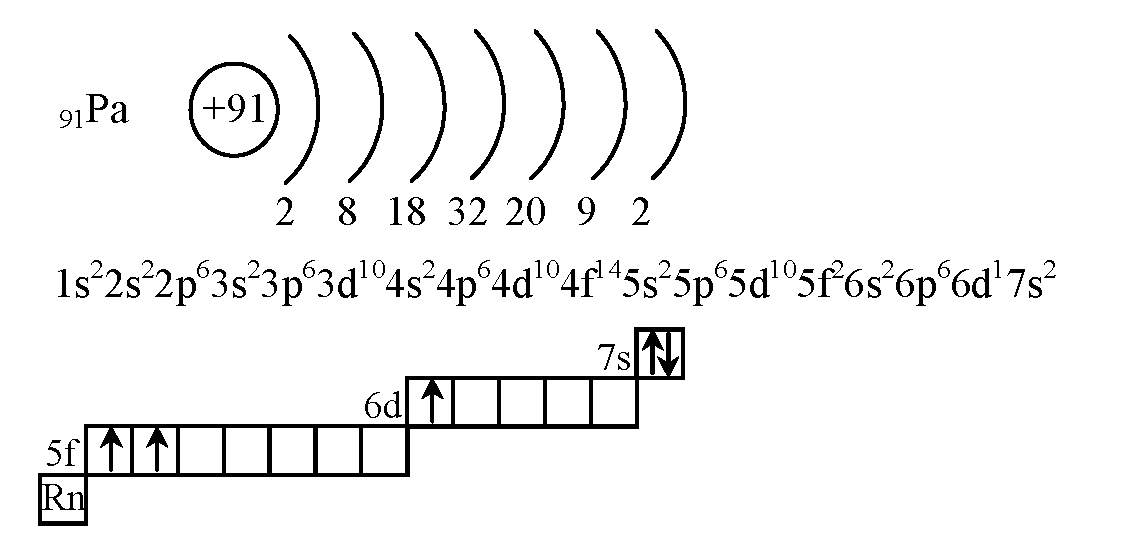 Наименьшей материальной частицей, являющейся носителем индивидуальных химических свойств данного элемента, является атом—сложная система, состоящая из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов. Размеры атома исчисляются стомиллионными долями сантиметра (Ю см), а размеры атомного ядра—в 10 ООО—100 ООО раз меньше. [c.9]
Наименьшей материальной частицей, являющейся носителем индивидуальных химических свойств данного элемента, является атом—сложная система, состоящая из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов. Размеры атома исчисляются стомиллионными долями сантиметра (Ю см), а размеры атомного ядра—в 10 ООО—100 ООО раз меньше. [c.9]
Мысль о том, что атом есть сложная система, впервые отчетливо прозвучала в высказываниях профессора Московского университетам. Г. Павлова, которые по тому времени не могли быть подтверждены опытами. В 1819,т. Павлов развил материалистическую в своей основе теорию строения вещества, согласно которой а) в природе доминирует движение, абсолютного покоя нет б) свет имеет электрическую природу в) все вещества образовались из первичной материи г) материя связана в своем строении с электрическим зарядом и состоит из разноименно заряженных начал (полюсов) д) элементы имеют планетарное строение. [c. 106]
106]
Результаты многих научных исследований доказали, что атом является сложной системой, в состав которой входят элементарные частицы. Созданы модели строения атома. [c.353]
ЭЛЕКТРОННАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА. АТОМ КАК СЛОЖНАЯ СИСТЕМА [c.53]
Современная химия установила, что и атом не предел делимости. Атом сам состоит из еще более простых частиц. Эти элементарные частицы названы протонами, нейтронами, электронами. Протоны и нейтроны составляют ядро атома, а вокруг ядра вращаются электроны. Например, атом водорода состоит из одного протона, вокруг которого двигается один электрон. Атом второго элемента из периодической системы элементов Д. И. Менделеева — гелия, сложнее, атом его состоит из 2 протонов, из 2 нейтронов и из 2 электронов. Атом углерода еще сложней. Ядро его состоит из 6 протонов,, из 6 нейтронов, вокруг ядра двигается 6 электронов. Последний элемент таблицы уран имеет очень сложное строение. Ядро его состоит из 92 протонов, 146 нейтронов и двигающихся вокруг ядра 92 электронов. [c.12]
Ядро его состоит из 92 протонов, 146 нейтронов и двигающихся вокруг ядра 92 электронов. [c.12]
Атомы. Последним известным в настоящее время пределом делимости вещества являются элементарные частицы — протоны, нейтроны и др. За последние десятилетия благодаря появлению мощных ускорителей и тщательному исследованию состава космических лучей стало известно около 200 элементарных частиц. Теперь ставится вопрос об их (строении в связи с этим вместо термина элементарные частицы иногда пользуются выражением фундаментальные частицы . Атомами называются наиболее простые электрически нейтральные системы, состоящие из элементарных частиц. Более сложные системы — молекулы— состоят из нескольких атомов. Химикам приходится иметь дело с атомами, образующим вещества, — атомами химических элементов они представляют наименьшие частицы химических элементов, являющиеся носителями их химических свойств. Атом химического элемента состоит з положительного ядра, содержащего протоны и нейтроны, и движущихся вокруг ядра электронов . Многие из этих атомов устойчивы, они могут существовать сколь угодно долго. Известно также больщое число радиоактивных атомов, которые спустя некоторое время превращаются в другие атомы в результате изменений, происходящих в ядре. [c.5]
Многие из этих атомов устойчивы, они могут существовать сколь угодно долго. Известно также больщое число радиоактивных атомов, которые спустя некоторое время превращаются в другие атомы в результате изменений, происходящих в ядре. [c.5]
Электронная теория строения атома. Атом как сложная система [c.30]
Валентность элементов зависит от строения их атомов. Согласно данным современной науки, атомы представляют собой сложные системы. Б центре атома находится ядро, имеющ,ее положительные электрические заряды. Вокруг ядра вращаются электроны (наименьшие частицы отрицательного электричества). Число положительных зарядов ядра равно числу отрицательно заряженных электронов атома. Поэтому атом в целом является электронейтраль-ным. Электроны располагаются вокруг ядра слоями, причем во внешнем слое не бывает больше 8 электронов. [c.50]
В результате последовательного развития представлений о строении атома ученые пришли к неопровержимому выводу, что атом — сложная, в целом электроней-тральная система, несколько напоминающая планетную, а именно состоящая из положительно заряженного ядра [c. 161]
161]
Несмотря на большой успех в объяснении спектров атом( в водорода, теория Бора оказалась не в состоянии объяснить спектры других атомов. Это побудило к созданию более общей квантовой теории, которая могла бы быть применена к различным сложным системам столь же успешно, как теория Бора для водорода. Дальнейшие исследования строения электронных оболочек атомов и характера взаимодействия электронов привели к рождению квантовой механики, которая позволяет успешно изучать системы, состоящие из микрочастиц. В отличие от классической механики, исследующей законы движения тел с большими массами, квантовая механика является механикой частиц малых масс. Хотя математический аппарат квантовой механики довольно сложен, а ее некоторые постулаты абстрактны, это не помешало бурному развитию квантовой теории строения вещества и привело к настолько важным практическим решениям, значение которых трудно переоценить. [c.16]
В XIX в. атомистика утвердилась и в физике в середине века была разработана атомно-молекулярная теория строения вещества, а в конце века открыты электрон и радиоактивность. Атом оказался вполне реальной и к тому же сложной системой, изучение которой привело в начале XX в. к революции в физике, а в его середине — к новой научно-технической революции. Так, на примере физики и химии было доказано, что атомистика, т. е. изучение природных процессов с точки зрения судьбы атомов в них, является мощным средством познания природы. [c.7]
Атом оказался вполне реальной и к тому же сложной системой, изучение которой привело в начале XX в. к революции в физике, а в его середине — к новой научно-технической революции. Так, на примере физики и химии было доказано, что атомистика, т. е. изучение природных процессов с точки зрения судьбы атомов в них, является мощным средством познания природы. [c.7]
Особый интерес представляет позиция английского химика Праута. Его теория о сложном составе атомов простых веществ, так называемая водородная гипотеза строения элементарных атомов, широко известна, но в то же время мало известно, что система атомных и молекулярных весов Праута опиралась на объемный метод. Плотность веществ в газообразном состоянии служила для него основой при определении атомных и молекулярных весов. Праут, как и Берцелиус, считал атом и объем однозначными. Но в отличие от Берцелиуса он принимал, что 2 объема водорода соответствуют одному атому. В связи с этим атомный вес кислорода равнялся 8, а молекулярные веса всех сложных веществ в газообразном состоянии соответствовали их плотности по водороду короче говоря, они соответствовали молекулярным весам Авогадро, принимавшим Н = 0,5 [44]. Интересно, что сам Авогадро причислял Праута к сторонникам своей гипотезы. [c.53]
Интересно, что сам Авогадро причислял Праута к сторонникам своей гипотезы. [c.53]
Сделаем теперь уже смелее прежний вывод по месту элемента в системе можно во всех подробностях изобразить строение его электронной оболочки. Это ли не парадоксально, если учесть, что, создавая систему, Менделеев смотрел на атом как на мельчайшую простую частицу вещества И тем не менее, благодаря подсознательному диалектико-материалистическому подходу к поставленной им перед собой задаче, он создал сис-те.му, действительно отображающую великий и сложный закон развития материи. [c.129]
Но уже в XIX в. многие крупнейшие ученые придерживались мнения о сложности структуры атомов. Созданная Менделеевым периодическая система давала хотя и косвенное, но убедительное указание на сложность строения атомов, на наличие внутри них таких структурных особенностей, которые периодически повторяются в рядах элементов. Менделеев прямо говорит о том, что атомы простых тел суть сложные вещества, образованные сложением некоторых, еще меньших частей, что называемое нами неделимым (атом) неделимо только обычными химическими силами . [c.36]
Менделеев прямо говорит о том, что атомы простых тел суть сложные вещества, образованные сложением некоторых, еще меньших частей, что называемое нами неделимым (атом) неделимо только обычными химическими силами . [c.36]
Впоследствии было показано (Г. Си бор г. Актинидные элементы. М., Атом-издат, 1960), что строение периодической системы элементов сложнее. Химические свойства элементов закономерно меняются с изменением электронной оболочки атома, и хотя уран имеет шести валентные соединения, он принадлежит не к VI группе, а к группе тяжелых редкоземельных элементов, аналогов группы элементов от лантана до лютеция. [c.8]
Уравнение Шредингера является основой всей квантовой механики. Однако решение этого уравнения связано с некоторыми трудностями. Как видно, уравнение Шредингера представляет собой дифференциальное уравнение второго порядка. Его решение, т. е. нахождение такой функции г)), которая в данном случае описывает движение электрона в атоме (молекуле), возможно только в простейших случаях. Примером таких простейших систем является атом водорода (один электрон движется в поле одного протона), водородоподобные ионы (He” ” и т. п.) и ион (электрон движется в поле двух протонов). В остальных случаях, вследствие необходимости учета взаимодействия всех частиц системы, уравнение Шредингера принимает настолько сложный вид, что его решение невозможно даже с помощью современной мощной вычислительной техники. Поэтому в квантовомеханических расчетах, как правило, прибегают к различным упрощениям, в результате чего получают уравнения, математическое решение которых уже возможно. Таким образом, создаются приближенные квантовомеханические теории строения атомов и молекул. Характер этих теорий и границы их применения зависят от характера допущенных упрощений. [c.79]
Примером таких простейших систем является атом водорода (один электрон движется в поле одного протона), водородоподобные ионы (He” ” и т. п.) и ион (электрон движется в поле двух протонов). В остальных случаях, вследствие необходимости учета взаимодействия всех частиц системы, уравнение Шредингера принимает настолько сложный вид, что его решение невозможно даже с помощью современной мощной вычислительной техники. Поэтому в квантовомеханических расчетах, как правило, прибегают к различным упрощениям, в результате чего получают уравнения, математическое решение которых уже возможно. Таким образом, создаются приближенные квантовомеханические теории строения атомов и молекул. Характер этих теорий и границы их применения зависят от характера допущенных упрощений. [c.79]
Такие понятия, как конфигурация и терм, являются характеристиками электронного строения молекулы, они неприменимы в строгом смысле к описанию состояния отдельных атомов в составе молекулы. Тем не менее с использованием соображений симметрии удается для некоторых молекул установить примерное строение электронной оболочки атома в составе молекулы. Хорошо известным примером в этом отношении может служить молекула метана, в которой, как это впервые показал Л. Полинг, эффективная конфигурация атома углерода есть Этот вопрос обсуждается, как правило, в литературе весьма подробно, см. [17], [8], [12], [20]. Рассмотрим подобную задачу на примере более сложной системы — комплекса №Уг, где в качестве У может быть взят атом кислорода. Симметрия комплекса предполагается Сзу Атомы переходных элементов имеют малую энергию возбуждения. Для атома N1 (см. гл. 3, 6) разность полных энергий АЕ = Е Зс 4х) — ( F, 3 4х ) составляет всего лишь 205 см” = 0,03 зВ. При столь незначительной величине АЕ орбитальные энергии 4s и Зй -злект-ронов претерпевают тем не менее существенные изменения. Например, для основного в конфигурации с F-тepмa = -0,70693, 45 = = -0,27624, в то время как для терма -0,45730 и = -0,23576. [c.218]
Результаты исследования в процессе полимеризации этилена активности каталитических систем с соединениями ванадия различного строения представлены в табл. 3.5. Все указанные в табл. 3.5 соединения ванадия достаточно активны. Соединения, в которых атом ванадия связан с более сложными лигандами, чем ОС2Н5, являются более термостабильными полимеризация этилена при 70 °С протекает с достаточно высоким выходом полимера, в 2— 4 раза превышающим выход на системах с УО(ОС2Н5)з или УОСЬ. Однако все соединения ванадия со сложными лигандами хелатного типа плохо растворимы или совсем нерастворимы в предельных углеводородах. Для введения в реакционную среду их необходимо предварительно растворить в бензоле. Образующийся при взаимодействии с алкилами алюминия каталитический комплекс, как правило, также совсем не растворяется или плохо растворяется в предельных углеводородах. [c.117]
Электронное строение и типы связей элементов периодической системы – ключ к пониманию Сфуктуры и свойств простых и сложных веществ, образованных эти.ми элементами Два или более атомов располагаются друг около друга так, как это энергетически выгодно. Это справедливо независимо от того, сильно или слабо связана фуппа атомов, содержит эта фуппа лишь несколько или 10 атомов, является расположение атомов упорядоченным (как в кристалле) или неупорядоченным (как в жидкости). Группа ато.мов устойчива тогда и только тогда, когда энергия атомов, расположенных вместе, ниже, чем у отдельных атомов. Единственной физической причиной конкретной кристаллической сфуктуры любого элемента и его модификаций является перекрытие валентных и подвалентных оболочек его атомов, приводящее к образованшо определенных межатомных связей. Число протяженность и симмефия орбиталей атомов данного конкретного элемента полностью определяют число, длину, ориентиров и энергию межатомных связей, образующихся в результате перекрытия этих орбита-лей, а следовательно, размещение атомов в пространстве, т е. кристаллическую структуру, основные физико-химические свойства элемента. [c.30]
О К И С Л Ы, оксиды — соединения хим. элементов с кислородом. В виде воды, горных пород, руд и др. известны с древнейших времен, однако их строение и состав впервые объяснил в 1770—80 франц. химик А.-Л. Лавуазье (он же дал и название). Общее число О., каждый из к-рых содержит только один элемент, больше числа элементов в периодической сист.еме элементов (некоторые элементы образуют несколько окислов) и составляет 185—200. Число двойных и более сложных О. достигает нескольких тысяч. Если элемент образует с кислородом несколько О., то низший по содержанию кислорода наз. закисью, а высший — перекисью. Иногда О. классифицируют по числу атомов кислорода на один атом металла (напр., TiO — моноокись, T12O3 или TiOj 5 — полуторная окись и TiOa — двуокись титана, WO3 — трехокись вольфрама). По хим. св-вам О. подразделяют на о с -н б в н ы е, образованные элементами I, II и III главных подгрупп периодической системы (к ним относятся также низшие О. большинства ме- [c.103]
Приведенные на рис. 2,6 спектры ароматических сульфидов 5—7 с фенильным кольцом, присоединенным к атому серы, имеют интенсивную сложную полосу поглощения с максимумом в области 250—260 нм. Наличие этой полосы ряд авторов [70] связывает с наложением полосы бензоидного перехода типа Вг и полосы, обусловленной сопряжением серы и я-электронной системы бензола. Установлено, что в алкилфенил-сульфидах очень существенны спектральные эффекты, обусловленные изгибом плоскости молекулы за счет особенностей строения алкильных заместителей и их положения в бензольном кольце [79]. Стерические препятствия сопряжению неподеленной пары электронов атома серы и я-электронов бензольного кольца, возникающие за счет орто-заместите-ля, можно обнаружить в молекуле децил-о-толилсульфида, что проявляется в заметном гипсохромном сдвиге ее максимума поглощения 6 относительно максимума поглощения в спектре пропилпаратолилсульфида 7. Интересно сопоставить спектры поглощения дифенилсульфида 8 и ди- фенилоксида [82]. Характер спектра 8 указывает на наличие значительного сопряжения вдоль всей молекулы, что следует из существенного отличия этого спектра от спектра тиоанизола или фенилпропилсульфи-да 5. С другой стороны, спектр дифенилоксида подобен спектру анизола. Отсюда можно заключить, что в отличие от молекулы дифенилоксида, являющейся некопланарной (фенильные кольца в ней расположены во взаимно перпендикулярных плоскостях [82], молекуле дифенилсульфида [c.191]
Витамин В12 отличается от всех остальных витаминов не только сложностью своего строения, но и тем, что он содержит важный для орг изма микроэлемент кобальт. Производное витамина 6 2, которое обычно получают при его выделении, называется цианкобалами-ном, так как в нем содержится цианогруппа, связанная с атомом кобальта. Сложная корриновая циклическая система витамина В г (рис. 10-15), с которой координационно связан атом кобальта, по химич ескому строению сходна с пор- [c.287]
Планетарная теория строения атомов. Резерфордовская нуклеарная модель атома для химиков не могла представить особого интереса. Она была еще слишком обща, слишком обезличена. Из того, что по сравнению с атомом аргона атом калия содержит лишнюю единицу положительного заряда в ядре и лишний электрон в электронной оболочке, никак не вытекал столь резкий скачок в свойствах между этими двумя элементами. Но исследование атома на нуклеарной модели атома не остановилось. Нуклеарная теория атома развилась в планетарную теорию. Что атом, есть нечто очень сложное, легко было заключить уже из крайней сложности спектров элементов искровой спектр железа заключает, например, в себе тысячи линий. Опираясь на теорию испускания световой энергии малыми, но конечными порциями — квантами, а также используя метод аналогии с коперниковой теорией солнечной системы, Нильс Бор создал планетарную теорию строения атомов. [c.78]
Ароматические гетероциклы (пиридин, пиррол, тиофен, фуран и др.) по геометрическому строению аналогичны бензольным ядрам это плоские системы, которые при наличии боковых цепей или при включении в сложные полициклические структуры могут проявлять совершенно такие же конфигурационные и конформационные особенности, как ароматические соединения. Так, например, стоящие у гетероциклических ядер заместители могут находиться в разных конформациях. В качестве примера приведем результаты изучения конформаций Л/-алкил-2-фор-милпирролов. Наиболее выгодны здесь две конформации (15) и (16), в которых кольцо и связь С=0 расположены в одной плоскости и между ними имеется сопряжение. Методами ЯМР- и ИК-спектроскопии показано, что предпочтительна конформация (15), в которой атом кислорода карбонильной группы повернут в сторону гетероатома цикла. [c.308]
«Вещество на 99% состоит из пустоты» / Хабр
При обсуждении строения атома и вещества часто можно прочитать, что вещество на 99.99…% состоит из пустоты, с разными версиями количества девяток. Как мы сейчас увидим, это утверждение имеет весьма шаткие основания, а попытки оценить долю пустоты в веществе могут с одинаковым успехом дать любое число от 0 до 100%. Последовательное же рассмотрение вопроса в рамках квантовой механики показывает, что от пустоты вещество отличается довольно сильно.
Традиционная линия рассуждений
(*)выглядит так: в атоме, имеющем размер около одного ангстрема (10
–10метра), электроны вращаются вокруг ядра, размер которого в 100 000 раз меньше (около 10
–15метра). Размер самого электрона равен нулю, это точечная частица
(**), поэтому атом оказывается практически пустым: в нем «непустое» лишь ядро. Чтобы получить долю объема атома, занимаемого ядром, нужно возвести в куб отношение их размеров. Получаем, что ядро занимает 10
–15объема атома, остальную долю объема — это 99.99…% с 13 девятками после запятой — занимает пустота.
Если атом растянуть до размеров футбольного поля, то ядро будет величиной с маковое зернышко.
Что не так в этих рассуждениях? Давайте продолжим ту же логику, рассматривая уже не атом, а его ядро. Мы считали атомное ядро непустым, но ведь оно состоит из протонов и нейтронов, которые, в свою очередь, состоят из фундаментальных частиц — кварков и глюонов(***). По современным представлениям, кварки и глюоны тоже являются точечными частицами, как и электрон. Следуя такой же линии рассуждений, как и в случае атома, получим, что ядро — тоже пустота, в которой летают частицы нулевых размеров. Итог: вещество ровно на 100% состоит из пустоты. Эта линия рассуждений завела нас в никуда.
Квантовая механика говорит нам, что электрон в атоме является не маленьким шариком, летающим по орбите вокруг ядра, а размазан по пространству в виде вероятностного облака, называемого орбиталью. Плотность этого облака, или просто электронная плотность
, зависит от координаты
. Эта зависимость своя для каждой орбитали, тем не менее, есть общая закономерность:
заметно отлична от нуля в области пространства размерами порядка ангстрема, а на больших расстояниях от ядра экспоненциально убывает.
Типичное поведение электронной плотности в атоме для разных электронных орбиталей. Источник.
Отсюда берется характерный размер атома в один ангстрем, использованный выше при сравнении размеров атома и ядра. Какой же количественный ответ на вопрос о доле пустоты в веществе может дать нам квантовая механика? Для этого нужно оценить суммарный объем, занимаемый электронными орбиталями всех атомов. А для этого, в свою очередь, следует провести четкую границу между атомом и окружающей его пустотой. Но как это сделать? Формально электронная плотность , хоть и стремится к нулю при удалении от ядра, никогда в ноль не обращается, поэтому каждая атомная орбиталь заполняет если не всю Вселенную, то, как минимум, весь объем рассматриваемого куска вещества. В этом случае получается, что пустоты в веществе нет — в любой точке есть отличная от нуля вероятность найти электрон.
Можно определить границу атома как место, где электронная плотность достигает 1/2 от максимальной. Или 1/15 — такая граница будет отстоять дальше от ядра. Или как поверхность, внутри которой содержится 1/2 всей суммарной электронной плотности. Можно ухватить и больше объема, проведя поверхность, внутрь которой попадает, например, 9/10 всей плотности.
Плотность электронного облака для орбитали в атоме водорода (показана белым цветом) и разные варианты проведения условной границы атома.
Как видим, по-разному проводя условные границы атомов, можно получать разные величины занимаемого ими объема. Поэтому и для доли пустоты в веществе можно получить любой ответ от 0 до 100%. Например, в этом видео доля пустоты оценивается как 90%. Почему именно 90, а не 80 или 95? Видимо, автор взял какой-то «стандартный» размер атома в районе одного ангстрема.
Хотя для точного определения границ атома поверхности равной электронной плотности и не годятся, они удобны, когда нужно наглядно изобразить структуру вещества на микроуровне. По форме этих поверхностей можно судить о структуре молекулярных орбиталей и химических связей.
Пример поверхности (она зеленая и полупрозрачная), на которой электронная плотность в кристалле принимает постоянное значение. Источник.
А так выглядят поверхности постоянной плотности в некоторых белках. Источник.
Даже если вещество от пустоты нельзя четко отделить, можно ли хотя бы ответить на вопрос, чем вообще, с точки зрения квантовой теории, вещество отличается от пустого пространства? Для ответа обратимся к квантовой теории поля, изучающей системы многих частиц и вакуум. В этой теории любое состояние системы (точнее, квантованного поля), в которой может находиться 0, 1, 2 и т.д. частиц, характеризуется вектором, длина которого равна единице.
ПодробнееКаждый вектор
можно задать его проекциями
на координатные оси, число которых равно размерности пространства
:
. Квантовые системы описываются векторами в бесконечномерном пространстве, то есть такими векторами, число проекций которого бесконечно:
. Сами же проекции
в квантовой механике являются комплексными числами, это обстоятельство важно при описании явлений интерференции.
Если в системе нет ни одной частицы (пустота), ее состояние называют вакуумом, и соответствующий вектор принято обозначать как
. Атом с одним электроном на любой орбитали — это состояние системы с одной частицей, вектор которого можно обозначить как
. Насколько отличаются эти два состояния друг от друга? Существуют разные способы описания «расстояния» между векторами, наиболее простой и часто используемый
(****)— посчитать длину разности векторов
. Можно показать, что векторы
и
взаимно перпендикулярны, это обычная ситуация для существенно отличающихся друг от друга квантовых состояний. Выходит, что, с точки зрения квантовой теории поля, «расстояние» между пустотой и электроном, находящимся на атомной орбитали, равно
.
Два взаимно перпендикулярных вектора состояния — вакуум и один электрон на атомной орбитали, — и расстояние между ними.
Получаемый ответ — что вещество всегда радикально отличается от пустоты, даже если содержит одну частицу на кубический километр, — не очень удовлетворителен, потому что из него начисто выпадает распределение вещества в пространстве. Можно ли ввести меру отличия вещества от пустоты, показывающую, насколько сильно они отличаются не в целом, а локально, в каждой точке ? Да, такую меру найти можно, и ей является не что иное как электронная плотность . Там, где электронная плотность спадает до предельно малых значений, отличие вещества от пустоты также становится несущественным.
Пара формулЭто можно понять, если учесть, что квадрат расстояния
представляется в виде:
где
— волновая функция многоэлектронной системы,
— число электронов. Как видим, квадрат расстояния складывается из двух частей: одна из них равна единице, другая набегает за счет интеграла от электронной плотности по пространству.
Линии равных электронных плотностей в кристалле Na2GeS3. Чем дальше от атомных ядер, тем ниже плотность, и тем ближе пустота. Источник.
Итак, мы видим, что:
- Если рассуждать в духе «в атоме непустым является лишь ядро», то придется признать, что вещество — ровно на 100% пустота, потому что ядро — это такой же пустой «атом», только состоящий из других частиц.
- В квантовой механике электронные оболочки атомов размазаны в пространстве, и невозможно точно сказать, где кончается атом и начинается окружающее его пустое пространство. Как следствие, нельзя и точно сказать, какова доля пустоты в веществе — с одинаковым успехом можно взять любое число от 0 до 100%.
- С точки зрения квантовой теории поля, вещество даже с одним электроном существенно отличается от вакуума — эти два квантовых состояния представляются взаимно перпендикулярными векторами, расстояние между которыми равно .
- Однако можно, в каком-то смысле, ввести меру отличия вещества от вакуума не в целом, а локально, в каждой точке пространства. Этой мерой является электронная плотность . К сожалению, электронная плотность — размерная величина, она имеет размерность м–3, и поэтому не дает нам ответа на вопрос «на сколько процентов вещество вот в этой точке отличается от пустоты». С ее помощью можно лишь судить о том, где вещество сильнее отличается от пустоты, а где слабее. Вблизи центров атомов максимальна, там вещество отличается от пустоты сильнее всего, а на больших расстояниях от атомов она очень быстро убывает, и отличие вещества от пустоты становится несущественным.
(*)Вот примеры такого рода рассуждений, в которых, впрочем, соотношение размеров атома и ядра иногда преувеличивают в миллионы раз:
• www.popmech.ru/science/10566-zhizn-v-pustote-kvantovoe-osoznanie
• www.yaplakal.com/forum7/topic1503279.html
• pikabu.ru/story/tyi_nichto_561687
• thequestion.ru/questions/10102/atom-sostoit-iz-pustoty-vsyo-materialnoe-sostoit-iz-atomov-kak-materialnoe-mozhet-sostoyat-iz-pustoty
(**)По крайней мере, эксперименты на Большом электрон-позитронном коллайдере показали, что размер электрона не превышает 10–19 м. Более поздние сверхточные измерения магнитного момента электрона дали верхнюю оценку размера электрона, равную 10–20 м. Эти оценки показывают, что электрон, как минимум, в десятки тысяч раз меньше ядра.
(***)Интересный факт: три кварка, из которых состоит протон, дают лишь менее 2% его массы. Остальная часть массы — это виртуальные частицы (кварки и глюоны), возникающие в результате взаимодействия трех исходных кварков. Этих частиц так много, что они образуют целое «море», и поэтому называются «морскими» кварками и глюонами.
(****)В случае двух чистых квантовых состояний и такие меры расстояния между ними, как метрика Гильберта-Шмидта и метрика Фубини-Штуди, сводятся именно к длине вектора .
3 Строение атома – СтудИзба
Строение атома
Установлено, что существует тесная связь между положением химических элементов в таблице Менделеева и строением атомов этих элементов.
Количество протонов в ядре (р) атома данного элемента числено совпадает с порядковым номером элемента (z).
Количество нейтронов (n) в ядре атома элемента равно разности между атомным весом (А) элемента (округленным до целого значения) и его порядковым номером в таблице Менделеева
n= A-z
Количество электронов в атоме данного элемента числено равно порядковому номеру элемента.
Так, например, золото имеет порядковый номер 79. Значит, в ядре его атома находится 79 протонов, а вокруг ядра движутся 79 электронов, что обеспечивает электронейтральность атома. Атомный вес золота равен 196.9655, или округленно 197. Следовательно, в ядре атома золота содержится 197-79=118 нейтронов.
Электроны в атомах располагаются на определенных энергетических уровнях.
Рекомендуемые файлы
Количество энергетических уровней электронов в атоме данного элемента числено равно периоду таблицы Менделеева этого элемента.
Так, золото находится в 6 периоде, следовательно, 79 электронов атома золота располагаются на 6 уровнях.
Максимальное число электронов, которое может располагаться в атоме на любом уровне, определяется его номером n и равно 2n2.
Так, в атоме золота на первом (n=1, ближайшем к ядру) уровне может находиться не более 2 электронов, на втором (n=2) – не более 8 электронов, на третьем (n=3)- не более 18 электронов, на четвертом (n=4) -не более 32 электронов и т.д. Электронное строение атома золота выглядит таким образом (79 электронов располагаются на 6 уровнях)
79Au 2,8,18,32,18,1
Для элементов, находящихся в главной подгруппе таблицы Менделеева, число электронов, вращающихся на внешнем (самом удаленном от ядра) уровне, числено равно номеру группы. Номер группы данного элемента в таблице Менделеева характеризует максимально возможную валентность данного элемента в его соединениях с другими элементами. Следовательно, максимально возможная валентность элемента главной подгруппы определяется числом электронов на внешнем энергетическом уровне. Поэтому такие электроны называют валентными электронами. Для элементов побочной подгруппы это правило не всегда соблюдается (например, для цинка 30Zn 2,8,18,2 оно соблюдается, а для титана 22Ti 2,8,10,2 -нет).
Опыт показал, что движение электронов в атоме нельзя описать в рамках классической ньютоновской механики, и к 1925-1926 году австрийским ученым Шредингером была разработана квантовая механика. Согласно принципу неопределенности Гейзенберга, невозможно одновременно точно определить местонахождение частицы и ее скорость, поэтому в квантовой механике говорят лишь о вероятности обнаружения электрона в той или иной области пространства. Поэтому под орбитой электрона в атоме (например, в атоме водорода) не следует понимать какую-то траекторию его движения вокруг ядра, как в планетарной модели строения атома
Электрон в атоме как бы размазан в пространстве вокруг ядра с определенной электронной плотностью. Поэтому говорят, что при своем движении в атоме электрон образует электронное облако. С учетом этого простейший атом водорода можно изобразить схемой
Согласно квантовой механике, состояние электронов в атоме (плотность электронного облака) полностью характеризуется волновой функцией Y, которая определяется набором из четырех квантовых чисел:
1. Главным квантовым числом -n, которое определяет дискретный (квантовый) набор разрешенных энергетических уровней энергии электронов. Главное квантовое число может принимать целочисленные положительные значения 1.2.3, и т.д. до бесконечности, т.е. n=1,2,3,….,¥, если количество химических элементов бесконечно. Для любого известного элемента таблицы Менделеева n совпадает с номером периода этого элемента.
Так, для всех элементов первого периода в атоме может быть только один энергетический уровень (n=1), а для всех элементов 7 периода электроны располагаются на 7 энергетических уровнях (n=7).
2. Орбитальным (или побочным) квантовым числом -l (эль), которое определяет величину орбитального момента количества движения электрона. Для каждого значения n побочное квантовое число l может принимать целый набор значений от нуля до n-1: l=0, 1, 2,…, n-1
Так, например,
для n=1 может быть только одно значение l=0;
для n=2 побочное квантовое число может иметь уже два значения: l=0 и 1;
для одного только значения главного квантового числа n побочное квантовое число l может принимать целый набор значений от 0 до n-1 включительно.
3. Магнитное квантовое число m определяет состояние электрона при наложении на атом внешнего магнитного поля. Оно может принимать значения от -l до +l, включая нуль, т.е. m=0,±1,±2,….,±l.
4. Спиновое квантовое число-s. Оно характеризует собственный момент количества движения электрона. Спиновое квантовое число может принимать всего два значения: s=+1/2, -1/2.
Таким образом, состояние электрона в атоме (волновая функция -Y) характеризуется набором четырех квантовых чисел Y(n,l,m,s). Согласно принципу запрета Паули, в любом атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Другими словами электроны в атоме неповторимы.
Состояние электрона, характеризующееся определенным значением главного квантового числа n, принято называть энергетическим уровнем электрона в атоме. Если n=1, то говорят, что электрон находится на первом (ближайшем к ядру атома) энергетическом уровне. При n=2 электроны образуют второй (более удаленный от ядра) энергетический уровень и т.д.. Максимальное количество электронов N, которые могут находиться на энергетическом уровне n равно
N=2n2
Отсюда следует, что на первом энергетическом уровне могут располагаться не более 2 электронов, на втором уровне – не более 8 электронов, на третьем энергетическом уровне не более 18 электронов, на четвертом уровне – не более 32 электронов и т.д.
Волновая функция со значением орбитального квантового числа l=0 называется S-орбиталью, т.е. S-орбиталь – это волновая функция видаY(n,0,m,s). Для каждого значения n существует своя единственная S-орбиталь. Чем выше значение n, тем выше значение энергии для соответствующей S-орбитали. Геометрически S-орбиталь представляет собой сферу
Волновая функция со значением орбитального квантового числа, равным единице (l=1) принято называть р-орбиталью, т.е. р-орбиталь – это волновая функция вида Y(n,1,m,s).
Для каждого значения n существует свои три р-орбитали:
Y(n,1,-1,s), Y(n,1,0,s), Y(n,1,1,s),
поскольку при l=1 магнитное квантовое число может принимать три значения m=
-1,0,1.
Чем выше значение n, тем выше значение энергии для соответствующей p-орбитали. Геометрически p-орбиталь напоминает восьмерку, или гантель, ориентированную вокруг соответствующей оси
Аналогичным образом выглядят рY и pZ– орбитали.
Волновая функция со значением орбитального квантового числа, равным двум (l=2) принято называть d-орбиталью, т.е. d-орбиталь – это волновая функция вида Y(n,2,m,s).
Для каждого значения n существует свои пять d-орбиталей:
Y(n,2,-2,s),Y(n,2,-1,s), Y(n,2,0,s), Y(n,2,1,s), Y(n,2,2,s),
поскольку при l=2 магнитное квантовое число может принимать пять значений m=-2,-1,0,1,2. Чем выше значение n, тем выше значение энергии для соответствующей d-орбитали. Геометрически d-орбиталь напоминает 4-x лепестковый цветок.
Волновая функция со значением орбитального квантового числа, равным трем (l=3) принято называть f-орбиталью, т.е. f-орбиталь – это волновая функция вида Y(n,3,m,s).
Для каждого значения n существует свои семь f-орбиталей:
Y(n,3,-3,s),Y(n,3,-2,s), Y(n,3,-1,s), Y(n,3,0,s), Y(n,3,1,s), Y(n,3,2,s), Y(n,3,3,s),
поскольку при l=3 магнитное квантовое число может принимать семь значений m=-3,-2,-1,0,1,2,3. Чем выше значение n, тем выше значение энергии для соответствующей f-орбитали. Геометрически f-орбиталь имеет еще более сложную конфигурацию. Аналогично вводятся понятия g и h- орбиталей.
Связь между значением l и типом орбитали суммирована в таблице:
значение l 0 1 2 3 4 5
тип орбитали s p d f g h
Энергия электрона в атоме неоднозначно определяется значением главного квантового числа n. Каждому значению n (т.е. каждому значению энергетического уровня) соответствует несколько значений орбитального квантового числа (l), которые называют энергетическими подуровнями. Эти подуровни различаются по энергии. В соответствии с этим говорят об s-подуровне, p-подуровне, d-подуровне и т.д. А электроны, находящиеся на этих подуровнях называют соответственно s-электронами, р-электронами, d-электронами и т.д. По энергии подуровни в атоме возрастают в следующем порядке:
1s<2s<2p<3s<3p<4s»3d<4p<5s»4d<5p<6s»5d»4f<6p
В такой последовательности происходит заполнение электронами энергетических уровней в атоме. Эта последовательность обусловлена действием двух правил Клечковского:
1. Заполнение энергетических подуровней электронами происходит таким образом, чтобы сумма n+l была минимальна, т.е. min(n+l)
2. Если возможны два различных пути заполнения, при которых выполняется 1 правило, то реализуется тот путь, при котором минимально n, min(n).
Так, например, после подуровня 3p в указанной выше последовательности происходит заполнение не подуровня 3d, а подуровня 4s. Действительно, для подуровня 3d n+l=3+2=5, а для 4s n+l=4+0=4, что отвечает 1 правилу Клечковского. Для подуровней 6s, 5d, 4f сумма n+l соответственно равна 6+0, 5+2, 4+3. Для этой последовательности соблюдаются оба правила Клечковского.
Таким образом, в атоме каждому энергетическому уровню соответствует несколько подуровней. Для n>1 число подуровней числено совпадает с n (на втором уровне могут быть только два подуровня, на третьем уровне только три подуровня и т.д.).
Максимальное количество электронов N’, которые могут находиться на подуровне со значением орбитального квантового числа, равного l, определяется уравнением
N’=2(2l + 1)
C учетом этой формулы получается, что каждый тип орбитали характеризуется следующими максимальными числами электронов, которые могут на них располагаться
тип орбитали s p d f g h
максимум электронов 2 6 10 14 18 22
На каждой орбитали располагается не более двух электронов, причем согласно принципу Паули каждая пара электронов в пределах одной и той же орбитали должна иметь антипараллельные спины (т.е. s=1/2 и s=-1/2).
Схему энергетических уровней и подуровней атома для n=3 можно изобразить таким образом
На этом рисунке все подуровни в пределах данных n и l обозначены одним цветом и имеют одинаковую энергию.
Согласно правилу Хунда, устойчивому состоянию электронов в атоме соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина электронов максимально.
До введения понятия энергетического подуровня мы записывали электронную конфигурацию (электронное строение) атомов по энергетическим уровням. Так для атома цинка она имела вид 30Zn 2,8,18,2. Теперь, с учетом представлений о существовании на каждом энергетическом уровне соответствующих подуровней, электронное строение атома цинка можно представить более детально.
Для первого энергетического уровня n=1, l=0, следовательно, возможно существование только s-подуровня, на котором может разместиться не более 2 электронов, что отразим записью 1s2.
На втором энергетическом уровне может быть только два подуровня: s и p, на которых максимальное число электронов равно, соответственно, 2 и 6. Поэтому 8 электронов второго энергетического уровня распределены таким образом: 2s22p6.
Следующие 18 электронов находятся на третьем уровне, на котором должно быть уже три подуровня: s, p и d, на которых максимальное число электронов составляет 2, 6 и 10. Следовательно, электронную конфигурацию третьего 18-электронного уровня можно представить в виде: 3s23p63d10.
Для последнего 4-го уровня могут существовать 4 подуровня: s,p,d,f, на которых может находиться 2, 6, 10 и 14 электронов. Но в атоме цинка на 4 уровне находится всего 2 электрона. Эти два электрона займут самый низший подуровень 4s. Поэтому электронное строение 4 уровня можно записать в виде: 4s2.
Соединив все полученные фрагменты электронного строения по всем уровням, получаем детализированную картину распределения электронов в атоме цинка: 30Zn 1s22s22p63s23p63d104s2.
Таким образом, основные особенности заполнения электронных оболочек атомов в периодической системе следующие:
1. Начало периода совпадает с началом образования нового энергетического уровня электронного слоя.
Период представляет собой последовательный ряд элементов, атомы которых различаются числом электронов в наружных слоях. Каждый период завершается благородным газом. У благородных газов наружная оболочка состоит из 8 электронов, за исключение гелия, у которого на внешней оболочке только 2 электрона.
2. Элементы главных и побочных подгрупп отличаются порядком заполнения электронных оболочек.
У всех элементов главных подгрупп заполняются только внешние оболочки. При этом у элементов I и II групп заполняются s-оболочки, поэтому эти элементы называются s-элементами. А у элементов III-VII групп заполняются p-оболочки, поэтому эти элементы называются р-элементами.
У элементов первых подгрупп (за исключением Mn, Zn, Tc, Ag, Cd, Hg) заполняются внутренние d-оболочки. Такие элементы называются d-элементами.
Элементы, у которых заполняются внутренние f-оболочки, называются f-элементами (лантаноиды и актиноиды).
Заполнение электронных оболочек электронами в таблице Менделеева происходит в согласии с двумя правилами Клечковского.
Ниже представлено электронное строение всех элементов таблицы Менделеева. Элементы, для которых наблюдается эффект проскока электрона с одного подуровня на другой выделены жирным шрифтом.
1 Н 1s1 1 период
2 He 1s2
3 Li 1s22s1 2 период
4 Be 1s22s2
5 B 1s22s22p1
6 C 1s22s22p2
7 N 1s22s22p3
8 O 1s22s22p4
9 F 1s22s22p5
10 Ne 1s22s22p6
11 Na 1s22s22p63s1 3 период
12 Mg 1s22s22p63s2
13 Al 1s22s22p63s23p1
14 Si 1s22s22p63s23p2
15 P 1s22s22p63s23p3
16 S 1s22s22p63s23p4
17 Cl 1s22s22p63s23p5
18 Ar 1s22s22p63s23p6
19 K 1s22s22p63s23p6 3d04s1 4 период
20 Ca 1s22s22p63s23p6 3d0 4s2
21 Sc 1s22s22p63s23p63d1 4s2
22 Ti 1s22s22p63s23p63d2 4s2
23 V 1s22s22p63s23p63d3 4s2
24 Cr 1s22s22p63s23p63d5 4s1 проскок 1 электрона с 4s на 3d
25 Mn 1s22s22p63s23p63d5 4s2
26 Fe 1s22s22p63s23p63d6 4s2
27 Co 1s22s22p63s23p63d7 4s2
28 Ni 1s22s22p63s23p63d8 4s2
29 Cu 1s22s22p63s23p63d10 4s1
30 Zn 1s22s22p63s23p63d10 4s2
31 Ga 1s22s22p63s23p63d10 4s2 4p1
32 Ge 1s22s22p63s23p63d10 4s2 4p2
33 As 1s22s22p63s23p63d10 4s2 4p3
34 Se 1s22s22p63s23p63d10 4s2 4p4
35 Br 1s22s22p63s23p63d10 4s2 4p5
36 Kr 1s22s22p63s23p63d10 4s2 4p6
37 Rb 1s22s22p63s23p63d10 4s2 4p6 4do4f05s1 5 период
38 Sr 1s22s22p63s23p63d10 4s2 4p6 4do4f05s2
39 Y 1s22s22p63s23p63d10 4s2 4p6 4d14f05s2
40 Zr 1s22s22p63s23p63d10 4s2 4p6 4d24f05s2
41 Nb 1s22s22p63s23p63d10 4s2 4p6 4d44f05s1
42 Mo 1s22s22p63s23p63d10 4s2 4p6 4d54f05s1
43 Te 1s22s22p63s23p63d10 4s2 4p6 4d54f05s2
44 Ru 1s22s22p63s23p63d10 4s2 4p6 4d74f05s1
45 Rh 1s22s22p63s23p63d10 4s2 4p6 4d84f05s1
46 Pd 1s22s22p63s23p63d10 4s2 4p6 4d104f05s0
47 Ag 1s22s22p63s23p63d10 4s2 4p6 4d104f05s1
48 Cd 1s22s22p63s23p63d10 4s2 4p6 4d104f05s2
49 In 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p1
50 Sn 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p2
51 Sb 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p3
52 Te 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p4
53 I 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p5
54 Xe 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p6
55 Cs 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p6 5d05f05g06s1 6 период
56 Ba 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p6 5d05f05g06s2
57 La 1s22s22p63s23p63d10 4s2 4p6 4d104f05s25p6 5d15f05g06s2
58 Ce 1s22s22p63s23p63d10 4s2 4p6 4d104f25s25p6 5d05f05g06s2
59 Pr 1s22s22p63s23p63d10 4s2 4p6 4d104f35s25p6 5d05f05g06s2
60 Nd 1s22s22p63s23p63d10 4s2 4p6 4d104f45s25p6 5d05f05g06s2
61 Pm 1s22s22p63s23p63d10 4s2 4p6 4d104f55s25p6 5d05f05g06s2
62 Sm 1s22s22p63s23p63d10 4s2 4p6 4d104f65s25p6 5d05f05g06s2
63 Eu 1s22s22p63s23p63d10 4s2 4p6 4d104f75s25p6 5d05f05g06s2
64 Gd 1s22s22p63s23p63d10 4s2 4p6 4d104f75s25p6 5d15f05g06s2
65 Tb 1s22s22p63s23p63d10 4s2 4p6 4d104f95s25p6 5d05f05g06s2
66 Dy 1s22s22p63s23p63d10 4s2 4p6 4d104f105s25p6 5d05f05g06s2
67 Ho 1s22s22p63s23p63d10 4s2 4p6 4d104f115s25p6 5d05f05g06s2
68 Er 1s22s22p63s23p63d10 4s2 4p6 4d104f125s25p6 5d05f05g06s2
69 Tm 1s22s22p63s23p63d10 4s2 4p6 4d104f135s25p6 5d05f05g06s2
70 Yb 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d05f05g06s2
71 Lu 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d15f05g06s2
72 Hf 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d25f05g06s2
73 Ta 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d35f05g06s2
74 W 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d45f05g06s2
75 Re 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d55f05g06s2
76 Os 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d65f05g06s2
77 Ir 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d75f05g06s2
78 Pt 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d95f05g06s1
79 Au 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s1
80 Hg 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s2
81 Tl 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p1
82 Pb 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p2
83 Bi 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p3
84 Po 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p4
85 At 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p5
86 Rn 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p6
87 Fr 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p6 6d07s1 7 период
88 Ra 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p6 6d07s2
89 Ac 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p6 6d17s2
90 Th 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f05g06s26p6 6d27s2
91Pa 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f25g06s16p6 6d17s2
92 U 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f35g06s26p6 6d17s2
93 Np 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f45g06s26p6 6d17s2
94 Pu 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f65g06s26p6 6d07s2
95 Am 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f75g06s26p6 6d07s2
96 Cm 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f75g06s26p6 6d17s2
97 Bk 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f85g06s26p6 6d17s2
98 Cf 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f105g06s26p6 6d07s2
99 Es 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f115g06s26p6 6d07s2
Вместе с этой лекцией читают “3.2. Внешние признаки рукописей XVII-XIX вв.”.
100 Fm 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f125g06s26p6 6d07s2
101 Md 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f135g06s26p6 6d07s2
102 No 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f145g06s26p6 6d07s2
103 Lr 1s22s22p63s23p63d10 4s2 4p6 4d104f145s25p6 5d105f145g06s26p6 6d17s2
2.2: Структура атома и как мы ее представляем
Развитие современной атомной теории многое раскрыло о внутренней структуре атомов. Стало известно, что атом содержит очень маленькое ядро, состоящее из положительно заряженных протонов и незаряженных нейтронов, окруженное гораздо большим объемом пространства, содержащим отрицательно заряженные электроны. Ядро содержит большую часть массы атома, потому что протоны и нейтроны намного тяжелее электронов, тогда как электроны занимают почти весь объем атома.Диаметр атома составляет порядка 10 −10 м, тогда как диаметр ядра примерно 10 −15 м – примерно в 100 000 раз меньше. Чтобы получить представление об их относительных размерах, рассмотрим следующее: если бы ядро было размером с чернику, атом был бы размером с футбольный стадион (рисунок \ (\ PageIndex {1} \)).
Рисунок \ (\ PageIndex {1} \): Если бы атом можно было расширить до размеров футбольного стадиона, ядро было бы размером с одну чернику.(в середине фото: модификация работы «babyknight» / Wikimedia Commons; право на кредит: изменение работы Паксона Вельбера).
Атомы и составляющие их протоны, нейтроны и электроны чрезвычайно малы. Например, атом углерода весит менее 2 \ (\ times \) 10 −23 г, а электрон имеет заряд менее 2 \ (\ times \) 10 −19 C (кулонов). При описании свойств крошечных объектов, таких как атомы, мы используем соответственно небольшие единицы измерения, такие как атомная единица массы (а.е.м.) и фундаментальная единица заряда (е).Первоначально аму определяли на основе водорода, самого легкого элемента, а затем – кислорода. С 1961 года он был определен в отношении наиболее распространенного изотопа углерода, атомам которого приписываются массы ровно 12 а.е.м. (Этот изотоп известен как углерод-12, как будет обсуждаться позже в этом модуле.) Таким образом, одна а.е.м. составляет ровно \ (1/12 \) массы одного атома углерода-12: 1 а.е.м. = 1,6605 \ ( \ раз \) 10 −24 г. (Дальтон (Да) и единая атомная единица массы (u) являются альтернативными единицами, эквивалентными аму.) Фундаментальная единица заряда (также называемая элементарным зарядом) равна величине заряда электрона (e) с e = 1,602 \ (\ times \) 10 −19 C.
Протон имеет массу 1,0073 а.е.м. и заряд 1+. Нейтрон – это немного более тяжелая частица с массой 1,0087 а.е.м. и нулевым зарядом; как следует из названия, он нейтрален. Электрон имеет заряд 1− и является гораздо более легкой частицей с массой около 0,00055 а.е.м. (потребуется около 1800 электронов, чтобы равняться массе одного протона.Свойства этих фундаментальных частиц сведены в Таблицу \ (\ PageIndex {1} \). (Наблюдательный студент может заметить, что сумма субатомных частиц атома не равна реальной массе атома: общая масса шести протонов, шести нейтронов и шести электронов составляет 12,0993 а.е.м., что немного больше, чем 12,00 а.е.м. реального углерода. 12 атома. Эта «недостающая» масса известна как дефект массы, и вы узнаете об этом в главе, посвященной ядерной химии.)
| Имя | Расположение | Заряд (К) | Стоимость единицы | Масса (а.е.м.) | Масса (г) |
|---|---|---|---|---|---|
| электрон | вне ядра | \ (- 1.{−24} \) |
Число протонов в ядре атома – это его атомный номер (Z). Это определяющая черта элемента: его значение определяет идентичность атома. Например, любой атом, содержащий шесть протонов, является элементом углерода и имеет атомный номер 6, независимо от того, сколько нейтронов или электронов он может иметь. Нейтральный атом должен содержать одинаковое количество положительных и отрицательных зарядов, поэтому количество протонов равно количеству электронов.Следовательно, атомный номер также указывает количество электронов в атоме. Общее количество протонов и нейтронов в атоме называется его массовым числом (А). Таким образом, количество нейтронов – это разница между массовым числом и атомным номером: A – Z = количество нейтронов.
\ [\ begin {align *}
\ ce {atomic \: number \ 🙁 Z) \: & = \: number \: of \: protons \\
mass \: number \ 🙁 A) \: & = \: число \: из \: протонов + число \: из \: нейтронов \\
AZ \: & = \: число \: из \: нейтронов}
\ end {align *} \]
Атомы электрически нейтральны, если они содержат одинаковое количество положительно заряженных протонов и отрицательно заряженных электронов.Когда количество этих субатомных частиц равно , а не , атом электрически заряжен и называется ионом. Заряд атома определяется следующим образом:
Заряд атома = количество протонов – количество электронов
Как будет обсуждаться более подробно позже в этой главе, атомы (и молекулы) обычно приобретают заряд, приобретая или теряя электроны. Атом, который получает один или несколько электронов, будет иметь отрицательный заряд и называется анионом. Положительно заряженные атомы, называемые катионами, образуются, когда атом теряет один или несколько электронов.Например, нейтральный атом натрия (Z = 11) имеет 11 электронов. Если этот атом потеряет один электрон, он станет катионом с зарядом 1+ (11-10 = 1+). Нейтральный атом кислорода (Z = 8) имеет восемь электронов, и если он получит два электрона, он станет анионом с зарядом 2− (8-10 = 2−).
Пример \ (\ PageIndex {1} \): состав атома
Йод – важный микроэлемент в нашем рационе; он необходим для выработки гормона щитовидной железы. Недостаток йода в рационе может привести к развитию зоба, увеличению щитовидной железы (Рисунок \ (\ PageIndex {2} \)).
Рисунок \ (\ PageIndex {2} \): (a) Недостаток йода в рационе может вызвать увеличение щитовидной железы, называемое зобом. (б) Добавление к соли небольшого количества йода, предотвращающего образование зоба, помогло устранить эту проблему в США, где потребление соли велико. (кредит а: модификация работы «Алмази» / Wikimedia Commons; кредит б: модификация работы Майка Моцарта)
Добавление небольшого количества йода к поваренной соли (йодированной соли) по существу устранило эту проблему для здоровья в Соединенных Штатах, но до 40% населения мира по-прежнему подвержены риску дефицита йода.Атомы йода добавляются в виде анионов, и каждый из них имеет заряд 1- и массовое число 127. Определите количество протонов, нейтронов и электронов в одном из этих анионов йода.
Решение
Атомный номер йода (53) говорит нам, что нейтральный атом йода содержит 53 протона в своем ядре и 53 электрона вне ядра. Поскольку сумма числа протонов и нейтронов равна массовому числу 127, число нейтронов равно 74 (127 – 53 = 74).Поскольку йод добавляется в виде аниона 1−, количество электронов равно 54 [53 – (1–) = 54].
Упражнение \ (\ PageIndex {1} \)
Ион платины имеет массовое число 195 и содержит 74 электрона. Сколько протонов и нейтронов он содержит и каков его заряд?
- Ответ
78 протонов; 117 нейтронов; заряд 4+
Химические символы
Химический символ – это сокращение, которое мы используем для обозначения элемента или атома элемента.Например, ртуть обозначается символом Hg (Рисунок \ (\ PageIndex {3} \)). Мы используем один и тот же символ для обозначения одного атома ртути (микроскопический домен) или для обозначения контейнера из многих атомов элемента ртути (макроскопический домен).
Рисунок \ (\ PageIndex {3} \) : символ Hg представляет элемент ртуть независимо от количества; он может представлять один атом ртути или большое количество ртути.
Символы для нескольких общих элементов и их атомов перечислены в Таблице \ (\ PageIndex {2} \).Некоторые символы являются производными от общего имени элемента; другие – это аббревиатуры имени на другом языке. Символы состоят из одной или двух букв, например H для водорода и Cl для хлора. Чтобы избежать путаницы с другими обозначениями, заглавными являются только первые буквы символа. Например, Co – это символ элемента кобальта, а CO – это обозначение соединения монооксида углерода, которое содержит атомы элементов углерода (C) и кислорода (O). Все известные элементы и их символы находятся в периодической таблице.
| Элемент | Обозначение | Элемент | Обозначение |
|---|---|---|---|
| алюминий | Al | утюг | Fe (из железа ) |
| бром | руб. | свинец | Пб (из свинца ) |
| кальций | Ca | магний | мг |
| углерод | С | ртуть | Hg (из гидраргирум ) |
| хлор | Класс | азот | N |
| хром | Cr | кислород | O |
| кобальт | Co | калий | К (из калия ) |
| медь | Cu (из меди ) | кремний | Si |
| фтор | F | серебро | Ag (из argentum ) |
| золото | Au (из aurum ) | натрия | Na (из натрия ) |
| гелий | He | сера | S |
| водород | H | банка | Sn (с олова ) |
| йод | I | цинк | Zn |
Традиционно первооткрыватель (или первооткрыватели) нового элемента дает ему имя.Однако до тех пор, пока название не будет признано Международным союзом теоретической и прикладной химии (IUPAC), рекомендуемое название нового элемента основано на латинских словах, обозначающих его атомный номер. Например, элемент 106 назывался уннилгексием (Unh), элемент 107 назывался unnilseptium (Uns), а элемент 108 назывался уннилоктиум (Uno) в течение нескольких лет. Эти элементы теперь названы в честь ученых или мест; например, элемент 106 теперь известен как seaborgium (Sg) в честь Гленна Сиборга, лауреата Нобелевской премии, который принимал активное участие в открытии нескольких тяжелых элементов.
ИЮПАК
Посетите этот сайт, чтобы узнать больше об ИЮПАК, Международном союзе теоретической и прикладной химии, и изучить его периодическую таблицу.
Структура атомов
В атомную теорию Дальтона внесено несколько незначительных, но важных изменений. Во-первых, Дальтон считал атомы неделимыми. Теперь мы знаем, что атомы не только могут быть разделены, но также состоят из трех разных типов частиц со своими собственными свойствами, отличными от химических свойств атомов.
Субатомные частицы
Первая субатомная частица была идентифицирована в 1897 году и названа электроном. Субатомная частица с отрицательным электрическим зарядом. Это чрезвычайно крошечная частица с массой около 9,109 × 10 -31 кг. Эксперименты с магнитными полями показали, что электрон имеет отрицательный электрический заряд.
К 1920 году экспериментальные данные указали на существование второй частицы. Протон – субатомная частица с положительным зарядом.имеет такой же заряд, что и электрон, но его заряд положительный, а не отрицательный. Еще одно важное различие между протоном и электроном – это масса. Хотя масса протона все еще невероятно мала, она составляет 1,673 × 10 −27 кг, что почти в 2000 раз больше массы электрона. Поскольку противоположные заряды притягиваются друг к другу (в то время как одинаковые заряды отталкиваются), протоны притягивают электроны (и наоборот).
Наконец, дополнительные эксперименты указали на существование третьей частицы.Доказательства, полученные в 1932 году, установили существование нейтрона – субатомной частицы без электрического заряда, частицы с массой примерно такой же, как у протона, но без электрического заряда.
Теперь мы понимаем, что все атомы можно разбить на субатомные частицы: протоны, нейтроны и электроны. В таблице 2.4 «Свойства субатомных частиц» перечислены некоторые из их важных характеристик и символы, используемые для обозначения каждой частицы.
Таблица 2.4 Свойства субатомных частиц
| Частица | Символ | Масса (кг) | Относительная масса (протон = 1) | Относительный заряд |
|---|---|---|---|---|
| протон | п. + | 1,673 × 10 −27 | 1 | +1 |
| нейтрон | п 0 | 1.675 × 10 −27 | 1 | 0 |
| электрон | e – | 9,109 × 10 −31 | 0,00055 | -1 |
Ядро
Как устроены эти субатомные частицы? Между 1909 и 1911 годами Эрнест Резерфорд, кембриджский физик, и его соратники Ханс Гейгер и Эрнест Марсден провели эксперименты, которые предоставили убедительные доказательства внутренней структуры атома.Они взяли очень тонкую металлическую фольгу, такую как золото или платина, и направили пучок положительно заряженных частиц (называемых альфа-частицами, которые представляют собой комбинацию двух протонов и двух нейтронов) от радиоактивного источника к фольге. Фольгу окружал детектор – либо сцинтиллятор (материал, который светится при попадании таких частиц), либо какая-то неэкспонированная пленка (которая обнажается там, где на нее попадают частицы). Детектор позволил ученым определить распределение альфа-частиц после их взаимодействия с фольгой.На рисунке 2.3 «Экспериментальная установка Гейгера-Марсдена» показана схема экспериментальной установки.
Рисунок 2.3 Экспериментальная установка Гейгера-Марсдена
Эксперименты на этой установке были использованы для исследования структуры атомов.
Большинство частиц проходило прямо через фольгу, но некоторые альфа-частицы отклонялись в сторону. Некоторые даже были отклонены назад к источнику. Это было неожиданно. Резерфорд однажды сказал: «Это было почти так же невероятно, как если бы вы выстрелили 15-дюймовым снарядом по куску папиросной бумаги, а он вернулся и попал в вас.”
Резерфорд предложил следующую модель, чтобы объяснить эти экспериментальные результаты. Протоны и нейтроны сосредоточены в центральной области, которую он назвал ядром – центральной частью атома, содержащей протоны и нейтроны. (множественное число, ядер, ) атома. Электроны находятся вне ядра и вращаются вокруг него, потому что их притягивает положительный заряд ядра. Большая часть массы атома находится в ядре, в то время как вращающиеся электроны определяют размер атома.В результате атом состоит в основном из пустого пространства. Резерфорд назвал свое описание «планетарной моделью» атома. Рисунок 2.4 «Эксперименты Резерфорда с металлической фольгой» показывает, как эта модель объясняет экспериментальные результаты.
Рис. 2.4 Эксперименты Резерфорда с металлической фольгой
Резерфорд объяснил результаты экспериментов с металлической фольгой, предположив, что большая часть массы и положительного заряда атома находится в его ядре, в то время как относительно маломассивные электроны вращаются вокруг ядра.Большинство альфа-частиц проходят прямо через пустое пространство, несколько частиц отклоняются, и еще меньшее количество отрикошетит обратно к источнику. Ядро пропорционально намного меньше, чем изображено здесь.
Примечание
Планетарная модель атома заменила модель сливового пудинга, в которой электроны бесцельно плавали, как сливы в «пудинге» положительного заряда.
Модель Резерфорда – это, по сути, та же модель, которую мы используем сегодня для описания атомов, но с одной важной модификацией.Планетарная модель предполагает, что электроны занимают определенные круговые орбиты вокруг ядра. Теперь мы знаем, что эта модель чрезмерно упрощена. Лучшее описание состоит в том, что электроны образуют нечеткие облака вокруг ядер. Рисунок 2.5 «Современное изображение атомной структуры» показывает более современную версию нашего понимания атомной структуры.
Рисунок 2.5 Современное изображение атомной структуры
Более современное понимание атомов, отраженное в этих представлениях электрона в атоме водорода, состоит в том, что электроны занимают области пространства вокруг ядра; они не находятся на дискретных орбитах, как планеты вокруг Солнца.(а) Чем темнее цвет, тем выше вероятность того, что электрон окажется в этой точке. (b) В двумерном поперечном сечении электрона в атоме водорода, чем больше точек, тем выше вероятность того, что электрон окажется в этой точке. И на (а), и на (б) ядро находится в центре диаграммы.
Упражнения по обзору концепций
Каковы заряды и относительные массы трех субатомных частиц?
Опишите структуру атома с помощью протонов, нейтронов и электронов.
ответов
протон: +1, большой; нейтрон: 0, большой; электрон: −1, маленький
Протоны и нейтроны расположены в центральном ядре, а электроны вращаются вокруг ядра.
Основные выводы
- Атомы состоят из трех основных субатомных частиц: протонов, нейтронов и электронов.
- Протоны и нейтроны группируются в ядре атома, а электроны вращаются вокруг ядра.
Упражнения
Что меньше – электрон или атом гелия?
Что больше – протон или атом свинца?
Какая субатомная частица имеет положительный заряд? Какая субатомная частица имеет отрицательный заряд?
Какая субатомная частица электрически нейтральна? Он существует внутри ядра или вне его?
Протоны являются одними из (наиболее, менее) массивных субатомных частиц, и они находятся (внутри и снаружи) ядра.
Электроны относятся к числу (наиболее, менее) массивных субатомных частиц, и они находятся (внутри и снаружи) ядра.
Опишите, почему Резерфорд использовал термин модель планеты для описания своей модели атомной структуры.
Почему модель планеты не подходит для описания структуры атома?
Что случилось с большинством альфа-частиц в эксперименте Резерфорда? Объясните, почему это произошло.
Электроны составляют (большинство, меньшинство) (масса, объем) атома.
ответов
Электроны движутся по орбите вокруг ядра.
Большая часть альфа-частиц прошла через металлический лист, потому что атомы в основном представляют собой пустое пространство.
Эти общие модели атомов на самом деле совершенно неверны
Если вы прямо сейчас поместите слово «атом» в поиск изображений Google, почти все, что вы получите, – это кучу модных планетарных моделей – это упрощенное представление атомной структуры, которая выглядит как планеты, вращающиеся вокруг центральной звезды.
Как бы важно ни было иметь упрощенную модель, чтобы мы могли изучить основы атомной структуры, эта планетная модель настолько неверна, что любые атомы, у которых есть электроны, вращающиеся вокруг своего ядра, очень быстро схлопнутся сами и исчезнут. .
Несмотря на то, что планетарная модель, или модель Резерфорда, была разработана более века назад и очень быстро заменена другим, столь же упрощенным представлением – моделью Бора, она остается в общественном сознании без каких-либо признаков исчезновения.
Как объясняется в эпизоде SciShow ниже, в 1913 году модель Бора улучшила планетарную модель, покончив с неустойчивыми спиралевидными орбитами и заменив их концентрическими кругами, которые визуализировали различные уровни энергии, на которых удерживаются электроны.
Но хотя мы часто видим, что эта модель используется в старших классах, чтобы научить нас достоинствам, она также не рассказывает всей истории – даже если вы допускаете упрощенную версию вещей.
Например, модель была разработана более чем за десять лет до того, как физики даже узнали, где находятся нейтроны, и они важны, если вы хотите правильно представить атом.
И еще есть странность квантовой механики, которая утверждает, что а) электроны вовсе не обязательно вращаются вокруг ядра, и б) они даже действительно не существуют в определенном месте в определенное время.
«Вместо этого они как бы одновременно находятся во множестве разных мест, в пределах большей площади. Затем, когда вы измеряете электрон, он внезапно оказывается в одном конкретном месте в этой области», – объясняет Оливия Гордон в видео. ниже.
«Это странная концепция, которая сильно отличается от того, как мы обычно воспринимаем мир, но для вас это квантовая механика.”
Более точный способ изобразить атом – сохраняя при этом простоту – состоит в том, чтобы изобразить пространство вокруг ядра как темное« электронное облако ».
Это в основном показывает, где электроны могут плавать в любой данный момент, не подразумевая, что они установили позиции:
SciShow
К чести, модель Бора показывает, где электроны с наибольшей вероятностью находятся в любой данный момент, поэтому, хотя модель электронного облака является наиболее точным способом простое изображение атома не делает другие варианты бесполезными.
Что круто в этих различных моделях, так это то, что вы можете использовать модель электронного облака, если вы хотите сосредоточиться на химических связях или на том, где в целом находятся электроны, а модель Бора может показать вам уровни энергии и излучение данного атома.
Даже ужасная планетарная модель может научить основам электронных орбит, но просто помните – правда намного интереснее, чем эта красивая картинка, и если вам нужно реальное изображение атомной структуры, у нас теперь тоже есть такие:
Первое изображение орбитальной структуры атома водорода.Предоставлено: APS / Alan Stonebrakere
The Chemistry Development Kit (CDK) v2.0: типирование атомов, отображение, молекулярные формулы и поиск субструктур | Journal of Cheminformatics
В этом разделе описываются особенности новых API-интерфейсов и улучшения уже существующих методов, которые доступны в последней версии CDK. Затем мы обсудим, как мы улучшили и формализовали модель разработки проекта с помощью модульного тестирования, проверки кода и рекомендаций по управлению версиями.Наконец, мы сообщаем о доступности двоичных дистрибутивов библиотеки, что позволяет пользователям включать определенные модули (и их зависимости) CDK в свои собственные проекты (в отличие от разработчиков, которые работают над самой библиотекой CDK).
Новые API-интерфейсы и улучшенные реализации
Здесь мы описываем различные новые и улучшенные API-интерфейсы в библиотеке CDK со времени двух предыдущих публикаций в 2003 и 2006 годах [3, 4].
Типирование атома
Восприятие типа атома – это основная функция хеминформатики: типы атомов описывают химические свойства атомов, такие как количество соседей, возможные формальные заряды, (приблизительную) гибридизацию, распределение электронов по орбиталям и так далее.Однако в предыдущих версиях CDK восприятие типа атома реализовывалось как часть различных алгоритмов, что приводило к дублированию, а иногда и к расходящимся схемам типизации. В результате было обременительно добавлять новые типы атомов и последовательно реализовывать поддержку новых заряженных и радикальных частиц.
Эта версия CDK имеет новую централизованную структуру атомной типизации, устраняющую восприятие типов атомов из различных алгоритмов. Это позволяет создать последовательную и обширную схему типизации, которую также можно протестировать независимо от другого кода.Новый код определяет типы атомов с помощью списка, который определяет для каждого типа символ элемента, гибридизацию, формальный заряд, количество одиночных пар и перечисление порядков облигаций (см. Рис. 1). Этот список свойств содержит информацию, необходимую для различных алгоритмов в CDK. Например, информация о гибридизации может использоваться в некоторых моделях ароматичности (см. Ниже), а информация об неподеленной паре необходима для расчета резонансной структуры, необходимой, например, для \ (\ pi \) – зарядов Гастайгера.3 \) – углерод гибридизированный
Эталонная реализация CDKAtomTypeMatcher была написана таким образом, чтобы воспринимать эти типы атомов и автоматически проверять восприятие на соответствие свойствам, определенным онтологией. Этот класс обрабатывает различные типы отсутствующей информации, которые обычно возникают из-за различных (файловых) форматов; например, он может обрабатывать неопределенные подсчеты водорода и неопределенные положения двойных связей, если вместо этого предоставляется информация о гибридизации.Это делает код восприятия гибким, но при этом более сложным. Альтернативные алгоритмы атомной типизации не исследовались. Эту эталонную реализацию можно использовать на отдельном атоме:
И на полной молекуле, и в этом случае список типов упорядочен в том же порядке, что и атомы в объекте молекулы:
Стереохимия
Предыдущие версии API представлял стереохимию по-разному. Это затрудняло взаимное преобразование между форматами файлов и внутри них.CDK v2.0 стандартизирован на основе нового представления ядра, а процедуры были обновлены или добавлены, чтобы обеспечить возможность дублирования проверки, сопоставления с образцом и взаимного преобразования.
В настоящее время предпочтительное представление стереохимии состоит в том, чтобы она сохранялась на уровне молекулы как StereoElement. В абстрактных терминах стереоэлемент описывает локальную геометрию, используя тип, фокус, несущие и конфигурацию (рис. 2). В настоящее время поддерживаются наиболее распространенные типы стереохимии: тетраэдрическая, цис-транс-изомерия вокруг двойной связи и расширенный тетраэдр.Более редкие типы стереохимии, такие как: квадратный плоский, тригонально-бипирамидальный, октаэдрический, могут быть легко включены в выбранное описание при наличии достаточного спроса со стороны сообщества.
Рис. 2Относительное хранение стереохимии, тип и фокус стереохимии фиксированы для данного описания стереоцентра, но носители и конфигурация являются относительными. Несколько строк для каждого типа стереохимии представляют собой разные внутренние представления, которые можно было бы считать эквивалентными.В тетраэдрических типах атомы водорода могут подавляться в молекулярном графе, поэтому фокус повторно используется в списке носителей в качестве заполнителя
Наряду с новым представлением стереохимии, алгоритмы требовались в нескольких областях. Как правило, пользователю не нужно вызывать эти процедуры явно, поскольку они вызываются по мере необходимости в существующих API:
восприятие по 2D-координатам,
восприятие по трехмерным координатам,
клин отводка,
сопоставление изоморфизма графов (под),
SMARTS сопоставление и
канонизация.
Восприятие по координатам и алгоритмы назначения клина являются фундаментальными для преобразования между форматами, которые хранят стереохимию неявно на основе координат (например, molfile, Footnote 1 CML) и явно (например, SMILES, CML, InChI). Восприятие из 2D-координат может опционально идентифицировать перспективные проекции, в частности: проекции Фишера, Хаворта и Стула. При включенном восприятии перспективных проекций записи в базе данных, которые в настоящее время считаются отдельными, могут быть объединены (рис.3).
Рис. 3Отображаются необработанные входные файлы CHEMBL23970 и CHEMBL444314 (ChEMBL 21). Без учета стереохимии, указанной проекцией Хаворта в CHEMBL23970, записи в базе данных ошибочно считаются отдельными. Базы данных агрегирования нисходящего потока отражают это разделение (PubChem CID 5280, CID 65119)
Сопоставление стереохимии по образцу с описанным представлением несложно. Учитывая отображение атом-атом из структуры запроса в целевую молекулу, фокус и носители стереохимии запроса отображаются в цель.Используя четность перестановок этого отображения, было проведено сравнение конфигураций. Соответствие SMARTS требует особой обработки для сложных случаев [39]. Для канонизации используется частичное каноническое упорядочение для присвоения абсолютной метки, которая затем может быть интегрирована в упорядочение. Алгоритмы, используемые для стереохимии, подробно описаны в главе 6 [40]. Восприятие из проекций основано на алгоритме, кратко описанном в [41].
Атомные и молекулярные сигнатуры
Была предоставлена реализация дескриптора структуры сигнатуры для молекул [42].Они действуют как линейные обозначения – как формат SMILES – для всей молекулы, а также для связанных субструктур, основанных на одном атоме. Дескриптор также может быть канонизирован для обеспечения независимых от изоморфизма представлений [43]. Сигнатуры глубины два могут быть рассчитаны для атомов с помощью:
Но они также могут быть рассчитаны для полных молекул:
Наконец, отпечаток сигнатуры может быть рассчитан для молекул, чтобы позволить вычисления подобия. Затем это можно использовать в QSAR-моделировании [34, 44,45,46,47,48,49].
API рендеринга
Новый API рендеринга был представлен, чтобы сделать код рендеринга независимым от наборов инструментов виджетов Java. Предыдущий код был тесно связан с набором инструментов Swing, но другие инструменты используют другие инструменты виджетов. Например, Bioclipse основан на Eclipse, который использует Standard Widget Toolkit (SWT) [27].
Вторая новая цель дизайна была введена для баланса между ограничениями размера некоторых вариантов использования, таких как Java-апплеты, и функциональностью рендеринга.В частности, для некоторых функций, даже после модульности, требовались значительные части библиотеки CDK, что делало невозможным создание апплета небольшого размера. Поэтому API рендеринга был модульным, чтобы можно было разделить функциональность рендеринга на модули с различными зависимостями CDK.
Рендеринг разделен на несколько этапов генерации: предыдущие версии разделяли связь от рендеринга атома. Символы гетероатома просто рисовались поверх линий, представляющих связи, с использованием белого прямоугольника для маскировки.Был представлен новый StandardGenerator, который одновременно выполняет рендеринг связей и атомов. Он включает в себя многие идеи, описанные Алексом Кларком [50, 51]. Созданные изображения имеют гораздо более высокое качество и подходят для публикации.
Кроме того, был представлен упрощенный высокоуровневый API, который удовлетворяет большинство общих потребностей рендеринга с помощью класса DepictionGenerator. Чтобы изобразить молекулу, загруженную в переменную «бензол», можно использовать следующий код:
Многие параметры визуализации доступны как параметры в основном API и как методы в классе DepictionGenerator.Это включает в себя окраску подструктуры, проиллюстрированную примером реакции, показанной на рис. 4. При отсутствии 2D-координаты генерируются на лету с помощью новой функциональности компоновки структурной схемы.
Рис. 4Интегрированный пример, показывающий функциональные возможности рендеринга и анализа SMILES. Пример из патента США US 2014 231770 A1, параграф 287
Макет структурной диаграммы
Макет структурной диаграммы был улучшен, и новый код решает ряд давних проблем.В частности, значительно улучшено предотвращение столкновений. На рисунке 5 показана разница в выводе между старой кодовой базой с и без разрешения наложения, а также с новой реализацией, основанной на уточнении [52]. Генерация двухмерных координат выполняется, как показано ниже:
Рис. 5Улучшенная генерация структурной диаграммы включает улучшенный код для решения проблемы перекрытия. В исходном коде SDG использовалась общая эвристика ( слева, ), а OverlapResolver точно настраивал макет, чтобы атомы не располагались в одном месте ( в середине ).Новый алгоритм SDG может вносить более строгие изменения, делая конечный результат более приятным ( справа )
Хотя сам API существенно не изменился, внутренняя часть была обновлена. В дополнение к улучшенному разрешению перекрытия, упомянутому выше, механизм соответствующим образом обрабатывает большие кольцевые системы, поддерживает стереохимию ввода и использует большую библиотеку шаблонов. Шаблоны полезны для разметки подконструкции. В то время как предыдущие версии CDK частично поддерживали стереохимию двойной связи, новый движок более эффективно использует эту информацию при создании 2D-макетов.Кроме того, механизм назначает информацию о связи клина на основе тетраэдрической стереохимии. Эти особенности иллюстрируются следующим кодом и результирующим изображением компоновки на рис. 6:
Рис. 6Создание структурной схемы для структур с двойной связью и тетраэдрической стереохимией
Молекулярная формула
Химическая формула – это простейшее химическое представление соединения. Он определяет количество изотопов или элементов, составляющих соединение, без описания того, как атомы связаны.С развитием метаболомики становится все более актуальной иметь полную поддержку для них в библиотеках хеминформатики [23, 53,54,55,56].
Интерфейсы CDK могут обрабатывать несколько концепций, связанных с химическими формулами: сама формула, наборы формул, диапазоны химических формул, аддукты, контейнеры и образцы изотопов, а также правила для фильтрации наборов формул. Эти новые инструменты могут использоваться для ряда задач, включая вычисление изотопного паттерна по заданной химической формуле, определение возможных элементных составов для заданной массы (массовое разложение) и вычисление точной массы по заданной химической формуле.
CDK содержит два алгоритма разложения диапазонов масс на возможные элементные формулы. Для большинства входных данных используется алгоритм Round Robin, первоначально разработанный для инструмента идентификации метаболитов SIRIUS [57]. Алгоритм дискретизирует задачу разложения вещественной массы на целочисленную задачу о рюкзаке [58]. Сначала он вычисляет таблицу динамического программирования, а затем выполняет обратный поиск в ней для создания формул сопоставления [59, 60]. Данные для алгоритма Round Robin хранятся в расширенной таблице остатков [61], что приводит к небольшому объему памяти в несколько килобайт.Для некоторых проблемных случаев, таких как очень большие значения массы (выше 400000 Да) или диапазон масс более 1 Да, алгоритм Round Robin не подходит, и CDK возвращается к оптимизированному методу поиска полного перечисления, первоначально разработанному как часть Фреймворк MZmine 2 для обработки данных масс-спектрометрии [54, 55].
Следующий код вычисляет все возможные химические формулы для данной точной массы в пределах разрешенного количества для каждого элемента:
Это дает следующий результат:
Чтобы оценить производительность генератора молекулярных формул CDK, мы сравнили время его работы с теми классического генератора формул HR2 на основе полного перечисления [62] и недавно разработанного генератора параллельных формул (PFG) [63] (таблица 1).В качестве входных данных мы использовали два набора из 10 000 малых (<500 Да) и 20 больших (> 1500 и <3500 Да) значений молекулярной массы, загруженных из базы данных Global Natural Products Social Molecular Networking [64]. Допуск по массе был установлен на 0,001 или 0,01 Да. Генератор циклических формул CDK v2.0 превосходит другие методы во всех случаях, несмотря на то, что он работает в одном потоке (PFG использует несколько потоков). Прирост производительности алгоритма Round Robin был особенно очевиден при запросе узких диапазонов масс (например,грамм. ± 0,001 Да), что свидетельствует о его пригодности для применения в масс-спектрометрии высокого разрешения.
Таблица 1 Оценка генераторов молекулярных формулСинтаксический анализатор и генератор SMILES
Синтаксический анализ SMILES [65] был заменен кодом из внешнего проекта Beam [66]. Этот анализатор SMILES под лицензией BSD представляет собой полную реализацию спецификаций SMILES и OpenSMILES (http://opensmiles.org/) одного из авторов (включая стереохимию) и не зависит от библиотеки CDK.SmilesParser API использует эту библиотеку внизу, а Beam API скрыт этим классом. Базовое использование выглядит следующим образом:
Наиболее значительным функциональным изменением здесь является то, что анализатор SMILES автоматически определяет положение двойных связей в делокализованных ароматических системах (кекулизация). Если этот инвариант не может быть соблюден, УЛЫБКА отклоняется как недействительная. Эту проверку можно обойти, но это настоятельно не рекомендуется, поскольку отброшенные молекулы не имеют фиксированной формулы или таутомера [40].
API поколения SMILES также был упрощен и сделан более гибким, позволяя производить несколько различных вкусов. Флаги SmiFlavor используются для управления типом создаваемых УЛЫБКОВ. Исторически термины: общий, изомерный, уникальный, абсолютный использовались в других инструментах и также поддерживаются.
В CDK v2.0 добавлена поддержка слоев ChemAxon Extended SMILES (CXSMILES) [67]. CXSMILES предоставляет мощные средства включения вспомогательной информации в строку SMILES, такую как 2D / 3D координаты, значения атомов, общие метки, повторяющиеся единицы и позиционные вариации.CXSMILES достигается за счет помещения дополнительной информации между вертикальными чертами (‘|’) в поле заголовка SMILES. Информация аннотируется на основе порядка атомов в строке SMILES. Пример CXSMILES для общей структуры показан ниже.
Сопоставление подструктуры и SMARTS
Сопоставление подструктуры является фундаментальной операцией хеминформатики и играет ключевую роль во многих других функциях, таких как создание отпечатков пальцев и дескрипторов, а также атомная типизация. Начиная с CDK v1.2, была добавлена функциональность для обработки языка запросов SMARTS.Язык SMARTS хорошо поддерживается, включая такие функции, как стереохимия, группировка компонентов и атомные карты (для соответствия преобразованиям реакций). Новый Pattern API был добавлен в CDK v2.0, который упрощает поиск, фильтрацию и преобразование результатов поиска. API является неизменным, что позволяет один раз инициализировать шаблон, а затем сопоставлять его с несколькими молекулами или реакциями в нескольких потоках. Во время инициализации шаблон проверяется, чтобы определить, какие инварианты потребуются (например,грамм. размер кольца) и рассчитываются только необходимые инварианты. Алгоритмы внутреннего сопоставления предоставляют ленивый итератор, так что следующее сопоставление вычисляется только тогда, когда оно необходимо. API обрабатывает реакции в дополнение к молекулам, и оба могут быть указаны как запросы или цели.
CDK v2.0 включает значительные улучшения в эффективности алгоритмов. Это подчеркивается в систематическом тесте генерации ключей типа MACCS 166 (таблица 5). Повышение эффективности – это комбинация оптимизации структур данных и ключевых алгоритмов обработки молекул (например,грамм. кекулизация и ароматичность), необходимые для проведения матча SMARTS [40, 68, 69].
Поиск колец
Поиск колец – еще одна ключевая функция библиотеки хеминформатики, и CDK знает долгую историю поиска колец [38, 70]. В частности, особый интерес вызывают неизбыточные наборы колец, такие как наименьший набор наименьших колец, для которого CDK реализует два классических алгоритма [70, 71]. В недавней работе был реализован новый, более быстрый алгоритм, позволяющий искать различные типы (неизбыточных) наборов колец [38].Они доступны через новый Cycles API:
Ароматичность
Ароматичность использовалась во многих определениях в прошлом, а для хеминформатики она часто определяется алгоритмически. Результат расчета ароматичности зависит от ряда особенностей типа атома и эвристик, которые часто неоднозначно определены в опубликованной литературе. На основе использованной информации можно дать несколько различных алгоритмических определений ароматичности. В более старых версиях CDK были реализованы различные модели ароматичности, но код был рассредоточен по всей библиотеке, что приводило к несовместимому API для вычисления ароматичности и значительной нагрузке на обслуживание.API был унифицирован в текущей версии, в результате чего были созданы три модели, две из которых основаны на типе атома CDK. Разница между этими двумя моделями заключается в том, как учитываются вклады экзоциклических двойных связей.
Текущая версия CDK дополнительно обобщает идею о том, что ароматичность является моделью, и предоставляет API, который позволяет пользователю выбрать одну из нескольких моделей ароматичности, что приводит к большей совместимости с другими наборами инструментов. Новый класс Aromaticity позволяет создавать собственные модели, выбирая и комбинируя параметры.Например, для воспроизведения функциональности предыдущего класса CDKAromaticity:
Здесь используется модель CDK для подсчета пожертвованных электронов, а также системы колец, которые были идентифицированы старым алгоритмом в предыдущих версиях, который был ограничен по количеству слитых электронов. кольцевые системы, которые были рассмотрены. Однако теперь можно легко создать альтернативный калькулятор ароматичности, который учитывает все возможные кольцевые системы:
Для сопоставления SMARTS и генерации SMILES можно использовать модель, основанную на дневном свете [72], которая предлагает значительные улучшения скорости по сравнению с моделью, основанной на CDK Atom. Типы.Эта модель недавно была задокументирована как часть спецификации OpenSMILES (http://opensmiles.org/):
Алгоритм ароматичности прост, потенциальное донорство электронов рассчитывается для каждого атома как \ (- 1 \) (не aromatic), 0, 1, 2. Затем генерируется набор циклов, указанный в конструкторе, и каждый проверяется на соответствие правилу Хюккеля (\ (4n + 2 \)).
Улучшения формата CTfile
Формат molfile по-прежнему очень популярен и, несмотря на то, что он является проприетарным форматом, стал стандартом де-факто.Формат формирует ядро более крупного семейства CTfile, которое изначально было разработано MDL Information Systems [73]. Текущая спецификация формата опубликована BIOVIA и доступна по запросу [74].
Блок CTAB (таблица соединений) molfile выпускается в двух версиях: V2000 и V3000. V3000 обеспечивает несколько улучшений, включая, помимо прочего: удаление ограничений на количество атомов и связей, улучшенную стереохимию и узлы связи. Для обратной совместимости часто предпочитают V2000, что приводит к ограниченному использованию V3000.
CDK v2.0 добавляет поддержку V3000, а также оптимизирует и расширяет поддержку V2000. В настоящее время они считаются отдельными форматами, требующими, чтобы пользователь заранее знал, какая версия читается. Будущие API-интерфейсы будут стремиться упростить это и предоставить унифицированного читателя. Обзор поддерживаемых в настоящее время форматов CTfile приведен в таблице 2.
Таблица 2 Поддержка формата CTfileCTfile Sgroups собирают и организуют высокоуровневую информацию о наборах атомов и связей [75].Существует четыре типа S-групп: ярлыки отображения, полимеры, смеси и данные. Наиболее знакомыми с точки зрения конечного пользователя S-группами являются единицы повторения структуры (например, брекетинг) и сокращения (рис. 8). CDK v2.0 добавляет поддержку для представления, чтения, записи и отображения S-групп.
Новые построители объектов
Первоначально CDK разрабатывался как разделяемая библиотека между JChemPaint [76] и Jmol [77, 78]. JChemPaint использовал подход MVC с механизмом передачи событий для обновления представления при изменении модели.Это может привести к передаче каскада событий изменения. Это не всегда было желательной функцией, особенно для кода, не относящегося к пользовательскому интерфейсу. Для решения этой проблемы были введены интерфейсы, позволяющие несколько реализаций основных интерфейсов. Поскольку большая часть кода библиотеки CDK больше не основана на исходной модели данных, необходим конструктор для создания объектов этой модели данных, таких как реализация IAtom. Новые IChemObjectBuilders позволяют создавать реализации, позволяя создавать экземпляры реализаций интерфейсов без необходимости явно ссылаться на эти реализации.Таким образом, любая реализация алгоритма в CDK может использовать любую из реализаций интерфейса модели данных.
Реализации IChemObjectBuilder CDK v1.0 и v1.2 имели, однако, один метод для каждого конструктора объекта данных, что приводило к очень большому интерфейсу. Более того, этот интерфейсный API приходилось обновлять каждый раз, когда вводился новый класс, а также при изменении существующих методов и обновлении конструкторов. Чтобы упростить API, новый IChemObjectBuilder сворачивает все методы в один метод, который принимает в качестве первого параметра класс интерфейса, который должен быть построен.Все остальные параметры передаются как параметры конструктору класса.
Например, чтобы построить новый атом из его символа элемента, можно было бы написать ранее:
В новом построителе код выглядит так:
Библиотека CDK теперь в основном переработана и больше не зависит от конкретной реализации IChemObjectBuilder, позволяющий пользователю CDK выбрать компоновщик, подходящий для его программного обеспечения. Следовательно, если программное обеспечение зависит от передачи событий, то можно использовать DefaultChemObjectBuilder, в большинстве случаев в этом нет необходимости и предпочтительнее SilentChemObjectBuilder, что дает типичное ускорение на 10–20%:
Третий конструктор – DataDebugChemObjectBuilder, который генерирует отладочную информацию для всех изменений содержимого классов данных.Это может быть полезно для отладки и других форм проверки кода.
Молекулярные отпечатки пальцев
Молекулярные отпечатки пальцев также претерпели значительные изменения в этой версии CDK. Ранее отпечатки пальцев представлялись с помощью класса BitSet из библиотеки Java. Хотя использование этого класса позволяло использовать уже существующие методы для управления битовыми строками, он сохраняет вектор битов в памяти. Решение было отличным для хешированных, относительно небольших отпечатков пальцев, например, 1024 бита, т.е.{32} \) битовое пространство индексации с использованием этого подхода было бы неэффективным с памятью (512 МБ). Чтобы обеспечить возможность представления нескольких отпечатков пальцев, был введен интерфейс побитового отпечатка пальца: IBitFingerprint.
Кроме того, хотя отпечатки пальцев традиционно являются битовыми векторами, также был введен счетный отпечаток пальца, позволяющий создавать отпечатки на основе целочисленных векторов, также поддерживаемых в CDK. Счетчики в отпечатке пальца показывают, как часто эта субструктура обнаруживается в молекуле, которую она представляет.
Отпечатки пальцев, которые в настоящее время предоставляет CDK, перечислены в таблице 3.
Таблица 3 Молекулярные отпечатки пальцев в CDKУлучшенные стандарты кодирования
По мере того, как библиотека CDK с годами росла, увеличивалась и сложность обслуживания. Основная ветвь часто не компилировалась, и исправление ошибок становилось более обременительным из-за неожиданных побочных эффектов. Часто исправляя ошибку в одной части кода, ломается другой код, что делает неверные предположения о фиксированном коде. С увеличением размера сообщества разработчиков CDK такие проблемы были неизбежны при отсутствии каких-либо формальных стандартов кодирования и тестирования.
Для решения этих проблем мы приняли ряд стандартов кодирования. Хотя они не являются всеобъемлющей реализацией передовых методов разработки программного обеспечения, они пытаются найти баланс между повышением ремонтопригодности кода и достаточной гибкостью для обеспечения эффективной разработки кода. Мы понимаем субъективный характер этого утверждения, а некоторые принятые правила активно обсуждались и обсуждались в сообществе CDK.
Возможно, самым большим фактором повышения качества кода является процесс экспертной оценки, когда любой патч, изменяющий функциональность, должен быть рассмотрен одним независимым старшим разработчиком CDK для ветви разработки и двумя рецензентами для стабильной ветви.Эта система разработки исправлений поддерживается рядом этапов автоматической проверки, описанных ниже. В следующих разделах описываются некоторые подходы, принятые в проекте, которые позволяют нам поддерживать библиотеку CDK в том виде, в каком она есть сегодня.
Стабильность и идентификатор версии
До CDK v2.0 четность второй цифры идентификатора версии указывала на стабильность. Четные числа (v1.2.x, v1.4.x), указывающие на стабильность API, и нечетные числа (v1.3.x, v1.5.x), указывающие на потенциальную нестабильность API.Версии v1.4.x и v1.5.x разрабатывались параллельно, и к обоим были применены возможные исправления. Поскольку API-интерфейсы разошлись по объему усилий по переносу исправлений от разработки, более надежные версии v1.5.x на v1.4.x стали неуправляемыми для основной группы разработчиков. Эта схема четно-нечетных версий была заимствована из старого управления версиями ядра Linux, от которого впоследствии отказались в 2004 году для выпусков, основанных на времени [79].
На момент написания в ветке разработки более 3000 коммитов опережают v1.4.x. Поскольку API v1.5.x стал стабильным, настало время выпустить v1.6.x. Из-за значительных изменений API в 2011 г. Footnote 2 было сочтено, что необходимо большее приращение цифр. Это дало возможность перейти на более управляемый и интуитивно понятный идентификатор версии.
Начиная с CDK v2.0 будет использоваться новая схема версий на основе последовательности. Идентификатор версии указывает на важность изменения следующим образом:
Из-за ограниченных ресурсов разработчика мы предполагаем, что выпуски будут в основном увеличивать второстепенную версию с выпуском случайных исправлений.Согласно соглашению Maven, версии для разработки имеют суффикс -SNAPSHOT. Изменений API по сравнению с v1.5.x и v2.0 нет.
Модульность
Один из основных подходов, которые мы приняли, – сделать CDK более модульным. CDK назначает каждый класс модулю и определяет зависимости между модулями. Например, базовым модулям не разрешается зависеть от модулей с классами данных, реализующими интерфейсы CDK; вместо этого они могут зависеть только от самих интерфейсов. Это гарантирует, что зависимости сведены к минимуму.Кроме того, он также позволяет выбирать функциональность CDK, уменьшая количество необходимых зависимостей сторонних библиотек. Обзор ключевых модулей с описанием, важными изменениями и зависимостями от сторонних библиотек приведен в таблице 4, а зависимости между модулями CDK показаны на рис. 7.
Таблица 4 Выбор ключевых модулей CDK с основными изменениями Рис. 7Зависимости между модулями CDK. Визуализация зависимостей между модулями CDK.Например, ядро cdk зависит от модуля cdk-interfaces. Осталось несколько модулей более высокого уровня: cdk-builder3dtools, cdk-legacy и cdk-depict
.Документация
Качество JavaDocs изначально проверялось с помощью DocCheck, а затем заменено специально написанным инструментом OpenJavaDocCheck. С переходом на Maven (поясняется позже), который не имеет интеграции для этого инструмента, мы приняли CheckStyle (http: //checkstyle.sourceforge.сеть/). Этот инструмент сообщает об отсутствующей документации и документации, которая не аннотирована должным образом в исходных файлах Java. На новом веб-сайте перечислены несколько ресурсов, которые помогут начинающим пользователям CDK, в том числе книга [80] и Chemistry Toolkit Rosetta Wiki (http://ctr.wikia.com/wiki/Chemistry_Toolkit_Rosetta_Wiki).
Тестирование
Годы разработки библиотеки CDK привели к появлению большого набора различных тестов. Сюда входят модульные тесты, которые тестируют основные API-интерфейсы, и функциональное тестирование, которое проверяет функциональность CDK более высокого уровня.Последние включают в себя тесты, если реализации алгоритмов вычисляют ожидаемые значения, но также содержат интегрированные тесты, которые включают более одного алгоритма, такие как анализ SMILES. Набор состоит из более 23 тысяч тестов.
Качество кода
Проект продолжает использовать PMD (http://pmd.sf.net/) для проверки качества кода, но отклоняется от правил по умолчанию. Например, мы более либеральны с длиной имени переменной. Более того, ряд дополнительных тестов PMD был разработан специально для CDK, которые, например, проверяют, использует ли класс базовые интерфейсы вместо их реализаций.То есть код использует IAtom вместо Atom. Однако эти тесты действительно генерируют несколько ложных срабатываний, поскольку тесты проверяют только имя класса, а не пакет Java, в котором он находится.
Непрерывная интеграция
У CDK уже много лет есть автоматизированная система сборки. Изначально Nightly интегрировал различные инструменты (сборка, тестирование, JavaDoc и т. Д.) [2]. После перехода на Maven выполнение различных шагов можно было выполнять с помощью Maven, и для выполнения этих шагов использовался Jenkins (один экземпляр все еще работает по адресу https: // jenkins.bigcat.unimaas.nl/job/cdk/. Онлайн-сервис Travis-CI используется для создания всех веток, включая запросы на вытягивание, чтобы гарантировать, что все правильно компилируется: https://travis-ci.org/cdk/cdk.
Git, ветвление и исправления
В старых версиях CDK для управления версиями использовалась Subversion. Несколько лет назад проект перешел на систему контроля версий Git. Ключевым преимуществом этого перехода является возможность иметь распределенные репозитории, более легкое ветвление и обеспечение исправлений.GitHub (https://cdk.github.io/) заменил SourceForge в качестве основной службы хостинга исходного кода, где мы можем использовать новые подходы для комментирования кода (экспертная оценка), запросов на вытягивание и т. Д. Эти новые функции упрощают нашу проверку кода. процесс.
Поддержка
Помимо вышеупомянутых источников документации, у проекта есть дополнительные источники поддержки. Во-первых, средство отслеживания проблем приветствует вопросы и другие типы запросов поддержки, доступные по адресу https://github.com/cdk/cdk/issues.Список рассылки – еще одно место, где можно запросить поддержку, в то время как архивы документируют многие прошлые вопросы пользователей. Список и архивы доступны по адресу https://sourceforge.net/p/cdk/mailman/cdk-user/.
Двоичные дистрибутивы
Пакеты Maven
Система сборки преобразована из Ant в Maven. Переход был мотивирован более простой обработкой зависимостей, более четким разделением кода тестирования от основной библиотеки и автоматической упаковкой. Переход к модулям потребовал разделения исходного монолитного дерева исходного кода на отдельные исходные папки для каждого модуля.Хотя это усложняет расположение исходного кода на диске, современные IDE обычно скрывают это.
В результате для многих модулей тестовый код теперь более тесно связан с тестируемым кодом: оба находятся в одной папке, хотя мы придерживаемся обычаев Maven, чтобы src / main / java и src / test / папки java. Однако для некоторых модулей это решение вводит циклические зависимости, и в этом случае для тестов создается отдельный модуль Maven.
Пакеты Maven для CDK доступны в Maven Central, что упрощает использование других проектов.Полная библиотека может быть включена в другое программное обеспечение в зависимости от артефакта cdk (http://search.maven.org/#search|ga|1|org.openscience), но зависимости также могут быть определены для отдельных модулей CDK.
Пакеты OSGi
Пакеты OSGi также доступны для CDK, которые используются, например, Биоклипс [27, 28] и KNIME [8]. Однако, поскольку пакеты Java CDK иногда разделяются между модулями CDK, в настоящее время CDK необходимо объединить как одну банку OSGi. Пакет доступен по адресу http: // pele.farmbio.uu.se/bioclipse/cdk/cdk-1.5.13/. Эта несовместимость Java-пакета и связок в настоящее время изучается и представляет собой область, в которой можно улучшить модульность.
Систематический тест
Систематический тест был проведен для оценки и количественной оценки улучшений производительности с версии 1.4.19 до версии 2.0. Тест разделен на несколько задач хеминформатики для распространенных случаев использования. Каждая задача оценивалась на основе данных из ChEBI 149 [81] и ChEMBL 22.1 [82] как SMILES и SDF.
Тест проводился на процессоре Java SE 8, CentOS 7, Intel Core i7-4790 с тактовой частотой 3,60 ГГц и 16 ГБ ОЗУ. Код для запуска теста доступен в дополнительном файле 1, позволяющем записывать числа в системе считывателя.
Результаты теста суммированы в таблицах 5 и 6. Общее прошедшее время указано в таблице 5, в таблице 6 вычитаются результаты первых задач (подсчет тяжелых атомов) для обеспечения сопоставимого измерения без накладных расходов на время чтения ввода. Сообщается о пропускной способности в виде молекул в минуту, но она менее точна для очень быстро выполняемых задач.
Таблица 5 Сводка систематических тестов, сравнивающих версии 1.4.19 и 2.0 Таблица 6 Сводка систематических тестов, сравнивающих версии 1.4.19 и 2.0 без времени чтенияПодсчет тяжелых атомов
В этой задаче подчеркивается улучшение производительности прямого чтения. Каждая запись считывается в резидентную таблицу подключений памяти, и количество тяжелых (неводородных) атомов подсчитывается путем последовательного перебора атомов.
Улучшение этой задачи наиболее заметно для ввода SMILES, раньше чтение ChEMBL 22 занимало более 8 минут.1, но это сокращено до менее 11 с. Вдобавок к этому усовершенствованию ввод SMILES теперь проверяется и ему присваивается структура Kekulé. Это определяет 9 недопустимых записей в ChEBI и еще 9 в ChEMBL. Большинство этих отклоненных SMILES происходит из-за неправильного кодирования стереохимии двойных связей цис / транс при замыкании кольца. Вход ChEBI 149 SMILES содержит 2107 пустых записей, которые v1.4.19 пропускает, v2.0 просто считывает их как пустые молекулы. Ввод из SDF также улучшился с ~ 3 до ~ 1 мин для ChEMBL. Вход SDF в v2.0 теперь включает восприятие стереохимии и чтение Sgroups CT-файла (рис. 8). Есть 9 записей из SDF ChEBI, которые отклоняются, потому что они содержат функции запроса CTfile (например, любой порядок облигаций).
Рис. 8Примеры S-групп, которые теперь захватываются CDK и закодированы в molfiles и CXSMILES. a Полностью расширенная реакция этиловой этерификации. b Использование сокращений Sgroup позволяет отображать короткие переходы и более компактное изображение. c Пример повторяющейся единицы структуры в 5′-фосфате ДНК (CHEBI: 4294)
Rings
Восприятие кольца – фундаментальный шаг во многих других алгоритмах.Задача кольца разделена на три подзадачи: отметка, sssr и все.
-mark Первая подзадача измеряет производительность при маркировке членства в кольце и сообщении количества кольцевых связей в каждой записи. Для этого требуется линейный алгоритм, основанный на поиске в глубину. Исходный код использовал взвешенное остовное дерево для вычисления принадлежности в линейнофмическом времени. Время выполнения для этих наборов данных аналогично (таблица 6), большие различия наблюдаются только для более сложных клеточных молекул, таких как фуллерены [38].
-sssr Вторая подзадача вычисляет наименьший набор наименьших колец (SSSR) и сообщает размер SSSR (ранг цепи) для каждой записи. Хотя ранг схемы может быть вычислен более эффективно с помощью линейного обхода (подсчета задних ребер DFS) или формулы многогранника Эйлера, мы проверяем время для перечисления набора SSSR. В целом SSSR считается неблагоприятным из-за неединственности набора и необходимости исключения гауссовой матрицы (кубическое время выполнения).Благодаря некоторой бухгалтерской отчетности время, затрачиваемое на удаление матрицы, было сокращено [38]. Для ChEMBL мы видим, что время для генерации SSSR теперь составляет ~ 16 с, тогда как раньше требовалось около ~ 3,5 мин (таблица 6).
-все Третья подзадача подсчитывает количество всех колец до размера 12 или равного ему. Это включает кольца, которые включают в себя другие меньшие кольца, например, 1H-индол имеет кольца размера 5, 6 и 9. В целом это проблема является экспоненциальной, поэтому используется регулируемый порог или тайм-аут, чтобы избежать проблемных молекул.CDK v1.4.19 использовал порог на основе тайм-аута (по умолчанию 5 с), тогда как v2.0 использует счетчик, основанный на свойствах алгоритма [38]. В версии 2.0 было пропущено 15/17 Footnote 3 записей из ChEBI, которые имеют сложные кольцевые системы, похожие на клетки (например, CHEBI: 33611), ни одна из записей в ChEMBL не достигла порогового значения. Для сравнения в v1.4.19 было пропущено 14/16 записей из ChEBI и 88/90 в ChEMBL из-за истечения тайм-аута.
Ускорение в v2.0 немного лучше, чем у SSSR. ChEMBL раньше занимала 4–5 мин, а теперь занимает всего ~ 12–14 с (таблица 6).В версии 2.0 поиск всех колец (\ (\ le \) 12 связей) выполняется быстрее, чем неуникальное вычисление SSSR.
Canonical SMILES
Эта задача измеряет создание уникальной строки SMILES. Их можно использовать для сравнения пересечения наборов данных и точного поиска. Из ввода SMILES v2.0 общее прошедшее время примерно в 20 раз быстрее как для ChEBI, так и для ChEMBL. Для ChEMBL теперь требуется чуть менее 41 секунды для чтения, изменения порядка и записи SMILES по сравнению с более чем 14 минутами ранее.
Преобразовать
Эта задача проверяет неканоническое преобразование между входными данными SDF и SMILES.
-ofmt smi SMILES – очень компактное средство для хранения таблиц соединений, v1.4.19 может писать только канонические SMILES, v2.0 позволяет создавать различные варианты SMILES, включая неканонический вариант. Эта задача выводит CXSMILES, который включает дополнительные поля, такие как повторяющиеся группы (используемые некоторыми записями ChEBI). Как и ожидалось, время выполнения v1.4.19 такое же, как и для задачи Canonical SMILES, но v2.0 может генерировать неканонические SMILES быстрее, занимая менее 30 секунд для SMILES из ChEMBL.
Назначение конфигураций двойной связи в SMILES нетривиально, и в версии 2.0 есть некоторые проверки безопасности, так как выход SMILES – это Keklué, но вход был ароматическим, когда ордерам облигаций назначается дополнительная двойная связь, это может быть случайно закодировано в SMILES, иногда это приемлемо, но в настоящее время выдает сообщение об ошибке.
-ofmt sdf Для записи вывода SDF есть минимальные улучшения по сравнению с v1.14.19, если не учитывать улучшения в производительности чтения, генерация SDF для ChEBI фактически работает немного медленнее, чем v1.4.19 (таблица 6). Частично это можно объяснить более полной генерацией SDF, которая теперь записывает S-группы, а также вычисляет значения для столбцов четности и валентности атомов.
-gen2d -ofmt sdf При записи SDF единственный переносимый способ сохранить стереохимию – это включение координат, это указывается с помощью опции -gen2d. Обсуждаемый ранее капитальный ремонт генерации макетов обеспечивает улучшенные макеты, но также включает в себя настройки производительности в CDK v1.4.19 генерация координат и запись SDF для ChEMBL заняли почти 3,5 часа, но теперь занимает всего ~ 18 минут.
Генерация отпечатков пальцев
Эта задача проверяет создание отпечатков пальцев для проверки сходства и субструктуры. Были протестированы три различных типа отпечатков пальцев: дневной хэшированный отпечаток пути, MACCS-подобные 166 ключей и конвейерный пилотный хэшированный круговой отпечаток (ECFP4). Задача генерирует шестнадцатеричный файл FPS, который можно использовать с chemfp [83].
Путь типа Отпечатки на основе пути кодируют пути длиной 0–7.Отпечатки на основе пути могут использоваться как для проверки субструктуры, так и для проверки сходства. Алгоритм был настроен для версии 2.0 для хеширования путей без предварительного вычисления всех путей и без необходимости генерировать символьные строки перед хешированием. Время на кодирование ChEMBL раньше занимало 42–47 мин, теперь всего 6–8 мин.
-type maccs Отпечаток MACCS CDK использует 166 ключей для кодирования характеристик структуры и может использоваться для поиска сходства.Это кодирование использует различные аспекты библиотеки, включая восприятие кольца и новое восприятие ароматичности, но скорость в первую очередь зависит от производительности сопоставления SMARTS. Создание отпечатка пальца ранее занимало ~ 1 день для ChEMBL и ~ 1,75 часа для ChEBI. Это было сокращено до менее 13,5 мин для ChEMBL и ~ 20 с для ChEBI.
-typeОднако известно, что отпечатки пальцев хорошо подходят для поиска [84]. Время включено сюда, чтобы показать, что они вычисляются быстрее, чем ключи пути или MACCS, и поэтому рекомендуется. CDK включает две реализации, основанные на подписях или расширенных возможностях подключения [35].
Сводка теста
Для всех задач общее затраченное время лучше в версии 2.0 по сравнению с версией 1.4.19. По многим задачам улучшение происходит более чем в десять раз быстрее. Мало того, что время выполнения улучшено, но улучшена надежность и правильность означает, что v2.0 часто выполняет гораздо больше работы, чем эквивалентные процедуры в v1.4.19.
3. Атомные модели: Резерфорд и Бор | Строение атома | Введение в химию твердого тела | Материаловедение и инженерия
«Предыдущая | Далее »
Обзор сессии
| Модули | Структура атома |
| Концепции | Модель сливового пудинга Томсона, модель ядра Резерфорда, модель атома водорода Борагерфорда – Ге, Резерфорд -Эксперимент Марсдена, соотношение Планка-Эйнштейна, изотопы водорода |
| Ключевые слова | лантаноиды, актиниды, электрон, масса, J.Дж. Томсон, протон, электрический заряд, янтарь, альфа-частица, бета-частица, ионизация, сохранение массы, Иоганнес Гейгер, Эрнест Марсден, кулон, Нильс Бор, модель водорода Бора, квантование энергии, орбитальный угловой момент, соотношение Планка-Эйнштейна , джоуль, сила Ньютона, кулоновская сила, Макс Планк, фотон, энергия, частота, постоянная Планка, изотоп, Генри Кавендиш, Гарольд Ури, Эрнест Резерфорд, излучение черного тела |
| Химические вещества | лантан (La), магний (Mg), хлор (Cl), титан (Ti), гелий (He), водород (H) |
| Приложения | деление ядер, нанотехнологии |
Предварительные условия
Перед началом этого занятия , вы должны быть знакомы с:
Взгляд в будущее
Проф.Садовей обсуждает атомные спектры водорода (Сессия 4).
Цели обучения
По завершении этого занятия вы должны уметь:
- Понять «сливовый пудинг» Thomson , модель .
- Понять «ядерную» модель Резерфорда .
- Объясните модель Бора водорода .
- Понять условие квантования Бора.
Чтение
Архивные конспекты лекций № 1 (PDF), разделы 1-3
| Главы книги | Темы |
|---|---|
| [Сейлор] 1.5, «Атом». | Электрон; радиоактивность; модель атома |
| [Saylor] 6.2, «Квантование энергии». | Излучение черного тела; фотоэффект |
| [Saylor] 6.3, «Атомные спектры и модели атома». | Линейчатые спектры; модель Бора; использование спектров излучения и поглощения |
Видео лекции
Ресурсы
Слайды лекций (PDF – 9.3MB)
Периодическая таблица и таблица констант
Краткое содержание лекции
Профессор Садовей рассказывает о принципах современной химии и о том, как это привело к пониманию структуры атома . Он подробно описывает постулаты Бора для атома водорода и обсуждает, как соотношение Планка-Эйнштейна применимо к электронным переходам. Он определяет изотопов водорода.
В эту лекцию входят:
- J.Модель «сливовый пудинг» Дж. Томсона модель
- Электроны равномерно распределены по всему атому
- «Ядерная» модель Эрнеста Резерфорда
- Выводы из эксперимента с золотой фольгой
- Большая часть массы находится в ядро
- Электроны вращаются вокруг ядра
- Квантование Нильса Бора условие
- Объяснение излучения черного тела и атомные спектры
- Постулаты:
- Электроны движутся по круговым орбитам 9047 вокруг ядра 9047 импульс квантован, следовательно, возможны только определенные орбиты
- Электроны на стабильных орбитах не излучают
- Электроны меняют орбиты, излучая или поглощая фотоны
Домашнее задание
Задачи (PDF)
Решения (PDF)
Задачи из учебника
| [Saylor] Разделы | Концептуальные | Числовые |
|---|---|---|
| .5, «Атом». | нет | 4 |
| [Сейлор] 1.6, «Изотопы и атомные массы». | нет | 10 |
| [Сейлор] 6.1, «Волны и электромагнитная энергия». | нет | 8 |
| [Сэйлор] 6.2, «Квантование энергии». | нет | 3, 6 |
Для дальнейшего изучения
Дополнительная литература
Ottaviani, J. Язык приостановлен: жизнь, открытия Нильса Бора и век, который он создал . GT Labs: Анн-Арбор, Мичиган, 2004. ISBN: 9780978803728.
Розенталь, С. Нильс Бор: его жизнь и работа глазами его друзей и коллег . Нью-Йорк, Нью-Йорк: Wiley, 1967.
Бор, Нильс Х. Д. О строении атомов и молекул . Нью-Йорк, Нью-Йорк: В. А. Бенджамин, 1963.
Бор, Нильс Х. Д. Атомная физика и человеческие знания . Нью-Йорк, Нью-Йорк: Уайли, 1958.
Бор, Нильс. «О строении атомов и молекул». Philosophical Magazine Series 6 26 (июль 1913 г.): 1-15.
Cathcart, B. Муха в соборе: как небольшая группа кембриджских ученых выиграла гонку за разделение атома . Нью-Йорк, Нью-Йорк: Penguin, 2005. ISBN: 9780670883219.
Андраде, Э. Н. Резерфорд и природа атома . Гарден-Сити, Нью-Йорк: Даблдей, 1964.
Фрейн, М. Копенгаген: Игра в двух действиях .Нью-Йорк, Нью-Йорк: С. Френч, 2000.
Миллер, Д. П. Открытие воды: Джеймс Ватт, Генри Кавендиш и спор о воде девятнадцатого века . Burlington, VT: Ashgate, 2004. ISBN: 9780754631774.
Кавендишская лаборатория
Как работают атомы
человек
Джозеф Томпсон – Нобелевская премия по физике 1906 г.
Эрнест Резерфорд – 1908 г. Нобелевская премия
Йоханнес Йоханн Эрнест МарсденМакс Планк – Нобелевская премия 1918 г. по физике
Альберт Эйнштейн – Нобелевская премия 1921 г. – Нобелевская премия по физике 1932 года
Гарольд Юри – Нобелевская премия 1934 года по химии
Шарль-Огюстен де Кулон
Джеймс Прескотт Джоуль
Прочие данные в OCW и OER
«Предыдущая | Следующая »
Что такое атомная модель Джона Далтона?
Атомная теория – то есть вера в то, что вся материя состоит из крошечных неделимых элементов – имеет очень глубокие корни.Изначально теория появилась тысячи лет назад в греческих и индийских текстах как философская идея. Тем не менее, это не было принято с научной точки зрения до 19 века, когда подход, основанный на фактах, начал раскрывать, как выглядела атомная модель.
Именно в это время Джон Далтон, английский химик, метеоролог и физик, начал серию экспериментов, завершившихся тем, что он предложил теорию атомного состава, впоследствии известную как теория атома Дальтона, которая стала одной из краеугольные камни современной физики и химии.
Помимо создания модели атомных взаимодействий, Джону Далтону также приписывают разработку законов для понимания того, как работают газы. Со временем это привело бы его к выводам о том, как атомы взаимодействуют, о весе атомов и к разработке законов, которые устанавливают атомную теорию как научную дисциплину.
Газовые законы Далтона:
Далтон придумал свою теорию атомов в результате своих исследований газов. Это началось в 1800 году, когда Далтон стал секретарем Манчестерского литературно-философского общества.Находясь там, Дальтон начал представлять серию эссе, в которых излагались его эксперименты по составу смешанных газов, включая давление пара и других паров при разных температурах при испарении. и о тепловом расширении газов.
В своих эссе Дальтон описал эксперименты, в которых он стремился определить давление пара в различных точках от 0 до 100 ° C (от 32 до 212 ° F). Основываясь на своих наблюдениях за шестью различными жидкостями, Дальтон пришел к выводу, что изменение давления пара для всех жидкостей было эквивалентным для одного и того же изменения температуры и одного и того же пара при любом заданном давлении.
Он также пришел к выводу, что все упругие жидкости под одним и тем же давлением расширяются одинаково при воздействии тепла. Кроме того, он заметил, что для любого данного расширения ртути (т. Е. Отмеченного повышения температуры с помощью ртутного термометра) соответствующее расширение воздуха пропорционально меньше, чем выше температура.
Изображение атомной структуры атома гелия. Предоставлено: Wikipedia / Creative Commons. Это стало основой закона Дальтона (он же закон парциальных давлений Дальтона), который гласил, что в смеси нереагирующих газов полное оказываемое давление равно сумме парциальных давлений. отдельных газов.
Атомная теория Дальтона:
В ходе исследования газов Дальтон также обнаружил, что определенные газы могут быть объединены только в определенных пропорциях, даже если два разных соединения имеют один и тот же общий элемент или группу элементов.
Эти эксперименты основывались на двух теориях, которые возникли в конце 18 века и относились к химическим реакциям. Первым был закон сохранения массы, сформулированный Антуаном Лавуазье в 1789 году, который гласил, что общая масса в химической реакции остается постоянной – т.е.е. что реагенты имеют ту же массу, что и продукты.
Второй – это закон определенных пропорций, впервые доказанный французским химиком Жозефом Луи Прустом в 1799 году. Этот закон гласит, что если соединение разбивается на составляющие элементы, то массы составляющих всегда будут иметь одинаковые пропорции, независимо от количества или источника исходного вещества.
Различные атомы и молекулы, изображенные в книге Джона Дальтона «Новая система химической философии» (1808).Фото: Public DomainИзучая эти законы и опираясь на них, Далтон разработал свой закон множественных пропорций. Этот закон гласит, что если два элемента могут быть объединены для образования ряда возможных соединений, то отношения масс второго элемента, которые объединяются с фиксированной массой первого элемента, будут отношениями малых целых чисел.
Другими словами, элементы объединяются на атомном уровне в фиксированных соотношениях, которые, естественно, различаются в зависимости от соединяемых соединений из-за их уникального атомного веса.Полученные результаты легли в основу «Атомных законов или модели» Дальтона, в которой основное внимание уделяется пяти основным теоремам. Т
Состояние, в котором элементы в чистом виде состоят из частиц, называемых атомами; что атомы определенного элемента одинаковы, вплоть до самого последнего атома; что атомы разных элементов можно отличить друг от друга по их атомному весу; что атомы элементов объединяются в химические соединения; и что атомы не могут быть ни созданы, ни разрушены в химической реакции, меняется только группировка.
Дальтон также считал, что атомная теория может объяснить, почему вода поглощает разные газы в разных пропорциях – например, он обнаружил, что вода поглощает углекислый газ намного лучше, чем азот. Дальтон предположил, что это произошло из-за различий в массе и сложности соответствующих частиц газа.
Модель атома Дальтона, основанная на пяти пунктах его атомной теории. Предоставлено: modernbiochemistry.weebly.comФактически, именно это наблюдение считается первым случаем, когда Дальтон намекнул на предполагаемое существование атомов.В статье, посвященной абсорбции газа в воде, которая была впервые опубликована в 1805 году, он писал:
«Почему вода не допускает в равной степени всех видов газа? Я должным образом рассмотрел этот вопрос, и хотя я не могу полностью удовлетворить себя, я почти убежден, что обстоятельства зависят от веса и количества основных частиц нескольких газов ».
Дальтон предположил, что каждый химический элемент состоит из атомов одного уникального типа, и, хотя они не могут быть изменены или разрушены химическими средствами, они могут объединяться, образуя более сложные структуры (т.е. химические соединения). Это ознаменовало собой первую по-настоящему научную теорию атома, поскольку Дальтон пришел к своим выводам путем экспериментов и изучения результатов эмпирическим путем.
Дальтон и атомный вес:
Dalton’s также начал изучать атомные веса на основе массовых соотношений, в которых они сочетаются, с атомом водорода, взятым в качестве стандарта. Однако Дальтон был ограничен грубостью своих лабораторных приборов и тем фактом, что он не предполагал, что атомы определенных элементов существуют в молекулярной форме, такой как чистый кислород (O 2 ).
Он также считал, что простейшее соединение между любыми двумя элементами всегда состоит из одного атома. Лучше всего это было проиллюстрировано тем, как он думал, что химическая формула воды – это H2O, а не H 2 O.
Джон Далтон, отец современной теории атома. Кредит: chemheritage.orgВ 1803 году Дальтон устно представил свой первый список относительных атомных масс для ряда веществ. Эта статья была опубликована в 1805 году, но он не обсуждал в ней, как именно он получил эти цифры.В 1807 году его метод был раскрыт его знакомым Томасом Томсоном в третьем издании учебника Томсона, A System of Chemistry . Наконец, Далтон опубликовал полный отчет в своем собственном учебнике A New System of Chemical Philosophy в 1808 и 1810 годах.
Научные недостатки:
Главный недостаток теории Дальтона – то есть существование как молекул, так и атомов – позже был исправлен в принципе в 1811 году Амедео Авогадро. Авогадро предположил, что равные объемы любых двух газов при одинаковой температуре и давлении содержат равное количество молекул.Другими словами, масса частиц газа не влияет на объем, который он занимает.
Закон Авогадро позволил ему установить двухатомную природу многих газов, изучая объемы, с которыми они реагируют. Таким образом, Авогадро смог предложить более точные оценки атомной массы кислорода и различных других элементов и провести четкое различие между молекулами и атомами. Увы, эти и другие открытия противоречили теориям Далтона и уточняли их.
Например, с тех пор ученые обнаружили, что атом, который когда-то считался самой маленькой частью материи, на самом деле может быть разделен на еще более мелкие элементарные частицы.И хотя Дальтон рассматривал атомы как единое целое без разделения между положительными, отрицательными и нейтральными зарядами, последующие эксперименты Дж. Дж. Томсон, Эрнест Резерфорд и Нилс Бор раскрыли более сложную структуру атома.
Модель атома азота Нилса Бора. Кредит: britannica.comЭти теории были позже подтверждены наблюдениями, сделанными с помощью электронного микроскопа. Мы также знаем, что атомный вес – это продукт строения самих атомов.Следовательно, модель атома Дальтона в ее чистом виде теперь считается пригодной только для химических реакций. Однако это не умаляет вклада Далтона в современную науку.
До его времени атом был не более чем философской конструкцией, унаследованной от классической античности. Новаторская работа Далтона не только воплотила теорию в жизнь, но и привела ко многим другим открытиям, таким как теория относительности Эйнштейна и квантовая теория Планка – две области исследований, которые составляют основу нашего современного понимания космоса.
Сегодня мы написали много интересных статей об атомной теории здесь, во Вселенной. Вот один о количестве атомов во Вселенной, о том, каковы части атома? Кто был Демокрит?, Об атомной модели Бора и о том, что такое модель сливового пудинга?
Если вы хотите узнать больше о модели Далтона, ознакомьтесь со статьей из Университета Центрального Квинсленда об атомной модели Далтона.
Astronomy Cast записали много интересных эпизодов на эту тему. Посмотрите их – Эпизод 138: Квантовая механика, Эпизод 378: Резерфорд и атомы и Эпизод 392: Стандартная модель – Введение.
Нравится:
Нравится Загрузка …
История атома 1: Древние греки
Фото: Clipart.com.Назначение
Чтобы познакомить студентов с древними теориями материи, которые привели к работе Джона Далтона.
Контекст
Этот урок является первым из серии из пяти частей, которая расширит и углубит понимание учащимися атома и истории его открытия и развития с древних времен до наших дней.
На этом уроке исследуются теории древних греков об атоме. История атома 2: Далтон исследует ранние вехи в теории атома и роль Джона Далтона. История атома 3: Периодическая таблица рассматривает раннее развитие периодической таблицы и ее влияние на атомную мысль. История атома 4: Дж. Дж. Томсон анализирует эволюцию современных представлений о внутренней работе атомов, а Дж. Дж. Вклад Томсона. История атома 5: Современная теория исследует развитие современной теории атома.
Греческие философы Левкипп и Демокрит впервые разработали концепцию атома в 5 -м веке до н. Э. Однако, поскольку Аристотель и другие выдающиеся мыслители того времени категорически противостояли их идее об атоме, их теория оставалась незамеченной и по существу похоронена до 16 -го и 17 -го веков. Со временем новаторские эксперименты Лавуазье 18 -го -го века точно измерили все вещества, участвующие в процессе горения, доказав, что «когда вещества горят, нет чистого прироста или потери веса.Лавуазье основал науку современной химии, которая получила большее признание благодаря усилиям Джона Дальтона, модернизировавшего древнегреческие идеи элемента, атома, соединения и молекулы; и предоставил средства количественного объяснения химических реакций. ( Наука для всех американцев, , стр. 153–155.)
По мере того, как эта серия уроков исследует дальнейшие открытия в конфигурации, связях и внутренних структурах атомов, учащиеся поймут, насколько более утонченной, модернизированной и научной атомной теория стала после критических открытий Лавуазье и Дальтона три столетия назад. .
Студентам важно понимать, что изучение материи продолжается и по сей день, и что тысячелетние усилия человечества по выявлению, пониманию и документированию природы материи в конечном итоге создали современные науки, такие как химия, и продолжают вести к бесчисленным целенаправленным исследованиям. технологические достижения и изобретения, такие как телевизоры и компьютеры, которые делают жизнь человечества все более и более полноценной, удобной, а иногда и неприятной. Студенты также должны осознать, что с течением времени представления древних о материи часто оказывались неточными с помощью современной науки.
В средней школе ученики должны были познакомиться с ранними теориями материи и с тем, как они привели к работам Лавуазье и рождению современной химии. Это понимание поможет студентам лучше понять важность работы Джона Далтона и то, как он в конечном итоге положил начало «последовательному использованию языка, научной классификации и символов в создании современной химии». ( Benchmarks for Science Literacy , pp. 250–251.)
Идеи этого урока также связаны с концепциями, содержащимися в этих стандартах Common Core State:
- CCSS.ELA-Literacy.RST.9-10.1 Приводите конкретные текстовые доказательства для поддержки анализа научных и технических текстов, уделяя внимание точным деталям объяснений или описаний.
- CCSS.ELA-Literacy.RST.9-10.2 Определение основных идей или выводов текста; проследить текст объяснения или изображения сложного процесса, явления или концепции; дайте точное изложение текста.
Планирование вперед
Этот урок должен длиться два урока по 45 минут.
Вы можете распечатать и сделать копии этих ресурсов, которые студенты будут читать на уроке, если у ваших учеников нет доступа к компьютерам с доступом в Интернет:
Мотивация
Перед тем, как учащиеся начнут изучение истории атома в Интернете, просмотрите свои нынешние знания, задав такие вопросы:
- Что такое материя?
- Что такое атом?
- Что такое элемент?
- Почему, по вашему мнению, важно изучать историю атома?
- Как вы думаете, каким образом изучение материи повлияло на нашу жизнь?
- (Ответы будут разными.Принимаю любые ответы.)
- (Материя – это все, что имеет массу и занимает пространство.)
- (Атом – самая маленькая частица элемента.)
- (Элемент – это вещество, которое не может быть разложено на более простые вещества в обычных условиях.)
- (Ответы могут быть разными. Примите любые ответы.)
Обсуждая эти идеи, помните о распространенных заблуждениях, которые могут иметь студенты. Например, учащиеся могут рассматривать материю как «все, что существует, является материей, включая тепло, свет и электричество». Они также могут подумать, что «материя не включает жидкости и газы или что они невесомые». Наконец, они могут рассматривать вес материи как «ощутимый вес» – то, что они не могут почувствовать, считается вообще не имеющим веса.”( Benchmarks for Science Literacy , pp. 336–337.) Старшеклассники должны уметь распознавать эти более ранние заблуждения.
Мероприятие – Путешествие во времени: Греция, 5 – век до н. Э.
Чтобы пробудить интерес студентов и сфокусировать обсуждение, предложите студентам следующий сценарий. Отображение старой карты Греции может улучшить этот опыт.
«Теперь представьте, если хотите, что вы можете отправиться в прошлое, в 5 -е годы века до нашей эры.C.E. Вы оказываетесь в Древней Греции в присутствии Левкиппа и Демокрита, двух философов, которым приписывают создание концепции атома. У вас есть привилегия наблюдать за двумя мужчинами, как они работают, и обсуждать свои идеи об атоме ».
Затем задайте следующие вопросы. Для студентов не так важно давать точные ответы, как пытаться понять эпоху, обстоятельства и особенности, которые могли произойти, когда впервые возникла атомарная концепция.Одевание учеников в сандалии древних греков также поможет им лучше понять простой человеческий мыслительный процесс, который участвовал в разработке этих поистине глубоких и невообразимых в других отношениях концепций.
Спросите студентов:
- Что вы видите? На что похожи эти мужчины?
- Почему они говорят о концепциях?
- Как вы думаете, что они думают об атоме?
- Как вы думаете, как они пришли к таким выводам? Какие инструменты, если таковые имеются, они используют?
- Что примечательного в том, что они делают?
(Примите все ответы, но попросите учащихся дать объяснения, подтверждающие их точку зрения.)
Цель этих упражнений состоит в том, чтобы подготовить урок и установить уровень осведомленности учащихся об основных концепциях и важнейших ранних фигурах, которые первыми их разработали.
Разработка
Class One
После этой разминки учащиеся должны использовать свою школьную тетрадь «Древние греки», чтобы перейти и прочитать «Греческую концепцию атома : неделимый атом». Эта статья должна послужить хорошим ориентиром в отношении ранних греческих теорий атома.По мере того, как студенты читают подробности о Левкиппе и Демокрите, пять основных моментов их атомной концепции и судьбу их идей до 17 -го века, побуждайте их делать заметки.
После того, как учащиеся прочитают статью, задайте им такие вопросы (перечислены в листе для учащихся «Древние греки»):
- Каким образом современная цивилизация узнала об идеях Левкиппа и Демокрита?
- Каковы пять основных положений их атомной теории?
- Какое значение имеет нижний предел, до которого можно разделить атом?
- Какова цель «пустоты»?
- Как, по вашему мнению, эти философы смогли теоретизировать с такой степенью конкретности о характеристиках (невидимого) атома и законах природы?
- Почему их идеи «отходили на задний план» атомной мысли до 17 -го века?
- (Поскольку почти все оригинальные сочинения Левкиппа и Демокрита были утеряны, современный мир узнал об их идеях из сочинений Эпикура и Лукреция.Выступление Аристотеля против их идей также помогло подавить теории атома в его время.)
- (Они заключаются в том, что (1) вся материя состоит из атомов, которые слишком малы, чтобы их можно было увидеть и которые нельзя разделить на другие части; (2) существует пустота, которая представляет собой пустое пространство между атомами; (3) атомы полностью состоят из твердые; (4) атомы однородны, без внутренней структуры; и (5) атомы различаются по размеру, форме и весу.)
- (Имея конечный, нижний предел, до которого можно разделить атом, устанавливается «постоянный фундамент из элементарных частиц, из которых можно построить все, что мы видим».)
- (Для изменения атомов необходимо движение. Движение становится возможным только в пустоте или «пространстве, полностью пустом от материи, через которое атомы могут перемещаться с места на место.”)
- (Аристотель, выдающийся философ того времени, не соглашался с их концепциями, как и католическая церковь, которая не соглашалась с атомистическим представлением о том, что вселенная бесконечна и «не создана какой-либо внешней силой» [Богом].)
Обсуждая конкретные перспективы каждого пункта, подчеркните, что современная наука доказала, что ранние греки неверны относительно атомов, не имеющих внутренних пустот (точка № 3, Резерфорд) или внутренней структуры (точка № 4, Томсон). . Неточное представление о том, что атомная теория была похоронена между «Демокритом и Дальтоном», также требует рассмотрения, поскольку ее эволюция и открытие можно приписать многочисленным важным фигурам, которые внесли свой вклад в ее развитие в промежутке.
Второй класс
Во-первых, учащиеся должны использовать свои электронные таблицы, чтобы перейти к «Атомистам: Левкипп из Милета и Демокрит из Абдеры», прочитать и сделать заметки. Обсуждая материал, задавайте следующие вопросы:
- Какой конкретный вклад внесли Левкипп и Демокрит в развитие своей теории атома?
- Почему Левкипп впервые разработал основную теорию атома в ответ на элеатов?
- Как философы оценивали атомы с точки зрения чувств?
- Согласно Демокриту, как образуются вселенные?
- Чем современная атомная теория отличается от ранних атомистов?
- (В общих чертах, Левкипп первым разработал теорию атомов и пустоты, а Демокрит развил ее.)
- (Он считал, что их теория о том, что Вселенная состоит из бесконечно неподвижной массы, называемой «Единым», была неточной, поскольку наши органы чувств говорят нам, что движение происходит.)
- (Они считали, что чувства «не совсем надежны в том, что они сообщают уму», но что независимо от того, является ли что-то горячим, холодным или определенного цвета, эти характеристики, в конце концов, определяются «типом атом и количество пустоты. »)
- (Его теория предполагает, что атомы соединяются и образуют водоворот или вихрь.Затем более тяжелые материалы притягиваются к центру вихря и образуют Землю. Более легкие материалы «выходят на край вихря и в конечном итоге воспламеняются из-за большой скорости его вращения. Эти более легкие атомы затем образуют небесные тела ».)
- (Современные теоретики считают, что «атом почти полностью пуст с очень плотным центром, а не полностью твердым без пустоты.»)
Студенты должны уйти от этого чтения с более глубоким пониманием отдельных вкладов Левкиппа и Демокрита в развитие их теории, противоположных теорий элеатов,« основ »их атомистической теории, того, как действуют органы чувств. Вселенная была рационализирована атомарно, и то, как такие фигуры, как Эпикур и Лукреций, позже внесут свой вклад в развитие теории, которая развивается до сих пор.
Затем учащиеся должны прочитать третье ключевое чтение этого урока, Демокрит Абдерский.Изучая его жизнь и роль в теории атома, включите в свое обсуждение следующие вопросы:
- Что сделало Демокрита «человеком большой учености»?
- Был ли Левкипп первым, кто предложил атомную теорию? Объяснять.
- Каким образом Демокрит продвинул и расширил атомную теорию?
- Насколько это было значительным?
- Что было необычного в теории Демокрита о происхождении Вселенной?
- Что примечательного в желании Демокрита «избавиться от веры в богов»?
- (Демокрит много путешествовал в поисках знаний и ученых людей, с которыми можно было бы заняться. Демокрит, опытный геометр, также внес свой вклад в развитие математики, физики, этики и поэзии.)
- (Нет. Анаксагор также придумал атомную систему, и считается, что атомная мысль восходит к ранней пифагорейской концепции, согласно которой «правильные твердые тела играли фундаментальную роль в устройстве Вселенной.”)
- (Он сделал атомную теорию более «детально проработанным и систематическим взглядом на физический мир», чем его предшественники. Он «утверждал, что пространство или Пустота имеет равное право с реальностью или Бытием, считаться существующим. Он задумал о Пустота как вакуум, бесконечное пространство, в котором движется бесконечное количество атомов, составляющих Существо [то есть физический мир]. Эти атомы вечны и невидимы, абсолютно малы, настолько малы, что их размер невозможно уменьшить.. . абсолютно полные и несжимаемые, так как не имеют пор и целиком заполняют занимаемое пространство; и однородные, различающиеся только формой, расположением, положением и величиной »)
- (Установив основу для физического мира, он мог описать, как вещи – атомы – изменяются, движутся и упаковываются вместе. Кроме того, он стремился объяснить «всю физику» и то, что физический мир в конечном итоге может быть объяснен в количественные термины и «подчиняются математическим законам».”)
- (Предполагалось, что мир возник из природы атомов [необходимость], а не был создан каким-то «сверхъестественным существом».)
- (Он считал, что боги были «представлены только для объяснения явлений, которым тогда не было научного объяснения». Такой взгляд предполагает, что существует альтернативный, нерелигиозный способ взглянуть на мир и его понимание: наука.)
Оценка
В зависимости от вашего свободного времени это задание может быть выполнено в классе и / или в качестве домашнего задания.
Студентам важно понимать ранние теории материи, которых придерживались Левкипп и Демокрит, включая взгляды тех, кто выступал против них, таких как элеаты и Аристотель. Чтобы лучше понять свои чтения и ресурсы, учащиеся должны создать таблицу, в которой они заполнят характеристики различных теорий.Они также должны написать очень краткий анализ того, чем теории похожи и чем они различаются. Их диаграммы могут послужить очень полезной основой при переходе к другим урокам этой серии.
Расширения
Следуйте этому уроку с другими уроками из серии по истории атома: История атома 2: Дальтон, История атома 3: Периодическая таблица, История атома 4: Дж. Дж. Томсон и История атома 5: современная теория.
Для более глубокого понимания развития теории атома и ее фигур предложите студентам прочитать «Атомизм», в котором подробно рассказывается о том, как развивалась ранняя теория атома на протяжении веков, вплоть до Галилея в 1600-х годах.
Для более глубокого понимания и подробностей согласия и противодействия Аристотеля теориям Левкиппа и Демокрита, предложите студентам изучить Атомистов до Аристотеля.
Студентам также может быть интересно прочитать и написать подробные биографии Левкиппа Милетского и Аристотеля.
Отправьте нам отзыв об этом уроке>
.