Константы диссоциации.
Закон действующих масс может быть применен к водным растворам кислот. Например, в водном растворе уксусной кислоты устанавливается следующее равновесие:
Константа этого равновесия определяется выражением
Величина Ка называется константой диссоциации кислоты. Ее размерность такая же, как размерность концентрации: моль/дм3. Константу диссоциации кислоты можно также выразить с помощью закона разбавления Оствальда:
где с-исходная концентрация кислоты, а а-степень диссоциации кислоты. Эту степень диссоциации можно установить, определяя молярные электропроводности раствора с заданной концентрацией, а также бесконечно разбавленного раствора (подробнее об этом см. в гл. 10).
Константа диссоциации кислоты является мерой силы этой кислоты. Для таких кислот, как соляная кислота, которая практически полностью диссоциирована в водном растворе, константа диссоциации имеет очень большую величину.
жением:
Для большинства известных кислот величина рКa принимает значения в интервале от 1 до 14. Сильные кислоты имеют низкие значения рКа, а слабые кислоты-высокие значения. В табл. 8.1 указаны значения Кл и рКл для некоторых кислот. Многопротонные кислоты, как, например, h3SO4 и h4PO4, характеризуются несколькими константами диссоциации.
Сильные основания характеризуются низкими значениями рКь, а слабые основания-высокими значениями. Значения Кь и рКь для некоторых оснований приведены в табл. 8.1.
Оглавление:
Определите константу равновесия Ka химической реакции В при температуре T с использованием средних изобарных теплоемкостей.
 2. Запишите в общем виде выражение
2. Запишите в общем виде выражениеНапишите мне в whatsapp, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
Закажите у меня новую работу, просто написав мне в whatsapp! |
Описание заказа и 38% решения ( + фото):
Определите константу равновесия Ka химической реакции В при температуре T с использованием средних изобарных теплоемкостей. Запишите в общем виде выражение для константы равновесия химической реакции B через парциальные давления реагирующих веществ. Определите парциальные давления газообразных веществ при температуре T и атмосферном давлении. Оцените влияние изменения общего давления, температуры и разбавления реакционной смеси газом, не участвующим в химической реакции, на положение равновесия реакции и равновесный выход продукта. PbS + 2O2 = PbO2 + SO2 Т = 500 К
Решение
1.
Похожие готовые решения по химии:
© Преподаватель Анна Евкова
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Правовые документы
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
YON-KA.RU » Что такое поры?
В этой статье мы рассмотрим тему пор, чтобы помочь вам понять, что это такое и какую роль они играют в здоровье кожи. Мы также рассмотрим более подробно, как очистить и сузить поры с помощью домашних препаратов по уходу за кожей.
Что же такое поры?
Если вы когда-нибудь видели рекламу средств по уходу или посещали спа-салон, вы слышали термин “поры”.
Поры находятся на поверхности кожи. Они расположены в верхней части каждого волосяного фолликула, и именно там кожа высвобождает кожное сало (масло), вырабатываемое естественным путем. Внешний вид ваших пор может меняться с течением времени и может зависеть от ряда факторов, включая генетику, факторы окружающей среды и различные проблемы с кожей.
Что вам нужно знать о порах?
Самое главное, что вы должны помнить о порах – их размер и внешний вид во многом определяются генетикой.
Ваш тип кожи влияет на то как выглядят поры. У большинства людей комбинированная кожа и размеры пор тоже разные. Расширенные поры у более жирной Т-зоны и маленькие у более сухой кожи. Поскольку размер пор в первую очередь определяется генетикой, вы не можете его контролировать. Однако правильное очищение поможет избавиться от расширенных пор.
Одним из самых важных шагов в сокращении размера пор является очищение. Когда ваши поры забиты, они могут воспалиться и стать более заметными. Когда ваши поры чистые они кажутся менее заметными.
Хотя вы не можете изменить размер пор, вы можете контролировать или реагировать на определенные факторы окружающей среды, которые могут повлиять на размер ваших пор. Читайте дальше, чтобы узнать больше.
Советы по очищению и сужению пор
Очищение это главный фактор для сужения пор. Кожа с маленькими порами выглядит более гладко и молодо, чего и добивается каждый.
Чтобы уменьшить поры, важно соблюдать регулярную процедуру ухода за кожей, состоящую из очищающих, детоксицирующих, отшелушивающих и увлажняющих препаратов. Регулярные очищающие процедуры для лица с физической или химической экстракцией в сочетании с глиняной маской – это лучший способ очистить поры.
Вот несколько советов для очищения и сужения пор:
- Пересмотрите свои препараты и убедитесь, что они правильно подходят для вашего типа кожи (сухой, жирной, чувствительной или комбинированной).

- Ограничьте использование высушивающих препаратов, таких как салициловая кислота (используется для лечения акне), потому что чрезмерное использование может раздражать и высушивать кожу, увеличивая поры.
- Выберите мягкое очищающее средство и используйте его дважды в день. Утром и перед сном.
- Эксфолиация один или два раза в неделю. Избегайте пилингов, если вы испытываете воспаление.
- Увлажните кожу. Выберите увлажняющий крем, соответствующий вашему типу кожи.
- Используйте глиняные маски для удаления жира, грязи и омертвевшей кожи из ваших пор – это лучший способ очистить ваши поры, чтобы они стали меньше.
- Всегда наносите солнцезащитный крем, чтобы защитить кожу от вредных UVA и UVB лучей.
- Полностью снимите макияж перед сном и нанесите увлажняющий крем или ночной крем для восстановления и увлажнения кожи.
Рекомендуемые в домашних условиях препараты для сужения пор
Очищение является важным элементом любого ухода, но оно особенно важно для уменьшения пор. Чтобы получить наилучший результат, выберите очищающее средство, которое хорошо подходит для вашего типа кожи.
Чтобы получить наилучший результат, выберите очищающее средство, которое хорошо подходит для вашего типа кожи.
Вот лучшие препараты
Yon-Ka (Йонка), которые мы рекомендуем для ухода за кожей:- Маска Masque 103 – предназначена для нормальной и жирной кожи. Эта тройная глиняная маска глубоко очищает поры. Благодаря составу из трех глин и эфирным маслам, маска способствует улучшению цвета лица и сокращению пор.
- Маска Masque 105 – глиняная маска разработана для сухой или чувствительной кожи. В то время как многие маски сушат кожу, Маска Masque 105 специально разработана для детоксикации и очищения кожи склонной к сухости и чувствительности.
- Эксфолиатор Gommage Yon-Ka – нежный, не гранулированный отшелушивающий гель. Он очищает кожу, увлажняя и осветляя ее. Благодаря экстракту Карбо, Эксфолиатор Gommage Yon-Ka сужает поры и укрепляет кожу, в то время как эфирное масло лайма улучшает сияния вашей кожи.

- Скраб Guarana Scrub – предназначен для всех типов кожи. Этот отшелушивающий скраб содержит 11 активных растительных экстрактов, включая Амазонское семя гуараны, органический порошок рисовых отрубей и ряд эфирных масел для смягчения, очистки и детоксикации кожи.
Если вы хотите очистить и сузить поры, подумайте об использовании профессиональных препаратов Yon-Ka.
Расчет значения Ka на основе известного значения pH
- Последнее обновление
- Сохранить как PDF
- Определения
- Ссылки
- Авторы и авторства
Величина pH , или «мощность водорода», представляет собой численное представление кислотности или основности раствора. +] & = -4.{-10} \ end {align *} \]
+] & = -4.{-10} \ end {align *} \]
Список литературы
- Петруччи и др. Общая химия: принципы и современные приложения; Девятое издание, Пирсон / Прентис Холл; Аппер-Сэдл-Ривер, Нью-Джерси 07.
Авторы и авторство
- Пейдж Норберг (UCD) и Габриэла Мастро (UCD)
Равновесие слабой кислоты
При добавлении незаряженной слабой кислоты в воду однородный равновесные формы, в которых водные молекулы кислоты, HA (aq), реагируют с жидкая вода с образованием водных ионов гидроксония и водных анионов, A – (водн.).Последние образуются, когда молекулы кислоты теряют ионы H + . к воде.
HA (водн.) + H 2 O (л) H 3 O + (водн.) + A – (водн.)
При написании выражения для константы равновесия для этого
однородный
равновесие, мы не учитываем концентрацию жидкой воды. В
константа равновесия для этого выражения называется кислотной диссоциацией
постоянная, К a .
В
константа равновесия для этого выражения называется кислотной диссоциацией
постоянная, К a .
= константа диссоциации кислоты
Когда в растворе возникает рассматриваемое равновесие, химический формулы, заключенные в скобки в выражении константы равновесия представляют собой молярности веществ (молей растворенного вещества на литр решение).
Помните, что H + можно использовать для представления H 3 O + , тем самым упрощая наше описание реакции между слабой кислотой и выражение константы диссоциации воды и ее кислоты:
HA (водн.) H + (водн.) + A – (водн.)
= константа диссоциации кислоты
Например, уксусная кислота является слабой кислотой, потому что, когда ее добавляют в
вода, он обратимо реагирует с водой с образованием
гидроксоний и ацетат-ионы.
HC 2 H 3 O 2 (водн.) + H 2 O (л) H 3 O + (водн.) + C 2 H 3 O 2 – (водн.)
или HC 2 H 3 O 2 (водн.) H + (водн.) + C 2 H 3 O 2 – (водн.)
= 1.8 × 10 -5
ПРИМЕР 1 – Написание кислоты Константа диссоциации: напишите уравнение реакции между слабокислой азотистой кислоты и воды и напишите выражение для ее константа диссоциации кислоты.
Решение :
HNO 2 (водн.) + H 2 O (л) H 3 O + (водн.) + NO 2 – (водн.)
или HNO 2 (водн.
) H + (водн.) + NO 2 – (водн.)
В таблице ниже приведены константы кислотной диссоциации некоторых распространенных слабые кислоты.Эти значения K a могут использоваться для описания относительная сила кислот. Более сильная кислота произведет больше ионы гидроксония в растворе. Чем больше K a , тем больше отношение ионов (включая ионы гидроксония) к незаряженной кислоте. Следовательно, большее значение K a указывает на более сильную кислоту. Например, чем больше K a для хлорноватистой кислоты (1,2
×
10 – 2 ) по сравнению с уксусная кислота (1.8×
10 – 5 ) говорит нам, что хлорноватистая кислота сильнее уксусной кислоты.Константы диссоциации кислоты, K a , для обычных слабых кислот
Слабая кислота | Уравнение | Ка |
уксусная кислота | HC 2 H 3 O 2 H + + C 2 H 3 O 2 – | 1. × 10 -5 |
бензойная кислота | C 6 H 5 CO 2 H | 6,4 × 10 -5 |
хлорноватистая кислота | HClO 2 H + + ClO 2 – | 1.2 × 10 -2 |
муравьиная кислота | HCHO 2 H + + CHO 2 – | 1,8 × 10 -4 |
синильная кислота | HCN H + + CN – | 6.2 × 10 -10 |
плавиковая кислота | ВЧ H + + F – | 7,2 × 10 -4 |
Бромистоводородная кислота | HOBr H + + OBr – | 2 × 10 -9 |
хлорноватистая кислота | HOCl H + + OCl – | 3. × 10 -8 |
гипоиодистая кислота | HOI H + + OI – | 2 × 10 -11 |
молочная кислота | CH 3 CH (OH) CO 2 H | 1.38 × 10 -4 |
азотистая кислота | HNO 2 H + + НЕТ 2 – | 4,0 × 10 -4 |
фенол | HOC 6 H 5 H + + OC 6 H 5 – | 1.6 × 10 -10 |
пропионовая кислота | CH 3 CH 2 CO 2 H | 1,3 × 10 -5 |
В следующем учебном листе описана одна процедура для расчета
pH растворов слабых кислот. Если вы посещаете другие курсы химии, вы
обнаружит, что существуют варианты этой процедуры для некоторых слабых кислот.
решения.
Если вы посещаете другие курсы химии, вы
обнаружит, что существуют варианты этой процедуры для некоторых слабых кислот.
решения.
Учебный лист – Расчет pH для слабых кислотных растворов
Наконечник – Вам дается концентрации слабого кислотного раствора и попросили вычислить его pH.
Общие шаги –
ШАГ 1 Запишите уравнение для ионизация слабой кислоты в воде.
HA (водн.) H + (водн.) + A
–
(водн.)ШАГ 2 Запишите Ka выражение для слабой кислоты.
ШАГ 3 Опишите каждый равновесная концентрация по x.
x = [H + ] равновесие = [A – ] равновесие
[HA] равновесие = [HA] исходный – x
ШАГ 4 Предположим, что начальная концентрация слабой кислоты примерно равна равновесной концентрация.(Слабые кислоты редко ионизируются в значительной степени. Мы чаще всего можно предположить, что начальная добавленная концентрация, [HA] initial намного больше x. Таким образом, равновесная концентрация равна примерно равняется добавленной концентрации. Вы можете узнать, как имеют дело со слабыми кислотными растворами, для которых это приближение не подходит для других курсов химии.)
[HA] равновесие = [HA] начальное
ШАГ 5 Подключите концентрацию описывается в терминах x в выражение Ka, и решает относительно x.
ПРИМЕР 2 – Расчет pH для Растворы слабой кислоты: уксус – это разбавленный водный раствор уксусной кислоты. с небольшим количеством других компонентов. Рассчитайте pH бутилированной уксус 0,667 M HC 2 H 3 O 2 , предполагая, что ни один из других компонентов не влияет на кислотность решение.
HC 2 H 3 O 2 (водн.) H + (водн.) + C 2 H 3 O 2 – (водн.)
Получаем значение константы диссоциации кислоты для этого реакция из таблицы выше.
x 2 = 1,2
×
10 – 5 x = 3,5×
10 -3[H + ] = 3,5
×
10 -3 М В + pH = -log (3,5×
10 -3 ) = 2,46Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Ka Chemistry Tutorial
Константы диссоциации кислоты Ka Chemistry Tutorial Больше бесплатных руководств Стать членом Члены Вход & тире; в Связаться с намиХотите игры по химии, упражнения, тесты и многое другое?
Вам необходимо стать членом AUS-e-TUTE!
Ключевые понятия
- K a , константа диссоциации кислоты или константа ионизации кислоты, представляет собой константу равновесия, которая относится к диссоциации или ионизации кислоты.
- Для реакции, в которой кислота HA диссоциирует с образованием ионов H + и A –:
HA H + + A –
- K a обеспечивает измерение положения равновесия
(i) если K a велико, предпочтение отдается продуктам реакции диссоциации.

(ii) если K a является небольшим, предпочтение отдается недиссоциированной кислоте.
- K a позволяет измерить концентрацию кислоты.
(i) если K a большой, кислота в значительной степени диссоциирована, поэтому кислота сильная
(ii) если K a мало, очень мало кислоты диссоциирует, поэтому кислота слабая.
- Степень диссоциации или ионизации кислоты может быть представлена в процентах:
% диссоциации (ионизация) = [H + в состоянии равновесия]
[кислотное исходное]× 100 (i) Если% диссоциации ≈ 100%, кислота является сильной кислотой.
(ii) Если% диссоциации невелик, кислота является слабой кислотой.
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Сравнение некоторых констант диссоциации кислоты (25 ° C)
Значение K a , константы диссоциации (константа ионизации) для ряда различных кислот при 25 ° C, показано ниже:
| кислота | формула | K a | |
|---|---|---|---|
| ион аммония | NH 4 + | 5. 6 × 10 -10 6 × 10 -10 | меньше K a |
| борная кислота | H 3 BO 3 | 5,8 × 10 -10 | ↓ |
| синильная кислота (цианистый водород) | HCN | 6,3 × 10 -10 | ↓ |
| бромистоводородная кислота | HOBr | 2.4 × 10 -9 | ↓ |
| хлорноватистая кислота | HOCl | 2,9 × 10 -8 | ↓ |
| пропановая кислота | C 2 H 5 COOH | 1,3 × 10 -5 | ↓ |
| уксусная кислота (этановая кислота) | CH 3 COOH | 1.8 × 10 -5 | ↓ |
| бензойная кислота | C 6 H 5 COOH | 6,4 × 10 -5 | ↓ |
| метановая кислота (муравьиная кислота) | HCOOH | 1,8 × 10 -4 | ↓ |
| молочная кислота | HC 3 H 5 O 3 | 1. 4 × 10 -4 4 × 10 -4 | ↓ |
| азотистая кислота | HNO 2 | 7,2 × 10 -4 | ↓ |
| плавиковая кислота | HF | 7,6 × 10 -4 | ↓ |
| хлорноватистая кислота | HClO 2 | 1.1 × 10 -2 | больше K a |
Сравните константы кислотной диссоциации метановой кислоты (муравьиной кислоты), HCOOH и этановой кислоты (уксусной кислоты), CH 3 COOH:
K a (HCOOH) = 1,8 × 10 -4 (больше K a )
K a (CH 3 COOH) = 1,8 × 10 -5 (меньший K a )
Метановая кислота (муравьиная кислота), HCOOH, имеет большее значение K и , чем этановая кислота (уксусная кислота), поэтому она диссоциирует больше, чем этановая кислота (уксусная кислота).
В водных растворах той же концентрации при тех же условиях, например 0,1 моль л -1 метановой кислоты и 0,1 моль л -1 этановой кислоты, будут:
- В растворе больше недиссоциированных молекул этановой кислоты, чем будет недиссоциированных молекул метановой кислоты На
- больше ионов водорода в растворе метановой кислоты, чем в растворе этановой кислоты.
- , что означает, что pH метановой кислоты будет ниже, чем у раствора этановой кислоты.
Узнайте больше о свойствах карбоновых кислот в учебнике по карбоновым кислотам
Пример: расчет [H
+ ], pH и% диссоциации для сильной кислотыРассчитайте [H + ], pH и% диссоциации в 0,10 моль л. -1 HCl (водн.) При 25 ° C.
- Напишите уравнение диссоциации кислоты:
HCl H + (водн.) + Cl – (водн.)
Поскольку соляная кислота, HCl (водн.), Является сильной монопротоновой кислотой, значение ее константы кислотной диссоциации, K a , будет чрезвычайно большим.

На самом деле, он настолько велик, что мы обычно считаем это реакцией, которая идет до завершения, а не реакцией в равновесии:
HCl → H + (водн.) + Cl – (водн.) - Рассчитайте начальную и равновесную концентрации присутствующих видов с помощью R.I.C.E. Стол:
HCl (водн.) – сильная кислота, она полностью диссоциирует с образованием H + и Cl –, т. Е. 0.10 моль HCl в 1,0 л воды полностью диссоциируют на 0,10 моль H + (водн.) И 0,10 моль Cl – (водн.):
R.I.C.E. Стол реагент товаров R eaction: HCl → H + (водн.) + Cl – (водн.) I начальные концентрации (моль л -1 ) 0.  10
100 0 C Изменение концентрации (моль л -1 ) -0,10 +0,10 +0,10 E равновесные концентрации (моль л -1 ) 0.10 – 0,10
= 00 + 0,10
= 0,100 + 0,10
= 0,10
Из R.I.C.E. Таблица, по завершении (равновесие):
[H + ] = 0,10 моль л -1 - Рассчитайте pH этого раствора при равновесии:
pH = -log 10 [H + ]
pH = -log 10 [0.10] = 1 - Рассчитайте% диссоциации:
[H + ] = 0,1 моль л -1 (при завершении)
[исходная HCl] = 0,1 моль л -1
% диссоциации = [H + ]
[исходный HCl]× 100 % диссоциации = 0.  1
1
0,1× 100 % диссоциации = 100% % диссокация для сильной монопротоновой кислоты составляет 100%.
Пример: расчет [H
+ ], pH и% диссоциации для слабой кислотыРассчитайте [H + ], pH и% диссоциации в 0,10 моль л. -1 HNO 2 (водн.).
K a = 5,0 × 10 -4 при 25 ° C- Напишите уравнение диссоциации кислоты:
HNO 2 (водн.) H + (водн.) + NO 2 – (водн.)
- Запишите выражение константы равновесия для кислотной диссоциации:
К a = [H + ] [NO 2 – ]
[HNO 2 ]5.0 × 10 -4 = [H + ] [НЕТ 2 –]
[HNO 2 ] - Рассчитайте начальную и равновесную концентрации присутствующих видов с помощью R.
 I.C.E. Стол:
I.C.E. Стол:пусть x = моль HNO 2 , которая диссоциирует с образованием H + (водн.) И NO 2 – (водн.)
р.ЛЕД. Стол реагент товаров R eaction: HNO 2 H + + NO 2 – I начальные концентрации (моль л -1 ) 0.10 0 0 Изменение концентрации C (моль л -1 ) – x + х + x E равновесные концентрации (моль л -1 ) 0.10 – х 0 + x
= x0 + x
= xПоскольку HNO 2 является слабой кислотой (K a мало), она диссоциирует лишь незначительно, x будет очень маленьким по сравнению с 0,10
Итак, в состоянии равновесия [HNO 2 ] ≈ 0.
 10 моль л -1
10 моль л -1 - Подставьте значения равновесной концентрации в выражение для константы диссоциации кислоты и решите:
Закон равновесия
Выражение:К, a = [H + ] [NO 2 –]
[HNO 2 ]Заменитель
известные значения:5.0 × 10 -4 = [ x ] [ x ]
[0,10]Собрать
похожих терминов:5,0 × 10 -4 = x 2
0,10Умножить обе стороны
на 0,105,0 × 10 -4 × 0,10 = x 2
0.10× 0,105,0 × 10 -4 × 0,10 = x 2 5,0 × 10 -5 = x 2 Извлечь квадратный корень
из обеих сторон√5,0 × 10 -5 = √ x 2 7.  1 × 10 -3 =
1 × 10 -3 =x Из журнала R.I.C.E. Таблица выше, в состоянии равновесия
[H + ] = x = 7,1 × 10 -3 моль л -1 - Рассчитайте pH при равновесии:
pH = -log 10 [H + ]
pH = -log 10 [7.1 × 10 -3 ] = 2,1
- Рассчитайте% диссоциации при равновесии:
[H + ] в равновесии = 7,1 × 10 -3 моль л -1
[HNO 2 начальная] = 0,10 моль л -1
% диссоциации = [H + ]
[кислотная начальная]× 100 % диссоциации = [7.1 × 10 -3 ]
[0,10]× 100 % диссоциации = 7,1% % диссоциации для слабой кислоты составляет менее 100%, то есть равновесная смесь содержит некоторые недиссоциированные молекулы кислоты, а также катионы и анионы.

Пример: расчет [OH
– ] и pOH для слабой кислоты при 25 ° CРассчитайте [OH – ] и pOH для водного раствора 0.5 моль л -1 уксусной кислоты (этановая кислота).
K a = 1,8 × 10 -5 при 25 ° C.- Напишите уравнение диссоциации кислоты:
CH 3 COOH (водн.) H + (водн.) + CH 3 COO – (водн.)
- Напишите выражение закона равновесия для кислотной диссоциации:
К a = [H + ] [CH 3 COO –]
[CH 3 COOH]1.8 × 10 -5 = [H + ] [CH 3 COO –]
[CH 3 COOH] - Рассчитайте начальную и равновесную концентрации присутствующих видов с помощью R.
 I.C.E. Стол:
I.C.E. Стол:пусть x = моль CH 3 COOH, которые диссоциируют с образованием H + (водн.) И CH 3 COO – (водн.)
р.ЛЕД. Стол реагент товаров R eaction: CH 3 COOH H + + CH 3 COO – I начальные концентрации (моль л -1 ) 0.5 0 0 C Изменение концентрации (моль л -1 ) – x + х + х E равновесные концентрации (моль л -1 ) 0.5 – х 0 + x
= x0 + x
= xТак как CH 3 COOH является слабой кислотой (K a мало), она диссоциирует лишь незначительно, x будет очень мало по сравнению с 0,5.

Итак, в состоянии равновесия [CH 3 COOH] ≈ 0.5 моль л -1
- Подставьте значения концентрации в выражение для константы диссоциации кислоты и решите:
Закон равновесия
Выражение:К, a = [H + ] [CH 3 COO –]
[CH 3 COOH]Заменитель
известные значения:1.8 × 10 -5 = [ x ] [ x ]
[0,5]Собрать
похожих терминов:1,8 × 10 -5 = [ x ] 2
[0,5]Умножить обе стороны
на 0,5:1.8 × 10 -5 × 0,5 = x 2
0,5× 0,59,0 × 10 -6 = x 2 Извлечь квадратный корень
из обеих сторон:√9,0 × 10 -6 = √ x 2 3.  0 × 10 -3 =
0 × 10 -3 =x [H + ] = x = 3,0 × 10 -3 моль л -1
- Рассчитайте концентрацию OH – в водном растворе уксусной кислоты при 25 ° C:
При 25 ° C, K w , константа равновесия для диссоциации воды, составляет 10 -14
Закон равновесия
Выражение:[H + ] [OH – ] = K w Заменить в
известных значений:[3.0 × 10 -3 ] [OH – ] = 10 -14 Разделите обе стороны
на 3,0 × 10 -3 :[ 3,0 × 10 -3] [OH –]
3,0 × 10 -3= 10 -14
3,0 × 10 -3[OH – ] = 3.  3 × 10 -12
3 × 10 -12 [OH – ] = 3,3 × 10 -12 моль л -1
- Рассчитать pOH:
pOH = -log 10 [OH – ]
pOH = -log 10 [3,3 × 10 -12 ] = 11,5
Предупреждение!
Некоторое содержимое на этой странице не может быть отображено.
Пожалуйста, включите JavaScript и всплывающие окна для просмотра всего содержимого страницы.
© AUS-e-TUTEwww.ausetute.com.au
- Напишите уравнение диссоциации кислоты:
Ка Йи Ли | Химический факультет Чикагского университета
Многие заболевания возникают в результате недостаточного или аномального взаимодействия белков и липидов. Выяснение этих взаимодействий и способность исследовать биомембраны, имитирующие реальные жизненные системы, и манипулировать ими, являются ключом к лучшему пониманию этих заболеваний. Используя методы микроскопии и рассеяния на двумерных монослоях и поддерживаемых бислоях в качестве модельных систем, мы проводим фундаментальные исследования взаимодействия между липидами и белками, чтобы лучше понять респираторный дистресс-синдром и болезнь Альцгеймера.
Используя методы микроскопии и рассеяния на двумерных монослоях и поддерживаемых бислоях в качестве модельных систем, мы проводим фундаментальные исследования взаимодействия между липидами и белками, чтобы лучше понять респираторный дистресс-синдром и болезнь Альцгеймера.
Поверхностно-активное вещество легких, сложная смесь липидов и белков, образует монослои на границе раздела воздух-вода альвеол. Поверхностно-активное вещество снижает поверхностное натяжение почти до нуля и, таким образом, снижает работу дыхания.Недостаток сурфактанта либо из-за незрелости у недоношенных детей, либо из-за болезни или травмы у взрослых может привести к РДС. Несмотря на серьезную заболеваемость и смертность от этого заболевания, твердого понимания роли сурфактанта как в нормальных, так и в пораженных легких легких еще не существует. Моя группа заинтересована в разработке подробных взаимосвязей между структурой и функцией различных компонентов легочного сурфактанта. В частности, мы исследуем фазовое поведение различных смесей компонентов легочного сурфактанта, а также взаимодействия между белками, специфичными для легочного сурфактанта, и окружающей липидной матрицей. Мы уделяем особое внимание влиянию белков сурфактанта легких на динамику коллапса монослоя и влиянию белков сыворотки на нормальное функционирование сурфактанта легких. Мы надеемся получить представление о морфологических последствиях разделения фаз и коллапса монослоя, что необходимо для продолжения разработки положительных вмешательств для пациентов, страдающих РДС.
Мы уделяем особое внимание влиянию белков сурфактанта легких на динамику коллапса монослоя и влиянию белков сыворотки на нормальное функционирование сурфактанта легких. Мы надеемся получить представление о морфологических последствиях разделения фаз и коллапса монослоя, что необходимо для продолжения разработки положительных вмешательств для пациентов, страдающих РДС.
А-бета, самособирающийся пептид из 39-43 остатков, образованный протеолитическим процессингом белка-предшественника амилоида, включает в себя основной белковый компонент нейритных бляшек и сосудистых отложений, которые появляются при болезни Альцгеймера, и является одним из причинных факторов при патологии недуга.Поскольку пептидный фрагмент Ab включает 28 остатков сразу за пределами мембраны, помимо первых 11-15 остатков трансмембранного домена, было показано, что он проявляет свойства, общие для поверхностно-активных веществ. Моя группа заинтересована в понимании агрегации пептидов Ab и в использовании двумерных тонких пленок (либо отдельно стоящих монослоев, либо поддерживаемых двойных слоев) в качестве шаблонов для изучения возможности агрегации, индуцированной поверхностью. Мы планируем изучить различные изоформы Ab и изучить их поверхностную активность и их связь с модельными мембранными системами как в их мономерном, так и в агрегированном состоянии.Это может прояснить зависимость процесса агрегации от длины остатка и помочь объяснить, почему более длинные изоформы Ab могут быть более тесно связаны с патологией болезни Альцгеймера, чем их более короткие аналоги. Также известно, что Ab агрегирует и формирует фибриллы, хотя механизм этого до сих пор не совсем понятен. Поскольку скорость этого процесса можно регулировать различными экспериментальными параметрами, мы планируем отслеживать процесс формирования и характеризовать структуру образующихся фибрилл.Наша цель – предоставить модель агрегации Ab.
Мы планируем изучить различные изоформы Ab и изучить их поверхностную активность и их связь с модельными мембранными системами как в их мономерном, так и в агрегированном состоянии.Это может прояснить зависимость процесса агрегации от длины остатка и помочь объяснить, почему более длинные изоформы Ab могут быть более тесно связаны с патологией болезни Альцгеймера, чем их более короткие аналоги. Также известно, что Ab агрегирует и формирует фибриллы, хотя механизм этого до сих пор не совсем понятен. Поскольку скорость этого процесса можно регулировать различными экспериментальными параметрами, мы планируем отслеживать процесс формирования и характеризовать структуру образующихся фибрилл.Наша цель – предоставить модель агрегации Ab.
Другие исследовательские проекты в нашей группе включают внедрение антимикробного пептида протегрина-1 в модельные мембранные системы, структуры и динамику однослойных и двухслойных доменов, герметизацию мембран с помощью полоксамеров и двумерное упорядочение сополимеров стержень-спираль. Экспериментальные методы, используемые в этих исследованиях, включают оптическую и сканирующую зондовую микроскопию, а также рассеяние рентгеновских лучей и нейтронов.
Экспериментальные методы, используемые в этих исследованиях, включают оптическую и сканирующую зондовую микроскопию, а также рассеяние рентгеновских лучей и нейтронов.
Избранные источники
1.Заказанные нанокластеры в липидных / холестериновых мембранах. Мария К. Ратайчак, Шелли Л. Фрей, Ева Ю. Чи, Ярослав Маевски, Кристиан Кьяер и Ка Йи К. Ли, Phys. Rev. Lett. , в печати (2009).
2. Локализация напряжений и складок в тонких упругих мембранах. Лука Поцивавсек, Роберт Деллси, Энди Керн, Себастьян Джонсон, Биньхуа Лин, Ка Йи К. Ли и Энрике Серда, Science 320 (2008) 912-916
3. Механизмы коллапса ленгмюровских монослоев. Ка Йи К.Ли, Ежегодный обзор физической химии 59 (2008) 771-791
4. Липидная мембрана определяет порядок и индуцирует фибриллогенез болезни Альцгеймера Амилоидный пептид. Eva Y. Chi, CanayEge, Amy Winans, JaroslawMajewski, KristianKjaer и Ka Yee C. Lee, Proteins 72 (2008) 1–24.
5. Вытеснение холестерина из мембранных фосфолипидов гексадеканолом. Мария К. Ратайчак, Y.T. Крис Ко, Ивонн Ланге, Теодор Л.Стек и Ка Йи К. Ли, Biophysical Journal , 93 (2007) 2038-2047.
6. Ганглиозид GM1, опосредованный амилоид-бета-фибриллогенез и нарушение мембраны. Ева Ю. Чи, Шелли Л. Фрей и Ка Йи К. Ли, Биохимия , 46 (2007) 1913-1924.
7. Механизм разрушения мембран антимикробным пептидом Протегрин-1. Кин Лок Лам, Юджи Ишицука, Ишан Ченг, Карен Чиен, Алан Дж. Уоринг, Роберт И. Лерер и Ка Йи К. Ли, Journal of Physical Chemistry B , 110 (2006) 21282-21286
8.Взаимодействие между липидными монослоями и полоксамером 188: исследование отражательной способности и дифракции рентгеновских лучей. Guohui Wu, JaroslawMajewski, CanayEge, KristianKjaer, Markus Weygand и Ka Yee C. Lee, Biophysical Journal 89 (2005) 3159-3173.
9. Липидный корроллинг и вытеснение полоксамера в мембранах. Guohui Wu, JaroslawMajewski, CanayEge, KristianKjaer, Markus Weygand и Ka Yee C. Lee, Physical Review Letters 93 (2004) 02810.
Guohui Wu, JaroslawMajewski, CanayEge, KristianKjaer, Markus Weygand и Ka Yee C. Lee, Physical Review Letters 93 (2004) 02810.
10.Взаимодействие антимикробного пептидного протегрина с биомембранами. Дэвид Гидалевиц, Адриан С. Муресан, Алан Дж. Уоринг, Роберт И. Лерер и Ка Йи К. Ли, Proc. Nat. Акад. Sci. 100 , 6302-6305 (2003)
Константы равновесия Ka и Kb Pka Pkb – кислотно-основные равновесия
Константа диссоциации кислоты (Ka) – это количественная мера силы кислоты в растворе, а константа диссоциации основания (Kb) – это мера основности – общей прочности основания.
Ka и pKa
Кислоты классифицируются как сильные и слабые в зависимости от их ионизации в воде. Сильная кислота – это кислота, которая полностью ионизируется в водном растворе. Слабая кислота – это кислота, которая лишь слегка ионизируется в водном растворе.
Ионизацию общей слабой кислоты HA можно записать следующим образом:
Поскольку кислота слабая, можно записать выражение равновесия. Константа ионизации кислоты ( K a ) – константа равновесия для ионизации кислоты.
Ионизация кислоты представляет собой долю исходной кислоты, которая была ионизирована в растворе. Следовательно, числовое значение K a является отражением силы кислоты. Слабые кислоты с относительно более высокими значениями K a сильнее кислот с относительно более низкими значениями K a . Поскольку сильные кислоты ионизированы на 100%, концентрация кислоты в знаменателе почти равна нулю, а значение K a приближается к бесконечности.По этой причине значения K a обычно приводятся только для слабых кислот.
Логарифмическая константа ( pKa ) равна -log10 (Ka).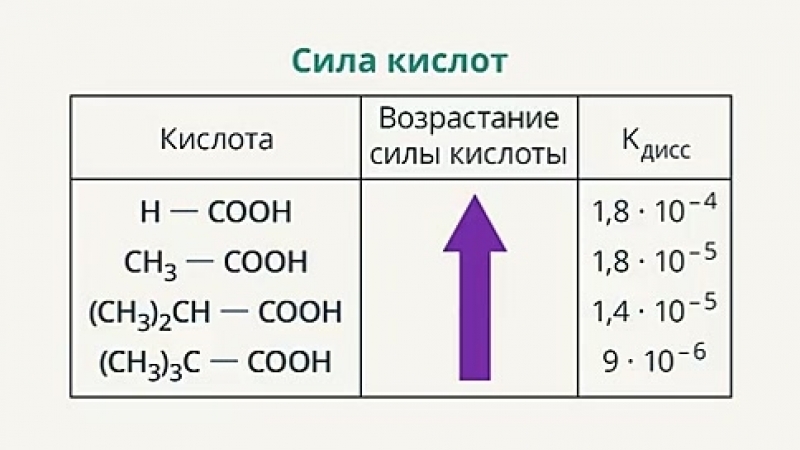 Чем больше значение pKa, тем меньше степень диссоциации . Слабая кислота имеет значение pKa примерно от -2 до 12 в воде. Кислоты со значением pKa менее примерно -2 считаются сильными кислотами.
Чем больше значение pKa, тем меньше степень диссоциации . Слабая кислота имеет значение pKa примерно от -2 до 12 в воде. Кислоты со значением pKa менее примерно -2 считаются сильными кислотами.
Kb и pKb
Как и кислоты, основания могут быть сильными или слабыми, в зависимости от степени их ионизации.Сильное основание – это основание, которое полностью ионизируется в водном растворе. Слабое основание – это основание, которое лишь незначительно ионизируется в водном растворе.
Выражение равновесия может быть записано для реакций слабых оснований с водой. Поскольку концентрация воды чрезвычайно велика и практически постоянна, вода не включается в выражение. Константа ионизации основания ( K b ) – константа равновесия для ионизации основания.
pKb можно рассчитать как pKb = -log 10 (Kb). Большое значение Kb указывает на высокий уровень диссоциации сильного основания. Более низкое значение pKb указывает на более сильное основание.
Большое значение Kb указывает на высокий уровень диссоциации сильного основания. Более низкое значение pKb указывает на более сильное основание.
Поскольку эти реакции происходят в водных растворах, вода не включается в уравнение, даже если она является частью реакции. Он считается растворителем в этих реакциях, поэтому концентрация остается практически постоянной.
Практические вопросы
Академия Хана
Официальная подготовка MCAT (AAMC)
Пакет вопросов по химии Отрывок 13, вопрос 77
Пакет вопросов по химии Отрывок 16, вопрос 88
Образец теста C / P Раздел Отрывок 6 Вопрос 30
Практический экзамен 1 Раздел C / P, вопрос 13
Практический экзамен 3 Раздел C / P, вопрос 12
Практический экзамен 4 Раздел C / P Отрывок 1 Вопрос 2
Практический экзамен 4 Раздел C / P Отрывок 4 Вопрос 18
Ключевые точки
• Ka константа диссоциации кислоты и Kb константа диссоциации основания являются мерой степени диссоциации слабой кислоты или основания в равновесии.
• pKa и pKb – логарифмические шкалы Ka и Kb.
• Kb связано с константой кислотной диссоциации Ka простым соотношением pKa + pKb = 14, где pKb и pKa – отрицательные логарифмы Kb и Ka, соответственно.
• Kb и Ka также связаны через ионную константу для воды, Kw, соотношением Kw = Kb x Kb = a
Ключевые термины
Диссоциация : процесс, при котором соединения расщепляются на более мелкие составляющие молекулы, обычно обратимо.
Слабая кислота : та, которая не полностью диссоциирует, отдавая только часть своих ионов водорода в раствор
Слабое основание : акцептор протонов, который не полностью ионизируется в водном растворе
Равновесие : состояние реакции, в котором скорости прямой и обратной реакций равны.
pKa : количественная мера силы кислоты в растворе; слабая кислота имеет значение pKa в приблизительном диапазоне от -2 до 12 в воде, а сильная кислота имеет значение pKa менее примерно -2.
Константа ионизации основания ( K b ) : Константа равновесия для ионизации основания.
Факультет – Лаосский университет Содружества Вирджинии
Образование
- Бакалавр, Национальный университет Цин Хуа
- Магистр наук, Национальный университет Цин Хуа
- доктор философии, Государственный университет Огайо
- Постдок, Корнельский университет
Особые награды и награды
- Схема награждения за выдающиеся таланты Макао (Фонд Макао, 2019)
- Премия «10 выдающихся молодых людей Китая» (2019)
- Премия научного сотрудника PCTC (Конференция Пенсильвании по теоретической химии, 2019)
- Награда Wiley Computers in Chemistry за выдающийся постдок от подразделения ACS COMP (2018)
- Устная награда за 1-е место в The Edward F.Форум аспирантов Hayes (ОГУ, 2016)
- Стипендия Среднеамериканской стипендии Phi Tau Phi (PTP) (2015)
- ACS COMP Division CCG Research Excellence Award for Graduate Studnets (2015)
- Президентская стипендия (ОГУ, 2015)
- Присуждение 1-го места в конкурсе исследований Альберта Л.
 Хенна (ОГУ, 2015)
Хенна (ОГУ, 2015) - Стипендия Президента (NTHU, 2009)
- Мемориальная медаль доктора И-Чи Мэй (NTHU, 2007)
- Почетный член Общества почетных ученых Пхи Тау Пхи на Тайване (2007)
Научные интересы
Лаосская группа – это вычислительная / теоретическая группа, которая занимается разработкой и применением новых моделей и алгоритмов электронной структуры, основанных на квантовой механике, объединяя концепции и методы из химии, физики, математики и информатики для изучения молекул, кластеров и конденсированных сред. фазовые системы, от химии до биохимии и материаловедения.Особое внимание уделяется точному и эффективному расчету межмолекулярных взаимодействий, что является сложной задачей для теории электронной структуры. Целью исследования Pir является разработка быстрых и точных подходов к фундаментальному пониманию факторов, управляющих связыванием лекарств и упаковкой молекулярных материалов, чтобы обеспечить основу для разработки новых молекул, связывающих лекарство, и функционализированных молекулярных материалов. Кроме того, адаптация методологии, которую мы собираемся разработать к быстрой эволюции методов машинного обучения, предлагает уникальную возможность для создания новой нековалентной молекулярной электроники и молекул лекарств посредством крупномасштабного компьютерного скрининга и дизайна, поскольку сочетание различных стратегий функционализации молекул является на вид бесконечно.Наша группа в основном работает с программой квантовой химии под названием Q-Chem, в которую мы вносим новые методы и алгоритмы. Посетите веб-страницу нашей исследовательской группы для получения дополнительной информации!
Кроме того, адаптация методологии, которую мы собираемся разработать к быстрой эволюции методов машинного обучения, предлагает уникальную возможность для создания новой нековалентной молекулярной электроники и молекул лекарств посредством крупномасштабного компьютерного скрининга и дизайна, поскольку сочетание различных стратегий функционализации молекул является на вид бесконечно.Наша группа в основном работает с программой квантовой химии под названием Q-Chem, в которую мы вносим новые методы и алгоритмы. Посетите веб-страницу нашей исследовательской группы для получения дополнительной информации!
Избранные публикации
К. Картер-Фенк, К. У. Лао и Дж. М. Герберт. Предсказание и понимание нековалентных взаимодействий с использованием новых форм адаптированной к симметрии теории возмущений. В соотв. Chem. Res. 54, 3679 (2021).
Е. Епифановский и др. Программное обеспечение для границ квантовой химии: обзор разработок в пакете Q-Chem 5.J. Chem. Phys. 155, 084801 (2021).
Ф. Баллестерос, С. Дуниван и К. У. Лао. Тесты связанных кластеров больших нековалентных комплексов: набор данных L7, а также ДНК-эллиптицин и бакикатчер-фуллерен. J. Chem. Phys. 154, 154104 (2021).
М. К. Шехаб, К. С. Вираратне, Т. Хуанг, К. У. Лао и Х. М. Эль-Кадери. Исключительное накопление ионов натрия за счет аза-ковалентного органического каркаса для высокоэнергетических и мощных натриево-ионных аккумуляторов. ACS Appl. Матер. Интерфейсов 13, 15083 (2021).
К. А. Мейсон, А. К. Пирси, К. У. Лао, З. А. Кристенсен и М. С. Эль-Шалл. Нековалентные взаимодействия цианистого водорода и ацетонитрила с катион-радикалом хинолина посредством ионной водородной связи. Chem. Phys. Lett. 754, 137744 (2020)
К. Картер-Фенк, К. У. Лао, К.-Й. Лю и Дж. М. Герберт. Точные и эффективные расчеты ab initio для супрамолекулярных комплексов: адаптированная к симметрии теория возмущений с многочастичной дисперсией. J. Phys. Chem.Lett. 10, 2706 (2019).
Д. М. Уилкинс, А. Грисафи, Ю. Ян, К. У. Лао, Р. А. ДиСтасио-младший и М. Чериотти. Точная молекулярная поляризуемость с помощью теории связанных кластеров и машинного обучения. Proc. Natl. Акад. Sci. США 116, 3401 (2019).
Янг Янг, К. У. Лао и Р. А. ДиСтасио мл. Влияние размера пор на ван-дер-ваальсово взаимодействие в двумерных молекулах и материалах. Phys. Rev. Lett. 122, 026001 (2019).
К. У.Лао, Дж. Цзя, Р. Майтра и Р. А. ДиСтасио мл. О геометрической зависимости дипольной поляризуемости молекул в воде: эталонное исследование корреляции электронов более высокого порядка, ошибки неполноты базисного набора, основных электронных эффектов и нулевой точки. колебательные вклады. J. Chem. Phys. 149, 204303 (2018). [Выбрана в качестве тематической статьи, выделена на главной странице JCP и показана на обложке]
X. Yu, J. Jia, S. Xu, K. U. Lao, M. J. Sanford, R.K. Ramakrishnan, S. I.Назаренко, Т. Р. Хой, Г. В. Коутс и Р. А. ДиСтасио-младший. Выявление влияния заместителей на температуру стеклования биовозобновляемых полиэфиров. Нац. Commun. 9, 2880 (2018).
ДиСтасио-младший. Выявление влияния заместителей на температуру стеклования биовозобновляемых полиэфиров. Нац. Commun. 9, 2880 (2018).
К. У. Лао и Дж. М. Герберт. Атомно-орбитальная реализация расширенной адаптированной к симметрии теории возмущений (XSAPT) и эталонных расчетов для больших супрамолекулярных комплексов. J. Chem. Теория вычисл. 14, 2955 (2018).
С. Се, Л. Ту, Ю. Хан, Л. Хуанг, К. Кан, К.У. Лао, П. Поддар, К. Парк, Д. А. Мюллер, Р. А. ДиСтасио-младший и Дж. Парк. Когерентные атомно-тонкие сверхрешетки с искусственной деформацией. Наука 359, 1131 (2018).
К. У. Лао, К.-Й. Лю, Р. М. Ричард и Дж. М. Герберт. Понимание многокомпонентного расширения для больших систем. II. Соображения точности. J. Chem. Phys. 144, 164105 (2016). [Выбрано редакцией JCP и выделено на главной странице JCP в течение недели 16 мая 2016 г.]
К.У. Лао и Дж. М. Герберт. Анализ разложения энергии со стабильным членом переноса заряда для интерпретации межмолекулярных взаимодействий.


 ) H + (водн.) + NO 2 – (водн.)
) H + (водн.) + NO 2 – (водн.) 8
8_20-1200x800.jpg) 5
5




 10
10 1
1  I.C.E. Стол:
I.C.E. Стол: 10 моль л -1
10 моль л -1  1 × 10 -3 =
1 × 10 -3 =
 I.C.E. Стол:
I.C.E. Стол:
 0 × 10 -3 =
0 × 10 -3 = 3 × 10 -12
3 × 10 -12  Хенна (ОГУ, 2015)
Хенна (ОГУ, 2015)