Таблица менделеева – Электронный учебник K-tree
Электронный учебник
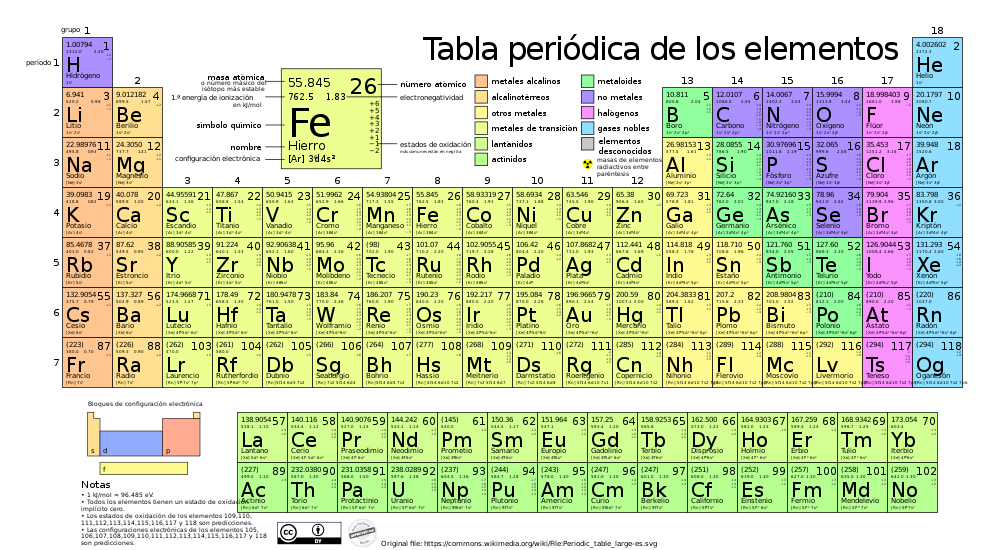
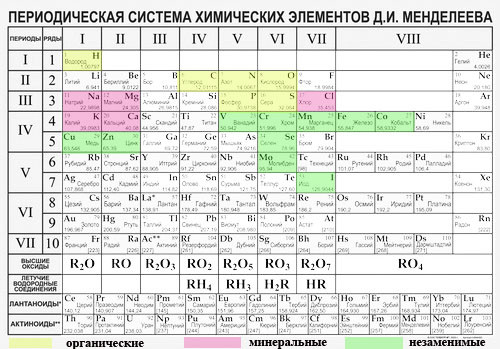
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
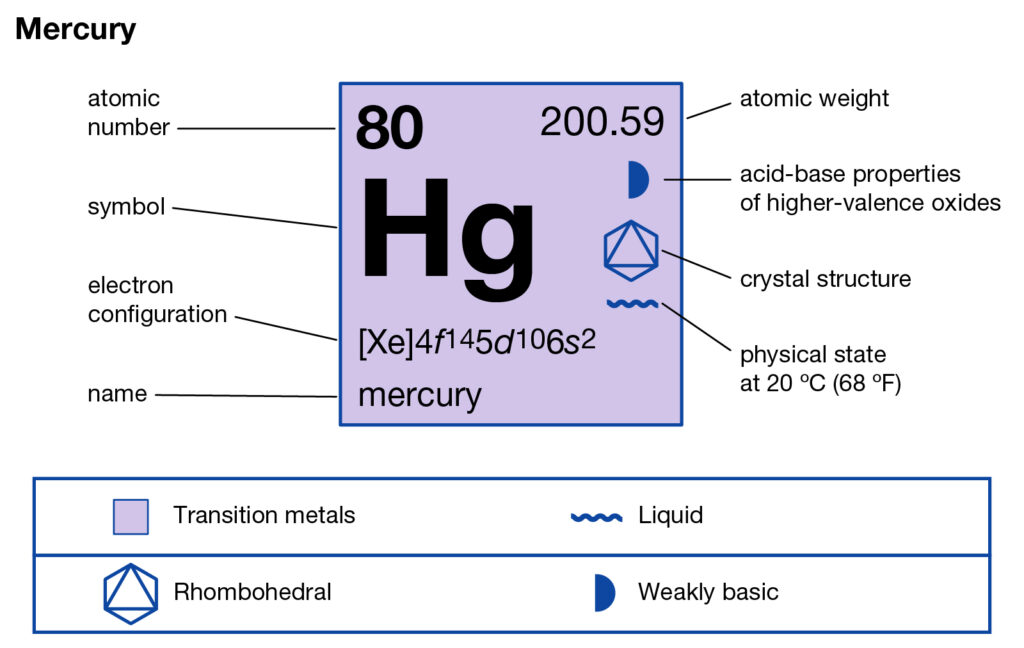
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Химический элемент Кадмий: свойства и применение
Содержание
- Изотопы
- В природе
- Физические свойства кадмия
- Химические свойства кадмия
- Области, в которых кадмий незаменим
- Физиологическое воздействие на человека
Кадмий – химический элемент побочной подгруппы второй группы (по-новому – двенадцатой группы, период пятый) в периодической системе Менделеева. Атомный номер – 48. Стоит в таблице под знаком Cd, свое название получил от названия руды в Германии, из которой там же получали цинк. Кадмий является ядовитым веществом, как и все его соединения.
Атомный номер – 48. Стоит в таблице под знаком Cd, свое название получил от названия руды в Германии, из которой там же получали цинк. Кадмий является ядовитым веществом, как и все его соединения.
Изотопы
У кадмия насчитываются целых восемь изотопов природного происхождения. Шесть из них стабильны, а для двух других обнаружена небольшая радиоактивность, из-за которой они претерпевают бета-распады. Это изотопы 113Cd и 116Cd.
В природе
В природе содержание самого кадмия невелико: 130 мг/т в толще земной коры и всего 0,11 мкг/л в морской воде. Данный элемент считается редким и весьма рассеянным, так как содержится в виде примесей в ряде минералов (более 50-ти) и на постоянной основе в минералах цинка. Кадмий входит в состав руд месторождений металлов, но никогда не образует собственные месторождения. При этом, данный элемент по СанПиНу входит в состав питьевой воды, а также в ряд продовольственного товара (рис, хлеб, свинина и другие).
Физические свойства кадмия
- Мягкий металл серебрено-белого окраса
- Имеет гексагональную решетку
- Температура плавления — 321 °C, температура кипения — 770 °C
- Существует эффект трения микрокристаллов между собой, что провоцирует звук небольшого треска
- Из-за мягкости его можно порезать ножом
- Непрочный, при нагревании свыше 80 °C его можно потолочь до порошкообразного состояния
Химические свойства кадмия
Так как по расположению в периодической таблице близок с цинком и ртутью, имеет схожие химические свойства. Взаимодействует с кислородом лишь при обширном нагревании (температура близится 350 °C). Нерастворим в составе оксидов и сульфидов. Также, реагирует при взаимодействии с кислотами-неокислителями, выделяя при этом водород.
Взаимодействует с кислородом лишь при обширном нагревании (температура близится 350 °C). Нерастворим в составе оксидов и сульфидов. Также, реагирует при взаимодействии с кислотами-неокислителями, выделяя при этом водород.
Области, в которых кадмий незаменим
- Ювелирные и легкоплавкие сплавы.
- Источники тока (хим.).
- Производство пигментов.
- Солнечные батареи.
- Как проводник полупроводников.
- Атомная промышленность.
- Металлургия.
- Электротехника и электроника.
Физиологическое воздействие на человека
Как упоминалось ранее, не только кадмий, но и все его соединения ядовиты. Наиболее опасным считается его оксид, так как при вдыхании его паров в малых количествах за небольшой период времени приводит к летальному исходу.
Кадмий обладает не только острой токсичностью, но и хронической, предполагая способность накапливаться в клетках любого живого организма.
Everyday Uses of Transition Metals
Revolutionized поддерживается читателями. Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Узнайте больше здесь.
Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Узнайте больше здесь.
Наш мир состоит в основном из металла. Вы сталкиваетесь с металлами каждый божий день, и, скорее всего, большинство из тех, с которыми вы сталкиваетесь, попадают в третью категорию периодической таблицы — переходные металлы. Что такое переходные металлы и где вы можете с ними столкнуться в повседневной жизни?
Свойства переходных металлов
Во-первых, что такое переходные металлы? В этом разделе очень много элементов. Переходные металлы состоят из групп с 3 по 12 периодической таблицы. Всего получается 38 элементов. Чуть позже мы подробно рассмотрим каждый элемент. К переходным металлам относятся:
| Период 4 | Период 5 | Период 6 | Период 7 |
|---|---|---|---|
| Скандий | Иттрий | Гафний | Резерфордий |
| Титан | Цирконий | Тантал | Дубниум |
| Ванадий | Ниобий | Вольфрам | Сиборгиум |
| Хром | Молибден | Рений | Борий |
| Марганец | Технеций | Осмий | Хассиум |
| Железо | Рутений | Иридиум | Мейтнерий |
| Кобальт | Родий | Платина | Дармштадтиум |
| Никель | Палладий | Золото | Рентгений |
| Медь | Серебро | Меркурий | Коперниций |
| Цинк | Кадмий |
Эти металлы считаются переходом или мостом между основными элементами группы по обе стороны таблицы. Они создают мост между щелочными металлами и щелочноземельными металлами в левой части таблицы, известными как активные металлы, и металлами, полуметаллами и неметаллами в правой части таблицы.
Они создают мост между щелочными металлами и щелочноземельными металлами в левой части таблицы, известными как активные металлы, и металлами, полуметаллами и неметаллами в правой части таблицы.
Эти металлы получили свое прозвище в 1921 году, когда английский химик Чарльз Бери назвал их переходным рядом элементов.
Международный союз теоретической и прикладной химии (IUPAC) определяет эти переходные металлы как «любой элемент с частично заполненной d-электронной подоболочкой». Элементы делятся и определяются одной из четырех различных электронных орбиталей, обозначенных как s, p, d и f, а последние три также имеют подуровни или подоболочки, которые могут содержать еще больше электронов. Орбитальное обозначение помогает химикам определить, где каждый элемент находится в периодической таблице.
По мере того, как вы перемещаетесь по периодической таблице слева направо, эти подоболочки становятся все более заполненными.
Одним из уникальных свойств этих переходных металлов является тот факт, что они необходимы для функционирования биологической жизни.
Есть еще две категории — лантаниды и актиниды — которые находятся в нижней части периодической таблицы. Люди иногда называют их внутренними переходными металлами, поскольку их атомные номера находятся между первым и вторым элементами в последних двух рядах переходных металлов. Однако мы вернемся к ним позже.
Химические и физические свойства
Все эти элементы являются металлами, что означает, что они блестят на вид, демонстрируя явный металлический блеск, который определяет их как металлы. Большинство из них очень твердые, имеют такие высокие температуры плавления и кипения, что их почти невозможно достичь. Почти все они хорошо проводят как тепло, так и электричество, что делает их полезными для различных применений.
Чаще всего металлы периодов 4, 5 и 6 используются в сплавах, что делает их невероятно универсальными. Сплавы представляют собой смеси двух или более металлов, чтобы сделать готовый продукт более прочным, легким или с ним было легче работать.
Обычно они невероятно податливы, хотя некоторые из них требуют очень высоких температур, чтобы сделать их достаточно податливыми для работы. Многие из этих металлов, такие как железо и медь, также обладают полезными структурными свойствами. Они способны сгибаться и изменять форму без потери структурной целостности и прочности. Хотя вы можете взять кусок железа или меди и сгибать его вперед и назад снова и снова, чтобы ослабить его связи или сломать его, в большинстве случаев эти металлы сохраняют свою структурную целостность независимо от их формы.
Эти металлы на атомном уровне склонны терять электроны при соединении. Это заставляет их создавать положительные ионы. Эти металлы также часто образуют окрашенные комплексы, а это означает, что если вы найдете их в различных соединениях или растворах, они могут быть очень красочными. Несколько примеров этого включают малахит, который имеет ярко-зеленый цвет, азурит, который обычно выглядит как ярко-синий, и прустит, который имеет темно-красный цвет.
Несколько примеров этого включают малахит, который имеет ярко-зеленый цвет, азурит, который обычно выглядит как ярко-синий, и прустит, который имеет темно-красный цвет.
Некоторые металлы этой категории являются реакционноспособными, но они не реагируют так быстро и бурно, как металлы из категории щелочных металлов. Их частично заполненные электронные подоболочки также означают, что эти металлы могут проявлять несколько различных степеней окисления, обычно разделенных одним электроном. Эти различные степени окисления также делают большинство переходных металлов парамагнитными — они демонстрируют слабое магнитное притяжение, но не сохраняют какого-либо постоянного магнетизма. Мы говорим «большинство», потому что в этой категории есть как минимум три металла, которые считаются черными, поэтому они обладают магнитными свойствами и сильно реагируют на магнитные поля.
Переходные металлы также проявляют высокую каталитическую активность. Другими словами, элементы этого раздела, а также их соединения действуют как хорошие катализаторы. Они либо будут с чем-то реагировать, изменяя при этом свою степень окисления, либо будут поглощать вещества, находящиеся на их поверхности, активируя их. Катализаторы работают, создавая каталитические пути для последующей реакции. Эти металлы более чем рады принять новые электроны или пожертвовать те, которые у них уже есть, для подпитки этих реакций.
Они либо будут с чем-то реагировать, изменяя при этом свою степень окисления, либо будут поглощать вещества, находящиеся на их поверхности, активируя их. Катализаторы работают, создавая каталитические пути для последующей реакции. Эти металлы более чем рады принять новые электроны или пожертвовать те, которые у них уже есть, для подпитки этих реакций.
Многие переходные металлы являются одними из самых распространенных элементов на Земле. Железо занимает четвертое место по распространенности. Титан входит в состав 10 th , а марганец входит в 13 th . Другие переходные металлы, такие как золото и серебро, также имеются в изобилии, но они не так высоко ценятся, как ранее упомянутые.
Для членов переходных металлов не существует официальных семейств, но люди часто дают им неофициальные обозначения, особенно для наиболее часто используемых. Давайте посмотрим на наиболее распространенные обозначения групп переходных металлов и на то, где вы можете столкнуться с ними в реальной жизни.
Применение в реальной жизни
Может быть трудно разбить некоторые из этих элементов, потому что не все из них имеют общее применение, поэтому давайте рассмотрим некоторые из неофициальных групповых обозначений широко используемых переходных металлов.
Черные или магнитные металлы
Черные металлы — это те, которые реагируют с магнитным полем. Вот почему вы можете прикрепить магнит к стальному холодильнику, но не к алюминиевому бамперу автомобиля. Эти металлы включают следующие элементы.
Железо
Железо — один из самых узнаваемых элементов периодической таблицы. Люди используют железо в его различных формах уже более 5000 лет. Мы могли бы написать целую статью только о железе и его различных применениях. Вот несколько приложений, с которыми вы можете столкнуться в повседневной жизни.
Применение для железа
-
 Этот сплав является основой большей части нашей глобальной инфраструктуры. Сталь используется во всем, от строительства до автомобилей и самолетов, и это лишь некоторые из них.
Этот сплав является основой большей части нашей глобальной инфраструктуры. Сталь используется во всем, от строительства до автомобилей и самолетов, и это лишь некоторые из них. - Гемоглобин: В вашей крови также есть железо в форме гемоглобина. Эти клетки переносят кислород из легких к вашим органам и тканям, а затем переносят углекислый газ обратно в легкие, чтобы вы могли его выдохнуть.
- Кулинария: Вы не ошибетесь, выбрав чугунную сковороду. Смешивая железо с углеродом или кремнием, вы получаете чугун, популярный выбор для декора и кухонных принадлежностей.
Кобальт
Кобальт получил свое название от немецкого слова кобальд , что относится к подземному гному, который любит создавать проблемы. Немецкие горняки назвали его в честь этого озорного маленького гнома, потому что добывать его невероятно сложно. В своей элементарной форме кобальт имеет ярко-синий цвет, но он также содержит мышьяк, что делает его невероятно токсичным. Каковы некоторые типичные области применения кобальта?
Каковы некоторые типичные области применения кобальта?
Использование кобальта
- Краски, чернила и пигменты: Этот блестящий синий кобальт сделал этот элемент невероятно популярным среди художников после его открытия. Он все еще используется сегодня, хотя он тщательно обрабатывается, чтобы удалить оставшийся мышьяк, что делает его более безопасным для работы.
- Перезаряжаемые батареи: Многие современные электронные устройства используют перезаряжаемые батареи, а эти батареи используют кобальт. Более 50% мировых запасов кобальта приходится на перезаряжаемые батареи.
-
Никель
Никель — еще один металл, из-за которого горняки испытывали припадки. В земле это похоже на медь, что побудило немецких горняков назвать его 9.0003 Kupfernickel , означает «медь имп». Возможно, он использовался в монете с таким же названием в прошлом, но в этих 5-центовых монетах больше нет никеля.
Возможно, он использовался в монете с таким же названием в прошлом, но в этих 5-центовых монетах больше нет никеля.
Применение для никеля
- Сплавы: Никель хорошо сочетается со всем, от стали и железа до меди, хрома, кобальта и большинства других переходных металлов.
- Антикоррозийные покрытия: Если вы когда-либо видели что-либо с пометкой «никелированный», то вы видели пример этого применения. Никель по своей природе не вызывает коррозии, что делает его отличным покрытием для металлов, которые в противном случае могли бы окислиться в присутствии кислорода.
- Батарейки: Никель является основным компонентом аккумуляторных батарей. Ищите те, которые помечены как NiMH или никель-металлогидридные.
Чеканка металлов
Как следует из названия, люди либо использовали эти металлы в монетах в прошлом, либо продолжают использовать их в качестве валюты сегодня.
Золото
Нужно ли описание этого металла? Мы веками использовали золото для изготовления монет и украшений.:max_bytes(150000):strip_icc()/PeriodicTableWallpaper-56a12d103df78cf7726827e8.png?resize=665%2C374&is-pending-load=1) Соединенные Штаты даже использовали золотой стандарт для поддержки своей валюты до 19 века.30 с. Федеральное правительство и по сей день содержит огромные запасы золотых слитков. Этот металл мягкий и податливый. Вы можете забить 1 тройскую унцию в лист, который растянется более чем на 68 квадратных футов. Из золота можно сделать почти что угодно. Каковы некоторые общие приложения помимо ювелирных изделий и монет? Давайте посмотрим на его различные приложения.
Соединенные Штаты даже использовали золотой стандарт для поддержки своей валюты до 19 века.30 с. Федеральное правительство и по сей день содержит огромные запасы золотых слитков. Этот металл мягкий и податливый. Вы можете забить 1 тройскую унцию в лист, который растянется более чем на 68 квадратных футов. Из золота можно сделать почти что угодно. Каковы некоторые общие приложения помимо ювелирных изделий и монет? Давайте посмотрим на его различные приложения.
Использование золота
- Электроника: Золото обладает невероятной проводимостью и коррозионной стойкостью, что позволяет использовать его во всех сферах электронной промышленности. Вы найдете его в таких вещах, как контакты на центральном процессоре (ЦП) и печатных платах.
- Стоматология: Золото — один из самых неактивных металлов в нашем списке. Он не реагирует на воду или кислоты, что делает его идеальным металлом для изготовления пломб и коронок в стоматологии.

- Еда: Хотите верьте, хотите нет, но вы действительно можете есть золото. Сусальное золото, невероятно тонко истолченное, — популярное украшение для дорогих блюд.
Серебро
Серебро — еще один металл, который невероятно популярен как для монет, так и для ювелирных изделий. Он не такой податливый, как золото, но его можно расплавить и отлить практически в любую форму. Он также не так ценен, как золото, потому что его больше в изобилии, но это не мешает ему быть невероятно популярным в качестве аксессуара. Вот несколько интересных способов использования серебра.
Использование серебра
- Электроника: Серебро — один из лучших металлов для электроники из-за его высокой тепло- и электропроводности. Он работает настолько хорошо, что его практически невозможно заменить менее дорогими металлами.
- Фотография: Хотя большая часть мира перешла на цифровую фотографию, некоторые традиционалисты все еще предпочитают пленку.
 Кристаллы галогенида серебра в пленке чувствительны к свету и записывают изображение, чтобы фотограф мог проявить его позже.
Кристаллы галогенида серебра в пленке чувствительны к свету и записывают изображение, чтобы фотограф мог проявить его позже. - Антимикробные покрытия: Серебро поглощает кислород, который убивает любые бактерии, вступающие в контакт с его поверхностью, что делает его прекрасным антимикробным веществом. Он даже используется в перевязках ран и мазях для лечения ожогов.
Медь
Когда вы думаете о меди, большинство людей представляет себе пенни, но прошло много времени с тех пор, как в американских пенни была медь. Сегодня эти 1-центовые монеты изготавливаются из цинка с тонким покрытием из меди на поверхности для сохранения цвета. Это оказалось хорошо, потому что существует так много различных применений меди, что мы не смогли бы перечислить их все.
Использование меди
- Электроника: По проводимости медь не имеет себе равных почти ни у одного из других металлов в этом списке. Он также податлив и легко втягивается в провод, поэтому вы часто найдете его во всем, от электроники до проводки в ваших стенах.

- Статуи: Медь становится зеленовато-синей при окислении. Знаете, что еще бывает зеленовато-голубым? Статуя Свободы. Одна из самых известных статуй страны сделана из меди.
- Кулинария: Медь также очень хорошо проводит тепло, что делает ее популярным выбором для кухонной утвари и посуды.
Легированные металлы
Легированные металлы необходимы для большинства современных конструкций просто из-за их обилия и частого использования в современных проектах. Одиннадцать из них составляют эту группу, потому что они часто встречаются вместе в природе. Давайте кратко рассмотрим эти металлы.
Титан
Титан получил свое название от Титанов из греческой мифологии, что связано с его невероятной силой. Горняки обнаружили его в 1700-х годах, но не могли изолировать и использовать его до 19 века.10. Как только они добились этого, это стало полезным для целого ряда приложений.
Использование титана
- Строительство: Титан является неотъемлемой частью современного строительства, потому что он прочный и легкий, что позволяет нам создавать массивные высотные здания и сложные конструкции, которые были бы невозможны из стали.

- Автомобили и самолеты: Легкая прочность титана делает его популярным выбором для уменьшения общего веса конструкции в самолетостроении и автомобилестроении.
- Космический корабль: Запуск ракет в космос стоит дорого, поэтому инженеры стремятся уменьшить вес везде, где это возможно. Титан также устойчив к коррозии и может выдерживать суровые условия на орбите.
Цирконий
Ученые обнаружили цирконий внутри минерального циркона, откуда он и получил свое название. Ученые открыли цирконий примерно в то же время, когда они обнаружили титан, но они не могли изолировать его до начала 1900-х годов.
Применение для циркония
- Атомная энергетика: Цирконий плохо поглощает нейтроны, поэтому его часто используют на атомных электростанциях в качестве оболочки топливных элементов.
- Сверхпроводящие магниты: При низких температурах цирконий становится сверхпроводником.
 В сплаве с ниобием он создает сверхпроводящие магниты.
В сплаве с ниобием он создает сверхпроводящие магниты. - Футеровка печи: Цирконий не передает тепло быстро, но он устойчив к тепловому удару, что делает его популярным выбором для футеровки печей и лабораторных тиглей.
У остальных легированных металлов не так много применений, но мы перечислили для вас некоторые из них. Вы, вероятно, не столкнетесь с ними в своей повседневной жизни, но они занимают свое место в неорганической химии:
- Гафний : Этот металл всегда встречается с цирконием, и его часто невозможно отделить от циркония. Он используется в нитях для лампочек.
- Хром : Хром используется для окрашивания стекла и хромирования металлов. Ванадий: этот элемент действует как связующее вещество при создании сплава стали и титана.
- Тантал : Этот металл имеет высокую температуру плавления, что повышает температуру плавления любых сплавов, в которых он существует.

- Ниобий : Ниобий всегда встречается с танталом, и его часто невозможно отделить от тантала.
- Молибден : Этот металл упрочняет вольфрамовые сплавы.
- Вольфрам : Этот элемент имеет самую высокую температуру плавления среди всех металлов и используется для повышения температуры плавления металлов. Люди изредка используют его для создания украшений.
- Марганец : Марганец повышает прочность металла при выплавке стали.
- Рений : Рений делает вольфрамовые сплавы прочнее.
Если вы имели дело с чем-то из вольфрама, вы, вероятно, сталкивались с большинством сплавов металлов в одном месте, включая некоторые внутренние переходные металлы. Однако, не разбивая его на составляющие, сказать невозможно.
Семейство цинка
Люди называют членов этой категории «семейство цинка», потому что они занимают одну и ту же группу в периодической таблице. Однако они имеют тенденцию демонстрировать очень разные свойства.
Однако они имеют тенденцию демонстрировать очень разные свойства.
Цинк
Если вы сталкиваетесь с цинком в своей повседневной жизни, обычно это будет один из его многочисленных сплавов или соединений. Сам по себе цинк — это серебристо-белый металл, который легко окисляется. Когда вы сплавляете его с другими металлами, его возможности безграничны.
Применение цинка
- Питание: Наличие достаточного количества цинка в рационе необходимо для здорового образа жизни. Цинк естественным образом содержится в таких продуктах, как говядина, семена подсолнечника и сыр.
- Антикоррозийные покрытия: В первую очередь цинк используется для гальванизации других металлов, которые в противном случае могли бы быть подвержены коррозии. Гальванизация предотвращает ржавчину, поэтому вы найдете ее в местах, где оцинкованное железо и сталь используются для наружных работ, например, на кузовах автомобилей или мостах.
- Латунь: Смешивание цинка и меди дает латунь.
 Этот металл является одним из первых металлических сплавов, сформировавших прогресс человечества и современный мир, который мы сегодня воспринимаем как должное.
Этот металл является одним из первых металлических сплавов, сформировавших прогресс человечества и современный мир, который мы сегодня воспринимаем как должное.
Кадмий
Кадмий восходит к 1817 году. Немецкий ученый обнаружил кадмий, скрывающийся в расплавленном каламине, который является другим названием карбонита цинка. Кадмий и цинк добываются вместе, и большая часть кадмия, который мы используем сегодня, является побочным продуктом добычи цинка.
Использование кадмия
- Припой: При соединении труб или электрических компонентов большинство инженеров, электриков и сантехников используют припой. Это вещество представляет собой сплав кадмия и серебра с более низкой температурой плавления, чем любой из основных металлов.
- Гальваническое покрытие: Подобно цинку, кадмий часто используется для гальванического покрытия других металлов для повышения их коррозионной стойкости.
- Атомная энергетика: Кадмий поглощает нейтроны, что делает его идеальным выбором для изготовления ядерных стержней для электростанций.

Ртуть
Ртуть — один из самых токсичных элементов в мире. Ему тысячи лет, он был найден в древнем Китае и Египте еще за 2000 лет до нашей эры. Его температура плавления составляет минус 37 градусов по Фаренгейту, поэтому он почти всегда находится в жидкой форме. Он обладает некоторыми сверхпроводящими свойствами, но вам нужно охладить его почти до абсолютного нуля, чтобы начать их видеть.
Использование для ртути
- Амальгамы: Сплавы ртути со многими другими переходными металлами, такими как серебро, золото и цинк, для создания амальгам. Вы найдете эти ртутные сплавы во всем, от сухих батарей до зубных пломб.
- Приборы для научных исследований: Жидкая ртуть часто использовалась для наполнения бытовых термометров, но если они ломались, это могло подвергнуть домохозяйство риску. Сегодня ртутные приборы относятся к научным лабораториям.
- Переключатели: Это может быть жидкость, но ртуть проводит электричество.
 Это полезно для создания переключателей, зависящих от положения.
Это полезно для создания переключателей, зависящих от положения.
The Platinum Group
Люди называют следующую группу платиновой, потому что в природе они часто встречаются вместе. Однако не все эти металлы имеют общее применение.
Платина
Сегодня платина может быть драгоценным металлом, но раньше горняки считали ее неприятностью. Часто она появлялась в тех же местах, где горняки находили золото, но в то время у платины было не так много применений. Сегодня этот переходный металл желанен для различных применений.
Использование платины
- Ювелирные изделия: Как драгоценный металл, платина популярна в ювелирных изделиях. Он выглядит как серебро по цене золота, что делает его отличным выбором для тех, кому не нравится внешний вид традиционного желтого золота.
- Каталитические нейтрализаторы: Каталитический нейтрализатор — это последняя часть выхлопной системы вашего автомобиля, и он содержит платину.
 Драгоценный металл окисляет угарный газ в выхлопных газах, чтобы уменьшить выбросы автомобиля.
Драгоценный металл окисляет угарный газ в выхлопных газах, чтобы уменьшить выбросы автомобиля. - Ракетные двигатели: Платина имеет такую высокую температуру плавления, что даже нашла применение в ракетостроении. Многие современные ракетные двигатели изготавливаются из платины или платиновых сплавов.
Иридий и осмий
Эти два элемента почти всегда встречаются в природе вместе. Иридий получил свое название из-за потрясающего разноцветного оттенка. Оба имеют очень ограниченное применение, поэтому здесь они прекрасно сочетаются друг с другом
Использование иридия и осмия
- Лазерные кристаллы: Единственное реальное применение иридия — создание лазерных кристаллов, особенно тех, которые выдерживают высокие температуры.
- Электрические применения: Осмий ценен для создания электрических контактов во многих приложениях.
- Перьевые ручки: Одним из наиболее распространенных применений осмия является создание высококачественных перьев для перьевых ручек.

Палладий, родий и рутений
Последние три элемента семейства платины имеют очень мало применений, если вообще имеют:
- Извлечение водорода: Палладий в основном используется для извлечения водорода. Он может поглощать до 900 раз больше собственного веса водорода.
- Платиновый сплав: Родий получил свое название из-за своего красно-красного цвета, но его единственное применение — отвердитель платины.
- Нет известных применений: Рутений не имеет известных применений.
Почетные упоминания или элементы, с которыми вы не хотели бы столкнуться
Вы, наверное, заметили, что среди перечисленных выше есть еще несколько элементов, которые мы не упомянули. Эти элементы не имеют применения в повседневной жизни, и, надеюсь, вы никогда с ними не столкнетесь.
Ученые обнаружили скандий и иттрий в Скандинавии. Скандий не имеет известных применений, а иттрий используется в сплавах для придания прочности другим металлам.
Остальные переходные металлы не встречаются в природе. За исключением технеция, созданного в лаборатории в 1936 году, все эти элементы имеют атомные номера выше, чем у урана, за что получили название трансурановых элементов. Вы не хотите сталкиваться ни с одним из этих элементов — все они очень радиоактивны. Скорее всего, вы этого не сделаете — ученые могут создавать их только в лаборатории, и после создания они существуют всего несколько минут, прежде чем испортятся. Переходные металлы составляют всю среднюю часть таблицы Менделеева, и из 38 элементов на выбор вы, вероятно, столкнетесь хотя бы с одним из них в своей повседневной жизни. Если вы читаете это на телефоне, у вас в руках медь, серебро и, возможно, платина. Где вы сталкивались с переходными металлами в своей повседневной жизни?
Эта статья впервые опубликована 01.03.2018. Мы обновили его 29.07.2020, чтобы расширить раздел «Применения в реальной жизни» более подробным использованием переходных металлов.Revolutionized поддерживается читателями. Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Узнайте больше здесь.
Металл: Справочник по химии
Любой химический элемент, являющийся эффективным проводником электричества и тепла, можно определить как металл. Металл также хорошо образует связи и катионы с неметаллами. Атомы внутри металла быстро теряют электроны, чтобы образовать положительные ионы или катионы. Ионы, в свою очередь, окружены делокализованными электронами, которые придают металлу его электропроводность.
Различные типы металлов в периодической таблице
Ниже мы более подробно рассмотрим различные типы металлов в периодической таблице, их свойства и использование.
Щелочные металлы
Какие элементы периодической таблицы относятся к щелочным металлам? Щелочные металлы представляют собой группу металлов в периодической таблице, известную как элементы группы 1. К щелочным металлам относятся калий, натрий, литий, цезий, рубидий и затем франций. Один элемент, водород, который обычно входит в эту группу металлов, часто не проявляет поведения, сравнимого с поведением остальных щелочных металлов. Что касается остальных щелочных металлов, то они демонстрируют один из лучших примеров групповых трендов свойств среди элементов периодической таблицы.
К щелочным металлам относятся калий, натрий, литий, цезий, рубидий и затем франций. Один элемент, водород, который обычно входит в эту группу металлов, часто не проявляет поведения, сравнимого с поведением остальных щелочных металлов. Что касается остальных щелочных металлов, то они демонстрируют один из лучших примеров групповых трендов свойств среди элементов периодической таблицы.
- Радиоактивные щелочные металлы: объяснение того, что такое щелочные металлы.
- Реакционная способность щелочных металлов: краткое объяснение реакционной способности щелочных металлов.
- Группа металлов под названием щелочные: статья о щелочных металлах содержит подробные пояснения и диаграммы.
- Факты о щелочных металлах: веб-страница, посвященная свойствам щелочных металлов.
- Щелочные металлы и их относительная активность: схема относительной активности щелочных металлов.
- Щелочные металлы и водород: быстрое объяснение связи щелочных металлов с водородом.

- Периодическая таблица, группа 1A: обсуждение той части периодической таблицы, которая включает щелочные металлы.
Щелочноземельный
Щелочноземельные металлы относятся к элементам 2 группы периодической таблицы и состоят из радия, бария, стронция, кальция, магния и бериллия. Название этой конкретной группы металлов происходит от их собственных оксидов, которые, в свою очередь, обеспечивают основные щелочные растворы. Помимо магния и бериллия, щелочноземельные металлы обладают узнаваемым цветом пламени. Эти цвета пламени: малиново-красный для радия, зеленый для бария, ярко-красный для стронция и оранжевый для кальция.
- Реактивность и щелочноземельные металлы: эксперимент для демонстрации реакционной способности щелочноземельных металлов.
- Группа 2А: лекция о группе 2А периодической таблицы, где вы найдете щелочноземельные металлы.
- Место щелочноземельных металлов в периодической таблице: веб-страница, объясняющая, как читать щелочноземельные металлы в периодической таблице.

- О щелочноземельных металлах: исследование того, как эти металлы образуют ионы.
- Химический глоссарий: глоссарий, который содержит определение щелочноземельных металлов наряду с другими химическими терминами.
- Данные о щелочноземельных металлах: информационная страница о щелочноземельных металлах.
Лантаниды
Лантаноиды — это 15 элементов с атомными номерами от 57 до 71 в периодической таблице. Ряд элементов варьируется от лантана до лютеция. Все лантанидные элементы являются элементами f-блока, что означает, что они коррелируют с заполнением электронной оболочки 4f. Несмотря на то, что элемент под названием лютеций является элементом d-блока, в большинстве случаев он также считается элементом d-блока. Группа элементов в целом называется лантанидом, потому что более легкие элементы в их ряду химически подобны лантану.
- Что такое элементы лантаноидов? : объяснение того, что на самом деле представляют собой лантаноиды.

- Лантаниды и периодическая таблица: веб-страница, на которой отображается ответ на вопрос о месте лантаноидов в таблице.
- Лантаниды и трансмутация отходов: веб-страница, на которой обсуждается, что происходит с лантанидами во время трансмутации отходов.
- Противоречие и лантаноиды: статья о сомнительном месте лантаноидов в периодической таблице.
- Страница ресурсов по лантаноидам: веб-страница, на которой рассказывается о распространении и извлечении лантаноидов.
Актиниды
Актиниды — это 15 химических элементов с номерами от 89 до 103, которые соответствуют актинию и лоуренцию. Название этой серии элементов происходит от элемента актиний. В то время как большинство актинидных элементов в списке актинидных элементов являются синтетическими элементами, уран и торий можно найти в природе не только в следовых количествах. Одним из свойств, которым славятся эти элементы, является радиоактивность, присущая всем им; плутоний, торий и уран используются в ядерном оружии и реакторах.
- Actinide Проблемы со здоровьем: изучаются проблемы со здоровьем, вызванные использованием актинидов.
- Совместное осаждение актинидов и кальцита: обсуждение утилизации ядерных отходов.
- Actinide Studies: статья, в которой рассказывается об исследованиях электронной структуры актинидов.
- Профили актинидов: веб-страница с изображениями и описаниями актинидов металлов.
- Объяснение актинидов: веб-страница, объясняющая, что такое актиниды металлов.
- Actinides: пошаговое руководство: знакомство с актинидами.
Переходные металлы
Переходные металлы — это элементы, атомы которых имеют незавершенную подоболочку. Переходные металлы или элементы отличаются от других элементов своими общими свойствами. Одним из свойств является то, что они образуют множество соединений в нескольких степенях окисления. Еще одним их известным свойством является склонность к образованию множества парамагнитных соединений, в основном из-за низкой реакционной способности их неспаренных d-электронов.
- Важность переходных металлов: изложены переходные металлы и их важность.
- Кластеры переходных металлов: взгляд на кластеры переходных металлов.
- Цвета в комплексах переходных металлов: введение в то, как цвет фигурирует в комплексах переходных металлов, и взгляд на таблицу цветов переходных металлов.
- Основы переходных металлов: на этой веб-странице представлены все основы переходных металлов.
- Список переходных металлов: представлен авторитетный список переходных металлов.
- Обзор: Обзор всего, что необходимо знать о переходных металлах.
Металлоиды
Металлоиды — это химические элементы, которые лучше всего определяются по двум критериям. Они часто образуют амфотерные оксиды и ведут себя так же, как полупроводники. Кремний, бор, германий, теллур, сурьма и мышьяк обычно классифицируются как металлоиды. Иногда в классификацию металлоидов включают также элемент под названием полоний, но по этому поводу среди специалистов до сих пор ведутся споры.
- Металлоиды в периодической таблице: список всех металлоидов в периодической таблице и их распределение.
- Эксперимент: эксперимент, связанный с физическими науками и металлоидами.
- Металлоиды (полупроводники): объяснение того, какое место занимают металлоиды в периодической таблице.
- Исследование металлоидов: научный эксперимент, который учит студентов классифицировать и идентифицировать металлоиды.
- Свойства металлоидов: веб-страница, содержащая простое определение свойств металлоидов.
- Классификация: веб-страница, содержащая урок о том, как классифицировать элементы, включая металлоиды.
- Токсичные металлоиды: взгляд на биометилирование токсичных металлоидов.
Химия металлов – другие металлы
Другие металлы или постпереходные металлы — это группа элементов периодической таблицы, расположенная справа от переходных элементов. До сих пор ведутся острые споры о том, какие элементы должны быть включены в эту группу.

 Этот сплав является основой большей части нашей глобальной инфраструктуры. Сталь используется во всем, от строительства до автомобилей и самолетов, и это лишь некоторые из них.
Этот сплав является основой большей части нашей глобальной инфраструктуры. Сталь используется во всем, от строительства до автомобилей и самолетов, и это лишь некоторые из них. Кристаллы галогенида серебра в пленке чувствительны к свету и записывают изображение, чтобы фотограф мог проявить его позже.
Кристаллы галогенида серебра в пленке чувствительны к свету и записывают изображение, чтобы фотограф мог проявить его позже.
 В сплаве с ниобием он создает сверхпроводящие магниты.
В сплаве с ниобием он создает сверхпроводящие магниты.
 Этот металл является одним из первых металлических сплавов, сформировавших прогресс человечества и современный мир, который мы сегодня воспринимаем как должное.
Этот металл является одним из первых металлических сплавов, сформировавших прогресс человечества и современный мир, который мы сегодня воспринимаем как должное.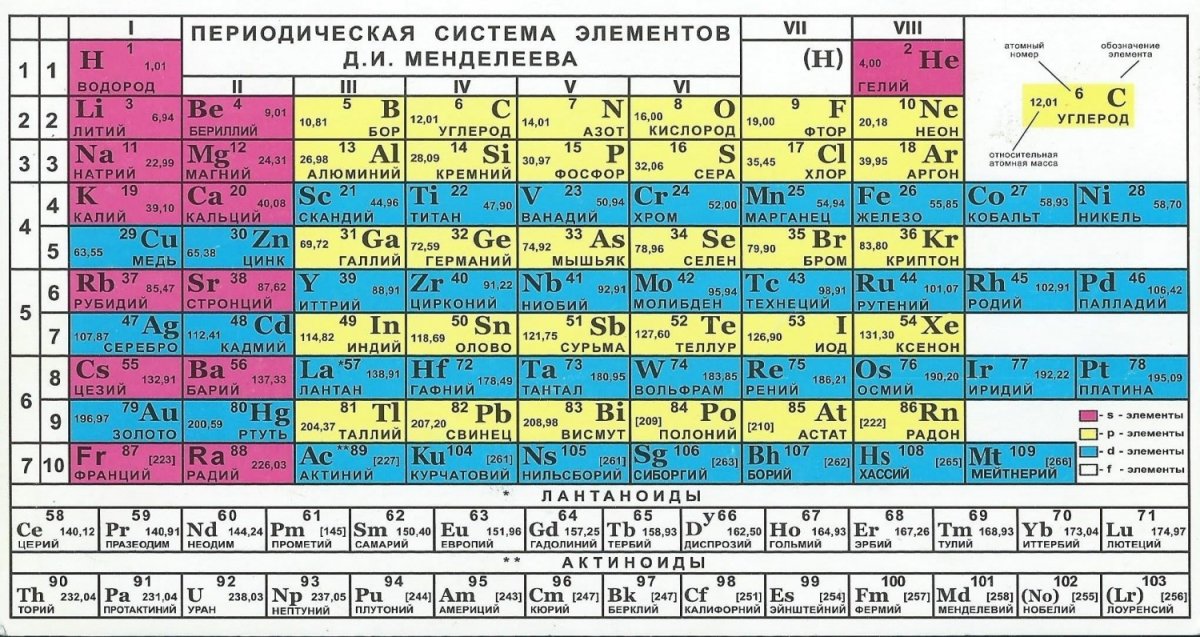
 Это полезно для создания переключателей, зависящих от положения.
Это полезно для создания переключателей, зависящих от положения. Драгоценный металл окисляет угарный газ в выхлопных газах, чтобы уменьшить выбросы автомобиля.
Драгоценный металл окисляет угарный газ в выхлопных газах, чтобы уменьшить выбросы автомобиля.