«Как изменяются свойства химических элементов в периодах и группах?» — Яндекс Кью
ПопулярноеСообщества
По каким закономерностям изменяются свойства элементов в таблице Менделеева?
Домашние заданияТаблица менделеева
Анонимный вопрос
·
701,3 K
ОтветитьУточнитьИлья Лаврёнов
272
Популяризатор науки, знаток химии и биологии, ценитель искусства. Меланхолик. Изучаю… · 30 апр 2021 ·
Периодическая система Д. И. Менделеева построена по двум основополагающим законам, именуемым периодическими.
Вещества в таблице распределены по периодам. Чем больше период, тем более сильно проявляются металлические свойства элемента (в пределах группы), соответственно, чем меньше период, тем меньше проявляются металлические свойства.

Чем больше номер группы, тем больше электронов на внешнем энергетическом уровне (их количество равно номеру группы). Неметаллические свойства (электроотрицательность) усиливаются, радиус атома уменьшается. Заряд ядер атомов растёт.
Стоит отметить, что вещества из одной группы обладают схожими свойствами, очевидно, благодаря одинаковому количеству электронов. У некоторых есть свои названия (только у главных A-групп). Это
101,1 K
Чащин Сергей
29 мая 2021
К сожалению, мы изучаем вещества, которые имеют все более и тяжелые. Давно уже за какой-то Хрен329 зайдем. А лечше… Читать дальше
Давно уже за какой-то Хрен329 зайдем. А лечше… Читать дальше
Лия Менделеева
1,7 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · 18 янв 2019 ·
mendo_him
При движении по группе главной подгруппы сверху вниз⬇️ 🔸Радиус атома увеличтвается 🔸Электроотрицательность уменьшается 🔸Окислительные свойства ослабевают 🔸Восстановительные свойства усиливаются 🔸Неметаллические ослабевают 🔸Металлические усиливаются По периоду слева направо всё наоброт🤯 🔹Радиус уменьшается 🔹ЭО возрастает 🔹Окислительные свойства усиливаются 🔹Вос… Читать далее
346,7 K
Кирилл О.
11 ноября 2019
Огромное спасибо
Комментировать ответ…Комментировать…
Анна Быкова
4
Учитель химии · 10 окт 2021
⬇️По группе и ⬅️ По периоду, т. е. по направлению к Франци, металлические, основные и восстановительные свойства возрастают, т.к. увеличивается радиус атома.
е. по направлению к Франци, металлические, основные и восстановительные свойства возрастают, т.к. увеличивается радиус атома.
⬆️по группе и ➡️ По периоду, т.е. по направлению ко фтору, неметаллические, кислотные и окислительные свойства возрастают,т.к. уменьшается радиус атома, а следовательно увеличивается электроотрицательность.
25,8 K
Ekaterina Raksha
29 марта
растут! чем больше возможностей (всяких протонов, нейтронов, электронов и и мелочи, тем больше приключений
Комментировать ответ…Комментировать…
TatyanaSun
6,1 K
Педагог, музыкант, начинающий путешественник и немножко психолог · 31 окт 2018
В периодах (слева направо): увеличивается заряд ядра, число электронов на внешнем уровне, уменьшается радиус атомов, в связи с этим увеличивается прочность связи электронов с ядром и электроотрицательность, что в свою очередь ведет к усилению окислительных свойств (неметаличности) и ослаблению восстановительных (металличности).
72,5 K
Света Ф.
21 апреля 2020
Можете зайти на этот форум и найти нужный вам ответ!!Осень будем рады вас там видеть!♥️https://blog.pachca.com/post… Читать дальше
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
1 ответ скрыто(Почему?)
Как усиливаются окислительные свойства в таблице менделеева. Как изменяются свойства химических элементов в подгруппах периодической системы менделеева
(Z ) имеет периодический характер. В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атомов. Например, во втором периоде атомные радиусы имеют следующие значения:
r , нм | 0,155 | 0,113 | 0,091 | 0,077 | 0,071 | 0,066 | 0,064 |
Это объясняется увеличением
притяжения электронов
внешнего слоя к ядру по мере возрастания заряда ядра. В подгруппах
сверху вниз
атомные радиусы возрастают, т.к. увеличивается число электронных слоев:
В подгруппах
сверху вниз
атомные радиусы возрастают, т.к. увеличивается число электронных слоев:
r , нм | r , нм | ||
0,155 | 0,071 | ||
0,189 | 0,130 | ||
0,236 | 0,148 | ||
0,248 | 0,161 | ||
0,268 | 0,182 |
Потеря атомом электронов
приводит к уменьшению его эффективных размеров, а присоединение
избыточных
электронов – к увеличению. Поэтому радиус положительного иона
(катиона) всегда
меньше, а радиус отрицательного иона (аниона) всегда больше, чем радиус
соответствующего электронейтрального
атома. Например:
Поэтому радиус положительного иона
(катиона) всегда
меньше, а радиус отрицательного иона (аниона) всегда больше, чем радиус
соответствующего электронейтрального
атома. Например:
r , нм | r , нм | ||
0,236 | Cl 0 | 0,099 | |
0,133 | Cl – | 0,181 |
Радиус иона тем сильнее отличается от радиуса атома, чем больше заряд иона:
Cr 0 | Cr 2+ | Cr 3+ | |
r , нм | 0,127 | 0,083 | 0,064 |
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра:
r , нм | r , нм | ||
Li + | 0,068 | 0,133 | |
Na + | 0,098 | Cl – | 0,181 |
0,133 | Br – | 0,196 | |
Rb + | 0,149 | 0,220 |
Такая закономерность
объясняется увеличением числа электронных слоев и растущим удалением
внешних
электронов от ядра.
б)Энергия ионизации и сродство к электрону . В химических реакциях ядра атомов не подвергаются изменению, электронная же оболочка перестраивается, причем атомы способны превращаться в положительно и отрицательно заряженные ионы . Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону .
Энергией ионизации (потенциалом ионизации) I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома с образованием катиона:
X – e → X +
Энергия ио низации измеряется в кДж/моль или в электронвольтах1 эВ = 1,602 . 10 -19 Дж или 96,485 кДж/моль. (эВ). Отрыв второго электрона происходит труднее, чем первого, т.к. второй электрон отрывается не от нейтрального атома, а от положительного иона:
X + – e → X 2+
Поэтому второй потенциал ионизации I 2 больше, чем
первый (I 2 >I 1). Очевидно, что
удаление каждого следующего электрона
будет требовать больших энергетических затрат, чем удаление
предыдущего. Для
характеристики свойств элементов обычно принимают во внимание энергию
отрыва
первого электрона.
Для
характеристики свойств элементов обычно принимают во внимание энергию
отрыва
первого электрона.
В группах потенциал ионизации уменьшается с увеличением атомного номера элемента:
I , эВ | 6,39 | 5,14 | 4,34 | 4,18 | 3,89 |
Это связано с большей
удаленностью валентных электронов от ядра и, следовательно, с их более
легким
отрывом по мере увеличения количества электронных слоев. Величина
потенциала
ионизации может служить мерой “металличности ”
элемента: чем меньше потенциал ионизации, тем легче удалить электрон из
атома,
тем сильнее выражены металлические
свойства .
В периодах слева направо заряд ядра возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации постепенно увеличивается, а металлические свойства ослабевают:
I , эВ | 5,39 | 9,32 | 8,30 | 11,26 | 14,53 | 13,61 | 17,42 | 21,56 |
Нарушение тенденции возрастания I наблюдается для атомов с целиком заполненным внешним энергетическим подуровнем, либо для атомов, у которых внешний энергетический подуровень заполнен ровно наполовину:
Это свидетельствует о повышенной
энергетической
устойчивости электронных конфигураций с полностью или ровно наполовину
занятыми
подуровнями.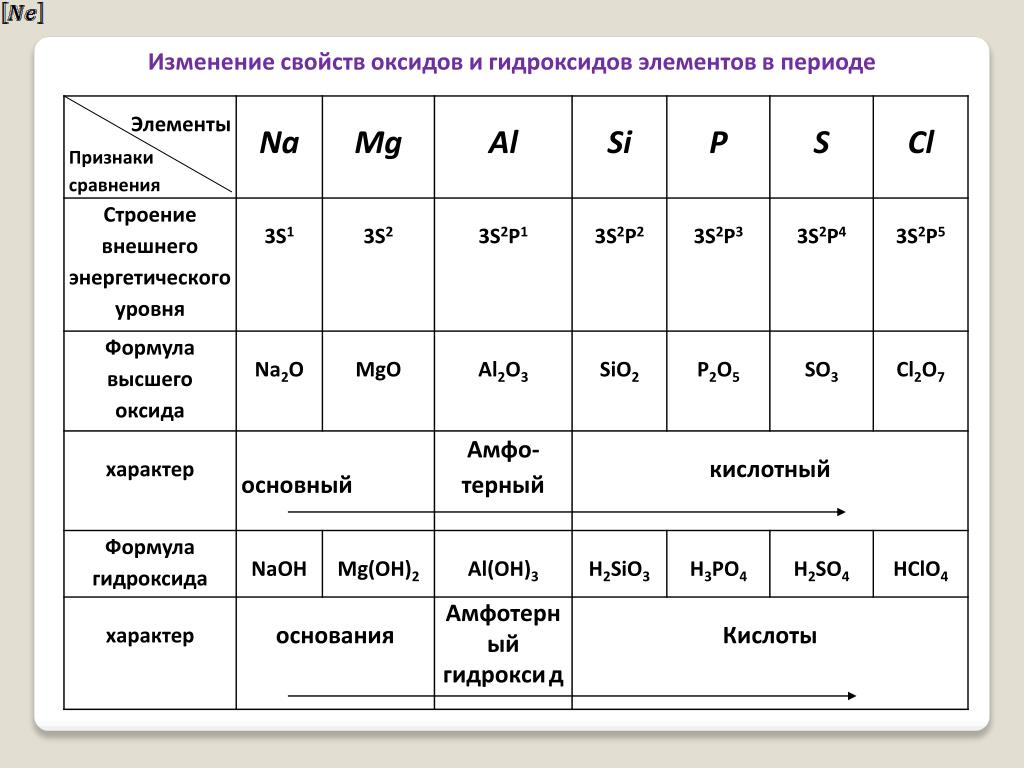
Степень притяжения электрона к ядру и, следовательно, потенциал ионизации зависят от ряда факторов, и прежде всего от заряда ядраЗаряд ядра равен порядковому номеру элемента в таблице Менделеева. , от расстояния между электроном и ядром, от экранирующего влияния других электронов. Так, у всех атомов, кроме элементов первого периода, влияние ядра на электроны внешнего слоя экранировано электронами внутренних слоев.
Поле ядра атома,
удерживающее электроны, притягивает также и свободный электрон, если он
окажется вблизи атома. Правда, этот электрон испытывает отталкивание со
стороны
электронов атома. Для многих атомов энергия притяжения дополнительного
электрона к ядру превышает энергию его отталкивания от электронных
оболочек.
Эти атомы могут присоединять электрон, образуя устойчивый однозарядный
анион.
Энергию отрыва электрона от отрицательного однозарядного иона в процессеX – –
e
→
X 0 называют сродством
атома к
электрону (A ), измеряемым
в кДж/моль
или эВ
. При
присоединении двух и более электронов к атому отталкивание преобладает
над
притяжением – сродство атома к двум и более электронам всегда
отрицательно. Поэтому одноатомные многозарядные отрицательные
ио
ны
(O 2- , S 2- ,
N 3- и т.п.) в свободном состоянии
существовать не могут.
Поэтому одноатомные многозарядные отрицательные
ио
ны
(O 2- , S 2- ,
N 3- и т.п.) в свободном состоянии
существовать не могут.
Сродство к электрону известно не для всех атомов. Максимальным сродством к электрону обладают атомы галогенов .
В)Электроотрицательность . Эта величина характеризует способность атома в молекуле притягивать к себе связующие электроны. Электроотрицательность не следует путать со сродством к электрону: первое понятие относится к атому в составе молекулы, а второе – к изолированному атому. Абсолютная электроотрицательность (кДж/моль или эВ1 электронвольт = 1,602 . 10 -19 Дж или 96,485 кДж/моль. ) равна сумме энергии ионизации и сродства к электрону :АЭО=I +A . На практике часто применяется величина относительной электроотрицательности , равная отношению АЭО данного элемента к АЭО лития (535 кДж/моль):
А.И. Хлебников, И.Н. Аржанова, О.А. Напилкова
Радиусы атомов элементов и ионов вычисляются исходя из межядерных расстояний, которые зависят не только от природы атомов, но также и от характера химической связи между ними и от агрегатного состояния вещества.
Радиусы атомов и одинаково заряженных ионов в периоде с увеличением зарядов ядра в основном (за несколькими исключениями) уменьшаются в связи с увеличением сил кулоновского притяжения из-за роста числа, а следовательно, и суммарного заряда электронов в электронных оболочках и ядер.
В подгруппах с увеличением заряда ядра (движение сверху вниз) атомные и ионные радиусы, как правило, увеличиваются, что связанно с увеличением числа электронных уровней.
Энергия ионизации (I) (потенциал ионизации) в периоде возрастает с ростом заряда ядра, в главных и третьей побочной подгруппах – убывает сверху вниз в связи с появлением нового энергетического уровня. В остальных побочных подгруппах энергия ионизации возрастает с ростом заряда ядра.
Сродством к электрону (Е) (энергия, которая выделяется при присоединении дополнительного электрона к атому, иону или молекуле). Максимальна у атомов галогенов. Сродство к электрону зависит не только от заряда ядра атома, но и от степени заполнения внешних электронных уровней.
Электроотрицательность (ЭО) – обобщенная характеристика элемента, определяемая как сумма энергии ионизации и сродства к электрону.
Относительную ЭО по Полингу определяют как отношение ЭО элемента к ЭО атома лития. Относительнаяэлектроотрицательность в периоде возрастает, а в подгруппах уменьшается с ростом заряда ядра.
Окислительная способность элемента меняется так же как и электроотрицательность, а восстановительная способность в обратном порядке.
Плотность простых веществ в периоде обычно проходит через максимум, лежащий примерно в середине периода, возрастает в подгруппах с ростом заряда ядра.
Основные свойства высших оксидов и гидроксидов элементов в периоде закономерно ослабляются, что связано с увеличением силы притяжения гидроксид-ионов к центральному атому с ростом заряда его ядра и уменьшением атомного радиуса, а в подгруппе, как правило, усиливаются, потому что атомный радиус элементов возрастает.
Кислотные свойства этих соединений изменяются в обратном направлении.
Неметаллические свойства в периоде, как правило, усиливаются слева направо, а в подгруппе – ослабевают сверху вниз, металлические – наоборот. Граница между металлами и неметаллами в таблице проходит по диагонали B-At таким образом, что все неметаллы находятся в верхней правой части таблицы (исключение составляют d- элементы).
Механизм образования химической связи может быть смоделирован различными способами.
Увеличение степени окисления элемента и уменьшение радиуса его иона (при этом происходит уменьшение эффективного отрицательного заряда на этоме кислорода) делают оксид более кислотным. Это и объясняет закономерное изменение свойств оксидов от основных к амфотерным и далее к кислотным.
1) В одном периоде при увеличении порядкового номера происходит усиление кислотных свойств оксидов и увеличение силы соответствующих им кислот.
2) В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление новых свойств оксидов:
3) При повышении степени окисления элемента усиливаются кислотные свойства оксида и ослабевают основные
Химические свойства оксидов
Основные оксиды
К основным оксидам относятся:
Оксиды всех металлов главной подгруппы первой группы (щелочные металлы Li – Fr)
Главной подгруппы второй группы, начиная с магния (Mg – Ra)
Оксиды переходных металлов в низших степенях окисления, например, MnO, FeO.
Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О2-, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава и могут существовать смешанные оксиды переменного состава.
Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути и благородных металлов:
2HgO = 2Hg + O 2
2Ag2O = 4Ag + O2
Основные оксиды при нагревании могут вступать в реакции кислотными и амфотерными оксидами, с кислотами:
ВаО + SiO 2 = ВаSiO 3 ,
МgО + Аl 2 О 3 = Мg(AlO 2) 2 ,
ZnО + Н 2 SО 4 = ZnSО 4 + Н 2 О.
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Как и другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
Fe 2 O 3 +2Al = Al 2 O 3 + 2Fe
3CuO+2NH 3 = 3Cu + N 2 +3H 2 O
4FeO+O 2 = 2Fe 2 + O 3
Основные оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с оксида кальция) при взаимодействии с водой (реакция гидратации) образуют соответствующие им гидроксиды (основания). Например, при растворении оксида кальция (негашёной извести) в воде образуется гидроксид кальция – сильное основание:
СаO + H 2 O → Са(OH) 2
Основные оксиды взаимодействуют с кислотами, образуя соответствующие соли:
CaO + 2HCl → CaCl 2 + H 2 O
К образованию солей также приводит реакция основных оксидов с кислотными оксидами:
Na 2 O + CO 2 → Na 2 CO 3
И с амфотерными оксидами:
Li 2 O+Al 2 O 3 → 2LiAlO 2
Кислотные оксиды
Большинство оксидов неметаллов являются кислотными оксидами (CO2, SO3, P4O10). Оксиды переходных металлов в высших степенях окисления проявляют преимущественно также свойства кислотных оксидов, например: CrO3, Mn2O7, V2O5.
Оксиды переходных металлов в высших степенях окисления проявляют преимущественно также свойства кислотных оксидов, например: CrO3, Mn2O7, V2O5.
Кислотные оксиды представляют ее оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:
4P+5O 2 = 2P 2 + O 5
2ZnS+3O 2 = 2ZnO + 2SO 2
K 2 Cr 2 O 7 +H 2 SO 4 = 2CrO 3 ↓+ K 2 SО 4 +H 2 O
Nа 2 SiO 3 + 2НСl = 2NаСl + SiO 2 ↓ + Н 2 О
Большинство кислотных оксидов непосредственно взаимодействует с водой с образованием кислот:
Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, с щелочами:
P 2 O 5 +Al 2 O 3 = 2AlPO 4
Са(ОН) 2 + СО 2 = СаСО 3 ↓ + Н 2 О.
Выше упоминалось, что кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например:
2SO 2 +O 2 2SO 3
SО 2 + 2Н 2 S = 3S + 2Н 2 О,
4CrO 3 + С 2 Н 5 ОН = 2Сr 2 О 3 + 2СО 2 + ЗН 2 О
Практически все кислотные оксиды при взаимодействии с водой (гидратации) образуют соответствующие им кислотные гидроксиды (кислородосодержащие кислоты).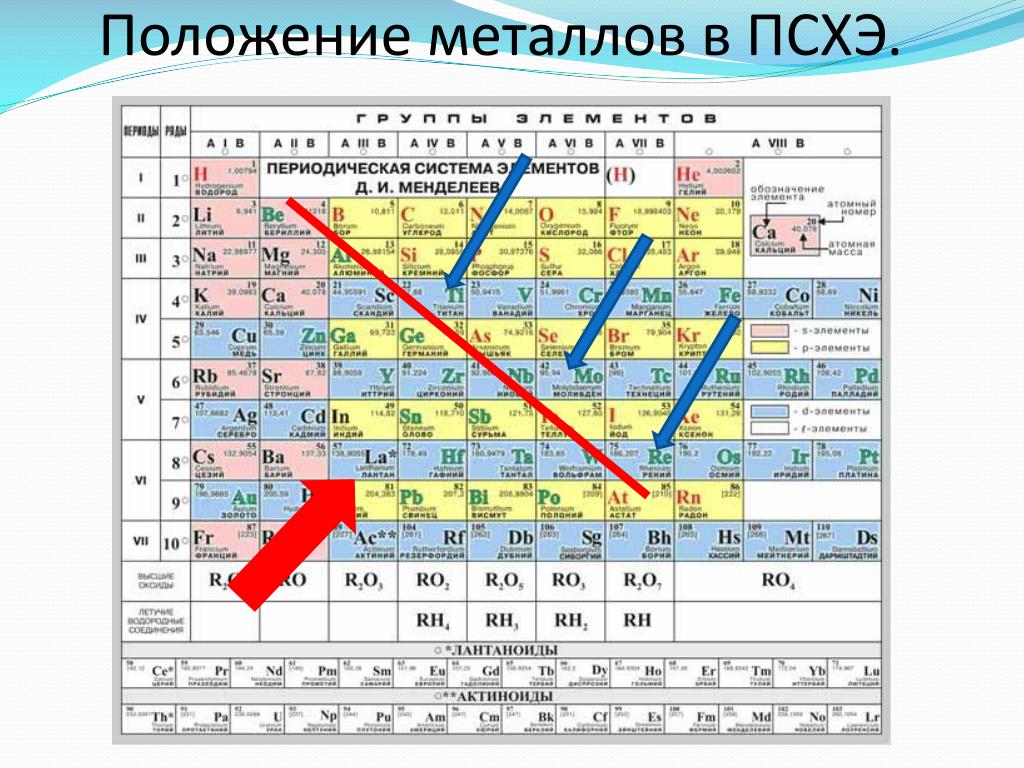 Например, при растворении оксида серы (VI) в воде образуется серная кислота:
Например, при растворении оксида серы (VI) в воде образуется серная кислота:
SO 3 + H 2 O → H 2 SO 4
Кислотные оксиды могут быть получены из соответствующей кислоты:
H 2 SiO 3 → SiO 2 + H 2 O
Амфотерные оксиды
Амфотерность (от греч. Amphoteros – и тот и другой) – способность химических соединений (оксидов, гидроксидов, аминокислот) проявлять как кислотные свойства, так и основные свойства, в зависимости от свойств второго реагента, учавствующего в реакции.
Амфотерные оксиды реагируют с сильными кислотами, образуя соли этих кислот. Такие реакции являются проявлением основных свойств амфотерных оксидов, например:
ZnO + H 2 SO 4 → ZnSO 4 + H 2 O
Они также реагируют с сильными щелочами, проявляя этим свои кислотные свойства, например:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
Амфотерные оксиды могут реагировать с щелочами двояко: в растворе и в расплаве.
При реакции с щёлочью в расплаве образуется обычная средняя соль(как показано на примере выше).
При реакции с щёлочью в растворе образуется комплексная соль.
Al 2 O 3 + 2NaOH + 3H 2 O → 2Na (В данном случае образуется тетрагидроксоаллюминат натрия)
Для каждого амфотерного металла есть свое координационное число.
Для Be и Zn – это 4; для и Al – это 4 или 6; для и Cr – это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Амфотерные оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
Аl 2 О 3 + 6НСl = 2АlСl 3 + ЗН 2 О,
Аl 2 О 3 + 2NаОН + ЗН 2 О = 2Nа[Аl(ОН) 4 ].
К числу амфотерных оксидов относятся оксид алюминия Аl2О3, оксид хрома (III) Сr2О3, оксид бериллия ВеО, оксид цинка ZnО, оксид железа (III) Fe2О3 и ряд других.
Идеально амфотерным оксидом является вода Н2О, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства). Амфотерные свойства воды ярко проявляются при гидролизе растворенных в ней солей:
Амфотерные свойства воды ярко проявляются при гидролизе растворенных в ней солей:
Сu 2+ + Н 2 О Сu(ОН) + + Н + ,
СО 3 2- + Н 2 О НСО 3- + ОН – .
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образуемых ими изменяются периодически. Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Для решения задания №2 ЕГЭ по химии нам всего лишь нужно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Всё это отображено на рисунке ниже.
Слева направо растут электроотрицательность, неметаллические свойства, высшие степени окисления и т.д. А металлические свойства и радиусы уменьшаются.
Сверху вниз наоборот: растут металлические свойства и радиусы атомов, а электроотрицательность падает. Высшая степень окисления, соответствующая количеству электронов на внешнем энергетическом уровне, в этом направлении не меняется.
Разберём на примерах.
Пример 1. В ряду элементов Na→Mg→Al→Si
А) уменьшаются радиусы атомов;
Б) уменьшается число протонов в ядрах атомов;
В) увеличивается число электронных слоёв в атомах;
Г) уменьшается высшая степень окисления атомов;
Если посмотреть в таблицу Менделеева, то мы увидим, что все элементы данного ряда находятся в одном периоде и перечислены в том порядке, как они стоят в таблице с лева направо. Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице. Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Если вы были внимательны, то уже поняли, что в данном случае уменьшаются радиусы атомов. Ответ А.
Ответ А.
Пример 2. В порядке усиления окислительных свойств элементы расположены в ряду:
А. F→O→N
Б. I→Br→Cl
В. Cl→S→P
Г. F→Cl→Br
Как вы знаете, в периодической таблице Менделеева окислительные свойства растут слева направо по периоду и снизу вверх по группе. В варианте Б как раз приведены элементы одной группы в порядке снизу вверх. Значит Б подходит.
Пример 3. Валентность элементов в высшем оксиде увеличивается в ряду:
А. Cl→Br→I
Б. Cs→K→Li
В. Cl→S→P
Г. Al→C→N
В высших оксидах элементы проявляют свою высшую степень окисления, которая будет совпадать с валентностью. А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них.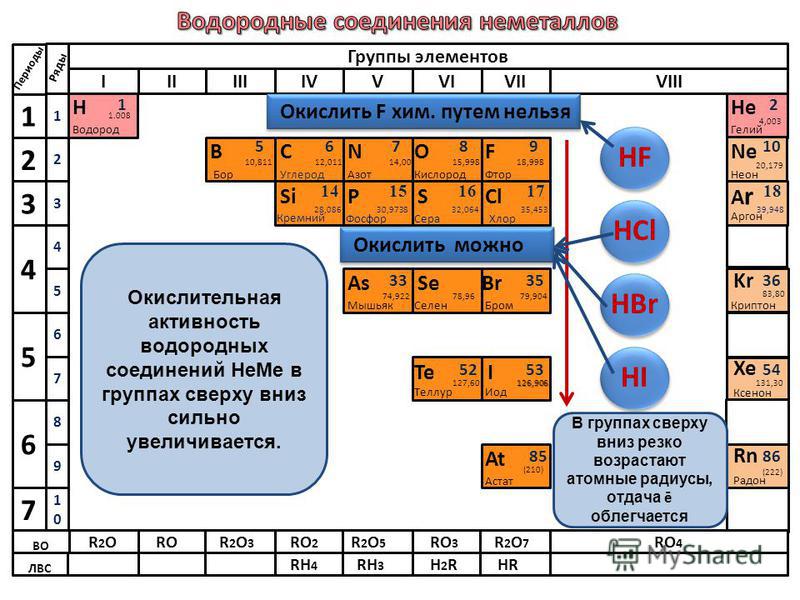 Ответ: Г
Ответ: Г
Пример 4. В ряду элементов S→Se→Te
А) увеличивается кислотность водородных соединений;
Б) увеличивается высшая степень окисления элементов;
В) увеличивается валентность элементов в водородных соединениях;
Г) уменьшается число электронов на внешнем уровне;
Сразу смотрим на расположение этих элементов в таблице Менделеева. Сера, селен и теллур находятся в одной группе, одной подгруппе. Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется. Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В – исключаем.
Остаётся вариант А. Проверяем для порядка. По схеме Косселя сила безкислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Ответ – А.
Пример 5. В порядке ослабления основных свойств оксиды расположены в ряду:
А. Na 2 O→K 2 O→Rb 2 O
Б. Na 2 O→MgO→Al 2 O 3
В. BeO→BaO→CaO
Г. SO 3 →P 2 O 5 →SiO 2
Основные свойства оксидов ослабевают синхронно с ослабление металлических свойств элементов их образующих. А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
Одним из важнейших законов природы является периодический закон, открытый в 1869 г. Менделеевым, который он сформулировал так: “Свойства простых веществ, также формы и свойства соединений находятся в периодической зависимости от атомных весов элементов”.
С
развитием квантовой химии периодический
закон получил строгое теоретическое
обоснование, а с ним и новую формулировку:
“Свойства
простых веществ, а также формы и свойства
соединений элементов находятся в
периодической зависимости от величины
зарядов ядер их атомов”.
До Менделеева многие пытались систематизировать элементы, наиболее близко подошел Майер (Германия). В 1864 г. в своей книге он привел таблицу, в которой элементы были также расположены в порядке возрастания их атомных масс, но в эту таблицу Майер поместил всего 27 элементов, меньше половины, известных в то время. Заслуга Менделеева, что в его таблице нашлось место не только всем известным элементам, но были оставлены пустые места для еще не открытых элементов (экабор – Sc, экаалюминий – Ga, экасилиций – Ge).
С точки зрения электронного строения атома:
Периодом называют горизонтальную последовательность элементов, начинающуюся со щелочного металла и заканчивающуюся благородным газом с тем же максимальным значением главного квантового числа, равного номеру периода.
Число элементов в периоде определяется емкостью подуровней.
Группой элементов
называют вертикальную совокупность
элементов, обладающую однотипной
электронной конфигурацией и определенным
химическим сходством. Номер группы (за
исключением I,
II,
VIII
побочных подгрупп) равен сумме валентных
электронов.
Номер группы (за
исключением I,
II,
VIII
побочных подгрупп) равен сумме валентных
электронов.
Кроме деления по периодам (определяемое главным квантовым числом) существует деление на семейства , определяемое орбитальным квантовым числом. Если у элемента заполняется s-подуровень, то s-семейство или s-элемент; p-подуровень – p‑элемент; d-подуровень – d-элемент; f-подуровень – f-элемент.
В короткопериодной форме периодической системы 8 групп, каждая из которых делится на главную и побочную подгруппы. I и II главные подгруппы заполняются s-элементами; III‑VIII главные подгруппы – р-элементами. d-элементы находятся в побочных подгруппах. f-элементы вынесены в отдельные группы.
Таким образом, каждый элемент в периодической системе элементов занимает строго определенное место, которое отмечается порядковым номером и связано со строением электронных оболочек атома.
Экспериментальными
исследованиями была установлена
зависимость химических и физических
свойств элементов от их положения в
периодической системе.
Энергией ионизации называется энергия, которую надо затратить для отрыва и удаления электрона от атома, иона или молекулы. Она выражается в Дж или эВ (1эВ=1,6 . 10 -19 Дж).
Энергия ионизации является мерой восстановительной способности атома. Чем ниже значение энергии ионизации, тем выше восстановительная способность атома. Атомы, теряя электрон, превращаются в положительно заряженные ионы.
Сродство к электрону называется энергия, которая выделяется при присоединении электрона к атому, молекуле или радикалу.
Энергия сродства к электрону атомов закономерно изменяется в соответствии с характером электронных структур атомов элементов. В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают. В группах сверху вниз сродство к электрону, как правило, уменьшается.
Галогены
отличаются самым высоким сродством к
электрону, т.к. присоединяя один электрон
к нейтральному атому, она приобретает
законченную электронную конфигурацию
благородного газа.
Характеристика о том, какой из атомов легче отдает или присоединяет электрон, называется электроотрицательностью которая равна полусумме энергии ионизации и сродства к электрону.
Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы ПС.
Атомные и ионные радиусы
Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому определяют условные радиусы атомов и ионов, связанных друг с другом химической связью в кристаллах.
Радиусы атомов металлов в периодах с ростом порядкового номера элементов уменьшаются , т.к. при одинаковом числе электронных слоев возрастает заряд ядра, а, следовательно, и притяжение им электронов.
В
пределах каждой группы элементов, как
правило, радиусы атомов увеличиваются
сверху вниз ,
т.к. возрастает число энергетических
уровней. Радиусы ионов также находятся
в периодической зависимости от порядкового
номера элемента.
Пример. Как изменяются размеры атомов внутри периода, при переходе от одного периода к другому и в пределах одной группы? Какие элементы имеют минимальное и максимальное значения размера атома?
Внутри периода (слева направо) размеры атомов уменьшаются, т.к. увеличивается заряд ядра и электроны сильнее притягиваются к ядру. В главных подгруппах размеры атомов увеличиваются, т.к. увеличивается число электронных слоев. В побочных подгруппах такие изменения меньше заметны, за счет d -сжатия, а при переходе из V в VI период происходит даже уменьшение уменьшение размеров атомов за счет f -сжатия.
Согласно этим правилам минимальное значение размера атома имеет гелий , а максимальное – цезий . Франций не имеет долгоживущих изотопов (природный изотоп радиоактивен, период полураспада 21 минута).
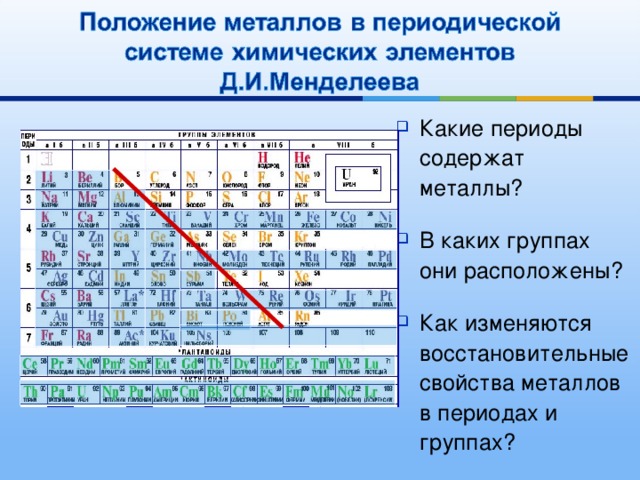
Металлы и неметаллы. Деление элементов и простых веществ на металлы и неметаллы в известной степени условно.
По
физическим свойствам металлы
характеризуются высокой теплопроводностью
и электрической проводимостью,
отрицательным температурным коэффициентом
проводимости, специфическим металлическим
блеском, ковкостью, пластичностью и
т.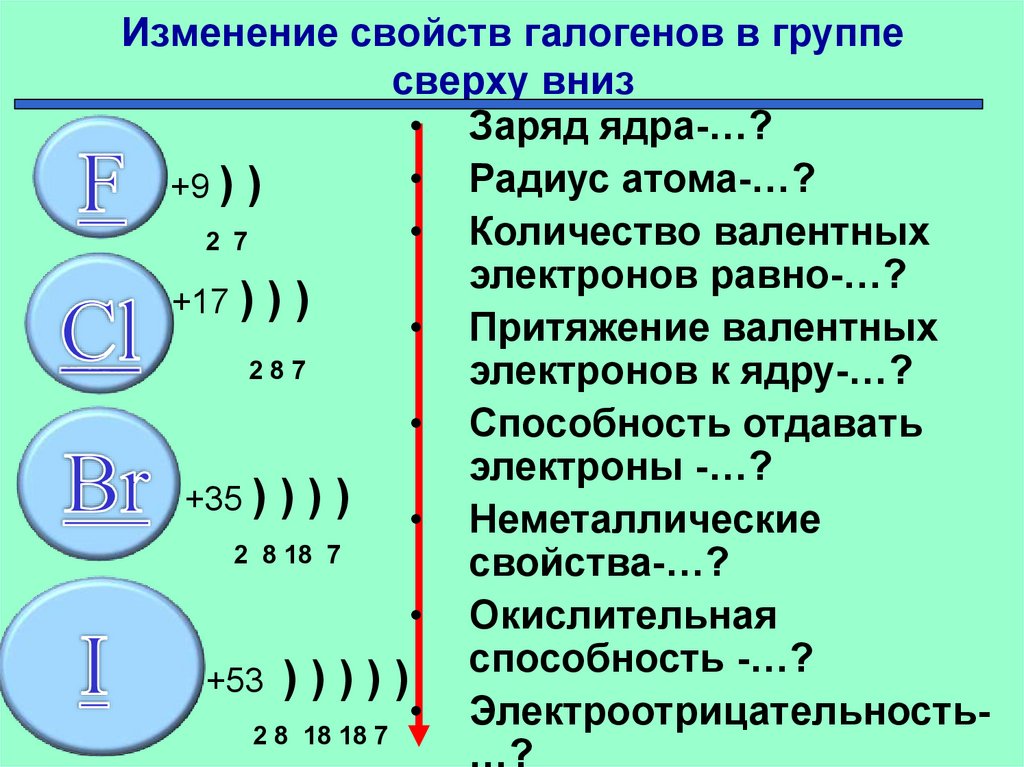 п.
п.
По химическим свойствам металлы характеризуются основными свойствами оксидов и гидроксидов и восстановительными свойствами.
Подобные различия в свойствах простых веществ связаны с характером химической связи при их образовании. Металлическая связь в металлах образуется при дефиците валентных электронов, а ковалентная в неметаллах при их достаточном количестве. Исходя из этого, можно провести вертикальную границу между элементами IIIA и IV групп. Слева – элементы с дефицитом валентных электронов, справа – с избытком. Это граница Цинтля.
Пример. Чем отличаются типичные металлы от неметаллов? Почему и как изменяются металлические свойства с увеличением порядкового номера элементов?
В периодической системе элементов в основном находятся металлы, неметаллов немного (всего 22). К металлам относятся все s -элементы. Это связано с наличием у них малого числа валентных электронов (1 или 2), в результате этого дефицита электронов образуется металлическая связь.
Все
d – и f -элементы тоже являются металлами.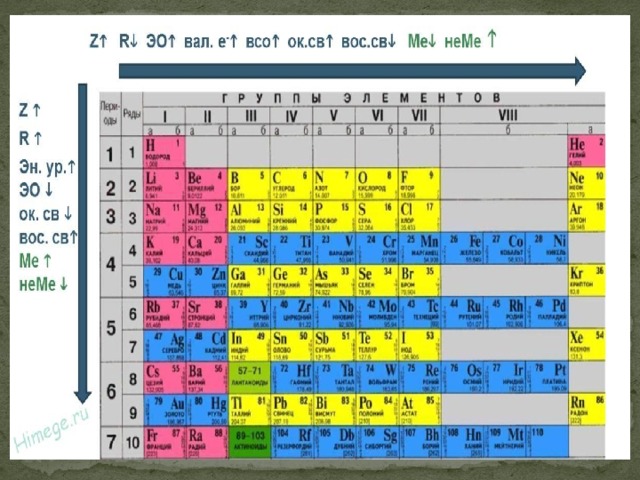 При образовании химических связей в
качестве валентных электронов у атомов
d -элементов выступают s -электроны
внешнего энергетического уровня и часть
или все d -электроны предпоследнего
уровня, причем d -электроны участвуют в
образовании химических связей лишь
после того, как будут связаны все внешние
s -электроны. Кроме того, легкости удаления
s -электронов способствует эффект
экранирования заряда ядра. Он состоит
в уменьшении воздействия на электрон
положительного заряда ядра из-за наличия
между рассматриваемым электроном и
ядром других электронов (это d – или f
-электроны).
При образовании химических связей в
качестве валентных электронов у атомов
d -элементов выступают s -электроны
внешнего энергетического уровня и часть
или все d -электроны предпоследнего
уровня, причем d -электроны участвуют в
образовании химических связей лишь
после того, как будут связаны все внешние
s -электроны. Кроме того, легкости удаления
s -электронов способствует эффект
экранирования заряда ядра. Он состоит
в уменьшении воздействия на электрон
положительного заряда ядра из-за наличия
между рассматриваемым электроном и
ядром других электронов (это d – или f
-электроны).
У р-элементов происходит конкуренция между увеличением числа валентных электронов (неметаллические свойства) и экранированием заряда ядра (усиливаются металлические свойства). В связи с этим у р-элементов по подгруппе сверху вниз увеличивается устойчивость низших степеней окисления.
По
периоду справа налево увеличиваются
неметаллические свойства атомов, за
счет увеличения заряда ядра атома и
трудности отдачи электронов. По подгруппе
сверху вниз увеличиваются металлические
свойства, т. к. ослабевает связь внешних
электронов с ядром.
По подгруппе
сверху вниз увеличиваются металлические
свойства, т. к. ослабевает связь внешних
электронов с ядром.
Свойства соединений подразделяются на кислотно-основные и окислительно-восстановительные. Периодическая система элементов хорошо объясняет эти закономерности. Рассмотрим это на примере гидроксидов.
Если элемент имеет степень окисления маленькую (+1 или +2), например, Na-O-H, то связь Na-O менее прочная, чем O-H и разрыв связи происходит по менее прочной связи.
Na-O-H Na + + OH – . Соединение обладает основными свойствами.
Если степень окисления элемента большая (от +5 до +7), то связь элемент – кислород прочнее, чем связь О-Н и соединение обладает кислотными свойствами. В азотной кислоте степень окисления азота большая (+5).
H + + NO 3 –
Соединения
в степени окисления +3 и +4 проявляют
амфотерные свойства, т.е. в зависимости
от партнера по реакции могут проявлять
как кислотные, так и основные свойства. Но есть исключения Zn +2 ,
Be +2 ,
Sn +2 ,
Pb +2 ,
Ge +2
имеют степень окисления +2, но являются
амфотерными соединениями.
Но есть исключения Zn +2 ,
Be +2 ,
Sn +2 ,
Pb +2 ,
Ge +2
имеют степень окисления +2, но являются
амфотерными соединениями.
По периоду справа налево увеличивается высшая степень окисления, равная номеру группы, поэтому увеличиваются неметаллические и кислотные свойства .
По подгруппе сверху вниз увеличиваются металлические и основные свойства , т.к. увеличивается размер атома и связь с соседним атомом ослабляется.
Таким образом, периодическая система позволяет проанализировать положение простых веществ в связи с особенностями их свойств (металлы, неметаллы).
Периодический закон Менделеева дает возможность определять и свойства простых веществ в химических соединениях. Впервые предсказание свойств было осуществлено самим Менделеевым. Он рассчитал свойства и тех элементов, которые еще не были открыты.
Изменение металлических и неметаллических свойств в таблице Менделеева
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Содержание:
- Что такое металлические и неметаллические свойства
- Как изменяются металлические свойства в периодической системе
- Как изменяются неметаллические свойства в периодической системе
- Видео
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
- фтор;
- кислород;
- азот;
- хлор;
- бром.
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее.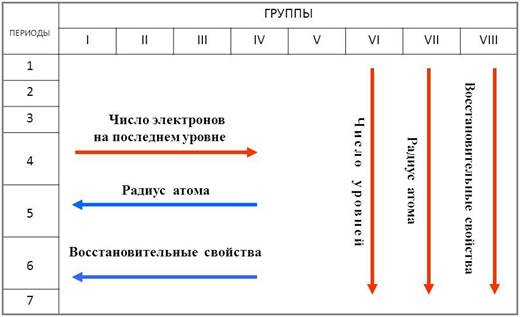 Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
2.6: Периодические тренды свойств элементов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 372868
- Мухаммад Ариф Малик
- Hampton University, Hampton, VA
Свойства элементов обычно показывают периодическую тенденцию, которая коррелирует с их положением в периодической таблице. Свойства и их периодические тренды описаны ниже.
Свойства и их периодические тренды описаны ниже.
Валентные электроны
Электроны на самой внешней оболочке являются валентными электронами. На рис. 2.5.8 красным шрифтом показаны валентные электроны первых двадцати элементов.
Периодический тренд валентных электронов
Все элементы в группе имеют одинаковое количество валентных электронов, равное первой цифре номера их группы. Например, 1-я группа водорода и щелочных металлов имеет один валентный электрон, 2-я группа щелочных металлов имеет два валентных электрона, галогены 17-й группы имеют семь валентных электронов, а благородные газы 18-й группы имеют восемь валентных электронов.
Предупреждение
Переходные металлы в группах с 3 по 12 и внутренние переходные металлы, т. е. лантаноиды и актиноиды — два ряда элементов, расположенных ниже периодической таблицы, являются исключением из общей тенденции валентных электронов, описанной выше. Конфигурации валентных электронов переходных металлов и внутренних переходных металлов здесь не описываются; это выходит за рамки этой книги.
Валентные электроны в основном определяют химические свойства элементов. Элементы одной и той же группы имеют схожие химические свойства, потому что они имеют одинаковую электронную конфигурацию валентной оболочки. Элементы в ряду демонстрируют постепенное изменение химических свойств, потому что их электронная конфигурация валентной оболочки постепенно меняется вдоль ряда.
Символы Льюиса
- Символы Льюиса показывают валентные электроны точками вокруг символа элемента. Одна точка представляет один валентный электрон, например, .
- Точки отображаются на любой из четырех сторон символа.
- Одна точка сверху, снизу, слева или справа показывает четыре валентных электрона. Затем начните соединять точки за пределами четырех валентных электронов, как показано на рис. 2.6.1 для первых двадцати элементов. Исключением является гелий
- , который имеет только два валентных электрона, но они показаны парными.

Электронные точки в структуре Льюиса — это удобный способ определить, сколько связей может образовать атом элемента.
Как правило, каждая непарная точка может образовывать одну связь.
Например, атом водорода с одной непроветриваемой точкой может образовать одну связь, как в H-H. Связь представлена линией между связанными атомами. Связь образуется при совместном использовании неспаренных валентных электронов. Она называется ковалентной связью. Углерод, азот, кислород и фтор с 4, 3, 2 и 1 непарной точкой могут образовывать 4, 3, 2 и 1 связь, например, в следующих молекулах: , , , и .
- Каждая линия в этих молекулах представляет связывающих электронных пар и
- пара точек представляет собой валентные электроны, которые не участвуют в связывании, называемые неподеленной парой электронов .
Размер атома
Электроны существуют вокруг ядра в виде облака без четко определенных границ. Следовательно, атомный размер обычно относится к ковалентному радиусу атома, который составляет половину расстояния между ядрами, ковалентно связанными в гомоядерной молекуле, такой как Cl 2 , I 2 , H 2 , как показано на рис. 2.6.2.
2.6.2.
Периодический тренд размеров атомов
- Размер атома обычно увеличивается сверху вниз в группа, потому что валентные электроны добавляются в более высокую оболочку в каждом последующем члене группы вниз по столбцу.
- Размер атома обычно уменьшается слева направо в ряду, потому что валентные электроны находятся в одной и той же оболочке, а к ядру присоединяется больше протонов, увеличивая притяжение валентных электронов, как показано на рис. 2.6.3.
Энергия ионизации
Положительно заряженное ядро притягивает отрицательно заряженные электроны. Поэтому удаление электрона из атома требует энергии. В результате ионизации образуется катион с меньшим количеством электронов, чем у исходного нейтрального атома, т. е. катионы. 9{-}\nonumber\]
В результате ионизации образуется катион с меньшим количеством электронов, чем у исходного нейтрального атома, т. е. катионы. 9{-}\nonumber\]
Периодический тренд энергии ионизации
- Энергия ионизации обычно уменьшается сверху вниз в столбце, потому что валентные электроны находятся дальше и испытывают меньшее притяжение к ядру вниз по столбцу.
- Энергия ионизации обычно увеличивается слева направо в ряду, потому что валентные электроны находятся в одной и той же оболочке, а к ядру присоединяется больше протонов, что увеличивает притяжение валентных электронов.
Рис. 2.6.4 иллюстрирует периодический тренд энергии ионизации.
Рисунок \(\PageIndex{4}\): Энергия ионизации 1 st в кДж/моль. Источник: Скачать бесплатно на сайте https://openstax.org/details/books/chemistryЭлектроотрицательность
Определение: Электроотрицательность
Электроотрицательность — это способность атома в соединении притягивать к себе связывающую электронную пару. Электроположительность противоположна электроотрицательности. Электроотрицательность — это свойство атома в соединении, то есть связанного атома, а не свойство отдельного атома.
Электроположительность противоположна электроотрицательности. Электроотрицательность — это свойство атома в соединении, то есть связанного атома, а не свойство отдельного атома.
Существует несколько шкал электроотрицательности. Наиболее часто используется шкала электроотрицательности Полинга. На рис. 2.6.5 показаны значения электроотрицательностей по шкале электроотрицательности Полинга.
Рисунок \(\PageIndex{5}\): Периодическая таблица элементов по шкале Полинга. Источник: https://en.Wikipedia.org/wiki/ElectronegativityПериодический тренд электроотрицательности
- Электроотрицательность обычно уменьшается сверху вниз в столбце, потому что размер атома увеличивается вниз по столбцу, делая ядро менее эффективным в притяжении связывающие электроны.
- Электроотрицательность обычно увеличивается слева направо в ряду, потому что размер атома уменьшается слева направо в ряду, благодаря чему ядро более эффективно притягивает к себе пару связывающих электронов.

Металлический характер
Металлический характер связан с легкостью потери электрона в химической реакции. Тренд металлического характера противоположен тренду энергии ионизации.
Периодическая тенденция металлического характера
- Металлический характер обычно увеличивается сверху вниз в колонке, потому что размер атомов увеличивается вниз по колонке, делая валентные электроны менее прочно удерживаемыми и легче удаляемыми.
- Металлический характер обычно уменьшается слева направо в ряду, потому что размер атома уменьшается слева направо, что делает валентные электроны более прочно удерживаемыми и трудными для удаления.
Резюме периодических тенденций
Энергия ионизации и электроотрицательность обычно увеличиваются слева направо в ряду и снизу вверх в столбце. Атомный размер и металлический характер противоположны, т. е. увеличиваются справа налево в ряду и сверху вниз в столбце. Рис. 2.6.6 суммирует периодическую тенденцию свойств элементов.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Мухаммад Малик
- Лицензия
- Общественное достояние
- Теги
Периодические изменения свойств элементов.
 Химия
ХимияЭлектронная структура и периодические свойства элементов
OpenStaxCollege
[латексная страница]
Цели обучения
К концу этого раздела вы сможете:
- Описывать и объяснять наблюдаемые тенденции изменения размеров атомов, энергии ионизации и сродства элементов к электрону
Элементы в группах (вертикальных столбцах) периодической таблицы демонстрируют сходное химическое поведение. Это сходство возникает из-за того, что члены группы имеют одинаковое количество и распределение электронов в своих валентных оболочках. Однако в периодической таблице есть и другие закономерности химических свойств. Например, по мере продвижения вниз по группе металлический характер атомов возрастает. Кислород в верхней части группы 16 (6А) представляет собой бесцветный газ; в середине группы селен — твердое полупроводниковое вещество; а внизу полоний — серебристо-серое твердое вещество, проводящее электричество.
Проходя период слева направо, мы добавляем протон к ядру и электрон к валентной оболочке с каждым последующим элементом. По мере того, как мы спускаемся по элементам в группе, число электронов на валентной оболочке остается постоянным, но главное квантовое число каждый раз увеличивается на единицу. Понимание электронной структуры элементов позволяет нам изучить некоторые свойства, определяющие их химическое поведение. Эти свойства периодически меняются по мере изменения электронной структуры элементов. Это (1) размер (радиус) атомов и ионов, (2) энергия ионизации и (3) сродство к электрону.
Квантово-механическая картина затрудняет установление определенного размера атома. Однако существует несколько практических способов определения радиуса атомов и, таким образом, определения их относительных размеров, дающих примерно одинаковые значения. Мы будем использовать ковалентный радиус ([ссылка]), который определяется как половина расстояния между ядрами двух одинаковых атомов, когда они соединены ковалентной связью (это измерение возможно, потому что атомы внутри молекул все еще сохраняют большую часть своего атомная идентичность). Мы знаем, что когда мы просматриваем группу, главное квантовое число n , увеличивается на единицу для каждого элемента. Таким образом, электроны добавляются в область пространства, которая все больше удаляется от ядра. Следовательно, размер атома (и его ковалентный радиус) должен увеличиваться по мере того, как мы увеличиваем расстояние от самых удаленных электронов от ядра. Эта тенденция проиллюстрирована для ковалентных радиусов галогенов в [ссылка] и [ссылка]. Тенденции для всей таблицы Менделеева можно увидеть в [ссылка].
Мы знаем, что когда мы просматриваем группу, главное квантовое число n , увеличивается на единицу для каждого элемента. Таким образом, электроны добавляются в область пространства, которая все больше удаляется от ядра. Следовательно, размер атома (и его ковалентный радиус) должен увеличиваться по мере того, как мы увеличиваем расстояние от самых удаленных электронов от ядра. Эта тенденция проиллюстрирована для ковалентных радиусов галогенов в [ссылка] и [ссылка]. Тенденции для всей таблицы Менделеева можно увидеть в [ссылка].
(а) Радиус атома определяется как половина расстояния между ядрами в молекуле, состоящей из двух одинаковых атомов, соединенных ковалентной связью. Атомный радиус галогенов увеличивается вниз по группе как и увеличивается. (b) Ковалентные радиусы элементов показаны в масштабе. Общая тенденция заключается в том, что радиусы увеличиваются вниз по группе и уменьшаются по периоду.
В каждом периоде тренд атомного радиуса уменьшается по мере увеличения Z ; например, от К до Кр. Внутри каждой группы (например, щелочные металлы, показанные фиолетовым) наблюдается тенденция к увеличению атомного радиуса по мере увеличения Z .
Как показано в [ссылка], при движении по периоду слева направо мы обычно обнаруживаем, что каждый элемент имеет меньший ковалентный радиус, чем предшествующий ему элемент. Это может показаться нелогичным, поскольку подразумевает, что атомы с большим количеством электронов имеют меньший атомный радиус. Это можно объяснить с помощью понятия эффективного ядерного заряда, Z эфф . Это притяжение, оказываемое ядром на конкретный электрон с учетом любых электрон-электронных отталкиваний. У водорода есть только один электрон, поэтому заряд ядра ( Z ) и эффективный заряд ядра ( Z эфф ) равны. Для всех других атомов внутренние электроны частично экранируют внешние электроны от притяжения ядра, и, таким образом:
Для всех других атомов внутренние электроны частично экранируют внешние электроны от притяжения ядра, и, таким образом:
\({Z}_{\text{eff}}=Z-экранирование\) определяется вероятностью того, что другой электрон находится между интересующим электроном и ядром, а также электрон-электронным отталкиванием, с которым сталкивается интересующий электрон. Электроны ядра умеют экранировать, в то время как электроны в одной и той же валентной оболочке не так эффективно блокируют ядерное притяжение, которое испытывают друг друга. Таким образом, каждый раз, когда мы переходим от одного элемента к другому через период, Z увеличивается на единицу, но экранирование увеличивается незначительно. Таким образом, Z эфф увеличивается, когда мы движемся слева направо по периоду. Более сильное притяжение (более высокий эффективный ядерный заряд), испытываемое электронами в правой части периодической таблицы, притягивает их ближе к ядру, уменьшая ковалентные радиусы.
Таким образом, как и следовало ожидать, самые внешние, или валентные, электроны удалить легче всего, потому что они имеют самые высокие энергии, больше экранированы и находятся дальше всего от ядра. Как правило, когда репрезентативные элементы образуют катионы, они делают это за счет потери нс или нп электронов, которые были добавлены последними в процессе Ауфбау. Переходные элементы, с другой стороны, теряют нс электронов до того, как они начинают терять ( n – 1) d электронов, хотя нс электронов добавляются первыми, согласно принципу Ауфбау.
Сортировка атомных радиусов
Предсказать порядок увеличения ковалентного радиуса для Ge, Fl, Br, Kr.
Решение
Радиус увеличивается по мере продвижения вниз по группе, поэтому Ge < Fl (Примечание: Fl — это символ флеровия, элемента 114, а НЕ фтора). Радиус уменьшается по мере продвижения по периоду, поэтому Kr < Br < Ge. Складывая тренды, получаем Kr < Br < Ge < Fl.
Радиус уменьшается по мере продвижения по периоду, поэтому Kr < Br < Ge. Складывая тренды, получаем Kr < Br < Ge < Fl.
Проверьте свои знания
Приведите пример атома, размер которого меньше размера фтора.
Ответ:
Ne или He
Ионный радиус — это мера, используемая для описания размера иона. У катиона всегда меньше электронов и такое же количество протонов, как у родительского атома; он меньше атома, из которого он получен ([ссылка]). Например, ковалентный радиус атома алюминия (1 с 2 2 с 2 2 p 6 3 s 2 3 p 1 ) is 118 pm, whereas the ionic radius of an Al 3+ (1 s 2 2 s 2 2 p 6 ) 68 вечера. Когда электроны удаляются с внешней валентной оболочки, оставшиеся электроны ядра, занимающие меньшие оболочки, испытывают больший эффективный ядерный заряд Z eff (как обсуждалось) и притягиваются еще ближе к ядру.
Когда электроны удаляются с внешней валентной оболочки, оставшиеся электроны ядра, занимающие меньшие оболочки, испытывают больший эффективный ядерный заряд Z eff (как обсуждалось) и притягиваются еще ближе к ядру.
Радиус катиона меньше, чем у родительского атома (Al), из-за потерянных электронов; радиус аниона больше, чем у исходного (S), из-за полученных электронов.
Катионы с большим зарядом меньше катионов с меньшим зарядом (например, V 2+ имеет ионный радиус 79 пм, а V 3+ равен 64 пм). Проходя по группам периодической таблицы, мы обнаруживаем, что катионы последовательных элементов с одинаковым зарядом обычно имеют больший радиус, что соответствует увеличению главного квантового числа, и .
Анион (отрицательный ион) образуется путем присоединения одного или нескольких электронов к валентной оболочке атома. Это приводит к большему отталкиванию электронов и уменьшению Z эфф на электрон.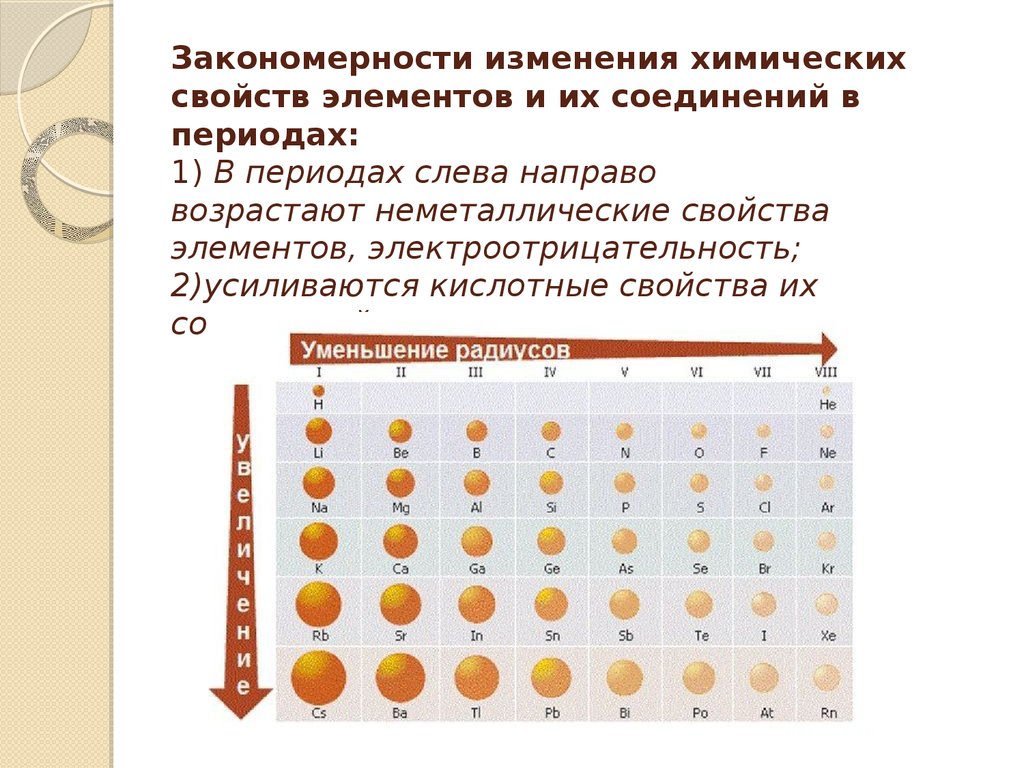 Оба эффекта (увеличение числа электронов и уменьшение Z эфф ) приводят к тому, что радиус аниона становится больше, чем у родительского атома ([ссылка]). Например, атом серы ([Ne]3 s 2 3 p 4 ) имеет ковалентный радиус 104 пм, тогда как ионный радиус сульфид-аниона ([Ne]3 s 2 3 p 6 ) составляет 170 пм. Для последовательных элементов, идущих вниз по любой группе, анионы имеют большие главные квантовые числа и, следовательно, большие радиусы.
Оба эффекта (увеличение числа электронов и уменьшение Z эфф ) приводят к тому, что радиус аниона становится больше, чем у родительского атома ([ссылка]). Например, атом серы ([Ne]3 s 2 3 p 4 ) имеет ковалентный радиус 104 пм, тогда как ионный радиус сульфид-аниона ([Ne]3 s 2 3 p 6 ) составляет 170 пм. Для последовательных элементов, идущих вниз по любой группе, анионы имеют большие главные квантовые числа и, следовательно, большие радиусы.
Атомы и ионы, имеющие одинаковую электронную конфигурацию, называются изоэлектронными. Примерами изоэлектронных частиц являются N 3–, O 2–, F –, Ne, Na 9.0117 + , Mg 2+ и Al 3+ (1 с 2 2 с 2 2 р2 ).
 Другой изоэлектронный ряд: P 3– , S 2– , Cl – , Ar, K + , Ca 2+ и Sc 3+ ([Ne]3
Другой изоэлектронный ряд: P 3– , S 2– , Cl – , Ar, K + , Ca 2+ и Sc 3+ ([Ne]3
Энергия, необходимая для удаления третьего электрона, представляет собой третью энергию ионизации и так далее. Для удаления электронов из атомов или ионов всегда требуется энергия, поэтому процессы ионизации являются эндотермическими, а значения IE всегда положительны. Для более крупных атомов наиболее слабо связанный электрон расположен дальше от ядра, и поэтому его легче удалить. Таким образом, с увеличением размера (радиуса атома) энергия ионизации должна уменьшаться. Соотнося эту логику с тем, что мы только что узнали о радиусах, мы ожидаем, что первая энергия ионизации будет уменьшаться по группе и увеличиваться по периоду.
[ссылка] показывает зависимость между первой энергией ионизации и атомным номером нескольких элементов. Значения первой энергии ионизации для элементов приведены в [ссылка]. В течение периода IE 1 обычно увеличивается с увеличением Z . Вниз по группе значение IE 1 обычно уменьшается с увеличением Z . Однако существуют некоторые систематические отклонения от этой тенденции. Обратите внимание, что энергия ионизации бора (атомный номер 5) меньше, чем у бериллия (атомный номер 4), хотя заряд ядра бора больше на один протон. Это можно объяснить тем, что энергия подоболочек возрастает как l увеличивается из-за проникновения и экранирования (как обсуждалось ранее в этой главе). Внутри любой оболочки электроны s имеют меньшую энергию, чем электроны p . Это означает, что s электрон труднее удалить из атома, чем p электрон в той же оболочке. Электрон, удаленный при ионизации бериллия ([He]2 s 2 ), представляет собой s электрон, тогда как электрон, удаленный при ионизации бора ([He]2 s 2 2 p 1 ) представляет собой p электрон; это приводит к более низкой первой энергии ионизации бора, хотя заряд его ядра больше на один протон. Таким образом, мы видим небольшое отклонение от предсказанной тенденции, происходящее каждый раз, когда начинается новая подоболочка.
Электрон, удаленный при ионизации бериллия ([He]2 s 2 ), представляет собой s электрон, тогда как электрон, удаленный при ионизации бора ([He]2 s 2 2 p 1 ) представляет собой p электрон; это приводит к более низкой первой энергии ионизации бора, хотя заряд его ядра больше на один протон. Таким образом, мы видим небольшое отклонение от предсказанной тенденции, происходящее каждый раз, когда начинается новая подоболочка.
Энергия первой ионизации элементов в первые пять периодов нанесена в зависимости от их атомного номера.
Эта версия периодической таблицы показывает первую энергию ионизации (IE 1 ), кДж/моль выбранных элементов.
Другое отклонение происходит, когда орбитали заполняются более чем наполовину. Первая энергия ионизации кислорода несколько меньше, чем у азота, несмотря на тенденцию к увеличению значений IE 1 за период. Глядя на орбитальную диаграмму кислорода, мы видим, что удаление одного электрона устранит электрон-электронное отталкивание, вызванное спариванием электронов на орбитали 2 p , и приведет к полузаполненной орбитали (что энергетически выгодно). Аналогичные изменения происходят и в последующие периоды (обратите внимание на падение серы после фосфора в [ссылка]).
Глядя на орбитальную диаграмму кислорода, мы видим, что удаление одного электрона устранит электрон-электронное отталкивание, вызванное спариванием электронов на орбитали 2 p , и приведет к полузаполненной орбитали (что энергетически выгодно). Аналогичные изменения происходят и в последующие периоды (обратите внимание на падение серы после фосфора в [ссылка]).
Отнять электрон у катиона сложнее, чем оторвать электрон от нейтрального атома из-за большего электростатического притяжения к катиону. Точно так же удалить электрон из катиона с более высоким положительным зарядом сложнее, чем удалить электрон из иона с более низким зарядом. Таким образом, последовательные энергии ионизации одного элемента всегда возрастают. Как видно из [ссылка], для каждого элемента наблюдается значительное увеличение энергии ионизации (изменение цвета). Этот скачок соответствует удалению остовных электронов, которые удалить труднее, чем валентные электроны. Например, Sc и Ga имеют по три валентных электрона, поэтому быстрое увеличение энергии ионизации происходит после третьей ионизации.
 4
4 Ранжирование энергий ионизации
Предсказать порядок возрастания энергии для следующих процессов: IE 1 для Al, IE 1 для Tl, IE 2 для Na, IE 3 для Al
Решение
Удаление электрона 6 p 1 из Tl легче, чем удаление электрона 3 p 1 из Al, потому что более высокая орбиталь n находится дальше от ядра, поэтому IE 9{\text{-}}\right)\) требует больше энергии, потому что катион Al 2+ оказывает более сильное притяжение на электрон, чем нейтральный атом Al, поэтому IE 1 (Al) < IE 3 ( Ал).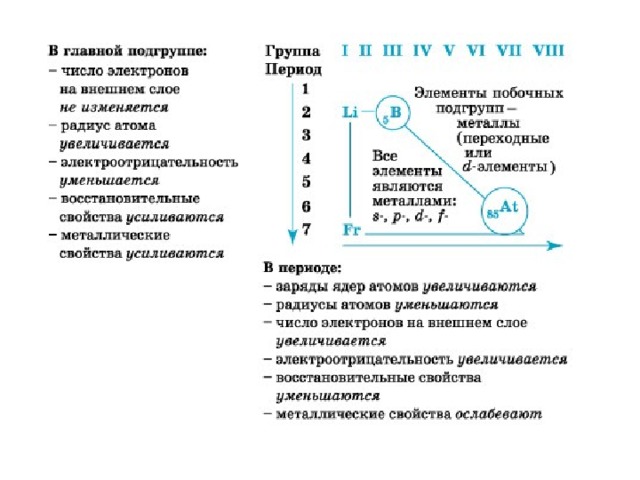 Вторая энергия ионизации натрия удаляет остовный электрон, что представляет собой гораздо более энергетический процесс, чем удаление валентных электронов. Сложив все это вместе, мы получаем: ИЭ 1 (Tl) < ИЭ 1 (Al) < ИЭ 3 (Al) < ИЭ 2 (Na).
Вторая энергия ионизации натрия удаляет остовный электрон, что представляет собой гораздо более энергетический процесс, чем удаление валентных электронов. Сложив все это вместе, мы получаем: ИЭ 1 (Tl) < ИЭ 1 (Al) < ИЭ 3 (Al) < ИЭ 2 (Na).
Проверьте свои знания 9{\text{-}}\left(g\right)\phantom{\rule{2em}{0ex}}{\text{EA}}_{1}\)
Этот процесс может быть эндотермическим или экзотермическим, в зависимости от элемента. Советник некоторых элементов приведен в [ссылка]. Вы можете видеть, что многие из этих элементов имеют отрицательные значения EA, что означает, что энергия высвобождается, когда газообразный атом принимает электрон. Однако для некоторых элементов требуется энергия, чтобы атом стал отрицательно заряженным и значение их EA положительно. Как и в случае с энергией ионизации, последующие значения EA связаны с образованием ионов с большим зарядом. Второй ЭА — это энергия, связанная с присоединением электрона к аниону с образованием иона -2 и так далее.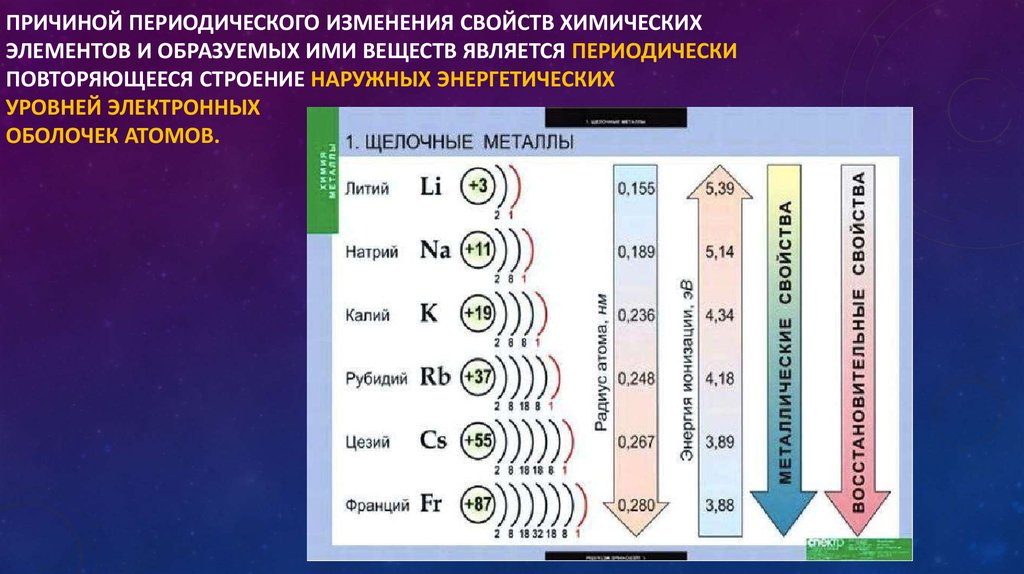
Как мы могли предсказать, становится легче добавить электрон к ряду атомов по мере увеличения эффективного ядерного заряда атомов. Мы обнаруживаем, что по мере продвижения слева направо по периоду СР имеют тенденцию становиться более отрицательными. Исключения среди элементов группы 2 (2А), группы 15 (5А) и группы 18 (8А) можно понять, исходя из электронной структуры этих групп. Инертные газы группы 18 (8А) имеют полностью заполненную оболочку, и прилетающий электрон должен добавляться к более высокой 9-й группе.0221 н уровень, что сложнее сделать. Группа 2 (2A) имеет заполненную подоболочку нс , и поэтому следующий добавленный электрон переходит в более высокую энергию np , поэтому, опять же, наблюдаемое значение EA не соответствует прогнозируемому тренду. Наконец, группа 15 (5A) имеет наполовину заполненную подоболочку np , и следующий электрон должен быть в паре с существующим электроном np . Во всех этих случаях исходная относительная стабильность электронной конфигурации нарушает ход ЭА.
Во всех этих случаях исходная относительная стабильность электронной конфигурации нарушает ход ЭА.
Мы также можем ожидать, что атом в верхней части каждой группы будет иметь самый большой EA; их первые потенциалы ионизации предполагают, что эти атомы имеют самые большие эффективные ядерные заряды. Однако, продвигаясь вниз по группе, мы видим, что второй элемент в группе чаще всего имеет наибольший EA. Уменьшение ЭА первого члена можно объяснить малым размером оболочки n = 2 и связанными с этим большими электрон-электронными отталкиваниями. Например, хлор со значением EA –348 кДж/моль имеет самое высокое значение среди всех элементов периодической таблицы. ЭА фтора составляет –322 кДж/моль. Когда мы присоединяем электрон к атому фтора с образованием аниона фтора (F – ), добавляем электрон на оболочку n = 2. Электрон притягивается к ядру, но также происходит значительное отталкивание от других электронов, уже присутствующих в этой небольшой валентной оболочке. Атом хлора имеет такую же электронную конфигурацию в валентной оболочке, но поскольку входящий электрон идет в оболочку n = 3, он занимает значительно большую область пространства и электрон-электронные отталкивания уменьшаются. Входящий электрон не испытывает такого сильного отталкивания, и атом хлора легче принимает дополнительный электрон.
Атом хлора имеет такую же электронную конфигурацию в валентной оболочке, но поскольку входящий электрон идет в оболочку n = 3, он занимает значительно большую область пространства и электрон-электронные отталкивания уменьшаются. Входящий электрон не испытывает такого сильного отталкивания, и атом хлора легче принимает дополнительный электрон.
Эта версия периодической таблицы отображает значения сродства к электрону (в кДж/моль) для выбранных элементов.
Свойства, обсуждаемые в этом разделе (размер атомов и ионов, эффективный заряд ядра, энергия ионизации и сродство к электрону), являются центральными для понимания химической реактивности. Например, поскольку фтор имеет энергетически выгодную ЭА и большой энергетический барьер ионизации (ИЭ), анионы фтора образуются гораздо легче, чем катионы. Металлические свойства, включая проводимость и ковкость (способность формироваться в листы), зависят от наличия легко удаляемых электронов.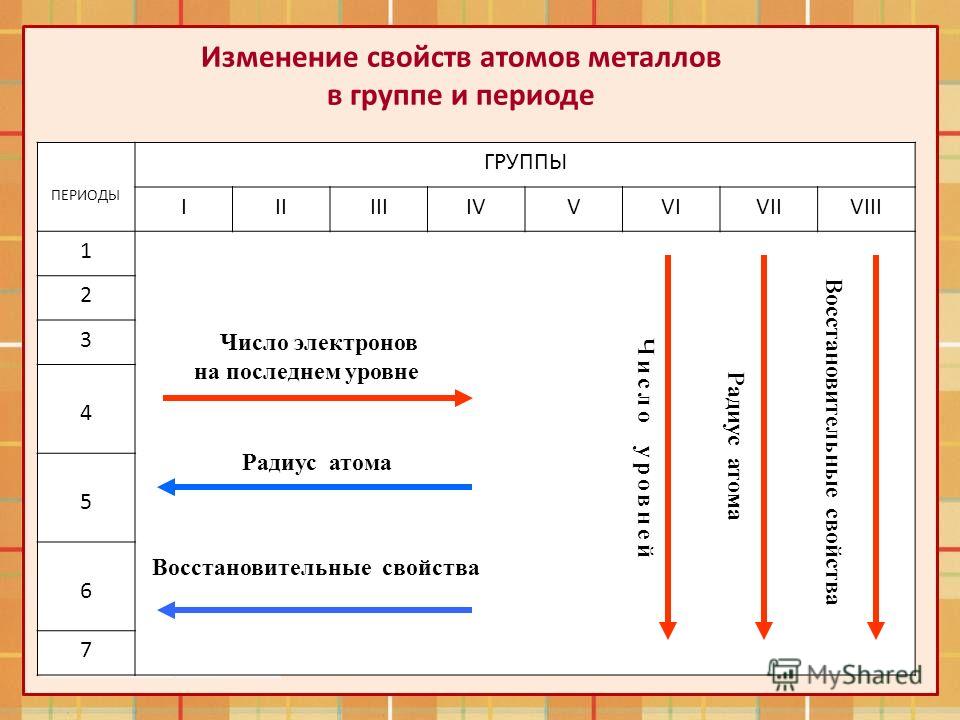 Таким образом, металлический характер увеличивается по мере продвижения вниз по группе и уменьшается по периоду в той же тенденции, что и для размера атома, потому что легче удалить электрон, который находится дальше от ядра.
Таким образом, металлический характер увеличивается по мере продвижения вниз по группе и уменьшается по периоду в той же тенденции, что и для размера атома, потому что легче удалить электрон, который находится дальше от ядра.
Конфигурации электронов позволяют нам понять многие периодические тренды. Ковалентный радиус увеличивается по мере продвижения вниз по группе, потому что увеличивается уровень n (размер орбиты). Ковалентный радиус в основном уменьшается, когда мы движемся слева направо по периоду, потому что эффективный ядерный заряд, испытываемый электронами, увеличивается, и электроны сильнее притягиваются к ядру. Радиусы анионов больше, чем у родительского атома, а радиусы катионов меньше, потому что число валентных электронов изменилось, а заряд ядра остался постоянным. Энергия ионизации (энергия, связанная с образованием катиона) уменьшается по группе и в основном увеличивается по периоду, потому что легче удалить электрон с большей орбиты с более высокой энергией. Сродство к электрону (энергия, связанная с образованием аниона) является более благоприятным (экзотермическим), когда электроны помещаются на орбитали с более низкой энергией, ближе к ядру. Следовательно, сродство к электрону становится все более отрицательным по мере того, как мы движемся слева направо по периодической таблице, и уменьшается по мере того, как мы движемся вниз по группе. Как для данных IE, так и для данных сродства к электрону существуют исключения из тенденций, когда речь идет о полностью или наполовину заполненных подоболочках.
Сродство к электрону (энергия, связанная с образованием аниона) является более благоприятным (экзотермическим), когда электроны помещаются на орбитали с более низкой энергией, ближе к ядру. Следовательно, сродство к электрону становится все более отрицательным по мере того, как мы движемся слева направо по периодической таблице, и уменьшается по мере того, как мы движемся вниз по группе. Как для данных IE, так и для данных сродства к электрону существуют исключения из тенденций, когда речь идет о полностью или наполовину заполненных подоболочках.
Основываясь на их положениях в периодической таблице, предскажите, какие атомы имеют наименьший радиус: Mg, Sr, Si, Cl, I. Li, Rb, N, F, I.
Основываясь на их позициях в периодической таблице, предскажите, у какого из них наибольшая первая энергия ионизации: Mg, Ba, B, O, Te.
O
Основываясь на их позициях в периодической таблице, предскажите, какая из них имеет наименьшую первую энергию ионизации: Li, Cs, N, F, I.
На основании их положения в периодической таблице расположите следующие атомы в порядке возрастания энергии первой ионизации: F, Li, N, Rb
Rb < Li < N < F
На основании их положения в периодической таблице, расположите следующие атомы или соединения в порядке возрастания энергии первой ионизации: Mg, O, S, Si
Атомы какой группы периодической таблицы имеют электронную конфигурацию валентной оболочки ns 2 np 3 ?
15 (5A)
Атомы какой группы периодической таблицы имеют электронную конфигурацию валентной оболочки нс 2 ?
На основании их положения в периодической таблице перечислите следующие атомы в порядке увеличения радиуса: Mg, Ca, Rb, Cs.
Mg < Ca < Rb < Cs
На основании их положения в периодической таблице перечислите следующие атомы в порядке увеличения радиуса: Sr, Ca, Si, Cl.
В зависимости от их положения в периодической таблице перечислите следующие ионы в порядке увеличения радиуса: K + , Са 2+ , Алюминий 3+ , Si 4+ .
Si 4+ < Al 3+ < Ca 2+ < K +
Перечислите следующие ионы в порядке увеличения радиуса: , Те 2– .
Какой атом и/или ион изоэлектронен Br + : Se 2+ , Se, As – , Kr, Ga 3+ , Cl – ?
Се, Ас −
Какие из следующих атомов и ионов изоэлектронны S 2+ : Si 4+ , Cl 3+ , Ar, As 3+ , Si, Al 3+ ?
Сравните количество протонов и электронов, присутствующих в каждом, чтобы ранжировать следующие ионы в порядке увеличения радиуса: As 3– , Br – , K + , Mg 2+ .
Mg 2+ < K + < Br – < As 3– 9{-}\)
O, IE 1
Ионные радиусы ионов S 2– , Cl – и K + равны 184, 181, 138 пм соответственно.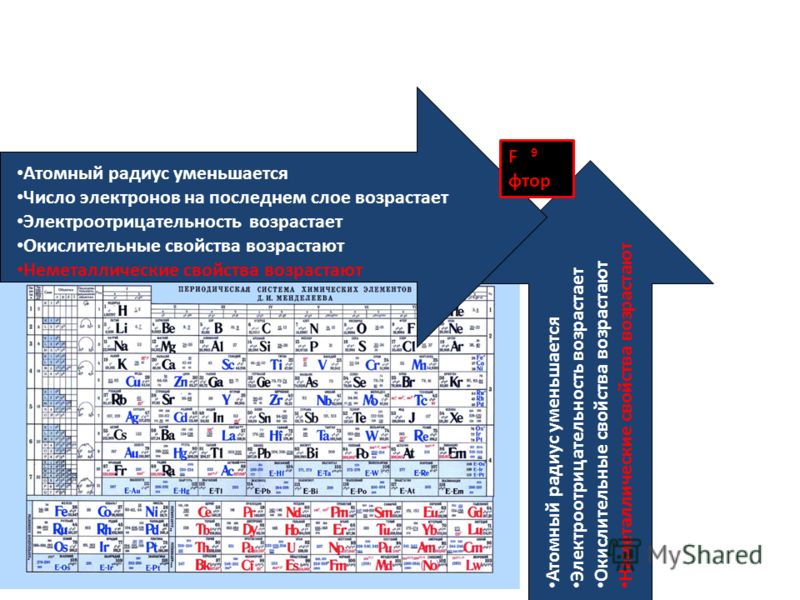 Объясните, почему эти ионы имеют разные размеры, хотя они содержат одинаковое число электронов.
Объясните, почему эти ионы имеют разные размеры, хотя они содержат одинаковое число электронов.
У атома какой основной группы ожидается наименьшая вторая энергия ионизации?
Ра
Объясните, почему Ал принадлежит к группе 13, а не к группе 3?
- ковалентный радиус
- половина расстояния между ядрами двух одинаковых атомов, когда они соединены ковалентной связью
- эффективный ядерный заряд
- заряд, который приводит к кулоновской силе, действующей ядром на электрон, рассчитывается как заряд ядра минус экранирование
- сродство к электрону
- энергия, необходимая для присоединения электрона к атому газа с образованием аниона
- энергия ионизации
- энергии, необходимой для отрыва электрона от газообразного атома или иона. Соответствующее число (например, вторая энергия ионизации) соответствует заряду образовавшегося иона (X 2+ )
- изоэлектронный
- группа ионов или атомов с идентичными электронными конфигурациями
периодическая таблица | Определение, элементы, группы, сборы, тенденции и факты
таблица Менделеева
Посмотреть все СМИ
- Ключевые люди:
- Дмитрий Менделеев Лотар Мейер Поль-Эмиль Лекок де Буабодран
- Похожие темы:
- химический элемент атом группа периодический закон период
Просмотреть весь связанный контент →
Популярные вопросы
Что такое периодическая таблица?
Периодическая таблица представляет собой табличный массив химических элементов, упорядоченных по атомному номеру, от элемента с наименьшим атомным номером, водорода, до элемента с наибольшим атомным номером, оганесона. Атомный номер элемента — это число протонов в ядре атома этого элемента. У водорода 1 протон, у оганесона 118.
Атомный номер элемента — это число протонов в ядре атома этого элемента. У водорода 1 протон, у оганесона 118.
Что общего у групп периодической таблицы?
Группы периодической таблицы отображаются в виде вертикальных столбцов, пронумерованных от 1 до 18. Элементы в группе имеют очень похожие химические свойства, которые возникают из-за количества присутствующих валентных электронов, то есть количества электронов в внешняя оболочка атома.
Откуда взялась периодическая таблица?
Расположение элементов в периодической таблице определяется электронной конфигурацией элементов. Из-за принципа запрета Паули не более двух электронов могут занимать одну и ту же орбиталь. Первый ряд периодической таблицы состоит всего из двух элементов, водорода и гелия. Чем больше у атомов электронов, тем больше у них орбит, доступных для заполнения, и, таким образом, строки содержат больше элементов в нижней части таблицы.
Почему таблица Менделеева делится?
Периодическая таблица имеет две строки внизу, которые обычно отделены от основной части таблицы. Эти ряды содержат элементы лантаноидного и актиноидного рядов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (актиний до лоуренсия) соответственно. Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
Эти ряды содержат элементы лантаноидного и актиноидного рядов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (актиний до лоуренсия) соответственно. Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
Сводка
Прочтите краткий обзор этой темы
периодическая таблица , полная периодическая таблица элементов , в химии упорядоченный массив всех химических элементов в порядке возрастания атомного номера, т. е. общее количество протонов в атомном ядре. Когда химические элементы расположены таким образом, в их свойствах возникает повторяющаяся закономерность, называемая «периодическим законом», при которой элементы в одном столбце (группе) обладают сходными свойствами. Первоначальное открытие, которое сделал Д.И. Менделеев в середине 19ХХ века, сыграл неоценимую роль в развитии химии.
Изучите периодический закон химии, чтобы понять свойства элементов и то, как они соотносятся друг с другом
Посмотреть все видео к этой статье До второго десятилетия 20-го века фактически не признавалось, что порядок элементов в периодической системе таков их атомных номеров, целые числа которых равны положительным электрическим зарядам атомных ядер, выраженным в электронных единицах. В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
История периодического закона
Узнайте, как устроена таблица Менделеева
Просмотреть все видео к этой статье В первые годы 19 века наблюдалось бурное развитие аналитической химии — искусства различать различные химические вещества — и, как следствие, накопление обширных знаний о химических и физических свойствах как элементов, так и соединений. Это быстрое распространение химических знаний вскоре потребовало классификации, ибо на классификации химических знаний основана не только систематизированная литература по химии, но и лабораторное искусство, с помощью которого химия передается как живая наука от одного поколения химиков к другому. Отношения между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отставала от классификации соединений. Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Дж.В. Доберейнер в 1817 году показал, что совокупный вес, то есть атомный вес, стронция находится посередине между весами кальция и бария, а несколько лет спустя он показал, что существуют и другие подобные «триады» (хлор, бром и йод [галогены] и литий, натрий и калий [щелочные металлы]). Ж.-Б.-А. Дюма, Л. Гмелин, Э. Ленссен, Макс фон Петтенкофер и Дж. П. Кук расширили предположения Доберейнера между 1827 и 1858 гг., показав, что подобные отношения простираются дальше, чем триады элементов: фтор добавляется к галогенам, а магний — к щелочноземельным. металлы, в то время как кислород, сера, селен и теллур были отнесены к одному семейству, а азот, фосфор, мышьяк, сурьма и висмут – к другому семейству элементов.
Britannica Quiz
36 вопросов из самых популярных научных викторин Britannica
Насколько хорошо вы знаете астрономию? Как насчет квантовой механики? Эта викторина проведет вас через 36 самых сложных вопросов из самых популярных викторин Britannica о естественных науках. Только лучшие викторины закончат его.
Только лучшие викторины закончат его.
Позднее были предприняты попытки показать, что атомные веса элементов могут быть выражены арифметической функцией, и в 1862 г. А.-Э.-Б. де Шанкуртуа предложил классификацию элементов, основанную на новых значениях атомных весов, данных системой Станислао Канниццаро 1858 года. Де Шанкуртуа нанес атомные веса на поверхность цилиндра с окружностью 16 единиц, что соответствует приблизительному атомному весу кислород. Получившаяся винтовая кривая перенесла тесно связанные элементы в соответствующие точки цилиндра, расположенные выше или ниже друг друга, и, следовательно, он предположил, что «свойства элементов — это свойства чисел» — замечательное предсказание в свете современных знаний.
Классификация элементов
В 1864 году Я.А.Р. Ньюлендс предложил классифицировать элементы в порядке увеличения атомного веса, при этом элементам присваивались порядковые номера от единицы и вверх, и они были разделены на семь групп, обладающих свойствами, тесно связанными с первыми семью из известных тогда элементов: водород, литий, бериллий, бор, углерод.


