Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического». | Учебно-методический материал по химии (9 класс) по теме:
Урок №20. Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического».
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой (эта), измеряется в процентах или долях.
m практическая х100%
= m теоретичееская
V практический х100%
= V теоретичееский
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Определите выход продукта реакции (%).
1. Записываем краткое условие задачи
Дано:
m (Mg) = 1,2 г
m практическая (MgSO4) = 5,5 г
_____________________
Найти: =?
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(Mg) = 24 г/моль
M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль
4. Находим количество вещества реагента по формулам
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
m = ν · M
mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) =
= 120 г/моль · 0,05 моль = 6 г
6. Находим массовую (объёмную) долю выхода продукта по формуле
(MgSO4)=(5,5г ·100%)/6г=91,7%
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
1. Записываем краткое условие задачи
Дано:
m(CaO) = 16,8 г
=80% или 0,8
_________________
Найти:
m практ (CaC2) = ?
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(CaO) = 40 + 16 = 56 г/моль
M(CaC2) = 40 + 2 · 12 = 64г/моль
4. Находим количество вещества реагента по формулам
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
6. Находим массовую (объёмную) долю выхода продукта по формуле
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г
Ответ: m практич (CaC2) = 15,36 г
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
1. Записываем краткое условие задачи
Дано: н. у.
Vm = 22,4 л/моль
Vпрактич(CO2) = 28,56 л
= 85% или 0,85
____________________
Найти:
m(Na2CO3) =?
2. Находим по ПСХЭ молярные массы веществ, если это необходимо
M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы:
Vтеоретич(CO2) =
= 28,56 л / 0,85 = 33,6 л
ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Находим количество вещества реагента по УХР
По УХР:
, следовательно
ν(Na2CO3) = ν(CO2) = 1,5 моль
5. Определяем массу (объём) реагента по формуле:
Определяем массу (объём) реагента по формуле:
m = ν · M
V = ν · Vm m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
у.). Практический выход продукта 85%.
ДЗ
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
№4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
ДЗ
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
№4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Как найти выход вещества. Как найти массу вещества? «на выход продукта от теоретически возможного»
ВЫЧИСЛЕНИЕ ВЫХОДА ПРОДУКТА РЕАКЦИИ В ПРОЦЕНТАХ ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО, ЕСЛИ ИЗВЕСТНЫ МАССЫ ИСХОДНОГО ВЕЩЕСТВА И ПРОДУКТА РЕАКЦИИ
Задача 1. Через известковую воду, содержащую 3,7 г гидроксида кальция, пропустили углекислый газ. Выпавший осадок отфильтровали, высушили, взвесили. Его масса оказалась равной 4,75 г. Вычислить выход продукта реакции (в процентах) от теоретически возможного.
Дано:I способ.
Определим количества приведенных в условии задачи веществ:
v = m / M = 3,7 г / 74 г/моль = 0,05 моль;
v = 0,05 моль
v(CaCO 3 ) = m(CaCO 3 ) / M(CaCO 3 ) = 4,75 г / 100 г/моль = 0,0475 моль;
v(CaCO 3 ) = 0,0475 моль
Запишем уравнение химической реакции:
Ca(OH) 2
Из уравнения химической реакции следует, что из 1 моль Ca(OH) 2 образуется 1 моль CaCO 3
 Практически же получено 0,0475 моль CaCO 3 , что составит:
Практически же получено 0,0475 моль CaCO 3 , что составит:w вых. (CaCO 3 ) = 0,0475 моль * 100 % / 0,05 моль = 95 %
w вых. (CaCO 3 ) = 95 %
II способ.
Принимаем во внимание массу исходного вещества (гидроксида кальция) и уравнение химической реакции:
Ca(OH) 2
Рассчитаем по уравнению реакции, сколько теоретически образуется карбоната кальция.
Из 74 г Ca(OH) 2Это означает, что из данных по условию задачи 3,7 г гидроксида кальция теоретически (из расчётов) можно было бы получить 5 г карбоната кальция, а практически получено лишь 4,75 г продукта реакции. Из этих данных определим выход карбоната кальция (в %) от теоретически возможного:
5 г CaCO 3 составляют 100% – ный выход
4,75 г CaCO 3 составляют х %
x = 4,75 моль * 100 % / 5 г = 95 % ;
w вых. (CaCO 3 ) = 95 %
(CaCO 3 ) = 95 %
Задача 2. При взаимодействии магния массой 36 г с избытком хлора получено 128,25 г хлорида магния. Определить выход продукта реакции в процентах от теоретически возможного.
Дано: Рассмотрим два способа решения этой задачи: с использованием величины количества вещества и массы вещества .I способ.
Из данных по условию задачи значений масс магния и хлорида магния рассчитаем значения количества этих веществ:
v(Mg) = m(Mg) / M(Mg) = 36 г / 24 г/моль = 1,5 моль; v(Mg) = 1,5 моль
v(MgCl 2
v(MgCl 2 ) = 1,35 моль
Составим уравнение химической реакции:
Mg
Воспользуемся уравнением химической реакции. Из этого уравнения следует, что из 1 моль магния можно получить 1 моль хлорида магния, а, значит, из данных 1,5 моль магния можно теоретически получить столько же, то есть 1,5 моль хлорида магния. А практически получено лишь 1,35 моль. Поэтому выход хлорида магния (в %) от теоретически возможного составит:
Из этого уравнения следует, что из 1 моль магния можно получить 1 моль хлорида магния, а, значит, из данных 1,5 моль магния можно теоретически получить столько же, то есть 1,5 моль хлорида магния. А практически получено лишь 1,35 моль. Поэтому выход хлорида магния (в %) от теоретически возможного составит:
х = 1,35 моль * 100%
II способ.
Рассмотрим уравнение химической реакции:
Mg
В первую очередь по уравнению химической реакции определим, сколько граммов хлорида магния можно получить из данных по условию задачи 36 г магния.
Из 24 г Mg 2Отсюда х = 36 г * 95 г / 24 г = 142,5 г; m(MgCl 2 ) = 142,5 г
Это означает, что из данного количества магния можно было бы получить 142,5 г хлорида магния (теоретический выход, составляющий 100%). А получено всего 128,25 г хлорида магния (практический выход).
Рассмотрим теперь, сколько процентов составляет практический выход от теоретически возможного:142,5 г MgCl 2
х = 128,25 г * 100 % / 142,5 г = 90 %, то есть w вых. (MgCl 2 ) = 90%
Ответ: выход хлорида магния составляет 90% от теоретически возможного.
Задача 3. Металлический калий массой 3,9 г поместили в дистиллированную воду объемом 50 мл. В результате реакции получили 53,8 г раствора едкого кали с массовой долей вещества равной 10%. Вычислить выход едкого кали (в процентах) от теоретически возможного.
Дано:2K
На основе этого уравнения химической реакции сделаем расчёты.
Отсюда: x = 3,9 г * 112 г / 78 г = 5,6 г m(KOH) = 5,6 г
Из этой формулы выражаем m в-ва:
m в-ва = m р-ра * w в-ва / 100%
Определим массу едкого кали, находящегося в 53,8 г 10% -ного его раствора:
m(KOH) = m р-ра * w(KOH) / 100% = 53,8 г * 10% / 100% = 5,38 г
m(KOH) = 5,38 г
Наконец, рассчитываем выход едкого кали в процентах от теоретически возможного:
w вых.
w вых. (КОН) = 96%
Ответ: Выход едкого кали составляет 96% от теоретически возможного.
Атомы и молекулы – мельчайшие частицы вещества, поэтому в качестве единицы измерения можно выбрать массу одного из атомов и выражать массы других атомов в соотношении с выбранной. Так что же такое молярная масса, и какова ее размерность?
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.
Рис. 1. Формула числа Авогадро.
Таким образом, молярная масса вещества – это масса одного моля, в котором находится 6,02*10^23 элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
где m – масса вещества, а v – количество вещества.
Рис. 2. Расчет молярной массы.
Как найти молярную массу вещества?
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H 2 SO 4 . Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Получается, что суммарная молекулярная масса равна 98 атомных единиц массы (1*2+32+16*4). Таким образом, мы выясняли, что один моль серной кислоты весит 98 грамм.
Таким образом, мы выясняли, что один моль серной кислоты весит 98 грамм.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.
Рис. 3. Формула единицы атомной массы углерода.
Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре. Известным способом измерения объема пара является определение количество вытесненного воздуха. Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.
Задачи на практический выход.
1 .Вычислите объем аммиака, который можно получить, нагревая 20г хлорида аммония с избытком гидроксида кальция, если объемная доля выхода аммиака составляет 98%.
2NH 4 Cl + Ca(OH) 2 = 2NH 3 +H 2 O; Mr(NH 4 Cl) =53,5
NH 4 Cl +0,5Са(ОH ) 2 = NH 3 +0,5H 2 O
1)Рассчитаем теоретический выход
20/53,5=Х/22,4; Х=8,37л(это теоретический выход)
2) Рассчитаем практический выход
V (практического)=V (теоретического)/выход прдукта*100%
V
(практического)=8,37л*98%/(делим на) 100% = 8. 2л
2л
Ответ: 8,2 л N Нз
2.Из 320г сернистого колчедана, содержащего 45% серы, было получено 405г серной кислоты (расчёт на безводную кислоту). Вычислите массовую долю выхода серной кислоты.
Составим схему производственного получения серной кислоты
320г 45% 405г, ή-?
FeS 2 → S → H 2 SO 4
1)Рассчитаем долю серы в колчедане
2)Рассчитаем теоретический выход серной кислоты
3) Рассчитаем выход продукта в процентах
З.Вычислите массу фосфора необходимую для получения 200 кг фосфорной кислоты, если массовая доля выхода продукта составляет 90%.
Составим схему производственного получения фосфорной кислоты
Х 200кг,ή=90%
P → H 3 PO 4
1)Рассчитаем массу теоретического выхода фосфорной кислоты
m
т =
2) Рассчитаем массу фосфора
Ответ:70,Зкг
4.Юный химик на занятиях кружка решил получить азотную кислоту реакцией обмена между нитратом калия и концентрированной серной кислотой. Вычислить массу азотной кислоты, которую он получил из 20,2г- нитрата калия, если массовая доля выхода кислоты была 0,98
Вычислить массу азотной кислоты, которую он получил из 20,2г- нитрата калия, если массовая доля выхода кислоты была 0,98
5.При нагревании нитрита аммония N Н 4 NO 2 образуются азот и вода. Вычислите объем азота (н. у), который можно получить при разложении 6,4г нитрита аммония, если объемная доля выхода азота составляет 89%.
6.Вычислите объем оксида азота (II), который можно получит при каталитическом окислении в лаборатории 5,6л аммиака, если объемная доля выхода оксида азота (II ) равна 90%.
7.Металлический барий получают восстановлением его оксида металлическим алюминием c образованием оксида алюминия и бария. Вычислите массовую долю выхода бария, если из 4,59 кг оксида бария было получено 3,8 кг бария.
Ответ: 92,5%
8.Определите, какая масса меди потребуется для реакции с избытком концентрированной азотной кислоты для получения 2,1 л (н. у) оксида азота (IV ), если объемная доля выхода оксида азота (IV ) равна 94%.
Ответ: 3,19
9.Какой объем оксида серы (IV
) надо взять для реакции окисления кислородом, чтобы получить оксид серы (V
I) массой 20г. если выход продукт равен 80% (н.у).?
если выход продукт равен 80% (н.у).?
2SO 2 + O 2 = 2SO 3 ; V.(SO 2 ) =22.4 л; Mr(SO 3 ) =80
1) Рассчитаем теоретический выход
m
(теорет) =
2)Рассчитаем массу SO 2
10.При нагревании смеси оксида кальция массой 19,6г с коксом массой 20г получили карбид кальция массой 16г. Определите выход карбида кальция, если массовая доля углерода в коксе составляет 90%.
Ответ: 71.4%
11 .Через раствор массой 50г с массовой долей иодида натрия 15% пропустили избыток хлора, выделился йод массой 5,6г. Определите выход продукта реакции от теоретически возможного в %.
Ответ: 88,2%.
12.Определить выход силиката натрия в % к теоретическому, если при сплавлении 10 кг гидроксида натрия с оксидом кремния (IV ) получено 12,2 кг силиката натрия. Ответ 80%
13.Из 4 кг оксида алюминия удаётся выплавить 2 кг алюминия. Вычислите массовую долю выхода алюминия от теоретически возможного.
Ответ:94,3%
14.Вьичислите объем аммиака, который получается при нагревании смеси хлорида аммония массой 160,5 г и гидроксида кальция, если объемная доля выхода аммиака от теоретически возможного составляет 78%.
Ответ:52.4л
15.Какое количество аммиака потребуется для получения 8 т нитрата аммония, если выход продукта составляет 80% от теоретически возможного?
Ответ:2,IЗт
16.Какое количество уксусного альдегида может быть получено по реакции Кучерова, если в реакцию вступило 83,6 л ацетилена, а практический выход составил 80% от теоретически возможного?
Ответ: 131,З6г
17.Какое количество бензола потребуется для получения 738г нитробензола, если практический выход составляет 92% от теоретического.?
Ответ 508.75г
1 8.При нитрировании 46,8 бензола получено 66,42г нитробензола. Определите практический выход нитробензола в % от теоретически возможного.
19.Сколько граммов бензола можно получить из 22,4 л ацетилена, если практический выход бензола составил 40%.?
20.Какой объем бензола (ρ=0,9г/см 3) потребуется, чтобы получить 30,75г нитробензола, если выход при нитровании составляет 90% от теоретически возможного?
21 .Из 32г этилена было получено 44г спирта. Вычислите практический выход продукта в % от теоретически возможного.
Вычислите практический выход продукта в % от теоретически возможного.
22.Сколько граммов этилового спирта можно получить из 1м 3 природного газа, содержащего 6% этилена, если практический выход составил 80%?
23.Какое количество кислоты и спирта необходимо для получения 29,6г уксуснометилового эфира, если его выход составил 80% от теоретически возможного?
24.При гидролизе 500кг древесины, содержащей 50% целлюлозьг, получается 70кг глюкозы. Вычислите ее практический выход в % от теоретически возможного.
25.Сколько глюкозы получается из 250 кг опилок, содержащих 40% глюкозы. Какое количество спирта можно получить из этого количества глюкозы при 85%-ном практическом выходе?
Ответ:43,43г
26.Сколько граммов нитробензола нужно взять, чтобы восстановлением получить 186г анилина, выход которого составляет 92% от теоретического 27. Вычислите массу сложного эфира, который получили из 460г муравьиной кислоты и 460г этилового спирта. Выход эфира от теоретически возможного составляет 80%.
28.При обработке 1т фосфорита, содержащего 62% фосфата кальция, серной кислотой было получено 910,8кг суперфосфата. Определить выход суперфосфата в % по отношению к теоретическому.
Са 3 (РО 4) 2 + 2Н 2 S 0 4 = Са (Н 2 Р0 4) 2 + 2СаS 0 4
З0.Для получения кальциевой селитры, 1т мела обработали разбавленной азотной кислотой. При этом выход кальциевой селитры составил 85% по отношению к теоретическому. Сколько селитры было получено?
Ответ: 1394кг
31 .Из 56кг азота было синтезировано 48 кг аммиака. Каков выход аммиака в процентах к теоретическому.
Ответ: 70,5%
32. 34 кг аммиака пропустили через раствор серной кислоты. Выход сульфата аммония составил 90% от теоретического. Сколько килограммов сульфата аммония получено?
Ответ:118,8кг
З3.При окислении З4кг аммиака было получено 54кг окиси азота (II ).Вычислить выход окиси азота в % по отношению к теоретическому.
34.В лаборатории аммиак получают взаимодействием хлористого аммония с гашёной известью. Сколько граммов аммиака было получено, если израсходовано 107г хлористого аммония и выход аммиака составил 90% от теоретического?
Сколько граммов аммиака было получено, если израсходовано 107г хлористого аммония и выход аммиака составил 90% от теоретического?
Ответ:30,6г
35.Из 60кг водорода и соответствующего количества азота было синтезировано 272 кг аммиака. Каков выход аммиака в % к теоретически возможному?
36. Из 86,7г натриевой селитры, содержащей 2% примесей, получено 56,7г азотной кислоты, каков выход азотной кислоты в % к теоретически возможному?
Ответ: 90%.
37.При пропускания аммиака через 6Зкг 50% раствора азотной кислоты было получено З8кг аммиачной селитры. Каков выход ее в % к теоретически возможному?
38.Для получения фосфорной кислоты было израсходовано ЗI4кг фосфорита, содержащего 50% фосфата кальция. Выход фосфорной кислоты составил 95%.Сколько кислоты было получено?
Ответ:94,Зкг
39.

40.Фосфор получают в технике по уравнению реакции;
Саз (Р0 4) 2 + 3SiО 2 +5С →ЗСaSi О 3 + 2Р +5СО
Каков выход фосфора в % к теоретическому, если его получилось 12,4 кг из 77 кг фосфорнокислого кальция?
Ответ: 80,5%
41 .Вычислите выход карбида кальция в % к теоретическому, если 15,2кг его
были получены из I4кг окиси кальция.
42. Ацетилен получают взаимодействием.карбида кальция с водой
СаС 2 +2Н 2 0= Са(ОН) 2 +С 2 Н 2
Сколько граммов ацетилена получится, если израсходовано 33,7г карбида кальция, содержащего 5% примесей и выход ацетилена составил 90% к теоретическому?
Ответ: 11,7г
43.При действии соляной кислоты на 50г мела получилось 20г углекислого газа. Каков выход его в % к теоретическому?
Ответ: 90,9%
44.При обжиге 1т известняка, содержащего 10% примесей, выход углекислого газа составил 95%. Сколько килограммов углекислого газа было получен?
Ответ: 376,2 кг.
45. Определить выход силиката натрия в % к теоретическому, если при сплавлении 10кг едкого натра с песком получено 12,2 кг силиката натрия.
Элемента).
Выражайте значение массы из формулы массовой доли вещества: w = m(x)*100%/m, где w – массовая доля вещества, m(x) – масса вещества, m – масса раствора, в котором растворено данное вещество. Чтобы найти массу вещества необходимо: m(x) = w*m/100%.
Из формулы выхода продукта вычисляйте нужную вам массу: выход продукта = mp(x)*100%/m(x), где mp(x) – масса продукта x, полученного в реальном процессе, m(x) – рассчитанная масса вещества x. Выводите: mp(x) = выход продукта* m(x)/100% или m(x) = mp(x)*100%/ выход продукта. При данном в условии задачи выходе продукта эта формула будет необходима. Если выход продукта не дан, то следует считать, что он равен 100%.
Если в условии присутствует уравнение реакции, то решайте задачу по нему. Для этого сначала составьте уравнение реакции, затем вычислите из него количества вещества полученного или затраченного для данной реакции и уже это количество вещества подставьте в нужные формулы. Например, Na2SO4 + BaCl2 = BaSO4 + 2NaCl. Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
Обратите внимание
Единицами измерения массы могут быть миллиграммы, граммы, килограммы.
Источники:
- “Пособие по химии”, Г.П. Хомченко, 2005.
Масса тела – это одна из важнейших его физических характеристик, которая показывает его гравитационные свойства. Зная объем вещества, а также его плотность, можно без труда вычислить и массу тела, в основе которого и лежит это вещество.
Вам понадобится
- Объем вещества V, его плотность p.
Инструкция
Пускай нам дано неоднородное с массой V и массой m. Тогда его можно будет рассчитать по формуле:
p = m/V.
Из этой следует, что для того, чтобы рассчитать массу , можно воспользоваться ее следствием:
m = p*V. Рассмотрим :Пусть нам дан платиновый брусок. Его объем равен 6 кубическим метрам. Найдем его массу.
Задача решается в 2 действия:
1) Согласно таблице плотности различных веществ, плотность платины составляет 21500 кг/куб. метров.
2) Тогда, зная плотность и объем этого вещества, рассчитаем его массу:
6*21500 = 129000 кг, или 129 тонн.
Видео по теме
Воду, как и любую жидкость, не всегда можно взвесить на весах. Но узнать массу воды бывает необходимо как на некоторых производствах, так и в обычных житейских ситуациях, от расчета резервуаров до решения вопроса, какой запас воды вы можете взять с собой в байдарку или резиновую лодку. Для того, чтобы вычислить массу воды или любой жидкости, помещенной в тот или иной объем, прежде всего необходимо знать ее плотность.
Вам понадобится
- Мерная посуда
- Линейка, рулетка или любой другой измерительный прибор
- Сосуд для переливания воды
Инструкция
Если вам нужно вычислить массу воды в небольшом сосуде, это можно сделать с помощью обычных весов. Взвесьте сначала сосуд вместе с . Затем перелейте воду в другую посуду. После этого взвесьте пустой сосуд. Из полного сосуда вычтите массу пустого. Это и будет содержавшейся в сосуде воды. Таким образом можно массу не только жидких, но и сыпучих веществ, если есть возможность их пересыпать в другую посуду. Такой способ иногда еще можно наблюдать в некоторых магазинах, где нет современного оборудования. Продавец сначала взвешивает пустую банку или бутылку, затем заполняет ее сметаной, взвешивает снова, определяет вес сметаны и только после этого рассчитывает ее стоимость.
Для того, чтобы определить массу воды в сосуде, который невозможно взвесить, необходимо знать два параметра – плотность воды (или любой другой жидкости) и объем сосуда. Плотность воды составляет 1 г/мл. Плотность другой жидкости можно найти в специальной таблице, которая обычно бывает в справочниках по химии.
Плотность воды составляет 1 г/мл. Плотность другой жидкости можно найти в специальной таблице, которая обычно бывает в справочниках по химии.
Если нет мерной посуды, в которую можно перелить воду, вычислите объем сосуда, в котором она находится. Объем всегда равен произведению площади основания на высоту, и с сосудами постой формы обычно проблем не возникает. Объем воды в банке будет равен площади круглого основания на высоту, заполненную водой. Умножив плотность? на объем воды V, вы получите массу воды m: m=?*V.
Видео по теме
Обратите внимание
Определить массу можно и зная количество воды и ее молярную массу. Молярная масса воды равна 18, поскольку состоит из молярных масс 2 атомов водорода и 1 атома кислорода. Mh3O = 2MH+MO=2·1+16=18 (г/моль). m=n*M, где m – масса воды, n – количество, M – молярная масса.
Плотность есть отношение массы к занимаемому ей объему – для твердых тел, и отношением молярной массы к молярному объему – для газов. В самом общем виде объем (или молярный объем) будет отношением массы (или молярной массы) к ее плотности. Плотность известна. Что делать? Сперва определить массу, затем вычислить объем, затем внести необходимые поправки.
Плотность известна. Что делать? Сперва определить массу, затем вычислить объем, затем внести необходимые поправки.
Инструкция
Объем газа равен отношению произведения , умноженного на его – к уже известной плотности. Иными , даже зная , необходимо знать молярную массу газа и количество , то есть – сколько у вас есть моль газа. В принципе, зная, сколько моль газа у вас есть, можно вычислить его объем, даже не зная плотности – согласно закону Авогадро, один моль любого газа занимает объем 22,4 л. Если же обязательно вычислять объем через плотность, то вам понадобится узнать массу газа в неизвестном пока объеме.
Объем твердого тела можно определить, даже не зная плотности, просто измерив его, а в случае сложной и очень неправильной формы объем определяется, например, по объему вытесненной твердым телом жидкости. Однако, если необходимо вычислять объем именно через плотность, то объем твердого тела есть отношение массы тела к его плотности, а масса обычно определяется простым взвешиванием. Если же взвесить тело по каким-то причинам (например, оно слишком большое или движется) невозможно, то придется прибегать к довольно сложным косвенным расчетам. К примеру, для движущегося тела масса есть отношение удвоенной кинетической энергии к квадрату его скорости, или отношение силы, приложенной к телу, к его ускорению. Для очень большого покоящегося тела придется прибегать к расчетам по отношению к массе Земли, с использованием гравитационной постоянной и момента вращения. Или же – через вычисление удельной теплоемкости вещества; в любом случае знания только плотности для вычисления объема будет недостаточно.
Если же взвесить тело по каким-то причинам (например, оно слишком большое или движется) невозможно, то придется прибегать к довольно сложным косвенным расчетам. К примеру, для движущегося тела масса есть отношение удвоенной кинетической энергии к квадрату его скорости, или отношение силы, приложенной к телу, к его ускорению. Для очень большого покоящегося тела придется прибегать к расчетам по отношению к массе Земли, с использованием гравитационной постоянной и момента вращения. Или же – через вычисление удельной теплоемкости вещества; в любом случае знания только плотности для вычисления объема будет недостаточно.
Вычислив массу твердого тела, можно вычислить объем – простым делением массы на плотность.
Обратите внимание
1. Указанные выше методы более или менее применимы только в случае однородности вещества, из которого состоит твердое тело
2. Приведенные методы более или менее применимы в сравнительно узком промежутке температур – от минус 25 до плюс 25 градусов Цельсия. При изменении агрегатного состояния вещества плотность может меняться скачкообразно; в этом случае формулы и методы вычислений будут совсем другими.
При изменении агрегатного состояния вещества плотность может меняться скачкообразно; в этом случае формулы и методы вычислений будут совсем другими.
Масса как физическая величина – это параметр, характеризующий силу воздействия тела на гравитацию. Для расчета массы тела в физике требуется знать две его величины: плотность материала тела и его объем.
Инструкция
Пусть задано некое тело объемом V его p. Тогда его подсчитывают так:
m = p*V. Для наглядности приводится :
Пусть дан алюминиевый объемом 5 куб. метров. Плотность алюминия составляет 2700 кг./куб. метр. В таком случае масса бруска составит:
m = 2700/5 = 540 кг.
Обратите внимание
Понятие массы часто путают с другой, не менее редко встречающейся, физической величиной – весом. Вес измеряется в н/м³ и характеризует силу, которая воздействует на точку опоры. Масса же, по своей природе, не имеет какой бы то ни было точки опоры, и воздействует, как было отмечено, лишь на гравитацию Земли.
Масса какого-либо тела является его важнейшей физической характеристикой. В современной физической науке есть разграничение понятия “масса”: гравитационная масса (как степень воздействия тела на земную гравитацию) и инертная масса (какое усилие потребуется для того, чтобы вывести тело из состояния инерции). В любом случае найти массу очень легко, если известны плотность и объем тела.
Инструкция
Для наглядности можно привести . Требуется найти массу бетонной плиты, чей объем составляет 15 м³.
Решение: массы бетонной плиты требуется знать лишь его плотность. Для того, чтобы узнать эту информацию, нужно воспользоваться таблицей плотностей различных веществ.
Согласно этой таблице плотность бетона составляет 2300 кг/м³. Тогда для того, чтобы найти массу бетонной плиты, потребуется совершить простое алгебраическое действие: m = 15*2300 = 34500 кг, или 34.5 тонн. Ответ: масса бетонной плиты составляет 34.5 тонн
Измерение массы традиционным способом происходит при помощи одного из древнейших приборов человечества – с помощью весов. Это происходит благодаря сравнению массы тела с помощью эталонной массы груза – гирь.
Это происходит благодаря сравнению массы тела с помощью эталонной массы груза – гирь.
Обратите внимание
Проводя расчет по указанной выше формуле, необходимо осознавать, что таким образом узнается масса покоя данного тела. Интересен факт того, что многие элементарные частицы обладают колеблющейся массой, которая зависит от скорости их движения. Если элементарная частица движется со скоростью тела, то эта частица является безмассовой (например, фотон). Если же скорость движения частицы ниже скорости света, то такая частица называется массивной.
Полезный совет
При измерении массы никогда нельзя забывать, в какой системе будет дан конечный результат. Имеется ввиду, что в системе СИ масса измеряется в килограммах, в то время как в системе СГС масса измеряется в граммах. Также масса измеряется в тоннах, центнерах, каратах, фунтах, унциях, пудах, а также во многих других единицах в зависимости от страны и культуры. В нашей стране, к примеру, массу издревле измеряли в пудах, берковцах, золотниках.
Источники:
- масса бетонной плиты
Все вещества имеют определенную плотность. В зависимости от занимаемого объема и заданной массы, вычисляется плотность. Она находится, исходя из экспериментальных данных и числовых преобразований. Кроме того, плотность зависит от множества различных факторов, в связи с которыми изменяется ее постоянное значение.
Инструкция
Представьте себе, что дан некоторый сосуд, до краев заполненный водой. В задаче необходимо найти плотность воды, при этом не зная ни массы, ни объема. Для того, чтобы вычислить плотность, следует найти оба параметра экспериментально. Начните с определения массы.
Возьмите сосуд и поставьте его на весы. Затем выльете из него воду, после чего снова поставьте сосуд на те же весы. Сравните результаты измерений и получите формулу для нахождения массы воды:
mоб.- mс.=mв., где mоб. – масса сосуда с водой (общая масса), mс – масса сосуда без воды.
Второе, что потребуется найти – воды. 3. При изменении меняется и плотность. Помимо этого, к факторам, влияющим на плотность относят давление, минерализация и соленость воды. Наиболее ярко выражено влияние на плотность температуры.
3. При изменении меняется и плотность. Помимо этого, к факторам, влияющим на плотность относят давление, минерализация и соленость воды. Наиболее ярко выражено влияние на плотность температуры.
Запомните, что плотность под действием температуры изменяется по параболическому закону. Значение t=4 °C является критической точкой данной параболы, на которой плотность воды достигает наибольшего значения. Любая температура, находящаяся выше или ниже этого значения, ведет к снижению плотности. При температуре 0 °C плотность воды значительно понижается.
Минерализация и давление действуют на плотность воды одинаково. При их повышении плотность растет. Также заметное плотность воды прямо пропорциональна концентрации в ней соли.
Существуют и другие факторы, от которых зависит плотность воды, но их влияние значительно слабее, чем у указанных выше.
Видео по теме
Масса вещества – это та мера, с помощью которой воздействует тело на свою опору. Она измеряется в килограммах (кг), граммах (г), тоннах (т). Найти массу вещества, если известен его объем, очень легко.
Найти массу вещества, если известен его объем, очень легко.
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
При обучении учащихся решению расчётных задач по химии учителя сталкиваются с рядом проблем
- решая задачу, учащиеся не понимают сущности задач и хода их решения;
- не анализируют содержание задачи;
- не определяют последовательность действий;
- неправильно используют химический язык, математические действия и обозначение физических величин и др.;
Преодоление этих недостатков является одной из главных целей, который ставит перед собой учитель, приступая к обучению решению расчетных задач.
Задача учителя состоит в том, чтобы научить
учащихся анализировать условия задач, через
составление логической схемы решения конкретной
задачи. Составление логической схемы задачи
предотвращает многие ошибки, которые допускают
учащиеся.
Составление логической схемы задачи
предотвращает многие ошибки, которые допускают
учащиеся.
Цели урока:
- формирование умения анализировать условие задачи;
- формирование умения определять тип расчетной задачи, порядок действий при ее решении;
- развитие познавательных, интеллектуальных и творческих способностей.
Задачи урока:
- овладеть способами решения химических задач с использованием понятия “массовая доля выхода продукта реакции от теоретического”;
- отработать навыки решения расчетных задач;
- способствовать усвоению материала, имеющего отношение к производственным процессам;
- стимулировать углубленное изучение теоретических вопросов, интерес к решению творческих задач.
Ход урока
Определяем причину и сущность ситуации, которые описываются в задачах “на выход продукта от теоретического”.
В реальных химических реакциях масса продукта
всегда оказывается меньше расчетной. Почему?
Почему?
- Многие химические реакции обратимы и не доходят до конца.
- При взаимодействии органических веществ часто образуются побочные продукты.
- При гетерогенных реакциях вещества плохо перемешиваются, и часть веществ просто не вступает в реакции.
- Часть газообразных веществ может улетучиться.
- При получении осадков часть вещества может остаться в растворе.
Вывод:
- масса теоретическая всегда больше практической;
- объём теоретический всегда больше объёма практического.
Теоретический выход составляет 100%, практический выход всегда меньше 100%.
Количество продукта, рассчитанное по уравнению реакции, – теоретический выход, соответствует 100%.
Доля выхода продукта реакции ( – “этта”) – это отношение массы полученного вещества к массе, которая должна была бы получиться в соответствии с расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного вещества и продукта
реакции . Определить выход продукта.
Даны массы исходного вещества и продукта
реакции . Определить выход продукта.
2. Даны массы исходного вещества и выход продукта реакции. Определить массу продукта.
3. Даны массы продукта и выход продукта. Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3 г хлора, было получено 24,3 г хлорида железа (III). Рассчитайте выход продукта реакции.
2. Над 16 г серы пропустили водород при нагревании. Определите объем (н.у.) полученного сероводорода, если выход продукта реакции составляет 85% от теоретически возможного.
3. Какой объём оксида углерода (II) был взят для восстановления оксида железа (III), если получено 11,2г железа с выходом 80% от теоретически возможного.
Анализ задач.
Каждая задача складывается из совокупности
данных (известные вещества) – условия задачи
(“выход” и т.п.) – и вопроса (вещества, параметры
которых требуется найти). Кроме этого, в ней есть
система зависимостей, которые связывают искомое
с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?
2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или теоретические, названы в условии задачи?
5. Какие из данных можно непосредственно использовать для расчётов по уравнениям реакций, а какие необходимо преобразовать, используя массовую долю выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически возможного.
1. Запишите уравнение химической реакции и расставьте коэффициенты.
2. Под формулами веществ напишите количество вещества согласно коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся
практическую массу к теоретической и умножив на
100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен выход продукта.
1. Запишите “дано” и “найти”, запишите уравнение, расставьте коэффициенты.
2. Найдите теоретическое количество вещества для исходных веществ. n =
3. Найдите теоретическое количество вещества продукта реакции, согласно коэффициентам.
4. Вычислите теоретические массу или объем продукта реакции.
m = M * n или V = V m * n
5. Вычислите практические массу или объем продукта реакции (умножьте массу теоретическую или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны масса продукта реакции и выход продукта.
1. По известному практическому объёму или массе, найдите теоретический объём или массу (используя долю выхода продукта).
2. Найдите теоретическое количество вещества для продукта.
3. Найдите теоретическое количество вещества для исходного вещества, согласно коэффициентам.
4. С помощью теоретического количества вещества
найдите массу или объем исходных веществ в
реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112 л (н.у.) кислорода и получили 760 г оксида серы (VI). Чему равен выход продукта в процентах от теоретически возможного?
2. При взаимодействии азота и водорода получили 95 г аммиака NH 3 с выходом 35%. Какие объёмы азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком углерода. Определите массу образовавшегося металла, если выход продукта реакции равен 65%.
Задачи. Выход продукта реакции
Здравствуйте! Друзья!
Сегодня мы познакомимся и научимся решать ещё один тип расчетных задач, связанных с вычислениями по уравнению химической реакции. Это расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического».
На уроке нам понадобятся:
1. Периодическая система химических элементов Д. И. Менделеева.
2. Калькулятор.
3. И, как всегда, огромное желание научиться чему-то новому!
Желаю вам успехов!
Задачи на вычисление выхода продукта реакции от теоретически возможного
Признак
В условии задачи встречается слово
«выход». Теоретический выход продукта всегда выше практического.
Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Массовая доля выхода продукта обозначается буквой h (эта), измеряется в процентах или долях, объёмная доля выхода продукта может обозначаться в различных источниках h (эта)
Также для расчётов может использоваться отношения количеств веществ:
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
1. | Дано: m(Mg) = 1,2 г mпрактическая (MgSO4) = 5,5 г _____________________ Найти: =? |
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
|
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
| M(Mg) = 24 г/моль M(MgSO4) = 24 +32 + 4 · 16 = 120 г/моль |
4. Находим количество вещества реагента по формулам
|
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M
mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
6. |
(MgSO4) = (5,5г · 100%)/6г=91,7%
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим выходом. |
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
1. Записываем краткое условие задачи | Дано: m(CaO) = 16,8 г =80% или 0,8 ____________________ Найти: mпракт (CaC2) = ?
|
2. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
|
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
| M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64 г/моль |
4. Находим количество вещества реагента по формулам
|
ν(CaO) = 16,8 (г) / 56 (г/моль) = 0,3 моль |
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции | |
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
mпрактич (CaC2) = 0,8 · 19,2 г = 15,36 г
Ответ: mпрактич (CaC2) = 15,36 г
|
Третий
тип задач – Известны масса (объём) практически
полученного вещества и выход этого продукта реакции. Необходимо вычислить массу
(объём) исходного вещества.
Необходимо вычислить массу
(объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
1. Записываем краткое условие задачи | Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л φ = 85% или 0,85 _____________________ Найти: m(Na2CO3) =?
|
2. Находим по ПСХЭ молярные массы веществ, если это необходимо
| M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы:
|
Vтеоретич(CO2) = Vпрактич(CO2) / 0,85 = = 28,56 л / 0,85 = 33,6 л
ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль
|
4. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
|
|
5. Находим количество вещества реагента по УХР
| По УХР: , следовательно ν(Na2CO3) = ν(CO2) = 1,5 моль
|
5. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm
|
m = ν · M
m (Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
Секретная шпаргалка по химии. 3.5 Выход реакции | Репетитор Богунова В.Г.
Утром меня разбудил телефонный звонок. Звонила моя ученица Лена Д. Со слезами в голосе она начала говорить, что ЕГЭ по химии точно завалит, потому как даже “такая простая и понятная 35 задача” может включать фишку на выход реакции, не считая кучи других “садистских приколов”. Лена скинула мне ВК условие злополучной 35-й задачи: “При гидратации 31,50 г этиленового углеводорода образовалось 23,76 г органического вещества. Выход продукта составил 60 %. Определите молекулярную формулу углеводорода и установите его структуру, если известно, что при его жёстком окислении перманганатом калия образуются кетон и кислота. Напишите уравнение реакции углеводорода с водой, в уравнении изобразите структурные формулы органических веществ”
Звонила моя ученица Лена Д. Со слезами в голосе она начала говорить, что ЕГЭ по химии точно завалит, потому как даже “такая простая и понятная 35 задача” может включать фишку на выход реакции, не считая кучи других “садистских приколов”. Лена скинула мне ВК условие злополучной 35-й задачи: “При гидратации 31,50 г этиленового углеводорода образовалось 23,76 г органического вещества. Выход продукта составил 60 %. Определите молекулярную формулу углеводорода и установите его структуру, если известно, что при его жёстком окислении перманганатом калия образуются кетон и кислота. Напишите уравнение реакции углеводорода с водой, в уравнении изобразите структурные формулы органических веществ”
В своей практике я, действительно, столкнулась с парадоксом, когда очень толковые ребята, хорошо знающие химию, жутко боятся элементарных расчетов на степень превращения вещества и выход продукта реакции. Их начинает терзать сомнение: “А справлюсь ли я на ЕГЭ?!” Такие переживания могут зайти далеко и перерасти в никому не нужную депрессию. Думаю, вы тоже сталкивались с аналогичными проблемами. Что делать? Я предлагаю все трудности преодолевать вместе. Вначале мы повторим тему “Выход продукта реакции”, поучимся решать задачи, обязательно разберем 35-ю задачу, предложенную моей ученицей, а в конце статьи я расскажу вам секретное упражнение, которое нужно выполнять всякий раз, когда вы начинаете сомневаться в собственных силах и способностях. Упражнение так и называется “У меня все получится!”. Итак, поехали!
Думаю, вы тоже сталкивались с аналогичными проблемами. Что делать? Я предлагаю все трудности преодолевать вместе. Вначале мы повторим тему “Выход продукта реакции”, поучимся решать задачи, обязательно разберем 35-ю задачу, предложенную моей ученицей, а в конце статьи я расскажу вам секретное упражнение, которое нужно выполнять всякий раз, когда вы начинаете сомневаться в собственных силах и способностях. Упражнение так и называется “У меня все получится!”. Итак, поехали!
Выход продукта реакции (выход реакции) – это коэффициент, определяющий полноту протекания химической реакции. Он численно равен отношению количества (массы, объема) реально полученного продукта к его количеству (массе, объему), которое может быть получено по стехиометрическим расчетам (по уравнению реакции).
Решим задачи на выход продукта реакции, используя Четыре Заповеди. Каждое действие обводится зеленым овалом. Читайте внимательно и обязательно записывайте решение каждой задачи. После проработки статьи попробуйте самостоятельно решить все разобранные задачи.
После проработки статьи попробуйте самостоятельно решить все разобранные задачи.
Задача 1
При действии алюминия на оксид цинка массой 32,4 г получили 24 г цинка. Определите выход продукта реакции
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”
2) Вторая Заповедь. Написать уравнение реакции
Повторим теорию химии. Способ восстановления металлов алюминием – алюмотермия. Следует помнить: металлы, стоящие в ряду активности левее (более активные) восстанавливают металлы, стоящие правее, из расплавов оксидов или растворов солей
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Cr→Zn→Fe→Cd→Co→Ni→Sn→Pb→(H)→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
3. Третья Заповедь. Сделать предварительные расчеты по данным условия задачи и по уравнению реакции
В условии задачи представлены данные по одному из реагентов (оксиду цинка) и по одному из реально полученных продуктов (цинку). Составляем два досье, в каждом – масса, молярная масса, количество вещества (моль). Для цинка (продукт), масса и количество вещества – практические, т.к. продукт был получен реально.
Для цинка (продукт), масса и количество вещества – практические, т.к. продукт был получен реально.
Теоретическое значение продукта рассчитываем по уравнению реакции. Точка расчета – количество вещества реагента (оксида цинка). Расчеты выполняем на основании закона кратных отношений по схеме: точку расчета делим на коэффициент при этом веществе, умножаем на коэффициент при искомом веществе и получаем результат. Выписывать отдельно пропорцию для расчетов не обязательно. Это – Легкие Расчеты по уравнениям реакций, которые не противоречат закону кратных отношений, но значительно упрощают решение задач по химии.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Формулизируем вопрос задачи “Определите выход продукта реакции”, – записываем соответствующую формулу и анализируем ее компоненты.
Подробно разберем решение обратной задачи: по известному выходу реакции определим неизвестное значение реагента или продукта.
Задача 2
Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции составляет 92% от теоретически возможного.
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”.
2) Вторая Заповедь. Написать уравнение реакции.
Небольшой экскурс в теорию химии. Многие нерастворимые в воде гидроксиды разлагаются при нагревании. Продукты разложения – оксиды соответствующих металлов и вода.
3. Третья Заповедь. Сделать предварительные расчеты по данным условия задачи и по уравнению реакции
Составляем досье на реагент (гидроксид алюминия) – определяем его молярную массу и количество вещества (моль). По уравнению реакции рассчитываем теоретическое количество продукта (оксида алюминия). Расчеты выполняем на основании закона кратных отношений по схеме: точку расчета делим на коэффициент при этом веществе, умножаем на коэффициент при искомом веществе и получаем результат.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Формулизируем вопрос задачи “Определите массу оксида алюминия”, т. е. записываем формулу расчета массы, которая для нас, как для химиков, должна быть представлена произведением количества вещества на молярную массу. Анализируем компоненты формулы: молярную массу определяем по таблице Менделеева, количество вещества (практическое) рассчитываем по формуле выхода реакции.
е. записываем формулу расчета массы, которая для нас, как для химиков, должна быть представлена произведением количества вещества на молярную массу. Анализируем компоненты формулы: молярную массу определяем по таблице Менделеева, количество вещества (практическое) рассчитываем по формуле выхода реакции.
Решим на закрепление еще несколько обратных задач с выходом реакции.
Задача 3
Карбонат натрия взаимодействует с соляной кислотой. Вычислите массу карбоната натрия для получения оксида углерода (IV) массой 56,1 г. Практический выход продукта 85%.
Задача 4
При действии оксида углерода (II) на оксид железа (III) получено железо массой 11,2 г. Найдите массу использованного оксида железа (III), если выход реакции составляет 80%.
Задача 5
При взаимодействии железа с хлором получено 10 г соли, что составляет 85% от теоретически возможного. Сколько граммов железа было взято для реакции с хлором?
В этой статье я не буду разбирать пошагово 35-ю задачу ЕГЭ, предложенную моей ученицей. На фото – подробное решение. Тот, кто уже решал аналогичные задачи, поймет без дополнительных объяснений. Для всех остальных – обязательно будем наслаждаться анализом этой задачи (и не только этой) в следующей статье. Обещаю ДРАЙВ!
На фото – подробное решение. Тот, кто уже решал аналогичные задачи, поймет без дополнительных объяснений. Для всех остальных – обязательно будем наслаждаться анализом этой задачи (и не только этой) в следующей статье. Обещаю ДРАЙВ!
Задача 35 ЕГЭ (восстановлена по памяти моей ученицы)
При гидратации 31,50 г этиленового углеводорода образовалось 23,76 г органического вещества. Выход продукта составил 60 %. Определите молекулярную формулу углеводорода и установите его структуру, если известно, что при его жёстком окислении перманганатом калия образуются кетон и кислота. Напишите уравнение реакции углеводорода с водой, в уравнении изобразите структурные формулы органических веществ
Вернемся к проблеме, которую я затронула в начале статьи. Что делать, если резко упала самооценка, ты чувствуешь себя полным идиотом и боишься не справиться с трудными заданиями ЕГЭ? Все очень просто – выполни секретное упражнение “У меня все получится!” Я подсмотрела его на просторах Интернета (автора не знаю) и модифицировала это упражнение под себя и своих учеников:
1.Сядь в спокойной обстановке, закрой глаза, успокой дыхание. Сосредоточься на своей цели. Представь, что у тебя уже все получилось и ты достиг всего, к чему стремился.
2. Сожми ладони вместе перед собой и прижми их к груди. Обратись к Высшему Разуму (как ты его себе представляешь – Бог, Вселенная, Космос, Мир, Природа) с просьбой реализовать твою цель и мечты.
3. Побудь в таком состоянии несколько минут, затем встань, расправь плечи и стряхни с себя все плохое.
В конце статьи хочу привести цитату из стихотворения американского поэта Эдгара Геста, который был очень популярен 100 лет назад:
“И ты не верь тому, кто скажет: “Это слишком сложно!”
Не слушай тех, кто будет утверждать, что это невозможно,
Не бойся трудностей – скорей берись за дело,
Гони сомненья прочь – к мечте иди решительно и смело!”
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.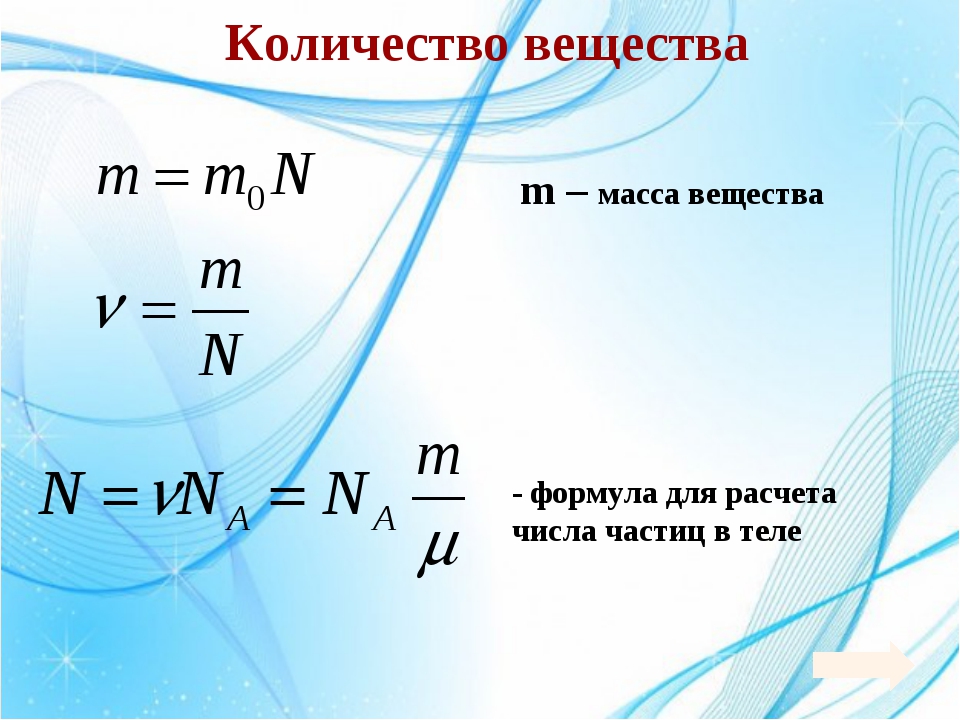 ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Решение задач на расчёт массы и массовой доли вещества
Важно знать! Как научиться решать задачи по химии.
Задача 1-10. Сколько граммов кислорода можно получить при нагревании 25 г перманганата калия, если реакция разложения протекает с выходом 86% ?
Решение. Выход реакции η определяется как отношение практически полученной массы продукта к теоретической массе, рассчитанной по уравнению реакции:
η = (mпракт / mтеор) • 100%
Выход дан в условии задачи, а теоретическую массу кислорода рассчитаем по уравнению реакции:
2KMnO4 = К2MnO4 + MnO2 + O2↑.
v(KMnO4) = m(KMnO4) /M (KMnO4) = 25 / 158 = 0,16 моль.
В уравнении реакции разложения коэффициент перед O2 в 2 раза меньше, чем коэффициент перед KMnO4, поэтому количество вещества кислорода также в 2 раза меньше:
v(O2) = v(KMnO4) / 2 = 0,08 моль.
Теоретически возможная масса кислорода
mтеор(O2) = v(O2) • М(O2) = 0,08 • 32 = 2,56 (г).
Согласно уравнению реакции
из 2 моль (2 • 158 = 316 г) KMnO4 образуется 1 моль (32 г) O2;
из 25 г KMnO4 ->>- x г O2.
x = 25 • (32 / 316) = 2,56 (г)
Практическую массу кислорода находим, умножая теоретическую на выход:
mпракт(O2) = mтеор(O2) • η = 2,56 • 0,86 = 2,2 (г)
Ответ: 2,2 г O2.
Задача 1-11. Рассчитайте массовые доли веществ в смеси этилового спирта и воды, в которой число атомов кислорода в 2,5 раза больше числа атомов углерода.
Решение. Стандартный способ решения расчетных задач на установление состава смеси состоит в том, чтобы обозначить количества
веществ через неизвестные переменные и составить для них систему уравнений.
Пусть моль, моль. По условию общее число атомов кислорода (из этилового спирта и воды) в 2,5 раза больше числа атомов углерода (из этилового спирта):
Теперь надо выразить количества атомов через количества молекул, т. е. через x и y. В молекуле содержится один атом , поэтому в х моль содержится столько же, т. е. x моль ; в y моль содержится y моль : Углерод содержится только в этиловом спирте: в молекуле содержится два атома , поэтому в x моль содержится в два раза больше, т. е. 2x моль : . Подставим эти количества атомов в условие задачи:
,
откуда .
Число молекул воды в смеси в 4 раза больше числа молекул спирта.
Массы веществ можно выразить черед количества вещества и учесть соотношение между x и y:
;
;
.
При расчете массовых долей переменная x сокращается, и мы еще раз убеждаемся, что массовая доля вещества не зависит от общего количества смеси:
;
.
Ответ:
[Сборник задач и упражнений по химии: Школьный курс / В.В. Еремин, Н.Е. Кузьменко]
Массовая доля. Расчеты по химическим формулам. Задачи по химии. Решение задач на растворы (массовая доля).
Видео ютуб канала “День знаний”
Поделитесь с друзьями:
Решение: | ||||||
m[Ca(OH)2] = 3,7 г wвых.(CaCO3) – ? | Известковая вода – это водный раствор гидроксида кальция Ca(OH)2. При пропускании через нее углекислого газа CO2 выпадает осадок карбоната кальция с диоксидом углерода (качественная реакция на углекислый газ). Эту задачу можно решить либо с использованием величины количества вещества, либо через массы указанных веществ. | + | CO2 | -> | CaCO3 | + | H2O |
1 моль | 1 моль | 1 моль | 1 моль | |||
M=74 г/моль | M=100 г/моль | |||||
m=74 г | m=100 г | + | CO2 | -> | CaCO3 | + | H2O |
1 моль | 1 моль | 1 моль | 1 моль | |||
M=74 г/моль | M=100 г/моль | |||||
m=74 г | m=100 г | образуется | 100 г CaCO3 (из уравнения реакции) | |||
Из 3,7 г Ca(OH)2 | образуется | х г CaCO3 (из условия задачи) | Решение: | |||
m(Mg) = 36 г wвых.(MgCl2) – ? | Указанная масса (m = 128,25 г) продукта реакции MgCl2 – это есть практически полученная масса вещества. Из 36 г магния теоретически можно получить больше хлорида магния, чем его получено. В задачах такого типа и требуется рассчитать, какую долю (в %) составляет практически полученная масса продукта реакции от той массы, которую можно было бы получить теоретически, т.е. из расчётов по уравнению реакции. Эту долю, выраженную в процентах, и называют выходом продукта от теоретически возможного. | + | Cl2 | -> | MgCl2 | |
1 моль> | 1 моль | 1 моль | ||||
M=24 г/моль | M=95 г/моль | |||||
m=24 г | m=95 г | соответствует | 100% – ному выходу | |||
1,35 моль MgCl2 | соответствует | х % | + | Cl2 | -> | MgCl2 |
1 моль> | 1 моль | 1 моль | ||||
M=24 г/моль | M=95 г/моль | |||||
m=24 г | m=95 г | образуется | 95 г MgCl2 (из уравнения реакции) | |||
Из 36 г Mg | образуется | х г MgCl2 (из условия задачи) | соответствует | 100% – ному выходу | ||
128,25 г MgCl2 | соответствует | х % | Решение: | |||
m(К) = 3,9 г wвых.(KOH) – ? | Металлический калий реагирует с водой подобно другим щелочным металлам с образованием гидроксида калия (едкого кали) и выделением водорода. Поскольку образующийся водород выделяется из реакционной смеси в виде газа, то фактически в резульате реакции образуется водный раствор гидроксида калия (едкого кали). | + | 2H2O | -> | 2KOH | + | H2 |
2 моль | 2 моль | 2 моль | 1 моль | |||
M=39 г/моль | M=56 г/моль | |||||
m=78 г | m=112 г | образуется | 112 г КОН (из уравнения реакции) | |||
Из 3,9 г К | образуется | х г КОН (из условия задачи) |
Ноябрьская химическая образовательная программа: О программе
Образовательная программа была направлена на формирование у школьников представлений о современной методологии и технике лабораторного химического синтеза и анализа.
В рамках программы были освещены аппаратные возможности и инструменты современных синтетических лабораторий. Учащиеся познакомились с теорией механохимических, фотохимических, электрохимических и микроволновых методов синтеза органических и неорганических соединений. Особое внимание было уделено свойствам (в т.ч. органолептическим) синтезируемых веществ и их связи со структурой соединений, а также сфере их применения.
В программу вошли научные и научно-популярные лекции профессора кафедры органической химии Института химии СПбГУ, доктора химических наук Карцовой Анны Алексеевна «Удивительный углерод» и «Аллотропные модификации углерода» и лекция «Алмазоподобные углеводороды: путь длиною в век» доцента Самарского государственного технического университета, доктора химических наук Яшкина Сергея Николаевича, семинары, олимпиадные тренинги, отборочный этап городской олимпиады СПбГУ по химии (1-й уровень) и научно-практическая конференция по итогам выполнения исследовательских проектов.
Лекции ведущих преподавателей
Яшкин Сергей Николаевич «Алмазоподобные углеводороды: путь длиною в век»: Одним из основных и интереснейших представителей алмазоподобных углеводородов является адамантан (буквальный перевод этого слова «алмазоподобный») – уникальная каркасная органическая молекула, обладающая кристаллической решеткой алмаза. В лекции пойдет речь об обнаружении адамантана в нефти и различных попытках синтеза этого соединения, его строении и свойствах, о диамандоидах и применении их в электронике, о наноалмазах и алмазоподобных покрытиях. На основе адамантана создаются оптические стекла, лекарственные препараты. Рассматриваются пути молекулярного дизайна в фармакологии адамантана, а также комплексы типа «гость-хозяин» с его участием.
Адамантильный фрагмент, обладая высокой липофильностью, может выполнить роль «пули», свободно проникающей сквозь биологические мембраны. Адамантан является важнейшим синтоном для получения многих органических соединений для нефтехимии, полимерной химии.
Олимпиадные тренинги
9 класс
Общая химия
Термохимия
10 класс
Органическая химия 1
Органическая химия 2
Общая и неорганическая химия
Неорганическая химия
11 класс
Общая и органическая химия
Органическая химия
Физическая химия
Олимпиада (районный этап ВсОШ)
В ходе программы школьники приняли участие в исследовательских проектах:
1. Синтез и изучение свойств азокрасителей
2. Хроматографический профиль антиоксидантов растений субтропического культур
3. Кристаллизация комплексных соединений из многокомпонентных растворов электролитов
4. Пара жемчужин из богатого мира наночастиц: магнитная жидкость и коллоидное золото
5. Определение содержания тяжелых металлов в почвах различных регионов России
6. Простые синтезы для аналитической электрохимии: сенсорные покрытия на основе галогенидов серебра
7. Применение современных ионно-обменных материалов для разделения ионов редкоземельных элементов
8. Синтез люминесцентных металл-органических каркасных структур лантаноидов для создания флуоресцентных красок
9. Влияние растворителя на синтез и свойства металл-органических структур
10. Ядерный магнитный резонанс в земном поле
11. Разработка и анализ перспектив нестандартных путей использования супергидрофобных покрытий
Описание проектов
1. Синтез и изучение свойств азокрасителей
Руководитель проекта: Коронатов А.Н.
Аннотация: Проект направлен на формирование у школьников представлений о взаимосвязи свойств органических веществ с их строением на примере некоторых азосоединений. Ароматические азосоединения были открыты в середине XIX века и получили разнообразное промышленное и лабораторно-практическое применение. В промышленности главной областью применения ароматических азосоединений является использование их в качестве красителей, которыми окрашивают ткани самого различного вида, кожу, мех, дерево, бумагу, различные виды пластмасс, резину, пищевые продукты, лекарственные средства и т.д. Также азокрасители получили широкое применение в качества кислотно-основных индикаторов. Помимо этого, некоторые азосоединения применяются в органическом синтезе в качестве исходных веществ для получения ряда гетероциклических структур.
В теоретической части проекта рассматриваются методы синтеза и свойства азосоединений и связанных с ними классов органических веществ — аминов, солей диазония. Учащиеся познакомятся с теорией цветности, электронными эффектами заместителей, основами ультрафиолетовой спектроскопии и спектроскопии ядерного магнитного резонанса, овладеют основами органического синтеза, а также основными методами очистки и идентификации органических веществ. Ключевыми практическими задачами являются получение ряда азосоединений и изучение их спектральных и кислотно-основных свойств. Полученные данные позволяют выявить на практике основные закономерности в изменении свойств соединений в зависимости от их строения. В завершение проекта с помощью синтезированных азосоединений будет проведена окраска образцов одежды.
Главные результаты
– Синтез азосоединений и исследование кислотно-основных свойств,
– синтез триазена,
– синтез изоксазолона,
– выяснение механизма в реакции получения изоксазолона,
– подтверждение структуры с использованием спектров поглощения поглощения и протонно-магнитного резонанса.
Презентация проекта
Методические материалы
2. Хроматографический профиль антиоксидантов растений субтропического культур
Руководитель проекта: Бессонова Е.А.
Волонтер проекта: Кравченко А.В.
Аннотация: Хотя кислород необходим для жизни человека, он также может и повредить клетки, когда в определенных химических процессах образуются свободные радикалы кислорода. Эти радикалы способствуют старению и участвуют в возникновении многих заболеваний, включая атеросклероз и рак. Многочисленные вещества, называемые антиоксидантами, встречающиеся в природе и в организме, функционируют в качестве защитных агентов против свободных радикалов кислорода. Известны фармакологические препараты, являющиеся синтетическими аналогами природных антиоксидантов, однако их перечень весьма ограничен. В связи с проблемами безопасности применения синтетических антиоксидантов, актуальным является поиск их природных источников.
Известно, что чайные и цитрусовые культуры, обладают широким спектром биологической активности. В работе в качестве объектов исследования будут выступать растения субтропического происхождения (чай и сорта цитрусовых культур), произрастающие в Краснодарском крае, плоды и листья которых имеют в питании человека большое профилактическое, лечебное и диетическое значение. В них содержатся такие биологически активные компоненты, как полифенолы, аминокислоты, витамины, сахара и органические кислоты, которые являются хорошо известными маркерами спелости, вкуса, запаха и качества продуктов растительного происхождения. Определение этих веществ в различных сортах хурмы, чая, цитрусовых позволяет предсказать и обосновать антиоксидантную и антибактериальную активность данных плодов, а также их листьев, что может быть использовано при селекционировании, разработке природных лекарственных препаратов, выборе наиболее перспективных сортов. Эта задача может быть решена с использованием современных физико-химических методов анализа смесей веществ: жидкостной хроматографии и капиллярного электрофореза, позволяющих одновременно определить несколько компонентов различной природы в одной пробе и получить характеристические профили образцов.
В ходе проекта участники изучат теоретические и практические основы хроматографии и капиллярного электрофореза, проведут сравнительный анализ результатов, полученных этими методами. Особое внимание в проекте будет уделено разработке способа подготовки образца к анализу, включающую очистку и концентрирование определяемых веществ. Участники проекта познакомятся с актуальными методами хемометрической обработки многомерных данных, которые позволят связать качество исследуемых объектов и их полезные свойства с содержанием конкретных компонентов и, тем самым, оптимизировать технологию его производства и сделать выбор наиболее перспективных сортов.
Главные результаты
В результате проведенных исследований предложен экспрессный вариант определения кофеина и катехинов, и аминокислот в чае и мандаринах методом ВЭТСХ с видеоденситометрическим детектированием.
Изучена МГК-модель по профилям полифенолов и аминокислот селекционных и ферментированных сортов чая. Выявлены доминирующие аналиты (аминокилослоты – серин, глутаиноквая кислота, аспарагиновая кислота и катехины – эпигаллокатехин галлат, эпикатехин галлат и галлокатехин), определяющие различие между сортами чая.
Презентация проекта
Методические материалы
3. Кристаллизация комплексных соединений из многокомпонентных растворов электролитов
Руководитель проекта: Богачев Н.А.
Волонтер проекта: Толмачев М.В.
Аннотация: Настоящая работа является продолжением проектов двух прошлых смен. Проект находится на стыке двух наук — физической и неорганической химии — и направлен на экспериментальный поиск закономерностей, управляющих формированием сольватов определенного состава и структуры в многокомпонентных растворах, содержащих органические растворители и соли элементов-комплексообразователей. В рамках работы по проекту участникам будет предложено совместить исследования первых двух лет, и, опираясь на полученные на прошлых сменах результатах, исследовать новые объекты для подтверждения ранее обнаруженных закономерностей в связях свойств компонентов многокомпонентных растворов и строением кристаллизующихся из них соединений. Принципиальным отличием настоящего проекта от предыдущих в части объектов исследования станет изучение сольватов не только солей переходных элементов, но и солей p-элементов, а также трехкомпонентных систем, содержащих две соли и один растворитель.
Участие в проекте с образовательной точки зрения позволит ребятам изучить (или глубже узнать) такие темы и области химии, как: сольватация, теория растворов, координационная химия, теория кристаллического поля, теории кислот и оснований (включая теорию ЖМКО), неорганический синтез.
С научно-практической точки зрения участники получат возможность ознакомиться с методами рентгеноструктурного анализа, порошковой рентгеновской дифракции, колебательной спектроскопии, комплексонометрического и окислительно-восстановительного титрования, а также с базовыми принципами работы с лабораторным оборудованием для проведения неорганического синтеза. Для обработки полученных экспериментальных данных участники будут обучены приемам расшифровки результатов рентгеноструктурного анализа и поиска необходимых кристаллографических данных в Кембриджской базе CCDC.
Главные результаты
Впервые определена растворимость солей в четырех тройных системах: ZnCl2-DMSO-DMA, ZnCl2-DMSO-DX, ZnCl2-CdCl2-DMSO, CoCl2-DMSO-DMA.
– Получено и структурно охарактеризовано новое соединение [Zn(DMSO)6][ZnCl3(DMSO)]2(DX),
– показано подобие систем-аналогов MeCl2-DMSO-DX (Me = Co, Cd, Zn): в обеих кристаллизуются изоструктурные сольваты смешанного состава в бинарном растворителе,
– обнаружено формирование двойных солей в тройной системе CdCl2-ZnCl2-DMSO,
– обнаружена связь растворимости и диэлектрической проницаемости растворителей — растворимость в тройных системах уменьшается при переходе от более полярного к менее полярному растворителю.
Презентация проекта
Методические материалы
4. Пара жемчужин из богатого мира наночастиц: магнитная жидкость и коллоидное золото
Руководитель проекта: Ванин А.А.
Волонтер проекта: Смирнов А.Н.
Аннотация: В ходе выполнения проекта участники познакомятся с подходом «снизу вверх» при создании наноматериалов, суть которого в направленном химическом синтезе из ионов и молекул частиц нанометрового размера и последующем приготовлении коллоидных систем. В теоретической части будут рассмотрены темы: синтез наночастиц, приготовление и устойчивость коллоидных систем, взаимодействие электромагнитного поля с веществом.
В практической части проекта предлагается:
– получить наночастицы магнетита и золота, стабилизировать дисперсии наночастиц,
– приготовить магнитные жидкости на гексановой основе и исследовать их магнитные и коллоидно-химические свойства,
– варьировать размер и форму наночастиц, управляя условиями синтеза,
– подтвердить размеры наночастиц золота спектрометрически.
Главные результаты
– Получен магнитный абсорбент для поглощения ионов тяжелых металлов,
– разработан быстрый и специфичный качественный тест на антибиотики (Ампициллин),
– разработана методика определения содержания АФС в ГЛФ (АФС – активная фармацевтическая субстанция – фолиевая кислота; ГЛФ – готовая лекарственная форма – таблетки фолиевой кислоты (1 мг).
Презентация проекта
Методические материалы
5. Определение содержания тяжелых металлов в почвах различных регионов России
Руководители проекта: Савинов С.С.
Волонтер поекта: Кудряшов Д.В.
Аннотация: Проект направлен на получение практических навыков в области аналитической химии (количественного химического анализа). Учащиеся получат опыт планирования аналитического эксперимента, познакомятся на практике с методиками пробоподготовки реальных природных объектов и последующего определения микроэлементного состава современными методами анализа, которые используются в практической деятельности химика-аналитика. Кроме того, учащиеся получат представления о способах обработки экспериментальных данных, приобретут опыт интерпретации результатов и их публичного представления.
Тяжелые металлы — группа элементов, оказывающих токсичное влияние даже при малых концентрациях. Тяжелые металлы попадают в почву обычно из техногенных источников и впоследствии накапливаются в поверхностном слое почвы. Их присутствие отрицательно сказывается на свойствах почвы и ее плодородии. Кроме того, металлы (как и другие элементы) из почвы попадают в растения и накапливаются в их тканях. Затем по трофическим цепям они попадают в другие живые организмы, в том числе и в организм человека.
Целью работы является определение концентраций веществ (в т.ч. тяжелых металлов) в почвах г. Сочи и Санкт-Петербурга и сопоставление получаемых результатов. Схема реализации проекта включает следующие пункты:
– литературный обзор: знакомство с составом и свойствами почв, нормативными документами, регламентирующими содержание металлов в почвах, научными публикациями, посвященными анализу почв,
– отбор образцов почв на территории г. Сочи (пробы почв из г. Санкт-Петербурга будут предоставлены),
– предварительная подготовка (усреднение и измельчение) анализируемых образцов,
– экспериментальное сравнением способов пробоподготовки (экстракции) анализируемых образцов для последующего определения металлов (на примере Mn),
– определение содержания подвижных форм тяжелых металлов в почвах методом молекулярной фотометрии,
– определение содержания углерода органических соединений в почвах титриметрическим методом,
– определение содержания фторидов в почвах и кислотности потенциометрическим методом,
– сравнительный качественный анализ образцов почв методом дуговой атомно-эмиссионной спектрометрии,
– метрологическая обработка получаемых данных, определение средних значений и доверительных интервалов, сравнение результатов с ПДК,
– статистическая обработка получаемых данных, сравнение состава различных образцов,
– подготовка научного доклада по результатам работы с его последующей презентацией на отчетной конференции.
Главные результаты
Установлено:
– разные методики пробоподготовки дают различные результаты определения подвижных форм металлов для разных проб,
– содержание углерода в почве Санкт-Петербурга — 4,4%, в Сочи — 1,6%,
– актуальная кислотность в pH составляет 7,2 для Санкт-Петербурга, 7,9 — для Сочи, обменная кислотность в pH 5,5 для Санкт-Петербурга, 6,7 — для Сочи,
– содержание тяжелых металлов (Mn, Zn, Pb, Co) в Санкт-Петербурге и в Сочи не превышает ПДК,
– содержание фторидов в почве г. Сочи превышает ПДК менее, чем в два раза.
Презентация проекта
Методические материалы
6. Простые синтезы для аналитической электрохимии: сенсорные покрытия на основе галогенидов серебра
Руководитель проекта: Калиничев А.В.
Волонтер проекта: Тюфтяков Н.Ю.
Аннотация: Суть проекта заключается в исследовании условий получения галогенид-серебряных электродов второго рода и апробация их в качестве электродов сравнения в прямой потенциометрии.
Целью проекта является обучение школьников теоретическим основам функционирования гальванических ячеек и электродов, химическим и электрохимическим методам получения нерастворимых покрытий для создания электродов второго рода и принципам их применения в качестве электродов сравнения.
Задачами и результатами проекта будут являться:
– теоретическая подготовка: понимание школьниками основных физико-химических процессов, лежащих в основе электроаналитической химии (электрохимическое равновесие, понятие гальванического элемента, принцип действия электродов первого и второго рода, понятие об электродах сравнения, равновесные электрохимические измерения и метод прямой потенциометрии, основы функционирования гальваностатов и высокоомных вольтметров),
– экспериментальная подготовка (освоение химической и электрохимической методик получения покрытий на основе галогенидов серебра для создания электродов второго рода; получение навыков измерений э.д.с. в простых гальванических ячейках, интерпретации электрического сигнала),
– формирование универсальных исследовательских навыков: установление связи между условиями получения нерастворимых покрытий (природой и концентрацией электролитов, используемых для осаждения, временем синтеза, плотностью тока) и их свойствами на микро- и макроуровне (морфологией поверхности, однородностью, толщиной, а также стабильностью и воспроизводимостью электродного потенциала),
– создание работоспособных электродов сравнения на основе галогенидов серебра и количественная проверка их работоспособности в ходе прямой потенциометрии.
Главные результаты
– Синтезированы галогенидсеребряные покрытия: хлоридные, бромидные, иодидные,
– созданы работоспособные электроды сравнения,
– установлены оптимальные значения концентрации и силы тока для успешного проведения синтеза,
– исследована методами микроскопии морфология полученных образцов.
Презентация проекта
Методические материалы
7. Применение современных ионно-обменных материалов для разделения ионов редкоземельных элементов
Руководитель проекта: Курапова О.Ю.
Аннотация: Проект знакомит обучающихся с теоретическими и практическими аспектами протекания ионно-обменных процессов, строением и свойствами органических и неорганических ионнообменных материалов, а также основами физической химии. Особое внимание в проекте будет уделено изучению химического равновесия. В настоящее время ионный обмен играет значительную роль для обеспечения безопасности на производствах, очистки сточных вод, очистки растворов от определенного типа ионов (катионов тяжелых металлов, радионуклидов, умягчения воды), получения веществ, прямой синтез которых невозможен, разделения аминокислот и витаминов. Участникам проекта предлагается ознакомиться с основами синтеза и анализа структуры ионно-обменных материалов методами РФА и гранулометрии, экспериментального определения основных физико-химических характеристик ионообменных материалов (констант обмена, обменной емкости), а также самостоятельного подбора оптимальных условий для разделения смесей Zn2+ и Cu2+ , а также «дидима» на Pr3+ и Nd3+.
Главные результаты
– Освоен синтез и анализ структуры ионообменных материалов методами РФА и гранулометрии,
– проведено экспериментального определения основных физико-химических характеристик ионообменных материалов (констант обмена, обменной емкости),
– найдены оптимальные условия для разделения смесей Zn2+ и Cu2+,
– достигнуто селективное разделение «дидима» на Pr3+ и Nd3+.
Презентация проекта
Методические материалы
8. Синтез люминесцентных металл-органических каркасных структур лантаноидов для создания флуоресцентных красок
Руководитель проекта: Мерещенко А.С.
Волонтер проекта: Видякина А.А.
Аннотация: Металл-органические каркасные структуры, обладающие люминесцентными свойствами, являются перспективными материалами для создания новых фотокатализаторов, фотогальванических элементов, фотоактивных наноматериалов, люминесцентных биомаркеров, сенсоров, препаратов для фотодинамической противораковой терапии и разработки новых методов органического синтеза. С целью рационального дизайна металл-органических каркасных структур, обладающих заданными люминесцентными характеристиками, необходимо глубокое понимание связи фотофизических свойств с их составом и строением. Многие соединения лантаноидов обладают выраженными люминесцентными свойствами за счет f-f переходов ионов лантаноидов. Однако, в связи с тем, что f-f переходы запрещены по симметрии, неорганические соединения лантаноидов слабо поглощают свет и, как следствие, слабо люминесцируют. Решением данной проблемы может быть перевод ионов лантаноидов в возбужденные электронные состояния не напрямую, а в результате передачи энергии, сенсибилизации. В качестве сенсибилизатора для соединений лантаноидов часто выступают органические молекулы, например, анионы бензолдикарбоновых и бензолтрикарбоновых кислот.
В данной работе будет проведён синтез металл-органических каркасных структур на основе смешанных терефталатов европия(III), тербия(III), празеодима(III), диспрозия(III), гадолиния(III), лютеция(III) и иттрия в водных и водно-органических растворителях. Синтез будет проводиться как при комнатной температуры при реакции солей терефталата с солями редкоземельных элементов, так и сольватермическим методом в автоклаве при температурах до 180 градусов Цельсия. Для полученных соединений будут изучены люминесцентные свойства, качественный и фазовый состав. По итогам работы из полученных материалов будут созданы люминесцентные краски, светящиеся различными цветами под действием ультрафиолетового света. Также будут проведены пробные эксперименты по созданию люминесцентных сенсоров на различные аналиты, такие как ионы тяжелых металлов и органические растворители.
Главные результаты
– Синтезированы смешанные терефталаты Tb-Gd, Eu-Gd, Tb-Lu изоструктурны терефталату тербия Tb2(1,4-bdc)3*4h3O. Установлено, что смешанные терефталаты Eu-Lu при низких концентрациях (< 10 ат.%) европия изоструктурны терефталату лютеция Lu2(1,4-bdc)3*10h3O, а при высоких концентрациях европия – терефталату тербия Tb2(1,4-bdc)3*4h3O.
– При возбуждении смешанных терефталатов, содержащих тербий и европий, в полосу поглощения терефталат иона на 254 нм наблюдается интенсивная люминесценция ионов тербия (488, 543, 586, 622 нм) и европия (577, 590, 615, 651, 700 нм).
– Показано, что с увеличением концентрации европия/тербия в смешанных терефталатах до 10% интенсивность люминесценции резко увеличивается, а затем плавно спадает.
– Установлено, что ионы Pb2+, Cu2+, Cr3+ и Fe3+ тушат люминесценцию терефталатов тербия и европия, что позволяет использовать данные терефталаты в качестве люминесцентных сенсоров. Тушение более выражено для смешанных терефталатов Tb-Lu, Eu-Lu и Tb-Eu-Lu.
– Разработаны люминесцентные краски на основе терефталатов тербия и европия. С помощью данных красок подготовлена иллюстрация к работе.
Презентация проекта
Методические материалы
9. Влияние растворителя на синтез и свойства металл-органических структур
Руководитель проекта: Скрипкин М.Ю.
Волонтер проекта: Булдаков А.В.
Аннотация: Синтез и изучение свойств металлорганических каркасных структур является одной из наиболее быстро развивающихся областей современной координационной химии. Этот класс координационных полимеров находит все большее практическое применение благодаря своим каталитическим, люминесцентным, газопоглотительным свойствам. Большое внимание уделяется не только синтезу новых металлорганических каркасных структур, но и оптимизации уже существующих методов синтеза, таких как метод медленного испарения, сольвотермальный, микроволновый, механохимический и так далее. Одним из возможных путей достижения оптимальных характеристик этих материалов (степени кристалличности, пористости, газопоглотительной способности) является подбор соответствующего растворителя. Целью настоящего проекта и станет выявление эффекта состава смешанного водно-органического растворителя на состав и структуру металлорганических каркасных структур (metal-organic frameworks, MOFs).
В ходе работы предполагается осуществить синтез ряда MOF, содержащих в качестве металлоцентров ионы переходных металлов, а в качестве линкеров — бензол ди- и трикарбоксилат-анионы и 4,4’-бипиридин. В качестве растворителя будут рассмотрены смеси воды с органическими растворителями с разной донорной способностью: этанолом, N,N-диметилформамидом, диметилсульфоксидом. В ходе выполнения проекта участники приобретут навыки химика-синтетика, познакомятся (теоретически и частично — на практике) с такими методами синтеза, как взаимная диффузия растворов, медленное испарение, сольвотермальный, сонохимический, электрохимический синтез, освоят базовые методы химического анализа, получат навыки расшифровки колебательных спектров и дифрактограмм вещества, данных ТГ, ДТА и ДСК. Предлагаемый проект является частью проекта, поддержанного грантом РФФИ.
Главные результаты
– Синтезировано более 50 синтезов металл-органических каркасных структур,
– получено 15 уникальных МОФов,
– структура МОФов подтверждена методами РФА и рамановской спектроскопии,
– выявлены зависимости влияния состава растворителя на структуру исследованных МОФов.
Презентация проекта
Методические материалы
10. Ядерный магнитный резонанс в земном поле
Руководители проекта: Иевлев А.В., Куприянов П.А.
Аннотация: Курс экспериментальных работ в рамках проекта по ядерному магнитному резонансу (ЯМР) в земном поле позволит школьникам полностью ознакомиться со всеми основными методами ЯМР, а также с его особенностями в слабых магнитных полях. Проект нацелен, в основном, на изучение возможностей ядерного магнитного резонанса, поскольку методы ЯМР являются одним из самых мощных инструментов для неразрушающего изучения как физико-химических свойств различных веществ, так и исследования самой структуры вещества. Кроме того, магнитный резонанс имеет достаточно широкие применения, такие как ЯМР-томография и магнитометрия, огромным плюсом к этому могут послужить возможности близких явлений электронного парамагнитного резонанса (ЭПР) и ядерного квадрупольного резонанса (ЯКР), с которыми также познакомятся участники проекта.
Порядок работ выстроен так, что школьники сначала получат необходимую начальную информацию о явлении и научатся работать с приборами: ЯМР-магнитометром и ЯМР-спектрометром, работающих в слабых магнитных полях. В этом проекте школьникам придется научиться настраивать экспериментальную установку, находить сигнал ЯМР, добиваться оптимальных режимов работы, регистрировать спектры ЯМР в земном магнитном поле, вычислять некоторые характеристики веществ, а также получать карты магнитного поля Земли.
Главные результаты
– Проведены измерения магнитного поля Земли с помощью низкополевого спектрометра,
– установлена временная вариация магнитного поля Земли, измеренная на внутреннем дворе школы,
– установлена вариация магнитного поля Земли с вариометрических станций, расположенных на примерно одной долготе(+/- 1,376°), а в углу зависимость наклонения вектора магнитного поля от широты, на которой расположена станция,
– обнаружен градиент МПЗ на участке около школы,
– измерено магнитное поле на участке около школы и градиент МПЗ на участке около школы.
Презентация проекта
Методические материалы
11. Разработка и анализ перспектив нестандартных путей использования супергидрофобных покрытий
Руководиитель проекта: Рогожин В.Б.
Волонтер проекта: Лезова А.А.
Аннотация: В последнее десятилетие появилось большое количество исследований, раскрывающих возможности использования супергидрофобных покрытий не только для защиты от влаги, но и для решения других задач: в микрофлюидике, в концепции «лаборатория-на-чипе», в медицине для уменьшения тромбообразования и т.д. Однако спектр возможных применений этих покрытий далеко не исчерпан. Известно, что режим Касси-Бакстера характеризуется наличием газа в полостях поверхности, непосредственно контактирующей с жидкостью. Совокупность свойств подобного контакта, а именно, свободный обмен частицами через границу раздела газ-жидкость, малые коэффициенты трения жидкости о подобную поверхность, возможность резкого увеличения ее площади при фиксированном объеме за счет размещения в нем тонких пленок или волокон с супергидрофобным покрытием могут иметь прямое практическое применение.
В ходе выполнения проекта участники проанализируют перспективы практического применения супергидрофобных поверхностей в медицине для создания искусственного легкого, в биотопливной энергетике для решения задачи высокоэффективного отделения высоколетучих топливных компонент из водного раствора, а также для опреснения морской воды при сравнительно низких температурах и малых энергетических затратах. В рамках проекта будут рассмотрены особенности гидрофобных и супергидрофобных покрытий, пути стабилизации режима Касси-Бакстера. Участники создадут и исследуют свои конструкции, связанные с проблематикой проекта.
Главные результаты
– Созданы две модели искусственного легкого и продемонстрирована их эффективность; предложены пути дальнейшего усовершенствования,
– собраны и испытаны две установки, позволяющие опреснять морскую воду за счет энергии окружающей среды,
– собрана установка по непрерывному отделению высоколетучих компонентов на примере C2H5OH, которую можно применять непосредственно в биореакторе в процессе жизнедеятельности микроорганизмов,
– исследовано поведение ферромагнитных жидкостей на супергидрофобной поверхности и проанализированы возможности применения супергидрофобной поверхности в контакте с ферромагнитной жидкостью.
Презентация проекта
Методические материалы
Расчет молей – Формула массы и расчет молей – Редакция GCSE Chemistry (Single Science) – Другое
Рассчитайте массу сульфата натрия , полученную, когда 20 г гидроксида натрия вступают в реакцию с избытком серной кислоты. (A r of H = 1, A r of O = 16, A r Na = 23, A r of S = 32)
M r NaOH = 23 + 16 + 1 = 40
M r Na 2 SO 4 = 23 + 23 + 32 + 16 + 16 + 16 + 16 = 142
Число молей NaOH = масса ÷ относительная формула масса = 20 ÷ 40 = 0.5 моль
Из уравнения 2 моль NaOH реагирует с 1 моль Na 2 SO 4 , поэтому 0,5 моль NaOH будет реагировать с 0,25 моль Na 2 SO 4 .
масса Na 2 SO 4 = моль × масса по относительной формуле = 0,25 × 142 = 35,5 г
Расчет молекулярной массы – Центр Гельфанда
- Химическая формула воды – h3O, что означает, что эта молекула имеет 3 атома: 2 атома водорода (H) и 1 атом кислорода (O).Используя периодическую таблицу элементов, чтобы найти атомные веса, мы находим, что водород имеет атомный вес 1, а кислород – 16. Чтобы вычислить молекулярный вес одной молекулы воды, мы складываем вклады от каждого атома; то есть 2 (1) + 1 (16) = 18 грамм / моль.
- Химическая формула мономера этилена – (Ch3-Ch3) -. Всего в нем 6 атомов: 2 атома углерода (C) и 4 атома водорода (H). Атомный вес углерода 12; а водород равен 1, поэтому один мер этилена имеет вес 2 (12) + 4 (1) = 28.Мы объединяем (реагируем) многие меры этилена вместе, образуя полиэтиленовую цепь. Одна тысяча мер, соединенных вместе, в сумме даст вес 28000 грамм / моль и будет иметь 6000 атомов.
моль – это стандартный химический метод определения количества присутствующего вещества. моль – это единица измерения количества вещества. Один моль «чего-то» содержит 6,022 x 1023 объекта. Например, на один моль химического соединения приходится 6.022 х 1023 молекул.
Рассчитаем молекулярную массу некоторых распространенных соединений. Используйте приведенную ниже таблицу, чтобы найти атомный вес каждого атома (элемента), или обратитесь к Периодической таблице элементов. Подсказка : Подсчитайте количество атомов каждого элемента, а затем умножьте это число на атомный вес элемента.
| Элемент | Атомный Вес |
|---|---|
| H (водород) | 1 |
| C (углерод) | 12 |
| N (азот) | 14 |
| O (кислород) | 16 |
| Na (натрий) | 23 |
| Cl (хлор) | 35 |
- Поваренная соль – NaCl
Ответ: 23 (1) +35 (1) = 58 - Аммиак – Nh4
Ответ: 1 (3) +14 (1) = 3 + 14 = 17 - Уксус (уксусная кислота) – Ch4COOH
Ответ: 1 (4) +12 (2) +16 (2) = 4 + 24 + 32 = 60
Осадки и расчеты – AP Chemistry
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает или несколько ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в качестве ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени; Идентификация авторских прав, которые, как утверждается, были нарушены; Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \ достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например нам требуется а ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание к какой конкретной части вопроса – изображению, ссылке, тексту и т. д. – относится ваша жалоба; Ваше имя, адрес, номер телефона и адрес электронной почты; а также Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Урок химии: молярная масса – справка по химии
[См. Сопутствующие практические задачи по преобразованию молярной массы здесь.]
Что такое молярная масса?
Молярная масса – это буквально масса одного моля вещества.На предыдущем уроке, посвященном атомной массе, мы видели, что таблица Менделеева дает нам среднюю атомную массу элементов. Например, атомная масса водорода (символ H) равна 1,01 а.е.м. (атомные единицы массы). Но один невероятно удобный аспект таблицы Менделеева состоит в том, что те же самые массы также являются массой одного моля элемента в граммах.
Например, один атом водорода имеет массу 1,01 а.е.м., а один моль водорода имеет массу 1,01 г. Помните, что одна родинка равна числу Авогардо, 6.022 × 10 23 частиц. Итак, один моль водорода, или 6,022 × 10 23 атомов водорода, имеет массу 1,01 г.
| Элемент | Атомная масса | Молярная масса | Число атомов |
| H | 1.01 а.е.м. | 1,01 г / моль | 6.022 × 10 23 |
| мг | 24,31 а.е.м. | 24,31 г / моль | 6.022 × 10 23 |
| Na | 22,99 а.е.м. | 22,99 г / моль | 6.022 × 10 23 |
Молярная масса of Compounds
Чтобы найти массу одного моля любого вещества, мы подсчитываем количество присутствующих элементов и складываем их атомные массы.
Например, давайте вычислим молярную массу оксида железа (III), Fe 2 O 3 . Fe 2 O 3 состоит из двух атомов железа и трех атомов кислорода.Чтобы вычислить его молярную массу, мы должны сложить массу двух атомов железа и трех атомов кислорода.
2 x Fe = 2 x 55,85 = 111,70
3 x O = 3 x 16,00 = + 48,00
Всего = 159,70 г / моль
Это молярная масса Fe 2 O 3 . Таким образом, один моль Fe 2 O 3 имел бы массу 159,70 г. Или число Авогадро, 6,022 × 10 23 , формульных единиц Fe 2 O 3 (частицы ионного соединения) будет иметь массу 159.70 г.
[Что касается значащих цифр, мы обычно просто сохраняем столько десятичных знаков для общей массы, сколько изначально присутствовало в массе элемента. Например, железо (Fe) имеет массу 55,85 – два десятичных знака. Поэтому, когда мы складываем два атома железа, мы сохраняем два десятичных знака и пишем 111,70.]
Примеры
Рассчитать молярную массу:
1. Mn (MnO 4 ) 4
Имеется 5 атомов Mn (масса 54.94) и 16 атомов O (масса 16.00).
5 x 54,94 + 16 x 16,00 = 530,70 г / моль
2. Al 2 (SO 4 ) 3
Есть 2 атома Al (масса 26,98), 3 атома S (масса 32,07) и 12 атомов O (масса 16,00).
2 x 26,98 + 3 x 32,07 + 12 x 16,00 = 342,17 г / моль
Обратите внимание, что молярная масса выражается в граммах на моль (г / моль). Это очень похоже на коэффициент преобразования, который связывает две единицы: граммы в моль.Так же, как 12 дюймов / 1 фут, для Al 2 (SO 4 ) 3 есть 342,17 г / моль. Это позволяет нам преобразовывать граммы Al 2 (SO 4 ) 3 в моль Al 2 (SO 4 ) 3 . Следующие два примера задач иллюстрируют, как использовать молярную массу в качестве коэффициента преобразования между молями и массой.
Примеры задач
3. Какова масса в граммах 3,81 моля Fe 2 O 3 ?
Ранее мы рассчитали, что молярная масса Fe 2 O 3 равна 159.70 г / моль.
3,81 моль Fe 2 O 3 x 159,70 г / 1 моль Fe 2 O 3 = 608 г
4. Сколько молей содержится в 713 граммах Al 2 (SO 4 ) 3 ?
Молярная масса Al 2 (SO 4 ) 3 ранее была рассчитана как 342,17 г / моль. Поскольку мы конвертируем граммы в моль, нам нужно перевернуть этот коэффициент преобразования так, чтобы граммы были внизу, чтобы отменить.
713 г x 1 моль Al 2 (SO 4 ) 3 / 342,17 г = 2,08 моль Al 2 (SO 4 ) 3
[Дополнительные практические задания по преобразованию молярной массы можно найти здесь.]
Комментарии
комментарии
Что такое молярная масса? – Определение, формула и примеры – Видео и стенограмма урока
Как найти молярную массу для соединений
Соединения – это вещества, состоящие из более чем одного элемента.Например, некоторые распространенные соединения включают соль, глюкозу, уксусную кислоту (или уксус) и бикарбонат натрия (или пищевую соду).
Хлорид натрия состоит из двух элементов: натрия и хлора. Давайте использовать это соединение, хлорид натрия, в качестве нашего первого примера расчета молярной массы соединений. Первое, что нам нужно сделать, это найти натрий и хлор в периодической таблице.
Шаг 1: Найдите атомные массы отдельных элементов в периодической таблице
Первое, что нам нужно, это найти отдельные атомные массы для каждого элемента.Если вы посмотрите записи для натрия и хлора в таблице, мы обратим внимание на цифры, которые появляются в верхнем левом углу (см. Видео). Они представляют собой атомную массу. Элемент натрия имеет атомную массу 22,98976 г / моль. Элемент хлор имеет атомную массу 35,453 г / моль.
Шаг 2: Подсчитайте, сколько атомов имеется для каждого элемента
Для соединения хлорида натрия, поскольку нет нижних индексов (маленькие числа внизу символа каждого элемента), это означает, что имеется только один натрий и только один хлор. атом для этого соединения.
Шаг 3: Найдите молярную массу
Теперь, когда мы знаем, сколько атомов имеется у каждого элемента, мы можем найти молярную массу.
Сначала мы вычисляем массу атомов натрия, которая составляет 22,98976 граммов на моль. Затем мы проделаем то же самое с массой атомов хлора, которая составляет 35,453 грамма на моль. Затем мы складываем эти две массы вместе, чтобы найти общую массу молекул хлорида натрия. Получается 58,44276 граммов на моль, которые мы можем округлить до 58.44 грамма на моль.
Пример: расчет молярной массы соединения
Давайте рассмотрим более сложный пример.
Найдите молярную массу уксусной кислоты .
Есть три элемента – углерод, водород и кислород – поэтому найдите их атомные массы в периодической таблице: 12,0107 г / моль для углерода, 1,00794 г / моль для водорода и 15,9994 г / моль для кислорода.
Далее, мы должны учитывать, что каждый элемент в химическом составе имеет нижний индекс, поэтому у каждого атома более одного.У нас есть два атома углерода, четыре атома водорода и два атома кислорода.
Теперь мы можем найти молярную массу каждого элемента. Для углерода мы умножаем его молярную массу 12,0107 грамма на моль на два, потому что у нас есть два атома углерода. Это равняется 24,0214 грамма на моль. Для водорода мы умножаем молярную массу 1,00794 на 4. Это равняется 4,03176 грамма на моль. Наконец, для кислорода мы умножаем молярную массу 15,9994 на 2. Это равняется 31,9988 грамма на моль.
Теперь, чтобы закончить, мы должны сложить все эти массы вместе, что дает нам 60.05196 грамм на моль для нашего соединения.
Расчет количества граммов по молярной массе
Ранее мы упоминали, что в научной лаборатории мы измеряем вес вещества в граммах. Иногда нам известно только количество молей присутствующего вещества. Проблема в том, что мы не можем измерить эти родинки с помощью прибора, чтобы определить массу. Здесь и появляется молярная масса. Мы можем использовать это, чтобы преобразовать любое количество молей в граммы, используя простую формулу. Количество граммов равно молярной массе элемента или соединения, умноженной на количество молей.
Допустим, нам нужно получить вес в граммах 1,5 моля пищевой соды. Как мы это делаем? Нам нужно получить молярную массу сложной пищевой соды, в данном случае 84 грамма на моль, и умножить ее на 1,5.
Когда мы умножаем количество молей на молярную массу, единица «моль» отменяется, и остается единица «граммы». В данном случае у нас 126 граммов пищевой соды.
Что, если мы хотим получить вес 0,5 моля соли или хлорида натрия в граммах? Молярная масса соли составляет 58,44 грамма на моль. Когда мы умножаем эти два вместе, мы получаем, что масса 0,5 моля соли составляет 29,22 грамма.
Резюме урока
Молярная масса – это масса всех атомов в молекуле в граммах на моль. Чтобы вычислить молярную массу молекулы, мы сначала получаем атомные веса отдельных элементов в периодической таблице.Затем мы подсчитываем количество атомов и умножаем его на массы отдельных атомов. Наконец, мы складываем все атомные массы вместе, чтобы получить молярную массу.
Молярная масса также является важным коэффициентом перевода из молей в граммы. Для этого умножаем количество молей вещества на молярную массу. Этот коэффициент пересчета важен при количественном определении веса в граммах в научных экспериментах.
Быстрые заметки
- Молярная масса – это масса всех атомов молекулы в граммах на моль.
- Молярную массу можно использовать для расчета массы соединения и перевода молей в граммы.
Результаты обучения
После изучения урока примените свои знания о молярной массе, чтобы сделать следующее:
- Обсудите значение моля и молярной массы
- Использовать молярную массу для определения массы соединения
- Перевести моль вещества в граммы
Глава 6 – Количества в химических реакциях – Химия
Глава 6 – Количества в химических реакцияхЭтот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
6.1: Введение в главу 6.2: Крот 6.3: Атомная и молярная масса 6.4: Преобразование молярной массы 6.5: Молекулярно-молекулярные отношения в химических реакциях 6.6: Задачи молекулярной массы и массы-массы 6.7: Краткое содержание главы 6.8: Каталожные номера6.1: Введение в главу
До сих пор мы говорили о химических реакциях в терминах отдельных атомов и молекул.Хотя это работает, большинство реакций, происходящих вокруг нас, связаны с гораздо большим количеством химикатов. Даже крошечный образец вещества будет содержать миллионы, миллиарды или сто миллиардов миллиардов атомов и молекул. Как мы можем сравнить количество веществ друг с другом в химическом отношении, если так сложно сосчитать до ста миллиардов миллиардов?
На самом деле, есть способы сделать это, которые мы рассмотрим в этой главе. Поступая таким образом, мы углубим наше понимание стехиометрии, которая представляет собой изучение численных соотношений между реагентами и продуктами в сбалансированной химической реакции.
(Вернуться к началу)6.2: Крот
Рисунок 6.1 «Молекулы воды» показывает, что нам нужны 2 атома водорода и 1 атом кислорода, чтобы образовать 1 молекулу воды. Если мы хотим получить 2 молекулы воды, нам потребуется 4 атома водорода и 2 атома кислорода. Если мы хотим получить 5 молекул воды, нам нужно 10 атомов водорода и 5 атомов кислорода. Соотношение атомов, которые нам понадобятся для образования любого количества молекул воды, одинаково: 2 атома водорода на 1 атом кислорода.
Рис. 6.1. Молекулы воды: Соотношение атомов водорода и кислорода, используемых для образования молекул воды, всегда 2: 1, независимо от того, сколько молекул воды получается.
Однако одна проблема, с которой мы сталкиваемся, заключается в том, что чрезвычайно трудно, если не невозможно, организовать атомы по одному. Как сказано во введении, мы имеем дело с миллиардами атомов одновременно. Как мы можем отслеживать так много атомов (и молекул) одновременно? Мы делаем это, используя массу, а не подсчитывая отдельные атомы.
Атом водорода имеет массу приблизительно 1 ед. Атом кислорода имеет массу примерно 16 единиц. Следовательно, отношение массы атома кислорода к массе атома водорода составляет примерно 16: 1.
Если у нас есть 2 атома каждого элемента, соотношение их масс будет примерно 32: 2, что уменьшится до 16: 1 – такое же соотношение. Если у нас есть 12 атомов каждого элемента, отношение их общих масс будет приблизительно (12 × 16) 🙁 12 × 1), или 192: 12, что также уменьшается до 16: 1. Если у нас есть 100 атомов каждого элемента, соотношение масс составляет примерно 1600: 100, что снова уменьшается до 16: 1.Пока у нас равное количество атомов водорода и кислорода, соотношение масс всегда будет 16: 1.
Такая же последовательность наблюдается при сравнении соотношений масс других элементов. Например, отношение масс атомов кремния к равному количеству атомов водорода всегда составляет примерно 28: 1, в то время как отношение масс атомов кальция к равному количеству атомов лития составляет примерно 40: 7.
Итак, мы установили, что массы атомов постоянны по отношению друг к другу, пока у нас одинаковое количество атомов каждого типа.Рассмотрим более макроскопический пример. Если образец содержит 40 г Ca, этот образец имеет такое же количество атомов, как и образец из 7 г Li. Что нам нужно, так это число, которое представляет удобное количество атомов, чтобы мы могли соотносить макроскопические количества веществ. Ясно, что даже 12 атомов – это слишком мало, потому что сами атомы такие маленькие. Нам нужно число, представляющее миллиарды и миллиарды атомов.
A моль определяется как 6,02 × 10 23 единиц и, таким образом, используется химиками для обозначения большого количества атомов или молекул.Подобно тому, как дюжина подразумевает 12 вещей, родинка (сокращенно моль ) представляет 6,02 × 10 23 вещи. Число 6,02 × 10 23 , названное числом Авогадро, в честь химика XIX века Амедео Авогадро, – это число, которое мы используем в химии для обозначения макроскопических количеств атомов и молекул. Таким образом, если у нас есть 6,02 × 10 23 атомов кислорода, мы говорим, что у нас есть 1 моль атомов кислорода. Если у нас есть 2 моля атомов Na, у нас будет 2 × (6,02 × 10 23 ) атомов Na, или 1.2044 × 10 24 атомов Na. Аналогично, если у нас есть 0,5 моль молекул бензола (C 6 H 6 ), мы имеем 0,5 × (6,02 × 10 23 ) C 6 H 6 молекул, или 3,011 × 10 23 C 6 H 6 молекул.
Обратите внимание, что мы применяем мольную единицу к различным типам химических соединений. В этих примерах мы указали молей атомов и молей молекул. Слово моль обозначает ряд вещей – 6.02 × 10 23 из них – но само по себе не указывает, что «они». Это могут быть атомы, формульные единицы (ионных соединений) или молекулы. Эту информацию еще нужно уточнить.
Поскольку 1 молекула H 2 содержит 2 атома H, 1 моль H 2 молекул (6,02 × 10 23 молекулы) содержит 2 моля атомов H. Используя формулы, чтобы указать, сколько атомов каждого элемента у нас есть в веществе, мы можем связать количество молей молекул с количеством молей атомов.Например, в 1 моль этанола (C 2 H 6 O) мы можем построить следующие зависимости (Таблица 6.1 «Молекулярные отношения»):
Таблица 6.1: Молекулярные отношения
В следующем примере показано, как мы можем использовать эти отношения в качестве коэффициентов пересчета.
(Вернуться к началу)6.3. Атомная и молярная масса .
Теперь, когда мы представили крот и попрактиковались в его использовании в качестве коэффициента преобразования, мы задаем очевидный вопрос: почему моль соответствует именно этому числу ? Почему это 6.022 × 10 23 , а не 1 × 10 23 или даже 1 × 10 20 ?
Число в моле, число Авогадро, связано с относительными размерами атомной единицы массы и грамма единиц массы. В то время как один атом водорода имеет массу приблизительно 1 а.е.м., 1 моль атомов H имеет массу приблизительно 1 грамм .И хотя один атом натрия имеет приблизительную массу 23 а.е.м., 1 моль атомов Na имеет приблизительную массу 23 граммов .
Масса одного моля вещества в граммах равна массе одного атома или молекулы в единицах атомной массы. Числа в периодической таблице, которые мы определили как атомные массы атомов, не только говорят нам массу одного атома в атомных единицах массы, но также говорят нам массу 1 моля атомов в граммах! Это потому, что все атомы состоят из одних и тех же частей (протонов, нейтронов и электронов), а протоны и нейтроны имеют почти одинаковые массы.Электроны, так как они такие легкие, пренебрегают своим вкладом в атомную массу даже в самых больших атомах. Таким образом, атомная или молекулярная масса указывает, сколько атомов или молекул присутствует. Таким образом, образуется важное трехкомпонентное соотношение: 1 моль = атомная или молекулярная масса в граммах = 6,02 X 10 23 атомов или молекул. Это эффективно дает нам возможность подсчитывать молекулы в лаборатории, используя общие весы! Обратите внимание, что в химических уравнениях и расчетах мольные концентрации обозначаются сокращенно моль.
Напомним, что масса ионного соединения (обозначается формулой массы ) или ковалентной молекулы (обозначается молекулярной массой ) – это просто сумма масс его атомов. Чтобы вычислить формулу или молекулярные массы, важно отслеживать количество атомов каждого элемента в молекулярной формуле, чтобы получить правильную молекулярную массу.
Например:
Молекула NaCl содержит 1 Na + и 1 Cl – .Таким образом, мы можем вычислить формулу массы этого соединения, сложив атомные массы натрия и хлора, как указано в таблице Менделеева (рис. 6.1).
Рисунок 6.1 Периодическая таблица элементов
Для более крупной молекулы, такой как глюкоза (C 6 H 12 O 6 ), которая имеет несколько атомов одного и того же типа, просто умножьте атомную массу каждого атома на количество присутствующих атомов, а затем добавьте увеличьте все атомные массы, чтобы получить окончательную молекулярную массу.
Концепция молей может быть распространена также на массы формульных единиц и молекул. Масса 1 моля молекул (или формульных единиц) в граммах численно эквивалентна массе одной молекулы (или формульной единицы) в атомных единицах массы. Например, одна молекула O 2 имеет массу 32,00 ед. (Сумма 2 атомов кислорода), а 1 моль молекул O 2 имеет массу 32,00 г. Как и в случае с атомными массами, основанными на единицах массы, чтобы получить массу 1 моля вещества, мы просто суммируем массы отдельных атомов в формуле этого вещества.Масса 1 моля вещества называется его молярной массой , независимо от того, является ли вещество элементом, ионным соединением или ковалентным соединением.
Рисунок 6.2: Удивительный крот. Показаны основные мольные коэффициенты пересчета.
Отношения между мольными количествами и коэффициентами пересчета в граммах, перечисленные выше на рис. 6.2, являются одними из наиболее полезных уравнений во всей химии. Они позволяют проводить химические реакции безопасным и эффективным образом и оказывают огромное влияние на экономику многих промышленных и производственных процессов, а также на производство лекарств.Если вы серьезно изучаете химию, я бы рекомендовал распечатать таблицу 6.2 и сохранить копию в своем блокноте. Это будет чрезвычайно полезно при постановке множества текстовых задач и функционально полезно в лаборатории.
Так почему же так важно соотношение между моль и составной массой? В микроскопическом мире химические уравнения строятся в масштабе молекул. На рисунке 6.3 изображена типичная химическая реакция. Как мы узнали в главе 5, коэффициенты перед каждым соединением представляют количество молекул, необходимое для протекания реакции.В этой реакции горения 2 молекулы бутана (C 4 H 10 ) реагируют с 13 молекулами кислорода с образованием 8 молекул диоксида углерода и 10 молекул воды. Однако в лаборатории химики не могут подсчитать молекулы и поместить их в реакционную колбу. Молекулы слишком малы, чтобы их можно было увидеть невооруженным глазом, и нет оборудования, способного таким образом сортировать и подсчитывать молекулы. С другой стороны, массу легко измерить с помощью весов.Таким образом, отношение массы к количеству присутствующих молекул становится очень важным преобразованием. Поскольку моль представляет собой фиксированное количество молекул (6,02 X 10 23 ), коэффициенты, используемые в химических реакциях, также можно рассматривать как молярные отношения. Вместо того, чтобы читать наше уравнение в терминах молекул, мы можем читать его в терминах молей. На макроскопическом уровне реакция ниже выглядит следующим образом: 2 моля бутана (C 4 H 10 ) реагируют с 13 молями кислорода с образованием 8 моль диоксида углерода и 10 моль воды.
Рисунок 6.3 Реакция горения бутана. Пример показывает молекулярные соотношения субстратов и продуктов реакции.
6.4 Преобразование молярных масс
Самый простой тип манипуляции с использованием молярной массы в качестве коэффициента преобразования – это преобразование молярной массы (или его обратное преобразование, преобразование массы в моль), как показано на рисунке 6.2. При таком преобразовании мы используем молярную массу вещества в качестве коэффициента преобразования для преобразования единиц моля в единицы массы (или, наоборот, единиц массы в единицы моля).
Мы установили, что 1 моль Al имеет массу 26,98 г (пример 3 в разделе 6.3). Выражается математически,
1 моль Al = 26,98 г Al
Мы можем разделить обе части этого выражения на любую сторону, чтобы получить один из двух возможных коэффициентов преобразования:
Первый коэффициент преобразования можно использовать для преобразования массы в моль, а второй – для преобразования моль в массу. Оба могут использоваться для решения проблем.
Подобные преобразования возможны для любого вещества, если правильная атомная масса, формула массы или молярная масса известна (или может быть определена) и выражена в граммах на моль.Рисунок 6.4 представляет собой диаграмму для определения необходимого коэффициента преобразования, а рисунок 6.5 представляет собой блок-схему шагов, необходимых для выполнения преобразования. Обратите внимание, что для преобразования из молей в массу или из массы в моли требуется один математический шаг.
Рис. 6.4 Простая блок-схема преобразования между массой и молями вещества.
Рисунок 6.5 Блок-схема, иллюстрирующая этапы преобразования единиц измерения.
Для вашего здоровья: минералыДля того, чтобы наш организм функционировал должным образом, мы должны потреблять определенные вещества из нашего рациона.Среди наших диетических потребностей минералы , неуглеродные элементы, которые наш организм использует для различных функций, таких как развитие костей или обеспечение надлежащей нервной передачи.
Министерство сельского хозяйства США разработало некоторые рекомендации по суточному потреблению (RDI) различных минералов. В прилагаемой таблице перечислены РСНП для минералов, как в массе, так и в молях, исходя из ежедневного рациона в 2000 калорий.
Таблица 6.2: Рекомендуемая суточная доза (РСН) минеральных добавок
Таблица 6.2 иллюстрирует несколько вещей. Во-первых, потребности мужчин и женщин в некоторых минералах различны. Крайний случай – для железа; женщинам нужно вдвое больше, чем мужчинам. Во всех остальных случаях, когда используется другой RDI, мужчинам нужно больше, чем женщинам.
Во-вторых, количество различных минералов, необходимых ежедневно, широко варьируется – как в массовом, так и в молярном масштабе. В среднем человеку требуется 0,1 моль Na в день, что составляет около 2,5 г. С другой стороны, человеку нужно всего около 25–35 мкг Cr в день, что составляет менее одной миллионной доли моля.Каким бы небольшим ни было это количество, дефицит хрома в рационе может привести к симптомам, подобным диабету, или неврологическим проблемам, особенно в конечностях (руках и ногах). Что касается некоторых минералов, организму не требуется много для нормальной работы.
Хотя правильно сбалансированная диета обеспечивает все необходимые минералы, некоторые люди принимают пищевые добавки. Однако слишком много хорошего, даже минералов, не есть хорошо. Воздействие слишком большого количества хрома, например, вызывает раздражение кожи, а некоторые формы хрома, как известно, вызывают рак (как показано в фильме Эрин Брокович ).
(Вернуться к началу)6.5 Молекулярные отношения в химических реакциях
В этом разделе вы узнаете, как использовать сбалансированную химическую реакцию для определения молярных соотношений между веществами.
В главе 5 вы научились балансировать химические уравнения, сравнивая количество атомов каждого типа в реагентах и продуктах. Коэффициенты перед химическими формулами представляют собой количество молекул или формульных единиц (в зависимости от типа вещества).Здесь мы расширим смысл коэффициентов в химическом уравнении.
Рассмотрим простое химическое уравнение
2H
2 + O 2 → 2H 2 OПри написании сбалансированных химических уравнений принято использовать наименьшее целочисленное отношение для коэффициентов. Однако уравнение сбалансировано, пока коэффициенты находятся в соотношении 2: 1: 2. Например, это уравнение также сбалансировано, если мы запишем его как
4H
2 + 2O 2 → 4H 2 OСоотношение коэффициентов составляет 4: 2: 4, что сокращается до 2: 1: 2.Уравнение также сбалансировано, если мы запишем его как
22H
2 + 11O 2 → 22H 2 O, потому что 22:11:22 также сокращается до 2: 1: 2.
Предположим, мы хотим использовать большие числа. Рассмотрим следующие коэффициенты:
12.044 × 10
23 H 2 + 6.022 × 10 23 O 2 → 12.044 × 10 23 H 2 OЭти коэффициенты также имеют соотношение 2: 1: 2 (проверьте и посмотрите), так что это уравнение сбалансировано.Но 6,022 × 10 23 – это 1 моль, а 12,044 × 10 23 – 2 моль (и число написано таким образом, чтобы сделать это более очевидным), поэтому мы можем упростить эту версию уравнения, записав ее как
2 моль H
2 + 1 моль O 2 → 2 моль H 2 OМы можем опустить слово моль и не записывать коэффициент 1 (как наша привычка), поэтому окончательная форма уравнения, все еще сбалансированная, будет
2H
2 + O 2 → 2H 2 OТеперь мы интерпретируем коэффициенты как относящиеся к молярным количествам, а не к отдельным молекулам.Урок? Сбалансированные химические уравнения сбалансированы не только на молекулярном уровне, но и с точки зрения молярных количеств реагентов и продуктов. Таким образом, мы можем прочитать эту реакцию как «два моля водорода реагируют с одним моль кислорода с образованием двух молей воды».
Точно так же отношения, которые мы построили в главе 5, также могут быть построены в единицах молей, а не молекул. Например, для реакции, в которой водород и кислород соединяются с образованием воды, мы можем построить следующие отношения:
Мы можем использовать эти соотношения, чтобы определить, какое количество вещества в молях будет реагировать с заданным количеством молей другого вещества или давать его.Изучение численных соотношений между реагентами и продуктами в сбалансированных химических реакциях называется стехиометрией .
6.6 Задачи молекулярной массы и массы-массыВ этом разделе вы научитесь преобразовывать массу или моль одного вещества в массу или моль другого вещества в ходе химической реакции.
Мы установили, что сбалансированное химическое уравнение сбалансировано с точки зрения молей, а также атомов или молекул.Мы использовали сбалансированные уравнения, чтобы установить соотношения, теперь в единицах молей материалов, которые мы можем использовать в качестве коэффициентов пересчета для ответа на стехиометрические вопросы, например, сколько молей вещества А реагирует с таким количеством молей реагента Б. Мы можем расширить эта техника даже дальше. Напомним, что мы можем связать молярное количество с массовым количеством, используя молярную массу. Мы можем использовать эту способность, чтобы ответить на вопросы о стехиометрии с точки зрения масс конкретного вещества в дополнение к молям. Делаем это в следующей последовательности:
Рисунок 6.6: Блок-схема для расчета преобразования молей в массу с использованием химических уравнений.
В совокупности эти преобразования называются расчетами молекулярной массы.
В качестве примера рассмотрим сбалансированное химическое уравнение
Fe
2 O 3 + 3SO 3 → Fe 2 (SO 4 ) 3Если у нас есть 3,59 моль Fe 2 O 3 , сколько граммов SO 3 может с ним вступить в реакцию? Используя последовательность расчета молекулярной массы, мы можем определить требуемую массу SO 3 в два этапа.Сначала мы строим соответствующее молярное соотношение, определенное из сбалансированного химического уравнения, для расчета необходимого количества молей SO 3 . Затем, используя молярную массу SO 3 в качестве коэффициента преобразования, мы определяем массу, которую имеет это количество молей SO 3 . Графически это представлено двумя этапами:
Первый шаг напоминает упражнения, которые мы делали в разделе 6.4 «Молочно-молекулярные отношения в химических реакциях». Как обычно, мы начинаем с того количества, которое нам дали:
Моль Fe 2 O 3 единиц аннулируют, оставляя моль SO 3 единиц.Теперь мы берем этот ответ и преобразуем его в граммы SO 3 , используя молярную массу SO 3 в качестве коэффициента преобразования:
Наш окончательный ответ выражается тремя значащими цифрами. Таким образом, в двухэтапном процессе мы обнаруживаем, что 862 г SO 3 будут реагировать с 3,59 моль Fe 2 O 3 . Таким образом можно ответить на многие проблемы этого типа.
Та же двухэтапная задача может быть решена в одной строке, а не в виде двух отдельных шагов, как показано ниже:
Мы получаем точно такой же ответ при объединении всех математических шагов вместе, как и при вычислении одного шага за раз.
Это небольшой шаг от расчета молекулярной массы к расчету массы-массы. Если мы начнем с известной массы одного вещества в химической реакции (вместо известного числа молей), мы можем вычислить соответствующие массы других веществ в реакции. Первым шагом в этом случае является преобразование известной массы в моль с использованием молярной массы вещества в качестве коэффициента преобразования. Затем – и только тогда – мы используем сбалансированное химическое уравнение, чтобы построить коэффициент преобразования, чтобы преобразовать это количество в моль другого вещества, которое, в свою очередь, может быть преобразовано в соответствующую массу.Последовательно процесс выглядит следующим образом:
Рисунок 6.7 Блок-схема проведения преобразований с использованием химических уравнений.
Этот трехэтапный процесс можно выполнить в три отдельных шага или объединить в один расчет, содержащий три коэффициента преобразования. Следующий пример иллюстрирует оба метода.
Для вашего здоровья: синтез таксола
Таксол – мощное противоопухолевое средство, которое первоначально было извлечено из тиса тихоокеанского ( Taxus brevifolia ).Как видно из прилагаемого рисунка, таксол – очень сложная молекула с молекулярной формулой C 47 H 51 NO 14 . Выделение таксола из его природного источника представляет определенные проблемы, в основном из-за того, что тихоокеанский тис является медленнорастущим деревом, и необходимо собрать шесть деревьев, эквивалентных шести деревьям, чтобы обеспечить достаточное количество таксола для лечения одного пациента. Хотя родственные виды тисов также производят таксол в небольших количествах, существует значительный интерес к синтезу этой сложной молекулы в лаборатории.
После 20-летних усилий две исследовательские группы объявили о полном лабораторном синтезе таксола в 1994 году. Однако каждый синтез требовал более 30 отдельных химических реакций с общей эффективностью менее 0,05%. Для сравнения: чтобы получить разовую дозу таксола 300 мг, вам нужно будет начать с 600 г исходного материала. Для лечения 26 000 женщин, у которых ежегодно диагностируется рак яичников с помощью одной дозы, почти 16 000 кг (более 17 тонн) исходного материала необходимо преобразовать в таксол.Таксол также используется для лечения рака груди, который ежегодно диагностируется у 200 000 женщин в Соединенных Штатах. Это только увеличивает необходимое количество исходного материала.
Очевидно, существует большой интерес к повышению общей эффективности синтеза таксола. Улучшенный синтез не только будет проще, но и будет производить меньше отходов, что позволит большему количеству людей воспользоваться этим потенциально спасительным лекарством.
Рисунок 6.8 Структура таксола лекарственного средства от рака. Из-за сложности молекулы атомы водорода не показаны, но они присутствуют на каждом атоме, чтобы дать ему правильное количество ковалентных связей (четыре связи для каждого атома углерода).
Ключевые вынос- Сбалансированное химическое уравнение может использоваться для связи масс или молей различных веществ в реакции.
Учитывая следующее несбалансированное химическое уравнение,
H 3 PO 4 + NaOH → H 2 O + Na 3 PO 4
какая масса H 2 O образуется при реакции 2.35 моль H 3 PO 4 ?
Учитывая следующее несбалансированное химическое уравнение,
C 2 H 6 + Br 2 → C 2 H 4 Br 2 + HBr
какая масса HBr образуется, если в реакцию вступает 0,884 моль C 2 H 6 ?
Определенные жиры используются для изготовления мыла. Первый шаг – реакция жира с водой с образованием глицерина (также известного как глицерин) и соединений, называемых жирными кислотами.Вот один пример:
C3H5 (OOC (Ch3) 14Ch4) 3a жир + 3h3O → C3H5 (OH) 3 глицерин + 3Ch4 (Ch3) 14COOH жирная кислота
Сколько молей глицерина можно получить в результате реакции 1 000,0 г C 3 H 5 (OOC (CH 2 ) 14 CH 3 ) 3 ?
Фотосинтез у растений приводит к общей реакции производства глюкозы (C 6 H 12 O 6 ):
6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2
Сколько молей глюкозы можно получить в результате реакции 544 г CO 2 ?
Реакции осаждения, в которых твердое вещество (называемое осадком) является продуктом, обычно используются для удаления определенных ионов из раствора.Одна из таких реакций следующая:
Ba (NO 3 ) 2 (водн.) + Na 2 SO 4 (водн.) → BaSO 4 (s) + 2NaNO 3 (водн.)
Сколько граммов Na 2 SO 4 необходимо для осаждения всех ионов бария, производимых 43,9 г Ba (NO 3 ) 2 ?
Нитроглицерин [C 3 H 5 (ONO 2 ) 3 ] получают реакцией азотной кислоты (HNO 3 ) с глицерином [C 3 H 5 (OH) 3 ] согласно этой реакции:
C 3 H 5 (OH) 3 + 3HNO 3 → C 3 H 5 (ONO 2 ) 3 + 3H 2 O
Если 87.4 г HNO 3 реагируют с избытком глицерина, какую массу нитроглицерина можно получить?
Антациды – это основания, нейтрализующие кислоты в пищеварительном тракте. Гидроксид магния [Mg (OH) 2 ] является одним из таких антацидов. Он реагирует с соляной кислотой в желудке по следующей реакции:
Mg (OH) 2 + 2HCl → MgCl 2 + 2H 2 O
Сколько граммов HCl может нейтрализовать доза 200 мг Mg (OH) 2 ?
Кислотный дождь возникает в результате реакции оксидов неметаллов с водой в атмосфере.В одной из таких реакций участвует диоксид азота (NO 2 ) и образуется азотная кислота (HNO 3 ):
3НО 2 + H 2 O → 2HNO 3 + NO
Если 1,82 × 10 13 г NO 2 попадает в атмосферу каждый год из-за деятельности человека, потенциально сколько граммов HNO 3 может производиться ежегодно?
Упрощенный вариант переработки железной руды в металлическое железо выглядит следующим образом:
2Fe 2 O 3 + 3C → 4Fe + 3CO 2
Сколько граммов C необходимо для производства 1.00 × 10 9 г Fe?
SS Hindenburg содержал около 5,33 × 10 5 г газа H 2 , когда он сгорел в Лейкхерсте, штат Нью-Джерси, в 1937 году. Химическая реакция выглядит следующим образом:
2H 2 + O 2 → 2H 2 O
Сколько граммов H 2 O было произведено?
6.7 Краткое содержание главы
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения следующих жирным шрифтом терминов в следующем резюме и спросить себя, как они соотносятся с темами в главе.
Химические реакции связаны с количеством реагентов и продуктов. Химики используют единицу моль для обозначения 6,022 × 10 23 предметов, независимо от того, являются ли эти предметы атомами элементов или молекулами соединений. Это число, называемое числом Авогадро , важно, потому что это количество атомов или молекул имеет ту же массу в граммах, что и один атом или молекула в единицах атомной массы. Молярные массы веществ могут быть определены путем суммирования соответствующих масс из периодической таблицы; окончательная молярная масса будет выражаться в граммах.
Поскольку один моль вещества будет иметь определенную массу, мы можем использовать это соотношение для построения коэффициентов преобразования, которые преобразуют количество моль в количество массы, или наоборот. Такое преобразование молярной массы из обычно занимает один алгебраический шаг.
Химические реакции содержат перечень реагентов и продуктов в молярных количествах, а не только в молекулярных количествах. Мы можем использовать коэффициенты сбалансированного химического уравнения, чтобы связать моли одного вещества в реакции с молями других веществ (стехиометрия).При вычислении молярной массы мы связываем количество молей одного вещества с массой другого вещества. В расчете массы-массы мы связываем массу одного вещества с массой другого вещества.
Дополнительные упражненияЕсли средний мужчина имеет массу тела 70 кг, из которых 60% – вода, сколько молей воды в среднем мужчине?
Если средняя женщина 60 лет.0 кг и содержит 0,00174% железа, сколько молей железа в средней женщине?
Сколько молей каждого элемента содержится в 2,67 моль каждого соединения?
- HCl
- H 2 SO 4
- Al (НЕТ 3 ) 3
- Ga 2 (SO 4 ) 3
Сколько молей каждого элемента содержится в 0,00445 моль каждого соединения?
- HCl
- H 2 SO 4
- Al 2 (CO 3 ) 3
- Ga 2 (SO 4 ) 3
Какова масса одного атома водорода в граммах? Какова масса одного атома кислорода в граммах? Соотношение этих масс 1:16, как и ожидалось?
Какова масса одного атома натрия в граммах?
Если 6.63 × 10 −6 моль соединения имеет массу 2,151 мг, какова молярная масса соединения?
Гемоглобин (молярная масса составляет примерно 64000 г / моль) является основным компонентом красных кровяных телец, которые переносят кислород и углекислый газ в организме. Сколько молей в 0,034 г гемоглобина?
- 2,67 моль H и 2,67 моль Cl
- 5.34 моль H, 2,67 моль S и 10,68 моль O
- 2,67 моль Al, 8,01 моль N и 24,03 моль O
- 5,34 моль Ga, 8,01 моль S и 32,04 моль O
H = 1,66 × 10 −24 г и O = 2,66 × 10 −23 г; да, они в соотношении 1:16.
6,8 Каталожный номер:
Материалы Главы 6 были адаптированы и изменены из следующих ресурсов Creative Commons, если не указано иное:
1.Анонимный. (2012) Введение в химию: общие, органические и биологические (V1.0). Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
2. Поулсен, Т. (2010) Введение в химию. Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://openedgroup.org/books/Chemistry.pdf
3. OpenStax (2015) Атомы, изотопы, ионы и молекулы: строительные блоки. OpenStax CNX.Доступно по адресу: http://cnx.org/contents/be8818d0-2dba-4bf3-859a-737c25fb2c99@12.
Плотность воды | Глава 3: Плотность
Тебе это нравится? Не любить это? Пожалуйста, уделите время и поделитесь с нами своим мнением. Спасибо!
Урок 3.3
Ключевые концепции
- Жидкости, как и твердые тела, обладают собственной характеристической плотностью.
- Объем жидкости можно измерить непосредственно с помощью градуированного цилиндра.
- Молекулы разных жидкостей имеют разный размер и массу.
- Масса и размер молекул в жидкости, а также то, насколько плотно они упакованы вместе, определяют плотность жидкости.
- Так же, как и твердое тело, плотность жидкости равна массе жидкости, деленной на ее объем; D = м / об.
- Плотность воды 1 грамм на кубический сантиметр.
- Плотность вещества одинакова независимо от размера образца.
Резюме
Учащиеся измеряют объем и массу воды, чтобы определить ее плотность. Затем они измеряют массу разных объемов воды и обнаруживают, что плотность всегда одинакова. Учащиеся составляют график зависимости между объемом и массой воды.
Цель
Студенты смогут измерять объем и массу воды и рассчитывать ее плотность.Студенты смогут объяснить, что, поскольку любой объем воды всегда имеет одинаковую плотность при данной температуре, эта плотность является характерным свойством воды.
Оценка
Загрузите лист активности учащегося и раздайте по одному каждому учащемуся, если это указано в упражнении. Лист упражнений будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и ваши ученики носите правильно подогнанные очки.
материалов для каждой группы
- Градуированный цилиндр, 100 мл
- Вода
- Весы с граммами (с точностью до 100 г)
- Капельница
Материалы для демонстрации
- Вода
- Два одинаковых ведра или большие емкости
Проведите демонстрацию, чтобы представить идею о плотности воды.
Материалы
- Вода
- Два одинаковых ведра или большие емкости
Подготовка учителей
Наполните одно ведро наполовину и добавьте примерно 1 стакан воды в другое.
Процедура
- Выберите ученика, который поднимет оба ведра с водой.
- Спросите студента-добровольца, какое ведро имеет большую массу.
Ожидаемые результаты
Ведро с большим количеством воды имеет большую массу.
Задайте вопрос студентам:
- В уроках 3.1 – Что такое плотность? и 3.2 – Метод вытеснения воды, плотность твердых тел определяется путем измерения их массы и объема. Как вы думаете, жидкость, такая как вода, может иметь плотность?
- Студенты должны понимать, что вода имеет объем и массу. Поскольку D = m / v, вода также должна иметь плотность.
- Как вы думаете, можно определить плотность жидкости, такой как вода?
- Ожидается, что на данный момент студенты не смогут полностью ответить на этот вопрос.Это сделано как начало расследования. Но студенты могут понять, что сначала им нужно каким-то образом определить массу и объем воды.
- Может ли и небольшое, и большое количество воды, которое поднял ваш одноклассник, иметь одинаковую плотность?
- Студенты могут указать, что ведро с большим количеством воды имеет большую массу, но больший объем. Ковш с меньшей массой имеет меньший объем. Таким образом, возможно, что разное количество воды может иметь одинаковую плотность.
Раздайте каждому учащемуся лист с упражнениями.
Учащиеся запишут свои наблюдения и ответят на вопросы о деятельности в листе действий. «Объясни это с помощью атомов и молекул» и «Возьми это». Дальнейшие разделы рабочего листа будут заполнены либо в классе, либо в группах, либо индивидуально в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Обсудите со студентами, как найти объем и массу воды.
Скажите студентам, что они попытаются найти плотность воды.
Задайте вопрос студентам:
- Какие две вещи вам нужно знать, чтобы определить плотность воды?
- Учащиеся должны понимать, что им нужен как объем, так и масса пробы воды, чтобы определить ее плотность.
- Как можно измерить объем воды?
- Предложите учащимся использовать мерный цилиндр для измерения объема в миллилитрах.Напомните учащимся, что каждый миллилитр равен 1 см 3 .
- Как можно измерить массу воды?
- Предложите учащимся использовать весы для измерения массы в граммах. Скажите студентам, что они могут набрать массу, взвесив воду. Однако, поскольку вода – это жидкость, она должна быть в каком-то контейнере. Таким образом, чтобы взвесить воду, они должны взвесить и контейнер. Объясните учащимся, что им придется вычесть массу пустого градуированного цилиндра из массы цилиндра и воды, чтобы получить массу только воды.
Попросите учащихся найти массу различных объемов воды, чтобы показать, что плотность воды не зависит от размера образца.
Вопрос для расследования
Имеет ли разное количество воды одинаковую плотность?
Материалы для каждой группы
- Градуированный цилиндр, 100 мл
- Вода
- Весы с граммами (с точностью до 100 г)
- Капельница
Процедура
- Найдите массу пустого градуированного цилиндра.Запишите массу в граммах в таблицу на рабочем столе.
Налейте 100 мл воды в мерный цилиндр. Постарайтесь быть максимально точными, убедившись, что мениск находится прямо на отметке 100 мл. Используйте пипетку, чтобы добавить или удалить небольшое количество воды.
- Взвесьте мерный цилиндр с водой. Запишите массу в граммах.
- Найдите массу только воды, вычтя массу пустого градуированного цилиндра.Запишите в таблицу массу 100 мл воды.
- Используйте массу и объем воды для расчета плотности. Запишите в таблицу плотность в г / см 3 .
- Слейте воду, пока в мерном цилиндре не будет 50 мл воды. Если вы случайно вылили слишком много воды, добавляйте воду, пока не дойдете до 50 мл.
Найдите массу 50 мл воды. Запишите массу в листе деятельности. Рассчитайте и запишите плотность.
- Затем слейте воду, пока в мерный цилиндр не будет 25 мл воды. Найдите массу 25 мл воды и запишите ее в таблицу. Рассчитайте и запишите плотность.
Таблица 1. Определение плотности различных объемов воды. Объем воды 100 миллилитров 50 миллилитров 25 миллилитров Масса мерного цилиндра + вода (г) Масса пустого градуированного цилиндра (г) Масса воды (г) Плотность воды (г / см 3 ) Ожидаемые результаты
Плотность воды должна быть близка к 1 г / см 3 .Это верно для 100, 50 или 25 мл.
Задайте вопрос студентам:
- Посмотрите на свои значения плотности на диаграмме. Кажется ли, что плотность разных объемов воды примерно одинакова?
- Помогите учащимся увидеть, что большинство различных значений плотности составляют около 1 г / см 3 . Они могут задаться вопросом, почему их значения не равны 1 г / см 3 . Одной из причин могут быть неточности в измерениях. Другая причина в том, что плотность воды меняется в зависимости от температуры.Вода наиболее плотная при 4 ° C и при этой температуре имеет плотность 1 г / см 3 . При комнатной температуре около 20–25 ° C плотность составляет около 0,99 г / см 3 .
- Какова плотность воды в г / см3?
- Ответы учащихся могут быть разными, но в большинстве случаев их значения должны составлять около 1 г / см. 3 .
Попросите учащихся построить график своих результатов.
Помогите учащимся составить диаграмму из данных в их листе деятельности.Ось X должна быть объемом, а ось Y – массой.
Когда учащиеся наносят на график свои данные, должна быть прямая линия, показывающая, что по мере увеличения объема масса увеличивается на ту же величину.
Обсудите наблюдения, данные и графики учащихся.
Задайте вопрос студентам:
- Используйте свой график, чтобы найти массу 40 мл воды. Какова плотность этого объема воды?
- Масса 40 мл воды 40 грамм.Поскольку D = m / v и mL = cm 3 , плотность воды составляет 1 г / см 3 .
- Выберите объем от 1 до 100 мл. Используйте свой график, чтобы найти массу. Какова плотность этого объема воды?
- Вне зависимости от того, весят ли учащиеся 100, 50, 25 мл или любое другое количество, плотность воды всегда будет 1 г / см. 3 .
Скажите студентам, что плотность – это характерное свойство вещества. Это означает, что плотность вещества одинакова независимо от размера образца.
Задайте вопрос студентам:
- Является ли плотность характерным свойством воды? Откуда вы знаете?
- Плотность – характерное свойство воды, потому что плотность любого образца воды (при той же температуре) всегда одинакова. Плотность 1 г / см 3 .
Объясните, почему плотность воды любого размера всегда одинакова.
Спроецируйте изображение Плотность воды.
Все молекулы воды имеют одинаковую массу и размер. Молекулы воды также расположены довольно близко друг к другу. Они упакованы одинаково во всей пробе воды. Итак, если объем воды имеет определенную массу, удвоенный объем будет иметь удвоенную массу, трехкратный объем будет иметь трехкратную массу и т. Д. Независимо от того, какой размер пробы воды вы измеряете, соотношение между массой и объемом всегда будет таким же. Поскольку D = m / v, плотность одинакова для любого количества воды.
Спроектируйте анимацию «Жидкая вода».
Молекулы воды всегда в движении. Но в среднем они все упакованы одинаково. Следовательно, соотношение между массой и объемом одинаково, а плотность одинакова. Это верно независимо от размера выборки или от того, где вы ее выбрали.
Попросите учащихся подумать, совпадает ли плотность большого куска твердого вещества с плотностью меньшего куска.
Дайте учащимся время, чтобы вычислить плотность каждого из трех образцов, нарисованных на их рабочих листах, и ответить на соответствующие вопросы.
Задайте вопрос студентам:
- Плотность жидкости одинакова независимо от размера образца. Может ли это быть верно и для твердых тел? Чтобы выяснить это, вычислите плотность каждого из трех образцов.
- Да. Плотность твердого вещества одинакова независимо от размера образца.
- Образец А имеет массу 200 г. Какова плотность образца А?
- D = м / об
- D = 200 г / 100 см 3
- D = 2 г / см 3
- Если разрезать образец A пополам и посмотреть только на одну половину, получится образец B. Какова плотность образца B?
- Если учащиеся не знают, какова масса, скажите им, что это половина массы образца А.Поскольку образец A был 200 г, образец B составляет половину объема и, следовательно, половину массы (100 г).



 Записываем краткое условие задачи
Записываем краткое условие задачи Находим
массовую (объёмную) долю выхода продукта по формуле
Находим
массовую (объёмную) долю выхода продукта по формуле Запишем
УХР. Расставим коэффициенты.
Запишем
УХР. Расставим коэффициенты. Запишем
УХР. Расставим коэффициенты.
Запишем
УХР. Расставим коэффициенты.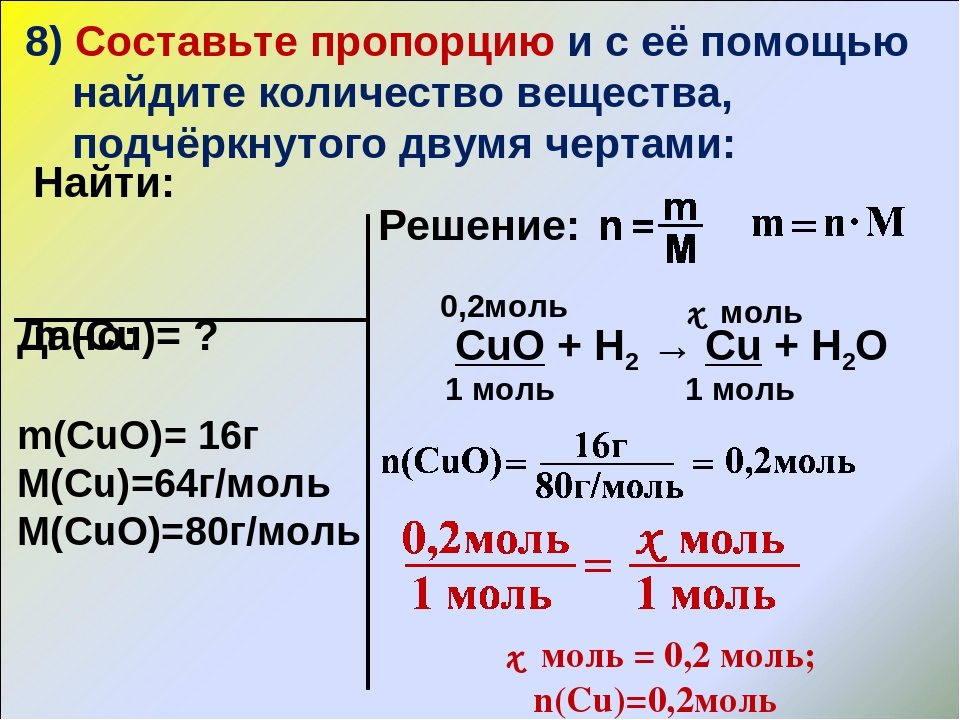
 Выпавший осадок отфильтровали, высушили, взвесили. Его масса оказалась равной 4,75 г. Вычислить выход продукта реакции (в процентах) от теоретически возможного.
Выпавший осадок отфильтровали, высушили, взвесили. Его масса оказалась равной 4,75 г. Вычислить выход продукта реакции (в процентах) от теоретически возможного. Практически же получено 0,0475 моль CaCO3, что составит:
Практически же получено 0,0475 моль CaCO3, что составит:


 Из этого уравнения следует, что из 1 моль магния можно получить 1 моль хлорида магния, а, значит, из данных 1,5 моль магния можно теоретически получить столько же, то есть 1,5 моль хлорида магния. А практически получено лишь 1,35 моль. Поэтому выход хлорида магния (в %) от теоретически возможного составит:
Из этого уравнения следует, что из 1 моль магния можно получить 1 моль хлорида магния, а, значит, из данных 1,5 моль магния можно теоретически получить столько же, то есть 1,5 моль хлорида магния. А практически получено лишь 1,35 моль. Поэтому выход хлорида магния (в %) от теоретически возможного составит:


 (КОН) = 5,38 г / 5,6 г * 100% = 96%
(КОН) = 5,38 г / 5,6 г * 100% = 96%