Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева – HIMI4KA
ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
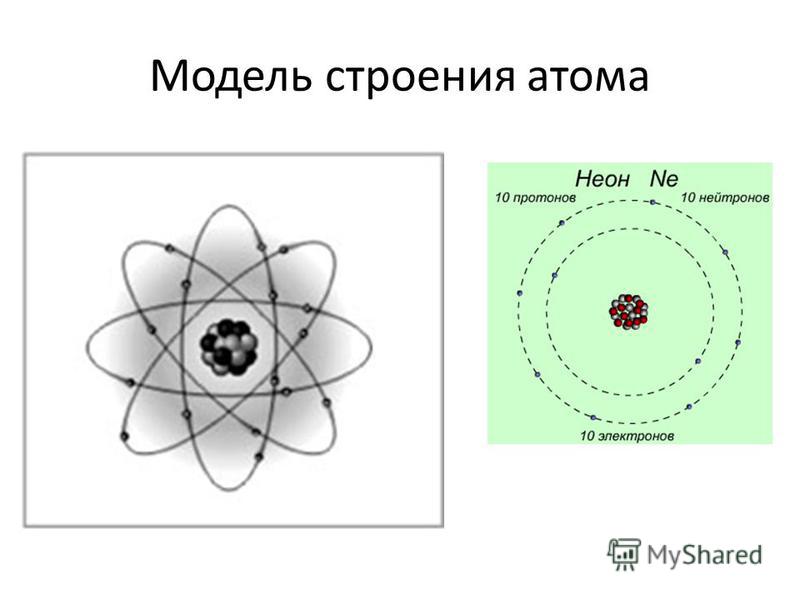
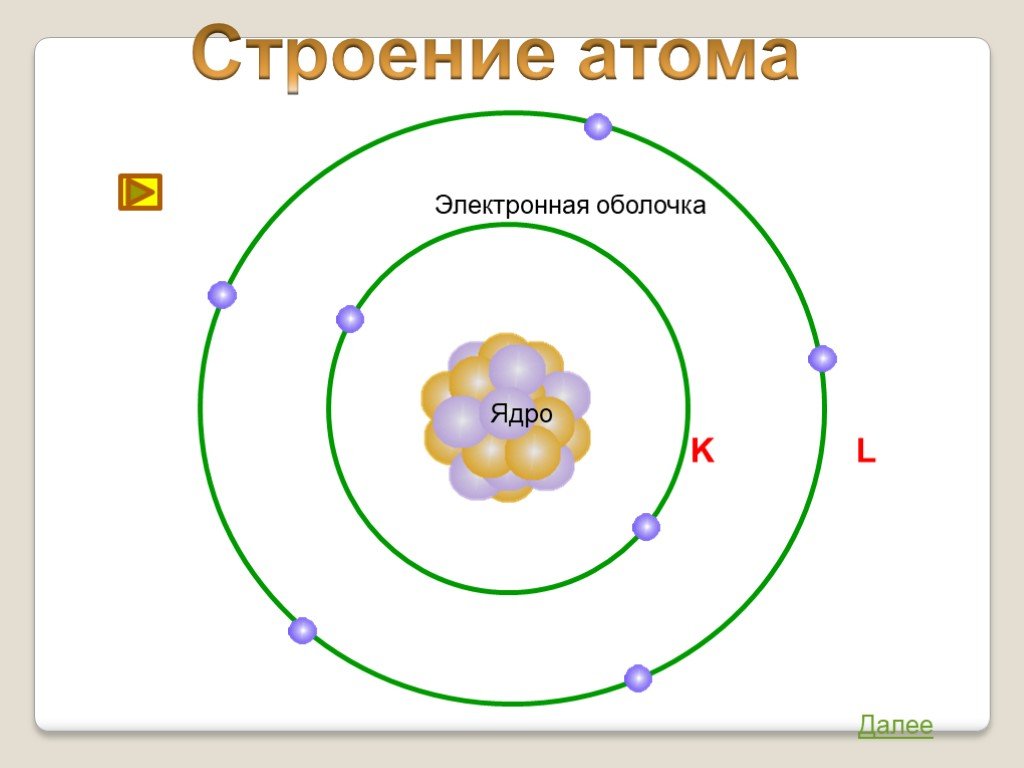
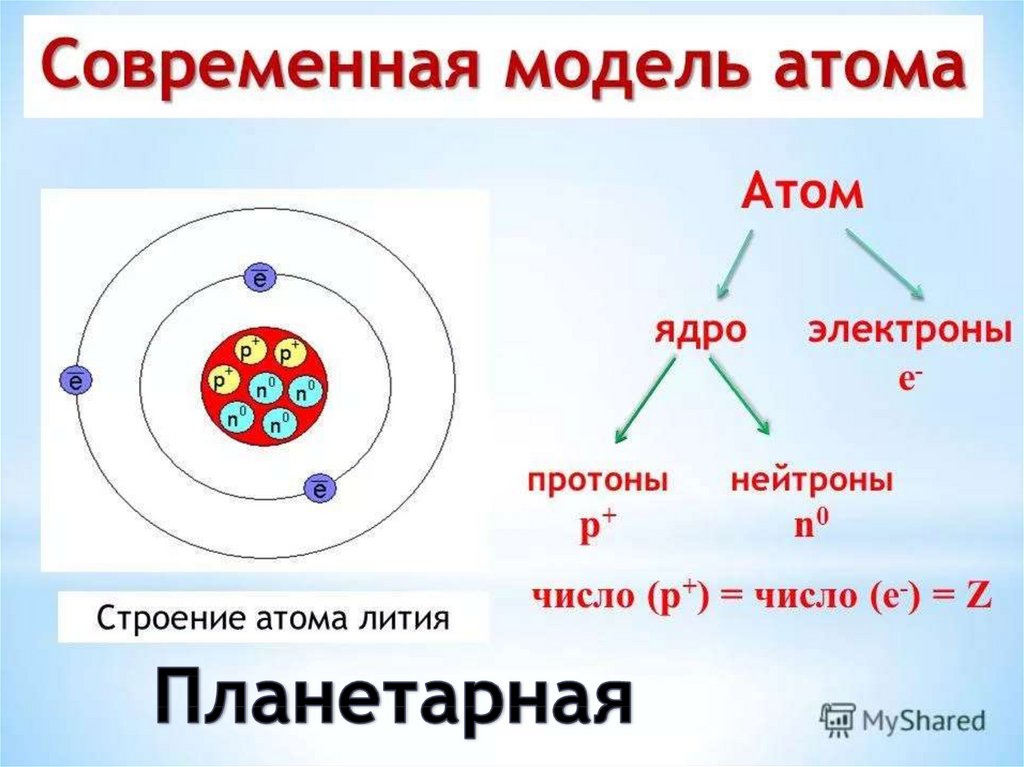
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:
Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е–) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д. И. Менделеева.
И. Менделеева.
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.
Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.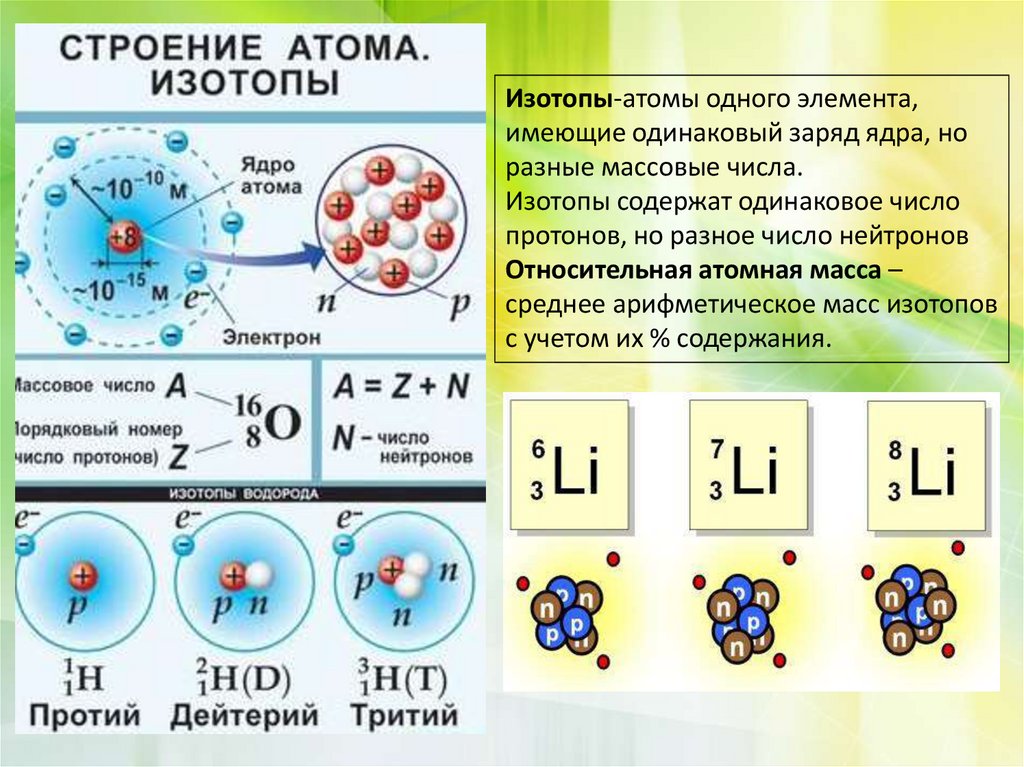
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1?
- Li
- Na
- K
- Cl
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns2np4
- ns2np2
- ns2np3
- ns2np6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания1. Общее число s-электронов в атоме кальция равно
1) 20
2) 40
3) 8
4) 6
2. Число спаренных p-электронов в атоме азота равно
Число спаренных p-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
3. Число неспаренных s-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
4. Число электронов на внешнем энергетическом уровне атома аргона равно
1) 18
2) 6
3) 4
4) 8
5. Число протонов, нейтронов и электронов в атоме 94Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s22s22p4 образует летучее водородное соединение, формула которого
1) ЭН
2) ЭН2
3) ЭН3
4) ЭН4
9. Число электронных слоёв в атоме химического элемента равно
Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s22s22p63s23p64s1, образует оксид состава
1) Li2O
2) MgO
3) K2O
4) Na2O
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns2np4 соответствует атому
Электронная конфигурация ns2np4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
1) 1
3) 3
2) 2
4) 4
20. В атоме кислорода в основном состоянии число спаренных электронов равно
В атоме кислорода в основном состоянии число спаренных электронов равно
1) 2
3) 4
2) 8
4) 6
Ответы
Периодический закон и Периодическая система химических элементов Д.И. Менделеева →
← Урок 42. Взаимосвязь между классами неорганических веществ
Состав и строение атома. Изотопы – методическая разработка для учителей, Хасанова Гульзира Жумагалиевна
|
Цели урока: |
Все учащиеся смогут – понимать модель строения атома. Большинство учащихся сможет – объяснять поведение потока протонов, нейтронов и электронов в электрическом поле. Некоторые учащиеся могут – анализировать существовавшие в различные периоды времени модели атома, определяя преимущества и недостатки каждой модели. |
|
Критерии оценивания: |
Учащиеся, достигнут целей обучения если: – Определять и описывать протоны, нейтроны и электроны с точки зрения их относительного заряда и относительной массы. – Описывать распределение массы и заряда внутри атома. – Понять модель строения атома. – Прогнозировать поведение потока протонов, нейтронов и электронов в электрическом поле. |
|
Языковые цели: |
Учащиеся смогут описывать строение атома, используя термины, специфичные для данной темы. Лексика и терминология, специфичная для предмета: Атом, нейтральный, ядро, протон, нейтрон, электрон, заряд, относительная масса, планетарная модель. Полезные выражения для диалогов и письма: В состав атома… входит… |
|
Межпредметные связи: |
История (работа с историческими фактами, различные этапы развития строения атома). Физика – строение атома, ядро, заряд, электрическое поле. |
|
Предварительные знания: |
Вещество, элемент, молекула, атом. |
Ход урока
|
|
Деятельность на уроке |
Ресурсы |
|
Орг. момент |
Приветствие учащихся Объединение в группы Психологический настрой «Моя минута» – диагностика работоспособности Тема «Состав и строение атома. Изотопы.» Критерий на доске – Определять и описывать протоны, нейтроны и электроны с точки зрения их относительного заряда и относительной массы – Описывать распределение массы и заряда внутри атома – Понять модель строения атома – Прогнозировать поведение потока протонов, нейтронов и электронов в электрическом поле |
https://twig-bilim. |
|
Вводная часть |
Задание группам: обсудить полученную информацию. Взаимооценка. Задание 1 (парная работа) https://bilimland.kz/ru/courses/chemistry-ru/obshaya-ximiya/stroenie-atoma/lesson/atomisticheskie-teorii Истина или ложь. Демонстрация у доски |
Ранняя теория атомов Демокрита https://bilimland.kz/ru/courses/chemistry-ru/obshaya-ximiya/stroenie-atoma/lesson/atomisticheskie-teorii (52 сек) Атомная теория Дальтона http://bilimland.kz/ru/content/lesson/10122-atomisticheskie_teorii (48 сек) Модель пудинга Томсона http://bilimland.kz/ru/content/lesson/10122-atomisticheskie_teorii (55 сек) Модель атома Резерфорда http://bilimland. |
|
Основная часть |
Творческое задание. Составить модель неизвестного атома, предложить другой группе для определения атома элемента. Взаимооценка. |
Видеоматериал: заряд ядра. https://bilimland.kz/ru/subject/ximiya/7-klass/sostav-i-stroenie-atoma-izotopy 0:51 сек |
|
Задание 2 (парная работа) https://bilimland.kz/ru/subject/ximiya/7-klass/sostav-i-stroenie-atoma-izotopy Определи массовые числа Взаимооценка |
Изотопы https://bilimland.kz/en/courses/chemistry-en/general-chemistry/atoms-and-molecules/lesson/isotopes page 2-3 1:00+0:42 |
|
|
Путем обсуждения выделить из группы самого креативного, активного, позитивного, идейного, мыслящего ученика. |
Прибавить один балл за СОР№3 |
|
|
Рефлексия «Мои открытия на уроке» |
Учащимся предлагается подумать и закончить предложения: я для себя сделал открытие…, меня удивило…, оказывается, что… Дети могут высказываться или написать на стикерах. |
Веселая минутка «Best way to learn the elements» 2 мин |
|
Домашняя работа |
§ 7, «Характеристики атомов». https://bilimland.kz/ru/subject/ximiya/7-klass/sostav-i-stroenie-atoma-izotopy |
Q16 Кратко опишите строение атома…
Перейти к
- Объективные вопросы – я
- Вопросы с короткими/длинными ответами – I
- Объективные вопросы – II
- Иметь значение
- Физические величины и измерения
- Сила и давление
- Энергия
- Световая энергия
- Теплопередача
- Звук
- Электричество
Главная > Селина Солюшнс Класс 8 Физика >
Вопрос 16 Вопросы с короткими/длинными ответами – II
Q16) Кратко опишите строение атома.
Ответ:
Решение:
В атоме одинаковое количество протонов (положительный заряд) и электронов (отрицательный заряд). У него есть нейтроны, которые присутствуют в ядре вместе с протонами. Электроны продолжают вращаться вокруг ядра в оболочках.
Связанные вопросы
Q1) Что вы понимаете под электричеством в состоянии покоя?
В2) Почему пластиковая расческа, натертая о сухие волосы, притягивает кусочки бумаги?
Q3) Кто открыл способ получения электричества трением?
Q4) Назовите два вещества, которые могут быть заряжены трением.
Q5) Каковы два вида сборов?
Q6) Стеклянная палочка натирается шелком. Укажите вид заряда, полученного каждым из них.
Укажите вид заряда, полученного каждым из них.
Фейсбук WhatsApp
Копировать ссылку
Было ли это полезно?
Упражнения
Объективные вопросы – I
Короткие/длинные вопросы ответа – I
Объективные вопросы – II
Короткие/длинные вопросы ответа – II
Главы
Маттер
Физические величины и измерения
Сила и давление
Energy
Энергия света
Теплопередача
Звук
Электричество
Курсы
Быстрые ссылки
Условия и политика
Условия и политика
2022 © Quality Tutorials Pvt Ltd Все права защищены
Основная структура атома
Химия и наша Вселенная
22 декабря 2016 г. Наука
Наука
В этой лекции вы узнаете, как эти частицы были открыты, и как кульминация нескольких поколений научной работы в конечном итоге привела к нашему пониманию самой фундаментальной единицы материи: атома.
Атомы состоят из 3 типов частиц, называемых субатомными частицами: положительно заряженные протоны, отрицательно заряженные электроны и нейтроны, которые не имеют заряда. Протоны и нейтроны имеют почти одинаковую массу и находятся в плотном ядре в центре атома. Но гораздо меньшие отрицательно заряженные электроны вращаются вокруг этого ядра, уравновешивая положительный заряд, обеспечиваемый протонами.
ПРОИСХОЖДЕНИЕ АТОМНОЙ ТЕОРИИ- Понятие об атомах было впервые выдвинуто древнегреческими философами, постулировавшими, что существует всего несколько основных веществ, которые комбинируются различными способами, образуя все остальные.
 Греки широко полагали, что этими элементами являются воздух, вода, земля и огонь, а также считали, что частицы этих элементов абсолютно неделимы.
Греки широко полагали, что этими элементами являются воздух, вода, земля и огонь, а также считали, что частицы этих элементов абсолютно неделимы.
- Сегодня мы знаем, что ни один из них на самом деле не является элементом, и мы также знаем, что атомы истинных элементов на самом деле могут быть разделены, но они превращаются в новый элемент, когда они есть. Тем не менее, греческий термин «атом», означающий «неделимый», прижился и до сих пор используется для обозначения наименьшего количества данного элемента, которое может существовать.
- Дискуссии о природе материи и ее основных единицах почти прекратились с падением Древней Греции, и только в начале 19 -го века Концепция атома была возрождена, прежде всего, в результате работ Джона Дальтона. У Дальтона не было сложного научного оборудования, которое есть у нас сегодня, поэтому у него не было возможности непосредственно наблюдать атомы или экспериментировать с ними.
 Однако у него был острый ум и польза от работ Антуана Лавуазье и других.
Однако у него был острый ум и польза от работ Антуана Лавуазье и других.
- Используя относительно простые наблюдения, Дальтон смог сформулировать надежную атомную теорию. Он обнаружил, что когда 2 элемента объединяются в соединение, масса всех продуктов равна массе всех исходных материалов. Это закон сохранения массы.
- Он также обнаружил, что когда 2 элемента объединяются, образуя более одного соединения, веса одного из элементов, которые соединяются с фиксированным весом другого, находятся в соотношении очень простых целых чисел. Это закон кратных пропорций.
- Именно комбинация этих двух законов дала Дальтону неопровержимый аргумент в пользу существования неделимых атомов, которые объединяются в этих простых соотношениях целых чисел для создания молекул.
- Но у Дальтона не было возможности эффективно исследовать структуры предложенных им атомов. Его наблюдения подтвердили их существование, но они не могли точно объяснить, из чего состоят сами атомы.
 Нам придется подождать еще столетие, прежде чем технологии догонят атом и дадут нам возможность изучить внутреннюю работу этого замечательного творения природы.
Нам придется подождать еще столетие, прежде чем технологии догонят атом и дадут нам возможность изучить внутреннюю работу этого замечательного творения природы.
- Первым из этих достижений является электронно-лучевая трубка, которая была разработана в конце 19 го века и использовалась в телевизорах вплоть до десяти лет назад. Электронно-лучевые трубки сыграли важную роль в развитии человеческого понимания атомов.
- Используя электронно-лучевую трубку, Дж. Дж. Томсон смог создать изолированные пучки чистых электронов, измеряя их массу, скорость и заряд. Измерения Томсона привели его к поразительному выводу: электроны намного меньше атомов.
- Это привело Томсона к предложению первой структурной модели атома. Спустя более 100 лет после того, как Дальтон вновь популяризировал концепцию атомов, наконец была предпринята первая попытка объяснить их строение. Томсон постулировал, что атомы состоят из маленьких отрицательно заряженных электронов, которые он наблюдал, встроенных в положительно заряженную сферическую матрицу очень низкой плотности, составляющую остальную часть его массы.

- Эскиз этой модели с электронами, присыпанными положительно заряженной сферой, вызывает образ изюма в миске с пудингом, за что получил прозвище модели сливового пудинга Томсона.
- Но эта первая попытка объяснить строение атома была недолгой, потому что менее чем через 2 десятилетия после того, как Томсон предложил модель сливового пудинга, его протеже Эрнест Резерфорд провел эксперимент, который намеревался развить модель Томсона, но вместо этого опроверг ее. Это.
- Резерфорду приписывают открытие так называемых альфа-частиц, которые представляют собой гораздо более крупные заряженные частицы (более чем в 1000 раз больше электронов), образующиеся при радиоактивном распаде урана. Но Резерфорд наиболее известен не тем, что открыл эти частицы, а тем, что он сделал с ними дальше.
- Резерфорду было любопытно узнать, как эти относительно большие энергичные частицы будут взаимодействовать с атомами при прохождении через тонкую фольгу, поэтому он направил пучок альфа-частиц на кусок золотой фольги, окружив фольгу особым флуоресцентным светом.
 экран, который загорался бы при попадании альфа-частицы. Предполагая, что модель Томсона верна, ожидалось, что альфа-частицы просто пройдут сквозь фольгу, лишь слегка рассеявшись, если вообще рассеются.
экран, который загорался бы при попадании альфа-частицы. Предполагая, что модель Томсона верна, ожидалось, что альфа-частицы просто пройдут сквозь фольгу, лишь слегка рассеявшись, если вообще рассеются.
- В ходе эксперимента он заметил, что самое яркое пятно находится прямо за золотой фольгой, как он и ожидал. Но Резерфорд был ошеломлен, когда обратил свое внимание на другую сторону экрана и увидел, что несколько частиц отклонились почти прямо назад к источнику.
- Очевидно, что модель Томсона неверна. Если бы масса атомов золота была распределена по всему их объему, то альфа-частица никак не могла отразиться обратно к источнику.
- Результаты Резерфорда убедительно показали, что атомы состоят в основном из пустого пространства, а высококонцентрированное ядро содержит большую часть его массы лишь в небольшой части общего объема атома. Это могло бы объяснить, почему в редких случаях альфа-частица отскакивала назад. Только чрезвычайно плотная точка материи, занимающая небольшой объем от всего атома, могла бы выдержать удар альфа-частицы и заставить ее отрикошетить назад в своем первоначальном направлении.

- Итак, в центре атомов должна была быть чрезвычайно плотная, но исчезающе малая точка массы. Тогда Резерфорд понял, что атомы в основном состоят из пустого пространства с плотной точкой массы в их центре. Его модель, которая объясняет это, была названа моделью Резерфорда, иногда также называемой ядерной моделью, потому что она впервые признала, что большая часть массы атома находится в маленьком плотном ядре в его центре.
- Резерфорд открыл, что атомы состоят из плотного положительно заряженного ядра, окруженного очень легкими отрицательно заряженными электронами. Хотя атомы имеют диаметр около 100 пикометров, или около одной десятой нанометра, работа Резерфорда в конечном итоге привела к открытию, что радиус типичного ядра составляет лишь около 1/100 000 радиуса его электронного облака, то есть 1 фемтометр. , или 0,000001 нм.
- Резерфорд определил, что массивные положительно заряженные частицы сосредоточены в ядре атома. Протоны были открыты.

- По мере продолжения исследований радиоактивности некоторые наблюдения атомных ядер не совпадали. В частности, исследователи облучили бериллий альфа-частицами, чтобы получить новый вид излучения — такое, которое не отскакивает от ядер, как альфа-частицы Резерфорда, а вместо этого врезается в них с силой, выбивая протоны из атомов-мишеней.
- Окончательный ключ к пониманию этих необычных наблюдений был получен в 1932 году, когда Джеймс Чедвик, бывший ученик одного из помощников Резерфорда, завершил инвентаризацию субатомных частиц. Чедвик рассудил, что излучение бериллия лучше проникает в другие атомные ядра, потому что оно не заряжено.
- В то время как альфа-частицы, используемые Резерфордом, несли положительный заряд и отталкивались от положительных ядер атомов, с которыми они сталкивались, отбрасывая их назад, эти новые частицы, хотя и массивные, должны быть незаряженными.
- Отсутствие электростатического отталкивания позволяло этим новым частицам сталкиваться с другими ядрами с большой силой — силой, которую Чедвик использовал для оценки массы одной из этих новых частиц, которую он назвал нейтронами.
 Неудивительно, что они были всего на долю процента больше, чем протоны.
Неудивительно, что они были всего на долю процента больше, чем протоны.
- Поскольку протоны и нейтроны очень похожи по массе и составляют почти всю массу атома, химики используют единицу массы, называемую атомной единицей массы (а.е.м.), чтобы сравнивать массы атомов друг с другом.
- К 1932 году объединенные мысли древних греков, Дальтона, Томсона, Резерфорда, Чедвика и многих других привели нас к пониманию атомной структуры, которая выглядит примерно так, как мы увидеть сегодня в популярных изображениях атома.
- Все атомы состоят из плотного центрального ядра материи, называемого ядром. В этом ядре находится один или несколько протонов. В случае с водородом есть только один. Атом элемента водорода является простейшим атомом.
- Вокруг этого плотного положительно заряженного ядра находятся электроны. В случае водорода только один электрон уравновешивает положительный заряд протона в ядре.
 Это полный атом водорода с ядром и электронным облаком вокруг него. Мы иногда называем эту версию водорода протием, потому что его ядро содержит всего один протон.
Это полный атом водорода с ядром и электронным облаком вокруг него. Мы иногда называем эту версию водорода протием, потому что его ядро содержит всего один протон.
- Количество протонов в ядре определяет их идентичность, поэтому мы можем добавить нейтрон к атому водорода и все равно получить водород. Но при этом масса атома водорода примерно в два раза превышает его первоначальную массу. Мы называем этот тип водорода — тот, в котором также присутствует нейтрон, что делает его более массивным, — дейтерием.
- Мы можем снова увеличить массу атома водорода, добавив еще один нейтрон, чтобы получить тритий — еще одну форму водорода, масса которой в 3 раза больше его простейшей формы. Все 3 из этих атомов являются водородом, но они различаются массой. Мы называем эти атомы изотопами друг друга.
- Если мы добавим еще один протон к ядру атома и еще один электрон к его облаку, чтобы сбалансировать заряд, мы получим новый элемент, потому что число протонов в ядре изменилось.




 kz/ru/film/what-is-an-atom
kz/ru/film/what-is-an-atom kz/ru/content/lesson/10122-atomisticheskie_teorii (1:34+0:29)
kz/ru/content/lesson/10122-atomisticheskie_teorii (1:34+0:29)
 Греки широко полагали, что этими элементами являются воздух, вода, земля и огонь, а также считали, что частицы этих элементов абсолютно неделимы.
Греки широко полагали, что этими элементами являются воздух, вода, земля и огонь, а также считали, что частицы этих элементов абсолютно неделимы.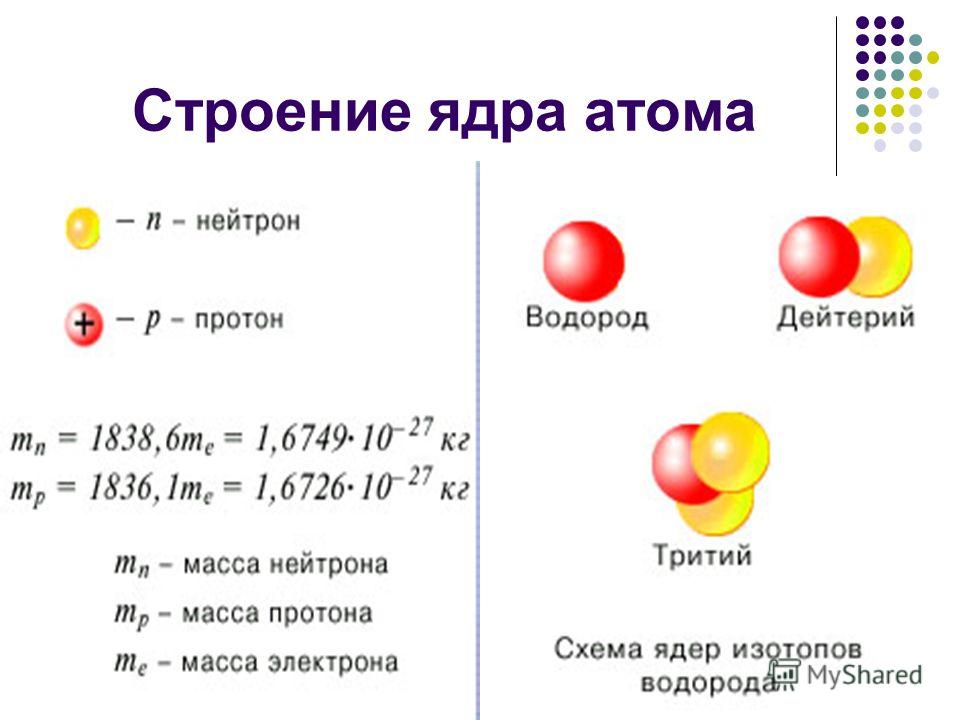 Однако у него был острый ум и польза от работ Антуана Лавуазье и других.
Однако у него был острый ум и польза от работ Антуана Лавуазье и других. Нам придется подождать еще столетие, прежде чем технологии догонят атом и дадут нам возможность изучить внутреннюю работу этого замечательного творения природы.
Нам придется подождать еще столетие, прежде чем технологии догонят атом и дадут нам возможность изучить внутреннюю работу этого замечательного творения природы.
 экран, который загорался бы при попадании альфа-частицы. Предполагая, что модель Томсона верна, ожидалось, что альфа-частицы просто пройдут сквозь фольгу, лишь слегка рассеявшись, если вообще рассеются.
экран, который загорался бы при попадании альфа-частицы. Предполагая, что модель Томсона верна, ожидалось, что альфа-частицы просто пройдут сквозь фольгу, лишь слегка рассеявшись, если вообще рассеются.

 Неудивительно, что они были всего на долю процента больше, чем протоны.
Неудивительно, что они были всего на долю процента больше, чем протоны. Это полный атом водорода с ядром и электронным облаком вокруг него. Мы иногда называем эту версию водорода протием, потому что его ядро содержит всего один протон.
Это полный атом водорода с ядром и электронным облаком вокруг него. Мы иногда называем эту версию водорода протием, потому что его ядро содержит всего один протон.