Урок 11. обзор металлических элементов а- и в-групп – Химия – 11 класс
Химия, 11 класс
Урок № 11. Обзор металлических элементов А- и B-групп
Перечень вопросов, рассматриваемых в теме: урок посвящён характеристике металлов А- и B-групп периодической системы химических элементов Д. И. Менделеева. Учащиеся получат представление о химических свойствах металлов в связи со строением их атомов
Глоссарий
d-элементы – элементы, в атомах которых заполняется d-подуровень.
p-элементы – элементы, в атомах которых заполняется p-подуровень.
s-элементы – элементы, в атомах которых заполняется s-подуровень.
Интерметаллид (интерметаллическое соединение) – химическое соединение двух или более металлов.
Полупроводники – материалы, по своей удельной проводимости занимающие промежуточное место между проводниками и диэлектриками.
«Провал» электрона – переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций.
Сверхпроводники – материалы, электрическое сопротивление которых при понижении температуры до некоторой величины становится равным нулю.
Щелочноземельные металлы – химические элементы 2А группы периодической таблицы элементов.
Щелочные металлы – элементы 1А группы периодической таблицы химических элементов.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс].
 М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Обзор металлических элементов А- и B-групп
- Химические свойства металлических элементов А-групп
Атомы металлических s- и p-элементов, обладая гораздо большим радиусом по сравнению с атомами неметаллов, способны только отдавать валентные электроны, проявляя восстановительные свойства.
Металлы вступают в реакции как с простыми, так и со сложными веществами.
Взаимодействие металлов с простыми веществами
Реакции металлов с галогенами и кислородом протекают очень энергично.
0 0 t +1 -1
2 Na + Cl2 = 2NaCl
0 0
2Al + 3Cl2 = 2AlCl3
0 0 t +2 -2
2Mg + O2 = 2MgO
0 0 t +3 -2
4Al + 3O2 = 2Al2O3
Не так энергично идет реакция с серой.
0 0 t +1 -2
2Na + S = Na2S
0 0 t +3 -2
2Al + 3S = Al2S3
Гораздо труднее идет взаимодействие с азотом и фосфором.
0 0
3Mg + N2 = Mg3N2
0 0 t +2 -3
3Ca + 2P = Ca3P2
При определенных условиях возможно также восстановление металлами водорода с образованием гидридов.
0 0 t +2 -1
Ca + H2 = CaH2
Металлы способны также взаимодействовать с другими металлами, образуя интерметаллические соединения. Многие интерметаллиды используются в технике как сильные магниты, полупроводники, сверхпроводники.
Взаимодействие металлов со сложными веществами
С водой при комнатной температуре взаимодействуют щелочные и щелочноземельные металлы (от Cs до Ca), а при нагревании – менее активные (от Mg до Sn).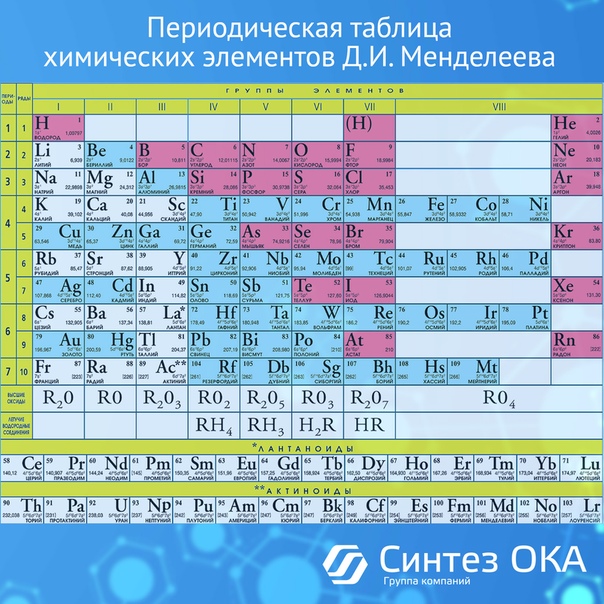
0 +1 +2 0
Ca + 2HOH = Ca(OH)2 + H2↑
0 +1 t +2 0
Mg + 2H2O = MgO + H2↑
Металлы, расположенные в ряду напряжений до водорода, восстанавливают ионы водорода из разбавленных кислот (кроме азотной).
0 +1 +2 0
Mg + H2SO4 = MgSO4 + H2↑
Одни металлы восстанавливают другие из водных растворов солей, если первые расположены левее вторых в ряду стандартных электродных потенциалов.
0 +2 +3 0
2Al + 3Pb(NO3)2 = 2Al(NO3)3 + 3Pb
Не нужно забывать, что такие сильные восстановители как Li, Na, K, Ca будут восстанавливать не металл из соли, а водород из воды.
- Химические свойства металлических элементов B-групп
Металлические элементы B-групп принадлежат к d-элементам. В их атомах заполняются d-орбитали предвнешнего энергетического уровня. Поскольку структура внешнего уровня d-элементов одного периода одинакова (1-2 s-электрона), а радиусы атомов имеют близкие значения, то и свойства атомов d-элементов изменяются в периоде слева направо более медленно по сравнению с s- и p-элементами. У атомов некоторых элементов (например, Cr, Cu) в результате «провала» наружных электронов на внешнем уровне остается по одному электрону, что и определяет их свойства.
В их атомах заполняются d-орбитали предвнешнего энергетического уровня. Поскольку структура внешнего уровня d-элементов одного периода одинакова (1-2 s-электрона), а радиусы атомов имеют близкие значения, то и свойства атомов d-элементов изменяются в периоде слева направо более медленно по сравнению с s- и p-элементами. У атомов некоторых элементов (например, Cr, Cu) в результате «провала» наружных электронов на внешнем уровне остается по одному электрону, что и определяет их свойства.
В B-группах радиусы атомов в направлении сверху вниз изменяются неравномерно, и восстановительные свойства (за некоторыми исключениями) уменьшаются.
В то же время у металлических элементов B-групп прослеживаются и некоторые общие закономерности, такие как:
- совпадение максимальной положительной степени окисления у p-элементов 3-7 B-групп с номером группы;
- образование некоторыми d-элементами (Ru, Os) соединений, в которых их максимальная степень окисления +8 совпадает с номером группы;
- ослабление основных и усиление кислотных свойств с увеличением степени окисления атомов металлов B-групп.

ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на расчеты по уравнению реакции
Условие задачи: При взаимодействии 3,12 г одновалентного металла с водой выделилось 0,896 л водорода. Определите этот металл. Ответ дайте в виде химического символа.
Шаг первый: Запишем уравнение реакции металла с водой, зная, что металл одновалентен
2Me + 2H2O = 2MeOH + H2↑
Шаг второй: Найдем количество вещества металла.
По уравнению реакции
n(Me) = 2n(h3)
n(h3) = 0,896/22.4=0.4 моль
n(Me) = 2 х 0.04 = 0,08 моль
Шаг третий: Вычислим молярную массу металла
M(Me) = m/n(Me) = 3,12/0,08 = 39 г/моль
Шаг четвёртый: С помощью таблицы Менделеева найдем металл с соответствующей относительной атомной массой, численно совпадающей с молярной. Этот металл – калий.
Ответ: K
2.
Условие задачи: В лаборатории химика имеется порошок желто-коричневого цвета, который при попадании в воду издает сильный чесночный запах. Какое вещество представляет собой порошок, если он получен в результате реакции между алюминием и селеном, протекающей аналогично реакции алюминия с серой или кислородом? Укажите формулу данного вещества.
Шаг первый: Запишем уравнения реакций алюминия с серой и кислородом
2Al + 3S = Al2S3
4Al + 3O2 = 2Al2O3
Шаг второй: аналогичным образом запишем уравнение реакции алюминия с селеном.
2Al + 3Se = Al2Se3
Это селенид алюминия.
Ответ: Al2Se3
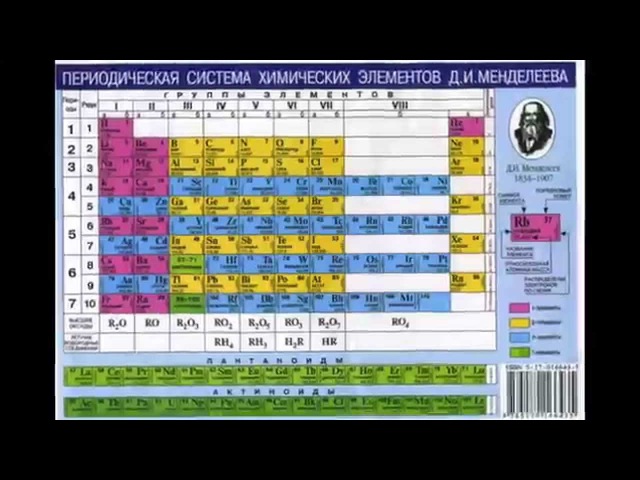
Периодическая система химических элементов Д. И. Менделеева. Группы
Периодическая система химических элементов Д. И. Менделеева. Группы☰
Группами называют вертикальные колонки периодической системы химических элементов. В коротком варианте таблицы выделяют восемь групп. Номер группы совпадает с высшей валентностью химического элемента, которую он может проявлять в оксидах. Так, углерод, находясь в IV группе, проявляет в соединении с кислородом высшую валентность IV (CO2). Кальций же валентен II (CaO), так как находится во второй группе.
В коротком варианте таблицы выделяют восемь групп. Номер группы совпадает с высшей валентностью химического элемента, которую он может проявлять в оксидах. Так, углерод, находясь в IV группе, проявляет в соединении с кислородом высшую валентность IV (CO2). Кальций же валентен II (CaO), так как находится во второй группе.
В коротком варианте таблицы каждую группу делят на две подгруппы — главную и побочную. В побочную подгруппу входят только элементы больших периодов — переходные металлы.
В длинном варианте периодической системы подгрупп нет, а количество групп равно 18.
В коротком варианте таблицы группы обозначают римскими цифрами, а подгруппы буквами A (главная) и B (побочная). В длинном варианте группы обозначаются арабскими цифрами.
В подгруппах (рассматриваем короткий вариант) химические элементы имеют сходные свойства. Например, элементы подгруппы IA — это щелочные металлы, а подгруппы VIIA — галогены. Как известно, у всех щелочных металлов есть похожие свойства, галогены также сходны между собой. Однако в подгруппах свойства элементов закономерно изменяются сверху вниз (с увеличением относительной атомной массы). В главных подгруппах сверху вниз увеличиваются металлические свойства простых веществ соответствующих химических элементов. Неметаллические свойства соответственно убывают. Так, в подгруппе IIIA бор (B) не металл, а расположенный под ним в третьем периоде алюминий (Al) уже является металлом. В следующей главной подгруппе — IVA — неметаллами являются углерод, кремний и германий, а вот расположенные под ними олово и свинец — металлы.
Однако в подгруппах свойства элементов закономерно изменяются сверху вниз (с увеличением относительной атомной массы). В главных подгруппах сверху вниз увеличиваются металлические свойства простых веществ соответствующих химических элементов. Неметаллические свойства соответственно убывают. Так, в подгруппе IIIA бор (B) не металл, а расположенный под ним в третьем периоде алюминий (Al) уже является металлом. В следующей главной подгруппе — IVA — неметаллами являются углерод, кремний и германий, а вот расположенные под ними олово и свинец — металлы.
В разных подгруппах одной группы свойства элементов различаются. Однако у них одинаковая высшая валентность, равная номеру группы.
Copyright © 2019. All Rights Reserved
Периодическая таблица через 150 лет
Ю. Ц. Оганесян
По материалам доклада на Научной сессии Общего собрания членов РАН, посвященной закрытию Международного года Периодической таблицы 14 ноября 2019 г. В варианте статьи журнала «Вестник Российской академии наук» № 4 2020 г.
В варианте статьи журнала «Вестник Российской академии наук» № 4 2020 г.
К началу 2019 г., провозглашенного ООН и ЮНЕСКО Международным годом Периодической таблицы химических элементов, 7-й период таблицы был уже заполнен новыми, самыми тяжелыми элементами. Согласно предсказаниям теории, изотопы сверхтяжелых элементов, обладающие повышенной стабильностью, образуют на карте нуклидов большую зону в виде острова с вершиной, расположенной вблизи «магических» чисел протонов Z=114 и нейтронов N=184. Новые элементы с атомными номерами от 114 до 118 были синтезированы в Лаборатории ядерных реакций им. Г.Н. Флёрова Объединённого института ядерных исследований (ОИЯИ) в Дубне в 2000–2012 гг. в реакциях слияния ядер мишени – тяжёлых изотопов актиноидов (Z = 94–98) – с бомбардирующими ионами кальция-48. Из полученных экспериментальных результатов следует, что могут существовать ядра/элементы с атомными номерами более 118 и массами более 300 а.е.м. Для исследования ядерной и электронной структур новых элементов, а также их химических свойств, равно как и синтеза элементов начала 8-го периода Периодической таблицы, в Дубне создан новый экспериментальный комплекс Фабрика сверхтяжелых элементов (Фабрика СТЭ), где уже состоялся пуск нового ускорителя DC-280 и в ближайшее время начнутся эксперименты. Вводная и заключительная части моего выступления на Научной сессии Общего собрания членов РАН относились к открытию периодического закона, опубликованного Д.И. Менделеевым 150 лет назад. Действие этого закона в свойствах тяжелейших элементов представляет и сегодня одну из актуальных и интересных задач естествознания.
Вводная и заключительная части моего выступления на Научной сессии Общего собрания членов РАН относились к открытию периодического закона, опубликованного Д.И. Менделеевым 150 лет назад. Действие этого закона в свойствах тяжелейших элементов представляет и сегодня одну из актуальных и интересных задач естествознания.
Ключевые слова: Периодическая таблица Д.И. Менделеева, сверхтяжёлые элементы, “остров” стабильности, Фабрика сверхтяжёлых элементов, спонтанное деление.
ПРОЛОГ
Предание гласит, что всё началось с письма, которое сэр Мартин Поляков, профессор Ноттингемского университета (Великобритания) и иностранный член РАН, направил 28 июля 2016 г. президенту Международного союза чистой и прикладной химии (ИЮПАК) члену-корреспонденту РАН Наталии Павловне Тарасовой:
«Уважаемая Наталия,
надеюсь, что Вы в порядке.
Как я понимаю, 2019 год станет 150-й годовщиной публикации Менделеевым Периодической таблицы. Было бы интересно знать, можно ли поднять вопрос о том, чтобы объявить 2019 год Международным годом Периодической таблицы. Чувствую, что это предложение может получить большую поддержку. Как Вы думаете?
Было бы интересно знать, можно ли поднять вопрос о том, чтобы объявить 2019 год Международным годом Периодической таблицы. Чувствую, что это предложение может получить большую поддержку. Как Вы думаете?
С наилучшими пожеланиями,
Мартин Поляков»
Н.П. Тарасова поставила этот вопрос на заседании Исполнительного комитета ИЮПАК, который, как ей показалось, со здоровым скептицизмом поддержал идею Международного года Периодической таблицы и предложил России воплотить её в жизнь через ЮНЕСКО. Начиная с этого момента, вся деятельность по данному вопросу, проводимая Международным союзом чистой и прикладной химии в течение 18 месяцев, легла на плечи президента ИЮПАК и её коллег.
Российская академия наук и российские химики с большим воодушевлением взялись за дело: написали обращение Менделеевского съезда (2016) и Российского химического общества к мировой научной общественности, президент РАН академик В.Е. Фортов направил письмо министру иностранных дел России С. В. Лаврову, РАН обратилась в ИЮПАК, Н.П. Тарасова написала письмо Генеральному директору ЮНЕСКО и пр. К этому времени подошло другое событие, непосредственно связанное с Периодической таблицей химических элементов. После включения в 2012 г. в таблицу 114-го и 116-го элементов ИЮПАК принял название и утвердил символы ещё четырех химических элементов, в их числе двух самых тяжёлых. Это случилось 28 ноября 2016 г. Все четыре элемента со своими названиями и символами заполнили и замкнули 7-й период Периодической таблицы Д.И. Менделеева. На инаугурации новых химических элементов, состоявшейся 2 марта 2017 г. в Доме учёных РАН, три директора сотрудничающих лабораторий – академик РАН Виктор Матвеев (ОИЯИ, Дубна, Россия), профессор Томас Мейсон (Ок-Риджская национальная Лаборатория, Oк-Ридж, США) и профессор Вильям Гольдштейн (Ливерморская национальная лаборатория, Ливермор, США) – направили совместное письмо в ЮНЕСКО в поддержку юбилейного года Периодической таблицы. И это далеко не полный перечень шагов, предпринятых научным сообществом в преддверии 2018 г.
В. Лаврову, РАН обратилась в ИЮПАК, Н.П. Тарасова написала письмо Генеральному директору ЮНЕСКО и пр. К этому времени подошло другое событие, непосредственно связанное с Периодической таблицей химических элементов. После включения в 2012 г. в таблицу 114-го и 116-го элементов ИЮПАК принял название и утвердил символы ещё четырех химических элементов, в их числе двух самых тяжёлых. Это случилось 28 ноября 2016 г. Все четыре элемента со своими названиями и символами заполнили и замкнули 7-й период Периодической таблицы Д.И. Менделеева. На инаугурации новых химических элементов, состоявшейся 2 марта 2017 г. в Доме учёных РАН, три директора сотрудничающих лабораторий – академик РАН Виктор Матвеев (ОИЯИ, Дубна, Россия), профессор Томас Мейсон (Ок-Риджская национальная Лаборатория, Oк-Ридж, США) и профессор Вильям Гольдштейн (Ливерморская национальная лаборатория, Ливермор, США) – направили совместное письмо в ЮНЕСКО в поддержку юбилейного года Периодической таблицы. И это далеко не полный перечень шагов, предпринятых научным сообществом в преддверии 2018 г.
А 20 декабря 2017 г. с интересной и необычной формулировкой – “признавая важность глобального расширения знаний о том, как химия способствует устойчивому развитию в области энергетики, образования, сельского хозяйства и здоровья,” – Генеральная Ассамблея ООН, затем и ЮНЕСКО провозгласили 2019-й Международным годом Периодической таблицы химических элементов – IYPT-2019.
НОВЫЕ ОБИТАТЕЛИ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
В 1928 г. Георгий Антонович Гамов, наш соотечественник, выпускник Ленинградского государственного университета, уже известный к тому времени советский физик, предложил первую теоретическую модель атомного ядра в виде капли заряженной жидкости с плотностью, на 15 порядков превышающей плотность воды [1]. В новой науке, ядерной физике, этой работе суждено было сыграть большую роль. На основе капельной модели ядра Гамов создал теорию альфа-распада (1928) [2], Карл Фридрих фон Вайцзеккер предложил свою знаменитую формулу для расчёта энергии связи ядер (1935) [3], а Нильс Бор и Джон А. Уилер создали теорию ядерного деления (1939) [4]*.
Уилер создали теорию ядерного деления (1939) [4]*.
Согласно Бору и Уилеру, тяжёлое ядро предохраняет от разделения на две части потенциальный барьер. Высота барьера деления ядра урана составляет 6 МэВ. Поэтому если в ядро внести энергию более чем 6 МэВ (например, энергию захвата ядром нейтрона), оно моментально разделится на две части. В этом процессе выделяется энергия около 200 МэВ, что используется в атомных электростанциях. Однако ядро урана может разделиться самопроизвольно (спонтанно) без вноса в ядро дополнительной энергии. Для этого, как было впервые измерено Г.Н. Флёровым и К.А. Петржаком (1940) [6], потребуется огромное время: 1016 лет! По мере удаления от урана в область более тяжелых ядер, высота барьера деления быстро уменьшается, что приводит к резкому увеличению вероятности спонтанного деления. При исчезновении барьера деления ядро будет испытывать спонтанное деление за время около 10-19 с. В теории Бора и Уилера подобная критическая ситуация наступает при подходе к элементам с атомным номером 100. По сути, это и есть предел существования ядер.
По сути, это и есть предел существования ядер.
Ещё 60 лет назад такое макроскопическое, и в этом смысле классическое, описание процесса деления не вызывало сомнений. Особенно после синтеза первых искусственных элементов тяжелее урана, прекрасно подтверждающих капельную теорию деления: от урана (Z = 92) до калифорния (Z = 98) период полураспада относительно спонтанного деления уменьшился в 1014 раз [7]! Сомнения в прогнозах капельной модели деления возникли позже, после открытия в Лаборатории ядерных реакций им. Г.Н. Флёрова ОИЯИ спонтанно-делящихся изомеров (1962) [8]. Оказалось, что внутренняя структура ядра, наблюдаемая в основных состояниях, сохраняется и в сильно деформированных конфигурациях на пути к делению, продолжая играть важную роль в вероятности спонтанного деления тяжёлых ядер. Теперь уже более сложное описание коллективного движения в новой микроскопической теории давало одновременно также и новые предсказания границы масс ядер. Результаты оказались весьма неожиданными. Согласно прогнозам, резкое падение стабильности трансурановых нуклидов относительно спонтанного деления должно смениться резким подъёмом в области сверхтяжёлых элементов при подходе к “магическим” ядрам с числом протонов Z = 114 и нейтронов N = 184. Эти нуклиды, обладающие большим избытком нейтронов, более связаны. Они отделены от известной области ядер. Их достаточно много. На карте ядер они представляют собой подобие некого “острова” весьма тяжёлых (сверхтяжёлых) элементов, у которых могут быть очень долгоживущие изотопы. В научных статьях и докладах начала 1970-х годов можно найти различные иллюстрации, подобные той, что представлена на рис. 1.
Согласно прогнозам, резкое падение стабильности трансурановых нуклидов относительно спонтанного деления должно смениться резким подъёмом в области сверхтяжёлых элементов при подходе к “магическим” ядрам с числом протонов Z = 114 и нейтронов N = 184. Эти нуклиды, обладающие большим избытком нейтронов, более связаны. Они отделены от известной области ядер. Их достаточно много. На карте ядер они представляют собой подобие некого “острова” весьма тяжёлых (сверхтяжёлых) элементов, у которых могут быть очень долгоживущие изотопы. В научных статьях и докладах начала 1970-х годов можно найти различные иллюстрации, подобные той, что представлена на рис. 1.
Рис. 1. Периоды полураспада ядер с Z ≥ 96 относительно спонтанного деления. Черные кружки – экспериментальные значения для актиноидов и изотопов 104 элемента. Открытые кружки – один из вариантов предсказаний для ядер c Z ≥ 106 и N ≥ 150.  С правой стороны: периоды спонтанного деления изотопов 114-го элемента, рассчитанные в макро – микроскопической модели ядра. С правой стороны: периоды спонтанного деления изотопов 114-го элемента, рассчитанные в макро – микроскопической модели ядра. |
Многие лаборатории мира буквально ринулись на поиски этих долгоживущих тяжеловесов. Но, к сожалению, все экстенсивные попытки найти их в природе, космических лучах и даже путём искусственного синтеза сверхтяжёлых элементов, предпринятые в течение 15 лет (1970–1985), не дали результатов. Оставляя пока вопрос о вероятности образования ядер с массой около 300 в процессах природного ядерного синтеза, отметим, что время жизни сверхтяжёлых долгожителей заметно меньше возраста Солнечной системы (4.5∙109 лет) и они не дожили до наших дней. Что же касается искусственного синтеза, то все методы синтеза двадцати известных к тому времени искусственных элементов тяжелее урана, к сожалению, не пригодны для этих целей. Они “не дотягивают” до “острова” стабильности прежде всего из-за дефицита нейтронов в системе сливающихся ядер.
После 1985 г. мы кардинально изменили подход к синтезу сверхтяжёлых элементов. Для того чтобы добраться до “острова” и увидеть резкий подъём стабильности, предсказанный теорией, пришлось существенно усложнить эксперимент. Теперь вместо использования стабильных ядер в качестве материала мишени были выбраны тяжёлые изотопы трансурановых элементов (такие как плутоний-244 или кюрий-248), полученные в высокопоточном ядерном реакторе. Мишени из этих материалов подвергались бомбардировке ускоренными ионами кальция-48, исключительно редкого и дорогого изотопа природного кальция. Содержание кальция-48 в естественной смеси по отношению к основному изотопу кальцию-40 составляет всего 0.2%. Преимущества этой реакции прямо следуют из сравнения результатов экспериментов по синтезу 113-го элемента Nh, проведённого в RIKEN (Япония) и 114-го элемента Fl – в ОИЯИ (Дубна). Элемент Nh был синтезирован при слиянии ядер висмута-209 и цинка-70 [9]. Составная система после слияния двух атомных ядер содержит 113 протонов и 165 нейтронов. В этой реакции в течение девяти лет были получены три атома 113-го элемента. Элемент Fl (Z = 114), полученный в Дубне в реакции плутоний-244 + кальций-48, имел в составном ядре 114 протонов и 178 нейтронов [10] – на 13 нейтронов больше, чем в предыдущем случае. Эти 13 нейтронов, как следует из дальнейшего, и сыграли решающую роль.
В этой реакции в течение девяти лет были получены три атома 113-го элемента. Элемент Fl (Z = 114), полученный в Дубне в реакции плутоний-244 + кальций-48, имел в составном ядре 114 протонов и 178 нейтронов [10] – на 13 нейтронов больше, чем в предыдущем случае. Эти 13 нейтронов, как следует из дальнейшего, и сыграли решающую роль.
Высадка на берег “острова” в северо-западной его части была действительно впечатляющей. Вероятность образования тяжёлого изотопа 114-го элемента оказалась примерно в 500 раз выше, чем 113-го элемента, полученного в RIKEN. Еще более сильное отличие наблюдалось в свойствах ядер, в частности, во временах жизни, измеряемых обычно периодами полураспада. Повышение числа нейтронов на 8 единиц в ядрах, синтезированных с ионами кальция-48, увеличило их период полураспада примерно в 100 тысяч раз! Оба фактора: рост вероятности образования и стабильности ядер демонстрируют сильный эффект “магической” структуры N = 184, даже несмотря на то, что синтезированный изотоп 114-го элемента содержит всего 175 нейтронов. После первых результатов по исследованию изотопов 114-го и 116-го элементов в реакциях с ионами кальция-48 (2000–2002) последующие эксперименты по синтезу других элементов с атомными номерами 115, 117 и 118 были проведены по той же методике с мишенями из америция-243, берклия-249 и калифорния-249 соответственно [11-13]. За 15 лет работы (около 100 тыс. часов облучения мишеней пучком ионов кальция-48) были синтезированы 52 новых изотопа [14] от 104-го до 118-го элементов (рис. 2, а). На карте нуклидов они простираются до ядер массой 294 а.е.м. (рис. 2, б). Это предельно тяжёлое ядро было получено в виде двух изобар: как чётно-чётный изотоп 118-го элемента с периодом полураспада около 0.5 миллисекунд и как нечётно-нечётный изотоп 117-го элемента с периодом полураспада около 50 миллисекунд. Оба периода полураспада в ядерном масштабе – огромные времена! Учитывая, что после образования нового ядра за время 10-14–10-13 секунды вокруг него выстраивается вся электронная система атома, то подобный вывод можно сделать и о существовании элементов.
После первых результатов по исследованию изотопов 114-го и 116-го элементов в реакциях с ионами кальция-48 (2000–2002) последующие эксперименты по синтезу других элементов с атомными номерами 115, 117 и 118 были проведены по той же методике с мишенями из америция-243, берклия-249 и калифорния-249 соответственно [11-13]. За 15 лет работы (около 100 тыс. часов облучения мишеней пучком ионов кальция-48) были синтезированы 52 новых изотопа [14] от 104-го до 118-го элементов (рис. 2, а). На карте нуклидов они простираются до ядер массой 294 а.е.м. (рис. 2, б). Это предельно тяжёлое ядро было получено в виде двух изобар: как чётно-чётный изотоп 118-го элемента с периодом полураспада около 0.5 миллисекунд и как нечётно-нечётный изотоп 117-го элемента с периодом полураспада около 50 миллисекунд. Оба периода полураспада в ядерном масштабе – огромные времена! Учитывая, что после образования нового ядра за время 10-14–10-13 секунды вокруг него выстраивается вся электронная система атома, то подобный вывод можно сделать и о существовании элементов. Из данных экспериментов следует, что мы не дошли до предела масс ядер. Определённо, ядра могут иметь массу более 300 а.е.м., а количество элементов может быть свыше 118.
Из данных экспериментов следует, что мы не дошли до предела масс ядер. Определённо, ядра могут иметь массу более 300 а.е.м., а количество элементов может быть свыше 118.
Рис. 2, а. Таблица Менделеева (площадь 150 м2). на фасаде химического факультета Университета в городе Мурсия (Испания, 2017). В красной рамке показаны элементы, полученные с пучком кальция-48. |
Рис. 2, б. Область конца карты нуклидов: показаны изотопы от свинца до элемента 118. Красными квадратами обозначены самые тяжелые ядра: с массой 252 а.е.м. (No, 1962) и 294 а.е.м. (Og, 2004), полученные впервые в Лаборатории ядерных реакций ОИЯИ. Желтым цветом показана область ядер, полученных в реакциях с использованием мишеней из свинца и висмута. Розовое поле – область ядер синтезированных в реакциях с пучком ионов кальция-48.  Фон – карта потенциальной энергии ядер в зависимости от содержания протонов и нейтронов, полученная в расчетах макро-микроскопической модели. Цифры и цвет указывают амплитуду структурной поправки (в МэВ) к жидко-капельной энергии ядра. Фон – карта потенциальной энергии ядер в зависимости от содержания протонов и нейтронов, полученная в расчетах макро-микроскопической модели. Цифры и цвет указывают амплитуду структурной поправки (в МэВ) к жидко-капельной энергии ядра. |
Заключая краткий экскурс в мир сверхтяжёлых, можно отметить, что уйдя от висмута, последнего стабильного элемента, в область больших масс и зарядов, мы наблюдаем удивительную живучесть атомных ядер. В области предельных кулоновских сил дополнительные связи протонов и нейтронов структурного свойства создают в тяжёлом ядре барьер деления и делают тем самым возможным существование сверхтяжёлых элементов.
Эксперименты проводились в Дубне на ускорителе У400 Лаборатории ядерных реакций им. Г.Н. Флерова (ОИЯИ) в сотрудничестве с ВНИИЭФ (Саров, Россия), НИИАР (Димитровград, Россия), а также с Ливерморской и Ок-Риджской национальными лабораториями (США), взявшими на себя труд по наработке мишенного материала и участвовавшими в ряде экспериментов.
ТЯЖЕЛЕЙШИЕ АТОМЫ И ХИМИЯ СВЕРХТЯЖЁЛЫХ ЭЛЕМЕНТОВ
На фотографии (см. рис. 2, а) изображена самая большая (150 м2) Периодическая таблица химических элементов, встроенная в фасад химического факультета Университета г. Мурсия (Испания).** На ней красной рамкой выделены сверхтяжёлые элементы от 112-го до 118-го, полученные в реакциях с кальцием-48, когда в качестве материала мишени использовались тяжёлые изотопы от урана (Z = 92) до калифорния (Z = 98), соответственно***.
В белой рамке находятся дочерние нуклиды – продукты альфа-распада ядер из красной рамки. Они заполняют практически все оставшиеся клетки 7-го периода, вплоть до резерфордия (Z = 104). Дочерние ядра, берущие начало от нейтронно-избыточных материнских изотопов сверхтяжёлых элементов, тоже обогащены нейтронами, что значительно повышает их период полураспада и открывает широкие возможности для исследования химических свойств транс-актиноидов. Подобные исследования элементов, особенно конца 7-го периода, представляют большой интерес. Их химическое поведение может отличаться от более лёгких гомологов из-за релятивистского возрастания массы электронов с ростом заряда ядра. В более лёгких элементах релятивистский эффект проявляется в свойствах благородных металлов: золото – мягкий металл жёлтого цвета – не окисляется, ртуть тоже металл, но жидкий при комнатной температуре. Благородные металлы способны взаимодействовать друг с другом и создавать соединения типа ртуть/золото (амальгама ртути и золота). С увеличением атомного номера элемента и приближением скорости электронов к скорости света эффект будет быстро возрастать, вследствие чего химическое поведение сверхтяжёлых элементов, например, 112-го элемента (Cn), может отличаться от своего лёгкого гомолога – ртути (Hg). В первом эксперименте, проведённом в Дубне (2007), исследовалась именно эта пара гомологов [15]. Измерялась адсорбция Cn и Hg на поверхности золота (Au) при различной температуре на предмет наблюдения различия в образовании соединений [Au-Hg] и [Au-Cn].
Подобные исследования элементов, особенно конца 7-го периода, представляют большой интерес. Их химическое поведение может отличаться от более лёгких гомологов из-за релятивистского возрастания массы электронов с ростом заряда ядра. В более лёгких элементах релятивистский эффект проявляется в свойствах благородных металлов: золото – мягкий металл жёлтого цвета – не окисляется, ртуть тоже металл, но жидкий при комнатной температуре. Благородные металлы способны взаимодействовать друг с другом и создавать соединения типа ртуть/золото (амальгама ртути и золота). С увеличением атомного номера элемента и приближением скорости электронов к скорости света эффект будет быстро возрастать, вследствие чего химическое поведение сверхтяжёлых элементов, например, 112-го элемента (Cn), может отличаться от своего лёгкого гомолога – ртути (Hg). В первом эксперименте, проведённом в Дубне (2007), исследовалась именно эта пара гомологов [15]. Измерялась адсорбция Cn и Hg на поверхности золота (Au) при различной температуре на предмет наблюдения различия в образовании соединений [Au-Hg] и [Au-Cn]. Наблюдаемое смещение пика адсорбции в область более низких температур было первым прямым экспериментальным наблюдением релятивистского эффекта в транс-актиноидах. В целом, 112-ый элемент продемонстрировал свою принадлежность 12-й группе Таблицы Менделеева. Но из результатов этого эксперимента и проведенных недавно расчетов [16] были выявлены также отличия физико-химических свойств Cn и Hg, в частности, в температурах их фазовых переходов. Как известно, температура плавления ртути составляет -38.8 °С, температура кипения 353.7 °С, в то время как расчетные значения для Сn заметно отличаются: 10 °С и 67 °С, соответственно. При комнатной температуре, с учетом погрешности измерений, 112-ый элемент будет либо сильно летучей жидкостью, либо газообразным.
Наблюдаемое смещение пика адсорбции в область более низких температур было первым прямым экспериментальным наблюдением релятивистского эффекта в транс-актиноидах. В целом, 112-ый элемент продемонстрировал свою принадлежность 12-й группе Таблицы Менделеева. Но из результатов этого эксперимента и проведенных недавно расчетов [16] были выявлены также отличия физико-химических свойств Cn и Hg, в частности, в температурах их фазовых переходов. Как известно, температура плавления ртути составляет -38.8 °С, температура кипения 353.7 °С, в то время как расчетные значения для Сn заметно отличаются: 10 °С и 67 °С, соответственно. При комнатной температуре, с учетом погрешности измерений, 112-ый элемент будет либо сильно летучей жидкостью, либо газообразным.
Но это первый звонок. Дальнейшее увеличение заряда ядра будет более ощутимым. Поэтому, спустя 100 лет после открытия Вильямом Рамзаем радона (1904) [17], последнего до 2004 года представителя семейства благородных газов 18 группы таблицы, мы задаемся сегодня вопросом: а будет ли 118-ый элемент благородным газом? Релятивистский эффект сильнее проявляется на ближайших к ядру электронах, скорость которых максимальна [18-20], что приводит к сжатию внутренних орбит (рис. 3, а). Для внешних электронов “релятивистское сжатие” приводит к экранированию положительного заряда ядра. В этой ситуации необходимо учитывать (пока в виде малых поправок) взаимодействие внешних электронов друг с другом, которое мало в природных элементах и которым пренебрегают в нерелятивистских расчётах. Нетрудно предвидеть, что роль этих поправок будет быстро возрастать с увеличением атомного номера в сверхтяжёлых элементах. Сам расчёт поправок – по сути, задача многих тел – требует огромных вычислительных мощностей. Большие надежды здесь связаны с квантовым компьютером. А пока доступными средствами в различном приближении отрабатываются методы расчёта на известных атомах, которые затем используются для предельно тяжёлых систем. Релятивистский расчёт элементов 18-й группы показывает, что пространственное распределение внешних электронов 118-го элемента [21] существенно размыто по сравнению с радоном и тем более с ксеноном (рис. 3, б). Подобная картина воспроизводится в расчётах В.М.
3, а). Для внешних электронов “релятивистское сжатие” приводит к экранированию положительного заряда ядра. В этой ситуации необходимо учитывать (пока в виде малых поправок) взаимодействие внешних электронов друг с другом, которое мало в природных элементах и которым пренебрегают в нерелятивистских расчётах. Нетрудно предвидеть, что роль этих поправок будет быстро возрастать с увеличением атомного номера в сверхтяжёлых элементах. Сам расчёт поправок – по сути, задача многих тел – требует огромных вычислительных мощностей. Большие надежды здесь связаны с квантовым компьютером. А пока доступными средствами в различном приближении отрабатываются методы расчёта на известных атомах, которые затем используются для предельно тяжёлых систем. Релятивистский расчёт элементов 18-й группы показывает, что пространственное распределение внешних электронов 118-го элемента [21] существенно размыто по сравнению с радоном и тем более с ксеноном (рис. 3, б). Подобная картина воспроизводится в расчётах В.М. Шабаева и его коллег [22], но указывается одновременно, что 118-й элемент на 94% будет благородным газом. Возможно, и не газом, а твёрдым телом при комнатной температуре [16,23].
Шабаева и его коллег [22], но указывается одновременно, что 118-й элемент на 94% будет благородным газом. Возможно, и не газом, а твёрдым телом при комнатной температуре [16,23].
Рис. 3, а. Расчетная плотность электронов 118-го элемента (Og) в зависимости от радиуса (логарифмическая шкала) в двух вариантах расчета: в релятивистском (синяя кривая) и не релятивистском (красный пунктир) приближениях. Цифрами на графике указаны электронные оболочки (периоды). Видно сильное сжатие внутренних электронных оболочек, в то время как средний радиус внешних (валентных) электронов мало меняется |
Рис. 3, б. Пространственные распределения (функции локализации) электронов 118-го элемента (Og), полученные в работе [20]. Хорошо видно размытие внешних электронов в сравнении с его гомологами — радоном и ксеноном |
На примере 118-го элемента можно видеть, что в конце 7-го периода у элементов, именуемых сегодня сверхтяжёлыми, появляются отличные от лёгких гомологов признаки. Экспериментальные данные, к сожалению, весьма скудны прежде всего из-за малого количества сверхтяжёлых элементов и короткого времени их жизни. Одно из направлений будущих исследований нацелено на изучение атомной структуры и химических свойств уже синтезированных сверхтяжёлых элементов на новом оборудовании (см. далее).
Экспериментальные данные, к сожалению, весьма скудны прежде всего из-за малого количества сверхтяжёлых элементов и короткого времени их жизни. Одно из направлений будущих исследований нацелено на изучение атомной структуры и химических свойств уже синтезированных сверхтяжёлых элементов на новом оборудовании (см. далее).
Пока не видно принципиальных ограничений для синтеза 119-го и 120-го элементов – начала 8-го периода таблицы. Несмотря на то, что попытки их получения на старых установках в реакциях с ионами титана, хрома и даже железа, предпринятые в разных лабораториях, не увенчались успехом [24-26], это остаётся делом техники. Сложнее будет изучать их химические свойства из-за короткого периода полураспада, исчисляемого долями миллисекунды. Но здесь не ожидается сюрпризов. Большой скачок в химии будет иметь место при переходе от 118-го к 119-му элементу (от последней колонки таблицы к первой). По всей вероятности, 120-й элемент также в целом будет следовать своим лёгким гомологам второй колонки. Отклонения начнутся, скорее всего, после 121-го элемента с различными сценариями дальнейшего продолжения таблицы (рис. 4). Элемент 122 либо откроет новую серию так называемых супер-актиноидов [27], включающую ещё 33 элемента вплоть до 155-го, либо 122-й элемент и все последующие продолжат 8-й период. Но в этом случае групповое различие элементов начнёт быстро исчезать (размываться). Пока же остается только гадать, как будет выглядеть химия атомных гигантов за пределами периодического закона.
Отклонения начнутся, скорее всего, после 121-го элемента с различными сценариями дальнейшего продолжения таблицы (рис. 4). Элемент 122 либо откроет новую серию так называемых супер-актиноидов [27], включающую ещё 33 элемента вплоть до 155-го, либо 122-й элемент и все последующие продолжат 8-й период. Но в этом случае групповое различие элементов начнёт быстро исчезать (размываться). Пока же остается только гадать, как будет выглядеть химия атомных гигантов за пределами периодического закона.
Рис. 4. Таблица Д.И. Менделеева с различными вариантами релятивистских расчетов. В синей рамке – сверхтяжёлые элементы, полученные в реакциях с пучком ионов кальция-48. |
ФАБРИКА СВЕРХТЯЖЁЛЫХ ЭЛЕМЕНТОВ
После открытия новых элементов, расположенных на “острове” стабильности, дальнейшее развитие исследований в этой области связано прежде всего с получением сверхтяжёлых нуклидов в значительно бóльших количествах. Спустя 10 лет после первых экспериментов по синтезу 114-го и 116-го элементов по результатам, полученным в опытах с пучком ионов кальция-48, а также в связи с общим прогрессом в смежных областях науки и техники стало ясно, что светимость экспериментов может быть существенно увеличена. Поэтому с 2012 г. мы сильно сократили экспериментальную программу на действующих установках и стали строить новую лабораторию – Фабрику cверхтяжёлых элементов, которая пока не имеет мировых аналогов. Она определяет и тем самым отражает технический уровень всех этапов работы по получению сверхтяжёлых элементов от создания мишеней из трансурановых элементов до доставки сверхтяжёлых нуклидов к экспериментальным физическим и химическим установкам. По достижению проектных параметров возможности Фабрики СТЭ будут превосходить современный уровень в 50–100 раз.
Спустя 10 лет после первых экспериментов по синтезу 114-го и 116-го элементов по результатам, полученным в опытах с пучком ионов кальция-48, а также в связи с общим прогрессом в смежных областях науки и техники стало ясно, что светимость экспериментов может быть существенно увеличена. Поэтому с 2012 г. мы сильно сократили экспериментальную программу на действующих установках и стали строить новую лабораторию – Фабрику cверхтяжёлых элементов, которая пока не имеет мировых аналогов. Она определяет и тем самым отражает технический уровень всех этапов работы по получению сверхтяжёлых элементов от создания мишеней из трансурановых элементов до доставки сверхтяжёлых нуклидов к экспериментальным физическим и химическим установкам. По достижению проектных параметров возможности Фабрики СТЭ будут превосходить современный уровень в 50–100 раз.
Новый комплекс с инфраструктурой для работы с высокорадиоактивными материалами расположен в отдельном строении (рис. 5, а). Там же находится новый сильноточный ускоритель тяжелых ионов – циклотрон DC-280 [28], пуск которого состоялся в марте 2019 года (рис. 5, б). Ускоритель доставляет пучки ионов в три экспериментальных зала, где размещаются сепарирующие каналы, химические и физические установки, а также другое экспериментальное оборудование. В настоящее время идет наладка нового сепаратора и подготовка первого эксперимента.
5, б). Ускоритель доставляет пучки ионов в три экспериментальных зала, где размещаются сепарирующие каналы, химические и физические установки, а также другое экспериментальное оборудование. В настоящее время идет наладка нового сепаратора и подготовка первого эксперимента.
Рис. 5, а. Строение ускорительного комплекса «Фабрики СТЭ» |
Рис. 5, б. Ускоритель тяжелых ионов — циклотрон DC-280 |
ЭПИЛОГ
За прошедшие 80 лет после открытия нептуния и плутония (1940) – первых искусственных элементов – Периодическая таблица пополнилась ещё 24 рукотворными элементами. Пять самых тяжёлых из них заняли своё место в таблице в последние семь лет. Искусственных элементов, как известно, в природе нет. А сверхтяжёлых элементов, скорее всего, не было и при зарождении Солнечной системы. Они получены в лабораториях в совершенно других условиях (реакциях), чем природные химические элементы. Однако все известные сегодня 118 элементов располагаются в единой таблице в строгом соответствии с периодическим законом, открытым Дмитрием Ивановичем Менделеевым 150 лет назад.
Они получены в лабораториях в совершенно других условиях (реакциях), чем природные химические элементы. Однако все известные сегодня 118 элементов располагаются в единой таблице в строгом соответствии с периодическим законом, открытым Дмитрием Ивановичем Менделеевым 150 лет назад.
Между тем Международный год Периодической таблицы — IYPT2019, начавший своё шествие в ЮНЕСКО 29 января 2019 г., закончился в Токио (Япония) 5 декабря. Огромное количество статей в научных, научно-популярных и совсем не научных изданиях, удивительный всплеск очень интересных работ в области ядерной физики, химии, атомной физики, астрофизики, истории науки – все посвященные 150-летию открытия Периодической таблицы химических элементов. Год был встречен с невероятным энтузиазмом не только научным миром, но и широкой общественностью. Форумы, конференции, симпозиумы, лекции, собрания научных обществ, академий наук многих стран мира, везде по-разному, но всегда одухотворенно и очень интересно.
Что-то объединяет людей. Быть может, также великие открытия и любовь к науке.
* В то же время в нашей стране теорию ядерного деления независимо развивал Я.И. Френкель [5].
** С 2019 года самая большая периодическая Таблица элементов (660 м2) находится в Австралии в государственном университете Эдит Коуэн (ECU) в г. Перт.
*** К сожалению, калифорний – самый тяжёлый элемент, который может быть получен в ядерном реакторе в количестве, необходимом для изготовления мишени. Для синтеза 119 элемента и более тяжелых придется увеличивать массу и заряд бомбардирующих ионов.
Литература
1. Gamov G. Discussion оn the structure of atomic nuclei// Proc. of the Royal Society A. 1929. № 123. P. 386–387.
2. Gamov G. Zur Quantentheorie des Atomkernes // Zeitschrift fur Physik. 1928. V. 51. № ¾. P. 204–212.
3. Von Weizsäcker C.F. Zur Theorie der Kernmassen// Zeitschrift fur Physik. 1935. V. 96. P. 431.
Von Weizsäcker C.F. Zur Theorie der Kernmassen// Zeitschrift fur Physik. 1935. V. 96. P. 431.
4. Bohr N., Weeler J.A. The Mechanism of Nuclear Fission // Phys. Rev. 1939. V. 56. P. 426–450.
5. Френкель Я.И. Электрокапиллярная теория расщепления тяжёлых ядер медленными нейтронами // ЖЭТФ. 1939. № 6. С. 641–653.
6. Flerov , Petrjak . Spontaneous Fission of Uranium // Phys. Rev. 1940. V. 58. Р. 89.
7. Seaborg G.T., Loveland W.D. Transuranium Nuclei // Treatise on Heavy-Ion Science / Edited by D.A. Bromley. V. 4. P. 289. N.Y.: Plenum Press, 1985.
8. Polikanov S.M., Druin A.V., Karnaukhov V.A. et al. Spontaneous fission with an anomalously short period // Soviet Physics JETP-USSR. 1962. № 15(6). P.1016–1021.
9. Morita K., Morimoto K., Kaji D. et al. Experiment on the Synthesis of Element 113 in the Reaction 209Bi (70Zn,n)278113 // J. Phys. Soc. Jpn. 2004. V.73. P. 2593–2596.
Phys. Soc. Jpn. 2004. V.73. P. 2593–2596.
10. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al., Synthesis of Superheavy Nuclei in the 48Ca+244Pu Reaction // Phys. Rev. Lett. 1999. V. 83. P. 3154–3157.
11. Oganessian Yu.Ts., Utyonkoy V.K., Lobanov Yu.V. et al. Experiments on the synthesis of element 115 in the reaction 243Am(48Ca,xn)291−x115 // Phys. Rev. C. 2004. V. 69. № 021601(R).
12. Oganessian Yu.Ts., Abdullin F.Sh., Bailey P.D. et al. Synthesis of a New Element with Atomic Number Z=117 // Phys. Rev. Lett. 2010. V. 104. № 142502.
13. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al. Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions // Phys. Rev. C. 2006. V. 74. № 044602.
14. Oganessian Yu.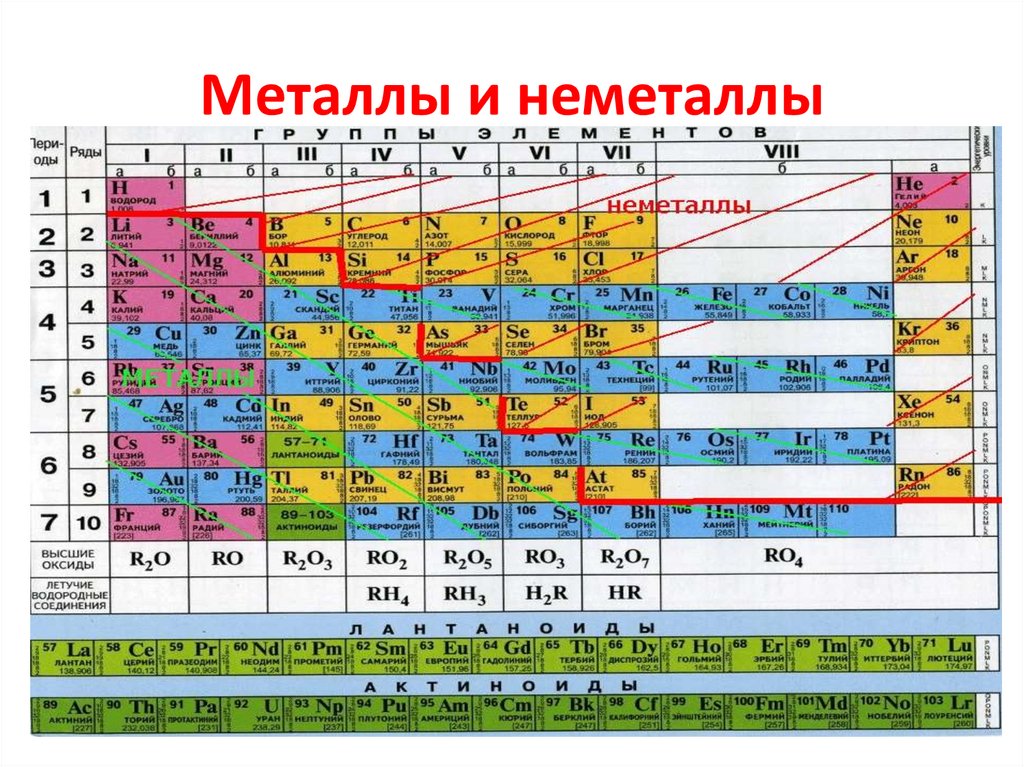 Ts., Utyonkov V.K. Super-heavy element research // Rep. Prog. Phys. 2015. V. 78. № 036301.
Ts., Utyonkov V.K. Super-heavy element research // Rep. Prog. Phys. 2015. V. 78. № 036301.
15. Eichler R., Aksenov N.V., Belozerov A.V. et al. Chemical characterization of element 112 // Nature. 2007. V. 447. P. 72–75.
16. Mewes J.-M., Smits O. R., Kresse G. et al. Copernicium: A Relativistic Noble Liquid // Angew. Chem. Int. Ed.2019. V.58, P.17964 – 17968
17. Ramsay W., Soddy F. Further Experiments on the Production of Helium from Radium // Proceedings of the Royal Society of London (1854–1905). 1904. V. 73. P. 346–358.
18. Pershina V. Relativity in the electronic structure of the heaviest elements and its influence on periodicities in properties // Radiochimica Acta. 2019. V. 107. Р. 833–864.
19. Eliav E., Borschevsky A., Kaldor U. Electronic Structure at the Edge of the Periodic Table // Nuclear Physics News. 2019. V. 29. Р. 16–20.
29. Р. 16–20.
20. Lackenby B.G.C., Dzuba V.A, Flambaum V.V. Atomic structure calculations of superheavy noble element oganesson (Z=118) // Phys.Rev. A. 2018. V. 98. P. 042512.
21. Jerabek P., Schuetrumpf B., Schwerdtfeger P., Nazarewicz W. Electron and Nucleon Localization Functions of Oganesson: Approaching the Thomas-Fermi Limit// Phys. Rev. Lett. 2018. V. 120. Р. 053001.
22. Shabaev V.M., Tupitsyn I.I., Kaygorodov M.Y., Kozhedub Y.S. Localisation of electron states of Oganesson atoms // The 4th International Symposium on Superheavy Elements (SHE2019). Hakone, Japan. Dec.1–5, 2019
23. Giuliani S. A., Matheson Z., Nazarewicz W. et al., Colloquium: Superheavy elements: Oganesson and beyond// Rev. Mod. Phys. 2019. V. 91. No. 1. P.01100.
24. Düllmann C.E. Superheavy Element Research at TASCA at GSI // Fission and Properties of Neutron-Rich Nuclei. 2013. V. 44. Р. 271–277.
V. 44. Р. 271–277.
25. Hofmann S., Heinz S., Mann R. et al. Review of even element super-heavy nuclei and search for element 120 // Eur. Phys. J. A. 2016. V. 52. Р. 180.
26. Oganessian Yu.Ts., Utyonkov V.K., Lobanov Yu.V. et al. Attempt to produce element 120 in the 244Pu+58Fe reaction // Phys. Rev. C. 2009. V. 79. Р. 024603.
27. Borschevsky A., Pershina V., Eliav E., Kaldor U. Ab initio predictions of atomic properties of element 120 and its lighter group-2 homologues // Phys. Rev. A. 2013. V. 87. P. 022502.
28. Gulbekian G.G., Dmitriev S.N., Itkis M.G. et al. Start-Up of the DC-280 Cyclotron, the Basic Facility of the Factory of Superheavy Elements of the Laboratory of Nuclear Reactions at the Joint Institute for Nuclear Research // Physics of Particles and Nuclei Letters. 2019. V. 16(6). Р. 866–875.
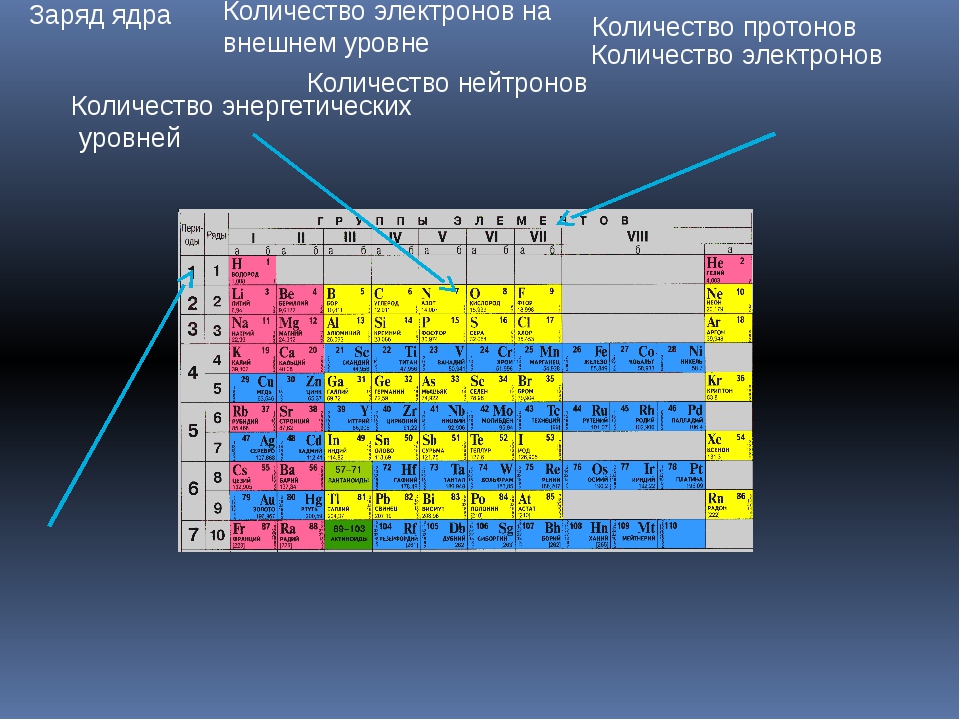
1.2.2. Общая характеристика металлов IА–IIIА групп.

Элементы IA группы
В IA группу (главная подгруппа первой группы) таблицы Менделеева входят металлы — литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr. Традиционно, данные элементы называют щелочными металлами (ЩМ), так как их простые вещества образуют при взаимодействии с водой едкие щелочи. Последний из известных представителей группы щелочных металлов (Fr) является радиоактивным элементом, в связи с чем его химические свойства изучены недостаточно: период полураспада его наиболее долгоживущего изотопа 223Fr составляет всего лишь около 22 мин.
Электронные формулы, а также некоторые свойства щелочных металлов представлены в таблице ниже:
| Свойство | Li | Na | К | Rb | Cs | Fr |
| Заряд ядра Z | 3 | 11 | 19 | 37 | 55 | 87 |
| Электронная конфигурация в основном состоянии | [He]2s1 | [Ne]3s1 | [Аr]4s1 | [Kr]5s1 | [Хе]6s1 | [Rn]7s1 |
| Металлический радиус rмет, нм | 0,152 | 0,186 | 0,227 | 0,248 | 0,265 | 0,270 |
| Ионный радиус rион*, нм | 0,074 | 0,102 | 0,138 | 0,149 | 0,170 | 0,180 |
| Радиус гидратированного иона,rион , нм | 0,340 | 0,276 | 0,232 | 0,228 | 0,228 | — |
| Энергия ионизации, кДж/моль: I1 I2 | 520,2 7298 | 495,8 4562 | 418,8 3052 | 403,0 2633 | 375,7 2234 | (380) (2100) |
| Электроотрицательность | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,70 |
При движении вниз по IA группе возрастает радиус атомов металлов (rмет), что, собственно, характерно для любых элементов всех главных подгрупп. Относительно малое увеличение радиуса при переходе от K к Rb и далее к Cs обусловлено заполнением 3d- и 4d-подуровней соответственно.
Относительно малое увеличение радиуса при переходе от K к Rb и далее к Cs обусловлено заполнением 3d- и 4d-подуровней соответственно.
Ионные радиусы ЩМ существенно меньше металлических, что связано с потерей единственного валентного электрона. Они также закономерно возрастают от Li+ к Cs+. Размеры же гидратированных катионов изменяются в противоположном направлении, что объясняется в рамках простейшей электростатической модели. Наименьший по размеру ион Li+ лучше катионов остальных щелочных металлов притягивает к себе полярные молекулы воды, образуя наиболее толстую гидратную оболочку. Исследования показали, что в водном растворе катион лития Li+ окружен 26 молекулами воды, из которых только 4 находятся в непосредственном контакте с ионом лития (первой координационной сфере). По этой причине многие соли лития, например, хлорид, перхлорат и сульфат, а также гидроксид выделяются из водных растворов в виде кристаллогидратов. Хлорид LiCl·Н2O теряет воду при температуре 95 °С, LiOH·Н2O — при 110°С, а LiClO4·Н2O — только при температуре выше 150°С. С увеличением ионного радиуса катиона щелочного металла сила его электростатического взаимодействия с молекулами воды ослабевает, что приводит к снижению толщины гидратной оболочки и, как следствие, радиуса гидратированного иона [М(Н2O)n] (где n = 17, 11, 10, 10 для М+ = Na+, К+, Rb+, Cs+ соответственно).
С увеличением ионного радиуса катиона щелочного металла сила его электростатического взаимодействия с молекулами воды ослабевает, что приводит к снижению толщины гидратной оболочки и, как следствие, радиуса гидратированного иона [М(Н2O)n] (где n = 17, 11, 10, 10 для М+ = Na+, К+, Rb+, Cs+ соответственно).
Внешний энергетический уровень атома ЩМ содержит один единственный электрон, который слабо связан с ядром, о чем говорят низкие значения энергии ионизации I1. Атомы щелочных металлов легко ионизируются с образованием катионов М+, входящих в состав практически всех химических соединений этих элементов. Значения I2 для всех щелочных металлов настолько высоки, что в реально осуществимых условиях ион М2+ не образуется. Электроотрицательность щелочных элементов мала, их соединения с наиболее электроотрицательными элементами (хлор, кислород, азот)имеют ионное строение, как минимум в кристаллическом состоянии.
Маленький радиус иона Li+ и высокая плотность заряда, являются причиной того, что соединения лития оказываются схожими по свойствам аналогичным соединениям магния (диагональное сходство) и в то же время отличаются от соединений остальных ЩМ.
Элементы IIA группы
В IIA группу Периодической системы элементов входят бериллий Ве, магний Мg и четыре щелочноземельных металла (ЩЗМ): кальций Са, стронций Sr, барий Ва и радий Ra, оксиды которых, раньше называемые «землями», при взаимодействии с водой образуют щелочи. Радий — радиоактивный элемент (α-распад, период полураспада примерно 1600 лет).
Электронная конфигурация и некоторые свойства элементов второй группы приведены в таблице ниже.
По электронному строению атомов элементы второй группы близки щелочным металлам. Они имеют конфигурацию благородного газа, дополненную
| Свойство | Be | Mg | Ca | Sr | Ba | Ra |
| Заряд ядра Z | 4 | 12 | 20 | 38 | 56 | 88 |
| Электронная конфигурация в основном состоянии | [He]2s2 | [Ne]3s2 | [Ar]4s2 | [Kr]5s2 | [Xe]6s2 | [Rn]7s2 |
| Металлический радиус rмет, нм | 0,112 | 0,160 | 0,197 | 0,215 | 0,217 | 0,223 |
| Ионный радиус rион*, нм | 0,027 | 0,72 | 0,100 | 0,126 | 0,142 | 0,148 |
| Энергия ионизации, кДж/моль: I1 I2 I3 | 899,5 1757 14850 | 737,7 1451 7733 | 589,8 1145 4912 | 549,5 1064 4138 | 502,8 965 3619 | 509,3 979 3300 |
| Электроотрицательность | 1,57 | 1,31 | 1,00 | 0,95 | 0,89 | 0,90 |
двумя s-электронами на внешнем уровне. В то же время от элементов первой группы они отличаются более высокими значениями энергии ионизации, убывающими в ряду Ве—Мg—Са—Sr— Ва. Эта тенденция нарушается при переходе от бария к радию: повышениe П и І, для Rа по сравнению с Ва объясняется эффектом инертной 6s2-пары.
В то же время от элементов первой группы они отличаются более высокими значениями энергии ионизации, убывающими в ряду Ве—Мg—Са—Sr— Ва. Эта тенденция нарушается при переходе от бария к радию: повышениe П и І, для Rа по сравнению с Ва объясняется эффектом инертной 6s2-пары.
Следует отметить, что в то время как для щелочных металлов характерна значительная разница между I1 и I2 для элементов второй группы подобный скачок наблюдается между I2 и I3. Именно поэтому щелочные металлы в сложных веществах проявляют только степень окисления +1, а элементы второй группы +2. Наличие единственной положительной степени окисления и невозможность восстановления ионов M2+ в водной среде придает большое сходство всем металлам s-блока.
Изменение свойств по группе следует общим закономерностям, рассмотренным на примере щелочных металлов. Элемент второго периода бериллий, подобно элементу первой группы литию, значительно отличается по своим свойствам от других элементов второй группы. Так, ион Be2+ благодаря чрезвычайно малому ионному радиусу (0,027 нм), высокой плотности заряда, большим значениям энергий атомизации и ионизации оказывается устойчивым лишь в газовой фазе при высоких температурах. Поэтому химическая связь в бинарных соединениях бериллия даже с наиболее электроотрицательными элементами (кислород, фтором) обладает высокой долей ковалентности. Химия водных растворов бериллия также имеет свою специфику: в первой координационной сфере бериллия могут находиться лишь четыре лиганда ([Be(H2O)4]2+, (Bе(OH)4]—), что связано с малым ионным радиусом металла и отсутствием d-орбиталей.
Так, ион Be2+ благодаря чрезвычайно малому ионному радиусу (0,027 нм), высокой плотности заряда, большим значениям энергий атомизации и ионизации оказывается устойчивым лишь в газовой фазе при высоких температурах. Поэтому химическая связь в бинарных соединениях бериллия даже с наиболее электроотрицательными элементами (кислород, фтором) обладает высокой долей ковалентности. Химия водных растворов бериллия также имеет свою специфику: в первой координационной сфере бериллия могут находиться лишь четыре лиганда ([Be(H2O)4]2+, (Bе(OH)4]—), что связано с малым ионным радиусом металла и отсутствием d-орбиталей.
Щелочноземельные металлы (Са, Sr, Ва, Ra) образуют единое семейство элементов, в пределах которого некоторые свойства (энергия гидратации, растворимость и термическая устойчивость солей) меняются монотонно с увеличением ионного радиуса, а многие их соединения являются изоморфными.
Элементы IIIA группы
Элементы IIIA группы: бор В, алюминий Al, галлий Ga, индий In и таллий Tl — имеют мало стабильных изотопов, что характерно для атомов с нечетными порядковыми номерами. Электронная конфигурация внешнего энергетического уровня в основном состоянии ns2nр1 характеризуется наличием одного неспаренного электрона. В возбужденном состоянии элементы IIIA группы содержат три неспаренных электрона, которые, находясь в sp2-гибридизации, принимают участие в образовании трех ковалентных связей. При этом у атомов остается одна незанятая орбиталь. Поэтому многие ковалентные соединения элементов IIIA группы являются акцепторами электронной пары (кислоты Льюиса), т.е. могут образовывать четвертую ковалентную связь по донорно-акцепторному механизму, создавая которую, они изменяют геометрию своего окружения — она из плоской становится тетраэдрической (состояние sp3-гибридизации). Бор сильно отличается по свойствам от других элементов IIIA группы. Он является единственным неметаллом, химически инертен и образует ковалентные связи со фтором, азотом, углеродом и т.д. Химия бора более близка химии кремния, в этом проявляется Диагональное сходство.
 У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома. Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-pяду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома. Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-pяду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
Для таллия, свинца, висмута и полония наиболее устойчивы соединения со степенью окисления +1, +2, +3, +4 соответственно.
| Свойство | B | Al | Ga | In | Tl |
| Заряд ядра Z | 5 | 13 | 31 | 49 | 81 |
| Электронная конфигурация в основном состоянии | [He]2s22p1 | [Ne]3s23p1 | [Ar]3d104s24p1 | [Kr]4d105s25p1 | [Xe]4f145d106s26p1 |
| Атомный радиус, нм | 0,083 | 0,143 | 0,122 | 0,163 | 0,170 |
| Энергия ионизации, кДж/моль: I1 I2 I3 | 801 2427 3660 | 577 1817 2745 | 579 1979 2963 | 558 1821 2704 | 589 1971 2878 |
| Электроотрицательность | 2,04 | 1,61 | 1,81 | 1,78 | 2,04 |
Для соединений элементов IIIA группы наиболее характерна степень окисления +3.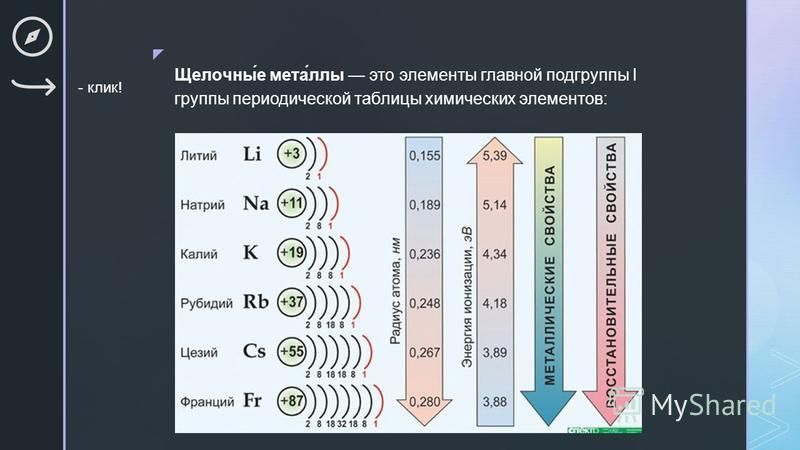 В ряду бор-алюминий-галлий-индий-таллий устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Hal в галогенидах последних при переходе от легких к более тяжелым элементам М уменьшаются, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности, склонность катионов к гидролизу (взаимодействию с водой) ослабевает.
В ряду бор-алюминий-галлий-индий-таллий устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Hal в галогенидах последних при переходе от легких к более тяжелым элементам М уменьшаются, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности, склонность катионов к гидролизу (взаимодействию с водой) ослабевает.
Химия индия и особенно галлия вообще очень близка химии алюминия. Соединения этих металлов в низших степенях окисления (Ga2O, Ga2S, InCl и др.) в водных растворах диспропорционируют. Для таллия состояние +1, напротив, является наиболее устойчивым из-за инертности электронной пары 6s2.
Валентность. Степень окисления химических элементов
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).
- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.
- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) – валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) – валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) – валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2h5 (гидразин) – валентность азота равна III, а степень окисления равна +2.
- h3 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)h5(-), B2(+3)H6(-), B(+3)h4(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)h3(-).
- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например h3(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом – фтором – степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).

- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.
- Низшая степень окисления = +№ группы – 8.
- Промежуточная степень окисления = +№ группы – 2.
Пример
Фосфор (P)
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)
Пятая группа периодической системы.
 Элементы главной подгруппы
Главная подгруппа V группы периодической системы химических элементов Д. И. Менделеева включает пять элементов азот N, фосфор Р, мышьяк Аа, сурьму 8Ь и висмут В1. Каждый из этих элементов на внешнем слое имеет 5 электронов (конфигурация С увеличением атомного номера свойства простых веществ, образованных атомами элементов этой подгруппы, закономерно изменяются увеличивается плотность, усиливается окраска, уменьшается электроотрицательность. Азот и фосфор — типичные неметаллы, висмут имеет больше металлических свойств. Мышьяк и сурьма занимают промежуточное положение. Многие их соединения обладают полупроводниковыми свойствами. Физические свойства элементов приведены в таблице 26, свойства простых веществ в таблице 27. [c.118]
Элементы главной подгруппы
Главная подгруппа V группы периодической системы химических элементов Д. И. Менделеева включает пять элементов азот N, фосфор Р, мышьяк Аа, сурьму 8Ь и висмут В1. Каждый из этих элементов на внешнем слое имеет 5 электронов (конфигурация С увеличением атомного номера свойства простых веществ, образованных атомами элементов этой подгруппы, закономерно изменяются увеличивается плотность, усиливается окраска, уменьшается электроотрицательность. Азот и фосфор — типичные неметаллы, висмут имеет больше металлических свойств. Мышьяк и сурьма занимают промежуточное положение. Многие их соединения обладают полупроводниковыми свойствами. Физические свойства элементов приведены в таблице 26, свойства простых веществ в таблице 27. [c.118]
Общая характеристика группы азот . Главную подгруппу пятой группы периодической системы составляют азот, фосфор, мышьяк, сурьма и висмут, объединяемые под общим названием подгруппы азота.
 Их атомы имеют в наружном слое пять электронов, что обусловливает преобладание у них неметаллических свойств. Их наибольшая положительная валентность равна пяти, что соответствует номеру группы в периодической системе отрицательная валентность равна трем. В системе Менделеева элементы подгруппы азота расположены левее, чем галогены и элементы подгруппы кислорода. Это объясняет их меньшее химическое сродство к водороду и металлам, т. е. более слабо выраженные неметаллические свойства. [c.154]
Их атомы имеют в наружном слое пять электронов, что обусловливает преобладание у них неметаллических свойств. Их наибольшая положительная валентность равна пяти, что соответствует номеру группы в периодической системе отрицательная валентность равна трем. В системе Менделеева элементы подгруппы азота расположены левее, чем галогены и элементы подгруппы кислорода. Это объясняет их меньшее химическое сродство к водороду и металлам, т. е. более слабо выраженные неметаллические свойства. [c.154]Главную подгруппу четвертой группы периодической системы образуют пять элементов — углерод, кремний, германий, олово и свинец. [c.404]
Главную подгруппу IV группы периодической системы элементов образуют пять элементов — углерод, кремний, германий, олово и свинец. Из них первые два относят к неметаллам, гер-маний причисляют и к металлам, и к неметаллам, а олово и свинец — к металлам. [c.45]
Общая характеристика. Азот и элементы фосфор, мышьяк, сурьма и висмут составляют главную подгруппу пятой группы периодической системы элементов Д. И. Менделеева. [c.160]
И. Менделеева. [c.160]
Азот — первый элемент главной подгруппы пятой группы периодической системы элементов Д. И. Менделеева. Электронная структура его атома соответствует формуле з 2з 2р н может быть выражена схемой [c.168]
Из элементов пятой группы периодической системы для медицины представляет интерес главная подгруппа, которая включает азот, фосфор, мышьяк, сурьму и висмут. В наружном слое атома этих элементов имеется пять электронов, поэтому способность к присоединению электронов выражена у них значительно слабее, чем у соответствующих элементов шестой я седьмой групп. С другой стороны, элементы главной подгруппы отдают электроны легче, чем элементы шестой и седьмой трупп, поэтому их кислородные соединения более устойчивы. [c.94]
Главная подгруппа VI группы периодической системы химических элементов Д. И. Менделеева, называемая также подгруппой кислорода, состоит из пяти элементов кислорода О, серы 8, селена 8е, теллура Те и полония Ро (последний радиоактивен). Внешние электронные слои их атомов содержат 6 электронов и имеют конфигурацию Главная особенность этих элементов — способность присоединять 2 электрона с образованием восьмиэлектронного слоя ближайшего инертного элемента, т. е. проявление степени окисления — 2 [c.109]
Внешние электронные слои их атомов содержат 6 электронов и имеют конфигурацию Главная особенность этих элементов — способность присоединять 2 электрона с образованием восьмиэлектронного слоя ближайшего инертного элемента, т. е. проявление степени окисления — 2 [c.109]
Азот находится в V группе периодической системы элементов. В главную подгруппу, кроме азота, входят также фосфор, мышьяк, сурьма и висмут. Атомы всех этих элементов во внешнем слое имеют по пяти электронов и обладают окислительными и восстановительными свойствами. Они могут принимать три электрона. Но способность к присоединению электронов у них выражена более слабо, чем у элементов соответствующих периодов VI и VII групп. Наоборот, они легче отдают электроны (максимально пять). [c.186]
Периодическая система состоит, как известно, из групп, которые в свою очередь включают в себя главные и побочные подгруппы элементов, обладающих схожими химическими свойствами, — в таблице они расположены друг под другом. В главной подгруппе первой группы находятся щелочные металлы — литий, калий, натрий, рубидий и цезий, а в побочной подгруппе первой группы — медь, серебро и золото. В главную подгруппу второй группы включены щелочноземельные металлы бериллий, магний, кальций, стронций, барий, радий, а в побочную — цинк, кадмий и ртуть. Третья группа начинается с неметалла бора, затем идут металлы, образующие земли алюминий, скандий, иттрий, 15 редкоземельных элементов и радиоактивный актиний. В соответствующей побочной подгруппе находятся мало известные металлы галлий, индий и таллий. В главных подгруппах четвертой и пятой групп металлический характер обнаруживают только последние члены группы, а в главных подгруппах шестой, седьмой и восьмой групп находятся только неметаллы. Но элементы побочных подгрупп этих групп периодической системы являются металлами. Особенно важны так называемые переходные металлы побочной подгруппы восьмой группы, которые образуют три подгруппы. Здесь содержатся металлы подгруппы железа и платины.
В главной подгруппе первой группы находятся щелочные металлы — литий, калий, натрий, рубидий и цезий, а в побочной подгруппе первой группы — медь, серебро и золото. В главную подгруппу второй группы включены щелочноземельные металлы бериллий, магний, кальций, стронций, барий, радий, а в побочную — цинк, кадмий и ртуть. Третья группа начинается с неметалла бора, затем идут металлы, образующие земли алюминий, скандий, иттрий, 15 редкоземельных элементов и радиоактивный актиний. В соответствующей побочной подгруппе находятся мало известные металлы галлий, индий и таллий. В главных подгруппах четвертой и пятой групп металлический характер обнаруживают только последние члены группы, а в главных подгруппах шестой, седьмой и восьмой групп находятся только неметаллы. Но элементы побочных подгрупп этих групп периодической системы являются металлами. Особенно важны так называемые переходные металлы побочной подгруппы восьмой группы, которые образуют три подгруппы. Здесь содержатся металлы подгруппы железа и платины. [c.74]
[c.74]
Общая характеристика элементов. В главную подгруппу пятой группы периодической системы входят азот, фосфор, мышьяк, сурьма и впсмут. [c.246]
Азот находится в V группе периодической системы элементов. В главную подгруппу кроме азота входят также фосфор, мышьяк, сурьма и висмут. Атомы всех этих элементов во внешнем слое имеют по пяти электронов и обла- [c.181]
ПЯТАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ. ЭЛЕМЕНТЫ ГЛАВНОЙ ПОДГРУППЫ [c.222]
Мышьяк, сурьма и висмут так же, как азот и фосфор, элементы главной подгруппы пятой группы, периодической системы. Однако из-за ряда отличных от азота и фосфора свойств их выделяют в особую подгруппу — подгруппу мышьяка. Все три элемента на внешнем электронном слое имеют по 5 электронов. Этим они сходны с азотом и фосфором. В предпоследнем их слое 18 электронов (у азота и фосфора 8 электронов). Для мышьяка и сурьмы характерные валентности 3 и 5, а для висмута 3. [c.157]
[c.157]
К главной подгруппе пятой группы периодической системы Д. И. Менделеева относятся типические элементы азот и фосфор, а также примыкающие к ним в больших периодах мышьяк, сурьма и висмут. Общее название их — подгруппа азота. [c.188]
В главную подгруппу V группы периодической системы элементов входят азот, фосфор, мышьяк, сурьма и висмут. Атомы подгруппы азота имеют во внешнем электронном слое по пять электронов (табл. 6) [c.163]
Фосфор, сурьма и висмут находятся в главной подгруппе V группы периодической системы. Фосфор — неметалл, сурьма и висмут проявляют металлические свойства. Атомы этих элементов на внешнем энергетическом уровне имеют по пять электронов (s р ). Они могут принимать три электрона. Но способность к присоединению электронов у них выражена значительно слабее, чем у элементов соответствующих периодов VI и VII групп. Для этих элементов характерны степени окисления +5, +3, —3. [c. 128]
128]
Химическое поведение элемента главной подгруппы периодической системы (как показано в гл. 5) существенно зависит от положения данного элемента по отношению к инертному газу. На основании этого проводят разделение элементов по главным и побочным подгруппам, а именно к элементам главных подгрупп (за исключением водорода, который занимает особое положение относятся те, порядковый номер которых на 1—2 единицы больше или на 5—1 единицу меньше, чем порядковый номер инертного газа. Остальные же элементы (исключая лантаниды и трансурановые элементы, которые образуют особые группы) принадлежат к побочным подгруппам периодической системы. Таким образом, все элементы распределяются по следующим пяти группам 1 — водород, 2 — главные подгруппы периодической системы, 3 — побочные подгруппы периодической системы, 4 — лантаниды, 5 — трансураны. [c.23]
Элементы пятой группы периодической системы Д. И, Менделеева почти всегда сопутствуют железу или специально вводятся в металл при его выплавке. Поэтому изучение их поведения при процессах производства стали и сплавов представляет интерес для практики. Элементы главной подгруппы фосфор, мышьяк и сурьма — являются, как правило, вредными примесями, и поэтому одна из важных задач металлургии заключается в их удалении из стали. Исследования по термодинамике распределения элементов этой подгруппы между жидким железом и шлаками ограничивались в основном изучением реакции окисления фосфора. [c.68]
Поэтому изучение их поведения при процессах производства стали и сплавов представляет интерес для практики. Элементы главной подгруппы фосфор, мышьяк и сурьма — являются, как правило, вредными примесями, и поэтому одна из важных задач металлургии заключается в их удалении из стали. Исследования по термодинамике распределения элементов этой подгруппы между жидким железом и шлаками ограничивались в основном изучением реакции окисления фосфора. [c.68]
В Периодической системе элементов фосфор находится в главной подгруппе пятой группы, в третьем периоде. Атомный номер фосфора 15, химический атомный вес 30,9738 молекула фосфора состоит из 4 атомов. Распределение электронов в атоме фосфора следующее [c.10]
Число валентных электронов атома соответствует номеру группы, в которой находится элемент в периодической системе. У атомов элементов главных подгрупп все валентные электроны расположены в наружном слое у атомов элементов побочных подгрупп и УИ1 группы часть валентных электронов находится в более глубоком электронном слое. Так, например, хлор располол ен в седьмой группе в главной подгруппе количество наружных электронов в его атоме равно 7, т. е. соответствует номеру группы наибольшая валентность хлора по кислороду 7. Марганец тоже находится в седьмой группе, но в побочной подгруппе, наибольшая валентность марганца по кислороду также равна семи и соответствует номеру группы но семь валентных электронов его находятся в двух слоях два электрона в наружном слое и пять электронов — в более глубоком. [c.64]
Так, например, хлор располол ен в седьмой группе в главной подгруппе количество наружных электронов в его атоме равно 7, т. е. соответствует номеру группы наибольшая валентность хлора по кислороду 7. Марганец тоже находится в седьмой группе, но в побочной подгруппе, наибольшая валентность марганца по кислороду также равна семи и соответствует номеру группы но семь валентных электронов его находятся в двух слоях два электрона в наружном слое и пять электронов — в более глубоком. [c.64]
Итак, к активным восстановителям относятся а) элементы главных подгрупп I, II и III групп периодической системы и из элементов четвертой группы — олово и свинец б) элементы побочных подгрупп всех групп периодической системы, в атомах которых заполняется электронами подуровень d в) элементы семейств лантаноидов и актиноидов, в атомах которых электронами заполняются подуровни / четвертого и пятого энергетических уровней. К активным же окислителям относятся кислород, сера и галогены. [c.151]
[c.151]
Четыре элемента главной подгруппы седьмой группы периодической системы Менделеева — фтор, хлор, бром и йод — по их способности образовывать с металлами соли названы галогенами (галоген значит образующий соль ). К этой же подгруппе относится пятый элемент, существование которого было предсказано Менделеевым, но разыскать его удалось только в наше время среди продуктов радиоактивного распада урана и тория, где [c.72]
Металлическими элементами, как известно, начинается каждый период (кроме первого), и число их возрастает с увеличением номера периода. Так, если в первом периоде металлических элементов нет совсем, то во втором их два, в третьем три, в четвертом тринадцать, в пятом четырнадцать, в шестом двадцать восемь. В седьмом периоде металлическими должны быть двадцать девять элементов. Элементы, составляющие главную подгруппу I группы периодической системы, называются щелочными металлами. Элементы главной подгруппы II группы (кроме бериллия) носят название щелочноземельных металлов. [c.164]
[c.164]
Полупроводники характеризуются удельным электрическим сопротивлением от 10 до 10 Ом-м. К полупроводникам относятся простые вещества, находящиеся при условиях, близких к нормальным, в твердом состоянии В, С, 81, Се, 8п, Р, Аз, 8Ь, 8, 8е, Те, I. Полупроводниками являются многие бинарные соединения оксиды (2пО, РеО), сульфиды (2п8, Стакже сложные соединения. Наиболее распространенные бинарные соединения полупроводников можно определить по простому правилу — это должны быть соединения по числу валентных электронов изоэлектронные бинарному соединению из атомов IV главной подгруппы. То есть это соединения элементов только четвертой, третьей и пятой, второй и шестой групп периодической системы. Ширина запрещенной зоны в полупроводниках изменяется от 0,08 эВ (у металла Зп) до 5,31 эВ (у неметалла С(алмаз))- [c.635]
Металлическими элементами, как известно, начинается каждый период, и число их возрастает с увеличением номера периода. Так, если в первом периоде металлических элементов нет совсем, то во втором их два, в третьем три, в четвертом тринадцать, в пятом четырнадцать, в шестом двадцать восемь. В седьмом периоде металлическими должны быть двадцать девять элементов. Металлические элементы по максимальной валентности, формам и свойствам главных соединений подразделяются на группы и подгруппы. Элементы, составляющие главную подгруппу I группы периодической системы (за исключением водорода), называются щелочными металлами. Элементы главной подгруппы П группы (кроме бериллия) носят название щелочноземельных металлов. [c.200]
В седьмом периоде металлическими должны быть двадцать девять элементов. Металлические элементы по максимальной валентности, формам и свойствам главных соединений подразделяются на группы и подгруппы. Элементы, составляющие главную подгруппу I группы периодической системы (за исключением водорода), называются щелочными металлами. Элементы главной подгруппы П группы (кроме бериллия) носят название щелочноземельных металлов. [c.200]
Общая характеристика углерода и кремния. Углерод и кремний находятся в главной подгруппе четвертой группы периодической системы. Высшая положительная и отрицательная валентность этих элементов равна четырем, что обусловлено наличием четырех электронов в наружных слоях их атомов. Углерод и кремний являются неметаллами по сравнению с неметаллами пятой группы они менее типичны. [c.175]
Сравните характер металлических свойств элементов главных подгрупп пятой, шестой и седьмой групп периодической системы. [c. 33]
33]
К ядам металлических катализаторов относятся химические соединения элементов второй подгруппы пятой и шестой групп периодической системы Ы, Р, Аз, 8Ь, О, 8, 8е, Те, а также сами эти элементы, за исключением азота. По Мэкстеду [60], ядами являются те соединения указанных элементов, в которых центральный атом обладает неподеленной парой электронов (табл. 1). При этом ядовитость кислорода обнаруживается лишь в отдельных случаях. То же можно сказать о ядовитости воды, являющейся единственным соединением, основную массу которого составляет кислород. Главные свойства других соединений кислорода определяются природой атома, связанного с кислородом. [c.90]
Основные свойства элементов главной подгруппы пятой группы удовлетворительно объясняются на основе теории валентности. Наивысшая положительная валентность (пятивалентность) элементов с порядковыми номерами 7, 15, 33, 51 и 83 следует, по теории Косселя, из того, что каждый из них содержит на пять электронов больше по сравнению с особенно устойчивыми конфигурациями с 2, 10, 28, 46 и 78 электронами (см. рис. 28 на стр. 136). Трехвалентность элементов главной подгруппы пятой группы по отношению к электроположительным элементам, например к водороду, также объясняется стремлением их приобрести особенно устойчивые электронные конфигурации, а именно такие, которые имеются у инертных газов, стоящих в периодической системе после элементов главной подгруппы пятой группы. [c.566]
рис. 28 на стр. 136). Трехвалентность элементов главной подгруппы пятой группы по отношению к электроположительным элементам, например к водороду, также объясняется стремлением их приобрести особенно устойчивые электронные конфигурации, а именно такие, которые имеются у инертных газов, стоящих в периодической системе после элементов главной подгруппы пятой группы. [c.566]
Указал (1814) состав многих соединений щелочных и щелочноземельных металлов, метана, этилового спирта, этилена. Первым обратил внимание на аналогию в свойствах азота, фосфора, мышьяка и сурьмы — химических элементов, составивших впоследствии главную подгруппу пятой группы периодической системы. Результаты работ Авогадро по молекулярной теории были признаны лишь в 1860 на I Международном конгрессе химиков в Карлсруэ. В 1820—1840 занимался электрохимией, изучал тепловое расширение тел, теплоемкости и атомные объемы при этом получил выводы, которые координируются с результатами исследований Д. И. Менделеева по удельным объемам тел и современными представлениями о строении вещества. Издал труд Физика весовых тел, или же трактат об общей конструкции тел (т. 1—4, 1837—1841), в котором, в частности, намечены пути к представлениям о нестехиомет-ричности твердых тел и о зависимости свойств кристаллов от их геометрии. [22, 23, 32, 113, 126, [c.10]
Менделеева по удельным объемам тел и современными представлениями о строении вещества. Издал труд Физика весовых тел, или же трактат об общей конструкции тел (т. 1—4, 1837—1841), в котором, в частности, намечены пути к представлениям о нестехиомет-ричности твердых тел и о зависимости свойств кристаллов от их геометрии. [22, 23, 32, 113, 126, [c.10]
Фосфор является представителем главной подгруппы пятой группы периодической системы Д. И. Менделеева и относится к типичным неметаллическим элементам. Металлоиодные свойства этого элемента объясняются тем, что его пять валентных электронов (два — 5 и три—р-электрона) расположены на внешнем энергетическом уровне. Электронная конфигурация нейтрального атома фосфора описывается следующим образом [c.106]
Элементы главной подгруппы пятой группы (включая мышьяк), обладающие ме-таллическимхарактером, не образуют соединений. Наоборот, Аз и ЗЬ, а также 8Ь и В1 неограниченно образуют между собой твердые растворы. Аз и В1 не способны к образованию твердых растворов. В расплавленном состоянии эти элементы растворяются один в другом неограниченно. Также и с металлами предшествующих главных подгрупп периодической системы в расплавленном состоянии они смешиваются, как правило, во всех отношениях. (Единственное известное исключение представляет система А1—В1.) В твердом состоянии с металлами двух первых главных подгрупп они образуют не твердые растворы, а соединения (см. табл. 98). Все соединения со щелочными и щелочноземельными металлами по своему составу соответствуют одному и тому же типу, а именно типу водородных соединений ВНз. Их следует рассматривать в каче стве истинных валентных соединений , прибли дсаюпщхся, по-видимому, к солеобразным соединением. Это, между прочим, подтверждается и тем, что таким соединениям на диаграммах состояния соответствующих систем отвечают особо четкие максимумы температур плавления. Но, кроме того, образуются еще и многочисленные соединения, которые не отвечают обычным соотношениям, допустимым с точки зрения валентностей соединяющихся элементов.
Аз и В1 не способны к образованию твердых растворов. В расплавленном состоянии эти элементы растворяются один в другом неограниченно. Также и с металлами предшествующих главных подгрупп периодической системы в расплавленном состоянии они смешиваются, как правило, во всех отношениях. (Единственное известное исключение представляет система А1—В1.) В твердом состоянии с металлами двух первых главных подгрупп они образуют не твердые растворы, а соединения (см. табл. 98). Все соединения со щелочными и щелочноземельными металлами по своему составу соответствуют одному и тому же типу, а именно типу водородных соединений ВНз. Их следует рассматривать в каче стве истинных валентных соединений , прибли дсаюпщхся, по-видимому, к солеобразным соединением. Это, между прочим, подтверждается и тем, что таким соединениям на диаграммах состояния соответствующих систем отвечают особо четкие максимумы температур плавления. Но, кроме того, образуются еще и многочисленные соединения, которые не отвечают обычным соотношениям, допустимым с точки зрения валентностей соединяющихся элементов. Эти соединения обладают значительно более низкими температурами плавления, в ряде случаев они плавятся инконгруентно. [c.631]
Эти соединения обладают значительно более низкими температурами плавления, в ряде случаев они плавятся инконгруентно. [c.631]
Водородные соединения элементов подгруппы щелочных металлов, входящих в первую группу периодической системы (как видно на примере гидрида лития), и элементов второй группы (как видно на примере гидридов бериллия, магния, цинка и кадмия) были получены с хорошими выходами путем восстановления моноалкильных и диалкильных производных соответствующих металлов [1, 52] исключение составили диэтилртуть и дифенилртуть [52, 53], причем последняя разлагается на рт ть и бензол [53]. Однако метильные производные элементов третьей группы — бора, алюминия и галлия — не вступают нормально в реакцию с алюмогидридом лития, но образуют гидрид диметилалюминия (СНз)гА1Н и соединения типа Ь1М (СНз)Нз, где М один из упомянутых выше элементов [1336]. С алкильными производными элементов четвертой, пятой и шестой главных подгрупп алюмогидрид лития в реакцию не вступает [1336].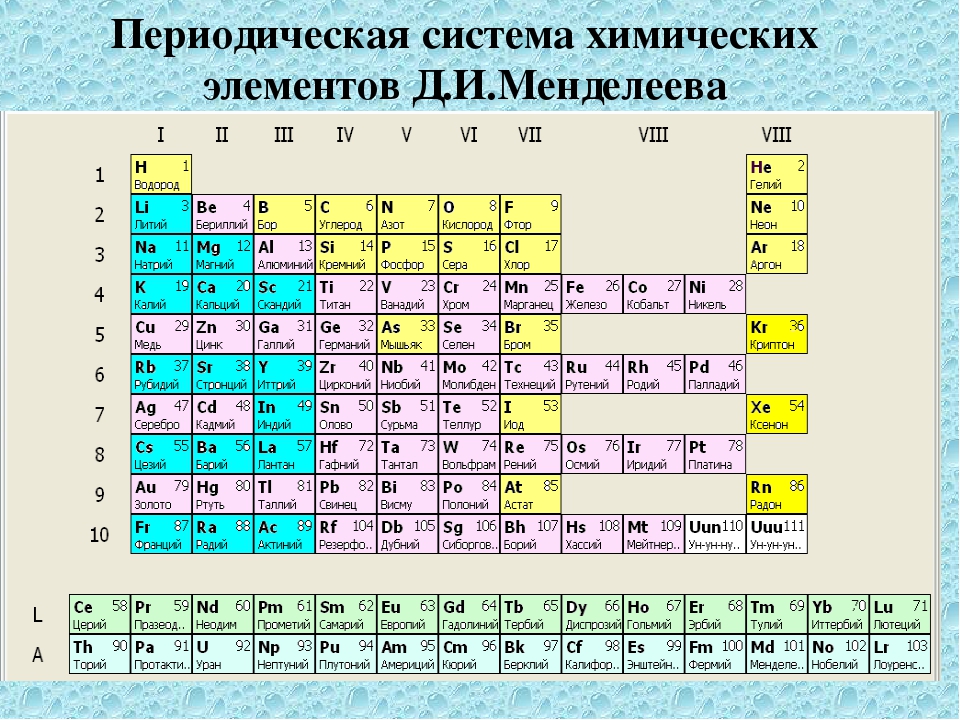 По-видимому, чем более электроположителен элемент, с которым связаны алкильные группы, тем легче последние замещаются в этих реакциях на водород. Обратная зависимость наблюдается при гидрогенизации галогенидов. Галогениды элементов третьей, четвертой и пятой [c.16]
По-видимому, чем более электроположителен элемент, с которым связаны алкильные группы, тем легче последние замещаются в этих реакциях на водород. Обратная зависимость наблюдается при гидрогенизации галогенидов. Галогениды элементов третьей, четвертой и пятой [c.16]
Химические свойства элемента определяются количеством валентных электронов. Очень устойчив при химических превращениях благородногазовый октет (s p ). У типических элементов валентные электроны расположены во внешнем слое. Аналоги лития (см. табл. 5.4) имеют только один валентный электрон (s ) У электронов подгруппы бериллия их два (s ) элементы, составляющие главную подгруппу III группы, во внешнем электронном. слое имеют три валентных электрона (s p ), аналоги углерода — четыре электрона (s p ), азота — пять (s p ), кислорода — шесть (s p ) н, наконец, галогенысемь электронов (s p ). Для типических элементов количество валентных электронов совпадает с номером группы в периодической системе элементов. [c.144]
[c.144]
На приводимом графике (рис. 1) сопоставлены аналитическая классификация катионов (по сероводородному методу) с положением соответствующих элементов в периодической системе Д. И. Менделеева. На оси абсцисс отложены порядковые номера рассматриваемых элементов (катионов). На верхней части оси ординат отложены отрезки., соответствующие пяти группам аналитической классификации катионов. Нижняя часть оси ординат разбита на отрезки, соответс гвуюигие группам периодической системы, с подразделением их на подгруппы главные — а и побочные — б. [c.38]
Побочную подгруппу VII группы периодической системы составляют элементы марганец, технеций и рений. В отличие от элементов главной подгруппы, валентные электроны в их атомах находятся на двух незаполненных электронных слоях и легко отрываются. Два электрона расположены на внешнем электронном слое и пять сверхоктетных на предпоследнем (в отличие от элементов главной подгруппы). [c. 436]
436]
Неметаллы: простые вещества – свойства неметаллов, история открытия – химия 9 класс
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Химия. Базовый уровень. 10 класс. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Простота и доступность изложения курса органической химии , большое количество иллюстраций , а также разнообразные вопросы упражнения и задачи способствуют успешному усвоению учебного материала. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
КупитьФизические свойства неметаллов.
 Аллотропия
АллотропияЕсли смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
- Реакции с металлами.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Са + Сl2 = СаСl2
Са + O2 = СаO2
Na + Сl2 = Na+Сl2
- Реакции с водородом
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
Cl2 + H2 = 2HCl
С + 2Н2 = СН4
- Реакции с кислородом.
S + O2 = SO2
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
Что ещё почитать?
ОГЭ по химии — 2019: расписание, критерии оценивания, типы заданий
Биография Д.И. Менделеева. Интересные факты из жизни великого химика
Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
- они проводят тепло и электрический ток;
- для них характерен металлический блеск;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
Попытки открытия фтора стоили исследователям не только здоровья, но и жизни. Деви, братья Кнокс, Гей-Люссак — это неполный список жертв науки, что потеряли здоровье в попытках выделить фтор из плавикового шпата. Лишь в 1886 году Муассан решил сложную задачу способом электролиза. И получил первый галоген, а ещё – ядовитый хлор. Во времена Первой мировой войны его использовали как оружие массового поражения.
В настоящее время открыто 22 неметаллических элемента.
#ADVERTISING_INSERT#
элементов
элементов Элементы расположены в периодической таблице по реакционной способности.
Элементы с аналогичной реакционной способностью помещаются в один столбец или группу . У некоторых из этих групп есть особые названия.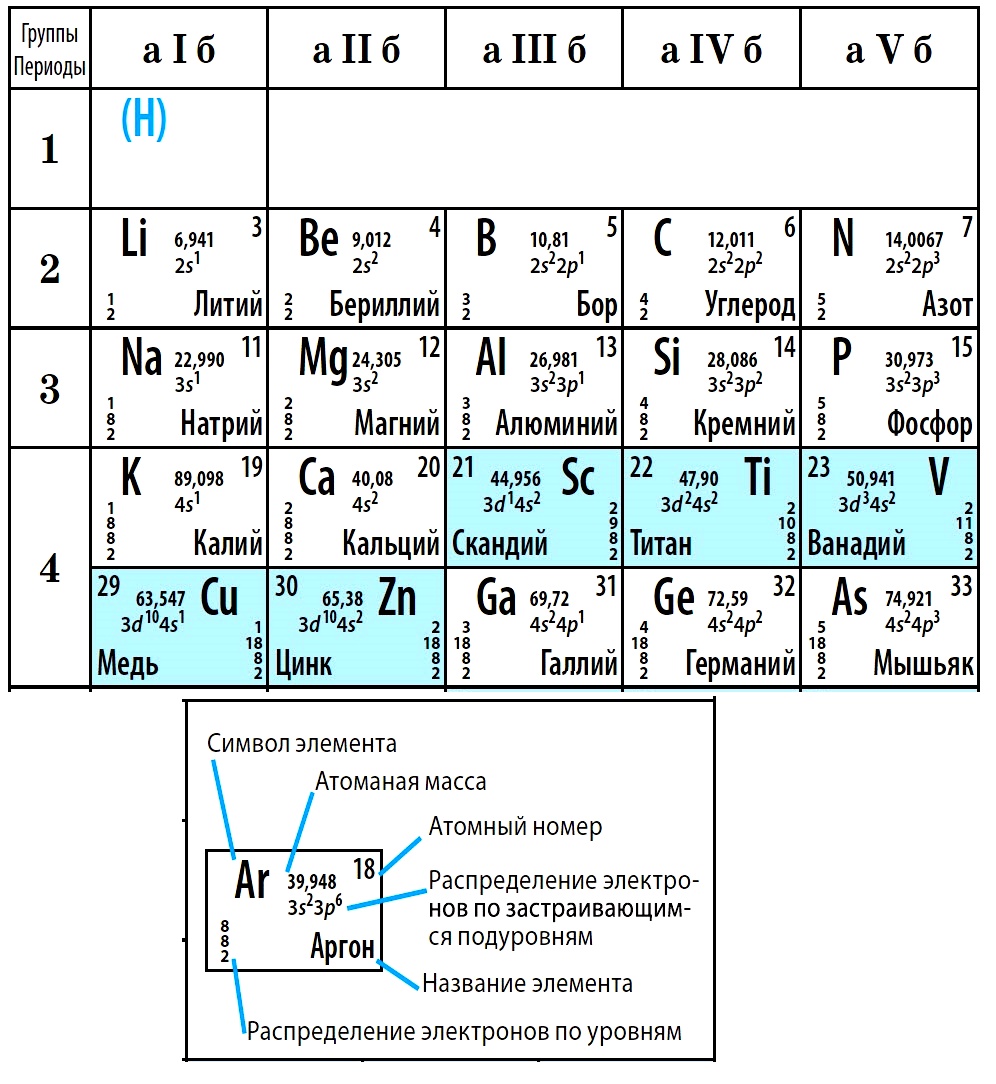 Элементы в группе IA называются щелочными металлами .
Элементы в группе IIA называются щелочноземельными металлами , .
Элементы в группе VIIA называются галогенами , и
Элементы в группе VIIIA называются благородными газами или инертными газами .
Металлы в группе IB (медь, серебро и золото) иногда называют металлами. чеканка металлов . Колонны
с B (с IB по VIIIB) называются переходными элементами .
Столбцы с буквой A (от IA до VIIIA) называются основной группой .
элементы .
Элементы в группе IA называются щелочными металлами .
Элементы в группе IIA называются щелочноземельными металлами , .
Элементы в группе VIIA называются галогенами , и
Элементы в группе VIIIA называются благородными газами или инертными газами .
Металлы в группе IB (медь, серебро и золото) иногда называют металлами. чеканка металлов . Колонны
с B (с IB по VIIIB) называются переходными элементами .
Столбцы с буквой A (от IA до VIIIA) называются основной группой .
элементы .
Элементы также можно разделить на две основные группы: металлы и
неметаллы.Металлы обычно
имеют металлический блеск (блестящие), пластичны (сгибаются) и проводят электричество.
Неметаллы обычно не проявляют этих свойств.
Есть некоторые элементы, которые показывают некоторые, но не все, металлические
характеристики. Эти элементы
называются металлоидами и обозначаются здесь как полупроводники.
Электроны – это клей, который скрепляет атомы в соединениях. Электроны внешней оболочки образуют эти связи между атомы. Первые два квантовых числа n (оболочка) и l (подоболочка) важны для понимание связи.В этом класс мы ориентируемся на оболочку. В оболочки соответствуют орбитам модели Бора. (См. Лекцию 10.3)
Первая оболочка – самая маленькая, поэтому она может содержать максимум 2 электрона. Вторая оболочка может содержать максимум 8 электронов. Третья оболочка может содержать не более 18 электронов, но она особенно стабилен на 8 электронах.
Поскольку реагируют именно внешние оболочки, нас больше всего интересуют
электроны внешней оболочки.Мы можем
Обозначьте количество электронов во внешней оболочке точками.
Внешняя оболочка получила название валентных электронов.
Официально валентные электроны – это электроны на внешней оболочке
незаряженный атом. Хлор имеет 7
электронов в его внешней оболочке и поэтому может представить его как Cl с семью
точки вокруг него.
становится . Обратите внимание, как 2 электрона в первая оболочка и 8 электронов во второй являются электронами внутренней оболочки и являются не написано точками. Вот диаграмма основных элементов группы и их точечные символы Льюиса.
Обратите внимание, что для элементов основной группы количество валентных электронов равно равняется номеру группы.
Современная периодическая таблица: периоды и группы
Цели обучения
- Опишите устройство современной таблицы Менделеева.
Как английский словарь менялся с течением времени?
Язык меняется со временем. Новые слова входят в язык, а старые слова часто исчезают из-за отсутствия использования.Словари публикуются, чтобы люди могли успевать за изменениями в языке и знать, как правильно использовать слова.
Эти публикации могут быть печатными или электронными. Словари можно найти в Интернете, а приложения доступны для смартфонов. Словари неоценимы для хорошего и надежного общения.
Словари неоценимы для хорошего и надежного общения.
Периодическая таблица Менделеева претерпела значительные изменения с тех пор, как она была первоначально разработана Менделеевым и Мозли. Было открыто много новых элементов, а другие синтезированы искусственно.Каждый правильно вписывается в группу элементов с похожими свойствами. Периодическая таблица представляет собой расположение элементов в порядке их атомных номеров, так что элементы с аналогичными свойствами появляются в одном вертикальном столбце или группе.
На рисунке ниже показана наиболее часто используемая форма таблицы Менделеева. Каждый квадрат показывает химический символ элемента вместе с его названием. Обратите внимание, что некоторые символы не связаны с названием элемента: Fe для железа, Pb для свинца и т. Д.Большинство из них – элементы, известные с древних времен и имеющие символы, основанные на их латинских названиях. Атомный номер каждого элемента написан над символом.
Период – горизонтальная строка периодической таблицы.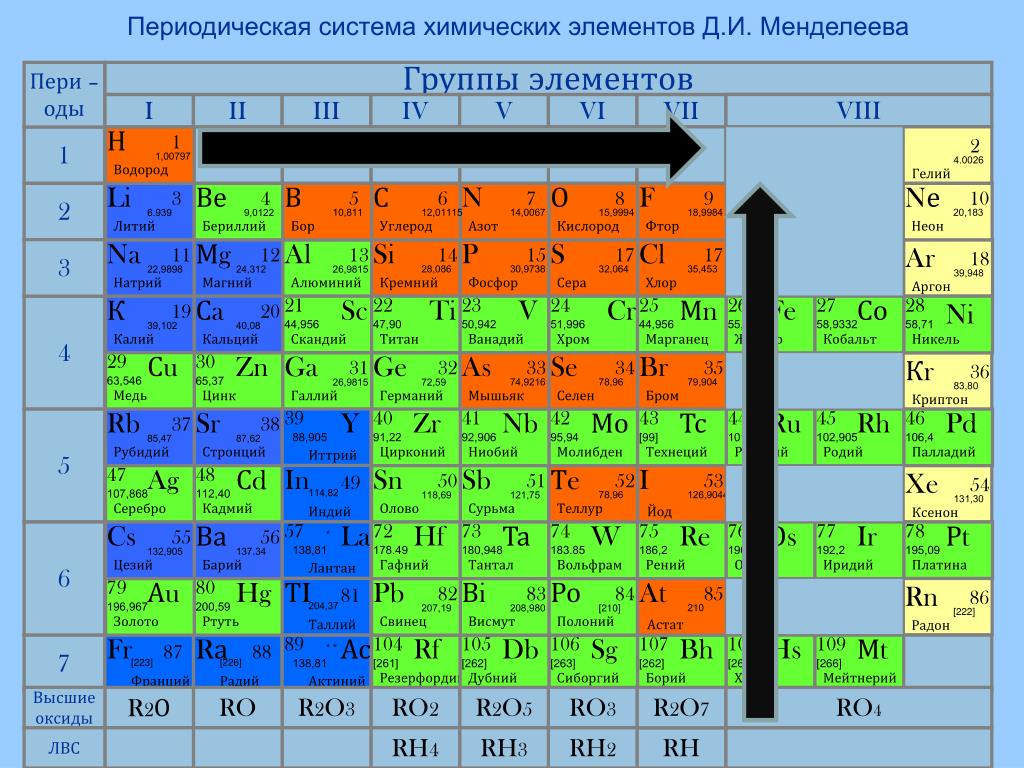 В периодической таблице есть семь периодов, каждый из которых начинается в крайнем левом углу. Новый период начинается, когда новый основной энергетический уровень начинает заполняться электронами. В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 – 8 элементов.Периоды 4 и 5 содержат 18 элементов. Периоды 6 и 7 содержат 32 элемента, потому что две нижние строки, которые отделены от остальной части таблицы, принадлежат этим периодам. Их вытаскивают, чтобы сама таблица умещалась на одной странице.
В периодической таблице есть семь периодов, каждый из которых начинается в крайнем левом углу. Новый период начинается, когда новый основной энергетический уровень начинает заполняться электронами. В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 – 8 элементов.Периоды 4 и 5 содержат 18 элементов. Периоды 6 и 7 содержат 32 элемента, потому что две нижние строки, которые отделены от остальной части таблицы, принадлежат этим периодам. Их вытаскивают, чтобы сама таблица умещалась на одной странице.
Группа представляет собой вертикальный столбец периодической таблицы, основанный на организации электронов внешней оболочки. Всего насчитывается 18 групп. Есть две разные системы нумерации, которые обычно используются для обозначения групп, и вы должны быть знакомы с обеими.Традиционная система, используемая в Соединенных Штатах, включает использование букв A и B. Первые две группы – это 1A и 2A, а последние шесть групп – от 3A до 8A. Средние группы используют B в своих названиях. К сожалению, в Европе действовала несколько иная система. Чтобы избежать путаницы, Международный союз теоретической и прикладной химии (IUPAC) решил, что официальная система нумерации групп будет простой от 1 до 18 слева направо. Многие периодические таблицы показывают обе системы одновременно.
К сожалению, в Европе действовала несколько иная система. Чтобы избежать путаницы, Международный союз теоретической и прикладной химии (IUPAC) решил, что официальная система нумерации групп будет простой от 1 до 18 слева направо. Многие периодические таблицы показывают обе системы одновременно.
Сводка
- Таблица Менделеева расположена в порядке атомного номера .
- Период – это горизонтальный ряд периодической таблицы.
- Группа представляет собой вертикальный ряд периодической таблицы Менделеева.
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://pontotriplo.org/triplepoint/2007/05/the_best_55_online_periodic_tables.html
- Выберите периодическую таблицу из столбца «лучший», который вам нравится больше всего.Почему вы выбрали этот стол?
- Какая таблица Менделеева из «конкретного» раздела вам больше всего нравится? Почему?
- Какая из «забавных» периодических таблиц вам нравится больше всего? Почему?
Обзор
- Чем сегодняшняя таблица Менделеева отличается от той, которую опубликовал Менделеев?
- Все ли элементы современной таблицы Менделеева встречаются в природе? Поясните свой ответ.

- Что такое «точка»? Что это собой представляет?
- Что такое «группа»? Что это собой представляет?
- Почему для групп используются две разные системы нумерации?
Глоссарий
- группа: Элементы с аналогичными химическими свойствами появляются через определенные промежутки времени в вертикальных столбцах.
- период: Период – это горизонтальный ряд периодической таблицы.
2.3: Семейства и периоды периодической таблицы
- Последнее обновление
- Сохранить как PDF
- Семейства периодической таблицы
- Периоды периодической таблицы
- Резюме
- Словарь
- Участники
Навыки для развития
- Укажите название и расположение определенных групп в периодической таблице, включая щелочные металлы, щелочноземельные металлы, благородные газы, галогены и переходные металлы.
- Объясните взаимосвязь между химическим поведением семейств в периодической таблице и их электронными конфигурациями.
- Определить элементы, которые будут иметь наиболее похожие свойства с данным элементом.
Химическое поведение атомов контролируется их электронной конфигурацией. Поскольку семейства элементов были организованы по их химическому поведению, вполне предсказуемо, что отдельные члены каждого химического семейства будут иметь схожие электронные конфигурации.
Семейства периодической таблицы
Помните, что Менделеев устроил периодическую таблицу таким образом, чтобы элементы с наиболее похожими свойствами были помещены в одну группу. Группа – это вертикальный столбец периодической таблицы. Все элементы 1A имеют один валентный электрон. Это то, что заставляет эти элементы реагировать так же, как и другие члены семьи. Все элементы в 1A очень реакционноспособны и образуют соединения в одинаковых соотношениях с аналогичными свойствами с другими элементами. Из-за сходства химических свойств Менделеев поместил эти элементы в одну группу. Группа 1А также известна как щелочные металлы . Хотя большинство металлов имеют тенденцию быть очень твердыми, на самом деле эти металлы мягкие и легко поддаются резке.
Из-за сходства химических свойств Менделеев поместил эти элементы в одну группу. Группа 1А также известна как щелочные металлы . Хотя большинство металлов имеют тенденцию быть очень твердыми, на самом деле эти металлы мягкие и легко поддаются резке.
Группа 2А также называется щелочноземельными металлами . Опять же, из-за их сходства в электронных конфигурациях эти элементы имеют схожие свойства друг с другом. То же самое верно и для других групп периодической таблицы.Помните, Менделеев расположил таблицу таким образом, чтобы элементы с наиболее похожими свойствами находились в одной группе в периодической таблице.
Важно узнать пару других важных групп в периодической таблице по названию группы. Элементы группы 7А (или 17) также называют галогенами . Эта группа содержит очень реактивные неметаллические элементы.
Благородные газы относятся к группе 8A. Эти элементы также имеют схожие свойства друг с другом, наиболее важным свойством является то, что они крайне инертны и редко образуют соединения.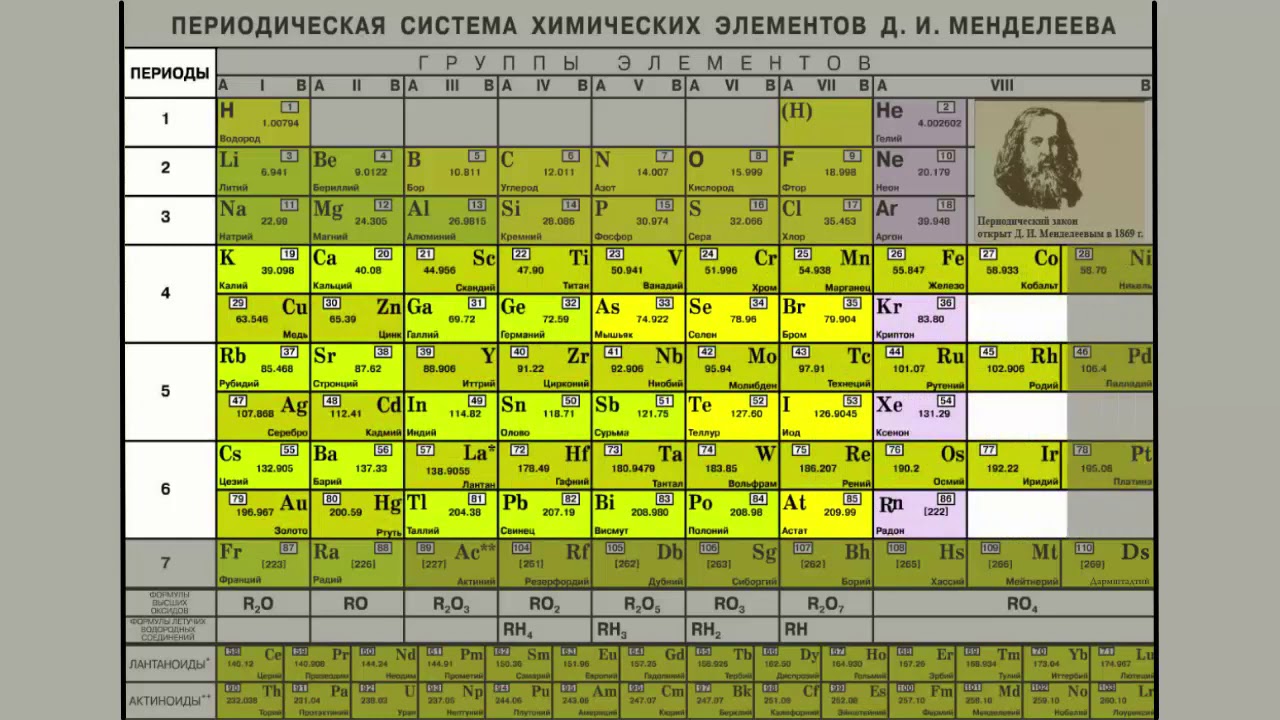 Мы узнаем причину этого позже, когда обсудим, как образуются соединения. Элементы этой группы также являются газами при комнатной температуре.
Мы узнаем причину этого позже, когда обсудим, как образуются соединения. Элементы этой группы также являются газами при комнатной температуре.
Альтернативная система нумерации нумерует все блочные элементы \ (s \), \ (p \) и \ (d \) от 1 до 18. В этой системе нумерации группа 1A является группой 1; группа 2А – это группа 2; галогены (7А) относятся к группе 17; а благородные газы (8A) относятся к группе 18. Вы встретите периодические таблицы с обеими системами нумерации. Важно распознать, какая система нумерации используется, и уметь определять количество валентных электронов в основных блочных элементах независимо от того, какая система нумерации используется.
Периоды Периодической таблицы элементов
Если вы можете найти элемент в Периодической таблице, вы можете использовать положение элемента, чтобы вычислить уровень энергии валентных электронов элемента. Период – это горизонтальный ряд элементов периодической таблицы. Например, элементы натрия (\ (\ ce {Na} \)) и магния (\ (\ ce {Mg} \)) оба находятся в периоде 3. Элементы астатин (\ (\ ce {At} \)) и радон (\ (\ ce {Rn} \)) находятся в периоде 6.
Элементы астатин (\ (\ ce {At} \)) и радон (\ (\ ce {Rn} \)) находятся в периоде 6.
Сводка
- Вертикальные столбцы в периодической таблице называются группами или семьями из-за схожего химического поведения.
- Все члены семейства элементов имеют одинаковое количество валентных электронов и сходные химические свойства.
- Горизонтальные ряды периодической таблицы называются периодами.
Словарь
- Группа (семья): Вертикальный столбец в периодической таблице.
- Щелочные металлы: Группа 1А периодической таблицы Менделеева.
- Щелочноземельные металлы: Группа 2А периодической таблицы Менделеева.
- Галогены: Группа 7А периодической таблицы.
- Благородные газы: Группа 8А периодической таблицы.
- Переходные элементы: группы с 3 по 12 периодической таблицы.
Авторы
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.

Разница между группой элементов и периодом
Группы и периоды – это два способа классификации элементов в периодической таблице.Периоды представляют собой горизонтальные строки (поперек) периодической таблицы, а группы – это вертикальные столбцы (вниз) таблицы. Атомный номер увеличивается по мере продвижения вниз по группе или по периоду.
Группы элементов
Элементы в группе имеют общее количество валентных электронов. Например, все элементы в группе щелочноземельных металлов имеют валентность, равную двум. Элементы, принадлежащие к группе, обычно имеют несколько общих свойств.
Группы в периодической таблице имеют множество разных названий:
| Название IUPAC | Общее название | Семья | Старый ИЮПАК | CAS | банкноты |
| Группа 1 | металлы щелочные | литиевое семейство | IA | IA | без водорода |
| Группа 2 | металлы щелочноземельные | Семейство бериллий | IIA | IIA | |
| Группа 3 | семейство скандиев | IIIA | IIIB | ||
| Группа 4 | семейство титанов | IVA | IVB | ||
| Группа 5 | Семейство ванадия | ВА | ВБ | ||
| Группа 6 | Семейство хрома | ЧЕРЕЗ | VIB | ||
| Группа 7 | марганцевое семейство | VIIA | VIIB | ||
| Группа 8 | семейство утюгов | VIII | VIIIB | ||
| Группа 9 | семейство кобальтов | VIII | VIIIB | ||
| Группа 10 | никелевое семейство | VIII | VIIIB | ||
| Группа 11 | чеканки металлов | медная семья | IB | IB | |
| Группа 12 | Металлы летучие | цинковые семейства | IIB | IIB | |
| Группа 13 | icoasagens | Семейство бора | IIIB | IIIA | |
| Группа 14 | тетрелы, кристаллогены | углеродное семейство | IVB | IVA | тетрель от греческого тетра на четверку |
| Группа 15 | пентелей, пниктогенов | азотное семейство | ВБ | ВА | пентелей от греческой пенты на пять |
| Группа 16 | халькогенов | кислородное семейство | VIB | ЧЕРЕЗ | |
| Группа 17 | галогены | Семейство фторов | VIIB | VIIA | |
| Группа 18 | газы благородные, аэрогены | Семейство гелия или неоновое семейство | Группа 0 | VIIIA |
Другой способ группировки элементов основан на их общих свойствах (в некоторых случаях эти группировки не соответствуют столбцам в периодической таблице). Такие группы включают щелочные металлы, щелочноземельные металлы, переходные металлы (включая редкоземельные элементы или лантаноиды, а также актиниды), основные металлы, металлоиды или полуметаллы, неметаллы, галогены и благородные газы. В рамках этой системы классификации водород – неметалл. Неметаллы, галогены и благородные газы – это все типы неметаллических элементов. Металлоиды обладают промежуточными свойствами. Все остальные элементы металлические.
Такие группы включают щелочные металлы, щелочноземельные металлы, переходные металлы (включая редкоземельные элементы или лантаноиды, а также актиниды), основные металлы, металлоиды или полуметаллы, неметаллы, галогены и благородные газы. В рамках этой системы классификации водород – неметалл. Неметаллы, галогены и благородные газы – это все типы неметаллических элементов. Металлоиды обладают промежуточными свойствами. Все остальные элементы металлические.
Периоды элементов
Элементы в периоде имеют самый высокий уровень энергии невозбужденных электронов.В одни периоды элементов больше, чем в другие, потому что количество элементов определяется количеством электронов, разрешенных на каждом подуровне энергии.
Для природных элементов существует семь периодов:
- Период 1: H, He (не следует правилу октетов)
- Период 2: Li, Be, B, C, N, O, F, Ne (включает s- и p-орбитали)
- Период 3: Na, Mg, Al, Si, P, S, Cl, Ar (все имеют по крайней мере 1 стабильный изотоп)
- Период 4: K, Ca, Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Ga, Ge, As, Se, Br, Kr (первый период с элементами d-блока)
- Период 5: Rb, Sr, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd, In, Sn, Sn, Te, I, Xe (такое же количество элементов, что и в периоде 4, те же общие структура, и включает первый исключительно радиоактивный элемент, Tc)
- Период 6: Cs, Ba, La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg, Tl, Pb, Bi, Po, At, Rn (первый период с элементами f-блока)
- Период 7: Fr, Ra, Ac, Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr, Rd, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn, Uut, Fl, Uup, Lv, Uus, Uuo (все элементы радиоактивны; содержат самые тяжелые природные элементы)
Семейство элементов Периодической таблицы
Элементы можно классифицировать по семействам элементов. Знание того, как определять семейства, какие элементы входят в состав, и их свойства, помогает предсказать поведение неизвестных элементов и их химические реакции.
Знание того, как определять семейства, какие элементы входят в состав, и их свойства, помогает предсказать поведение неизвестных элементов и их химические реакции.
Семейства элементов
Семейства элементов обозначены числами, расположенными вверху таблицы Менделеева.Тодд Хелменстайн
Семейство элементов – это набор элементов, обладающих общими свойствами. Элементы классифицируются по семействам, потому что три основные категории элементов (металлы, неметаллы и полуметаллы) очень широки.Характеристики элементов этих семейств определяются в первую очередь количеством электронов во внешней энергетической оболочке. С другой стороны, группы элементов – это совокупности элементов, категоризированных по схожим свойствам. Поскольку свойства элементов в значительной степени определяются поведением валентных электронов, семейства и группы могут быть одинаковыми. Однако есть разные способы разбивки элементов на семейства. Во многих учебниках химии и химии выделяются пять основных семейств:
5-элементные семейства
- Щелочные металлы
- Щелочноземельные металлы
- Переходные металлы
- Галогены
- Благородные газы
9-элементные семейства
Другой распространенный метод категоризации распознает девять семейств элементов:
- Щелочные металлы: Группа 1 (IA) – 1 валентный электрон
- Щелочноземельные металлы: Группа 2 (IIA) – 2 валентных электрона
- Переходные металлы: Группы 3-12 – металлы блока d и f имеют 2 валентных электрона
- Группа бора или земные металлы: Группа 13 (IIIA) – 3 валентных электрона
- Углеродная группа или тетрелы: – Группа 14 (IVA) – 4 валентных электрона
- Группа азота или пниктогены: – Группа 15 (VA) – 5 валентных электронов
- Кислородная группа или халькогены: – Группа 16 (VIA) – 6 валентных электронов
- Галогены: – Группа 17 (VIIA) – 7 валентных электронов
- Благородные газы: – Группа 18 (VIIIA) – 8 валентных электронов
Распознавание семей в периодической таблице
Столбцы периодической таблицы обычно отмечают группы или семьи. Для нумерации семейств и групп использовались три системы:
Для нумерации семейств и групп использовались три системы:
- В старой системе ИЮПАК использовались римские цифры вместе с буквами, чтобы различать левую (A) и правую (B) стороны периодической таблицы.
- В системе CAS используются буквы для различения элементов основной группы (A) и переходных (B) элементов.
- В современной системе ИЮПАК используются арабские числа от 1 до 18, просто пронумерованные столбцы периодической таблицы слева направо.
Многие периодические таблицы содержат как римские, так и арабские числа.Арабская система нумерации сегодня является наиболее широко принятой.
Щелочные металлы или семейство элементов группы 1
Выделенные элементы периодической таблицы принадлежат к семейству щелочных металлов.Тодд Хелменстайн
Щелочные металлы считаются группой и семейством элементов. Эти элементы – металлы. Натрий и калий являются примерами элементов этого семейства. Водород не считается щелочным металлом, потому что газ не проявляет типичных свойств группы.Однако при правильных условиях температуры и давления водород может быть щелочным металлом.
- Группа 1 или IA
- Щелочные металлы
- 1 валентный электрон
- Мягкие металлические частицы
- Блестящий, блестящий
- Высокая теплопроводность и электрическая проводимость
- Низкие плотности, увеличивающиеся с атомной массой
- Относительно низкие температуры плавления, уменьшающиеся с увеличением атомной массы
- Энергичная экзотермическая реакция с водой с образованием газообразного водорода и раствора гидроксида щелочного металла
- Ионизируйте, чтобы потерять свой электрон, поэтому ион имеет заряд +1
Щелочноземельные металлы или семейство элементов группы 2
Выделенные элементы этой периодической таблицы принадлежат к семейству щелочноземельных элементов.Тодд ХелменстайнЩелочноземельные металлы или просто щелочноземельные металлы признаны важной группой и семейством элементов. Эти элементы – металлы. Примеры включают кальций и магний.
- Группа 2 или IIA
- Щелочноземельные металлы (Щелочноземельные металлы)
- 2 валентных электрона
- Твердые металлические вещества тверже щелочных металлов
- Блестящий, блестящий, легко окисляется
- Высокая теплопроводность и электрическая проводимость
- Более плотный, чем щелочные металлы
- Более высокие температуры плавления, чем у щелочных металлов
- Экзотермическая реакция с водой, усиливающаяся по мере продвижения вниз по группе; бериллий не реагирует с водой; магний реагирует только с паром
- Ионизируйте, чтобы потерять валентные электроны, поэтому ион имеет заряд +2
Семейство элементов переходных металлов
Выделенные элементы этой таблицы Менделеева принадлежат к семейству элементов переходных металлов.Ряды лантаноидов и актинидов, расположенные ниже основной части таблицы Менделеева, также являются переходными металлами. Тодд ХелменстайнСамое большое семейство элементов состоит из переходных металлов. В центре таблицы Менделеева находятся переходные металлы, плюс два ряда под основной таблицей (лантаноиды и актиниды) – это особые переходные металлы.
- Группы 3-12
- Переходные металлы или переходные элементы
- Металлы блока d и f имеют 2 валентных электрона
- Твердые металлические частицы
- Блестящий, блестящий
- Высокая теплопроводность и электрическая проводимость
- плотный
- Высокая температура плавления
- Крупные атомы имеют разную степень окисления
Группа бора или семейство элементов земных металлов
Это элементы, принадлежащие к семейству бора.Тодд ХелменстайнГруппа бора или семейство земных металлов не так хорошо известны, как некоторые другие семейства элементов.
- Группа 13 или IIIA
- Группа бора или земные металлы
- 3 валентных электрона
- Различные свойства, промежуточные между свойствами металлов и неметаллов
- Самый известный член: алюминий
Группа углерода или семейство элементов Тетрелс
Выделенные элементы относятся к семейству элементов углерода.Эти элементы вместе известны как тетрелы. Тодд ХелменстайнУглеродная группа состоит из элементов, называемых тетрелами, что означает их способность нести заряд 4.
- Группа 14 или IVA
- Carbon Group или Tetrels
- 4 валентных электрона
- Различные свойства, промежуточные между свойствами металлов и неметаллов
- Самый известный член: углерод, который обычно образует 4 связи
Группа азота или семейство элементов пниктогенов
Выделенные элементы относятся к семейству азота.Эти элементы вместе известны как пниктогены. Тодд ХелменстайнПниктогены или азотная группа – важное семейство элементов.
- Группа 15 или VA
- Группа азота или пниктогены
- 5 валентных электронов
- Различные свойства, промежуточные между свойствами металлов и неметаллов
- Самый известный представитель: азот
Кислородная группа или семейство халькогенов
Выделенные элементы принадлежат к семейству кислорода.Эти элементы называются халькогенами. Тодд ХелменстайнСемейство халькогенов также известно как кислородная группа.
- Группа 16 или VIA
- Кислородная группа или халькогены
- 6 валентных электронов
- Разнообразные свойства, меняющиеся от неметаллических до металлических по мере перехода к семейству
- Самый известный член: кислород
Семейство галогенных элементов
Выделенные элементы этой таблицы Менделеева принадлежат к семейству галогенных элементов.Тодд ХелменстайнСемейство галогенов – это группа химически активных неметаллов.
- Группа 17 или VIIA
- Галогены
- 7 валентных электронов
- Реактивные неметаллы
- Точки плавления и кипения увеличиваются с увеличением атомного номера
- Высокое сродство к электрону
- Изменение состояния по мере продвижения по семейству: фтор и хлор существуют в виде газов при комнатной температуре, в то время как бром является жидкостью, а йод – твердым веществом.
Семейство элементов благородного газа
Выделенные элементы этой таблицы Менделеева принадлежат к семейству благородных газов.Тодд ХелменстайнБлагородные газы представляют собой семейство неметаллов, не вступающих в реакцию. Примеры включают гелий и аргон.
- Группа 18 или VIIIA
- Благородные газы или инертные газы
- 8 валентных электронов
- Обычно существуют в виде одноатомных газов, хотя эти элементы (редко) образуют соединения
- Стабильный октет электрона делает инертным (инертным) при обычных обстоятельствах
Источники
- Флак, Э. «Новые обозначения в периодической таблице.” Pure Appl. Chem. IUPAC . 60 (3): 431–436. 1988. DOI: 10.1351 / pac198860030431
- Ли, Дж. Дж. Номенклатура неорганической химии: Рекомендации . Blackwell Science, 1990, Хобокен, Нью-Джерси,
- Scerri, E. R. Периодическая таблица Менделеева, ее история и ее значение . Oxford University Press, 2007, Оксфорд.
Частей Периодической таблицы
Когда элементы объединяются, чтобы сформировать соединения, есть два основных типа соединение, которое может возникнуть. Ионные связи образуются при наличии перенос электронов от одного вида к другому, производя заряженные ионы, которые очень сильно притягиваются друг к другу электростатическим взаимодействия и ковалентных связей , которые возникают, когда атомы делятся электронами , чтобы произвести нейтральные молекулы. В целом металл и неметаллы объединяются с образованием ионных соединений , а неметаллы соединяются с другими неметаллами с образованием ковалентных соединений (молекулы).
Поскольку металлы в периодической таблице расположены левее, они имеют низкую энергию ионизации и низкое сродство к электрону, поэтому они относительно легко теряют электроны и с трудом их приобретают. Они также имеют относительно мало валентных электронов и могут образовывать ионы (и тем самым удовлетворять правилу октетов) легче, теряя свою валентность электронов с образованием положительно заряженных катионов .
- Металлы основной группы обычно образуют такие же заряды, как и их номер группы: то есть металлы Группы 1А, такие как натрий и калий образуют заряд +1, металлы группы 2А, такие как магний и кальций образуют 2+ зарядов, а металлы группы 3A, такие как в виде алюминия образуют 3+ заряда.
- Металлы, следующие за переходными металлами (в сторону нижняя часть групп 4A и 5A) могут потерять либо их крайние s и p электронов, образуя заряды, идентичные их номер группы, или они могут потерять только p электронов, пока сохраняя свои два электрона s , образуя заряды, которые являются номер группы минус два. Другими словами, олово и свинец в Группе 4A может образовывать 4+ или 2+ зарядов, в то время как висмут в группе 5A может образовывать заряды 4+ или 2+. формируют заряд 5+ или 3+.
- Переходные металлы обычно способны образовывать 2+ заряда. теряя валентность s электронов, но также могут терять электроны со своих орбиталей d , чтобы сформировать другие заряды. Большинство переходных металлов могут образовывать более одного возможного заряда. в ионных соединениях.
Неметаллы находятся правее в таблице Менделеева и имеют высокие энергии ионизации и высокое сродство к электрону, поэтому они относительно легко получают электроны и с трудом теряют их. У них также есть большее количество валентных электронов, и они уже близко к полному октету из восьми электронов. Неметаллы набирать электроны до тех пор, пока у них не будет того же количества электронов, что и у ближайший благородный газ (группа 8А), образующий отрицательно заряженные анионы которые имеют заряды, равные номеру группы минус восемь. Это, неметаллы группы 7A образуют заряды 1, неметаллы группы 6A образуют 2- заряды, а металлы группы 5А образуют 3- заряды.Группа 8А элементы уже имеют восемь электронов в их валентных оболочках и имеют малая тенденция к получению или потере электронов, и образуют ионные или молекулярные соединения.
Ионные соединения удерживаются вместе в регулярном массиве, называемом кристаллом . решетка силами притяжения между противоположно заряженными катионы и анионы. Эти силы притяжения очень сильны, и поэтому большинство ионных соединений имеют очень высокие температуры плавления.(Для Например, хлорид натрия, NaCl, плавится при 80 ° С, а оксид алюминия, Al 2 O 3 , плавится при 2054 ° C.) Ионные соединения: обычно твердые, жесткие и хрупкие. Ионные соединения не проводят электричество, потому что ионы не могут двигаться в твердой фазе, но ионные соединения могут проводить электричество, когда они растворяются в вода.
Когда неметаллы объединяются с другими неметаллами, они имеют тенденцию делиться электроны в ковалентных связях вместо образования ионов, что приводит к образование нейтральных молекул.(Имейте в виду, что поскольку водород также неметалл, сочетание водорода с другим неметаллом также будет образовывать ковалентную связь.) Молекулярные соединения могут быть газы, жидкости или твердые вещества с низкой температурой плавления и включают широкий спектр веществ. (См. Галерея молекул для примеры.)
Когда металлы соединяются друг с другом, обычно описывается соединение. как металлическое соединение (вы уже догадались).В этом модели, каждый атом металла отдает один или несколько своих валентных электронов в создать море электронов , которое окружает все атомы, удерживая вещества вместе за счет притяжения между катионами металлов и отрицательно заряженные электроны. Поскольку электроны в электроне море может свободно перемещаться, металлы очень легко проводят электричество, в отличие от молекулы, где электроны более локализованы. Атомы металлов могут проходить мимо друг друга легче, чем в ионных соединениях (которые удерживаются в фиксированных положениях притяжениями между катионами и анионы), позволяя металлу раскалывать листы или втягивать провод.Можно легко комбинировать разные металлы, чтобы получить . сплавы , физические свойства которых могут сильно отличаться от их составляющие металлы. Сталь представляет собой сплав железа и углерода, которое намного тверже самого железа; хром, ванадий, никель и другие металлы также часто добавляют в железо для производства сталей различных типы. Латунь – это сплав меди и цинка, который используется в сантехнике, электрических деталях и музыкальных инструментах. Бронза – это сплав меди и олова, который намного тверже, чем медь; когда бронза была открыта древними цивилизациями, она ознаменовала значительный шаг вперед от использования менее прочных каменных орудий.
Поиск местоположения элементов в Периодической таблице с примерами
Поиск расположения элементов в Периодической таблице с примерами
a) Период обнаружения элементов:
Период элемента равен наивысшему уровню энергии электронов или главному квантовому числу.Для лучшего понимания посмотрите следующие примеры;
16 S: 1s 2 2s 2 2p 6 3 s 2 3 p 4 3 – это наивысший уровень энергии электронов или главное квантовое число. Таким образом, период S равен 3.
23 Cr: 1s 2 2s 2 2p 6 3s 2 3p 6 4 s 2 3d 4 4 – наивысший уровень энергии электронов или главного кванта номер.Таким образом, период Cr равен 4.
б) Поиск группы элементов:
Группа элементов равна количеству валентных электронов элемента или количеству электронов на самом высоком энергетическом уровне элементов. Другой способ найти группу элементов – это посмотреть на субоболочки. Если последняя подоболочка электронной конфигурации – «s» или «p», тогда группа становится A.
19 K : 1s 2 2s 2 2p 6 3s 2 3p 6 4 s 1 Поскольку последняя вспомогательная оболочка является “s”, группа K – A .
35 Br : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4 p 5 С последней оболочки Группа “р” Br – A.
Элементы в группе B имеют электронную конфигурацию нс, и (n-1) d , общее количество электронов на этих орбиталях дает нам группу элементов. Взгляните на следующие примеры.
26 Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 6 + 2 = 8 Группа B
Вот несколько подсказок, чтобы найти количество элементов в группе.
Последний виток Группа
нс 1 1A
нс 2 2A
нс 2 нс 1 3A
нс 2 нс 2 4A
нс 2 нс 3 5A
нс 2 нс 4 6A
нс 2 нс 5 7A
нс 2 нс 6 8A
Последний виток Группа
нс 2 (н-1) d 1 3B
нс 2 (н-1) d 2 4B
нс 2 (н-1) д 3 5B
нс 2 (n-1) d 4 или нс 1 (n-1) d 5 6B
нс 2 (н-1) d 5 7B
нс 2 (н-1) д 6 8B
нс 2 (н-1) d 7 8B
нс 2 (н-1) d 8 8B
нс 2 (n-1) d 9 или нс 1 (n-1) d 10 1B
нс 2 (н-1) d 10 2B
Пример: Найдите период и группу 16 X.
16 X: 1s 2 2s 2 2p 6 3s 2 3p 4
3. период и 2 + 4 = 6 Группа
Пример: Найти период и группу 24 X.
24 X: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 4
4. период и 4 + 2 = 6 группа B
Группы и периоды элементов находятся в соответствии с их нейтральными состояниями.Ионы и изотопы элементов не показаны в таблице Менделеева.
Пример: Если ион X +2 имеет 10 электронов, найдите его группу и номер периода.
Количество протонов = 10 + 2 = 12
В нейтральном элементе количество протонов равно количеству электронов. Таким образом, X имеет 12 электронов в нейтральном состоянии. Записываем конфигурацию электронов в соответствии с нейтральным состоянием элемента.
12 X = 1s 2 2s 2 2p 6 3s 2
Номер периода 3
Номер группы – 2, группа – A (последняя орбиталь – “s”)
Пример: Если электронная конфигурация X + 5 равна 1s 2 2s 2 2p 6 3s 2 3p 6 , какое из следующих утверждений верно для элемента X.
I. Номер периода X равен 4, и это переходный элемент
II. Х металл
III. Валентные электроны X находятся в s и d
Нейтральный элемент X имеет электронную конфигурацию;
X: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3
X находится в 4. периоде и 3 + 2 = 5 группе B.
Таким образом, это металл и все утверждения I.II. и III. верны.
Пример: Расположение элементов X, Y, Z, T и U показано на рисунке ниже. Какие из следующих утверждений неверны для этих элементов.
I. X – щелочной металл
II. Y находится в блоке p
III. Z – галогены
IV. U – лантаноид
V. T благородный газ
Поскольку X находится в группе 1A, это щелочной металл, I верно.
Y находится в группе III A и находится в блоке p. II верно.
Z находится в группе VII A, и мы знаем, что это галогены. III правда
U находится в блоке d и является переходным элементом, а не лантаноидом, IV. ложно
T, s в группе VIII A это благородный газ, V также верно.
Экзамены по таблице Менделеева и решения проблем
| Таблица Менделеева <Предыдущая | Далее> Периодические свойства элементов с примерами |
|---|
