Кремний – общая характеристика химического элемента
Химия
12.11.21
9 мин.
Кремний – химический элемент таблицы Менделеева. Попробуем разобраться, что же такое кремний – металл или неметалл?
Оглавление:
- Общая характеристика
- Состав и структура кремния
- Физические свойства
- Химические свойства
- Получение кремния
- Области применения
- Плюсы и минусы кремния
- Заключение
Кремний – химический элемент таблицы Менделеева. Попробуем разобраться, что же такое кремний – металл или неметалл?
Какова его природа, общая характеристика и свойства не только в физике, но и в химии? Как реагирует с другими веществами? Какие соединения образуют? Каковы области применения этого элемента?
Общая характеристика
Обозначение этого элемента в таблице Менделеева – Si (silicium – «силициум»). В таблице он стоит в четвертой группе третьего периода.
В таблице он стоит в четвертой группе третьего периода.
Первое название этого элемента – силиций. В середине 19 века его стали называть «кремнием».
Основные особенности:
- Второй по распространенности элемент таблицы Менделеева.
- Аналог углерода – это элемент (а также его генетический ряд) со своими специфическими особенностями.
Где можно взять кремний? В основном, в природе он находится в земле в виде оксидов и других структур горных пород (кварц, силикат и т. д.).
Состав и структура кремния
Рассмотрим основные параметры этого элемента в таблице.
| Признак | Характеристика |
| Атомная масса | 28,086 а. е. м. |
| Молекулярная (молярная) масса | 28,086 г/моль |
| Размер атома / заряд ядра | 14 |
| Валентность | 2,4 |
| Степень окисления | ±4, -2 |
| Плотность | 2,33 г/см3 |
| Температура плавления | 1688 К |
| Химическая связь | ковалентная неполярная |
| Кристаллическая решетка | атомная |
У кремния есть 3 изотопа: Si (28), Si (29), Si (30).
Электронное строение атома кремния показано на картинке:
Физические свойства
Строение атома кремния, из которого состоит большинство материалов, позволяет доказать ученым наличие аллотропии у этого элемента.
Выделяют 2 модификации:
- аморфный;
- кристаллический.
Первый представляет собой порошок коричневого цвета, который плавится при температуре свыше 1400 градусов Цельсия.
Второй – кристаллизованный кремний темно-серого оттенка с блестящей поверхностью.
По сравнению с предыдущим, обладает высокими показателями тепло- и электропроводности.
Химические свойства
Рассмотрим по отдельности каждый вид реакций.
Восстановительные процессы
С простыми веществами:
Si + 2Br2 = SiBr4;
Si + O2 = SiO2.
Со сложными веществами:
Кислоты
3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O.
Гидроксиды
Si + 2NaOH + H2O = Na2SiO3 + 2H2.
Окислительные процессы
Он проявляет при взаимодействии с гидридами, металлами, солями, сильными концентрированными кислотами.
Как правило, в качестве побочных продуктов в таких реакциях выступают окиси неметаллов, сульфаты, нитраты и другие соли, содержащие этот элемент.
Получение кремния
Различают два способа получения кремния: лабораторный и промышленный. Рассмотрим подробно оба.
В лаборатории
Его восстанавливают с помощью магния или алюминия при нагревании.
В промышленности
Получение этим способом требует больших усилий:
- В печах под действием кокса идет разложение диоксида кремния при температуре свыше 1790 градусов по Цельсию.
- Очищают полученный кремний от примесей.

- Очистку проводят до тех пор, пока массовая доля в образце не будет ниже 95%.
Кроме того, в промышленности в последние годы популярным способом очистки стало хлорирование. Оно используется чаще, поскольку этот метод экономически выгоден и дает большую степень очистки.
В России существует всего два завода по производству технического кремния: Каменск-Уральский и Усолье-Сибирский.
Области применения
Кремний имеет широкую область применения:
- Он является хорошим сырьем для получения его аллотропных модификаций и различных соединений на его основе.
- Это главный компонент при получении различных сплавов. Как правило, в металлургии это главный окислитель и модифицирующий элемент.
- Кремний часто используется для получения стекла и цемента.
- Он является незаменимым компонентом в производстве батарей.
- Кремний чаще всего используется как подручное средство для получения других простых веществ в лаборатории.

Плюсы и минусы кремния
Попробуем разобраться, в чем же заключаются преимущества и недостатки этого элемента? Как он вообще влияет на жизнь различных организмов?
Кремний необходим растениям для питания и роста, некоторым простейшим организмам – для правильного протекания процессов жизнедеятельности.
В организмах высших существ он играет важную роль (является одним из незаменимых микроэлементов), но помимо этого может вредить им (вызывать силикоз – отравление солями этого неметалла).
Незаменима его роль в промышленности и технике, металлургии. А вот медицинские показатели еще до конца не изучены, поэтому применять его для лечения различных заболеваний можно с осторожностью и только по рекомендациям врача.
Заключение
Кремний незаменим в химии и физике. Он играет важнейшую роль в биохимических реакциях организма человека. Правда избыток этого элемента может привести к хроническим болезням.
Как определить элементы главной и побочной подгруппы?
Как определить элементы главной и побочной подгруппы?
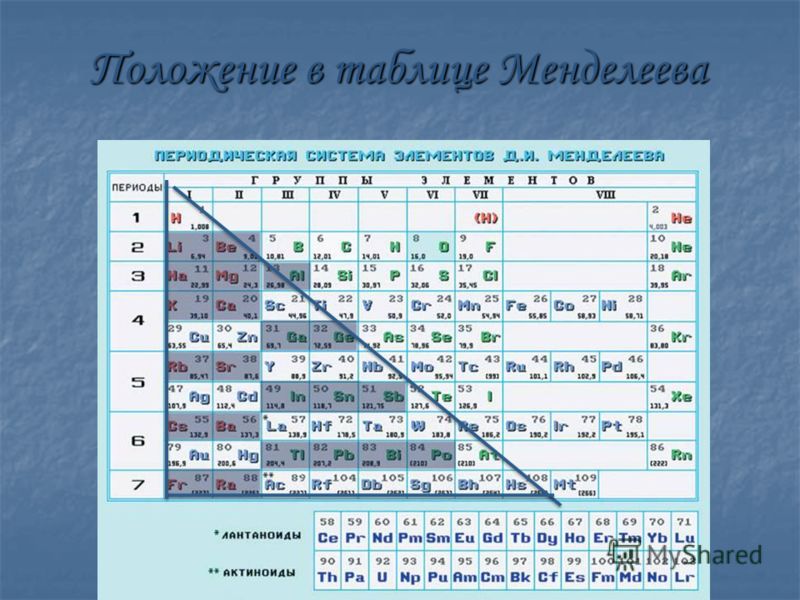
Как отличить главную подгруппу от побочной в таблице Менделеева? Главная подгруппа слева, а побочная — справа. То есть, если элемент выровнен по левому краю, то группа главная, а если по правому — то побочная.
В чем причина разделения элементов на основные и побочные подгруппы?
В элементах главных подгрупп периодической системы элементов происходит заполнение электронами орбиталей внешнего электронного уровня. … В элементах побочных подгрупп происходит заполнение электронами орбиталей предпоследнего электронного уровня.
Что означают А и Б в таблице Менделеева?
Группы A начинаются элементами малых периодов, включают также и элементы больших периодов; содержат и металлы, и неметаллы. … Группы B содержат элементы больших периодов, и это только металлы. В коротком варианте Периодической таблицы это побочные подгруппы.
В коротком варианте Периодической таблицы это побочные подгруппы.
Что значит побочная подгруппа?
Химические элементы в периодической системе по вертикали образуют группы. … ✓ Побочная подгруппа – вертикальный ряд химических элементов только больших периодов. Принято элементы главных подгрупп обозначать заглавной буквой А, а элементы побочных подгрупп – В.
Какие подгруппы называют главными?
Подгруппы, в которых расположены s- и p-элементы, называют ГЛАВНЫМИ, а подгруппы с d-элементами – ПОБОЧНЫМИ ПОДГРУППАМИ. Главные и побочные подгруппы иногда обозначают соответственно буквами “А” и “Б”, или “А” и “В”, или “а” и “б”.
Как определить в какой группе находится элемент?
Гру́ппа периодической системы химических элементов — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением. Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома.
Сколько групп элементов в периодической системе?
Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных …
Что называют периодом и группой периодической системы?
Пери́од — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки. … Первый период, содержащий 2 элемента, а также второй и третий, насчитывающие по 8 элементов, называются малыми.
Какие формы периодической таблицы вы знаете?
Формы периодической таблицы Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая», «длинная», «сверхдлинная». В «короткой» форме записи четвертый и последующие периоды занимают по 2 строчки.
Что такое ряды в таблице Менделеева?
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. … Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства.
Что означают цифры в таблице Менделеева?
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда их атомного ядра. Система является графическим выражением периодического закона, открытого русским учёным Д.
Чем различаются короткий и длинный варианты периодической таблицы?
В коротком варианте таблицы каждую группу делят на две подгруппы — главную и побочную. В побочную подгруппу входят только элементы больших периодов — переходные металлы. В длинном варианте периодической системы подгрупп нет, а количество групп равно 18. … В длинном варианте группы обозначаются арабскими цифрами.
… В длинном варианте группы обозначаются арабскими цифрами.
Сколько групп в таблице Менделеева?
Группа периодической системы — последовательность атомов по возрастанию заряда ядра, включающая один или несколько столбцов в таблице Менделеева. В периодической системе восемь групп элементов. Положение в группах s- и р-элементов определяется общим числом электронов внешнего слоя.
В каком году была отменена короткая форма таблицы?
1989
Какие из химических элементов в таблице Менделеева связаны с Россией?
Менделеева связаны с Россией? Рутений – первооткрыватель элемента К. К. Клаус назвал рутений в честь России; дубний – назван в честь российского центра по исследованиям в области ядерной физики – Дубны; менделевий – назван в честь великого русского учёного Д.
Какой химический элемент нашли в России?
Рутений Рутений (Ruthenium, символ – Ru) – химический элемент с атомным номером 44.
Какой из этих химических элементов был открыт в России?
К тому времени чуть ли не весь мир включился в гонку за сверхтяжёлыми ядрами. В 1964 году новый химический элемент с атомным номером 104 впервые синтезировали в СССР, в Объединённом институте ядерных исследований (ОИЯИ), который находится в подмосковной Дубне. Позднее этот элемент получил имя “резерфордий”.
В 1964 году новый химический элемент с атомным номером 104 впервые синтезировали в СССР, в Объединённом институте ядерных исследований (ОИЯИ), который находится в подмосковной Дубне. Позднее этот элемент получил имя “резерфордий”.
Что такое с в химии?
s-Элементы в периодической таблице элементов — химические элементы, электронная оболочка которых включает в себя первые два s-электрона. Такие элементы объединяются в группу, называемую s-блок.
Как произносится сера?
Для правильного произношения названий и символов в русских названиях и произношениях проставлены ударения….Химические элементы: названия, символы и произношение символов
| Русское название элемента | Се́ра |
|---|---|
| Латинское название элемента | Sulfur |
| Символ элемента | S |
| Произношение символа | эс |
Как определить какой химический элемент?
Хими́ческий элеме́нт — совокупность атомов с одинаковым зарядом атомных ядер. Атомное ядро состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным.
Атомное ядро состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным.
Что обозначают химические элементы?
Современные символы химических элементов состоят из первой буквы или из первой и одной из следующих букв латинского названия элементов. При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат.
Как расположены химические элементы в таблице Менделеева?
В своей таблице (сегодня мы ее называем периодической таблицей, или системой, элементов) Менделеев расположил химические элементы по рядам в порядке возрастания их массы, подобрав длину рядов таким образом, чтобы химические элементы в одной колонке имели похожие химические свойства.
Какие элементы в таблице Менделеева металлы?
К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов.
Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов.
Какие бывают химические элементы?
Список химических элементов
| № | Название | Латинское название |
|---|---|---|
| 1 | Водород | Hydrogenium |
| 2 | Гелий | Helium |
| 3 | Литий | Lithium |
| 4 | Бериллий | Beryllium |
Сколько элементов простые вещества которых неметаллы представлены в таблице Менделеева?
В отличие от металлов, неметаллов гораздо меньше, всего их насчитывается 22 элемента.
Сколько химических элементов в главной подгруппе четвертой группы?
К элементам IV группы главной подгруппы относят: углерод С, кремний Si, германий Ge, олово Sn и свинец РЬ.
Как называются элементы 4 группы?
а) Углерод (С), кремний (Si), германий (Ge), олово (Sn), свинец (РЬ) — элементы 4 группы главной подгруппы ПСЭ.
Как называются элементы главной подгруппы 8 группы?
Некоторые свойства элементов 8 группы
| Атомный номер | Химический элемент | Электронная оболочка |
|---|---|---|
| 26 | железо | 2, 8, 14, 2 |
| 44 | рутений | 2, 8, 18, 15, 1 |
| 76 | осмий | 2, 8, 18, 32, 14, 2 |
| 108 | хассий | 2, 8, 18, 32, 32, 14, 2 |
Сколько элементов в главной подгруппе пятой группы?
включает в себя 5 элементов азотN, фосфорP, мышьякAa, сурьмуSb и висмут Bi.
история металла, описание, физико-химические свойства, применение в чистом виде и в сплавах
Аргентум, или серебро — металл и химический элемент, которому присвоен атомный номер 47 в периодической таблице Менделеева. Химическая формула металла — Ag. Серебро было исследовано человечеством еще в четвертом тысячелетии до нашей эры. Открытие этого металла обошлось без помощи ученых, поскольку он был найден человеком как самородное серебро. Причем самородки достигали весьма впечатлительных размеров. К примеру, в пятнадцатом столетии был добыт самородок массой свыше 20 тонн.
Причем самородки достигали весьма впечатлительных размеров. К примеру, в пятнадцатом столетии был добыт самородок массой свыше 20 тонн.
Однако добыча серебра требовала больше усилий по сравнению с теми, которые приходилось прикладывать для добычи золота. По этой причине на протяжении нескольких столетий серебро стоило дороже золота. Запасы серебряной руды на Земле на сегодня составляют свыше 550 тонн, причем государствами-лидерами в добыче серебра считаются:
- Перу.
- Австралия.
- Чили.
- Мексика.
Драгоценный металл содержится в коре Земли в концентрации 70 миллиграммов на тонну. В условиях природы аргентум встречается в большинстве случаев в рудных залежах в комбинации с другими элементами. В природе находится свыше пятидесяти видов серебряных руд, однако эффективными, с точки зрения экономики, считаются такие:
- самородное серебро;
- кюстелит;
- электрум;
- бромаргерит;
- прустит;
- агвиларит и другие.

Серебро может встречаться в природе совместно с золотом, и такое образование называется электрумом. Благородный металл в большом количестве сосредоточен в рудах, содержащих уран, висмут и никель.
Кристаллы серебра
Самородное серебро есть в сульфидных рудах, в которых оно образует мельчайшие кристаллы, распыленные среди других металлов, из которых состоят руды. На изломах кристаллы имеют неровную угловатую поверхность, что делает их похожими на крючки. Это находка, которая встречается в природных условиях гораздо реже золота. Причем внешний вид таких самородков весьма необычный. Из-за своей пластичности серебро образует самородки, напоминающие решетки, трубочки, ветви и жгуты. По этой причине такое серебро не используется в промышленных целях, а служит лишь экспонатом в музеях.
История добычи серебра с древних времен: разное значение и применение
Условный срок знакомства человека с серебром измеряется 6 тысячелетиями.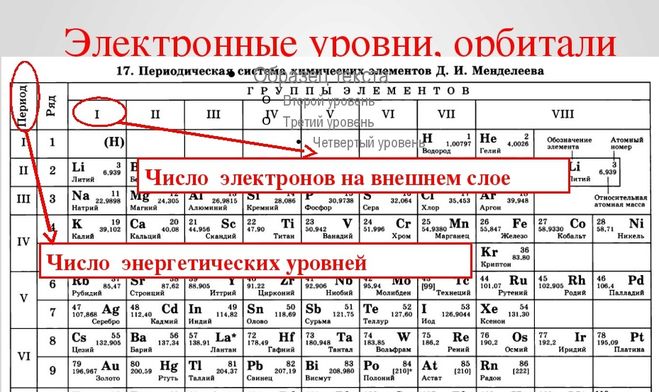 Такой возраст имеют самые древние украшения, обнаруженные при раскопках на Ближнем Востоке. Во времена Вавилона и Ассирии металл считался магическим элементом Луны, имеющим мистическое значение. Эту роль он выполнял также во времена Средневековья: алхимики рассматривали необычного цвета вещество как второй по совершенству металл и неотъемлемую часть Великого Делания.
Такой возраст имеют самые древние украшения, обнаруженные при раскопках на Ближнем Востоке. Во времена Вавилона и Ассирии металл считался магическим элементом Луны, имеющим мистическое значение. Эту роль он выполнял также во времена Средневековья: алхимики рассматривали необычного цвета вещество как второй по совершенству металл и неотъемлемую часть Великого Делания.
Ковкость, красота, относительная устойчивость к окислению обеспечили металлу еще одно применение. Для первых на свете денег в виде монет использовался сплав золота или серебра.
Какое-то время металл ценился выше золота, так как последнее слишком пластично, а серебряные украшения служили дольше.
Коэффициент соотношения цены благородных металлов, введенный И. Ньютоном, сыграл в популяризации серебра немаловажную роль.
AG серебро химический элемент
В 13 веке появилась серебряная посуда и подсвечники, позже – приборы, инструменты. С 19 века, когда человечество освоило электричество, металл, его сплавы стали незаменимыми для изготовления электротехники.
История
Серебро известно человечеству с древнейших времён. Это связано с тем, что в своё время серебро, равно как и золото, часто встречалось в самородном виде — его не приходилось выплавлять из руд. Это предопределило довольно значительную роль серебра в культурных традициях различных народов. Одним из древнейших центров добычи и обработки серебра была доисторическая Сардиния, где оно было известно с раннего энеолита.
В Ассирии и Вавилоне серебро считалось священным металлом и являлось символом Луны. В Средние века серебро и его соединения были очень популярны среди алхимиков. С середины XIII века серебро становится традиционным материалом для изготовления посуды. Кроме того, серебро и по сей день используется для чеканки юбилейных монет (выход из оборота последних серебряных монет в 1960—1970-е годы примерно совпал с кризисом Бреттон-Вудской валютной системы).
Происхождение названия
Славянские названия металла — рус. серебро, польск. srebro, болг. сребро, ст.‑слав. сьребро — восходят к праславянскому *sьrebro
сребро, ст.‑слав. сьребро — восходят к праславянскому *sьrebro
, которое имеет соответствия в балтийских (лит. sidabras, др.-прусск.
sirablan
) и германских (готск. silubr, нем. Silber, англ. silver) языках. Дальнейшая этимология за пределами германо-балто-славянского круга языков неясна, предполагают либо происхождение от той же основы, что и анатолийское
subau-ro
«блестящий», либо раннее заимствование из языков Ближнего Востока: ср. аккад. sarpu «очищенное серебро», от аккад. sarapu «очищать, выплавлять», или из доиндоевропейских языков древней Европы: ср. баск. zilar.
Греческое название серебра ἄργυρος, árgyros
произошло от индоевропейского корня
*H₂erǵó-, *H₂erǵí-
, означающего «белый, блистающий». Из того же корня происходит и его латинское название —
argentum
.
Форма существования серебра в природе. Главные месторождения
Человечество так рано познакомилось с серебром, поскольку оно часто встречалось как блестящий самородок. Даже в 15 веке все еще находили крупные по размеру залежи: например, серебряная 20 тонная глыба, обнаруженная в 1477 году на территории Шенберга. Но сегодня вещество чаще добывают из пород со сложным составом.
Даже в 15 веке все еще находили крупные по размеру залежи: например, серебряная 20 тонная глыба, обнаруженная в 1477 году на территории Шенберга. Но сегодня вещество чаще добывают из пород со сложным составом.
Самые известные месторождения находятся в Мексике, Чили, Китае, Австралии. Фаворитами выступает Перу и Польша – на долю этих стран приходится по 110 тыс. т благородного металла. К первой семерке также относится США.
Серебро ископаемое
Запасы вещества на территории России составляют 68 тыс. т, что делает РФ значимым участником серебряного рынка. Известны месторождения Казахстана, Канады, Армении, Индии, Аргентины.
Значение европейского серебра после завоевания Перу и Аргентины уменьшилось. Тем не менее добыча металла продолжается в месторождениях: Германии, Норвегии, Швеции, Австрии. Не снижались темпы разработки руды в Венгрии, Румынии, Чехии.
Кто знал эти данные?
- Атомный символ серебра – Ag, который, кажется, имеет мало отношения к названию элемента.
 На самом деле Ag – сокращение от argentums, латинское слово для серебра. Слово «серебро» происходит от англосаксонского слова seolfor.
На самом деле Ag – сокращение от argentums, латинское слово для серебра. Слово «серебро» происходит от англосаксонского слова seolfor. - Первым огромным серебряным ударом в Соединенных Штатах был Comstock Lode в Неваде, впервые обнаруженный в 1857 году двумя братьями, которые умерли до того, как смогли воспользоваться преимуществами своего требования. По данным Online Nevada , в период с 1859 по 1992 год с земли было добыто 305 779 612,48 долларов.
- Там нет сомнений по этому поводу; серебро красиво, и люди давно так думали. В феврале 2014 года археологи обнаружили находку из серебра, в том числе пять сережек-обручей , на участке в 3200 лет в Израиле.
- Серебро обладает антимикробными свойствами, но это не делает его хорошим вариантом для домашних средств. Поставщики гомеопатии иногда продают коллоидное серебро для различных жалоб на здоровье, но употребление этого вещества имеет странный побочный эффект: кожа становится синей .
- Оставьте хорошее серебро в ящике между Рождествами, и оно может потускнеть.
 Так как же серебряные экспонаты музея остаются такими блестящими? Они покрыты прозрачными лаками. Исследователи работают над созданием покрытий нанометровой толщины, которые могут заменить современные лаки с ручной росписью чем-то более тонким, полностью невидимым и долговечным.
Так как же серебряные экспонаты музея остаются такими блестящими? Они покрыты прозрачными лаками. Исследователи работают над созданием покрытий нанометровой толщины, которые могут заменить современные лаки с ручной росписью чем-то более тонким, полностью невидимым и долговечным.
Минералы природного серебра
Благородный металл. Называют его так не из-за красоты и блеска, а из-за определенной химической инертности. Он медленнее окисляется, дольше сохраняет внешний вид. Однако по сравнению с золотом или платиной, кажется активным, поэтому в земной коре чаще встречается как комплекс серебросодержащих пород.
Известно более 50 минералов металла. В промышленности используются только содержащие достаточно большую долю вещества. Таких набирается не более 20:
- самородки;
- электрум – включает золото и серебро;
- кюстелит – содержит больше белого металла;
- аргентин – соединение с серой;
- прустит – твердый раствор серебра, серы и мышьяка, довольно токсичен;
- бромаргерит – соединение с бромом;
- кераргирит – комплекс хлористых веществ;
- пираргирит и стефанит – включают также серу, сурьму;
- полибазит – дополняется медь;
- фрейбергит – комплекс с медью, серой;
- аргентоярозит – включает железо;
- дискразит – соединение с сурьмой;
- агвиларит – содержит также селен.

На заметку! 70% серебряных месторождений относятся к комплексным.
Самородок серебра
Рекомендации по уходу чистке и хранению
Держать серебро рекомендуется подальше от солнечных лучей, в отдельных мешочках или футлярах. Проводить чистку металла при первых признаках налета, поскольку со временем навести лоск будет все сложнее.
Такие предметы нуждаются в механической очистке, поскольку сульфид серебра – тот самый темный налет на изделии – мало чем растворяется. Для ухода за драгоценностями можно использовать зубную пасту и мягкую щетку или салфетку и осторожно, без нажима, провести соответствующие манипуляции.
Химические характеристики элемента
Химические свойства не слишком разнообразны: вещество достаточно инертно, как благородный металл не растворяется соляной или серной кислотой. Но если создать определенные условия, металл проявит химическую активность.
| Реагент | Реакция |
| O2 | С кислородом воздуха не взаимодействует даже при высоких температурах . Возможно получение оксида при взаимодействии с озоном Возможно получение оксида при взаимодействии с озоном |
| h3S + O2 | Образует соединение с серой, при наличии даже ее следов |
| Галогены (CL2, I2) | Окисляют до галогенида |
| S | Реакция идет при нагревании до сульфида |
| FeCl3 | Растворяется, образуя хлорид |
| HNO3 | Взаимодействует с горячей концентрированной кислотой |
Вещество склонно к образованию сложных комплексов цианидами, аммиаком, тиосульфатами.
Серебро в пробирке
Как проверить подлинность
Подлинность серебряного изделия можно проверить в домашних условиях несколькими способами:
- Поднести к образцу магнит. Аргентум не магнитится.
- Царапнуть поверхность. Так обнаруживается другой металл под серебром.
- Опустить образец в горячую воду. Серебро нагреется сразу.
- Потереть изделие. Если пальцы испачкались, в сплаве избыток цинка.

Покупая цепочки, браслеты, другие изделия сложных форм, стоит присмотреться к исполнению: форма звеньев, исправность замочка, аккуратность исполнения в целом. Проба может подтверждать только подлинность участка, на который нанесена.
Домашние методы идентификации дают оценку в первом приближении. Например, способ магнетизма: не все металлы магнитятся. Полную гарантию дают ювелиры или работники ломбардов.
Широкое применение химических свойств серебра
Использование вещества чаще основано на его физических свойствах, чем химических, так как его реакционная способность очень ограничена.
- Для контактов электротехнических изделий – драгоценный металл проявляет самую высокую электро- и теплопроводность. Начиная с 19 века его берут для изготовления контактов реле, ламелей, керамических конденсаторов.
- Составляющий различных припоев – благодаря ковкости может буквально соединить собой разные материалы.
 Металл незаменим при пайке. Составы с большой его долей используются ювелирами, со средней – в технических изделиях, от жидкостных двигателей для ракеты до выключателей. При добавке свинца серебряный припой заменяет собой оловянный.
Металл незаменим при пайке. Составы с большой его долей используются ювелирами, со средней – в технических изделиях, от жидкостных двигателей для ракеты до выключателей. При добавке свинца серебряный припой заменяет собой оловянный. - Для изготовления электросхем – вещество образует твердые растворы с огромным количеством элементов. Это свойство эксплуатируется при изготовлении, например, катодов гальванических элементов.
- Как драгоценный металл в ювелирной индустрии – отличается роскошной привлекательностью, востребован для ковки самых филигранных, изящных украшений: диадем, серег, колец, браслетов. Чаще используются сплавы с незначительной долей никеля или меди: они более прочны.
- Для чеканки монет, орденов – деньги из серебра чеканили с начала времен. Сегодня материал используют для изготовления юбилейных монет, для чеканки орденов, медалей.
- В фотографии – галогениды вещества на свету разлагаются, обработанная ими поверхность чернеет.
 Это свойство используется для черно-белой фотографии.
Это свойство используется для черно-белой фотографии. - Для «разгона облаков» перед парадом – опрыскивание небес йодистым серебром вызывает резкое изменение локальной температуры. Таким образом обеспечивают хорошую погоду на ответственных мероприятиях.
- При изготовлении электротехники, электроники покрывают контакты и проводники в высокочастотных цепях, внутреннюю поверхность волноводов. Металл обеспечивает самую высокую электропроводность.
- Для зеркал – амальгама придает зеркалу куда более высокую светоотражающую способность по сравнению с алюминиевой.
- Как катализатор в химических процессах – вещество ускоряет химические реакции промышленного производства, например, при получении эпоксида из этилена.
- Сфера медицины – антибактериальные свойства серебра эксплуатировались во времена Египта и Древней Греции. Металл используется для обеззараживания фильтров кондиционеров, водных очистителей.

Соли, полученные в результате взаимодействия металла с кислотами (нитрат, хлорид), токсичны и применяются в лечебных целях.
Серебро слитки
Изотопы
Существуют два естественных изотопа серебра: серебро-107 и серебро-109. Изотопы – это две или более формы элемента. Изотопы отличаются друг от друга по их массовому числу. Число, написанное справа от имени элемента, является массовым числом. Массовое число представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Известно также около 16 радиоактивных изотопов серебра. Радиоактивный изотоп – это тот, который распадается на части и испускает некоторую форму радиации. Радиоактивные изотопы образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Ни один из радиоактивных изотопов серебра не имеет коммерческого использования.
Снижение, которое развивается в течение долгого времени на серебряных изделиях и других посеребренных объектах, является сульфидом серебра.
Физиологическое действие серебра и применение в медицине
Безопасное количество вещества, точнее говоря его ионов, в крови не оказывает никакого физиологического воздействия. Утверждение, приписывающее ему обеззараживающие свойства и целительские способности – миф, родом из Египта и Вавилона. Превышение безопасной дозы вызывает отравление и летальный исход.
В США и Австралии запрещается приписывать коллоидному серебру и другим, такого рода продуктам, лечебные свойства.
Серебро / Argentum (AG)
Отзывы
Лидия:
Лет десять назад купила слиток серебра, очень выгодно продала недавно, рекомендую серебро в качестве денежных вложений.
Светлана:
Всегда любила серебряные украшения больше золота, да и для здоровья, говорят, полезно.
Григорий:
Купил для дома столовое серебро, пользуемся, продолжаем традиции предков, правда, жена ругается, что чистить устала.
Российские пробы блестящего металла
В ювелирном деле и электротехнике используют серебряные сплавы. А это подразумевает некоторое количество примесей. Обозначают долю чистого Ag с помощью специальной классификации – метрической системы проб.
- Менее 800 – техническое серебро, пригодное для промышленных нужд.
- 800 – состав высокопрочный, но тускнеет со временем и окисляется. Называют его желтым серебром из-за оттенка. Применяют при отливке посуды, столовых приборов, декора.
- 830 – ювелирный сплав, который, все же, сохраняет желтоватый оттенок. Изготавливают из него посуду и украшения среднего ценового сегмента.
- 875 – сплав без оттенков, твердый и прочный, но со временем теряет блеск. Идет на столовые приборы, ювелирные изделия.

- 925 –основной ювелирный материал. Сплав прочен, не включает оттенков, почти не окисляется. Из него отливают монеты, ордена, украшения, предметы искусства.
- 960 – пластичный вариант. Используется для получения филигранных украшений премиум-класса. Его легко повредить.
- 999 – беспримесное серебро. Применяется в электротехнике. Также из него отливают банковские слитки.
Проба указывает на количество серебра внутри металла. То есть 875 означает, что 1000 г содержит 875 г серебра и 125 г примесей.
Где можно купить или продать
В ювелирных магазинах можно приобрести украшение различной пробы на любой вкус и кошелек. Торговцы предоставляют широчайший выбор предметов из серебра всевозможных проб и видов.
Продать такое изделие проще всего в скупку, ломбард, или воспользовавшись всевозможными торговыми интернет площадками.
Сколько стоит 1 грамм на сегодня
Цена за 1 грамм серебра непрерывно меняется в зависимости от спроса и предложения на мировом рынке по результатам ежедневных торгов.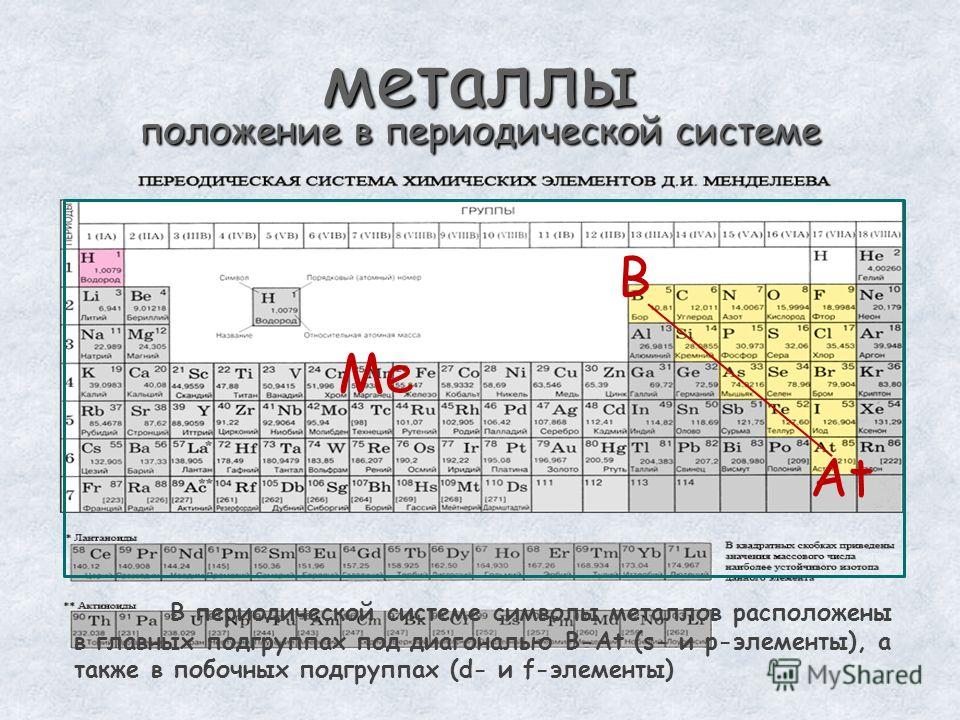 На нее же ориентируются все торговцы, будь то банк или ломбард. Следить за изменениями стоимости металла следует при помощи интерактивной таблицы.
На нее же ориентируются все торговцы, будь то банк или ломбард. Следить за изменениями стоимости металла следует при помощи интерактивной таблицы.
Цена за лом
Стоимость серебряного лома напрямую зависит от пробы металла и степени востребованности сплава на данный момент. Оставлю здесь таблицу с ценами за лом для удобства расчетов.
| Цена 999 пробы по ЦБ | Рыночная стоимость пробы на сегодня | Цена на лом | Цена в ювелирных |
Магические свойства и влияние на человека
Серебряные украшения таят в себе следующие магические свойства:
- Избавляют от плохого настроения, депрессии.
- Ограждают от негативных людей и неприятного общения.
- Защищают от коварности и вероломства недоброжелателей и завистников.
- Обеспечивают энергией и дарят заряд сил для новых свершений, особенно в период растущей луны.
- Развивают интуитивные возможности.
В древние времена ритуальные талисманы и другие атрибуты, имеющие отношение к колдовству, изготовляли исключительно из серебра.
Для женщин
Женщина, что носит великолепные серебряные украшения, становится более обаятельной, привлекательной и сексуальной. Также металл защитит девушек от сплетен и интриг, которые могут сделать жизнь ее невыносимой.
Если девушка заметит, что украшение из серебра сильно потемнело, значит на нее пытаются навести порчу или сглаз.
Для мужчин
Серебро поможет мужчина стать более уверенным в себе, развивать силу и волю характера, избавиться от сентиментальности. А также будет способствовать улучшению материального благосостояния. Считается, что серебреная цепочка способна очертить защитный круг вокруг своего владельца. Металл будет впитывать негативную энергетику, исходящую как от самого мужчины, так и его окружения.
СТРУКТУРА
Кристаллическая структура серебра
Сингония кубическая; гексаоктаэдрический в. с. ЗL44L636L29РС. Кристаллическая структура. Гранецентрированный куб. Облик кристаллов. Правильно образованные кристаллы очень редки. Встречающиеся формы: {100}, {111}. Двойники по (111). Агрегаты. Встречается иногда в виде типичных «вязаных» перистых дендритов, тонких неправильных пластин и листочков. Характерны также моховидные, волосовидные и проводочные формы. Наиболее распространены зерна неправильной формы и более крупные сплошные скопления — самородки.
Облик кристаллов. Правильно образованные кристаллы очень редки. Встречающиеся формы: {100}, {111}. Двойники по (111). Агрегаты. Встречается иногда в виде типичных «вязаных» перистых дендритов, тонких неправильных пластин и листочков. Характерны также моховидные, волосовидные и проводочные формы. Наиболее распространены зерна неправильной формы и более крупные сплошные скопления — самородки.
Это интересно
Наиболее интересные факты про серебро:
- Калифорнийские ученые определили новый метод использования серебра для изготовления твердого металла при производстве медицинских имплантатов.
- Элемент применяют при создании необычных нано частиц, что позволяют обнаружить болезнетворные бактерии и вирусы. Большой популярностью стала пользоваться респираторная маска с серебром, способная обезвредить множество патогенов.
- Серебро официально считается пищевой добавкой Е174. Каждый человек ежедневно употребляет с пищей 0,1 г этого элемента.
- В XV веке был обнаружен серебряный самородок массой 20 тонн.
 Подобные крупные образцы находили и в других частях света.
Подобные крупные образцы находили и в других частях света.
Биологическая роль серебра изучена неокончательно, но ученые уверенны, что жизнь человека невозможна без наличия в нейронах головного мозга данного элемента.
экстракция
Руды, богатые серебром, давно исчезли из-за добычи. Сегодня серебро обычно поступает из руд, которые содержат очень небольшое количество металла. Эти суммы могут варьироваться от нескольких тысячных
Небольшой процент серебра, произведенного в Соединенных Штатах, используется для монет. Старый серебряный доллар «Мир», показанный здесь, чеканился с 1921 по 1935 год.
унции за тонну руды до 100 унций за тонну. Металл чаще всего производится как побочный продукт добычи других металлов. После удаления первичного металла отходы часто содержат небольшое количество серебра. Эти отходы обрабатываются химическими веществами, которые реагируют с серебром. Серебро может быть затем извлечено электролизом . Электролиз – это процесс, при котором соединение разрушается при пропускании через него электрического тока.
Электролиз – это процесс, при котором соединение разрушается при пропускании через него электрического тока.
Кальций – информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к скандию >
| | 2 | Температура плавления | 842°С, 1548°F, 1115 К |
| Период | 4 | Температура кипения | 1484 ° С, 2703 ° F, 1757 К |
| Блок | с | Плотность (г см −3 ) | 1,54 |
| Атомный номер | 20 | Относительная атомная масса | 40. |
| Состояние при 20°С | Твердый | Ключевые изотопы | 40 Са |
| Электронная конфигурация | [Ар] 4с 2 | КАС номер | 7440-70-2 |
| ChemSpider ID | 4573905 | ChemSpider — бесплатная база данных химической структуры. | |
Спиральная раковина и кости отражают необходимое присутствие кальция во всех живых существах.
Кальций — серебристо-белый мягкий металл, который быстро тускнеет на воздухе и вступает в реакцию с водой.
Металлический кальций используется в качестве восстановителя при получении других металлов, таких как торий и уран. Он также используется в качестве легирующей добавки для сплавов алюминия, бериллия, меди, свинца и магния.
Соединения кальция широко используются. Имеются обширные залежи известняка (карбоната кальция), который используется непосредственно в качестве строительного камня и косвенно для производства цемента. Когда известняк нагревается в печах, он выделяет углекислый газ, оставляя после себя негашеную известь (оксид кальция). Он энергично реагирует с водой, образуя гашеную известь (гидроксид кальция). Гашеная известь используется для производства цемента, в качестве кондиционера почвы и при очистке воды для снижения кислотности, а также в химической промышленности. Он также используется в производстве стали для удаления примесей из расплавленной железной руды. При смешивании с песком гашеная известь поглощает углекислый газ из воздуха и затвердевает в виде известкового гипса.
Он также используется в производстве стали для удаления примесей из расплавленной железной руды. При смешивании с песком гашеная известь поглощает углекислый газ из воздуха и затвердевает в виде известкового гипса.
Гипс (сульфат кальция) используется строителями в качестве пластыря и медсестрами для вправления костей, как «гипс».
Кальций необходим всем живым существам, особенно для роста здоровых зубов и костей. Фосфат кальция является основным компонентом кости. Среднестатистический человек содержит около 1 кг кальция.
Детям и беременным женщинам рекомендуется есть продукты, богатые кальцием, такие как молоко и молочные продукты, листовые зеленые овощи, рыба, орехи и семена.
Кальций является пятым по распространенности металлом в земной коре (4,1%). Он не встречается в природе в разобранном виде, но в изобилии встречается в виде известняка (карбонат кальция), гипса (сульфат кальция), флюорита (фторид кальция) и апатита (хлор- или фторфосфат кальция).
Жесткая вода содержит растворенный бикарбонат кальция. Когда он просачивается сквозь землю и достигает пещеры, он выпадает в осадок, образуя сталактиты и сталагмиты.
Металлический кальций получают путем нагревания извести с алюминием в вакууме.
История элементов и периодической таблицы
Известь (оксид кальция, CaO) была полезным материалом, полученным путем нагревания известняка и веками использовавшимся для изготовления штукатурки и раствора. Антуан Лавуазье классифицировал его как «землю», потому что дальнейшее восстановление казалось невозможным, но он подозревал, что это оксид неизвестного элемента. В 1808 году Гемфри Дэви попытался восстановить влажную известь электролизом, как он это сделал с натрием и калием, но безуспешно. Поэтому он попробовал смесь извести и оксида ртути, и хотя это привело к образованию смеси кальция и ртути, этого было недостаточно, чтобы подтвердить, что он получил новый элемент. (Йёнс Якоб Берцелиус провел аналогичный эксперимент и также получил амальгаму. ) Дэви попытался добавить в смесь больше извести и произвел больше амальгамы, из которой он отогнал ртуть, оставив только кальций.
) Дэви попытался добавить в смесь больше извести и произвел больше амальгамы, из которой он отогнал ртуть, оставив только кальций.
| Атомный радиус, несвязанный (Å) | 2,31 | Ковалентный радиус (Å) | 1,74 |
| Сродство к электрону (кДж моль −1 ) | 2,369 | Электроотрицательность (шкала Полинга) | 1,00 |
| Энергии ионизации (кДж моль −1 ) | 1 ст 589,83 2 -й 1145. 3 рд 4912.368 4 -й 6490,57 5 -й 8153 6 -й 10495,68 7 -й 12272,9 8 -й 14206,5 | ||
| Общие степени окисления | 2 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 40 Са | 39,963 | 96,941 | 5,92 х 10 21 г | ЕС-ЕС | |
| 42 Ка | 41,959 | 0,647 | – | – | |
| 43 Ка | 42,959 | 0,135 | – | – | |
| 44 Са | 43.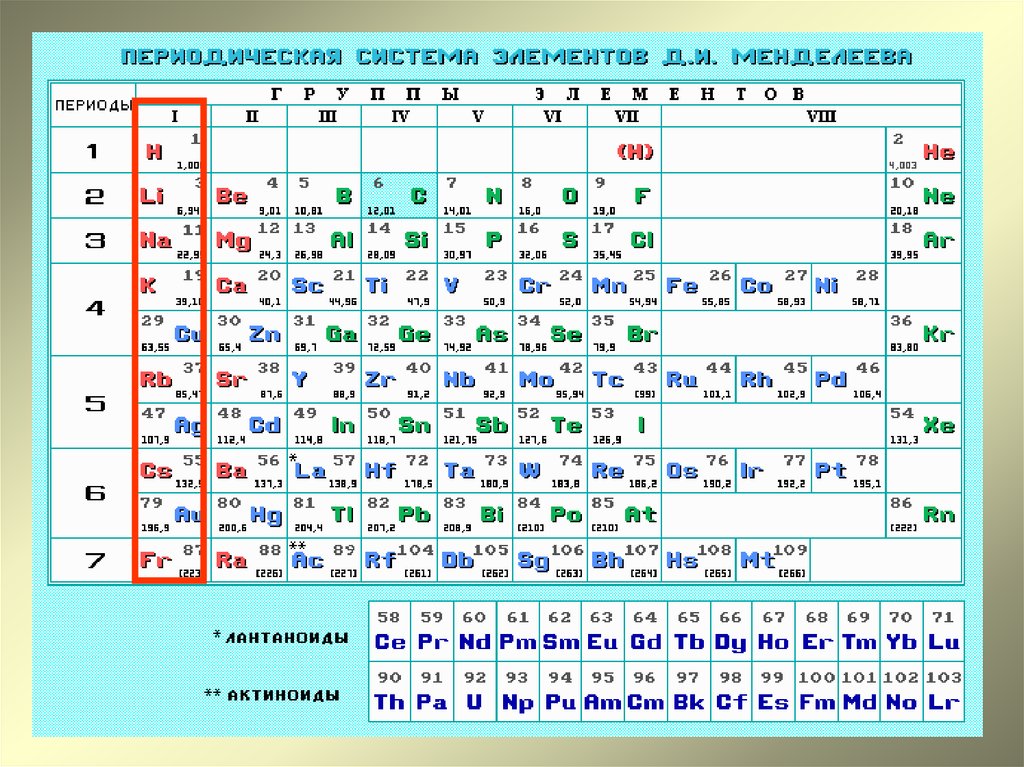 955 955 | 2.086 | – | – | |
| 46 Са | 45.954 | 0,004 | > 0,4 х 10 16 г | β-β- | |
| 48 Ка | 47,953 | 0,187 | 4,4 х 10 19 г | β-β- | |
| > 7,1 х 10 19 г | β- | ||||
|
|
| Удельная теплоемкость (Дж кг -1 К -1 ) | 647 | Модуль Юнга (ГПа) | Неизвестный | |||||||||||
| Модуль сдвига (ГПа) | Неизвестный | Объемный модуль (ГПа) | 17. 2 2 | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
| Слушайте подкаст о кальции |
Стенограмма: (Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец рекламного ролика) Крис Смит Привет, добро пожаловать на эту неделю в Химия в ее элементах, я Крис Смит. На этой неделе настала очередь стихии, дающей нам цемент, гипс, наши собственные кости, твердые зубы и жесткую воду. Карен Фолдс Молоко, сыр, йогурт, шпинат, миндаль. Какой элемент их всех объединяет? Это, конечно, кальций! Но в то время как большинство из нас сразу же думает о еде, когда кто-то упоминает кальций (и я лично считаю, что в этом виновата старая телевизионная реклама молока), на самом деле он играет гораздо большую роль в нашей жизни. Кальций вокруг нас. Среднестатистический человек содержит около 1 кг кальция, из которых 99% хранится в наших костях. Это пятый по распространенности элемент в земной коре, широко распространенный в виде карбоната кальция, более известного как известняк. Это также пятый по распространенности растворенный ион в морской воде. Кальций был назван в честь латинского термина calx, означающего известь, и представляет собой химически активный серебристый металлический элемент, находящийся во 2-й группе периодической таблицы. Впервые он был выделен в 1808 году в Англии, когда сэр Хамфри Дэви провел электролиз смеси извести и оксида ртути. Сегодня мы получаем кальций путем электролиза расплавленной соли, такой как хлорид кальция. На воздухе элементарный кальций быстро образует серо-белое оксидно-нитридное покрытие. В отличие от магния, кальций довольно трудно зажечь, но после возгорания он горит ярко-красным пламенем высокой интенсивности. Однако соединения кальция гораздо полезнее, чем сам элемент. Литература, относящаяся к 975 году нашей эры, показывает, что гипс (который представляет собой сульфат кальция) уже тогда использовался для вправления сломанных костей. Оксид кальция (также известный как известь или негашеная известь) является основным компонентом строительных растворов и цемента. Производство цемента с использованием оксида кальция известно давно; его использовали римляне, а также египтяне, построившие Великую пирамиду в Гизе и гробницу Тутанхамона. Наша питьевая вода также содержит ионы кальция, особенно в регионах с так называемой жесткой водой. Жесткая вода — это термин, используемый для воды с высоким содержанием ионов кальция и магния (2 плюс). Кальций обычно попадает в воду, когда она проходит через карбонат кальция из известняка и мела или сульфат кальция из других месторождений полезных ископаемых. Хотя некоторым людям не нравится вкус, жесткая вода, как правило, не вредна для здоровья. Хотя это делает ваш чайник пушистым! Интересно, что вкус пива (что-то дорогое моему сердцу) кажется связанным с концентрацией кальция в используемой воде, и утверждается, что хорошее пиво должно иметь концентрацию кальция выше, чем в жесткой водопроводной воде. Кальций известен как незаменимый элемент, что означает, что это элемент, который абсолютно необходим для жизненных процессов. Ионы кальция также играют решающую роль в высших организмах в качестве внутриклеточного мессенджера. Потоки Ca2+ вызывают действие ферментов в клетках в ответ на получение гормонального или электрического сигнала из других частей организма. Кальций также очень важен для свертывания крови. Когда внезапно возникает кровотечение из раны, тромбоциты собираются в ране и пытаются блокировать кровоток. Кальций, витамин К и белок, называемый фибриногеном, помогают тромбоцитам образовывать сгусток. Если в вашей крови не хватает кальция или одного из этих других питательных веществ, для свертывания крови потребуется больше времени, чем обычно. Способность обнаруживать чрезвычайно малые количества элемента может быть очень полезной адаптацией для животного, если этот элемент важен для него. Например, крабы-отшельники, обитающие в бывших в употреблении раковинах и меняющие свои раковины на новые, более крупные по мере своего роста, обладают способностью распознавать раковины, подходящие для обитания, не только на ощупь, но, по-видимому, также путем измерения незначительного количества карбоната кальция, которое содержится в них. Итак, от крепких зубов и костей до хорошего вкуса пива и обеспечения того, чтобы крабы-отшельники нашли свой идеальный дом — вы можете видеть, что кальций действительно является важным элементом. Крис Смит Что ж, я чувствую себя как дома с моей жесткой водой, и местное пиво тоже имеет неплохой вкус, хотя я и пропиваю довольно много чайников – действительно, Рассел Хоббс, вероятно, обязан своим жизнерадостным курсом акций всего лишь до меня. Ну, возможно. Это была Карен Фолдс из Стратклайдского университета с историей о кальции. На следующей неделе, если бы вы были элементом, каким бы вы были? Пэт Бэйли Если бы мне пришлось выбирать человека, который будет представлять золото, то я думаю, что это мог бы быть амбициозный молодой биржевой маклер, немного кричащий и неспособный к установлению отношений. Крис Смит И вы можете получить внутреннюю историю о свинговых выходках Борона с Пэт Бейли в выпуске «Химия в ее стихии» на следующей неделе. Я Крис Смит, спасибо за внимание и до свидания. (Promo) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. (окончание акции) |
Нажмите здесь, чтобы посмотреть видео о кальции
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
W.M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г. & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
John Emsley, Строительные блоки природы: справочник по элементам от А до Я , Oxford University Press, New York, 2nd, New York, 2nd Издание 2011 г.
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.
Периодическая таблица видео, по состоянию на декабрь 2014 г.
Частично получены из материалов, предоставленных Британской геологической службой © NERC.
Исторический текст
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
Podcasts
, созданные The Nake Scients Scientists. .
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
Гелий — информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к литию >
| Группа | 18 | Температура плавления | Неизвестный |
| Период | 1 | Температура кипения | -268,928 ° С, -452,07 ° F, 4,222 К |
| Блок | с | Плотность (г см −3 ) | 0,000164 |
| Атомный номер | 2 | Относительная атомная масса | 4. 003 003 |
| Состояние при 20°С | Газ | Ключевые изотопы | 4 Он |
| Электронная конфигурация | 1с 2 | КАС номер | 7440-59-7 |
| ChemSpider ID | 22423 | ChemSpider — бесплатная база данных химической структуры. | |
Это изображение солнца, потому что гелий получил свое название от «гелиос», греческого слова, обозначающего солнце. Гелий был обнаружен на Солнце по его спектральным линиям за много лет до того, как он был обнаружен на Земле.
Бесцветный газ без запаха, абсолютно нереакционноспособный.
Гелий используется в качестве охлаждающей среды для Большого адронного коллайдера (БАК) и сверхпроводящих магнитов в сканерах МРТ и ЯМР-спектрометрах. Он также используется для охлаждения спутниковых приборов и используется для охлаждения жидкого кислорода и водорода, питающих космические аппараты «Аполлон».
Из-за своей низкой плотности гелий часто используется для наполнения декоративных воздушных шаров, метеозондов и дирижаблей. Когда-то водород использовался для наполнения воздушных шаров, но он опасно реакционноспособен.
Поскольку гелий очень неактивен, он используется для создания инертной защитной атмосферы при изготовлении волоконной оптики и полупроводников, а также для дуговой сварки. Гелий также используется для обнаружения утечек, например, в автомобильных системах кондиционирования воздуха, и, поскольку он быстро рассеивается, его используют для надувания автомобильных подушек безопасности после удара.
Гелий также используется для обнаружения утечек, например, в автомобильных системах кондиционирования воздуха, и, поскольку он быстро рассеивается, его используют для надувания автомобильных подушек безопасности после удара.
Смесь 80 % гелия и 20 % кислорода используется в качестве искусственной атмосферы для глубоководных водолазов и других лиц, работающих в условиях повышенного давления.
Газовые гелий-неоновые лазеры используются для сканирования штрих-кодов на кассах супермаркетов. Новым применением гелия является гелий-ионный микроскоп, который дает лучшее разрешение изображения, чем сканирующий электронный микроскоп.
Гелий не играет известной биологической роли. Он нетоксичен.
После водорода гелий является вторым наиболее распространенным элементом во Вселенной. Он есть у всех звезд. Он образовался и до сих пор образуется в результате альфа-распада радиоактивных элементов в Земле. Часть образовавшегося гелия уходит в атмосферу, которая содержит около 5 частей на миллион по объему. Это динамическое равновесие, когда гелий низкой плотности постоянно убегает в космос.
Это динамическое равновесие, когда гелий низкой плотности постоянно убегает в космос.
Извлекать гелий из воздуха невыгодно. Основным источником является природный газ, который может содержать до 7% гелия.
Элементы и история периодической таблицы
В 1868 году Пьер Дж. К. Янссен отправился в Индию, чтобы измерить солнечный спектр во время полного затмения, и увидел новую желтую линию, указывающую на новый элемент. Джозеф Норман Локьер зафиксировал ту же линию, наблюдая за солнцем сквозь лондонский смог, и, предположив, что новый элемент представляет собой металл, назвал его гелием.
В 1882 году итальянец Луиджи Пальмьери обнаружил ту же линию в спектре газов, испускаемых Везувием, что и американец Уильям Хиллебранд в 1889 году, когда он собрал газ, выделяемый минералом уранинитом (UO2) при его растворении в кислоте. Однако именно Пер Теодор Клив и Нильс Абрахам Лангер в Уппсале, Швеция, в 1895 году повторили этот эксперимент, подтвердили, что это гелий, и измерили его атомный вес.
| Атомный радиус, несвязанный (Å) | 1.400 | Ковалентный радиус (Å) | 0,37 |
| Сродство к электрону (кДж моль −1 ) | Нестабильный | Электроотрицательность (шкала Полинга) | Неизвестный |
| Энергии ионизации (кДж моль −1 ) | 1 ст 2372. 2 -й 5250.516 | ||
| Общие степени окисления | | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 3 Он | 3. 016 016 | 0,000134 | – | – | |
| 4 Он | 4.003 | 99,9999 | – | – | |
|
|
| Удельная теплоемкость (Дж кг -1 К -1 ) | 5193 | Модуль Юнга (ГПа) | Неизвестный | |||||||||||
| Модуль сдвига (ГПа) | Неизвестный | Объемный модуль (ГПа) | Неизвестный | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
| Слушайте подкаст Гелий |
Стенограмма: (Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец рекламного ролика) Крис Смит Здравствуйте, на этой неделе мы почти на вершине таблицы Менделеева, потому что рассматриваем гелий, который легче воздуха. Но для этого химика шарик, наполненный гелием, на самом деле является источником боли, а не источником удовольствия. Вот Питер Уотерс. Питер Уотерс Мы все знакомы с гелием, который легче воздуха, но всякий раз, когда я вижу воздушный шар, парящий на веревке, мне становится немного грустно. Это не потому, что я несчастный старый такой-то, а просто потому, что, в отличие от счастливого ребенка на другом конце провода, я знаю о ценном ресурсе, который вот-вот будет потерян навсегда. Гелий — второй по распространенности элемент во Вселенной, но здесь, на Земле, он встречается довольно редко. Большинство людей догадываются, что мы добываем гелий из воздуха, но на самом деле мы добываем его из земли. Гелий можно найти в некоторых частях мира, особенно в Техасе, в качестве второстепенного компонента в некоторых источниках природного газа. Гелий образуется при естественном радиоактивном распаде таких элементов, как уран и торий. Эти тяжелые элементы образовались до Земли, но они нестабильны и очень медленно распадаются. Одним из способов распада урана является испускание альфа-частицы. Эта альфа-частица на самом деле является сердцевиной атома гелия — его ядром. Как только он захватил пару электронов, родился атом гелия. Этот процесс распада урана невероятно медленный; время, за которое данное количество урана распадается вдвое, так называемый период полураспада, сравнимо с возрастом Земли. Это означает, что гелий непрерывно генерируется с тех пор, как сформировалась Земля. Часть газа может в конечном итоге просочиться сквозь землю и выйти в атмосферу; к счастью, при подходящих условиях некоторые из них остаются в ловушке под землей и могут быть собраны для нашего использования. В космосе ситуация совсем другая. Солнце состоит примерно из 75% по массе водорода и 24% гелия. Оставшийся один процент составляют все более тяжелые элементы. При высоких температурах Солнца ядра водорода сливаются вместе, в конечном итоге образуя гелий. Этот процесс синтеза, при котором более тяжелые атомы образуются из более легких, высвобождает огромное количество энергии. Воссоздание процесса на Земле может стать ответом на наши энергетические проблемы в будущем. Поскольку гелий составляет около четверти массы Солнца, неудивительно, что его присутствие было обнаружено там более 100 лет назад. Что, пожалуй, удивительно, так это то, что гелий был обнаружен в космосе за 26 лет до того, как его нашли на Земле. Уже сотни лет известно, что определенные элементы придают пламени характерные цвета — факт, имеющий решающее значение для цветных фейерверков, которыми мы наслаждаемся. Медь, например, дает зеленый цвет, тогда как натрий дает желтый цвет. На самом деле можно идентифицировать элементы путем тщательного изучения такого цветного пламени. В 19 веке ученые направили свои спектроскопы на Солнце и стали обнаруживать там некоторые металлы, в том числе натрий, магний, кальций и железо. В 1868 году два астронома, Янссен и Локьер, независимо друг от друга заметили несколько очень четких линий в солнечном спектре, которые не соответствовали ни одному из известных металлов. В то время как другие астрономы того времени не были уверены, Локьер предположил, что эти неопознанные линии принадлежат новому металлу, который он назвал Гелий в честь греческого олицетворения солнца, Гелиос . В течение более 20 лет на Земле не было обнаружено никаких признаков металлического гелия, и Локьера начали высмеивать за его мифический элемент. Наконец, на Земле был открыт элемент Локьера, но это был не металл, а крайне нереакционноспособный газ. По сей день гелий остается единственным неметаллом, название которого заканчивается суффиксом -ium, окончанием, которое в остальном используется исключительно для металлов. Помимо использования для наполнения воздушных шаров, как для нашего развлечения, так и для более серьезных целей, таких как метеорологические зонды, гелий используется в других целях, которые зависят от его уникальных свойств. Будучи таким легким и при этом совершенно химически инертным, гелий можно смешивать с кислородом, чтобы облегчить дыхание. Эта смесь, известная как гелиокс, может помочь спасти новорожденных детей с проблемами дыхания или помочь подводным ныряльщикам безопасно достичь глубин океана. На многих объектах, где используется гелий, он улавливается и используется повторно. Если это не так, он убегает в воздух. Но он не просто накапливается в атмосфере. Гелий настолько легок, что может избежать гравитационного поля Земли и навсегда покинуть нашу планету. Такова судьба гелия в наших воздушных шарах. В то время как другие элементы, которые мы использовали и выбрасываем, можно восстановить и переработать, когда мы тратим впустую гелий, он теряется навсегда. Через 100 лет люди будут оглядываться назад с недоверием к тому, что мы потратили впустую этот драгоценный, уникальный элемент, надувая воздушные шары для вечеринок. Крис Смит Питер Уотерс из Кембриджского университета рассказывает нам историю об элементе номер два, гелии. Ричард Ван Ноорден В 1787 году в Эдинбург из свинцового рудника в небольшой деревне на берегу озера Лох-Сунарт, Аргайл, прибыл загадочный минерал. В то время считалось, что этот материал представляет собой какое-то соединение бария. Другие химики, такие как Томас Хоуп из Эдинбурга, позже приготовили ряд соединений с этим элементом, отметив, что он заставляет пламя свечи гореть красным, а соединения бария дают зеленый цвет. Крис Смит И это потому, что это был вовсе не барий, а стронций, и Ричард Ван Норден объяснит, как, среди прочего, он показал нам, что римские гладиаторы не были мясоедами, а были на самом деле вегетарианцы. Это Химия в своей стихии на следующей неделе, и я надеюсь, что вы сможете присоединиться к нам. Я Крис Смит, спасибо за внимание и до свидания. (Promo) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists. (окончание акции) |
Нажмите здесь, чтобы посмотреть видео о гелии
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
W.M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г. & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
& Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
John Emsley, Строительные блоки природы: справочник по элементам от А до Я , Oxford University Press, New York, 2nd, New York, 2nd Издание 2011 г.
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.
Периодическая таблица видео, по состоянию на декабрь 2014 г.
Частично получены из материалов, предоставленных Британской геологической службой © NERC.
Исторический текст
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
Podcasts
, созданные The Nake Scients Scientists. .
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
Разница между Менделеевым и современной таблицей Менделеева
3 января 2016 г.
от администратора
5 минут чтения
Основное отличие Менделеева от современной периодической таблицы
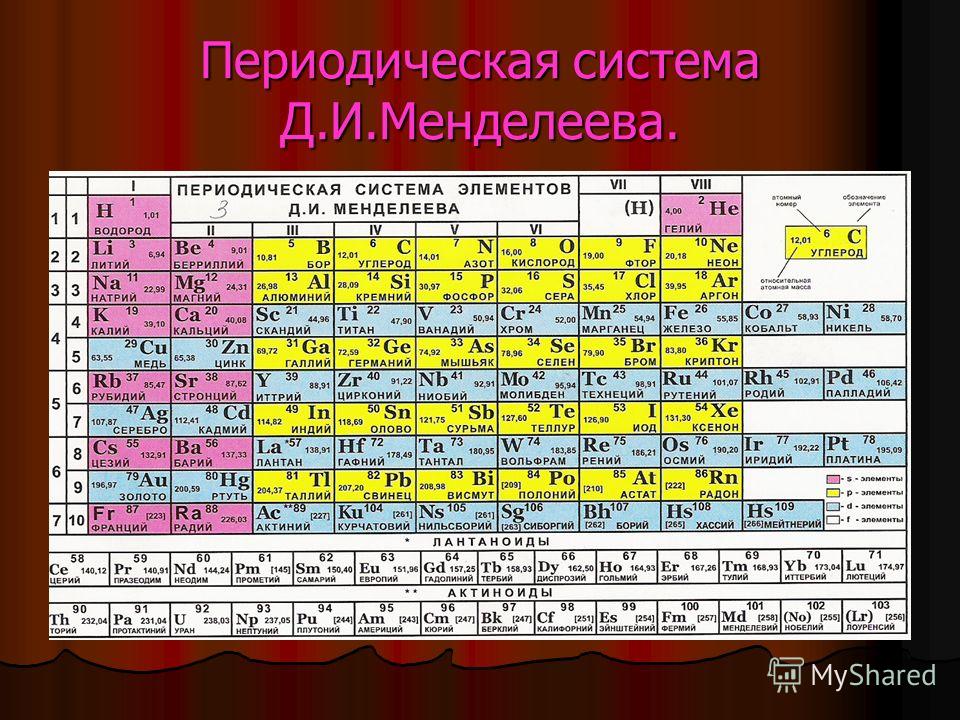
Периодическая таблица представляет собой расположение химических элементов в соответствии с их химическими и физическими свойствами. Современная таблица Менделеева была создана после серии различных версий таблицы Менделеева. Русский химик/профессор Дмитрий Менделеев первым придумал структуру периодической таблицы со столбцами и строками. Эта функция также является основным строительным блоком современной периодической таблицы. Менделеев смог установить, что химические свойства элементов начинали повторяться каждый раз после определенного числа элементов. Отсюда и вошел в обиход термин «периоды», напоминающий этот характер повторения. Столбцы в периодической таблице называются групп, и они объединяют элементы со схожими свойствами. Строки в периодической таблице называются периодами , и представляют собой наборы элементов, которые повторяются из-за обладания схожими свойствами. Основное различие между Менделеевым и современной периодической таблицей заключается в том, что периодическая таблица Менделеева упорядочивает элементы на основе их атомной массы, тогда как в современной периодической таблице элементы упорядочиваются на основе их атомного номера.
Современная таблица Менделеева была создана после серии различных версий таблицы Менделеева. Русский химик/профессор Дмитрий Менделеев первым придумал структуру периодической таблицы со столбцами и строками. Эта функция также является основным строительным блоком современной периодической таблицы. Менделеев смог установить, что химические свойства элементов начинали повторяться каждый раз после определенного числа элементов. Отсюда и вошел в обиход термин «периоды», напоминающий этот характер повторения. Столбцы в периодической таблице называются групп, и они объединяют элементы со схожими свойствами. Строки в периодической таблице называются периодами , и представляют собой наборы элементов, которые повторяются из-за обладания схожими свойствами. Основное различие между Менделеевым и современной периодической таблицей заключается в том, что периодическая таблица Менделеева упорядочивает элементы на основе их атомной массы, тогда как в современной периодической таблице элементы упорядочиваются на основе их атомного номера.
Что такое периодическая таблица Менделеева
Основой периодической таблицы Менделеева была классификация элементов в соответствии с их физическими и химическими характеристиками в зависимости от их атомного веса. Были и другие ученые, которые работали над табулированием информации об элементах еще до Менделеева, однако он был первым ученым, который придумал периодическую тенденцию для предсказания свойств элементов, которые не были открыты в то время. Следовательно, в периодической таблице Менделеева были пустые места/пробелы, чтобы эти элементы, однажды найденные, можно было включить. Галлий и герань были двумя такими элементами.
Также в некоторых случаях Менделеев не следовал строго правилу упорядочения атомов в соответствии с их атомным весом; он разместил элементы, отдавая предпочтение их химическим свойствам, чтобы их можно было точно сгруппировать. Элементы теллур и йод являются хорошим примером для этого. В первой периодической таблице Менделеева элементы со схожими свойствами были сгруппированы в строки. Затем он выпустил вторую версию своей периодической таблицы, в которой элементы были сгруппированы в столбцы с номерами l-Vlll в зависимости от степени окисления элемента. Однако периодическая таблица Менделеева не подтверждала существование изотопов. Это атомы одного и того же элемента с разным весом.
Затем он выпустил вторую версию своей периодической таблицы, в которой элементы были сгруппированы в столбцы с номерами l-Vlll в зависимости от степени окисления элемента. Однако периодическая таблица Менделеева не подтверждала существование изотопов. Это атомы одного и того же элемента с разным весом.
Периодическая таблица Менделеева
Что такое современная периодическая таблица
Основой современной периодической таблицы является атомное число элементов; физические и химические свойства элементов рассматриваются как периодические функции их атомных номеров. Следовательно, это придает смысл электронной конфигурации каждого элемента. Современная периодическая таблица состоит из 18 столбцов, называемых , групп и 7 строк, называемых периодами . Лантаниды и актиниды расположены в разных блоках. Поэтому современную периодическую таблицу тоже можно рассматривать как блоки. Он построен из четырех разных блоков. Первые два столбца принадлежат S блок ; столбцы 3-12 относятся к блоку d , 13-18 — элементы блока p , и, наконец, лантаноиды и актиноиды относятся к блоку f . Разделение на блоки основано на орбитали, на которой заполняется последний электрон.
Разделение на блоки основано на орбитали, на которой заполняется последний электрон.
Таблица Менделеева имеет особые тенденции и может быть помечена для дальнейшей дифференциации. Например, группа 17 называется галогенами, , а группа 18 — благородными газами . Первая группа — щелочные металлы; второй называется щелочноземельными металлами, d-блок элементов известен как переходный ряд. Около 4/5 элементов таблицы Менделеева составляют металлы. Все элементы переходного ряда и f-блока, а также элементы первых двух групп являются металлами. Металлический характер уменьшается при движении слева направо по периоду таблицы Менделеева. Радиус атома уменьшается, а электроотрицательность увеличивается при движении слева направо по периоду. Размер атомов увеличивается при движении вниз по любому столбцу таблицы Менделеева.
Современная периодическая таблица
Разница между Менделеевым и современной периодической таблицей
Определение
Периодическая таблица Менделеева была создана на основе периодических функций элементов, оставляя место для будущих открытий отсутствующих элементов в то время.
Современная периодическая таблица используется в настоящее время как коллективное усовершенствование работ многих химиков и ученых в попытке упорядочить химические элементы так, чтобы они напоминали сходство по своим свойствам.
Основа упорядочения
Периодическая таблица Менделеева упорядочивает элементы на основе их атомного веса.
Современная таблица Менделеева упорядочивает элементы на основе их атомного номера.
Пробелы для отсутствующих элементов
В периодической таблице Менделеева в то время были пробелы для отсутствующих элементов.
Современная таблица Менделеева не имеет понятия как такового.
Количество столбцов и строк
Периодическая таблица Менделеева имеет 8 вертикальных столбцов, называемых группами, и 12 горизонтальных рядов, называемых периодами.
Современная таблица Менделеева имеет 18 столбцов, называемых группами, и 7 строк, называемых периодами.
Характеристики сгруппированных элементов
Периодическая таблица Менделеева иногда содержит элементы с разными свойствами в одной и той же группе.
Элементы современной таблицы Менделеева имеют схожие свойства, повторяющиеся через равные промежутки времени.
Существование изотопов
Периодическая таблица Менделеева не подтверждает факт существования изотопов.
Современная периодическая таблица подтверждает этот факт, поскольку классификация основана на атомном номере, а не на атомном весе элемента.
Определение структуры атома
Периодическая таблица Менделеева не поддерживает концепцию строения атома.
Современная таблица Менделеева подтверждает этот факт, группируя элементы таким образом, что их электронная конфигурация может быть легко выведена.
Изображение предоставлено:
«Менделеевская система периодики 1871 г.



 На самом деле Ag – сокращение от argentums, латинское слово для серебра. Слово «серебро» происходит от англосаксонского слова seolfor.
На самом деле Ag – сокращение от argentums, латинское слово для серебра. Слово «серебро» происходит от англосаксонского слова seolfor. Так как же серебряные экспонаты музея остаются такими блестящими? Они покрыты прозрачными лаками. Исследователи работают над созданием покрытий нанометровой толщины, которые могут заменить современные лаки с ручной росписью чем-то более тонким, полностью невидимым и долговечным.
Так как же серебряные экспонаты музея остаются такими блестящими? Они покрыты прозрачными лаками. Исследователи работают над созданием покрытий нанометровой толщины, которые могут заменить современные лаки с ручной росписью чем-то более тонким, полностью невидимым и долговечным.

 Металл незаменим при пайке. Составы с большой его долей используются ювелирами, со средней – в технических изделиях, от жидкостных двигателей для ракеты до выключателей. При добавке свинца серебряный припой заменяет собой оловянный.
Металл незаменим при пайке. Составы с большой его долей используются ювелирами, со средней – в технических изделиях, от жидкостных двигателей для ракеты до выключателей. При добавке свинца серебряный припой заменяет собой оловянный.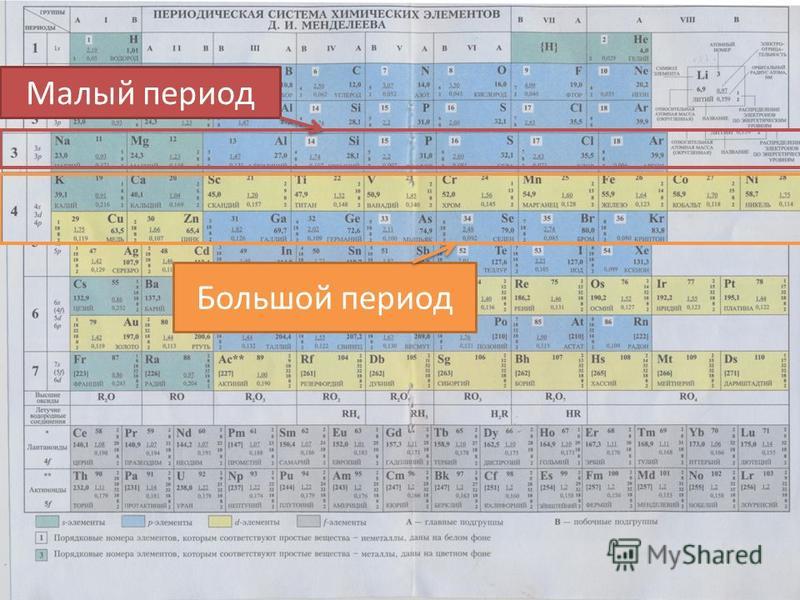 Это свойство используется для черно-белой фотографии.
Это свойство используется для черно-белой фотографии.


 Подобные крупные образцы находили и в других частях света.
Подобные крупные образцы находили и в других частях света. 447
447 1
1


 Фторид кальция также хорошо известен своей нерастворимостью и прозрачностью в широком диапазоне длин волн, что делает его полезным для изготовления ячеек и окон для инфракрасных и ультрафиолетовых спектрометров.
Фторид кальция также хорошо известен своей нерастворимостью и прозрачностью в широком диапазоне длин волн, что делает его полезным для изготовления ячеек и окон для инфракрасных и ультрафиолетовых спектрометров. Именно это старая телевизионная реклама молока и пыталась нам внушить. Кальций используется для производства минералов, содержащихся в костях, раковинах и зубах, посредством процесса, называемого биоминерализацией. Фосфат кальция (также известный как гидроксиапатит) является минеральным компонентом костей и зубов и является особенно хорошим примером того, как организмы производят «живые» композитные материалы. Действительно, различные свойства (такие как жесткость) кости обусловлены изменением количества органического компонента, в основном волокнистого белка, называемого коллагеном, с которым связан гидроксиапатит. Кость в нашем организме функционирует не только как структурная опора, но и как центральное хранилище кальция. Таким образом, во время беременности кости, как правило, подвергаются набегам на кальций в процессе, называемом деминерализацией. Кость не вечна; серьезной медицинской проблемой является остеопороз, который представляет собой декальцинацию костей. Эта потеря костной массы, которая происходит с возрастом, делает кости более восприимчивыми к переломам при стрессе, и это происходит в основном у пожилых людей, особенно у женщин.
Именно это старая телевизионная реклама молока и пыталась нам внушить. Кальций используется для производства минералов, содержащихся в костях, раковинах и зубах, посредством процесса, называемого биоминерализацией. Фосфат кальция (также известный как гидроксиапатит) является минеральным компонентом костей и зубов и является особенно хорошим примером того, как организмы производят «живые» композитные материалы. Действительно, различные свойства (такие как жесткость) кости обусловлены изменением количества органического компонента, в основном волокнистого белка, называемого коллагеном, с которым связан гидроксиапатит. Кость в нашем организме функционирует не только как структурная опора, но и как центральное хранилище кальция. Таким образом, во время беременности кости, как правило, подвергаются набегам на кальций в процессе, называемом деминерализацией. Кость не вечна; серьезной медицинской проблемой является остеопороз, который представляет собой декальцинацию костей. Эта потеря костной массы, которая происходит с возрастом, делает кости более восприимчивыми к переломам при стрессе, и это происходит в основном у пожилых людей, особенно у женщин.
 растворяется в воде вокруг раковины. Они могут легко отличить натуральные раковины, содержащие карбонат кальция, от содержащих кальций реплик, сделанных из сульфата кальция. Концентрация кальция, обнаруженная раком-отшельником, составляет порядка 4 частей на миллион или меньше, что является удивительно низким показателем.
растворяется в воде вокруг раковины. Они могут легко отличить натуральные раковины, содержащие карбонат кальция, от содержащих кальций реплик, сделанных из сульфата кальция. Концентрация кальция, обнаруженная раком-отшельником, составляет порядка 4 частей на миллион или меньше, что является удивительно низким показателем.