Металлы и неметаллы – объясняю так, чтобы вы точно поняли разницу
Одни отдают электроны, другие принимают.
Металлы – это такие элементы, которые стараются отдавать свои электроны. Неметаллы – наоборот, стараются их принимать. Вам надо понять, почему это происходит, и что значат фразы типа «металлические свойства усиливаются, а неметаллические ослабевают». Сейчас я вам это объясню.
Почему металлические свойства слабеют «слева направо»
Итак. В атоме есть три частицы: протоны, нейтроны и электроны. У протонов заряд +1, у электронов -1. У нейтронов заряда нет.
Протоны и нейтроны находятся в ядре. Поэтому заряд ядра всегда плюсовой. А электроны крутятся вокруг ядра и притягиваются к нему, потому что у них заряд минусовой.
Электроны крутятся по электронным уровням – как планеты по орбитам вокруг Солнца.
Атомный номер показывает, сколько в атоме протонов. Как видите, это количество постоянно увеличивается.
Чем больше протонов, тем сильнее они «тянут» к себе электроны. Сравните:
Сравните:
Вывод – чем больше становится протонов, тем сильнее они удерживают электроны. Тем сложнее становится эти электроны отдавать. Поэтому слева направо, с увеличением порядкового номера (и, соответственно, числа протонов) металлические свойства слабеют, а неметаллические усиливаются.
На заметку – про радиус атома
Чем сильнее протоны притягивают электроны, тем ближе эти электроны становятся к протонам. Поэтому радиус атома уменьшается, атом как бы сжимается из-за увеличения заряда.
Почему неметаллические свойства слабеют «сверху вниз»
Идем дальше. Период в таблице показывает количество уровней (тех самых орбит), по которым летают электроны.
Чем больше период, тем больше этих орбит и тем дальше оказываются электроны от ядра. Сравните:
Кому сложнее удерживать электроны на последнем уровне? Меди, конечно, потому что эти электроны в два раза дальше от ядра, чем, например, у лития. Их проще становится отдать, чем пытаться удерживать.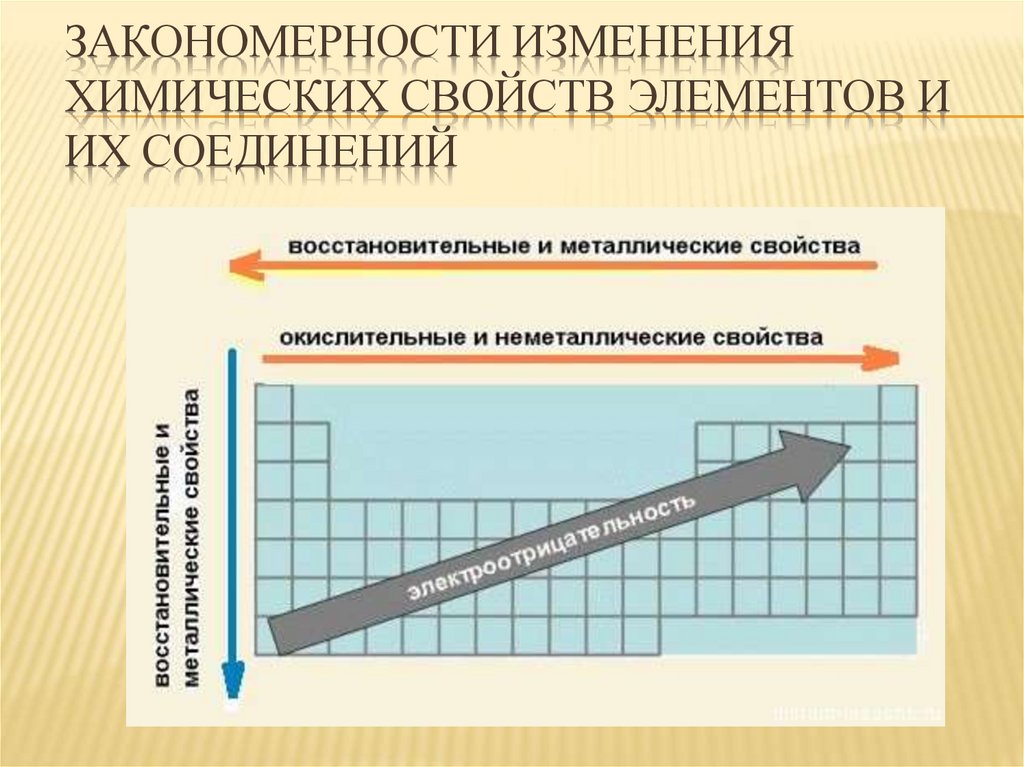
Следовательно, «сверху вниз» количество уровней, по которым движутся электроны, растет, удерживать их становится сложнее, поэтому металлические свойства усиливаются, а неметаллические – слабеют.
Еще про радиус
Если смотреть на таблицу «сверху вниз» радиус ядра растет, потому что уровней становится больше.
Да, заряд атома тоже растет, но все-таки расстояние перевешивает. Чем больше уровней, тем труднее становится держать электроны, даже несмотря на то, что заряд увеличивается.
Обобщаю:
- Слева направо в таблице металлические свойства слабеют, неметаллические усиливаются из-за того, что ядро сильнее тянет к себе электроны.
- Сверху вниз металлические свойства усиливаются, неметаллические слабеют, потому что уровней становится больше, и удерживать электроны на последних уровнях становится труднее.
Из этих двух положений следует, что в правом углу таблицы Менделеева будут сосредоточены неметаллы, а в левом – металлы.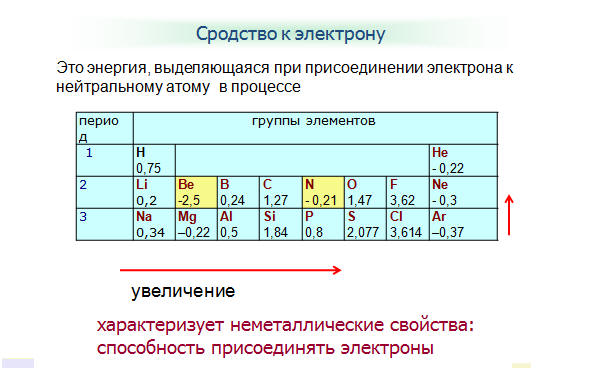
Я нашел вам вот такую картинку, на ней показаны все неметаллы. То, что выделено курсивом – это так называемые металлоиды – вроде и не совсем металлы, и в то же время не неметаллы. Нечто среднее.
Это основа основ. Надеюсь, я объяснил понятно и вы разобрались. Если нет – перечитайте еще раз, задайте вопросы мне в комментариях. Только когда разберетесь – читайте дальше.
Свойства металлов
Эти свойства проявляются в разной мере, но все-таки присущи всем металлам:
- Плавятся.
- Их можно ковать.
- Обладают металлическим блеском.
- Проводят электрический ток. Это происходит благодаря металлической связи, которая соединяет их атомы.
- Проводят тепло.
- Твердые – это касается всех, кроме ртути.
На сегодняшний день металлов известно 87.
Свойства неметаллов
У них почти все наоборот:
- Ковать нельзя, потому что они хрупкие.

- Не обладают металлическим блеском.
- Не проводят электрический ток (за редким исключением – кремний и графит могут быть проводниками).
- Очень плохо проводят тепло.
- Есть твердые, газообразные, жидкие.
Неметаллов на данный момент 22.
Это первая статья по химии на нашем сайте. Напишите, что не так, что нравится и не нравится. Я буду думать, как сделать материал лучше.
И еще – есть идея записывать видеоролики с объяснениями. Лично вам удобнее разбираться в чем-то, читая текст, или просматривая видео?
Буду рад каждому вашему отзыву и комментарию.
ЕЖЕНЕДЕЛЬНАЯ РАССЫЛКА
Получайте самые интересные статьи по почте и подписывайтесь на наши социальные сети
ПОДПИСАТЬСЯВаш браузер устарел рекомендуем обновить его до последней версии
или использовать другой более современный.
Ослабевание неметаллических свойств. Металлические свойства химических элементов
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Эти свойства зависят от способности элемента
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом.
Список неметаллов с наиболее выраженными характеристиками:
- фтор;
- кислород;
- азот;
- хлор;
- бром.
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк.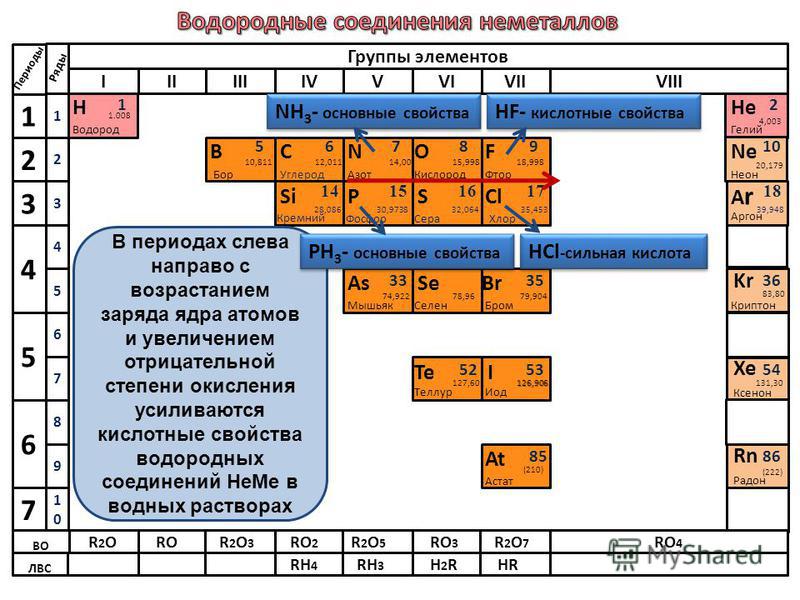 Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк . Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Не получили ответ на свой вопрос? Предложите авторам тему.
Систематизированных в виде периодической таблицы. Подавляющее большинство из них причисляют к металлам, что подразумевает наличие у этих элементов особых качеств. Это так называемые металлические свойства. К таким характеристикам, в первую очередь, относятся пластичность, повышенная тепло- и электропроводимость, способность к образованию сплавов, низкое значение потенциала ионизации.
Металлические свойства того или иного элемента обусловлены способностью его атомов при возникновении взаимодействия с атомными структурами других элементов смещать в их направлении электронные облака или же «отдавать» им свои свободные электроны. Самыми активными металлами являются те, что имеют низкую и электроотрицательность. Также ярко выраженные металлические свойства характерны для элементов, имеющих максимально большой радиус атома и предельно малое число внешних
По мере наполнения валентной орбиты количество электронов во внешнем слое атомной структуры возрастает, и радиус, соответственно, уменьшается. В связи с этим атомы начинают стремиться к присоединению свободных электронов, а не к их отдаче. таких элементов приобретают тенденцию к уменьшению, а их неметаллические свойства – к увеличению. И, наоборот, при увеличении атомного радиуса отмечается усиление металлических свойств. Поэтому характерной общей чертой всех металлов являются, так называемые, восстановительные качества – та самая способность атома отдавать свободные электроны.
В связи с этим атомы начинают стремиться к присоединению свободных электронов, а не к их отдаче. таких элементов приобретают тенденцию к уменьшению, а их неметаллические свойства – к увеличению. И, наоборот, при увеличении атомного радиуса отмечается усиление металлических свойств. Поэтому характерной общей чертой всех металлов являются, так называемые, восстановительные качества – та самая способность атома отдавать свободные электроны.
Наиболее ярко металлические свойства элементов проявляются у веществ первой, второй групп главных подгрупп периодической таблицы, а также у щелочных и Но самые сильные восстановительные качества наблюдаются у франция, а в водной среде – у лития благодаря более высокому показателю энергии гидратации.
Количество элементов, у которых проявляются металлические свойства, в пределах периода возрастает с увеличением номера периода. В периодической таблице металлы от неметаллов отделены диагональной линией, которая тянется от бора к астату. По этой разделительной черте расположены элементы, у которых в равной степени проявляются и те, и другие качества.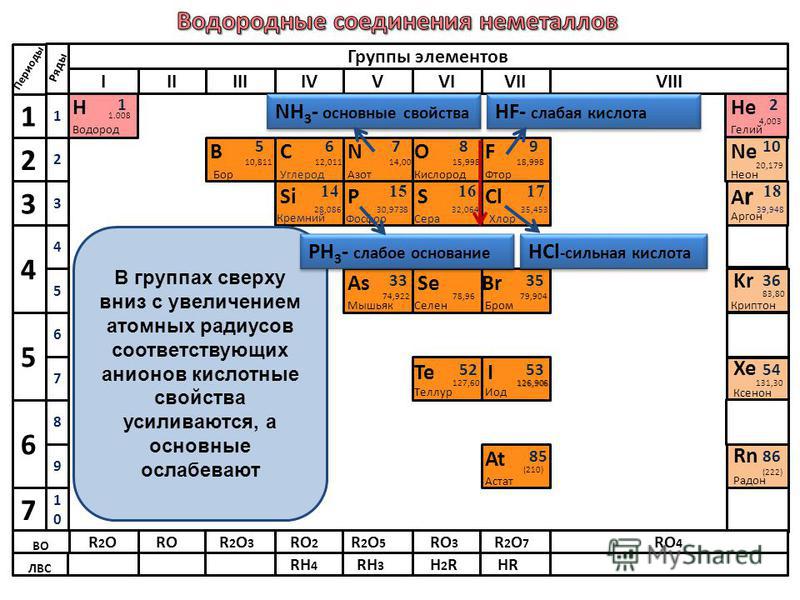
Каждый период характеризуется наличием своеобразной «пограничной зоны», в которой располагаются элементы с двойственными качествами. Следовательно, переход от ярко выраженного металла к типичному неметаллу осуществляется постепенно, что и нашло отражение в периодической таблице.
Общие свойства металлических элементов (высокая ковкость, характерный блеск, пластичность и др.) обусловлены схожестью их внутреннего строения, а точнее – наличием Однако существует немало качеств (плотность, твердость, температура плавления), которые придают всем металлам сугубо индивидуальные физико-химические свойства. Эти характеристики зависят от строения кристаллической решетки каждого конкретного элемента.
Задания А 2 (ГИА 2012)
Неметаллические свойства усиливаются в ряду: 1) N → P → As, 2) N → C → B, 3) N → O → F, 4) C → Si → Ge
Порядковый номер
химического элемента в Периодической
системе Д. И.Менделеева соответствует:
1) числу электронов в атоме, 2)
значению высшей валентности элемента
по кислороду, 3)числу электронов,
недостающих до завершения внешнего
электронного слоя, 4)
числу электронных слоев в атоме.
И.Менделеева соответствует:
1) числу электронов в атоме, 2)
значению высшей валентности элемента
по кислороду, 3)числу электронов,
недостающих до завершения внешнего
электронного слоя, 4)
числу электронных слоев в атоме.
Неметаллические свойства серы выражены сильнее, чем неметаллические свойства: 1) селена, 2) фтора, 3) кислорода, 4) хлора.
Номер группы в Периодической системе химических элементов Д.И.Менделеева соответствует: 1) числу электронов в атоме, 2) значению высшей валентности элемента по кислороду, 3)числу электронов, недостающих до завершения внешнего электронного слоя, 4) числу электронных слоев в атоме.
В периоде с увеличением атомного номера химического элемента происходит: 1) уменьшение заряда ядра атома, 3) уменьшение атомного радиуса, 2) усиление металлических свойств, 4) уменьшение числа валентных электронов.
Номер периода в
Периодической системе химических
элементов Д.И.Менделеева равен числу:
1) числу электронов в атоме,
2) числу электронов во внешнем слое
атомов, 3) недостающих
электронов до завершения электронного
слоя, 4)
заполняемых электронных слоев в атоме.
В подгруппах Периодической системы с увеличением заряда ядра атомов происходит: 1) усиление неметаллических свойств элементов, 3) увеличение радиуса атома, 2) уменьшение числа протонов в ядре, 4) увеличение электроотрицательности.
Кислотные свойства высших оксидов ослабевают в ряду: 1) P 2 O 5 → SiO 2 → Al 2 O 3 , 2) P 2 O 5 → SO 3 → Cl 2 O 7 , 3) Al 2 O 3 → P 2 O 5 → N 2 O 5 , 4) SiO 2 → P 2 O 5 → SO 3 .
В главных подгруппах Периодической системы с увеличением заряда ядра атомов химических элементов: 1) усиливаются неметаллические свойства, 2) уменьшаются металлические свойства, 3) изменяется валентность в водородных соединениях, 4) остается постоянной высшая валентность.
Амфотерным является высший оксид каждого из химических элементов, имеющих в Периодической системе Д.И.Менделеева порядковые номера: 1) 4, 13, 30, 2) 6, 11, 16, 3) 19, 12, 3, 4) 6, 14, 17.
В каком ряду химических элементов усиливаются неметаллические свойства
соответствующих им простых веществ?
1) алюминий → фосфор → хлор 3) хлор → бром → иод
2) фтор → азот → углерод 4) кремний → сера → фосфор
В каком ряду химические элементы расположены в порядке усиления неметаллических свойств? 1) O → S → Se 2) Si → P → S 3) S → P → Si 4) O → N → C
В каком ряду химические элементы расположены в порядке увеличения металлических свойств? 1) Li → Be → B 2) Li → Na → K 3) Mg → Al → Si 4) Ca → Mg → Be
В каком ряду химические элементы расположены в порядке уменьшения атомного радиуса? 1) P → S → Cl 2) А → O → N 3) Be → Mg → Ca 4) Li → Na → K
В ряду оксидов MgO
→ Al 2 O 3
→ SiO 2 свойства
изменяются от:
1) основных к амфотерным и кислотным,
3) кислотных к амфотерным,
2) кислотных к основным,
4) основных к
амфотерным.
В ряду гидроксидов H 2 SiO 3 → H 3 PO 4 → H 2 SO 4 1) кислоты становятся слабее, 3) усиливаются амфотерные свойства, 2) кислоты становятся сильнее, 4) кислотные и основные свойства не изменяются.
В ряду гидроксидов Mg(OH) 2 → Ca(OH) 2 → Sr(OH) 2: 1) основания становятся слабее, 3) усиливаются амфотерные свойства, 2) основания становятся сильнее, 4) основные свойства не изменяются.
В каком ряду элементы расположены в порядке уменьшения неметаллических свойств? 1) B → C → N, 2) Se → S → O, 3) F → Cl → Br, 4) Na → Mg → Al
В каком ряду элементы расположены в порядке увеличения числа валентных электронов? 1) P → S → Cl, 2) Na → K → Rb, 3) O → N → C, 4) C → Si → Ge
Наиболее ярко выражены металлические свойства у: 1) Na, 2) Li, 3) Rb, 4) Mg.
С увеличением зарядов ядер атомов Са → Sr → Ba металлические свойства: 1) ослабевают, 2) не изменяются, 3) изменяются периодически, 4) усиливаются.
Наименьший радиус
у атома: 1) бария, 2) кальция, 3) магния,
4) стронция.
Выберите общие формулы, соответствующие высшим оксиду и гидроксиду азота: 1) R 2 O 5 , RH 3 , 2) R 3 O 3 , HRO 3 , 3) R 2 O 5 , HRO 2 , 4) R 2 O 5 , HRO 3 .
Выберите общие формулы, соответствующие высшим оксиду и летучему водородному соединению кремния: 1) RO 2 , H 2 RO 3 , 2) RO, RH 4 , 3) RO 2 , RH 4 , 4) RO 3 , RH 3.
В ряду элементов Na → Mg → Al → Si металлические свойства и радиус атома соответственно: 1) ослабевают и уменьшается, 3) ослабевают и увеличивается, 2) возрастают и увеличивается, 4) усиливаются и уменьшается.
В ряду элементов Na → Mg → Al → Si: 1) металлические свойства усиливаются, 3) свойства не изменяются, 2) неметаллические свойства усиливаются, 4) металлические и неметаллические свойства изменяются периодически.
В главных подгруппах Периодической системы химических элементов с увеличением зарядов ядер радиус атомов: 1) увеличивается, 2) уменьшается, 3) не изменяется, 4) изменяется периодически.
Атомные радиусы
уменьшаются в ряду:
1) Li
→ Na → K,
2) F → O →
N, 3) Li
→ Be → B,
4) F → Сl →
Br.
Кислотные свойства оксидов усиливаются в ряду: 1) P → S → Cl, 2) C → Si → Ge, 3) P → Si → Al, 4) C → N → P.
Неметаллические свойства усиливаются в ряду: 1) C → N → P, 2) P → S → О, 3) Cl → S → P, 4) Cl → F → O.
Наименьший радиус имеет атом: 1) F, 2) Cl, 3) O, 4) S.
Основные свойства наиболее выражены у оксида:
натрия 2) калия 3) магния 4) бериллия
Наиболее сильным основанием является:
NaOH 2) RbOH 3) KOH 4) LiOH
В периоде с увеличением порядкового номера элемента химические свойства оксидов меняются в ряду:
Основный, амфотерный, кислотный 3) кислотный, амфотерный, основный
Амфотерный, кислотный, основный 4) основный, кислотный, амфотерный
Электроотрицательность элементов увеличивается в ряду:
F, Cl, Br 2) Na, K, Rb 3) Be, Mg, Ca 4) P, S, Cl
Электроотрицательность элементов уменьшается в ряду:
N, P, As 2) N, O, F 3) Li, Be, B 4) Se, S, O
В третьем периоде с увеличением порядкового номера элементов химические свойства гидроксидов, отвечающих высшей степени окисления, изменяются соответственно:
Основание, амфотерный гидроксид, кислота 3) кислота, амфотерный гидроксид, основание
Амфотерный гидроксид, основание, кислота 4) основание, кислота, амфотерный гидроксид
В ряду Mg – Ca – Sr – Ba
увеличивается число заполненных энергетических уровней в атомах
увеличивается электроотрицательность 3) изменяется агрегатное состояние простых веществ
ослабевают металлические свойства элементов
В ряду F – Cl – Br – I
уменьшается радиус атома 3) усиливаются неметаллические свойства элементов
увеличивается электроотрицательность 4) увеличивается число заполненных энергетических уровней в атомах
В ряду Li – Na – K – Rb
изменяется агрегатное состояние простых веществ 3) изменяется заряд иона
увеличивается электроотрицательность 4) усиливаются металлические свойства элементов
В ряду Si – P – S – Cl
увеличивается радиус атома
агрегатное состояние простых веществ одинаковое при обычных условиях
увеличивается электроотрицательность 4) усиливаются металлические свойства
Металличекие свойства элементов:
Возрастают в периоде слева направо 3) изменяются в периоде немонотонно
Возрастают в группе сверху вниз 4) характерны только для щелочных элементов
Среди всех элементов третьего периода элемент хлор обладает:
наиболее выраженными металлическими свойствами 3) самой высокой электроотрицательностью
самой большой атомной массой 4) самым большим радиусом атома
Среди всех элементов третьего периода элемент натрий обладает:
самой высокой электроотрицательностью 3) самым маленьким радиусом атома
наиболее выраженными металлическими свойствами 4) самой большой плотностью
Среди всех элементов главной подгруппы II группы элемент бериллий обладает:
наиболее выраженными металлическими свойствами 3) самой большой атомной массой
наименьшим радиусом атома 4) самой низкой электроотрицательностью
Среди всех элементов главной подгруппы IV группы элемент свинец обладает:
самым большим радиусом атома 3) наименее выраженными металлическими свойствами
самой высокой валентностью 4) самой высокой электроотрицательностью
Кислотные свойства в ряду высших оксидов углерода – кремния – фосфора:
Кислотные свойства в ряду высших гидроксидов серы – хлора – йода:
возрастают 2) ослабевают 3) сначала возрастают, затем ослабевают 4) сначала ослабевают, затем возрастают
Кислотность оксидов, образованных элементами IVА группы, сверху вниз:
Не изменяется 2) изменяется периодически 3) увеличивается 4) уменьшается
Кислотные свойства в ряду высших оксидов бора – углерода – кремния:
возрастают 2) ослабевают 3) сначала возрастают, затем ослабевают 4) сначала ослабевают, затем возрастают
В каком ряду вещества расположены в порядке увеличения металлических свойств?
Na, Mg, Al 2) Mg, Ca, Sr 3) Rb, Ca, Na 4) Ca, Mg, Be
В каком ряду простые вещества расположены в порядке уменьшения металлических свойств?
Sr, Ba, Ca 2) Na, K, Rb 3) Mg, Ca, Sr 4) Al, Mg, Na
При увеличении порядкового номера элемента неметаллические свойства:
усиливаются 2) ослабевают 3) не изменяются 4) изменяются периодически
Восстановительные свойства металлов в главной подгруппе с увеличением порядкового номера элемента:
убывают
2) не изменяются 3) возрастают 4)
сначала возрастают, затем убывают.
Электроотрицательность в ряду Na – Mg – Al
не изменяется 2) уменьшается 3) увеличивается 4) сначала уменьшается, затем увеличивается.
Неметаллическим (окислительными) свойствамисчитают способ-
ность нейтральных атомов элементов к присоединению дополнительных электронов. Движущей силой этого процесса также является стремление атомов приобрести наиболее стабильную восьмиэлектронную конфигурацию благородных газов. Наибольшую тенденцию к присоединению электронов имеют атомы элементов, обладающие относительно большим числом собственных валентных электронов.
Энергия сродства к электрону
(обозначается буквой A от “a
ffinity” – “сродство”) – это энергия, которая выделяется в процессе присоединения электрона к нейтральному атому. При этом атом превращается в отрицательно заряженный ион. Энергия сродства к электрону измеряется в кДж/моль (ее значения отрицательны, что отвечает экзотермическому процессу) и характеризует степень проявления элементами неметаллических свойств.
В периоде системы Д. И. Менделеева число валентных электронов и эффективный заряд ядра растут с ростом порядкового номера, что сопровождается возрастанию тенденции к проявлению неметаллических свойств и, соответственно, увеличению энергии сродства к электрону. Наибольшим сродством к электрону характеризуются галогены – элементы подгруппы VIIA.
В подгруппе системы элементов с ростом порядкового номера неметаллические свойства элементов ослабевают. Соответственно, уменьшается и энергия сродства к электрону.
Это объясняется тем, что в этом же направлении возрастает число энергетических уровней и увеличивается радиус атомов. Однако, теперь речь идет о присоединении электрона к атому, происходящее как результат притяжения этого электрона положительно заряженным ядром. Если атомное ядро экранировано многими электронными слоями собственного атома, сила его притяжения по отношению к электрону, поступающему извне, невелика по сравнению с ядром, окруженным небольшим числом собственных электронных слоев.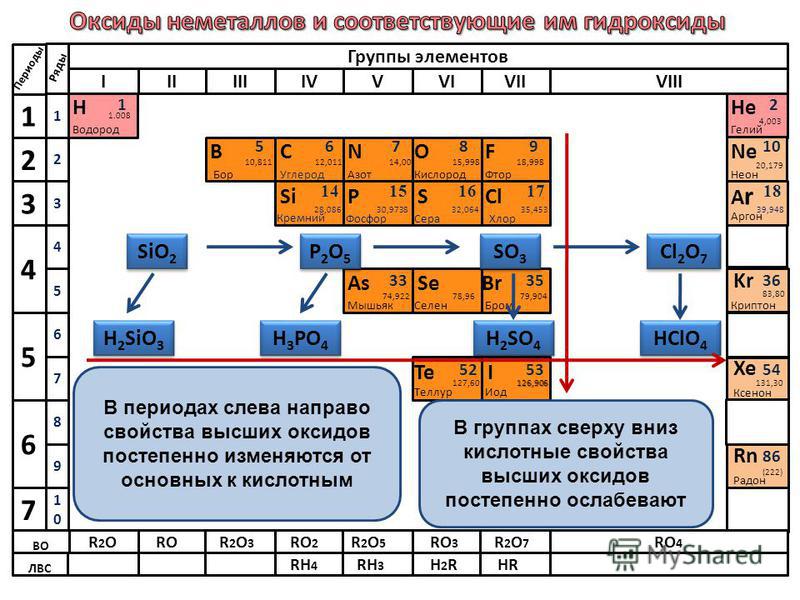
Так, например, атомы галогенов характеризуются валентной конфигурацией s2 p5 . Все они – наиболее активные неметаллы в таблице элементов. В зависимости от принадлежности каждого из них к тому или иному периоду семь валентных электронов этих атомов находятся на следующих энергетических уровнях:
2s2 p5 | периода), | ||||
3s2 p5 | периода), | ||||
4s2 p5 | периода), | ||||
5s2 p5 | периода), | ||||
6s2 p5 | периода). |
Атомное ядро элемента астата закрыто шестью электронными слоями, тогда как ядро атома фтора, обладающего наименьшим атомным радиусом среди галогенов, экранировано лишь двумя электронными слоями. По этой причине способность к притяжению дополнительного электрона (атомам галогенов не достает всего одного электрона до восьмиэлектронной оболочки благородного газа) у ядра атома фтора существенно выше, чем у ядра атома астата.
По этой причине способность к притяжению дополнительного электрона (атомам галогенов не достает всего одного электрона до восьмиэлектронной оболочки благородного газа) у ядра атома фтора существенно выше, чем у ядра атома астата.
Фтор – наиболее активный неметалл среди элементов системы Д. И. Менделеева. Теоретический прогноз позволяет предполагать для него наивысшее сродство к электрону. Однако экспериментальное определение энергии сродства к электрону дает величину, промежуточную между соответствующими величинами для хлора и брома: AF = –328 кДж/моль, ACl = –349 кДж/моль, ABr = –325 кДж/моль. Причины подобного явления требуют более детального рассмотрения, выходящего за рамки настоящего издания.
2.5.3. Электроотрицательность
Если энергия ионизации характеризует процесс отдачи электрона атомом, а энергия сродства к электрону – процесс присоединения электрона к нейтральному атому, то электроотрицательность, выполняя роль своеобразной равно-
действующей, определяет промежуточную тенденцию – тенденцию к смещению электронной плотности от одного атома к другому.
Электроотрицательность обозначают символом EN (от e lectron egativity) или ЭО (в русскоязычном варианте) и измеряют в тех же единицах, что и энергию ионизации, и энергию сродства к электрону – в кДж/моль.
Электроотрицательность не является строго определенной физической величиной, а может расцениваться как некая условная характеристика, позволяющая делать удачные прогнозы, например, в области природы химической связи между атомами. Если энергия ионизации и энергия сродства к электрону являются характеристиками изолированных атомов, то электроотрицательность есть свойство атомов, которое проявляется лишь в процессе взаимодействия между ними.
Понятие электроотрицательности было впервые введено Лайнусом Полингом. Имеется несколько шкал электроотрицательности элементов, базирующихся на разных экспериментальных или расчетных данных. Например, шкала Малликена основана на использовании среднего значения энергии ионизации и энергии сродства к электрону:
ЭО = I + 2 А .
В Приложении 3 помещена одна из наиболее распространенных шкал электроотрицательности элементов по Л. Полингу.
Полингу.
Учитывая проведенный выше анализ изменения энергии ионизации и энергии сродства к электрону по периодам и группам таблицы Д. И. Менделеева, можно заключить, что электроотрицательность s- и p-элементов возрастает в периоде и уменьшается в подгруппе с ростом порядкового номера элементов. Наименьшими электроотрицательностями характеризуются элемент франций (теоретически) и цезий (0.9), наибольшей – элемент фтор (4.1).
Электроотрицательность переходных элементов меняется не столь существенно, однако ее увеличение с ростом порядкового номера в пределах периода прослеживается довольно четко.
2.5.4. Атомные радиусы
Атомные и ионные радиусы определяют геометрические размеры атомов и ионов, оказывающие значительное влияние на многие свойства как самих элементов, так и их соединений. Эти параметры изменяются периодически в зависимости от порядкового номера элемента.
Атомный радиус
– величина условная, т.к. очертить точные границы электронного облака невозможно.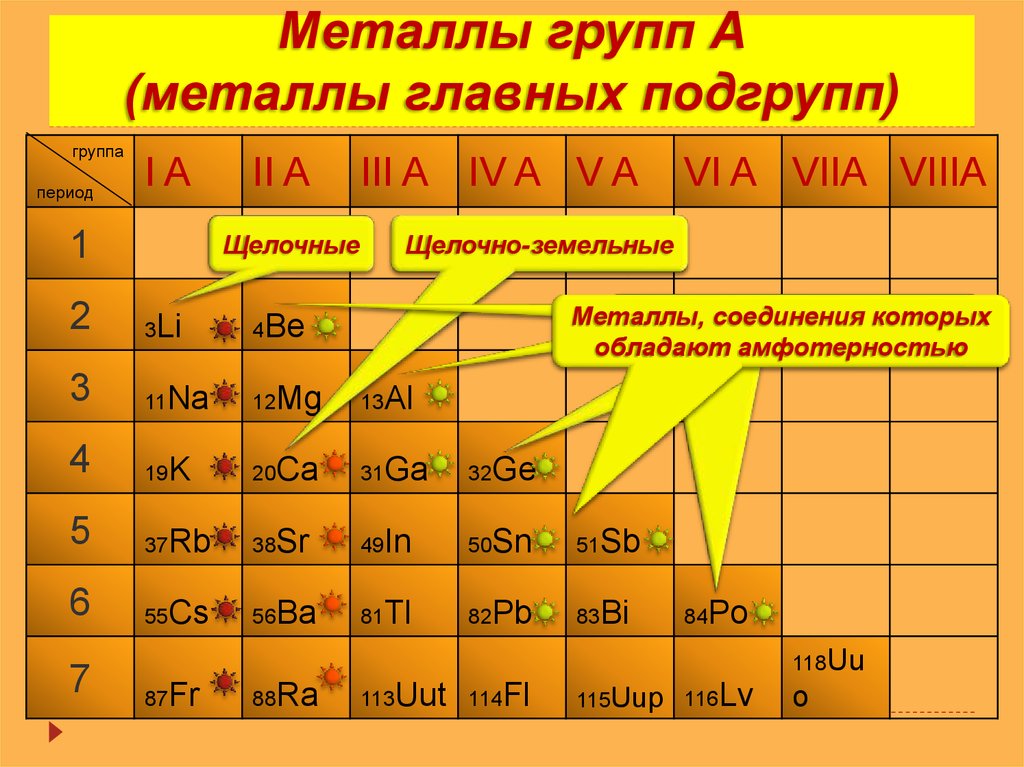 Строго говоря, атом не является сферой с четко определенной поверхностью и радиусом. Электронная плотность равна нулю лишь на бесконечном расстоянии от ядра. Размеры атома принято отождествлять с размерами сферы, внутри которой сосредоточено 90–99% электронной плотности. Экспериментальной основой для расчета атомных радиусов служит определение межатомных расстояний в кристаллах или газах. В зависимости от природы кристалла (металлический, ионный) получают значенияметаллического
илиионного радиусов
. Измерения в газах дают возможность оценитьковалентный радиус
. Такие эксперименты проводят с помощью рентгеноструктурного анализа или электронографии. За радиус атома принимают половину наименьшего межъядерного расстояния между одинаковыми атомами.
Строго говоря, атом не является сферой с четко определенной поверхностью и радиусом. Электронная плотность равна нулю лишь на бесконечном расстоянии от ядра. Размеры атома принято отождествлять с размерами сферы, внутри которой сосредоточено 90–99% электронной плотности. Экспериментальной основой для расчета атомных радиусов служит определение межатомных расстояний в кристаллах или газах. В зависимости от природы кристалла (металлический, ионный) получают значенияметаллического
илиионного радиусов
. Измерения в газах дают возможность оценитьковалентный радиус
. Такие эксперименты проводят с помощью рентгеноструктурного анализа или электронографии. За радиус атома принимают половину наименьшего межъядерного расстояния между одинаковыми атомами.
В периоде с ростом порядкового номера атомные радиусы, как правило, уменьшаются (есть исключения!), вгруппе , напротив, увеличиваются.
Уменьшение атомных радиусов элементов одного и того же периода можно объяснить увеличением величины эффективного заряда ядра на фоне постоянства числа электронных слоев. Силы притяжения между ядром и электронами начинают играть преобладающую роль по сравнению с силами отталкивания между электронами. Уменьшение радиусов атомов 4f-элементов (лантаноидов) и 5f-элементов (актиноидов) с ростом их порядкового номера назы-
Силы притяжения между ядром и электронами начинают играть преобладающую роль по сравнению с силами отталкивания между электронами. Уменьшение радиусов атомов 4f-элементов (лантаноидов) и 5f-элементов (актиноидов) с ростом их порядкового номера назы-
вают, соответственно, лантаноидными актиноидным сжатием.
Тенденции периодической таблицы: металлы, неметаллы и металлоиды
Пэм Фьер-Хансен, Средняя школа Маршалла, Маршалл, Миннесота, на основе лабораторной работы Glencoe Chemistry Concepts and Applications.
Профиль автора
Резюме
В этой лабораторной работе учащимся будет предложено наблюдать, а затем проверять свойства нескольких различных элементов. В своих наблюдениях они будут искать физическое состояние, будь то блестящее или тусклое, кажется ли оно податливым или хрупким. Для некоторых элементов они также проверят проводимость, ковкость и реакционную способность с разбавленной кислотой. На основании своих данных они классифицируют каждый элемент как металл, неметалл или металлоид.
Результаты будут иметь цветовую кодировку в периодической таблице (например, синий для металлов, желтый для неметаллов и зеленый для металлоидов). Они будут использовать это для определения тенденций металлических свойств элементов.
Развернуть для более подробной информации
Классификация занятий и связь с соответствующими ресурсами
Свернуть
Темы
Элементы и периодическая таблицаУровень класса
Средняя школа (9-12)Цели обучения
1. Ознакомиться со свойствами металлов, неметаллов и металлоидов.
2. Выяснить расположение металлов, неметаллов и металлоидов в периодической таблице.
3. Наблюдение за тенденциями металлических свойств элементов.
Будут развиты навыки наблюдения, классификации и анализа.
Понятия:
1. Металлы имеют тенденцию быть блестящими, твердыми, ковкими и хорошими проводниками электричества.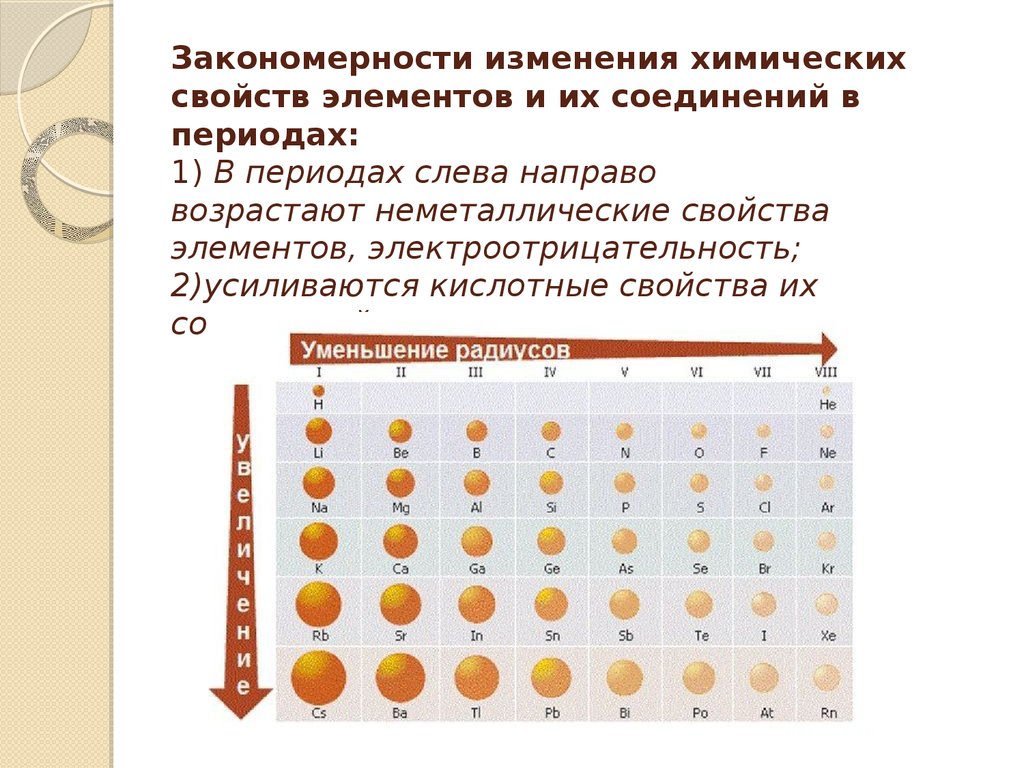 Они расположены в левой части периодической таблицы.
Они расположены в левой части периодической таблицы.
2. Неметаллы могут быть твердыми, жидкими или газообразными. Если они твердые, они имеют тенденцию быть хрупкими. Они плохие проводники. Они расположены в правой части периодической таблицы.
3. Металлоиды сочетают в себе некоторые свойства металлов и неметаллов и находятся между ними в таблице Менделеева.
Словарь:
Металлоид
Ковкость
Блеск
Проводимость
Контекст использования
Это лабораторное задание для вводной химической лаборатории средней школы. Его можно использовать как введение в периодическую таблицу. Для этого потребуются образцы элементов (см. список в раздаточном материале), тестеры микропроводимости (сделанные из девятивольтовой батарейки, светодиода и проводов), разбавленная HCl и молотки. Это требует приблизительно 60-75 минут учебного времени. Его можно легко адаптировать для использования в курсе физических наук
Описание и учебные материалы
Это лабораторное задание будет использоваться для того, чтобы учащиеся обнаружили расположение металлов, неметаллов и металлоидов в периодической таблице.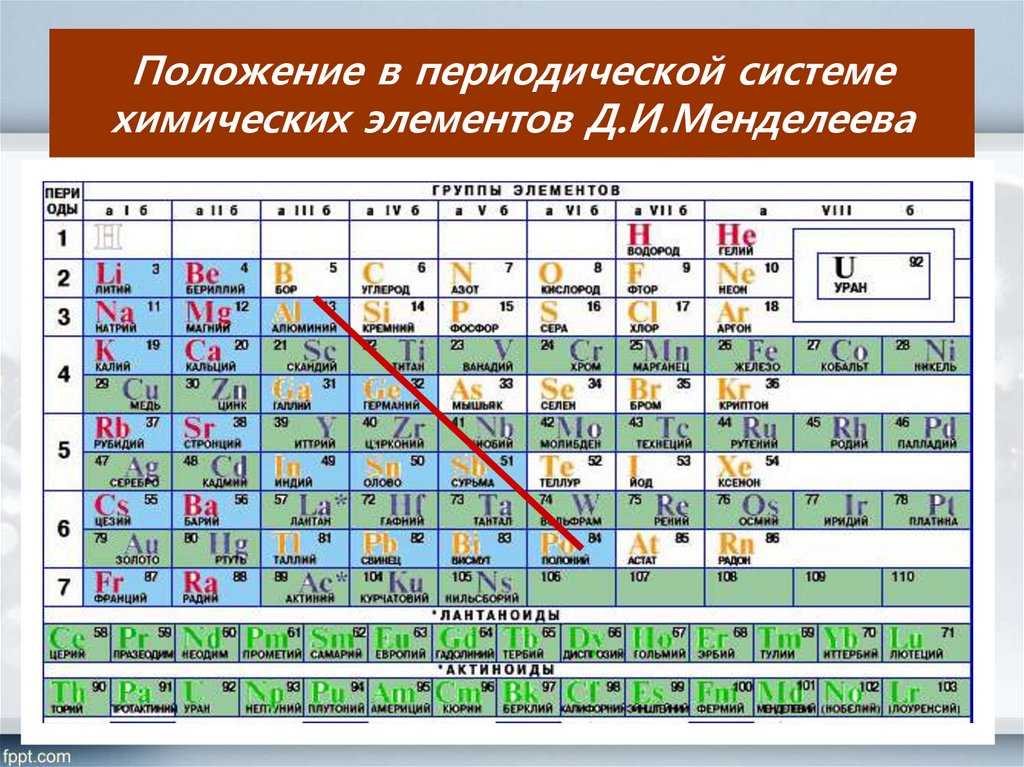 Перед началом лабораторной работы мы рассмотрим свойства каждой группы. Учащимся будет выдан раздаточный материал для учащихся (прилагается), и их попросят записать эксперимент в своих лабораторных тетрадях. Учащиеся будут работать в парах или небольших группах, чередуя станции наблюдения, электропроводности, пластичности и реактивности, пока не завершат все станции. Станции можно собирать в любом порядке. После того, как они завершили свои наблюдения, они определят, является ли каждый протестированный элемент металлом, неметаллом или металлоидом, основываясь на своих наблюдениях. Они пометят каждый из этих элементов в пустой таблице Менделеева и раскрасят каждую группу в свой цвет. Они будут использовать эту информацию, чтобы ответить на вопросы анализа в конце лабораторной работы. После того, как все закончат запись, мы сравним наши результаты с книжной классификацией и расположением этих элементов.
Перед началом лабораторной работы мы рассмотрим свойства каждой группы. Учащимся будет выдан раздаточный материал для учащихся (прилагается), и их попросят записать эксперимент в своих лабораторных тетрадях. Учащиеся будут работать в парах или небольших группах, чередуя станции наблюдения, электропроводности, пластичности и реактивности, пока не завершат все станции. Станции можно собирать в любом порядке. После того, как они завершили свои наблюдения, они определят, является ли каждый протестированный элемент металлом, неметаллом или металлоидом, основываясь на своих наблюдениях. Они пометят каждый из этих элементов в пустой таблице Менделеева и раскрасят каждую группу в свой цвет. Они будут использовать эту информацию, чтобы ответить на вопросы анализа в конце лабораторной работы. После того, как все закончат запись, мы сравним наши результаты с книжной классификацией и расположением этих элементов.
Это копия студенческого раздаточного материала лаборатории. Он включает в себя материалы в нем. Копия также прилагается к документам.
Копия также прилагается к документам.
Периодическая таблица Лаборатория:
Цель:
Исследовать свойства нескольких элементов периодической таблицы и классифицировать их как металлы, неметаллы или металлоиды.
Предварительные вопросы:
В тетради для лабораторной работы нарисуйте следующую таблицу. Запишите каждое из следующих свойств под соответствующим заголовком. Пишите все свойство, а не только его букву.
МЕТАЛЛЫ НЕМЕТАЛЛЫ МЕТАЛЛОИДЫ
а. хороший проводник тепла
b. плохой проводник тепла (изолятор)
c. полупроводник
d. блестящий, высокий блеск
e. твердые тела имеют тенденцию быть тусклыми
f. ковкий
г. хрупкий
ч. пластичный
i. хороший проводник электричества
Дж. плохой проводник электричества
Материалы:
Для наблюдательных пунктов следует приготовить герметичные пробирки, содержащие следующие элементы:
медь, кремний, магний, углерод, никель, алюминий, цинк, сера, кислород, свинец, висмут, серебро, азот , сурьма и водород
Для станции электропроводности необходимо иметь пластиковую посуду с одним куском каждого тестируемого элемента и тестеры микропроводимости.
Для станции пластичности имейте по одной штуке каждого элемента на группу вместе с бумажными полотенцами и молотками.
Для станции реактивности: по одной штуке каждого элемента на группу, 9 пробирок, штатив для пробирок и 1 М HCl.
Процедура:
1. В лабораторной тетради нарисуйте таблицу, как показано ниже.
2. Обратите внимание на внешний вид каждого из элементов. Запишите физическое состояние, цвет, блеск и другие наблюдаемые характеристики.
3. Используя тестер микропроводимости, определить, проводят ли элементы электричество. Если вы внимательно понаблюдаете, то увидите, что некоторые из них являются полупроводниками.
4. Чтобы определить, какие элементы податливы, положите один кусок элемента на бумажное полотенце и осторожно постучите по нему молотком. Элемент считается хрупким, если он разбивается при ударе. Элемент является податливым, если он сплющивается при постукивании по нему.
5. Для проверки реакционной способности с 1 М HCl пометьте 9 пробирок символами каждого элемента. Добавьте в каждую пробирку по 5 мл кислоты. Затем добавьте небольшой образец (около 0,1 грамма) каждого элемента в промаркированные пробирки. Образование пузырьков водорода свидетельствует о протекании реакции. (Примечание: не все реакции бурные, поэтому внимательно следите)
Добавьте в каждую пробирку по 5 мл кислоты. Затем добавьте небольшой образец (около 0,1 грамма) каждого элемента в промаркированные пробирки. Образование пузырьков водорода свидетельствует о протекании реакции. (Примечание: не все реакции бурные, поэтому внимательно следите)
Элемент Внешний вид Проводимость Пластичность Реакционная способность с HCL Неметалл Металл или металлоид
Медь
Кремний
Магний
Углерод
Никель
Алюминий
Цинк
Сера
Олово
Для следующих элементов попробуйте решить, являются ли они металлами, но не металлами. -металл или металлоид в зависимости от их внешнего вида.
Элемент Внешний вид Неметалл Металл или металлоид
кислород
свинец
висмут
серебро
азот
сурьма
водород
На пустой таблице Менделеева отметьте элементы, которые мы тестировали в лаборатории. По вашим наблюдениям назовите их металлическими, неметаллическими или металлоидными. Раскрасьте каждую группу (металлы, неметаллы и металлоиды) в свой цвет.
Проанализируйте и сделайте вывод:
Ответьте на следующие вопросы в лабораторной тетради. Используйте обобщающие предложения.
1. Какие элементы проявляли свойства металлов?
2. Где расположены металлы в периодической таблице?
3. Какие элементы проявляли свойства неметаллов?
4. Где в периодической таблице расположены неметаллы?
5. Какие элементы проявляли некоторые свойства металлов и некоторые неметаллы?
6. Возрастают ли металлические характеристики элементов слева направо или справа налево?
7. Увеличиваются ли металлические характеристики сверху вниз или снизу вверх? Лаборатория периодической таблицы — раздаточный материал для учащихся (Microsoft Word, 48 КБ, 24 августа 2007 г.)
Учебные заметки и советы
Лабораторию удобно размещать на станциях. Я делю лабораторию на станции наблюдения, электропроводности, пластичности и реактивности. Группы проходят через каждую станцию. Если вы проводите этот эксперимент с младшими учащимися, вы можете провести реакцию с 1 M HCl в качестве демонстрации. Для анализа я даю ученикам пустую таблицу Менделеева. Они маркируют его элементами, которые тестируют. Основываясь на том, что они наблюдали, я прошу их определить, является ли каждый элемент металлом, неметаллом или металлоидом.
Для анализа я даю ученикам пустую таблицу Менделеева. Они маркируют его элементами, которые тестируют. Основываясь на том, что они наблюдали, я прошу их определить, является ли каждый элемент металлом, неметаллом или металлоидом.
Я также постараюсь предложить учащимся выяснить, где в периодической таблице расположены металлы, неметаллы и металлоиды.
Оценка
Будут использоваться два метода оценки. Во-первых, это общий опрос студентов во время выполнения лабораторной работы. Официальная оценка будет проведена, когда я оценю результаты лабораторных работ в их лабораторных тетрадях.
Стандарты
9-12 IIA4 – Природа материи
Ссылки и ресурсы
Подробнее MnSTEP Деятельность »
Периодические тенденции в физических свойствах
Систематическое расположение элементов в периодической таблице выявляет некоторые периодические тенденции в свойствах элементов. Атомные и ионные радиусы, например, уменьшаются слева направо в периоде.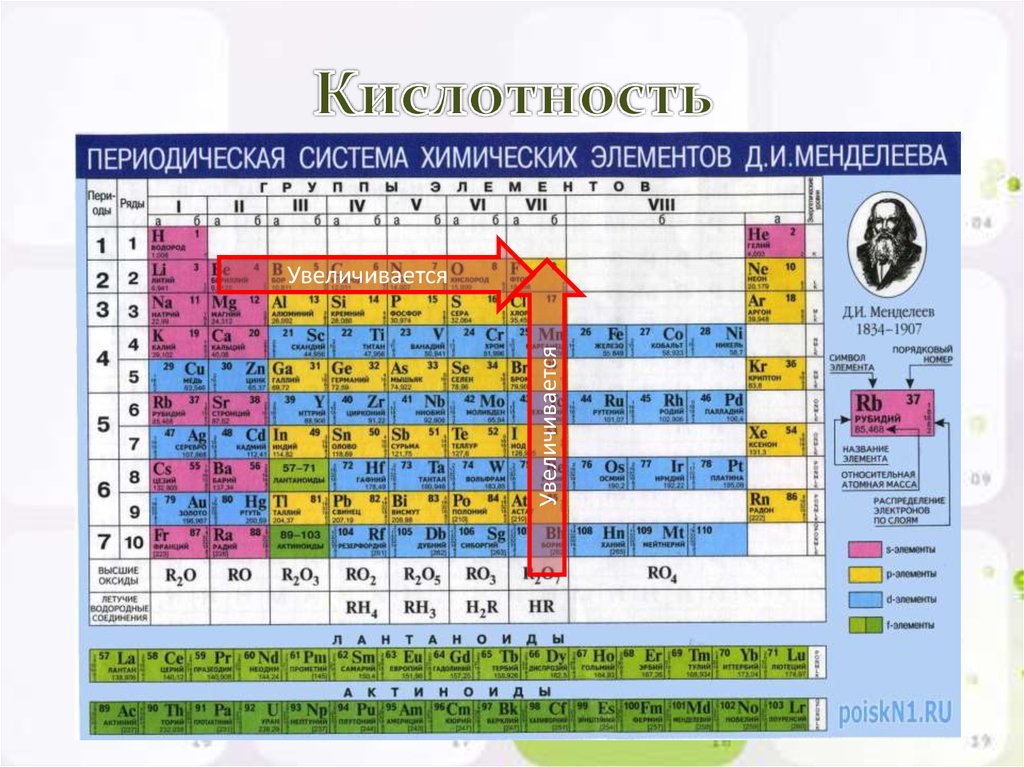 Понимание закономерностей фундаментальных свойств элементов (атомных и ионных радиусов, энтальпии ионизации и энтальпии присоединения электронов) приведет вас к выводу, что периодичность свойств в основном определяется электронной конфигурацией элемента. Мы можем обнаружить взаимосвязь между химическими свойствами и фундаментальными качествами элементов после тщательного изучения концепций.
Понимание закономерностей фундаментальных свойств элементов (атомных и ионных радиусов, энтальпии ионизации и энтальпии присоединения электронов) приведет вас к выводу, что периодичность свойств в основном определяется электронной конфигурацией элемента. Мы можем обнаружить взаимосвязь между химическими свойствами и фундаментальными качествами элементов после тщательного изучения концепций.
Период и группа
- Периоды — это элементы, организованные горизонтально (слева направо).
- Группа состоит из элементов, расположенных вертикально (сверху вниз).
Периодические тенденции в физических свойствах
Существуют различные тенденции в физических свойствах, например, атомный радиус, валентные электроны, температура плавления, температура кипения, энтальпия ионизации и так далее. Давайте рассмотрим их подробно,
- Атомный радиус
Атомный радиус — это расстояние между ядром атома и его внешней оболочкой. Периодический тренд атомного радиуса в течение периода. Атомный радиус неуклонно уменьшается по мере того, как мы движемся слева направо в периоде. Это связано с тем, что по мере того, как мы движемся слева направо в периоде, атомный номер элементов увеличивается, что приводит к увеличению заряда ядра, в то время как количество оболочек у элементов остается постоянным. Двигаясь в группе сверху вниз, атомные радиусы постепенно увеличиваются по мере увеличения заряда ядра и числа оболочек.
Периодический тренд атомного радиуса в течение периода. Атомный радиус неуклонно уменьшается по мере того, как мы движемся слева направо в периоде. Это связано с тем, что по мере того, как мы движемся слева направо в периоде, атомный номер элементов увеличивается, что приводит к увеличению заряда ядра, в то время как количество оболочек у элементов остается постоянным. Двигаясь в группе сверху вниз, атомные радиусы постепенно увеличиваются по мере увеличения заряда ядра и числа оболочек.
Исключение: Благородные газы проявляют необычное поведение. По сравнению с предшествующим атомом галогена атомные радиусы межгазов быстро увеличиваются. Объяснение этого необычного поведения заключается в том, что в случае благородных газов атомный радиус относится к радиусу Ван-дер-Ваальса, тогда как в случае других элементов он относится к ковалентному радиусу.
- Валентные электроны
Электроны во внешней оболочке атома называются валентными электронами атома.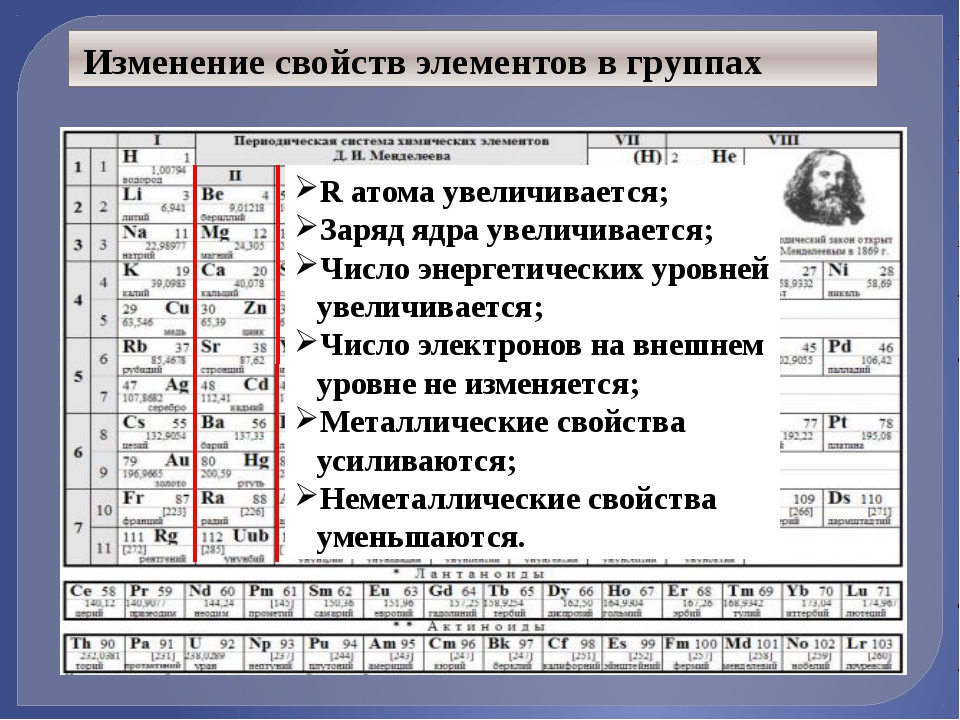 Количество валентных электронов растет по мере того, как мы движемся слева направо по периоду периодической таблицы. Валентные электроны остаются постоянными в группе. Это означает, что элементы одной и той же группы имеют одинаковое количество валентных электронов. Водород, литий и натрий, например, относятся к первой группе и имеют одинаковое число валентных электронов, равное одному.
Количество валентных электронов растет по мере того, как мы движемся слева направо по периоду периодической таблицы. Валентные электроны остаются постоянными в группе. Это означает, что элементы одной и той же группы имеют одинаковое количество валентных электронов. Водород, литий и натрий, например, относятся к первой группе и имеют одинаковое число валентных электронов, равное одному.
- Валентность
Валентность атома — это его способность объединяться. При движении слева направо по периоду периодической таблицы валентность сначала увеличивается, а затем уменьшается. Валентность членов группы не меняется. Валентность элементов из одних и тех же групп одинакова.
- Металлический характер элементов
Металлические свойства элементов уменьшаются по мере того, как мы перемещаемся слева направо по периоду периодической таблицы. Металлические свойства элементов растут по мере того, как мы продвигаемся вверх по периодической таблице сверху вниз.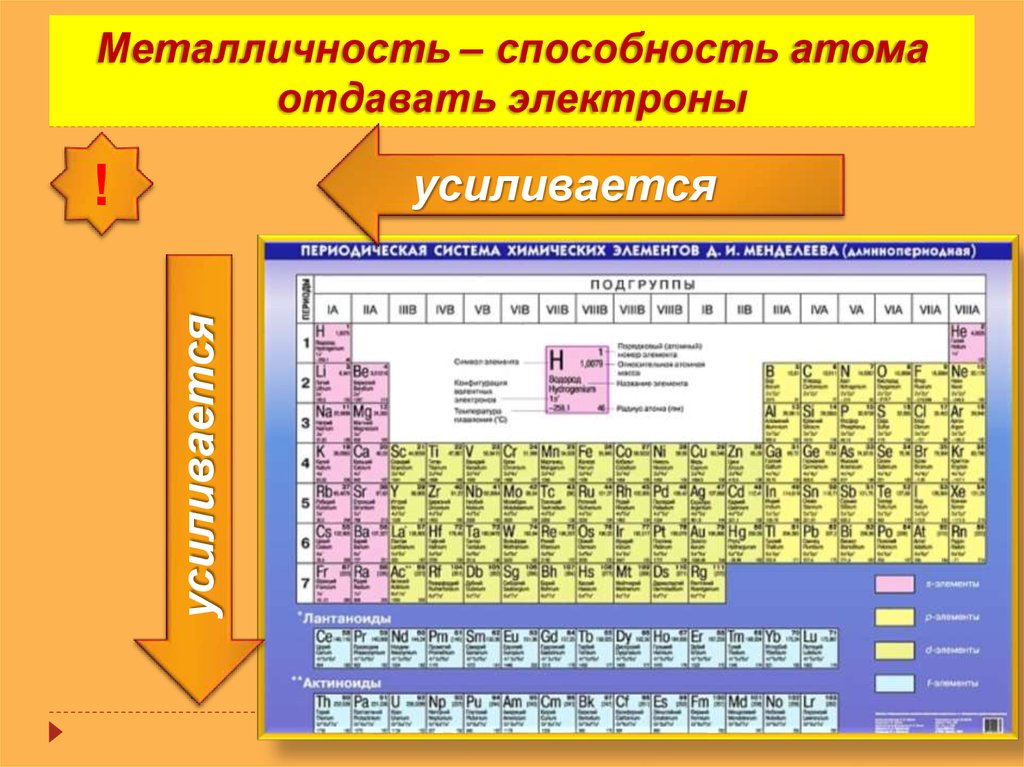
- Неметаллический характер элементов
Неметаллические свойства элементов возрастают по мере того, как мы перемещаемся слева направо по периоду периодической таблицы. Неметаллическая природа группы элементов периодической таблицы уменьшается по мере продвижения сверху вниз.
- Реакционная способность элементов
Реакционная способность металлов определяется их электроположительной природой. В результате, чем металличнее элемент, тем он более электроположителен и тем более реактивен. По мере уменьшения металлического характера слева направо уменьшается и реакционная способность. Хотя реакционная способность неметаллов возрастает при движении слева направо с течением времени. В результате мы можем сделать вывод, что по мере того, как мы движемся слева направо в периоде, реактивность элементов неуклонно уменьшается до тринадцатой группы, когда она начинает увеличиваться.
- Температура плавления
Температура плавления — это общее количество энергии, необходимое для превращения твердого вещества в жидкость.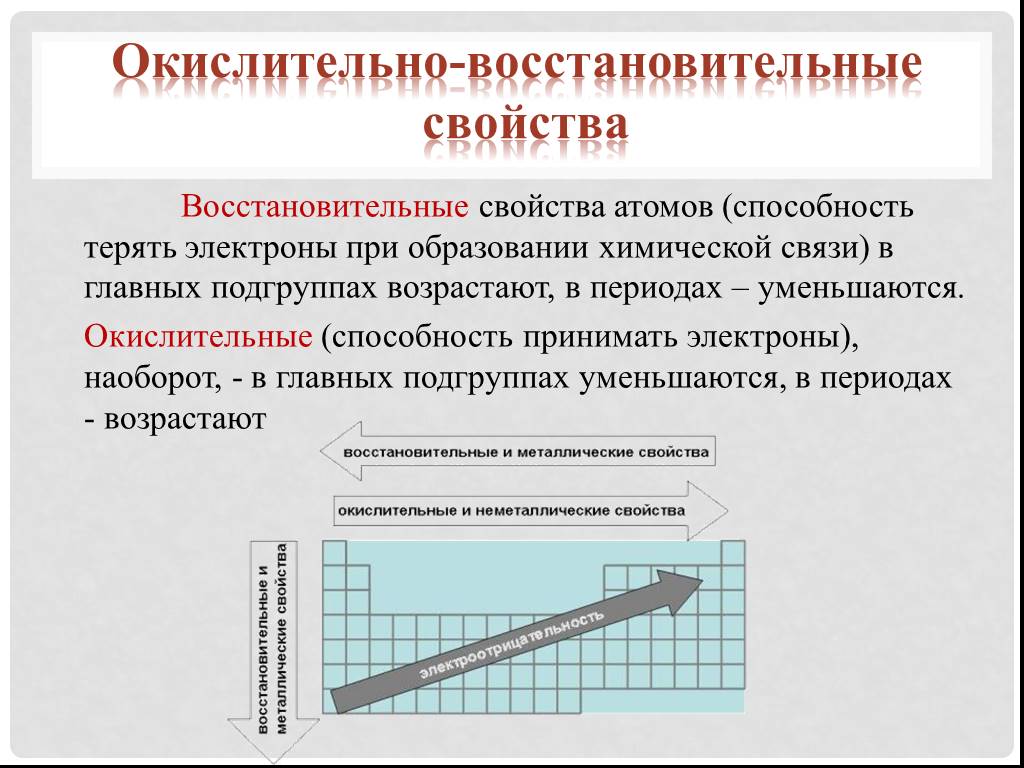 Если связь между атомами элементов сильна, требуется много энергии, чтобы разорвать эту связь. Он становится меньше по мере того, как мы идем сверху вниз. С другой стороны, неметаллы поднимаются сверху вниз в периодической таблице. Среди металлов углерод имеет высокую температуру плавления. Бор имеет высокую температуру плавления по сравнению с другими полуметаллами. Вольфрам имеет высокую температуру плавления по сравнению с другими металлами.
Если связь между атомами элементов сильна, требуется много энергии, чтобы разорвать эту связь. Он становится меньше по мере того, как мы идем сверху вниз. С другой стороны, неметаллы поднимаются сверху вниз в периодической таблице. Среди металлов углерод имеет высокую температуру плавления. Бор имеет высокую температуру плавления по сравнению с другими полуметаллами. Вольфрам имеет высокую температуру плавления по сравнению с другими металлами.
- Температуры кипения элементов
Температуры кипения металлов в группе постепенно падают сверху вниз. В то время как температуры кипения неметаллов растут сверху вниз в группе периодической таблицы.
- Энтальпия ионизации
Радиус атома уменьшается при движении периода слева направо. В результате с уменьшением размера атома уменьшается и притяжение между ядром и внешними электронами. В результате энергия ионизации часто увеличивается по таблице Менделеева.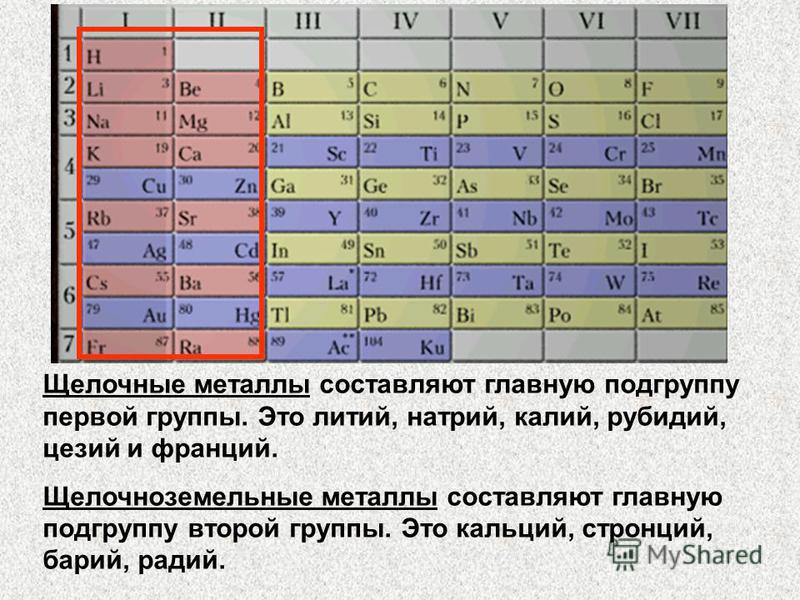 Однако, если мы посмотрим на распределение энтальпии ионизации по группам, то увидим, что в группе она падает сверху вниз. Это связано с тем, что по мере того, как количество оболочек растет вниз по группе, самые внешние электроны будут удаляться от ядра, что приводит к снижению эффективного заряда ядра. Во-вторых, с ростом числа оболочек вниз по группе экранирующий эффект увеличивается, что приводит к уменьшению энергии ионизации.
Однако, если мы посмотрим на распределение энтальпии ионизации по группам, то увидим, что в группе она падает сверху вниз. Это связано с тем, что по мере того, как количество оболочек растет вниз по группе, самые внешние электроны будут удаляться от ядра, что приводит к снижению эффективного заряда ядра. Во-вторых, с ростом числа оболочек вниз по группе экранирующий эффект увеличивается, что приводит к уменьшению энергии ионизации.
- Энтальпия усиления электронов
При движении слева направо в периоде энтальпия усиления электронов становится все более отрицательной. Мы можем заключить из закономерностей атрибутов в периодической таблице, что элементы в двух крайних точках периодической таблицы наиболее реакционноспособны (примечание: инертные газы имеют полностью заполненные оболочки, поэтому они наименее реакционноспособны), а элементы в середине являются наиболее реакционноспособными. наименее реактивный. Крайние слева элементы — это щелочи, которые легко отдают электроны, образуя катионы.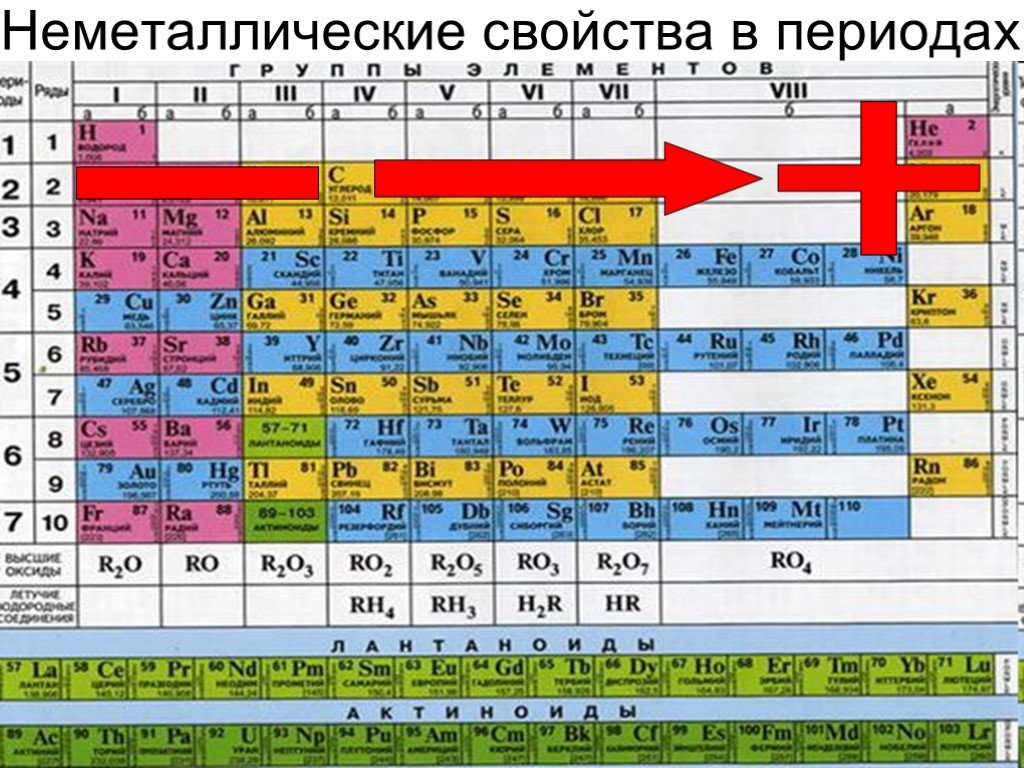 С другой стороны, присутствуют галогены — элементы в крайнем правом углу, которые легко присоединяют электроны для создания аниона. Это связано с металлическими и неметаллическими свойствами элементов. И перемещаясь слева направо в периоде, металлические свойства падают, а неметаллические увеличиваются. Металлические свойства повышаются в группе, в то время как неметаллические свойства снижаются. Кроме того, по мере продвижения периода слева направо металлические свойства уменьшаются, а неметаллические увеличиваются. В группе металлические признаки увеличиваются, а неметаллические уменьшаются.
С другой стороны, присутствуют галогены — элементы в крайнем правом углу, которые легко присоединяют электроны для создания аниона. Это связано с металлическими и неметаллическими свойствами элементов. И перемещаясь слева направо в периоде, металлические свойства падают, а неметаллические увеличиваются. Металлические свойства повышаются в группе, в то время как неметаллические свойства снижаются. Кроме того, по мере продвижения периода слева направо металлические свойства уменьшаются, а неметаллические увеличиваются. В группе металлические признаки увеличиваются, а неметаллические уменьшаются.
Примеры задач
Вопрос 1: Что понимается под электронной конфигурацией элемента?
Ответ:
Электронная конфигурация элемента — это символическое представление того, как электроны его атомов расположены на разных атомных орбиталях. Стандартные обозначения используются для выражения электронных конфигураций, в которых уровень энергии и тип орбитали записываются первыми, за которыми следует количество электронов, присутствующих на орбитали, выраженное в верхнем индексе.
Вопрос 2: Легче оторвать электрон от натрия или алюминия?
Ответ:
Чтобы извлечь один электрон из атома натрия и получить ион Na+ с электронной конфигурацией заполненной оболочки, не требуется много энергии. Вторая энергия ионизации алюминия больше первой, а третья значительно выше.
Вопрос 3: Что такое эффект проникновения?
Ответ:
Близость электрона на орбитали к ядру называется проникновением. Его можно рассматривать как относительную плотность электронов вблизи ядра атома для каждой оболочки и подоболочки. Глядя на радиальные функции распределения вероятностей, мы видим, что электронная плотность s-орбиталей выше, чем у p- и d-орбиталей.
Вопрос 4: Как влияет на металлический характер движение по периодической таблице?
Ответ:
По мере того, как мы продвигаемся вниз по группе, металлический характер повышается, потому что размер атома увеличивается, что приводит к легкой потере электронов.




