Периодическая система элементов | Дистанционные уроки
02-Авг-2012 | комментариев 7 | Лолита Окольнова
«Периодичка» — так чаще всего называют эту систему в школе — исследуем содержимое.
Вообще, периодичка — это как отмычка для множества замков… ОЧЕНЬ много ответов на вопросы по химии лежат в понимании периодической системы. При этом ее вовсе не надо знать наизусть. Ее надо понимать и уметь в ней ориентироваться. Как с картой.
Давайте разбираться…
«…Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Это формулировка периодического закона, написанная самим Д.И.Менделеевым
современная формулировка периодического закона звучит так:
Свойства элементов, а также свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядра их атомов.
Итак…
1. Все элементы в системе расположены в порядке увеличения заряда ядра (=количеству протонов, следовательно, = количеству электронов)
2. Горизонтальные ряды — это ПЕРИОДЫ. Их 7 штук — по числу энергетических уровней атома.
Очень похоже на кольца сатурна 🙂
Первый период состоит из атомов, в которых электронная оболочка состоит из
во втором периоде — из двух («красные» и «желтые»),
в третьем — из трех («красные», «желтые» и один пустой слой) ,
в четвертом — из четырех и т. д.
д.
Каждый новый период начинается тогда, когда начинает заполняться новый энергетический уровень.
В периодической системе каждый период начинается элементами, атомы которых на внешнем уровне имеют
один электрон, — атомами щелочных металлов — и заканчивается элементами, атомы которых на внешнем уровне имеют 2 (в первом периоде) или 8 электронов (во всех последующих) — атомами благородных газов. Группы — вертикальные ряды — атомы располагаются по возрастанию заряда ядра, количества электронов, атомы одной группы имеют сходное электронное строение.
Номер группы соответствует количеству электронов на внешнем энергетическом уровне. В этом примере нам дана 6-я группа, значит, у всех элементов этой группы 6 электронов на внешнем уровне.
Группы подразделяются на
подгруппы — главные (в столбце выровнены по левому краю), это подгруппы, содержащие s- и p- элементы, начинающиеся с элементов первого и второго периодов, и побочные (выровнены по правому краю), содержащие d-элементы.
Максимальное число электронов на энергетическом уровне — 8. Число переходных элементов (элементов побочных подгрупп) определяется максимальным числом электронов на d-подуровне и равно 10 в каждом из больших периодов.
Максимальное число электронов на уровне:
S— 2 электрона
p— 6
d— 10
По аналогии с переходными элементами, число лантаноидов и актиноидов, вынесенных внизу Периодической системы в виде самостоятельных рядов, равно максимальному числу электронов на f-подуровне, т.е. 14.
Теперь рассмотрим «содержимое» ячейки системы
- находится во 2-ом периоде, значит в атоме 2 энергетических уровня
- располагается в 5-ой группе, значит, на внешнем энергетическом уровне у него
Так по содержимому периодической системы можно проанализировать любой элемент:
Порядковый номер элемента | Общее количество протонов и электронов |
| Число в нижней части ячейки | Атомная масса |
| Номер периода | Количество энергетических уровней атома |
Номер группы | Количество внешних, валентных электронов |
В периодической системе 114 химических элементов.
Условной границей, отделяющей металлы от неметаллов, служит прямая, проведенная от бора до астата
- в длиннопериодном варианте периодической таблицы элементы-металлы расположены в начале периодов, а также в побочных подгруппах.
- металлы оказываются левее и ниже этой прямой, неметаллы — правее и выше, а элементы, находящиеся вблизи прямой, имеют двойственную природу, иногда их называют металлоидами, или амфотерными элементами
Категории: |
(Правила комментирования)
§ 7. Периодическая система химических элементов » Народна Освіта
Основываясь на Периодическом законе, Д. И. Менделеев создал классификацию химических элементов, которую называют Периодической системой. Обычно ее представляют в виде таблицы. В настоящее время чаще используют два варианта графического представления Периодической системы: короткий и длинный. Д. И. Менделеев чаще использовал более компактный короткий вариант Периодической системы (см. форзац 1). В нем большие периоды разбиты на две строки, в каждой из которых высшая валентность элементов последовательно увеличивается от I до VIII.
Обычно ее представляют в виде таблицы. В настоящее время чаще используют два варианта графического представления Периодической системы: короткий и длинный. Д. И. Менделеев чаще использовал более компактный короткий вариант Периодической системы (см. форзац 1). В нем большие периоды разбиты на две строки, в каждой из которых высшая валентность элементов последовательно увеличивается от I до VIII.
Если же записать символы элементов каждого периода в отдельную строку так, чтобы каждое семейство элементов (щелочные элементы, галогены, инертные элементы) образовывало отдельный столбец, то получим длинный вариант Периодической системы (рис. 7.1). Этот вариант был предложен Альфредом Вернером значительно позже открытия Периодического закона.
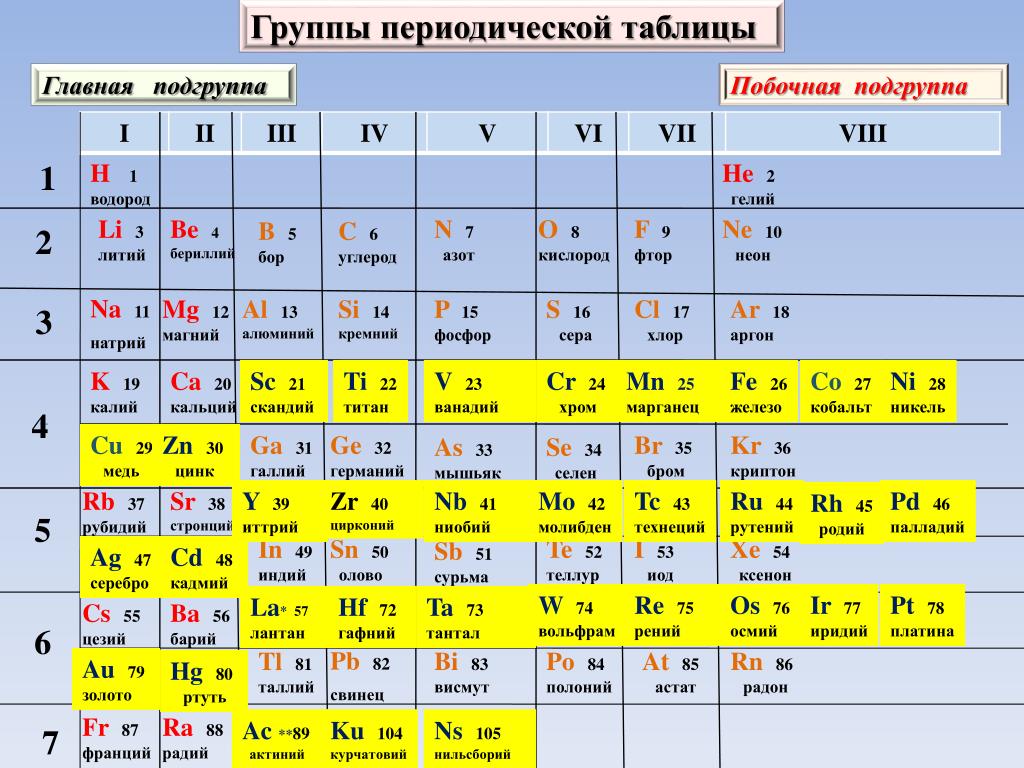
Группы элементов. Главные и побочные подгруппы
Вертикальные столбцы Периодической системы называют группами. В коротком варианте системы номера групп обозначают римскими цифрами, а число групп равно восьми. Номер группы обычно совпадает с высшей валентностью химического элемента.
В нижней части периодической таблицы расположены семейства лантаноидов и актиноидов. Это элементы, которые должны быть размещены после Лантана (№ 57) и Актиния (№ 89) и также относятся к III группе (подгруппе Скандия). Однако размещение этих элементов в таблице сделало бы ее громоздкой и неудобной, поэтому обычно их выносят за ее пределы.
В большинстве европейских стран пользуются длинным вариантом периодической таблицы, в котором число групп равно 18. Номера групп в длинном варианте таблицы обозначают арабскими цифрами. В длинном варианте главных и побочных подгрупп нет, там они образуют отдельные группы, например: группа 1 — щелочные элементы, группа 17 — галогены, группа 18 — инертные элементы. Элементы побочных подгрупп размещены в группах от 3 до 12. Обратите внимание, как соотносятся номера групп в разных вариантах периодической таблицы: номер группы в коротком варианте равен номеру в длинном минус 10.
Свойства элементов в подгруппах
Подгруппы образованы элементами со сходными свойствами: семейства щелочных и инертных элементов, галогенов — именно они и составляют отдельные подгруппы. Многие свойства элементов в подгруппах закономерно изменяются с увеличением относительной атомной массы. В главных подгруппах при увеличении атомной массы усиливаются металлические свойства элементов и образованных ими простых веществ, а неметаллические — ослабевают. Так, в подгруппе Карбона (главная подгруппа IV группы) Карбон и Силиций являются неметаллическими элементами, Германий — полуметаллическим, а Станнум и Плюмбум — металлическими.
Сходными свойствами обладают лишь элементы, относящиеся к одной подгруппе. Свойства элементов главной и побочной подгрупп одной группы могут существенно отличаться. Например, в VII группе расположены галогены — типичные неметаллические элементы (главная подгруппа) и переходные металлические элементы Манган, Технеций, Рений (побочная подгруппа) (рис.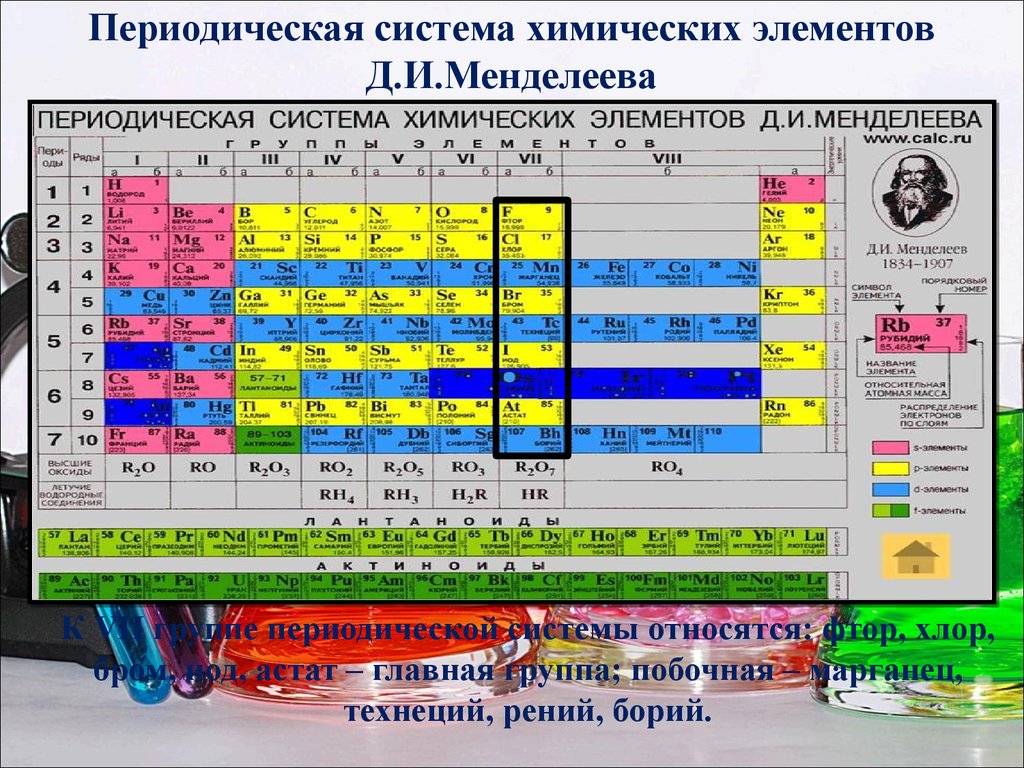
Есть ли между ними что-то общее? Обычно у элементов одной группы одинаковая высшая валентность, которую они проявляют в соединениях с Оксигеном, — она равна номеру группы.
Соединения с Гидрогеном образуют почти все элементы, но летучие соединения образуют только неметаллические элементы. Такие соединения являются веществами молекулярного строения. Металлические элементы не способны образовывать летучих соединений с Гидрогеном.
В соединениях с Гидрогеном неметаллические элементы проявляют свою низшую валентность. Чтобы ее определить, необходимо от 8 отнять номер группы. Например, Хлор, расположенный в VII группе, в соединении с Гидрогеном одновалентен (8 – 7 = 1), поэтому формула данного соединения — HCl. Элемент V группы Фосфор в соединении с Гидрогеном трехвалентен (8 – 5 = 3), поэтому формула соединения — PH3.
|
Группа ПС |
І |
ІІ |
ІІІ |
IV |
V |
VI |
VII |
|
Высшая валентность |
I |
II |
III |
IV |
V |
VI |
VII |
|
Высший оксид |
R2O |
RO |
R2O3 |
RO2 |
R2O5 |
RO3 |
R2O7 |
|
Низшая валентность |
IV |
III |
II |
I |
|||
|
Летучее соединение с Гидрогеном |
RH4 |
RH3 |
h3R |
HR |
Для удобства общие формулы высших оксидов и летучих соединений с Гидрогеном вынесены в отдельные строки периодической таблицы (см. форзац 1). Необходимо помнить, что формулы летучих соединений с Гидрогеном относятся только к неметаллическим элементам.
форзац 1). Необходимо помнить, что формулы летучих соединений с Гидрогеном относятся только к неметаллическим элементам.
Выводы
1. Графическим отображением Периодического закона является Периодическая система. Наиболее распространены ее короткий и длинный варианты. Они отличаются числом строк, отведенных на один период. В длинном варианте каждый период занимает одну строку, а в коротком малые периоды расположены в одну строку, а большие — в две.
2. Группа химических элементов — это вертикальный столбец, объединяющий элементы со сходными свойствами. В коротком варианте Периодической системы каждая группа делится на главную и побочную. Главные подгруппы состоят из элементов всех периодов, а побочные — только из элементов больших периодов.
Контрольные вопросы
1. Чем отличаются короткий и длинный варианты Периодической системы химических элементов?
2. Что называют периодом, группой, главной и побочной подгруппой?
3. Как изменяются металлические и неметаллические свойства элементов в периодах? в главных группах?
4. Почему группы элементов в коротком варианте Периодической системы необходимо разделять на главные и побочные подгруппы?
Почему группы элементов в коротком варианте Периодической системы необходимо разделять на главные и побочные подгруппы?
Задания для усвоения материала
1. Назовите химические элементы I группы Периодической системы. Какие из них относятся к главной подгруппе, а какие — к побочной?
2. В четвертом периоде, пятой группе, главной подгруппе Периодической системы расположен: а) Силиций; б) Станнум; в) Арсен; г) Стибий.
3. Какие из следующих элементов относятся к главным, а какие — к побочным подгруппам: Нитроген, Оксиген, Гидроген, Купрум, Феррум, Алюминий?
4. Определите в каждом ряду один химический элемент, отличающийся от других местом в Периодической системе: а) H, He, Ne, Ar; б) Fe, Co, Ni, Ar; в) H, Li, Be, B; г) F, Cl, Br, Mn.
5. Какой химический элемент по свойствам подобен Силицию: а) Алюминий; б) Фосфор; в) Германий; г) Титан? Ответ поясните.
6. Составьте формулу высшего оксида и формулу летучего соединения с Гидрогеном (если она существует) для следующих элементов: а) Магний; б) Силиций; в) Рений; г) Осмий; д) Теллур; е) Радий.
7. У какого элемента сильнее выражены металлические (или неметаллические) свойства: а) у Бора или Алюминия; б) у Арсена или Нитрогена; в) Арсена или Стибия? Ответ обоснуйте.
8. Найдите в Периодической системе элемент, расположенный в четвертом периоде и проявляющий одинаковые валентности в высшем оксиде и в соединении с Гидрогеном.
9. Порядковые номера химических элементов А, Б, и В равны соответственно n, n + 2, n + 4.
1) Если химический элемент А — самый легкий галоген, то каким химическим элементом будет Б?
2) Если химический элемент В — инертный, а Б — металлический, то каким химическим элементом является А?
3) Если химические элементы А и Б принадлежат к одной группе, то каким химическим элементом является В?
4) Могут ли простые вещества, образованные А, Б и В, при обычных условиях быть газами?
10. Элементы А и Б относятся к I группе, а элемент В — к VII группе. Соединение элементов А и В растворимо в воде, а соединение элементов Б и В имеет белый цвет и нерастворимо в воде. Какими элементами могут быть А, Б и В?
Какими элементами могут быть А, Б и В?
11. Определите элемент, единственный оксид которого имеет относительную молекулярную массу 40 ± 1, а валентность — не больше IV. Докажите, что существует только один такой элемент.
12. Высший оксид элемента, образующий с Гидрогеном летучее соединение состава RH4, содержит 53,3 % Оксигена. Назовите этот элемент.
13. Элемент, высший оксид которого соответствует формуле RO3, образует соединение с Гидрогеном, содержащее 2,47 % Гидрогена. Назовите этот элемент.
14. Выполните учебный проект № 2 «Формы Периодической системы химических элементов».
Это материал учебника Химия 8 класс Григорович
Видео с вопросами
: Определение группы элемента на основе его последовательных энергий ионизации
Учитывая данные о последовательных энергиях ионизации (в кДж/моль) в приведенной таблице, какой из следующих элементов, скорее всего, будет в группе III периодической таблицы? [A] Элемент 1 [B] Элемент 2 [C] Элемент 3 [D] Элемент 4 [E] Элемент 5
Только для подписчиков
03:28
Стенограмма видео
Учитывая данные последовательных энергии ионизации в килоджоулях на моль в таблице показано, какая из следующие элементы, скорее всего, будут в третьей группе периодической таблицы?
В таблице представлены последовательные
энергии ионизации пяти неизвестных элементов от первой энергии ионизации до
шестой.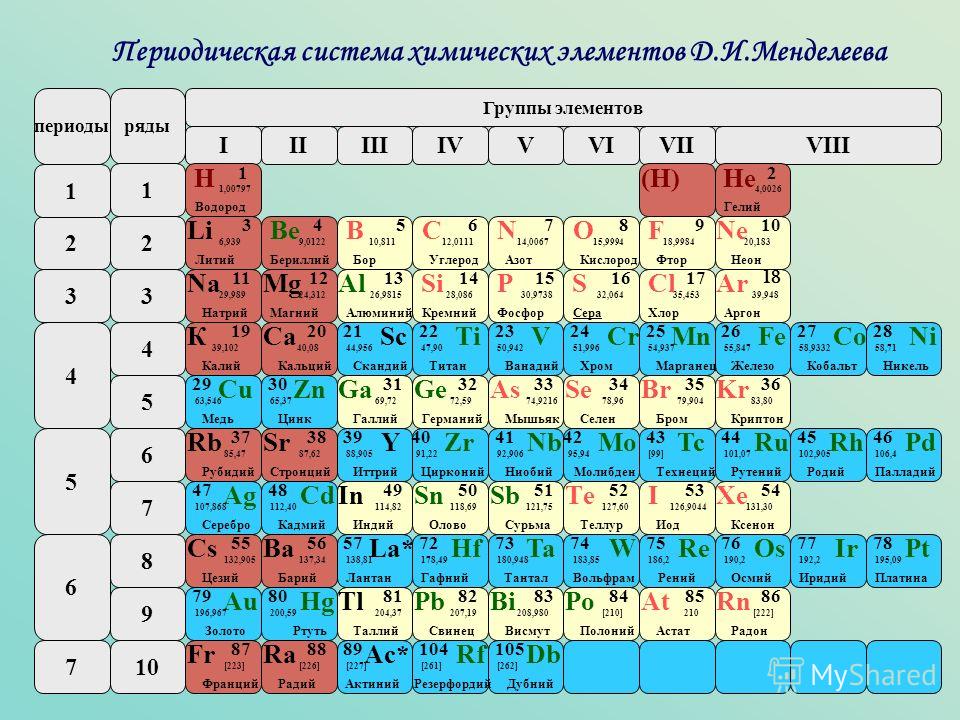 Последовательные энергии ионизации
значения, которые количественно определяют, сколько энергии необходимо для последовательного удаления электронов
из одного элемента в газообразном состоянии. Образец определенного элемента
последовательные энергии ионизации дают представление об электронной конфигурации
его атомы.
Последовательные энергии ионизации
значения, которые количественно определяют, сколько энергии необходимо для последовательного удаления электронов
из одного элемента в газообразном состоянии. Образец определенного элемента
последовательные энергии ионизации дают представление об электронной конфигурации
его атомы.
Обычно энергия ионизации
увеличивается по мере удаления большего количества электронов. Удаление электронов из положительно
заряженные ионы требуют больше энергии. Однако значительное увеличение
энергии ионизации, которые существенно отличаются от общего увеличения
свидетельствуют о том, что электроны удаляются с энергетического уровня, расположенного ближе к
ядро. Электроны ближе к ядру
сильнее связаны электростатическим притяжением, поэтому требуется больше энергии, чтобы
удалить их.
Давайте посмотрим на узоры каждого из пяти неизвестных элементов, чтобы раскрыть их электронные конфигурации и определить, какие из них могут быть в третьей группе периодической таблицы. Первый элемент имеет наибольшее значительное увеличение энергии ионизации между четвертой и пятой ионизацией энергии. Это указывает на то, что первые четыре удаленные электроны, вероятно, находились на одном энергетическом уровне и были более слабо связаны чем пятый. Пятый удаленный электрон был вероятно, на энергетическом уровне ближе к ядру, чем первые четыре электрона. Поэтому вполне вероятно, что элемент один имеет четыре валентных электрона и может быть найден в четвертой группе Периодическая таблица, которую мы могли бы также назвать группой 14, в зависимости от того, считаем ли мы d-блок переходные металлы.
Второй элемент показывает больше всего
значительное увеличение между первой и второй энергиями ионизации.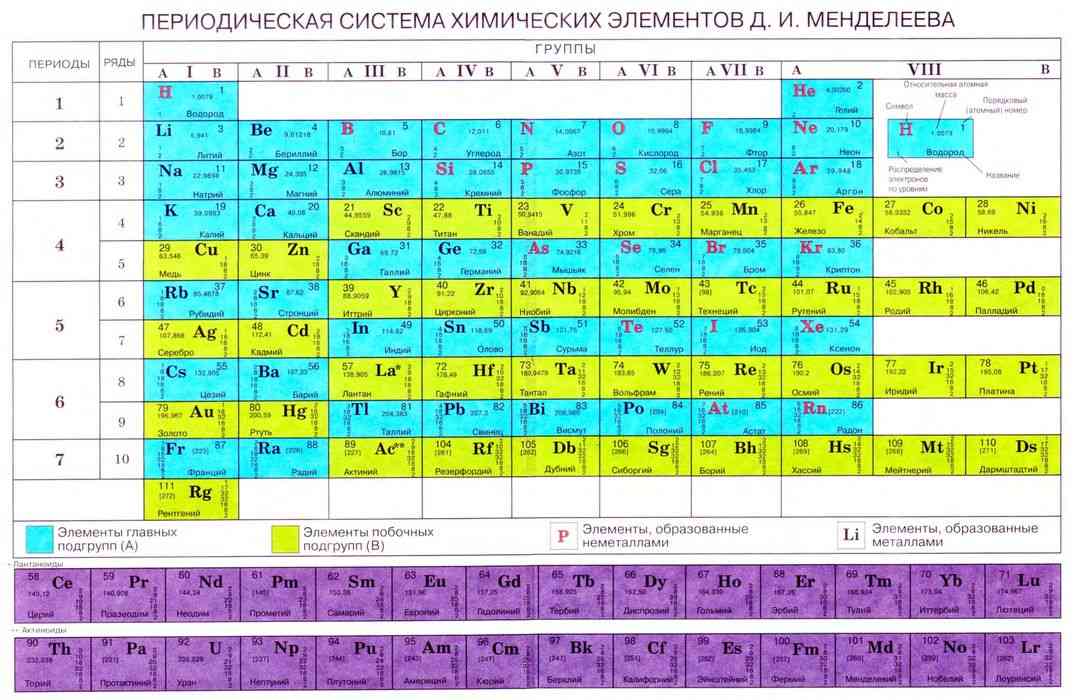 Поэтому вполне вероятно, что
второй элемент находится в первой группе периодической таблицы. Третий элемент имеет наибольшее
значительное увеличение между второй и третьей энергиями ионизации. Скорее всего, это третий элемент.
во второй группе периодической таблицы. Четвертый элемент имеет наибольшую
увеличивается между третьей и четвертой энергиями ионизации. Вероятно, четвертый элемент
в группе 3 или 13 периодической таблицы. Наконец, пятый элемент не имеет
увеличения, которые значительно отличаются от остальных и, таким образом, могут быть в
группа 16, 17 или 18.
Поэтому вполне вероятно, что
второй элемент находится в первой группе периодической таблицы. Третий элемент имеет наибольшее
значительное увеличение между второй и третьей энергиями ионизации. Скорее всего, это третий элемент.
во второй группе периодической таблицы. Четвертый элемент имеет наибольшую
увеличивается между третьей и четвертой энергиями ионизации. Вероятно, четвертый элемент
в группе 3 или 13 периодической таблицы. Наконец, пятый элемент не имеет
увеличения, которые значительно отличаются от остальных и, таким образом, могут быть в
группа 16, 17 или 18.
Таким образом, наиболее Вероятно, в третьей группе периодической таблицы находится четвертый элемент.
Элемент P имеет атомный номер 19 К какой группе и периоду принадлежит P Это металл или неметалл W…
Перейти к
- Упражнение 5А
- Упражнение 5Б
- Упражнение 5С
- Глава 1.
 Язык химии
Язык химии - Глава 2 Химические изменения и реакции
- Глава 3 Вода
- Глава 4. Атомная структура и химическая связь
- Глава 5 Периодическая таблица
- Глава 6 Изучение первого элемента водорода
- Глава 7 Изучение газовых законов
- Глава 8.
 Загрязнение атмосферы
Загрязнение атмосферы
Главная > Селина Солюшнс Класс 9 Химия > Глава 5 – Глава 5 Периодическая таблица > Упражнение 5С > Вопрос 1
Вопрос 1 Упражнение 5C
Элемент P имеет атомный номер 19. К какой группе и периоду. принадлежит П? Это металл или неметалл? Почему
Ответ:
Номер группы. элемента = 1A
№ периода элемента = 4
P является металлом, потому что номер строки, в которой вы найдете этот элемент, является точкой. Число в верхней части 9Столбец 0003
— номер группы. Элементы слева в таблице — это металлы, а справа — неметаллы
Связанные вопросы
**Назовите или сформулируйте следующее со ссылкой на элемент первых трех периодов периода.




 Язык химии
Язык химии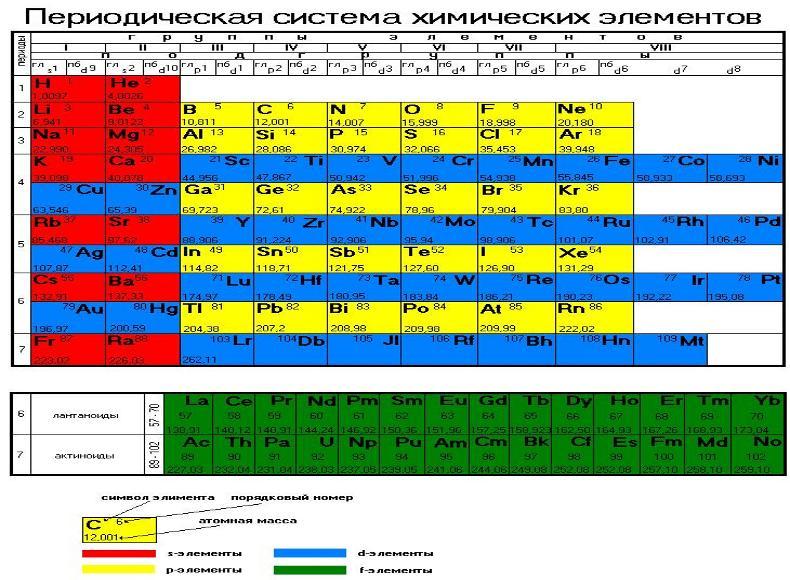 Загрязнение атмосферы
Загрязнение атмосферы